血管内皮細胞における細胞接着因子の発現抑制剤
【課題】 硫酸銅で安定化処理されたクマザサエキスの細胞、遺伝子レベルにおける薬効を有する医薬、すなわち血管内皮細胞における細胞接着因子の発現抑制剤の提供。
【解決手段】 その発現抑制剤は、硫酸銅で安定化処理されたクマザサエキスを有効成分とするものであり、その細胞接着因子は、VCAM又はICAMであるのがよく、さらに、その発現抑制剤中の硫酸銅で安定化処理されたクマザサエキスの銅クロロフィリンナトリウム含有量(濃度)は2.3mg/100mL〜0.23mg/100mLが好ましい。
また、前記クマザサエキス製造時に用いる生の熊笹は新葉が良く、その採取時期は8〜10月がよい。
【解決手段】 その発現抑制剤は、硫酸銅で安定化処理されたクマザサエキスを有効成分とするものであり、その細胞接着因子は、VCAM又はICAMであるのがよく、さらに、その発現抑制剤中の硫酸銅で安定化処理されたクマザサエキスの銅クロロフィリンナトリウム含有量(濃度)は2.3mg/100mL〜0.23mg/100mLが好ましい。
また、前記クマザサエキス製造時に用いる生の熊笹は新葉が良く、その採取時期は8〜10月がよい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血管内皮細胞における細胞接着因子の発現抑制剤に関する。より詳しくは、クマザサエキスを有効成分とする血管内皮細胞における細胞接着因子の発現抑制剤に関するものであり、更に詳しくはVCAM又はICAMの発現抑制剤に関する。
【背景技術】
【0002】
クマザサは、大形の笹の俗称(原色牧野和漢薬草大図鑑:チシマザサ、チマキザサ、ネマガリダケ等)で、日本各地の高原地帯に生育するイネ科の多年草であり、その若葉は古くから日本各地でクマザサ茶として利用されている。
また、その若葉から抽出した葉緑素を含むエキスは、健康食品あるいは滋養強壮剤としても利用されている。
【0003】
そのクマザサエキス(熊笹葉緑素液)の製造方法としては、古くは熊笹を乾燥して水分を排除した後有機溶剤により抽出し油溶性のクロロフィルを細胞膜を破壊することなく浸透してその他の樹脂、油分等と共に溶剤中に溶解した後蒸発し、残渣をメチルアルコールのアルカリ性溶液中において溶解すると同時に鹸化せしめて水溶性のクロロフィリンのアルカリ塩として採取する方法がある。(特許文献1参照)
【0004】
また、その後、開発された方法としては、まず生のままの熊笹を硫酸銅溶液中で加熱攪拌した後、酸性亜硫酸ソーダ水溶液中で加熱処理してリグニンを除去し、次いで処理後の熊笹を希薄苛性ソーダ溶液中に浸漬し、処理後の液を固体分と溶液にろ別し、得られた溶液を塩酸にて微酸性にして沈殿物を形成し、これをアルカリにて中和して緑色の溶液を得る方法がある(特許文献1参照)。
【0005】
そのエキスの製造方法にはそれ以外にもあり、それには、クマザサエキス中の葉緑素をを安定的に保持できる製造方法ということで、重炭酸ナトリウム、塩化ナトリウム及び炭酸ナトリウムからなる処理液を用いて、70〜80℃で加熱処理する方法(特許文献2参照)、マグネシウムイオンが自然のまま存在する葉緑素を製造するということで、アルカリ性溶液を用いて70〜80℃で加熱処理し、その後乾燥させ、更にエチルアルコールで抽出する方法がある(特許文献3参照)。
【0006】
そして、本出願人企業も、クマザサエキスを数十年に亘り製造し、それを含有する医薬も製造販売している。そのエキスの製造方法は、特許文献1に記載の方法に沿うものであって、硫酸銅で処理し、次いでリグニンを除去し、更にアルカリ処理し、その後固液分離し、酸にて中和するものであり、これらの範囲では特許文献1に記載の方法と共通し、硫酸銅で安定化処理されたクマザサエキスを製造することができるものではあるが、本出願人企業は、この方法に関し、効率的、かつ大量生産に適する改良技術を開発し、既に特許を取得している(特許文献4参照)。
【0007】
その改良した安定化処理されたクマザサエキスの製造方法、すなわち熊笹葉葉緑素液の製造方法を具体的に示すと以下のとおりである。
それは、生の熊笹を加熱した希薄硫酸銅溶液で安定化処理する工程、処理後の熊笹を冷凍保存する工程、保存後の熊笹を加熱した希薄酸性亜硫酸ソーダ溶液で処理してリグニンを除去する工程、リグニン除去後の熊笹を切断する工程、切断後の熊笹を加熱した希薄苛性ソーダ溶液で処理する工程、処理後の熊笹含有液を固液分離する工程、得られたアルカリ性熊笹葉緑素液を中和して酸性熊笹葉緑素沈殿物を生成せしめる工程、得られた沈殿物を脱水しペースト状酸性熊笹葉緑素を回収する工程及びこのペースト状酸性熊笹葉緑素に炭酸水素ナトリウムを加え熊笹葉葉緑素液を調製する工程からなるものである。
【0008】
本出願人企業は、この製造方法に好適に用いることができる製造装置の発明も開発し、それについても既に特許を取得している(特許文献5参照)
その概要を以下において簡単に述べると以下のとおりである。すなわち、それは一端に熊笹を収容する容器を搬入する入口及び他端に該容器を搬出する出口を備え、かつ入口から出口に向かって前記容器を連続的に搬送する装置を備えた加熱処理液を収容する細長い加熱処理槽、前記容器を加熱処理槽入口に移送及び搬入させる第1の移載装置、並びに該容器を加熱処理槽出口から搬出及び移送させる第2の移載装置を備えた熊笹を連続的に加熱処理する装置である。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特公昭32−2782号公報
【特許文献2】特公平6−102601号公報
【特許文献3】特公平6−47552号公報
【特許文献4】特許第3527614号(特開平10−279494号公報)
【特許文献5】特許第3597703号(特開平11−343246号公報)
【非特許文献】
【0010】
【非特許文献1】New England Journal of Medicine 340:115-126,1999
【非特許文献2】Nature,407:233-241,2000
【非特許文献3】Arterioscloris Thrombosis and Vascular Biology,27:2292-2301,2007
【非特許文献4】Cellular Physiology Biochemistry,20:859-866
【非特許文献5】American Journal of Physiology:Cell Physiology,292:C82-C97,2007
【発明の概要】
【発明が解決しようとする課題】
【0011】
本出願人企業は、前記した製造方法及び製造装置を用いてクマザサエキスを製造し、それを含有する医薬、具体的には滋養強壮剤を長年に亘り製造販売している。
また、クマザサ及びそのエキスには、高血圧予防、腎臓病予防、疲労回復、止血効果、貧血改善、胃腸病改善、糖尿病予防、体臭予防等の効能があると言われ、それらはお茶、健康食品、滋養・強壮剤等として利用されているものの、本出願人が知る限り、細胞、遺伝子レベルにおいて、その働きを調査、検討した事実は見当たらない。
【0012】
そのようことから、本出願人企業は富山大学との産学共同研究の下に、硫酸銅で安定化処理されたクマザサエキスの細胞、遺伝子レベルにおける働き(効能)について、鋭意調査検討を進めた。
その共同研究におけるメンバーのうち、本発明者の恒枝及び笹岡は、血管内皮細胞における接着因子に関する研究を長年継続して行っており、その経験を活かして、その方向からクマザサエキスの働き(効能)について鋭意調査検討を進めたものであり、それに関し以下において具体的に述べる。
【0013】
単球やT−cell等の末梢血白血球と血管壁を構成する血管内皮細胞の接着は、アテローム性動脈硬化の進展過程の初期段階に出現する血管機能の異常現象であり、血管壁に接着した血球は血管組織内に浸潤した後、泡沫化し、サイトカインを放出して炎症を誘発すること(特許文献1及び2参照)、血球と血管内皮細胞の接着には各細胞における細胞接着因子が介在しており、炎症部位の血管内皮細胞ではその発現が著しく増加すること(非特許文献3参照)が既に知られている。
【0014】
また、これらの異常を誘発する因子として組織レニン−アンジオテンシン系の関与があること、特に血管局所で増加するアンジオテンシンIIは血管内皮細胞においてマイトジェン活性化プロテインキナーゼ(mitogen-activated protein kinase)の活性化を介して細胞接着因子の発現を誘導し(非特許文献4参照)、動脈硬化を促進すること(非特許文献5参照)等も既に知られている。
【0015】
本発明者らは、これらの研究に長年関与し、前記した通り先行技術文献も熟知し多くの知識を有することから、その方向からクマザサエキスの働き(効能)について、鋭意調査検討を進めた結果見出すことができたのが、クマザサエキスの血管内皮細胞における細胞接着因子に対する発現抑制作用である。
したがって、本願発明は、硫酸銅で安定化処理されたクマザサエキスの細胞、遺伝子レベルにおける前記新たに知見した働き(効能)に基づく医薬を提供することを発明の解決すべき課題とするものである。
【課題を解決するための手段】
【0016】
本発明は、血管内皮細胞における細胞接着因子の発現抑制剤を提供するものであり、その発現抑制剤は硫酸銅で安定化処理されたクマザサエキスを含有とするものである。
その細胞接着因子は、VCAM又はICAMであるのがよく、さらに、その発現抑制剤中の硫酸銅で安定化処理されたクマザサエキスの含有量(濃度)については、銅クロロフィリンナトリウムの濃度で23mg/100mL〜0.05mg/100mLがよく、好ましくは2.3mg/100mL〜0.23mg/100mLがよい。
また、前記クマザサエキス製造時に用いる生の熊笹についてはチシマザサの新葉が良く、その採取時期は8〜10月がよい。
【発明の効果】
【0017】
本発明のクマザサエキス及びクマザサは、お茶、滋養強壮剤あるいは健康食品として、日本各地の多くの人々に既に広く利用されており、それらの範囲における利用量あるいは濃度である限り、毒性あるいは副作用について、特段配慮する必要はない。
そのため、本発明では、安全に利用することができる血管内皮細胞における細胞接着因子の発現抑制剤を提供することができる。
【図面の簡単な説明】
【0018】
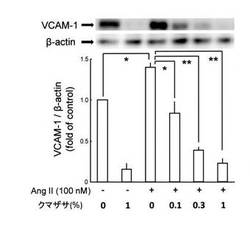
【図1】実施例1で行った、硫酸銅で安定化処理されたクマザサエキスによるVCAM−1発現に対する抑制性能試験結果。
【図2】実施例1で行った、硫酸銅で安定化処理されたクマザサエキスによるICAM−1発現に対する抑制性能試験結果。
【発明を実施するための形態】
【0019】
本発明の血管内皮細胞における細胞接着因子の発現抑制剤は、硫酸銅で安定化処理されたクマザサエキスを含有し、それを有効成分とするものであり、その有効成分は硫酸銅で安定化処理されたクマザサエキスである限り、特に製造方法により制限されることなく各種のものが使用可能であり、それには前記した特許文献1に記載のもの、あるいは本出願人が開発した特許文献4に記載のものなどが例示できる。
【0020】
そのうち好ましいものは、本出願人が開発した特許文献4に記載の製造方法を基本とする方法で製造されたものである。
すなわち、前記特許文献4に記載の製造方法では、リグニンを除去する工程が存在したが、その後クマザサエキスを有効成分とする滋養強壮剤においては、敢えてリグニンを除去する必要はないということで、現在においてはこのリグニンを除去する工程を省いてクマザサエキスを製造しており、本願発明でもこれを用いるのが好ましい。
【0021】
その製造方法の概要を示すと以下のとおりであり、それは、生の熊笹を加熱した希薄硫酸銅溶液で安定化処理する工程、処理後の熊笹を冷凍保存する工程、保存後の熊笹を切断する工程、切断後の熊笹を加熱した希薄苛性ソーダ溶液で処理する工程、処理後の熊笹含有液を固液分離する工程、得られたアルカリ性熊笹葉緑素液を中和して酸性熊笹葉緑素沈殿物を生成せしめる工程、得られた沈殿物を脱水しペースト状酸性熊笹葉緑素を回収する工程及びこのペースト状酸性熊笹葉緑素に炭酸水素ナトリウムを加え熊笹葉葉緑素液を調製する工程からなるものである。
【0022】
その製造に用いるクマザサについては、日本各地に自生するものが特に制限させることなく使用可能であり、クマイザサ、チマキザサ及びチシマザサ(学名)等が例示できる。
また、それを採取するに当たっては、葉緑素等の有効成分の含有量が多いことから新葉が良く、その採取時期については特に限定されるものではないが、葉緑素及びアミノ酸等の有効成分の含有率が高いことからして、8月から10月に採取するが好ましい。
【0023】
硫酸銅による安定化処理は、熊笹中に存在するクロロフィル分解酵素のクロロフィラーゼにより光分解され葉緑素中の不安定なMg核が脱離し易くなるのを回避するためのもので、この処理により硫酸銅溶液の銅がMgと置換して酵素破壊を回避する。
その際に使用する希薄硫酸銅溶液の濃度は2〜4重量%のものがよく、溶液の温度は80〜100℃のものがよい。さらに処理時間は15〜80分程度であり、好ましくは60分程度である。
【0024】
安定化処理後に熊笹を冷凍保存する工程における冷凍温度は−5〜−10℃が好ましく、保存期間は3月以上が好ましい。熊笹を切断する工程は、熊笹を細かくし、後に続く工程における有効成分の抽出効率を向上せしめるためであり、その後に続く希薄苛性ソーダ溶液で処理する工程は、葉緑素等の有効成分を抽出するためのもので、苛性ソーダにより葉緑素を銅クロロフィリンナトリウムに鹸化して、水溶液への葉緑素成分の溶解度を高めるものである。 苛性ソーダの濃度は0.6〜3.0重量%がよく、処理する温度は80〜100℃が好ましい。処理時間は30〜80分必要である。
【0025】
前記処理後の熊笹を含有する液を固液分離する工程は、苛性ソーダにより抽出された葉緑素等の可溶性有効成分含有液と残渣の熊笹とを分離するためのものである。
得られたアルカリ性熊笹葉緑素液を中和し酸性熊笹葉緑素沈殿物を生成せしめる工程は、濃度5〜10重量%程度の塩酸を用いて行うのがよい。中和が進行するにしたがい葉緑素沈殿物が生成し、酸性葉緑素沈殿物が得られる。この酸性葉緑素沈殿物を上水(すなわち飲料に適する水)にて水洗液のpHが3前後になるまで水洗するのがよい。
【0026】
ペースト状酸性熊笹葉緑素を回収する工程は、この沈殿物をフィルタープレス等の固液分離機を用いて脱水するものである。
熊笹葉葉緑素液を調製する工程では、炭酸水素ナトリウム水溶液を加えてpHが7.0〜8.0になるまで中和することによりペーストが液化し、最終製品である熊笹葉葉緑素液、すなわちクマザサエキス(このエキスのことを必要に応じて「原液エキス」と呼称することがある)を得る。
【0027】
得られた原液エキス中の銅クロロフィリンナトリウムの濃度は、135mg/100mL〜250mg/mLであり、その液中には、銅クロロフィリンナトリウムのほかに各種のアミノ酸、鉄、マグネシウム等の無機質成分、ビタミン等が含有されている。
これに含有されるアミノ酸には、リジン、ヒスチジン、アルギニン、アスパラギン酸、スレオニン、セリン、グルタミン酸、プロリン、グリシン、アラニン、バリン、メチオニン、イソロイシン、ロイシン、フェニールアラニン、GABAなどがある。
【0028】
本発明では、このクマザサエキスを血管内皮細胞における細胞接着因子の発現を抑制する医薬の有効成分として用いるものである。
実施例では、原エキスを100倍〜1000倍に希釈し、その希釈した範囲において血管内皮細胞における細胞接着因子の発現を濃度依存的に有意に抑制することを確認している。すなわち、細胞接着因子の発現抑制性能試験の結果を示す図1及び2によれば、前記範囲において明確に細胞接着因子の発現抑制性能を示している。
【0029】
そして、両図に図示されている結果によれば、希釈度が100倍を下回る10倍の場合にも、その性能を発現することは否定できないし、逆に1000倍を超えた5000倍希釈の場合にも、クマザサエキス無添加の場合のコントロールよりも細胞接着因子の発現抑制性能が優れていることは否定しがたい。
前記のとおりであるから、細胞接着因子の発現抑制剤中における、クマザサエキスの濃度は、原エキスの20倍〜5000倍に希釈したものがよく、好ましくは100倍〜1000倍に希釈したものがよい。
【0030】
また、クマザサエキスは原エキスを5〜10倍に希釈されたものを主成分として含む液剤が滋養強壮剤として多くの人に常用されており、この点からすれば、この範囲の濃度のクマザサエキスを血管内皮細胞に対する細胞接着因子の発現抑制剤として用いることは、毒性、副作用の点からは何等の問題もなく、かつその場合に該抑制効果を奏することも、前記したとおり実施例における「細胞接着因子の発現抑制性能試験」の結果から十分に期待できるところである。
逆に、実施例にある1000倍希釈を更に5倍希釈した場合である5000倍に希釈した場合についても前記した発現抑制性能試験結果から、前記したとおり該抑制効果があることは十分に期待できるところである。
【0031】
そのクマザサエキスの濃度を銅クロロフィリンナトリウムの濃度で示すと、実施例の製造方法で作製したクマザサエキス、すなわち原エキス中の銅クロロフィリンナトリウムの濃度は230mg/100mLである。
したがって、本発明の細胞接着因子の発現抑制剤中におけるクマザサエキスの銅クロロフィリンナトリウム濃度は、23mg/100mL〜0.05mg/100mLがよく、好ましくは2.3mg/100mL〜0.23mg/100mLがよい、
【実施例1】
【0032】
以下において、実施例1として、クマザサエキスの製造実施例、並びにそのエキスを用いたVCAM−1の発現抑制性能試験例及びICAM−1の発現抑制性能試験例を示すが、本発明は、この実施例によって何ら限定されるものではなく、特許請求の範囲によって把握されるものであることはいうまでもない。
【0033】
[クマザサエキスの製造例]
クマザサエキス(熊笹葉葉緑素液)の製造原料である、採取後2日目の生のクマザサの新葉4000kgを、温度90℃の硫酸銅3重量%水溶液が入れられている硫酸銅処理液槽に浸漬して、1時間処理した。この処理により葉緑素中のMgがCuに置換され葉緑素は安定化され、熊笹の容量は約1/3に減少した。処理後の熊笹を温度−5℃の冷凍庫で3ケ月保存した。その保存後の熊笹を温湯で解凍した後、回転する刃を備えた切断機にて切断した。
【0034】
その切断後濃度3重量%で90℃の苛性ソーダ溶液を含有する溶解釜にて処理して、葉緑素成分を含有する液を形成し、ついでこれをベルトプレス分離機にて残渣と分離して葉緑素液を得た。その分離後、葉緑素液を温度20℃に低下させた後、中和水洗タンクに入れて7%塩酸を加えて中和し、酸性熊笹沈殿物を生成し常水にてpHが3になるまで水洗する。沈殿物(水分99%)をフィルタープレスにて脱水し、ペースト状酸性熊笹葉緑素4065リットル(L)を得、これに純水3053Lを加えて液状葉緑素7118Lを得た。この液状葉緑素に59kgの炭酸水素ナトリウムを加えて約pH7.3の熊笹葉葉緑素液を製造した。
【0035】
その製造された熊笹葉葉緑素液中の銅クロロフィリンナトリウム濃度は230mg/100mLであった。その葉緑素液中には、銅クロロフィリンナトリウムのほかに各種のアミノ酸、鉄、マグネシウムなどの無機質成分、ビタミン等が含有された。含有される各種アミノ酸は、リジン、ヒスチジン、アルギニン、アスパラギン酸、スレオニン、セリン、グルタミン酸、プロリン、グリシン、アラニン、バリン、メチオニン、イソロイシン、ロイシン、フェニールアラニン、GABAであった。
【0036】
[細胞接着因子の発現抑制性能試験例]
前記製造例で作製されたクマザサエキスを純水で希釈し、その希釈されたクマザサエキスを用いて、ヒト臍帯静脈内皮細胞[human umbilical vein endothelial cell(HUVEC) 三光純薬(株)製]における細胞接着因子の発現に対する抑制効果を調査する。その際には、100倍から1000倍の間で数種の希釈率のものを作製し、それを用いてウエスタンブロット(Western blot)法により細胞接着因子の発現に対する抑制効果を調査した。
【0037】
(細胞培養)
ヒト臍帯静脈内皮細胞[human umbilical vein endothelial cell(HUVEC) 三光純薬(株)製]を5%ウシ胎児血清[fetal bovine serum(FBS)、米国JRHバイオサイエンス(JRH Bioscienses)社製]を含む血管内皮細胞用基礎培地(endothelial cell basal medium)−2で懸濁し、50μg/mLのコラーゲンタイプI[米国BDバイオサイエンス(BD Biosciences)社製]でコーティングした培養皿(dish)に播種した後、37℃、5%の二酸化炭素(CO2)雰囲気の条件下で100%コンフルエント状態になるまで培養した。
【0038】
(ウエスタンブロット法による抑制効果の調査)
前記で培養したものを、100倍−1000倍に希釈したクマザサエキス(銅クロロフィリンナトリウム濃度2.3mg/100mL−0.23mg/100mL)、50μg/mL ECGS[血管内皮細胞増殖添加物、米国シグマ(Sigma)社製)]及び5unit/mLヘパリンを含む培地(Medium)199中で24時間培養した後、アンジオテンシンII[米国シグマ(Sigma)社製)]に15時間暴露した。
【0039】
その後、細胞溶解液(lysis buffer)[30mM トリス塩基(Tris),150mM NaCl,10mM エチレンジアミン4酢酸(EDTA),0.5% デオキシコール酸ナトリウム(sodium deoxycholate),1mM Na3VO4,160mM NaF,1% トリトンX-100(TritonX-100),1mM フッ化フェニルメチルスルホニル(phenylmethylsulfonylfluoride),12μg/mLアプロチニン(aporotinin),1μM ロイペプチン(leupeptin)]を用いて細胞を溶解した。
【0040】
この細胞溶解液を遠心分離(14,000rpm、10分、4℃)し、その上清をSDSポリアクリルアミドゲル(SDS−polyacrylamide gel)で電気泳動して、ポリビニリデンジフルオライド膜[polyvinyldene difluoride membrane[米国ミリポア(Millipore)社製]にタンパクを転写した。
【0041】
次いで、スキムミルク(non-fat milk)/TBS−T[トリスバッファー+ポリオキシエチレン(20)ソルビタンモノラウレート(Tris-Buffered saline-Tween 20)]、10mM トリス塩基(Tris),150mM NaCl,0.1% ポリオキシソルビタンモノラウレート(Tween20),pH7.5]で1時間ブロッキングした後、1次抗体と4℃で一晩反応させた。なお、前記1次抗体としては、anti−VCAM−1抗体[米国サンタクルズバイオテクノロジー(Santa Cruz Biotechnology)社製]、anti−ICAM−1抗体(米国サンタクルズバイオテクノロジー社製)、及びアンチβ−アクチン(anti-β-actin)抗体(米国シグマ(Sigma)社製)を使用した。
【0042】
その後、TBS−Tで前記した膜(membrane)を洗浄した後に、西洋わさびペルオキシダーゼ(horseradish peroxidase)標識2次抗体(英国GEヘルスケアー(GE Healthcare)社製)と室温で1時間反応させた。
さらに、ウエスタンブロッテング検出試薬[ECL Western Blotting Detection Reagents(英国GEヘルスケアー社製)]と反応させ、ルミノイメージアナライザーLAS−4000(富士フイルム社製)を用いて解析した。
【0043】
(抑制効果の調査結果)
前記解析した結果、すなわちヒト臍帯静脈内皮細胞(HUVEC)における細胞接着因子の発現に対するクマザサエキスの抑制効果を図1及び2に示す。
また、それらの図には、前記調査で実施したクマザサエキスが与えるβ−actinタンパク発現に対する影響、及びアンジオテンシンII刺激による影響に関する調査結果についても合わせて示した。
【0044】
〈VCAM−1の発現に対する抑制効果〉
図1には、VCAM−1の発現に対するクマザサエキスの抑制効果が図示されている。
それによれば、HUVECをクマザサエキス100倍希釈液(銅クロロフィリンナトリウム濃度2.3mg/100mL)で処置すると、VCAM−1タンパクの発現レベルが未処置群(コントロール)の16%まで減少することがわかる。
また、その際、クマザサエキスの処置によっては、内部標準としてのβ−アクチン(actin)タンパクの発現量には何等変化が認められないので、クマザサエキスがVCAM−1タンパクの発現を特異的に減少させていることがわかる。
【0045】
〈ICAM−1の発現に対する抑制効果〉
図2には、ICAM−1の発現に対するクマザサエキスの抑制効果が図示されている。
それによれば、HUVECをクマザサエキス100倍希釈液(銅クロロフィリンナトリウム濃度2.3mg/100mL)で処置すると、IVCAM−1タンパクの発現レベルが未処置群(コントロール)の74%に減少することがわかる。
また、その際には、クマザサエキスの処置後に内部標準としてのβ−アクチン(actin)タンパクの発現量には何等変化が認められないにもかかわらず、クマザサエキスがICAM−1タンパクの発現を減少させていることがわかる。
【0046】
〈アンジオテンシンII刺激による影響の調査結果〉
以上の調査のほかに酸化ストレス刺激としてアンジオテンシンII(100nM)で15時間処置した後に細胞接着因子量を調査すると、VCAM−1及びICAM−1の発現量は図1及び2に図示するとおり基礎値(basalレベル)の1.4倍に増加した。
これに対し、更にHUVECをクマザサエキス(100倍、300倍、1000倍の各希釈液)で24時間処置した後に同様にアンジオテンシンII刺激を行った場合には、図1及び2に図示するとおりVCAM−1及びICAM−1の発現増加は濃度依存的に有意に抑制された。これらの場合にも、内部標準としてのβ−アクチン(actin)タンパクの発現量には何等変化が認められないので、クマザサエキスがこれらの細胞接着因子の発現を特異的に抑制することがわかる。
【産業上の利用可能性】
【0047】
本発明は、お茶、滋養強壮剤あるいは健康食品として国内で広く利用されている範囲の濃度、すなわち毒性あるいは副作用に関し懸念する必要のない濃度で、服用することにより、血管内皮細胞において細胞接着因子の発現抑制することができる。
その結果、血管内皮細胞における細胞接着因子の増殖に伴って発症する各種疾病の治療、予防に役立つことが期待できる。
具体的には、動脈硬化、高血圧症、心筋梗塞、脳梗塞、あるいはがん転移等の治療薬及び予防薬として役立つことが期待される。
【技術分野】
【0001】
本発明は、血管内皮細胞における細胞接着因子の発現抑制剤に関する。より詳しくは、クマザサエキスを有効成分とする血管内皮細胞における細胞接着因子の発現抑制剤に関するものであり、更に詳しくはVCAM又はICAMの発現抑制剤に関する。
【背景技術】
【0002】
クマザサは、大形の笹の俗称(原色牧野和漢薬草大図鑑:チシマザサ、チマキザサ、ネマガリダケ等)で、日本各地の高原地帯に生育するイネ科の多年草であり、その若葉は古くから日本各地でクマザサ茶として利用されている。
また、その若葉から抽出した葉緑素を含むエキスは、健康食品あるいは滋養強壮剤としても利用されている。
【0003】
そのクマザサエキス(熊笹葉緑素液)の製造方法としては、古くは熊笹を乾燥して水分を排除した後有機溶剤により抽出し油溶性のクロロフィルを細胞膜を破壊することなく浸透してその他の樹脂、油分等と共に溶剤中に溶解した後蒸発し、残渣をメチルアルコールのアルカリ性溶液中において溶解すると同時に鹸化せしめて水溶性のクロロフィリンのアルカリ塩として採取する方法がある。(特許文献1参照)
【0004】
また、その後、開発された方法としては、まず生のままの熊笹を硫酸銅溶液中で加熱攪拌した後、酸性亜硫酸ソーダ水溶液中で加熱処理してリグニンを除去し、次いで処理後の熊笹を希薄苛性ソーダ溶液中に浸漬し、処理後の液を固体分と溶液にろ別し、得られた溶液を塩酸にて微酸性にして沈殿物を形成し、これをアルカリにて中和して緑色の溶液を得る方法がある(特許文献1参照)。
【0005】
そのエキスの製造方法にはそれ以外にもあり、それには、クマザサエキス中の葉緑素をを安定的に保持できる製造方法ということで、重炭酸ナトリウム、塩化ナトリウム及び炭酸ナトリウムからなる処理液を用いて、70〜80℃で加熱処理する方法(特許文献2参照)、マグネシウムイオンが自然のまま存在する葉緑素を製造するということで、アルカリ性溶液を用いて70〜80℃で加熱処理し、その後乾燥させ、更にエチルアルコールで抽出する方法がある(特許文献3参照)。
【0006】
そして、本出願人企業も、クマザサエキスを数十年に亘り製造し、それを含有する医薬も製造販売している。そのエキスの製造方法は、特許文献1に記載の方法に沿うものであって、硫酸銅で処理し、次いでリグニンを除去し、更にアルカリ処理し、その後固液分離し、酸にて中和するものであり、これらの範囲では特許文献1に記載の方法と共通し、硫酸銅で安定化処理されたクマザサエキスを製造することができるものではあるが、本出願人企業は、この方法に関し、効率的、かつ大量生産に適する改良技術を開発し、既に特許を取得している(特許文献4参照)。
【0007】
その改良した安定化処理されたクマザサエキスの製造方法、すなわち熊笹葉葉緑素液の製造方法を具体的に示すと以下のとおりである。
それは、生の熊笹を加熱した希薄硫酸銅溶液で安定化処理する工程、処理後の熊笹を冷凍保存する工程、保存後の熊笹を加熱した希薄酸性亜硫酸ソーダ溶液で処理してリグニンを除去する工程、リグニン除去後の熊笹を切断する工程、切断後の熊笹を加熱した希薄苛性ソーダ溶液で処理する工程、処理後の熊笹含有液を固液分離する工程、得られたアルカリ性熊笹葉緑素液を中和して酸性熊笹葉緑素沈殿物を生成せしめる工程、得られた沈殿物を脱水しペースト状酸性熊笹葉緑素を回収する工程及びこのペースト状酸性熊笹葉緑素に炭酸水素ナトリウムを加え熊笹葉葉緑素液を調製する工程からなるものである。
【0008】
本出願人企業は、この製造方法に好適に用いることができる製造装置の発明も開発し、それについても既に特許を取得している(特許文献5参照)
その概要を以下において簡単に述べると以下のとおりである。すなわち、それは一端に熊笹を収容する容器を搬入する入口及び他端に該容器を搬出する出口を備え、かつ入口から出口に向かって前記容器を連続的に搬送する装置を備えた加熱処理液を収容する細長い加熱処理槽、前記容器を加熱処理槽入口に移送及び搬入させる第1の移載装置、並びに該容器を加熱処理槽出口から搬出及び移送させる第2の移載装置を備えた熊笹を連続的に加熱処理する装置である。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特公昭32−2782号公報
【特許文献2】特公平6−102601号公報
【特許文献3】特公平6−47552号公報
【特許文献4】特許第3527614号(特開平10−279494号公報)
【特許文献5】特許第3597703号(特開平11−343246号公報)
【非特許文献】
【0010】
【非特許文献1】New England Journal of Medicine 340:115-126,1999
【非特許文献2】Nature,407:233-241,2000
【非特許文献3】Arterioscloris Thrombosis and Vascular Biology,27:2292-2301,2007
【非特許文献4】Cellular Physiology Biochemistry,20:859-866
【非特許文献5】American Journal of Physiology:Cell Physiology,292:C82-C97,2007
【発明の概要】
【発明が解決しようとする課題】
【0011】
本出願人企業は、前記した製造方法及び製造装置を用いてクマザサエキスを製造し、それを含有する医薬、具体的には滋養強壮剤を長年に亘り製造販売している。
また、クマザサ及びそのエキスには、高血圧予防、腎臓病予防、疲労回復、止血効果、貧血改善、胃腸病改善、糖尿病予防、体臭予防等の効能があると言われ、それらはお茶、健康食品、滋養・強壮剤等として利用されているものの、本出願人が知る限り、細胞、遺伝子レベルにおいて、その働きを調査、検討した事実は見当たらない。
【0012】
そのようことから、本出願人企業は富山大学との産学共同研究の下に、硫酸銅で安定化処理されたクマザサエキスの細胞、遺伝子レベルにおける働き(効能)について、鋭意調査検討を進めた。
その共同研究におけるメンバーのうち、本発明者の恒枝及び笹岡は、血管内皮細胞における接着因子に関する研究を長年継続して行っており、その経験を活かして、その方向からクマザサエキスの働き(効能)について鋭意調査検討を進めたものであり、それに関し以下において具体的に述べる。
【0013】
単球やT−cell等の末梢血白血球と血管壁を構成する血管内皮細胞の接着は、アテローム性動脈硬化の進展過程の初期段階に出現する血管機能の異常現象であり、血管壁に接着した血球は血管組織内に浸潤した後、泡沫化し、サイトカインを放出して炎症を誘発すること(特許文献1及び2参照)、血球と血管内皮細胞の接着には各細胞における細胞接着因子が介在しており、炎症部位の血管内皮細胞ではその発現が著しく増加すること(非特許文献3参照)が既に知られている。
【0014】
また、これらの異常を誘発する因子として組織レニン−アンジオテンシン系の関与があること、特に血管局所で増加するアンジオテンシンIIは血管内皮細胞においてマイトジェン活性化プロテインキナーゼ(mitogen-activated protein kinase)の活性化を介して細胞接着因子の発現を誘導し(非特許文献4参照)、動脈硬化を促進すること(非特許文献5参照)等も既に知られている。
【0015】
本発明者らは、これらの研究に長年関与し、前記した通り先行技術文献も熟知し多くの知識を有することから、その方向からクマザサエキスの働き(効能)について、鋭意調査検討を進めた結果見出すことができたのが、クマザサエキスの血管内皮細胞における細胞接着因子に対する発現抑制作用である。
したがって、本願発明は、硫酸銅で安定化処理されたクマザサエキスの細胞、遺伝子レベルにおける前記新たに知見した働き(効能)に基づく医薬を提供することを発明の解決すべき課題とするものである。
【課題を解決するための手段】
【0016】
本発明は、血管内皮細胞における細胞接着因子の発現抑制剤を提供するものであり、その発現抑制剤は硫酸銅で安定化処理されたクマザサエキスを含有とするものである。
その細胞接着因子は、VCAM又はICAMであるのがよく、さらに、その発現抑制剤中の硫酸銅で安定化処理されたクマザサエキスの含有量(濃度)については、銅クロロフィリンナトリウムの濃度で23mg/100mL〜0.05mg/100mLがよく、好ましくは2.3mg/100mL〜0.23mg/100mLがよい。
また、前記クマザサエキス製造時に用いる生の熊笹についてはチシマザサの新葉が良く、その採取時期は8〜10月がよい。
【発明の効果】
【0017】
本発明のクマザサエキス及びクマザサは、お茶、滋養強壮剤あるいは健康食品として、日本各地の多くの人々に既に広く利用されており、それらの範囲における利用量あるいは濃度である限り、毒性あるいは副作用について、特段配慮する必要はない。
そのため、本発明では、安全に利用することができる血管内皮細胞における細胞接着因子の発現抑制剤を提供することができる。
【図面の簡単な説明】
【0018】
【図1】実施例1で行った、硫酸銅で安定化処理されたクマザサエキスによるVCAM−1発現に対する抑制性能試験結果。
【図2】実施例1で行った、硫酸銅で安定化処理されたクマザサエキスによるICAM−1発現に対する抑制性能試験結果。
【発明を実施するための形態】
【0019】
本発明の血管内皮細胞における細胞接着因子の発現抑制剤は、硫酸銅で安定化処理されたクマザサエキスを含有し、それを有効成分とするものであり、その有効成分は硫酸銅で安定化処理されたクマザサエキスである限り、特に製造方法により制限されることなく各種のものが使用可能であり、それには前記した特許文献1に記載のもの、あるいは本出願人が開発した特許文献4に記載のものなどが例示できる。
【0020】
そのうち好ましいものは、本出願人が開発した特許文献4に記載の製造方法を基本とする方法で製造されたものである。
すなわち、前記特許文献4に記載の製造方法では、リグニンを除去する工程が存在したが、その後クマザサエキスを有効成分とする滋養強壮剤においては、敢えてリグニンを除去する必要はないということで、現在においてはこのリグニンを除去する工程を省いてクマザサエキスを製造しており、本願発明でもこれを用いるのが好ましい。
【0021】
その製造方法の概要を示すと以下のとおりであり、それは、生の熊笹を加熱した希薄硫酸銅溶液で安定化処理する工程、処理後の熊笹を冷凍保存する工程、保存後の熊笹を切断する工程、切断後の熊笹を加熱した希薄苛性ソーダ溶液で処理する工程、処理後の熊笹含有液を固液分離する工程、得られたアルカリ性熊笹葉緑素液を中和して酸性熊笹葉緑素沈殿物を生成せしめる工程、得られた沈殿物を脱水しペースト状酸性熊笹葉緑素を回収する工程及びこのペースト状酸性熊笹葉緑素に炭酸水素ナトリウムを加え熊笹葉葉緑素液を調製する工程からなるものである。
【0022】
その製造に用いるクマザサについては、日本各地に自生するものが特に制限させることなく使用可能であり、クマイザサ、チマキザサ及びチシマザサ(学名)等が例示できる。
また、それを採取するに当たっては、葉緑素等の有効成分の含有量が多いことから新葉が良く、その採取時期については特に限定されるものではないが、葉緑素及びアミノ酸等の有効成分の含有率が高いことからして、8月から10月に採取するが好ましい。
【0023】
硫酸銅による安定化処理は、熊笹中に存在するクロロフィル分解酵素のクロロフィラーゼにより光分解され葉緑素中の不安定なMg核が脱離し易くなるのを回避するためのもので、この処理により硫酸銅溶液の銅がMgと置換して酵素破壊を回避する。
その際に使用する希薄硫酸銅溶液の濃度は2〜4重量%のものがよく、溶液の温度は80〜100℃のものがよい。さらに処理時間は15〜80分程度であり、好ましくは60分程度である。
【0024】
安定化処理後に熊笹を冷凍保存する工程における冷凍温度は−5〜−10℃が好ましく、保存期間は3月以上が好ましい。熊笹を切断する工程は、熊笹を細かくし、後に続く工程における有効成分の抽出効率を向上せしめるためであり、その後に続く希薄苛性ソーダ溶液で処理する工程は、葉緑素等の有効成分を抽出するためのもので、苛性ソーダにより葉緑素を銅クロロフィリンナトリウムに鹸化して、水溶液への葉緑素成分の溶解度を高めるものである。 苛性ソーダの濃度は0.6〜3.0重量%がよく、処理する温度は80〜100℃が好ましい。処理時間は30〜80分必要である。
【0025】
前記処理後の熊笹を含有する液を固液分離する工程は、苛性ソーダにより抽出された葉緑素等の可溶性有効成分含有液と残渣の熊笹とを分離するためのものである。
得られたアルカリ性熊笹葉緑素液を中和し酸性熊笹葉緑素沈殿物を生成せしめる工程は、濃度5〜10重量%程度の塩酸を用いて行うのがよい。中和が進行するにしたがい葉緑素沈殿物が生成し、酸性葉緑素沈殿物が得られる。この酸性葉緑素沈殿物を上水(すなわち飲料に適する水)にて水洗液のpHが3前後になるまで水洗するのがよい。
【0026】
ペースト状酸性熊笹葉緑素を回収する工程は、この沈殿物をフィルタープレス等の固液分離機を用いて脱水するものである。
熊笹葉葉緑素液を調製する工程では、炭酸水素ナトリウム水溶液を加えてpHが7.0〜8.0になるまで中和することによりペーストが液化し、最終製品である熊笹葉葉緑素液、すなわちクマザサエキス(このエキスのことを必要に応じて「原液エキス」と呼称することがある)を得る。
【0027】
得られた原液エキス中の銅クロロフィリンナトリウムの濃度は、135mg/100mL〜250mg/mLであり、その液中には、銅クロロフィリンナトリウムのほかに各種のアミノ酸、鉄、マグネシウム等の無機質成分、ビタミン等が含有されている。
これに含有されるアミノ酸には、リジン、ヒスチジン、アルギニン、アスパラギン酸、スレオニン、セリン、グルタミン酸、プロリン、グリシン、アラニン、バリン、メチオニン、イソロイシン、ロイシン、フェニールアラニン、GABAなどがある。
【0028】
本発明では、このクマザサエキスを血管内皮細胞における細胞接着因子の発現を抑制する医薬の有効成分として用いるものである。
実施例では、原エキスを100倍〜1000倍に希釈し、その希釈した範囲において血管内皮細胞における細胞接着因子の発現を濃度依存的に有意に抑制することを確認している。すなわち、細胞接着因子の発現抑制性能試験の結果を示す図1及び2によれば、前記範囲において明確に細胞接着因子の発現抑制性能を示している。
【0029】
そして、両図に図示されている結果によれば、希釈度が100倍を下回る10倍の場合にも、その性能を発現することは否定できないし、逆に1000倍を超えた5000倍希釈の場合にも、クマザサエキス無添加の場合のコントロールよりも細胞接着因子の発現抑制性能が優れていることは否定しがたい。
前記のとおりであるから、細胞接着因子の発現抑制剤中における、クマザサエキスの濃度は、原エキスの20倍〜5000倍に希釈したものがよく、好ましくは100倍〜1000倍に希釈したものがよい。
【0030】
また、クマザサエキスは原エキスを5〜10倍に希釈されたものを主成分として含む液剤が滋養強壮剤として多くの人に常用されており、この点からすれば、この範囲の濃度のクマザサエキスを血管内皮細胞に対する細胞接着因子の発現抑制剤として用いることは、毒性、副作用の点からは何等の問題もなく、かつその場合に該抑制効果を奏することも、前記したとおり実施例における「細胞接着因子の発現抑制性能試験」の結果から十分に期待できるところである。
逆に、実施例にある1000倍希釈を更に5倍希釈した場合である5000倍に希釈した場合についても前記した発現抑制性能試験結果から、前記したとおり該抑制効果があることは十分に期待できるところである。
【0031】
そのクマザサエキスの濃度を銅クロロフィリンナトリウムの濃度で示すと、実施例の製造方法で作製したクマザサエキス、すなわち原エキス中の銅クロロフィリンナトリウムの濃度は230mg/100mLである。
したがって、本発明の細胞接着因子の発現抑制剤中におけるクマザサエキスの銅クロロフィリンナトリウム濃度は、23mg/100mL〜0.05mg/100mLがよく、好ましくは2.3mg/100mL〜0.23mg/100mLがよい、
【実施例1】
【0032】
以下において、実施例1として、クマザサエキスの製造実施例、並びにそのエキスを用いたVCAM−1の発現抑制性能試験例及びICAM−1の発現抑制性能試験例を示すが、本発明は、この実施例によって何ら限定されるものではなく、特許請求の範囲によって把握されるものであることはいうまでもない。
【0033】
[クマザサエキスの製造例]
クマザサエキス(熊笹葉葉緑素液)の製造原料である、採取後2日目の生のクマザサの新葉4000kgを、温度90℃の硫酸銅3重量%水溶液が入れられている硫酸銅処理液槽に浸漬して、1時間処理した。この処理により葉緑素中のMgがCuに置換され葉緑素は安定化され、熊笹の容量は約1/3に減少した。処理後の熊笹を温度−5℃の冷凍庫で3ケ月保存した。その保存後の熊笹を温湯で解凍した後、回転する刃を備えた切断機にて切断した。
【0034】
その切断後濃度3重量%で90℃の苛性ソーダ溶液を含有する溶解釜にて処理して、葉緑素成分を含有する液を形成し、ついでこれをベルトプレス分離機にて残渣と分離して葉緑素液を得た。その分離後、葉緑素液を温度20℃に低下させた後、中和水洗タンクに入れて7%塩酸を加えて中和し、酸性熊笹沈殿物を生成し常水にてpHが3になるまで水洗する。沈殿物(水分99%)をフィルタープレスにて脱水し、ペースト状酸性熊笹葉緑素4065リットル(L)を得、これに純水3053Lを加えて液状葉緑素7118Lを得た。この液状葉緑素に59kgの炭酸水素ナトリウムを加えて約pH7.3の熊笹葉葉緑素液を製造した。
【0035】
その製造された熊笹葉葉緑素液中の銅クロロフィリンナトリウム濃度は230mg/100mLであった。その葉緑素液中には、銅クロロフィリンナトリウムのほかに各種のアミノ酸、鉄、マグネシウムなどの無機質成分、ビタミン等が含有された。含有される各種アミノ酸は、リジン、ヒスチジン、アルギニン、アスパラギン酸、スレオニン、セリン、グルタミン酸、プロリン、グリシン、アラニン、バリン、メチオニン、イソロイシン、ロイシン、フェニールアラニン、GABAであった。
【0036】
[細胞接着因子の発現抑制性能試験例]
前記製造例で作製されたクマザサエキスを純水で希釈し、その希釈されたクマザサエキスを用いて、ヒト臍帯静脈内皮細胞[human umbilical vein endothelial cell(HUVEC) 三光純薬(株)製]における細胞接着因子の発現に対する抑制効果を調査する。その際には、100倍から1000倍の間で数種の希釈率のものを作製し、それを用いてウエスタンブロット(Western blot)法により細胞接着因子の発現に対する抑制効果を調査した。
【0037】
(細胞培養)
ヒト臍帯静脈内皮細胞[human umbilical vein endothelial cell(HUVEC) 三光純薬(株)製]を5%ウシ胎児血清[fetal bovine serum(FBS)、米国JRHバイオサイエンス(JRH Bioscienses)社製]を含む血管内皮細胞用基礎培地(endothelial cell basal medium)−2で懸濁し、50μg/mLのコラーゲンタイプI[米国BDバイオサイエンス(BD Biosciences)社製]でコーティングした培養皿(dish)に播種した後、37℃、5%の二酸化炭素(CO2)雰囲気の条件下で100%コンフルエント状態になるまで培養した。
【0038】
(ウエスタンブロット法による抑制効果の調査)
前記で培養したものを、100倍−1000倍に希釈したクマザサエキス(銅クロロフィリンナトリウム濃度2.3mg/100mL−0.23mg/100mL)、50μg/mL ECGS[血管内皮細胞増殖添加物、米国シグマ(Sigma)社製)]及び5unit/mLヘパリンを含む培地(Medium)199中で24時間培養した後、アンジオテンシンII[米国シグマ(Sigma)社製)]に15時間暴露した。
【0039】
その後、細胞溶解液(lysis buffer)[30mM トリス塩基(Tris),150mM NaCl,10mM エチレンジアミン4酢酸(EDTA),0.5% デオキシコール酸ナトリウム(sodium deoxycholate),1mM Na3VO4,160mM NaF,1% トリトンX-100(TritonX-100),1mM フッ化フェニルメチルスルホニル(phenylmethylsulfonylfluoride),12μg/mLアプロチニン(aporotinin),1μM ロイペプチン(leupeptin)]を用いて細胞を溶解した。
【0040】
この細胞溶解液を遠心分離(14,000rpm、10分、4℃)し、その上清をSDSポリアクリルアミドゲル(SDS−polyacrylamide gel)で電気泳動して、ポリビニリデンジフルオライド膜[polyvinyldene difluoride membrane[米国ミリポア(Millipore)社製]にタンパクを転写した。
【0041】
次いで、スキムミルク(non-fat milk)/TBS−T[トリスバッファー+ポリオキシエチレン(20)ソルビタンモノラウレート(Tris-Buffered saline-Tween 20)]、10mM トリス塩基(Tris),150mM NaCl,0.1% ポリオキシソルビタンモノラウレート(Tween20),pH7.5]で1時間ブロッキングした後、1次抗体と4℃で一晩反応させた。なお、前記1次抗体としては、anti−VCAM−1抗体[米国サンタクルズバイオテクノロジー(Santa Cruz Biotechnology)社製]、anti−ICAM−1抗体(米国サンタクルズバイオテクノロジー社製)、及びアンチβ−アクチン(anti-β-actin)抗体(米国シグマ(Sigma)社製)を使用した。
【0042】
その後、TBS−Tで前記した膜(membrane)を洗浄した後に、西洋わさびペルオキシダーゼ(horseradish peroxidase)標識2次抗体(英国GEヘルスケアー(GE Healthcare)社製)と室温で1時間反応させた。
さらに、ウエスタンブロッテング検出試薬[ECL Western Blotting Detection Reagents(英国GEヘルスケアー社製)]と反応させ、ルミノイメージアナライザーLAS−4000(富士フイルム社製)を用いて解析した。
【0043】
(抑制効果の調査結果)
前記解析した結果、すなわちヒト臍帯静脈内皮細胞(HUVEC)における細胞接着因子の発現に対するクマザサエキスの抑制効果を図1及び2に示す。
また、それらの図には、前記調査で実施したクマザサエキスが与えるβ−actinタンパク発現に対する影響、及びアンジオテンシンII刺激による影響に関する調査結果についても合わせて示した。
【0044】
〈VCAM−1の発現に対する抑制効果〉
図1には、VCAM−1の発現に対するクマザサエキスの抑制効果が図示されている。
それによれば、HUVECをクマザサエキス100倍希釈液(銅クロロフィリンナトリウム濃度2.3mg/100mL)で処置すると、VCAM−1タンパクの発現レベルが未処置群(コントロール)の16%まで減少することがわかる。
また、その際、クマザサエキスの処置によっては、内部標準としてのβ−アクチン(actin)タンパクの発現量には何等変化が認められないので、クマザサエキスがVCAM−1タンパクの発現を特異的に減少させていることがわかる。
【0045】
〈ICAM−1の発現に対する抑制効果〉
図2には、ICAM−1の発現に対するクマザサエキスの抑制効果が図示されている。
それによれば、HUVECをクマザサエキス100倍希釈液(銅クロロフィリンナトリウム濃度2.3mg/100mL)で処置すると、IVCAM−1タンパクの発現レベルが未処置群(コントロール)の74%に減少することがわかる。
また、その際には、クマザサエキスの処置後に内部標準としてのβ−アクチン(actin)タンパクの発現量には何等変化が認められないにもかかわらず、クマザサエキスがICAM−1タンパクの発現を減少させていることがわかる。
【0046】
〈アンジオテンシンII刺激による影響の調査結果〉
以上の調査のほかに酸化ストレス刺激としてアンジオテンシンII(100nM)で15時間処置した後に細胞接着因子量を調査すると、VCAM−1及びICAM−1の発現量は図1及び2に図示するとおり基礎値(basalレベル)の1.4倍に増加した。
これに対し、更にHUVECをクマザサエキス(100倍、300倍、1000倍の各希釈液)で24時間処置した後に同様にアンジオテンシンII刺激を行った場合には、図1及び2に図示するとおりVCAM−1及びICAM−1の発現増加は濃度依存的に有意に抑制された。これらの場合にも、内部標準としてのβ−アクチン(actin)タンパクの発現量には何等変化が認められないので、クマザサエキスがこれらの細胞接着因子の発現を特異的に抑制することがわかる。
【産業上の利用可能性】
【0047】
本発明は、お茶、滋養強壮剤あるいは健康食品として国内で広く利用されている範囲の濃度、すなわち毒性あるいは副作用に関し懸念する必要のない濃度で、服用することにより、血管内皮細胞において細胞接着因子の発現抑制することができる。
その結果、血管内皮細胞における細胞接着因子の増殖に伴って発症する各種疾病の治療、予防に役立つことが期待できる。
具体的には、動脈硬化、高血圧症、心筋梗塞、脳梗塞、あるいはがん転移等の治療薬及び予防薬として役立つことが期待される。
【特許請求の範囲】
【請求項1】
硫酸銅で安定化処理されたクマザサエキスを含有する血管内皮細胞における細胞接着因子の発現抑制剤。
【請求項2】
前記細胞接着因子がVCAM又はICAMである請求項1に記載の血管内皮細胞における細胞接着因子の発現抑制剤。
【請求項3】
前記クマザサエキスにおける銅クロロフィリンナトリウム濃度が2.3mg/100mL〜0.23mg/100mLである請求項1又は2に記載の血管内皮細胞における細胞接着因子の発現抑制剤。
【請求項4】
前記クマザサエキス作製に使用したクマザサが新葉である請求項1、2又は3に記載の血管内皮細胞における細胞接着因子の発現抑制剤。
【請求項1】
硫酸銅で安定化処理されたクマザサエキスを含有する血管内皮細胞における細胞接着因子の発現抑制剤。
【請求項2】
前記細胞接着因子がVCAM又はICAMである請求項1に記載の血管内皮細胞における細胞接着因子の発現抑制剤。
【請求項3】
前記クマザサエキスにおける銅クロロフィリンナトリウム濃度が2.3mg/100mL〜0.23mg/100mLである請求項1又は2に記載の血管内皮細胞における細胞接着因子の発現抑制剤。
【請求項4】
前記クマザサエキス作製に使用したクマザサが新葉である請求項1、2又は3に記載の血管内皮細胞における細胞接着因子の発現抑制剤。
【図1】


【図2】




【図2】


【公開番号】特開2011−219434(P2011−219434A)
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願番号】特願2010−92795(P2010−92795)
【出願日】平成22年4月14日(2010.4.14)
【出願人】(397009462)株式会社和漢薬研究所 (2)
【出願人】(305060567)国立大学法人富山大学 (194)
【Fターム(参考)】
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願日】平成22年4月14日(2010.4.14)
【出願人】(397009462)株式会社和漢薬研究所 (2)
【出願人】(305060567)国立大学法人富山大学 (194)
【Fターム(参考)】
[ Back to top ]

