被検物質の電気化学的検出方法
【課題】高い検出感度で被検物質を検出することができる被検物質の電気化学的検出方法を提供する。
【解決手段】作用電極上に捕捉された被検物質Sを標識し検出する際に、被検物質Sと、被検物質Sに結合する結合物質91に、電解液と捕捉物質が結合している部位以外の作用電極部位とに対して相互作用を生じる修飾物質92を介して標識物質93が保持された標識結合物質90とを含む複合体を形成させる。そして、作用電極60上に存在する標識物質93を電気化学的に検出する。
【解決手段】作用電極上に捕捉された被検物質Sを標識し検出する際に、被検物質Sと、被検物質Sに結合する結合物質91に、電解液と捕捉物質が結合している部位以外の作用電極部位とに対して相互作用を生じる修飾物質92を介して標識物質93が保持された標識結合物質90とを含む複合体を形成させる。そして、作用電極60上に存在する標識物質93を電気化学的に検出する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、被検物質の電気化学的検出方法に関する。より詳しくは、核酸、タンパク質等の被検物質の検出及び定量等、並びに、これらを利用する疾病の臨床検査及び診断等に有用な、被検物質の電気化学的検出方法に関する。
【背景技術】
【0002】
疾病の臨床検査及び診断は、生体試料中に含まれる疾病に関連する遺伝子又はタンパク質等を、遺伝子検出法及び免疫学的検出法等の検出法によって検出することにより行なわれている。かかる臨床検査及び診断を行なうための方法として、光化学的に活性な標識物質を光励起させることにより生じる光電流を、核酸、タンパク質等の被検物質の検出に利用する光化学的検出方法が提案されている。ここで、臨床検査及び診断では、検体に含まれる微量な被検物質を検出する必要があるため、被検物質の検出感度の向上が求められている。
【0003】
例えば、特許文献1の段落番号[0069]〜[0078]には、被検物質であるタンパク質を特異的に認識する捕捉物質である抗体が固定化された電極と、電気化学的に活性な標識物質により結合物質である抗体が標識された標識抗体とを用いる光電流による被検物質の特異的検出法が開示されている。特許文献1に記載の方法では、まず、被検物質と電極上の抗体とを接触させ、抗体によって被検物質を電極上に捕捉する。その後、電極上に捕捉された被検物質と、標識抗体とを接触させて、捕捉物質と被検物質と標識抗体とを含む複合体を形成させる。そして、複合体中の標識物質に基づく光電流を測定することにより、被検物質が検出される。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】国際公開第2010/024446号、段落番号[0069]〜[0078]
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、電極上で形成された複合体が嵩高いため、複合体中に含まれる標識物質と電極との間の物理的距離が長くなり、標識物質と電極との間において、電子輸送が行なわれにくくなる。例えば、IgG抗体は、10nm程度の大きさを有している。したがって、特許文献1に記載の方法において、捕捉物質及び標識抗体を構成する抗体としてIgG抗体を用いる場合、被検物質の検出に際して、電極上に形成される複合体中の標識物質は、電子輸送が効率よく起こりうる電極表面から非常に離れた位置に存在することになる。このように、特許文献1に記載の方法では、被検物質の検出の際に形成される複合体の嵩高さが、高感度化を図る上で大きな制約となっている。
【0006】
本発明は、前述の事情に鑑みてなされたものであり、高い検出感度で被検物質を検出することができる被検物質の電気化学的検出方法を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは、上記課題を解決するために鋭意検討した結果、被検物質の検出に際して、電解液と捕捉物質が結合している部位以外の作用電極部位とに対して相互作用を生じる修飾物質を介して、標識物質が抗体に固定された標識結合物質を用いることにより、検出感度が著しく向上するという知見を得て、本発明を完成させた。
【0008】
すなわち、本発明は、
〔1〕 被検物質を電解液中で電気化学的に検出する方法であって、
(1) 被検物質を含む試料を、この被検物質を捕捉する捕捉物質が作用電極本体上に固定された作用電極に接触させ、前記捕捉物質によって被検物質を作用電極上に捕捉する工程、
(2) 前記工程(1)で作用電極上に捕捉された被検物質と、当該被検物質に結合する結合物質に修飾物質を介して標識物質が保持された標識結合物質と、を含む複合体を作用電極上に形成させる工程、及び
(3) 前記工程(2)で得られた作用電極上に存在する標識物質を電気化学的に検出する工程
を含み、
前記修飾物質は、電解液と、補足物質が結合している部位以外の作用電極部位と、に対して相互作用を生じる物質である、
被検物質の電気化学的検出方法、
〔2〕 前記電解液が、非プロトン性溶媒を含有し、かつ前記作用電極の表面及び前記修飾物質が親水性を示す前記〔1〕に記載の方法、
〔3〕 前記修飾物質が、DNAである前記〔1〕又は〔2〕に記載の方法、
〔4〕 前記電解液が、プロトン性溶媒を含有し、かつ前記作用電極の表面及び前記修飾物質が疎水性を示す前記〔1〕に記載の方法、
〔5〕 前記工程(2)において、前記工程(1)で作用電極上に捕捉された被検物質と、前記標識結合物質とを接触させることにより、前記複合体を作用電極上に形成させる前記〔1〕〜〔4〕のいずれかに記載の方法、
〔6〕 前記工程(2)において、前記被検物質に結合する第1結合物質を含む結合体と、前記工程(1)で作用電極上に捕捉された被検物質とを接触させ、その後、被検物質に結合した前記結合体と、前記結合体に結合する第2結合物質に前記修飾物質を介して前記標識物質が結合した標識体とを接触させることにより、前記複合体を作用電極上に形成させる前記〔1〕に記載の方法、
〔7〕 前記工程(2)の後、作用電極を洗浄し、被検物質に結合していない標識結合物質を除去する前記〔1〕〜〔6〕のいずれかに記載の方法、
〔8〕 前記標識物質が、電気化学的又は光化学的に活性な物質である前記〔1〕〜〔7〕のいずれかに記載の方法、
〔9〕 前記標識結合物質が、前記結合物質に、修飾物質を介して複数の標識物質が保持された多価標識結合物質である、〔1〕〜〔8〕のいずれかに記載の方法、
〔10〕 前記工程(3)で得られた検出結果に基づいて、前記被検物質を定量する、〔9〕に記載の方法、並びに
〔11〕 前記被検物質は複数種類である、請求項〔9〕又は〔10〕のいずれかに記載の方法
に関する。
【発明の効果】
【0009】
本発明の被検物質の電気化学的検出方法によれば、高い検出感度で、被検物質を検出することができる。
【図面の簡単な説明】
【0010】
【図1】本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出装置を示す斜視図である。
【図2】図1に示される検出装置の構成を示すブロック図である。
【図3】本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出チップを示す斜視図である。
【図4】(A)は図3に示される検出チップのAA線での断面図である。(B)は図3に示される検出チップの上基板を下面側から見た斜視図である。(C)は図3に示される検出チップの下基板を上面側から見た斜視図である。
【図5】本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出チップ中の電極を含む部分の一例を模式的に表した断面説明図である。
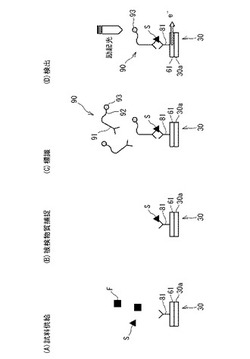
【図6】本発明の一実施の形態に係る被検物質の電気化学的検出方法の処理手順を示す工程説明図である。
【図7】従来の被検物質の電気化学的検出方法における検出工程を示す概略説明図である。
【図8】本発明の他の実施の形態に係る被検物質の電気化学的検出方法の処理手順を示す工程説明図である。
【図9】本発明のさらに他の実施の形態に係る被検物質の電気化学的検出方法の処理手順を示す工程説明図である。
【図10】(A)は試験例1において、実施例1で得られた標識結合物質を用いて被検物質を検出する場合(実験番号1)の検出工程を示す概略説明図である。(B)は、試験例1において、比較例1で得られた標識抗体を用いて被検物質を検出する場合(実験番号3)の検出工程を示す概略説明図である。
【図11】試験例1において、検出方法の種類と光電流との関係を調べた結果を示すグラフである。
【図12】実施例2における実験番号5の被検物質の電気化学的検出方法の処理手順の一部を示す工程説明図である。
【図13】実施例2における実験番号7の被検物質の電気化学的検出方法の処理手順の一部を示す工程説明図である。
【図14】(A)は実施例2における実験番号5の被検物質の電気化学的検出方法の検出工程を示す概略説明図である。(B)は実施例2における実験番号7の被検物質の電気化学的検出方法の検出工程を示す概略説明図である。
【図15】実施例2において、検出方法の種類と光電流との関係を調べた結果を示すグラフである。
【図16】製造例5で得られたビオチン化DNA−AlexaFluor750標識DNA複合体の概略説明図である。
【図17】実施例3における実験番号9の被検物質の電気化学的検出方法の処理手順の一部を示す工程説明図である。
【図18】実施例3において、検出方法の種類と光電流との関係を調べた結果を示すグラフである。
【図19】実施例4において、被検物質(マウスIgG)の濃度と光電流との関係を調べた結果を示すグラフである。
【図20】実施例5において、被検物質(ヒトIL−6)の濃度と光電流との関係を調べた結果を示すグラフである。
【図21】実施例6において、検出対象物の種類と光電流との関係を調べた結果を示すグラフである。
【発明を実施するための形態】
【0011】
[検出装置の構成]
本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出装置の一例を添付図面により説明する。
図1は、本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出装置を示す斜視図である。この検出装置1は、光化学的に活性な物質を標識物質として用いる検出方法に用いる検出装置である。
【0012】
検出装置1は、検出チップ20が挿入されるチップ受入部11と、検出結果を表示するディスプレイ12とを備えている。
【0013】
図2は、図1に示される検出装置の構成を示すブロック図である。検出装置1は、光源13と、電流計14と、電源15と、A/D変換部16と、制御部17と、ディスプレイ12とを備えている。
光源13は、検出チップ20の作用電極上に存在させた標識物質に光を照射して当該標識物質を励起させる。光源13は、励起光を発生する光源であればよい。かかる光源としては、例えば、蛍光灯、ブラックライト、殺菌ランプ、白熱電球、低圧水銀ランプ、高圧水銀ランプ、キセノンランプ、水銀−キセノンランプ、ハロゲンランプ、メタルハライドランプ、LED(白色LED、青色LED、緑色LED、赤色LED等)、レーザー(炭酸ガスレーザー、色素レーザー、半導体レーザー)、太陽光等が挙げられる。これらの光源のなかでは、蛍光灯、白熱電球、キセノンランプ、ハロゲンランプ、メタルハライドランプ、LED、レーザー又は太陽光が好ましく、レーザーが特に好ましい。光源は、必要に応じて、分光器やバンドパスフィルタにより、特定波長領域の光のみが放出されるように構成されたものであってもよい。
電流計14は、励起された標識物質から放出される電子に起因して検出チップ20内を流れる電流を測定する。
電源15は、検出チップ20に設けられた電極に対して所定の電位を印加する。
A/D変換部16は、電流計14によって測定された光電流値をデジタル変換する。
制御部17は、CPU(Central Processing Unit)、ROM(Read Only Memory)、RAM(Random Access Memory)等から構成されている。この制御部17は、ディスプレイ12、光源13、電流計14及び電源15の動作を制御する。また、制御部17は、A/D変換部16でデジタル変換された光電流値から、予め作成された光電流値と標識物質の量との関係を示す検量線に基づき、標識物質の量を概算し、被検物質の量を算出する。
ディスプレイ12は、制御部17で概算された被検物質の量等の情報を表示する。
【0014】
なお、標識物質を後述の酸化還元電流・電気化学発光検出法にしたがって検出する場合、検出装置は、光源13を備えていなくてもよい(図示せず)。
標識物質を電気化学発光により検出する場合、検出装置は、標識物質から生じる光等を検出するためのセンサをさらに備えていればよい。
【0015】
[検出チップの構成]
つぎに、本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出チップ20の構成を説明する。
【0016】
図3は、本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出チップを示す斜視図である。図4(A)は、図3に示される検出チップのAA線での断面図であり、図4(B)は、図3に示される検出チップの上基板を下面側から見た斜視図であり、図4(C)は、図3に示される検出チップの下基板を上面側から見た斜視図である。
【0017】
検出チップ20は、上基板30と、上基板30の下方に設けられた下基板40と、上基板30と下基板40とに挟まれた間隔保持部材50とを備えている。検出チップ20では、上基板30と下基板40とは、一側部において重複して配置されている。そして、上基板30と下基板40とが重複する部分には、間隔保持部材50が介在している。
【0018】
上基板30は、図4(B)に示されるように、基板本体30aと、作用電極60とを備えている。この基板本体30aには、被検物質を含む試料等を内部に注入するための試料注入口30bが設けられている。基板本体30aの表面には、作用電極60と、作用電極60に接続されている電極リード71とが形成されている。上基板30においては、作用電極60は、基板本体30aの一側部〔図4(B)の左側〕に配置されている。電極リード71は、作用電極60から基板本体30aの他側部〔図4(B)の右側〕に向けて延びている。試料注入口30bは、基板本体30aにおいて、間隔保持部材50が介装される部分よりも内側に設けられている。
【0019】
本実施の形態において、基板本体30aは、矩形状に形成されている。なお、基板本体30aの形状は、特に限定されるものではなく、多角形形状、円盤状等であってもよい。基板本体30aの形状は、基板の作製及び取り扱いの簡便性の観点から、好ましくは矩形状である。
【0020】
基板本体30aを構成する材料としては、特に限定されないが、例えば、ガラス、ポリエチレンテレフタレート、ポリイミド樹脂等のプラスチック類、金属等の無機材料等が挙げられる。これらのなかでは、光の透過性、十分な耐熱性、耐久性、平滑性等を確保し、かつ材料に要するコストを低減させる観点から、好ましくはガラスである。基板本体30aの厚さは、十分な耐久性を確保する観点から、好ましくは0.01〜1mm、より好ましくは0.1〜0.7mm、さらに好ましくは約0.5mmである。基板本体30aの大きさは、特に限定されないが、多種類の被検物質の検出(多項目)を前提とした場合には項目数によるが、通常、20mm×20mm程度の大きさである。
【0021】
下基板40は、図4(C)に示されるように、基板本体40aと、対極66と、参照電極69とを備えている。基板本体40aは、上基板30の基板本体30aと略同寸法の矩形状に形成されている。基板本体40a及び基板本体30aは、必ずしも、同寸法である必要はない。
【0022】
基板本体40aを構成する材料としては、特に限定されないが、例えば、ガラス、ポリエチレンテレフタレート、ポリイミド樹脂等のプラスチック類、金属等の無機材料等が挙げられる。これらのなかでは、耐熱性、耐久性、平滑性等を確保し、かつ材料に要するコストを低減させる観点から、好ましくはガラスである。基板本体40aの厚さ及び大きさは、上基板30の基板本体30aの厚さ及び大きさと同様である。
【0023】
基板本体40aの表面には、対極66と、対極66に接続された電極リード72と、参照電極69と、参照電極69に接続された電極リード73とが形成されている。下基板40においては、対極66は、基板本体40aの一側部〔図4(C)の右側〕に配置されている。参照電極69は、基板本体40a上において、対極66と対向する位置に配置されている。対極66の電極リード72と参照電極69の電極リード73とは、それぞれ、基板本体40aの一側部〔図4(C)の右側〕から他側部〔図4(C)の左側〕へ向けて延びている。対極66及び参照電極69の各電極リード72,73は、基板本体40aの他側部〔図4(C)の左側〕において互いに並列するように配置されている。電極リード72,73は、上基板30と下基板40とが重複する部分からはみ出して外部に露出している〔図3及び図4(A)参照〕。なお、基板本体30a及び基板本体40aは、当該基板本体を透過させるようにして光を照射する場合には、透過性を有する材料から構成された基板本体であることが望ましい。この場合、基板本体30a及び基板本体40aのうち、光を照射する側の基板本体が、透過性を有する材料から構成されていればよい。
【0024】
つぎに、作用電極60、対極66及び参照電極69について、詳細に説明する。
図5は、本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出チップ中の電極を含む部分の一例を模式的に表した断面説明図である。作用電極60は、ほぼ四角形状に形成されている。作用電極60は、図5に示されるように、基板本体30a上に形成された作用電極本体61と、作用電極本体61上に固定化された捕捉物質81とから構成されている。作用電極本体61には、電極リード71が接続されている。
【0025】
後述の光電気化学検出法に用いる検出チップにおいては、作用電極本体61は、励起光が照射されることにより被検物質から生じた電子を受容する半導体からなる。この半導体は、導電体及び電子受容体として機能する。半導体は、光励起により被検物質から生じた電子の注入が可能なエネルギー準位をとり得る物質であればよい。ここで、「光励起により被検物質から生じた電子の注入が可能なエネルギー準位」とは、伝導帯(コンダクションバンド)を意味する。すなわち、半導体は、後述の標識物質の最低非占有分子軌道(LUMO)のエネルギー準位よりも低いエネルギー順位を有すればよい。かかる半導体としては、特に限定されないが、例えば、シリコン、ゲルマニウム等の単体半導体;チタン、スズ、亜鉛、鉄、タングステン、ジルコニウム、ハフニウム、ストロンチウム、インジウム、セリウム、イットリウム、ランタン、バナジウム、ニオブ、タンタル等の酸化物を含む酸化物半導体;チタン酸ストロンチウム、チタン酸カルシウム、チタン酸ナトリウム、チタン酸バナジウム、ニオブ酸カリウム等のペロブスカイト型半導体;カドニウム、亜鉛、鉛、銀、アンチモン、ビスマス等の硫化物を含む硫化物半導体;ガリウム、チタン等の窒化物を含む半導体;カドミウム、鉛のセレン化物からなる半導体(例えば、カドミウムセレナイド等);カドミウムのテルル化物を含む半導体;亜鉛、ガリウム、インジウム、カドミウム等のリン化合物からなる半導体;ガリウム砒素、銅−インジウム−セレン化物、銅−インジウム−硫化物等の化合物を含む半導体;カーボン等の化合物半導体又は有機物半導体等が挙げられる。なお、半導体は、真性半導体及び不純物半導体のいずれであってもよい。上記した半導体のなかでは、酸化物半導体が好ましい。酸化物半導体のうち、真性半導体のなかでは、酸化チタン、酸化亜鉛、酸化スズ、酸化ニオブ、酸化インジウム、酸化タングステン、酸化タンタル及びチタン酸ストロンチウムが好ましい。酸化物半導体のうち、不純物半導体のなかでは、スズをドーパントとして含む酸化インジウム(ITO)及びフッ素をドーパントとして含む酸化スズ(FTO)が好ましい。作用電極の厚さは、通常、0.1〜1μm、好ましくは0.1〜200nm、より好ましくは0.1〜10nmである。
【0026】
本発明においては、後述の光電気化学検出法に用いる検出チップにおける作用電極本体61は、半導体層と導電層とから構成されていてもよい。この場合、作用電極本体61の電極リード71は、導電層に接続される。
半導体層を構成する半導体は、上記した半導体と同様である。この場合の半導体層の厚さは、好ましくは0.1〜100nm、さらに好ましくは0.1〜10nmである。
導電層は、導電性材料からなる。導電性材料としては、例えば、金、銀、銅、カーボン、白金、パラジウム、クロム、アルミニウム、ニッケル等の金属又はこれらの少なくとも1つを含む合金;酸化インジウム、スズをドーパントとして含む酸化インジウム(ITO)等の酸化インジウム系材料;酸化スズ、アンチモンをドーパントとして含む酸化スズ(ATO)、フッ素をドーパントとして含む酸化スズ(FTO)等の酸化スズ系材料;チタン、酸化チタン、窒化チタン等のチタン系材料;グラファイト、グラシーカーボン、パイロリティックグラファイト、カーボンペースト、カーボンファイバー等の炭素系材料等が挙げられる。導電層の厚さは、好ましくは1〜1000nm、より好ましくは1〜200nm、さらに好ましくは1〜100nmである。導電層の厚さは、導電性が確保でき、かつ電極から生じる光電流(バックグランド電流)が最小となる膜厚が望ましい。なお、導電性材料は、ガラス、プラスチック等の非導電性物質からなる非導電性基材の表面に導電性を有する材料からなる導電材層が設けられた複合基材であってもよい。かかる導電材層の形状は、薄膜状及びスポット状のいずれであってもよい。導電材層を構成する材料としては、例えば、スズをドーパントとして含む酸化インジウム(ITO)、アンチモンをドーパントとして含む酸化スズ(ATO)、フッ素をドーパントとして含む酸化スズ(FTO)等が挙げられる。導電層は、例えば、当該導電層を構成する材料の種類に応じた膜形成方法により形成させることができる。
【0027】
一方、後述の酸化還元電流・電気化学発光検出方法に用いる検出チップにおいては、作用電極本体61は、導電性材料からなる。
導電性材料は、光電気化学検出法に用いる検出チップにおける作用電極本体61の導電層に用いられる導電性材料と同様である。
導電性材料は、ガラス、プラスチック等の非導電性物質からなる非導電性基材の表面に導電性を有する材料からなる導電材層が設けられた複合基材であってもよい。かかる導電材層の形状は、薄膜状及びスポット状のいずれであってもよい。
この場合、作用電極本体61の厚さは、好ましくは1〜1000nm、さらに好ましくは10〜200nmである。
【0028】
作用電極本体61の表面には、捕捉物質81が固定化されている〔図5参照〕。捕捉物質81は、被検物質を捕捉する物質である。これにより、被検物質を作用電極本体61の近傍に存在させることができる。捕捉物質81は、被検物質の種類に応じて、適宜選択することができる。捕捉物質81としては、例えば、核酸、タンパク質、ペプチド、糖鎖、抗体、特異的な認識能を持つナノ構造体等が挙げられる。
【0029】
対極66は、図5に示されるように、基板本体40a上に形成されている。対極66は、導電性材料からなる薄膜からなる。導電性材料としては、例えば、金、銀、銅、カーボン、白金、パラジウム、クロム、アルミニウム、ニッケル等の金属又はこれらの少なくとも1つを含む合金、ITO、酸化インジウム等の導電性セラミックス、ATO、FTO等の金属酸化物、チタン、酸化チタン、窒化チタン等のチタン化合物等が挙げられる。導電性材料からなる薄膜の厚さは、好ましくは1〜1000nm、より好ましくは10〜200nmである。
【0030】
参照電極69は、図5に示されるように、基板本体40a上に形成されている。参照電極69は、導電性材料からなる薄膜からなる。導電性材料としては、例えば、金、銀、銅、カーボン、白金、パラジウム、クロム、アルミニウム、ニッケル等の金属又はこれらの少なくとも1つを含む合金、ITO、酸化インジウム等の導電性セラミックス、ATO、FTO等の金属酸化物、チタン、酸化チタン、窒化チタン等のチタン化合物等が挙げられる。導電性材料からなる薄膜の厚さは、好ましくは1〜1000nm、より好ましくは10〜200nmである。本実施の形態では、参照電極69を設けているが、本発明においては、参照電極69を設けなくてもよい。対極66に用いる電極の種類、膜厚にもよるが、電圧降下の影響が僅かな小さな電流(例えば、1μA以下)を測定する場合は、対極66が参照電極69を兼ねていてもよい。一方、大きな電流を測定する場合、電圧降下の影響を抑制し、作用電極60に印加する電圧を安定化させる観点から、参照電極69を設けることが好ましい。
【0031】
つぎに、間隔保持部材50について、説明する。間隔保持部材50は、矩形の環状体形状に形成され、絶縁体であるシリコーンゴムからなっている。間隔保持部材50は、作用電極60、対極66及び参照電極69を取り囲むように配置されている〔図4(A)、図5及び図6参照〕。上基板30と下基板40との間には間隔保持部材50の厚さに相当する間隔が形成されている。これにより、各電極(作用電極60、対極66及び参照電極69)の間には試料や電解液を収容するための空間20aが形成されている〔図4(A)、図5及び図6参照〕。間隔保持部材50の厚さは、通常、0.2〜300μmである。本発明においては、間隔保持部材50を構成する材料として、シリコーンゴムの代わりに、例えば、ポリエステルフィルム等のプラスチック製両面テープ等を用いることもできる。
【0032】
本発明においては、作用電極60、対極66及び参照電極69は、各電極が他の電極と接触しないように間隔保持部材50の枠内に配置されていればよい。したがって、作用電極60、対極66及び参照電極69は、同一の基板本体上に形成されていてもよい。本発明においては、対極66及び参照電極69は、基板本体上に形成された薄膜状の電極でなくてもよい。この場合、対極66及び参照電極69のうちの少なくともいずれかが間隔保持部材50の部材本体に設けられていてもよい。そして、上基板30及び下基板40のいずれかに、間隔保持部材50の部材本体に設けた電極以外の電極が設けられていればよい。
【0033】
[被検物質の電気化学的検出方法]
本発明の被検物質の電気化学的検出方法は、被検物質を電解液中で電気化学的に検出する方法であって、
(1) 被検物質を含む試料を、この被検物質を捕捉する捕捉物質が作用電極本体上に固定された作用電極に接触させ、捕捉物質によって被検物質を作用電極上に捕捉する工程、
(2) 工程(1)で作用電極上に捕捉された被検物質と、当該被検物質に結合する結合物質に、電解液と捕捉物質が結合している部位以外の作用電極部位とに対して相互作用を生じる修飾物質を介して標識物質が保持された標識結合物質と、を含む複合体を作用電極上に形成させる工程、及び
(3) 工程(2)で得られた作用電極上に存在する標識物質を電気化学的に検出する工程
を含むことを特徴とする。
【0034】
本発明の被検物質の電気化学的検出方法では、被検物質と、結合物質に修飾物質を介して標識物質が保持された標識結合物質と、を含む複合体を作用電極上に形成させる点に1つの大きな特徴がある。
【0035】
本発明の方法では、標識物質として、光化学的又は電気化学的に活性な物質が用いられる。光化学的に活性な物質は、当該物質が光により励起されることにより放出される電子を用いて検出される。一方、電気化学的に活性な物質は、当該物質に基づく酸化還元電流及び/又は電気化学発光を用いて検出される。したがって、本発明の方法は、標識物質の検出技術の種類によって、光電気化学検出方法(図6及び図8参照)及び酸化還元電流・電気化学発光検出方法(図9参照)に大別することができる。
【0036】
1.光電気化学検出方法
まず、光電気化学検出方法について説明する。光電気化学検出方法には、上述した図1に示される検出装置及び図3に示される検出チップを用いることができるが、これらに限定されるものではない。以下、図1に示される検出装置及び図3に示される検出チップを用いる場合を例としてあげて説明する。図6は、本発明の一実施の形態に係る被検物質の電気化学的検出方法の処理手順を示す工程説明図である。
【0037】
光電気化学検出方法では、ユーザーは、被検物質Sを含む試料を、検出チップ20の試料注入口30bより注入する〔図6(A)試料供給工程を参照〕。これにより、試料中の被検物質が検出チップ20を構成する上基板30の作用電極本体61上の捕捉物質81によって捕捉される〔図6(B)被検物質捕捉工程を参照〕。このとき、試料中の被検物質S以外の物質(夾雑物質F)は、捕捉物質81に捕捉されない。
捕捉物質81は、被検物質Sの種類に応じて適宜選択することができる。例えば、被検物質Sが核酸である場合、捕捉物質81として、かかる核酸にハイブリダイズする核酸プローブ、核酸に対する抗体、核酸と結合するタンパク質等を用いることができる。被検物質Sがタンパク質又はペプチドである場合、捕捉物質81として、かかるタンパク質又はペプチドに対する抗体等を用いることができる。
【0038】
捕捉物質81による被検物質の捕捉は、例えば、捕捉物質81と被検物質とが結合する条件下で行なうことができる。捕捉物質81と被検物質とが結合する条件は、被検物質の種類等に応じて適宜選択することができる。例えば、被検物質が核酸であり、捕捉物質81が核酸にハイブリダイズする核酸プローブである場合、被検物質の捕捉は、ハイブリダイゼーション用緩衝液存在下に行なうことができる。被検物質が核酸、タンパク質又はペプチドであり、捕捉物質81が核酸に対する抗体、タンパク質に対する抗体又はペプチドに対する抗体である場合、被検物質の捕捉は、リン酸緩衝生理的食塩水、ヘペス(HEPES)緩衝液、ピペス(PIPES)緩衝液、トリス(Tris)緩衝液等の抗原抗体反応を行なうのに適した溶液中で行なうことができる。被検物質がリガンドであり、捕捉物質81がリガンドに対するレセプターである場合、及び、被検物質がレセプターであり、捕捉物質81がレセプターに対するリガンドである場合には、被検物質の捕捉は、リガンドとレセプターとの結合に適した溶液中で行なうことができる。
【0039】
つぎに、ユーザーは、試料注入口30bから当該検出チップ20内に標識結合物質90を注入して、標識結合物質90を、作用電極本体61上の捕捉物質81により捕捉された被検物質Sに結合させる〔図6(C)標識工程を参照〕。標識工程では、作用電極本体61上の捕捉物質81と、被検物質Sと、標識結合物質90とを含む複合体が形成される。
【0040】
標識結合物質90は、被検物質Sに結合する結合物質91と、修飾物質92と、標識物質93とから構成されている。標識結合物質90では、標識物質93が修飾物質92を介して結合物質91に固定化されている。
【0041】
結合物質91は、被検物質Sにおいて、捕捉物質81とは異なる位置や場所に結合する物質であればよい。結合物質91は、被検物質Sの種類に応じて適宜選択される。例えば、被検物質Sが核酸である場合、結合物質91として、かかる核酸にハイブリダイズする核酸プローブ、核酸に対する抗体、核酸と結合するタンパク質等を用いることができる。また、被検物質Sがタンパク質又はペプチドである場合、結合物質91として、かかるタンパク質又はペプチドに対する抗体等を用いることができる。
【0042】
修飾物質92は、結合物質91と標識物質93との間に介在している。修飾物質92は、電解液と作用電極本体61とに対する相互作用を生じる物質である。
【0043】
修飾物質92は、後述の検出工程に用いられる電解液及び作用電極の表面の極性に応じて、親水性を示す修飾物質及び疎水性を示す修飾物質のなかから選択することが好ましい。
本実施の形態に係る被検物質の電気化学的検出方法では、電解液が、非プロトン性溶媒を含有し、かつ作用電極の表面及び修飾物質が親水性を示すか、あるいは電解液が、プロトン性溶媒を含有し、かつ作用電極の表面及び修飾物質が疎水性を示すことが好ましい。
【0044】
親水性を示す修飾物質としては、例えば、DNA、RNA等の核酸;親水性高分子化合物であるポリエチレングリコール;親水性アミノ酸であるアスパラギン、セリン、アスパラギン酸、グルタミン、グルタミン酸、トレオニン、アルギニン、ヒスチジン、リシン、チロシン、システイン等から主に構成される親水性ポリペプチド等が挙げられる。非プロトン性溶媒としては、例えば、アセトニトリル(CH3CN)等のニトリル類;プロピレンカーボネート、エチレンカーボネート等のカーボネート類、1,3−ジメチルイミダゾリノン、3−メチルオキサゾリノン、ジアルキルイミダゾリウム塩等の複素環化合物;ジメチルホルムアミド、ジメチルスルホキシド、スルホラン等が挙げられる。非プロトン性溶媒のなかでは、アセトニトリルが好ましい。親水性を示す作用電極としては、例えば、表面に親水性官能基を有する電極等が挙げられる。親水性官能基としては、例えば、水酸基を含む官能基(例えば、シラノール基等)、アミノ基、チオール基等が挙げられる。かかる親水性を示す作用電極は、例えば、作用電極本体を、アミノ基を付与するアミノプロピルトリエトキシシラン、チオール基を付与するメルカプトプロピルトリエトキシシラン等のシランカップリング剤で処理を施すこと等により得ることができる。また、本発明においては、表面に親水性官能基を有する電極に、ポリエチレングリコール、核酸等をさらに結合させて親水性処理を施してもよい。
【0045】
一方、疎水性を示す修飾物質としては、例えば、疎水性アミノ酸であるグリシン、トリプトファン、メチオニン、プロリン、フェニルアラニン、アラニン、バリン、ロイシン、イソロイシン等から主に構成される疎水性ペプチド;疎水性を示す炭化水素から主に構成される高分子化合物(例えば、スチレンオリゴマー、アクリルオリゴマー等)が挙げられる。プロトン性溶媒としては、例えば、水;水を主体に緩衝液成分を混合した極性溶媒等が挙げられる。疎水性を示す作用電極としては、例えば、表面に疎水性官能基を有する電極等が挙げられる。かかる疎水性を示す作用電極は、例えば、シラノール基が導入された金属酸化物からなる作用電極本体に対して、当該作用電極本体の表面にメチル基やフェニル基を導入しうる化合物、例えば、メチルトリメトキシシラン、フェニルトリエトキシシラン等で処理すること等により得ることができる。
【0046】
修飾物質92の長さは、作用電極上での複合体の形成反応、例えば、捕捉した被検物質への結合物質の結合反応を阻害しない範囲で適宜選択することができる。修飾物質92の長さは、通常、100nm以下が好ましい。なお、修飾物質92の長さの下限値は、修飾物質92の種類などにより異なるので、修飾物質92の種類などに応じて適宜設定することが望ましい。
【0047】
標識物質93は、光を照射することにより励起状態となり電子を放出する物質である。標識物質93として、金属錯体、有機蛍光体、量子ドット及び無機蛍光体からなる群より選択された少なくとも1つを用いることができる。
標識物質の具体例としては、金属フタロシアン、ルテニウム錯体、オスミウム錯体、鉄錯体、亜鉛錯体、9−フェニルキサンテン系色素、シアニン系色素、メタロシアニン色素、キサンテン系色素、トリフェニルメタン系色素、アクリジン系色素、オキサジン系色素、クマリン系色素、メロシアニン系色素、ロダシアニン系色素、ポリメチン系色素、ポルフィリン系色素、フタロシアニン系色素、ローダミン系色素、キサンテン系色素、クロロフィル系色素、エオシン系色素、マーキュロクロム系色素、インジゴ系色素、BODIPY系色素、CALFluor系色素、オレゴングリーン系色素、ロードル(Rhodol)グリーン、テキサスレッド、カスケードブルー、核酸(DNA、RNA等)、セレン化カドミウム、テルル化カドミウム、Ln2O3:Re、Ln2O2S:Re、ZnO、CaWO4、MO・xAl2O3:Eu、Zn2SiO4:Mn、LaPO4:Ce、Tb、Cy3、Cy3.5、Cy5、Cy5.5、Cy7、Cy7.5及びCy9(いずれも、アマシャムバイオサイエンス社製);Alexa Fluor 355、Alexa Fluor 405、Alexa Fluor 430、Alexa Fluor 488、Alexa Fluor 532、Alexa Fluor546、Alexa Fluor 555、Alexa Fluor 568、Alexa Fluor 594、Alexa Fluor 633、Alexa Fluor 647、Alexa Fluor 660、Alexa Fluor 680、Alexa Fluor 700、Alexa Fluor 750及びAlexa Fluor 790(いずれも、モレキュラープローブ社製);DY−610、DY−615、DY−630、DY−631、DY−633、DY−635、DY−636、EVOblue10、EVOblue30、DY−647、DY−650、DY−651、DY−800、DYQ−660及びDYQ−661(いずれも、Dyomics社製);Atto425、Atto465、Atto488、Atto495、Atto520、Atto532、Atto550、Atto565、Atto590、Atto594、Atto610、Atto611X、Atto620、Atto633、Atto635、Atto637、Atto647、Atto655、Atto680、Atto700、Atto725及びAtto740(いずれも、Atto−TEC GmbH社製);VivoTagS680、VivoTag680及びVivoTagS750(いずれも、VisEnMedical社製)等が挙げられる。なお、LnはLa、Gd、Lu又はYを示し、Reはランタニド族元素を示し、Mはアルカリ土類金属元素を示し、xは0.5〜1.5の数を示す。標識物質の他の例については、例えば、特許第4086090号公報、特開平7−83927号公報等を参照することができる。
【0048】
修飾物質92と結合物質91との結合様式としては、共有結合、非共有結合等が挙げられる。
【0049】
修飾物質92を結合物質91に共有結合により結合させる方法は、特に限定されるものではない。
【0050】
結合物質91において、修飾物質92を共有結合させる部位は、特に限定されないが、結合物質91と修飾物質92との結合等の操作が簡便であることから、アミノ基及びスルフヒドリル基が好ましい。
【0051】
アミノ基へ結合できる反応基としては、例えば、サクシンイミド基(NHS)、イソチオシアノ基(ITC)、クロロスルホニル基、クロロアシル基、オキシエチレン基、クロロアルキル基、アルデヒド基、カルボキシル基等が挙げられる。これらのなかでは、アミノ基を介して目的とする修飾物質92を共有結合により結合させる場合には、水系での反応が必須であり、反応溶液のpHが中性〜弱アルカリ性領域にあること、氷冷下から37℃程度の反応温度で短時間に反応が進むこと等のように反応化合物を使用できる条件が限られていることから、好ましくはNHS及びITCである。したがって、修飾物質92として、NHS及び/又はITCを有する修飾物質を用いることができる。
【0052】
スルフヒドリル基に結合させることができる反応基としては、例えば、マレイミド基、ブロモアセトアミド基等があげられる。スルホヒドリル基は、通常、ポリペプチド中ではジスルフィド(S−S)結合を形成している。そのため、スルフヒドリル基を、修飾物質92を結合させる部位として用いる場合、ポリペプチド中のジスルフィド構造を還元し、スルフヒドリル基として用いることになる。ジスルフィド結合の還元には、ジチオスレイトール(DTT)、β−メルカプトエタノール(β−ME)、メルカプトエチルアミン(MEA)等を用いることができる。したがって、修飾物質92が、アミノ基及びスルフヒドリル基に対する反応性の高い官能基(例えば、サクシンイミド基、マレイミド基等)を有している場合には、結合物質91と修飾物質92とを混合するだけで、結合物質91のアミノ基及びスルフヒドリル基に修飾物質92を直接結合させることができる。かかる修飾物質92としては、例えば、サクシンイミドエステル修飾したDNA等が挙げられる。
【0053】
修飾物質92が、アミノ基、スルフヒドリル基、アルデヒド基、カルボキシル基等を有している場合は、例えば、化学クロスリンカーを介して結合物質91と修飾物質92とを結合させること;結合物質91がスルフヒドリル基を有する場合、結合物質91と修飾物質92との間にジチオール結合を形成させること;一般的な化学反応を行なうこと等により、結合物質91と修飾物質92とを容易に結合させることができる。
【0054】
クロスリンカーは、一般的に直鎖状の構造を有しており、両末端にアミノ基やチオール基と反応するサクシンイミド基、マレイミド基等を有するスペーサーからなる。かかるクロスリンカーを用いることにより、結合物質91と修飾物質92とを連結させることが可能である。
【0055】
例えば、修飾物質92がチオール基を有する場合、この修飾物質92を結合物質91のアミノ基に結合させる際に、一方の末端にサクシンイミド基を有し、かつ他方の末端にマレイミド基を有するクロスリンカーを用いることができる。この場合、まず、結合物質91中のアミノ基とクロスリンカー中のサクシンイミド基とを反応させ、クロスリンカーのマレイミド基を結合物質91に導入する。そして、マレイミド基と修飾物質92中のチオール基とを反応させることにより結合させることができる。ここで、クロスリンカーのスペーサーの長さは、特に限定されるものではない。クロスリンカーの具体例としては、N−[α−マレイミドアセトアセトキシ]スクシンイミドエステル(AMAS)、N−[β−マレイミドプロピルオキシ]スクシンイミドエステル(BMPS)、(マレイミドブチリルオキシ−スクシンイミドエステル(GMBS)、m−マレイミドベンゾイル−N−ヒドロキシスクシンイミドエステル(MBS)、スクシンイミジル トランス−4−(N−マレイミジルメチル)−シクロヘキサン−1−カルボキシラート(SMCC)、N−[ε−マレイミドカプロイルオキシ]スクシンイミドエステル(EMCS)、スクシンイミジル−4−(p−マレイミドフェニル)ブチラート(SMPB)、スクシンイミジル−6−[(β−マレイミドプロピオンアミド)ヘキサノエート](SMPH)、スクシンイミジル−4−[N−マレイミドメチル]シクロヘキサン−1−カルボキシ−[6−アミドカプロエート](LC−SMCC)、NHS−PEGn−Maleimid等が挙げられる。クロスリンカーは、両末端の官能基がアミノ基との反応性を有するグルタルアルデヒド、アミン反応性のNHSエステル基と光反応性のジアジリン基の2つの官能基を末端に有するクロスリンカー等であってもよい。
【0056】
結合物質91及び修飾物質92の両方がチオール基を有している場合、結合物質91のチオール基と修飾物質92のチオール基とを反応させることにより、ジチオール結合を形成することによっても結合可能である。修飾物質92がカルボキシル基を有し、かつ結合物質91がアミノ基を有する場合、カルボキシル基をNHSで活性化して、結合物質91のアミノ基と結合させることができる。修飾物質92がアルデヒド基を有し、かつ結合物質91がアミノ基を有する場合、修飾物質92のアルデヒド基と結合物質91のアミノ基との間でシッフ塩基を形成させた後、還元して安定な結合をつくることができる。
【0057】
修飾物質92を結合物質91に非共有結合により結合させる方法は、特に限定されるものではない。
【0058】
修飾物質92を結合物質91に非共有結合により結合させる方法としては、修飾物質92を結合物質91に非共有結合により直接結合させる方法、結合物質91に共有結合により結合させた物質を介して修飾物質92を非共有結合により結合させる方法等が考えられる。
【0059】
修飾物質92を結合物質91に非共有結合により結合させる方法としては、例えば、ストレプトアビジンとビオチンとの結合を利用する方法等が挙げられる。結合物質91に共有結合により結合させた物質を介して修飾物質92を非共有結合により結合させる方法としては、例えば、まず、末端にアミノ基等を有するDNAを結合物質91に共有結合させ、つぎに、上記したDNAに、修飾物質92を結合させた相補的なDNAをハイブリダイゼーションにより非共有結合的に結合させる方法等が挙げられる。
【0060】
修飾物質92への標識物質93の結合方法についても、修飾物質92を結合物質91に結合させるのと同様の方法により行なうことができる。
【0061】
つぎに、検出工程が行なわれる〔図6(D)検出工程を参照〕。
【0062】
かかる検出工程では、まず、ユーザーは、電解液を、検出チップ20の試料注入口30bより注入する。その後、ユーザーは、図1に示される検出装置1のチップ受入部11に検出チップ20を挿入する。そして、ユーザーは、検出装置1に測定開始を指示する。ここでは、検出装置1に挿入された検出チップ20の電極リード71,72,73は電流計14や電源15に接続される。そして、検出装置1の電源15により、参照電極69を基準として任意の電位が作用電極本体61に印加される。電極に印加される電位は、被検物質に対する励起光が照射されていない場合の電流値(定常電流、暗電流)が小さく、被検物質から生じる光電流が最大となる電位が好ましい。電位は、対極66に印加してもよく、作用電極本体61に印加してもよい。
【0063】
その後、検出装置1の光源13により、作用電極60上の標識物質93に励起光が照射される。これにより、標識物質93が励起し、電子を発生する。そして、発生した電子は、作用電極60に移動する。その結果、作用電極60と対極66との間に電流が流れる。そして、検出装置1の電流計14により、作用電極60と対極66との間に流れる電流が測定される。電流計14で測定された電流値は、標識物質93の個数と相関している。したがって、測定された電流値に基づき、被検物質Sを定量することができる。なお、励起光は、必要に応じて、分光器やバンドパスフィルタを用いて得られる特定波長領域の光のみであってもよい。
【0064】
その後、まず、A/D変換部16によってデジタル変換された電流値が制御部17に入力される。つぎに、予め作成された電流値と被検物質量との関係を示す検量線に基づき、制御部17により、デジタル変換後の電流値から、試料中の被検物質量が概算される。そして、概算された被検物質量の情報をディスプレイ12に表示するための検出結果画面が、制御部17によって作成される。その後、制御部17によって作成された検出結果画面がディスプレイ12に送信され、ディスプレイ12に表示される。
【0065】
電解液として、酸化された状態の標識物質93に電子を供給しうる塩からなる電解質と、非プロトン性溶媒又はプロトン性極性溶媒と、を含む溶液を用いることができる。この電解液は、所望により、他の成分をさらに含んでいてもよい。電解液は、ゲル状であってもよく、固体であってもよい。
【0066】
電解質としては、例えば、ヨウ化物、臭化物、金属錯体、チオ硫酸塩、亜硫酸塩、これらの混合物等が挙げられる。電解質の具体例としては、ヨウ化リチウム、ヨウ化ナトリウム、ヨウ化カリウム、ヨウ化セシウム、ヨウ化カルシウム等の金属ヨウ化物;テトラアルキルアンモニウムヨーダイド、ピリジニウムヨーダイド、イミダゾリウムヨーダイド等の4級アンモニウム化合物のヨウ素塩;臭化リチウム、臭化ナトリウム、臭化カリウム、臭化セシウム、臭化カルシウム等の金属臭化物;テトラアルキルアンモニウムブロマイド、ピリジニウムブロマイド等の4級アンモニウム化合物の臭素塩;フェロシアン酸塩、フェリシニウムイオン等の金属錯体;チオ硫酸ナトリウム、チオ硫酸アンモニウム、チオ硫酸カリウム、チオ硫酸カルシウム等のチオ硫酸塩;亜硫酸ナトリウム、亜硫酸カリウム、亜硫酸アンモニウム、亜硫酸鉄、亜硫酸水素ナトリウム、亜硫酸カルシウム等の亜硫酸塩;及びこれらの混合物等が挙げられる。これらのなかでは、テトラプロピルアンモニウムヨーダイド及びヨウ化カルシウムが好ましい。
【0067】
電解液の電解質濃度は、好ましくは0.001〜15Mである。
【0068】
標識物質93への光の照射には、標識物質93を光励起することができる波長の光を照射できる光源を用いることができる。かかる光源は、標識物質93の種類等に応じて、適宜選択することができる。光源としては、例えば、蛍光灯、ブラックライト、殺菌ランプ、白熱電球、低圧水銀ランプ、高圧水銀ランプ、キセノンランプ、水銀−キセノンランプ、ハロゲンランプ、メタルハライドランプ、LED(白色LED、青色LED、緑色LED、赤色LED等)、レーザー(炭酸ガスレーザー、色素レーザー、半導体レーザー)、太陽光等が挙げられる。光源のなかでは、蛍光灯、白熱電球、キセノンランプ、ハロゲンランプ、メタルハライドランプ、LED又は太陽光が好ましい。検出工程においては、必要に応じて、分光器やバンドパスフィルタを用いて得られる特定波長領域の光のみを標識物質93に照射してもよい。
【0069】
標識物質93に由来する光電流の測定には、例えば、電流計、ポテンショスタット、レコーダ、計算機等を備える測定装置を用いることができる。
かかる検出工程では、光電流を定量することにより、被検物質の量を調べることができる。
【0070】
以上のように、本実施の形態に係る被検物質の電気化学的検出方法では、被検物質Sの検出時には、結合物質91と標識物質93との間に修飾物質92が介在した状態となっている〔図6(D)を参照〕。これに対して、従来の被検物質の電気化学的検出方法では、例えば、図7(A)に示されるように、被検物質Sの標識には、結合物質としての抗体102が標識物質103により直接標識された標識抗体101が用いられている。そして、作用電極本体61上の捕捉物質81と、被検物質Sと、標識抗体101とを含む複合体を形成させ、電極上に形成された複合体中の標識物質103から生じる電流(光電流)に基づいて被検物質Sが検出される。そのため、図7に示される従来の方法では、被検物質Sの検出の際に形成される複合体の嵩高さが、高感度化を図る上で大きな制約となり、検出される光電流が小さくなる傾向にある。
【0071】
ところが、本実施の形態に係る被検物質の電気化学的検出方法では、作用電極60上に形成される複合体は、図7に示される従来の方法での被検物質Sの標識の際に形成される複合体と比べ、より嵩高くなっているにもかかわらず、予想外にも、図7に示される従来の方法よりも、高い検出感度で被検物質を検出することができる。
【0072】
なお、本実施の形態に係る被検物質の電気化学的検出方法では、夾雑物質に基づくノイズの発生を抑制する観点から、ユーザーは、被検物質捕捉工程後、検出チップ20の試料注入口30bより夾雑物質を含む残部の液体を排出し、検出チップ20内を洗浄してもよい。検出チップ20内の洗浄には、例えば、緩衝液(特に界面活性剤を含んだ緩衝液);精製水(特に界面活性剤を含んだ精製水);エタノール等の有機溶媒等を用いることができる。
【0073】
本実施の形態に係る被検物質の電気化学的検出方法では、被検物質Sに結合していない遊離の標識結合物質90を除去して、検出精度を向上させる観点から、標識工程の後、検出チップ20内を洗浄し、遊離の標識結合物質190を除去する工程をさらに行なってもよい。かかる洗浄には、例えば、エタノール、精製水等を用いることができる。
【0074】
さらに、本発明においては、標識工程において、標識物質が予め結合されている標識結合物質を用いて被検物質Sを標識する代わりに、図8に示されるように、標識工程中において、標識結合物質が形成されるように操作を行なってもよい。図8は、本発明の他の実施の形態に係る被検物質の電気化学的検出方法の処理手順を示す工程説明図である。図8に示される被検物質の電気化学的検出方法では、(A)試料供給工程、(B)被検物質捕捉工程及び(D)検出工程は、前述した図6に示される方法の(A)試料供給工程、(B)被検物質捕捉工程及び(D)検出工程と同様である。一方、図8に示される被検物質の電気化学的検出方法では、(C)標識工程において、まず、被検物質Sに結合体〔第1結合体90a及び第2結合体90b〕を付加する〔図8(C−1)結合体付加工程を参照〕。この(C−1)結合体付加工程では、まず、被検物質Sに結合する第1結合物質91aと、第2結合物質91bとからなる第1結合体90aを、作用電極本体61上の捕捉物質により捕捉された被検物質Sに結合させる〔図8(C−1−1)第1結合体付加工程を参照〕。つぎに、第1結合体90aに含まれる第2結合物質91bに結合する第2結合体90bを、第1結合体90aに結合させる〔図8(C−1−2)第2結合体付加工程を参照〕。その後、第2結合物質91bに修飾物質92を介して標識物質93が固定された標識体90cを、第2結合体90bに結合させる〔図8(C−2)標識体付加工程を参照〕。なお、図8に示される方法では、第1結合体90a及び標識体90cは、同じ結合物質(第2結合物質91b)により、第2結合体90bに結合するが、第1結合体90a中において、第2結合体90bと結合する結合物質と、標識体90c中において、第2結合体90bと結合する結合物質とは、互いに異なる物質であってもよい。
【0075】
2.酸化還元電流・電気化学発光検出方法
つぎに、酸化還元電流・電気化学発光検出方法について説明する。図9は、本発明のさらに他の実施の形態に係る被検物質の電気化学的検出方法の処理手順を示す工程説明図である。
【0076】
かかる酸化還元電流・電気化学発光検出方法は、標識工程〔図9(C)参照〕において、標識物質193として、電圧を印加することにより酸化還元電流を生じる標識物質又は電圧を印加することにより発光する標識物質を用いる点及び検出工程〔図9(D)参照〕において、電圧を作用電極60に印加して標識物質193から生じた光を検出する点が光電気化学検出方法と大きく異なっている。したがって、試料供給工程〔図9(A)参照〕及び被検物質捕捉工程〔図9(B)参照〕は、光電気化学検出方法と同様である。なお、本実施の形態に係る被検物質の電気化学的検出方法に用いられる検出装置1は、光源13を備えず、標識物質から生じる光を検出するためのセンサをさらに備えている装置である。本実施の形態に係る被検物質の電気化学的検出方法に用いられる検出チップ20は、作用電極本体61が導電性材料からなるものである。
【0077】
標識工程においては、ユーザーは、試料注入口30bから当該検出チップ20内に標識結合物質190を注入して、標識結合物質190を作用電極本体61上の捕捉物質81により捕捉された被検物質Sに結合させる〔図9(C)標識工程を参照〕。標識工程では、作用電極本体61上の捕捉物質81と、被検物質Sと、標識結合物質190とを含む複合体が形成される。
【0078】
標識結合物質190は、被検物質Sに結合する第1結合物質91と、修飾物質92と、標識物質193とから構成されている。標識結合物質190では、第1結合物質91と、標識物質193とが修飾物質92を介して連結されている。
【0079】
標識物質193は、電圧を印加することにより発光する標識物質である。
電圧を印加することにより発光する標識物質としては、例えば、ルミノール、ルシゲニン、ピレン、ジフェニルアントラセン、ルブレン等が挙げられる。
これらの標識物質の発光は、例えば、ホタルルシフェリン、デヒドロルシフェリンのようなルシフェリン誘導体、フェニルフェノール、クロロフェノールのようなフェノール類若しくはナフトール類のようなエンハンサ−を用いることにより増強することが可能である。
なお、本実施の形態に係る被検物質の電気化学的検出方法では、標識物質193として、電圧を印加することにより発光する標識物質の代わりに、電圧を印加することにより酸化還元電流を生じる標識物質を用いてもよい。
電圧を印加することにより酸化還元電流を生じる標識物質としては、例えば、電気的に可逆的な酸化還元反応を起こす金属を中心金属として含む金属錯体等が挙げられる。このような金属錯体としては、例えば、トリス(フェナントロリン)亜鉛錯体、トリス(フェナントロリン)ルテニュウム錯体、トリス(フェナントロリン)コバルト錯体、ジ(フェナントロリン)亜鉛錯体、ジ(フェナントロリン)ルテニュウム錯体、ジ(フェナントロリン)コバルト錯体、ビピリジンプラチナ錯体、ターピリジンプラチナ錯体、フェナントロリンプラチナ錯体、トリス(ビピリジル)亜鉛錯体、トリス(ビピリジル)ルテニュウム錯体、トリス(ビピリジル)コバルト錯体、ジ(ビピリジル)亜鉛錯体、ジ(ビピリジル)ルテニュウム錯体、ジ(ビピリジル)コバルト錯体等が挙げられる。
【0080】
なお、第1結合物質91及び修飾物質92は、光電気化学検出方法における第1結合物質91及び修飾物質92と同様である。
【0081】
つぎに、検出工程が行なわれる〔図9(D)検出工程を参照〕。
【0082】
かかる検出工程では、まず、ユーザーは、電解液を、検出チップ20の試料注入口30bより注入する。その後、ユーザーは、図1に示される検出装置1のチップ受入部11に検出チップ20を挿入する。そして、ユーザーは、検出装置1に測定開始を指示する。ここでは、検出装置1に挿入された検出チップ20の電極リード71,72,73は電流計14や電源15に接続される。そして、検出装置1の電源15により、作用電極60に電圧が印加される。これにより、標識物質193が励起され、光が生じる。標識物質193に基づく光の測定には、フォトンカウンタ等が用いられる。また、この場合、電極の代わりに、光ファイバーの先端に透明電極を形成することにより得られる光ファイバー電極を用いて光を間接的に検出することもできる(特許第2573443号公報を参照)。
【0083】
その後、まず、A/D変換部16によってデジタル変換された光量の値が制御部17に入力される。つぎに、予め作成された光量の値と被検物質量との関係を示す検量線に基づき、制御部17により、デジタル変換後の電流値から、試料中の被検物質量が概算される。そして、概算された被検物質量の情報をディスプレイ12に表示するための検出結果画面が、制御部17によって作成される。その後、制御部17によって作成された検出結果画面がディスプレイ12に送信され、ディスプレイ12に表示される。
【0084】
なお、本実施の形態に係る被検物質の電気化学的検出方法においても、夾雑物質に基づくノイズの発生を抑制する観点から、ユーザーは、被検物質捕捉工程後、検出チップ20の試料注入口30bより夾雑物質を含む残部の液体を排出し、検出チップ20内を洗浄してもよい。検出チップ20内の洗浄には、例えば、緩衝液(特に界面活性剤を含んだ緩衝液);精製水(特に界面活性剤を含んだ精製水);エタノール等の有機溶媒等を用いることができる。
【0085】
本実施の形態に係る被検物質の電気化学的検出方法では、被検物質Sに結合していない遊離の標識結合物質190を除去して、検出精度を向上させる観点から、標識工程の後、検出チップ20内を洗浄し、遊離の標識結合物質190を除去する工程をさらに行なってもよい。かかる洗浄には、例えば、エタノール、精製水等を用いることができる。
【0086】
さらに、本発明においては、標識工程において、標識物質193が予め結合されている標識結合物質190を用いて被検物質Sを標識する代わりに、標識工程中において、作用電極本体61上の捕捉物質81と、被検物質Sと、標識結合物質190とを含む複合体が形成されるように操作を行なってもよい。
【0087】
図9(D)では、光を測定する場合を例として挙げて示しているが、標識物質193が電圧を印加することにより酸化還元電流を生じる標識物質である場合には、標識物質193が励起され、電子が発生する。そして、発生した電子は、作用電極60に移動する。その結果、作用電極60と対極66との間に電流が流れる。そして、検出装置1の電流計14により、作用電極60と対極66との間に流れる電流が測定される。電流計14で測定された電流値は、標識物質の個数と相関している。したがって、測定された電流値に基づき、被検物質を定量することができる。
【実施例】
【0088】
以下、実施例等により、本発明を詳細に説明するが、本発明はこれらに限定されるものではない。
【0089】
(製造例1)
シランカップリング剤である3−メルカプトプロピルトリエトキシシラン(MPTES)を、その濃度が1体積%となるようにトルエンに添加し、溶液Aを得た。
【0090】
(製造例2)作用電極基板の作製
スパッタリング法により、二酸化ケイ素(SiO2)からなる基板本体上に、スズをドープした酸化インジウムの薄膜(厚さ200nm)からなる作用電極本体を形成した。この薄膜は、導電層と電子受容層とを兼ねている。つぎに、作用電極本体に、電流計と接続するための作用電極リードを接続した。
【0091】
つぎに、作用電極本体の表面を製造例1で得られた溶液Aを接触させて作用電極の本体表面にチオール基を付与した。
【0092】
また、捕捉物質である抗マウスIgG F(ab’)2抗体〔ダコ社製〕を、還元剤であるトリス(2−カルボキシエチル)ホスフィン塩酸塩(TCEP)固定ゲル〔ピアース製、商品名:Immobilized TCEP Disulfide Reducing Gel〕と接触させて還元し、抗マウスIgG Fab抗体を作製した。得られた抗マウスIgG Fab抗体を、その濃度が10μg/mLとなるようにトリス緩衝溶液〔pH7.2、以下、「TBS」という〕に添加し、抗体溶液を得た。
【0093】
つぎに、得られた抗体溶液を作用電極本体上に滴下した。そして、作用電極本体を4℃で一晩インキュベーションし、抗マウスIgG Fab抗体と作用電極本体上のチオール基とを反応させジチオール結合を形成した。これにより、抗マウスIgG Fab抗体を作用電極本体上に固定した。つぎに、作用電極本体上に、1mMトリエチレングリコール モノ−11−メルカプトウンデシルエーテル〔シグマ社製〕を滴下した。そして、作用電極本体を4℃で一晩インキュベーションして作用電極本体のブロッキングを行なった。これにより、作用電極基板を得た。
【0094】
(製造例3)
アセトニトリルとエチレンカーボネートとを体積比で2:3となるように混合し、非プロトン性溶媒を得た。この非プロトン性溶媒に、電解質塩としてテトラプロピルアンモニウムヨーダイドをその濃度が0.6Mとなるように溶解させた。得られた溶液に、さらに電解質として、ヨウ素をその濃度が0.06Mとなるように溶解させ、電解液を得た。
【0095】
(製造例4)
スパッタリング法により、二酸化ケイ素(SiO2)からなる基板本体上に、厚さ200nmの白金薄膜(導電層)からなる対極を形成し、対極基板を得た。この対極には電流計と接続するための対極リードを接続した。これにより、対極基板を得た。
【0096】
(実施例1)
抗マウスIgG抗体(シグマ社製)を、その濃度が7.3μMとなるように、0.1Mリン酸ナトリウム緩衝液(pH7)に添加した。つぎに、得られた混合物に、クロスリンカー〔(株)同仁化学研究所製、N−(4−マレイミドブチリルオキシ)スクシンイミド(GMBS)〕のジメチルスルホキシド(DMSO)溶液〔クロスリンカーの濃度:25mM〕を、クロスリンカーの濃度が2.5mMになるように添加した。得られた混合物を室温で30分間インキュベーションし、抗マウスIgG抗体とGMBSとを反応させた。得られた産物を脱塩カラム〔ピアース社製、商品名:Zeba Spin Micro desalting Column〕に供して未反応のGMBSを除去し、クロスリンカー結合抗体を得た。
【0097】
つぎに、得られたクロスリンカー結合抗体と、AlexaFluor750標識チオール化DNAとを、スクシンイミド基導入抗体/AlexaFluor750標識チオール化DNA(モル比)が1/14となるように混合した。得られた混合物を室温で4時間インキュベーションして、クロスリンカー結合抗体と、AlexaFluor750標識チオール化DNAとを反応させた。なお、AlexaFluor750標識チオール化DNAは、24ヌクレオチド長のDNA〔インビトロジェン社製5'-AACTACTGTCTTCACGCAGAAAGC-3'(配列番号:1)〕の5’末端がAlexaFluor750で標識され、かつ3’末端がチオール基修飾されたDNAである。
【0098】
得られた産物を、限外ろ過カラム〔アミコン社製、商品名:Amicon Ultra−0.5 100K〕に4回通して未反応のAlexaFluor750標識チオール化DNAを完全に除去し、標識結合物質を得た。得られた標識結合物質を、その濃度が1mg/mLとなるように、0.1Mリン酸ナトリウム緩衝液(pH7.0)を添加し、標識結合物質含有溶液を得た。
【0099】
得られた標識結合物質について、AlexaFluor750の吸収波長749nmにおける吸収を測定することにより、抗体1分子あたりの標識物質(AlexaFluor750)の数を調べた。その結果、抗体1分子あたりの標識物質(AlexaFluor750)の数は、9個であることが確認された。
【0100】
(比較例1)
抗マウスIgG抗体(シグマ社製)を、その濃度が14.6μMとなるように、0.1M炭酸ナトリウム緩衝液(pH8.5)に添加した。つぎに、得られた混合物に、AlexaFluor750誘導体〔商品名:AlexaFluor750 carboxylic acid,succinimidyl ester(インビトロジェン社製)〕のDMSO溶液〔AlexaFluor750誘導体の濃度:15mM〕を、AlexaFluor750誘導体の濃度が1.5mMになるように添加した。得られた混合物を室温で1時間インキュベーションし、抗マウスIgG抗体とAlexaFluor750誘導体とを反応させた。得られた産物を脱塩カラム〔ピアース社製、商品名:Zeba Spin Micro desalting Column〕に供して未反応のAlexaFluor750を除去し、標識抗体を得た。得られた標識抗体を、その濃度が2mg/mLとなるように、0.1Mリン酸ナトリウム緩衝液(pH7.0)を添加し、標識抗体含有溶液を得た。
【0101】
得られた標識抗体について、AlexaFluor750の吸収波長749nmにおける吸収を測定することにより、抗体1分子あたりの標識物質(AlexaFluor750)の数を調べた。その結果、抗体1分子あたりの標識物質(AlexaFluor750)の数は、10個であることが確認された。
【0102】
(試験例1)
(1−1)被検物質の捕捉
製造例2で得られた作用電極基板の作用電極の周囲に、隔壁となるようにシリコーンゴム(厚さ0.1mm)を配置した。その後、この作用電極基板とシリコーンゴムとに囲まれた空間に、1質量%ウシ血清アルブミン(BSA)を含む0.05質量%ポリオキシエチレンソルビタンモノラウラート(Tween−20)含有トリス緩衝溶液(TBS−T)を入れた。つぎに、上記した空間内の液体の排出後、100ng/mLマウスIgG(被験物質)含有1質量%BSAを含むTBS−T30μLを、上記した空間内に添加した。その後、作用電極基板を25℃1時間インキュベーションし、捕捉物質〔抗マウスIgG F(ab’)2抗体〕に、被検物質〔マウスIgG〕を捕捉させた〔図6(B)被検物質捕捉工程を参照〕。
【0103】
(1−2)標識
作用電極基板をTBS−Tで洗浄した。つぎに、実施例1で得られた1mg/mL標識結合物質含有溶液を、標識結合物質の濃度が20μg/mLとなるように1質量%BSAを含むTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションして、作用電極上の被検物質を標識した〔図6(C)参照〕(実験番号1)。
【0104】
一方、被検物質が存在しない場合の対照実験を以下のように行なった。まず、被検物質を捕捉させていない作用電極基板をTBS−Tで洗浄した。つぎに、実施例1で得られた1mg/mL標識結合物質含有溶液を、標識結合物質の濃度が20μg/mLとなるように1質量%BSAを含むTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした(実験番号2)。
【0105】
(2)対照実験
(1−1)と同様の操作を行ない、捕捉物質〔抗マウスIgG F(ab’)2抗体〕に、被検物質〔マウスIgG〕を捕捉させた。
【0106】
その後、(1−2)において、実施例1で得られた標識結合物質含有溶液の代わりに、比較例1で得られた標識抗体含有溶液を用いたことを除き、(1−2)と同様の操作を行ない、作用電極上の被検物質を標識した(実験番号3)。
【0107】
一方、被検物質が存在しない場合の対照実験を以下のように行なった。被検物質を捕捉させていない作用電極基板をTBS−Tで洗浄した。つぎに、比較例1で得られた2mg/mL標識抗体含有溶液を、標識結合物質の濃度が20μg/mLとなるように1質量%BSAを含むTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした(実験番号4)。
【0108】
(3)光電流の測定
実験番号1〜4の各作用電極基板の周囲に、厚さ0.2mmの側壁となるようにシリコーンゴムを配置した。つぎに、作用電極基板とシリコーンゴムとに囲まれた空間に、製造例3で得られた電解液を充填した。その後、電解液が充填された空間を、作用電極基板の上方から、製造例4で得られた対極基板で密封した。これにより、作用電極及び対極を電解液に接触させた。つぎに、作用電極基板及び対極からなる検出チップを電気化学計測装置に設置し、作用電極リード及び対極リードを電流計に接続した。
【0109】
作用電極基板側から対極基板に向けて、光源(波長781nm、出力13mWのレーザー光源)から励起光を照射した。光照射により、標識物質が励起され、電子を生じる。そして、生成した電子が作用電極に輸送されることにより、作用電極と対極との間に電流が流れる。そこで、この電流を測定した〔図6(D)検出工程参照〕。
【0110】
試験例1において、実施例1で得られた標識結合物質を用いて被検物質を検出する場合(実験番号1)の検出工程を示す概略説明図を図10(A)に、試験例1において、比較例1で得られた標識抗体を用いて被検物質を検出する場合(実験番号3)の検出工程を示す概略説明図を図10(B)に示す。また、試験例1において、検出方法の種類と光電流との関係を調べた結果を図11に示す。
【0111】
実験番号1の被検物質の電気化学的検出方法においては、実施例1で得られた標識結合物質〔図10(A)において、110を参照〕が用いられている。そのため、図10(A)に示されるように、検出工程では、励起光の照射により、抗体1分子あたり9個の標識物質から光電流が生じる。これに対して、実験番号3の被検物質の電気化学的検出方法においては、比較例1で得られた標識抗体〔図10(B)中、121参照〕が用いられている。そのため、図10(B)に示されるように、検出工程では、励起光の照射により、抗体1分子あたり10個の標識物質から光電流が生じる。したがって、実験番号1の被検物質の電気化学的検出方法で検出される光電流は、実験番号3の被検物質の電気化学的検出方法で検出される光電流と略同じであるか、若干小さいことが予想されうる。
【0112】
しかしながら、図11に示された結果から、実験番号1の被検物質の電気化学的検出方法で検出される光電流は20nAであるのに対して、実験番号3の被検物質の電気化学的検出方法で検出される光電流は4.5nAであることがわかる。これらの結果から、実験番号1の被検物質の電気化学的検出方法で検出される光電流は、予想外にも、実験番号3の被検物質の電気化学的検出方法で検出される光電流と比べ、はるかに大きいことがわかる。
【0113】
実施例1で得られた標識結合物質及び比較例1で得られた標識抗体では、結合物質として同一の抗体が用いられている。そのため、被検物質への実施例1で得られた標識結合物質及び比較例1で得られた標識抗体それぞれの結合効率は、略同じであると考えられる。また、被検物質がない場合では、いずれも、光電流は約0nAである(図11中、実験番号2及び実験番号4を参照)。そのため、実験番号1の被検物質の電気化学的検出方法で検出される光電流と実験番号3の被検物質の電気化学的検出方法で検出される光電流との違いは、ノイズの影響ではないと考えられる。したがって、実験番号1の被検物質の電気化学的検出方法で検出される光電流と実験番号3の被検物質の電気化学的検出方法で検出される光電流との違いは、標識物質と結合物質との間にDNAが介在しているかどうかによると考えられる。
【0114】
(実施例2)
(1−1)被検物質の捕捉
製造例2で得られた作用電極基板の作用電極の周囲に、隔壁となるようにシリコーンゴム(厚さ0.1mm)を配置した。その後、この作用電極基板とシリコーンゴムとに囲まれた空間に、1質量%BSAを含むTBS−Tを入れた。上記した空間内の液体の排出後、100ng/mLマウスIgG(被検物質)含有1質量%BSAを含むTBS−T30μLを、上記した空間内に添加した〔図12(A)を参照〕。その後、作用電極基板を25℃で1時間インキュベーションし、捕捉物質〔抗マウスIgG F(ab’)2抗体〕に、被検物質〔マウスIgG〕を捕捉させた〔図12(B)を参照〕。
【0115】
(1−2)標識
作用電極基板をTBS−Tで洗浄した。つぎに、2.1mg/mLビオチン標識抗マウスIgG抗体〔シグマ社製〕を含む溶液を、濃度が4μg/mLとなるように1質量%BSAを含むTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした。これにより、第1結合体であるビオチン標識抗マウスIgG抗体〔図12(B)において、130aを参照〕を、捕捉物質〔図12(B)において、81を参照〕に捕捉された被検物質〔図12(B)において、Sを参照〕に結合させた。なお、ビオチン標識抗マウスIgG抗体は、抗マウスIgG抗体〔図12(B)において、131aを参照〕をビオチン〔図12(B)において、131bを参照〕で標識したものである。
【0116】
作用電極基板をTBS−Tで洗浄した。つぎに、第2結合体であるストレプトアビジン〔ベクター社製〕を含む溶液〔第2結合体の濃度:2mg/mL〕を、第2結合体の濃度が4μg/mLとなるようにTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、ストレプトアビジン〔図12(C)において、130bを参照〕を、作用電極上のビオチン標識抗マウスIgG抗体に結合させた。
【0117】
作用電極基板をTBS−Tで洗浄した。つぎに、標識体であるビオチン化AlexaFluor750標識DNAを含有する溶液〔標識体の濃度:100μM〕を、標識体の濃度が1μMとなるようにTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、作用電極上に、被検物質と第1結合体と第2結合体と標識体とを含む複合体を形成させた(実験番号5)。第1結合体と第2結合体とからなる複合体〔図12(D)において、131を参照〕は、実施例1で得られた標識結合物質中の結合物質に対応している。すなわち、作用電極上においては、被検物質に結合した結合物質〔図12(D)において、131を参照〕に、修飾物質であるDNA〔図12(D)において、132を参照〕を介して、標識物質であるAlexaFluor750〔図12(D)において、133参照〕が結合している。
【0118】
なお、ビオチン化AlexaFluor750標識DNAは、24ヌクレオチド長のDNA〔インビトロジェン社製、5'-AACTACTGTCTTCACGCAGAAAGC-3'(配列番号:1)〕の5’末端がビオチン修飾され、かつ3’末端がAlexaFluor750で標識されたDNAである。
【0119】
一方、被検物質を用いなかったことを除き、上記と同様に操作を行ない、被検物質が存在しない場合の対照実験を行なった(実験番号6)。
【0120】
(2)対照実験
第1結合体、第2結合体及び標識体を用いる代わりに、標識物質が抗体に直接結合した標識抗体〔比較例1で得られた標識抗体〕を用い、以下のように、対照実験を行なった。まず、(1−1)と同様の操作を行ない、捕捉物質〔抗マウスIgG F(ab’)2抗体〕に、被検物質〔マウスIgG〕を捕捉させた〔図13(B)を参照〕。
【0121】
作用電極基板をTBS−Tで洗浄した後、比較例1で得られた1mg/mL標識抗体含有溶液を、標識抗体の濃度が20μg/mLとなるように1質量%BSAを含むTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションして、作用電極上の被検物質を標識した〔図13(B)参照〕(実験番号7)。
【0122】
一方、被検物質が存在しない場合の対照実験を以下のように行なった。まず、被検物質を捕捉させていない作用電極基板をTBS−Tで洗浄した。つぎに、比較例1で得られた2mg/mL標識抗体含有溶液を、標識抗体の濃度が20μg/mLとなるように1質量%BSAを含むTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした(実験番号8)。
【0123】
(3)光電流の測定
実験番号5〜8の各作用電極基板の周囲に、厚さ0.2mmの側壁となるようにシリコーンゴムを配置した。つぎに、作用電極基板とシリコーンゴムとに囲まれた空間に、製造例3で得られた電解液を充填した。その後、電解液が充填された空間を、作用電極基板の上方から、製造例4で得られた対極基板で密封した。これにより、作用電極及び対極を電解液に接触させた。つぎに、作用電極基板及び対極からなる検出チップを電気化学計測装置に設置し、作用電極リード及び対極リードを電流計に接続した。
【0124】
作用電極基板側から対極基板に向けて、光源(波長781nm、出力13mWのレーザー光源)から励起光を照射した。光照射により、標識物質であるAlexaFluor750〔図12(D)において、133参照〕が励起され、電子を生じる。そして、生成した電子が作用電極に輸送されることにより、作用電極と対極との間に電流が流れる。そこで、この電流を測定した。
【0125】
実施例2における実験番号5の被検物質の電気化学的検出方法の検出工程を示す概略説明図を図14(A)に、実施例2における実験番号7の被検物質の電気化学的検出方法の検出工程を示す概略説明図を図14(B)に示す。また、実施例2において、検出方法の種類と光電流との関係を調べた結果を図15に示す。
【0126】
実験番号5の被検物質の電気化学的検出方法においては、図14(A)に示されるように、第1結合体であるビオチン標識抗マウスIgG抗体〔図中、131aを参照〕と、第2結合体であるストレプトアビジン〔図中、130bを参照〕と、標識体であるビオチン化AlexaFluor750標識DNA〔図中、130cを参照〕とが用いられている。ここで、ストレプトアビジンの分子量は、53kDa程度であり、ビオチン標識抗マウスIgG抗体のビオチンとストレプトアビジンが結合したときの立体障害を考慮すると、1分子のビオチン標識抗マウスIgG抗体(分子量150kDa程度)に結合させることができるAlexaFluor750の数は、最大4分子程度であると考えられる。また、ストレプトアビジン中の4つのビオチン結合サイトのうちの3つに、ビオチン化AlexaFluor750標識DNAを結合させることができる。そのため、図14(A)に示されるように、検出工程では、励起光の照射により、抗体1分子あたり9〜12個の標識物質から光電流が生じる。これに対して、実験番号7の被検物質の電気化学的検出方法においては、標識抗体〔図14(B)において、141を参照〕が用いられている。そのため、図14(B)に示されるように、検出工程では、励起光の照射により、抗体〔図14(B)において、142を参照〕1分子あたり10個の標識物質〔AlexaFluor750、図14(B)において、143を参照〕から光電流が生じる。したがって、DNAを考慮しなければ、実験番号5の被検物質の電気化学的検出方法で検出される光電流は、実験番号7の被検物質の電気化学的検出方法で検出される光電流と同程度であることが予想されうる。
【0127】
しかしながら、図15に示された結果から、実験番号5の被検物質の電気化学的検出方法で検出される光電流は12nAであるのに対して、実験番号7の被検物質の電気化学的検出方法で検出される光電流は4.5nAであることがわかる。これらの結果から、実験番号5の被検物質の電気化学的検出方法で検出される光電流は、予想外にも、実験番号7の被検物質の電気化学的検出方法で検出される光電流と比べ、はるかに大きいことがわかる。したがって、実験番号5の被検物質の電気化学的検出方法で検出される光電流と実験番号7の被検物質の電気化学的検出方法で検出される光電流との違いは、標識物質と結合物質との間にDNAが介在しているかどうかによると考えられる。
【0128】
DNAは、親水性を示す。したがって、DNAは、非プロトン性溶媒を含有する電解液及び親水性のトリエチレングリコール(TEG)鎖が導入された作用電極本体に対し、相互作用(親水性相互作用)を生じると考えられる。一方、電解液がプロトン性溶媒を含有し、かつ作用電極本体に疎水性の官能基が導入されている場合には、DNAの代わりに疎水性を有する物質を用いることにより、相互作用(疎水性相互作用)が生じると考えられる。
【0129】
以上の結果から、被検物質を標識するために、電解液と捕捉物質が結合している部位以外の作用電極部位とに対して相互作用を生じる修飾物質を介して標識物質が結合物質に少なくとも固定された標識結合物質を用いることにより、高感度で被検物質を検出することができることが示唆される。
【0130】
(製造例5)
ビオチン化DNA及びAlexaFluor750標識DNAを、それぞれの濃度が1μM及び10μMとなるように1M塩化ナトリウム含有リン酸緩衝液中に添加した。得られた混合物を80℃で1分間加熱した後、当該混合物の温度を毎分1℃下降させながら4℃まで冷却した。これにより、ビオチン化DNAとAlexaFluor750標識DNAとをハイブリダイゼーションさせ、ビオチン化DNA−AlexaFluor750標識DNA複合体(図16中、170参照)を作製した。なお、ビオチン化DNAは、84ヌクレオチド長のDNA〔インビトロジェン社製、5'-biotin-AAACCACGGCCCTAGGGACAACGACCACGGCCCTAGGGACAACGACCACGGCCCTAGGGACAACGACCACGGCCCTAGGGACAACGA-3'(配列番号:2)、図16中、172a参照〕の5’末端がビオチン(図16中、172b参照)で修飾されたDNA(リン酸骨格の5’末端に(CH2)3リンカーを介してビオチンが結合しているDNA)である(図16中、172参照)。また、AlexaFluor750標識DNAは、20ヌクレオチド長のDNA〔インビトロジェン社製、5'-CGTTGTCCCTAGGGCCGTGGGTATGCGCGCTGCTATGCCG-3'(配列番号:3)、図16中、171b参照〕の5’末端及び3’末端がAlexaFluor750(図16中、171a参照)で標識されたDNAである(図16中、171参照)。
【0131】
(実施例3)
多価標識DNAによるマウスIgGの検出
(1−1)被検物質の捕捉
製造例2で得られた作用電極基板の作用電極の周囲に、隔壁となるようにシリコーンゴム(厚さ0.1mm)を配置した。その後、この作用電極基板とシリコーンゴムとに囲まれた空間に、0.4質量%ブロックエース〔DSファーマバイオメディカル社製〕を含むTBS−Tを入れた。つぎに、作用電極基板を25℃で30分間インキュベーションした。作用電極基板をTBS−Tで洗浄した後、被検物質である10ng/mLマウスIgG含有1質量%BSAを含むTBS−T 30μLを、上記した空間内に添加した。その後、作用電極基板を25℃で1時間インキュベーションし、作用電極基板の作用電極本体(図17中、61参照)上に固定された捕捉物質〔抗マウスIgG F(ab’)2抗体、図17中、81参照〕に、被検物質〔マウスIgG、図17中、S参照〕を捕捉させた〔図17(A)参照〕。
【0132】
(1−2)標識
(1−1)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、ビオチン標識抗マウスIgG F(ab’)2抗体〔ダコ社製〕を、その濃度が4μg/mLとなるように1質量%BSAを含むTBS−Tに添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした。これにより、第1結合体であるビオチン標識抗マウスIgG F(ab’)2抗体(図17中、151参照)を、捕捉物質(図17中、81参照)に捕捉された被検物質(図17中、S参照)に結合させた〔図17(B)参照〕。なお、ビオチン標識抗マウスIgG F(ab’)2抗体は、抗マウスIgGF(ab’)2抗体(図17中、152参照)をビオチン(図17中、153参照)で標識したものである。
【0133】
つぎに、作用電極基板をTBS−Tで洗浄した。つぎに、第2結合体であるストレプトアビジン〔ベクター社製〕を、その濃度が4μg/mLとなるようにTBS−Tに添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、ストレプトアビジン(図17中、160参照)を、作用電極本体(図17中、61参照)上のビオチン標識抗マウスIgG F(ab’)2抗体(図17中、151参照)中のビオチン(図17中、153)に結合させた〔図17(C)参照〕。
【0134】
(1−3)色素標識
(1−2)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、製造例5で得られたビオチン化DNA−AlexaFluor750標識DNA複合体を含有する溶液(複合体の濃度:93μg/mL)30μLに当該溶液の10倍容量のTBS−Tを添加した後、得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、作用電極本体(図17中、61参照)上に、被検物質(図17中、S参照)と第1結合体であるビオチン標識抗マウスIgG F(ab’)2抗体(図17中、151参照)と第2結合体であるストレプトアビジン(図17中、160参照)と標識体であるビオチン化DNA−AlexaFluor750標識DNA複合体(図17中、170参照)とを含む複合体を形成させた〔図17(D)参照〕。第1結合体と第2結合体とからなる複合体は、実施例1で得られた標識結合物質中の結合物質に対応している。すなわち、作用電極上においては、被検物質に結合した結合物質に、修飾物質であるDNAを介して、標識物質であるAlexaFluor750が結合している。
【0135】
(2)光電流の測定
作用電極基板の周囲に、厚さ0.2mmの側壁となるようにシリコーンゴムを配置した。そして、作用電極基板とシリコーンゴムとに囲まれた空間に、製造例3で得られた電解液を充填した。そして、電解液が充填された空間を、作用電極基板の上方から、製造例4で得られた対極基板で密封した。これにより、作用電極及び対極を電解液に接触させた。つぎに、作用電極基板及び対極からなる検出チップを電気化学計測装置に設置し、作用電極リード及び対極リードを電流計に接続した。
【0136】
作用電極基板側から対極基板に向けて、光源(波長781nm、出力13mWのレーザー光源)から励起光を照射した。光照射により、標識物質であるAlexaFluor750が励起され、電子を生じる。そして、生成した電子が作用電極に輸送されることにより、作用電極と対極との間に電流が流れる。そこで、この電流を測定した(実験番号9)。
【0137】
なお、製造例5で得られたビオチン化DNA−AlexaFluor750標識DNA複合体の代わりに、実験番号5(ビオチン化AlexaFluor750標識DNA:配列番号1)で使用した複合体を用いて、上記と同様の操作を行なったものを対照実験とした(実験番号10)。
【0138】
実施例3において、検出方法の種類と光電流との関係を調べた結果を図18に示す。
【0139】
図18に示された結果から、実験番号9の被検物質の電気化学的検出方法で検出される光電流は3.6nAであるのに対して、実験番号10の被検物質の電気化学的検出方法で検出される光電流は0.68nAであることがわかる。これらの結果から、実験番号9の被検物質の電気化学的検出方法で検出される光電流は、実験番号10の被検物質の電気化学的検出方法で検出される光電流と比べて大きいことがわかる。
【0140】
以上の結果から、被検物質を標識するために、修飾物質間の相互作用を介してより多くの標識物質が結合物質に固定された多価標識結合物質を用いることにより、より高感度で被検物質を検出することができることが示唆される。
【0141】
(実施例4)
多価標識DNAによるマウスIgGの定量検出
(1−1)被検物質の捕捉
製造例2で得られた作用電極基板の作用電極の周囲に、隔壁となるようにシリコーンゴム(厚さ0.1mm)を配置した。その後、この作用電極基板とシリコーンゴムとに囲まれた空間に、0.4質量%ブロックエース〔DSファーマバイオメディカル社製〕を含むTBS−Tを入れた。その後、作用電極基板を25℃で30分間インキュベーションした。つぎに、作用電極基板をTBS−Tで洗浄した後、被検物質である10ng/mLマウスIgG含有1質量%BSAを含むTBS−T 30μLを上記した空間内に添加した。その後、前記作用電極基板を25℃で1時間インキュベーションし、捕捉物質〔抗マウスIgG F(ab’)2抗体〕に、被検物質〔マウスIgG〕を捕捉させた。
【0142】
(1−2)標識
(1−1)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、ビオチン標識抗マウスIgG F(ab’)2抗体〔ダコ社製〕を、その濃度が4μg/mLとなるように1質量%BSAを含むTBS−Tに添加した後、得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした。これにより、第1結合体であるビオチン標識抗マウスIgG F(ab’)2抗体を、捕捉物質に捕捉された被検物質に結合させた。なお、ビオチン標識抗マウスIgG F(ab’)2抗体は、抗マウスIgGF(ab’)2抗体をビオチンで標識したものである。
【0143】
つぎに、作用電極基板をTBS−Tで洗浄した後、第2結合体であるストレプトアビジン〔ベクター社製〕2mg/mLを、濃度が4μg/mLとなるようにTBS−Tに添加した後、得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、ストレプトアビジンを、作用電極上のビオチン標識抗マウスIgG F(ab’)2抗体に結合させた。
【0144】
(1−3)色素標識
(1−2)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、製造例5で得られたビオチン化DNA−AlexaFluor750標識DNA複合体を含有する溶液(複合体の濃度:93μg/mL)30μLに当該溶液の10倍容量のTBS−Tを添加した後、得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、作用電極上に、被検物質と第1結合体と第2結合体と標識体とを含む複合体を形成させた。第1結合体と第2結合体とからなる複合体は、実施例1で得られた標識結合物質中の結合物質に対応している。すなわち、作用電極上においては、被検物質に結合した結合物質に、修飾物質であるDNAを介して、標識物質であるAlexaFluor750が結合している。
【0145】
(2)光電流の測定
作用電極基板の周囲に、厚さ0.2mmの側壁となるようにシリコーンゴムを配置した。そして、作用電極基板とシリコーンゴムとに囲まれた空間に、製造例3で得られた電解液を充填した。そして、電解液が充填された空間を、作用電極基板の上方から、製造例4で得られた対極基板で密封した。これにより、作用電極及び対極を電解液に接触させた。つぎに、作用電極基板及び対極からなる検出チップを電気化学計測装置に設置し、作用電極リード及び対極リードを電流計に接続した。
【0146】
作用電極基板側から対極基板に向けて、光源(波長781nm、出力13mWのレーザー光源)から励起光を照射した。光照射により、標識物質であるAlexaFluor750が励起され、電子を生じる。そして、生成した電子が作用電極に輸送されることにより、作用電極と対極との間に電流が流れる。そこで、この電流を測定した。
【0147】
なお、(1−1)において、被検物質として、10ng/mLマウスIgGを用いる代わりに、100pg/mLマウスIgG、1ng/mLマウスIgGを用いたことを除き、上記と同様の操作を行なって電流を測定した。また、被検物質を用いなかったことを除き、上記と同様に操作を行ない、被検物質が存在しない場合の対照実験を行なった。
【0148】
実施例4において、被検物質(マウスIgG)の濃度と光電流との関係を調べた結果を図19に示す。
【0149】
図19に示された結果から、被検物質の濃度が100pg/mL、1ng/mL及び10ng/mLである場合に検出される光電流は、それぞれ、0.95nA、2.85nA及び14.9nAであることがわかる。また、被検物質が存在しない場合に検出される光電流は、0.47nAであることがわかる。したがって、これらの結果から、被検物質の電気化学的検出方法で検出される光電流は被検物質の濃度に応じて増加していることがわかる。また、これらの結果から、被検物質の濃度が100pg/mL〜10ng/mLの範囲である場合、被検物質を定量的に検出することができることがわかる。
【0150】
以上の結果から、被検物質を標識するために、修飾物質間の相互作用を介してより多くの標識物質が結合物質に固定された多価標識結合物質を用いることにより、高感度で定量的に被検物質を検出することができることが示唆される。
【0151】
(製造例6)作用電極基板の作製
スパッタリング法により、二酸化ケイ素(SiO2)からなる基板本体上に、スズをドープした酸化インジウムの薄膜(厚さ200nm)からなる作用電極本体を形成した。上記した薄膜は、導電層と電子受容層とを兼ねている。つぎに、作用電極本体に、電流計と接続するための作用電極リードを接続した。
【0152】
つぎに、作用電極本体の表面を製造例1で得られた溶液Aを接触させて作用電極の本体表面にチオール基を付与した。
【0153】
また、捕捉物質である抗ヒトインターロイキン−6抗体〔バイオレジェンド社製〕を、還元剤であるトリス(2−カルボキシエチル)ホスフィン塩酸塩(TCEP)固定ゲル〔ピアース社製、商品名:Immobilized TCEP Disulfide Reducing Gel〕と接触させて還元し、重鎖還元型抗ヒトインターロイキン−6抗体を作製した。得られた抗ヒトインターロイキン−6抗体を、その濃度が10μg/mLとなるようにTBSに添加し、抗体溶液を得た。
【0154】
つぎに、得られた抗体溶液を作用電極本体上に滴下した。そして、作用電極本体を4℃で一晩インキュベーションし、抗ヒトインターロイキン−6抗体と作用電極本体上のチオール基とを反応させジチオール結合を形成した。これにより、抗ヒトインターロイキン−6抗体を作用電極本体上に固定した。つぎに、作用電極本体上に、1mMトリエチレングリコール モノ−11−メルカプトウンデシルエーテル〔シグマ社製〕を滴下した。そして、作用電極本体を4℃で一晩インキュベーションして作用電極本体のブロッキングを行なった。これにより、作用電極基板を得た。
【0155】
(実施例5)
多価標識DNAによるインターロイキン−6(IL−6)の定量検出
(1−1)被検物質の捕捉
製造例6で得られた作用電極基板の作用電極の周囲に、隔壁となるようにシリコーンゴム(厚さ0.1mm)を配置した。その後、この作用電極基板とシリコーンゴムとに囲まれた空間に、0.4質量%ブロックエース〔DSファーマバイオメディカル社製〕を含むTBS−Tを入れた。上記した空間内の液体の排出後、被検物質であるヒトインターロイキン−6を25質量%ウシ血清〔サーモサイエンティフィック社製〕と0.75質量%BSAとを含むTBS−Tで希釈して得られた被検物質溶液(被検物質の濃度:500pg/mL)30μLを、上記した空間内に添加した。その後、作用電極基板を25℃で1時間インキュベーションし、捕捉物質〔抗ヒトインターロイキン−6抗体〕に、被検物質〔インターロイキン−6〕を捕捉させた。
【0156】
(1−2)標識
(1−1)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、ビオチン標識抗ヒトインターロイキン−6抗体〔バイオレジェンド社製〕をその濃度が1μg/mLとなるように1質量%BSAを含むTBS−Tに添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした。これにより、第1結合体であるビオチン標識抗ヒトインターロイキン−6抗体を、捕捉物質に捕捉された被検物質に結合させた。なお、ビオチン標識抗ヒトインターロイキン−6抗体は、抗ヒトインターロイキン−6抗体をビオチンで標識したものである。
【0157】
つぎに、作用電極基板をTBS−Tで洗浄した。つぎに、第2結合体であるストレプトアビジン〔ベクター社製〕2mg/mLを、濃度が4μg/mLとなるようにTBS−Tに添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、ストレプトアビジンを、作用電極上のビオチン標識ヒトインターロイキン−6抗体に結合させた。
【0158】
(1−3)色素標識
(1−2)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、製造例5で得られたビオチン化DNA−AlexaFluor750標識DNA複合体を含有する溶液(複合体の濃度:93μg/mL)100μLに当該溶液の10倍容量のTBS−Tを添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、作用電極上に、被検物質と第1結合体と第2結合体と標識体とを含む複合体を形成させた。第1結合体と第2結合体とからなる複合体は、実施例1で得られた標識結合物質中の結合物質に対応している。すなわち、作用電極上においては、被検物質に結合した結合物質に、修飾物質であるDNAを介して、標識物質であるAlexaFluor750が結合している。
【0159】
(2)光電流の測定
作用電極基板の周囲に、厚さ0.2mmの側壁となるようにシリコーンゴムを配置した。そして、作用電極基板とシリコーンゴムとに囲まれた空間に、製造例3で得られた電解液を充填した。そして、電解液が充填された空間を、作用電極基板の上方から、製造例4で得られた対極基板で密封した。これにより、作用電極及び対極を電解液に接触させた。つぎに、作用電極基板及び対極からなる検出チップを電気化学計測装置に設置し、作用電極リード及び対極リードを電流計に接続した。
【0160】
作用電極基板側から対極基板に向けて、光源(波長781nm、出力13mWのレーザー光源)から励起光を照射した。光照射により、標識物質であるAlexaFluor750が励起され、電子を生じる。そして、生成した電子が作用電極に輸送されることにより、作用電極と対極との間に電流が流れる。そこで、この電流を測定した。
【0161】
なお、(1−1)において、被検物質の濃度が500pg/mLである被検物質溶液を用いる代わりに、被検物質の濃度が7.8pg/mL、15.6pg/mL、31.2pg/mL、62.5pg/mL、125pg/mL又は250pg/mLである被検物質溶液を用いたことを除き、上記と同様の操作を行なって電流を測定した。また、被検物質を用いなかったことを除き、上記と同様に操作を行ない、被検物質が存在しない場合の対照実験を行なった。
【0162】
実施例5において、被検物質(ヒトIL−6)の濃度と光電流との関係を調べた結果を図20に示す。
【0163】
図20に示された結果から被検物質の濃度が7.8pg/mL、15.6pg/mL、31.2pg/mL、62.5pg/mL、125pg/mL、250pg/mL及び500pg/mLである場合に検出される光電流は、それぞれ、0.089nA、0.092nA、0.095nA、0.11nA、0.14nA、0.21nA及び0.3nAであることがわかる。また、被検物質が存在しない場合に検出される光電流は、0.083nAであることがわかる。したがって、これらの結果から、被検物質の電気化学的検出方法で検出される光電流は被検物質の濃度に応じて増加しており、被検物質を定量的に検出することができることがわかる。
【0164】
以上の結果から、マウスIgG以外の被検物質に対しても、修飾物質間の相互作用を介してより多くの標識物質が結合物質に固定された多価標識結合物質を用いることにより、高感度で定量的に被検物質を検出することができることが示唆される。
【0165】
(製造例7)作用電極基板の作製
スパッタリング法により、二酸化ケイ素(SiO2)からなる基板本体上に、スズをドープした酸化インジウムの薄膜(厚さ200nm)からなる作用電極本体を形成した。上記した薄膜は、導電層と電子受容層とを兼ねている。つぎに、作用電極本体に、電流計と接続するための作用電極リードを接続した。
【0166】
つぎに、作用電極本体の表面を製造例1で得られた溶液Aを接触させて作用電極の本体表面にチオール基を付与した。
【0167】
また、捕捉物質である抗ヒトインターロイキン−6抗体〔バイオレジェンド社製〕、又は抗ヒトインターフェロン−γ抗体〔バイオレジェンド社製〕を、還元剤であるトリス(2−カルボキシエチル)ホスフィン塩酸塩(TCEP)固定ゲル〔ピアース社製、商品名:Immobilized TCEP Disulfide Reducing Gel〕と接触させて還元し、重鎖還元型抗ヒトインターロイキン−6抗体、又は抗ヒトインターフェロン−γ抗体を作製した。得られた抗ヒトインターロイキン−6抗体又は抗ヒトインターフェロン−γ抗体を、その濃度が10μg/mLとなるようにTBSに添加し、抗ヒトインターロイキン−6抗体溶液又は抗ヒトインターフェロン−γ抗体溶液を得た。
【0168】
作用電極上に、2つの開口部を有するシリコーンゴム(厚さ0.1mm)を隔壁となるように配置した。その後、作用電極本体とシリコーンゴムとに囲まれた空間の一方に抗ヒトインターロイキン−6抗体溶液を入れ、もう一方に抗ヒトインターフェロン−γ抗体を入れた。そして、作用電極本体を4℃で一晩インキュベーションし、抗ヒトインターロイキン−6抗体又は抗ヒトインターフェロン−γ抗体と、作用電極本体上のチオール基とを反応させジチオール結合を形成した。これにより、抗ヒトインターロイキン−6抗体及び抗ヒトインターフェロン−γ抗体を作用電極本体上に固定した。作用電極本体からシリコーンゴムを外した、その後、前述した2つの開口部に相当する範囲を含む大きさの開口部を1つ有するシリコーンゴム(厚さ0.1mm)を、隔壁となるように作用電極上に配置した。つぎに、作用電極本体上に、1mMトリエチレングリコール モノ−11−メルカプトウンデシルエーテル〔シグマ社製〕を滴下した。そして、作用電極本体を4℃で一晩インキュベーションして作用電極本体のブロッキングを行なった。これにより、作用電極基板を得た。
【0169】
(実施例6)
多価標識DNAによるインターロイキン−6(IL−6)ならびにインターフェロン−γの同時検出
(1−1)被検物質の捕捉
製造例7で得られた作用電極基板の周囲に厚さ0.2mmの側壁となるようにシリコーンゴムを配置した。つぎに、作用電極基板とシリコーンゴムとに囲まれた空間に、0.4質量%ブロックエース〔DSファーマバイオメディカル社製〕を含むTBS−Tを入れた。上記した空間内の液体の排出後、被検物質としてのヒトインターロイキン−6〔バイオレジェンド社製〕単独、被検物質としてのヒトインターフェロン−γ〔バイオレジェンド社製〕単独、又は、被検物質としてのヒトインターロイキン−6とヒトインターフェロン−γとの混合物を、25%質量ウシ血清〔サーモサイエンティフィック社製〕と0.75質量%BSAとを含むTBS−Tで希釈して得られた検出対象物溶液(検出対象物の濃度:250pg/mL)30μLを、上記した空間内に添加した。その後、作用電極基板を25℃で1時間インキュベーションし、捕捉物質〔抗ヒトインターロイキン−6抗体、抗ヒトインターフェロン−γ抗体〕に、被検物質〔インターロイキン−6、ヒトインターフェロン−γ〕を捕捉させた。
【0170】
(1−2)標識
(1−1)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、ビオチン標識抗ヒトインターロイキン−6抗体〔バイオレジェンド社製〕と抗ヒトインターフェロン−γ抗体〔バイオレジェンド社製〕とを、それぞれの濃度が1μg/mLとなるように1質量%BSAを含むTBS−Tに添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした。これにより、第1結合体であるビオチン標識抗ヒトインターロイキン−6抗体及びビオチン標識抗ヒトインターフェロン−γ抗体を、捕捉物質に捕捉された被検物質に結合させた。なお、ビオチン標識抗ヒトインターロイキン−6抗体及びビオチン標識抗ヒトインターフェロン−γ抗体は、抗ヒトインターロイキン−6抗体及び抗ヒトインターフェロン−γ抗体それぞれをビオチンで標識したものである。
【0171】
つぎに、作用電極基板をTBS−Tで洗浄した。つぎに、第2結合体であるストレプトアビジン〔ベクター社製〕2mg/mLを、その濃度が4μg/mLとなるようにTBS−Tに添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、ストレプトアビジンを、作用電極上のビオチン標識抗ヒトインターロイキン−6抗体又は抗ヒトインターフェロン−γ抗体に結合させた。
【0172】
(1−3)色素標識
(1−1)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、製造例5で得られたビオチン化DNA−AlexaFluor750標識DNA複合体を含有する溶液(複合体の濃度:93μg/mL)100μLに当該溶液の10倍容量のTBS−Tを添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、作用電極上に、検出対象物としての被検物質と第1結合体と第2結合体と標識体とを含む複合体を形成させた。第1結合体と第2結合体とからなる複合体は、実施例1で得られた標識結合物質中の結合物質に対応している。すなわち、作用電極上においては、被検物質に結合した結合物質に、修飾物質であるDNAを介して、標識物質であるAlexaFluor750が結合している。
【0173】
(2)光電流の測定
作用電極基板の周囲に、厚さ0.2mmの側壁となるようにシリコーンゴムを配置した。そして、作用電極基板とシリコーンゴムとに囲まれた空間に、製造例3で得られた電解液を充填した。そして、電解液が充填された空間を、作用電極基板の上方から、製造例4で得られた対極基板で密封した。これにより、作用電極及び対極を電解液に接触させた。つぎに、作用電極基板及び対極からなる検出チップを電気化学計測装置に設置し、作用電極リード及び対極リードを電流計に接続した。
【0174】
作用電極基板側から対極基板に向けて、光源(波長781nm、出力13mWのレーザー光源)から励起光を照射した。光照射により、標識物質であるAlexaFluor750が励起され、電子を生じる。そして、生成した電子が作用電極に輸送されることにより、作用電極と対極との間に電流が流れる。そこで、この電流を測定した。抗インターロイキン−6抗体固定部及び抗インターフェロン−γ抗体固定部の両方において電流の測定を行なった。なお、被検物質を用いなかったことを除き、上記と同様に操作を行ない、被検物質が存在しない場合の対照実験を行なった。
【0175】
実施例6において、検出対象物の種類と光電流との関係を調べた結果を図21に示す。
【0176】
図21に示された結果から、被検物質がインターロイキン−6である場合に検出される光電流は、抗インターロイキン−6抗体固定部で0.20nA及び抗インターフェロン−γ抗体固定部で0.08nAであるのに対して、被検物質非存在下で検出される光電流は、抗インターロイキン−6抗体固定部で0.06nA及び抗インターフェロン−γ抗体固定部で0.07nAであることがわかる。また、被検物質がインターフェロン−γである場合に検出される光電流は、抗インターロイキン−6抗体固定部で0.09nA及び抗インターフェロン−γ抗体固定部で0.14nAであることがわかる。これらの結果から、同一電極上において、固定された捕捉物質である抗体に特異的な被検物質の検出が可能であることが示唆される。
【0177】
一方、被検物質がインターロイキン−6とインターフェロン−γとの混合物である場合に検出される光電流は、抗インターロイキン−6抗体固定部で0.17nA及び抗インターフェロン−γ抗体固定部で0.10nAであることがわかる。これらの光電流は、被検物質非存在下での光電流よりも大きいが、被検物質がインターロイキン−6単独又はインターフェロン−γ単独である場合に検出される光電流よりも小さい。したがって、検出対象物が複数種類の被検物質の混合物である場合には、各被検物質の特異的検出は可能ではあるが、単独の被検物質を検出する場合と比べて、若干の検出感度低下が認められることがわかる。
【0178】
以上の結果から、被検物質を標識するために、修飾物質間の相互作用を介してより多くの標識物質が結合物質に固定された多価標識結合物質を用いることにより、同一電極上で多種類の被検物質を同時に検出することができることが示唆される。
【符号の説明】
【0179】
1 検出装置
11 チップ受入部
12 ディスプレイ
13 光源
14 電流計
15 電源
16 変換部
17 制御部
20 検出チップ
20a 空間
30 上基板
30a 基板本体
30b 試料注入口
40 下基板
40a 基板本体
50 間隔保持部材
60 作用電極
61 作用電極本体
66 対極
69 参照電極
71 電極リード
72 電極リード
73 電極リード
81 捕捉物質
90 結合物質
90 標識結合物質
90a 第1結合体
90b 第2結合体
90c 標識体
91 結合物質
91a 第1結合物質
91b 第2結合物質
92 修飾物質
93 標識物質
93 標識体
101 標識抗体
102 抗体
103 標識物質
121 標識抗体
130a ビオチン標識抗マウスIgG抗体
130b ストレプトアビジン
130c ビオチン化AlexaFluor750標識DNA
131a 抗マウスIgG抗体
131b ビオチン
132 DNA
133 標識物質(AlexaFluor750)
141 標識抗体
142 抗体
143 標識物質(AlexaFluor750)
151 ビオチン標識抗マウスIgG抗体
152 ビオチン
153 抗マウスIgG抗体
160 ストレプトアビジン
170 ビオチン化DNA−AlexaFluor750標識DNA複合体
171 AlexaFluor750標識DNA
171a DNA
171b AlexaFluor750
172 ビオチン化DNA
172a DNA
172b ビオチン
190 標識結合物質
190 結合物質
193 標識物質
S 被検物質
【配列表フリーテキスト】
【0180】
配列番号:1は、実施例1及び実施例2において、修飾物質として用いられたDNAの配列である。
配列番号:2は、ビオチン化DNAの配列である。
配列番号:3は、AlexaFluor750標識DNAの配列である。
【技術分野】
【0001】
本発明は、被検物質の電気化学的検出方法に関する。より詳しくは、核酸、タンパク質等の被検物質の検出及び定量等、並びに、これらを利用する疾病の臨床検査及び診断等に有用な、被検物質の電気化学的検出方法に関する。
【背景技術】
【0002】
疾病の臨床検査及び診断は、生体試料中に含まれる疾病に関連する遺伝子又はタンパク質等を、遺伝子検出法及び免疫学的検出法等の検出法によって検出することにより行なわれている。かかる臨床検査及び診断を行なうための方法として、光化学的に活性な標識物質を光励起させることにより生じる光電流を、核酸、タンパク質等の被検物質の検出に利用する光化学的検出方法が提案されている。ここで、臨床検査及び診断では、検体に含まれる微量な被検物質を検出する必要があるため、被検物質の検出感度の向上が求められている。
【0003】
例えば、特許文献1の段落番号[0069]〜[0078]には、被検物質であるタンパク質を特異的に認識する捕捉物質である抗体が固定化された電極と、電気化学的に活性な標識物質により結合物質である抗体が標識された標識抗体とを用いる光電流による被検物質の特異的検出法が開示されている。特許文献1に記載の方法では、まず、被検物質と電極上の抗体とを接触させ、抗体によって被検物質を電極上に捕捉する。その後、電極上に捕捉された被検物質と、標識抗体とを接触させて、捕捉物質と被検物質と標識抗体とを含む複合体を形成させる。そして、複合体中の標識物質に基づく光電流を測定することにより、被検物質が検出される。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】国際公開第2010/024446号、段落番号[0069]〜[0078]
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、電極上で形成された複合体が嵩高いため、複合体中に含まれる標識物質と電極との間の物理的距離が長くなり、標識物質と電極との間において、電子輸送が行なわれにくくなる。例えば、IgG抗体は、10nm程度の大きさを有している。したがって、特許文献1に記載の方法において、捕捉物質及び標識抗体を構成する抗体としてIgG抗体を用いる場合、被検物質の検出に際して、電極上に形成される複合体中の標識物質は、電子輸送が効率よく起こりうる電極表面から非常に離れた位置に存在することになる。このように、特許文献1に記載の方法では、被検物質の検出の際に形成される複合体の嵩高さが、高感度化を図る上で大きな制約となっている。
【0006】
本発明は、前述の事情に鑑みてなされたものであり、高い検出感度で被検物質を検出することができる被検物質の電気化学的検出方法を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは、上記課題を解決するために鋭意検討した結果、被検物質の検出に際して、電解液と捕捉物質が結合している部位以外の作用電極部位とに対して相互作用を生じる修飾物質を介して、標識物質が抗体に固定された標識結合物質を用いることにより、検出感度が著しく向上するという知見を得て、本発明を完成させた。
【0008】
すなわち、本発明は、
〔1〕 被検物質を電解液中で電気化学的に検出する方法であって、
(1) 被検物質を含む試料を、この被検物質を捕捉する捕捉物質が作用電極本体上に固定された作用電極に接触させ、前記捕捉物質によって被検物質を作用電極上に捕捉する工程、
(2) 前記工程(1)で作用電極上に捕捉された被検物質と、当該被検物質に結合する結合物質に修飾物質を介して標識物質が保持された標識結合物質と、を含む複合体を作用電極上に形成させる工程、及び
(3) 前記工程(2)で得られた作用電極上に存在する標識物質を電気化学的に検出する工程
を含み、
前記修飾物質は、電解液と、補足物質が結合している部位以外の作用電極部位と、に対して相互作用を生じる物質である、
被検物質の電気化学的検出方法、
〔2〕 前記電解液が、非プロトン性溶媒を含有し、かつ前記作用電極の表面及び前記修飾物質が親水性を示す前記〔1〕に記載の方法、
〔3〕 前記修飾物質が、DNAである前記〔1〕又は〔2〕に記載の方法、
〔4〕 前記電解液が、プロトン性溶媒を含有し、かつ前記作用電極の表面及び前記修飾物質が疎水性を示す前記〔1〕に記載の方法、
〔5〕 前記工程(2)において、前記工程(1)で作用電極上に捕捉された被検物質と、前記標識結合物質とを接触させることにより、前記複合体を作用電極上に形成させる前記〔1〕〜〔4〕のいずれかに記載の方法、
〔6〕 前記工程(2)において、前記被検物質に結合する第1結合物質を含む結合体と、前記工程(1)で作用電極上に捕捉された被検物質とを接触させ、その後、被検物質に結合した前記結合体と、前記結合体に結合する第2結合物質に前記修飾物質を介して前記標識物質が結合した標識体とを接触させることにより、前記複合体を作用電極上に形成させる前記〔1〕に記載の方法、
〔7〕 前記工程(2)の後、作用電極を洗浄し、被検物質に結合していない標識結合物質を除去する前記〔1〕〜〔6〕のいずれかに記載の方法、
〔8〕 前記標識物質が、電気化学的又は光化学的に活性な物質である前記〔1〕〜〔7〕のいずれかに記載の方法、
〔9〕 前記標識結合物質が、前記結合物質に、修飾物質を介して複数の標識物質が保持された多価標識結合物質である、〔1〕〜〔8〕のいずれかに記載の方法、
〔10〕 前記工程(3)で得られた検出結果に基づいて、前記被検物質を定量する、〔9〕に記載の方法、並びに
〔11〕 前記被検物質は複数種類である、請求項〔9〕又は〔10〕のいずれかに記載の方法
に関する。
【発明の効果】
【0009】
本発明の被検物質の電気化学的検出方法によれば、高い検出感度で、被検物質を検出することができる。
【図面の簡単な説明】
【0010】
【図1】本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出装置を示す斜視図である。
【図2】図1に示される検出装置の構成を示すブロック図である。
【図3】本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出チップを示す斜視図である。
【図4】(A)は図3に示される検出チップのAA線での断面図である。(B)は図3に示される検出チップの上基板を下面側から見た斜視図である。(C)は図3に示される検出チップの下基板を上面側から見た斜視図である。
【図5】本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出チップ中の電極を含む部分の一例を模式的に表した断面説明図である。
【図6】本発明の一実施の形態に係る被検物質の電気化学的検出方法の処理手順を示す工程説明図である。
【図7】従来の被検物質の電気化学的検出方法における検出工程を示す概略説明図である。
【図8】本発明の他の実施の形態に係る被検物質の電気化学的検出方法の処理手順を示す工程説明図である。
【図9】本発明のさらに他の実施の形態に係る被検物質の電気化学的検出方法の処理手順を示す工程説明図である。
【図10】(A)は試験例1において、実施例1で得られた標識結合物質を用いて被検物質を検出する場合(実験番号1)の検出工程を示す概略説明図である。(B)は、試験例1において、比較例1で得られた標識抗体を用いて被検物質を検出する場合(実験番号3)の検出工程を示す概略説明図である。
【図11】試験例1において、検出方法の種類と光電流との関係を調べた結果を示すグラフである。
【図12】実施例2における実験番号5の被検物質の電気化学的検出方法の処理手順の一部を示す工程説明図である。
【図13】実施例2における実験番号7の被検物質の電気化学的検出方法の処理手順の一部を示す工程説明図である。
【図14】(A)は実施例2における実験番号5の被検物質の電気化学的検出方法の検出工程を示す概略説明図である。(B)は実施例2における実験番号7の被検物質の電気化学的検出方法の検出工程を示す概略説明図である。
【図15】実施例2において、検出方法の種類と光電流との関係を調べた結果を示すグラフである。
【図16】製造例5で得られたビオチン化DNA−AlexaFluor750標識DNA複合体の概略説明図である。
【図17】実施例3における実験番号9の被検物質の電気化学的検出方法の処理手順の一部を示す工程説明図である。
【図18】実施例3において、検出方法の種類と光電流との関係を調べた結果を示すグラフである。
【図19】実施例4において、被検物質(マウスIgG)の濃度と光電流との関係を調べた結果を示すグラフである。
【図20】実施例5において、被検物質(ヒトIL−6)の濃度と光電流との関係を調べた結果を示すグラフである。
【図21】実施例6において、検出対象物の種類と光電流との関係を調べた結果を示すグラフである。
【発明を実施するための形態】
【0011】
[検出装置の構成]
本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出装置の一例を添付図面により説明する。
図1は、本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出装置を示す斜視図である。この検出装置1は、光化学的に活性な物質を標識物質として用いる検出方法に用いる検出装置である。
【0012】
検出装置1は、検出チップ20が挿入されるチップ受入部11と、検出結果を表示するディスプレイ12とを備えている。
【0013】
図2は、図1に示される検出装置の構成を示すブロック図である。検出装置1は、光源13と、電流計14と、電源15と、A/D変換部16と、制御部17と、ディスプレイ12とを備えている。
光源13は、検出チップ20の作用電極上に存在させた標識物質に光を照射して当該標識物質を励起させる。光源13は、励起光を発生する光源であればよい。かかる光源としては、例えば、蛍光灯、ブラックライト、殺菌ランプ、白熱電球、低圧水銀ランプ、高圧水銀ランプ、キセノンランプ、水銀−キセノンランプ、ハロゲンランプ、メタルハライドランプ、LED(白色LED、青色LED、緑色LED、赤色LED等)、レーザー(炭酸ガスレーザー、色素レーザー、半導体レーザー)、太陽光等が挙げられる。これらの光源のなかでは、蛍光灯、白熱電球、キセノンランプ、ハロゲンランプ、メタルハライドランプ、LED、レーザー又は太陽光が好ましく、レーザーが特に好ましい。光源は、必要に応じて、分光器やバンドパスフィルタにより、特定波長領域の光のみが放出されるように構成されたものであってもよい。
電流計14は、励起された標識物質から放出される電子に起因して検出チップ20内を流れる電流を測定する。
電源15は、検出チップ20に設けられた電極に対して所定の電位を印加する。
A/D変換部16は、電流計14によって測定された光電流値をデジタル変換する。
制御部17は、CPU(Central Processing Unit)、ROM(Read Only Memory)、RAM(Random Access Memory)等から構成されている。この制御部17は、ディスプレイ12、光源13、電流計14及び電源15の動作を制御する。また、制御部17は、A/D変換部16でデジタル変換された光電流値から、予め作成された光電流値と標識物質の量との関係を示す検量線に基づき、標識物質の量を概算し、被検物質の量を算出する。
ディスプレイ12は、制御部17で概算された被検物質の量等の情報を表示する。
【0014】
なお、標識物質を後述の酸化還元電流・電気化学発光検出法にしたがって検出する場合、検出装置は、光源13を備えていなくてもよい(図示せず)。
標識物質を電気化学発光により検出する場合、検出装置は、標識物質から生じる光等を検出するためのセンサをさらに備えていればよい。
【0015】
[検出チップの構成]
つぎに、本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出チップ20の構成を説明する。
【0016】
図3は、本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出チップを示す斜視図である。図4(A)は、図3に示される検出チップのAA線での断面図であり、図4(B)は、図3に示される検出チップの上基板を下面側から見た斜視図であり、図4(C)は、図3に示される検出チップの下基板を上面側から見た斜視図である。
【0017】
検出チップ20は、上基板30と、上基板30の下方に設けられた下基板40と、上基板30と下基板40とに挟まれた間隔保持部材50とを備えている。検出チップ20では、上基板30と下基板40とは、一側部において重複して配置されている。そして、上基板30と下基板40とが重複する部分には、間隔保持部材50が介在している。
【0018】
上基板30は、図4(B)に示されるように、基板本体30aと、作用電極60とを備えている。この基板本体30aには、被検物質を含む試料等を内部に注入するための試料注入口30bが設けられている。基板本体30aの表面には、作用電極60と、作用電極60に接続されている電極リード71とが形成されている。上基板30においては、作用電極60は、基板本体30aの一側部〔図4(B)の左側〕に配置されている。電極リード71は、作用電極60から基板本体30aの他側部〔図4(B)の右側〕に向けて延びている。試料注入口30bは、基板本体30aにおいて、間隔保持部材50が介装される部分よりも内側に設けられている。
【0019】
本実施の形態において、基板本体30aは、矩形状に形成されている。なお、基板本体30aの形状は、特に限定されるものではなく、多角形形状、円盤状等であってもよい。基板本体30aの形状は、基板の作製及び取り扱いの簡便性の観点から、好ましくは矩形状である。
【0020】
基板本体30aを構成する材料としては、特に限定されないが、例えば、ガラス、ポリエチレンテレフタレート、ポリイミド樹脂等のプラスチック類、金属等の無機材料等が挙げられる。これらのなかでは、光の透過性、十分な耐熱性、耐久性、平滑性等を確保し、かつ材料に要するコストを低減させる観点から、好ましくはガラスである。基板本体30aの厚さは、十分な耐久性を確保する観点から、好ましくは0.01〜1mm、より好ましくは0.1〜0.7mm、さらに好ましくは約0.5mmである。基板本体30aの大きさは、特に限定されないが、多種類の被検物質の検出(多項目)を前提とした場合には項目数によるが、通常、20mm×20mm程度の大きさである。
【0021】
下基板40は、図4(C)に示されるように、基板本体40aと、対極66と、参照電極69とを備えている。基板本体40aは、上基板30の基板本体30aと略同寸法の矩形状に形成されている。基板本体40a及び基板本体30aは、必ずしも、同寸法である必要はない。
【0022】
基板本体40aを構成する材料としては、特に限定されないが、例えば、ガラス、ポリエチレンテレフタレート、ポリイミド樹脂等のプラスチック類、金属等の無機材料等が挙げられる。これらのなかでは、耐熱性、耐久性、平滑性等を確保し、かつ材料に要するコストを低減させる観点から、好ましくはガラスである。基板本体40aの厚さ及び大きさは、上基板30の基板本体30aの厚さ及び大きさと同様である。
【0023】
基板本体40aの表面には、対極66と、対極66に接続された電極リード72と、参照電極69と、参照電極69に接続された電極リード73とが形成されている。下基板40においては、対極66は、基板本体40aの一側部〔図4(C)の右側〕に配置されている。参照電極69は、基板本体40a上において、対極66と対向する位置に配置されている。対極66の電極リード72と参照電極69の電極リード73とは、それぞれ、基板本体40aの一側部〔図4(C)の右側〕から他側部〔図4(C)の左側〕へ向けて延びている。対極66及び参照電極69の各電極リード72,73は、基板本体40aの他側部〔図4(C)の左側〕において互いに並列するように配置されている。電極リード72,73は、上基板30と下基板40とが重複する部分からはみ出して外部に露出している〔図3及び図4(A)参照〕。なお、基板本体30a及び基板本体40aは、当該基板本体を透過させるようにして光を照射する場合には、透過性を有する材料から構成された基板本体であることが望ましい。この場合、基板本体30a及び基板本体40aのうち、光を照射する側の基板本体が、透過性を有する材料から構成されていればよい。
【0024】
つぎに、作用電極60、対極66及び参照電極69について、詳細に説明する。
図5は、本発明の一実施の形態に係る被検物質の電気化学的検出方法に用いる検出チップ中の電極を含む部分の一例を模式的に表した断面説明図である。作用電極60は、ほぼ四角形状に形成されている。作用電極60は、図5に示されるように、基板本体30a上に形成された作用電極本体61と、作用電極本体61上に固定化された捕捉物質81とから構成されている。作用電極本体61には、電極リード71が接続されている。
【0025】
後述の光電気化学検出法に用いる検出チップにおいては、作用電極本体61は、励起光が照射されることにより被検物質から生じた電子を受容する半導体からなる。この半導体は、導電体及び電子受容体として機能する。半導体は、光励起により被検物質から生じた電子の注入が可能なエネルギー準位をとり得る物質であればよい。ここで、「光励起により被検物質から生じた電子の注入が可能なエネルギー準位」とは、伝導帯(コンダクションバンド)を意味する。すなわち、半導体は、後述の標識物質の最低非占有分子軌道(LUMO)のエネルギー準位よりも低いエネルギー順位を有すればよい。かかる半導体としては、特に限定されないが、例えば、シリコン、ゲルマニウム等の単体半導体;チタン、スズ、亜鉛、鉄、タングステン、ジルコニウム、ハフニウム、ストロンチウム、インジウム、セリウム、イットリウム、ランタン、バナジウム、ニオブ、タンタル等の酸化物を含む酸化物半導体;チタン酸ストロンチウム、チタン酸カルシウム、チタン酸ナトリウム、チタン酸バナジウム、ニオブ酸カリウム等のペロブスカイト型半導体;カドニウム、亜鉛、鉛、銀、アンチモン、ビスマス等の硫化物を含む硫化物半導体;ガリウム、チタン等の窒化物を含む半導体;カドミウム、鉛のセレン化物からなる半導体(例えば、カドミウムセレナイド等);カドミウムのテルル化物を含む半導体;亜鉛、ガリウム、インジウム、カドミウム等のリン化合物からなる半導体;ガリウム砒素、銅−インジウム−セレン化物、銅−インジウム−硫化物等の化合物を含む半導体;カーボン等の化合物半導体又は有機物半導体等が挙げられる。なお、半導体は、真性半導体及び不純物半導体のいずれであってもよい。上記した半導体のなかでは、酸化物半導体が好ましい。酸化物半導体のうち、真性半導体のなかでは、酸化チタン、酸化亜鉛、酸化スズ、酸化ニオブ、酸化インジウム、酸化タングステン、酸化タンタル及びチタン酸ストロンチウムが好ましい。酸化物半導体のうち、不純物半導体のなかでは、スズをドーパントとして含む酸化インジウム(ITO)及びフッ素をドーパントとして含む酸化スズ(FTO)が好ましい。作用電極の厚さは、通常、0.1〜1μm、好ましくは0.1〜200nm、より好ましくは0.1〜10nmである。
【0026】
本発明においては、後述の光電気化学検出法に用いる検出チップにおける作用電極本体61は、半導体層と導電層とから構成されていてもよい。この場合、作用電極本体61の電極リード71は、導電層に接続される。
半導体層を構成する半導体は、上記した半導体と同様である。この場合の半導体層の厚さは、好ましくは0.1〜100nm、さらに好ましくは0.1〜10nmである。
導電層は、導電性材料からなる。導電性材料としては、例えば、金、銀、銅、カーボン、白金、パラジウム、クロム、アルミニウム、ニッケル等の金属又はこれらの少なくとも1つを含む合金;酸化インジウム、スズをドーパントとして含む酸化インジウム(ITO)等の酸化インジウム系材料;酸化スズ、アンチモンをドーパントとして含む酸化スズ(ATO)、フッ素をドーパントとして含む酸化スズ(FTO)等の酸化スズ系材料;チタン、酸化チタン、窒化チタン等のチタン系材料;グラファイト、グラシーカーボン、パイロリティックグラファイト、カーボンペースト、カーボンファイバー等の炭素系材料等が挙げられる。導電層の厚さは、好ましくは1〜1000nm、より好ましくは1〜200nm、さらに好ましくは1〜100nmである。導電層の厚さは、導電性が確保でき、かつ電極から生じる光電流(バックグランド電流)が最小となる膜厚が望ましい。なお、導電性材料は、ガラス、プラスチック等の非導電性物質からなる非導電性基材の表面に導電性を有する材料からなる導電材層が設けられた複合基材であってもよい。かかる導電材層の形状は、薄膜状及びスポット状のいずれであってもよい。導電材層を構成する材料としては、例えば、スズをドーパントとして含む酸化インジウム(ITO)、アンチモンをドーパントとして含む酸化スズ(ATO)、フッ素をドーパントとして含む酸化スズ(FTO)等が挙げられる。導電層は、例えば、当該導電層を構成する材料の種類に応じた膜形成方法により形成させることができる。
【0027】
一方、後述の酸化還元電流・電気化学発光検出方法に用いる検出チップにおいては、作用電極本体61は、導電性材料からなる。
導電性材料は、光電気化学検出法に用いる検出チップにおける作用電極本体61の導電層に用いられる導電性材料と同様である。
導電性材料は、ガラス、プラスチック等の非導電性物質からなる非導電性基材の表面に導電性を有する材料からなる導電材層が設けられた複合基材であってもよい。かかる導電材層の形状は、薄膜状及びスポット状のいずれであってもよい。
この場合、作用電極本体61の厚さは、好ましくは1〜1000nm、さらに好ましくは10〜200nmである。
【0028】
作用電極本体61の表面には、捕捉物質81が固定化されている〔図5参照〕。捕捉物質81は、被検物質を捕捉する物質である。これにより、被検物質を作用電極本体61の近傍に存在させることができる。捕捉物質81は、被検物質の種類に応じて、適宜選択することができる。捕捉物質81としては、例えば、核酸、タンパク質、ペプチド、糖鎖、抗体、特異的な認識能を持つナノ構造体等が挙げられる。
【0029】
対極66は、図5に示されるように、基板本体40a上に形成されている。対極66は、導電性材料からなる薄膜からなる。導電性材料としては、例えば、金、銀、銅、カーボン、白金、パラジウム、クロム、アルミニウム、ニッケル等の金属又はこれらの少なくとも1つを含む合金、ITO、酸化インジウム等の導電性セラミックス、ATO、FTO等の金属酸化物、チタン、酸化チタン、窒化チタン等のチタン化合物等が挙げられる。導電性材料からなる薄膜の厚さは、好ましくは1〜1000nm、より好ましくは10〜200nmである。
【0030】
参照電極69は、図5に示されるように、基板本体40a上に形成されている。参照電極69は、導電性材料からなる薄膜からなる。導電性材料としては、例えば、金、銀、銅、カーボン、白金、パラジウム、クロム、アルミニウム、ニッケル等の金属又はこれらの少なくとも1つを含む合金、ITO、酸化インジウム等の導電性セラミックス、ATO、FTO等の金属酸化物、チタン、酸化チタン、窒化チタン等のチタン化合物等が挙げられる。導電性材料からなる薄膜の厚さは、好ましくは1〜1000nm、より好ましくは10〜200nmである。本実施の形態では、参照電極69を設けているが、本発明においては、参照電極69を設けなくてもよい。対極66に用いる電極の種類、膜厚にもよるが、電圧降下の影響が僅かな小さな電流(例えば、1μA以下)を測定する場合は、対極66が参照電極69を兼ねていてもよい。一方、大きな電流を測定する場合、電圧降下の影響を抑制し、作用電極60に印加する電圧を安定化させる観点から、参照電極69を設けることが好ましい。
【0031】
つぎに、間隔保持部材50について、説明する。間隔保持部材50は、矩形の環状体形状に形成され、絶縁体であるシリコーンゴムからなっている。間隔保持部材50は、作用電極60、対極66及び参照電極69を取り囲むように配置されている〔図4(A)、図5及び図6参照〕。上基板30と下基板40との間には間隔保持部材50の厚さに相当する間隔が形成されている。これにより、各電極(作用電極60、対極66及び参照電極69)の間には試料や電解液を収容するための空間20aが形成されている〔図4(A)、図5及び図6参照〕。間隔保持部材50の厚さは、通常、0.2〜300μmである。本発明においては、間隔保持部材50を構成する材料として、シリコーンゴムの代わりに、例えば、ポリエステルフィルム等のプラスチック製両面テープ等を用いることもできる。
【0032】
本発明においては、作用電極60、対極66及び参照電極69は、各電極が他の電極と接触しないように間隔保持部材50の枠内に配置されていればよい。したがって、作用電極60、対極66及び参照電極69は、同一の基板本体上に形成されていてもよい。本発明においては、対極66及び参照電極69は、基板本体上に形成された薄膜状の電極でなくてもよい。この場合、対極66及び参照電極69のうちの少なくともいずれかが間隔保持部材50の部材本体に設けられていてもよい。そして、上基板30及び下基板40のいずれかに、間隔保持部材50の部材本体に設けた電極以外の電極が設けられていればよい。
【0033】
[被検物質の電気化学的検出方法]
本発明の被検物質の電気化学的検出方法は、被検物質を電解液中で電気化学的に検出する方法であって、
(1) 被検物質を含む試料を、この被検物質を捕捉する捕捉物質が作用電極本体上に固定された作用電極に接触させ、捕捉物質によって被検物質を作用電極上に捕捉する工程、
(2) 工程(1)で作用電極上に捕捉された被検物質と、当該被検物質に結合する結合物質に、電解液と捕捉物質が結合している部位以外の作用電極部位とに対して相互作用を生じる修飾物質を介して標識物質が保持された標識結合物質と、を含む複合体を作用電極上に形成させる工程、及び
(3) 工程(2)で得られた作用電極上に存在する標識物質を電気化学的に検出する工程
を含むことを特徴とする。
【0034】
本発明の被検物質の電気化学的検出方法では、被検物質と、結合物質に修飾物質を介して標識物質が保持された標識結合物質と、を含む複合体を作用電極上に形成させる点に1つの大きな特徴がある。
【0035】
本発明の方法では、標識物質として、光化学的又は電気化学的に活性な物質が用いられる。光化学的に活性な物質は、当該物質が光により励起されることにより放出される電子を用いて検出される。一方、電気化学的に活性な物質は、当該物質に基づく酸化還元電流及び/又は電気化学発光を用いて検出される。したがって、本発明の方法は、標識物質の検出技術の種類によって、光電気化学検出方法(図6及び図8参照)及び酸化還元電流・電気化学発光検出方法(図9参照)に大別することができる。
【0036】
1.光電気化学検出方法
まず、光電気化学検出方法について説明する。光電気化学検出方法には、上述した図1に示される検出装置及び図3に示される検出チップを用いることができるが、これらに限定されるものではない。以下、図1に示される検出装置及び図3に示される検出チップを用いる場合を例としてあげて説明する。図6は、本発明の一実施の形態に係る被検物質の電気化学的検出方法の処理手順を示す工程説明図である。
【0037】
光電気化学検出方法では、ユーザーは、被検物質Sを含む試料を、検出チップ20の試料注入口30bより注入する〔図6(A)試料供給工程を参照〕。これにより、試料中の被検物質が検出チップ20を構成する上基板30の作用電極本体61上の捕捉物質81によって捕捉される〔図6(B)被検物質捕捉工程を参照〕。このとき、試料中の被検物質S以外の物質(夾雑物質F)は、捕捉物質81に捕捉されない。
捕捉物質81は、被検物質Sの種類に応じて適宜選択することができる。例えば、被検物質Sが核酸である場合、捕捉物質81として、かかる核酸にハイブリダイズする核酸プローブ、核酸に対する抗体、核酸と結合するタンパク質等を用いることができる。被検物質Sがタンパク質又はペプチドである場合、捕捉物質81として、かかるタンパク質又はペプチドに対する抗体等を用いることができる。
【0038】
捕捉物質81による被検物質の捕捉は、例えば、捕捉物質81と被検物質とが結合する条件下で行なうことができる。捕捉物質81と被検物質とが結合する条件は、被検物質の種類等に応じて適宜選択することができる。例えば、被検物質が核酸であり、捕捉物質81が核酸にハイブリダイズする核酸プローブである場合、被検物質の捕捉は、ハイブリダイゼーション用緩衝液存在下に行なうことができる。被検物質が核酸、タンパク質又はペプチドであり、捕捉物質81が核酸に対する抗体、タンパク質に対する抗体又はペプチドに対する抗体である場合、被検物質の捕捉は、リン酸緩衝生理的食塩水、ヘペス(HEPES)緩衝液、ピペス(PIPES)緩衝液、トリス(Tris)緩衝液等の抗原抗体反応を行なうのに適した溶液中で行なうことができる。被検物質がリガンドであり、捕捉物質81がリガンドに対するレセプターである場合、及び、被検物質がレセプターであり、捕捉物質81がレセプターに対するリガンドである場合には、被検物質の捕捉は、リガンドとレセプターとの結合に適した溶液中で行なうことができる。
【0039】
つぎに、ユーザーは、試料注入口30bから当該検出チップ20内に標識結合物質90を注入して、標識結合物質90を、作用電極本体61上の捕捉物質81により捕捉された被検物質Sに結合させる〔図6(C)標識工程を参照〕。標識工程では、作用電極本体61上の捕捉物質81と、被検物質Sと、標識結合物質90とを含む複合体が形成される。
【0040】
標識結合物質90は、被検物質Sに結合する結合物質91と、修飾物質92と、標識物質93とから構成されている。標識結合物質90では、標識物質93が修飾物質92を介して結合物質91に固定化されている。
【0041】
結合物質91は、被検物質Sにおいて、捕捉物質81とは異なる位置や場所に結合する物質であればよい。結合物質91は、被検物質Sの種類に応じて適宜選択される。例えば、被検物質Sが核酸である場合、結合物質91として、かかる核酸にハイブリダイズする核酸プローブ、核酸に対する抗体、核酸と結合するタンパク質等を用いることができる。また、被検物質Sがタンパク質又はペプチドである場合、結合物質91として、かかるタンパク質又はペプチドに対する抗体等を用いることができる。
【0042】
修飾物質92は、結合物質91と標識物質93との間に介在している。修飾物質92は、電解液と作用電極本体61とに対する相互作用を生じる物質である。
【0043】
修飾物質92は、後述の検出工程に用いられる電解液及び作用電極の表面の極性に応じて、親水性を示す修飾物質及び疎水性を示す修飾物質のなかから選択することが好ましい。
本実施の形態に係る被検物質の電気化学的検出方法では、電解液が、非プロトン性溶媒を含有し、かつ作用電極の表面及び修飾物質が親水性を示すか、あるいは電解液が、プロトン性溶媒を含有し、かつ作用電極の表面及び修飾物質が疎水性を示すことが好ましい。
【0044】
親水性を示す修飾物質としては、例えば、DNA、RNA等の核酸;親水性高分子化合物であるポリエチレングリコール;親水性アミノ酸であるアスパラギン、セリン、アスパラギン酸、グルタミン、グルタミン酸、トレオニン、アルギニン、ヒスチジン、リシン、チロシン、システイン等から主に構成される親水性ポリペプチド等が挙げられる。非プロトン性溶媒としては、例えば、アセトニトリル(CH3CN)等のニトリル類;プロピレンカーボネート、エチレンカーボネート等のカーボネート類、1,3−ジメチルイミダゾリノン、3−メチルオキサゾリノン、ジアルキルイミダゾリウム塩等の複素環化合物;ジメチルホルムアミド、ジメチルスルホキシド、スルホラン等が挙げられる。非プロトン性溶媒のなかでは、アセトニトリルが好ましい。親水性を示す作用電極としては、例えば、表面に親水性官能基を有する電極等が挙げられる。親水性官能基としては、例えば、水酸基を含む官能基(例えば、シラノール基等)、アミノ基、チオール基等が挙げられる。かかる親水性を示す作用電極は、例えば、作用電極本体を、アミノ基を付与するアミノプロピルトリエトキシシラン、チオール基を付与するメルカプトプロピルトリエトキシシラン等のシランカップリング剤で処理を施すこと等により得ることができる。また、本発明においては、表面に親水性官能基を有する電極に、ポリエチレングリコール、核酸等をさらに結合させて親水性処理を施してもよい。
【0045】
一方、疎水性を示す修飾物質としては、例えば、疎水性アミノ酸であるグリシン、トリプトファン、メチオニン、プロリン、フェニルアラニン、アラニン、バリン、ロイシン、イソロイシン等から主に構成される疎水性ペプチド;疎水性を示す炭化水素から主に構成される高分子化合物(例えば、スチレンオリゴマー、アクリルオリゴマー等)が挙げられる。プロトン性溶媒としては、例えば、水;水を主体に緩衝液成分を混合した極性溶媒等が挙げられる。疎水性を示す作用電極としては、例えば、表面に疎水性官能基を有する電極等が挙げられる。かかる疎水性を示す作用電極は、例えば、シラノール基が導入された金属酸化物からなる作用電極本体に対して、当該作用電極本体の表面にメチル基やフェニル基を導入しうる化合物、例えば、メチルトリメトキシシラン、フェニルトリエトキシシラン等で処理すること等により得ることができる。
【0046】
修飾物質92の長さは、作用電極上での複合体の形成反応、例えば、捕捉した被検物質への結合物質の結合反応を阻害しない範囲で適宜選択することができる。修飾物質92の長さは、通常、100nm以下が好ましい。なお、修飾物質92の長さの下限値は、修飾物質92の種類などにより異なるので、修飾物質92の種類などに応じて適宜設定することが望ましい。
【0047】
標識物質93は、光を照射することにより励起状態となり電子を放出する物質である。標識物質93として、金属錯体、有機蛍光体、量子ドット及び無機蛍光体からなる群より選択された少なくとも1つを用いることができる。
標識物質の具体例としては、金属フタロシアン、ルテニウム錯体、オスミウム錯体、鉄錯体、亜鉛錯体、9−フェニルキサンテン系色素、シアニン系色素、メタロシアニン色素、キサンテン系色素、トリフェニルメタン系色素、アクリジン系色素、オキサジン系色素、クマリン系色素、メロシアニン系色素、ロダシアニン系色素、ポリメチン系色素、ポルフィリン系色素、フタロシアニン系色素、ローダミン系色素、キサンテン系色素、クロロフィル系色素、エオシン系色素、マーキュロクロム系色素、インジゴ系色素、BODIPY系色素、CALFluor系色素、オレゴングリーン系色素、ロードル(Rhodol)グリーン、テキサスレッド、カスケードブルー、核酸(DNA、RNA等)、セレン化カドミウム、テルル化カドミウム、Ln2O3:Re、Ln2O2S:Re、ZnO、CaWO4、MO・xAl2O3:Eu、Zn2SiO4:Mn、LaPO4:Ce、Tb、Cy3、Cy3.5、Cy5、Cy5.5、Cy7、Cy7.5及びCy9(いずれも、アマシャムバイオサイエンス社製);Alexa Fluor 355、Alexa Fluor 405、Alexa Fluor 430、Alexa Fluor 488、Alexa Fluor 532、Alexa Fluor546、Alexa Fluor 555、Alexa Fluor 568、Alexa Fluor 594、Alexa Fluor 633、Alexa Fluor 647、Alexa Fluor 660、Alexa Fluor 680、Alexa Fluor 700、Alexa Fluor 750及びAlexa Fluor 790(いずれも、モレキュラープローブ社製);DY−610、DY−615、DY−630、DY−631、DY−633、DY−635、DY−636、EVOblue10、EVOblue30、DY−647、DY−650、DY−651、DY−800、DYQ−660及びDYQ−661(いずれも、Dyomics社製);Atto425、Atto465、Atto488、Atto495、Atto520、Atto532、Atto550、Atto565、Atto590、Atto594、Atto610、Atto611X、Atto620、Atto633、Atto635、Atto637、Atto647、Atto655、Atto680、Atto700、Atto725及びAtto740(いずれも、Atto−TEC GmbH社製);VivoTagS680、VivoTag680及びVivoTagS750(いずれも、VisEnMedical社製)等が挙げられる。なお、LnはLa、Gd、Lu又はYを示し、Reはランタニド族元素を示し、Mはアルカリ土類金属元素を示し、xは0.5〜1.5の数を示す。標識物質の他の例については、例えば、特許第4086090号公報、特開平7−83927号公報等を参照することができる。
【0048】
修飾物質92と結合物質91との結合様式としては、共有結合、非共有結合等が挙げられる。
【0049】
修飾物質92を結合物質91に共有結合により結合させる方法は、特に限定されるものではない。
【0050】
結合物質91において、修飾物質92を共有結合させる部位は、特に限定されないが、結合物質91と修飾物質92との結合等の操作が簡便であることから、アミノ基及びスルフヒドリル基が好ましい。
【0051】
アミノ基へ結合できる反応基としては、例えば、サクシンイミド基(NHS)、イソチオシアノ基(ITC)、クロロスルホニル基、クロロアシル基、オキシエチレン基、クロロアルキル基、アルデヒド基、カルボキシル基等が挙げられる。これらのなかでは、アミノ基を介して目的とする修飾物質92を共有結合により結合させる場合には、水系での反応が必須であり、反応溶液のpHが中性〜弱アルカリ性領域にあること、氷冷下から37℃程度の反応温度で短時間に反応が進むこと等のように反応化合物を使用できる条件が限られていることから、好ましくはNHS及びITCである。したがって、修飾物質92として、NHS及び/又はITCを有する修飾物質を用いることができる。
【0052】
スルフヒドリル基に結合させることができる反応基としては、例えば、マレイミド基、ブロモアセトアミド基等があげられる。スルホヒドリル基は、通常、ポリペプチド中ではジスルフィド(S−S)結合を形成している。そのため、スルフヒドリル基を、修飾物質92を結合させる部位として用いる場合、ポリペプチド中のジスルフィド構造を還元し、スルフヒドリル基として用いることになる。ジスルフィド結合の還元には、ジチオスレイトール(DTT)、β−メルカプトエタノール(β−ME)、メルカプトエチルアミン(MEA)等を用いることができる。したがって、修飾物質92が、アミノ基及びスルフヒドリル基に対する反応性の高い官能基(例えば、サクシンイミド基、マレイミド基等)を有している場合には、結合物質91と修飾物質92とを混合するだけで、結合物質91のアミノ基及びスルフヒドリル基に修飾物質92を直接結合させることができる。かかる修飾物質92としては、例えば、サクシンイミドエステル修飾したDNA等が挙げられる。
【0053】
修飾物質92が、アミノ基、スルフヒドリル基、アルデヒド基、カルボキシル基等を有している場合は、例えば、化学クロスリンカーを介して結合物質91と修飾物質92とを結合させること;結合物質91がスルフヒドリル基を有する場合、結合物質91と修飾物質92との間にジチオール結合を形成させること;一般的な化学反応を行なうこと等により、結合物質91と修飾物質92とを容易に結合させることができる。
【0054】
クロスリンカーは、一般的に直鎖状の構造を有しており、両末端にアミノ基やチオール基と反応するサクシンイミド基、マレイミド基等を有するスペーサーからなる。かかるクロスリンカーを用いることにより、結合物質91と修飾物質92とを連結させることが可能である。
【0055】
例えば、修飾物質92がチオール基を有する場合、この修飾物質92を結合物質91のアミノ基に結合させる際に、一方の末端にサクシンイミド基を有し、かつ他方の末端にマレイミド基を有するクロスリンカーを用いることができる。この場合、まず、結合物質91中のアミノ基とクロスリンカー中のサクシンイミド基とを反応させ、クロスリンカーのマレイミド基を結合物質91に導入する。そして、マレイミド基と修飾物質92中のチオール基とを反応させることにより結合させることができる。ここで、クロスリンカーのスペーサーの長さは、特に限定されるものではない。クロスリンカーの具体例としては、N−[α−マレイミドアセトアセトキシ]スクシンイミドエステル(AMAS)、N−[β−マレイミドプロピルオキシ]スクシンイミドエステル(BMPS)、(マレイミドブチリルオキシ−スクシンイミドエステル(GMBS)、m−マレイミドベンゾイル−N−ヒドロキシスクシンイミドエステル(MBS)、スクシンイミジル トランス−4−(N−マレイミジルメチル)−シクロヘキサン−1−カルボキシラート(SMCC)、N−[ε−マレイミドカプロイルオキシ]スクシンイミドエステル(EMCS)、スクシンイミジル−4−(p−マレイミドフェニル)ブチラート(SMPB)、スクシンイミジル−6−[(β−マレイミドプロピオンアミド)ヘキサノエート](SMPH)、スクシンイミジル−4−[N−マレイミドメチル]シクロヘキサン−1−カルボキシ−[6−アミドカプロエート](LC−SMCC)、NHS−PEGn−Maleimid等が挙げられる。クロスリンカーは、両末端の官能基がアミノ基との反応性を有するグルタルアルデヒド、アミン反応性のNHSエステル基と光反応性のジアジリン基の2つの官能基を末端に有するクロスリンカー等であってもよい。
【0056】
結合物質91及び修飾物質92の両方がチオール基を有している場合、結合物質91のチオール基と修飾物質92のチオール基とを反応させることにより、ジチオール結合を形成することによっても結合可能である。修飾物質92がカルボキシル基を有し、かつ結合物質91がアミノ基を有する場合、カルボキシル基をNHSで活性化して、結合物質91のアミノ基と結合させることができる。修飾物質92がアルデヒド基を有し、かつ結合物質91がアミノ基を有する場合、修飾物質92のアルデヒド基と結合物質91のアミノ基との間でシッフ塩基を形成させた後、還元して安定な結合をつくることができる。
【0057】
修飾物質92を結合物質91に非共有結合により結合させる方法は、特に限定されるものではない。
【0058】
修飾物質92を結合物質91に非共有結合により結合させる方法としては、修飾物質92を結合物質91に非共有結合により直接結合させる方法、結合物質91に共有結合により結合させた物質を介して修飾物質92を非共有結合により結合させる方法等が考えられる。
【0059】
修飾物質92を結合物質91に非共有結合により結合させる方法としては、例えば、ストレプトアビジンとビオチンとの結合を利用する方法等が挙げられる。結合物質91に共有結合により結合させた物質を介して修飾物質92を非共有結合により結合させる方法としては、例えば、まず、末端にアミノ基等を有するDNAを結合物質91に共有結合させ、つぎに、上記したDNAに、修飾物質92を結合させた相補的なDNAをハイブリダイゼーションにより非共有結合的に結合させる方法等が挙げられる。
【0060】
修飾物質92への標識物質93の結合方法についても、修飾物質92を結合物質91に結合させるのと同様の方法により行なうことができる。
【0061】
つぎに、検出工程が行なわれる〔図6(D)検出工程を参照〕。
【0062】
かかる検出工程では、まず、ユーザーは、電解液を、検出チップ20の試料注入口30bより注入する。その後、ユーザーは、図1に示される検出装置1のチップ受入部11に検出チップ20を挿入する。そして、ユーザーは、検出装置1に測定開始を指示する。ここでは、検出装置1に挿入された検出チップ20の電極リード71,72,73は電流計14や電源15に接続される。そして、検出装置1の電源15により、参照電極69を基準として任意の電位が作用電極本体61に印加される。電極に印加される電位は、被検物質に対する励起光が照射されていない場合の電流値(定常電流、暗電流)が小さく、被検物質から生じる光電流が最大となる電位が好ましい。電位は、対極66に印加してもよく、作用電極本体61に印加してもよい。
【0063】
その後、検出装置1の光源13により、作用電極60上の標識物質93に励起光が照射される。これにより、標識物質93が励起し、電子を発生する。そして、発生した電子は、作用電極60に移動する。その結果、作用電極60と対極66との間に電流が流れる。そして、検出装置1の電流計14により、作用電極60と対極66との間に流れる電流が測定される。電流計14で測定された電流値は、標識物質93の個数と相関している。したがって、測定された電流値に基づき、被検物質Sを定量することができる。なお、励起光は、必要に応じて、分光器やバンドパスフィルタを用いて得られる特定波長領域の光のみであってもよい。
【0064】
その後、まず、A/D変換部16によってデジタル変換された電流値が制御部17に入力される。つぎに、予め作成された電流値と被検物質量との関係を示す検量線に基づき、制御部17により、デジタル変換後の電流値から、試料中の被検物質量が概算される。そして、概算された被検物質量の情報をディスプレイ12に表示するための検出結果画面が、制御部17によって作成される。その後、制御部17によって作成された検出結果画面がディスプレイ12に送信され、ディスプレイ12に表示される。
【0065】
電解液として、酸化された状態の標識物質93に電子を供給しうる塩からなる電解質と、非プロトン性溶媒又はプロトン性極性溶媒と、を含む溶液を用いることができる。この電解液は、所望により、他の成分をさらに含んでいてもよい。電解液は、ゲル状であってもよく、固体であってもよい。
【0066】
電解質としては、例えば、ヨウ化物、臭化物、金属錯体、チオ硫酸塩、亜硫酸塩、これらの混合物等が挙げられる。電解質の具体例としては、ヨウ化リチウム、ヨウ化ナトリウム、ヨウ化カリウム、ヨウ化セシウム、ヨウ化カルシウム等の金属ヨウ化物;テトラアルキルアンモニウムヨーダイド、ピリジニウムヨーダイド、イミダゾリウムヨーダイド等の4級アンモニウム化合物のヨウ素塩;臭化リチウム、臭化ナトリウム、臭化カリウム、臭化セシウム、臭化カルシウム等の金属臭化物;テトラアルキルアンモニウムブロマイド、ピリジニウムブロマイド等の4級アンモニウム化合物の臭素塩;フェロシアン酸塩、フェリシニウムイオン等の金属錯体;チオ硫酸ナトリウム、チオ硫酸アンモニウム、チオ硫酸カリウム、チオ硫酸カルシウム等のチオ硫酸塩;亜硫酸ナトリウム、亜硫酸カリウム、亜硫酸アンモニウム、亜硫酸鉄、亜硫酸水素ナトリウム、亜硫酸カルシウム等の亜硫酸塩;及びこれらの混合物等が挙げられる。これらのなかでは、テトラプロピルアンモニウムヨーダイド及びヨウ化カルシウムが好ましい。
【0067】
電解液の電解質濃度は、好ましくは0.001〜15Mである。
【0068】
標識物質93への光の照射には、標識物質93を光励起することができる波長の光を照射できる光源を用いることができる。かかる光源は、標識物質93の種類等に応じて、適宜選択することができる。光源としては、例えば、蛍光灯、ブラックライト、殺菌ランプ、白熱電球、低圧水銀ランプ、高圧水銀ランプ、キセノンランプ、水銀−キセノンランプ、ハロゲンランプ、メタルハライドランプ、LED(白色LED、青色LED、緑色LED、赤色LED等)、レーザー(炭酸ガスレーザー、色素レーザー、半導体レーザー)、太陽光等が挙げられる。光源のなかでは、蛍光灯、白熱電球、キセノンランプ、ハロゲンランプ、メタルハライドランプ、LED又は太陽光が好ましい。検出工程においては、必要に応じて、分光器やバンドパスフィルタを用いて得られる特定波長領域の光のみを標識物質93に照射してもよい。
【0069】
標識物質93に由来する光電流の測定には、例えば、電流計、ポテンショスタット、レコーダ、計算機等を備える測定装置を用いることができる。
かかる検出工程では、光電流を定量することにより、被検物質の量を調べることができる。
【0070】
以上のように、本実施の形態に係る被検物質の電気化学的検出方法では、被検物質Sの検出時には、結合物質91と標識物質93との間に修飾物質92が介在した状態となっている〔図6(D)を参照〕。これに対して、従来の被検物質の電気化学的検出方法では、例えば、図7(A)に示されるように、被検物質Sの標識には、結合物質としての抗体102が標識物質103により直接標識された標識抗体101が用いられている。そして、作用電極本体61上の捕捉物質81と、被検物質Sと、標識抗体101とを含む複合体を形成させ、電極上に形成された複合体中の標識物質103から生じる電流(光電流)に基づいて被検物質Sが検出される。そのため、図7に示される従来の方法では、被検物質Sの検出の際に形成される複合体の嵩高さが、高感度化を図る上で大きな制約となり、検出される光電流が小さくなる傾向にある。
【0071】
ところが、本実施の形態に係る被検物質の電気化学的検出方法では、作用電極60上に形成される複合体は、図7に示される従来の方法での被検物質Sの標識の際に形成される複合体と比べ、より嵩高くなっているにもかかわらず、予想外にも、図7に示される従来の方法よりも、高い検出感度で被検物質を検出することができる。
【0072】
なお、本実施の形態に係る被検物質の電気化学的検出方法では、夾雑物質に基づくノイズの発生を抑制する観点から、ユーザーは、被検物質捕捉工程後、検出チップ20の試料注入口30bより夾雑物質を含む残部の液体を排出し、検出チップ20内を洗浄してもよい。検出チップ20内の洗浄には、例えば、緩衝液(特に界面活性剤を含んだ緩衝液);精製水(特に界面活性剤を含んだ精製水);エタノール等の有機溶媒等を用いることができる。
【0073】
本実施の形態に係る被検物質の電気化学的検出方法では、被検物質Sに結合していない遊離の標識結合物質90を除去して、検出精度を向上させる観点から、標識工程の後、検出チップ20内を洗浄し、遊離の標識結合物質190を除去する工程をさらに行なってもよい。かかる洗浄には、例えば、エタノール、精製水等を用いることができる。
【0074】
さらに、本発明においては、標識工程において、標識物質が予め結合されている標識結合物質を用いて被検物質Sを標識する代わりに、図8に示されるように、標識工程中において、標識結合物質が形成されるように操作を行なってもよい。図8は、本発明の他の実施の形態に係る被検物質の電気化学的検出方法の処理手順を示す工程説明図である。図8に示される被検物質の電気化学的検出方法では、(A)試料供給工程、(B)被検物質捕捉工程及び(D)検出工程は、前述した図6に示される方法の(A)試料供給工程、(B)被検物質捕捉工程及び(D)検出工程と同様である。一方、図8に示される被検物質の電気化学的検出方法では、(C)標識工程において、まず、被検物質Sに結合体〔第1結合体90a及び第2結合体90b〕を付加する〔図8(C−1)結合体付加工程を参照〕。この(C−1)結合体付加工程では、まず、被検物質Sに結合する第1結合物質91aと、第2結合物質91bとからなる第1結合体90aを、作用電極本体61上の捕捉物質により捕捉された被検物質Sに結合させる〔図8(C−1−1)第1結合体付加工程を参照〕。つぎに、第1結合体90aに含まれる第2結合物質91bに結合する第2結合体90bを、第1結合体90aに結合させる〔図8(C−1−2)第2結合体付加工程を参照〕。その後、第2結合物質91bに修飾物質92を介して標識物質93が固定された標識体90cを、第2結合体90bに結合させる〔図8(C−2)標識体付加工程を参照〕。なお、図8に示される方法では、第1結合体90a及び標識体90cは、同じ結合物質(第2結合物質91b)により、第2結合体90bに結合するが、第1結合体90a中において、第2結合体90bと結合する結合物質と、標識体90c中において、第2結合体90bと結合する結合物質とは、互いに異なる物質であってもよい。
【0075】
2.酸化還元電流・電気化学発光検出方法
つぎに、酸化還元電流・電気化学発光検出方法について説明する。図9は、本発明のさらに他の実施の形態に係る被検物質の電気化学的検出方法の処理手順を示す工程説明図である。
【0076】
かかる酸化還元電流・電気化学発光検出方法は、標識工程〔図9(C)参照〕において、標識物質193として、電圧を印加することにより酸化還元電流を生じる標識物質又は電圧を印加することにより発光する標識物質を用いる点及び検出工程〔図9(D)参照〕において、電圧を作用電極60に印加して標識物質193から生じた光を検出する点が光電気化学検出方法と大きく異なっている。したがって、試料供給工程〔図9(A)参照〕及び被検物質捕捉工程〔図9(B)参照〕は、光電気化学検出方法と同様である。なお、本実施の形態に係る被検物質の電気化学的検出方法に用いられる検出装置1は、光源13を備えず、標識物質から生じる光を検出するためのセンサをさらに備えている装置である。本実施の形態に係る被検物質の電気化学的検出方法に用いられる検出チップ20は、作用電極本体61が導電性材料からなるものである。
【0077】
標識工程においては、ユーザーは、試料注入口30bから当該検出チップ20内に標識結合物質190を注入して、標識結合物質190を作用電極本体61上の捕捉物質81により捕捉された被検物質Sに結合させる〔図9(C)標識工程を参照〕。標識工程では、作用電極本体61上の捕捉物質81と、被検物質Sと、標識結合物質190とを含む複合体が形成される。
【0078】
標識結合物質190は、被検物質Sに結合する第1結合物質91と、修飾物質92と、標識物質193とから構成されている。標識結合物質190では、第1結合物質91と、標識物質193とが修飾物質92を介して連結されている。
【0079】
標識物質193は、電圧を印加することにより発光する標識物質である。
電圧を印加することにより発光する標識物質としては、例えば、ルミノール、ルシゲニン、ピレン、ジフェニルアントラセン、ルブレン等が挙げられる。
これらの標識物質の発光は、例えば、ホタルルシフェリン、デヒドロルシフェリンのようなルシフェリン誘導体、フェニルフェノール、クロロフェノールのようなフェノール類若しくはナフトール類のようなエンハンサ−を用いることにより増強することが可能である。
なお、本実施の形態に係る被検物質の電気化学的検出方法では、標識物質193として、電圧を印加することにより発光する標識物質の代わりに、電圧を印加することにより酸化還元電流を生じる標識物質を用いてもよい。
電圧を印加することにより酸化還元電流を生じる標識物質としては、例えば、電気的に可逆的な酸化還元反応を起こす金属を中心金属として含む金属錯体等が挙げられる。このような金属錯体としては、例えば、トリス(フェナントロリン)亜鉛錯体、トリス(フェナントロリン)ルテニュウム錯体、トリス(フェナントロリン)コバルト錯体、ジ(フェナントロリン)亜鉛錯体、ジ(フェナントロリン)ルテニュウム錯体、ジ(フェナントロリン)コバルト錯体、ビピリジンプラチナ錯体、ターピリジンプラチナ錯体、フェナントロリンプラチナ錯体、トリス(ビピリジル)亜鉛錯体、トリス(ビピリジル)ルテニュウム錯体、トリス(ビピリジル)コバルト錯体、ジ(ビピリジル)亜鉛錯体、ジ(ビピリジル)ルテニュウム錯体、ジ(ビピリジル)コバルト錯体等が挙げられる。
【0080】
なお、第1結合物質91及び修飾物質92は、光電気化学検出方法における第1結合物質91及び修飾物質92と同様である。
【0081】
つぎに、検出工程が行なわれる〔図9(D)検出工程を参照〕。
【0082】
かかる検出工程では、まず、ユーザーは、電解液を、検出チップ20の試料注入口30bより注入する。その後、ユーザーは、図1に示される検出装置1のチップ受入部11に検出チップ20を挿入する。そして、ユーザーは、検出装置1に測定開始を指示する。ここでは、検出装置1に挿入された検出チップ20の電極リード71,72,73は電流計14や電源15に接続される。そして、検出装置1の電源15により、作用電極60に電圧が印加される。これにより、標識物質193が励起され、光が生じる。標識物質193に基づく光の測定には、フォトンカウンタ等が用いられる。また、この場合、電極の代わりに、光ファイバーの先端に透明電極を形成することにより得られる光ファイバー電極を用いて光を間接的に検出することもできる(特許第2573443号公報を参照)。
【0083】
その後、まず、A/D変換部16によってデジタル変換された光量の値が制御部17に入力される。つぎに、予め作成された光量の値と被検物質量との関係を示す検量線に基づき、制御部17により、デジタル変換後の電流値から、試料中の被検物質量が概算される。そして、概算された被検物質量の情報をディスプレイ12に表示するための検出結果画面が、制御部17によって作成される。その後、制御部17によって作成された検出結果画面がディスプレイ12に送信され、ディスプレイ12に表示される。
【0084】
なお、本実施の形態に係る被検物質の電気化学的検出方法においても、夾雑物質に基づくノイズの発生を抑制する観点から、ユーザーは、被検物質捕捉工程後、検出チップ20の試料注入口30bより夾雑物質を含む残部の液体を排出し、検出チップ20内を洗浄してもよい。検出チップ20内の洗浄には、例えば、緩衝液(特に界面活性剤を含んだ緩衝液);精製水(特に界面活性剤を含んだ精製水);エタノール等の有機溶媒等を用いることができる。
【0085】
本実施の形態に係る被検物質の電気化学的検出方法では、被検物質Sに結合していない遊離の標識結合物質190を除去して、検出精度を向上させる観点から、標識工程の後、検出チップ20内を洗浄し、遊離の標識結合物質190を除去する工程をさらに行なってもよい。かかる洗浄には、例えば、エタノール、精製水等を用いることができる。
【0086】
さらに、本発明においては、標識工程において、標識物質193が予め結合されている標識結合物質190を用いて被検物質Sを標識する代わりに、標識工程中において、作用電極本体61上の捕捉物質81と、被検物質Sと、標識結合物質190とを含む複合体が形成されるように操作を行なってもよい。
【0087】
図9(D)では、光を測定する場合を例として挙げて示しているが、標識物質193が電圧を印加することにより酸化還元電流を生じる標識物質である場合には、標識物質193が励起され、電子が発生する。そして、発生した電子は、作用電極60に移動する。その結果、作用電極60と対極66との間に電流が流れる。そして、検出装置1の電流計14により、作用電極60と対極66との間に流れる電流が測定される。電流計14で測定された電流値は、標識物質の個数と相関している。したがって、測定された電流値に基づき、被検物質を定量することができる。
【実施例】
【0088】
以下、実施例等により、本発明を詳細に説明するが、本発明はこれらに限定されるものではない。
【0089】
(製造例1)
シランカップリング剤である3−メルカプトプロピルトリエトキシシラン(MPTES)を、その濃度が1体積%となるようにトルエンに添加し、溶液Aを得た。
【0090】
(製造例2)作用電極基板の作製
スパッタリング法により、二酸化ケイ素(SiO2)からなる基板本体上に、スズをドープした酸化インジウムの薄膜(厚さ200nm)からなる作用電極本体を形成した。この薄膜は、導電層と電子受容層とを兼ねている。つぎに、作用電極本体に、電流計と接続するための作用電極リードを接続した。
【0091】
つぎに、作用電極本体の表面を製造例1で得られた溶液Aを接触させて作用電極の本体表面にチオール基を付与した。
【0092】
また、捕捉物質である抗マウスIgG F(ab’)2抗体〔ダコ社製〕を、還元剤であるトリス(2−カルボキシエチル)ホスフィン塩酸塩(TCEP)固定ゲル〔ピアース製、商品名:Immobilized TCEP Disulfide Reducing Gel〕と接触させて還元し、抗マウスIgG Fab抗体を作製した。得られた抗マウスIgG Fab抗体を、その濃度が10μg/mLとなるようにトリス緩衝溶液〔pH7.2、以下、「TBS」という〕に添加し、抗体溶液を得た。
【0093】
つぎに、得られた抗体溶液を作用電極本体上に滴下した。そして、作用電極本体を4℃で一晩インキュベーションし、抗マウスIgG Fab抗体と作用電極本体上のチオール基とを反応させジチオール結合を形成した。これにより、抗マウスIgG Fab抗体を作用電極本体上に固定した。つぎに、作用電極本体上に、1mMトリエチレングリコール モノ−11−メルカプトウンデシルエーテル〔シグマ社製〕を滴下した。そして、作用電極本体を4℃で一晩インキュベーションして作用電極本体のブロッキングを行なった。これにより、作用電極基板を得た。
【0094】
(製造例3)
アセトニトリルとエチレンカーボネートとを体積比で2:3となるように混合し、非プロトン性溶媒を得た。この非プロトン性溶媒に、電解質塩としてテトラプロピルアンモニウムヨーダイドをその濃度が0.6Mとなるように溶解させた。得られた溶液に、さらに電解質として、ヨウ素をその濃度が0.06Mとなるように溶解させ、電解液を得た。
【0095】
(製造例4)
スパッタリング法により、二酸化ケイ素(SiO2)からなる基板本体上に、厚さ200nmの白金薄膜(導電層)からなる対極を形成し、対極基板を得た。この対極には電流計と接続するための対極リードを接続した。これにより、対極基板を得た。
【0096】
(実施例1)
抗マウスIgG抗体(シグマ社製)を、その濃度が7.3μMとなるように、0.1Mリン酸ナトリウム緩衝液(pH7)に添加した。つぎに、得られた混合物に、クロスリンカー〔(株)同仁化学研究所製、N−(4−マレイミドブチリルオキシ)スクシンイミド(GMBS)〕のジメチルスルホキシド(DMSO)溶液〔クロスリンカーの濃度:25mM〕を、クロスリンカーの濃度が2.5mMになるように添加した。得られた混合物を室温で30分間インキュベーションし、抗マウスIgG抗体とGMBSとを反応させた。得られた産物を脱塩カラム〔ピアース社製、商品名:Zeba Spin Micro desalting Column〕に供して未反応のGMBSを除去し、クロスリンカー結合抗体を得た。
【0097】
つぎに、得られたクロスリンカー結合抗体と、AlexaFluor750標識チオール化DNAとを、スクシンイミド基導入抗体/AlexaFluor750標識チオール化DNA(モル比)が1/14となるように混合した。得られた混合物を室温で4時間インキュベーションして、クロスリンカー結合抗体と、AlexaFluor750標識チオール化DNAとを反応させた。なお、AlexaFluor750標識チオール化DNAは、24ヌクレオチド長のDNA〔インビトロジェン社製5'-AACTACTGTCTTCACGCAGAAAGC-3'(配列番号:1)〕の5’末端がAlexaFluor750で標識され、かつ3’末端がチオール基修飾されたDNAである。
【0098】
得られた産物を、限外ろ過カラム〔アミコン社製、商品名:Amicon Ultra−0.5 100K〕に4回通して未反応のAlexaFluor750標識チオール化DNAを完全に除去し、標識結合物質を得た。得られた標識結合物質を、その濃度が1mg/mLとなるように、0.1Mリン酸ナトリウム緩衝液(pH7.0)を添加し、標識結合物質含有溶液を得た。
【0099】
得られた標識結合物質について、AlexaFluor750の吸収波長749nmにおける吸収を測定することにより、抗体1分子あたりの標識物質(AlexaFluor750)の数を調べた。その結果、抗体1分子あたりの標識物質(AlexaFluor750)の数は、9個であることが確認された。
【0100】
(比較例1)
抗マウスIgG抗体(シグマ社製)を、その濃度が14.6μMとなるように、0.1M炭酸ナトリウム緩衝液(pH8.5)に添加した。つぎに、得られた混合物に、AlexaFluor750誘導体〔商品名:AlexaFluor750 carboxylic acid,succinimidyl ester(インビトロジェン社製)〕のDMSO溶液〔AlexaFluor750誘導体の濃度:15mM〕を、AlexaFluor750誘導体の濃度が1.5mMになるように添加した。得られた混合物を室温で1時間インキュベーションし、抗マウスIgG抗体とAlexaFluor750誘導体とを反応させた。得られた産物を脱塩カラム〔ピアース社製、商品名:Zeba Spin Micro desalting Column〕に供して未反応のAlexaFluor750を除去し、標識抗体を得た。得られた標識抗体を、その濃度が2mg/mLとなるように、0.1Mリン酸ナトリウム緩衝液(pH7.0)を添加し、標識抗体含有溶液を得た。
【0101】
得られた標識抗体について、AlexaFluor750の吸収波長749nmにおける吸収を測定することにより、抗体1分子あたりの標識物質(AlexaFluor750)の数を調べた。その結果、抗体1分子あたりの標識物質(AlexaFluor750)の数は、10個であることが確認された。
【0102】
(試験例1)
(1−1)被検物質の捕捉
製造例2で得られた作用電極基板の作用電極の周囲に、隔壁となるようにシリコーンゴム(厚さ0.1mm)を配置した。その後、この作用電極基板とシリコーンゴムとに囲まれた空間に、1質量%ウシ血清アルブミン(BSA)を含む0.05質量%ポリオキシエチレンソルビタンモノラウラート(Tween−20)含有トリス緩衝溶液(TBS−T)を入れた。つぎに、上記した空間内の液体の排出後、100ng/mLマウスIgG(被験物質)含有1質量%BSAを含むTBS−T30μLを、上記した空間内に添加した。その後、作用電極基板を25℃1時間インキュベーションし、捕捉物質〔抗マウスIgG F(ab’)2抗体〕に、被検物質〔マウスIgG〕を捕捉させた〔図6(B)被検物質捕捉工程を参照〕。
【0103】
(1−2)標識
作用電極基板をTBS−Tで洗浄した。つぎに、実施例1で得られた1mg/mL標識結合物質含有溶液を、標識結合物質の濃度が20μg/mLとなるように1質量%BSAを含むTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションして、作用電極上の被検物質を標識した〔図6(C)参照〕(実験番号1)。
【0104】
一方、被検物質が存在しない場合の対照実験を以下のように行なった。まず、被検物質を捕捉させていない作用電極基板をTBS−Tで洗浄した。つぎに、実施例1で得られた1mg/mL標識結合物質含有溶液を、標識結合物質の濃度が20μg/mLとなるように1質量%BSAを含むTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした(実験番号2)。
【0105】
(2)対照実験
(1−1)と同様の操作を行ない、捕捉物質〔抗マウスIgG F(ab’)2抗体〕に、被検物質〔マウスIgG〕を捕捉させた。
【0106】
その後、(1−2)において、実施例1で得られた標識結合物質含有溶液の代わりに、比較例1で得られた標識抗体含有溶液を用いたことを除き、(1−2)と同様の操作を行ない、作用電極上の被検物質を標識した(実験番号3)。
【0107】
一方、被検物質が存在しない場合の対照実験を以下のように行なった。被検物質を捕捉させていない作用電極基板をTBS−Tで洗浄した。つぎに、比較例1で得られた2mg/mL標識抗体含有溶液を、標識結合物質の濃度が20μg/mLとなるように1質量%BSAを含むTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした(実験番号4)。
【0108】
(3)光電流の測定
実験番号1〜4の各作用電極基板の周囲に、厚さ0.2mmの側壁となるようにシリコーンゴムを配置した。つぎに、作用電極基板とシリコーンゴムとに囲まれた空間に、製造例3で得られた電解液を充填した。その後、電解液が充填された空間を、作用電極基板の上方から、製造例4で得られた対極基板で密封した。これにより、作用電極及び対極を電解液に接触させた。つぎに、作用電極基板及び対極からなる検出チップを電気化学計測装置に設置し、作用電極リード及び対極リードを電流計に接続した。
【0109】
作用電極基板側から対極基板に向けて、光源(波長781nm、出力13mWのレーザー光源)から励起光を照射した。光照射により、標識物質が励起され、電子を生じる。そして、生成した電子が作用電極に輸送されることにより、作用電極と対極との間に電流が流れる。そこで、この電流を測定した〔図6(D)検出工程参照〕。
【0110】
試験例1において、実施例1で得られた標識結合物質を用いて被検物質を検出する場合(実験番号1)の検出工程を示す概略説明図を図10(A)に、試験例1において、比較例1で得られた標識抗体を用いて被検物質を検出する場合(実験番号3)の検出工程を示す概略説明図を図10(B)に示す。また、試験例1において、検出方法の種類と光電流との関係を調べた結果を図11に示す。
【0111】
実験番号1の被検物質の電気化学的検出方法においては、実施例1で得られた標識結合物質〔図10(A)において、110を参照〕が用いられている。そのため、図10(A)に示されるように、検出工程では、励起光の照射により、抗体1分子あたり9個の標識物質から光電流が生じる。これに対して、実験番号3の被検物質の電気化学的検出方法においては、比較例1で得られた標識抗体〔図10(B)中、121参照〕が用いられている。そのため、図10(B)に示されるように、検出工程では、励起光の照射により、抗体1分子あたり10個の標識物質から光電流が生じる。したがって、実験番号1の被検物質の電気化学的検出方法で検出される光電流は、実験番号3の被検物質の電気化学的検出方法で検出される光電流と略同じであるか、若干小さいことが予想されうる。
【0112】
しかしながら、図11に示された結果から、実験番号1の被検物質の電気化学的検出方法で検出される光電流は20nAであるのに対して、実験番号3の被検物質の電気化学的検出方法で検出される光電流は4.5nAであることがわかる。これらの結果から、実験番号1の被検物質の電気化学的検出方法で検出される光電流は、予想外にも、実験番号3の被検物質の電気化学的検出方法で検出される光電流と比べ、はるかに大きいことがわかる。
【0113】
実施例1で得られた標識結合物質及び比較例1で得られた標識抗体では、結合物質として同一の抗体が用いられている。そのため、被検物質への実施例1で得られた標識結合物質及び比較例1で得られた標識抗体それぞれの結合効率は、略同じであると考えられる。また、被検物質がない場合では、いずれも、光電流は約0nAである(図11中、実験番号2及び実験番号4を参照)。そのため、実験番号1の被検物質の電気化学的検出方法で検出される光電流と実験番号3の被検物質の電気化学的検出方法で検出される光電流との違いは、ノイズの影響ではないと考えられる。したがって、実験番号1の被検物質の電気化学的検出方法で検出される光電流と実験番号3の被検物質の電気化学的検出方法で検出される光電流との違いは、標識物質と結合物質との間にDNAが介在しているかどうかによると考えられる。
【0114】
(実施例2)
(1−1)被検物質の捕捉
製造例2で得られた作用電極基板の作用電極の周囲に、隔壁となるようにシリコーンゴム(厚さ0.1mm)を配置した。その後、この作用電極基板とシリコーンゴムとに囲まれた空間に、1質量%BSAを含むTBS−Tを入れた。上記した空間内の液体の排出後、100ng/mLマウスIgG(被検物質)含有1質量%BSAを含むTBS−T30μLを、上記した空間内に添加した〔図12(A)を参照〕。その後、作用電極基板を25℃で1時間インキュベーションし、捕捉物質〔抗マウスIgG F(ab’)2抗体〕に、被検物質〔マウスIgG〕を捕捉させた〔図12(B)を参照〕。
【0115】
(1−2)標識
作用電極基板をTBS−Tで洗浄した。つぎに、2.1mg/mLビオチン標識抗マウスIgG抗体〔シグマ社製〕を含む溶液を、濃度が4μg/mLとなるように1質量%BSAを含むTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした。これにより、第1結合体であるビオチン標識抗マウスIgG抗体〔図12(B)において、130aを参照〕を、捕捉物質〔図12(B)において、81を参照〕に捕捉された被検物質〔図12(B)において、Sを参照〕に結合させた。なお、ビオチン標識抗マウスIgG抗体は、抗マウスIgG抗体〔図12(B)において、131aを参照〕をビオチン〔図12(B)において、131bを参照〕で標識したものである。
【0116】
作用電極基板をTBS−Tで洗浄した。つぎに、第2結合体であるストレプトアビジン〔ベクター社製〕を含む溶液〔第2結合体の濃度:2mg/mL〕を、第2結合体の濃度が4μg/mLとなるようにTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、ストレプトアビジン〔図12(C)において、130bを参照〕を、作用電極上のビオチン標識抗マウスIgG抗体に結合させた。
【0117】
作用電極基板をTBS−Tで洗浄した。つぎに、標識体であるビオチン化AlexaFluor750標識DNAを含有する溶液〔標識体の濃度:100μM〕を、標識体の濃度が1μMとなるようにTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、作用電極上に、被検物質と第1結合体と第2結合体と標識体とを含む複合体を形成させた(実験番号5)。第1結合体と第2結合体とからなる複合体〔図12(D)において、131を参照〕は、実施例1で得られた標識結合物質中の結合物質に対応している。すなわち、作用電極上においては、被検物質に結合した結合物質〔図12(D)において、131を参照〕に、修飾物質であるDNA〔図12(D)において、132を参照〕を介して、標識物質であるAlexaFluor750〔図12(D)において、133参照〕が結合している。
【0118】
なお、ビオチン化AlexaFluor750標識DNAは、24ヌクレオチド長のDNA〔インビトロジェン社製、5'-AACTACTGTCTTCACGCAGAAAGC-3'(配列番号:1)〕の5’末端がビオチン修飾され、かつ3’末端がAlexaFluor750で標識されたDNAである。
【0119】
一方、被検物質を用いなかったことを除き、上記と同様に操作を行ない、被検物質が存在しない場合の対照実験を行なった(実験番号6)。
【0120】
(2)対照実験
第1結合体、第2結合体及び標識体を用いる代わりに、標識物質が抗体に直接結合した標識抗体〔比較例1で得られた標識抗体〕を用い、以下のように、対照実験を行なった。まず、(1−1)と同様の操作を行ない、捕捉物質〔抗マウスIgG F(ab’)2抗体〕に、被検物質〔マウスIgG〕を捕捉させた〔図13(B)を参照〕。
【0121】
作用電極基板をTBS−Tで洗浄した後、比較例1で得られた1mg/mL標識抗体含有溶液を、標識抗体の濃度が20μg/mLとなるように1質量%BSAを含むTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションして、作用電極上の被検物質を標識した〔図13(B)参照〕(実験番号7)。
【0122】
一方、被検物質が存在しない場合の対照実験を以下のように行なった。まず、被検物質を捕捉させていない作用電極基板をTBS−Tで洗浄した。つぎに、比較例1で得られた2mg/mL標識抗体含有溶液を、標識抗体の濃度が20μg/mLとなるように1質量%BSAを含むTBS−Tに添加した。得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした(実験番号8)。
【0123】
(3)光電流の測定
実験番号5〜8の各作用電極基板の周囲に、厚さ0.2mmの側壁となるようにシリコーンゴムを配置した。つぎに、作用電極基板とシリコーンゴムとに囲まれた空間に、製造例3で得られた電解液を充填した。その後、電解液が充填された空間を、作用電極基板の上方から、製造例4で得られた対極基板で密封した。これにより、作用電極及び対極を電解液に接触させた。つぎに、作用電極基板及び対極からなる検出チップを電気化学計測装置に設置し、作用電極リード及び対極リードを電流計に接続した。
【0124】
作用電極基板側から対極基板に向けて、光源(波長781nm、出力13mWのレーザー光源)から励起光を照射した。光照射により、標識物質であるAlexaFluor750〔図12(D)において、133参照〕が励起され、電子を生じる。そして、生成した電子が作用電極に輸送されることにより、作用電極と対極との間に電流が流れる。そこで、この電流を測定した。
【0125】
実施例2における実験番号5の被検物質の電気化学的検出方法の検出工程を示す概略説明図を図14(A)に、実施例2における実験番号7の被検物質の電気化学的検出方法の検出工程を示す概略説明図を図14(B)に示す。また、実施例2において、検出方法の種類と光電流との関係を調べた結果を図15に示す。
【0126】
実験番号5の被検物質の電気化学的検出方法においては、図14(A)に示されるように、第1結合体であるビオチン標識抗マウスIgG抗体〔図中、131aを参照〕と、第2結合体であるストレプトアビジン〔図中、130bを参照〕と、標識体であるビオチン化AlexaFluor750標識DNA〔図中、130cを参照〕とが用いられている。ここで、ストレプトアビジンの分子量は、53kDa程度であり、ビオチン標識抗マウスIgG抗体のビオチンとストレプトアビジンが結合したときの立体障害を考慮すると、1分子のビオチン標識抗マウスIgG抗体(分子量150kDa程度)に結合させることができるAlexaFluor750の数は、最大4分子程度であると考えられる。また、ストレプトアビジン中の4つのビオチン結合サイトのうちの3つに、ビオチン化AlexaFluor750標識DNAを結合させることができる。そのため、図14(A)に示されるように、検出工程では、励起光の照射により、抗体1分子あたり9〜12個の標識物質から光電流が生じる。これに対して、実験番号7の被検物質の電気化学的検出方法においては、標識抗体〔図14(B)において、141を参照〕が用いられている。そのため、図14(B)に示されるように、検出工程では、励起光の照射により、抗体〔図14(B)において、142を参照〕1分子あたり10個の標識物質〔AlexaFluor750、図14(B)において、143を参照〕から光電流が生じる。したがって、DNAを考慮しなければ、実験番号5の被検物質の電気化学的検出方法で検出される光電流は、実験番号7の被検物質の電気化学的検出方法で検出される光電流と同程度であることが予想されうる。
【0127】
しかしながら、図15に示された結果から、実験番号5の被検物質の電気化学的検出方法で検出される光電流は12nAであるのに対して、実験番号7の被検物質の電気化学的検出方法で検出される光電流は4.5nAであることがわかる。これらの結果から、実験番号5の被検物質の電気化学的検出方法で検出される光電流は、予想外にも、実験番号7の被検物質の電気化学的検出方法で検出される光電流と比べ、はるかに大きいことがわかる。したがって、実験番号5の被検物質の電気化学的検出方法で検出される光電流と実験番号7の被検物質の電気化学的検出方法で検出される光電流との違いは、標識物質と結合物質との間にDNAが介在しているかどうかによると考えられる。
【0128】
DNAは、親水性を示す。したがって、DNAは、非プロトン性溶媒を含有する電解液及び親水性のトリエチレングリコール(TEG)鎖が導入された作用電極本体に対し、相互作用(親水性相互作用)を生じると考えられる。一方、電解液がプロトン性溶媒を含有し、かつ作用電極本体に疎水性の官能基が導入されている場合には、DNAの代わりに疎水性を有する物質を用いることにより、相互作用(疎水性相互作用)が生じると考えられる。
【0129】
以上の結果から、被検物質を標識するために、電解液と捕捉物質が結合している部位以外の作用電極部位とに対して相互作用を生じる修飾物質を介して標識物質が結合物質に少なくとも固定された標識結合物質を用いることにより、高感度で被検物質を検出することができることが示唆される。
【0130】
(製造例5)
ビオチン化DNA及びAlexaFluor750標識DNAを、それぞれの濃度が1μM及び10μMとなるように1M塩化ナトリウム含有リン酸緩衝液中に添加した。得られた混合物を80℃で1分間加熱した後、当該混合物の温度を毎分1℃下降させながら4℃まで冷却した。これにより、ビオチン化DNAとAlexaFluor750標識DNAとをハイブリダイゼーションさせ、ビオチン化DNA−AlexaFluor750標識DNA複合体(図16中、170参照)を作製した。なお、ビオチン化DNAは、84ヌクレオチド長のDNA〔インビトロジェン社製、5'-biotin-AAACCACGGCCCTAGGGACAACGACCACGGCCCTAGGGACAACGACCACGGCCCTAGGGACAACGACCACGGCCCTAGGGACAACGA-3'(配列番号:2)、図16中、172a参照〕の5’末端がビオチン(図16中、172b参照)で修飾されたDNA(リン酸骨格の5’末端に(CH2)3リンカーを介してビオチンが結合しているDNA)である(図16中、172参照)。また、AlexaFluor750標識DNAは、20ヌクレオチド長のDNA〔インビトロジェン社製、5'-CGTTGTCCCTAGGGCCGTGGGTATGCGCGCTGCTATGCCG-3'(配列番号:3)、図16中、171b参照〕の5’末端及び3’末端がAlexaFluor750(図16中、171a参照)で標識されたDNAである(図16中、171参照)。
【0131】
(実施例3)
多価標識DNAによるマウスIgGの検出
(1−1)被検物質の捕捉
製造例2で得られた作用電極基板の作用電極の周囲に、隔壁となるようにシリコーンゴム(厚さ0.1mm)を配置した。その後、この作用電極基板とシリコーンゴムとに囲まれた空間に、0.4質量%ブロックエース〔DSファーマバイオメディカル社製〕を含むTBS−Tを入れた。つぎに、作用電極基板を25℃で30分間インキュベーションした。作用電極基板をTBS−Tで洗浄した後、被検物質である10ng/mLマウスIgG含有1質量%BSAを含むTBS−T 30μLを、上記した空間内に添加した。その後、作用電極基板を25℃で1時間インキュベーションし、作用電極基板の作用電極本体(図17中、61参照)上に固定された捕捉物質〔抗マウスIgG F(ab’)2抗体、図17中、81参照〕に、被検物質〔マウスIgG、図17中、S参照〕を捕捉させた〔図17(A)参照〕。
【0132】
(1−2)標識
(1−1)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、ビオチン標識抗マウスIgG F(ab’)2抗体〔ダコ社製〕を、その濃度が4μg/mLとなるように1質量%BSAを含むTBS−Tに添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした。これにより、第1結合体であるビオチン標識抗マウスIgG F(ab’)2抗体(図17中、151参照)を、捕捉物質(図17中、81参照)に捕捉された被検物質(図17中、S参照)に結合させた〔図17(B)参照〕。なお、ビオチン標識抗マウスIgG F(ab’)2抗体は、抗マウスIgGF(ab’)2抗体(図17中、152参照)をビオチン(図17中、153参照)で標識したものである。
【0133】
つぎに、作用電極基板をTBS−Tで洗浄した。つぎに、第2結合体であるストレプトアビジン〔ベクター社製〕を、その濃度が4μg/mLとなるようにTBS−Tに添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、ストレプトアビジン(図17中、160参照)を、作用電極本体(図17中、61参照)上のビオチン標識抗マウスIgG F(ab’)2抗体(図17中、151参照)中のビオチン(図17中、153)に結合させた〔図17(C)参照〕。
【0134】
(1−3)色素標識
(1−2)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、製造例5で得られたビオチン化DNA−AlexaFluor750標識DNA複合体を含有する溶液(複合体の濃度:93μg/mL)30μLに当該溶液の10倍容量のTBS−Tを添加した後、得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、作用電極本体(図17中、61参照)上に、被検物質(図17中、S参照)と第1結合体であるビオチン標識抗マウスIgG F(ab’)2抗体(図17中、151参照)と第2結合体であるストレプトアビジン(図17中、160参照)と標識体であるビオチン化DNA−AlexaFluor750標識DNA複合体(図17中、170参照)とを含む複合体を形成させた〔図17(D)参照〕。第1結合体と第2結合体とからなる複合体は、実施例1で得られた標識結合物質中の結合物質に対応している。すなわち、作用電極上においては、被検物質に結合した結合物質に、修飾物質であるDNAを介して、標識物質であるAlexaFluor750が結合している。
【0135】
(2)光電流の測定
作用電極基板の周囲に、厚さ0.2mmの側壁となるようにシリコーンゴムを配置した。そして、作用電極基板とシリコーンゴムとに囲まれた空間に、製造例3で得られた電解液を充填した。そして、電解液が充填された空間を、作用電極基板の上方から、製造例4で得られた対極基板で密封した。これにより、作用電極及び対極を電解液に接触させた。つぎに、作用電極基板及び対極からなる検出チップを電気化学計測装置に設置し、作用電極リード及び対極リードを電流計に接続した。
【0136】
作用電極基板側から対極基板に向けて、光源(波長781nm、出力13mWのレーザー光源)から励起光を照射した。光照射により、標識物質であるAlexaFluor750が励起され、電子を生じる。そして、生成した電子が作用電極に輸送されることにより、作用電極と対極との間に電流が流れる。そこで、この電流を測定した(実験番号9)。
【0137】
なお、製造例5で得られたビオチン化DNA−AlexaFluor750標識DNA複合体の代わりに、実験番号5(ビオチン化AlexaFluor750標識DNA:配列番号1)で使用した複合体を用いて、上記と同様の操作を行なったものを対照実験とした(実験番号10)。
【0138】
実施例3において、検出方法の種類と光電流との関係を調べた結果を図18に示す。
【0139】
図18に示された結果から、実験番号9の被検物質の電気化学的検出方法で検出される光電流は3.6nAであるのに対して、実験番号10の被検物質の電気化学的検出方法で検出される光電流は0.68nAであることがわかる。これらの結果から、実験番号9の被検物質の電気化学的検出方法で検出される光電流は、実験番号10の被検物質の電気化学的検出方法で検出される光電流と比べて大きいことがわかる。
【0140】
以上の結果から、被検物質を標識するために、修飾物質間の相互作用を介してより多くの標識物質が結合物質に固定された多価標識結合物質を用いることにより、より高感度で被検物質を検出することができることが示唆される。
【0141】
(実施例4)
多価標識DNAによるマウスIgGの定量検出
(1−1)被検物質の捕捉
製造例2で得られた作用電極基板の作用電極の周囲に、隔壁となるようにシリコーンゴム(厚さ0.1mm)を配置した。その後、この作用電極基板とシリコーンゴムとに囲まれた空間に、0.4質量%ブロックエース〔DSファーマバイオメディカル社製〕を含むTBS−Tを入れた。その後、作用電極基板を25℃で30分間インキュベーションした。つぎに、作用電極基板をTBS−Tで洗浄した後、被検物質である10ng/mLマウスIgG含有1質量%BSAを含むTBS−T 30μLを上記した空間内に添加した。その後、前記作用電極基板を25℃で1時間インキュベーションし、捕捉物質〔抗マウスIgG F(ab’)2抗体〕に、被検物質〔マウスIgG〕を捕捉させた。
【0142】
(1−2)標識
(1−1)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、ビオチン標識抗マウスIgG F(ab’)2抗体〔ダコ社製〕を、その濃度が4μg/mLとなるように1質量%BSAを含むTBS−Tに添加した後、得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした。これにより、第1結合体であるビオチン標識抗マウスIgG F(ab’)2抗体を、捕捉物質に捕捉された被検物質に結合させた。なお、ビオチン標識抗マウスIgG F(ab’)2抗体は、抗マウスIgGF(ab’)2抗体をビオチンで標識したものである。
【0143】
つぎに、作用電極基板をTBS−Tで洗浄した後、第2結合体であるストレプトアビジン〔ベクター社製〕2mg/mLを、濃度が4μg/mLとなるようにTBS−Tに添加した後、得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、ストレプトアビジンを、作用電極上のビオチン標識抗マウスIgG F(ab’)2抗体に結合させた。
【0144】
(1−3)色素標識
(1−2)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、製造例5で得られたビオチン化DNA−AlexaFluor750標識DNA複合体を含有する溶液(複合体の濃度:93μg/mL)30μLに当該溶液の10倍容量のTBS−Tを添加した後、得られた混合物30μLを上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、作用電極上に、被検物質と第1結合体と第2結合体と標識体とを含む複合体を形成させた。第1結合体と第2結合体とからなる複合体は、実施例1で得られた標識結合物質中の結合物質に対応している。すなわち、作用電極上においては、被検物質に結合した結合物質に、修飾物質であるDNAを介して、標識物質であるAlexaFluor750が結合している。
【0145】
(2)光電流の測定
作用電極基板の周囲に、厚さ0.2mmの側壁となるようにシリコーンゴムを配置した。そして、作用電極基板とシリコーンゴムとに囲まれた空間に、製造例3で得られた電解液を充填した。そして、電解液が充填された空間を、作用電極基板の上方から、製造例4で得られた対極基板で密封した。これにより、作用電極及び対極を電解液に接触させた。つぎに、作用電極基板及び対極からなる検出チップを電気化学計測装置に設置し、作用電極リード及び対極リードを電流計に接続した。
【0146】
作用電極基板側から対極基板に向けて、光源(波長781nm、出力13mWのレーザー光源)から励起光を照射した。光照射により、標識物質であるAlexaFluor750が励起され、電子を生じる。そして、生成した電子が作用電極に輸送されることにより、作用電極と対極との間に電流が流れる。そこで、この電流を測定した。
【0147】
なお、(1−1)において、被検物質として、10ng/mLマウスIgGを用いる代わりに、100pg/mLマウスIgG、1ng/mLマウスIgGを用いたことを除き、上記と同様の操作を行なって電流を測定した。また、被検物質を用いなかったことを除き、上記と同様に操作を行ない、被検物質が存在しない場合の対照実験を行なった。
【0148】
実施例4において、被検物質(マウスIgG)の濃度と光電流との関係を調べた結果を図19に示す。
【0149】
図19に示された結果から、被検物質の濃度が100pg/mL、1ng/mL及び10ng/mLである場合に検出される光電流は、それぞれ、0.95nA、2.85nA及び14.9nAであることがわかる。また、被検物質が存在しない場合に検出される光電流は、0.47nAであることがわかる。したがって、これらの結果から、被検物質の電気化学的検出方法で検出される光電流は被検物質の濃度に応じて増加していることがわかる。また、これらの結果から、被検物質の濃度が100pg/mL〜10ng/mLの範囲である場合、被検物質を定量的に検出することができることがわかる。
【0150】
以上の結果から、被検物質を標識するために、修飾物質間の相互作用を介してより多くの標識物質が結合物質に固定された多価標識結合物質を用いることにより、高感度で定量的に被検物質を検出することができることが示唆される。
【0151】
(製造例6)作用電極基板の作製
スパッタリング法により、二酸化ケイ素(SiO2)からなる基板本体上に、スズをドープした酸化インジウムの薄膜(厚さ200nm)からなる作用電極本体を形成した。上記した薄膜は、導電層と電子受容層とを兼ねている。つぎに、作用電極本体に、電流計と接続するための作用電極リードを接続した。
【0152】
つぎに、作用電極本体の表面を製造例1で得られた溶液Aを接触させて作用電極の本体表面にチオール基を付与した。
【0153】
また、捕捉物質である抗ヒトインターロイキン−6抗体〔バイオレジェンド社製〕を、還元剤であるトリス(2−カルボキシエチル)ホスフィン塩酸塩(TCEP)固定ゲル〔ピアース社製、商品名:Immobilized TCEP Disulfide Reducing Gel〕と接触させて還元し、重鎖還元型抗ヒトインターロイキン−6抗体を作製した。得られた抗ヒトインターロイキン−6抗体を、その濃度が10μg/mLとなるようにTBSに添加し、抗体溶液を得た。
【0154】
つぎに、得られた抗体溶液を作用電極本体上に滴下した。そして、作用電極本体を4℃で一晩インキュベーションし、抗ヒトインターロイキン−6抗体と作用電極本体上のチオール基とを反応させジチオール結合を形成した。これにより、抗ヒトインターロイキン−6抗体を作用電極本体上に固定した。つぎに、作用電極本体上に、1mMトリエチレングリコール モノ−11−メルカプトウンデシルエーテル〔シグマ社製〕を滴下した。そして、作用電極本体を4℃で一晩インキュベーションして作用電極本体のブロッキングを行なった。これにより、作用電極基板を得た。
【0155】
(実施例5)
多価標識DNAによるインターロイキン−6(IL−6)の定量検出
(1−1)被検物質の捕捉
製造例6で得られた作用電極基板の作用電極の周囲に、隔壁となるようにシリコーンゴム(厚さ0.1mm)を配置した。その後、この作用電極基板とシリコーンゴムとに囲まれた空間に、0.4質量%ブロックエース〔DSファーマバイオメディカル社製〕を含むTBS−Tを入れた。上記した空間内の液体の排出後、被検物質であるヒトインターロイキン−6を25質量%ウシ血清〔サーモサイエンティフィック社製〕と0.75質量%BSAとを含むTBS−Tで希釈して得られた被検物質溶液(被検物質の濃度:500pg/mL)30μLを、上記した空間内に添加した。その後、作用電極基板を25℃で1時間インキュベーションし、捕捉物質〔抗ヒトインターロイキン−6抗体〕に、被検物質〔インターロイキン−6〕を捕捉させた。
【0156】
(1−2)標識
(1−1)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、ビオチン標識抗ヒトインターロイキン−6抗体〔バイオレジェンド社製〕をその濃度が1μg/mLとなるように1質量%BSAを含むTBS−Tに添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした。これにより、第1結合体であるビオチン標識抗ヒトインターロイキン−6抗体を、捕捉物質に捕捉された被検物質に結合させた。なお、ビオチン標識抗ヒトインターロイキン−6抗体は、抗ヒトインターロイキン−6抗体をビオチンで標識したものである。
【0157】
つぎに、作用電極基板をTBS−Tで洗浄した。つぎに、第2結合体であるストレプトアビジン〔ベクター社製〕2mg/mLを、濃度が4μg/mLとなるようにTBS−Tに添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、ストレプトアビジンを、作用電極上のビオチン標識ヒトインターロイキン−6抗体に結合させた。
【0158】
(1−3)色素標識
(1−2)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、製造例5で得られたビオチン化DNA−AlexaFluor750標識DNA複合体を含有する溶液(複合体の濃度:93μg/mL)100μLに当該溶液の10倍容量のTBS−Tを添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、作用電極上に、被検物質と第1結合体と第2結合体と標識体とを含む複合体を形成させた。第1結合体と第2結合体とからなる複合体は、実施例1で得られた標識結合物質中の結合物質に対応している。すなわち、作用電極上においては、被検物質に結合した結合物質に、修飾物質であるDNAを介して、標識物質であるAlexaFluor750が結合している。
【0159】
(2)光電流の測定
作用電極基板の周囲に、厚さ0.2mmの側壁となるようにシリコーンゴムを配置した。そして、作用電極基板とシリコーンゴムとに囲まれた空間に、製造例3で得られた電解液を充填した。そして、電解液が充填された空間を、作用電極基板の上方から、製造例4で得られた対極基板で密封した。これにより、作用電極及び対極を電解液に接触させた。つぎに、作用電極基板及び対極からなる検出チップを電気化学計測装置に設置し、作用電極リード及び対極リードを電流計に接続した。
【0160】
作用電極基板側から対極基板に向けて、光源(波長781nm、出力13mWのレーザー光源)から励起光を照射した。光照射により、標識物質であるAlexaFluor750が励起され、電子を生じる。そして、生成した電子が作用電極に輸送されることにより、作用電極と対極との間に電流が流れる。そこで、この電流を測定した。
【0161】
なお、(1−1)において、被検物質の濃度が500pg/mLである被検物質溶液を用いる代わりに、被検物質の濃度が7.8pg/mL、15.6pg/mL、31.2pg/mL、62.5pg/mL、125pg/mL又は250pg/mLである被検物質溶液を用いたことを除き、上記と同様の操作を行なって電流を測定した。また、被検物質を用いなかったことを除き、上記と同様に操作を行ない、被検物質が存在しない場合の対照実験を行なった。
【0162】
実施例5において、被検物質(ヒトIL−6)の濃度と光電流との関係を調べた結果を図20に示す。
【0163】
図20に示された結果から被検物質の濃度が7.8pg/mL、15.6pg/mL、31.2pg/mL、62.5pg/mL、125pg/mL、250pg/mL及び500pg/mLである場合に検出される光電流は、それぞれ、0.089nA、0.092nA、0.095nA、0.11nA、0.14nA、0.21nA及び0.3nAであることがわかる。また、被検物質が存在しない場合に検出される光電流は、0.083nAであることがわかる。したがって、これらの結果から、被検物質の電気化学的検出方法で検出される光電流は被検物質の濃度に応じて増加しており、被検物質を定量的に検出することができることがわかる。
【0164】
以上の結果から、マウスIgG以外の被検物質に対しても、修飾物質間の相互作用を介してより多くの標識物質が結合物質に固定された多価標識結合物質を用いることにより、高感度で定量的に被検物質を検出することができることが示唆される。
【0165】
(製造例7)作用電極基板の作製
スパッタリング法により、二酸化ケイ素(SiO2)からなる基板本体上に、スズをドープした酸化インジウムの薄膜(厚さ200nm)からなる作用電極本体を形成した。上記した薄膜は、導電層と電子受容層とを兼ねている。つぎに、作用電極本体に、電流計と接続するための作用電極リードを接続した。
【0166】
つぎに、作用電極本体の表面を製造例1で得られた溶液Aを接触させて作用電極の本体表面にチオール基を付与した。
【0167】
また、捕捉物質である抗ヒトインターロイキン−6抗体〔バイオレジェンド社製〕、又は抗ヒトインターフェロン−γ抗体〔バイオレジェンド社製〕を、還元剤であるトリス(2−カルボキシエチル)ホスフィン塩酸塩(TCEP)固定ゲル〔ピアース社製、商品名:Immobilized TCEP Disulfide Reducing Gel〕と接触させて還元し、重鎖還元型抗ヒトインターロイキン−6抗体、又は抗ヒトインターフェロン−γ抗体を作製した。得られた抗ヒトインターロイキン−6抗体又は抗ヒトインターフェロン−γ抗体を、その濃度が10μg/mLとなるようにTBSに添加し、抗ヒトインターロイキン−6抗体溶液又は抗ヒトインターフェロン−γ抗体溶液を得た。
【0168】
作用電極上に、2つの開口部を有するシリコーンゴム(厚さ0.1mm)を隔壁となるように配置した。その後、作用電極本体とシリコーンゴムとに囲まれた空間の一方に抗ヒトインターロイキン−6抗体溶液を入れ、もう一方に抗ヒトインターフェロン−γ抗体を入れた。そして、作用電極本体を4℃で一晩インキュベーションし、抗ヒトインターロイキン−6抗体又は抗ヒトインターフェロン−γ抗体と、作用電極本体上のチオール基とを反応させジチオール結合を形成した。これにより、抗ヒトインターロイキン−6抗体及び抗ヒトインターフェロン−γ抗体を作用電極本体上に固定した。作用電極本体からシリコーンゴムを外した、その後、前述した2つの開口部に相当する範囲を含む大きさの開口部を1つ有するシリコーンゴム(厚さ0.1mm)を、隔壁となるように作用電極上に配置した。つぎに、作用電極本体上に、1mMトリエチレングリコール モノ−11−メルカプトウンデシルエーテル〔シグマ社製〕を滴下した。そして、作用電極本体を4℃で一晩インキュベーションして作用電極本体のブロッキングを行なった。これにより、作用電極基板を得た。
【0169】
(実施例6)
多価標識DNAによるインターロイキン−6(IL−6)ならびにインターフェロン−γの同時検出
(1−1)被検物質の捕捉
製造例7で得られた作用電極基板の周囲に厚さ0.2mmの側壁となるようにシリコーンゴムを配置した。つぎに、作用電極基板とシリコーンゴムとに囲まれた空間に、0.4質量%ブロックエース〔DSファーマバイオメディカル社製〕を含むTBS−Tを入れた。上記した空間内の液体の排出後、被検物質としてのヒトインターロイキン−6〔バイオレジェンド社製〕単独、被検物質としてのヒトインターフェロン−γ〔バイオレジェンド社製〕単独、又は、被検物質としてのヒトインターロイキン−6とヒトインターフェロン−γとの混合物を、25%質量ウシ血清〔サーモサイエンティフィック社製〕と0.75質量%BSAとを含むTBS−Tで希釈して得られた検出対象物溶液(検出対象物の濃度:250pg/mL)30μLを、上記した空間内に添加した。その後、作用電極基板を25℃で1時間インキュベーションし、捕捉物質〔抗ヒトインターロイキン−6抗体、抗ヒトインターフェロン−γ抗体〕に、被検物質〔インターロイキン−6、ヒトインターフェロン−γ〕を捕捉させた。
【0170】
(1−2)標識
(1−1)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、ビオチン標識抗ヒトインターロイキン−6抗体〔バイオレジェンド社製〕と抗ヒトインターフェロン−γ抗体〔バイオレジェンド社製〕とを、それぞれの濃度が1μg/mLとなるように1質量%BSAを含むTBS−Tに添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で1時間インキュベーションした。これにより、第1結合体であるビオチン標識抗ヒトインターロイキン−6抗体及びビオチン標識抗ヒトインターフェロン−γ抗体を、捕捉物質に捕捉された被検物質に結合させた。なお、ビオチン標識抗ヒトインターロイキン−6抗体及びビオチン標識抗ヒトインターフェロン−γ抗体は、抗ヒトインターロイキン−6抗体及び抗ヒトインターフェロン−γ抗体それぞれをビオチンで標識したものである。
【0171】
つぎに、作用電極基板をTBS−Tで洗浄した。つぎに、第2結合体であるストレプトアビジン〔ベクター社製〕2mg/mLを、その濃度が4μg/mLとなるようにTBS−Tに添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、ストレプトアビジンを、作用電極上のビオチン標識抗ヒトインターロイキン−6抗体又は抗ヒトインターフェロン−γ抗体に結合させた。
【0172】
(1−3)色素標識
(1−1)を行なった後の作用電極基板をTBS−Tで洗浄した。つぎに、製造例5で得られたビオチン化DNA−AlexaFluor750標識DNA複合体を含有する溶液(複合体の濃度:93μg/mL)100μLに当該溶液の10倍容量のTBS−Tを添加した後、得られた混合物30μLを、上記した空間に入れた。その後、作用電極基板を25℃で30分間インキュベーションした。これにより、作用電極上に、検出対象物としての被検物質と第1結合体と第2結合体と標識体とを含む複合体を形成させた。第1結合体と第2結合体とからなる複合体は、実施例1で得られた標識結合物質中の結合物質に対応している。すなわち、作用電極上においては、被検物質に結合した結合物質に、修飾物質であるDNAを介して、標識物質であるAlexaFluor750が結合している。
【0173】
(2)光電流の測定
作用電極基板の周囲に、厚さ0.2mmの側壁となるようにシリコーンゴムを配置した。そして、作用電極基板とシリコーンゴムとに囲まれた空間に、製造例3で得られた電解液を充填した。そして、電解液が充填された空間を、作用電極基板の上方から、製造例4で得られた対極基板で密封した。これにより、作用電極及び対極を電解液に接触させた。つぎに、作用電極基板及び対極からなる検出チップを電気化学計測装置に設置し、作用電極リード及び対極リードを電流計に接続した。
【0174】
作用電極基板側から対極基板に向けて、光源(波長781nm、出力13mWのレーザー光源)から励起光を照射した。光照射により、標識物質であるAlexaFluor750が励起され、電子を生じる。そして、生成した電子が作用電極に輸送されることにより、作用電極と対極との間に電流が流れる。そこで、この電流を測定した。抗インターロイキン−6抗体固定部及び抗インターフェロン−γ抗体固定部の両方において電流の測定を行なった。なお、被検物質を用いなかったことを除き、上記と同様に操作を行ない、被検物質が存在しない場合の対照実験を行なった。
【0175】
実施例6において、検出対象物の種類と光電流との関係を調べた結果を図21に示す。
【0176】
図21に示された結果から、被検物質がインターロイキン−6である場合に検出される光電流は、抗インターロイキン−6抗体固定部で0.20nA及び抗インターフェロン−γ抗体固定部で0.08nAであるのに対して、被検物質非存在下で検出される光電流は、抗インターロイキン−6抗体固定部で0.06nA及び抗インターフェロン−γ抗体固定部で0.07nAであることがわかる。また、被検物質がインターフェロン−γである場合に検出される光電流は、抗インターロイキン−6抗体固定部で0.09nA及び抗インターフェロン−γ抗体固定部で0.14nAであることがわかる。これらの結果から、同一電極上において、固定された捕捉物質である抗体に特異的な被検物質の検出が可能であることが示唆される。
【0177】
一方、被検物質がインターロイキン−6とインターフェロン−γとの混合物である場合に検出される光電流は、抗インターロイキン−6抗体固定部で0.17nA及び抗インターフェロン−γ抗体固定部で0.10nAであることがわかる。これらの光電流は、被検物質非存在下での光電流よりも大きいが、被検物質がインターロイキン−6単独又はインターフェロン−γ単独である場合に検出される光電流よりも小さい。したがって、検出対象物が複数種類の被検物質の混合物である場合には、各被検物質の特異的検出は可能ではあるが、単独の被検物質を検出する場合と比べて、若干の検出感度低下が認められることがわかる。
【0178】
以上の結果から、被検物質を標識するために、修飾物質間の相互作用を介してより多くの標識物質が結合物質に固定された多価標識結合物質を用いることにより、同一電極上で多種類の被検物質を同時に検出することができることが示唆される。
【符号の説明】
【0179】
1 検出装置
11 チップ受入部
12 ディスプレイ
13 光源
14 電流計
15 電源
16 変換部
17 制御部
20 検出チップ
20a 空間
30 上基板
30a 基板本体
30b 試料注入口
40 下基板
40a 基板本体
50 間隔保持部材
60 作用電極
61 作用電極本体
66 対極
69 参照電極
71 電極リード
72 電極リード
73 電極リード
81 捕捉物質
90 結合物質
90 標識結合物質
90a 第1結合体
90b 第2結合体
90c 標識体
91 結合物質
91a 第1結合物質
91b 第2結合物質
92 修飾物質
93 標識物質
93 標識体
101 標識抗体
102 抗体
103 標識物質
121 標識抗体
130a ビオチン標識抗マウスIgG抗体
130b ストレプトアビジン
130c ビオチン化AlexaFluor750標識DNA
131a 抗マウスIgG抗体
131b ビオチン
132 DNA
133 標識物質(AlexaFluor750)
141 標識抗体
142 抗体
143 標識物質(AlexaFluor750)
151 ビオチン標識抗マウスIgG抗体
152 ビオチン
153 抗マウスIgG抗体
160 ストレプトアビジン
170 ビオチン化DNA−AlexaFluor750標識DNA複合体
171 AlexaFluor750標識DNA
171a DNA
171b AlexaFluor750
172 ビオチン化DNA
172a DNA
172b ビオチン
190 標識結合物質
190 結合物質
193 標識物質
S 被検物質
【配列表フリーテキスト】
【0180】
配列番号:1は、実施例1及び実施例2において、修飾物質として用いられたDNAの配列である。
配列番号:2は、ビオチン化DNAの配列である。
配列番号:3は、AlexaFluor750標識DNAの配列である。
【特許請求の範囲】
【請求項1】
被検物質を電解液中で電気化学的に検出する方法であって、
(1) 被検物質を含む試料を、この被検物質を捕捉する捕捉物質が作用電極本体上に固定された作用電極に接触させ、前記捕捉物質によって被検物質を作用電極上に捕捉する工程、
(2) 前記工程(1)で作用電極上に捕捉された被検物質と、当該被検物質に結合する結合物質に修飾物質を介して標識物質が保持された標識結合物質と、を含む複合体を作用電極上に形成させる工程、及び
(3) 前記工程(2)で得られた作用電極上に存在する標識物質を電気化学的に検出する工程
を含み、
前記修飾物質は、電解液と、捕捉物質が結合している部位以外の作用電極部位と、に対して相互作用を生じる物質である、
被検物質の電気化学的検出方法。
【請求項2】
前記電解液が、非プロトン性溶媒を含有し、かつ前記作用電極の表面及び前記修飾物質が親水性を示す請求項1に記載の方法。
【請求項3】
前記修飾物質が、DNAである請求項1又は2に記載の方法。
【請求項4】
前記電解液が、プロトン性溶媒を含有し、かつ前記作用電極の表面及び前記修飾物質が疎水性を示す請求項1に記載の方法。
【請求項5】
前記工程(2)において、前記工程(1)で作用電極上に捕捉された被検物質と、前記標識結合物質とを接触させることにより、前記複合体を作用電極上に形成させる請求項1〜4のいずれかに記載の方法。
【請求項6】
前記工程(2)において、前記被検物質に結合する第1結合物質を含む結合体と、前記工程(1)で作用電極上に捕捉された被検物質と、を接触させ、その後、被検物質に結合した前記結合体と、前記結合体に結合する第2結合物質に前記修飾物質を介して前記標識物質が結合した標識体と、を接触させることにより、前記複合体を作用電極上に形成させる請求項1に記載の方法。
【請求項7】
前記工程(2)の後、作用電極を洗浄し、被検物質に結合していない標識結合物質を除去する請求項1〜6のいずれかに記載の方法。
【請求項8】
前記標識物質が、電気化学的又は光化学的に活性な物質である請求項1〜7のいずれかに記載の方法。
【請求項9】
前記標識結合物質が、前記結合物質に、修飾物質を介して複数の標識物質が保持された多価標識結合物質である、請求項1〜8のいずれかに記載の方法。
【請求項10】
前記工程(3)で得られた検出結果に基づいて、前記被検物質を定量する、請求項9に記載の方法。
【請求項11】
前記被検物質は複数種類である、請求項9又は10のいずれかに記載の方法。
【請求項1】
被検物質を電解液中で電気化学的に検出する方法であって、
(1) 被検物質を含む試料を、この被検物質を捕捉する捕捉物質が作用電極本体上に固定された作用電極に接触させ、前記捕捉物質によって被検物質を作用電極上に捕捉する工程、
(2) 前記工程(1)で作用電極上に捕捉された被検物質と、当該被検物質に結合する結合物質に修飾物質を介して標識物質が保持された標識結合物質と、を含む複合体を作用電極上に形成させる工程、及び
(3) 前記工程(2)で得られた作用電極上に存在する標識物質を電気化学的に検出する工程
を含み、
前記修飾物質は、電解液と、捕捉物質が結合している部位以外の作用電極部位と、に対して相互作用を生じる物質である、
被検物質の電気化学的検出方法。
【請求項2】
前記電解液が、非プロトン性溶媒を含有し、かつ前記作用電極の表面及び前記修飾物質が親水性を示す請求項1に記載の方法。
【請求項3】
前記修飾物質が、DNAである請求項1又は2に記載の方法。
【請求項4】
前記電解液が、プロトン性溶媒を含有し、かつ前記作用電極の表面及び前記修飾物質が疎水性を示す請求項1に記載の方法。
【請求項5】
前記工程(2)において、前記工程(1)で作用電極上に捕捉された被検物質と、前記標識結合物質とを接触させることにより、前記複合体を作用電極上に形成させる請求項1〜4のいずれかに記載の方法。
【請求項6】
前記工程(2)において、前記被検物質に結合する第1結合物質を含む結合体と、前記工程(1)で作用電極上に捕捉された被検物質と、を接触させ、その後、被検物質に結合した前記結合体と、前記結合体に結合する第2結合物質に前記修飾物質を介して前記標識物質が結合した標識体と、を接触させることにより、前記複合体を作用電極上に形成させる請求項1に記載の方法。
【請求項7】
前記工程(2)の後、作用電極を洗浄し、被検物質に結合していない標識結合物質を除去する請求項1〜6のいずれかに記載の方法。
【請求項8】
前記標識物質が、電気化学的又は光化学的に活性な物質である請求項1〜7のいずれかに記載の方法。
【請求項9】
前記標識結合物質が、前記結合物質に、修飾物質を介して複数の標識物質が保持された多価標識結合物質である、請求項1〜8のいずれかに記載の方法。
【請求項10】
前記工程(3)で得られた検出結果に基づいて、前記被検物質を定量する、請求項9に記載の方法。
【請求項11】
前記被検物質は複数種類である、請求項9又は10のいずれかに記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【公開番号】特開2012−233878(P2012−233878A)
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願番号】特願2012−75914(P2012−75914)
【出願日】平成24年3月29日(2012.3.29)
【出願人】(390014960)シスメックス株式会社 (810)
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願日】平成24年3月29日(2012.3.29)
【出願人】(390014960)シスメックス株式会社 (810)
[ Back to top ]

