複数種の目的物質を同時に検出又は定量するための分析方法
【課題】 複数種の目的物質を同時に検出又は定量するために、プローブビーズからの信号光を局在化すること。
【解決手段】単一の容器内に収容された、複数種の目的物質を捕獲するための物質 捕獲物質 捕獲物質がそれぞれ固定された複数の担体が、液体に浸漬された状態で発光し、この発光を容器外部から測定することで、複数種の目的物質を同時に検出又は定量するための分析方法であって、前記複数担体からの発光信号の光学的交差を抑制するため、前記発光波長帯における前記液体の光線透過率が抑制又は調整されていることを特徴とする前記方法。前記方法に用いられる検査キット及び装置も提供される。
【解決手段】単一の容器内に収容された、複数種の目的物質を捕獲するための物質 捕獲物質 捕獲物質がそれぞれ固定された複数の担体が、液体に浸漬された状態で発光し、この発光を容器外部から測定することで、複数種の目的物質を同時に検出又は定量するための分析方法であって、前記複数担体からの発光信号の光学的交差を抑制するため、前記発光波長帯における前記液体の光線透過率が抑制又は調整されていることを特徴とする前記方法。前記方法に用いられる検査キット及び装置も提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、複数種の目的物質を同時に検出又は定量するための分析方法に関する。
【背景技術】
【0002】
複数の分析対象を同時に検出するための技術として、BIST(Beads array In Single Tip)が開発された(非特許文献1)。BISTとは、抗原や遺伝子などの測定対象物質と結合する抗体、抗原、あるいはDNA断片などの生体分子を固定化した直径1 mmのプローブビーズを円筒状のチップ(以下、「キャピラリー」と呼ぶ)部分に並べて封入したデバイスである。このBISTは、マグトレーション装置のノズルに嵌合できるので、核酸抽出と同じ自動化装置(例えば、Magtration(登録商標)System 6GC、Magtration(登録商標)System 12GC Plus(プレシジョン・システム・サイエンス社製) )を用いて、ハイブリダイゼーション反応又は抗原抗体反応及び洗浄操作ができる。発生するシグナルはスキャナー(例えば、BISTnner(プレシジョン・システム・サイエンス社製))で検出される。
【0003】
BISTの技術的な最大の特徴としては、キャピラリー中に異なる目的物質を捕獲するためのプローブビーズが複数配置され、多項目の同時検出が可能な点にある。甲状腺刺激ホルモン(TSH: thyroid stimulating hormone)や、これと同時に検査されることで臨床上の有用性の高いFT3(Free Triiodo thyronine)、FT4(Free thyroxine)の定量検査への応用においては、実用上要求される検出濃度域が広範囲に及ぶ(TSH:0.05- 50uIu/mL, FT3:0.5-20pg/mL,FT4:0.1-10ng/dL、ダイナミックレンジで103程度)。このため、多項目同時検査を実現するためには、各プローブビーズからの信号光(目的物質の濃度に比例して強度が増加する光)を局在化させ、他のプローブビーズからの信号光との干渉を抑制しなければならない。しかし、これまでのところ、信号光の局在化は十分とは言えなかった。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】遺伝子多型簡易測定法 シーエムシー出版刊「月刊バイオインダストリー2008年9月号」
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、複数種の目的物質を同時に検出又は定量するために、プローブビーズからの信号光を局在化することを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは、鋭意努力した結果、以下の対策を施すことで、信号光拡散が有意に改善されることを見出し、本発明を完成させるに至った。
【0007】
1.反応及び検出工程において、キャピラリーに対しプローブビーズを固定すること。
2.基質吸引時に低温を保つこと。
3.反応液自体の遮光性を高めること。
4.キャピラリーの透明度を高めること。
【0008】
本発明の要旨は以下の通りである。
(1)単一の容器内に収容された、複数種の目的物質を捕獲するための物質がそれぞれ固定された複数の担体が、液体に浸漬された状態で発光し、この発光を容器外部から測定することで、複数種の目的物質を同時に検出又は定量するための分析方法であって、前記複数担体からの発光信号の光学的交差を抑制するため、前記発光波長帯における前記液体の光線透過率が抑制又は調整されていることを特徴とする前記方法。
(2)発光が化学発光又は蛍光であり、発光の波長帯が340-900nmである(1)に記載の方法。
(3)光線吸収体の添加により、液体の光線透過率が抑制又は調整されている(1)又は(2)に記載の方法。
(4)光線吸収体が微粒子である(3)記載の方法。
(5)液体の光線透過率が、光路長1mm当たり80%以下であるように抑制又は調整されている(1)〜(4)のいずれかに記載の方法。
(6)容器と担体表面形状と容器外部に位置する測光部の相対的な位置関係により、測光部と複数の各担体間の光路長を幾何学的に規定することで、測光部に最近接の担体からの発光信号を選択的に受光する(1)〜(5)のいずれかに記載の方法。
(7)担体が球状である(1)〜(6)のいずれかに記載の方法。
(8)担体が1次元的又は2次元的に配置している(1)〜(7)のいずれかに記載の方法。
(9)容器の構成材料が、厚み1 mmのヘイズ値で20%以下である(1)〜(8)のいずれかに記載の方法。
(10)発光又は放射の波長帯における容器の屈折率が1.6以下である(1)〜(9)のいずれかに記載の方法。
(11)複数種の目的物質を捕獲するための物質がそれぞれ固定された複数の担体を含む(1)〜(10)のいずれかに記載の方法に用いるための検査キット。
(12)容器内に収容されている担体に目的物質を捕獲するための物質が固定され、前記物質が、外部から添加される液体中に含有される発光能を有する物質との反応を介して、前記発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する方法であって、前記液体を添加する際に、前記液体及び/又は容器の温度を調節することを含む前記方法。
(13)発光能を有する物質が、ルミノール、シュウ酸ジフェニル、ルテニウム錯体、塩化オキサリル、ルシフェリン、AMPPD、インドール、ポリフェノール、ジオキセタン、及びこれら物質の誘導体からなる群より選択される少なくとも1種の化合物である(12)記載の方法。
(14)液体及び/又は容器の温度を15℃以下に調節する(12)又は(13)に記載の方法。
(15)液体を添加する際に、担体が容器に対して固定されている(12)〜(14)のいずれかに記載の方法。
(16)発光又は放射の波長帯における液体の光線透過率を抑制又は調整する手段と、目的物質を発光又は放射現象により光学的に検出及び/又は定量する手段とを備えた、(1)〜(10)のいずれかに記載の方法に用いる装置。
(17)液体の温度を調節する手段、発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する手段とを備えた、(12)〜(15)のいずれかに記載の方法に用いる装置。
(18)さらに、容器の温度を調節する手段を備えた、(17)記載の装置。
(19)容器の温度を調節する手段、発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する手段とを備えた、(12)〜(15)のいずれかに記載の方法に用いる装置。
(20)さらに、液体の温度を調節する手段を備えた、(19)記載の装置。
【発明の効果】
【0009】
本発明により、複数種の目的物質を同時に検出又は定量する系において、目的物質を捕獲するための物質が固定されたプローブビーズからの信号光を局在化させ、他のプローブビーズからの信号光との干渉を抑制することができるようになった。
【図面の簡単な説明】
【0010】
【図1】ポリプロピレン製キャピラリーを用いて、室温中条件下で基質吸引後に転倒混和行った場合のBISTにおけるTSH測定の信号光分布。
【図2】円筒内部に球状の発光体を含んだポリプロピレン製及び、ポリカーボネート製BISTキャピラリーの信号光分布の比較。
【図3】ポリカーボネート製BISTキャピラリーの円筒内部に充填された液体の光線透過率の違いによる、信号光分布の変化。
【図4】ポリプロピレン製BISTキャピラリーの円筒内部に充填された液体の光線透過率の違いによる、信号光分布の変化。
【図5】基質吸引後の攪拌の程度の違いによる、BISTキャピラリーの信号光分布の変化。
【図6】室温条件下で基質を吸引した場合の、BISTキャピラリーの信号光分布。
【図7】基質吸引時の温度条件の違いによる、BISTキャピラリーの信号光分布。
【図8】基質吸引後の攪拌抑制による信号光の拡散と、光学的拡散の比較。
【図9】本発明の第1の実施の形態に係る検体検査装置の筐体の一部を除去して示す斜視図である。
【図10】図9の検体検査装置の一部部品を除去し検査カートリッジ容器を引き出した状態を示す斜視図である。
【図11】図9および図10に示す光測定部に内蔵された部品の拡大斜視図である。
【図12】図9および図10に示す検査カートリッジ容器の拡大斜視図である。
【図13】図12に示す検査カートリッジ容器に収容された各種チップを示す斜視図である。
【図14】図9および図10に示す検体検査装置の処理流れ図である。
【図15】本発明の第2の実施の形態に係る検体検査装置の主要部品を筐体から取り出して示す斜視図である。
【図16】本発明の第3の実施の形態に係る検体検査装置の主要部品を筐体から取り出して示す斜視図である。
【図17】図16に示す光測定部および温度制御器を一部切り欠いて示す拡大斜視図である。
【図18】本発明の第4の実施の形態に係る検体検査装置の主要部品を筐体から取り出して示す斜視図である。
【図19】図18に示す光測定部および温度制御器を一部切り欠いて示す拡大斜視図である。
【図20】図19に示す蓋を示す拡大斜視図である。
【図21】図20に示す蓋を一部切り欠いて示す斜視図である。
【図22】本発明の第5の実施の形態に係る検体検査装置の4つの検査カートリッジ容器を含む主要部品を筐体から取り出して示す模式図である。
【発明を実施するための形態】
【0011】
以下、本発明の実施の形態についてより詳細に説明する。
【0012】
本発明は、単一の容器内に収容された、複数種の目的物質を捕獲するための物質(以下、「捕獲物質」と記す)がそれぞれ固定された複数の担体が、液体に浸漬された状態で発光し、この発光を容器外部から測定することで、複数種の目的物質を同時に検出又は定量するための分析方法であって、前記複数担体からの発光信号の光学的交差を抑制するため、前記発光波長帯における前記液体の光線透過率が抑制又は調整されていることを特徴とする前記方法を提供する。
【0013】
容器は、発光を容器外部から測定可能であればいかなるものであってもよいが、透光性であるとよく、樹脂やガラスなどの光を透過する材質であることが好ましい。また、容器の形状は、特に限定されるものではないが、細管、ピペット状などの形状であるとよい。例えば、BISTの場合、容器は、内部に収容した液体の吸引吐出が可能な円筒状のチップである。
【0014】
本発明の方法において、容器の透明度を高めることで、信号光の拡散を低減させることができる。容器の厚み1 mmのヘイズ値は20%以下であるとよく、好ましくは、10%以下であり、より好ましくは、1%以下である。厚み1 mmのヘイズ値が20%以下である容器の材質としては、ポリプロピレン、ポリカーボーネート、ポリスチレン、ポリメチルメタクリレート、環状ポリオレフィン、ポリメチルペンテンなどを例示することができる。
ヘイズ値は、透明性の度合いを表す値であり、JIS K7136では、全光線透過率に対する拡散透過率の比として定義されている。
【0015】
また、発光又は放射の波長帯における容器の屈折率は、1.6以下であるとよく、好ましくは、1.55以下であり、より好ましくは、1.50以下である。屈折率が1.6以下の容器の材質としては、ポリプロピレン、ポリカーボーネート、ポリスチレン、ポリメチルメタクリレート、環状ポリオレフィン、ポリメチルペンテンなどを例示することができる。
【0016】
目的物質は、血液、血清、尿、リンパ液、口腔内粘膜、爪、喀痰などの生体試料、河川水、湖水、海水、土壌などの試料に含まれる分析対象となる物質でありうる。目的物質としては、核酸、タンパク質、抗原、抗体、酵素、糖などの生体物質、サルモネラ菌、大腸菌などの細菌類、コバルト、鉄、モリブデン、銅、亜鉛、ヒ素、カドミウム、バナジウムなどの金属などを例示することができる。
【0017】
目的物質は、測定可能な標識がなされてもよく、測定可能な標識としては、蛍光標識、化学発光標識、電気化学発光標識、酵素標識、放射性標識、磁気標識などを例示することができる。標識物質としては、Marine Blue、 Cascade Blue、 Cascade Yellow、Fluorescein、Rhodamine、Phycoerythrin、CyChrome、PerCP、Texas Red、Allophycocyanin、PharRed、Oregon Green-488、Cy系色素(例えば、Cy2, Cy3, Cy3.5, Cy5, Cy7など)、Alexa系色素(例えば、Alexa-488、Alexa-532、Alexa-546、Alexa-633、Alexa-680、Alexa-700、Alexa-750など)、BODIPY系色素(例えば、BODIPY FL, BODIPY TR-など)などの蛍光物質、ルミノール、アクリジン、アダマンチルジオキタセン、シュウ酸エステル、ロフィン、ルシゲニン、イゾルミノール誘導体などの化学発光物質、トリス−ビピリジン−(4-メチルスルホン)NHSエステルルテニウム(II)錯体、ジフェニルアントラセン、テトラフェニルアントラセンなどの電気化学発光物質、POD(Hydrogen peroxidase)、AP(alkaline phosphatase)、βガラクトシダーゼ、グルコースオキシダーゼ、グルコースオキシダーゼ、グルコース-6-燐酸脱水素酵素などの酵素などを例示することができる。この他にも、放射性同位元素(例えば、3H, 14C, 32P, 33P, 35S, 125Iなど)などの放射性物質などの標識物質を用いてもよい。
【0018】
目的物質は、直接的に標識されてもよいし、間接的に標識されてもよい。例えば、後述の実施例においては、サンドイッチELISA法が用いられている。具体的には、担体に固定された一次抗体に、抗原である目的物質が結合した後、二次抗体であるビオチン標識抗体が目的物質に結合する。さらにこの二次抗体に対して、化学発光を触媒するストレプトアビジン化されたHRPが結合し、目的物質を標識する。
【0019】
目的物質を捕獲するための物質は、目的物質と結合する物質であればよく、抗体、抗原、DNA断片、金属錯体、その他低分子化合物などを例示することができるが、これらに限定されるわけではない。
【0020】
担体は、不定形粒子、球(ビーズ)、糸(ストランド)、磁性ビーズなどのいかなる形状であってもよいが、球状であることが好ましい。担体が球(ビーズ)又は磁性ビーズの形状をとる場合には、球(ビーズ)又は磁性ビーズのそれぞれに異なる目的物質を捕獲するための物質が固定されているとよい。担体が糸の形状をとる場合には、糸の異なる位置のそれぞれに異なる目的物質を捕獲するための物質が固定されているとよい。BISTの場合、担体は球(ビーズ)の形状をとる。
【0021】
球(ビーズ)は、大きさは1mm程度で、プラスチックやセラミックなどの材質のものであるとよく、このような球(ビーズ)は、特開2000-346842号公報、特表平14-534657号公報などに記載されている。
【0022】
磁性ビーズは、大きさは数十μmで、プラスチックやセラミックなどに鉄粉等を混ぜ、磁気化したものであるとよい。このような磁性ビーズは、特開平8-62224号公報(特許第3115501号明細書)、国際公開WO96/29602パンフレット、国際公開WO97/44671パンフレットなどに記載されている。
【0023】
糸(ストランド)は、大きさは直径0.1mm程度で、樹脂系の材質のものであるとよく、このような糸は、特開2006-214759号公報、国際公開WO01/53831パンフレット、国際公開WO2003/7901パンフレットなどに記載されている。
【0024】
担体は、1次元的又は2次元的に配置しているとよい。担体が1次元的に配置しているとは、観測された発光信号がどの担体に由来するものかを特定するために必要な位置情報が1次元であるような状態を意味し、例えば、BISTにおいて、担体(ビーズ)は一次元的に配置していると言える。担体が2次元的に配置しているとは、観測された発光信号がどの担体に由来するものかを特定するために必要な位置情報が2次元であるのような状態を意味し、例えば、プレート上に担体が単層で敷き詰められた測定キットは、担体が2次元的に配置されたものといえる。
【0025】
目的物質を捕獲するための物質は、共有結合、化学吸着、物理吸着、電気的相互作用、疎水的相互作用、ファンデルワールス力、水素結合などにより、担体に固定されている。
【0026】
目的物質の分析は、目的物質を捕獲するための物質と目的物質とを液体に浸漬された状態で接触させ、その後生じる発光を測定することにより行うことができる。
【0027】
液体は、担体を浸漬可能で、発光を容器外部から測定可能とするものであればよく、水、有機溶媒、緩衝液などを例示することができるが、これらに限定されるわけではない。
【0028】
本発明の方法において、液体の光線透過率を抑制又は調整することで、信号光の拡散を低減させることができる。液体の光線透過率は、光路長1mm当たり80%以下であるように抑制又は調整されているとよい。好ましくは、光路長1mm当たり60〜80%であるように、より好ましくは、光路長1mm当たり50%以下であるように、液体の光線透過率は抑制又は調整される。
【0029】
発光は、化学発光、蛍光又は電気化学発光などでありうるが、化学発光又は蛍光であり、発光の波長帯が340-900nmであるとよい。発光は、蛍光計、分光光度計、シンチレーションカウンター、フォトダイオード、CCD、CMOS、光電子増倍管などの公知の技術を用いて、測定することができる。
【0030】
本発明の方法においては、複数種の目的物質が同時に検出又は定量される。複数種とは、少なくとも2種、例えば、2、3、4、5種又はそれ以上である。複数種の目的物質を捕獲するための物質がそれぞれ複数の担体に固定される。例えば、BISTの場合、全長50 mmのキャピラリーに、プローブビーズ(目的物質を捕獲するための物資が固定されたビーズ)及び遮光ビーズを併せて50個程度のビーズを配置できる。プローブビーズには、ブランクと内部標準を含めてもよい。ブランクとは、捕獲物質が固定されていない担体である。内部標準とは、検体には含有し得ず、分析前に添加される既知濃度の標準物質を捕獲する物質が固定されている担体である。
【0031】
複数種の目的物質を同時に検出又は定量するには、捕獲物質は他の捕獲物質の存在の有無に関わらず、特異的に目的物質を捕獲するため、異なる種類の捕獲物質が固定された複数種類の担体を、同一容器内に配置させ、液状の検体をこれらに接触させることで、複数種の目的物質を同時に検出できる。
【0032】
本明細書において、「複数担体からの発光信号の光学的交差」とは、複数の担体からの発光信号が同時に検出器で受光され、各担体からの発光信号を分離できない状態をいう。
【0033】
複数担体からの発光信号の光学的交差は、発光波長帯における液体の光線透過率を抑制又は調整することにより、抑制することができる。
【0034】
例えば、光線吸収体の添加により、液体の光線透過率を抑制又は調整することができる。光線吸収体としては、微粒子(例えば、カーボンブラック、無機又は、有機物からなる微粒子など)、無機又は有機物が溶解する染料などを例示することができるが、これらに限定されるわけではない。
【0035】
本発明の方法において、容器と担体表面形状と容器外部に位置する測光部の相対的な位置関係により、測光部と複数の各担体間の光路長を幾何学的に規定することで、測光部に最近接の担体からの発光信号を選択的に受光するとよい。BISTの例で具体的に説明すると、BISTチップでは、内径1.1〜1.2mmの円筒状キャピラリー内部に、直径1mm程の球状担体が1次元的に配置している。担体表面から発せられキャピラリー外部に到達する発光信号のうち、光線吸収帯を含む液体部分を通過する距離が最も短いのは、担体最外周(担体のキャピラリー内壁に最も近い)部分から、円筒内壁に対して垂直に発せられた光線である。同時に、発光信号の進行方向が、円筒内壁に対する垂直から離れるに従って、光線吸収帯を含む液体部分を通過する距離は増大する。従って、円筒外部より、担体からの発光信号を受光する場合、最近接の担体からの信号光を選択的に受光できる。
【0036】
本発明は、発光又は放射の波長帯における液体の光線透過率を抑制又は調整する手段と、目的物質を発光又は放射現象により光学的に検出及び/又は定量する手段とを備えた、複数種類の目的物質を同時に検出又は定量するための装置を提供する。本発明の装置は、単一の容器内に収容された、複数種の目的物質を捕獲するための物質(捕獲物質)がそれぞれ固定された複数の担体が、液体に浸漬された状態で発光し、この発光を容器外部から測定することで、複数種の目的物質を同時に検出又は定量するための分析方法であって、前記複数担体からの発光信号の光学的交差を抑制するため、前記発光波長帯における前記液体の光線透過率が抑制又は調整されていることを特徴とする前記方法に用いることができる。
【0037】
本装置は、検体や試薬の分注、混合等を行う機能、検体、試薬の温度調節を行う機能、信号光を検出する機能を有する。
【0038】
また、本発明は、単一の容器内に収容された、複数種の目的物質を捕獲するための物質 捕獲物質がそれぞれ固定された複数の担体を含む検査キットを提供する。このキットは、単一の容器内に収容された、複数種の目的物質を捕獲するための物質(捕獲物質)がそれぞれ固定された複数の担体が、液体に浸漬された状態で発光し、この発光を容器外部から測定することで、複数種の目的物質を同時に検出又は定量するための分析方法であって、前記複数担体からの発光信号の光学的交差を抑制するため、前記発光波長帯における前記液体の光線透過率が抑制又は調整されていることを特徴とする前記方法に用いることができる。容器、目的物質を捕獲するための物質及び担体については上述した。
【0039】
さらに、本発明は、容器内に収容されている担体に目的物質を捕獲するための物質が固定され、前記物質が、外部から添加される液体中に含有される発光能を有する物質との反応を介して、前記発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する方法であって、前記液体を添加する際に、前記液体及び/又は容器の温度を調節することを含む前記方法を提供する。この方法は、上述の発光波長域における液体の光線透過率を抑制又は調整する方法と組み合わせて用いるとよい。そうすることで、より効果的に信号光を局在化させることができる。容器、目的物質を捕獲するための物質及び担体については上述した。
【0040】
液体は上記の液体と同様であるが、液体は、発光能を有する物質を含有し、容器の外部から添加される。発光能を有する物質としては、ルミノール、シュウ酸ジフェニル、ルテニウム錯体、塩化オキサリル、ルシフェリン、AMPPD(3-(2’-スピロアダマンタン)-4-メトキシ-4- (3”-ホスホリルオキシ)フェニル-1,2-ジオキセタン・2ナトリウム塩)、インドール、ポリフェノール、ジオキセタン、及びこれら物質の誘導体などを例示することができるが、これらに限定されるわけではない。
【0041】
例えばルミノールは、鉄等の触媒作用によって、過酸化水素と反応し不安定な反応中間体を生成する。この反応中間体がフタル酸ジアニオンに変化する際、発光を伴う。BISTにおける目的物質の検出ではサンドイッチELISA法が用いられるが、二次抗体がヘムを含む西洋ワサビペルオキシダーゼにより標識されており、これによりルミノールの発光が触媒される。
【0042】
本発明の方法において、発光能を有する物質を含有する液体を添加する際に、その液体及び/又はその液体が添加される容器の温度を調節し、最適化することにより、信号光の拡散を低減させることができる。液体及び/又は容器の温度を低温に保つことで、信号光の拡散を小さくすることができる。液体及び/又は容器の温度は、15℃以下に調節するとよく、好ましくは10〜2℃、より好ましくは6〜4℃に調節する。液体及び/又は容器の温度は、ペルチェ素子、電熱線、液体窒素などにより調節することができる。
【0043】
本発明の方法において、発光能を有する物質を含有する液体を添加する際に、担体が容器に対して固定されているとよい。担体を容器に対して固定することで、信号光の拡散を小さくすることができる。担体を容器に対して固定する方法としては、担体間の距離を短くする方法、担体と担体の間の位置でかしめる方法、位置決め用のピンを使用する方法などを例示することができる。
【0044】
本発明は、液体の温度を調節する手段、発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する手段とを備えた、目的物質を検出又は定量するための装置を提供する。本発明の装置は、容器内に収容されている担体に目的物質を捕獲するための物質が固定され、前記物質が、外部から添加される液体中に含有される発光能を有する物質との反応を介して、前記発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する方法であって、前記液体を添加する際に、前記液体及び/又は容器の温度を調節することを含む前記方法に用いることができる。本発明の装置は、さらに、容器の温度を調節する手段を備えるとよい。
【0045】
さらにまた、本発明は、容器の温度を調節する手段、発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する手段とを備えた、目的物質を検出又は定量するための装置を提供する。本発明の装置は、容器内に収容されている担体に目的物質を捕獲するための物質が固定され、前記物質が、外部から添加される液体中に含有される発光能を有する物質との反応を介して、前記発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する方法であって、前記液体を添加する際に、前記液体及び/又は容器の温度を調節することを含む前記方法に用いることができる。本発明の装置は、さらに、液体の温度を調節する手段を備えるとよい。
【0046】
続いて、本発明の第1の実施の形態に係る検体検査装置10を図9乃至図14に基づいて説明する。
【0047】
該検体検査装置10は、例えば、長さ250〜400mm(X軸方向)、幅70〜100mm(Y軸方向)、高さ300〜500mm(Z軸方向)程度のブック状の筐体12で囲まれている。該筐体12内には、検体および該検体の検査に用いる1または2以上の試薬溶液等が収容されまたは収容可能な複数(この例では10個)のウェル22および検査用器具としての複数種類(この例では3種類)のチップが収容されたチップ収容部20が一列状に配列されて設けられかつ該検体を識別しまたは管理する検体情報および検査内容を示す検査情報が可視記録媒体としてのシール24上に表示され透光性の部材で形成された検査カートリッジ容器14と、該検査カートリッジ容器14に収容された検体と前記試薬とを反応させて所定の光学状態としての発光を得るための自動検査部(15,19)と、該自動検査部による検査の結果として生じた前記発光を測定する光測定部17と、前記検体情報および前記検査情報を含む前記検査カートリッジ容器14に表示された内容を撮影して画像データを得るデジタル・カメラ28と、前記検査カートリッジ容器14の前記シール24の空欄に検査結果を印字可能な熱転写プリンタ機構21と、前記自動検査部(15,19)、光測定部17、デジタル・カメラ28、および熱転写プリンタ機構21についての制御を行うためのCPU等の集積回路が設けられたボード52とを有する。
【0048】
前記検査カートリッジ容器14は、手動によって前記筐体12から該筐体12外に引き出し可能に設けられた該嵌装板16と連結する装填箱18に着脱可能に装填されている。
【0049】
前記自動検査部(15,19)、前記検査カートリッジ容器14、光測定部17が設けられた室と、前記ボード52とが設けられた室とは仕切り板51によって仕切られて、吸引吐出がされる液体の飛沫等による回路の破壊や汚染の防止を図っている。換気用ファン54が、該仕切り板51を貫通して設けられ、前記ボード52が設けられた室の筐体12を貫通するように別の換気用ファン56が設けられている。
【0050】
前記自動検査部(15,19)は、分注機のノズルヘッド15と、前記筐体12内に収納された前記検査カートリッジ容器14に対して前記ノズルヘッド15を移動可能とする移動機構19とを有する。
【0051】
前記分注機の前記ノズルヘッド15は、前記移動機構19により、筐体12内に収納された前記検査カートリッジ容器14に対してその長手方向に相当するX軸方向に移動可能なX軸移動体11と、該X軸移動体11に対して上下方向にガイド柱41に案内されて移動可能に設けられたZ軸移動体13とを有する。前記X軸移動体11には、前記Z軸移動体13に連結したナット部が螺合し、該Z軸移動体13を上下方向に移動させる後述するZ軸移動用ボール螺子43が回転可能に取り付けられるとともに、前記ガイド柱41および該ガイド柱41を介して取り付けられた支持プレート39が取り付けられている。
【0052】
該ノズルヘッド15には、前記Z軸移動体13に取り付けられ、気体の吸引吐出を行なうシリンダと側面から突出するようにして設けられたエアゴム管31を介して連通するノズル30と、前記シリンダ内のピストンを駆動するためのモータ40と、回転可能に取り付けられたボール螺子42とを有する。
【0053】
また、前記X軸移動体11に取り付けられた前記支持プレート39は、前記ボール螺子42を回転可能に支持するとともに、その下側で、該担体封入チップ26等のチップを前記ノズル30から脱着させるために該ノズル30の径よりも大きく前記チップの最も太い部分の外径よりも細いU字状の孔が形成されたチップ脱着板48を前後方向に移動可能に支持し、その支持プレート39の上側では、該チップ脱着板48を前後方向に駆動するモータ38が前記X軸移動体11に取り付けられている。
【0054】
前記デジタル・カメラ28は前記X軸移動体11にカメラ支持プレート29を介して取り付けられており、該筐体12に収納された前記検査カートリッジ容器14の前記シール24上の検体情報および検査情報の全体を撮影可能な位置に前記ノズルヘッド15を移動させて撮影することになる。
【0055】
該分注機のノズルヘッド15を前記筐体12内に収納された前記検査カートリッジ容器14に対して移動させる移動機構19は、前記ノズルヘッド15の前記X軸移動体11と係わり合って前記検査カートリッジ容器14の長手方向、すなわちX軸方向に沿って案内するレール44と、該ノズルヘッド15をX軸方向に沿って移動させるX軸移動用モータ58と、前記Z軸移動体13を上下方向すなわちZ軸方向に沿って案内する前記ガイド柱41と、前記Z軸移動用ボール螺子43と、Z軸移動用モータとを有する。なお、前記シリンダ、前記ボール螺子42および前記モータ40は吸引吐出機構に相当する。また、前記ガイド柱41、前記Z軸移動用ボール螺子43、Z軸移動用モータは移動機構19の内のZ軸移動機構に相当する。
【0056】
前記光測定部17は、チップ挿入部34と、受光した蛍光を所定の電気信号に変換する光電子増倍管等の1の光電素子を少なくとも有する光電部32とを有する。
【0057】
前記熱転写プリンタ機構21は、前記光測定部17と前記ボード52を介して接続し、該光測定部17の測定結果に応じた電気信号を受けて前記検査カートリッジ容器14の前記シール24に印字を行なうものである。該熱転写プリンタ機構21は、前記検査カートリッジ容器14を該筐体12内に挿入する際には、該検査カートリッジ容器14と接触しないように上方に位置し、該検査カートリッジ容器14を収納することによって、例えば、カム機構によって下降して該検査カートリッジ容器14の前記シール24上の所定の空欄部分に該熱転写プリンタ機構21の印字ヘッド21aが位置するように設けられるようにするのが好ましい。該印字ヘッド21aとしては、所定桁数のデジタル数字で形成し、印字ヘッド21aのデジタル数字の所定のセグメントを加熱することで、感熱媒体で形成された前記シール24に該当するデジタル数字を自動的に書き込むものである。
【0058】
図10は、前記検体検査装置10の前記検査カートリッジ容器14を前記筐体12から手動により引き出された状態を示すものである。なお、前記熱転写プリンタ機構21は説明の便宜上取り除かれている。
【0059】
前記検査カートリッジ容器14が装填される前記装填箱18は、その装填箱18の長手方向、すなわちX軸方向に沿って延びるガイド部材18aが前記筐体12内にX軸方向に沿って敷設されたガイドレール23に案内されて手動でX軸方向に移動可能に設けられ、これによって該検査カートリッジ容器14を該筐体12内に完全に収納することができる。
【0060】
なお、該ガイド部材18aおよび前記熱転写プリンタ機構21に前記カム機構を設けて該容器14の挿抜と該機構21の上下動を連動させるのが好ましい。
【0061】
また、前記ノズルヘッド15の前記ノズル30には、内部に複数の担体である粒子26cが収容された担体封入チップ26が着脱可能に装着されている。
【0062】
前記光測定部17は、さらに、半円状孔36aが縁に形成され前記光電部32に固定された測定用ブロック36と、該測定用ブロック36の下側でかつ前記チップ挿入部34の上方に長孔35aが縁に形成され電磁石によって該長孔35aの長軸方向(X軸方向)に沿って前後に進退可能に設けられた測定プレート35と、を有している。該測定プレート35の下方に設けられた前記チップ挿入部34は、前記半円状孔36aおよび長孔35aによって組み合わされた空隙部分を通って下降した前記担体封入チップ26の細径管26aがその四角孔34aを通って挿入可能となるように箱状に形成されている。前記測定プレート35および測定用ブロック36、および前記光電部32は、前記筐体12に対して測定時において固定されており、前記担体封入チップ26を前記筐体12に対して上昇または下降させることにより複数の粒子26cを走査して測定する。
【0063】
図11は、前記光測定部17に内蔵された光学系を示すものである。該光学系は、例えば化学発光を測定するのに適した装置であって、3組の光ファイバ37a,37b,37cと、該光ファイバの先端に設けられたレンズ等からなる受光端33a,33b,33cとが設けられている。前記受光端33a,33bは、前記測定プレート35の前記長孔35aの側壁に配置され、前記受光端33cは、前記測定用ブロック36の半円状孔36aの側壁に配置され、これらの前記受光端33a,33b,33cが、前記担体封入チップ26の細径管26aを3方向から放射状に囲むことになる。前記測定プレート35は、前記担体封入チップ26の挿入時には、前方向に電磁石による磁力を用いて移動させて長孔35aと半円状孔36aで形成される空隙部分の水平断面積を拡大し、測定時にあっては、前記測定プレート35を後方向に移動して長孔35aに挿入した前記担体封入チップ26に接近させて前記水平断面積を狭める。
【0064】
図12は前記検査カートリッジ容器14を拡大して示すものである。
【0065】
該検査カートリッジ容器14の基板14aには、チップ収容部20の開口部およびウェル22の開口部が設けられている。該各ウェル22の容量は、例えば、1ccから数cc程度、例えば2ccである。チップ収容部20には、この例では3本のチップ、この例では分注チップ25、担体封入チップ26、および穿孔用チップ27が、前記ノズル30の下降および挿入によって装着可能な状態に装着用の開口部を上にして、各々該当する深さの筒体20a,20b,20c内に収容されている。10個のウェル22には、検体、該検体の検査に用いる1または2以上の試薬溶液が収容され、該開口部は前記穿孔用チップ27で穿孔可能な1枚のフィルムで閉塞されている。なお、前記チップ収容部20の開口部については、人手によって剥離可能なシールで閉塞され、使用時において該シールを剥離して用いる。
【0066】
該検査カートリッジ容器14の前記基板14aの前記媒体取付け部としてのシール貼着領域14bには、前述したように検体情報(24a,24b)および検査内容を示す検査情報(24c,24d,24e)が可視的に表示されたシール24が着脱可能に貼られている。ここで、前記検体情報(24a,24b)には、例えば、患者名を手書きで記入して表示する欄24a、患者の識別番号を表示する欄24bが設けられ、検査情報(24c,24d,24e)には、例えば、検査項目を表示する欄24c、前記検査カートリッジ容器14に予め収容された1または2以上の各試薬の製造場所、製造時期、有効期限、製造試薬数、保管場所、品質等の管理情報を示すLOT番号を表示するLOT番号欄24d、および備考欄24eとして、例えば、前記光測定部17によって測定された検査結果を記入して表示する欄を設ける。前記検査項目としては、例えば、TSH(甲状腺刺激ホルモン)、体内炎症、アレルギー等の検査があり、図11に示すように、例えば、2次元コードで表示する。なお、符号24fは、該シール24を前記基板14aから剥離する場合の摘み部である。
【0067】
図13は、前記検査カートリッジ容器14のチップ収容部20に収容された3種類のチップ(25,26,27)を示す。
【0068】
図13(A)に示すように、分注チップ25は、液体の吸引により液体をチップ内に収容し前記ウェル22間を移動して収容した液体を吐出して該ウェル22間の液体の移送等に用いられる。該分注チップ25は、先端が前記ウェル22に挿入可能な太さを有する細径管25aと、前記細径管25aと連通し後端に前記ノズル30が装着可能な装着用開口部を有する太径管25bと、該太径管25bの後端部に軸方向に平行に設けられた複数の突条25dとを有する。
【0069】
図13(B)に示すように、前記担体封入チップ26は、複数個(この例では、43個)の担体としての粒子26cが、前記ウェル22に挿入可能な太さの前記細径管26a内に一列状に配列され、各粒子には、目的物質と結合可能な結合物質が固定されたものであり、該細径管26aを位置26d,26eにおいてかしめることで内部に封入されている。位置26dと26eの距離を短くすることで、粒子26cを担体封入チップ26に対して固定することができる。あるいはまた、複数の粒子26cの粒子と粒子の間の位置でかしめることで、粒子26cを担体封入チップ26に対して固定してもよい。該細径管26aは、空気のみを通すフィルタが設けられたフィルタ部26fを介して太径管26bと連通し、該太径管26bの開口部は前記ノズル30に装着可能に設けられている。太径管26bの周囲には、複数個の突条26gが軸方向に平行に設けられている。担体封入チップ26は光線透過率が70%以上であるとよい。また、担体封入チップ26の屈折率は、1.6以下であるとよい。担体封入チップ26の材質としては、ポリカーボーネート、ポリスチレン、ポリメチルメタクリレート、環状ポリオレフィン、ポリメチルペンテンであることが好ましい。
【0070】
図13(C)に示すように、穿孔用チップ27は、前記検査カートリッジ容器14の前記ウェル22の開口部を閉塞するフィルムを穿孔するために、鋭い先端部27aをもち、後端部27bにある開口部は前記ノズル30に装着可能であり、後端部27bの外周には、複数の突条27cが軸方向に平行に設けられている。なお、これらのチップは、細径管または先端部の長さは、例えば1cmから10cmであり、太径管の長さは例えば1cmから10cmであり、前記粒子の径は、例えば、0.1mmから3mmである。すると、前記細径管26aの内径は、この粒子を一列状に保持可能な大きさであって、例えば、約0.2mmから6mm程度の内径をもたせる。
【0071】
続いて、第1の実施の形態に係る検体検査装置10の動作について、図14に基づいて説明する。
【0072】
図14(A)に示すように、ステップS1で、該検体検査装置10の筐体12の嵌装板16を手で引き出す。図14(B)に示すように、ステップS2で前記装填箱18を筐体12の外部に展開する。図14(C)に示すように、ステップS3で検査対象となる検体および検査用の試薬、チップが予め収容された前記検査カートリッジ容器14を前記装填箱18内に装填する。その際、該検査カートリッジ容器14の前記シール24には、前記検体情報に属する患者の氏名が手書きで記入され、検査内容を示す検査情報が予め記載されている。図14(D)に示すように、ステップS4で、手で前記装填箱18および装填した前記検査カートリッジ容器14を前記筐体12内に挿入して収納する。
【0073】
図14(D)の状態で、以下に示す処理が行われる。
【0074】
ステップS5で、前記ノズルヘッド15は、前記検査カートリッジ容器14のチップ収容部20にまで移動し、前記ノズル30が穿孔用チップ27の真上にまで位置させる。前記ノズル30をZ軸方向に沿って下降させて、該ノズル30の先端を前記穿孔用チップ27の開口部に挿入させて押し込み装着させる。
【0075】
ステップS6で、該穿孔用チップ27が装着された該ノズル30は、該検査カートリッジ容器14の各ウェル22の真上に順次位置させた後、下降させることで、10個の各ウェル22を覆っていたフィルムを穿孔する。
【0076】
ステップS7で、全ウェル22の穿孔が終了すると、該ノズル30は、前記チップ収容部20の前記穿孔用チップ27が収容された位置にまで移動し、前記チップ脱着板48のU字状の溝を前記ノズル30に接近させた後、該ノズル30を上方向(Z軸方向)に沿って移動させることによって前記チップ収容部20の筒体20cの中に前記穿孔用チップ27を脱着させる。
【0077】
ステップS8で、前記ノズル30を前記チップ収容部20の分注チップ25(または担体封入チップ26)が収容されている位置の真上にまで移動し、前記ノズル30をZ軸方向に沿って下降させて、該ノズル30の先端を前記分注チップ25(または前記担体封入チップ26)の開口部に挿入させて押し込み装着させる。
【0078】
例えば、被験者のアレルギー検査を行なう場合についての前記検体検査装置10の処理について説明する。
【0079】
各種アレルゲン物質、例えば、スギ花粉、ブタクサ、卵白、大豆、ハウスダスト、ダニ、カビ等から得られた数種類のアレルゲン物質(抗体)を、前記担体封入チップ26の前記粒子26cに固定させる。各アレルゲン物質が固定された粒子26cは、固定されたアレルゲン物質の種類に応じた配列位置に予め封入しておく。また、いずれの種類のアレルゲン物質をも固定されていない粒子26cも前記担体封入チップ26内に前記アレルゲン物質が固定された各粒子26c間に配置させておく。
【0080】
また、前記検査カートリッジ容器14のウェル22aには、検体として被験者から採取した血清を収容し、ウェル22bには、標識酵素のペルオキシダーゼ溶液を収容し、ウェル22cには、化学発光の基質液としてルミノール/過酸化水素溶液を収容しておく。また、ウェル22dからウェル22iには、例えば、リン酸バッファ液またはトリスバッファ液等の洗浄液を収容しておく。ウェル22dからウェル22iまでのいずれか一つ又はそれ以上のウェルに、光線吸収体含有液を収容しておいてもよい。あるいは、光線吸収体を化学発光の基質液に添加してもよい。以上の各粒子26cの配置、試薬等の種類は検査情報として表示され、被験者の情報は検体情報として表示される。
【0081】
ステップS9において、前記分注チップ25をノズル30に装着し、装着した該分注チップ25を前記ウェル22bに位置させ、該ペルオキシダーゼ溶液を吸引し、移動して血清が収容されている前記ウェル22aに吐出して室温で一定時間維持する。これによって、前記血清中のヒトIgE抗体を前記ペルオキシダーゼで標識化する。
【0082】
ステップS10において、該分注チップ25を、前記検査カートリッジ容器14の前記チップ収容部20の前記分注チップ25が収容されていた位置にまで移動し、前記チップ脱着板48のU字状の溝を前記ノズル30に接近させた後、該ノズル30を上方向に沿って移動させることによって前記チップ収容部20の筒体20aに向けて前記分注チップ25を脱着させる。
【0083】
ステップS11において、前記ノズル30を、前記チップ収容部20の前記担体封入チップ26が収容されている位置の真上にまで移動し、前記ノズル30をZ軸方向に沿って下降させて、該ノズル30の先端を該担体封入チップ26の開口部に挿入させて押し込み装着させる。
【0084】
ステップS12において、該担体封入チップ26をウェル22dにまで移動し、前記洗浄液を、例えば100μリットルを吸引吐出することによって洗浄する。
【0085】
ステップS13において、該担体封入チップ26をウェル22eにまで移動し、該ウェル22eに収容された前記洗浄液を吸引吐出することでさらに洗浄する。
【0086】
ステップS14において、前記ノズル30に装着された担体封入チップ26をウェル22aの位置にまで移動し、該ウェル22aに収容された前記ペルオキシダーゼで標識化されたヒトIgE抗体を含有する血清を該担体封入チップ26の前記細径管26aを満たすように、太径管26bにまで吸引して前記粒子26cと接触させ、約30分間、血清中のヒトIgE抗体と前記アレルゲン物質とを反応させる。
【0087】
ステップS15において、該担体封入チップ26を、前記検査カートリッジ容器14のウェル22fにまで移動し、該ウェル22fに収容された前記洗浄液を例えば、約100μリットルを10回の吸引吐出を繰り返すことで洗浄し、さらに該担体封入チップ26を前記検査カートリッジ容器14のウェル22gにまで移動し、該ウェル22gにまで移送して、洗浄を繰り返す。
【0088】
ステップS16において、該担体封入チップ26を、前記検査カートリッジ容器14のウェル22cにまで移送して、前記基質液としてのルミナール/過酸化水素溶液を吸引して前記標識化物質である前記ペルオキシダーゼと反応を生じさせ、発光の生じた該担体封入チップ26を前記光測定部17の前記半円状孔36aの真上にまで位置させる。化学発光の基質液には光線吸収体を添加してもよい。あるいは、ウェル22dからウェル22iまでのいずれか一つ又はそれ以上のウェルに光線吸収体含有液を収容しておき、そのウェルにまで担体封入チップ26を移動し、そのウェルに収容された光線吸収体含有液を吸引してもよい。また、化学発光の基質液又はそれを収容するウェル22cは温度制御されるとよい。あるいは、担体封入チップ26を温度制御してもよい。温度制御は、後述する温度制御器によって行うことができる。
【0089】
ステップS17において、該担体封入チップ26の細径管26aを該半円状孔36aおよび長孔35aで形成される空隙部分内に挿入する。その際、前記測定プレート35を後方向に移動させて前記長孔35aをその軸方向に沿って移動させて接近させて、前記担体封入チップ26の前記細径管26aを下降させて、該細径管26aを前記チップ挿入部34内に収容させることで前記粒子26cを走査して各粒子26cごとにその発光状態を測定する。
【0090】
ステップS18において、各粒子26cごとにその発光の有無を測定する。各粒子26cはその配列順に、各々アレルギー物質が予め対応づけられており、前記標識化された抗体と結合したアレルゲン物質がその発光により特定されることになる。その測定結果は、前記ボード52の制御部によって解析され、その測定結果が前記熱転写プリンタ機構21に送られ、前記印字ヘッド21aによって前記シール24の備考欄にその測定結果が前記検査情報の1つとして印字され、数字によって表示されることになる。
【0091】
ステップS19において、前記デジタル・カメラ28は、前記ボード52からの指示信号によって、前記検査カートリッジ容器14のシール24上の検体情報および検査情報を含めて画像データとして撮影する。その際、前記制御部の解析部は、該画像データから解析可能なデータを探し、該画像データ中に、前記検査情報に含まれる前記検査内容を示す2次元バーコードデータを探し出すと、該2次元バーコードデータを解析し、解析データを得るとともに、前記制御部の前記データ組合せ部は、前記解析データと前記画像データと組み合わせて出力可能なものとしてメモリに格納する。
【0092】
ステップS20において、前記ノズル30に装着された前記担体封入チップ26は、前記チップ収容部20にまで移動し、該担体封入チップ26が収容されていた位置の真上にまで、該担体封入チップ26を移動し、前記チップ脱着板48のU字状の溝を前記ノズル30に接近させた後、該ノズル30を上方向に移動させることによって前記チップ収容部20の筒体20bの中に該担体封入チップ26を脱着させる。
【0093】
ステップS21で、前記検体検査が完了すると、前記検査カートリッジ容器14を装填した装填箱18が前記筐体12から手動で引き出されて、該検査カートリッジ容器14に貼着された前記シール24を剥がして、別に用意した管理用の台紙等にはりつけて保存し、該検査カートリッジ容器14自体は、廃棄されるが、該筐体12にさらに新たな検査カートリッジ容器14を装填することで新たな検体の検査を行なうことができる。
【0094】
続いて、食品のアレルゲン物質の有無の検査を行なう場合について前記検体検査装置10による処理を説明する。
【0095】
例えば、日本で食品における表示義務となっている材料の7項目、卵、乳、小麦、そば、落花生、えび、かに、さらには、例えば、表示推奨項目となっている18項(桃、豚肉、鶏肉、牛肉等)等から得られたアレルゲン物質(抗体)の中から選択されたアレルゲン物質を、前記担体封入チップ26の前記粒子26cに固定させる。各アレルゲン物質が固定された粒子26cには、固定されたアレルゲン物質の種類に応じた配置にブロッキングを施した後に予め封入しておく。また、いずれの種類のアレルゲン物質をも固定されていない粒子26cも前記担体封入チップ26内に前記アレルゲン物質が固定された各粒子26c間に配置させておく。
【0096】
また、前記検査カートリッジ容器14のウェル22aには、検体として、食品から抽出した抽出液(抗原)を収容し、ウェル22bには、化学発光物質HRP酵素により標識化された各種の標識抗体の溶液を収容しておく。ウェル22cには、化学発光の基質液としてのTMBを収容しておく。ウェル22dからウェル22jには洗浄液またはバッファ液を収容しておく。ウェル22dからウェル22iまでのいずれか一つ又はそれ以上のウェルに、光線吸収体含有液を収容しておいてもよい。あるいは、光線吸収体を化学発光の基質液に添加してもよい。これらの粒子26cの配置および試薬の種類等は検査情報として表示され、被験者の情報は検体情報として手書き等で表示される。
【0097】
ステップS9'において、前記ノズル30を、前記チップ収容部20の前記担体封入チップ26が収容されている位置の真上にまで移動し、前記ノズル30をZ軸方向に沿って下降させて、該ノズル30の先端を該担体封入チップ26の開口部に挿入させて押し込み装着させる。
【0098】
ステップS10'において、前記担体封入チップ26をウェル22dにまで移動し、前記洗浄液を、例えば100μリットル吸引吐出することで洗浄する。
【0099】
ステップS11'において、前記担体封入チップ26をウェル22aにまで移動し、検体としての食品抽出液の20μリットルについて、該担体封入チップ26に対して吸引吐出を行なって前記粒子と接触させる。
【0100】
ステップS12'において、該担体封入チップ26を前記ウェル22eにまで移動し、前記バッファ液を80μリットルについて吸引吐出を300回繰り返すことで、30分間室温でインキュベーションを行なう。その際、必要がある場合には、後述する温度制御器によって温度制御されたバッファ液を用いることが好ましい。
【0101】
ステップS13'において、該担体封入チップ26を前記ウェル22fにまで移動し、前記洗浄液を100μリットルを吸引吐出することで洗浄し、同様にして洗浄液が収容されているウェル22g、22hに前記担体封入チップ26を移動して100μリットル吸引吐出することで全部で3回洗浄を行なう。
【0102】
ステップS14'において、洗浄した前記担体封入チップ26をウェル22bにまで移動して、該ウェル22bに収容された標識抗体を100μリットルについて吸引吐出を300回繰り返すことで30分間インキュベーションを行なう。
【0103】
ステップS15'において、該担体封入チップ26をウェル22iにまで移動し、洗浄液を100μリットルを吸引吐出することにより洗浄し、同様にして該担体封入チップ26をウェル22jにまで移動し洗浄液を100μリットルを吸引吐出することにより洗浄し、洗浄した担体封入チップ26をウェル22cにまで移動し、基質液を60μリットル吸引吐出して化学発光を行なわせる。化学発光の基質液には光線吸収体を添加してもよい。あるいは、ウェル22dからウェル22iまでのいずれか一つ又はそれ以上のウェルに光線吸収体含有液を収容しておき、そのウェルにまで担体封入チップ26を移動し、そのウェルに収容された光線吸収体含有液を吸引してもよい。また、化学発光の基質液又はそれを収容するウェル22cは温度制御されるとよい。あるいは、担体封入チップ26を温度制御してもよい。温度制御は、後述する温度制御器によって行うことができる。
【0104】
以下の処理は、前述したステップS17からステップS21と同様なので説明を省略する。
【0105】
続いて、第2の実施の形態に係る検体検査装置70を図15に示す。
【0106】
該検体検査装置70は、第1の実施の形態に係る検体検査装置10で用いた前記光測定部17の代わりに、光測定部77を用いる点で異なっている。
【0107】
該光測定部77は、少なくとも1の前記光電素子が設けられた前記光電部32と、前記担体封入チップ26の細径管26aが挿入可能な孔76を有し、該孔76を通って挿入された前記担体封入チップ26の細径管26aを囲むように設けられた前記光電部32と接続された光ファイバ37a,37b,37cの各受光端33a,33b,33cが前記孔76を通って挿入された前記細径管26aの軸方向に沿って移動可能に設けられた走査測定部74とを有するものである。すなわち、測定時において、前記各受光端33a,33b,33cが前記筐体12に対して固定されているのではなく相対的に移動可能である点において、第1の実施の形態に係る光測定部17とは異なるものである。
【0108】
図16は、第3の実施の形態に係る検体検査装置80を示すものである。
【0109】
該検体検査装置80は、第1および第2の実施の形態に係る検体検査装置10,70とは、主として、分注チップ25の細径管25aに対して磁力を及ぼしかつ除去することが可能となるように該細径管25に対して接離可能に設けた磁石106を有する磁力手段79、検査カートリッジ容器84に設けられた後述するウェル96についての温度制御を行う温度制御器82、および、該ウェル96を蓋92で閉塞するための蓋移動機構86を設けた点において相違する。
【0110】
該検体検査装置80は、第1および第2の実施の形態に係る検体検査装置10,70と同様に、前記筐体12に組み込まれている。該筐体12内には、複数種類の(この例では、容量の異なる2種類の分注チップ25,125と穿孔用チップ27の3種類)のチップが収容されたチップ収容部20、検体および検体の検査に用いる1または2以上の試薬溶液が収容されまたは収容可能な複数(この例では10個)のウェル22、およびウェル22と離れて設けられ温度制御が行われるウェル96が一列状に配列して設けられかつ前記検体を識別しまたは管理する検体情報および検査内容を示す検査情報が可視記録媒体としてのシール94上に表示され透光性の部材で形成された検査カートリッジ容器84と、該検査カートリッジ容器84に収容された検体と前記試薬とを反応させて所定の発光を得るための自動検査部(85,19)と、該自動検査部による検査の結果として生じた発光を測定する光測定部177と、前記検体情報および前記検査情報を含む前記検査カートリッジ容器84に表示された内容を撮影して画像データを得るデジタル・カメラ28と、前記検査カートリッジ容器84の前記シール94の空欄に検査結果を印字可能な書き込み機構としての熱転写プリンタ21(図9参照)と、前記磁力手段79と、前記温度制御器82と、前記蓋移動機構86と、前記自動検査部(85,19)、光測定部177、デジタル・カメラ28、熱転写プリンタ機構21、磁力手段79、温度制御器82、および蓋移動機構86についての制御を行うためのCPU等の集積回路が設けられたボード52と、を有する。
【0111】
前記検査カートリッジ容器84は、図9、図10に示すように、手動によって前記筐体12から該筐体12外に引出し可能に設けられている。なお、前記検査カートリッジ容器84の温度制御を行うウェル96の容量は、例えば0.2ccである。
【0112】
前記自動検査部(85,19)は、分注機のノズルヘッド85と、前記筐体12内に収納された前記検査カートリッジ容器84に対して、前記ノズルヘッド85を移動可能とする移動機構119とを有する。
【0113】
前記分注機の前記ノズルヘッド85は、前記移動機構119により、筐体12内に収納された前記検査カ−トリッジ容器84に対してその長手方向に相当するX軸方向に移動可能なX軸移動体81と、該X軸移動体81に対して上下方向にガイド柱111に案内されて移動可能に設けられたZ軸移動体83とを有する。前記X軸移動体81には、前記Z軸移動体83に連結したナット部が螺合し、該Z軸移動体83を上下方向に移動させる後述するZ軸移動用ボール螺子113が回転可能に取り付けられるとともに、前記ガイド柱111および該ガイド柱111を介して取り付けられた支持プレート89が取り付けられている。
【0114】
該ノズルヘッド85には、前記Z軸移動体83に取り付けられ、気体の吸引吐出を行なうシリンダと側面に設けられたエアゴム管101を介して連通するノズル100と、前記シリンダ内のピストンを駆動するためのモータ110と、回転可能に取り付けられたボール螺子112とを有する。
【0115】
また、前記X軸移動体81に取り付けられた前記支持プレート89は、前記ボール螺子113を回転可能に支持するとともに、その下側で、前記分注チップ25等のチップを前記ノズル100から脱着させるために該ノズル100の径よりも大きく前記チップの最も太い部分の外径よりも細いU字状の孔が形成されたチップ脱着板118と、前記ノズル100に装着された分注チップ25の細径管25aに対して接離可能に設けられ、該細径管25a内にその外部から磁力を及ぼしかつ除去することが可能な磁石106とを各々前後方向に移動可能に支持し、その支持プレート89の上側では、該チップ脱着板118を駆動するモータ108と、該磁石106を駆動するモータ109とが前記X軸移動体81に取り付けられている。該磁石106およびモータ109は磁力手段79に相当する。
【0116】
デジタル・カメラ28は、前記X軸移動体81にカメラ支持プレート99を介して取り付けられており、筐体12に収納された前記検査カートリッジ容器84の前記シール94上の検体情報および検査情報の全体を撮影可能な位置に前記ノズルヘッド85を移動させて撮影することになる。
【0117】
前記分注機のノズルヘッド85を前記筐体12内に収納された前記検査カートリッジ容器84に対して移動させる移動機構119は、前記ノズルヘッド85の前記X軸移動体81と係わりあって前記検査カートリッジ容器84の長手方向、すなわちX軸方向に沿って案内するレール44と、該ノズルヘッド85をX軸方向に沿って移動させるX軸移動用モータ58(図9参照)と、前記X軸移動体83を上下方向すなわちZ軸方向に沿って案内する前記ガイド柱111と、前記Z軸移動用ボール螺子113と、Z軸移動用モータとを有する。なお、前記ボール螺子112および前記モータ110は吸引吐出機構に相当する。また、前記ガイド柱111、前記Z軸移動用ボール螺子113、Z軸移動用モータは移動機構の内のZ軸移動機構に相当する。
【0118】
なお、本実施の形態に係る検体検査装置80には、書込み機構としての熱転写プリンタ機構21をも有する。該熱転写プリンタ機構21については前述した通りである。
【0119】
前記蓋移動機構86は、前記ウェル96の開口部を覆うための蓋92と、該蓋92を一端に有し他端が回転軸に軸支され該回転軸によって90度回転可能に設けられたアーム93と、前記回転軸を駆動するモータが設けられた回転駆動部95とを有する。
【0120】
また、該検体検査装置80は、さらに前記検査カートリッジ容器84のウェル96の開口部を閉塞した前記蓋92を、前記Z軸移動機構を含む移動機構119によってZ軸方向、X軸方向、Y軸方向に沿って押圧、振盪または移動可能なノズル100を用いて、該蓋92の押圧、振動または移動を可能とする。すなわち、前記Z軸移動機構を含む移動機構119によって駆動される前記ノズル100は蓋閉塞時作用機構に相当する。その際、前記蓋92は、前記回転軸に対してZ軸方向に弾性力で付勢して支持されるようにするのが好ましい。
【0121】
図17に示すように、前記温度制御器82は、前記ウェル収容孔として前記検査カートリッジ容器84の前記ウェル96と嵌合する形状および大きさの先細りの嵌合孔が中央に穿設された温度制御ブロック98と、前記温度制御ブロック98と接触して設けられた前記加熱冷却部としてのペルチェ素子が設けられたペルチェ素子部97と、該ペルチェ素子部97の下側に設けられたフィン103と、該フィン103の下側に設けられたファン収容枠体102とを有し、前記嵌合孔の底から前記ペルチェ素子部97を通りフィン103を通って延びる照射用光ファイバ74aおよび6本の受光用光ファイバ74bと、該照射用光ファイバ74aの一端は、励起光用光源75bと接続し、前記受光用光ファイバ74bの一端は、光電子増倍管72bと接続し、これらの光ファイバ74a,74bの他端74cは、前記照射用光ファイバを中心にして束ねられて前記ウェル収容孔としての前記嵌合孔の底にその先端が位置するように設けられている。
【0122】
ここで、前記光ファイバ74a,74bは前記光測定部177のファイバ収容部174を通り、光電・光源部72に内蔵されている前記励起光用光源72aおよび前記光電子増倍管72bと接続している。
【0123】
続いて、第3の実施の形態に係る検体検査装置80の動作について説明する。
ステップS31からステップS38においては、ノズルヘッド15の代わりにノズルヘッド85を用いる点、ノズル30の代わりにノズル100を用いる点、検査カートリッジ容器14の代わりに検査カートリッジ容器84を用いる点を除いて、ステップS1からステップS8で説明した通りである。
【0124】
図14(D)の状態で、以下に示す処理が行われる。
ここでは、第1の実施の形態で説明したアレルギー検査を行なう代わりに、DNAまたはゲノムを、温度制御してPCR処理を行なう場合の動作を説明する。
【0125】
前記検査カートリッジ容器84のウェル22aには、例えば、被験者から採取した口腔粘膜等の検体が収容されている。ウェル22bには、ゲノム抽出用試薬が収容されている。
ウェル22cには磁性粒子懸濁液が収容されている。ウェル22dには、乖離液が収容されている。ウェル22eは空である。ウェル22fからウェル22iには、PCR用試薬としてプライマー含有液等および洗浄液が収容されている。ウェル22jにはミネラルオイルが収容されている。また、チップ収容部20には、2種類の分注チップ25、125、および穿孔用チップ27が収容されている。ウェル22fからウェル22iまでのいずれか一つ又はそれ以上のウェルに、光線吸収体含有液を収容しておいてもよい。あるいは、光線吸収体をプライマー含有液に添加してもよい。
【0126】
ステップS39において、前記ノズル100を前記チップ収容部20の端に収容されている分注チップ25の位置にまで移動し、下降させることで該ノズル100にゲノム抽出用として装着させ、該分注チップ25を前記移動機構119によってウェル22bにまで移動し、吸引吐出機構を用いて該当する抽出用試薬を吸引する。該分注チップ25を前記検体が収容されているウェル22aにまで移動して、該分注チップ25に吸引した該液体を該ウェル22a内に吐出する。また、該分注チップ25をウェル22cにまで移動して、磁性粒子懸濁液を吸引して該分注チップ25を前記ウェル22aにまで移動して吐出し、その他抽出に必要な試薬があればそれらを該分注チップ25を用いて前記ウェル22aにまで移送して吐出する。ウェル22aに収容されたこれらの混合液は吸引および吐出を繰り返すことによって攪拌かつインキュベートして反応させ、抽出されたDNAを前記磁性粒子の表面に結合して捕獲する。
【0127】
ステップS40において、前記磁力手段79を用いて、前記磁石106を、該分注チップ25の細径管25aに接近することによって磁場を内部に及ぼして前記磁性粒子を前記細径管25aの内壁に吸着させることによってDNAを分離する。
【0128】
ステップS41で、ゲノム抽出用の該分注チップ25を、前記DNAを捕獲した磁性粒子を該内壁に吸着させたまま前記移動機構119によって移動させて、前記乖離液を収容するウェル22dに位置させ、該分注チップ25の先端口部を該ウェル22d内に挿入し、前記磁性粒子を内壁に吸着したまま吸引吐出を繰り返すことによって前記磁性粒子から前記DNAを乖離する。磁性粒子から乖離したDNAを含有する該DNA溶液を空の前記ウェル22e内に吐出させて収容した後、該ゲノム抽出用の分注チップ25を内壁に前記磁性粒子を吸着したまま前記チップ収容部20の元の収容位置にまで移送して前記チップ脱着板118を用いて脱着する。
【0129】
ステップS42で、該ノズルヘッド85を移動させて、該ノズルヘッド85の前記ノズル100を前記チップ収容部20の真ん中の位置に収容されている新たなPCR用の分注チップ125にまで移動させた後、該ノズル100をZ軸移動機構によって、下降させることによって、収容されたPCR用の分注チップ125の装着用開口部に前記ノズル100を挿入させて装着させる。
【0130】
ステップS43において、該ノズルヘッド85を移動させて、図17に示すように、前記アーム93を90度回転することによって、前記蓋92をウェル96の開口部を開いてから前記ウェル96の開口部を外部に露出させる。次に、PCR用の分注チップ125を用いて、ウェル22fからウェル22iまでに収容されているPCR用の試薬、例えば、蛍光物質で標識化されたプライマー含有液を吸引して、前記ウェル96内に分注することで収容する。以上の工程を必要な試薬を分注し終わるまで繰り返す。
【0131】
ステップS44において、前記分注チップ125を洗浄した後、前記ノズルヘッド85を移動して、前記ウェル22eに収容されている抽出されたDNA液を吸引して前記ウェル96内に分注する。その後、該分注チップ125を用いて前記ウェル22jにまで移動し、前記ミネラルオイルを吸引し、前記ウェル96内に吐出することで導入する。
【0132】
ステップS45において、前記蓋92を90度回転させて前記ウェル96の開口部を覆う。
【0133】
ステップS46において、前記ノズル100を下降させてZ軸移動機構を用いて前記蓋92を押圧する。
【0134】
ステップS47において、前記ウェル96に対して前記温度制御器82によって、PCR法に従った温度制御を行なう。PCR法に従った温度制御は、投入された2本鎖の検体のDNAを、一本鎖に変性するために前記ウェル96の温度を94℃に設定し、次に、一本鎖のDNAとプライマーとのアニーリングまたはハイブリダイゼイションを行わしめるために、前記ウェル96の温度を50℃から60℃に設定する。次に、前記一本鎖に相補的なDNA鎖を合成するために前記温度を74℃に設定してインキュベートするという操作を1サイクルとして、所定回繰り返して、例えば、約数分間行なうという温度制御を行う。プライマー含有液には光線吸収体を添加してもよい。あるいは、ウェル22fからウェル22iまでのいずれか一つ又はそれ以上のウェルに光線吸収体含有液を収容しておき、そのウェルにまで担体封入チップ125を移動し、そのウェルに収容された光線吸収体含有液を吸引してもよい。
【0135】
その際、前記温度制御ブロック98の前記ウェル収容孔としての嵌合孔に設けた光ファイバ74a,74bを用いて励起光を照射し、発生する蛍光強度を光ファイバ74bを介して受光し、光電子増倍管72bにより電気信号に変えられてその蛍光強度が測定されることになる。
【0136】
ステップS48において、その測定結果は、前記ボード52の制御部によって解析され、その測定結果が前記熱転写プリンタ機構21に送られ、前記印字ヘッド21aによって前記シール24の備考欄にその測定結果が前記検査情報の1つとして印字され、数字によって表示されることになる。
【0137】
ステップS49において、前記デジタル・カメラ28は、前記ボード52からの指示信号によって、前記検査カートリッジ容器84のシール94上の検体情報および検査情報を含めて画像データとして撮影する。その際、前記制御部の解析部は、該画像データから解析可能なデータを探し、該画像データ中に、前記検査情報に含まれる前記検査内容を示す2次元バーコードデータを探し出すと、該2次元バーコードデータを解析し、解析データを得るとともに、前記制御部の前記データ組合せ部は、該解析データと前記画像データと組み合わせて出力可能なものとしてメモリに格納する。
【0138】
ステップS50において、前記ノズル100に装着された前記分注チップ125は、前記チップ収容部20にまで移動し、該分注チップ125が収容されていた位置の真上にまで、該分注チップ125を移動し、前記チップ脱着板118のU字状の溝を前記ノズル100に接近させた後、該ノズル100を上方向に移動させることによって前記チップ収容部20の筒体20bの中に該分注チップ125を脱着させる。
【0139】
ステップS51で、前記検体検査が完了すると、前記検査カートリッジ容器84を装填した装填箱18が前記筐体12から手動で引き出されて、該検査カートリッジ容器84に貼着された前記シール94を剥がして、別に用意した管理用の台紙等にはりつけて保存し、該検査カートリッジ容器84自体は、廃棄されるが、該筐体12にさらに新たな検査カートリッジ容器84を装填することで新たな検体の検査を行なうことができる。本実施の形態によれば、蓋92を前記移動機構を用いて押圧等を行なうことができるので、前記ウェル96の開口部の閉塞を確実にし、かつ、結露を防止して蓋92の開放を容易に行なうことができる。
【0140】
図18、図19は、第4の実施の形態に係る検体検査装置180を示すものである。
なお、図16に示す検体検査装置80と同一のものについては、同一の符号を付してまたは付さずに説明を省略する。
【0141】
本検体検査装置180は、図16に示す第3の実施の形態に係る検体検査装置80とは、ノズルヘッド185には、気体の吸引吐出を行なうシリンダとエアゴム管201を介して連通する分注チップ25等が装着可能なノズル200と、Z軸方向に移動可能なZ軸移動体83と連動し、前記該ノズル200が取り付けられたノズル支持体183と、該ノズル支持体183に取り付けられ検査カートリッジ容器184の前記ウェル96の開口部を覆う透光性のある蓋192の上方から光の測定を行なうため内部に受光用光ファイバ174aの端部および照射用光ファイバ174bの端部が設けられた測定用ロッド172(図19参照)とを有する点で相違する。
【0142】
本検体検査装置180は、その他、第3の実施の形態に係る検体検査装置80と相違し、蓋移動機構86を有しない代わりに、蓋192は、検査カートリッジ容器184のチップ収容部120に、前記担体封入チップ26の代わりに予め収容され、前記ノズル200の先端または前記測定用ロッド172の先端に、前記Z軸移動機構により前記ノズル200および前記測定用ロッド172を下降させることによって装着させて、押圧等の際または測定の際に用いるものである。したがって、検査カートリッジ容器184についても、蓋192をチップ収容部120に収容可能とする点で相違する。
【0143】
また、図19に示すように、光測定部277と、温度制御器182についても、第3の実施の形態に係る光測定部177および温度制御器82とは相違する。
該光測定部277は、前記測定用ロッド172内に前記受光用光ファイバ174aの端部および照射用光ファイバ174bの端部が設けられるとともに、該受光用光ファイバ174aの他方の端部は、光電素子172aと接続し、前記照射用光ファイバ174bの他方の端部は、光源部172bと接続する。
【0144】
また、前記温度制御器182は、ウェル収容孔として前記検査カートリッジ容器184の前記ウェル96と嵌合する形状および大きさの先細りの嵌合孔が中央に穿設された温度制御ブロック198と、前記温度制御ブロック198と接触して設けられた前記加熱冷却部としてのペルチェ素子が設けられたペルチェ素子部197と、該ペルチェ素子部197の下側に設けられたフィン203と、該フィン203の下側に設けられたファン収容枠体102とを有するのみで、前記嵌合孔の底には光ファイバの端部は設けられておらず、また、フィン203等を光ファイバは通っていない。
【0145】
図20、図21は、前記蓋192を示す。該蓋192は、前記測定用ロッド172およびノズル200が装着可能な装着用開口部193と、前記ウェル96の開口部に嵌合する嵌合部194とを有するものである。本実施の形態に係る装置によれば、蓋移動機構を設けることなく蓋でウェル96の開口部を閉塞することができるので、装置の構造を簡単化することができる。また、検体に汚染されるおそれがある蓋は、検査カートリッジ容器に収容するので検査終了後にチップのように検査カートリッジ容器とともに処分することができるので、安全性の高い管理を行なうことができる。
【0146】
続いて、第5の実施の形態に係る検体検査装置について、図22に基づいて説明する。
本実施の形態に係る検体検査装置280は、例えば、長さ250〜400mm(X軸方向)、幅140〜200mm(Y軸方向)、高さ300〜500mm(Z軸方向)程度の筐体内に設けられた、検体および該検体の検査に用いる1または2以上の検査用器具としての複数種類(この例では3種類)のチップが収容されたチップ収容部220a,220b,220cが一列状に配列されかつ該検体を識別しまたは管理する検体情報および検査内容を示す検査情報が可視的記録媒体としてのシール224上に表示され平行に並んで配列された2つの検査カートリッジ284と、検体および検体の検査に用いる1または2以上の試薬溶液等が収容されまたは収容可能な複数(この例では、10個)の収容部としてのウェル322が一列状に設けられかつ該検体を識別しまたは管理する検体情報および検査内容を示す検査情報が可視記録媒体としてシール324上に表示された透光性の部材で形成され平行に並んで配列された2つの検査カートリッジ容器384と、2つの該検査カートリッジ容器384に収容された検体と前記試薬とを反応させて所定の光学状態(例えば、発光)を得るための自動検査部(285,289)と、該自動検査部による検査の結果として生じた前記光学状態を測定する光測定部、デジタル・カメラ228と、前記検査カートリッジ容器284,384の前記シール224,324の空欄に検査結果を印字可能な熱転写プリンタ機構と、前記自動検査部(285,289)、光測定部、デジタル・カメラ228、および熱転写プリンタ機構について制御を行うためのCPU等の集積回路が設けられたボードとを有する。個々で、符号285aは、主として、前記ノズル230をZ軸方向に移動させるZ軸移動機構が設けられたユニットを示す。
【0147】
ここで、2本のカートリッジ容器284は、前記検査用器具として複数種類(この例では3種類)のチップである、分注チップ225、担体封入チップ226および穿孔用チップ227が各々チップ収容部220a,220b,220cに収容されまたは収容可能である。分注チップ225については、既に、前記ノズルヘッド285のノズル230に装着されているので、前記収容部220aは空になっている。
【0148】
該2本のカートリッジ容器284には、その基板284aには、チップ収容部220a,220b,220cの開口部が設けられている。その基板284aの媒体取り付け部としてのシール貼着領域には、検体情報欄224aおよび検査内容を示す検査情報欄224bが設けられたシール224が着脱可能に貼られている。ここで、前記検体情報欄224aにはQRコードが予め印刷され、かつ手書きの記入欄が設けられ、検査情報欄224bには、検査情報が予め印刷され、かつ手書きの記入欄や印字用の空欄が設けられている。同様に、2本のカートリッジ容器384には、その基板384aには、10個の試薬溶液や検体溶液が収容されたウェル322a−322jが設けられている。その基板384aの媒体取り付け部としてのシール貼着領域には、検体情報欄324aおよび検査内容を示す検査情報欄324bが設けられたシール324が着脱可能に貼られている。ここで、前記検体情報欄324aにはQRコードが印刷されかつ手書きの記入欄が設けられ、検査情報欄324bには、検査情報が印刷されかつ手書きの記入欄や印字用の空欄が設けられている。
【0149】
なお、該検体検査装置に配列された全カートリッジ容器284,384は、同一の検査に用いられる場合には、検査情報については共通する内容をもつことになる。また、1列状に(X軸方向に沿って)配列された検査カートリッジ容器284,384列は共通の検体情報をもつことになるが、他の列の検査カートリッジ容器284,384列が異なる検体に対応する場合には、前記検体情報とは異なる検体情報をもつことになる。
【0150】
前記自動検査部(285,289)としては、2本のノズル230,230が設けられ、各ノズル230には、分注チップ225が各々着脱可能に装着され、各分注チップ225は前記2列のカートリッジ容器284、384に沿って移動可能に設けられている。なお、符号244a,244bは、ノズルヘッド285をX軸方向に移動させるためのレールであリ、移動機構289に属するものである。
【0151】
なお、ここでは、デジタル・カメラ228はX軸方向に沿った回転軸をもつ回転機構228aによって一定角度回転可能に設けることによって、1台で、2列の検査カートリッジ容器284,384をカバーすることができる。また、前記光測定部、熱転写プリンタ機構、光測定部についても、Y軸方向に移動可能に設けることによって、1台で、2列の検査カートリッジ容器に対応することができるようにして、装置規模をコンパクトに形成している。本実施の形態によれば、複数の検査を並行して処理することができるので、効率が良くかつ迅速な処理を行なうことができることになる。
【0152】
以上説明した各実施の形態は、本発明をより良く理解させる為に具体的に説明したものであって、別形態を制限するものではない。したがって、発明の主旨を変更しない範囲で変更可能である。例えば、前記実施の形態では、アレルゲン物質、食品及びDNAの場合についてのみ説明したが、その他のタンパク質、糖鎖、DNA物質、RNA等の検査であっても当然適用され得る。また、以上の説明で用いた数値、回数、形状、個数、量等についてもこれらの場合に限定されるものではない。
【0153】
また、前記検査カートリッジ容器の構成として収容すべきチップ、蓋、ロッド等の種類、チップ、蓋、ロッドの構造もしくは個数、ウェルの個数もしくは容量、または、検体情報および検査情報の内容等については例を示すものであって、これらは、検体や検査内容に応じて適宜変更することができる。
【0154】
また、以上の各構成要素、例えば、各ノズルヘッド、各種チップ、各蓋、各ノズル、各温度制御器、各光測定部、各検査カートリッジ容器、または磁力手段等は、適当に変形しながら任意に組み合わせることができる。
【0155】
例えば、前記担体封入チップを用いるとともに、温度制御がされるウェルを有する検査カートリッジ容器、および前記温度制御器を用いることができる。また、前述した試薬や検体や処理工程は例を示すものであって、他の試薬や検体や処理工程を使用することももちろん可能である。
以上の例では、1列または2列の検査カートリッジ容器を検体検査装置に装填して用いる場合のみを説明したが、該場合に限られることなく、3列以上についても適用することができることはいうまでもない。また、2列の検査カートリッジ容器を装填して用いる場合にも、この例に限られることなく、第1の実施の形態で用いた検査カートリッジ容器を並べて装填して用いることももちろん可能である。
【0156】
以下に、本発明を実施例により具体的に説明するが、本発明の範囲はこれらに何ら影響されることはない。
【実施例】
【0157】
本実施例においては、全長50mm程度のキャピラリーによるTSH検出において、ダイナミックレンジ103を確保するための、信号光局在化に関する基礎的検証を行った。
【0158】
(要旨)
ルミノール、過酸化水素、酵素(西洋わさびペルオキシダーゼ(以下、「HRP」))を用いた化学発光系を目的物質の検出に用いた。この系において、信号光拡散の原因は以下のとおりに分類される。
【0159】
A、光学的拡散
A−1、キャピラリー壁が関わる拡散
A−2、反応液(水)中の伝播による拡散
A−3、測定器の分解能
A−4、その他
B、物質の拡散
B−1、発光体そのもの(活性化ルミノール等)の拡散
B−2、発光を触媒する物質(活性化過酸化水素または、HRP等)の拡散
B−3、その他
本実施例では、A−1、A−2について、信号光拡散との相関を検証した。結果、検証した要素全てが、信号光拡散の要因となっており、定量的には、B(恐らくB−2)が定量的に最大の要因であった。さらに、各要因に対して、
B 反応及び検出工程において、キャピラリーに対しプローブビーズを固定すること
B−2、基質吸引時に低温を保つこと
A−2、反応液自体の遮光性を高めること
A−1、キャピラリーの透明度を高めること
等の対策を施すことで、信号光拡散についての有意な改善が見込めることが示唆された。
【0160】
(実験方法)
3−1 光学的拡散についての検証実験
(1)φ1mm ZrO2ビーズ表面に、アサヒペン社製夜光塗料(若草色)を被覆した。これを3度繰り返し厚塗りし、必要に応じてバリや、余剰部分を削りとった。
(2)これらビーズを、実験条件に応じてポリプロピレン(1 mmのヘイズ値25%)又は、ポリカーボネート(1 mmのヘイズ値0.1%)製キャピラリー(φ1.1mm、L50mm)に充填した。このとき、キャピラリーホルダー側から、遮光ビーズ20個/夜光プローブビーズ1個/遮光ビーズ10個の順で配置させた。
(3)キャピラリーホルダー側及び吸引口側をかしめ、実験条件に応じて液体を吸引した。
(4)必要に応じて、光を照射し夜光プローブビーズを蓄光させた。
(5)これをLuBEA(プレシジョン・システム・サイエンス社)に装着、検出のみのプロトコルを実行し、発光強度の分布を計測した。
【0161】
3−2 物質の拡散についての検証実験
プローブビーズへの抗体固層及びBISTの作成
(1)TSH抗体を担持したビーズの作成
適量のTSH抗体を含む緩衝液中に球状担体(ビーズ)を浸漬させることで、抗体をビーズに吸着させた。洗浄工程を経て、市販のブロッキング剤を適量含む緩衝液中に、抗体を担持したビーズを浸漬させ、ブロッキング処理を行った。緩衝液で数回洗浄することで、抗体担持ビーズが調整された。
【0162】
(2)遮光ビーズの作製
市販のブロッキング剤を適量含む緩衝液中に、遮光ビーズを浸漬させ、ブロッキング処理を行った。緩衝液で数回洗浄することで、遮光ビーズを調整した。
【0163】
(3)BISTの作製
BISTキャピラリーの下端側をかしめた後、遮光ビーズ10個、抗体固層ビーズ1個、遮光ビーズ10個又は40個の順に充填し、上端側をかしめた。上端側のかしめ位置は、ビーズ配置40-1-10でビーズが動かない位置とし、ビーズ配置10-1-10の場合も40-1-10とほぼ同位置でかしめた。
【0164】
反応条件
(1)表1のようにGC seriesカートリッジに試薬を添加し、SX-12GCにセットした。SX-12GCコンボラックのHole-2にSheath DN-100とともにBISTをセットした。(”well mixed”および”Not mixed”は「BIST-ELISA_ver.5BS01.pcl」、”Fixed bead”は「BIST-ELISA_ver.5BS01-fixedbead.pcl」を使用)約110分で反応が終了する。
(2)反応が終了した後、well 1の溶液をキャピラリー内に満たし測定まで保存した。測定直前にキャピラリー内の溶液を抜き去った後、検出試薬(サーモフィッシャーサイエンティフィック社製SuperSignal West Femto Maxmum Sensitivity Substrate)を80ul吸引した。その後LuBEAにて直ちに測定、または3回転倒混和し攪拌した後測定した。
【0165】
【表1】

【0166】
(結果)
4−0 コントロール
信号光局在の程度について、発光強度が10,000カウント程度となるTSH(13uIU/mL)を用いて、3−2の手順で、BISTの信号光強度分布を計測した。なお本実験には、キャピラリー:ポリプロピレン製、プローブビーズ:ZrO2(ロットID4)、遮光ビーズ:SiCを用いた。
【0167】
図1(a)には、プローブビーズから一定程度離れた位置の信号光の拡散を比較するため、ピークの発光強度を10,000カウントに規格化して表示すると同時に、図1 (b)に生データをフルスケールで記載した。図中の横軸には、実際のプローブビーズと遮光ビーズの配置の概要を模式的に重ねた。
【0168】
図1 (a)では、信号光の発光強度を10,000カウントに規格化してあるため、103のダイナミックレンジを確保するためには、同一キャピラリー中で発光強度10カウントを良好に検出できることが一つの目安となる。これに対して、現状の信号光の拡散は、ベースライン及びノイズレベル(ベースラインのばらつき)とも、発光強度10カウントを上回る水準であった。またキャピラリー中で、ビーズが存在する領域(ビーズ領域)に比べ、ビーズが存在しない領域(非ビーズ領域)の方が検出された光の強度が強かった。
【0169】
4−1 光学的拡散についての検証
4−1−1 キャピラリー壁が関わる光の拡散(A−1)
キャピラリー壁内の光伝播及び、キャピラリー壁面反射等、キャピラリー壁が関わる光拡散の程度を検証するため、透明度の異なる2種類のキャピラリー(ポリプロピレン製(PP):比較的低透明度)及び、ポリカーボネート製(PC):比較的高透明度)を用いて、物質の拡散を無視できる3−1の手順でBISTの信号光強度の分布を計測した。なお本実験では、遮光ビーズ:SiCを用いた。
【0170】
図2には、プローブビーズから一定程度離れた位置の信号光の拡散を比較するため、ピークの発光強度を10,000カウントに規格化して表示すると同時に、図中の横軸には、実際のプローブビーズと遮光ビーズの配置の概要を模式的に重ねた。
【0171】
結果、PP、PCキャピラリーともに、物質の拡散も含むと予想される図1のデータとの比較において、信号光の拡散は低い水準であった。また、PCの信号光の拡散は、PPに比べ低水準であった。
【0172】
4−1−2、反応液(水)中の伝播による光の拡散(A−2)についての検証
キャピラリーを満たす反応液(水)中を伝播する信号光拡散の程度の検証するため、物質の拡散を無視できる3−1の手順で、
・キャピラリー中の水の有無による信号光強度の分布の違い
・反応液の着色による光透過率抑制の影響
を評価した。
【0173】
なお本実験では、キャピラリー:PC、遮光ビーズ:SiCを用い、PMTからのデータ収集に分周回路は使用しなかった。また、着色反応液としては、株式会社呉竹製「清書用ぼくてき」(墨汁)を200倍希釈した水溶液を用いた。
【0174】
図3には、プローブビーズから一定程度離れた位置の信号光の拡散を比較するため、ピークの発光強度を10,000カウントに規格化して表示すると同時に、図中の横軸には、実際のプローブビーズと遮光ビーズの配置の概要を模式的に重ねた。
【0175】
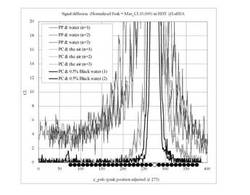
結果、キャピラリー中の水を排出した場合(air)、キャピラリーが水で満たされている場合(water)に比べ、信号光の拡散は低い水準に抑制された。さらに反応液を黒色に染める(Black water)ことによる遮光性の向上は、信号光の局在化にもっとも効果が高かった。
【0176】
4−1−3 光学的拡散についての検証のまとめ
4−1−1、4−1−2の信号光拡散についての基礎的検証から、1)キャピラリーの透明度を高める、2)反応液(水)中を伝播する信号光の拡散を抑制することが、信号の局在に有効であることが示唆された。図4のPP&Waterでは、同一キャピラリー中(プローブビーズ間隔、約20個以内)で発光強度10カウントを検出するのは困難であるが、PC& AirやPC&Black waterでは、検出可能であった。
【0177】
4−2 物質の拡散についての検証
4−2−1 ビーズの運動の影響
検出光強度が10,000カウントを超えるような比較的高濃度のTSHを検出する際に見られる、図1(a)のような信号光の乱れた拡散の原因として、物質(発光体又は、発光を触媒する物質)の拡散が考えられる。そこで、物質の拡散を助長する一つの要素として、反応工程におけるプローブビーズのキャピラリー内部での運動に着目した。現状のBIST構成において、ビーズはキャピラリー中の一定範囲内を自由に運動することができる。反応工程中のビーズの運動と、信号光の拡散の相関を検証するため、3−2の手順及び、表2の3種のプロトコルにてBISTを調整し、TSH検出に際しての信号光の分布を計測した。図5には、プローブビーズから一定程度離れた位置の信号光の拡散を比較するため、ピークの発光強度を10,000カウントに規格化して表示すると同時に、図中の横軸には、実際のプローブビーズと遮光ビーズの配置の概要を模式的に重ねた。
【0178】
結果、現行の標準プロトコルである”well mixed”は、非ビーズ領域に最大で50カウントを超える信号光の乱れた拡散が見られたのに対し、”Not mixed”及び”Fixed bead”については、ビーズ領域、非ビーズ領域に関わらず、この部分が大幅に低減された。
【0179】
【表2】

【0180】
4−2−2 反応基質を吸引することの影響
キャピラリー内のビーズ運動抑制による、物質拡散由来の信号光拡散の低減効果について、繰り返し再現性を確認するため、比較的高濃度域でのTSH検出繰り返し行う実験を試みた。実験は、3−2の手順に従い、13uIU/mL(n=5)、50uIU/mL(n=6)、及び100uIU/mL(n=3)の3水準のTSH濃度で信号光拡散の程度を検証した。図6は、プローブビーズから一定程度離れた位置の信号光の拡散を比較するため、ピークの発光強度を10,000カウントに規格化して表示すると同時に、図中の横軸には、実際のプローブビーズと遮光ビーズの配置の概要を模式的に重ねた。
【0181】
図6から明らかなように、転倒混和による攪拌を行った4−2−1の実験で見られたような、極端にピークから離れた位置での信号光の拡散は見られなかった。ところが、複数のデータを重ねることで、信号光ピークの左斜面(z_pulsの若い領域)に、細かい特徴的なノイズが散発的に現れることが明らかとなった。
【0182】
この結果は、反応基質の吸引が、発光体拡散の原因となっている可能性を示唆する。そもそも本検出系では、プローブビーズ上に固定された酵素と基質の反応により、酵素的に化学発光が誘引され、TSHが検出される。図6において、反応基質はピークの右側(z_pulsの大きい側)から左に向かって吸引されるため、プローブビーズよりも左側(z_pulsの小さい側)に位置する反応基質は全て、プローブビーズに接触していることになる。この基質吸引時の、基質とプローブビーズの瞬間的な接触により、発光体がピークの左側のみに拡散された可能性が考えられる。
【0183】
基質吸引時の、基質とプローブビーズの瞬間的な接触によるノイズの発生という仮説を検証するため、基質吸引時の酵素活性に大きな影響を及ぼす温度に着目し、次の実験を試みた。プローブビーズ上の酵素活性が最大となる40℃付近と、酵素活性が低下する4℃付近で、それぞれ基質吸引を行い、特徴的ノイズの発生を比較した。結果を図7に示す。図6同様、プローブビーズから一定程度離れた位置の信号光の拡散を比較するため、ピークの発光強度を10,000カウントに規格化して表示すると同時に、図中の横軸には、実際のプローブビーズと遮光ビーズの配置の概要を模式的に重ねた。
【0184】
図7において、赤線が40℃、青線が4℃での基質吸引を行ったときのデータである。図から明らかなように、40℃での基質吸引においては、ピークの左側に顕著なノイズが検出されたのに対し、4℃での基質吸引ではノイズは検出されなかった。この結果は、前述の仮説を支持し、また、基質吸引時の温度制御がノイズ低減に有意な効果を持つことが示された。
【0185】
(考察)
4−1、4−2の検証実験から、TSH検出系に見られる信号光の拡散の要因は、光学的拡散と、物質の拡散に大別されることが示唆された。また4−2の検証から、キャピラリー内のビーズの運動を抑制すること、及び基質吸引時の温度を最適化することで、信号光の拡散が有意に改善される可能性が示された。しかし、計測上の有効な信号強度を、S/N比の10倍と仮に定義すると、4−2の改善においても、同一キャピラリー中での発光強度10カウントの検出を可能にするまでには至っていないと思われる。
【0186】
そこで、図5〜7の残存の信号光拡散の要因のうち、4−1で検証した、光学的拡散の成分がどの程度影響しているかを見積もるため、図2〜4の”PP & water”(夜光ビーズ及び遮光ビーズをPPキャピラリーに充填し、内部を水で満たした系)における信号光分布を図5〜7に重ねた(図8)。
【0187】
図8には、プローブビーズから一定程度離れた位置の信号光の拡散を比較するため、ピークの発光強度を10,000カウントに規格化して表示すると同時に、図中の横軸には、実際のプローブビーズと遮光ビーズの配置の概要を模式的に重ねた。
【0188】
図8のとおり、キャピラリー内のビーズの運動を抑制し、物質の拡散を大幅に抑制した”Not mixed”及び”Fixed bead”における残存の信号光拡散(z_puls= 50-200の領域)は、光学的拡散のみを有する”PP & water”と良い一致を示した。このことから、キャピラリー内のビーズ運動の抑制によって、物質の拡散由来の信号光拡散が大部分低減されたと考察される。加えて、3−2での検証のとおり、A-1)キャピラリー由来の光学的拡散、A-2)反応液中を伝播する光学的拡散を抑制することで、BISTによる測定のダイナミックレンジを大幅に増加させることが可能となる。
【産業上の利用可能性】
【0189】
本発明の方法及び装置は、複数の生体分子や生体分子と結合する低分子の検出及び定量的な解析に利用することができる。
【符号の説明】
【0190】
10、70、80、180、280 検体検査装置
14、84、184、284、384 検査カートリッジ容器
15、85、185、285 ノズルヘッド
17、77、177、277 光測定部
24、94、224 シール
25、125、225 分注チップ
26、226 担体封入チップ(固相内蔵チップ)
28、228 デジタル・カメラ
30、100、200、230 ノズル
92、192 蓋
【技術分野】
【0001】
本発明は、複数種の目的物質を同時に検出又は定量するための分析方法に関する。
【背景技術】
【0002】
複数の分析対象を同時に検出するための技術として、BIST(Beads array In Single Tip)が開発された(非特許文献1)。BISTとは、抗原や遺伝子などの測定対象物質と結合する抗体、抗原、あるいはDNA断片などの生体分子を固定化した直径1 mmのプローブビーズを円筒状のチップ(以下、「キャピラリー」と呼ぶ)部分に並べて封入したデバイスである。このBISTは、マグトレーション装置のノズルに嵌合できるので、核酸抽出と同じ自動化装置(例えば、Magtration(登録商標)System 6GC、Magtration(登録商標)System 12GC Plus(プレシジョン・システム・サイエンス社製) )を用いて、ハイブリダイゼーション反応又は抗原抗体反応及び洗浄操作ができる。発生するシグナルはスキャナー(例えば、BISTnner(プレシジョン・システム・サイエンス社製))で検出される。
【0003】
BISTの技術的な最大の特徴としては、キャピラリー中に異なる目的物質を捕獲するためのプローブビーズが複数配置され、多項目の同時検出が可能な点にある。甲状腺刺激ホルモン(TSH: thyroid stimulating hormone)や、これと同時に検査されることで臨床上の有用性の高いFT3(Free Triiodo thyronine)、FT4(Free thyroxine)の定量検査への応用においては、実用上要求される検出濃度域が広範囲に及ぶ(TSH:0.05- 50uIu/mL, FT3:0.5-20pg/mL,FT4:0.1-10ng/dL、ダイナミックレンジで103程度)。このため、多項目同時検査を実現するためには、各プローブビーズからの信号光(目的物質の濃度に比例して強度が増加する光)を局在化させ、他のプローブビーズからの信号光との干渉を抑制しなければならない。しかし、これまでのところ、信号光の局在化は十分とは言えなかった。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】遺伝子多型簡易測定法 シーエムシー出版刊「月刊バイオインダストリー2008年9月号」
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、複数種の目的物質を同時に検出又は定量するために、プローブビーズからの信号光を局在化することを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは、鋭意努力した結果、以下の対策を施すことで、信号光拡散が有意に改善されることを見出し、本発明を完成させるに至った。
【0007】
1.反応及び検出工程において、キャピラリーに対しプローブビーズを固定すること。
2.基質吸引時に低温を保つこと。
3.反応液自体の遮光性を高めること。
4.キャピラリーの透明度を高めること。
【0008】
本発明の要旨は以下の通りである。
(1)単一の容器内に収容された、複数種の目的物質を捕獲するための物質がそれぞれ固定された複数の担体が、液体に浸漬された状態で発光し、この発光を容器外部から測定することで、複数種の目的物質を同時に検出又は定量するための分析方法であって、前記複数担体からの発光信号の光学的交差を抑制するため、前記発光波長帯における前記液体の光線透過率が抑制又は調整されていることを特徴とする前記方法。
(2)発光が化学発光又は蛍光であり、発光の波長帯が340-900nmである(1)に記載の方法。
(3)光線吸収体の添加により、液体の光線透過率が抑制又は調整されている(1)又は(2)に記載の方法。
(4)光線吸収体が微粒子である(3)記載の方法。
(5)液体の光線透過率が、光路長1mm当たり80%以下であるように抑制又は調整されている(1)〜(4)のいずれかに記載の方法。
(6)容器と担体表面形状と容器外部に位置する測光部の相対的な位置関係により、測光部と複数の各担体間の光路長を幾何学的に規定することで、測光部に最近接の担体からの発光信号を選択的に受光する(1)〜(5)のいずれかに記載の方法。
(7)担体が球状である(1)〜(6)のいずれかに記載の方法。
(8)担体が1次元的又は2次元的に配置している(1)〜(7)のいずれかに記載の方法。
(9)容器の構成材料が、厚み1 mmのヘイズ値で20%以下である(1)〜(8)のいずれかに記載の方法。
(10)発光又は放射の波長帯における容器の屈折率が1.6以下である(1)〜(9)のいずれかに記載の方法。
(11)複数種の目的物質を捕獲するための物質がそれぞれ固定された複数の担体を含む(1)〜(10)のいずれかに記載の方法に用いるための検査キット。
(12)容器内に収容されている担体に目的物質を捕獲するための物質が固定され、前記物質が、外部から添加される液体中に含有される発光能を有する物質との反応を介して、前記発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する方法であって、前記液体を添加する際に、前記液体及び/又は容器の温度を調節することを含む前記方法。
(13)発光能を有する物質が、ルミノール、シュウ酸ジフェニル、ルテニウム錯体、塩化オキサリル、ルシフェリン、AMPPD、インドール、ポリフェノール、ジオキセタン、及びこれら物質の誘導体からなる群より選択される少なくとも1種の化合物である(12)記載の方法。
(14)液体及び/又は容器の温度を15℃以下に調節する(12)又は(13)に記載の方法。
(15)液体を添加する際に、担体が容器に対して固定されている(12)〜(14)のいずれかに記載の方法。
(16)発光又は放射の波長帯における液体の光線透過率を抑制又は調整する手段と、目的物質を発光又は放射現象により光学的に検出及び/又は定量する手段とを備えた、(1)〜(10)のいずれかに記載の方法に用いる装置。
(17)液体の温度を調節する手段、発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する手段とを備えた、(12)〜(15)のいずれかに記載の方法に用いる装置。
(18)さらに、容器の温度を調節する手段を備えた、(17)記載の装置。
(19)容器の温度を調節する手段、発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する手段とを備えた、(12)〜(15)のいずれかに記載の方法に用いる装置。
(20)さらに、液体の温度を調節する手段を備えた、(19)記載の装置。
【発明の効果】
【0009】
本発明により、複数種の目的物質を同時に検出又は定量する系において、目的物質を捕獲するための物質が固定されたプローブビーズからの信号光を局在化させ、他のプローブビーズからの信号光との干渉を抑制することができるようになった。
【図面の簡単な説明】
【0010】
【図1】ポリプロピレン製キャピラリーを用いて、室温中条件下で基質吸引後に転倒混和行った場合のBISTにおけるTSH測定の信号光分布。
【図2】円筒内部に球状の発光体を含んだポリプロピレン製及び、ポリカーボネート製BISTキャピラリーの信号光分布の比較。
【図3】ポリカーボネート製BISTキャピラリーの円筒内部に充填された液体の光線透過率の違いによる、信号光分布の変化。
【図4】ポリプロピレン製BISTキャピラリーの円筒内部に充填された液体の光線透過率の違いによる、信号光分布の変化。
【図5】基質吸引後の攪拌の程度の違いによる、BISTキャピラリーの信号光分布の変化。
【図6】室温条件下で基質を吸引した場合の、BISTキャピラリーの信号光分布。
【図7】基質吸引時の温度条件の違いによる、BISTキャピラリーの信号光分布。
【図8】基質吸引後の攪拌抑制による信号光の拡散と、光学的拡散の比較。
【図9】本発明の第1の実施の形態に係る検体検査装置の筐体の一部を除去して示す斜視図である。
【図10】図9の検体検査装置の一部部品を除去し検査カートリッジ容器を引き出した状態を示す斜視図である。
【図11】図9および図10に示す光測定部に内蔵された部品の拡大斜視図である。
【図12】図9および図10に示す検査カートリッジ容器の拡大斜視図である。
【図13】図12に示す検査カートリッジ容器に収容された各種チップを示す斜視図である。
【図14】図9および図10に示す検体検査装置の処理流れ図である。
【図15】本発明の第2の実施の形態に係る検体検査装置の主要部品を筐体から取り出して示す斜視図である。
【図16】本発明の第3の実施の形態に係る検体検査装置の主要部品を筐体から取り出して示す斜視図である。
【図17】図16に示す光測定部および温度制御器を一部切り欠いて示す拡大斜視図である。
【図18】本発明の第4の実施の形態に係る検体検査装置の主要部品を筐体から取り出して示す斜視図である。
【図19】図18に示す光測定部および温度制御器を一部切り欠いて示す拡大斜視図である。
【図20】図19に示す蓋を示す拡大斜視図である。
【図21】図20に示す蓋を一部切り欠いて示す斜視図である。
【図22】本発明の第5の実施の形態に係る検体検査装置の4つの検査カートリッジ容器を含む主要部品を筐体から取り出して示す模式図である。
【発明を実施するための形態】
【0011】
以下、本発明の実施の形態についてより詳細に説明する。
【0012】
本発明は、単一の容器内に収容された、複数種の目的物質を捕獲するための物質(以下、「捕獲物質」と記す)がそれぞれ固定された複数の担体が、液体に浸漬された状態で発光し、この発光を容器外部から測定することで、複数種の目的物質を同時に検出又は定量するための分析方法であって、前記複数担体からの発光信号の光学的交差を抑制するため、前記発光波長帯における前記液体の光線透過率が抑制又は調整されていることを特徴とする前記方法を提供する。
【0013】
容器は、発光を容器外部から測定可能であればいかなるものであってもよいが、透光性であるとよく、樹脂やガラスなどの光を透過する材質であることが好ましい。また、容器の形状は、特に限定されるものではないが、細管、ピペット状などの形状であるとよい。例えば、BISTの場合、容器は、内部に収容した液体の吸引吐出が可能な円筒状のチップである。
【0014】
本発明の方法において、容器の透明度を高めることで、信号光の拡散を低減させることができる。容器の厚み1 mmのヘイズ値は20%以下であるとよく、好ましくは、10%以下であり、より好ましくは、1%以下である。厚み1 mmのヘイズ値が20%以下である容器の材質としては、ポリプロピレン、ポリカーボーネート、ポリスチレン、ポリメチルメタクリレート、環状ポリオレフィン、ポリメチルペンテンなどを例示することができる。
ヘイズ値は、透明性の度合いを表す値であり、JIS K7136では、全光線透過率に対する拡散透過率の比として定義されている。
【0015】
また、発光又は放射の波長帯における容器の屈折率は、1.6以下であるとよく、好ましくは、1.55以下であり、より好ましくは、1.50以下である。屈折率が1.6以下の容器の材質としては、ポリプロピレン、ポリカーボーネート、ポリスチレン、ポリメチルメタクリレート、環状ポリオレフィン、ポリメチルペンテンなどを例示することができる。
【0016】
目的物質は、血液、血清、尿、リンパ液、口腔内粘膜、爪、喀痰などの生体試料、河川水、湖水、海水、土壌などの試料に含まれる分析対象となる物質でありうる。目的物質としては、核酸、タンパク質、抗原、抗体、酵素、糖などの生体物質、サルモネラ菌、大腸菌などの細菌類、コバルト、鉄、モリブデン、銅、亜鉛、ヒ素、カドミウム、バナジウムなどの金属などを例示することができる。
【0017】
目的物質は、測定可能な標識がなされてもよく、測定可能な標識としては、蛍光標識、化学発光標識、電気化学発光標識、酵素標識、放射性標識、磁気標識などを例示することができる。標識物質としては、Marine Blue、 Cascade Blue、 Cascade Yellow、Fluorescein、Rhodamine、Phycoerythrin、CyChrome、PerCP、Texas Red、Allophycocyanin、PharRed、Oregon Green-488、Cy系色素(例えば、Cy2, Cy3, Cy3.5, Cy5, Cy7など)、Alexa系色素(例えば、Alexa-488、Alexa-532、Alexa-546、Alexa-633、Alexa-680、Alexa-700、Alexa-750など)、BODIPY系色素(例えば、BODIPY FL, BODIPY TR-など)などの蛍光物質、ルミノール、アクリジン、アダマンチルジオキタセン、シュウ酸エステル、ロフィン、ルシゲニン、イゾルミノール誘導体などの化学発光物質、トリス−ビピリジン−(4-メチルスルホン)NHSエステルルテニウム(II)錯体、ジフェニルアントラセン、テトラフェニルアントラセンなどの電気化学発光物質、POD(Hydrogen peroxidase)、AP(alkaline phosphatase)、βガラクトシダーゼ、グルコースオキシダーゼ、グルコースオキシダーゼ、グルコース-6-燐酸脱水素酵素などの酵素などを例示することができる。この他にも、放射性同位元素(例えば、3H, 14C, 32P, 33P, 35S, 125Iなど)などの放射性物質などの標識物質を用いてもよい。
【0018】
目的物質は、直接的に標識されてもよいし、間接的に標識されてもよい。例えば、後述の実施例においては、サンドイッチELISA法が用いられている。具体的には、担体に固定された一次抗体に、抗原である目的物質が結合した後、二次抗体であるビオチン標識抗体が目的物質に結合する。さらにこの二次抗体に対して、化学発光を触媒するストレプトアビジン化されたHRPが結合し、目的物質を標識する。
【0019】
目的物質を捕獲するための物質は、目的物質と結合する物質であればよく、抗体、抗原、DNA断片、金属錯体、その他低分子化合物などを例示することができるが、これらに限定されるわけではない。
【0020】
担体は、不定形粒子、球(ビーズ)、糸(ストランド)、磁性ビーズなどのいかなる形状であってもよいが、球状であることが好ましい。担体が球(ビーズ)又は磁性ビーズの形状をとる場合には、球(ビーズ)又は磁性ビーズのそれぞれに異なる目的物質を捕獲するための物質が固定されているとよい。担体が糸の形状をとる場合には、糸の異なる位置のそれぞれに異なる目的物質を捕獲するための物質が固定されているとよい。BISTの場合、担体は球(ビーズ)の形状をとる。
【0021】
球(ビーズ)は、大きさは1mm程度で、プラスチックやセラミックなどの材質のものであるとよく、このような球(ビーズ)は、特開2000-346842号公報、特表平14-534657号公報などに記載されている。
【0022】
磁性ビーズは、大きさは数十μmで、プラスチックやセラミックなどに鉄粉等を混ぜ、磁気化したものであるとよい。このような磁性ビーズは、特開平8-62224号公報(特許第3115501号明細書)、国際公開WO96/29602パンフレット、国際公開WO97/44671パンフレットなどに記載されている。
【0023】
糸(ストランド)は、大きさは直径0.1mm程度で、樹脂系の材質のものであるとよく、このような糸は、特開2006-214759号公報、国際公開WO01/53831パンフレット、国際公開WO2003/7901パンフレットなどに記載されている。
【0024】
担体は、1次元的又は2次元的に配置しているとよい。担体が1次元的に配置しているとは、観測された発光信号がどの担体に由来するものかを特定するために必要な位置情報が1次元であるような状態を意味し、例えば、BISTにおいて、担体(ビーズ)は一次元的に配置していると言える。担体が2次元的に配置しているとは、観測された発光信号がどの担体に由来するものかを特定するために必要な位置情報が2次元であるのような状態を意味し、例えば、プレート上に担体が単層で敷き詰められた測定キットは、担体が2次元的に配置されたものといえる。
【0025】
目的物質を捕獲するための物質は、共有結合、化学吸着、物理吸着、電気的相互作用、疎水的相互作用、ファンデルワールス力、水素結合などにより、担体に固定されている。
【0026】
目的物質の分析は、目的物質を捕獲するための物質と目的物質とを液体に浸漬された状態で接触させ、その後生じる発光を測定することにより行うことができる。
【0027】
液体は、担体を浸漬可能で、発光を容器外部から測定可能とするものであればよく、水、有機溶媒、緩衝液などを例示することができるが、これらに限定されるわけではない。
【0028】
本発明の方法において、液体の光線透過率を抑制又は調整することで、信号光の拡散を低減させることができる。液体の光線透過率は、光路長1mm当たり80%以下であるように抑制又は調整されているとよい。好ましくは、光路長1mm当たり60〜80%であるように、より好ましくは、光路長1mm当たり50%以下であるように、液体の光線透過率は抑制又は調整される。
【0029】
発光は、化学発光、蛍光又は電気化学発光などでありうるが、化学発光又は蛍光であり、発光の波長帯が340-900nmであるとよい。発光は、蛍光計、分光光度計、シンチレーションカウンター、フォトダイオード、CCD、CMOS、光電子増倍管などの公知の技術を用いて、測定することができる。
【0030】
本発明の方法においては、複数種の目的物質が同時に検出又は定量される。複数種とは、少なくとも2種、例えば、2、3、4、5種又はそれ以上である。複数種の目的物質を捕獲するための物質がそれぞれ複数の担体に固定される。例えば、BISTの場合、全長50 mmのキャピラリーに、プローブビーズ(目的物質を捕獲するための物資が固定されたビーズ)及び遮光ビーズを併せて50個程度のビーズを配置できる。プローブビーズには、ブランクと内部標準を含めてもよい。ブランクとは、捕獲物質が固定されていない担体である。内部標準とは、検体には含有し得ず、分析前に添加される既知濃度の標準物質を捕獲する物質が固定されている担体である。
【0031】
複数種の目的物質を同時に検出又は定量するには、捕獲物質は他の捕獲物質の存在の有無に関わらず、特異的に目的物質を捕獲するため、異なる種類の捕獲物質が固定された複数種類の担体を、同一容器内に配置させ、液状の検体をこれらに接触させることで、複数種の目的物質を同時に検出できる。
【0032】
本明細書において、「複数担体からの発光信号の光学的交差」とは、複数の担体からの発光信号が同時に検出器で受光され、各担体からの発光信号を分離できない状態をいう。
【0033】
複数担体からの発光信号の光学的交差は、発光波長帯における液体の光線透過率を抑制又は調整することにより、抑制することができる。
【0034】
例えば、光線吸収体の添加により、液体の光線透過率を抑制又は調整することができる。光線吸収体としては、微粒子(例えば、カーボンブラック、無機又は、有機物からなる微粒子など)、無機又は有機物が溶解する染料などを例示することができるが、これらに限定されるわけではない。
【0035】
本発明の方法において、容器と担体表面形状と容器外部に位置する測光部の相対的な位置関係により、測光部と複数の各担体間の光路長を幾何学的に規定することで、測光部に最近接の担体からの発光信号を選択的に受光するとよい。BISTの例で具体的に説明すると、BISTチップでは、内径1.1〜1.2mmの円筒状キャピラリー内部に、直径1mm程の球状担体が1次元的に配置している。担体表面から発せられキャピラリー外部に到達する発光信号のうち、光線吸収帯を含む液体部分を通過する距離が最も短いのは、担体最外周(担体のキャピラリー内壁に最も近い)部分から、円筒内壁に対して垂直に発せられた光線である。同時に、発光信号の進行方向が、円筒内壁に対する垂直から離れるに従って、光線吸収帯を含む液体部分を通過する距離は増大する。従って、円筒外部より、担体からの発光信号を受光する場合、最近接の担体からの信号光を選択的に受光できる。
【0036】
本発明は、発光又は放射の波長帯における液体の光線透過率を抑制又は調整する手段と、目的物質を発光又は放射現象により光学的に検出及び/又は定量する手段とを備えた、複数種類の目的物質を同時に検出又は定量するための装置を提供する。本発明の装置は、単一の容器内に収容された、複数種の目的物質を捕獲するための物質(捕獲物質)がそれぞれ固定された複数の担体が、液体に浸漬された状態で発光し、この発光を容器外部から測定することで、複数種の目的物質を同時に検出又は定量するための分析方法であって、前記複数担体からの発光信号の光学的交差を抑制するため、前記発光波長帯における前記液体の光線透過率が抑制又は調整されていることを特徴とする前記方法に用いることができる。
【0037】
本装置は、検体や試薬の分注、混合等を行う機能、検体、試薬の温度調節を行う機能、信号光を検出する機能を有する。
【0038】
また、本発明は、単一の容器内に収容された、複数種の目的物質を捕獲するための物質 捕獲物質がそれぞれ固定された複数の担体を含む検査キットを提供する。このキットは、単一の容器内に収容された、複数種の目的物質を捕獲するための物質(捕獲物質)がそれぞれ固定された複数の担体が、液体に浸漬された状態で発光し、この発光を容器外部から測定することで、複数種の目的物質を同時に検出又は定量するための分析方法であって、前記複数担体からの発光信号の光学的交差を抑制するため、前記発光波長帯における前記液体の光線透過率が抑制又は調整されていることを特徴とする前記方法に用いることができる。容器、目的物質を捕獲するための物質及び担体については上述した。
【0039】
さらに、本発明は、容器内に収容されている担体に目的物質を捕獲するための物質が固定され、前記物質が、外部から添加される液体中に含有される発光能を有する物質との反応を介して、前記発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する方法であって、前記液体を添加する際に、前記液体及び/又は容器の温度を調節することを含む前記方法を提供する。この方法は、上述の発光波長域における液体の光線透過率を抑制又は調整する方法と組み合わせて用いるとよい。そうすることで、より効果的に信号光を局在化させることができる。容器、目的物質を捕獲するための物質及び担体については上述した。
【0040】
液体は上記の液体と同様であるが、液体は、発光能を有する物質を含有し、容器の外部から添加される。発光能を有する物質としては、ルミノール、シュウ酸ジフェニル、ルテニウム錯体、塩化オキサリル、ルシフェリン、AMPPD(3-(2’-スピロアダマンタン)-4-メトキシ-4- (3”-ホスホリルオキシ)フェニル-1,2-ジオキセタン・2ナトリウム塩)、インドール、ポリフェノール、ジオキセタン、及びこれら物質の誘導体などを例示することができるが、これらに限定されるわけではない。
【0041】
例えばルミノールは、鉄等の触媒作用によって、過酸化水素と反応し不安定な反応中間体を生成する。この反応中間体がフタル酸ジアニオンに変化する際、発光を伴う。BISTにおける目的物質の検出ではサンドイッチELISA法が用いられるが、二次抗体がヘムを含む西洋ワサビペルオキシダーゼにより標識されており、これによりルミノールの発光が触媒される。
【0042】
本発明の方法において、発光能を有する物質を含有する液体を添加する際に、その液体及び/又はその液体が添加される容器の温度を調節し、最適化することにより、信号光の拡散を低減させることができる。液体及び/又は容器の温度を低温に保つことで、信号光の拡散を小さくすることができる。液体及び/又は容器の温度は、15℃以下に調節するとよく、好ましくは10〜2℃、より好ましくは6〜4℃に調節する。液体及び/又は容器の温度は、ペルチェ素子、電熱線、液体窒素などにより調節することができる。
【0043】
本発明の方法において、発光能を有する物質を含有する液体を添加する際に、担体が容器に対して固定されているとよい。担体を容器に対して固定することで、信号光の拡散を小さくすることができる。担体を容器に対して固定する方法としては、担体間の距離を短くする方法、担体と担体の間の位置でかしめる方法、位置決め用のピンを使用する方法などを例示することができる。
【0044】
本発明は、液体の温度を調節する手段、発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する手段とを備えた、目的物質を検出又は定量するための装置を提供する。本発明の装置は、容器内に収容されている担体に目的物質を捕獲するための物質が固定され、前記物質が、外部から添加される液体中に含有される発光能を有する物質との反応を介して、前記発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する方法であって、前記液体を添加する際に、前記液体及び/又は容器の温度を調節することを含む前記方法に用いることができる。本発明の装置は、さらに、容器の温度を調節する手段を備えるとよい。
【0045】
さらにまた、本発明は、容器の温度を調節する手段、発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する手段とを備えた、目的物質を検出又は定量するための装置を提供する。本発明の装置は、容器内に収容されている担体に目的物質を捕獲するための物質が固定され、前記物質が、外部から添加される液体中に含有される発光能を有する物質との反応を介して、前記発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する方法であって、前記液体を添加する際に、前記液体及び/又は容器の温度を調節することを含む前記方法に用いることができる。本発明の装置は、さらに、液体の温度を調節する手段を備えるとよい。
【0046】
続いて、本発明の第1の実施の形態に係る検体検査装置10を図9乃至図14に基づいて説明する。
【0047】
該検体検査装置10は、例えば、長さ250〜400mm(X軸方向)、幅70〜100mm(Y軸方向)、高さ300〜500mm(Z軸方向)程度のブック状の筐体12で囲まれている。該筐体12内には、検体および該検体の検査に用いる1または2以上の試薬溶液等が収容されまたは収容可能な複数(この例では10個)のウェル22および検査用器具としての複数種類(この例では3種類)のチップが収容されたチップ収容部20が一列状に配列されて設けられかつ該検体を識別しまたは管理する検体情報および検査内容を示す検査情報が可視記録媒体としてのシール24上に表示され透光性の部材で形成された検査カートリッジ容器14と、該検査カートリッジ容器14に収容された検体と前記試薬とを反応させて所定の光学状態としての発光を得るための自動検査部(15,19)と、該自動検査部による検査の結果として生じた前記発光を測定する光測定部17と、前記検体情報および前記検査情報を含む前記検査カートリッジ容器14に表示された内容を撮影して画像データを得るデジタル・カメラ28と、前記検査カートリッジ容器14の前記シール24の空欄に検査結果を印字可能な熱転写プリンタ機構21と、前記自動検査部(15,19)、光測定部17、デジタル・カメラ28、および熱転写プリンタ機構21についての制御を行うためのCPU等の集積回路が設けられたボード52とを有する。
【0048】
前記検査カートリッジ容器14は、手動によって前記筐体12から該筐体12外に引き出し可能に設けられた該嵌装板16と連結する装填箱18に着脱可能に装填されている。
【0049】
前記自動検査部(15,19)、前記検査カートリッジ容器14、光測定部17が設けられた室と、前記ボード52とが設けられた室とは仕切り板51によって仕切られて、吸引吐出がされる液体の飛沫等による回路の破壊や汚染の防止を図っている。換気用ファン54が、該仕切り板51を貫通して設けられ、前記ボード52が設けられた室の筐体12を貫通するように別の換気用ファン56が設けられている。
【0050】
前記自動検査部(15,19)は、分注機のノズルヘッド15と、前記筐体12内に収納された前記検査カートリッジ容器14に対して前記ノズルヘッド15を移動可能とする移動機構19とを有する。
【0051】
前記分注機の前記ノズルヘッド15は、前記移動機構19により、筐体12内に収納された前記検査カートリッジ容器14に対してその長手方向に相当するX軸方向に移動可能なX軸移動体11と、該X軸移動体11に対して上下方向にガイド柱41に案内されて移動可能に設けられたZ軸移動体13とを有する。前記X軸移動体11には、前記Z軸移動体13に連結したナット部が螺合し、該Z軸移動体13を上下方向に移動させる後述するZ軸移動用ボール螺子43が回転可能に取り付けられるとともに、前記ガイド柱41および該ガイド柱41を介して取り付けられた支持プレート39が取り付けられている。
【0052】
該ノズルヘッド15には、前記Z軸移動体13に取り付けられ、気体の吸引吐出を行なうシリンダと側面から突出するようにして設けられたエアゴム管31を介して連通するノズル30と、前記シリンダ内のピストンを駆動するためのモータ40と、回転可能に取り付けられたボール螺子42とを有する。
【0053】
また、前記X軸移動体11に取り付けられた前記支持プレート39は、前記ボール螺子42を回転可能に支持するとともに、その下側で、該担体封入チップ26等のチップを前記ノズル30から脱着させるために該ノズル30の径よりも大きく前記チップの最も太い部分の外径よりも細いU字状の孔が形成されたチップ脱着板48を前後方向に移動可能に支持し、その支持プレート39の上側では、該チップ脱着板48を前後方向に駆動するモータ38が前記X軸移動体11に取り付けられている。
【0054】
前記デジタル・カメラ28は前記X軸移動体11にカメラ支持プレート29を介して取り付けられており、該筐体12に収納された前記検査カートリッジ容器14の前記シール24上の検体情報および検査情報の全体を撮影可能な位置に前記ノズルヘッド15を移動させて撮影することになる。
【0055】
該分注機のノズルヘッド15を前記筐体12内に収納された前記検査カートリッジ容器14に対して移動させる移動機構19は、前記ノズルヘッド15の前記X軸移動体11と係わり合って前記検査カートリッジ容器14の長手方向、すなわちX軸方向に沿って案内するレール44と、該ノズルヘッド15をX軸方向に沿って移動させるX軸移動用モータ58と、前記Z軸移動体13を上下方向すなわちZ軸方向に沿って案内する前記ガイド柱41と、前記Z軸移動用ボール螺子43と、Z軸移動用モータとを有する。なお、前記シリンダ、前記ボール螺子42および前記モータ40は吸引吐出機構に相当する。また、前記ガイド柱41、前記Z軸移動用ボール螺子43、Z軸移動用モータは移動機構19の内のZ軸移動機構に相当する。
【0056】
前記光測定部17は、チップ挿入部34と、受光した蛍光を所定の電気信号に変換する光電子増倍管等の1の光電素子を少なくとも有する光電部32とを有する。
【0057】
前記熱転写プリンタ機構21は、前記光測定部17と前記ボード52を介して接続し、該光測定部17の測定結果に応じた電気信号を受けて前記検査カートリッジ容器14の前記シール24に印字を行なうものである。該熱転写プリンタ機構21は、前記検査カートリッジ容器14を該筐体12内に挿入する際には、該検査カートリッジ容器14と接触しないように上方に位置し、該検査カートリッジ容器14を収納することによって、例えば、カム機構によって下降して該検査カートリッジ容器14の前記シール24上の所定の空欄部分に該熱転写プリンタ機構21の印字ヘッド21aが位置するように設けられるようにするのが好ましい。該印字ヘッド21aとしては、所定桁数のデジタル数字で形成し、印字ヘッド21aのデジタル数字の所定のセグメントを加熱することで、感熱媒体で形成された前記シール24に該当するデジタル数字を自動的に書き込むものである。
【0058】
図10は、前記検体検査装置10の前記検査カートリッジ容器14を前記筐体12から手動により引き出された状態を示すものである。なお、前記熱転写プリンタ機構21は説明の便宜上取り除かれている。
【0059】
前記検査カートリッジ容器14が装填される前記装填箱18は、その装填箱18の長手方向、すなわちX軸方向に沿って延びるガイド部材18aが前記筐体12内にX軸方向に沿って敷設されたガイドレール23に案内されて手動でX軸方向に移動可能に設けられ、これによって該検査カートリッジ容器14を該筐体12内に完全に収納することができる。
【0060】
なお、該ガイド部材18aおよび前記熱転写プリンタ機構21に前記カム機構を設けて該容器14の挿抜と該機構21の上下動を連動させるのが好ましい。
【0061】
また、前記ノズルヘッド15の前記ノズル30には、内部に複数の担体である粒子26cが収容された担体封入チップ26が着脱可能に装着されている。
【0062】
前記光測定部17は、さらに、半円状孔36aが縁に形成され前記光電部32に固定された測定用ブロック36と、該測定用ブロック36の下側でかつ前記チップ挿入部34の上方に長孔35aが縁に形成され電磁石によって該長孔35aの長軸方向(X軸方向)に沿って前後に進退可能に設けられた測定プレート35と、を有している。該測定プレート35の下方に設けられた前記チップ挿入部34は、前記半円状孔36aおよび長孔35aによって組み合わされた空隙部分を通って下降した前記担体封入チップ26の細径管26aがその四角孔34aを通って挿入可能となるように箱状に形成されている。前記測定プレート35および測定用ブロック36、および前記光電部32は、前記筐体12に対して測定時において固定されており、前記担体封入チップ26を前記筐体12に対して上昇または下降させることにより複数の粒子26cを走査して測定する。
【0063】
図11は、前記光測定部17に内蔵された光学系を示すものである。該光学系は、例えば化学発光を測定するのに適した装置であって、3組の光ファイバ37a,37b,37cと、該光ファイバの先端に設けられたレンズ等からなる受光端33a,33b,33cとが設けられている。前記受光端33a,33bは、前記測定プレート35の前記長孔35aの側壁に配置され、前記受光端33cは、前記測定用ブロック36の半円状孔36aの側壁に配置され、これらの前記受光端33a,33b,33cが、前記担体封入チップ26の細径管26aを3方向から放射状に囲むことになる。前記測定プレート35は、前記担体封入チップ26の挿入時には、前方向に電磁石による磁力を用いて移動させて長孔35aと半円状孔36aで形成される空隙部分の水平断面積を拡大し、測定時にあっては、前記測定プレート35を後方向に移動して長孔35aに挿入した前記担体封入チップ26に接近させて前記水平断面積を狭める。
【0064】
図12は前記検査カートリッジ容器14を拡大して示すものである。
【0065】
該検査カートリッジ容器14の基板14aには、チップ収容部20の開口部およびウェル22の開口部が設けられている。該各ウェル22の容量は、例えば、1ccから数cc程度、例えば2ccである。チップ収容部20には、この例では3本のチップ、この例では分注チップ25、担体封入チップ26、および穿孔用チップ27が、前記ノズル30の下降および挿入によって装着可能な状態に装着用の開口部を上にして、各々該当する深さの筒体20a,20b,20c内に収容されている。10個のウェル22には、検体、該検体の検査に用いる1または2以上の試薬溶液が収容され、該開口部は前記穿孔用チップ27で穿孔可能な1枚のフィルムで閉塞されている。なお、前記チップ収容部20の開口部については、人手によって剥離可能なシールで閉塞され、使用時において該シールを剥離して用いる。
【0066】
該検査カートリッジ容器14の前記基板14aの前記媒体取付け部としてのシール貼着領域14bには、前述したように検体情報(24a,24b)および検査内容を示す検査情報(24c,24d,24e)が可視的に表示されたシール24が着脱可能に貼られている。ここで、前記検体情報(24a,24b)には、例えば、患者名を手書きで記入して表示する欄24a、患者の識別番号を表示する欄24bが設けられ、検査情報(24c,24d,24e)には、例えば、検査項目を表示する欄24c、前記検査カートリッジ容器14に予め収容された1または2以上の各試薬の製造場所、製造時期、有効期限、製造試薬数、保管場所、品質等の管理情報を示すLOT番号を表示するLOT番号欄24d、および備考欄24eとして、例えば、前記光測定部17によって測定された検査結果を記入して表示する欄を設ける。前記検査項目としては、例えば、TSH(甲状腺刺激ホルモン)、体内炎症、アレルギー等の検査があり、図11に示すように、例えば、2次元コードで表示する。なお、符号24fは、該シール24を前記基板14aから剥離する場合の摘み部である。
【0067】
図13は、前記検査カートリッジ容器14のチップ収容部20に収容された3種類のチップ(25,26,27)を示す。
【0068】
図13(A)に示すように、分注チップ25は、液体の吸引により液体をチップ内に収容し前記ウェル22間を移動して収容した液体を吐出して該ウェル22間の液体の移送等に用いられる。該分注チップ25は、先端が前記ウェル22に挿入可能な太さを有する細径管25aと、前記細径管25aと連通し後端に前記ノズル30が装着可能な装着用開口部を有する太径管25bと、該太径管25bの後端部に軸方向に平行に設けられた複数の突条25dとを有する。
【0069】
図13(B)に示すように、前記担体封入チップ26は、複数個(この例では、43個)の担体としての粒子26cが、前記ウェル22に挿入可能な太さの前記細径管26a内に一列状に配列され、各粒子には、目的物質と結合可能な結合物質が固定されたものであり、該細径管26aを位置26d,26eにおいてかしめることで内部に封入されている。位置26dと26eの距離を短くすることで、粒子26cを担体封入チップ26に対して固定することができる。あるいはまた、複数の粒子26cの粒子と粒子の間の位置でかしめることで、粒子26cを担体封入チップ26に対して固定してもよい。該細径管26aは、空気のみを通すフィルタが設けられたフィルタ部26fを介して太径管26bと連通し、該太径管26bの開口部は前記ノズル30に装着可能に設けられている。太径管26bの周囲には、複数個の突条26gが軸方向に平行に設けられている。担体封入チップ26は光線透過率が70%以上であるとよい。また、担体封入チップ26の屈折率は、1.6以下であるとよい。担体封入チップ26の材質としては、ポリカーボーネート、ポリスチレン、ポリメチルメタクリレート、環状ポリオレフィン、ポリメチルペンテンであることが好ましい。
【0070】
図13(C)に示すように、穿孔用チップ27は、前記検査カートリッジ容器14の前記ウェル22の開口部を閉塞するフィルムを穿孔するために、鋭い先端部27aをもち、後端部27bにある開口部は前記ノズル30に装着可能であり、後端部27bの外周には、複数の突条27cが軸方向に平行に設けられている。なお、これらのチップは、細径管または先端部の長さは、例えば1cmから10cmであり、太径管の長さは例えば1cmから10cmであり、前記粒子の径は、例えば、0.1mmから3mmである。すると、前記細径管26aの内径は、この粒子を一列状に保持可能な大きさであって、例えば、約0.2mmから6mm程度の内径をもたせる。
【0071】
続いて、第1の実施の形態に係る検体検査装置10の動作について、図14に基づいて説明する。
【0072】
図14(A)に示すように、ステップS1で、該検体検査装置10の筐体12の嵌装板16を手で引き出す。図14(B)に示すように、ステップS2で前記装填箱18を筐体12の外部に展開する。図14(C)に示すように、ステップS3で検査対象となる検体および検査用の試薬、チップが予め収容された前記検査カートリッジ容器14を前記装填箱18内に装填する。その際、該検査カートリッジ容器14の前記シール24には、前記検体情報に属する患者の氏名が手書きで記入され、検査内容を示す検査情報が予め記載されている。図14(D)に示すように、ステップS4で、手で前記装填箱18および装填した前記検査カートリッジ容器14を前記筐体12内に挿入して収納する。
【0073】
図14(D)の状態で、以下に示す処理が行われる。
【0074】
ステップS5で、前記ノズルヘッド15は、前記検査カートリッジ容器14のチップ収容部20にまで移動し、前記ノズル30が穿孔用チップ27の真上にまで位置させる。前記ノズル30をZ軸方向に沿って下降させて、該ノズル30の先端を前記穿孔用チップ27の開口部に挿入させて押し込み装着させる。
【0075】
ステップS6で、該穿孔用チップ27が装着された該ノズル30は、該検査カートリッジ容器14の各ウェル22の真上に順次位置させた後、下降させることで、10個の各ウェル22を覆っていたフィルムを穿孔する。
【0076】
ステップS7で、全ウェル22の穿孔が終了すると、該ノズル30は、前記チップ収容部20の前記穿孔用チップ27が収容された位置にまで移動し、前記チップ脱着板48のU字状の溝を前記ノズル30に接近させた後、該ノズル30を上方向(Z軸方向)に沿って移動させることによって前記チップ収容部20の筒体20cの中に前記穿孔用チップ27を脱着させる。
【0077】
ステップS8で、前記ノズル30を前記チップ収容部20の分注チップ25(または担体封入チップ26)が収容されている位置の真上にまで移動し、前記ノズル30をZ軸方向に沿って下降させて、該ノズル30の先端を前記分注チップ25(または前記担体封入チップ26)の開口部に挿入させて押し込み装着させる。
【0078】
例えば、被験者のアレルギー検査を行なう場合についての前記検体検査装置10の処理について説明する。
【0079】
各種アレルゲン物質、例えば、スギ花粉、ブタクサ、卵白、大豆、ハウスダスト、ダニ、カビ等から得られた数種類のアレルゲン物質(抗体)を、前記担体封入チップ26の前記粒子26cに固定させる。各アレルゲン物質が固定された粒子26cは、固定されたアレルゲン物質の種類に応じた配列位置に予め封入しておく。また、いずれの種類のアレルゲン物質をも固定されていない粒子26cも前記担体封入チップ26内に前記アレルゲン物質が固定された各粒子26c間に配置させておく。
【0080】
また、前記検査カートリッジ容器14のウェル22aには、検体として被験者から採取した血清を収容し、ウェル22bには、標識酵素のペルオキシダーゼ溶液を収容し、ウェル22cには、化学発光の基質液としてルミノール/過酸化水素溶液を収容しておく。また、ウェル22dからウェル22iには、例えば、リン酸バッファ液またはトリスバッファ液等の洗浄液を収容しておく。ウェル22dからウェル22iまでのいずれか一つ又はそれ以上のウェルに、光線吸収体含有液を収容しておいてもよい。あるいは、光線吸収体を化学発光の基質液に添加してもよい。以上の各粒子26cの配置、試薬等の種類は検査情報として表示され、被験者の情報は検体情報として表示される。
【0081】
ステップS9において、前記分注チップ25をノズル30に装着し、装着した該分注チップ25を前記ウェル22bに位置させ、該ペルオキシダーゼ溶液を吸引し、移動して血清が収容されている前記ウェル22aに吐出して室温で一定時間維持する。これによって、前記血清中のヒトIgE抗体を前記ペルオキシダーゼで標識化する。
【0082】
ステップS10において、該分注チップ25を、前記検査カートリッジ容器14の前記チップ収容部20の前記分注チップ25が収容されていた位置にまで移動し、前記チップ脱着板48のU字状の溝を前記ノズル30に接近させた後、該ノズル30を上方向に沿って移動させることによって前記チップ収容部20の筒体20aに向けて前記分注チップ25を脱着させる。
【0083】
ステップS11において、前記ノズル30を、前記チップ収容部20の前記担体封入チップ26が収容されている位置の真上にまで移動し、前記ノズル30をZ軸方向に沿って下降させて、該ノズル30の先端を該担体封入チップ26の開口部に挿入させて押し込み装着させる。
【0084】
ステップS12において、該担体封入チップ26をウェル22dにまで移動し、前記洗浄液を、例えば100μリットルを吸引吐出することによって洗浄する。
【0085】
ステップS13において、該担体封入チップ26をウェル22eにまで移動し、該ウェル22eに収容された前記洗浄液を吸引吐出することでさらに洗浄する。
【0086】
ステップS14において、前記ノズル30に装着された担体封入チップ26をウェル22aの位置にまで移動し、該ウェル22aに収容された前記ペルオキシダーゼで標識化されたヒトIgE抗体を含有する血清を該担体封入チップ26の前記細径管26aを満たすように、太径管26bにまで吸引して前記粒子26cと接触させ、約30分間、血清中のヒトIgE抗体と前記アレルゲン物質とを反応させる。
【0087】
ステップS15において、該担体封入チップ26を、前記検査カートリッジ容器14のウェル22fにまで移動し、該ウェル22fに収容された前記洗浄液を例えば、約100μリットルを10回の吸引吐出を繰り返すことで洗浄し、さらに該担体封入チップ26を前記検査カートリッジ容器14のウェル22gにまで移動し、該ウェル22gにまで移送して、洗浄を繰り返す。
【0088】
ステップS16において、該担体封入チップ26を、前記検査カートリッジ容器14のウェル22cにまで移送して、前記基質液としてのルミナール/過酸化水素溶液を吸引して前記標識化物質である前記ペルオキシダーゼと反応を生じさせ、発光の生じた該担体封入チップ26を前記光測定部17の前記半円状孔36aの真上にまで位置させる。化学発光の基質液には光線吸収体を添加してもよい。あるいは、ウェル22dからウェル22iまでのいずれか一つ又はそれ以上のウェルに光線吸収体含有液を収容しておき、そのウェルにまで担体封入チップ26を移動し、そのウェルに収容された光線吸収体含有液を吸引してもよい。また、化学発光の基質液又はそれを収容するウェル22cは温度制御されるとよい。あるいは、担体封入チップ26を温度制御してもよい。温度制御は、後述する温度制御器によって行うことができる。
【0089】
ステップS17において、該担体封入チップ26の細径管26aを該半円状孔36aおよび長孔35aで形成される空隙部分内に挿入する。その際、前記測定プレート35を後方向に移動させて前記長孔35aをその軸方向に沿って移動させて接近させて、前記担体封入チップ26の前記細径管26aを下降させて、該細径管26aを前記チップ挿入部34内に収容させることで前記粒子26cを走査して各粒子26cごとにその発光状態を測定する。
【0090】
ステップS18において、各粒子26cごとにその発光の有無を測定する。各粒子26cはその配列順に、各々アレルギー物質が予め対応づけられており、前記標識化された抗体と結合したアレルゲン物質がその発光により特定されることになる。その測定結果は、前記ボード52の制御部によって解析され、その測定結果が前記熱転写プリンタ機構21に送られ、前記印字ヘッド21aによって前記シール24の備考欄にその測定結果が前記検査情報の1つとして印字され、数字によって表示されることになる。
【0091】
ステップS19において、前記デジタル・カメラ28は、前記ボード52からの指示信号によって、前記検査カートリッジ容器14のシール24上の検体情報および検査情報を含めて画像データとして撮影する。その際、前記制御部の解析部は、該画像データから解析可能なデータを探し、該画像データ中に、前記検査情報に含まれる前記検査内容を示す2次元バーコードデータを探し出すと、該2次元バーコードデータを解析し、解析データを得るとともに、前記制御部の前記データ組合せ部は、前記解析データと前記画像データと組み合わせて出力可能なものとしてメモリに格納する。
【0092】
ステップS20において、前記ノズル30に装着された前記担体封入チップ26は、前記チップ収容部20にまで移動し、該担体封入チップ26が収容されていた位置の真上にまで、該担体封入チップ26を移動し、前記チップ脱着板48のU字状の溝を前記ノズル30に接近させた後、該ノズル30を上方向に移動させることによって前記チップ収容部20の筒体20bの中に該担体封入チップ26を脱着させる。
【0093】
ステップS21で、前記検体検査が完了すると、前記検査カートリッジ容器14を装填した装填箱18が前記筐体12から手動で引き出されて、該検査カートリッジ容器14に貼着された前記シール24を剥がして、別に用意した管理用の台紙等にはりつけて保存し、該検査カートリッジ容器14自体は、廃棄されるが、該筐体12にさらに新たな検査カートリッジ容器14を装填することで新たな検体の検査を行なうことができる。
【0094】
続いて、食品のアレルゲン物質の有無の検査を行なう場合について前記検体検査装置10による処理を説明する。
【0095】
例えば、日本で食品における表示義務となっている材料の7項目、卵、乳、小麦、そば、落花生、えび、かに、さらには、例えば、表示推奨項目となっている18項(桃、豚肉、鶏肉、牛肉等)等から得られたアレルゲン物質(抗体)の中から選択されたアレルゲン物質を、前記担体封入チップ26の前記粒子26cに固定させる。各アレルゲン物質が固定された粒子26cには、固定されたアレルゲン物質の種類に応じた配置にブロッキングを施した後に予め封入しておく。また、いずれの種類のアレルゲン物質をも固定されていない粒子26cも前記担体封入チップ26内に前記アレルゲン物質が固定された各粒子26c間に配置させておく。
【0096】
また、前記検査カートリッジ容器14のウェル22aには、検体として、食品から抽出した抽出液(抗原)を収容し、ウェル22bには、化学発光物質HRP酵素により標識化された各種の標識抗体の溶液を収容しておく。ウェル22cには、化学発光の基質液としてのTMBを収容しておく。ウェル22dからウェル22jには洗浄液またはバッファ液を収容しておく。ウェル22dからウェル22iまでのいずれか一つ又はそれ以上のウェルに、光線吸収体含有液を収容しておいてもよい。あるいは、光線吸収体を化学発光の基質液に添加してもよい。これらの粒子26cの配置および試薬の種類等は検査情報として表示され、被験者の情報は検体情報として手書き等で表示される。
【0097】
ステップS9'において、前記ノズル30を、前記チップ収容部20の前記担体封入チップ26が収容されている位置の真上にまで移動し、前記ノズル30をZ軸方向に沿って下降させて、該ノズル30の先端を該担体封入チップ26の開口部に挿入させて押し込み装着させる。
【0098】
ステップS10'において、前記担体封入チップ26をウェル22dにまで移動し、前記洗浄液を、例えば100μリットル吸引吐出することで洗浄する。
【0099】
ステップS11'において、前記担体封入チップ26をウェル22aにまで移動し、検体としての食品抽出液の20μリットルについて、該担体封入チップ26に対して吸引吐出を行なって前記粒子と接触させる。
【0100】
ステップS12'において、該担体封入チップ26を前記ウェル22eにまで移動し、前記バッファ液を80μリットルについて吸引吐出を300回繰り返すことで、30分間室温でインキュベーションを行なう。その際、必要がある場合には、後述する温度制御器によって温度制御されたバッファ液を用いることが好ましい。
【0101】
ステップS13'において、該担体封入チップ26を前記ウェル22fにまで移動し、前記洗浄液を100μリットルを吸引吐出することで洗浄し、同様にして洗浄液が収容されているウェル22g、22hに前記担体封入チップ26を移動して100μリットル吸引吐出することで全部で3回洗浄を行なう。
【0102】
ステップS14'において、洗浄した前記担体封入チップ26をウェル22bにまで移動して、該ウェル22bに収容された標識抗体を100μリットルについて吸引吐出を300回繰り返すことで30分間インキュベーションを行なう。
【0103】
ステップS15'において、該担体封入チップ26をウェル22iにまで移動し、洗浄液を100μリットルを吸引吐出することにより洗浄し、同様にして該担体封入チップ26をウェル22jにまで移動し洗浄液を100μリットルを吸引吐出することにより洗浄し、洗浄した担体封入チップ26をウェル22cにまで移動し、基質液を60μリットル吸引吐出して化学発光を行なわせる。化学発光の基質液には光線吸収体を添加してもよい。あるいは、ウェル22dからウェル22iまでのいずれか一つ又はそれ以上のウェルに光線吸収体含有液を収容しておき、そのウェルにまで担体封入チップ26を移動し、そのウェルに収容された光線吸収体含有液を吸引してもよい。また、化学発光の基質液又はそれを収容するウェル22cは温度制御されるとよい。あるいは、担体封入チップ26を温度制御してもよい。温度制御は、後述する温度制御器によって行うことができる。
【0104】
以下の処理は、前述したステップS17からステップS21と同様なので説明を省略する。
【0105】
続いて、第2の実施の形態に係る検体検査装置70を図15に示す。
【0106】
該検体検査装置70は、第1の実施の形態に係る検体検査装置10で用いた前記光測定部17の代わりに、光測定部77を用いる点で異なっている。
【0107】
該光測定部77は、少なくとも1の前記光電素子が設けられた前記光電部32と、前記担体封入チップ26の細径管26aが挿入可能な孔76を有し、該孔76を通って挿入された前記担体封入チップ26の細径管26aを囲むように設けられた前記光電部32と接続された光ファイバ37a,37b,37cの各受光端33a,33b,33cが前記孔76を通って挿入された前記細径管26aの軸方向に沿って移動可能に設けられた走査測定部74とを有するものである。すなわち、測定時において、前記各受光端33a,33b,33cが前記筐体12に対して固定されているのではなく相対的に移動可能である点において、第1の実施の形態に係る光測定部17とは異なるものである。
【0108】
図16は、第3の実施の形態に係る検体検査装置80を示すものである。
【0109】
該検体検査装置80は、第1および第2の実施の形態に係る検体検査装置10,70とは、主として、分注チップ25の細径管25aに対して磁力を及ぼしかつ除去することが可能となるように該細径管25に対して接離可能に設けた磁石106を有する磁力手段79、検査カートリッジ容器84に設けられた後述するウェル96についての温度制御を行う温度制御器82、および、該ウェル96を蓋92で閉塞するための蓋移動機構86を設けた点において相違する。
【0110】
該検体検査装置80は、第1および第2の実施の形態に係る検体検査装置10,70と同様に、前記筐体12に組み込まれている。該筐体12内には、複数種類の(この例では、容量の異なる2種類の分注チップ25,125と穿孔用チップ27の3種類)のチップが収容されたチップ収容部20、検体および検体の検査に用いる1または2以上の試薬溶液が収容されまたは収容可能な複数(この例では10個)のウェル22、およびウェル22と離れて設けられ温度制御が行われるウェル96が一列状に配列して設けられかつ前記検体を識別しまたは管理する検体情報および検査内容を示す検査情報が可視記録媒体としてのシール94上に表示され透光性の部材で形成された検査カートリッジ容器84と、該検査カートリッジ容器84に収容された検体と前記試薬とを反応させて所定の発光を得るための自動検査部(85,19)と、該自動検査部による検査の結果として生じた発光を測定する光測定部177と、前記検体情報および前記検査情報を含む前記検査カートリッジ容器84に表示された内容を撮影して画像データを得るデジタル・カメラ28と、前記検査カートリッジ容器84の前記シール94の空欄に検査結果を印字可能な書き込み機構としての熱転写プリンタ21(図9参照)と、前記磁力手段79と、前記温度制御器82と、前記蓋移動機構86と、前記自動検査部(85,19)、光測定部177、デジタル・カメラ28、熱転写プリンタ機構21、磁力手段79、温度制御器82、および蓋移動機構86についての制御を行うためのCPU等の集積回路が設けられたボード52と、を有する。
【0111】
前記検査カートリッジ容器84は、図9、図10に示すように、手動によって前記筐体12から該筐体12外に引出し可能に設けられている。なお、前記検査カートリッジ容器84の温度制御を行うウェル96の容量は、例えば0.2ccである。
【0112】
前記自動検査部(85,19)は、分注機のノズルヘッド85と、前記筐体12内に収納された前記検査カートリッジ容器84に対して、前記ノズルヘッド85を移動可能とする移動機構119とを有する。
【0113】
前記分注機の前記ノズルヘッド85は、前記移動機構119により、筐体12内に収納された前記検査カ−トリッジ容器84に対してその長手方向に相当するX軸方向に移動可能なX軸移動体81と、該X軸移動体81に対して上下方向にガイド柱111に案内されて移動可能に設けられたZ軸移動体83とを有する。前記X軸移動体81には、前記Z軸移動体83に連結したナット部が螺合し、該Z軸移動体83を上下方向に移動させる後述するZ軸移動用ボール螺子113が回転可能に取り付けられるとともに、前記ガイド柱111および該ガイド柱111を介して取り付けられた支持プレート89が取り付けられている。
【0114】
該ノズルヘッド85には、前記Z軸移動体83に取り付けられ、気体の吸引吐出を行なうシリンダと側面に設けられたエアゴム管101を介して連通するノズル100と、前記シリンダ内のピストンを駆動するためのモータ110と、回転可能に取り付けられたボール螺子112とを有する。
【0115】
また、前記X軸移動体81に取り付けられた前記支持プレート89は、前記ボール螺子113を回転可能に支持するとともに、その下側で、前記分注チップ25等のチップを前記ノズル100から脱着させるために該ノズル100の径よりも大きく前記チップの最も太い部分の外径よりも細いU字状の孔が形成されたチップ脱着板118と、前記ノズル100に装着された分注チップ25の細径管25aに対して接離可能に設けられ、該細径管25a内にその外部から磁力を及ぼしかつ除去することが可能な磁石106とを各々前後方向に移動可能に支持し、その支持プレート89の上側では、該チップ脱着板118を駆動するモータ108と、該磁石106を駆動するモータ109とが前記X軸移動体81に取り付けられている。該磁石106およびモータ109は磁力手段79に相当する。
【0116】
デジタル・カメラ28は、前記X軸移動体81にカメラ支持プレート99を介して取り付けられており、筐体12に収納された前記検査カートリッジ容器84の前記シール94上の検体情報および検査情報の全体を撮影可能な位置に前記ノズルヘッド85を移動させて撮影することになる。
【0117】
前記分注機のノズルヘッド85を前記筐体12内に収納された前記検査カートリッジ容器84に対して移動させる移動機構119は、前記ノズルヘッド85の前記X軸移動体81と係わりあって前記検査カートリッジ容器84の長手方向、すなわちX軸方向に沿って案内するレール44と、該ノズルヘッド85をX軸方向に沿って移動させるX軸移動用モータ58(図9参照)と、前記X軸移動体83を上下方向すなわちZ軸方向に沿って案内する前記ガイド柱111と、前記Z軸移動用ボール螺子113と、Z軸移動用モータとを有する。なお、前記ボール螺子112および前記モータ110は吸引吐出機構に相当する。また、前記ガイド柱111、前記Z軸移動用ボール螺子113、Z軸移動用モータは移動機構の内のZ軸移動機構に相当する。
【0118】
なお、本実施の形態に係る検体検査装置80には、書込み機構としての熱転写プリンタ機構21をも有する。該熱転写プリンタ機構21については前述した通りである。
【0119】
前記蓋移動機構86は、前記ウェル96の開口部を覆うための蓋92と、該蓋92を一端に有し他端が回転軸に軸支され該回転軸によって90度回転可能に設けられたアーム93と、前記回転軸を駆動するモータが設けられた回転駆動部95とを有する。
【0120】
また、該検体検査装置80は、さらに前記検査カートリッジ容器84のウェル96の開口部を閉塞した前記蓋92を、前記Z軸移動機構を含む移動機構119によってZ軸方向、X軸方向、Y軸方向に沿って押圧、振盪または移動可能なノズル100を用いて、該蓋92の押圧、振動または移動を可能とする。すなわち、前記Z軸移動機構を含む移動機構119によって駆動される前記ノズル100は蓋閉塞時作用機構に相当する。その際、前記蓋92は、前記回転軸に対してZ軸方向に弾性力で付勢して支持されるようにするのが好ましい。
【0121】
図17に示すように、前記温度制御器82は、前記ウェル収容孔として前記検査カートリッジ容器84の前記ウェル96と嵌合する形状および大きさの先細りの嵌合孔が中央に穿設された温度制御ブロック98と、前記温度制御ブロック98と接触して設けられた前記加熱冷却部としてのペルチェ素子が設けられたペルチェ素子部97と、該ペルチェ素子部97の下側に設けられたフィン103と、該フィン103の下側に設けられたファン収容枠体102とを有し、前記嵌合孔の底から前記ペルチェ素子部97を通りフィン103を通って延びる照射用光ファイバ74aおよび6本の受光用光ファイバ74bと、該照射用光ファイバ74aの一端は、励起光用光源75bと接続し、前記受光用光ファイバ74bの一端は、光電子増倍管72bと接続し、これらの光ファイバ74a,74bの他端74cは、前記照射用光ファイバを中心にして束ねられて前記ウェル収容孔としての前記嵌合孔の底にその先端が位置するように設けられている。
【0122】
ここで、前記光ファイバ74a,74bは前記光測定部177のファイバ収容部174を通り、光電・光源部72に内蔵されている前記励起光用光源72aおよび前記光電子増倍管72bと接続している。
【0123】
続いて、第3の実施の形態に係る検体検査装置80の動作について説明する。
ステップS31からステップS38においては、ノズルヘッド15の代わりにノズルヘッド85を用いる点、ノズル30の代わりにノズル100を用いる点、検査カートリッジ容器14の代わりに検査カートリッジ容器84を用いる点を除いて、ステップS1からステップS8で説明した通りである。
【0124】
図14(D)の状態で、以下に示す処理が行われる。
ここでは、第1の実施の形態で説明したアレルギー検査を行なう代わりに、DNAまたはゲノムを、温度制御してPCR処理を行なう場合の動作を説明する。
【0125】
前記検査カートリッジ容器84のウェル22aには、例えば、被験者から採取した口腔粘膜等の検体が収容されている。ウェル22bには、ゲノム抽出用試薬が収容されている。
ウェル22cには磁性粒子懸濁液が収容されている。ウェル22dには、乖離液が収容されている。ウェル22eは空である。ウェル22fからウェル22iには、PCR用試薬としてプライマー含有液等および洗浄液が収容されている。ウェル22jにはミネラルオイルが収容されている。また、チップ収容部20には、2種類の分注チップ25、125、および穿孔用チップ27が収容されている。ウェル22fからウェル22iまでのいずれか一つ又はそれ以上のウェルに、光線吸収体含有液を収容しておいてもよい。あるいは、光線吸収体をプライマー含有液に添加してもよい。
【0126】
ステップS39において、前記ノズル100を前記チップ収容部20の端に収容されている分注チップ25の位置にまで移動し、下降させることで該ノズル100にゲノム抽出用として装着させ、該分注チップ25を前記移動機構119によってウェル22bにまで移動し、吸引吐出機構を用いて該当する抽出用試薬を吸引する。該分注チップ25を前記検体が収容されているウェル22aにまで移動して、該分注チップ25に吸引した該液体を該ウェル22a内に吐出する。また、該分注チップ25をウェル22cにまで移動して、磁性粒子懸濁液を吸引して該分注チップ25を前記ウェル22aにまで移動して吐出し、その他抽出に必要な試薬があればそれらを該分注チップ25を用いて前記ウェル22aにまで移送して吐出する。ウェル22aに収容されたこれらの混合液は吸引および吐出を繰り返すことによって攪拌かつインキュベートして反応させ、抽出されたDNAを前記磁性粒子の表面に結合して捕獲する。
【0127】
ステップS40において、前記磁力手段79を用いて、前記磁石106を、該分注チップ25の細径管25aに接近することによって磁場を内部に及ぼして前記磁性粒子を前記細径管25aの内壁に吸着させることによってDNAを分離する。
【0128】
ステップS41で、ゲノム抽出用の該分注チップ25を、前記DNAを捕獲した磁性粒子を該内壁に吸着させたまま前記移動機構119によって移動させて、前記乖離液を収容するウェル22dに位置させ、該分注チップ25の先端口部を該ウェル22d内に挿入し、前記磁性粒子を内壁に吸着したまま吸引吐出を繰り返すことによって前記磁性粒子から前記DNAを乖離する。磁性粒子から乖離したDNAを含有する該DNA溶液を空の前記ウェル22e内に吐出させて収容した後、該ゲノム抽出用の分注チップ25を内壁に前記磁性粒子を吸着したまま前記チップ収容部20の元の収容位置にまで移送して前記チップ脱着板118を用いて脱着する。
【0129】
ステップS42で、該ノズルヘッド85を移動させて、該ノズルヘッド85の前記ノズル100を前記チップ収容部20の真ん中の位置に収容されている新たなPCR用の分注チップ125にまで移動させた後、該ノズル100をZ軸移動機構によって、下降させることによって、収容されたPCR用の分注チップ125の装着用開口部に前記ノズル100を挿入させて装着させる。
【0130】
ステップS43において、該ノズルヘッド85を移動させて、図17に示すように、前記アーム93を90度回転することによって、前記蓋92をウェル96の開口部を開いてから前記ウェル96の開口部を外部に露出させる。次に、PCR用の分注チップ125を用いて、ウェル22fからウェル22iまでに収容されているPCR用の試薬、例えば、蛍光物質で標識化されたプライマー含有液を吸引して、前記ウェル96内に分注することで収容する。以上の工程を必要な試薬を分注し終わるまで繰り返す。
【0131】
ステップS44において、前記分注チップ125を洗浄した後、前記ノズルヘッド85を移動して、前記ウェル22eに収容されている抽出されたDNA液を吸引して前記ウェル96内に分注する。その後、該分注チップ125を用いて前記ウェル22jにまで移動し、前記ミネラルオイルを吸引し、前記ウェル96内に吐出することで導入する。
【0132】
ステップS45において、前記蓋92を90度回転させて前記ウェル96の開口部を覆う。
【0133】
ステップS46において、前記ノズル100を下降させてZ軸移動機構を用いて前記蓋92を押圧する。
【0134】
ステップS47において、前記ウェル96に対して前記温度制御器82によって、PCR法に従った温度制御を行なう。PCR法に従った温度制御は、投入された2本鎖の検体のDNAを、一本鎖に変性するために前記ウェル96の温度を94℃に設定し、次に、一本鎖のDNAとプライマーとのアニーリングまたはハイブリダイゼイションを行わしめるために、前記ウェル96の温度を50℃から60℃に設定する。次に、前記一本鎖に相補的なDNA鎖を合成するために前記温度を74℃に設定してインキュベートするという操作を1サイクルとして、所定回繰り返して、例えば、約数分間行なうという温度制御を行う。プライマー含有液には光線吸収体を添加してもよい。あるいは、ウェル22fからウェル22iまでのいずれか一つ又はそれ以上のウェルに光線吸収体含有液を収容しておき、そのウェルにまで担体封入チップ125を移動し、そのウェルに収容された光線吸収体含有液を吸引してもよい。
【0135】
その際、前記温度制御ブロック98の前記ウェル収容孔としての嵌合孔に設けた光ファイバ74a,74bを用いて励起光を照射し、発生する蛍光強度を光ファイバ74bを介して受光し、光電子増倍管72bにより電気信号に変えられてその蛍光強度が測定されることになる。
【0136】
ステップS48において、その測定結果は、前記ボード52の制御部によって解析され、その測定結果が前記熱転写プリンタ機構21に送られ、前記印字ヘッド21aによって前記シール24の備考欄にその測定結果が前記検査情報の1つとして印字され、数字によって表示されることになる。
【0137】
ステップS49において、前記デジタル・カメラ28は、前記ボード52からの指示信号によって、前記検査カートリッジ容器84のシール94上の検体情報および検査情報を含めて画像データとして撮影する。その際、前記制御部の解析部は、該画像データから解析可能なデータを探し、該画像データ中に、前記検査情報に含まれる前記検査内容を示す2次元バーコードデータを探し出すと、該2次元バーコードデータを解析し、解析データを得るとともに、前記制御部の前記データ組合せ部は、該解析データと前記画像データと組み合わせて出力可能なものとしてメモリに格納する。
【0138】
ステップS50において、前記ノズル100に装着された前記分注チップ125は、前記チップ収容部20にまで移動し、該分注チップ125が収容されていた位置の真上にまで、該分注チップ125を移動し、前記チップ脱着板118のU字状の溝を前記ノズル100に接近させた後、該ノズル100を上方向に移動させることによって前記チップ収容部20の筒体20bの中に該分注チップ125を脱着させる。
【0139】
ステップS51で、前記検体検査が完了すると、前記検査カートリッジ容器84を装填した装填箱18が前記筐体12から手動で引き出されて、該検査カートリッジ容器84に貼着された前記シール94を剥がして、別に用意した管理用の台紙等にはりつけて保存し、該検査カートリッジ容器84自体は、廃棄されるが、該筐体12にさらに新たな検査カートリッジ容器84を装填することで新たな検体の検査を行なうことができる。本実施の形態によれば、蓋92を前記移動機構を用いて押圧等を行なうことができるので、前記ウェル96の開口部の閉塞を確実にし、かつ、結露を防止して蓋92の開放を容易に行なうことができる。
【0140】
図18、図19は、第4の実施の形態に係る検体検査装置180を示すものである。
なお、図16に示す検体検査装置80と同一のものについては、同一の符号を付してまたは付さずに説明を省略する。
【0141】
本検体検査装置180は、図16に示す第3の実施の形態に係る検体検査装置80とは、ノズルヘッド185には、気体の吸引吐出を行なうシリンダとエアゴム管201を介して連通する分注チップ25等が装着可能なノズル200と、Z軸方向に移動可能なZ軸移動体83と連動し、前記該ノズル200が取り付けられたノズル支持体183と、該ノズル支持体183に取り付けられ検査カートリッジ容器184の前記ウェル96の開口部を覆う透光性のある蓋192の上方から光の測定を行なうため内部に受光用光ファイバ174aの端部および照射用光ファイバ174bの端部が設けられた測定用ロッド172(図19参照)とを有する点で相違する。
【0142】
本検体検査装置180は、その他、第3の実施の形態に係る検体検査装置80と相違し、蓋移動機構86を有しない代わりに、蓋192は、検査カートリッジ容器184のチップ収容部120に、前記担体封入チップ26の代わりに予め収容され、前記ノズル200の先端または前記測定用ロッド172の先端に、前記Z軸移動機構により前記ノズル200および前記測定用ロッド172を下降させることによって装着させて、押圧等の際または測定の際に用いるものである。したがって、検査カートリッジ容器184についても、蓋192をチップ収容部120に収容可能とする点で相違する。
【0143】
また、図19に示すように、光測定部277と、温度制御器182についても、第3の実施の形態に係る光測定部177および温度制御器82とは相違する。
該光測定部277は、前記測定用ロッド172内に前記受光用光ファイバ174aの端部および照射用光ファイバ174bの端部が設けられるとともに、該受光用光ファイバ174aの他方の端部は、光電素子172aと接続し、前記照射用光ファイバ174bの他方の端部は、光源部172bと接続する。
【0144】
また、前記温度制御器182は、ウェル収容孔として前記検査カートリッジ容器184の前記ウェル96と嵌合する形状および大きさの先細りの嵌合孔が中央に穿設された温度制御ブロック198と、前記温度制御ブロック198と接触して設けられた前記加熱冷却部としてのペルチェ素子が設けられたペルチェ素子部197と、該ペルチェ素子部197の下側に設けられたフィン203と、該フィン203の下側に設けられたファン収容枠体102とを有するのみで、前記嵌合孔の底には光ファイバの端部は設けられておらず、また、フィン203等を光ファイバは通っていない。
【0145】
図20、図21は、前記蓋192を示す。該蓋192は、前記測定用ロッド172およびノズル200が装着可能な装着用開口部193と、前記ウェル96の開口部に嵌合する嵌合部194とを有するものである。本実施の形態に係る装置によれば、蓋移動機構を設けることなく蓋でウェル96の開口部を閉塞することができるので、装置の構造を簡単化することができる。また、検体に汚染されるおそれがある蓋は、検査カートリッジ容器に収容するので検査終了後にチップのように検査カートリッジ容器とともに処分することができるので、安全性の高い管理を行なうことができる。
【0146】
続いて、第5の実施の形態に係る検体検査装置について、図22に基づいて説明する。
本実施の形態に係る検体検査装置280は、例えば、長さ250〜400mm(X軸方向)、幅140〜200mm(Y軸方向)、高さ300〜500mm(Z軸方向)程度の筐体内に設けられた、検体および該検体の検査に用いる1または2以上の検査用器具としての複数種類(この例では3種類)のチップが収容されたチップ収容部220a,220b,220cが一列状に配列されかつ該検体を識別しまたは管理する検体情報および検査内容を示す検査情報が可視的記録媒体としてのシール224上に表示され平行に並んで配列された2つの検査カートリッジ284と、検体および検体の検査に用いる1または2以上の試薬溶液等が収容されまたは収容可能な複数(この例では、10個)の収容部としてのウェル322が一列状に設けられかつ該検体を識別しまたは管理する検体情報および検査内容を示す検査情報が可視記録媒体としてシール324上に表示された透光性の部材で形成され平行に並んで配列された2つの検査カートリッジ容器384と、2つの該検査カートリッジ容器384に収容された検体と前記試薬とを反応させて所定の光学状態(例えば、発光)を得るための自動検査部(285,289)と、該自動検査部による検査の結果として生じた前記光学状態を測定する光測定部、デジタル・カメラ228と、前記検査カートリッジ容器284,384の前記シール224,324の空欄に検査結果を印字可能な熱転写プリンタ機構と、前記自動検査部(285,289)、光測定部、デジタル・カメラ228、および熱転写プリンタ機構について制御を行うためのCPU等の集積回路が設けられたボードとを有する。個々で、符号285aは、主として、前記ノズル230をZ軸方向に移動させるZ軸移動機構が設けられたユニットを示す。
【0147】
ここで、2本のカートリッジ容器284は、前記検査用器具として複数種類(この例では3種類)のチップである、分注チップ225、担体封入チップ226および穿孔用チップ227が各々チップ収容部220a,220b,220cに収容されまたは収容可能である。分注チップ225については、既に、前記ノズルヘッド285のノズル230に装着されているので、前記収容部220aは空になっている。
【0148】
該2本のカートリッジ容器284には、その基板284aには、チップ収容部220a,220b,220cの開口部が設けられている。その基板284aの媒体取り付け部としてのシール貼着領域には、検体情報欄224aおよび検査内容を示す検査情報欄224bが設けられたシール224が着脱可能に貼られている。ここで、前記検体情報欄224aにはQRコードが予め印刷され、かつ手書きの記入欄が設けられ、検査情報欄224bには、検査情報が予め印刷され、かつ手書きの記入欄や印字用の空欄が設けられている。同様に、2本のカートリッジ容器384には、その基板384aには、10個の試薬溶液や検体溶液が収容されたウェル322a−322jが設けられている。その基板384aの媒体取り付け部としてのシール貼着領域には、検体情報欄324aおよび検査内容を示す検査情報欄324bが設けられたシール324が着脱可能に貼られている。ここで、前記検体情報欄324aにはQRコードが印刷されかつ手書きの記入欄が設けられ、検査情報欄324bには、検査情報が印刷されかつ手書きの記入欄や印字用の空欄が設けられている。
【0149】
なお、該検体検査装置に配列された全カートリッジ容器284,384は、同一の検査に用いられる場合には、検査情報については共通する内容をもつことになる。また、1列状に(X軸方向に沿って)配列された検査カートリッジ容器284,384列は共通の検体情報をもつことになるが、他の列の検査カートリッジ容器284,384列が異なる検体に対応する場合には、前記検体情報とは異なる検体情報をもつことになる。
【0150】
前記自動検査部(285,289)としては、2本のノズル230,230が設けられ、各ノズル230には、分注チップ225が各々着脱可能に装着され、各分注チップ225は前記2列のカートリッジ容器284、384に沿って移動可能に設けられている。なお、符号244a,244bは、ノズルヘッド285をX軸方向に移動させるためのレールであリ、移動機構289に属するものである。
【0151】
なお、ここでは、デジタル・カメラ228はX軸方向に沿った回転軸をもつ回転機構228aによって一定角度回転可能に設けることによって、1台で、2列の検査カートリッジ容器284,384をカバーすることができる。また、前記光測定部、熱転写プリンタ機構、光測定部についても、Y軸方向に移動可能に設けることによって、1台で、2列の検査カートリッジ容器に対応することができるようにして、装置規模をコンパクトに形成している。本実施の形態によれば、複数の検査を並行して処理することができるので、効率が良くかつ迅速な処理を行なうことができることになる。
【0152】
以上説明した各実施の形態は、本発明をより良く理解させる為に具体的に説明したものであって、別形態を制限するものではない。したがって、発明の主旨を変更しない範囲で変更可能である。例えば、前記実施の形態では、アレルゲン物質、食品及びDNAの場合についてのみ説明したが、その他のタンパク質、糖鎖、DNA物質、RNA等の検査であっても当然適用され得る。また、以上の説明で用いた数値、回数、形状、個数、量等についてもこれらの場合に限定されるものではない。
【0153】
また、前記検査カートリッジ容器の構成として収容すべきチップ、蓋、ロッド等の種類、チップ、蓋、ロッドの構造もしくは個数、ウェルの個数もしくは容量、または、検体情報および検査情報の内容等については例を示すものであって、これらは、検体や検査内容に応じて適宜変更することができる。
【0154】
また、以上の各構成要素、例えば、各ノズルヘッド、各種チップ、各蓋、各ノズル、各温度制御器、各光測定部、各検査カートリッジ容器、または磁力手段等は、適当に変形しながら任意に組み合わせることができる。
【0155】
例えば、前記担体封入チップを用いるとともに、温度制御がされるウェルを有する検査カートリッジ容器、および前記温度制御器を用いることができる。また、前述した試薬や検体や処理工程は例を示すものであって、他の試薬や検体や処理工程を使用することももちろん可能である。
以上の例では、1列または2列の検査カートリッジ容器を検体検査装置に装填して用いる場合のみを説明したが、該場合に限られることなく、3列以上についても適用することができることはいうまでもない。また、2列の検査カートリッジ容器を装填して用いる場合にも、この例に限られることなく、第1の実施の形態で用いた検査カートリッジ容器を並べて装填して用いることももちろん可能である。
【0156】
以下に、本発明を実施例により具体的に説明するが、本発明の範囲はこれらに何ら影響されることはない。
【実施例】
【0157】
本実施例においては、全長50mm程度のキャピラリーによるTSH検出において、ダイナミックレンジ103を確保するための、信号光局在化に関する基礎的検証を行った。
【0158】
(要旨)
ルミノール、過酸化水素、酵素(西洋わさびペルオキシダーゼ(以下、「HRP」))を用いた化学発光系を目的物質の検出に用いた。この系において、信号光拡散の原因は以下のとおりに分類される。
【0159】
A、光学的拡散
A−1、キャピラリー壁が関わる拡散
A−2、反応液(水)中の伝播による拡散
A−3、測定器の分解能
A−4、その他
B、物質の拡散
B−1、発光体そのもの(活性化ルミノール等)の拡散
B−2、発光を触媒する物質(活性化過酸化水素または、HRP等)の拡散
B−3、その他
本実施例では、A−1、A−2について、信号光拡散との相関を検証した。結果、検証した要素全てが、信号光拡散の要因となっており、定量的には、B(恐らくB−2)が定量的に最大の要因であった。さらに、各要因に対して、
B 反応及び検出工程において、キャピラリーに対しプローブビーズを固定すること
B−2、基質吸引時に低温を保つこと
A−2、反応液自体の遮光性を高めること
A−1、キャピラリーの透明度を高めること
等の対策を施すことで、信号光拡散についての有意な改善が見込めることが示唆された。
【0160】
(実験方法)
3−1 光学的拡散についての検証実験
(1)φ1mm ZrO2ビーズ表面に、アサヒペン社製夜光塗料(若草色)を被覆した。これを3度繰り返し厚塗りし、必要に応じてバリや、余剰部分を削りとった。
(2)これらビーズを、実験条件に応じてポリプロピレン(1 mmのヘイズ値25%)又は、ポリカーボネート(1 mmのヘイズ値0.1%)製キャピラリー(φ1.1mm、L50mm)に充填した。このとき、キャピラリーホルダー側から、遮光ビーズ20個/夜光プローブビーズ1個/遮光ビーズ10個の順で配置させた。
(3)キャピラリーホルダー側及び吸引口側をかしめ、実験条件に応じて液体を吸引した。
(4)必要に応じて、光を照射し夜光プローブビーズを蓄光させた。
(5)これをLuBEA(プレシジョン・システム・サイエンス社)に装着、検出のみのプロトコルを実行し、発光強度の分布を計測した。
【0161】
3−2 物質の拡散についての検証実験
プローブビーズへの抗体固層及びBISTの作成
(1)TSH抗体を担持したビーズの作成
適量のTSH抗体を含む緩衝液中に球状担体(ビーズ)を浸漬させることで、抗体をビーズに吸着させた。洗浄工程を経て、市販のブロッキング剤を適量含む緩衝液中に、抗体を担持したビーズを浸漬させ、ブロッキング処理を行った。緩衝液で数回洗浄することで、抗体担持ビーズが調整された。
【0162】
(2)遮光ビーズの作製
市販のブロッキング剤を適量含む緩衝液中に、遮光ビーズを浸漬させ、ブロッキング処理を行った。緩衝液で数回洗浄することで、遮光ビーズを調整した。
【0163】
(3)BISTの作製
BISTキャピラリーの下端側をかしめた後、遮光ビーズ10個、抗体固層ビーズ1個、遮光ビーズ10個又は40個の順に充填し、上端側をかしめた。上端側のかしめ位置は、ビーズ配置40-1-10でビーズが動かない位置とし、ビーズ配置10-1-10の場合も40-1-10とほぼ同位置でかしめた。
【0164】
反応条件
(1)表1のようにGC seriesカートリッジに試薬を添加し、SX-12GCにセットした。SX-12GCコンボラックのHole-2にSheath DN-100とともにBISTをセットした。(”well mixed”および”Not mixed”は「BIST-ELISA_ver.5BS01.pcl」、”Fixed bead”は「BIST-ELISA_ver.5BS01-fixedbead.pcl」を使用)約110分で反応が終了する。
(2)反応が終了した後、well 1の溶液をキャピラリー内に満たし測定まで保存した。測定直前にキャピラリー内の溶液を抜き去った後、検出試薬(サーモフィッシャーサイエンティフィック社製SuperSignal West Femto Maxmum Sensitivity Substrate)を80ul吸引した。その後LuBEAにて直ちに測定、または3回転倒混和し攪拌した後測定した。
【0165】
【表1】

【0166】
(結果)
4−0 コントロール
信号光局在の程度について、発光強度が10,000カウント程度となるTSH(13uIU/mL)を用いて、3−2の手順で、BISTの信号光強度分布を計測した。なお本実験には、キャピラリー:ポリプロピレン製、プローブビーズ:ZrO2(ロットID4)、遮光ビーズ:SiCを用いた。
【0167】
図1(a)には、プローブビーズから一定程度離れた位置の信号光の拡散を比較するため、ピークの発光強度を10,000カウントに規格化して表示すると同時に、図1 (b)に生データをフルスケールで記載した。図中の横軸には、実際のプローブビーズと遮光ビーズの配置の概要を模式的に重ねた。
【0168】
図1 (a)では、信号光の発光強度を10,000カウントに規格化してあるため、103のダイナミックレンジを確保するためには、同一キャピラリー中で発光強度10カウントを良好に検出できることが一つの目安となる。これに対して、現状の信号光の拡散は、ベースライン及びノイズレベル(ベースラインのばらつき)とも、発光強度10カウントを上回る水準であった。またキャピラリー中で、ビーズが存在する領域(ビーズ領域)に比べ、ビーズが存在しない領域(非ビーズ領域)の方が検出された光の強度が強かった。
【0169】
4−1 光学的拡散についての検証
4−1−1 キャピラリー壁が関わる光の拡散(A−1)
キャピラリー壁内の光伝播及び、キャピラリー壁面反射等、キャピラリー壁が関わる光拡散の程度を検証するため、透明度の異なる2種類のキャピラリー(ポリプロピレン製(PP):比較的低透明度)及び、ポリカーボネート製(PC):比較的高透明度)を用いて、物質の拡散を無視できる3−1の手順でBISTの信号光強度の分布を計測した。なお本実験では、遮光ビーズ:SiCを用いた。
【0170】
図2には、プローブビーズから一定程度離れた位置の信号光の拡散を比較するため、ピークの発光強度を10,000カウントに規格化して表示すると同時に、図中の横軸には、実際のプローブビーズと遮光ビーズの配置の概要を模式的に重ねた。
【0171】
結果、PP、PCキャピラリーともに、物質の拡散も含むと予想される図1のデータとの比較において、信号光の拡散は低い水準であった。また、PCの信号光の拡散は、PPに比べ低水準であった。
【0172】
4−1−2、反応液(水)中の伝播による光の拡散(A−2)についての検証
キャピラリーを満たす反応液(水)中を伝播する信号光拡散の程度の検証するため、物質の拡散を無視できる3−1の手順で、
・キャピラリー中の水の有無による信号光強度の分布の違い
・反応液の着色による光透過率抑制の影響
を評価した。
【0173】
なお本実験では、キャピラリー:PC、遮光ビーズ:SiCを用い、PMTからのデータ収集に分周回路は使用しなかった。また、着色反応液としては、株式会社呉竹製「清書用ぼくてき」(墨汁)を200倍希釈した水溶液を用いた。
【0174】
図3には、プローブビーズから一定程度離れた位置の信号光の拡散を比較するため、ピークの発光強度を10,000カウントに規格化して表示すると同時に、図中の横軸には、実際のプローブビーズと遮光ビーズの配置の概要を模式的に重ねた。
【0175】
結果、キャピラリー中の水を排出した場合(air)、キャピラリーが水で満たされている場合(water)に比べ、信号光の拡散は低い水準に抑制された。さらに反応液を黒色に染める(Black water)ことによる遮光性の向上は、信号光の局在化にもっとも効果が高かった。
【0176】
4−1−3 光学的拡散についての検証のまとめ
4−1−1、4−1−2の信号光拡散についての基礎的検証から、1)キャピラリーの透明度を高める、2)反応液(水)中を伝播する信号光の拡散を抑制することが、信号の局在に有効であることが示唆された。図4のPP&Waterでは、同一キャピラリー中(プローブビーズ間隔、約20個以内)で発光強度10カウントを検出するのは困難であるが、PC& AirやPC&Black waterでは、検出可能であった。
【0177】
4−2 物質の拡散についての検証
4−2−1 ビーズの運動の影響
検出光強度が10,000カウントを超えるような比較的高濃度のTSHを検出する際に見られる、図1(a)のような信号光の乱れた拡散の原因として、物質(発光体又は、発光を触媒する物質)の拡散が考えられる。そこで、物質の拡散を助長する一つの要素として、反応工程におけるプローブビーズのキャピラリー内部での運動に着目した。現状のBIST構成において、ビーズはキャピラリー中の一定範囲内を自由に運動することができる。反応工程中のビーズの運動と、信号光の拡散の相関を検証するため、3−2の手順及び、表2の3種のプロトコルにてBISTを調整し、TSH検出に際しての信号光の分布を計測した。図5には、プローブビーズから一定程度離れた位置の信号光の拡散を比較するため、ピークの発光強度を10,000カウントに規格化して表示すると同時に、図中の横軸には、実際のプローブビーズと遮光ビーズの配置の概要を模式的に重ねた。
【0178】
結果、現行の標準プロトコルである”well mixed”は、非ビーズ領域に最大で50カウントを超える信号光の乱れた拡散が見られたのに対し、”Not mixed”及び”Fixed bead”については、ビーズ領域、非ビーズ領域に関わらず、この部分が大幅に低減された。
【0179】
【表2】

【0180】
4−2−2 反応基質を吸引することの影響
キャピラリー内のビーズ運動抑制による、物質拡散由来の信号光拡散の低減効果について、繰り返し再現性を確認するため、比較的高濃度域でのTSH検出繰り返し行う実験を試みた。実験は、3−2の手順に従い、13uIU/mL(n=5)、50uIU/mL(n=6)、及び100uIU/mL(n=3)の3水準のTSH濃度で信号光拡散の程度を検証した。図6は、プローブビーズから一定程度離れた位置の信号光の拡散を比較するため、ピークの発光強度を10,000カウントに規格化して表示すると同時に、図中の横軸には、実際のプローブビーズと遮光ビーズの配置の概要を模式的に重ねた。
【0181】
図6から明らかなように、転倒混和による攪拌を行った4−2−1の実験で見られたような、極端にピークから離れた位置での信号光の拡散は見られなかった。ところが、複数のデータを重ねることで、信号光ピークの左斜面(z_pulsの若い領域)に、細かい特徴的なノイズが散発的に現れることが明らかとなった。
【0182】
この結果は、反応基質の吸引が、発光体拡散の原因となっている可能性を示唆する。そもそも本検出系では、プローブビーズ上に固定された酵素と基質の反応により、酵素的に化学発光が誘引され、TSHが検出される。図6において、反応基質はピークの右側(z_pulsの大きい側)から左に向かって吸引されるため、プローブビーズよりも左側(z_pulsの小さい側)に位置する反応基質は全て、プローブビーズに接触していることになる。この基質吸引時の、基質とプローブビーズの瞬間的な接触により、発光体がピークの左側のみに拡散された可能性が考えられる。
【0183】
基質吸引時の、基質とプローブビーズの瞬間的な接触によるノイズの発生という仮説を検証するため、基質吸引時の酵素活性に大きな影響を及ぼす温度に着目し、次の実験を試みた。プローブビーズ上の酵素活性が最大となる40℃付近と、酵素活性が低下する4℃付近で、それぞれ基質吸引を行い、特徴的ノイズの発生を比較した。結果を図7に示す。図6同様、プローブビーズから一定程度離れた位置の信号光の拡散を比較するため、ピークの発光強度を10,000カウントに規格化して表示すると同時に、図中の横軸には、実際のプローブビーズと遮光ビーズの配置の概要を模式的に重ねた。
【0184】
図7において、赤線が40℃、青線が4℃での基質吸引を行ったときのデータである。図から明らかなように、40℃での基質吸引においては、ピークの左側に顕著なノイズが検出されたのに対し、4℃での基質吸引ではノイズは検出されなかった。この結果は、前述の仮説を支持し、また、基質吸引時の温度制御がノイズ低減に有意な効果を持つことが示された。
【0185】
(考察)
4−1、4−2の検証実験から、TSH検出系に見られる信号光の拡散の要因は、光学的拡散と、物質の拡散に大別されることが示唆された。また4−2の検証から、キャピラリー内のビーズの運動を抑制すること、及び基質吸引時の温度を最適化することで、信号光の拡散が有意に改善される可能性が示された。しかし、計測上の有効な信号強度を、S/N比の10倍と仮に定義すると、4−2の改善においても、同一キャピラリー中での発光強度10カウントの検出を可能にするまでには至っていないと思われる。
【0186】
そこで、図5〜7の残存の信号光拡散の要因のうち、4−1で検証した、光学的拡散の成分がどの程度影響しているかを見積もるため、図2〜4の”PP & water”(夜光ビーズ及び遮光ビーズをPPキャピラリーに充填し、内部を水で満たした系)における信号光分布を図5〜7に重ねた(図8)。
【0187】
図8には、プローブビーズから一定程度離れた位置の信号光の拡散を比較するため、ピークの発光強度を10,000カウントに規格化して表示すると同時に、図中の横軸には、実際のプローブビーズと遮光ビーズの配置の概要を模式的に重ねた。
【0188】
図8のとおり、キャピラリー内のビーズの運動を抑制し、物質の拡散を大幅に抑制した”Not mixed”及び”Fixed bead”における残存の信号光拡散(z_puls= 50-200の領域)は、光学的拡散のみを有する”PP & water”と良い一致を示した。このことから、キャピラリー内のビーズ運動の抑制によって、物質の拡散由来の信号光拡散が大部分低減されたと考察される。加えて、3−2での検証のとおり、A-1)キャピラリー由来の光学的拡散、A-2)反応液中を伝播する光学的拡散を抑制することで、BISTによる測定のダイナミックレンジを大幅に増加させることが可能となる。
【産業上の利用可能性】
【0189】
本発明の方法及び装置は、複数の生体分子や生体分子と結合する低分子の検出及び定量的な解析に利用することができる。
【符号の説明】
【0190】
10、70、80、180、280 検体検査装置
14、84、184、284、384 検査カートリッジ容器
15、85、185、285 ノズルヘッド
17、77、177、277 光測定部
24、94、224 シール
25、125、225 分注チップ
26、226 担体封入チップ(固相内蔵チップ)
28、228 デジタル・カメラ
30、100、200、230 ノズル
92、192 蓋
【特許請求の範囲】
【請求項1】
単一の容器内に収容された、複数種の目的物質を捕獲するための物質がそれぞれ固定された複数の担体が、液体に浸漬された状態で発光し、この発光を容器外部から測定することで、複数種の目的物質を同時に検出又は定量するための分析方法であって、前記複数担体からの発光信号の光学的交差を抑制するため、前記発光波長帯における前記液体の光線透過率が抑制又は調整されていることを特徴とする前記方法。
【請求項2】
発光が化学発光又は蛍光であり、発光の波長帯が340-900nmである請求項1に記載の方法。
【請求項3】
光線吸収体の添加により、液体の光線透過率が抑制又は調整されている請求項1又は2に記載の方法。
【請求項4】
光線吸収体が微粒子である請求項3記載の方法。
【請求項5】
液体の光線透過率が、光路長1mm当たり80%以下であるように抑制又は調整されている請求項1〜4のいずれかに記載の方法。
【請求項6】
容器と担体表面形状と容器外部に位置する測光部の相対的な位置関係により、測光部と複数の各担体間の光路長を幾何学的に規定することで、測光部に最近接の担体からの発光信号を選択的に受光する請求項1〜5のいずれかに記載の方法。
【請求項7】
担体が球状である請求項1〜6のいずれかに記載の方法。
【請求項8】
担体が1次元的又は2次元的に配置している請求項1〜7のいずれかに記載の方法。
【請求項9】
容器の構成材料が、厚み1 mmのヘイズ値で20%以下である請求項1〜8のいずれかに記載の方法。
【請求項10】
発光又は放射の波長帯における容器の屈折率が1.6以下である請求項1〜9のいずれかに記載の方法。
【請求項11】
単一の容器内に収容された、複数種の目的物質を捕獲するための物質がそれぞれ固定された複数の担体を含む請求項1〜10のいずれかに記載の方法に用いるための検査キット。
【請求項12】
容器内に収容されている担体に目的物質を捕獲するための物質が固定され、前記物質が、外部から添加される液体中に含有される発光能を有する物質との反応を介して、前記発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する方法であって、前記液体を添加する際に、前記液体及び/又は容器の温度を調節することを含む前記方法。
【請求項13】
発光能を有する物質が、ルミノール、シュウ酸ジフェニル、ルテニウム錯体、塩化オキサリル、ルシフェリン、AMPPD、インドール、ポリフェノール、ジオキセタン、及びこれら物質の誘導体からなる群より選択される少なくとも1種の化合物である請求項12記載の方法。
【請求項14】
液体及び/又は容器の温度を15℃以下に調節する請求項12又は13に記載の方法。
【請求項15】
液体を添加する際に、担体が容器に対して固定されている請求項12〜14のいずれかに記載の方法。
【請求項16】
発光又は放射の波長帯における液体の光線透過率を抑制又は調整する手段と、目的物質を発光又は放射現象により光学的に検出及び/又は定量する手段とを備えた、請求項1〜10のいずれかに記載の方法に用いる装置。
【請求項17】
液体の温度を調節する手段、発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する手段とを備えた、請求項12〜15のいずれかに記載の方法に用いる装置。
【請求項18】
さらに、容器の温度を調節する手段を備えた、請求項17記載の装置。
【請求項19】
容器の温度を調節する手段、発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する手段とを備えた、請求項12〜15のいずれかに記載の方法に用いる装置。
【請求項20】
さらに、液体の温度を調節する手段を備えた、請求項19記載の装置。
【請求項1】
単一の容器内に収容された、複数種の目的物質を捕獲するための物質がそれぞれ固定された複数の担体が、液体に浸漬された状態で発光し、この発光を容器外部から測定することで、複数種の目的物質を同時に検出又は定量するための分析方法であって、前記複数担体からの発光信号の光学的交差を抑制するため、前記発光波長帯における前記液体の光線透過率が抑制又は調整されていることを特徴とする前記方法。
【請求項2】
発光が化学発光又は蛍光であり、発光の波長帯が340-900nmである請求項1に記載の方法。
【請求項3】
光線吸収体の添加により、液体の光線透過率が抑制又は調整されている請求項1又は2に記載の方法。
【請求項4】
光線吸収体が微粒子である請求項3記載の方法。
【請求項5】
液体の光線透過率が、光路長1mm当たり80%以下であるように抑制又は調整されている請求項1〜4のいずれかに記載の方法。
【請求項6】
容器と担体表面形状と容器外部に位置する測光部の相対的な位置関係により、測光部と複数の各担体間の光路長を幾何学的に規定することで、測光部に最近接の担体からの発光信号を選択的に受光する請求項1〜5のいずれかに記載の方法。
【請求項7】
担体が球状である請求項1〜6のいずれかに記載の方法。
【請求項8】
担体が1次元的又は2次元的に配置している請求項1〜7のいずれかに記載の方法。
【請求項9】
容器の構成材料が、厚み1 mmのヘイズ値で20%以下である請求項1〜8のいずれかに記載の方法。
【請求項10】
発光又は放射の波長帯における容器の屈折率が1.6以下である請求項1〜9のいずれかに記載の方法。
【請求項11】
単一の容器内に収容された、複数種の目的物質を捕獲するための物質がそれぞれ固定された複数の担体を含む請求項1〜10のいずれかに記載の方法に用いるための検査キット。
【請求項12】
容器内に収容されている担体に目的物質を捕獲するための物質が固定され、前記物質が、外部から添加される液体中に含有される発光能を有する物質との反応を介して、前記発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する方法であって、前記液体を添加する際に、前記液体及び/又は容器の温度を調節することを含む前記方法。
【請求項13】
発光能を有する物質が、ルミノール、シュウ酸ジフェニル、ルテニウム錯体、塩化オキサリル、ルシフェリン、AMPPD、インドール、ポリフェノール、ジオキセタン、及びこれら物質の誘導体からなる群より選択される少なくとも1種の化合物である請求項12記載の方法。
【請求項14】
液体及び/又は容器の温度を15℃以下に調節する請求項12又は13に記載の方法。
【請求項15】
液体を添加する際に、担体が容器に対して固定されている請求項12〜14のいずれかに記載の方法。
【請求項16】
発光又は放射の波長帯における液体の光線透過率を抑制又は調整する手段と、目的物質を発光又は放射現象により光学的に検出及び/又は定量する手段とを備えた、請求項1〜10のいずれかに記載の方法に用いる装置。
【請求項17】
液体の温度を調節する手段、発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する手段とを備えた、請求項12〜15のいずれかに記載の方法に用いる装置。
【請求項18】
さらに、容器の温度を調節する手段を備えた、請求項17記載の装置。
【請求項19】
容器の温度を調節する手段、発光能を有する物質が発光又は放射することによって目的物質を検出又は定量する手段とを備えた、請求項12〜15のいずれかに記載の方法に用いる装置。
【請求項20】
さらに、液体の温度を調節する手段を備えた、請求項19記載の装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【公開番号】特開2012−233888(P2012−233888A)
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願番号】特願2012−95665(P2012−95665)
【出願日】平成24年4月19日(2012.4.19)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.QRコード
【出願人】(502338292)ユニバーサル・バイオ・リサーチ株式会社 (23)
【Fターム(参考)】
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願日】平成24年4月19日(2012.4.19)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.QRコード
【出願人】(502338292)ユニバーサル・バイオ・リサーチ株式会社 (23)
【Fターム(参考)】
[ Back to top ]

