試薬キット
【課題】複数種類の試薬を精度良く分注する技術は、従来では機構が複雑になるため、小型化及び低価格化が困難であった。
【解決手段】キャピラリーを用いる加圧分注方式を複数試薬で実現し、さらに分注試薬以外の他の試薬の漏洩を減少させるため、分注後にキャピラリー先端部に空気層を設けることにより、小型で簡便で低価格な分析装置を実現する。
【解決手段】キャピラリーを用いる加圧分注方式を複数試薬で実現し、さらに分注試薬以外の他の試薬の漏洩を減少させるため、分注後にキャピラリー先端部に空気層を設けることにより、小型で簡便で低価格な分析装置を実現する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、核酸を分析する装置に関する。より詳しくは、遺伝子配列解析、遺伝子多型解析及び遺伝子変異解析を可能とする装置に関する。
【背景技術】
【0002】
DNA塩基配列決定にはゲル電気泳動と蛍光検出を用いた方法が広く用いられている。この方法ではまず、配列解析を行おうとするDNA断片のコピーを沢山作製する。DNAの5'末端を始点として種々の長さの蛍光標識断片を作製する。また、これらDNA断片の3'末端の塩基種に応じて波長の異なる蛍光標識を付加しておく。ゲル電気泳動により長さの違いを1塩基の差で識別し、それぞれの断片群が発する発光を検出する。発光波長色から測定中のDNA断片群のDNA末端塩基種を知る。DNAは短い断片群から順次蛍光検出部を通過するので、蛍光色を計測することで短いDNAから順に末端塩基種を知ることができる。これにより、配列決定をする。このような蛍光式DNAシーケンサーは幅広く普及しており、また、ヒトゲノム解析にも大いに活躍した。一方、2003年に宣言された様にヒトゲノム配列解析は終了し、配列情報を医療や種々の産業に活用する時代になってきた。そこでは長いDNAの全てを解析する必要はなく、目的とする短いDNA配列を知れば十分なことも多い。このようなDNA配列解析では簡便な方法・装置が必要とされる。
【0003】
このような要求に応える方法として生まれた技術にパイロシーケンシングに代表される段階的化学反応による配列決定がある(例えば特許文献1及び特許文献2)。この方法ではターゲットとするDNA鎖にプライマーをハイブリダイズさせ、4種の相補鎖合成核酸基質(dATP、dCTP、dGTP、dTTP)を1種類ずつ順番に反応液中に加えて相補鎖合成反応を行う。相補鎖合成反応が起きるとDNA相補鎖が伸長し、副産物としてピロリン酸(PPi)が生成する。ピロリン酸は共存する酵素の働きでATPに変換され、ルシフェリンとルシフェラーゼの共存下で反応して発光を生じる。この光を検出することで加えた相補鎖合成基質がDNA鎖に取り込まれたことがわかり、相補鎖の配列情報、従ってターゲットとなったDNA鎖の配列情報がわかる。一方、反応に使われなかった相補鎖合成基質はアピラーゼなどの酵素により速やかに分解され、次の反応ステップには影響が無いようにしている(例えば特許文献2)。このパイロシーケンシングを行う装置は96穴の反応セル(体積100μl以下)を持つタイタープレートを反応セル板として活用する化学発光検出システムが用いられる場合が多い。その装置では4種の相補鎖合成核酸基質(dATP、dCTP、dGTP、dTTP)を別々の反応試薬溜に保持し、順番に反応セルに注入していく(例えば特許文献3)。即ち、あらかじめDNA、プライマー、相補鎖合成酵素、化学発光試薬などを反応セルにいれ、4本のノズルからなる試薬分注器の、ノズルあるいはタイタープレートをX-Y方向、および回転方向に動かし、試薬溜に空気を加圧し、ノズル先端部から試薬液滴を順次滴下して、発光を検出している。
【0004】
また、以上のパイロシーケンシングを可能とする小型化技術が開示されている(例えば特許文献4)。この技術では、反応部に各dNTP溜から細管を接続し、その細管を利用して4種のdNTPを順次注入する手法により、小型・簡便な解析の実現が示唆されている。
【0005】
一方、小型の生物発光測定装置としては、試薬分注を加圧ディスペンサ方式で行う発光検出装置が開示されている(例えば特許文献5)。同技術では、分注用キャピラリーは反応セルと1対1に配置され、加圧制御により試薬が分注される。
【0006】
また、パイロシーケンシング反応へ応用が可能な試薬として、先に述べた技術と異なる反応系の例が開示されている(例えば特許文献6)。この従来技術では、酵素ピルビン酸リン酸ジキナーゼ(PPDK)の逆反応を用いて、AMPとPPiをATPに合成し、AMP濃度を測定している。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】国際公開第98/13523号パンフレット
【特許文献2】国際公開第98/28440号パンフレット
【特許文献3】国際公開第00/56455号パンフレット
【特許文献4】特開2001−258543号公報
【特許文献5】特開2004−12411号公報
【特許文献6】特開平09−234099号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
パイロシーケンシング法は、用いる反応メカニズムが簡便であるため、装置の小型化及び低価格化に適していると考えられている。先に記述した通り、測定には4種類の相補鎖合成核酸基質を必要とするため、これらを精度良く分注する必要がある。また、小型化及び低価格化のためには、用いる試薬の総量を微量化することが必須である。
【0009】
従来技術では、精度の良い試薬分注機構は、高価で且つ小型化できないという課題があった。例えば、小型化のためには、0.1〜0.2μL程度の分注を、誤差10%以内で行う必要がある。しかし、従来、簡便な試薬分注方法とされる試薬滴下の方式は、例えば0.4μLの分注時において、分注誤差は15%程度が発生してしまい、さらに0.4μL未満の分注では、液体の表面張力により分注が実現できない場合も多かった。また、微量分注を実現する他の例として、一般的にインクジェット方式のプリンターに利用されているバブルジェット(登録商標)技術は、加熱により試薬が劣化する課題や、補給やメンテナンスの簡便化が難しいという課題があった。また、簡便・安価で精度の良い分注を実現できるキャピラリーを利用した加圧ディスペンサ方式は、キャピラリー先端部が反応槽内の試料溶液に接触しているため、空気の加圧時以外の試薬の漏洩が問題となる場合がある。
【0010】
また、4種の試薬を、予め設定された順番に、反応槽に注入する必要がある。従来技術のノズル方式は、小型化が難しく、並列化も難しいという課題があった。即ち、本分野で広く用いられている96穴タイタプレートは、96個の反応槽(穴)が、9mmピッチで配置されているが、従来技術のノズルを9mmピッチで複数設けることは不可能である。そのため、1組のノズルで複数の反応槽に分注を行うため、測定効率が悪く、横方向の移動機構が大型で高価なものとなってしまう課題があった。
【0011】
また、分注した基質が、反応槽内の試料に効率よく混合するメカニズムが必要となる。簡便で小型・低価格な装置を実現するためには、これらの課題が克服される必要があった。
【課題を解決するための手段】
【0012】
上記困難を解決するため、本発明では、4種の試薬保持空間を有する一体型分注用チップを考案した。本チップは、分注精度の良いキャピラリーを用いた加圧ディスペンサ方式を採用した。チップは、9mmピッチでの配置を実現するため、小型化し、試薬の補充等が簡便に可能となる様に、チップをヘッドに装着し、使いきりのディスポーザブルタイプとした。
【0013】
さらに、チップをホールドするヘッド部分には、上下機構を設ける。これにより、試薬の分注時と攪拌時においてキャピラリーと反応槽内の液体との接触、非接触の状態を制御することができる。さらにキャピラリーにエアギャップを設ける。これにより、チップのキャピラリー先端部からの試薬の漏洩を防ぐことができる。また、小型で簡便なエアギャップ生成方法として、加圧ディスペンサ方式で用いる高圧ガス(空気や窒素など)を利用するマイクロエジェクタを設置し、それにより発生させる陰圧を利用する。これにより、エアギャップを確実に生成することができる。
【0014】
本発明による分析装置の一例としては、試薬を納める試薬容器を保持する試薬容器保持手段と、前記試薬容器保持手段を上下方向に移動させる移動手段と、前記試薬容器から前記試薬の供給を受け、かつ液体を収めるための反応槽と、前記試薬容器から前記反応槽へ加圧により前記試薬を供給するための圧力印加手段と、前記反応槽に振動を印加する振動印加手段と、前記反応槽について光学的に検出する検出器とを有することを特徴とする。
【0015】
本発明による分析装置の他の例としては、試薬導出部を具備してかつ試薬を納める試薬容器を保持する試薬容器保持手段と、前記試薬容器保持手段を上下方向に移動させる移動手段と、前記試薬容器から前記試薬の供給を受け、かつ試料を収めるための反応槽と、前記試薬容器から前記反応槽へ加圧により前記試薬を供給するための圧力印加手段と、前記反応槽に振動を印加する振動印加手段と、前記反応槽について光学的に検出する検出器と、前記試薬導出部の内部に気体層を設けるための陰圧発生手段とを有することを特徴とする。
【0016】
本発明による試薬キットの一例としては、第1の液体導出部を具備し、第1の液体を収める第1の槽と、第2の液体導出部を具備し、第2の液体を収める第2の槽と、第3の液体導出部を具備し、第3の液体を収める第3の槽と、第4の液体導出部を具備し、第4の液体を収める第4の槽とを有し、前記第1の液体導出部と前記第2の液体導出部と前記第3の液体導出部と前記第4の液体導出部とは、実質的に点対称に位置されることを特徴とする。
【発明の効果】
【0017】
本発明によれば、小型で安価な核酸分析装置、遺伝子配列解析装置を実現できる。まず、本発明の手法により、分注チップは必要なだけ並列化することが、安価に実現できる。また、所要の分注精度を小型・簡便に実現でき、さらに試薬の補充などが簡便である。また、反応効率を決定する試薬の混合にも適しており、精度の良い配列解析が可能となる。さらに、キャピラリーを用いた加圧ディスペンサ方式について、試薬の漏洩を押さえ、反応の精度が向上させることができる。
【図面の簡単な説明】
【0018】
【図1】装置構成の例の図。
【図2】分注チップの例の図。
【図3】分注チップを設置する分注ヘッドの説明図。
【図4】測定時の装置動作を説明するシーケンスの例の図。
【図5】配列解析結果の例の図。
【図6】測定時の装置動作のシーケンスの例の図。
【図7】ATP分注量と発光量の関係を示す図。
【図8】マイクロエジェクタを示す図及びマイクロエジェクタを含む装置構成の例の図。
【図9】分注する試薬の濃度を変えて2回分注を行う場合の発光量の例の図。
【発明を実施するための形態】
【実施例1】
【0019】
以下本発明を、実施例により説明する。本発明は、測定対象の遺伝子の配列を、従来技術で説明したパイロシーケンシング法の原理を用いて、決定する。まず、本発明の分析装置の構成例を、図1(a)に示した。まず、装置は反応槽ホルダー101を有している。ホルダー101は、4個の反応槽1011〜1014を9mmピッチで1列に保持する。本装置は、酵素による核酸伸張を行うが、酵素反応は、大抵、室温より高い温度条件で、効率よく機能するため、ホルダーには任意の温度に加熱・冷却することが可能な温度制御手段(ペリチエ素子など)を接続している方がより好ましい。なお、本実施例は、反応槽の数量が4個で、9mmピッチ(96穴タイタプレートピッチ)で配置されている場合を示すが、実施に当たり、個数やピッチは任意であり、限定されない。さらに、図の1列配置を、複数列設けることにより、反応槽の総数を増加させることも可能である。ホルダー101は、振動モーターなどの振動発生器により、その全体を振動させることが可能である。この振動は、試薬分注時に、分注した試薬と反応槽内の試料を混合させることに役立つ。
【0020】
光検出部102は、全体を導電性材料の筐体で覆われている。反応槽側に見込む、4つのフォトダイオードを、反応槽のピッチにあわせて有し、反応槽との境界部分は、裏面に透明電極層(ITO等)を有したガラス1021を有する。この透明電極は、全体を覆う導電性筐体に電気的に接続され、装置の接地電位に接続している。また筐体内には、フォトダイオードの信号を増幅するアンプを含み、検出部外のA/D変換回路に接続している。
【0021】
A/D変換回路103は、光検出信号をディジタル化し、装置制御及びデータ取り込み用のコンピューターにデータを転送する。
【0022】
分注ヘッド104は、内部に分注チップを保持する分注チップ保持手段としての機能を有する。ここで、チップは分注用キャピラリーを具備し、分注用キャピラリーの端面が反応槽に対向するように保持される。また、4種類の試薬それぞれに対応した4本の加圧用エアーチューブ群105が、電磁弁群106に接続している。なお分注ヘッドと電磁弁群を一体とすることも可能である。また、分注ヘッド全体を上下する機構107を有する。上下機構107としては、例えば、図1(b)に示す通り、ヘッド104にラック1071を設け、ピニオン1072をモーター等で駆動して行うことが簡単である。この場合、接触スイッチやモーターの回転数により、ヘッドの高さを制御することが可能となる。なお、高さの制御が可能である場合の効果に関しては、後ほど記述する。また、簡単には、高圧ガス源から供給される気体を用いたシリンジを用いて上下させることも可能である。この場合は、上下の制御が、1つの電磁弁を用いた気体の封入により達成されるため、簡便である。
【0023】
電磁弁群は、4個の3方式電磁弁を有し、その高圧ガス源側は、装置の有する高圧ガスタンクや実験室に設置されている高圧ガスライン源に接続されている。また、排気側は、さらに1つの電磁弁108を介し、陰圧源109であるマイクロエジェクタに接続する。陰圧源109は、マイクロエジェクタと高圧ガス源を用いて、約0.5気圧程度の陰圧を発生させている。陰圧の発生は、電磁弁108で制御する。
【0024】
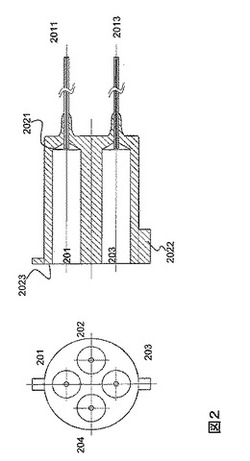
分注チップの上面図及び断面図を図2に示す。分注チップは、4種の試薬を、それぞれ個別に保持する試薬槽201〜204を有している。試薬槽は、分注経路であるキャピラリー2011〜2014を、それぞれ有している。本実施例では、キャピラリーとして、全長20mm、外形約350μm、内径約50μmのガラスキャピラリーを用い、1つの試薬槽は、内径2.4mm、長さ10mmとした。試薬槽の容量は、およそ45μLである。試薬槽に収める4種の試薬の例としては、デオキシヌクレオチド三リン酸(dNTP)が想定される。具体的には、4つの試薬槽の各々にデオキシアデノシン三リン酸(dATP)、デオキシチミジン三リン酸(dTTP)、デオキシシチジン三リン酸(dCTP)、デオキシグアノシン三リン酸(dGTP)を収めることが想定される。なお、dNTPの類似体を用いることも可能である。例えば、三リン酸のかわりに、α位置に相当するひとつのリンがイオウに置き換わったdNTPαSなどがある。
【0025】
分注チップは、4つの試薬槽を実質的に点対称で配置することにより、各試薬間の分注位置を、中心から平等に配置している。以下の利点を有する。まず、分注チップと反応容器の中心を一致させることにより、4種の試薬に位置的差異が生じない。つまり、反応容器内におけるキャピラリー位置は、分注後の試薬の混合度合いに密接に関係している。反応容器は円筒であるため、試薬の混合性能を考慮した理想的分注位置は容器の中心である。しかし、4種の試薬を一括で分注する場合、全てを中心とすることは、水平方向の移動機構などが必要となり、装置のコスト増につながる。そのため、4種の試薬を均等に扱うためには、反応容器の中心から実質的に同心円状に配置することが最も適している。
【0026】
また、試薬槽の底面、即ちキャピラリーとの接続部分は、キャピラリー配置位置を中心とする実質的な円錐形状となっている(2021)。これは、試薬分注不可能となる量、即ちデッドボリュームを少なくすることが可能である。また、分注チップ本体は、線対称となるため、4種の試薬配置を間違わない様に、位置決定用つめ2022をつけておくことが便利である。さらに、チップの上面2023は、その端面が実質的に同一平面上に位置する設計となっている。これは、チップホルダーにおいて、後述の気密保持用部材3001〜3004による気密保持が容易になる利点がある。また、同様に上部にシール用の蓋、或いはシール剤を用いて、試薬の乾燥を防止することが簡便になる。
【0027】
また、本チップ本体は、直径9mm未満の円筒状であることにより、タイタプレートピッチで配置できることが有効である。
【0028】
図3は、分注ヘッドを模式的に説明する図である。(1)は分注ヘッド上部の底面図、(2)はヘッド部分の断面図、(3)は分注ヘッド下部の上面図である。分注ヘッドは、(1)の底面と、(3)の上面を合わせる様にして、組み立てられる。分注ヘッドは、詳細には、分注ヘッド下部301と分注ヘッド上部302に分離でき、その間に図2で示した分注チップを挟み込む構造となっている。分注ヘッド下部は、各分注チップのキャピラリーを通す穴が設けられている。分注ヘッド上部は、各チップの試薬槽に接続する、高圧ガス流入口が、1チップにつき4個、設けられている。303には、1つの高圧ガス流路が示されている。1つの高圧ガス流路は、1つの試薬槽に対応し、各分注チップのガス流入口に接続する。流路は、1つに集合し、1本のエアーチューブに接続している。3001〜3004は、チップと密着して、各試薬槽の気密を保持できる。密着性を最適とする部材としては、シリコンゴムやバイトンゴムなど、ゴム弾性を有する材料が好適である。
【0029】
まず、本発明の分注チップなどの特性を説明する。キャピラリーを用いた加圧ディスペンサ方式は、微量分注において分注精度が高いことが特徴である。例えば、本実施例における分注量0.20μL分注時の分注誤差は、約10%以下が実現できた。また、内径25μmの本実施例より細いキャピラリーでは、分注誤差は約8%以下であった。ここで細管(キャピラリー)を用いる効果について、説明する。本発明の分注方法では、試薬分注量Qは印加する外圧力と加圧時間により、以下のHagen-Poiseuilleの法則にしたがって決められる。
Q = ΔP・π・r4・t/(8μL)
ここで、ΔP:圧力,r:細管の径,t:加圧時間,μ:溶液の粘性,L:細管の長さである。
【0030】
分注精度は、制御可能なメカニズムにより決まるため、この場合、加圧圧力の誤差と、加圧時間の誤差の評価が、重要である。上式の示す通り、これらの誤差が等しい場合、その誤差に起因する分注量の誤差は、細管の半径の4乗に比例し、細管の長さに反比例する。そのため、径が小さいほど、加圧圧力及び分注時間の誤差の、分注誤差への影響が小さくなる。本実施例では、細管として直径50μm〜25μmの範囲を用いている。管径としては、1〜25μm程度の物も利用できるが、分注対象の試薬に依っては、目詰まりが発生しやすい。一方、50μmより大きい管径を用いると、先述のごとく、分注精度が劣化する。用いる管径は、使用する形態の分注量と要求される分注精度により、適宜決めれば良いが、本実施例における分注量及び目詰まりを考慮した条件では25〜50μmの細管が適する。分注量は、分注前後での質量変化から、求めたものであるが、この誤差は、ほぼ測定限界である。また、本システムでは、分注時以外にも、キャピラリー先端部を反応槽内の液体に接触させておくことにより、装置の上下機構107を省くことも可能である。しかし、接触させておく場合、キャピラリー先端から不要の試薬漏れが発生することが予想される。つまり、通常の使用方法では、キャピラリー内部は、試薬で満たされている。本装置は、核酸検査において、4種の試薬から任意のものを、任意の量分注できることが必要であるため、期待しない試薬が反応容器内に漏れることは、期待しない反応の発生につながり、重大な測定誤差を発生してしまう。そのため、本装置における、試薬の拡散による漏れ量を、以下の様に評価した。評価は、生物発光の試薬を用いて行った。まず、反応容器に生物発光試薬であるルシフェラーゼ及びルシフェリンをバッファに溶かして分注し、キャピラリーに試薬としてATPを分注する。ATPの分注量に対する発光量は図7の例の様に、線形で且つ既知であるため、分注せずに、即ち高圧ガスを注入せずに放置した状態で得られる弱い発光を測定することにより、ATPの漏れ量が評価できる。
【0031】
まず、反応槽を静的な状態に保ったままにおいて、2分間の試薬漏洩量を測定したところ、漏洩は観測されなかった。一方、試薬攪拌のため、反応槽を振動発生器で20秒間振動させたところ、大量の漏洩が観測された。すなわち、試薬攪拌を行う場合、攪拌前にキャピラリー先端を試薬より離脱させることが重要であることが分かった。しかし、上下機構を用いる場合、再度、キャピラリー先端部を反応槽内の液体に挿入する際に、その衝撃を要因と考えられる試薬の漏れが観測された。例えば、内径50μmのキャピラリーでは、先端部を反応槽の液面に挿入する衝撃により、約6nLの試薬漏洩が観測された。また、内径25μmのキャピラリーでは、同様に約3nLの試薬漏洩が観測された。これらの問題については、試薬分注後に、キャピラリー先端部を反応槽の液面より離脱させ、その後に、キャピラリーの先端部(液体溶出端部)に、気体(ここでは空気)の層、すなわちエアギャップを精製させることによって解決することができる。気体の層の存在によって、キャピラリー内部の試薬境界位置を約5mm程度引き込ませ、キャピラリーの先端部からの偶発的な試薬漏洩を回避できるためである。エアギャップは、一般的には試薬槽をシリンジ等で吸引すれば、生成できる。しかし、シリンジを用いる場合、その機構系を含め、複雑になること、及びコスト増につながることが、問題として挙げられる。そのため、本実施例では、より簡便な方法として、マイクロエジェクタを用いた陰圧を利用した。マイクロエジェクタとは、図8(a)の断面図に示す、細管81と高圧ガス源と連結するハウジング82とを備えた陰圧発生手段である。内部に高圧のガスが、流入口801から排出口802に流れると、内部の細管の近傍において803の様な流れが発生し、その結果804の方向に細管内部の空気が引き込まれ、結果として805の方向に陰圧が発生するものである。本装置は、既に高圧ガス源を有しているため、マイクロエジェクタを用いれば、簡単に陰圧を得ることが可能である。微小時間だけ試薬槽をマイクロエジェクタに接続することにより、キャピラリーに陰圧を印加することによって生成することができる。その結果、約5mmのエアギャップは、試薬の漏洩防止に寄与し、内径50μmのキャピラリーでは、漏洩量は約0.6nLに減少できた。マイクロエジェクタを用いた陰圧は、機構がとても小型で簡便なため、小型の遺伝子検査などの核酸分析装置に好適である。マイクロエジェクタを備えた装置の構成例を図8(b)に示す。ここで、マイクロエジェクタ1000は、細管81とハウジング82とを備えている。ハウジング82は、電磁弁108と、チューブ810を介して高圧ガス源に直結している。また、細管82は、チューブ811により、電磁弁群106の排気口に接続している。ガスが、高圧ガス源より、チューブ810を経由して、ハウジング82に流入すると先述の通り陰圧が細管81に発生し、電磁弁群106の排気口を吸引する。電磁弁群106は、先述の通り、3方式電磁弁であるため、電磁弁OFF時には排気口は直接チューブ群105につながっている。従って、排気口を吸引することは、即ち、分注チップの試薬槽の空気を吸引することになる。吸引時間は、電磁弁108のON/OFFで制御できるため、所望の時間だけ、試薬槽の空気を吸引できる。従って、吸引時間を適当に設定すれば、所望のエアギャップを、キャピラリー先端に生成できる。
【0032】
試薬漏れの問題は、核酸分析装置において、重要である。例えば、パイロシーケンシングを利用する配列解析では、4種の核酸基質のうちの1種を分注し、その結果、伸長が生じたか否かを、発光で確認するため、目的の核酸基質以外が混入すると、それはそのまま解析誤差となる。複数塩基の配列を連続的に評価する場合、その解析誤差は、解析する配列数だけ指数的に増加するため、解析可能な塩基長が著しく制限される。そのため、試薬の漏れ量の減少は、重要な課題である。本実施例の核酸分析装置は、反応槽の試料液量は、約20μL程度を利用する。0.6nLは、それに対して10000分の1以下であり、無視できる値である。すなわち、本構成により、漏れ量を無視できる値にまで低減化させることが可能となる。
【0033】
次に、本実施例の装置を用いた遺伝子解析法について説明する。図4は、試薬として4種のdNTP(すなわち、dATPαS、dGTP、dCTP、dTTP)のうちの一種を、本実施例の分注チップより分注する際の分注ヘッド,加圧,および攪拌用振動モータの動作のタームシーケンスを示したものである。動作は以下の通りである。まず、分注ヘッドを降下させ、反応槽内の液体の液面とキャピラリー先端を接触させる。次に、必要な試薬分注量に応じた加圧時間だけ、高圧ガスにより加圧を行い、試薬分注を行う。その後、分注ヘッドを上昇させ、反応槽内の液体の液面よりキャピラリー先端を離脱させる。最後に、所定の攪拌時間だけ攪拌モーターを動作させ、並行してキャピラリー内にエアーギャップを生成するため陰圧吸引を規定時間行う。遺伝子配列解析は、この一連の動作を、一塩基の解析ごと繰り返し行なえばよい。本実施例で得られた遺伝子配列解析例を、図5に示した。なお、図5に示した基質とは、A、G、C、Tは各々dATPαS、dGTP、dCTP、dTTPを指す。即ち、Aのみ、dATPの擬似体を用いている。解析結果は、予め既知であった試料の塩基配列と完全に一致していることがわかる。
【実施例2】
【0034】
実施例1に記載の装置を用いた、試薬分注に関するさらなる実施の例を記載する。まず、1種の基質を分注する際、予め基質の濃度や分注量を小さくし、複数回分注する。本装置によれば、かかる分注方法が簡単に実現できる。これは、先述の漏れ量が0.6nL程度である場合、漏れる分子量を減少させる目的で、試薬の濃度を下げる場合や、連続的に配列解析する際、同じ塩基の連続が観測されたことに伴い、試薬を追加する必要が生じた場合などに有効である。本実施例では、2回分注を行う場合について、説明する。図6は、1種類の試薬を、2回に分けて分注する場合の分注ヘッド,加圧,および攪拌用振動モータの動作のタームシーケンスを示したものである。同じ試薬を2回に分けて分注し、1回目の分注による発光と、2回目の分注による発光を比較すると、試料である核酸の伸長反応が、完全に生じたか、或いはまだ未反応の試料が残っているかを判断することが可能である。図9は、分注する試薬の濃度を変えて、2回分注を行った例である。破線は、実線の条件に対し、分注試薬濃度を1/2に変えたものであり、両者とも901及び902の2回分注を行っている。この図より、注入した試薬が十分である場合には、902の分注では、発光ピークが殆ど見られないのに対し、試薬濃度が1/2量では、未反応成分が残っていたことから、2回目の分注においても発光が見られる。本実験例は、1例であるが、このように、複数回注入し、その結果得られる発光シグナルから、注入した試薬が十分であるか否かを判断することができる。
【0035】
これは、配列解析の精度向上に有効である。なぜならば、注入する試薬量は、反応に最適な量とする必要があるからである。仮に、注入する量が不足していると、未反応な核酸が、その後の測定ノイズ源となってしまう。また、過剰な量を混入すると、次の試薬を注入する際に、前の試薬が完全に分解されずに残留し、キャリーオーバーを起こす。キャリーオーバーは、先読みなどの要因になり、測定精度を劣化させる。
【0036】
最適な試薬量は、伸長する塩基数で異なる。即ち、2塩基伸長する場合は、1塩基伸長の場合より、2倍量の試薬が必要となる。測定対象の核酸は、配列数が未知である場合が多いため、注入する試薬の塩基長は未知である。そのため、最適試薬量を予め決めることができない。この場合、必要に応じて、複数回分注することは、有効である。
【実施例3】
【0037】
実施例1に記載の装置を用いた、一度に複数種類の試薬を分注する方法に関するさらなる実施の例を記載する。
【0038】
実施例2では4種の基質を1種づつ分注しているが、必要に応じて、4種のうち2種、3種或いは全種、すなわち2種以上の基質を同時に分注することが可能である。この際、分注チップは通常の配列解析用と同じものが利用できることが重要である。例えば、多型解析では、伸長プローブ側において多型判定が可能となる用に3’末端を多型とし、その相補性を判断して、多型解析する技術がある。この場合、用いる試薬は、4種の基質の混合溶液である。そのため、通常の配列解析試薬とは取扱いが異なり、多型解析の際には特に4種の基質の混合溶液を準備しなければならない。しかし、本装置では、配列解析を行った後に、反応槽の試料だけ交換し、同じ試薬分注チューブを多型解析に使用することが可能であり、様々な分析を簡便に実現することができる。
【0039】
また、既知の配列の確認解析を行っている場合、予めSNPのヘテロの可能性がある場合は、その2種の塩基を同時に分注することにより、パイロシーケンシングにおいて問題となる位相ズレが生じなくなる。
【実施例4】
【0040】
実施例1に記載の分注チップにつき、実験者への供給に関するさらなる実施の例を記載する。ここで、実験者および供給者の試薬管理が簡便となる例がある。本発明は、4種の核酸基質を、分注チップの試薬槽に注入して利用することができるが、この分注チップに予め4種の核酸基質を分注し、そのまま封入して凍結することが可能である。仮に、試薬販売者が予め試薬の封入および凍結を行えば、実験者はその封入済み分注チップを、分注ヘッドに装填するだけで実験が開始できる。分注チップは滅菌や凍結で劣化せず、生産コストも低いため、分注チップを使いきりとする事により、試薬の汚染による実験ミスの可能性を著しく低減できる。
【産業上の利用可能性】
【0041】
本発明はライフサイエンス及びバイオ産業分野の基本的なツールである核酸を分析する装置、より具体的にはDNA配列決定装置及びDNA検査装置に活用するものである。
【技術分野】
【0001】
本発明は、核酸を分析する装置に関する。より詳しくは、遺伝子配列解析、遺伝子多型解析及び遺伝子変異解析を可能とする装置に関する。
【背景技術】
【0002】
DNA塩基配列決定にはゲル電気泳動と蛍光検出を用いた方法が広く用いられている。この方法ではまず、配列解析を行おうとするDNA断片のコピーを沢山作製する。DNAの5'末端を始点として種々の長さの蛍光標識断片を作製する。また、これらDNA断片の3'末端の塩基種に応じて波長の異なる蛍光標識を付加しておく。ゲル電気泳動により長さの違いを1塩基の差で識別し、それぞれの断片群が発する発光を検出する。発光波長色から測定中のDNA断片群のDNA末端塩基種を知る。DNAは短い断片群から順次蛍光検出部を通過するので、蛍光色を計測することで短いDNAから順に末端塩基種を知ることができる。これにより、配列決定をする。このような蛍光式DNAシーケンサーは幅広く普及しており、また、ヒトゲノム解析にも大いに活躍した。一方、2003年に宣言された様にヒトゲノム配列解析は終了し、配列情報を医療や種々の産業に活用する時代になってきた。そこでは長いDNAの全てを解析する必要はなく、目的とする短いDNA配列を知れば十分なことも多い。このようなDNA配列解析では簡便な方法・装置が必要とされる。
【0003】
このような要求に応える方法として生まれた技術にパイロシーケンシングに代表される段階的化学反応による配列決定がある(例えば特許文献1及び特許文献2)。この方法ではターゲットとするDNA鎖にプライマーをハイブリダイズさせ、4種の相補鎖合成核酸基質(dATP、dCTP、dGTP、dTTP)を1種類ずつ順番に反応液中に加えて相補鎖合成反応を行う。相補鎖合成反応が起きるとDNA相補鎖が伸長し、副産物としてピロリン酸(PPi)が生成する。ピロリン酸は共存する酵素の働きでATPに変換され、ルシフェリンとルシフェラーゼの共存下で反応して発光を生じる。この光を検出することで加えた相補鎖合成基質がDNA鎖に取り込まれたことがわかり、相補鎖の配列情報、従ってターゲットとなったDNA鎖の配列情報がわかる。一方、反応に使われなかった相補鎖合成基質はアピラーゼなどの酵素により速やかに分解され、次の反応ステップには影響が無いようにしている(例えば特許文献2)。このパイロシーケンシングを行う装置は96穴の反応セル(体積100μl以下)を持つタイタープレートを反応セル板として活用する化学発光検出システムが用いられる場合が多い。その装置では4種の相補鎖合成核酸基質(dATP、dCTP、dGTP、dTTP)を別々の反応試薬溜に保持し、順番に反応セルに注入していく(例えば特許文献3)。即ち、あらかじめDNA、プライマー、相補鎖合成酵素、化学発光試薬などを反応セルにいれ、4本のノズルからなる試薬分注器の、ノズルあるいはタイタープレートをX-Y方向、および回転方向に動かし、試薬溜に空気を加圧し、ノズル先端部から試薬液滴を順次滴下して、発光を検出している。
【0004】
また、以上のパイロシーケンシングを可能とする小型化技術が開示されている(例えば特許文献4)。この技術では、反応部に各dNTP溜から細管を接続し、その細管を利用して4種のdNTPを順次注入する手法により、小型・簡便な解析の実現が示唆されている。
【0005】
一方、小型の生物発光測定装置としては、試薬分注を加圧ディスペンサ方式で行う発光検出装置が開示されている(例えば特許文献5)。同技術では、分注用キャピラリーは反応セルと1対1に配置され、加圧制御により試薬が分注される。
【0006】
また、パイロシーケンシング反応へ応用が可能な試薬として、先に述べた技術と異なる反応系の例が開示されている(例えば特許文献6)。この従来技術では、酵素ピルビン酸リン酸ジキナーゼ(PPDK)の逆反応を用いて、AMPとPPiをATPに合成し、AMP濃度を測定している。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】国際公開第98/13523号パンフレット
【特許文献2】国際公開第98/28440号パンフレット
【特許文献3】国際公開第00/56455号パンフレット
【特許文献4】特開2001−258543号公報
【特許文献5】特開2004−12411号公報
【特許文献6】特開平09−234099号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
パイロシーケンシング法は、用いる反応メカニズムが簡便であるため、装置の小型化及び低価格化に適していると考えられている。先に記述した通り、測定には4種類の相補鎖合成核酸基質を必要とするため、これらを精度良く分注する必要がある。また、小型化及び低価格化のためには、用いる試薬の総量を微量化することが必須である。
【0009】
従来技術では、精度の良い試薬分注機構は、高価で且つ小型化できないという課題があった。例えば、小型化のためには、0.1〜0.2μL程度の分注を、誤差10%以内で行う必要がある。しかし、従来、簡便な試薬分注方法とされる試薬滴下の方式は、例えば0.4μLの分注時において、分注誤差は15%程度が発生してしまい、さらに0.4μL未満の分注では、液体の表面張力により分注が実現できない場合も多かった。また、微量分注を実現する他の例として、一般的にインクジェット方式のプリンターに利用されているバブルジェット(登録商標)技術は、加熱により試薬が劣化する課題や、補給やメンテナンスの簡便化が難しいという課題があった。また、簡便・安価で精度の良い分注を実現できるキャピラリーを利用した加圧ディスペンサ方式は、キャピラリー先端部が反応槽内の試料溶液に接触しているため、空気の加圧時以外の試薬の漏洩が問題となる場合がある。
【0010】
また、4種の試薬を、予め設定された順番に、反応槽に注入する必要がある。従来技術のノズル方式は、小型化が難しく、並列化も難しいという課題があった。即ち、本分野で広く用いられている96穴タイタプレートは、96個の反応槽(穴)が、9mmピッチで配置されているが、従来技術のノズルを9mmピッチで複数設けることは不可能である。そのため、1組のノズルで複数の反応槽に分注を行うため、測定効率が悪く、横方向の移動機構が大型で高価なものとなってしまう課題があった。
【0011】
また、分注した基質が、反応槽内の試料に効率よく混合するメカニズムが必要となる。簡便で小型・低価格な装置を実現するためには、これらの課題が克服される必要があった。
【課題を解決するための手段】
【0012】
上記困難を解決するため、本発明では、4種の試薬保持空間を有する一体型分注用チップを考案した。本チップは、分注精度の良いキャピラリーを用いた加圧ディスペンサ方式を採用した。チップは、9mmピッチでの配置を実現するため、小型化し、試薬の補充等が簡便に可能となる様に、チップをヘッドに装着し、使いきりのディスポーザブルタイプとした。
【0013】
さらに、チップをホールドするヘッド部分には、上下機構を設ける。これにより、試薬の分注時と攪拌時においてキャピラリーと反応槽内の液体との接触、非接触の状態を制御することができる。さらにキャピラリーにエアギャップを設ける。これにより、チップのキャピラリー先端部からの試薬の漏洩を防ぐことができる。また、小型で簡便なエアギャップ生成方法として、加圧ディスペンサ方式で用いる高圧ガス(空気や窒素など)を利用するマイクロエジェクタを設置し、それにより発生させる陰圧を利用する。これにより、エアギャップを確実に生成することができる。
【0014】
本発明による分析装置の一例としては、試薬を納める試薬容器を保持する試薬容器保持手段と、前記試薬容器保持手段を上下方向に移動させる移動手段と、前記試薬容器から前記試薬の供給を受け、かつ液体を収めるための反応槽と、前記試薬容器から前記反応槽へ加圧により前記試薬を供給するための圧力印加手段と、前記反応槽に振動を印加する振動印加手段と、前記反応槽について光学的に検出する検出器とを有することを特徴とする。
【0015】
本発明による分析装置の他の例としては、試薬導出部を具備してかつ試薬を納める試薬容器を保持する試薬容器保持手段と、前記試薬容器保持手段を上下方向に移動させる移動手段と、前記試薬容器から前記試薬の供給を受け、かつ試料を収めるための反応槽と、前記試薬容器から前記反応槽へ加圧により前記試薬を供給するための圧力印加手段と、前記反応槽に振動を印加する振動印加手段と、前記反応槽について光学的に検出する検出器と、前記試薬導出部の内部に気体層を設けるための陰圧発生手段とを有することを特徴とする。
【0016】
本発明による試薬キットの一例としては、第1の液体導出部を具備し、第1の液体を収める第1の槽と、第2の液体導出部を具備し、第2の液体を収める第2の槽と、第3の液体導出部を具備し、第3の液体を収める第3の槽と、第4の液体導出部を具備し、第4の液体を収める第4の槽とを有し、前記第1の液体導出部と前記第2の液体導出部と前記第3の液体導出部と前記第4の液体導出部とは、実質的に点対称に位置されることを特徴とする。
【発明の効果】
【0017】
本発明によれば、小型で安価な核酸分析装置、遺伝子配列解析装置を実現できる。まず、本発明の手法により、分注チップは必要なだけ並列化することが、安価に実現できる。また、所要の分注精度を小型・簡便に実現でき、さらに試薬の補充などが簡便である。また、反応効率を決定する試薬の混合にも適しており、精度の良い配列解析が可能となる。さらに、キャピラリーを用いた加圧ディスペンサ方式について、試薬の漏洩を押さえ、反応の精度が向上させることができる。
【図面の簡単な説明】
【0018】
【図1】装置構成の例の図。
【図2】分注チップの例の図。
【図3】分注チップを設置する分注ヘッドの説明図。
【図4】測定時の装置動作を説明するシーケンスの例の図。
【図5】配列解析結果の例の図。
【図6】測定時の装置動作のシーケンスの例の図。
【図7】ATP分注量と発光量の関係を示す図。
【図8】マイクロエジェクタを示す図及びマイクロエジェクタを含む装置構成の例の図。
【図9】分注する試薬の濃度を変えて2回分注を行う場合の発光量の例の図。
【発明を実施するための形態】
【実施例1】
【0019】
以下本発明を、実施例により説明する。本発明は、測定対象の遺伝子の配列を、従来技術で説明したパイロシーケンシング法の原理を用いて、決定する。まず、本発明の分析装置の構成例を、図1(a)に示した。まず、装置は反応槽ホルダー101を有している。ホルダー101は、4個の反応槽1011〜1014を9mmピッチで1列に保持する。本装置は、酵素による核酸伸張を行うが、酵素反応は、大抵、室温より高い温度条件で、効率よく機能するため、ホルダーには任意の温度に加熱・冷却することが可能な温度制御手段(ペリチエ素子など)を接続している方がより好ましい。なお、本実施例は、反応槽の数量が4個で、9mmピッチ(96穴タイタプレートピッチ)で配置されている場合を示すが、実施に当たり、個数やピッチは任意であり、限定されない。さらに、図の1列配置を、複数列設けることにより、反応槽の総数を増加させることも可能である。ホルダー101は、振動モーターなどの振動発生器により、その全体を振動させることが可能である。この振動は、試薬分注時に、分注した試薬と反応槽内の試料を混合させることに役立つ。
【0020】
光検出部102は、全体を導電性材料の筐体で覆われている。反応槽側に見込む、4つのフォトダイオードを、反応槽のピッチにあわせて有し、反応槽との境界部分は、裏面に透明電極層(ITO等)を有したガラス1021を有する。この透明電極は、全体を覆う導電性筐体に電気的に接続され、装置の接地電位に接続している。また筐体内には、フォトダイオードの信号を増幅するアンプを含み、検出部外のA/D変換回路に接続している。
【0021】
A/D変換回路103は、光検出信号をディジタル化し、装置制御及びデータ取り込み用のコンピューターにデータを転送する。
【0022】
分注ヘッド104は、内部に分注チップを保持する分注チップ保持手段としての機能を有する。ここで、チップは分注用キャピラリーを具備し、分注用キャピラリーの端面が反応槽に対向するように保持される。また、4種類の試薬それぞれに対応した4本の加圧用エアーチューブ群105が、電磁弁群106に接続している。なお分注ヘッドと電磁弁群を一体とすることも可能である。また、分注ヘッド全体を上下する機構107を有する。上下機構107としては、例えば、図1(b)に示す通り、ヘッド104にラック1071を設け、ピニオン1072をモーター等で駆動して行うことが簡単である。この場合、接触スイッチやモーターの回転数により、ヘッドの高さを制御することが可能となる。なお、高さの制御が可能である場合の効果に関しては、後ほど記述する。また、簡単には、高圧ガス源から供給される気体を用いたシリンジを用いて上下させることも可能である。この場合は、上下の制御が、1つの電磁弁を用いた気体の封入により達成されるため、簡便である。
【0023】
電磁弁群は、4個の3方式電磁弁を有し、その高圧ガス源側は、装置の有する高圧ガスタンクや実験室に設置されている高圧ガスライン源に接続されている。また、排気側は、さらに1つの電磁弁108を介し、陰圧源109であるマイクロエジェクタに接続する。陰圧源109は、マイクロエジェクタと高圧ガス源を用いて、約0.5気圧程度の陰圧を発生させている。陰圧の発生は、電磁弁108で制御する。
【0024】
分注チップの上面図及び断面図を図2に示す。分注チップは、4種の試薬を、それぞれ個別に保持する試薬槽201〜204を有している。試薬槽は、分注経路であるキャピラリー2011〜2014を、それぞれ有している。本実施例では、キャピラリーとして、全長20mm、外形約350μm、内径約50μmのガラスキャピラリーを用い、1つの試薬槽は、内径2.4mm、長さ10mmとした。試薬槽の容量は、およそ45μLである。試薬槽に収める4種の試薬の例としては、デオキシヌクレオチド三リン酸(dNTP)が想定される。具体的には、4つの試薬槽の各々にデオキシアデノシン三リン酸(dATP)、デオキシチミジン三リン酸(dTTP)、デオキシシチジン三リン酸(dCTP)、デオキシグアノシン三リン酸(dGTP)を収めることが想定される。なお、dNTPの類似体を用いることも可能である。例えば、三リン酸のかわりに、α位置に相当するひとつのリンがイオウに置き換わったdNTPαSなどがある。
【0025】
分注チップは、4つの試薬槽を実質的に点対称で配置することにより、各試薬間の分注位置を、中心から平等に配置している。以下の利点を有する。まず、分注チップと反応容器の中心を一致させることにより、4種の試薬に位置的差異が生じない。つまり、反応容器内におけるキャピラリー位置は、分注後の試薬の混合度合いに密接に関係している。反応容器は円筒であるため、試薬の混合性能を考慮した理想的分注位置は容器の中心である。しかし、4種の試薬を一括で分注する場合、全てを中心とすることは、水平方向の移動機構などが必要となり、装置のコスト増につながる。そのため、4種の試薬を均等に扱うためには、反応容器の中心から実質的に同心円状に配置することが最も適している。
【0026】
また、試薬槽の底面、即ちキャピラリーとの接続部分は、キャピラリー配置位置を中心とする実質的な円錐形状となっている(2021)。これは、試薬分注不可能となる量、即ちデッドボリュームを少なくすることが可能である。また、分注チップ本体は、線対称となるため、4種の試薬配置を間違わない様に、位置決定用つめ2022をつけておくことが便利である。さらに、チップの上面2023は、その端面が実質的に同一平面上に位置する設計となっている。これは、チップホルダーにおいて、後述の気密保持用部材3001〜3004による気密保持が容易になる利点がある。また、同様に上部にシール用の蓋、或いはシール剤を用いて、試薬の乾燥を防止することが簡便になる。
【0027】
また、本チップ本体は、直径9mm未満の円筒状であることにより、タイタプレートピッチで配置できることが有効である。
【0028】
図3は、分注ヘッドを模式的に説明する図である。(1)は分注ヘッド上部の底面図、(2)はヘッド部分の断面図、(3)は分注ヘッド下部の上面図である。分注ヘッドは、(1)の底面と、(3)の上面を合わせる様にして、組み立てられる。分注ヘッドは、詳細には、分注ヘッド下部301と分注ヘッド上部302に分離でき、その間に図2で示した分注チップを挟み込む構造となっている。分注ヘッド下部は、各分注チップのキャピラリーを通す穴が設けられている。分注ヘッド上部は、各チップの試薬槽に接続する、高圧ガス流入口が、1チップにつき4個、設けられている。303には、1つの高圧ガス流路が示されている。1つの高圧ガス流路は、1つの試薬槽に対応し、各分注チップのガス流入口に接続する。流路は、1つに集合し、1本のエアーチューブに接続している。3001〜3004は、チップと密着して、各試薬槽の気密を保持できる。密着性を最適とする部材としては、シリコンゴムやバイトンゴムなど、ゴム弾性を有する材料が好適である。
【0029】
まず、本発明の分注チップなどの特性を説明する。キャピラリーを用いた加圧ディスペンサ方式は、微量分注において分注精度が高いことが特徴である。例えば、本実施例における分注量0.20μL分注時の分注誤差は、約10%以下が実現できた。また、内径25μmの本実施例より細いキャピラリーでは、分注誤差は約8%以下であった。ここで細管(キャピラリー)を用いる効果について、説明する。本発明の分注方法では、試薬分注量Qは印加する外圧力と加圧時間により、以下のHagen-Poiseuilleの法則にしたがって決められる。
Q = ΔP・π・r4・t/(8μL)
ここで、ΔP:圧力,r:細管の径,t:加圧時間,μ:溶液の粘性,L:細管の長さである。
【0030】
分注精度は、制御可能なメカニズムにより決まるため、この場合、加圧圧力の誤差と、加圧時間の誤差の評価が、重要である。上式の示す通り、これらの誤差が等しい場合、その誤差に起因する分注量の誤差は、細管の半径の4乗に比例し、細管の長さに反比例する。そのため、径が小さいほど、加圧圧力及び分注時間の誤差の、分注誤差への影響が小さくなる。本実施例では、細管として直径50μm〜25μmの範囲を用いている。管径としては、1〜25μm程度の物も利用できるが、分注対象の試薬に依っては、目詰まりが発生しやすい。一方、50μmより大きい管径を用いると、先述のごとく、分注精度が劣化する。用いる管径は、使用する形態の分注量と要求される分注精度により、適宜決めれば良いが、本実施例における分注量及び目詰まりを考慮した条件では25〜50μmの細管が適する。分注量は、分注前後での質量変化から、求めたものであるが、この誤差は、ほぼ測定限界である。また、本システムでは、分注時以外にも、キャピラリー先端部を反応槽内の液体に接触させておくことにより、装置の上下機構107を省くことも可能である。しかし、接触させておく場合、キャピラリー先端から不要の試薬漏れが発生することが予想される。つまり、通常の使用方法では、キャピラリー内部は、試薬で満たされている。本装置は、核酸検査において、4種の試薬から任意のものを、任意の量分注できることが必要であるため、期待しない試薬が反応容器内に漏れることは、期待しない反応の発生につながり、重大な測定誤差を発生してしまう。そのため、本装置における、試薬の拡散による漏れ量を、以下の様に評価した。評価は、生物発光の試薬を用いて行った。まず、反応容器に生物発光試薬であるルシフェラーゼ及びルシフェリンをバッファに溶かして分注し、キャピラリーに試薬としてATPを分注する。ATPの分注量に対する発光量は図7の例の様に、線形で且つ既知であるため、分注せずに、即ち高圧ガスを注入せずに放置した状態で得られる弱い発光を測定することにより、ATPの漏れ量が評価できる。
【0031】
まず、反応槽を静的な状態に保ったままにおいて、2分間の試薬漏洩量を測定したところ、漏洩は観測されなかった。一方、試薬攪拌のため、反応槽を振動発生器で20秒間振動させたところ、大量の漏洩が観測された。すなわち、試薬攪拌を行う場合、攪拌前にキャピラリー先端を試薬より離脱させることが重要であることが分かった。しかし、上下機構を用いる場合、再度、キャピラリー先端部を反応槽内の液体に挿入する際に、その衝撃を要因と考えられる試薬の漏れが観測された。例えば、内径50μmのキャピラリーでは、先端部を反応槽の液面に挿入する衝撃により、約6nLの試薬漏洩が観測された。また、内径25μmのキャピラリーでは、同様に約3nLの試薬漏洩が観測された。これらの問題については、試薬分注後に、キャピラリー先端部を反応槽の液面より離脱させ、その後に、キャピラリーの先端部(液体溶出端部)に、気体(ここでは空気)の層、すなわちエアギャップを精製させることによって解決することができる。気体の層の存在によって、キャピラリー内部の試薬境界位置を約5mm程度引き込ませ、キャピラリーの先端部からの偶発的な試薬漏洩を回避できるためである。エアギャップは、一般的には試薬槽をシリンジ等で吸引すれば、生成できる。しかし、シリンジを用いる場合、その機構系を含め、複雑になること、及びコスト増につながることが、問題として挙げられる。そのため、本実施例では、より簡便な方法として、マイクロエジェクタを用いた陰圧を利用した。マイクロエジェクタとは、図8(a)の断面図に示す、細管81と高圧ガス源と連結するハウジング82とを備えた陰圧発生手段である。内部に高圧のガスが、流入口801から排出口802に流れると、内部の細管の近傍において803の様な流れが発生し、その結果804の方向に細管内部の空気が引き込まれ、結果として805の方向に陰圧が発生するものである。本装置は、既に高圧ガス源を有しているため、マイクロエジェクタを用いれば、簡単に陰圧を得ることが可能である。微小時間だけ試薬槽をマイクロエジェクタに接続することにより、キャピラリーに陰圧を印加することによって生成することができる。その結果、約5mmのエアギャップは、試薬の漏洩防止に寄与し、内径50μmのキャピラリーでは、漏洩量は約0.6nLに減少できた。マイクロエジェクタを用いた陰圧は、機構がとても小型で簡便なため、小型の遺伝子検査などの核酸分析装置に好適である。マイクロエジェクタを備えた装置の構成例を図8(b)に示す。ここで、マイクロエジェクタ1000は、細管81とハウジング82とを備えている。ハウジング82は、電磁弁108と、チューブ810を介して高圧ガス源に直結している。また、細管82は、チューブ811により、電磁弁群106の排気口に接続している。ガスが、高圧ガス源より、チューブ810を経由して、ハウジング82に流入すると先述の通り陰圧が細管81に発生し、電磁弁群106の排気口を吸引する。電磁弁群106は、先述の通り、3方式電磁弁であるため、電磁弁OFF時には排気口は直接チューブ群105につながっている。従って、排気口を吸引することは、即ち、分注チップの試薬槽の空気を吸引することになる。吸引時間は、電磁弁108のON/OFFで制御できるため、所望の時間だけ、試薬槽の空気を吸引できる。従って、吸引時間を適当に設定すれば、所望のエアギャップを、キャピラリー先端に生成できる。
【0032】
試薬漏れの問題は、核酸分析装置において、重要である。例えば、パイロシーケンシングを利用する配列解析では、4種の核酸基質のうちの1種を分注し、その結果、伸長が生じたか否かを、発光で確認するため、目的の核酸基質以外が混入すると、それはそのまま解析誤差となる。複数塩基の配列を連続的に評価する場合、その解析誤差は、解析する配列数だけ指数的に増加するため、解析可能な塩基長が著しく制限される。そのため、試薬の漏れ量の減少は、重要な課題である。本実施例の核酸分析装置は、反応槽の試料液量は、約20μL程度を利用する。0.6nLは、それに対して10000分の1以下であり、無視できる値である。すなわち、本構成により、漏れ量を無視できる値にまで低減化させることが可能となる。
【0033】
次に、本実施例の装置を用いた遺伝子解析法について説明する。図4は、試薬として4種のdNTP(すなわち、dATPαS、dGTP、dCTP、dTTP)のうちの一種を、本実施例の分注チップより分注する際の分注ヘッド,加圧,および攪拌用振動モータの動作のタームシーケンスを示したものである。動作は以下の通りである。まず、分注ヘッドを降下させ、反応槽内の液体の液面とキャピラリー先端を接触させる。次に、必要な試薬分注量に応じた加圧時間だけ、高圧ガスにより加圧を行い、試薬分注を行う。その後、分注ヘッドを上昇させ、反応槽内の液体の液面よりキャピラリー先端を離脱させる。最後に、所定の攪拌時間だけ攪拌モーターを動作させ、並行してキャピラリー内にエアーギャップを生成するため陰圧吸引を規定時間行う。遺伝子配列解析は、この一連の動作を、一塩基の解析ごと繰り返し行なえばよい。本実施例で得られた遺伝子配列解析例を、図5に示した。なお、図5に示した基質とは、A、G、C、Tは各々dATPαS、dGTP、dCTP、dTTPを指す。即ち、Aのみ、dATPの擬似体を用いている。解析結果は、予め既知であった試料の塩基配列と完全に一致していることがわかる。
【実施例2】
【0034】
実施例1に記載の装置を用いた、試薬分注に関するさらなる実施の例を記載する。まず、1種の基質を分注する際、予め基質の濃度や分注量を小さくし、複数回分注する。本装置によれば、かかる分注方法が簡単に実現できる。これは、先述の漏れ量が0.6nL程度である場合、漏れる分子量を減少させる目的で、試薬の濃度を下げる場合や、連続的に配列解析する際、同じ塩基の連続が観測されたことに伴い、試薬を追加する必要が生じた場合などに有効である。本実施例では、2回分注を行う場合について、説明する。図6は、1種類の試薬を、2回に分けて分注する場合の分注ヘッド,加圧,および攪拌用振動モータの動作のタームシーケンスを示したものである。同じ試薬を2回に分けて分注し、1回目の分注による発光と、2回目の分注による発光を比較すると、試料である核酸の伸長反応が、完全に生じたか、或いはまだ未反応の試料が残っているかを判断することが可能である。図9は、分注する試薬の濃度を変えて、2回分注を行った例である。破線は、実線の条件に対し、分注試薬濃度を1/2に変えたものであり、両者とも901及び902の2回分注を行っている。この図より、注入した試薬が十分である場合には、902の分注では、発光ピークが殆ど見られないのに対し、試薬濃度が1/2量では、未反応成分が残っていたことから、2回目の分注においても発光が見られる。本実験例は、1例であるが、このように、複数回注入し、その結果得られる発光シグナルから、注入した試薬が十分であるか否かを判断することができる。
【0035】
これは、配列解析の精度向上に有効である。なぜならば、注入する試薬量は、反応に最適な量とする必要があるからである。仮に、注入する量が不足していると、未反応な核酸が、その後の測定ノイズ源となってしまう。また、過剰な量を混入すると、次の試薬を注入する際に、前の試薬が完全に分解されずに残留し、キャリーオーバーを起こす。キャリーオーバーは、先読みなどの要因になり、測定精度を劣化させる。
【0036】
最適な試薬量は、伸長する塩基数で異なる。即ち、2塩基伸長する場合は、1塩基伸長の場合より、2倍量の試薬が必要となる。測定対象の核酸は、配列数が未知である場合が多いため、注入する試薬の塩基長は未知である。そのため、最適試薬量を予め決めることができない。この場合、必要に応じて、複数回分注することは、有効である。
【実施例3】
【0037】
実施例1に記載の装置を用いた、一度に複数種類の試薬を分注する方法に関するさらなる実施の例を記載する。
【0038】
実施例2では4種の基質を1種づつ分注しているが、必要に応じて、4種のうち2種、3種或いは全種、すなわち2種以上の基質を同時に分注することが可能である。この際、分注チップは通常の配列解析用と同じものが利用できることが重要である。例えば、多型解析では、伸長プローブ側において多型判定が可能となる用に3’末端を多型とし、その相補性を判断して、多型解析する技術がある。この場合、用いる試薬は、4種の基質の混合溶液である。そのため、通常の配列解析試薬とは取扱いが異なり、多型解析の際には特に4種の基質の混合溶液を準備しなければならない。しかし、本装置では、配列解析を行った後に、反応槽の試料だけ交換し、同じ試薬分注チューブを多型解析に使用することが可能であり、様々な分析を簡便に実現することができる。
【0039】
また、既知の配列の確認解析を行っている場合、予めSNPのヘテロの可能性がある場合は、その2種の塩基を同時に分注することにより、パイロシーケンシングにおいて問題となる位相ズレが生じなくなる。
【実施例4】
【0040】
実施例1に記載の分注チップにつき、実験者への供給に関するさらなる実施の例を記載する。ここで、実験者および供給者の試薬管理が簡便となる例がある。本発明は、4種の核酸基質を、分注チップの試薬槽に注入して利用することができるが、この分注チップに予め4種の核酸基質を分注し、そのまま封入して凍結することが可能である。仮に、試薬販売者が予め試薬の封入および凍結を行えば、実験者はその封入済み分注チップを、分注ヘッドに装填するだけで実験が開始できる。分注チップは滅菌や凍結で劣化せず、生産コストも低いため、分注チップを使いきりとする事により、試薬の汚染による実験ミスの可能性を著しく低減できる。
【産業上の利用可能性】
【0041】
本発明はライフサイエンス及びバイオ産業分野の基本的なツールである核酸を分析する装置、より具体的にはDNA配列決定装置及びDNA検査装置に活用するものである。
【特許請求の範囲】
【請求項1】
第1の液体導出部を具備し、第1の液体を収める第1の槽と、
第2の液体導出部を具備し、第2の液体を収める第2の槽と、
第3の液体導出部を具備し、第3の液体を収める第3の槽と、
第4の液体導出部を具備し、第4の液体を収める第4の槽とが一体として備えられ、
前記第1〜第4の液体導出部の端部は、実質的に同心円上であって点対称に位置されることを特徴とする試薬キット。
【請求項2】
前記第1の液体導出部、前記第2の液体導出部、前記第3の液体導出部、及び前記第4の液体導出部の外径は、9mm以下であることを特徴とする請求項10に記載の試薬キット。
【請求項3】
前記第1の液体導出部、前記第2の液体導出部、前記第3の液体導出部、及び前記第4の液体導出部は、各々キャピラリーであることを特徴とする請求項1に記載の試薬キット。
【請求項4】
前記第1の液体、前記第2の液体、前記第3の液体、及び前記第4の液体の各々は凍結していることを特徴とする請求項1に記載の試薬キット。
【請求項5】
前記第1の槽、前記第2の槽、前記第3の槽、及び前記第4の槽の各々は、前記第1の液体導出部、前記第2の液体導出部、前記第3の液体導出部、及び前記第4の液体導出部との接続部分の各々が、前記第1の液体導出部、前記第2の液体導出部、前記第3の液体導出部、及び前記第4の液体導出部の各々の配置位置を中心とする実質的な円錐形状であることを特徴とする請求項1に記載の試薬キット。
【請求項6】
前記第1〜4の液体は、それぞれdATP, dCTP, dTTP, dGTP又はそれらの少なくともひとつがdNTPの類似体であることを特徴とする請求項1に記載の試薬キット。
【請求項7】
前記dNTPの類似体は、dNTPαSであることを特徴とする請求項5に記載の試薬キット。
【請求項8】
前記第1〜4の槽とそれに対応する前記第1〜4の液体導出部との組を合わせたものが、直径9mm以内で実質的に同心円上で点対象に配置されていることを特徴とする請求項1記載の試薬キット。
【請求項1】
第1の液体導出部を具備し、第1の液体を収める第1の槽と、
第2の液体導出部を具備し、第2の液体を収める第2の槽と、
第3の液体導出部を具備し、第3の液体を収める第3の槽と、
第4の液体導出部を具備し、第4の液体を収める第4の槽とが一体として備えられ、
前記第1〜第4の液体導出部の端部は、実質的に同心円上であって点対称に位置されることを特徴とする試薬キット。
【請求項2】
前記第1の液体導出部、前記第2の液体導出部、前記第3の液体導出部、及び前記第4の液体導出部の外径は、9mm以下であることを特徴とする請求項10に記載の試薬キット。
【請求項3】
前記第1の液体導出部、前記第2の液体導出部、前記第3の液体導出部、及び前記第4の液体導出部は、各々キャピラリーであることを特徴とする請求項1に記載の試薬キット。
【請求項4】
前記第1の液体、前記第2の液体、前記第3の液体、及び前記第4の液体の各々は凍結していることを特徴とする請求項1に記載の試薬キット。
【請求項5】
前記第1の槽、前記第2の槽、前記第3の槽、及び前記第4の槽の各々は、前記第1の液体導出部、前記第2の液体導出部、前記第3の液体導出部、及び前記第4の液体導出部との接続部分の各々が、前記第1の液体導出部、前記第2の液体導出部、前記第3の液体導出部、及び前記第4の液体導出部の各々の配置位置を中心とする実質的な円錐形状であることを特徴とする請求項1に記載の試薬キット。
【請求項6】
前記第1〜4の液体は、それぞれdATP, dCTP, dTTP, dGTP又はそれらの少なくともひとつがdNTPの類似体であることを特徴とする請求項1に記載の試薬キット。
【請求項7】
前記dNTPの類似体は、dNTPαSであることを特徴とする請求項5に記載の試薬キット。
【請求項8】
前記第1〜4の槽とそれに対応する前記第1〜4の液体導出部との組を合わせたものが、直径9mm以内で実質的に同心円上で点対象に配置されていることを特徴とする請求項1記載の試薬キット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2010−268817(P2010−268817A)
【公開日】平成22年12月2日(2010.12.2)
【国際特許分類】
【出願番号】特願2010−187767(P2010−187767)
【出願日】平成22年8月25日(2010.8.25)
【分割の表示】特願2005−341367(P2005−341367)の分割
【原出願日】平成17年11月28日(2005.11.28)
【出願人】(000005108)株式会社日立製作所 (27,607)
【Fターム(参考)】
【公開日】平成22年12月2日(2010.12.2)
【国際特許分類】
【出願日】平成22年8月25日(2010.8.25)
【分割の表示】特願2005−341367(P2005−341367)の分割
【原出願日】平成17年11月28日(2005.11.28)
【出願人】(000005108)株式会社日立製作所 (27,607)
【Fターム(参考)】
[ Back to top ]

