質量分析方法及び質量分析システム
【課題】 物質の構造に関する情報の取得効率を向上し、測定及び物質同定の時間を短縮することのできる質量分析方法を提供する。
【解決手段】 イオントラップ型質量分析装置を用いた質量分析システムにおいて、試料をイオン源でイオン化し、イオントラップ内に蓄積した全イオンに対し、高周波電圧を印加しない低フラグメント化スペクトルと、質量電荷比に依存した周波数をもつ高周波電圧を印加した高フラグメント化スペクトルを取得し、両スペクトルを比較することで、解離しやすい物質を探索することを特徴とする質量分析方法を開示する。
【解決手段】 イオントラップ型質量分析装置を用いた質量分析システムにおいて、試料をイオン源でイオン化し、イオントラップ内に蓄積した全イオンに対し、高周波電圧を印加しない低フラグメント化スペクトルと、質量電荷比に依存した周波数をもつ高周波電圧を印加した高フラグメント化スペクトルを取得し、両スペクトルを比較することで、解離しやすい物質を探索することを特徴とする質量分析方法を開示する。
【発明の詳細な説明】
【技術分野】
【0001】
質量分析法を用いた生体高分子の探索方法に関する。
【背景技術】
【0002】
ヒトにはおよそ10万種のタンパク質が存在すると言われている。タンパク質の機能は、プロテアーゼによる切断、糖鎖やリン酸基などの付加による活性・相互作用調節、ミリスチル化やパルミチル化などのアシル化による膜への局在化など、様々の翻訳後修飾により巧妙な調節を受けている。特に真核生物においては、遺伝子配列をもとに合成されたタンパク質がそのままの状態で機能を発揮することはむしろまれで、リボソーム上での合成後にその場で、あるいは細胞内での最終的な局在が決まるまでの様々の段階で多種多様な修飾を受ける。時間空間的に変化するこれらの生体高分子はゲノム情報のみでは決定できず、タンパク質を直接解析して初めて決定できる。
【0003】
その構造解析手段の1つとして、質量分析法(mass spectrometry)がある。質量分析法を用いて、生体高分子を構成するアミノ酸がペプチド結合でつながったポリペプチド(ペプチドやタンパク質)の配列情報や翻訳後修飾情報を得ることができる。とくに高周波電場を用いたイオントラップやQマスフィルターを用いた質量分析法や、飛行時間型質量分析法(Time-of-Flight :TOF) は高速分析法のため、液体クロマトグラフィー装置などに代表される試料を分離する前処理手段との結合性がよい。そこで、多種類の試料を連続解析することが求められるプロテオーム解析などの目的に合致しており、幅広く使われている。
【0004】
一般に質量分析法では、試料分子をイオン化して真空中に導入し( または真空中でイオン化し) 、電磁場中におけるそのイオンの運動を測定することにより、対象とする分子イオンの電荷と質量の比(m/z)が測定される。得られる情報が質量と電荷の比という巨視的な量であるため、単に1度の質量分析操作では内部構造情報まで得ることは出来ない。そこで、タンデム質量分析法と呼ばれる方法が用いられる。すなわち、1回目の質量分析操作で試料分子イオンを特定する、もしくは、単離する。このイオンをプリカーサーイオンとよぶ。つづいて、このプリカーサーイオンを何らかの手法で解離する。解離したイオンをフラグメントイオンと呼ぶ。そのフラグメントイオンをさらに質量分析することにより、フラグメントイオンの生成パターンの情報を得る。解離手法により、解離パターンの法則性があるので、親イオンの配列構造を推察することが可能となる。とくに、アミノ酸を骨格とする生体分子の分析分野では、解離手法として衝突励起解離( Collision-Induced-Dissociation:CID)、赤外多光子吸収(Infra-Red-Multi-Photon-Dissociation:IRMPD) そして、電子捕獲解離(Electron-Capture-Dissociation:ECD)や電子移動解離(Electron-Transfer-Dissociation:ETD)が使われる。
【0005】
タンパク質解析分野において、現在もっとも広く使われている手法がCIDである。プリカーサーイオンに運動エネルギーを与えてガスと衝突させる。衝突により分子振動が励起されて、分子鎖の切れやすい部分で解離する。また、最近使われるようになった方法がIRMPDである。親イオンに赤外レーザ光を照射して、多数の光子を吸収させる。分子振動が励起されて、分子鎖の切れやすい部位で解離する。解離部位は図3に示す。a,b,cはNH2末端側を含む分子、x,y,zはCOOH末端側を含む分子である。CIDやIRMPDで切れやすい部位は、アミノ酸配列からなる主鎖のうち、a - x、b - yで命名されている部位である。a- x、b - yの部位であっても、アミノ酸配列パターンによっては切れにくい場合があるために、CID やIRMPDのみでは完全な構造解析ができないことが知られている。そのために、酵素などを用いた前処理が必要になり、高速な分析を妨げている。また、翻訳後修飾を受けた生体高分子では、CID やIRMPDを用いると、ポリペプチド側鎖に存在する翻訳後修飾が切れやすい傾向がある。側鎖が切れやすいため、失われた質量から修飾分子種と修飾されているかどうかの判定は可能である。ただし、どのアミノ酸部分で修飾されていたかという修飾部位に関する重要な情報は失われる。
【0006】
一方、ECDやETDは、アミノ酸配列に依存せず( ただし例外として環状構造であるプロリン残基のN末端側は切断しない)、アミノ酸配列の主鎖上のc - z部位の1 箇所を切断する。そのために、タンパク質分子を質量分析的手法のみで完全解析出来る。また、側鎖を切断しにくいという特徴をもっていることから、翻訳後修飾の研究・解析の手段として適している。このために、近年特に注目を受けているのがこのECDやETDという解離手法である。
【0007】
最近、質量分析装置や液体クロマトグラフィーの進化、さらにデータベースの充実によって大規模タンパク質解析が実現しつつある。しかし、それでも一度に分析できるタンパク質としては、せいぜい数千種類が限度である。そのため、すべてのタンパク質を対象にするのではなく、特定の集団だけを相手にするいわゆる「フォーカスド・プロテオーム」が昨今の主流になりつつある。
【0008】
例えば、代表的な翻訳後修飾であるリン酸にフォーカスした分析が盛んに行われている。リン酸化物を分析するには2つの課題がある。一つ目として、リン酸化物は非リン酸化物に比べ、数倍から数百倍イオン化効率が低くなることがある。2つめとして、CIDを解離手法とする場合、タンパク質のままでは解離が困難なため、酵素消化によって、ペプチド断片化する必要がある。分子量40万のタンパク質が酵素消化により400断片のペプチドに分解されたと仮定すると、全タンパク質のおよそ30%存在していたリン酸化物は、酵素消化により存在比は0.08%以下になると試算される(非特許文献1)。
【0009】
この2つの制限により、ペプチド断片化した生体試料サンプルをそのまま質量分析してもリン酸化ペプチドが同定できることはほとんどない。そこで、現在、リン酸化ペプチドを特異的に検出するための手法がいくつか存在する。
まず、サンプル調製方法としては、負に帯電したリン酸基が鉄やガリウムに静電的に結合する原理を利用した金属キレートアフィニティクロマトグラフィーを用いることによって、リン酸化物を特異的に精製する手法が広く利用されている。その他、抗体を利用した精製方法も存在する。しかし、特異的に目的物を精製しても多くの夾雑物が混入してくる。そこで、質量分析において、CIDに特徴的である翻訳後修飾部位の脱離を利用した特異的検出手法が利用されている。CIDによるタンデム質量分析法では、多くの場合、リン酸化ペプチドからリン酸基だけが失われたフラグメントイオンと、リン酸基に由来するフラグメントイオンが生成する。前者に注目してリン酸化ペプチドを探索する手法はニュートラルロススキャン法と呼ばれている。 リン酸化ペプチドでニュートラルロスが発生した場合、分子量が98小さいフラグメントイオンが観察される。このイオンが観察されれば、その親イオンは高い確率でリン酸化ペプチドだと推測される。その場合、ニュートラルロスイオンに対して、CIDを実施したり、親イオンに対して、ECDやETDを実施することで、そのアミノ酸配列や修飾部位の同定を行っている。プリカーサーイオンスキャン法は、特定のフラグメントイオンを生成する全てのプリカーサーイオンをスキャンする測定方法である。1台目の質量分離部MS-1のスキャンで透過したイオンを、コリジョンセルでCIDを行い、得られたフラグメントイオンの中で、特定のm/zのイオンのみを2台目の質量分離部MS-2で検出する。このようにして、MS-2で特定のフラグメントイオンが検出された時、MS-1を通過したプリカーサーイオンを特定する。リン酸基を特異的に検出する場合は、ネガティブモードで、m/z79(PO3-)をMS-2で検出する。(非特許文献2)
タンデム質量分析法ではイオン強度が高いプリカーサーイオンほど多種類のフラグメントイオンが高いイオン強度で検出される可能性が高い。そのため、イオン強度順にプリカーサーイオンを選択し、分析する方法が一般的である。図2に多数の非リン酸化に紛れたリン酸化ペプチドを解析した場合の模式図を示す。MS1スペクトルで様々なイオンが検出される。その中からイオン強度順にプリカーサーイオンが選択される。イオン1が1番目にMS/MS解析され、イオン2が2番目にMS/MS解析される。しかしこれらのイオンはリン酸化ペプチドではないため、ニュートラルロスは検出されない。3番目にMS/MS解析されたイオン3ではリン酸基の分子量98だけが失われたフラグメントイオン5と解離せずに残ったプリカーサーイオン4が検出された。これらの結果により、イオン3は高い確率でリン酸化ペプチドであると判断され、様々な解離方法で詳細解析される。このように、この方法では、目的物ではない非リン酸化物も分析対象となっており、非効率的である。最大の欠点はニュートラルロススキャン法にしてもプリカーサーイオンスキャン法にしても、プリカーサーイオンを解離してみなければリン酸化物かそうでないかの判断ができない点にある。
【0010】
また、一般的な翻訳後修飾のひとつである糖鎖は8種類の単糖が鎖状に連結、あるいは、分岐した構造を持ち、タンパク質に修飾されている。糖鎖はリン酸基とは異なり、一定の分子量をもたないため、ニュートラルロススキャン法を用いることは難しい。また、プリカーサーイオンスキャン法を用いた場合、ある単糖を指標にその単糖が含まれる糖鎖ポリペプチドを探索することは可能ではあるが、すべての糖鎖ポリペプチドを一斉に探索することは困難である。
【0011】
そこで、イオン源でイオン化された全イオン、あるいは、一部のイオンに対し、高フラグメント化スペクトルと低フラグメント化スペクトルを取得し、両者を比較することによってプリカーサーイオンを選択する方法が特許文献1に記載されている。フラグメント化はコリジョンセルと呼ばれるイオンを解離させるための部屋で実施される。高フラグメント化スペクトルはコリジョンセルに高い電圧を印加し、選択された全てのイオンを解離させる。低フラグメント化スペクトルはコリジョンセルに低い電圧を印加し、ほとんどイオンを解離させることなくコリジョンセルを通過させている。
【0012】
【非特許文献1】実験医学 Vol.23 No.19 2005,p2951-2956.
【非特許文献2】プロテオミクス実験プロトコール(秀潤社)p156-168
【特許文献1】特開2002-110081.
【発明の開示】
【発明が解決しようとする課題】
【0013】
タンパク質やペプチドの定性解析では、アミノ酸配列の同定だけでなく、翻訳後修飾の種類や修飾物の構造あるいは修飾部位の同定が求められる。サンプルは貴重であるため、効率よく最大限のアウトプットを獲得することが求められる。そのため、サンプル調製の段階で特異的な精製を実施し、質量分析では、目的物質を特異的に検出する手法を用いて解析を実施している。
【0014】
前述したように、代表的なフォーカスドプロテオームであるリン酸化をターゲットにした解析では、リン酸化物特異的な精製を実施した後に、CIDを用いたニュートラルロススキャン法、プリカーサーイオンスキャン法によって、リン酸化ペプチドの探索を行う。しかし、これらの方法では親イオンはイオン強度順に選択されるのが一般的であり、リン酸化物であるかどうかはCIDを実施して初めて判明する。このため、非効率的である。特許文献1の方法では、フラグメント化スペクトルを取得するためにコリジョンセルを使用している。コリジョンセルにある一定の電圧を印加し、イオンをコリジョンセルに導入しガスとの衝突によって解離を起こす。しかし、ある一定の電圧、つまりある一定のエネルギーが個々のイオンの解離に用いられる。分子量が小さく化学結合部位が少ないイオンに対しては、十分な解離エネルギーであっても、分子量が大きく化学結合部位が多いイオンでは解離が起きないため、リン酸化ペプチドを見落とす可能性がある。また、解離が困難なイオンを解離するため、高いエネルギーに設定した場合、比較的低いエネルギーでニュートラルロスを起こしたイオンがさらに解離し、リン酸化ペプチドを見落とす可能性もある。
【0015】
本発明は、以上の課題を解決し、物質の構造に関する情報の取得効率を向上させる質量分析方法を提供することを目的とする。
【課題を解決するための手段】
【0016】
本発明の質量分析方法では、試料をイオン化する工程と、イオン化されたイオンをイオントラップ部に蓄積する工程と、イオントラップ部をイオントラップ部に蓄積したイオンを実質的に解離させない第1の条件で動作させる工程と、第1の条件で動作させたイオントラップ部から排出されたイオンの低フラグメント化質量スペクトルを取得する工程と、イオントラップ部を前記第1の条件とは異なる第2の条件で動作するよう切替える工程と、第2の条件で動作させたイオントラップ部から排出されたイオンの高フラグメント化質量スペクトルを取得する工程と、低フラグメント化質量スペクトルと高フラグメント化質量スペクトルとを比較し、所定の条件により分析対象イオンを選択する工程と、を有することを特徴とする。
【0017】
本発明の質量分析システムは、試料をイオン化させるイオン源と、イオン源によりイオン化されたイオンを蓄積し、特定の質量範囲のイオンを排出するイオントラップ部と、イオントラップ部より排出されたイオンを質量分析する質量分析部と、イオントラップ部に蓄積したイオンを実質的に解離させない第1の条件、及び、第1の条件とは異なる第2の条件で動作するようにイオントラップ部を構成する電極に印加する電圧を制御する制御部と、第1の条件でイオントラップ部から排出されたイオンの低フラグメント化質量スペクトル、及び、第2の条件でイオントラップ部から排出されたイオンの高フラグメント化質量スペクトルを取得し、低フラグメント化質量スペクトルと高フラグメント化質量スペクトルとを比較し、所定の条件により分析対象イオンを選択する機能を有する全体処理部と、を有することを特徴とする。
【発明の効果】
【0018】
本発明によると、特定の物質を精度高く優先的に詳細分析することが可能であり、質量分析による物質の同定において、物質の構造に関する情報を取得する効率が向上し、測定及び物質同定の時間が短縮する。
【実施例1】
【0019】
図8に、本発明に基づく質量分析システムの構成例を示す。分析対象の試料101は、ガスクロマトグラフ(GC)または液体クロマトグラフ102の前処理により分離される。分離された試料は、イオン源103においてイオン化され、質量分析装置に導入される。導入されたイオンはリニアイオントラップ(LIT)104で蓄積され、特定のイオン(あるいは全イオン)を単離し、単離されたイオンはガスとの衝突により解離され、排出される。低フラグメントスペクトルの場合、全イオンを単離し、解離させないで排出する。高フラグメントスペクトルの場合、全イオンを単離し、解離させてから排出する。排出されたイオンはTOF検出器107でイオンの質量電荷比m/zに応じて分離される。TOF検出器107の前段には高分解能であるTOFが存在する。イオン源は、エレクトロスプレイイオン源、大気圧化学イオン化によるイオン源、マトリックス支援レーザ脱離イオン源、電気衝撃イオン源、化学イオン化によるイオン源、フィールドイオン化によるイオン源から選択され、正イオン化でも負イオン化でもかまわない。LIT104は多くのイオンが蓄積できるため、高感度検出が可能であるが、三次元四重極イオントラップでもかまわない。また、本装置構成では、イオン解離方法としてCIDを用いているが、IRMPDでも可能だと推測される。また、ECDやETDを用いてもよい。TOF106は高分解能で質量精度も高いので好ましいが、四重極質量フィルター、イオントラップ、磁場型質量分析器、フーリエ変換イオンサイクロトロン共鳴質量分析器でもかまわない。
【0020】
イオン検出器107で検出された各イオンは、m/z値と共に全体処理部108でデータ整理・処理され、その分析結果である質量分析データ、あるいは、低フラグメントスペクトルと高フラグメントスペクトルの差分スペクトルはデータ表示部115にて表示される。この一連の質量分析過程、すなわち、試料の分離、イオン化、質量分析装置内のイオン輸送、及び、解離、質量分離、及び、イオン検出、データ処理の全体を全体処理部108で制御する。パラメータ入力部115からユーザの必要な情報である高周波電圧決定部109、解離物イオン、ニュートラルロス決定部112を入力する。イオントラップで解離に用いる高周波電圧の周波数と振幅は分析したい物質により、設定され、高周波電圧決定部109に入力する。例えば、糖鎖のシアル酸やフコースは解離しやすいことが知られている。これらを含む糖鎖ペプチドを優先的に解析する場合、弱い高周波電圧を印加し、他の糖鎖ペプチドも一斉に分析する場合は、特定の糖鎖ペプチドを優先的に解析する場合よりも強い高周波電圧条件で分析される。
【0021】
差分スペクトルからプリカーサーイオンを選択するためのパラメータとして、プリカーサーイオンの強度、プリカーサーイオンのm/z値や分子量、イオン強度の減少量、価数、フラグメントイオンとの分子量の差が一定(ニュートラルロス)、などが入力される。これらによって、プリカーサーイオン決定部113にてプリカーサーイオンが決定される。プリカーサーイオンの選択は実時間で実施され、分析を妨げない必要がある。さらに、プリカーサーイオンが選択できない場合は、自動的に高周波電圧を高く設定し、プリカーサーイオンが多く選択され、詳細解析が間に合わない場合は、自動的に高周波電圧を低く設定する制御システムがあることが望ましい。
【0022】
選択されたプリカーサーイオンは詳細解析され、アミノ酸配列や修飾部位を同定する必要がある。その場合、ECDやETDなどの解離方法が適している。
【0023】
図9に、ECDを使用した場合の構成例を示す。分析対象の試料101は、ガスクロマトグラフ(GC)または液体クロマトグラフ112の前処理により分離される。分離された試料は、イオン源103においてイオン化され、質量分析装置に導入される。導入されたイオンはLIT104で蓄積され、特定のイオン(あるいは全イオン)を単離し、単離されたイオンはガスとの衝突により解離され、排出される。低フラグメントスペクトルの場合、全イオンを単離し、解離させないで排出する。高フラグメントスペクトルの場合、全イオンを単離し、解離させてから排出する。排出されたイオンはQディフレクター116を通過し、TOF検出器107でイオンの質量電荷比m/zに応じて分離される。TOF検出器107の前段には高分解能であるTOFが存在する。LIT104は多くのイオンが蓄積できるため、高感度検出が可能であり、TOF106は高分解能で質量精度も高いので好ましい。
【0024】
イオン検出器107で検出された各イオンは、m/z値と共に全体処理部108でデータ整理・処理され、その分析結果である質量分析データ、あるいは、低フラグメントスペクトルと高フラグメントスペクトルの差分スペクトルはデータ表示部115にて表示される。この一連の質量分析過程、すなわち、試料の分離、イオン化、質量分析装置内のイオン輸送、及び、解離、質量分離、及び、イオン検出、データ処理の全体を全体処理部108で制御する。パラメータ入力部115からユーザの必要な情報である高周波電圧周波数決定部109、解離物イオン、ニュートラルロス決定部112を入力する。イオントラップで解離に用いる高周波電圧の周波数と振幅は分析したい物質により、設定され、高周波電圧決定部109に入力する。さらに、差分スペクトルからプリカーサーイオンを選択するためのパラメータとして、プリカーサーイオンの強度、プリカーサーイオンのm/z値、イオン強度の減少量、価数、比較スペクトル面積値の減少率、解離物イオン、ニュートラルロスの分子量などが入力される。これらによって、プリカーサーイオン決定部113にてプリカーサーイオンが決定される。選択されたプリカーサーイオンは詳細解析される。詳細解析方法として、ユーザはイオン解離決定部118でイオン解離方法を選択することができる。
【0025】
CIDで詳細解析を実施する場合、導入されたイオンはLIT104で蓄積され、プリカーサーイオンを単離し、単離されたイオンはCIDにより解離され、生成したフラグメントイオンは排出される。排出されたフラグメントイオンはQディフレクター116を通過し、TOF検出器107でイオンの質量電荷比m/zに応じて分離される。その質量スペクトルからアミノ酸配列や修飾部位を同定する。
【0026】
ECDで詳細解析を実施する場合、導入されたイオンはLIT104で蓄積され、プリカーサーイオンを単離し、単離されたイオンは排出される。排出されたイオンはQディフレクター116を通過し、ECDセル117に導入され、ECDにより解離させる。生成したフラグメントイオンはQディフレクター116を通過し、TOF検出器107でイオンの質量電荷比m/zに応じて分離される。その質量スペクトルからアミノ酸配列や修飾部位を同定する。
【0027】
また、CIDは2,3価など低い価数のイオンを効率的に解離し、ECDやETDは、高い価数のイオンを効率的に解離することが知られている。ユーザは価数の閾値を設定し、ある価数以上のイオンに対しては、ECDやETD、ある価数未満のイオンに対しては、CIDやIRMPDで詳細解析を実施することも可能である。
【0028】
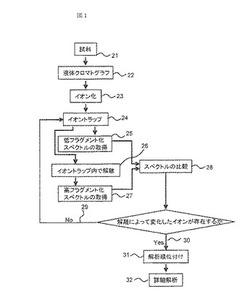
図1に本発明に基づく物質同定フローを示す。複数物質の混合物である試料21は、液体クロマトグラフ22やガスクロマトグラフに導入される。クロマトグラフには物質の性質によって分離させるための分離カラムが装着されており、分離カラムを通過した試料は、成分ごとに異なる時間に溶出する。溶出した試料の各成分は、イオン源にて、イオン化23される。イオンは質量分析装置内のイオントラップ24に導入、蓄積され、排出される。排出されたイオンは検出器にて検出され、横軸m/z、縦軸イオン強度の低フラグメント化スペクトルを得る(25)。次に、イオン源にて、イオン化23されたイオンは前述と同条件でイオントラップ24に導入し、蓄積される。このイオンに対しては所定の強度で解離26を実行、排出し、高フラグメント化スペクトルを得る(27)。獲得した両スペクトルを比較する(28)。比較の結果、イオン強度が変化したイオンが存在しない場合(29)、低フラグメント化スペクトル25と高フラグメント化スペクトル27を測定し、比較する(28)。イオン強度が変化したイオンが存在する場合(30)、解析の優先順位付けを実施し(31)、優先順位の高いイオンから詳細な解析を実施する32。
【0029】
優先順位の決定パラメータとして考えられるものとして、1.一定以上のイオン強度をもつイオン、2.減少率の大きいイオン、3.増加率の大きいイオン、4.分子量の大きさ、5.イオン強度が減少したイオンとイオン強度が増加したイオンの分子量の差が特定の値に一致するもの、あるいはさらに、そのイオン減少量と増加量が誤差を含む一定値であること、6.価数、7.あるイオンの質量スペクトルでの面積値の減少率などが挙げられる。
【0030】
イオン強度が高いイオンと比べ、低いイオンをある特定の解離方法で解離し詳細解析する場合、そのフラグメントイオンは低く、同定は困難となる。そのため、一定の閾値以上のイオンを選択することが望ましい(1)。
【0031】
ある特定の解離方法で解離し詳細解析する場合、その解離手法によって、適する分子量の範囲が存在する。そのため、解離手法によって分子量の範囲を指定することが望ましい(4)。
【0032】
所定の強度で修飾物をもつイオン解離させ、修飾物由来のイオンとポリペプチド由来のイオンに解離した場合、これらのイオンは増加し、元のイオンは減少する。ある特定の修飾物をもつイオンを優先的に分析したい場合、ポリペプチド由来のイオンと元のイオンの分子量差がその修飾物固有の値であることを検知し、元のイオンを詳細解析することができる。また、それらのイオンの増加量と減少量は一致するはずである(5)。
【0033】
ある特定の解離方法で解離し詳細解析する場合、その解離手法によって、適する価数の範囲が存在する。そのため、解離手法によって価数の範囲を指定することが望ましい(6)。
【0034】
修飾物のポリペプチドの結合はペプチド結合よりも一般的に解離しやすいため、所定の強度で解離させた場合、修飾物は解離し、低フラグメント化スペクトルと比較すると高フラグメント化スペクトルでは修飾を持つイオンは減少する(2)。
【0035】
しかし、低フラグメント化スペクトルでイオン強度1000のイオンが高フラグメント化スペクトルでイオン強度900になったものと低フラグメント化スペクトルでイオン強度100のイオンが高フラグメント化スペクトルでイオン強度0になったものでは、イオン強度の減少量は同値となる。そこで、イオン強度が一定以上減少したイオンについては質量スペクトルでの面積値比較が有効となる(7)。
【0036】
イオン強度が変化したイオンが存在しない場合(29)、ユーザが予めプリカーサーイオン個数を設定し、閾値よりも少ない場合、より解離が起きやすくするため高周波電圧を大きく設定し、閾値よりも多い場合、解離を抑えるように高周波電圧を小さく設定する自動制御システムが搭載されていても良い。
【実施例2】
【0037】
糖鎖修飾ペプチドの例
低フラグメント化スペクトルと高フラグメント化スペクトルを取得する方法としては、通常イオントラップ内での単離に用いられるシステムをそのまま使用した。通常混合物であるサンプルはイオン化され、ある一定時間内イオントラップ内に蓄積される。通常、その中からある親イオンだけをイオントラップ内に単離する。単離は選択された親イオンのm/z値±数m/zの範囲以外に数ms間、高周波電圧を印加し、分子に運動エネルギーを与えることでイオントラップの外へとイオンを排除する。印加される高周波電圧は、m/z値に依存する周波数を重畳した高周波電圧にFNF Gainと呼ばれる値を乗ずる。本方法の目的は全イオンをガスと衝突させることで、壊れやすいポリペプチドを解離させ、解離させなかったスペクトルと比較することで、翻訳後修飾ポリペプチドを探索することである。そのため、低フラグメント化スペクトルとはFNF Gain 値を0に設定し、そのスペクトルを取得した。高フラグメント化スペクトルはあるFNF Gain 値を与え、そのスペクトルを取得した。
【0038】
糖鎖ペプチドは卵黄から精製したKVANKTを用いた。糖鎖はアスパラギン(N)に結合し、本修飾ペプチドの分子量は2865である。このペプチドに3種類の非修飾ペプチド1:AWAVAR(分子量672.4)、非修飾ペプチド2:HPDYSVVLLLR(分子量1310.8)、非修飾ペプチド3:LCTVATLR(分子量876.5)を混合し、サンプルとした。サンプルはシリンジポンプを用いて、一定流量で質量分析装置に導入した。
【0039】
イオン化したサンプルは一定時間内イオントラップ内に蓄積し、全イオンに対し、0.2ms間、FNF Gain値0で図4の低フラグメント化スペクトル41を取得した。高フラグメント化スペクトル42はFNF Gain値14で取得した。横軸がm/zで、縦軸がイオン強度を示す。糖鎖ペプチドは3価イオン48として検出された。非修飾ペプチド1はイオン43,44として検出された。イオン43は2価イオンであり、イオン44は1価イオンである。非修飾ペプチド2は2価イオン45として検出された。非修飾ペプチド3はイオン46,47として検出された。イオン46は2価イオンであり、イオン47は1価イオンである。低フラグメント化スペクトルと高フラグメント化スペクトルを比較すると、高フラグメント化スペクトルでは糖鎖ペプチドイオン48のイオン強度が減少している。イオン強度順に定性解析する場合、糖鎖ペプチドイオン48の強度は11番目の強度であり、分析されない可能性が高い。
【0040】
次に低フラグメント化スペクトルから高フラグメント化スペクトルの差分を求めたスペクトルを図5に示す。横軸がm/zで、縦軸がイオン強度の差分を示す。正の値になっているイオンは高フラグメント化スペクトルでイオン強度が増加したイオン、負の値になっているイオンは高フラグメント化スペクトルでイオン強度が減少したイオンである。高フラグメント化スペクトルで大きく増加したイオン56は不純物だと思われる。糖鎖ペプチド53は減少している。非修飾ペプチド1は2価イオン51が減少し、1価イオン55はわずかに増加している。非修飾ペプチド2イオン54は減少している。非修飾ペプチド3の2価イオン52は減少し、1価イオン57はわずかに増加している。修飾部位の結合がペプチド結合よりも弱いという観点から探索する場合、単純に減少したイオン順に定性解析を実施することも可能である。糖鎖ペプチド53の減少イオン量は2番目である。優先順位11位であった糖鎖ペプチドは本方法により優先順位2位となった。しかし、低フラグメント化スペクトルでイオン強度1000であったイオンが高フラグメント化スペクトルで900になった場合(減少率10%)と低フラグメント化スペクトルでイオン強度100であったイオンが高フラグメント化スペクトルで0になった場合(減少率100%)、減少イオン量は同等となる。
【0041】
そこで、イオン51〜53のイオンピーク面積値を比較した(表1)。
表1 糖鎖ポリペプチドの差分スペクトルでイオン減少量が大きいイオンの面積値比較の表

【0042】
表1は各イオンの低フラグメント化スペクトル、及び、高フラグメント化スペクトルでの面積値、各面積値において低フラグメント化スペクトルに対する高フラグメント化スペクトルの割合、その割合から最も減少率の大きいものからタンデムマス優先順位をつけた。その結果、イオン51(非修飾ペプチド1:337.2m/z)では、18%程度、イオン52(非修飾ペプチド3:438.0m/z)では4%程度しかイオン面積値が減少していないのに対し、イオン53(糖鎖ペプチド:956.0m/z)では、59%イオン面積値が減少した。この面積値比較によると、優先順位は1位となる。
【実施例3】
【0043】
リン酸化ペプチドの例
リン酸化ペプチドはLCTVApTLR(分子量954.5)を用いた。リン酸基は2番目のスレオニン(T)に結合している。このペプチドに3種類の非修飾ペプチド1:AWAVAR(分子量672.4)、非修飾ペプチド2:HPDYSVVLLLR(分子量1310.8)、非修飾ペプチド3:LCTVATLR(分子量876.5)を混合し、サンプルとした。サンプルはシリンジポンプを用いて、一定流量で質量分析装置に導入した。イオン化したサンプルは一定時間内イオントラップ内に蓄積し、全イオンに対し、0.2ms間、FNF Gain値0で図6の低フラグメント化スペクトル66を取得した。高フラグメント化スペクトル67はFNF Gain値17で取得した。横軸がm/zで、縦軸がイオン強度を示す。リン酸化ペプチドは1価イオン65として検出された。非修飾ペプチド1はイオン60,63として検出された。イオン60は2価イオンであり、イオン63は1価イオンである。非修飾ペプチド2は2価イオン62として検出された。非修飾ペプチド3はイオン61,64として検出された。イオン61は2価イオンであり、イオン64は1価イオンである。低フラグメント化スペクトルと高フラグメント化スペクトルを比較すると、高フラグメント化スペクトルではリン酸化ペプチドイオン65とイオン60のイオン強度が減少している。イオン強度順に定性解析する場合、糖鎖ペプチドイオン48の強度は10番目の強度であり、分析されない可能性が高い。
【0044】
次に低フラグメント化スペクトルから高フラグメント化スペクトルの差分を求めたスペクトルを図7に示す。横軸がm/zで、縦軸がイオン強度の差分を示す。正の値になっているイオンは高フラグメント化スペクトルでイオン強度が増加したイオン、負の値になっているイオンは高フラグメント化スペクトルでイオン強度が減少したイオンである。高フラグメント化スペクトルで大きく増加したイオン83は不純物だと思われる。リン酸化ペプチドイオン82は減少している。非修飾ペプチド1は2価イオン80が減少し、1価イオン86はわずかに増加している。非修飾ペプチド2イオン85はわずかに増加している。非修飾ペプチド3の2価イオン84はわずかに増加し、1価イオン81はわずかに減少している。修飾部位の結合がペプチド結合よりも弱いという観点から探索する場合、単純に減少したイオン順に定性解析を実施することも可能である。リン酸化ペプチドイオン82の減少イオン量は最も大きかった。優先順位10位であった糖鎖ペプチドは本方法により優先順位1位となった。
イオン80〜82のイオンピーク面積値を比較した結果を表2に示す。
表2 糖鎖ポリペプチドの差分スペクトルでイオン減少量が大きいイオンの面積値比較の表

【0045】
表2は各イオンの低フラグメント化スペクトル、及び、高フラグメント化スペクトルでの面積値、各面積値において低フラグメント化スペクトルに対する高フラグメント化スペクトルの割合、その割合から最も減少率の大きいものから優先順位をつけた。イオン80(非修飾ペプチド1:337.2m/z)では、54%程度、イオン87(イオン由来不明:539.3m/z)では83%程度イオン面積値が減少したのに対し、イオン82(リン酸化ペプチド:955.5m/z)では、90%イオン面積値が減少した。この面積値比較でも優先順位は1位となる。
【図面の簡単な説明】
【0046】
【図1】本発明に基づく翻訳後修飾ポリペプチド探索のフロー図。
【図2】従来の翻訳後修飾ポリペプチド探索の概略図(ニュートラルロススキャン)。
【図3】ポリペプチドの解離パターン。
【図4】糖鎖ポリペプチド探索の実施例。低フラグメント化スペクトルと高フラグメント化スペクトル図。
【図5】糖鎖ポリペプチドの高フラグメント化スペクトルと低フラグメント化スペクトルの差分スペクトル図。
【図6】リン酸化ペプチド探索の実施例。低フラグメント化スペクトルと高フラグメント化スペクトル図。
【図7】リン酸化ペプチドの高フラグメント化スペクトルと低フラグメント化スペクトルの差分スペクトル図。
【図8】本発明に基づく質量分析システムの構成例を示す図。
【図9】本発明に基づくECDセルを含む質量分析システムの構成例を示す図。
【符号の説明】
【0047】
1:優先順位1位のイオン、2:優先順位2位のイオン、3:優先順位3位のイオン、4:解離しなかったイオン3、5:リン酸基を失ったイオン3、6:低フラグメント化スペクトル、7:高フラグメント化スペクトル、8:高フラグメント化スペクトルでイオン量が減少したイオン、9:高フラグメント化スペクトルでイオン量が増加したイオン、10:比較スペクトル、11:高フラグメント化スペクトルで減少したイオンとその減少量、12:高フラグメント化スペクトルで増加したイオンとその増加量、21:試料導入、22:試料分離(LCまたはGC)、23:イオン化(ポジティブまたはネガティブ)、24:イオントラップ、25:低フラグメント化スペクトルの取得、26:イオントラップ内での解離、27:高フラグメント化スペクトルの取得、28:低フラグメント化スペクトルと高フラグメント化スペクトルの比較、29:基準を満たす変化したイオンが存在しない場合、30:基準を満たす変化したイオンが存在する場合、31:イオンの優先順位付け、32:様々な解離手法による詳細解析、41:糖鎖ペプチドと非修飾ペプチドの混合物における低フラグメント化スペクトル、42:糖鎖ペプチドと非修飾ペプチドの混合物における低フラグメント化スペクトル、43:非修飾ペプチド1の2価イオン、44:非修飾ペプチド1の1価イオン、45:非修飾ペプチド2の2価イオン、46:非修飾ペプチド3の2価イオン、47:非修飾ペプチド3の1価イオン、48:糖鎖ペプチドの3価イオン、51:非修飾ペプチド1の2価イオン、52:非修飾ペプチド3の2価イオン、53:糖鎖ペプチドの3価イオン、54:非修飾ペプチド2の2価イオン、55:非修飾ペプチド1の1価イオン、56:身元不明イオン、57:非修飾ペプチド3の1価イオン、60:非修飾ペプチド1の2価イオン、61:非修飾ペプチド3の2価イオン、62:非修飾ペプチド2の2価イオン、63:非修飾ペプチド1の1価イオン、64:非修飾ペプチド3の1価イオン、65:リン酸化ペプチドの2価イオン、66:リン酸化ペプチドと非修飾ペプチドの混合物における低フラグメント化スペクトル、67:リン酸化ペプチドと非修飾ペプチドの混合物における高フラグメント化スペクトル、80:非修飾ペプチド1の2価イオン、81:非修飾ペプチド3の1価イオン、82:リン酸化ペプチドの2価イオン、83:身元不明イオン、84:非修飾ペプチド3の2価イオン、85:非修飾ペプチド2の2価イオン、86:非修飾ペプチド1の1価イオン、87:身元不明イオン、101:試料導入、102:試料分離(LCまたはGC)、103:イオン化、104:リニアイオントラップ(LIT)、105:質量分析装置制御部、106:TOF部、107:TOF検出器、108:全体処理部、109:解析手段決定部、110:高周波電圧周波数決定部、112:解離物イオン、及び、ニュートラルロス決定部、113:プリカーサーイオン決定部、115:データ表示部/パラメーター入力部、
116:Qディフレクター、117:ECDセル、118:イオン解離方法決定部
【技術分野】
【0001】
質量分析法を用いた生体高分子の探索方法に関する。
【背景技術】
【0002】
ヒトにはおよそ10万種のタンパク質が存在すると言われている。タンパク質の機能は、プロテアーゼによる切断、糖鎖やリン酸基などの付加による活性・相互作用調節、ミリスチル化やパルミチル化などのアシル化による膜への局在化など、様々の翻訳後修飾により巧妙な調節を受けている。特に真核生物においては、遺伝子配列をもとに合成されたタンパク質がそのままの状態で機能を発揮することはむしろまれで、リボソーム上での合成後にその場で、あるいは細胞内での最終的な局在が決まるまでの様々の段階で多種多様な修飾を受ける。時間空間的に変化するこれらの生体高分子はゲノム情報のみでは決定できず、タンパク質を直接解析して初めて決定できる。
【0003】
その構造解析手段の1つとして、質量分析法(mass spectrometry)がある。質量分析法を用いて、生体高分子を構成するアミノ酸がペプチド結合でつながったポリペプチド(ペプチドやタンパク質)の配列情報や翻訳後修飾情報を得ることができる。とくに高周波電場を用いたイオントラップやQマスフィルターを用いた質量分析法や、飛行時間型質量分析法(Time-of-Flight :TOF) は高速分析法のため、液体クロマトグラフィー装置などに代表される試料を分離する前処理手段との結合性がよい。そこで、多種類の試料を連続解析することが求められるプロテオーム解析などの目的に合致しており、幅広く使われている。
【0004】
一般に質量分析法では、試料分子をイオン化して真空中に導入し( または真空中でイオン化し) 、電磁場中におけるそのイオンの運動を測定することにより、対象とする分子イオンの電荷と質量の比(m/z)が測定される。得られる情報が質量と電荷の比という巨視的な量であるため、単に1度の質量分析操作では内部構造情報まで得ることは出来ない。そこで、タンデム質量分析法と呼ばれる方法が用いられる。すなわち、1回目の質量分析操作で試料分子イオンを特定する、もしくは、単離する。このイオンをプリカーサーイオンとよぶ。つづいて、このプリカーサーイオンを何らかの手法で解離する。解離したイオンをフラグメントイオンと呼ぶ。そのフラグメントイオンをさらに質量分析することにより、フラグメントイオンの生成パターンの情報を得る。解離手法により、解離パターンの法則性があるので、親イオンの配列構造を推察することが可能となる。とくに、アミノ酸を骨格とする生体分子の分析分野では、解離手法として衝突励起解離( Collision-Induced-Dissociation:CID)、赤外多光子吸収(Infra-Red-Multi-Photon-Dissociation:IRMPD) そして、電子捕獲解離(Electron-Capture-Dissociation:ECD)や電子移動解離(Electron-Transfer-Dissociation:ETD)が使われる。
【0005】
タンパク質解析分野において、現在もっとも広く使われている手法がCIDである。プリカーサーイオンに運動エネルギーを与えてガスと衝突させる。衝突により分子振動が励起されて、分子鎖の切れやすい部分で解離する。また、最近使われるようになった方法がIRMPDである。親イオンに赤外レーザ光を照射して、多数の光子を吸収させる。分子振動が励起されて、分子鎖の切れやすい部位で解離する。解離部位は図3に示す。a,b,cはNH2末端側を含む分子、x,y,zはCOOH末端側を含む分子である。CIDやIRMPDで切れやすい部位は、アミノ酸配列からなる主鎖のうち、a - x、b - yで命名されている部位である。a- x、b - yの部位であっても、アミノ酸配列パターンによっては切れにくい場合があるために、CID やIRMPDのみでは完全な構造解析ができないことが知られている。そのために、酵素などを用いた前処理が必要になり、高速な分析を妨げている。また、翻訳後修飾を受けた生体高分子では、CID やIRMPDを用いると、ポリペプチド側鎖に存在する翻訳後修飾が切れやすい傾向がある。側鎖が切れやすいため、失われた質量から修飾分子種と修飾されているかどうかの判定は可能である。ただし、どのアミノ酸部分で修飾されていたかという修飾部位に関する重要な情報は失われる。
【0006】
一方、ECDやETDは、アミノ酸配列に依存せず( ただし例外として環状構造であるプロリン残基のN末端側は切断しない)、アミノ酸配列の主鎖上のc - z部位の1 箇所を切断する。そのために、タンパク質分子を質量分析的手法のみで完全解析出来る。また、側鎖を切断しにくいという特徴をもっていることから、翻訳後修飾の研究・解析の手段として適している。このために、近年特に注目を受けているのがこのECDやETDという解離手法である。
【0007】
最近、質量分析装置や液体クロマトグラフィーの進化、さらにデータベースの充実によって大規模タンパク質解析が実現しつつある。しかし、それでも一度に分析できるタンパク質としては、せいぜい数千種類が限度である。そのため、すべてのタンパク質を対象にするのではなく、特定の集団だけを相手にするいわゆる「フォーカスド・プロテオーム」が昨今の主流になりつつある。
【0008】
例えば、代表的な翻訳後修飾であるリン酸にフォーカスした分析が盛んに行われている。リン酸化物を分析するには2つの課題がある。一つ目として、リン酸化物は非リン酸化物に比べ、数倍から数百倍イオン化効率が低くなることがある。2つめとして、CIDを解離手法とする場合、タンパク質のままでは解離が困難なため、酵素消化によって、ペプチド断片化する必要がある。分子量40万のタンパク質が酵素消化により400断片のペプチドに分解されたと仮定すると、全タンパク質のおよそ30%存在していたリン酸化物は、酵素消化により存在比は0.08%以下になると試算される(非特許文献1)。
【0009】
この2つの制限により、ペプチド断片化した生体試料サンプルをそのまま質量分析してもリン酸化ペプチドが同定できることはほとんどない。そこで、現在、リン酸化ペプチドを特異的に検出するための手法がいくつか存在する。
まず、サンプル調製方法としては、負に帯電したリン酸基が鉄やガリウムに静電的に結合する原理を利用した金属キレートアフィニティクロマトグラフィーを用いることによって、リン酸化物を特異的に精製する手法が広く利用されている。その他、抗体を利用した精製方法も存在する。しかし、特異的に目的物を精製しても多くの夾雑物が混入してくる。そこで、質量分析において、CIDに特徴的である翻訳後修飾部位の脱離を利用した特異的検出手法が利用されている。CIDによるタンデム質量分析法では、多くの場合、リン酸化ペプチドからリン酸基だけが失われたフラグメントイオンと、リン酸基に由来するフラグメントイオンが生成する。前者に注目してリン酸化ペプチドを探索する手法はニュートラルロススキャン法と呼ばれている。 リン酸化ペプチドでニュートラルロスが発生した場合、分子量が98小さいフラグメントイオンが観察される。このイオンが観察されれば、その親イオンは高い確率でリン酸化ペプチドだと推測される。その場合、ニュートラルロスイオンに対して、CIDを実施したり、親イオンに対して、ECDやETDを実施することで、そのアミノ酸配列や修飾部位の同定を行っている。プリカーサーイオンスキャン法は、特定のフラグメントイオンを生成する全てのプリカーサーイオンをスキャンする測定方法である。1台目の質量分離部MS-1のスキャンで透過したイオンを、コリジョンセルでCIDを行い、得られたフラグメントイオンの中で、特定のm/zのイオンのみを2台目の質量分離部MS-2で検出する。このようにして、MS-2で特定のフラグメントイオンが検出された時、MS-1を通過したプリカーサーイオンを特定する。リン酸基を特異的に検出する場合は、ネガティブモードで、m/z79(PO3-)をMS-2で検出する。(非特許文献2)
タンデム質量分析法ではイオン強度が高いプリカーサーイオンほど多種類のフラグメントイオンが高いイオン強度で検出される可能性が高い。そのため、イオン強度順にプリカーサーイオンを選択し、分析する方法が一般的である。図2に多数の非リン酸化に紛れたリン酸化ペプチドを解析した場合の模式図を示す。MS1スペクトルで様々なイオンが検出される。その中からイオン強度順にプリカーサーイオンが選択される。イオン1が1番目にMS/MS解析され、イオン2が2番目にMS/MS解析される。しかしこれらのイオンはリン酸化ペプチドではないため、ニュートラルロスは検出されない。3番目にMS/MS解析されたイオン3ではリン酸基の分子量98だけが失われたフラグメントイオン5と解離せずに残ったプリカーサーイオン4が検出された。これらの結果により、イオン3は高い確率でリン酸化ペプチドであると判断され、様々な解離方法で詳細解析される。このように、この方法では、目的物ではない非リン酸化物も分析対象となっており、非効率的である。最大の欠点はニュートラルロススキャン法にしてもプリカーサーイオンスキャン法にしても、プリカーサーイオンを解離してみなければリン酸化物かそうでないかの判断ができない点にある。
【0010】
また、一般的な翻訳後修飾のひとつである糖鎖は8種類の単糖が鎖状に連結、あるいは、分岐した構造を持ち、タンパク質に修飾されている。糖鎖はリン酸基とは異なり、一定の分子量をもたないため、ニュートラルロススキャン法を用いることは難しい。また、プリカーサーイオンスキャン法を用いた場合、ある単糖を指標にその単糖が含まれる糖鎖ポリペプチドを探索することは可能ではあるが、すべての糖鎖ポリペプチドを一斉に探索することは困難である。
【0011】
そこで、イオン源でイオン化された全イオン、あるいは、一部のイオンに対し、高フラグメント化スペクトルと低フラグメント化スペクトルを取得し、両者を比較することによってプリカーサーイオンを選択する方法が特許文献1に記載されている。フラグメント化はコリジョンセルと呼ばれるイオンを解離させるための部屋で実施される。高フラグメント化スペクトルはコリジョンセルに高い電圧を印加し、選択された全てのイオンを解離させる。低フラグメント化スペクトルはコリジョンセルに低い電圧を印加し、ほとんどイオンを解離させることなくコリジョンセルを通過させている。
【0012】
【非特許文献1】実験医学 Vol.23 No.19 2005,p2951-2956.
【非特許文献2】プロテオミクス実験プロトコール(秀潤社)p156-168
【特許文献1】特開2002-110081.
【発明の開示】
【発明が解決しようとする課題】
【0013】
タンパク質やペプチドの定性解析では、アミノ酸配列の同定だけでなく、翻訳後修飾の種類や修飾物の構造あるいは修飾部位の同定が求められる。サンプルは貴重であるため、効率よく最大限のアウトプットを獲得することが求められる。そのため、サンプル調製の段階で特異的な精製を実施し、質量分析では、目的物質を特異的に検出する手法を用いて解析を実施している。
【0014】
前述したように、代表的なフォーカスドプロテオームであるリン酸化をターゲットにした解析では、リン酸化物特異的な精製を実施した後に、CIDを用いたニュートラルロススキャン法、プリカーサーイオンスキャン法によって、リン酸化ペプチドの探索を行う。しかし、これらの方法では親イオンはイオン強度順に選択されるのが一般的であり、リン酸化物であるかどうかはCIDを実施して初めて判明する。このため、非効率的である。特許文献1の方法では、フラグメント化スペクトルを取得するためにコリジョンセルを使用している。コリジョンセルにある一定の電圧を印加し、イオンをコリジョンセルに導入しガスとの衝突によって解離を起こす。しかし、ある一定の電圧、つまりある一定のエネルギーが個々のイオンの解離に用いられる。分子量が小さく化学結合部位が少ないイオンに対しては、十分な解離エネルギーであっても、分子量が大きく化学結合部位が多いイオンでは解離が起きないため、リン酸化ペプチドを見落とす可能性がある。また、解離が困難なイオンを解離するため、高いエネルギーに設定した場合、比較的低いエネルギーでニュートラルロスを起こしたイオンがさらに解離し、リン酸化ペプチドを見落とす可能性もある。
【0015】
本発明は、以上の課題を解決し、物質の構造に関する情報の取得効率を向上させる質量分析方法を提供することを目的とする。
【課題を解決するための手段】
【0016】
本発明の質量分析方法では、試料をイオン化する工程と、イオン化されたイオンをイオントラップ部に蓄積する工程と、イオントラップ部をイオントラップ部に蓄積したイオンを実質的に解離させない第1の条件で動作させる工程と、第1の条件で動作させたイオントラップ部から排出されたイオンの低フラグメント化質量スペクトルを取得する工程と、イオントラップ部を前記第1の条件とは異なる第2の条件で動作するよう切替える工程と、第2の条件で動作させたイオントラップ部から排出されたイオンの高フラグメント化質量スペクトルを取得する工程と、低フラグメント化質量スペクトルと高フラグメント化質量スペクトルとを比較し、所定の条件により分析対象イオンを選択する工程と、を有することを特徴とする。
【0017】
本発明の質量分析システムは、試料をイオン化させるイオン源と、イオン源によりイオン化されたイオンを蓄積し、特定の質量範囲のイオンを排出するイオントラップ部と、イオントラップ部より排出されたイオンを質量分析する質量分析部と、イオントラップ部に蓄積したイオンを実質的に解離させない第1の条件、及び、第1の条件とは異なる第2の条件で動作するようにイオントラップ部を構成する電極に印加する電圧を制御する制御部と、第1の条件でイオントラップ部から排出されたイオンの低フラグメント化質量スペクトル、及び、第2の条件でイオントラップ部から排出されたイオンの高フラグメント化質量スペクトルを取得し、低フラグメント化質量スペクトルと高フラグメント化質量スペクトルとを比較し、所定の条件により分析対象イオンを選択する機能を有する全体処理部と、を有することを特徴とする。
【発明の効果】
【0018】
本発明によると、特定の物質を精度高く優先的に詳細分析することが可能であり、質量分析による物質の同定において、物質の構造に関する情報を取得する効率が向上し、測定及び物質同定の時間が短縮する。
【実施例1】
【0019】
図8に、本発明に基づく質量分析システムの構成例を示す。分析対象の試料101は、ガスクロマトグラフ(GC)または液体クロマトグラフ102の前処理により分離される。分離された試料は、イオン源103においてイオン化され、質量分析装置に導入される。導入されたイオンはリニアイオントラップ(LIT)104で蓄積され、特定のイオン(あるいは全イオン)を単離し、単離されたイオンはガスとの衝突により解離され、排出される。低フラグメントスペクトルの場合、全イオンを単離し、解離させないで排出する。高フラグメントスペクトルの場合、全イオンを単離し、解離させてから排出する。排出されたイオンはTOF検出器107でイオンの質量電荷比m/zに応じて分離される。TOF検出器107の前段には高分解能であるTOFが存在する。イオン源は、エレクトロスプレイイオン源、大気圧化学イオン化によるイオン源、マトリックス支援レーザ脱離イオン源、電気衝撃イオン源、化学イオン化によるイオン源、フィールドイオン化によるイオン源から選択され、正イオン化でも負イオン化でもかまわない。LIT104は多くのイオンが蓄積できるため、高感度検出が可能であるが、三次元四重極イオントラップでもかまわない。また、本装置構成では、イオン解離方法としてCIDを用いているが、IRMPDでも可能だと推測される。また、ECDやETDを用いてもよい。TOF106は高分解能で質量精度も高いので好ましいが、四重極質量フィルター、イオントラップ、磁場型質量分析器、フーリエ変換イオンサイクロトロン共鳴質量分析器でもかまわない。
【0020】
イオン検出器107で検出された各イオンは、m/z値と共に全体処理部108でデータ整理・処理され、その分析結果である質量分析データ、あるいは、低フラグメントスペクトルと高フラグメントスペクトルの差分スペクトルはデータ表示部115にて表示される。この一連の質量分析過程、すなわち、試料の分離、イオン化、質量分析装置内のイオン輸送、及び、解離、質量分離、及び、イオン検出、データ処理の全体を全体処理部108で制御する。パラメータ入力部115からユーザの必要な情報である高周波電圧決定部109、解離物イオン、ニュートラルロス決定部112を入力する。イオントラップで解離に用いる高周波電圧の周波数と振幅は分析したい物質により、設定され、高周波電圧決定部109に入力する。例えば、糖鎖のシアル酸やフコースは解離しやすいことが知られている。これらを含む糖鎖ペプチドを優先的に解析する場合、弱い高周波電圧を印加し、他の糖鎖ペプチドも一斉に分析する場合は、特定の糖鎖ペプチドを優先的に解析する場合よりも強い高周波電圧条件で分析される。
【0021】
差分スペクトルからプリカーサーイオンを選択するためのパラメータとして、プリカーサーイオンの強度、プリカーサーイオンのm/z値や分子量、イオン強度の減少量、価数、フラグメントイオンとの分子量の差が一定(ニュートラルロス)、などが入力される。これらによって、プリカーサーイオン決定部113にてプリカーサーイオンが決定される。プリカーサーイオンの選択は実時間で実施され、分析を妨げない必要がある。さらに、プリカーサーイオンが選択できない場合は、自動的に高周波電圧を高く設定し、プリカーサーイオンが多く選択され、詳細解析が間に合わない場合は、自動的に高周波電圧を低く設定する制御システムがあることが望ましい。
【0022】
選択されたプリカーサーイオンは詳細解析され、アミノ酸配列や修飾部位を同定する必要がある。その場合、ECDやETDなどの解離方法が適している。
【0023】
図9に、ECDを使用した場合の構成例を示す。分析対象の試料101は、ガスクロマトグラフ(GC)または液体クロマトグラフ112の前処理により分離される。分離された試料は、イオン源103においてイオン化され、質量分析装置に導入される。導入されたイオンはLIT104で蓄積され、特定のイオン(あるいは全イオン)を単離し、単離されたイオンはガスとの衝突により解離され、排出される。低フラグメントスペクトルの場合、全イオンを単離し、解離させないで排出する。高フラグメントスペクトルの場合、全イオンを単離し、解離させてから排出する。排出されたイオンはQディフレクター116を通過し、TOF検出器107でイオンの質量電荷比m/zに応じて分離される。TOF検出器107の前段には高分解能であるTOFが存在する。LIT104は多くのイオンが蓄積できるため、高感度検出が可能であり、TOF106は高分解能で質量精度も高いので好ましい。
【0024】
イオン検出器107で検出された各イオンは、m/z値と共に全体処理部108でデータ整理・処理され、その分析結果である質量分析データ、あるいは、低フラグメントスペクトルと高フラグメントスペクトルの差分スペクトルはデータ表示部115にて表示される。この一連の質量分析過程、すなわち、試料の分離、イオン化、質量分析装置内のイオン輸送、及び、解離、質量分離、及び、イオン検出、データ処理の全体を全体処理部108で制御する。パラメータ入力部115からユーザの必要な情報である高周波電圧周波数決定部109、解離物イオン、ニュートラルロス決定部112を入力する。イオントラップで解離に用いる高周波電圧の周波数と振幅は分析したい物質により、設定され、高周波電圧決定部109に入力する。さらに、差分スペクトルからプリカーサーイオンを選択するためのパラメータとして、プリカーサーイオンの強度、プリカーサーイオンのm/z値、イオン強度の減少量、価数、比較スペクトル面積値の減少率、解離物イオン、ニュートラルロスの分子量などが入力される。これらによって、プリカーサーイオン決定部113にてプリカーサーイオンが決定される。選択されたプリカーサーイオンは詳細解析される。詳細解析方法として、ユーザはイオン解離決定部118でイオン解離方法を選択することができる。
【0025】
CIDで詳細解析を実施する場合、導入されたイオンはLIT104で蓄積され、プリカーサーイオンを単離し、単離されたイオンはCIDにより解離され、生成したフラグメントイオンは排出される。排出されたフラグメントイオンはQディフレクター116を通過し、TOF検出器107でイオンの質量電荷比m/zに応じて分離される。その質量スペクトルからアミノ酸配列や修飾部位を同定する。
【0026】
ECDで詳細解析を実施する場合、導入されたイオンはLIT104で蓄積され、プリカーサーイオンを単離し、単離されたイオンは排出される。排出されたイオンはQディフレクター116を通過し、ECDセル117に導入され、ECDにより解離させる。生成したフラグメントイオンはQディフレクター116を通過し、TOF検出器107でイオンの質量電荷比m/zに応じて分離される。その質量スペクトルからアミノ酸配列や修飾部位を同定する。
【0027】
また、CIDは2,3価など低い価数のイオンを効率的に解離し、ECDやETDは、高い価数のイオンを効率的に解離することが知られている。ユーザは価数の閾値を設定し、ある価数以上のイオンに対しては、ECDやETD、ある価数未満のイオンに対しては、CIDやIRMPDで詳細解析を実施することも可能である。
【0028】
図1に本発明に基づく物質同定フローを示す。複数物質の混合物である試料21は、液体クロマトグラフ22やガスクロマトグラフに導入される。クロマトグラフには物質の性質によって分離させるための分離カラムが装着されており、分離カラムを通過した試料は、成分ごとに異なる時間に溶出する。溶出した試料の各成分は、イオン源にて、イオン化23される。イオンは質量分析装置内のイオントラップ24に導入、蓄積され、排出される。排出されたイオンは検出器にて検出され、横軸m/z、縦軸イオン強度の低フラグメント化スペクトルを得る(25)。次に、イオン源にて、イオン化23されたイオンは前述と同条件でイオントラップ24に導入し、蓄積される。このイオンに対しては所定の強度で解離26を実行、排出し、高フラグメント化スペクトルを得る(27)。獲得した両スペクトルを比較する(28)。比較の結果、イオン強度が変化したイオンが存在しない場合(29)、低フラグメント化スペクトル25と高フラグメント化スペクトル27を測定し、比較する(28)。イオン強度が変化したイオンが存在する場合(30)、解析の優先順位付けを実施し(31)、優先順位の高いイオンから詳細な解析を実施する32。
【0029】
優先順位の決定パラメータとして考えられるものとして、1.一定以上のイオン強度をもつイオン、2.減少率の大きいイオン、3.増加率の大きいイオン、4.分子量の大きさ、5.イオン強度が減少したイオンとイオン強度が増加したイオンの分子量の差が特定の値に一致するもの、あるいはさらに、そのイオン減少量と増加量が誤差を含む一定値であること、6.価数、7.あるイオンの質量スペクトルでの面積値の減少率などが挙げられる。
【0030】
イオン強度が高いイオンと比べ、低いイオンをある特定の解離方法で解離し詳細解析する場合、そのフラグメントイオンは低く、同定は困難となる。そのため、一定の閾値以上のイオンを選択することが望ましい(1)。
【0031】
ある特定の解離方法で解離し詳細解析する場合、その解離手法によって、適する分子量の範囲が存在する。そのため、解離手法によって分子量の範囲を指定することが望ましい(4)。
【0032】
所定の強度で修飾物をもつイオン解離させ、修飾物由来のイオンとポリペプチド由来のイオンに解離した場合、これらのイオンは増加し、元のイオンは減少する。ある特定の修飾物をもつイオンを優先的に分析したい場合、ポリペプチド由来のイオンと元のイオンの分子量差がその修飾物固有の値であることを検知し、元のイオンを詳細解析することができる。また、それらのイオンの増加量と減少量は一致するはずである(5)。
【0033】
ある特定の解離方法で解離し詳細解析する場合、その解離手法によって、適する価数の範囲が存在する。そのため、解離手法によって価数の範囲を指定することが望ましい(6)。
【0034】
修飾物のポリペプチドの結合はペプチド結合よりも一般的に解離しやすいため、所定の強度で解離させた場合、修飾物は解離し、低フラグメント化スペクトルと比較すると高フラグメント化スペクトルでは修飾を持つイオンは減少する(2)。
【0035】
しかし、低フラグメント化スペクトルでイオン強度1000のイオンが高フラグメント化スペクトルでイオン強度900になったものと低フラグメント化スペクトルでイオン強度100のイオンが高フラグメント化スペクトルでイオン強度0になったものでは、イオン強度の減少量は同値となる。そこで、イオン強度が一定以上減少したイオンについては質量スペクトルでの面積値比較が有効となる(7)。
【0036】
イオン強度が変化したイオンが存在しない場合(29)、ユーザが予めプリカーサーイオン個数を設定し、閾値よりも少ない場合、より解離が起きやすくするため高周波電圧を大きく設定し、閾値よりも多い場合、解離を抑えるように高周波電圧を小さく設定する自動制御システムが搭載されていても良い。
【実施例2】
【0037】
糖鎖修飾ペプチドの例
低フラグメント化スペクトルと高フラグメント化スペクトルを取得する方法としては、通常イオントラップ内での単離に用いられるシステムをそのまま使用した。通常混合物であるサンプルはイオン化され、ある一定時間内イオントラップ内に蓄積される。通常、その中からある親イオンだけをイオントラップ内に単離する。単離は選択された親イオンのm/z値±数m/zの範囲以外に数ms間、高周波電圧を印加し、分子に運動エネルギーを与えることでイオントラップの外へとイオンを排除する。印加される高周波電圧は、m/z値に依存する周波数を重畳した高周波電圧にFNF Gainと呼ばれる値を乗ずる。本方法の目的は全イオンをガスと衝突させることで、壊れやすいポリペプチドを解離させ、解離させなかったスペクトルと比較することで、翻訳後修飾ポリペプチドを探索することである。そのため、低フラグメント化スペクトルとはFNF Gain 値を0に設定し、そのスペクトルを取得した。高フラグメント化スペクトルはあるFNF Gain 値を与え、そのスペクトルを取得した。
【0038】
糖鎖ペプチドは卵黄から精製したKVANKTを用いた。糖鎖はアスパラギン(N)に結合し、本修飾ペプチドの分子量は2865である。このペプチドに3種類の非修飾ペプチド1:AWAVAR(分子量672.4)、非修飾ペプチド2:HPDYSVVLLLR(分子量1310.8)、非修飾ペプチド3:LCTVATLR(分子量876.5)を混合し、サンプルとした。サンプルはシリンジポンプを用いて、一定流量で質量分析装置に導入した。
【0039】
イオン化したサンプルは一定時間内イオントラップ内に蓄積し、全イオンに対し、0.2ms間、FNF Gain値0で図4の低フラグメント化スペクトル41を取得した。高フラグメント化スペクトル42はFNF Gain値14で取得した。横軸がm/zで、縦軸がイオン強度を示す。糖鎖ペプチドは3価イオン48として検出された。非修飾ペプチド1はイオン43,44として検出された。イオン43は2価イオンであり、イオン44は1価イオンである。非修飾ペプチド2は2価イオン45として検出された。非修飾ペプチド3はイオン46,47として検出された。イオン46は2価イオンであり、イオン47は1価イオンである。低フラグメント化スペクトルと高フラグメント化スペクトルを比較すると、高フラグメント化スペクトルでは糖鎖ペプチドイオン48のイオン強度が減少している。イオン強度順に定性解析する場合、糖鎖ペプチドイオン48の強度は11番目の強度であり、分析されない可能性が高い。
【0040】
次に低フラグメント化スペクトルから高フラグメント化スペクトルの差分を求めたスペクトルを図5に示す。横軸がm/zで、縦軸がイオン強度の差分を示す。正の値になっているイオンは高フラグメント化スペクトルでイオン強度が増加したイオン、負の値になっているイオンは高フラグメント化スペクトルでイオン強度が減少したイオンである。高フラグメント化スペクトルで大きく増加したイオン56は不純物だと思われる。糖鎖ペプチド53は減少している。非修飾ペプチド1は2価イオン51が減少し、1価イオン55はわずかに増加している。非修飾ペプチド2イオン54は減少している。非修飾ペプチド3の2価イオン52は減少し、1価イオン57はわずかに増加している。修飾部位の結合がペプチド結合よりも弱いという観点から探索する場合、単純に減少したイオン順に定性解析を実施することも可能である。糖鎖ペプチド53の減少イオン量は2番目である。優先順位11位であった糖鎖ペプチドは本方法により優先順位2位となった。しかし、低フラグメント化スペクトルでイオン強度1000であったイオンが高フラグメント化スペクトルで900になった場合(減少率10%)と低フラグメント化スペクトルでイオン強度100であったイオンが高フラグメント化スペクトルで0になった場合(減少率100%)、減少イオン量は同等となる。
【0041】
そこで、イオン51〜53のイオンピーク面積値を比較した(表1)。
表1 糖鎖ポリペプチドの差分スペクトルでイオン減少量が大きいイオンの面積値比較の表

【0042】
表1は各イオンの低フラグメント化スペクトル、及び、高フラグメント化スペクトルでの面積値、各面積値において低フラグメント化スペクトルに対する高フラグメント化スペクトルの割合、その割合から最も減少率の大きいものからタンデムマス優先順位をつけた。その結果、イオン51(非修飾ペプチド1:337.2m/z)では、18%程度、イオン52(非修飾ペプチド3:438.0m/z)では4%程度しかイオン面積値が減少していないのに対し、イオン53(糖鎖ペプチド:956.0m/z)では、59%イオン面積値が減少した。この面積値比較によると、優先順位は1位となる。
【実施例3】
【0043】
リン酸化ペプチドの例
リン酸化ペプチドはLCTVApTLR(分子量954.5)を用いた。リン酸基は2番目のスレオニン(T)に結合している。このペプチドに3種類の非修飾ペプチド1:AWAVAR(分子量672.4)、非修飾ペプチド2:HPDYSVVLLLR(分子量1310.8)、非修飾ペプチド3:LCTVATLR(分子量876.5)を混合し、サンプルとした。サンプルはシリンジポンプを用いて、一定流量で質量分析装置に導入した。イオン化したサンプルは一定時間内イオントラップ内に蓄積し、全イオンに対し、0.2ms間、FNF Gain値0で図6の低フラグメント化スペクトル66を取得した。高フラグメント化スペクトル67はFNF Gain値17で取得した。横軸がm/zで、縦軸がイオン強度を示す。リン酸化ペプチドは1価イオン65として検出された。非修飾ペプチド1はイオン60,63として検出された。イオン60は2価イオンであり、イオン63は1価イオンである。非修飾ペプチド2は2価イオン62として検出された。非修飾ペプチド3はイオン61,64として検出された。イオン61は2価イオンであり、イオン64は1価イオンである。低フラグメント化スペクトルと高フラグメント化スペクトルを比較すると、高フラグメント化スペクトルではリン酸化ペプチドイオン65とイオン60のイオン強度が減少している。イオン強度順に定性解析する場合、糖鎖ペプチドイオン48の強度は10番目の強度であり、分析されない可能性が高い。
【0044】
次に低フラグメント化スペクトルから高フラグメント化スペクトルの差分を求めたスペクトルを図7に示す。横軸がm/zで、縦軸がイオン強度の差分を示す。正の値になっているイオンは高フラグメント化スペクトルでイオン強度が増加したイオン、負の値になっているイオンは高フラグメント化スペクトルでイオン強度が減少したイオンである。高フラグメント化スペクトルで大きく増加したイオン83は不純物だと思われる。リン酸化ペプチドイオン82は減少している。非修飾ペプチド1は2価イオン80が減少し、1価イオン86はわずかに増加している。非修飾ペプチド2イオン85はわずかに増加している。非修飾ペプチド3の2価イオン84はわずかに増加し、1価イオン81はわずかに減少している。修飾部位の結合がペプチド結合よりも弱いという観点から探索する場合、単純に減少したイオン順に定性解析を実施することも可能である。リン酸化ペプチドイオン82の減少イオン量は最も大きかった。優先順位10位であった糖鎖ペプチドは本方法により優先順位1位となった。
イオン80〜82のイオンピーク面積値を比較した結果を表2に示す。
表2 糖鎖ポリペプチドの差分スペクトルでイオン減少量が大きいイオンの面積値比較の表

【0045】
表2は各イオンの低フラグメント化スペクトル、及び、高フラグメント化スペクトルでの面積値、各面積値において低フラグメント化スペクトルに対する高フラグメント化スペクトルの割合、その割合から最も減少率の大きいものから優先順位をつけた。イオン80(非修飾ペプチド1:337.2m/z)では、54%程度、イオン87(イオン由来不明:539.3m/z)では83%程度イオン面積値が減少したのに対し、イオン82(リン酸化ペプチド:955.5m/z)では、90%イオン面積値が減少した。この面積値比較でも優先順位は1位となる。
【図面の簡単な説明】
【0046】
【図1】本発明に基づく翻訳後修飾ポリペプチド探索のフロー図。
【図2】従来の翻訳後修飾ポリペプチド探索の概略図(ニュートラルロススキャン)。
【図3】ポリペプチドの解離パターン。
【図4】糖鎖ポリペプチド探索の実施例。低フラグメント化スペクトルと高フラグメント化スペクトル図。
【図5】糖鎖ポリペプチドの高フラグメント化スペクトルと低フラグメント化スペクトルの差分スペクトル図。
【図6】リン酸化ペプチド探索の実施例。低フラグメント化スペクトルと高フラグメント化スペクトル図。
【図7】リン酸化ペプチドの高フラグメント化スペクトルと低フラグメント化スペクトルの差分スペクトル図。
【図8】本発明に基づく質量分析システムの構成例を示す図。
【図9】本発明に基づくECDセルを含む質量分析システムの構成例を示す図。
【符号の説明】
【0047】
1:優先順位1位のイオン、2:優先順位2位のイオン、3:優先順位3位のイオン、4:解離しなかったイオン3、5:リン酸基を失ったイオン3、6:低フラグメント化スペクトル、7:高フラグメント化スペクトル、8:高フラグメント化スペクトルでイオン量が減少したイオン、9:高フラグメント化スペクトルでイオン量が増加したイオン、10:比較スペクトル、11:高フラグメント化スペクトルで減少したイオンとその減少量、12:高フラグメント化スペクトルで増加したイオンとその増加量、21:試料導入、22:試料分離(LCまたはGC)、23:イオン化(ポジティブまたはネガティブ)、24:イオントラップ、25:低フラグメント化スペクトルの取得、26:イオントラップ内での解離、27:高フラグメント化スペクトルの取得、28:低フラグメント化スペクトルと高フラグメント化スペクトルの比較、29:基準を満たす変化したイオンが存在しない場合、30:基準を満たす変化したイオンが存在する場合、31:イオンの優先順位付け、32:様々な解離手法による詳細解析、41:糖鎖ペプチドと非修飾ペプチドの混合物における低フラグメント化スペクトル、42:糖鎖ペプチドと非修飾ペプチドの混合物における低フラグメント化スペクトル、43:非修飾ペプチド1の2価イオン、44:非修飾ペプチド1の1価イオン、45:非修飾ペプチド2の2価イオン、46:非修飾ペプチド3の2価イオン、47:非修飾ペプチド3の1価イオン、48:糖鎖ペプチドの3価イオン、51:非修飾ペプチド1の2価イオン、52:非修飾ペプチド3の2価イオン、53:糖鎖ペプチドの3価イオン、54:非修飾ペプチド2の2価イオン、55:非修飾ペプチド1の1価イオン、56:身元不明イオン、57:非修飾ペプチド3の1価イオン、60:非修飾ペプチド1の2価イオン、61:非修飾ペプチド3の2価イオン、62:非修飾ペプチド2の2価イオン、63:非修飾ペプチド1の1価イオン、64:非修飾ペプチド3の1価イオン、65:リン酸化ペプチドの2価イオン、66:リン酸化ペプチドと非修飾ペプチドの混合物における低フラグメント化スペクトル、67:リン酸化ペプチドと非修飾ペプチドの混合物における高フラグメント化スペクトル、80:非修飾ペプチド1の2価イオン、81:非修飾ペプチド3の1価イオン、82:リン酸化ペプチドの2価イオン、83:身元不明イオン、84:非修飾ペプチド3の2価イオン、85:非修飾ペプチド2の2価イオン、86:非修飾ペプチド1の1価イオン、87:身元不明イオン、101:試料導入、102:試料分離(LCまたはGC)、103:イオン化、104:リニアイオントラップ(LIT)、105:質量分析装置制御部、106:TOF部、107:TOF検出器、108:全体処理部、109:解析手段決定部、110:高周波電圧周波数決定部、112:解離物イオン、及び、ニュートラルロス決定部、113:プリカーサーイオン決定部、115:データ表示部/パラメーター入力部、
116:Qディフレクター、117:ECDセル、118:イオン解離方法決定部
【特許請求の範囲】
【請求項1】
試料をイオン化する工程と、
イオン化されたイオンをイオントラップ部に蓄積する工程と、
該イオントラップ部を、該イオントラップ部に蓄積したイオンを実質的に解離させない第1の条件で動作させる工程と、
該第1の条件で動作させた前記イオントラップ部から排出されたイオンの低フラグメント化質量スペクトルを取得する工程と、
前記イオントラップ部を、前記第1の条件とは異なる第2の条件で動作するよう切替える工程と、
該第2の条件で動作させた前記イオントラップ部から排出されたイオンの高フラグメント化質量スペクトルを取得する工程と、
前記低フラグメント化質量スペクトルと前記高フラグメント化質量スペクトルとを比較し、所定の条件により分析対象イオンを選択する工程と、を有することを特徴とする質量分析方法。
【請求項2】
請求項1に記載の質量分析方法において、
前記第1の条件では前記イオントラップ部に高周波電圧を印加せず、前記第2の条件では前記イオントラップ部に高周波電圧を印加することを特徴とする質量分析方法。
【請求項3】
請求項2に記載の質量分析方法において、
前記高周波電圧は、周波数に応じて振幅を設定することを特徴とする質量分析方法。
【請求項4】
請求項1に記載の質量分析方法において、
前記イオントラップ部は多重極ロッド電極を有するリニアイオントラップであることを特徴とする質量分析方法。
【請求項5】
請求項1に記載の質量分析方法において、
クロマトグラフで試料を分離する工程とをさらに有することを特徴とする質量分析方法。
【請求項6】
請求項1に記載の質量分析方法において、
前記高フラグメント化質量スペクトルよりも前記低フラグメント化質量スペクトルでのイオン強度が高いイオンを分析対象イオンとして選択することを特徴とする質量分析方法。
【請求項7】
請求項1に記載の質量分析方法において、
前記分析対象イオンを選択する工程は、前記高フラグメント化質量スペクトル及び前記低フラグメント化質量スペクトルのイオンピークの面積値を求める工程と、
前記高フラグメント化質量スペクトルよりも前記低フラグメント化質量スペクトルでの前記面積値が大きいイオンを分析対象イオンとして選択する工程と、を含むことを特徴とする質量分析方法。
【請求項8】
請求項1に記載の質量分析方法において、
前記分析対象イオンを選択する工程は、前記高フラグメント化質量スペクトル及び前記低フラグメント化質量スペクトルのイオンピークの面積値を求める工程と、
前記低フラグメント化質量スペクトと前記高フラグメント化質量スペクトルの前記面積値の比率に基づいて分析対象イオンを選択する工程と、を含むことを特徴とする質量分析方法。
【請求項9】
請求項1に記載の質量分析方法において、
前記分析対象イオンの衝突励起解離によるタンデム質量分析を行う工程と、
前記分析対象イオンの電子捕獲解離によるタンデム質量分析を行う工程と、を有することを特徴とする質量分析方法。
【請求項10】
請求項1に記載の質量分析方法において、
前記分析対象イオンの価数を決定する工程と、
前記価数が所定の値よりも小さい場合に衝突励起解離手段若しくは赤外多光吸収解離手段により前記分析対象イオンを解離する工程、又は、前記価数が所定の値よりも大きい場合に電子捕獲解離手段若しくは電子移動解離手段により前記分析対象イオンを解離する工程と、を有することを特徴とする質量分析方法。
【請求項11】
試料をイオン化させるイオン源と、
前記イオン源によりイオン化されたイオンを蓄積し、特定の質量範囲のイオンを排出するイオントラップ部と、
前記イオントラップ部より排出されたイオンを質量分析する質量分析部と、
前記イオントラップ部に蓄積したイオンを実質的に解離させない第1の条件、及び、前記第1の条件とは異なる第2の条件で動作するように前記イオントラップ部を構成する電極に印加する電圧を制御する制御部と、
前記第1の条件で前記イオントラップ部から排出されたイオンの低フラグメント化質量スペクトル、及び、前記第2の条件で前記イオントラップ部から排出されたイオンの高フラグメント化質量スペクトルを取得し、前記低フラグメント化質量スペクトルと前記高フラグメント化質量スペクトルとを比較し、所定の条件により分析対象イオンを選択する機能を有する全体処理部と、を有することを特徴とする質量分析システム。
【請求項12】
請求項11に記載の質量分析システムにおいて、
前記分析対象イオンの電子捕獲解離によるタンデム質量分析を行う電子捕獲解離部を有することを特徴とする質量分析システム。
【請求項13】
請求項11に記載の質量分析システムにおいて、
前記イオントラップ部は多重極ロッド電極を有するリニアイオントラップであることを特徴とする質量分析システム。
【請求項14】
請求項11に記載の質量分析システムにおいて、
前記制御部は、前記第1の条件では前記イオントラップ部に高周波電圧を印加せず、前記第2の条件では前記イオントラップ部に高周波電圧を印加することを特徴とする質量分析システム。
【請求項15】
請求項11に記載の質量分析システムにおいて、
前記全体処理部は、前記高フラグメント化質量スペクトルよりも前記低フラグメント化質量スペクトルでのイオン強度が高いイオンを分析対象イオンとして選択する機能を有することを特徴とする質量分析システム。
【請求項16】
請求項11に記載の質量分析システムにおいて、
前記全体処理部は、前記高フラグメント化質量スペクトル及び前記低フラグメント化質量スペクトルのイオンピークの面積値を求める機能と、前記低フラグメント化質量スペクトと前記高フラグメント化質量スペクトルの前記面積値の比率に基づいて分析対象イオンを選択する機能と、を有することを特徴とする質量分析システム。
【請求項1】
試料をイオン化する工程と、
イオン化されたイオンをイオントラップ部に蓄積する工程と、
該イオントラップ部を、該イオントラップ部に蓄積したイオンを実質的に解離させない第1の条件で動作させる工程と、
該第1の条件で動作させた前記イオントラップ部から排出されたイオンの低フラグメント化質量スペクトルを取得する工程と、
前記イオントラップ部を、前記第1の条件とは異なる第2の条件で動作するよう切替える工程と、
該第2の条件で動作させた前記イオントラップ部から排出されたイオンの高フラグメント化質量スペクトルを取得する工程と、
前記低フラグメント化質量スペクトルと前記高フラグメント化質量スペクトルとを比較し、所定の条件により分析対象イオンを選択する工程と、を有することを特徴とする質量分析方法。
【請求項2】
請求項1に記載の質量分析方法において、
前記第1の条件では前記イオントラップ部に高周波電圧を印加せず、前記第2の条件では前記イオントラップ部に高周波電圧を印加することを特徴とする質量分析方法。
【請求項3】
請求項2に記載の質量分析方法において、
前記高周波電圧は、周波数に応じて振幅を設定することを特徴とする質量分析方法。
【請求項4】
請求項1に記載の質量分析方法において、
前記イオントラップ部は多重極ロッド電極を有するリニアイオントラップであることを特徴とする質量分析方法。
【請求項5】
請求項1に記載の質量分析方法において、
クロマトグラフで試料を分離する工程とをさらに有することを特徴とする質量分析方法。
【請求項6】
請求項1に記載の質量分析方法において、
前記高フラグメント化質量スペクトルよりも前記低フラグメント化質量スペクトルでのイオン強度が高いイオンを分析対象イオンとして選択することを特徴とする質量分析方法。
【請求項7】
請求項1に記載の質量分析方法において、
前記分析対象イオンを選択する工程は、前記高フラグメント化質量スペクトル及び前記低フラグメント化質量スペクトルのイオンピークの面積値を求める工程と、
前記高フラグメント化質量スペクトルよりも前記低フラグメント化質量スペクトルでの前記面積値が大きいイオンを分析対象イオンとして選択する工程と、を含むことを特徴とする質量分析方法。
【請求項8】
請求項1に記載の質量分析方法において、
前記分析対象イオンを選択する工程は、前記高フラグメント化質量スペクトル及び前記低フラグメント化質量スペクトルのイオンピークの面積値を求める工程と、
前記低フラグメント化質量スペクトと前記高フラグメント化質量スペクトルの前記面積値の比率に基づいて分析対象イオンを選択する工程と、を含むことを特徴とする質量分析方法。
【請求項9】
請求項1に記載の質量分析方法において、
前記分析対象イオンの衝突励起解離によるタンデム質量分析を行う工程と、
前記分析対象イオンの電子捕獲解離によるタンデム質量分析を行う工程と、を有することを特徴とする質量分析方法。
【請求項10】
請求項1に記載の質量分析方法において、
前記分析対象イオンの価数を決定する工程と、
前記価数が所定の値よりも小さい場合に衝突励起解離手段若しくは赤外多光吸収解離手段により前記分析対象イオンを解離する工程、又は、前記価数が所定の値よりも大きい場合に電子捕獲解離手段若しくは電子移動解離手段により前記分析対象イオンを解離する工程と、を有することを特徴とする質量分析方法。
【請求項11】
試料をイオン化させるイオン源と、
前記イオン源によりイオン化されたイオンを蓄積し、特定の質量範囲のイオンを排出するイオントラップ部と、
前記イオントラップ部より排出されたイオンを質量分析する質量分析部と、
前記イオントラップ部に蓄積したイオンを実質的に解離させない第1の条件、及び、前記第1の条件とは異なる第2の条件で動作するように前記イオントラップ部を構成する電極に印加する電圧を制御する制御部と、
前記第1の条件で前記イオントラップ部から排出されたイオンの低フラグメント化質量スペクトル、及び、前記第2の条件で前記イオントラップ部から排出されたイオンの高フラグメント化質量スペクトルを取得し、前記低フラグメント化質量スペクトルと前記高フラグメント化質量スペクトルとを比較し、所定の条件により分析対象イオンを選択する機能を有する全体処理部と、を有することを特徴とする質量分析システム。
【請求項12】
請求項11に記載の質量分析システムにおいて、
前記分析対象イオンの電子捕獲解離によるタンデム質量分析を行う電子捕獲解離部を有することを特徴とする質量分析システム。
【請求項13】
請求項11に記載の質量分析システムにおいて、
前記イオントラップ部は多重極ロッド電極を有するリニアイオントラップであることを特徴とする質量分析システム。
【請求項14】
請求項11に記載の質量分析システムにおいて、
前記制御部は、前記第1の条件では前記イオントラップ部に高周波電圧を印加せず、前記第2の条件では前記イオントラップ部に高周波電圧を印加することを特徴とする質量分析システム。
【請求項15】
請求項11に記載の質量分析システムにおいて、
前記全体処理部は、前記高フラグメント化質量スペクトルよりも前記低フラグメント化質量スペクトルでのイオン強度が高いイオンを分析対象イオンとして選択する機能を有することを特徴とする質量分析システム。
【請求項16】
請求項11に記載の質量分析システムにおいて、
前記全体処理部は、前記高フラグメント化質量スペクトル及び前記低フラグメント化質量スペクトルのイオンピークの面積値を求める機能と、前記低フラグメント化質量スペクトと前記高フラグメント化質量スペクトルの前記面積値の比率に基づいて分析対象イオンを選択する機能と、を有することを特徴とする質量分析システム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2010−14563(P2010−14563A)
【公開日】平成22年1月21日(2010.1.21)
【国際特許分類】
【出願番号】特願2008−175199(P2008−175199)
【出願日】平成20年7月4日(2008.7.4)
【出願人】(000005108)株式会社日立製作所 (27,607)
【Fターム(参考)】
【公開日】平成22年1月21日(2010.1.21)
【国際特許分類】
【出願日】平成20年7月4日(2008.7.4)
【出願人】(000005108)株式会社日立製作所 (27,607)
【Fターム(参考)】
[ Back to top ]

