超親水性材料、医療用材料及び医療用器具
【課題】DLC膜の親水性を向上させると共に、生体適合性等の機能の付与を効率良く行うことが可能なDLC膜の修飾方法を実現できるようにする。
【解決手段】超親水性材料は、基材と、基材の表面に形成され且つ親水性の官能基を有するDLC膜を備えている。DLC膜の表面における水の接触角が10度以下であり、基材とDLC膜との間には、基材と前記DLC膜との密着性を向上させる中間層が設けられている。DLC膜の厚さは0.01μm以上、3μm以下であり、中間層の厚さは0.01μm以上、0.3μm以下である。
【解決手段】超親水性材料は、基材と、基材の表面に形成され且つ親水性の官能基を有するDLC膜を備えている。DLC膜の表面における水の接触角が10度以下であり、基材とDLC膜との間には、基材と前記DLC膜との密着性を向上させる中間層が設けられている。DLC膜の厚さは0.01μm以上、3μm以下であり、中間層の厚さは0.01μm以上、0.3μm以下である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、本発明は超親水性材料、医療用材料及び医療用器具に関し、特に生体適合性に優れた材料に関する。
【背景技術】
【0002】
ダイヤモンド様薄膜(DLC膜)は、硬く緻密で且つ不活性な表面を有しているため、金属やセラミックス等の無機系材料及び樹脂等の有機系材料等からなる基材の表面に形成することにより基材の表面に耐摩耗性、耐蝕性及び表面平滑性等の性質を付与することができる。
【0003】
例えば、金型や治工具の表面をDLC膜によりコーティングすることにより、耐久性を向上させたり、離型性を向上させたりすることが知られている。また、非常に平滑で不活性な表面であるため、生体物質との相互作用を嫌う医療用器具の基材を表面処理する方法としても期待されている(例えば、特許文献1及び非特許文献1を参照)。
【0004】
さらに、本願発明者らはDLC膜にプラズマを照射することによりDLC膜に反応性の部位を導入する方法について報告している(例えば、特許文献2を参照。)。プラズマ照射により、DLC膜にラジカル等の反応性の部位を導入し、導入されたラジカルを開始点として生体適合性ポリマーをグラフト重合することが可能となる。また、ラジカルを導入した後、大気暴露を行うことにより水酸基等の官能基を生成することができ、生成した官能基を用いればDLC膜に種々の修飾を行うことができる。このように、DLC膜を修飾することにより生体適合性等の種々の機能を付加することが可能であり、耐久性と機能性とを併せ持つ材料を実現することができる。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平10−248923号公報
【特許文献2】国際公開第2005/97673号パンフレット
【非特許文献】
【0006】
【非特許文献1】伊藤晴夫ら、「生体材料」、1985年、第3巻、p.45−53
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、本願発明者らの検討の結果、前記従来のDLC膜の修飾方法には以下のような問題があることが明らかになった。従来のDLC膜を修飾する方法においては、基材の表面を被覆するDLC膜にプラズマ照射をすることによりDLC膜の炭素−炭素結合を開裂させることによりラジカルを生成している。DLC膜の炭素−炭素結合を開裂させることにより形成されたラジカルは、不安定であり消滅しやすく、DLC膜にプラズマ照射を行った後、すぐにポリマーのグラフトを行わなければならない。
【0008】
また、ラジカルが不安定であるため、プラズマを照射してから重合を開始するまでの時間を一定にしたとしても、ポリマーのグラフトに寄与するラジカルの数を一定にすることができない。その結果、ロット間でポリマーの被覆状態がばらついてしまい、生体適合性等の機能を再現性良く付与することができない。
【0009】
さらに、ラジカルを導入したDLC膜を大気暴露することにより水酸基等の親水性の官能基を導入する場合にも、ラジカルと酸素との反応が十分に進行しない。このため、DLC膜の親水性が十分向上しない。また、一旦、親水性が向上しても時間の経過により再び親水性が悪化してしまう。
【0010】
本発明は、前記従来の問題を解決し、DLC膜の親水性を向上させると共に、生体適合性等の機能の付与を効率良く行うことが可能なDLC膜の修飾方法を実現できるようにすることを目的とする。
【課題を解決するための手段】
【0011】
前記の目的を達成するため、本発明はDLC膜の修飾方法を、DLC膜に反応性の部位を形成する第1のプラズマ照射工程と反応性の部位を親水性の官能基に変換する第2のプラズマ照射工程とを備えた構成とする。
【0012】
本発明に係るダイヤモンド様薄膜の修飾方法は、基材の表面にダイヤモンド様薄膜を形成する工程(a)と、ダイヤモンド様薄膜に第1のプラズマを照射することにより反応性の部位をダイヤモンド様薄膜の表面に生起させる工程(b)と、ダイヤモンド様薄膜に少なくとも酸素を含む第2のプラズマを照射することにより反応性の部位と酸素とを反応させて親水性の官能基を導入する工程(c)とを備えていることを特徴とする。
【0013】
本発明のダイヤモンド様薄膜の修飾方法は、ダイヤモンド様薄膜に少なくとも酸素を含む第2のプラズマを照射することにより反応性の部位と酸素とを反応させることにより親水性の官能基を導入する工程を備えているため、第1のプラズマ照射によりダイヤモンド様薄膜の表面に形成された反応性の部位を確実に親水性の官能基とすることができる。このため、基材に耐久性だけでなく親水性の機能を効率良く付与することができる。従って、医療用材料をはじめとする種々の分野の材料に耐久性と親水性とを付与することができる。また、導入された官能基を用いることによりダイヤモンド様薄膜の表面をさらに改質することも可能となる。
【0014】
本発明のダイヤモンド様薄膜の修飾方法において、工程(c)では、ダイヤモンド様薄膜における水の接触角を10度以下にすることが好ましい。このような構成とすることにより、いわゆる超親水性の材料を実現することができる。
【0015】
本発明のダイヤモンド様薄膜の修飾方法において、第1のプラズマは、アルゴン、キセノン、ネオン、ヘリウム、クリプトン、窒素、酸素、アンモニア、水素、水蒸気、鎖式又は環式の炭化水素、酸素を含む有機化合物及び窒素を含む有機化合物からなる群から選択された1つの気体又は2つ以上からなる混合気体のプラズマであることが好ましい。
【0016】
本発明のダイヤモンド様薄膜の修飾方法において、第2のプラズマは、酸素、空気、水蒸気及び酸素を含む有機化合物からなる群から選択された1つの気体又は2つ以上からなる混合気体のプラズマであることが好ましい。
【0017】
本発明のダイヤモンド様薄膜の修飾方法において、親水性の官能基はカルボキシル基を含むことが好ましい。
【0018】
本発明のダイヤモンド様薄膜の修飾方法は、工程(c)よりも後に、親水性の官能基を用いてダイヤモンド様薄膜の表面に機能性材料を固定する工程(d)をさらに備えていることが好ましく、工程(d)では、親水性の官能基と機能性材料に含まれる官能基とを共有結合させてかまわない。また、工程(d)は親水性の官能基を活性化する工程と、活性化した親水性の官能基を開始点としてグラフト重合を行う工程とを含んでいてもよい。
【0019】
本発明のダイヤモンド様薄膜の修飾方法において、機能性材料は生体適合性ポリマーであることが好ましい。
【0020】
この場合において、生体適合性ポリマーは、ポリウレタン、ポリアクリルアミド、ポリエチレンオキシド、ポリエチレンカーボネート、ポリエチレン、ポリエチレングリコール、ポリビニルピロリドン、ポリプロピレンカーボネート、ポリアミド、フィブリン、リン脂質の重合体、疎水親水ミクロ相分離重合体、ヒドロキシエチルメタクリレートの重合体又は共重合体、ビニルピロリドンの重合体又は共重合体、フッ素含有モノマーの重合体又は共重合体、Si含有モノマーの重合体又は共重合体及びビニルエーテルの重合体又は共重合体からなる群から選択された少なくとも1つのポリマー又はポリマーのエステル化物であることが好ましい。
【0021】
本発明のダイヤモンド様薄膜の修飾方法において、機能性材料は抗血栓性の薬剤を担持し且つ担持した薬剤を除放する生分解性ポリマーであってもよい。
【0022】
この場合において、生分解性ポリマーは、ポリ乳酸、ポリグリコール酸、ポリ乳酸とポリグリコール酸との共重合体、コラーゲン、ゼラチン、キチン、キトサン、ヒアルロン酸、ポリアミノ酸、澱粉、ポリ−ε−カプロラクトン、ポリエチレンサクシネート、及びポリ−β−ヒドロキシアルカノエートからなる群から選択された少なくとも1つのポリマーであることが好ましい。また、生分解性ポリマーは、可塑剤を含んでいてもよい。
【0023】
本発明のダイヤモンド様薄膜の修飾方法において、工程(a)よりも前に、基材とダイヤモンド様薄膜との密着性を向上させる中間層を基材の表面に形成する中間層形成工程をさらに備えていることが好ましい。
【0024】
この場合において、中間層は珪素及び炭素を主成分とするアモルファス膜であることが好ましい。
【0025】
本発明に係る医療用材料の製造方法は、本発明のダイヤモンド様薄膜の修飾方法を用いることを特徴とする。
【0026】
本発明に係る医療用器具の製造方法は、本発明の医療用材料の製造方法を用いることを特徴とする。
【0027】
本発明の医療用器具の製造方法において、医療用器具は、人体組織と直接的に接触するものであってよい。
【0028】
本発明の医療用器具の製造方法において、医療用器具は、ステント、カテーテル、バルーンカテーテル、ガイドワイヤ、ペースメーカーリード、体内留置用器材、注射針、メス、真空採血管、輸液バッグ、プレフィルドシリンジ、傷口保持部品のいずれか1つであることが好ましい。
【0029】
本発明に係る超親水性材料は、基材と、基材の表面に形成され且つ親水性の官能基を有するダイヤモンド様薄膜とを備え、ダイヤモンド様薄膜の表面における水の接触角が10度以下であることを特徴とする。
【0030】
本発明の超親水性材料は、ダイヤモンド様薄膜の表面における水の接触角が10度以下であり、超親水性だけでなく優れた耐久性を有している。従って、耐久性と親水性とが要求される医療材料をはじめとする種々の分野における材料として用いることができる。
【0031】
本発明の超親水性材料において、親水性の官能基は、少なくともカルボキシル基を含むことが好ましい。
【0032】
本発明の超親水性材料において基材は、金属材料、セラミックス材料若しくは高分子材料又はこれらの複合体であることが好ましい。
【0033】
本発明の超親水性材料において、基材とダイヤモンド様薄膜との間には、基材とダイヤモンド様薄膜との密着性を向上させる中間層が設けられていることが好ましい。
【0034】
本発明の超親水性材料において中間層は、珪素及び炭素を主成分とするアモルファス膜であることが好ましい。
【0035】
本発明に係る医療用材料は、本発明の超親水性材料を用いることを特徴とする。
【0036】
本発明に係る医療用器具は、本発明の医療用材料を用いることを特徴とする。
【0037】
本発明の医療用器具において、医療用器具は、人体組織と直接的に接触するものであってよい。
【0038】
本発明の医療用器具において、医療用器具は、ステント、カテーテル、バルーンカテーテル、ガイドワイヤ、ペースメーカーリード、体内留置用器材、注射針、メス、真空採血管、輸液バッグ、プレフィルドシリンジ、傷口保持部品のいずれか1つであることが好ましい。
【発明の効果】
【0039】
本発明に係るDLC膜の修飾方法及び超親水性材料、医療用材料、医療用器具とその製造方法によれば、DLC膜の親水性を向上させると共に、生体適合性等の機能の付与を効率良く行うことが可能であり、DLC膜の修飾方法及び超親水性材料、医療用材料、医療用器具とその製造方法を実現できる。
【図面の簡単な説明】
【0040】
【図1】本発明の一実施例において用いたイオン化蒸着装置を示す概略図である。
【図2】本発明の一実施例において用いたプラズマ照射装置を示す概略図である。
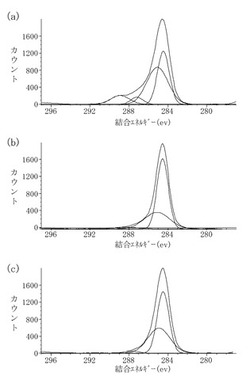
【図3】(a)〜(c)は本発明の一実施例に係るDLC膜のX線光電子分光分析の結果を示すチャートであり、(a)は第1のプラズマ照射と第2のプラズマ照射を行ったDLC膜であり、(b)はプラズマ照射を行っていないDLC膜であり、(c)は第1のプラズマ照射のみを行ったDLC膜である。
【図4】本発明の一実施例に係るDLC膜のぬれ性の経時変化を示すグラフである。
【図5】本発明の一実施例に係るDLC膜へのポリマーの導入を評価したX線光電子分光分析の結果を示すチャートである。
【発明を実施するための形態】
【0041】
本発明の一実施形態について図面を参照して説明する。本実施形態のDLC膜の修飾方法は、まず、基材の表面を覆うダイヤモンド様薄膜(DLC膜)を形成する。
【0042】
基材には、金属材料及び樹脂材料をはじめとする有機及び無機材料を用いることができる。
【0043】
具体的には、特に限定されるものではないが例えば、鉄、ニッケル、クロム、銅、チタン、白金、タングステン又はタンタル等の金属を基材として用いることができる。また、これらの合金である、SUS316L等のステンレス鋼、Ti−Ni合金若しくはCu−Al−Mn合金等の形状記憶合金、Cu−Zn合金、Ni−Al合金、チタン合金、タンタル合金、プラチナ合金又はタングステン合金等の合金を用いることもできる。また、アルミ、シリコン若しくはジルコン等の酸化物、窒化物若しくは炭化物等の生体不活性なセラミックス又はアパタイト若しくは生体ガラス等の生体活性を有するセラミックスでもよい。さらに、ポリメタクリル酸メチル(PMMA)、高密度ポリエチレン若しくはポリアセタール等の高分子樹脂又はポリジメチルシロキサン等のシリコンポリマー若しくはポリテトラフルオロエチレン等のフッ素系ポリマー等であってもよい。
【0044】
また、これらの材料はワイヤ、チューブ及び平板等の素材であってかまわない。さらに、医療用器具等の具体的な形状に形成されたもの及び形成途中のものであってもかまわない。医療用器具には、例えばステント、カテーテル、バルーンカテーテル、ガイドワイヤ、ペースメーカーリード、体内留置用器材、注射針、メス、真空採血管、輸液バッグ、プレフィルドシリンジ、傷口保持部品、人工心臓弁膜及び人工関節等が含まれる。
【0045】
基材の表面を覆うDLC膜は、既知の方法を用いて形成すればよい。例えば、スパッタ法、DCマグネトロンスパッタ法、RFマグネトロンスパッタ法、化学気相堆積法(CVD法)、プラズマCVD法、プラズマイオン注入法、重畳型RFプラズマイオン注入法、イオンプレーティング法、アークイオンプレーティング法、イオンビーム蒸着法又はレーザーアブレーション法等により基材の表面に形成することができる。また、その厚みは特に限定されるものではないが、0.005〜3μmの範囲が好ましく、より好ましくは0.01〜1μmの範囲である。
【0046】
また、DLC膜は基材の表面に直接形成することができるが、基材とDLC膜とをより強固に密着させるために、基材とDLC膜との間に中間層を設けてもよい。中間層の材質としては、基材の種類に応じて種々のものを用いることができるが、珪素(Si)と炭素(C)、チタン(Ti)と炭素(C)又はクロム(Cr)と炭素(C)からなるアモルファス膜等の公知のものを用いることができる。その厚みは特に限定されるものではないが、0.005〜0.3μmの範囲が好ましく、より好ましくは0.01〜0.1μmの範囲である。
【0047】
中間層は、公知の方法を用いて形成することができ、例えば、スパッタ法、CVD法、プラズマCVD法、溶射法、イオンプレーティング法又はアークイオンプレーティング法等を用いればよい。
【0048】
基材を覆うように形成したDLC膜に、第1のプラズマ照射を行うことにより、DLC膜にラジカル等の反応性の部位を生成する。反応性の部位を生成するためのプラズマは、DLC膜の表面に存在する炭素−炭素結合を切断して酸化開始点を生起させることが可能なプラズマであればよい。具体的には、例えばアルゴン(Ar)、ネオン(Ne)、ヘリウム(He)、クリプトン(Cr)、キセノン(Xe)、窒素ガス(N2)、酸素ガス(O2)、アンモニアガス(NH4)、水素ガス(H2)若しくは水蒸気(H2O)等のガス又はこれらの混合ガスをプラズマガス種とするプラズマを用いればよい。
【0049】
本実施形態の医療用材料の製造方法においては、第1のプラズマ照射を行った後、第2のプラズマ照射を行う。第2のプラズマ照射により、第1のプラズマ照射により形成したラジカル等の反応性の部位を酸素と反応させ、カルボキシル基等の酸素を含む親水性の官能基を生成する。
【0050】
第1のプラズマ照射により生成した反応性の部位は、酸素又は水を含む雰囲気に曝すことにより、カルボキシル基及び水酸基等に変換されることが期待される。しかし、第1のプラズマ照射を行った後のDLC膜を単純に酸素又は水を含む雰囲気に曝した場合に生成されるカルボキシル基及び水酸基の量は僅かであり、十分に親水性の官能基を生成することができない。しかし、第2のプラズマ照射を行うことにより、効率良くカルボキシル基等の親水性の官能基に変換することができる。
【0051】
第2のプラズマ照射は、酸素原子を含むプラズマを照射すればよく、具体的には、酸素、空気、水蒸気若しくは酸素原子を含む有機化合物等のガス又はこれらの混合ガスをプラズマガス種としてプラズマ照射を行えばよい。
【0052】
第2のプラズマ照射を行ったDLC膜は、表面に導入されたカルボキシル基等により親水性となっている。このため、このままでも優れた生体適合性を有しており、ステント等の医療用器具として用いることができる。
【0053】
また、DLC膜の表面に導入されたカルボキシル基を用いて、DLC膜の表面に生体適合性を有するポリマー等の機能性材料を固定してもよい。
【0054】
機能性材料の固定は公知の方法により行えばよい。例えば、機能性材料中の官能基と水酸基又はカルボキシル基とをカップリング試薬を介して固定したり、機能性材料に水酸基又はカルボキシル基と反応する官能基を導入し、機能性材料の官能基とDLC膜表面の官能基とを反応させて固定したりすればよい。
【0055】
また、水酸基及びカルボキシル基を、3-アミノプロピルトリメトキシシラン等の官能性アルコキシシラン誘導体、2-メルカプト酢酸等の官能性カルボン酸誘導体、ジイソシアネート誘導体、2-メタクリロイルオキシエチルイソシアネート、2-アクリロイルオキシエチルイソシアネート、N-メタクリロイルスクシンイミド、又はN-アクリロイルスクシンイミド等と反応させることにより、アミノ基、イソシアネート基又はビニル基等に容易に変換することができる。このような変換された官能基を用いて機能性材料を固定してもよい。
【0056】
また、機能性材料を共有結合により固定するのではなく、カルボキシル基等によりイオン結合させて固定してもよい。この場合、カルボキシル基等を他のイオン性の官能基に変換してもよい。イオン結合させることにより、機能性材料がヒドロキシアパタイト等の無機物であっても容易にDLC膜の表面に導入できる。
【0057】
DLC膜の表面に固定する機能性材料は、どのようなものであってもよいが、医療用材料として用いる場合には、生体適合性を有するポリマーを用いればよい。例えば、パリレン、ポリエチレン、ポリエチレンテレフタレート、エチレンビニルアセテート、シリコン、ポリエチレンオキシド(PEO)、ポリブチルメチルアクリレート、ポリアクリルアミド、ポリビニルピロリドン、ポリエチレンカーボネート若しくはポリプロピレンカーボネート等のポリカーボネート、セグメント化ポリウレタン等のポリウレタン又はポリエーテル型ポリウレタンとジメチルシリコンとのブレンド若しくはブロック共重合体等の合成ポリマーを用いることが可能である。また、ペプチド、タンパク質、核酸塩基、糖鎖、キチン若しくはキトサン等の天然のポリマーを用いてもよい。
【0058】
また、DLC膜に生体適合性ではなく、抗血栓性等の機能性を付与してもよい。この場合には薬剤をその中に含有し且つ薬剤を一定速度で放出する能力を有するポリマーを固定することが好ましい。
【0059】
例えば、生分解性のポリマーに抗血栓性を有する薬剤を担持させたものを固定すればよい。生分解性ポリマーが分解されDLC膜が露出したとしても、下地のDLC膜が親水性であるためなんら問題は生じない。生分解性のポリマーは、例えばポリグリコール酸、乳酸とグリコール酸の共重合体、ポリDL乳酸(DL−PLA)、ポリL乳酸(L−PLA)、ラクチド、ポリカプロラクトン(PCL)、コラーゲン、ゼラチン、キチン、キトサン、ヒアルロン酸、ポリ−L−グルタミン酸、ポリ−L−リジン等のポリアミノ酸、澱粉、ポリ−ε−カプロラクトン、ポリエチレンサクシネート又はポリ−β−ヒドロキシアルカノエート等とすればよい。また、これに限らず、生体内で酵素的又は非酵素的に分解され、分解産物が毒性を示さず、薬物の放出が可能なものであれば、いずれの生分解性ポリマーも利用可能である。
【0060】
生分解性のポリマーに担持させる抗血栓性の薬剤は、抗血小板剤、抗凝固剤、アンチフィブリン及びアンチトロンビンとしては、ヘパリンナトリウム、低分子量ヘパリン、ヒルジン、アルガトロバン、フォルスコリン、塩酸サルボクレラート、バピプロスト、プロスタサイクリン、プロスタサイクリン同族体、デキストラン、D−フェ−プロ−アルグ−クロロメチルケトン(合成アンチトロンビン)、ディピリダモール、グリコプロテインIIb/IIIa血小板膜受容抗体、ビトロネクチン受容体拮抗物質及びトロンビン防止剤等を用いればよい。
【0061】
また、生体によるポリマーの分解を促進し、薬剤の放出を効率良く行うためにポリマーに可塑剤を添加してもよい。可塑剤は、例えば酒石酸、リンゴ酸若しくはクエン酸のエステル系の可塑剤又は他の生体に対する安全性が確認された可塑剤を用いればよい。
【0062】
なお、用途に応じて生体適合性及び生分解性以外の機能を有するポリマーを固定することも可能である。
【0063】
さらに、カルボキシル基等の官能基をプラズマ、紫外線、放射線等の照射により活性化し、活性化した官能基を開始点としてモノマーをグラフト重合することにより、ポリマーを固定してもよい。カルボキシル基の活性化に要するエネルギーは、炭素−炭素結合の開裂と比べるとはるかに小さい。従って、DLC膜の表面にラジカルを導入する場合と比べて、カルボキシル基の活性化は容易である。このため、DLC膜へのグラフト重合を効率良く行うことが可能である。
【0064】
(一実施例)
以下に、本発明に係るDLC膜の修飾方法について実施例を用いてより具体的に説明する。
【0065】
本実施例において基材には、12mm角で厚さが5mmの高速度工具鋼(JIS規格SKH51)を用いた。
【0066】
図1は、本実施例において用いたイオン化蒸着装置を模式的に示したものであり、真空チャンバーの内部に設けられた直流アーク放電プラズマ発生器2に、イオン源であるAr並びにベンゼン(C6H6)ガスを導入することにより発生させたプラズマを、負電圧にバイアスしたターゲット1に衝突させることによりターゲット1の上にDLC膜を固体化して成膜する通常のイオン化蒸着装置である。
【0067】
基材を図1に示すイオン化蒸着装置のチャンバ内にセットし、チャンバーにアルゴンガス(Ar)を圧力が10-1Pa〜10-3Pa(10-3Torr〜10-5Torr)となるように導入した後、放電を行うことによりArイオン発生させ、発生したArイオンを基材の表面に衝突させるボンバードクリーニングを約30分間行った。
【0068】
続いて、チャンバにテトラメチルシラン(Si(CH3)4)を3分間導入し、珪素(Si)及び炭素(C)を主成分とするアモルファス状で膜厚が20nmの中間層を形成する。
【0069】
中間層を形成した後、C6H6ガスをチャンバーに導入し、ガス圧を10-1Paとする。C6H6を30mL/分の速度で連続的に導入しながら放電を行うことによりC6H6をイオン化し、イオン化蒸着を約2分間行い、厚さ30nmのDLC膜を基材の表面に形成した。
【0070】
DLC膜を形成する際のターゲット電圧は1.5kV、ターゲット電流は50mA、フィラメント電圧は14V、フィラメント電流は30A、アノード電圧は50V、アノード電流は0.6A、リフレクタ電圧は50V、リフレクタ電流は6mAとした。また、形成時における基材の温度は約160℃であった。
【0071】
なお、中間層は基材とDLC膜との密着性を向上させるために設けており、基材とDLC膜との密着性を十分に確保できる場合には省略してもよい。
【0072】
また、本実施例においては炭素源としてC6H6の単独ガスを用いたが、他の炭化水素原料を用いてもよい。また、C6H6等の炭化水素原料とCF4等のフロンガスとの混合ガスを用いて、フッ素を含むDLC膜を基材の表面に形成してもよい。
【0073】
次に、基材の表面に形成したDLC膜にプラズマを照射することによりDLC膜の表面にラジカルを導入した。図2は本実施例において使用したプラズマ照射装置を模式的に示している。
【0074】
図2に示すように本実施例において用いたプラズマ照射装置は、一般的なプラズマ照射装置であり、真空ポンプ22が接続されガス置換が可能なチャンバー21の底面及び胴部にそれぞれ電極23及び電極24が設けられている。電極23及び電極24に、マッチングネットワーク26を通して高周波電源25から高周波を印加することによりチャンバーの内部にプラズマを発生させ、電極23の上に設置したターゲット11にプラズマを照射する。
【0075】
まず、DLC膜を形成した基材に対して、ラジカルを発生させる第1のプラズマ照射を行った。DLC膜を形成した基材をプラズマ照射装置のチャンバーの内部にセットした後、アセチレン(C2H2)を流してチャンバーの内圧を133Paとした。続いて、高周波電源(アドテックプラズマテクノロジー製、AX−300型;周波数13.56MHz)を用いて50Wの高周波を電極に印加して、チャンバー内にアセチレンのプラズマを発生させ、DLC膜を形成した基材へアセチレンのプラズマを30秒間照射した。
【0076】
第1のプラズマ照射は、DLC膜の炭素炭素結合を切断しラジカルを発生させることができればよく、アセチレン以外のガスを用いて生成したプラズマを照射してもかまわない。
【0077】
次に、チャンバー内部の雰囲気をC2H2から酸素(O2)ガスに置換し内圧を133Paとした。続いて、50Wの高周波を電極に印加して、チャンバーの内部に酸素プラズマを発生させることにより第2のプラズマ照射を30秒間行った。
【0078】
第2のプラズマ照射は、第1のプラズマ照射により生成したラジカルと酸素とを効率良く反応させカルボキシル基を含む親水性の官能基を生成することを目的とする。従って、酸素ガスに変えて酸素原子を含む他のガスを用いて生成したプラズマを照射してもよい。
【0079】
次に、カルボキシル基を導入したDLC膜の表面に、N-ビニル-2-ピロリドン(NVP)を重合した化合物であるポリビニルピロリドン(Polyvinylpyrrolidone、略称PVP)を以下のようにしてグラフトした。
【0080】
まず、DLC膜に導入されたカルボキシル基の活性化を行った。カルボキシル基の活性化は、アルゴンプラズマを照射することにより行った。チャンバ内にカルボキシル基を導入したDLC膜をセットした後、アルゴンガスを流してチャンバの内圧を133Paとした。続いて、20Wの高周波を電極に印加して、アルゴンプラズマを2分間照射した。
【0081】
チャンバから基材を取り出した後、1分間大気暴露を行い、2mol/LのNVPを含むトルエン溶液と共に、ガラススクリュー管内に封入した。ガラススクリュー管内を窒素置換した後、80℃の温度で20時間重合を行った。重合後に基材を取り出し、多量のエタノール中に浸漬して洗浄することにより未反応のモノマー及びグラフトしていないポリマーを除去した。
【0082】
なお、カルボキシル基の活性化にプラズマ照射を用いたが、紫外線、電子線又はγ線等を用いてもよい。
【0083】
−DLC膜の評価−
以下に、本実施例において作製したDLC膜について評価した結果について説明する。まず、DLC膜の表面に生成した官能基をX線光電子分光法(XPS)を用いて測定した。XPS測定には、日本電子社製XPS装置JPS9010を用い、X線源には、Alkα(1486.5eV)を出力100W(10kV、10mA)で用いた。
【0084】
図3(a)は、アセチレンのプラズマによる第1のプラズマ照射と酸素プラズマによる第2のプラズマ照射とを行い、さらに2分間の大気暴露を行ったDLC膜の表面をXPSにより測定した結果を示している。289eV付近にC1s軌道のピークが観測された。このピークは、カルボキシル基のO=C―OH結合に基づくピークである。一方、図3(b)に示すように、プラズマ照射を行っていないDLC膜には、289eV付近にピークは認められない。
【0085】
このことから、第1のプラズマ照射の後、酸素を含む第2のプラズマ照射を行うことにより、第1のプラズマ照射において生成したラジカルが、酸素と反応しカルボキシル基が生成することが明らかである。
【0086】
また、図3(c)は、アセチレンのプラズマによる第1のプラズマ照射のみを行った後、2分間の大気暴露を行ったDLC膜の表面をXPSにより測定した結果を示している。図3(c)にも、カルボキシル基に由来するピークはほとんど認められない。
【0087】
また、図3(a)には287eV付近にも図3(b)及び(c)にはほとんど認められないピークが認められる。これは、水酸基のC−O−H結合に基づくピークであり、カルボキシル基の他に親水性の水酸基も生成していることがわかる。
【0088】
以上の結果から、第1のプラズマ照射により生成したラジカルは、大気暴露だけではほとんど酸素と反応しないことが明らかである。つまり、DLC膜に効率良く親水性の官能基を導入するためには、反応性部位を形成する第1のプラズマ照射と、酸素を含むプラズマを用いた第2のプラズマ照射とが不可欠であることが明らかである。
【0089】
次に、第2のプラズマ照射を行ったDLC膜の表面のぬれ性を接触角測定器により測定した。接触角の測定には、協和界面科学株式会社社製の自動接触角測定機DM300型を用い、医療用材料の表面上に1μLの水滴を置き、接触角を測定した。なお、測定値は10点の平均値とした。
【0090】
図4はプラズマ照射後の接触角の経時変化を示している。図4において△で示したプラズマ照射を行っていないDLC膜の接触角は、70度〜80度の範囲内でほぼ一定であった。これに対して、○で示したアセチレンによる第1のプラズマ照射と酸素による第2のプラズマ照射を行ったDLC膜の接触角は、3度程度でほぼ一定であり、第2のプラズマ照射を行うことにより親水性が大きく向上し、いわゆる超親水性の表面となっていることがわかる。
【0091】
一方、図4で●で示したアセチレンによる第1のプラズマ照射のみを行った場合には、初期の接触角が120度であり、プラズマ照射を行っていないDLC膜よりも接触角が大きくなった。また、時間と共に接触角が低下し、最終的にはプラズマ照射を行っていないDLC膜よりも少し大きな値となった。これは、アセチレンによる第1のプラズマ照射により形成されたラジカルと大気中の酸素との反応は非常に遅く、また生成したラジカルのうち一部しか反応しないことを示している。
【0092】
また、第1のプラズマ照射をアセチレンに代えて酸素により行った場合の結果を▽で示した。第1のプラズマ照射に酸素プラズマを用いることにより、ラジカルの生成と酸素との反応が同時に進行し、DLC膜の表面が親水性となることが期待される。しかし、この場合には、一旦接触角が低下するが、時間の経過と共に接触角が上昇する傾向が認められた。このような挙動を示す原因は明らかではないが、1回目の酸素プラズマの照射の際には、DLC膜に形成されたラジカルと酸素との反応が十分生じていないのではないかと考えられる。
【0093】
以上のように、DLC膜に反応性の部位を形成する第1のプラズマ照射を行った後、酸素を含むプラズマによる第2のプラズマ照射を行うことにより、DLC膜を接触角が10度以下のいわゆる超親水性とすることができる。また、DLC膜であるため超親水性であるだけでなく耐久性も有しているため、医療用材料をはじめとして様々な分野において用いることができる。さらに、DLC膜に導入された官能基を用いることにより、DLC膜にポリマー等を固定し、超親水性以外の機能を付与することも可能である。
【0094】
図5(a)及び(b)はそれぞれ、アセチレンによる第1のプラズマ照射と酸素による第2のプラズマ照射を行いカルボキシル基を導入したDLC膜にNPVをグラフトした場合及びカルボキシル基の導入を行っていないDLC膜にNPVをグラフトした場合のXPSの測定結果を示している。図5(a)に示すように、カルボキシル基の導入を行った場合には、ポリビニルピロリドンのピロリドン環に由来するN1sのピークが認められた。また、第2のプラズマ照射後には約3度であった接触角が、ポリビニルピロリドンのグラフト後には57±3度まで上昇した。このことから、第2のプラズマ照射によりDLC膜に導入されたカルボキシル基によりポリビニルピロリドンがグラフトされたことが明らかである。
【0095】
一方、図5(b)に示すように、カルボキシル基の導入を行っていない場合には、N1sのピークは認められていない。このことから、カルボキシル基の活性化に用いたプラズマの照射条件によっては、DLC膜の炭素−炭素結合が開裂せず、グラフト重合が進行しないことがわかる。
【0096】
また、第2のプラズマ照射を行った後、10日間放置したDLC膜に対してポリビニルピロリドンのグラフトを行ったが、なんら問題なくグラフトを行うことができた。
【0097】
以上説明したように、DLC膜の炭素−炭素結合を開裂させラジカルを形成する第1のプラズマ照射と、第1のプラズマ照射により形成されたラジカルを酸素と反応させる第2のプラズマ照射とを行うことにより、DLC膜の表面を超親水性とすることが可能である。
【0098】
プラズマ照射を2回行うことにより、DLC膜の表面が超親水性となる理由は明確ではないが、1回目のプラズマ照射により形成された反応性部位が、2回目の酸素を含むプラズマの照射により効率良く反応してカルボキシル基等の親水性の官能基となるためであると考えられる。また、DLC膜に導入された親水性の官能基は安定であり、長期にわたり超親水性を維持することができる。また、導入された官能基は、容易に活性化することができ、ポリマーをグラフトすることができる。また、官能基をポリマーを結合する結合部位として用いることも可能であり、ポリマーの有する種々の機能をDLC膜に容易に付与することができる。
【0099】
超親水性又は機能性を付与したDLC膜は、種々の用途に用いることができる。例えば、耐久性及び生体適合性が要求される、ステント、カテーテル、バルーンカテーテル、ガイドワイヤ、ペースメーカーリード、体内留置用器材、注射針、メス、真空採血管、輸液バッグ、プレフィルドシリンジ及び傷口保持部品等の医療用器具又は医療用器具の材料として用いることができる。
【産業上の利用可能性】
【0100】
本発明に係る超親水性材料、医療用材料及び医療用器具は、DLC膜の親水性を向上させると共に、生体適合性等の機能の付与を効率良く行うことが可能であり、ダイヤモンド様薄膜の修飾方法として有用であると共に、超親水性材料、医療用材料、医療用器具とその製造方法等として有用である。
【符号の説明】
【0101】
1 ターゲット
2 直流アーク放電プラズマ発生器
11 ターゲット
21 チャンバー
22 真空ポンプ
23 電極
24 電極
25 高周波電源
26 マッチングネットワーク
【技術分野】
【0001】
本発明は、本発明は超親水性材料、医療用材料及び医療用器具に関し、特に生体適合性に優れた材料に関する。
【背景技術】
【0002】
ダイヤモンド様薄膜(DLC膜)は、硬く緻密で且つ不活性な表面を有しているため、金属やセラミックス等の無機系材料及び樹脂等の有機系材料等からなる基材の表面に形成することにより基材の表面に耐摩耗性、耐蝕性及び表面平滑性等の性質を付与することができる。
【0003】
例えば、金型や治工具の表面をDLC膜によりコーティングすることにより、耐久性を向上させたり、離型性を向上させたりすることが知られている。また、非常に平滑で不活性な表面であるため、生体物質との相互作用を嫌う医療用器具の基材を表面処理する方法としても期待されている(例えば、特許文献1及び非特許文献1を参照)。
【0004】
さらに、本願発明者らはDLC膜にプラズマを照射することによりDLC膜に反応性の部位を導入する方法について報告している(例えば、特許文献2を参照。)。プラズマ照射により、DLC膜にラジカル等の反応性の部位を導入し、導入されたラジカルを開始点として生体適合性ポリマーをグラフト重合することが可能となる。また、ラジカルを導入した後、大気暴露を行うことにより水酸基等の官能基を生成することができ、生成した官能基を用いればDLC膜に種々の修飾を行うことができる。このように、DLC膜を修飾することにより生体適合性等の種々の機能を付加することが可能であり、耐久性と機能性とを併せ持つ材料を実現することができる。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平10−248923号公報
【特許文献2】国際公開第2005/97673号パンフレット
【非特許文献】
【0006】
【非特許文献1】伊藤晴夫ら、「生体材料」、1985年、第3巻、p.45−53
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、本願発明者らの検討の結果、前記従来のDLC膜の修飾方法には以下のような問題があることが明らかになった。従来のDLC膜を修飾する方法においては、基材の表面を被覆するDLC膜にプラズマ照射をすることによりDLC膜の炭素−炭素結合を開裂させることによりラジカルを生成している。DLC膜の炭素−炭素結合を開裂させることにより形成されたラジカルは、不安定であり消滅しやすく、DLC膜にプラズマ照射を行った後、すぐにポリマーのグラフトを行わなければならない。
【0008】
また、ラジカルが不安定であるため、プラズマを照射してから重合を開始するまでの時間を一定にしたとしても、ポリマーのグラフトに寄与するラジカルの数を一定にすることができない。その結果、ロット間でポリマーの被覆状態がばらついてしまい、生体適合性等の機能を再現性良く付与することができない。
【0009】
さらに、ラジカルを導入したDLC膜を大気暴露することにより水酸基等の親水性の官能基を導入する場合にも、ラジカルと酸素との反応が十分に進行しない。このため、DLC膜の親水性が十分向上しない。また、一旦、親水性が向上しても時間の経過により再び親水性が悪化してしまう。
【0010】
本発明は、前記従来の問題を解決し、DLC膜の親水性を向上させると共に、生体適合性等の機能の付与を効率良く行うことが可能なDLC膜の修飾方法を実現できるようにすることを目的とする。
【課題を解決するための手段】
【0011】
前記の目的を達成するため、本発明はDLC膜の修飾方法を、DLC膜に反応性の部位を形成する第1のプラズマ照射工程と反応性の部位を親水性の官能基に変換する第2のプラズマ照射工程とを備えた構成とする。
【0012】
本発明に係るダイヤモンド様薄膜の修飾方法は、基材の表面にダイヤモンド様薄膜を形成する工程(a)と、ダイヤモンド様薄膜に第1のプラズマを照射することにより反応性の部位をダイヤモンド様薄膜の表面に生起させる工程(b)と、ダイヤモンド様薄膜に少なくとも酸素を含む第2のプラズマを照射することにより反応性の部位と酸素とを反応させて親水性の官能基を導入する工程(c)とを備えていることを特徴とする。
【0013】
本発明のダイヤモンド様薄膜の修飾方法は、ダイヤモンド様薄膜に少なくとも酸素を含む第2のプラズマを照射することにより反応性の部位と酸素とを反応させることにより親水性の官能基を導入する工程を備えているため、第1のプラズマ照射によりダイヤモンド様薄膜の表面に形成された反応性の部位を確実に親水性の官能基とすることができる。このため、基材に耐久性だけでなく親水性の機能を効率良く付与することができる。従って、医療用材料をはじめとする種々の分野の材料に耐久性と親水性とを付与することができる。また、導入された官能基を用いることによりダイヤモンド様薄膜の表面をさらに改質することも可能となる。
【0014】
本発明のダイヤモンド様薄膜の修飾方法において、工程(c)では、ダイヤモンド様薄膜における水の接触角を10度以下にすることが好ましい。このような構成とすることにより、いわゆる超親水性の材料を実現することができる。
【0015】
本発明のダイヤモンド様薄膜の修飾方法において、第1のプラズマは、アルゴン、キセノン、ネオン、ヘリウム、クリプトン、窒素、酸素、アンモニア、水素、水蒸気、鎖式又は環式の炭化水素、酸素を含む有機化合物及び窒素を含む有機化合物からなる群から選択された1つの気体又は2つ以上からなる混合気体のプラズマであることが好ましい。
【0016】
本発明のダイヤモンド様薄膜の修飾方法において、第2のプラズマは、酸素、空気、水蒸気及び酸素を含む有機化合物からなる群から選択された1つの気体又は2つ以上からなる混合気体のプラズマであることが好ましい。
【0017】
本発明のダイヤモンド様薄膜の修飾方法において、親水性の官能基はカルボキシル基を含むことが好ましい。
【0018】
本発明のダイヤモンド様薄膜の修飾方法は、工程(c)よりも後に、親水性の官能基を用いてダイヤモンド様薄膜の表面に機能性材料を固定する工程(d)をさらに備えていることが好ましく、工程(d)では、親水性の官能基と機能性材料に含まれる官能基とを共有結合させてかまわない。また、工程(d)は親水性の官能基を活性化する工程と、活性化した親水性の官能基を開始点としてグラフト重合を行う工程とを含んでいてもよい。
【0019】
本発明のダイヤモンド様薄膜の修飾方法において、機能性材料は生体適合性ポリマーであることが好ましい。
【0020】
この場合において、生体適合性ポリマーは、ポリウレタン、ポリアクリルアミド、ポリエチレンオキシド、ポリエチレンカーボネート、ポリエチレン、ポリエチレングリコール、ポリビニルピロリドン、ポリプロピレンカーボネート、ポリアミド、フィブリン、リン脂質の重合体、疎水親水ミクロ相分離重合体、ヒドロキシエチルメタクリレートの重合体又は共重合体、ビニルピロリドンの重合体又は共重合体、フッ素含有モノマーの重合体又は共重合体、Si含有モノマーの重合体又は共重合体及びビニルエーテルの重合体又は共重合体からなる群から選択された少なくとも1つのポリマー又はポリマーのエステル化物であることが好ましい。
【0021】
本発明のダイヤモンド様薄膜の修飾方法において、機能性材料は抗血栓性の薬剤を担持し且つ担持した薬剤を除放する生分解性ポリマーであってもよい。
【0022】
この場合において、生分解性ポリマーは、ポリ乳酸、ポリグリコール酸、ポリ乳酸とポリグリコール酸との共重合体、コラーゲン、ゼラチン、キチン、キトサン、ヒアルロン酸、ポリアミノ酸、澱粉、ポリ−ε−カプロラクトン、ポリエチレンサクシネート、及びポリ−β−ヒドロキシアルカノエートからなる群から選択された少なくとも1つのポリマーであることが好ましい。また、生分解性ポリマーは、可塑剤を含んでいてもよい。
【0023】
本発明のダイヤモンド様薄膜の修飾方法において、工程(a)よりも前に、基材とダイヤモンド様薄膜との密着性を向上させる中間層を基材の表面に形成する中間層形成工程をさらに備えていることが好ましい。
【0024】
この場合において、中間層は珪素及び炭素を主成分とするアモルファス膜であることが好ましい。
【0025】
本発明に係る医療用材料の製造方法は、本発明のダイヤモンド様薄膜の修飾方法を用いることを特徴とする。
【0026】
本発明に係る医療用器具の製造方法は、本発明の医療用材料の製造方法を用いることを特徴とする。
【0027】
本発明の医療用器具の製造方法において、医療用器具は、人体組織と直接的に接触するものであってよい。
【0028】
本発明の医療用器具の製造方法において、医療用器具は、ステント、カテーテル、バルーンカテーテル、ガイドワイヤ、ペースメーカーリード、体内留置用器材、注射針、メス、真空採血管、輸液バッグ、プレフィルドシリンジ、傷口保持部品のいずれか1つであることが好ましい。
【0029】
本発明に係る超親水性材料は、基材と、基材の表面に形成され且つ親水性の官能基を有するダイヤモンド様薄膜とを備え、ダイヤモンド様薄膜の表面における水の接触角が10度以下であることを特徴とする。
【0030】
本発明の超親水性材料は、ダイヤモンド様薄膜の表面における水の接触角が10度以下であり、超親水性だけでなく優れた耐久性を有している。従って、耐久性と親水性とが要求される医療材料をはじめとする種々の分野における材料として用いることができる。
【0031】
本発明の超親水性材料において、親水性の官能基は、少なくともカルボキシル基を含むことが好ましい。
【0032】
本発明の超親水性材料において基材は、金属材料、セラミックス材料若しくは高分子材料又はこれらの複合体であることが好ましい。
【0033】
本発明の超親水性材料において、基材とダイヤモンド様薄膜との間には、基材とダイヤモンド様薄膜との密着性を向上させる中間層が設けられていることが好ましい。
【0034】
本発明の超親水性材料において中間層は、珪素及び炭素を主成分とするアモルファス膜であることが好ましい。
【0035】
本発明に係る医療用材料は、本発明の超親水性材料を用いることを特徴とする。
【0036】
本発明に係る医療用器具は、本発明の医療用材料を用いることを特徴とする。
【0037】
本発明の医療用器具において、医療用器具は、人体組織と直接的に接触するものであってよい。
【0038】
本発明の医療用器具において、医療用器具は、ステント、カテーテル、バルーンカテーテル、ガイドワイヤ、ペースメーカーリード、体内留置用器材、注射針、メス、真空採血管、輸液バッグ、プレフィルドシリンジ、傷口保持部品のいずれか1つであることが好ましい。
【発明の効果】
【0039】
本発明に係るDLC膜の修飾方法及び超親水性材料、医療用材料、医療用器具とその製造方法によれば、DLC膜の親水性を向上させると共に、生体適合性等の機能の付与を効率良く行うことが可能であり、DLC膜の修飾方法及び超親水性材料、医療用材料、医療用器具とその製造方法を実現できる。
【図面の簡単な説明】
【0040】
【図1】本発明の一実施例において用いたイオン化蒸着装置を示す概略図である。
【図2】本発明の一実施例において用いたプラズマ照射装置を示す概略図である。
【図3】(a)〜(c)は本発明の一実施例に係るDLC膜のX線光電子分光分析の結果を示すチャートであり、(a)は第1のプラズマ照射と第2のプラズマ照射を行ったDLC膜であり、(b)はプラズマ照射を行っていないDLC膜であり、(c)は第1のプラズマ照射のみを行ったDLC膜である。
【図4】本発明の一実施例に係るDLC膜のぬれ性の経時変化を示すグラフである。
【図5】本発明の一実施例に係るDLC膜へのポリマーの導入を評価したX線光電子分光分析の結果を示すチャートである。
【発明を実施するための形態】
【0041】
本発明の一実施形態について図面を参照して説明する。本実施形態のDLC膜の修飾方法は、まず、基材の表面を覆うダイヤモンド様薄膜(DLC膜)を形成する。
【0042】
基材には、金属材料及び樹脂材料をはじめとする有機及び無機材料を用いることができる。
【0043】
具体的には、特に限定されるものではないが例えば、鉄、ニッケル、クロム、銅、チタン、白金、タングステン又はタンタル等の金属を基材として用いることができる。また、これらの合金である、SUS316L等のステンレス鋼、Ti−Ni合金若しくはCu−Al−Mn合金等の形状記憶合金、Cu−Zn合金、Ni−Al合金、チタン合金、タンタル合金、プラチナ合金又はタングステン合金等の合金を用いることもできる。また、アルミ、シリコン若しくはジルコン等の酸化物、窒化物若しくは炭化物等の生体不活性なセラミックス又はアパタイト若しくは生体ガラス等の生体活性を有するセラミックスでもよい。さらに、ポリメタクリル酸メチル(PMMA)、高密度ポリエチレン若しくはポリアセタール等の高分子樹脂又はポリジメチルシロキサン等のシリコンポリマー若しくはポリテトラフルオロエチレン等のフッ素系ポリマー等であってもよい。
【0044】
また、これらの材料はワイヤ、チューブ及び平板等の素材であってかまわない。さらに、医療用器具等の具体的な形状に形成されたもの及び形成途中のものであってもかまわない。医療用器具には、例えばステント、カテーテル、バルーンカテーテル、ガイドワイヤ、ペースメーカーリード、体内留置用器材、注射針、メス、真空採血管、輸液バッグ、プレフィルドシリンジ、傷口保持部品、人工心臓弁膜及び人工関節等が含まれる。
【0045】
基材の表面を覆うDLC膜は、既知の方法を用いて形成すればよい。例えば、スパッタ法、DCマグネトロンスパッタ法、RFマグネトロンスパッタ法、化学気相堆積法(CVD法)、プラズマCVD法、プラズマイオン注入法、重畳型RFプラズマイオン注入法、イオンプレーティング法、アークイオンプレーティング法、イオンビーム蒸着法又はレーザーアブレーション法等により基材の表面に形成することができる。また、その厚みは特に限定されるものではないが、0.005〜3μmの範囲が好ましく、より好ましくは0.01〜1μmの範囲である。
【0046】
また、DLC膜は基材の表面に直接形成することができるが、基材とDLC膜とをより強固に密着させるために、基材とDLC膜との間に中間層を設けてもよい。中間層の材質としては、基材の種類に応じて種々のものを用いることができるが、珪素(Si)と炭素(C)、チタン(Ti)と炭素(C)又はクロム(Cr)と炭素(C)からなるアモルファス膜等の公知のものを用いることができる。その厚みは特に限定されるものではないが、0.005〜0.3μmの範囲が好ましく、より好ましくは0.01〜0.1μmの範囲である。
【0047】
中間層は、公知の方法を用いて形成することができ、例えば、スパッタ法、CVD法、プラズマCVD法、溶射法、イオンプレーティング法又はアークイオンプレーティング法等を用いればよい。
【0048】
基材を覆うように形成したDLC膜に、第1のプラズマ照射を行うことにより、DLC膜にラジカル等の反応性の部位を生成する。反応性の部位を生成するためのプラズマは、DLC膜の表面に存在する炭素−炭素結合を切断して酸化開始点を生起させることが可能なプラズマであればよい。具体的には、例えばアルゴン(Ar)、ネオン(Ne)、ヘリウム(He)、クリプトン(Cr)、キセノン(Xe)、窒素ガス(N2)、酸素ガス(O2)、アンモニアガス(NH4)、水素ガス(H2)若しくは水蒸気(H2O)等のガス又はこれらの混合ガスをプラズマガス種とするプラズマを用いればよい。
【0049】
本実施形態の医療用材料の製造方法においては、第1のプラズマ照射を行った後、第2のプラズマ照射を行う。第2のプラズマ照射により、第1のプラズマ照射により形成したラジカル等の反応性の部位を酸素と反応させ、カルボキシル基等の酸素を含む親水性の官能基を生成する。
【0050】
第1のプラズマ照射により生成した反応性の部位は、酸素又は水を含む雰囲気に曝すことにより、カルボキシル基及び水酸基等に変換されることが期待される。しかし、第1のプラズマ照射を行った後のDLC膜を単純に酸素又は水を含む雰囲気に曝した場合に生成されるカルボキシル基及び水酸基の量は僅かであり、十分に親水性の官能基を生成することができない。しかし、第2のプラズマ照射を行うことにより、効率良くカルボキシル基等の親水性の官能基に変換することができる。
【0051】
第2のプラズマ照射は、酸素原子を含むプラズマを照射すればよく、具体的には、酸素、空気、水蒸気若しくは酸素原子を含む有機化合物等のガス又はこれらの混合ガスをプラズマガス種としてプラズマ照射を行えばよい。
【0052】
第2のプラズマ照射を行ったDLC膜は、表面に導入されたカルボキシル基等により親水性となっている。このため、このままでも優れた生体適合性を有しており、ステント等の医療用器具として用いることができる。
【0053】
また、DLC膜の表面に導入されたカルボキシル基を用いて、DLC膜の表面に生体適合性を有するポリマー等の機能性材料を固定してもよい。
【0054】
機能性材料の固定は公知の方法により行えばよい。例えば、機能性材料中の官能基と水酸基又はカルボキシル基とをカップリング試薬を介して固定したり、機能性材料に水酸基又はカルボキシル基と反応する官能基を導入し、機能性材料の官能基とDLC膜表面の官能基とを反応させて固定したりすればよい。
【0055】
また、水酸基及びカルボキシル基を、3-アミノプロピルトリメトキシシラン等の官能性アルコキシシラン誘導体、2-メルカプト酢酸等の官能性カルボン酸誘導体、ジイソシアネート誘導体、2-メタクリロイルオキシエチルイソシアネート、2-アクリロイルオキシエチルイソシアネート、N-メタクリロイルスクシンイミド、又はN-アクリロイルスクシンイミド等と反応させることにより、アミノ基、イソシアネート基又はビニル基等に容易に変換することができる。このような変換された官能基を用いて機能性材料を固定してもよい。
【0056】
また、機能性材料を共有結合により固定するのではなく、カルボキシル基等によりイオン結合させて固定してもよい。この場合、カルボキシル基等を他のイオン性の官能基に変換してもよい。イオン結合させることにより、機能性材料がヒドロキシアパタイト等の無機物であっても容易にDLC膜の表面に導入できる。
【0057】
DLC膜の表面に固定する機能性材料は、どのようなものであってもよいが、医療用材料として用いる場合には、生体適合性を有するポリマーを用いればよい。例えば、パリレン、ポリエチレン、ポリエチレンテレフタレート、エチレンビニルアセテート、シリコン、ポリエチレンオキシド(PEO)、ポリブチルメチルアクリレート、ポリアクリルアミド、ポリビニルピロリドン、ポリエチレンカーボネート若しくはポリプロピレンカーボネート等のポリカーボネート、セグメント化ポリウレタン等のポリウレタン又はポリエーテル型ポリウレタンとジメチルシリコンとのブレンド若しくはブロック共重合体等の合成ポリマーを用いることが可能である。また、ペプチド、タンパク質、核酸塩基、糖鎖、キチン若しくはキトサン等の天然のポリマーを用いてもよい。
【0058】
また、DLC膜に生体適合性ではなく、抗血栓性等の機能性を付与してもよい。この場合には薬剤をその中に含有し且つ薬剤を一定速度で放出する能力を有するポリマーを固定することが好ましい。
【0059】
例えば、生分解性のポリマーに抗血栓性を有する薬剤を担持させたものを固定すればよい。生分解性ポリマーが分解されDLC膜が露出したとしても、下地のDLC膜が親水性であるためなんら問題は生じない。生分解性のポリマーは、例えばポリグリコール酸、乳酸とグリコール酸の共重合体、ポリDL乳酸(DL−PLA)、ポリL乳酸(L−PLA)、ラクチド、ポリカプロラクトン(PCL)、コラーゲン、ゼラチン、キチン、キトサン、ヒアルロン酸、ポリ−L−グルタミン酸、ポリ−L−リジン等のポリアミノ酸、澱粉、ポリ−ε−カプロラクトン、ポリエチレンサクシネート又はポリ−β−ヒドロキシアルカノエート等とすればよい。また、これに限らず、生体内で酵素的又は非酵素的に分解され、分解産物が毒性を示さず、薬物の放出が可能なものであれば、いずれの生分解性ポリマーも利用可能である。
【0060】
生分解性のポリマーに担持させる抗血栓性の薬剤は、抗血小板剤、抗凝固剤、アンチフィブリン及びアンチトロンビンとしては、ヘパリンナトリウム、低分子量ヘパリン、ヒルジン、アルガトロバン、フォルスコリン、塩酸サルボクレラート、バピプロスト、プロスタサイクリン、プロスタサイクリン同族体、デキストラン、D−フェ−プロ−アルグ−クロロメチルケトン(合成アンチトロンビン)、ディピリダモール、グリコプロテインIIb/IIIa血小板膜受容抗体、ビトロネクチン受容体拮抗物質及びトロンビン防止剤等を用いればよい。
【0061】
また、生体によるポリマーの分解を促進し、薬剤の放出を効率良く行うためにポリマーに可塑剤を添加してもよい。可塑剤は、例えば酒石酸、リンゴ酸若しくはクエン酸のエステル系の可塑剤又は他の生体に対する安全性が確認された可塑剤を用いればよい。
【0062】
なお、用途に応じて生体適合性及び生分解性以外の機能を有するポリマーを固定することも可能である。
【0063】
さらに、カルボキシル基等の官能基をプラズマ、紫外線、放射線等の照射により活性化し、活性化した官能基を開始点としてモノマーをグラフト重合することにより、ポリマーを固定してもよい。カルボキシル基の活性化に要するエネルギーは、炭素−炭素結合の開裂と比べるとはるかに小さい。従って、DLC膜の表面にラジカルを導入する場合と比べて、カルボキシル基の活性化は容易である。このため、DLC膜へのグラフト重合を効率良く行うことが可能である。
【0064】
(一実施例)
以下に、本発明に係るDLC膜の修飾方法について実施例を用いてより具体的に説明する。
【0065】
本実施例において基材には、12mm角で厚さが5mmの高速度工具鋼(JIS規格SKH51)を用いた。
【0066】
図1は、本実施例において用いたイオン化蒸着装置を模式的に示したものであり、真空チャンバーの内部に設けられた直流アーク放電プラズマ発生器2に、イオン源であるAr並びにベンゼン(C6H6)ガスを導入することにより発生させたプラズマを、負電圧にバイアスしたターゲット1に衝突させることによりターゲット1の上にDLC膜を固体化して成膜する通常のイオン化蒸着装置である。
【0067】
基材を図1に示すイオン化蒸着装置のチャンバ内にセットし、チャンバーにアルゴンガス(Ar)を圧力が10-1Pa〜10-3Pa(10-3Torr〜10-5Torr)となるように導入した後、放電を行うことによりArイオン発生させ、発生したArイオンを基材の表面に衝突させるボンバードクリーニングを約30分間行った。
【0068】
続いて、チャンバにテトラメチルシラン(Si(CH3)4)を3分間導入し、珪素(Si)及び炭素(C)を主成分とするアモルファス状で膜厚が20nmの中間層を形成する。
【0069】
中間層を形成した後、C6H6ガスをチャンバーに導入し、ガス圧を10-1Paとする。C6H6を30mL/分の速度で連続的に導入しながら放電を行うことによりC6H6をイオン化し、イオン化蒸着を約2分間行い、厚さ30nmのDLC膜を基材の表面に形成した。
【0070】
DLC膜を形成する際のターゲット電圧は1.5kV、ターゲット電流は50mA、フィラメント電圧は14V、フィラメント電流は30A、アノード電圧は50V、アノード電流は0.6A、リフレクタ電圧は50V、リフレクタ電流は6mAとした。また、形成時における基材の温度は約160℃であった。
【0071】
なお、中間層は基材とDLC膜との密着性を向上させるために設けており、基材とDLC膜との密着性を十分に確保できる場合には省略してもよい。
【0072】
また、本実施例においては炭素源としてC6H6の単独ガスを用いたが、他の炭化水素原料を用いてもよい。また、C6H6等の炭化水素原料とCF4等のフロンガスとの混合ガスを用いて、フッ素を含むDLC膜を基材の表面に形成してもよい。
【0073】
次に、基材の表面に形成したDLC膜にプラズマを照射することによりDLC膜の表面にラジカルを導入した。図2は本実施例において使用したプラズマ照射装置を模式的に示している。
【0074】
図2に示すように本実施例において用いたプラズマ照射装置は、一般的なプラズマ照射装置であり、真空ポンプ22が接続されガス置換が可能なチャンバー21の底面及び胴部にそれぞれ電極23及び電極24が設けられている。電極23及び電極24に、マッチングネットワーク26を通して高周波電源25から高周波を印加することによりチャンバーの内部にプラズマを発生させ、電極23の上に設置したターゲット11にプラズマを照射する。
【0075】
まず、DLC膜を形成した基材に対して、ラジカルを発生させる第1のプラズマ照射を行った。DLC膜を形成した基材をプラズマ照射装置のチャンバーの内部にセットした後、アセチレン(C2H2)を流してチャンバーの内圧を133Paとした。続いて、高周波電源(アドテックプラズマテクノロジー製、AX−300型;周波数13.56MHz)を用いて50Wの高周波を電極に印加して、チャンバー内にアセチレンのプラズマを発生させ、DLC膜を形成した基材へアセチレンのプラズマを30秒間照射した。
【0076】
第1のプラズマ照射は、DLC膜の炭素炭素結合を切断しラジカルを発生させることができればよく、アセチレン以外のガスを用いて生成したプラズマを照射してもかまわない。
【0077】
次に、チャンバー内部の雰囲気をC2H2から酸素(O2)ガスに置換し内圧を133Paとした。続いて、50Wの高周波を電極に印加して、チャンバーの内部に酸素プラズマを発生させることにより第2のプラズマ照射を30秒間行った。
【0078】
第2のプラズマ照射は、第1のプラズマ照射により生成したラジカルと酸素とを効率良く反応させカルボキシル基を含む親水性の官能基を生成することを目的とする。従って、酸素ガスに変えて酸素原子を含む他のガスを用いて生成したプラズマを照射してもよい。
【0079】
次に、カルボキシル基を導入したDLC膜の表面に、N-ビニル-2-ピロリドン(NVP)を重合した化合物であるポリビニルピロリドン(Polyvinylpyrrolidone、略称PVP)を以下のようにしてグラフトした。
【0080】
まず、DLC膜に導入されたカルボキシル基の活性化を行った。カルボキシル基の活性化は、アルゴンプラズマを照射することにより行った。チャンバ内にカルボキシル基を導入したDLC膜をセットした後、アルゴンガスを流してチャンバの内圧を133Paとした。続いて、20Wの高周波を電極に印加して、アルゴンプラズマを2分間照射した。
【0081】
チャンバから基材を取り出した後、1分間大気暴露を行い、2mol/LのNVPを含むトルエン溶液と共に、ガラススクリュー管内に封入した。ガラススクリュー管内を窒素置換した後、80℃の温度で20時間重合を行った。重合後に基材を取り出し、多量のエタノール中に浸漬して洗浄することにより未反応のモノマー及びグラフトしていないポリマーを除去した。
【0082】
なお、カルボキシル基の活性化にプラズマ照射を用いたが、紫外線、電子線又はγ線等を用いてもよい。
【0083】
−DLC膜の評価−
以下に、本実施例において作製したDLC膜について評価した結果について説明する。まず、DLC膜の表面に生成した官能基をX線光電子分光法(XPS)を用いて測定した。XPS測定には、日本電子社製XPS装置JPS9010を用い、X線源には、Alkα(1486.5eV)を出力100W(10kV、10mA)で用いた。
【0084】
図3(a)は、アセチレンのプラズマによる第1のプラズマ照射と酸素プラズマによる第2のプラズマ照射とを行い、さらに2分間の大気暴露を行ったDLC膜の表面をXPSにより測定した結果を示している。289eV付近にC1s軌道のピークが観測された。このピークは、カルボキシル基のO=C―OH結合に基づくピークである。一方、図3(b)に示すように、プラズマ照射を行っていないDLC膜には、289eV付近にピークは認められない。
【0085】
このことから、第1のプラズマ照射の後、酸素を含む第2のプラズマ照射を行うことにより、第1のプラズマ照射において生成したラジカルが、酸素と反応しカルボキシル基が生成することが明らかである。
【0086】
また、図3(c)は、アセチレンのプラズマによる第1のプラズマ照射のみを行った後、2分間の大気暴露を行ったDLC膜の表面をXPSにより測定した結果を示している。図3(c)にも、カルボキシル基に由来するピークはほとんど認められない。
【0087】
また、図3(a)には287eV付近にも図3(b)及び(c)にはほとんど認められないピークが認められる。これは、水酸基のC−O−H結合に基づくピークであり、カルボキシル基の他に親水性の水酸基も生成していることがわかる。
【0088】
以上の結果から、第1のプラズマ照射により生成したラジカルは、大気暴露だけではほとんど酸素と反応しないことが明らかである。つまり、DLC膜に効率良く親水性の官能基を導入するためには、反応性部位を形成する第1のプラズマ照射と、酸素を含むプラズマを用いた第2のプラズマ照射とが不可欠であることが明らかである。
【0089】
次に、第2のプラズマ照射を行ったDLC膜の表面のぬれ性を接触角測定器により測定した。接触角の測定には、協和界面科学株式会社社製の自動接触角測定機DM300型を用い、医療用材料の表面上に1μLの水滴を置き、接触角を測定した。なお、測定値は10点の平均値とした。
【0090】
図4はプラズマ照射後の接触角の経時変化を示している。図4において△で示したプラズマ照射を行っていないDLC膜の接触角は、70度〜80度の範囲内でほぼ一定であった。これに対して、○で示したアセチレンによる第1のプラズマ照射と酸素による第2のプラズマ照射を行ったDLC膜の接触角は、3度程度でほぼ一定であり、第2のプラズマ照射を行うことにより親水性が大きく向上し、いわゆる超親水性の表面となっていることがわかる。
【0091】
一方、図4で●で示したアセチレンによる第1のプラズマ照射のみを行った場合には、初期の接触角が120度であり、プラズマ照射を行っていないDLC膜よりも接触角が大きくなった。また、時間と共に接触角が低下し、最終的にはプラズマ照射を行っていないDLC膜よりも少し大きな値となった。これは、アセチレンによる第1のプラズマ照射により形成されたラジカルと大気中の酸素との反応は非常に遅く、また生成したラジカルのうち一部しか反応しないことを示している。
【0092】
また、第1のプラズマ照射をアセチレンに代えて酸素により行った場合の結果を▽で示した。第1のプラズマ照射に酸素プラズマを用いることにより、ラジカルの生成と酸素との反応が同時に進行し、DLC膜の表面が親水性となることが期待される。しかし、この場合には、一旦接触角が低下するが、時間の経過と共に接触角が上昇する傾向が認められた。このような挙動を示す原因は明らかではないが、1回目の酸素プラズマの照射の際には、DLC膜に形成されたラジカルと酸素との反応が十分生じていないのではないかと考えられる。
【0093】
以上のように、DLC膜に反応性の部位を形成する第1のプラズマ照射を行った後、酸素を含むプラズマによる第2のプラズマ照射を行うことにより、DLC膜を接触角が10度以下のいわゆる超親水性とすることができる。また、DLC膜であるため超親水性であるだけでなく耐久性も有しているため、医療用材料をはじめとして様々な分野において用いることができる。さらに、DLC膜に導入された官能基を用いることにより、DLC膜にポリマー等を固定し、超親水性以外の機能を付与することも可能である。
【0094】
図5(a)及び(b)はそれぞれ、アセチレンによる第1のプラズマ照射と酸素による第2のプラズマ照射を行いカルボキシル基を導入したDLC膜にNPVをグラフトした場合及びカルボキシル基の導入を行っていないDLC膜にNPVをグラフトした場合のXPSの測定結果を示している。図5(a)に示すように、カルボキシル基の導入を行った場合には、ポリビニルピロリドンのピロリドン環に由来するN1sのピークが認められた。また、第2のプラズマ照射後には約3度であった接触角が、ポリビニルピロリドンのグラフト後には57±3度まで上昇した。このことから、第2のプラズマ照射によりDLC膜に導入されたカルボキシル基によりポリビニルピロリドンがグラフトされたことが明らかである。
【0095】
一方、図5(b)に示すように、カルボキシル基の導入を行っていない場合には、N1sのピークは認められていない。このことから、カルボキシル基の活性化に用いたプラズマの照射条件によっては、DLC膜の炭素−炭素結合が開裂せず、グラフト重合が進行しないことがわかる。
【0096】
また、第2のプラズマ照射を行った後、10日間放置したDLC膜に対してポリビニルピロリドンのグラフトを行ったが、なんら問題なくグラフトを行うことができた。
【0097】
以上説明したように、DLC膜の炭素−炭素結合を開裂させラジカルを形成する第1のプラズマ照射と、第1のプラズマ照射により形成されたラジカルを酸素と反応させる第2のプラズマ照射とを行うことにより、DLC膜の表面を超親水性とすることが可能である。
【0098】
プラズマ照射を2回行うことにより、DLC膜の表面が超親水性となる理由は明確ではないが、1回目のプラズマ照射により形成された反応性部位が、2回目の酸素を含むプラズマの照射により効率良く反応してカルボキシル基等の親水性の官能基となるためであると考えられる。また、DLC膜に導入された親水性の官能基は安定であり、長期にわたり超親水性を維持することができる。また、導入された官能基は、容易に活性化することができ、ポリマーをグラフトすることができる。また、官能基をポリマーを結合する結合部位として用いることも可能であり、ポリマーの有する種々の機能をDLC膜に容易に付与することができる。
【0099】
超親水性又は機能性を付与したDLC膜は、種々の用途に用いることができる。例えば、耐久性及び生体適合性が要求される、ステント、カテーテル、バルーンカテーテル、ガイドワイヤ、ペースメーカーリード、体内留置用器材、注射針、メス、真空採血管、輸液バッグ、プレフィルドシリンジ及び傷口保持部品等の医療用器具又は医療用器具の材料として用いることができる。
【産業上の利用可能性】
【0100】
本発明に係る超親水性材料、医療用材料及び医療用器具は、DLC膜の親水性を向上させると共に、生体適合性等の機能の付与を効率良く行うことが可能であり、ダイヤモンド様薄膜の修飾方法として有用であると共に、超親水性材料、医療用材料、医療用器具とその製造方法等として有用である。
【符号の説明】
【0101】
1 ターゲット
2 直流アーク放電プラズマ発生器
11 ターゲット
21 チャンバー
22 真空ポンプ
23 電極
24 電極
25 高周波電源
26 マッチングネットワーク
【特許請求の範囲】
【請求項1】
基材と、
前記基材の表面に形成され且つ親水性の官能基を有するDLC膜とを備え、
前記基材と前記DLC膜との間には、前記基材と前記DLC膜との密着性を向上させる中間層が設けられ、
前記DLC膜の表面における水の接触角は10度以下であり、
前記DLC膜の厚さは0.01μm以上、3μm以下であり、
前記中間層の厚さは0.01μm以上、0.3μm以下であることを特徴とする超親水性材料。
【請求項2】
前記親水性の官能基は、少なくともカルボキシル基を含むことを特徴とする請求項1に記載の超親水性材料。
【請求項3】
前記基材は、金属材料、セラミックス材料若しくは高分子材料又はこれらの複合体であることを特徴とする請求項1又は2に記載の超親水性材料。
【請求項4】
前記中間層は、珪素及び炭素を主成分とするアモルファス膜であることを特徴とする請求項1から3のいずれか1項に記載の超親水性材料。
【請求項5】
請求項1〜4のいずれか1項に記載の超親水性材料を用いた医療用材料。
【請求項6】
請求項5に記載の医療用材料を用いた医療用器具。
【請求項7】
前記医療用器具は、人体組織と直接的に接触することを特徴とする請求項6に記載の医療用器具。
【請求項8】
前記医療用器具は、ステント、カテーテル、バルーンカテーテル、ガイドワイヤ、ペースメーカーリード、体内留置用器材、注射針、メス、真空採血管、輸液バッグ、プレフィルドシリンジ及び傷口保持部品のいずれか1つであることを特徴とする請求項6又は7に記載の医療用器具。
【請求項1】
基材と、
前記基材の表面に形成され且つ親水性の官能基を有するDLC膜とを備え、
前記基材と前記DLC膜との間には、前記基材と前記DLC膜との密着性を向上させる中間層が設けられ、
前記DLC膜の表面における水の接触角は10度以下であり、
前記DLC膜の厚さは0.01μm以上、3μm以下であり、
前記中間層の厚さは0.01μm以上、0.3μm以下であることを特徴とする超親水性材料。
【請求項2】
前記親水性の官能基は、少なくともカルボキシル基を含むことを特徴とする請求項1に記載の超親水性材料。
【請求項3】
前記基材は、金属材料、セラミックス材料若しくは高分子材料又はこれらの複合体であることを特徴とする請求項1又は2に記載の超親水性材料。
【請求項4】
前記中間層は、珪素及び炭素を主成分とするアモルファス膜であることを特徴とする請求項1から3のいずれか1項に記載の超親水性材料。
【請求項5】
請求項1〜4のいずれか1項に記載の超親水性材料を用いた医療用材料。
【請求項6】
請求項5に記載の医療用材料を用いた医療用器具。
【請求項7】
前記医療用器具は、人体組織と直接的に接触することを特徴とする請求項6に記載の医療用器具。
【請求項8】
前記医療用器具は、ステント、カテーテル、バルーンカテーテル、ガイドワイヤ、ペースメーカーリード、体内留置用器材、注射針、メス、真空採血管、輸液バッグ、プレフィルドシリンジ及び傷口保持部品のいずれか1つであることを特徴とする請求項6又は7に記載の医療用器具。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−10007(P2013−10007A)
【公開日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願番号】特願2012−220866(P2012−220866)
【出願日】平成24年10月3日(2012.10.3)
【分割の表示】特願2007−70884(P2007−70884)の分割
【原出願日】平成19年3月19日(2007.3.19)
【出願人】(391003668)トーヨーエイテック株式会社 (145)
【Fターム(参考)】
【公開日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願日】平成24年10月3日(2012.10.3)
【分割の表示】特願2007−70884(P2007−70884)の分割
【原出願日】平成19年3月19日(2007.3.19)
【出願人】(391003668)トーヨーエイテック株式会社 (145)
【Fターム(参考)】
[ Back to top ]

