足場材料
【課題】 ES細胞やAS細胞、iPS細胞等の多分化能を有する未分化細胞を未分化の状態で培養するための、合成高分子を用いた足場材料を提供する。
【解決手段】 未分化細胞を未分化の状態で培養するための足場材料であって、ハイドロゲルからなり、ES細胞や成体幹細胞、iPS細胞等の未分化細胞を未分化の状態で培養することができる材料である。本発明によれば、ウイルス感染や異種細胞との接触等の問題を生ずることなく、未分化細胞に酸素と栄養を十分かつ効率的に補給することができ、ハイドロゲル上で未分化細胞を未分化の状態で培養することができる。
【解決手段】 未分化細胞を未分化の状態で培養するための足場材料であって、ハイドロゲルからなり、ES細胞や成体幹細胞、iPS細胞等の未分化細胞を未分化の状態で培養することができる材料である。本発明によれば、ウイルス感染や異種細胞との接触等の問題を生ずることなく、未分化細胞に酸素と栄養を十分かつ効率的に補給することができ、ハイドロゲル上で未分化細胞を未分化の状態で培養することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、胚性幹細胞や成体幹細胞、ヒト人工多能性幹細胞等の多分化能を有する未分化細胞を未分化の状態で培養するための足場材料に関する。
【背景技術】
【0002】
近年、胚性幹細胞(Embryonic Stem cell;ES細胞)や成体幹細胞(Adult Stem cell;AS細胞)、人工多能性幹細胞(Induced Pluripotent Stem cell;iPS細胞)等の未分化細胞を分離する技術、生物組織細胞への分化誘導に関する技術、生物組織や組織再生用足場をラピッド・プロトタイピングするためのバイオプリンティング技術、或いはより複雑な細胞を再生するための生体材料足場材料等の開発により、未分化細胞から生物組織を作製することが可能となっている。これら未分化細胞は分化万能性や多能性等の多分化能を有する細胞であるため、特にヒト未分化細胞の再生医療分野や組織工学分野への応用がさらに期待されており、一部では臨床試験や早期商業化がなされている。
【0003】
そこで、近年では、未分化細胞から組織細胞への分化を制御する研究が盛んに行われている。例えば、マウスES細胞は、白血病抑制因子(Leukemia Inhibitory Factor;LIF)存在下、マウス胎児線維芽細胞(Mouse Embryonic Fibroblast;MEF)等のフィーダ細胞上で共培養することにより、未分化性を維持することができることが確認されている(非特許文献1)。また、ヒトES細胞については、例えば、bFGF (Basic Fibroblast Growth Factor)とヘパリンとの存在下、未分化性を維持することができることが確認されている(非特許文献2)。
【0004】
しかしながら、ヒトES細胞やヒトAS細胞、ヒトiPS細胞等は自発的に分化しやすい細胞であり、多分化能の状態を保ったままの継代が難しいため、これら未分化細胞を再生医療分野や組織工学分野で用いるためには、未分化の状態で大量に培養する技術が必要であるが、これを行うことのできる最適な培養法は未だ確立されていない。
【0005】
一方、本発明者等は、独自に開発したハイドロゲルを応用して、様々な再生医療材料や組織工学材料の創作を行っている。例えば、特開2006−42795号公報には、p−スチレンスルホン酸ナトリウム(NaSS)や2−アクリルアミド−2−メチルプロパンスルホン酸ナトリウム(NaAMPS)をモノマー単位とする合成高分子を含有する細胞培養用基材が開示されており(特許文献1)、特開2007−307300号公報には、ポリ(p−スチレンスルホン酸ナトリウム)(PNaSS)ゲルまたはポリ(2−アクリルアミド−2−メチル−1−プロパンスルホン酸ナトリウム)(PNaAMPS)ゲルである人工血管用材料が開示されている(特許文献2)。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2006−42795号公報
【特許文献2】特開2007−307300号公報
【非特許文献】
【0007】
【非特許文献1】Smith A.G. et al., Nature 336: 688-90(1988)
【非特許文献2】Miho K. et al., Proc. Natl. Acad. Sci. USA 105(36), 13409-13414(2008)
【発明の概要】
【発明が解決しようとする課題】
【0008】
特許文献1および特許文献2に開示された細胞培養用基材や人工血管材料に基づいては、未分化細胞を未分化の状態で培養することができる足場材料を確立することはできず、最適な培養法が求められている。
【0009】
本発明は、前記問題点を解決するためになされたものであって、ES細胞やAS細胞、iPS細胞等の多分化能を有する未分化細胞を未分化の状態で培養するための、合成高分子を用いた足場材料を提供することを目的としている。
【課題を解決するための手段】
【0010】
本発明に係る足場材料は、未分化細胞を未分化の状態で培養するための足場材料であって、ハイドロゲルからなる。
【0011】
また、本発明の好適な態様は、前記ハイドロゲルが、2−アクリルアミド−2−メチルプロパンスルホン酸(AMPS)、p−スチレンスルホン酸(SS)またはそのスルホン酸基に金属もしくは塩基が付加された塩をモノマー単位として含むハイドロゲル、N,N−ジメチルアクリルアミド(DMAAm)をモノマー単位として含むハイドロゲル、ビニルアルコール(VA)をモノマー単位として含むハイドロゲルまたは2種以上の前記モノマー単位を含むハイドロゲルよりなる群から選ばれるハイドロゲルである、前記足場材料である。
【発明の効果】
【0012】
本発明によれば、ウイルス感染や異種細胞との接触等の問題を生ずることなく、未分化細胞に酸素と栄養を十分かつ効率的に補給することができ、ハイドロゲル上で未分化細胞を未分化の状態で培養することができる。
【図面の簡単な説明】
【0013】
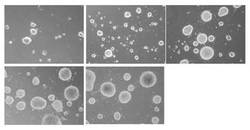
【図1】架橋密度が0.5mol%PNaAMPSディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養24時間、48時間、72時間、左下から右へ順に培養96時間、120時間)を示す写真図である。
【図2】架橋密度が2mol%PNaAMPSディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図3】架橋密度が15mol%PNaAMPSディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図4】架橋密度が4mol%であってFa値が0.1のP(NaAMPS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図5】架橋密度が4mol%であってFa値が0.3のP(NaAMPS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図6】架橋密度が4mol%であってFa値が0.6のP(NaAMPS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図7】架橋密度が4mol%であってFa値が0.8のP(NaAMPS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図8】架橋密度が2mol%PNaSSディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養24時間、48時間、72時間、左下から右へ順に培養96時間、120時間)を示す写真図である。
【図9】架橋密度が4mol%PNaSSディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図10】架橋密度が15mol%PNaSSディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図11】架橋密度が1mol%PDMAAmディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、左下から右へ順に培養96時間、120時間)を示す写真図である。
【図12】架橋密度が2mol%PDMAAmディスクにおけるマウスES細胞コロニーの形態(左から右へ順に培養72時間、120時間)を示す写真図である。
【図13】架橋密度が4mol%であってFb値が0.05のP(NaSS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図14】架橋密度が4mol%であってFb値が0.1のP(NaSS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図15】架橋密度が4mol%であってFb値が0.2のP(NaSS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図16】架橋密度が4mol%であってFb値が0.5のP(NaSS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図17】各ディスクの弾性率および膨潤度を示した図である。
【図18】PNaAMPSディスクにおける架橋密度と96時間培養後のES細胞コロニーの数との関係を示した図である。
【図19】5wt%PVAディスクにおけるマウスES細胞の形態(培養120時間)を示す写真図である。
【図20】10wt%PVAディスクにおけるマウスES細胞の形態(培養120時間)を示す写真図である。
【図21】比較例であるPSディスクにおけるマウスES細胞の形態(培養24時間)を示す写真図である。
【図22】比較例であるPSディスクにおけるマウスES細胞の形態(培養48時間)を示す写真図である。
【図23】比較例であるPSディスクにおけるマウスES細胞の形態(培養72時間)を示す写真図である。
【図24】比較例であるPSディスクにおけるマウスES細胞の形態(培養96時間)を示す写真図である。
【図25】比較例であるPSディスクにおけるマウスES細胞の形態(培養120時間)を示す写真図である。
【図26】架橋密度が0.5mol%PNaAMPSディスクにおけるマウスES細胞をALP染色した状態(培養120時間)を示す写真図である。
【図27】架橋密度が4mol%PNaAMPSディスクにおけるマウスES細胞をALP染色した状態(培養120時間)を示す写真図である。
【図28】架橋密度が10mol%PNaAMPSディスクにおけるマウスES細胞をALP染色した状態(培養120時間)を示す写真図である。
【図29】架橋密度が15mol%PNaAMPSディスクにおけるマウスES細胞をALP染色した状態(培養120時間)を示す写真図である。
【図30】架橋密度が4mol%であってFa値が0.5のP(NaAMPS−DMAAm)ディスクにおけるマウスES細胞をALP染色した状態を示す写真図である。
【図31】架橋密度が4mol%であってFa値が0.6のP(NaAMPS−DMAAm)ディスクにおけるマウスES細胞をALP染色した状態を示す写真図である。
【図32】架橋密度が4mol%であってFa値が0.8のP(NaAMPS−DMAAm)ディスクにおけるマウスES細胞をALP染色した状態を示す写真図である。
【図33】架橋密度が4mol%であってFb値が0.2のP(NaSS−DMAAm)ディスクにおけるマウスES細胞をALP染色した状態を示す写真図である。
【図34】架橋密度が4mol%であってFb値が0.5のP(NaSS−DMAAm)ディスクにおけるマウスES細胞をALP染色した状態を示す写真図である。
【図35】比較例であるPSディスクにおけるマウスES細胞をALP染色した状態を示す写真図である。
【図36】各ディスク上のマウスES細胞コロニーのうちALP陽性を呈したコロニーの割合を示す図である。
【図37】各ディスク上のマウスES細胞の未分化マーカー遺伝子の発現量を示す図である。
【図38】各ディスク上のマウスES細胞の外胚葉系分化マーカー遺伝子の発現量を示す図である。
【図39】各ディスク上のマウスES細胞の内胚葉系分化マーカー遺伝子の発現量を示す図である。
【図40】各ディスク上のマウスES細胞の中胚葉系分化マーカー遺伝子の発現量を示す図である。
【図41】各ディスク上のマウスES細胞の表面に結合した抗SSEA−1抗体の平均蛍光値を示すグラフである。図中、黒いバーはLIFを含む培地で培養したES細胞における平均蛍光値を、斜線のバーはLIFを含まない培地で培養したES細胞における平均蛍光値をそれぞれ示す。
【発明を実施するための形態】
【0014】
以下、本発明に係る足場材料について詳細に説明する。本発明に係る足場材料は、ハイドロゲルからなり、ES細胞や成体幹細胞、iPS細胞等の未分化細胞を未分化の状態で培養することができる材料である。
【0015】
本発明における「未分化細胞」とは、動物由来の分化万能性や多能性等の多分化能を有する細胞を意味する。分化万能性を有する未分化細胞としては、例えば、ES細胞やiPS細胞を挙げることができ、多能性を有する細胞としては、例えば、AS細胞を挙げることができる。また、動物由来であれば特に限定されないが、哺乳類由来が好ましく、霊長目由来がより好ましく、ヒト由来がさらに好ましい。ここで、「未分化の状態」とは、視覚的には未分化細胞のコロニーが存在する状態をいうが、例えば、後述するアルカリフォスファターゼ(ALP)染色反応を呈する状態や未分化細胞特有の遺伝子または抗原を発現する状態をいう。すなわち、未分化の状態であるか否かの判断は、当業者が通常選択可能な手法によりすることができる。
【0016】
また、本発明において「足場材料」は、「足場基材」、「スキャフォールド」、「スカフォールド」、「培養(用)基板」、「培養(用)基材」、「培養(用)担体」、或いは「固定(用)装置」と交換可能に用いられる。
【0017】
本発明における重合体は、高分子が化学結合によって網目状構造をとり、網目に多量の水を保有しているという特徴を有する、いわゆるハイドロゲルであればよいが、好ましくは、2−アクリルアミド−2−メチルプロパンスルホン酸(AMPS)、p−スチレンスルホン酸(SS)またはそのスルホン酸基に金属もしくは塩基が付加された塩をモノマー単位として含むハイドロゲル、N,N−ジメチルアクリルアミド(DMAAm)をモノマー単位として含むハイドロゲル、ビニルアルコールをモノマー単位として含むハイドロゲルまたは2種以上の前記モノマー単位を含むハイドロゲルよりなる群から選ばれるハイドロゲルである。
【0018】
本発明において好ましいハイドロゲルの一つは、2−アクリルアミド−2−メチルプロパンスルホン酸(AMPS)またはそのスルホン酸基に金属もしくは塩基が付加された塩をモノマー単位として含むハイドロゲルである。このようなゲルとしては、例えば、ポリ(2−アクリルアミド−2−メチルプロパンスルホン酸)(PAMPS)ゲルや、ポリ(2−アクリルアミド−2−メチルプロパンスルホン酸アルカリ金属塩)ゲル、これらハイドロゲルが第1のポリマーであってその架橋網目構造に第2のポリマーが侵入した構造を有するハイドロゲル等を挙げることができるが、2−アクリルアミド−2−メチルプロパンスルホン酸ナトリウム(NaAMPS)をモノマー単位として含んでいることが好ましく、ポリ(2−アクリルアミド−2−メチルプロパンスルホン酸ナトリウム)(PNaAMPS)ゲルがより好ましい。
【0019】
ここで、NaAMPSは以下の構造式I(化1)で示すことができる、マイナス電荷を有するモノマーであり、PNaAMPSは以下の構造式II(化2)で示すことができる、マイナス電荷を有するポリマーである。
【化1】

【化2】

【0020】
本発明において好ましいハイドロゲルのもう一つは、p−スチレンスルホン酸(SS)またはそのスルホン酸基に金属もしくは塩基が付加された塩をモノマー単位として含むハイドロゲルである。このようなゲルとしては、例えば、ポリ(p−スチレンスルホン酸)(PSS)ゲルや、ポリ(p−スチレンスルホン酸アルカリ金属塩)ゲル、これらハイドロゲルが第1のポリマーであってその架橋網目構造に第2のポリマーが侵入した構造を有するハイドロゲル等を挙げることができるが、p−スチレンスルホン酸ナトリウム(NaSS)をモノマー単位として含んでいることが好ましく、ポリ(p−スチレンスルホン酸ナトリウム)(PNaSS)ゲルがより好ましい。
【0021】
ここで、NaSSは、以下の構造式III(化3)で示すことができる、マイナス電荷を有するモノマーであり、PNaSSは以下の構造式IV(化4)で示すことができる、マイナス電荷を有するポリマーである。
【化3】

【化4】

【0022】
本発明において好ましいハイドロゲルの別の一つは、N,N−ジメチルアクリルアミド(DMAAm)をモノマー単位として含むハイドロゲルである。このようなゲルとしては、例えば、ポリ(N,N−ジメチルアクリルアミド)(PDMAAm)ゲルやPDMAAmが第1のポリマーであってその架橋網目構造に第2のポリマーが侵入した構造を有するハイドロゲル等を挙げることができるが、PDMAAmが好ましい。
【0023】
ここで、DMAAmは以下の構造式V(化5)で示すことができる、中性モノマーであり、PDMAAmは以下の構造式VI(化6)で示すことができる、中性ポリマーである。
【化5】

【化6】

【0024】
PNaAMPSゲル、PNaSSおよびPDMAAmは、周知或いは公知の方法によって調製することができるが、例えば、Chen Y.M.等の方法(Chen Y. M., Shiraishi N., Satokawa H., Kakugo K., Narita T., Gong J. P., Osada Y., Yamamoto K., Ando J., Biomaterials 26:4588-4596(2005)) に従い、それぞれのモノマー溶液であるNaAMPS溶液、NaSS溶液またはDMAAm溶液に適当なUV開始剤と架橋剤とを加え、ラジカル重合させることによって調製することができる。これらUV開始剤および架橋剤は、PNaAMPSゲルが調製できれば特に限定されないが、例えば、UV開始剤として2−Oxoglutaricacidを利用することができ、また、架橋剤としてN,N−methylenebis−acrylamide (MBAA)を利用することができる。また、ラジカル重合反応の条件は適宜選択することができ、例えば、前記Chen Y.M.等の方法における反応条件に従うことができる。具体的には、反応温度を20℃〜30℃、反応時間を6〜10時間、前記UV開始剤の添加量を0.1mol%、架橋剤の添加量を2mol%〜10mol%の各範囲から適宜選択することができる。なお、ラジカル重合反応を行うに際し、不活性化ガスを用いたバブリング等によってNaAMPS溶液、NaSS溶液またはDMAAm溶液の溶存酸素を不活性化ガスに置換することが好ましい。
【0025】
本発明において好ましいハイドロゲルのもう一つは、ビニルアルコール(CH2CH−OH;VA)をモノマー単位として含むハイドロゲルであり、より好ましくはポリビニルアルコール(PVA)である。PVAは、酢酸ビニルを重合して得たポリ酢酸ビニルを加水分解(けん化)する方法その他の周知或いは公知の方法によって調製することができる。
【0026】
また、本発明のハイドロゲルは、前記2種以上のモノマー単位を含むハイドロゲルであってもよい。このようなゲルとしては、例えば、PAMPS、ポリ(2−アクリルアミド−2−メチルプロパンスルホン酸アルカリ金属塩)、PSSまたはポリ(p−スチレンスルホン酸アルカリ金属塩)が第1のポリマーであってその架橋網目構造に第2のポリマーであるPDMAAmが侵入した構造を有するハイドロゲル等を挙げることができる。なお、このようなハイドロゲルは、例えば、本発明者等による発明に係る特願2006−350526に記載されており、この内容は本明細書に包含される。
【0027】
本発明に係る足場材料は、調製するハイドロゲルの形態を平板状または円盤状の薄膜とすることが好ましく、例えば、適当な間隔を空けた2枚のガラス板の間にモノマー溶液を充填してラジカル重合を行わせる等の方法によって、平板状または円盤状の薄膜に調製することができる。また薄膜の厚みは適宜決定することができるが、0.1mm〜10mmとするのが好ましく、0.2mm〜5mmとするのがより好ましく、0.5mm〜3mmとするのがさらに好ましい。
【0028】
前述のように調製したハイドロゲルは、そのままヒトES細胞やヒトAS細胞、iPS細胞等の未分化細胞の培養に供することができるが、未分化細胞の培養に適当な緩衝液中または細胞培養液中でハイドロゲルを膨潤させ、ゲル中の溶媒を交換することが好ましい。好適な緩衝液としては、実施例で使用される4−(−2−hydroxyethyl)−piperazine−1−ethansulfonicacid(HEPES)緩衝液やウシ胎児血清(FBS)、ゼラチン水溶液の他、PBS等を挙げることができる。また、好適な細胞培養液の種類及び組成は、未分化細胞の種類に応じて適宜選択することができる。
【0029】
また、個々の成分の正確な組成に従った既知組成培地を使用してもよく、そのような培地として、例えば、MEM(Eagle’s Minimum Essential Medium)、DMEM(Dulbecco’s Modified Eagle’s Medium)、IMDM (Iscove’s Modified Dulbecco’s Medium)、RPMI1640 、AIM−V、ADC、LPM、Ham’s F10、Ham’sF12、DCCM1、DCCM2、BGJ、BME(Basal Medium Eagle)、GMEM(Glasgow’s Modified Eagle’s Medium)、L−15(Leibovitz−15)、McCoy5A、M199、Fisher、Schneider等を挙げることができる。さらに、必要に応じて、公知の構成の培地成分や、アール平衡塩溶液、ハンクス平衡塩溶液、ダルベッコPBS、スピナー塩溶液等の公知の平衡塩類組成成分、種々の細胞増殖因子、抗生物質、ビタミン類、ホルモン類、pH調整剤、血清、その他生物由来成分等を加えることができる。
【0030】
なお、未分化細胞の培養に際し、UV滅菌やオートクレーブ滅菌等によりハイドロゲルを滅菌しておくことが好ましい。
【0031】
前述のように調製したハイドロゲル上での未分化細胞の培養は、適当な容器に置いたハイドロゲルに適当な個数の未分化細胞を含む細胞懸濁液を加えることで行うことができる。例えば、ハイドロゲル単位面積(cm2)当たり1×104〜1×106個の未分化細胞を播種し、標準的な未分化細胞の培養条件下にハイドロゲルを置くことで行うことができる。例えば、培養条件は、20℃ 〜 40℃の培養温度、1% 〜10%のCO2雰囲気、24時間〜168時間の培養時間から適宜選択することができる。
【0032】
本発明においては、未分化の状態であるか否かの判断を、細胞の形態観察やアルカリフォスファターゼ(ALP)染色法によって行っている。細胞の形態観察は、培養ディスク上の細胞の形態を適当な倍率の顕微鏡を用いて観察し、コロニーの崩れや分化した細胞の存在を確認するものである。また、ALP染色法は、培養ディスク上の細胞に基質としてリン酸エステル塩とジアゾニウム塩を含む反応溶液を添加することにより、細胞膜状に存在するアルカリフォスファターゼによってリン酸エステル塩が加水分解され、さらにジアゾニウム塩とカップリング反応することによりアゾ色素が生じ、ALP活性部位に色素が沈殿する。こうして染色されたコロニー数を計測することにより、細胞のALP活性を定量化することが可能となり、これにより細胞の未分化度合いを定量することができる。
【0033】
ALP染色は、適宜ALP染色液を調製して行ってもよく、市販のキットを用いて行ってもよい。このような市販のキットとしては、Leukocyte Alkaline Phosphatase Kit(Sigma社)、New Fuchsin Substrate System(DAKO社)、StemTAG Alkaline Phosphatase Staining Kit(Cell Biolabs社)、Alkaline Phosphatase Detection Kit from Millipore(CHEMICON社)等を挙げることができる。
【0034】
また、未分化の状態であるか否かの判断は、RT−PCR(Reverse Transcription Polymerase Chain Reaction)法を用いて未分化マーカー遺伝子を含む細胞分化マーカー遺伝子の発現量を定量することにより行ってもよい。
【0035】
RT−PCRは、通常の実験書の記載に従って行うことができ、そのような実験書として、例えば、Sambrookら(Molecular Cloning、A laboratory manual、2001年版、Cold Spring Harbor Laboratory Press)を挙げることができる。
【0036】
また、RT−PCRはtotal RNAを抽出した後に行ってもよく、total RNAを抽出せずに行う、いわゆるリアルタイムRT−PCRを行ってもよい。前者の場合、RNAの抽出には、例えば、RNeasy Mini Kit(Qiagen社)、QIAamp RNA kit(Qiagen社)、Concert Plant RNA Regent(Invitrogen社)、QuickPrep Total RNA Extraction Kit(GEヘルスケア社)等を用いることができ、RT−PCR法には、例えば、Expand High FidelityPLUS PCR System (Roche社)、Pyrobest (タカラバイオ社)、ThermoScript RT−PCR System 、PLATIUM taq DNA Polymerase High fidelity(いずれもGibco社)、ABI Prism 7000、同7900(いずれもABI社)、Superscript III First Strand Synthesis System(Invitrogen社)等を用いることができる。一方、後者の場合、例えば、Smart Cycler System II(Cepheid社)、TaqMan Gene Expression Cells−to−CT Kit(ABI社)、CellAmp Direct RNA Prep Kit for One Step RT−PCR(タカラバイオ社)、MasterAmp Real−Time RT−PCR System(Molecular Probes社)等を用いることができる。
【0037】
さらに、未分化の状態であるか否かの判断は、胚性幹細胞の未分化マーカーSSEA−1抗原の発現を、抗SSEA−1抗体(Thomsonら、Science,282(114),1998)染色とフローサイトメトリー(Flow cytometry;FCM)とを用いて確認することにより行ってもよい。
【0038】
なお、フローサイトメトリーはフローサイトメーターやフローサイトメトリーシステムを用いて行うことができ、例えば、Becton Dickinson社やBeckman Coulter社等の各種フローサイトメーターやフローサイトメトリーシステムを挙げることができる。
【0039】
以下、本発明に係る足場材料について、実施例に基づいて説明する。なお、本発明の技術的範囲は、これらの実施例によって示される特徴に限定されない。
【実施例】
【0040】
<実施例1>
(1)PNaAMPSゲルの調製
2−アクリルアミド−2−メチル−1−プロパンスルホン酸ナトリウム(NaAMPS)、UV開始剤である0.1mol%の2−Oxoglutaric acidおよび架橋剤である4mol%のN,N−methylenebisacrylamide(MBAA)を含む水溶液20mLを調製し、窒素バブリングによって溶存酸素を窒素置換した。PNaAMPSのモノマー濃度(架橋密度)は、0.5mol%、1mol%、2mol%、4mol%、10mol%および15mol%の6種類を用意した。
【0041】
窒素置換後の各モノマー溶液を、10×10mm四方の2枚のガラス基板で1.5mmのシリコンスペーサーを挟むことにより形成された鋳型に流し込んだ後、室温で6時間重合させて、架橋密度がそれぞれ0.5mol%、1mol%、2mol%、4mol%ル、10mol%および15mol%であるポリ(2−アクリルアミド−2−メチル−1−プロパンスルホン酸ナトリウム)(PNaAMPS)ゲルを得た。
【0042】
ガラス基板から各ハイドロゲルを取り出し、1Lの蒸留水を一日ごと交換することにより一週間膨潤させた後、ハイドロゲルを15.5mMのNaHCO3、140mMのNaClを含む5mMの4−(−2−hydroxyethyl)−piperazine−1−ethansulfonicacid(HEPES)緩衝液(pH7.4)に一週間浸漬することにより、ハイドロゲルの溶媒交換を行った。
【0043】
(2)P(NaAMPS−DMAAm)ゲルの調製
Fa(モル比)=[NaAMPSモノマー濃度(架橋密度)]/[N,N−ジメチルアクリルアミド(DMAAm)モノマー濃度(架橋密度)+NaAMPSモノマー濃度(架橋密度)]と定義し、このFa値がそれぞれ0.1、0.2、0.3、0.5、0.6および0.8であって、かつ架橋密度がいずれも4mol%のポリ{(2−アクリルアミド−2−メチル−1−プロパンスルホン酸ナトリウム)−(N,N−ジメチルアクリルアミド)}{P(NaAMPS−DMAAm)}ゲルを調製した。
【0044】
具体的には、1mol/LのNaAMPS、NaAMPSに対し4mol%のMBAAおよびNaAMPSに対し0.1mol%のα−ケトグルタル酸を含む水溶液にUV(波長365nm)を6時間当て、架橋度4mol%のPNaAMPSを得た。
【0045】
Fa値に応じた1mol/LのNaAMPSとDMAAmのモノマー混合溶液、NaAMPSとDMAAmモノマー混合溶液に対し4mol%のMBAAおよびNaAMPSとDMAAmモノマー混合溶液に対し0.1mol%のα−ケトグルタル酸を含む水溶液を調製し、窒素バブリングによって溶存酸素を窒素置換した後、10×10mm四方の2枚のガラス基板で1.5mmのシリコンスペーサーを挟むことにより形成された鋳型に流し込み、封をした後、UV(波長365nm)を6時間当て、Fa値がそれぞれ0.1、0.2、0.3、0.5、0.6および0.8であって、かつ架橋密度がいずれも4mol%のP(NaAMPS−DMAAm)ゲルを得た。得られたP(NaAMPS−DMAAm)ゲルの溶媒交換は本実施例(1)と同様にして行った。
【0046】
(3)ハイドロゲルディスクの調製
溶媒交換した本実施例(1)および(2)の各ハイドロゲルをシャーレに移し、121℃ 、20分オートクレーブ滅菌後、各ハイドロゲルから直径15mm、厚さ1〜3mmのハイドロゲルディスク{架橋密度がそれぞれ0.5mol%PNaAMPSディスク、1mol%PNaAMPSディスク、2mol%PNaAMPSディスク、4mol%PNaAMPSディスク、10mol%PNaAMPSディスクおよび15mol%PNaAMPSディスク、ならびに架橋密度がいずれも4mol%であってFa値がそれぞれ0.1のP(NaAMPS−DMAAm)ディスク、0.2のP(NaAMPS−DMAAm)ディスク、0.3のP(NaAMPS−DMAAm)ディスク、0.5のP(NaAMPS−DMAAm)ディスク、0.6のP(NaAMPS−DMAAm)ディスクおよび0.8のP(NaAMPS−DMAAm)ディスク}を調製した。
【0047】
(4)マウスES細胞のハイドロゲルディスク上での培養
本実施例(3)で調製したディスクを24穴ポリスチレン(PS)ディッシュにそれぞれ置き、その上から未分化細胞培養液として20%ウシ胎児血清(fetal bovine serum;FBS)を含むDMEM(IBL)0.5mL/ウェル加え、24時間後にこの溶液を取り除いた後、1.25×104cells/mLのMGZ5マウス胚幹細胞(以下、「マウスES細胞」という。)懸濁液(20%FBSを含むDMEM)1mL/ウェル加えた。この24穴PSディッシュを37℃ 、5%CO2雰囲気のインキュベータ内に置き、マウスES細胞を培養した。
【0048】
<実施例2>
(1)PNaSSゲルディスクの調製
架橋密度がそれぞれ2mol%、4mol%、10mol%および15mol%のポリ(p−スチレンスルホン酸ナトリウム)(PNaSS)ゲルからなる直径15mm、厚さ1〜3mmのディスクを、実施例1(1)および(3)に記載の方法に従って調製した。
【0049】
(2)P(NaSS−DMAAm)ゲルディスクの調製
Fb(モル比)=[p−スチレンスルホン酸ナトリウム(NaSS)モノマー濃度(架橋密度)]/[DMAAmモノマー濃度(架橋密度)+NaSSモノマー濃度(架橋密度)]と定義し、このFb値がそれぞれ0.05、0.1、0.2および0.5であって、かつ架橋密度がいずれも4mol%のポリ{(p−スチレンスルホン酸ナトリウム)−(N’,N−ジメチルアクリルアミド)}{P(NaSS−DMAAm)}ゲルからなる直径15mm、厚さ1〜3mmのハイドロゲルディスク{架橋密度がいずれも4mol%であってFb値がそれぞれ0.05のP(NaSS−DMAAm)ディスク、0.1のP(NaSS−DMAAm)ディスク、0.2のP(NaSS−DMAAm)ディスクおよび0.5のP(NaSS−DMAAm)ディスク}を、実施例1(2)および(3)に記載の方法に従って調製した。
【0050】
(3)マウスES細胞のハイドロゲルディスク上での培養
本比較例(1)および(2)で調製したそれぞれのPNaSSディスクおよびP(NaSS−DMAAm)ディスクを、実施例1(3)と同様にオートクレーブ滅菌し、実施例1(4)に記載の条件の下、24穴PSディッシュ内にそれぞれ置いてマウスES細胞の培養を行った。
【0051】
<実施例3>
(1)PDMAAmゲルディスクの調製
架橋密度がそれぞれ1mol%および2mol%のポリ(N,N−ジメチルアクリルアミド)(PDMAAm)ゲルからなる直径15mm、厚さ1〜3mmのディスクを、実施例1(1)および(3)に記載の方法に従って調製した。
【0052】
(2)マウスES細胞のハイドロゲルディスク上での培養
本実施例(1)で調製したそれぞれのPDMAAmディスクを、実施例1(3)と同様にオートクレーブ滅菌し、実施例1(4)に記載の条件の下、24穴PSディッシュ内にそれぞれ置いてマウスES細胞の培養を行った。
【0053】
<実施例4>
(1)PVAゲルディスクの調製
PVA粉末(重合度2,000、分子量約90,000)を5重量%と10重量%とになるようにジメチルスルホキシド(DMSO)と水の混合溶媒(DMSOと水との重量比3:1)に90℃で溶解したそれぞれの溶液を、実施例1の(2)と同様にしてガラスの型に流し込み、−40℃で16時間凍結した後に室温で解凍してゲルを形成させた。ガラス基板からそれぞれのゲルを取り出し、1Lの蒸留水を一日ごとに交換することによって一週間膨潤させた後、ゲルを15.5mMのNaHCO3および140mMのNaClを含む5mMの4−(−2−hydroxyethyl)−piperazine−1−ethansulfonicacid(HEPES)緩衝液(pH7.4)に一週間浸漬して溶媒交換を行い、5%PVAゲルディスクおよび10%PVAゲルディスクを調製した。
【0054】
(2)マウスES細胞のハイドロゲルディスク上での培養
本実施例(1)で調製したそれぞれのPVAゲルディスクを、75%のエタノール中に浸漬、UVランプを用いて一晩で滅菌し、実施例1(4)に記載の条件の下、24穴PSディッシュ内にそれぞれ置いてマウスES細胞の培養を行った。
【0055】
<比較例>
24穴PSディッシュの上から直接に0.1%ゼラチンを0.4mL/ウェル加え、37℃ 、5%CO2雰囲気のインキュベータ内に30分間置いてゼラチンコーティングすることによりPSディスクを調製し、実施例1(4)に記載の条件下でマウスES細胞の培養を行い、比較例とした。
【0056】
<試験例1> マウスES細胞コロニーの形態観察
実施例1〜4の各ハイドロゲルディスクおよび比較例として調製したPSディスクについて、ディスク上でのマウスES細胞コロニーの形態を、位相差顕微鏡を用いて時系列に観察し、下記(1)〜(6)の結果を得た。
【0057】
(1)PNaAMPSディスク上でのマウスES細胞コロニーの形態
架橋密度が0.5mol%PNaAMPSディスクにおいて、マウスES細胞コロニーは良好に成長し、120時間培養後には、はっきりした輪郭を持つコロニーが確認された(図1)。架橋密度が2mol%PNaAMPSディスク上では、48時間培養後には直径約10μmのマウスES細胞コロニーが形成され、168時間培養後には直径約15〜35μmにまで成長した。なお、架橋密度が2mol%PNaAMPSディスク上では、96時間培養後には分化した細胞が若干観察されたものの、その後も分化した細胞は少数観察されるにとどまった(図2)。また、架橋密度が15mol%PNaAMPSディスク上では、48時間培養後には直径約10μmのマウスES細胞コロニーが形成され、これが168時間培養後には直径約25〜55μmにまで成長したが、72時間培養後には分化した細胞が観察され、120時間培養後までにマウスES細胞コロニーの輪郭の崩れが確認され、さらに168時間培養後には、架橋密度が2mol%PNaAMPSディスク上のものと比較して、分化した細胞が多数観察された(図3)。
【0058】
(2)P(NaAMPS−DMAAm)ディスク上でのマウスES細胞コロニーの形態
架橋密度が4mol%であってFa値が0.1のP(NaAMPS−DMAAm)ディスクにおいて、マウスES細胞コロニーは良好に成長し、168時間培養後には直径約50μmにまで成長した。ただし、観察されたマウスES細胞コロニーの数は時間の経過とともに減少する傾向が認められた(図4)。また、架橋密度が4mol%であってFa値が0.3のP(NaAMPS−DMAAm)ディスク上でもマウスES細胞コロニーは良好に成長するが、120時間培養後にマウスES細胞コロニーの輪郭の崩れが確認されはじめ、168時間経過後にはマウスES細胞コロニーは観察されなくなった(図5)。架橋密度がいずれも4mol%であってFa値がそれぞれ0.6のP(NaAMPS−DMAAm)ディスクおよび0.8のP(NaAMPS−DMAAm)ディスクの場合においても、架橋密度が4mol%であってFa値が0.3のP(NaAMPS−DMAAm)ディスク上と同様の傾向を示した(図6および図7)。
【0059】
(3)PNaSSディスク上でのマウスES細胞コロニーの形態
架橋密度が2mol%PNaSSディスク上では、72時間培養後までマウスES細胞コロニーの輪郭の維持が確認された。その後、この輪郭の崩れが確認されたものの、120時間培養後でもマウス細胞コロニーを観察することができた(図8)。また、架橋密度が4mol%PNaSSディスク上では、48時間経過後には直径約10〜20μmのマウスES細胞コロニーが形成され、96時間経過後にはマウスES細胞コロニーが直径約25〜55μmにまで成長した。ただし、96時間培養によってコロニーの輪郭に若干の崩れが観察された(図9)。架橋密度が15mol%PNaSSディスクの場合においても、これと同様の傾向を示した(図10)。
【0060】
(4)PDMAAmディスク上でのマウスES細胞コロニーの形態
架橋密度がそれぞれ1mol%PDMAAmディスクおよび2mol%PDMAAmディスク上では、PDMAAmの架橋密度に関係なくマウスES細胞コロニーの成長が観察されるが、その成長速度は72時間培養後から遅くなりはじめ、120時間培養後にはほぼ成長が停止した(図11および図12)。
【0061】
(5)P(NaSS−DMAAm)ディスク上でのマウスES細胞コロニーの形態
架橋密度が4mol%であってFb値が0.05のP(NaSS−DMAAm)ディスクにおいて、マウスES細胞コロニーは培養時間に伴って成長し、168時間培養後には直径約50μmにまで成長した。ただし、観察されたマウスES細胞コロニーの数は、時間の経過とともに減少する傾向が認められた(図13)。架橋密度が4mol%であってFb値が0.1のP(NaSS−DMAAm)ディスクにおいてもこれと同様の傾向を示した(図14)。一方、架橋密度がいずれも4mol%であってFb値がそれぞれ0.2のP(NaSS−DMAAm)ディスクおよび0.5のP(NaSS−DMAAm)ディスク上では、マウスES細胞コロニーは培養時間に伴って成長するが、120時間培養後にコロニーの輪郭の崩れが確認された(図15および図16)。
【0062】
架橋密度がそれぞれ0.5mol%、2mol%、4mol%、10mol%および15mol%のPNaAMPSディスク、ならびに架橋密度がそれぞれ2mol%、4mol%、10mol%および15mol%のPNaSSディスクの弾性率および膨潤度を示した表を図17に、PNaAMPSディスクにおける架橋密度と96時間培養後のES細胞コロニーの数との関係を示したグラフを図18に示す
【0063】
(6)PVAディスク上でのマウスES細胞コロニーの形態
5wt%PVAゲルディスクおよび10wt%PVAゲルディスクでは、いずれも120時間培養までマウスES細胞コロニーの成長が観察された(図19および図20)。
【0064】
(7)PSディスク上でのマウスESコロニーの形態
比較例であるPSディスク上でのマウスES細胞コロニーの形態を、位相差顕微鏡を用いて時系列に観察した結果(写真)を図21〜図25に示す。24時間培養後にPSディスク上に伸展した細胞が観察された。これらの細胞は培養時間とともに増殖し、72時間培養後には大量の伸展した細胞と少量の小さい丸い細胞が観察された。さらに96時間培養後には、小さい丸い細胞が伸展した細胞の上に重なっているような状態が観察され、120時間培養後にこのような状態の細胞が大量に増加した。一方、前記ハイドロゲルを用いた場合の結果と異なり、PSディスク上では、培養過程中に細胞によるコロニー形成は確認できなかった。これらの結果は、PSディスク上で培養した細胞の多くが分化した細胞であると推察した。
【0065】
以上より、細胞形態の顕微鏡観察の結果によると、いずれのハイドロゲル上でも、マウスES細胞は未分化の状態でコロニーを形成し、増殖することが分かる。また、架橋密度が同じPNaAMPSディスクとPNaSSディスクとを比較した場合、PNaAMPSディスク上ではPNaSSディスク上よりもマウスES細胞コロニーが成長し、かつ分化した細胞が少数となることが分かる。また、P(NaAMPS−DMAAm)ディスクとPDMAAmディスクとを比較した場合、PDMAAmディスク上でのマウスES細胞コロニーの数は時間の経過とともに減少する傾向にあるが、P(NaAMPS−DMAAm)ディスクを用いた場合は、そのFa値により、PDMAAmディスクを用いた場合と比較して成長したマウスES細胞コロニーの数は減少せず、その形態が維持されることが分かる。さらに、架橋密度が異なるPNaAMPSディスクを互いに比較した場合、架橋密度すなわち弾性率の低いPNaAMPSディスク上では、弾性率の高いPNaAMPSディスク上よりも成長したマウスES細胞コロニーの数は多く、その形態が維持されることが分かる。
【0066】
<試験例2> マウスES細胞の未分化性確認試験(ALP染色)
(2)ALP染色
実施例1(3)で調製した架橋密度がそれぞれ0.5、4、10、15mol%のPNaAMPSディスクおよび架橋密度がいずれも4mol%であってFa値がそれぞれ0.5、0.6、0.8のP(NaAMPS−DMAAm)ディスク、実施例2(2)で調製した架橋密度がいずれも4mol%であってFb値がそれぞれ0.2、0.5のP(NaSS−DMAAm)ディスク、ならびに比較例で調製したPSディスクの各々のディスク上でマウスES細胞を120時間培養後、PBSで洗浄し、ウェル中の細胞をAlkaline Phosphatase Detection Kit from Millipore(CHEMICON社)のプロトコールに従ってALP染色した。その結果(写真)を図26〜35に示す。また、それぞれのディスク上のマウスES細胞コロニーのうちALP陽性を呈したコロニーの割合を示したグラフを図36に示す。
【0067】
以上より、架橋密度がそれぞれ0.5mol%PNaAMPSディスク、4mol%PNaAMPSディスク、10mol%PNaAMPSディスク、15mol%PNaAMPSディスク上で120時間培養したマウスES細胞において、その90%以上のコロニーがALP陽性を呈することが分かる。また、架橋密度が0.5mol%のPNaAMPSディスクおよび架橋密度が4mol%であってFa値が0.5のP(NaAMPS−DMAAm)ディスク上では、ALP陽性を呈するマウスES細胞コロニーの割合が最も高いことが分かる。
【0068】
<試験例3> RT−PCR法による細胞分化マーカー遺伝子発現の定量
実施例1(3)で調製した、架橋密度がそれぞれ0.5mol%PNaAMPSディスク、1mol%PNaAMPSディスク、2mol%PNaAMPSディスク、4mol%PNaAMPSディスク、10mol%PNaAMPSディスクおよび15mol%PNaAMPSディスク上で120時間培養したマウスES細胞から、TaqMan GAPDH Control Reagents(ABI社)のプライマーおよびReal Time One Step RNA PCR Kit(タカラバイオ社)を使用して鋳型サンプルを作製した。次いで、PSディスク上のマウスES細胞の各遺伝子の発現量をコントロールとして、未分化マーカー遺伝子であるNanog、Oct3/4、SOX2およびDPPA5/ESG1(以下、「DPPA5」という場合がある。)、外胚葉系分化マーカー遺伝子であるNestinおよびOtx2、内胚葉系分化マーカー遺伝子であるGATA−4、SOX17、およびNHF−3βFoxA2、中胚葉系分化マーカー遺伝子であるBrachyuryについての発現量をmRNAレベルで調べるため、インターカレーターであるSYBR Green I(タカラバイオ社)の存在下、Smart Cycler System II(Cepheid社)を用いてリアルタイムOne Step RT−PCRにより調べた。その結果を図37〜40に示す。
【0069】
未分化マーカー遺伝子であるNanogの発現量は、架橋密度にかかわらずPNaAMPSディスク上で培養したマウスES細胞で多く、SOX2の発現量は、架橋密度が0.5mol%PNaAMPSディスク以外のPNaAMPSディスク上で培養したマウスES細胞において多いことが分かる。また、Oct3/4およびDPPA5の発現量は、架橋密度が0.5mol%PNaAMPS上で培養したマウスES細胞において最も多いが、PSディスク上で培養したのとほとんど差がないことが分かる(図37)。
【0070】
外胚葉系分化マーカー遺伝子であるNestinおよびOtx2の発現量については、PNaAMPSディスク上で培養したマウスES細胞におけるNestinの発現量は、架橋密度にかかわらず少なく、Otx2の発現量は、PSディスク上で培養したのと同等またはそれ以上発現することが分かる(図38)。
【0071】
内胚葉系分化マーカー遺伝子であるGATA−4、SOX17、およびNHF−3βFoxA2の発現量については、いずれもPSディスク上で培養したマウスES細胞において多く、PNaAMPSディスク上で培養したマウスES細胞において少ないことが分かる(図39)。
【0072】
中胚葉系分化マーカー遺伝子であるBrachyuryの発現量については、いずれもPSディスク上で培養したマウスES細胞において多く、PNaAMPSディスク上で培養したマウスES細胞において少ないことが分かる(図40)。
【0073】
<試験例4> フローサイトメトリーを用いた未分化状態の確認
実施例1〜4に記載の方法に準じて、0.5mol%PNaAMPSディスク、2mol%PNaAMPSディスク、10mol%PNaAMPSディスク、0.5mol%ポリ(2−アクリルアミド−2−メチルプロパンスルホン酸)(PAMPS)ディスク、2mol%PAMPSディスク、2mol%PNaSSディスク、4mol%PNaSSディスク、15mol%PNaSSディスク、5wt%PVAディスク、10wt%PVAディスク、1mol%PDMAAmディスク、8mol%PDMAAmディスクおよび15mol%PDMAAmディスクを調製した。
【0074】
上記各ディスクについて、試験例1に示した培養を、マウスES細胞の分化を阻止する機能を有することが知られているニワトリ白血病抑制因子(Leukemia Inhibitory Factor;LIF)を含む培地とこれを含まない培地とをそれぞれ用いて行った。
【0075】
培養後の各ディスクに1mLのPBS溶液を加えてES細胞を洗浄後、さらに5mMのEDTA/PBS溶液1mLを加えた。室温で15分間静置後、セルスクレイパーでゲルから細胞を剥がして、回収された細胞を含むEDTA/PBS溶液を調製した。この溶液5mLをポリスチレン丸底チューブに移し、1300rpm、4℃で5分間遠心して、細胞を回収した。ここにFITC(fluorescein isothiocyanate)ラベルしたマウス抗SSEA−1抗体(BD Pharmingen)5μLを加え、氷上で1時間遮光下で細胞を静置した。この後、1%ウシ血清アルブミン(bovine serum albumin;BSA)を含むPBS溶液1mLを加え、1300rpm、4℃で5分間遠心する洗浄を2回行った。洗浄後の細胞に1%BSAを含むPBS溶液200μLを加え、フローサイトメーター(Becton Dickinson)で細胞表面に結合したFITCラベルしたマウス抗SSEA−1抗体の蛍光値を測定した。コントロールは、比較例のPSディスク上で培養した細胞を上記と同様に処理したものを用意した。前期蛍光値の平均値を図41に示す。
【0076】
コントロールであるPSディスク上のES細胞に関する平均蛍光値と比較すると、本発明であるハイドロゲルからなるディスク上のES細胞に関する平均蛍光値はいずれも高く、特にPVAディスク及びPDMAAmディスク上のES細胞に関する平均蛍光値はコントロールの平均蛍光値の10〜20倍となっていた。これらの結果は、本発明であるハイドロゲルディスク上で培養されたES細胞が高い未分化性を維持していることを示すものである。
【0077】
また、培地中にLIFが存在しない場合には、マイナス電荷を有するPNaAMPSディスクおよびPNaSSディスク上で培養したES細胞の平均蛍光値は、培地中にLIFが存在する場合の平均蛍光値より高いが、電荷が中性であるPVAディスク及びPDMAAmディスク上で培養したES細胞の平均蛍光値は、培地中にLIFが存在する場合とLIFが存在しない場合でほぼ同等であった。
【0078】
以上の実施例および試験例より、PNaAMPSディスク上で培養したマウスES細胞は未分化が維持される傾向が、PSディスク上で培養したマウスES細胞は内胚葉系または中胚葉系の細胞に分化する傾向がみられることが分かる。
【0079】
以上のように、ウイルス感染や異種細胞との接触等の問題を生ずることなく、未分化細胞に酸素と栄養とを十分かつ効率的に補給することができ、ハイドロゲル上で未分化細胞を未分化の状態で培養することができる。
【0080】
なお、本発明に係る足場材料は、前述した実施例に限定されるものではなく、適宜変更することができる。例えば、本発明に係る足場材料を分化細胞(differentiated cell)や前駆細胞(progenitor cell)の培養に用いてもよい。
【技術分野】
【0001】
本発明は、胚性幹細胞や成体幹細胞、ヒト人工多能性幹細胞等の多分化能を有する未分化細胞を未分化の状態で培養するための足場材料に関する。
【背景技術】
【0002】
近年、胚性幹細胞(Embryonic Stem cell;ES細胞)や成体幹細胞(Adult Stem cell;AS細胞)、人工多能性幹細胞(Induced Pluripotent Stem cell;iPS細胞)等の未分化細胞を分離する技術、生物組織細胞への分化誘導に関する技術、生物組織や組織再生用足場をラピッド・プロトタイピングするためのバイオプリンティング技術、或いはより複雑な細胞を再生するための生体材料足場材料等の開発により、未分化細胞から生物組織を作製することが可能となっている。これら未分化細胞は分化万能性や多能性等の多分化能を有する細胞であるため、特にヒト未分化細胞の再生医療分野や組織工学分野への応用がさらに期待されており、一部では臨床試験や早期商業化がなされている。
【0003】
そこで、近年では、未分化細胞から組織細胞への分化を制御する研究が盛んに行われている。例えば、マウスES細胞は、白血病抑制因子(Leukemia Inhibitory Factor;LIF)存在下、マウス胎児線維芽細胞(Mouse Embryonic Fibroblast;MEF)等のフィーダ細胞上で共培養することにより、未分化性を維持することができることが確認されている(非特許文献1)。また、ヒトES細胞については、例えば、bFGF (Basic Fibroblast Growth Factor)とヘパリンとの存在下、未分化性を維持することができることが確認されている(非特許文献2)。
【0004】
しかしながら、ヒトES細胞やヒトAS細胞、ヒトiPS細胞等は自発的に分化しやすい細胞であり、多分化能の状態を保ったままの継代が難しいため、これら未分化細胞を再生医療分野や組織工学分野で用いるためには、未分化の状態で大量に培養する技術が必要であるが、これを行うことのできる最適な培養法は未だ確立されていない。
【0005】
一方、本発明者等は、独自に開発したハイドロゲルを応用して、様々な再生医療材料や組織工学材料の創作を行っている。例えば、特開2006−42795号公報には、p−スチレンスルホン酸ナトリウム(NaSS)や2−アクリルアミド−2−メチルプロパンスルホン酸ナトリウム(NaAMPS)をモノマー単位とする合成高分子を含有する細胞培養用基材が開示されており(特許文献1)、特開2007−307300号公報には、ポリ(p−スチレンスルホン酸ナトリウム)(PNaSS)ゲルまたはポリ(2−アクリルアミド−2−メチル−1−プロパンスルホン酸ナトリウム)(PNaAMPS)ゲルである人工血管用材料が開示されている(特許文献2)。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2006−42795号公報
【特許文献2】特開2007−307300号公報
【非特許文献】
【0007】
【非特許文献1】Smith A.G. et al., Nature 336: 688-90(1988)
【非特許文献2】Miho K. et al., Proc. Natl. Acad. Sci. USA 105(36), 13409-13414(2008)
【発明の概要】
【発明が解決しようとする課題】
【0008】
特許文献1および特許文献2に開示された細胞培養用基材や人工血管材料に基づいては、未分化細胞を未分化の状態で培養することができる足場材料を確立することはできず、最適な培養法が求められている。
【0009】
本発明は、前記問題点を解決するためになされたものであって、ES細胞やAS細胞、iPS細胞等の多分化能を有する未分化細胞を未分化の状態で培養するための、合成高分子を用いた足場材料を提供することを目的としている。
【課題を解決するための手段】
【0010】
本発明に係る足場材料は、未分化細胞を未分化の状態で培養するための足場材料であって、ハイドロゲルからなる。
【0011】
また、本発明の好適な態様は、前記ハイドロゲルが、2−アクリルアミド−2−メチルプロパンスルホン酸(AMPS)、p−スチレンスルホン酸(SS)またはそのスルホン酸基に金属もしくは塩基が付加された塩をモノマー単位として含むハイドロゲル、N,N−ジメチルアクリルアミド(DMAAm)をモノマー単位として含むハイドロゲル、ビニルアルコール(VA)をモノマー単位として含むハイドロゲルまたは2種以上の前記モノマー単位を含むハイドロゲルよりなる群から選ばれるハイドロゲルである、前記足場材料である。
【発明の効果】
【0012】
本発明によれば、ウイルス感染や異種細胞との接触等の問題を生ずることなく、未分化細胞に酸素と栄養を十分かつ効率的に補給することができ、ハイドロゲル上で未分化細胞を未分化の状態で培養することができる。
【図面の簡単な説明】
【0013】
【図1】架橋密度が0.5mol%PNaAMPSディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養24時間、48時間、72時間、左下から右へ順に培養96時間、120時間)を示す写真図である。
【図2】架橋密度が2mol%PNaAMPSディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図3】架橋密度が15mol%PNaAMPSディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図4】架橋密度が4mol%であってFa値が0.1のP(NaAMPS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図5】架橋密度が4mol%であってFa値が0.3のP(NaAMPS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図6】架橋密度が4mol%であってFa値が0.6のP(NaAMPS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図7】架橋密度が4mol%であってFa値が0.8のP(NaAMPS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図8】架橋密度が2mol%PNaSSディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養24時間、48時間、72時間、左下から右へ順に培養96時間、120時間)を示す写真図である。
【図9】架橋密度が4mol%PNaSSディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図10】架橋密度が15mol%PNaSSディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図11】架橋密度が1mol%PDMAAmディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、左下から右へ順に培養96時間、120時間)を示す写真図である。
【図12】架橋密度が2mol%PDMAAmディスクにおけるマウスES細胞コロニーの形態(左から右へ順に培養72時間、120時間)を示す写真図である。
【図13】架橋密度が4mol%であってFb値が0.05のP(NaSS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図14】架橋密度が4mol%であってFb値が0.1のP(NaSS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図15】架橋密度が4mol%であってFb値が0.2のP(NaSS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図16】架橋密度が4mol%であってFb値が0.5のP(NaSS−DMAAm)ディスクにおけるマウスES細胞コロニーの形態(左上から右へ順に培養48時間、72時間、96時間、左下から右へ順に培養120時間、168時間)を示す写真図である。
【図17】各ディスクの弾性率および膨潤度を示した図である。
【図18】PNaAMPSディスクにおける架橋密度と96時間培養後のES細胞コロニーの数との関係を示した図である。
【図19】5wt%PVAディスクにおけるマウスES細胞の形態(培養120時間)を示す写真図である。
【図20】10wt%PVAディスクにおけるマウスES細胞の形態(培養120時間)を示す写真図である。
【図21】比較例であるPSディスクにおけるマウスES細胞の形態(培養24時間)を示す写真図である。
【図22】比較例であるPSディスクにおけるマウスES細胞の形態(培養48時間)を示す写真図である。
【図23】比較例であるPSディスクにおけるマウスES細胞の形態(培養72時間)を示す写真図である。
【図24】比較例であるPSディスクにおけるマウスES細胞の形態(培養96時間)を示す写真図である。
【図25】比較例であるPSディスクにおけるマウスES細胞の形態(培養120時間)を示す写真図である。
【図26】架橋密度が0.5mol%PNaAMPSディスクにおけるマウスES細胞をALP染色した状態(培養120時間)を示す写真図である。
【図27】架橋密度が4mol%PNaAMPSディスクにおけるマウスES細胞をALP染色した状態(培養120時間)を示す写真図である。
【図28】架橋密度が10mol%PNaAMPSディスクにおけるマウスES細胞をALP染色した状態(培養120時間)を示す写真図である。
【図29】架橋密度が15mol%PNaAMPSディスクにおけるマウスES細胞をALP染色した状態(培養120時間)を示す写真図である。
【図30】架橋密度が4mol%であってFa値が0.5のP(NaAMPS−DMAAm)ディスクにおけるマウスES細胞をALP染色した状態を示す写真図である。
【図31】架橋密度が4mol%であってFa値が0.6のP(NaAMPS−DMAAm)ディスクにおけるマウスES細胞をALP染色した状態を示す写真図である。
【図32】架橋密度が4mol%であってFa値が0.8のP(NaAMPS−DMAAm)ディスクにおけるマウスES細胞をALP染色した状態を示す写真図である。
【図33】架橋密度が4mol%であってFb値が0.2のP(NaSS−DMAAm)ディスクにおけるマウスES細胞をALP染色した状態を示す写真図である。
【図34】架橋密度が4mol%であってFb値が0.5のP(NaSS−DMAAm)ディスクにおけるマウスES細胞をALP染色した状態を示す写真図である。
【図35】比較例であるPSディスクにおけるマウスES細胞をALP染色した状態を示す写真図である。
【図36】各ディスク上のマウスES細胞コロニーのうちALP陽性を呈したコロニーの割合を示す図である。
【図37】各ディスク上のマウスES細胞の未分化マーカー遺伝子の発現量を示す図である。
【図38】各ディスク上のマウスES細胞の外胚葉系分化マーカー遺伝子の発現量を示す図である。
【図39】各ディスク上のマウスES細胞の内胚葉系分化マーカー遺伝子の発現量を示す図である。
【図40】各ディスク上のマウスES細胞の中胚葉系分化マーカー遺伝子の発現量を示す図である。
【図41】各ディスク上のマウスES細胞の表面に結合した抗SSEA−1抗体の平均蛍光値を示すグラフである。図中、黒いバーはLIFを含む培地で培養したES細胞における平均蛍光値を、斜線のバーはLIFを含まない培地で培養したES細胞における平均蛍光値をそれぞれ示す。
【発明を実施するための形態】
【0014】
以下、本発明に係る足場材料について詳細に説明する。本発明に係る足場材料は、ハイドロゲルからなり、ES細胞や成体幹細胞、iPS細胞等の未分化細胞を未分化の状態で培養することができる材料である。
【0015】
本発明における「未分化細胞」とは、動物由来の分化万能性や多能性等の多分化能を有する細胞を意味する。分化万能性を有する未分化細胞としては、例えば、ES細胞やiPS細胞を挙げることができ、多能性を有する細胞としては、例えば、AS細胞を挙げることができる。また、動物由来であれば特に限定されないが、哺乳類由来が好ましく、霊長目由来がより好ましく、ヒト由来がさらに好ましい。ここで、「未分化の状態」とは、視覚的には未分化細胞のコロニーが存在する状態をいうが、例えば、後述するアルカリフォスファターゼ(ALP)染色反応を呈する状態や未分化細胞特有の遺伝子または抗原を発現する状態をいう。すなわち、未分化の状態であるか否かの判断は、当業者が通常選択可能な手法によりすることができる。
【0016】
また、本発明において「足場材料」は、「足場基材」、「スキャフォールド」、「スカフォールド」、「培養(用)基板」、「培養(用)基材」、「培養(用)担体」、或いは「固定(用)装置」と交換可能に用いられる。
【0017】
本発明における重合体は、高分子が化学結合によって網目状構造をとり、網目に多量の水を保有しているという特徴を有する、いわゆるハイドロゲルであればよいが、好ましくは、2−アクリルアミド−2−メチルプロパンスルホン酸(AMPS)、p−スチレンスルホン酸(SS)またはそのスルホン酸基に金属もしくは塩基が付加された塩をモノマー単位として含むハイドロゲル、N,N−ジメチルアクリルアミド(DMAAm)をモノマー単位として含むハイドロゲル、ビニルアルコールをモノマー単位として含むハイドロゲルまたは2種以上の前記モノマー単位を含むハイドロゲルよりなる群から選ばれるハイドロゲルである。
【0018】
本発明において好ましいハイドロゲルの一つは、2−アクリルアミド−2−メチルプロパンスルホン酸(AMPS)またはそのスルホン酸基に金属もしくは塩基が付加された塩をモノマー単位として含むハイドロゲルである。このようなゲルとしては、例えば、ポリ(2−アクリルアミド−2−メチルプロパンスルホン酸)(PAMPS)ゲルや、ポリ(2−アクリルアミド−2−メチルプロパンスルホン酸アルカリ金属塩)ゲル、これらハイドロゲルが第1のポリマーであってその架橋網目構造に第2のポリマーが侵入した構造を有するハイドロゲル等を挙げることができるが、2−アクリルアミド−2−メチルプロパンスルホン酸ナトリウム(NaAMPS)をモノマー単位として含んでいることが好ましく、ポリ(2−アクリルアミド−2−メチルプロパンスルホン酸ナトリウム)(PNaAMPS)ゲルがより好ましい。
【0019】
ここで、NaAMPSは以下の構造式I(化1)で示すことができる、マイナス電荷を有するモノマーであり、PNaAMPSは以下の構造式II(化2)で示すことができる、マイナス電荷を有するポリマーである。
【化1】

【化2】

【0020】
本発明において好ましいハイドロゲルのもう一つは、p−スチレンスルホン酸(SS)またはそのスルホン酸基に金属もしくは塩基が付加された塩をモノマー単位として含むハイドロゲルである。このようなゲルとしては、例えば、ポリ(p−スチレンスルホン酸)(PSS)ゲルや、ポリ(p−スチレンスルホン酸アルカリ金属塩)ゲル、これらハイドロゲルが第1のポリマーであってその架橋網目構造に第2のポリマーが侵入した構造を有するハイドロゲル等を挙げることができるが、p−スチレンスルホン酸ナトリウム(NaSS)をモノマー単位として含んでいることが好ましく、ポリ(p−スチレンスルホン酸ナトリウム)(PNaSS)ゲルがより好ましい。
【0021】
ここで、NaSSは、以下の構造式III(化3)で示すことができる、マイナス電荷を有するモノマーであり、PNaSSは以下の構造式IV(化4)で示すことができる、マイナス電荷を有するポリマーである。
【化3】

【化4】

【0022】
本発明において好ましいハイドロゲルの別の一つは、N,N−ジメチルアクリルアミド(DMAAm)をモノマー単位として含むハイドロゲルである。このようなゲルとしては、例えば、ポリ(N,N−ジメチルアクリルアミド)(PDMAAm)ゲルやPDMAAmが第1のポリマーであってその架橋網目構造に第2のポリマーが侵入した構造を有するハイドロゲル等を挙げることができるが、PDMAAmが好ましい。
【0023】
ここで、DMAAmは以下の構造式V(化5)で示すことができる、中性モノマーであり、PDMAAmは以下の構造式VI(化6)で示すことができる、中性ポリマーである。
【化5】

【化6】

【0024】
PNaAMPSゲル、PNaSSおよびPDMAAmは、周知或いは公知の方法によって調製することができるが、例えば、Chen Y.M.等の方法(Chen Y. M., Shiraishi N., Satokawa H., Kakugo K., Narita T., Gong J. P., Osada Y., Yamamoto K., Ando J., Biomaterials 26:4588-4596(2005)) に従い、それぞれのモノマー溶液であるNaAMPS溶液、NaSS溶液またはDMAAm溶液に適当なUV開始剤と架橋剤とを加え、ラジカル重合させることによって調製することができる。これらUV開始剤および架橋剤は、PNaAMPSゲルが調製できれば特に限定されないが、例えば、UV開始剤として2−Oxoglutaricacidを利用することができ、また、架橋剤としてN,N−methylenebis−acrylamide (MBAA)を利用することができる。また、ラジカル重合反応の条件は適宜選択することができ、例えば、前記Chen Y.M.等の方法における反応条件に従うことができる。具体的には、反応温度を20℃〜30℃、反応時間を6〜10時間、前記UV開始剤の添加量を0.1mol%、架橋剤の添加量を2mol%〜10mol%の各範囲から適宜選択することができる。なお、ラジカル重合反応を行うに際し、不活性化ガスを用いたバブリング等によってNaAMPS溶液、NaSS溶液またはDMAAm溶液の溶存酸素を不活性化ガスに置換することが好ましい。
【0025】
本発明において好ましいハイドロゲルのもう一つは、ビニルアルコール(CH2CH−OH;VA)をモノマー単位として含むハイドロゲルであり、より好ましくはポリビニルアルコール(PVA)である。PVAは、酢酸ビニルを重合して得たポリ酢酸ビニルを加水分解(けん化)する方法その他の周知或いは公知の方法によって調製することができる。
【0026】
また、本発明のハイドロゲルは、前記2種以上のモノマー単位を含むハイドロゲルであってもよい。このようなゲルとしては、例えば、PAMPS、ポリ(2−アクリルアミド−2−メチルプロパンスルホン酸アルカリ金属塩)、PSSまたはポリ(p−スチレンスルホン酸アルカリ金属塩)が第1のポリマーであってその架橋網目構造に第2のポリマーであるPDMAAmが侵入した構造を有するハイドロゲル等を挙げることができる。なお、このようなハイドロゲルは、例えば、本発明者等による発明に係る特願2006−350526に記載されており、この内容は本明細書に包含される。
【0027】
本発明に係る足場材料は、調製するハイドロゲルの形態を平板状または円盤状の薄膜とすることが好ましく、例えば、適当な間隔を空けた2枚のガラス板の間にモノマー溶液を充填してラジカル重合を行わせる等の方法によって、平板状または円盤状の薄膜に調製することができる。また薄膜の厚みは適宜決定することができるが、0.1mm〜10mmとするのが好ましく、0.2mm〜5mmとするのがより好ましく、0.5mm〜3mmとするのがさらに好ましい。
【0028】
前述のように調製したハイドロゲルは、そのままヒトES細胞やヒトAS細胞、iPS細胞等の未分化細胞の培養に供することができるが、未分化細胞の培養に適当な緩衝液中または細胞培養液中でハイドロゲルを膨潤させ、ゲル中の溶媒を交換することが好ましい。好適な緩衝液としては、実施例で使用される4−(−2−hydroxyethyl)−piperazine−1−ethansulfonicacid(HEPES)緩衝液やウシ胎児血清(FBS)、ゼラチン水溶液の他、PBS等を挙げることができる。また、好適な細胞培養液の種類及び組成は、未分化細胞の種類に応じて適宜選択することができる。
【0029】
また、個々の成分の正確な組成に従った既知組成培地を使用してもよく、そのような培地として、例えば、MEM(Eagle’s Minimum Essential Medium)、DMEM(Dulbecco’s Modified Eagle’s Medium)、IMDM (Iscove’s Modified Dulbecco’s Medium)、RPMI1640 、AIM−V、ADC、LPM、Ham’s F10、Ham’sF12、DCCM1、DCCM2、BGJ、BME(Basal Medium Eagle)、GMEM(Glasgow’s Modified Eagle’s Medium)、L−15(Leibovitz−15)、McCoy5A、M199、Fisher、Schneider等を挙げることができる。さらに、必要に応じて、公知の構成の培地成分や、アール平衡塩溶液、ハンクス平衡塩溶液、ダルベッコPBS、スピナー塩溶液等の公知の平衡塩類組成成分、種々の細胞増殖因子、抗生物質、ビタミン類、ホルモン類、pH調整剤、血清、その他生物由来成分等を加えることができる。
【0030】
なお、未分化細胞の培養に際し、UV滅菌やオートクレーブ滅菌等によりハイドロゲルを滅菌しておくことが好ましい。
【0031】
前述のように調製したハイドロゲル上での未分化細胞の培養は、適当な容器に置いたハイドロゲルに適当な個数の未分化細胞を含む細胞懸濁液を加えることで行うことができる。例えば、ハイドロゲル単位面積(cm2)当たり1×104〜1×106個の未分化細胞を播種し、標準的な未分化細胞の培養条件下にハイドロゲルを置くことで行うことができる。例えば、培養条件は、20℃ 〜 40℃の培養温度、1% 〜10%のCO2雰囲気、24時間〜168時間の培養時間から適宜選択することができる。
【0032】
本発明においては、未分化の状態であるか否かの判断を、細胞の形態観察やアルカリフォスファターゼ(ALP)染色法によって行っている。細胞の形態観察は、培養ディスク上の細胞の形態を適当な倍率の顕微鏡を用いて観察し、コロニーの崩れや分化した細胞の存在を確認するものである。また、ALP染色法は、培養ディスク上の細胞に基質としてリン酸エステル塩とジアゾニウム塩を含む反応溶液を添加することにより、細胞膜状に存在するアルカリフォスファターゼによってリン酸エステル塩が加水分解され、さらにジアゾニウム塩とカップリング反応することによりアゾ色素が生じ、ALP活性部位に色素が沈殿する。こうして染色されたコロニー数を計測することにより、細胞のALP活性を定量化することが可能となり、これにより細胞の未分化度合いを定量することができる。
【0033】
ALP染色は、適宜ALP染色液を調製して行ってもよく、市販のキットを用いて行ってもよい。このような市販のキットとしては、Leukocyte Alkaline Phosphatase Kit(Sigma社)、New Fuchsin Substrate System(DAKO社)、StemTAG Alkaline Phosphatase Staining Kit(Cell Biolabs社)、Alkaline Phosphatase Detection Kit from Millipore(CHEMICON社)等を挙げることができる。
【0034】
また、未分化の状態であるか否かの判断は、RT−PCR(Reverse Transcription Polymerase Chain Reaction)法を用いて未分化マーカー遺伝子を含む細胞分化マーカー遺伝子の発現量を定量することにより行ってもよい。
【0035】
RT−PCRは、通常の実験書の記載に従って行うことができ、そのような実験書として、例えば、Sambrookら(Molecular Cloning、A laboratory manual、2001年版、Cold Spring Harbor Laboratory Press)を挙げることができる。
【0036】
また、RT−PCRはtotal RNAを抽出した後に行ってもよく、total RNAを抽出せずに行う、いわゆるリアルタイムRT−PCRを行ってもよい。前者の場合、RNAの抽出には、例えば、RNeasy Mini Kit(Qiagen社)、QIAamp RNA kit(Qiagen社)、Concert Plant RNA Regent(Invitrogen社)、QuickPrep Total RNA Extraction Kit(GEヘルスケア社)等を用いることができ、RT−PCR法には、例えば、Expand High FidelityPLUS PCR System (Roche社)、Pyrobest (タカラバイオ社)、ThermoScript RT−PCR System 、PLATIUM taq DNA Polymerase High fidelity(いずれもGibco社)、ABI Prism 7000、同7900(いずれもABI社)、Superscript III First Strand Synthesis System(Invitrogen社)等を用いることができる。一方、後者の場合、例えば、Smart Cycler System II(Cepheid社)、TaqMan Gene Expression Cells−to−CT Kit(ABI社)、CellAmp Direct RNA Prep Kit for One Step RT−PCR(タカラバイオ社)、MasterAmp Real−Time RT−PCR System(Molecular Probes社)等を用いることができる。
【0037】
さらに、未分化の状態であるか否かの判断は、胚性幹細胞の未分化マーカーSSEA−1抗原の発現を、抗SSEA−1抗体(Thomsonら、Science,282(114),1998)染色とフローサイトメトリー(Flow cytometry;FCM)とを用いて確認することにより行ってもよい。
【0038】
なお、フローサイトメトリーはフローサイトメーターやフローサイトメトリーシステムを用いて行うことができ、例えば、Becton Dickinson社やBeckman Coulter社等の各種フローサイトメーターやフローサイトメトリーシステムを挙げることができる。
【0039】
以下、本発明に係る足場材料について、実施例に基づいて説明する。なお、本発明の技術的範囲は、これらの実施例によって示される特徴に限定されない。
【実施例】
【0040】
<実施例1>
(1)PNaAMPSゲルの調製
2−アクリルアミド−2−メチル−1−プロパンスルホン酸ナトリウム(NaAMPS)、UV開始剤である0.1mol%の2−Oxoglutaric acidおよび架橋剤である4mol%のN,N−methylenebisacrylamide(MBAA)を含む水溶液20mLを調製し、窒素バブリングによって溶存酸素を窒素置換した。PNaAMPSのモノマー濃度(架橋密度)は、0.5mol%、1mol%、2mol%、4mol%、10mol%および15mol%の6種類を用意した。
【0041】
窒素置換後の各モノマー溶液を、10×10mm四方の2枚のガラス基板で1.5mmのシリコンスペーサーを挟むことにより形成された鋳型に流し込んだ後、室温で6時間重合させて、架橋密度がそれぞれ0.5mol%、1mol%、2mol%、4mol%ル、10mol%および15mol%であるポリ(2−アクリルアミド−2−メチル−1−プロパンスルホン酸ナトリウム)(PNaAMPS)ゲルを得た。
【0042】
ガラス基板から各ハイドロゲルを取り出し、1Lの蒸留水を一日ごと交換することにより一週間膨潤させた後、ハイドロゲルを15.5mMのNaHCO3、140mMのNaClを含む5mMの4−(−2−hydroxyethyl)−piperazine−1−ethansulfonicacid(HEPES)緩衝液(pH7.4)に一週間浸漬することにより、ハイドロゲルの溶媒交換を行った。
【0043】
(2)P(NaAMPS−DMAAm)ゲルの調製
Fa(モル比)=[NaAMPSモノマー濃度(架橋密度)]/[N,N−ジメチルアクリルアミド(DMAAm)モノマー濃度(架橋密度)+NaAMPSモノマー濃度(架橋密度)]と定義し、このFa値がそれぞれ0.1、0.2、0.3、0.5、0.6および0.8であって、かつ架橋密度がいずれも4mol%のポリ{(2−アクリルアミド−2−メチル−1−プロパンスルホン酸ナトリウム)−(N,N−ジメチルアクリルアミド)}{P(NaAMPS−DMAAm)}ゲルを調製した。
【0044】
具体的には、1mol/LのNaAMPS、NaAMPSに対し4mol%のMBAAおよびNaAMPSに対し0.1mol%のα−ケトグルタル酸を含む水溶液にUV(波長365nm)を6時間当て、架橋度4mol%のPNaAMPSを得た。
【0045】
Fa値に応じた1mol/LのNaAMPSとDMAAmのモノマー混合溶液、NaAMPSとDMAAmモノマー混合溶液に対し4mol%のMBAAおよびNaAMPSとDMAAmモノマー混合溶液に対し0.1mol%のα−ケトグルタル酸を含む水溶液を調製し、窒素バブリングによって溶存酸素を窒素置換した後、10×10mm四方の2枚のガラス基板で1.5mmのシリコンスペーサーを挟むことにより形成された鋳型に流し込み、封をした後、UV(波長365nm)を6時間当て、Fa値がそれぞれ0.1、0.2、0.3、0.5、0.6および0.8であって、かつ架橋密度がいずれも4mol%のP(NaAMPS−DMAAm)ゲルを得た。得られたP(NaAMPS−DMAAm)ゲルの溶媒交換は本実施例(1)と同様にして行った。
【0046】
(3)ハイドロゲルディスクの調製
溶媒交換した本実施例(1)および(2)の各ハイドロゲルをシャーレに移し、121℃ 、20分オートクレーブ滅菌後、各ハイドロゲルから直径15mm、厚さ1〜3mmのハイドロゲルディスク{架橋密度がそれぞれ0.5mol%PNaAMPSディスク、1mol%PNaAMPSディスク、2mol%PNaAMPSディスク、4mol%PNaAMPSディスク、10mol%PNaAMPSディスクおよび15mol%PNaAMPSディスク、ならびに架橋密度がいずれも4mol%であってFa値がそれぞれ0.1のP(NaAMPS−DMAAm)ディスク、0.2のP(NaAMPS−DMAAm)ディスク、0.3のP(NaAMPS−DMAAm)ディスク、0.5のP(NaAMPS−DMAAm)ディスク、0.6のP(NaAMPS−DMAAm)ディスクおよび0.8のP(NaAMPS−DMAAm)ディスク}を調製した。
【0047】
(4)マウスES細胞のハイドロゲルディスク上での培養
本実施例(3)で調製したディスクを24穴ポリスチレン(PS)ディッシュにそれぞれ置き、その上から未分化細胞培養液として20%ウシ胎児血清(fetal bovine serum;FBS)を含むDMEM(IBL)0.5mL/ウェル加え、24時間後にこの溶液を取り除いた後、1.25×104cells/mLのMGZ5マウス胚幹細胞(以下、「マウスES細胞」という。)懸濁液(20%FBSを含むDMEM)1mL/ウェル加えた。この24穴PSディッシュを37℃ 、5%CO2雰囲気のインキュベータ内に置き、マウスES細胞を培養した。
【0048】
<実施例2>
(1)PNaSSゲルディスクの調製
架橋密度がそれぞれ2mol%、4mol%、10mol%および15mol%のポリ(p−スチレンスルホン酸ナトリウム)(PNaSS)ゲルからなる直径15mm、厚さ1〜3mmのディスクを、実施例1(1)および(3)に記載の方法に従って調製した。
【0049】
(2)P(NaSS−DMAAm)ゲルディスクの調製
Fb(モル比)=[p−スチレンスルホン酸ナトリウム(NaSS)モノマー濃度(架橋密度)]/[DMAAmモノマー濃度(架橋密度)+NaSSモノマー濃度(架橋密度)]と定義し、このFb値がそれぞれ0.05、0.1、0.2および0.5であって、かつ架橋密度がいずれも4mol%のポリ{(p−スチレンスルホン酸ナトリウム)−(N’,N−ジメチルアクリルアミド)}{P(NaSS−DMAAm)}ゲルからなる直径15mm、厚さ1〜3mmのハイドロゲルディスク{架橋密度がいずれも4mol%であってFb値がそれぞれ0.05のP(NaSS−DMAAm)ディスク、0.1のP(NaSS−DMAAm)ディスク、0.2のP(NaSS−DMAAm)ディスクおよび0.5のP(NaSS−DMAAm)ディスク}を、実施例1(2)および(3)に記載の方法に従って調製した。
【0050】
(3)マウスES細胞のハイドロゲルディスク上での培養
本比較例(1)および(2)で調製したそれぞれのPNaSSディスクおよびP(NaSS−DMAAm)ディスクを、実施例1(3)と同様にオートクレーブ滅菌し、実施例1(4)に記載の条件の下、24穴PSディッシュ内にそれぞれ置いてマウスES細胞の培養を行った。
【0051】
<実施例3>
(1)PDMAAmゲルディスクの調製
架橋密度がそれぞれ1mol%および2mol%のポリ(N,N−ジメチルアクリルアミド)(PDMAAm)ゲルからなる直径15mm、厚さ1〜3mmのディスクを、実施例1(1)および(3)に記載の方法に従って調製した。
【0052】
(2)マウスES細胞のハイドロゲルディスク上での培養
本実施例(1)で調製したそれぞれのPDMAAmディスクを、実施例1(3)と同様にオートクレーブ滅菌し、実施例1(4)に記載の条件の下、24穴PSディッシュ内にそれぞれ置いてマウスES細胞の培養を行った。
【0053】
<実施例4>
(1)PVAゲルディスクの調製
PVA粉末(重合度2,000、分子量約90,000)を5重量%と10重量%とになるようにジメチルスルホキシド(DMSO)と水の混合溶媒(DMSOと水との重量比3:1)に90℃で溶解したそれぞれの溶液を、実施例1の(2)と同様にしてガラスの型に流し込み、−40℃で16時間凍結した後に室温で解凍してゲルを形成させた。ガラス基板からそれぞれのゲルを取り出し、1Lの蒸留水を一日ごとに交換することによって一週間膨潤させた後、ゲルを15.5mMのNaHCO3および140mMのNaClを含む5mMの4−(−2−hydroxyethyl)−piperazine−1−ethansulfonicacid(HEPES)緩衝液(pH7.4)に一週間浸漬して溶媒交換を行い、5%PVAゲルディスクおよび10%PVAゲルディスクを調製した。
【0054】
(2)マウスES細胞のハイドロゲルディスク上での培養
本実施例(1)で調製したそれぞれのPVAゲルディスクを、75%のエタノール中に浸漬、UVランプを用いて一晩で滅菌し、実施例1(4)に記載の条件の下、24穴PSディッシュ内にそれぞれ置いてマウスES細胞の培養を行った。
【0055】
<比較例>
24穴PSディッシュの上から直接に0.1%ゼラチンを0.4mL/ウェル加え、37℃ 、5%CO2雰囲気のインキュベータ内に30分間置いてゼラチンコーティングすることによりPSディスクを調製し、実施例1(4)に記載の条件下でマウスES細胞の培養を行い、比較例とした。
【0056】
<試験例1> マウスES細胞コロニーの形態観察
実施例1〜4の各ハイドロゲルディスクおよび比較例として調製したPSディスクについて、ディスク上でのマウスES細胞コロニーの形態を、位相差顕微鏡を用いて時系列に観察し、下記(1)〜(6)の結果を得た。
【0057】
(1)PNaAMPSディスク上でのマウスES細胞コロニーの形態
架橋密度が0.5mol%PNaAMPSディスクにおいて、マウスES細胞コロニーは良好に成長し、120時間培養後には、はっきりした輪郭を持つコロニーが確認された(図1)。架橋密度が2mol%PNaAMPSディスク上では、48時間培養後には直径約10μmのマウスES細胞コロニーが形成され、168時間培養後には直径約15〜35μmにまで成長した。なお、架橋密度が2mol%PNaAMPSディスク上では、96時間培養後には分化した細胞が若干観察されたものの、その後も分化した細胞は少数観察されるにとどまった(図2)。また、架橋密度が15mol%PNaAMPSディスク上では、48時間培養後には直径約10μmのマウスES細胞コロニーが形成され、これが168時間培養後には直径約25〜55μmにまで成長したが、72時間培養後には分化した細胞が観察され、120時間培養後までにマウスES細胞コロニーの輪郭の崩れが確認され、さらに168時間培養後には、架橋密度が2mol%PNaAMPSディスク上のものと比較して、分化した細胞が多数観察された(図3)。
【0058】
(2)P(NaAMPS−DMAAm)ディスク上でのマウスES細胞コロニーの形態
架橋密度が4mol%であってFa値が0.1のP(NaAMPS−DMAAm)ディスクにおいて、マウスES細胞コロニーは良好に成長し、168時間培養後には直径約50μmにまで成長した。ただし、観察されたマウスES細胞コロニーの数は時間の経過とともに減少する傾向が認められた(図4)。また、架橋密度が4mol%であってFa値が0.3のP(NaAMPS−DMAAm)ディスク上でもマウスES細胞コロニーは良好に成長するが、120時間培養後にマウスES細胞コロニーの輪郭の崩れが確認されはじめ、168時間経過後にはマウスES細胞コロニーは観察されなくなった(図5)。架橋密度がいずれも4mol%であってFa値がそれぞれ0.6のP(NaAMPS−DMAAm)ディスクおよび0.8のP(NaAMPS−DMAAm)ディスクの場合においても、架橋密度が4mol%であってFa値が0.3のP(NaAMPS−DMAAm)ディスク上と同様の傾向を示した(図6および図7)。
【0059】
(3)PNaSSディスク上でのマウスES細胞コロニーの形態
架橋密度が2mol%PNaSSディスク上では、72時間培養後までマウスES細胞コロニーの輪郭の維持が確認された。その後、この輪郭の崩れが確認されたものの、120時間培養後でもマウス細胞コロニーを観察することができた(図8)。また、架橋密度が4mol%PNaSSディスク上では、48時間経過後には直径約10〜20μmのマウスES細胞コロニーが形成され、96時間経過後にはマウスES細胞コロニーが直径約25〜55μmにまで成長した。ただし、96時間培養によってコロニーの輪郭に若干の崩れが観察された(図9)。架橋密度が15mol%PNaSSディスクの場合においても、これと同様の傾向を示した(図10)。
【0060】
(4)PDMAAmディスク上でのマウスES細胞コロニーの形態
架橋密度がそれぞれ1mol%PDMAAmディスクおよび2mol%PDMAAmディスク上では、PDMAAmの架橋密度に関係なくマウスES細胞コロニーの成長が観察されるが、その成長速度は72時間培養後から遅くなりはじめ、120時間培養後にはほぼ成長が停止した(図11および図12)。
【0061】
(5)P(NaSS−DMAAm)ディスク上でのマウスES細胞コロニーの形態
架橋密度が4mol%であってFb値が0.05のP(NaSS−DMAAm)ディスクにおいて、マウスES細胞コロニーは培養時間に伴って成長し、168時間培養後には直径約50μmにまで成長した。ただし、観察されたマウスES細胞コロニーの数は、時間の経過とともに減少する傾向が認められた(図13)。架橋密度が4mol%であってFb値が0.1のP(NaSS−DMAAm)ディスクにおいてもこれと同様の傾向を示した(図14)。一方、架橋密度がいずれも4mol%であってFb値がそれぞれ0.2のP(NaSS−DMAAm)ディスクおよび0.5のP(NaSS−DMAAm)ディスク上では、マウスES細胞コロニーは培養時間に伴って成長するが、120時間培養後にコロニーの輪郭の崩れが確認された(図15および図16)。
【0062】
架橋密度がそれぞれ0.5mol%、2mol%、4mol%、10mol%および15mol%のPNaAMPSディスク、ならびに架橋密度がそれぞれ2mol%、4mol%、10mol%および15mol%のPNaSSディスクの弾性率および膨潤度を示した表を図17に、PNaAMPSディスクにおける架橋密度と96時間培養後のES細胞コロニーの数との関係を示したグラフを図18に示す
【0063】
(6)PVAディスク上でのマウスES細胞コロニーの形態
5wt%PVAゲルディスクおよび10wt%PVAゲルディスクでは、いずれも120時間培養までマウスES細胞コロニーの成長が観察された(図19および図20)。
【0064】
(7)PSディスク上でのマウスESコロニーの形態
比較例であるPSディスク上でのマウスES細胞コロニーの形態を、位相差顕微鏡を用いて時系列に観察した結果(写真)を図21〜図25に示す。24時間培養後にPSディスク上に伸展した細胞が観察された。これらの細胞は培養時間とともに増殖し、72時間培養後には大量の伸展した細胞と少量の小さい丸い細胞が観察された。さらに96時間培養後には、小さい丸い細胞が伸展した細胞の上に重なっているような状態が観察され、120時間培養後にこのような状態の細胞が大量に増加した。一方、前記ハイドロゲルを用いた場合の結果と異なり、PSディスク上では、培養過程中に細胞によるコロニー形成は確認できなかった。これらの結果は、PSディスク上で培養した細胞の多くが分化した細胞であると推察した。
【0065】
以上より、細胞形態の顕微鏡観察の結果によると、いずれのハイドロゲル上でも、マウスES細胞は未分化の状態でコロニーを形成し、増殖することが分かる。また、架橋密度が同じPNaAMPSディスクとPNaSSディスクとを比較した場合、PNaAMPSディスク上ではPNaSSディスク上よりもマウスES細胞コロニーが成長し、かつ分化した細胞が少数となることが分かる。また、P(NaAMPS−DMAAm)ディスクとPDMAAmディスクとを比較した場合、PDMAAmディスク上でのマウスES細胞コロニーの数は時間の経過とともに減少する傾向にあるが、P(NaAMPS−DMAAm)ディスクを用いた場合は、そのFa値により、PDMAAmディスクを用いた場合と比較して成長したマウスES細胞コロニーの数は減少せず、その形態が維持されることが分かる。さらに、架橋密度が異なるPNaAMPSディスクを互いに比較した場合、架橋密度すなわち弾性率の低いPNaAMPSディスク上では、弾性率の高いPNaAMPSディスク上よりも成長したマウスES細胞コロニーの数は多く、その形態が維持されることが分かる。
【0066】
<試験例2> マウスES細胞の未分化性確認試験(ALP染色)
(2)ALP染色
実施例1(3)で調製した架橋密度がそれぞれ0.5、4、10、15mol%のPNaAMPSディスクおよび架橋密度がいずれも4mol%であってFa値がそれぞれ0.5、0.6、0.8のP(NaAMPS−DMAAm)ディスク、実施例2(2)で調製した架橋密度がいずれも4mol%であってFb値がそれぞれ0.2、0.5のP(NaSS−DMAAm)ディスク、ならびに比較例で調製したPSディスクの各々のディスク上でマウスES細胞を120時間培養後、PBSで洗浄し、ウェル中の細胞をAlkaline Phosphatase Detection Kit from Millipore(CHEMICON社)のプロトコールに従ってALP染色した。その結果(写真)を図26〜35に示す。また、それぞれのディスク上のマウスES細胞コロニーのうちALP陽性を呈したコロニーの割合を示したグラフを図36に示す。
【0067】
以上より、架橋密度がそれぞれ0.5mol%PNaAMPSディスク、4mol%PNaAMPSディスク、10mol%PNaAMPSディスク、15mol%PNaAMPSディスク上で120時間培養したマウスES細胞において、その90%以上のコロニーがALP陽性を呈することが分かる。また、架橋密度が0.5mol%のPNaAMPSディスクおよび架橋密度が4mol%であってFa値が0.5のP(NaAMPS−DMAAm)ディスク上では、ALP陽性を呈するマウスES細胞コロニーの割合が最も高いことが分かる。
【0068】
<試験例3> RT−PCR法による細胞分化マーカー遺伝子発現の定量
実施例1(3)で調製した、架橋密度がそれぞれ0.5mol%PNaAMPSディスク、1mol%PNaAMPSディスク、2mol%PNaAMPSディスク、4mol%PNaAMPSディスク、10mol%PNaAMPSディスクおよび15mol%PNaAMPSディスク上で120時間培養したマウスES細胞から、TaqMan GAPDH Control Reagents(ABI社)のプライマーおよびReal Time One Step RNA PCR Kit(タカラバイオ社)を使用して鋳型サンプルを作製した。次いで、PSディスク上のマウスES細胞の各遺伝子の発現量をコントロールとして、未分化マーカー遺伝子であるNanog、Oct3/4、SOX2およびDPPA5/ESG1(以下、「DPPA5」という場合がある。)、外胚葉系分化マーカー遺伝子であるNestinおよびOtx2、内胚葉系分化マーカー遺伝子であるGATA−4、SOX17、およびNHF−3βFoxA2、中胚葉系分化マーカー遺伝子であるBrachyuryについての発現量をmRNAレベルで調べるため、インターカレーターであるSYBR Green I(タカラバイオ社)の存在下、Smart Cycler System II(Cepheid社)を用いてリアルタイムOne Step RT−PCRにより調べた。その結果を図37〜40に示す。
【0069】
未分化マーカー遺伝子であるNanogの発現量は、架橋密度にかかわらずPNaAMPSディスク上で培養したマウスES細胞で多く、SOX2の発現量は、架橋密度が0.5mol%PNaAMPSディスク以外のPNaAMPSディスク上で培養したマウスES細胞において多いことが分かる。また、Oct3/4およびDPPA5の発現量は、架橋密度が0.5mol%PNaAMPS上で培養したマウスES細胞において最も多いが、PSディスク上で培養したのとほとんど差がないことが分かる(図37)。
【0070】
外胚葉系分化マーカー遺伝子であるNestinおよびOtx2の発現量については、PNaAMPSディスク上で培養したマウスES細胞におけるNestinの発現量は、架橋密度にかかわらず少なく、Otx2の発現量は、PSディスク上で培養したのと同等またはそれ以上発現することが分かる(図38)。
【0071】
内胚葉系分化マーカー遺伝子であるGATA−4、SOX17、およびNHF−3βFoxA2の発現量については、いずれもPSディスク上で培養したマウスES細胞において多く、PNaAMPSディスク上で培養したマウスES細胞において少ないことが分かる(図39)。
【0072】
中胚葉系分化マーカー遺伝子であるBrachyuryの発現量については、いずれもPSディスク上で培養したマウスES細胞において多く、PNaAMPSディスク上で培養したマウスES細胞において少ないことが分かる(図40)。
【0073】
<試験例4> フローサイトメトリーを用いた未分化状態の確認
実施例1〜4に記載の方法に準じて、0.5mol%PNaAMPSディスク、2mol%PNaAMPSディスク、10mol%PNaAMPSディスク、0.5mol%ポリ(2−アクリルアミド−2−メチルプロパンスルホン酸)(PAMPS)ディスク、2mol%PAMPSディスク、2mol%PNaSSディスク、4mol%PNaSSディスク、15mol%PNaSSディスク、5wt%PVAディスク、10wt%PVAディスク、1mol%PDMAAmディスク、8mol%PDMAAmディスクおよび15mol%PDMAAmディスクを調製した。
【0074】
上記各ディスクについて、試験例1に示した培養を、マウスES細胞の分化を阻止する機能を有することが知られているニワトリ白血病抑制因子(Leukemia Inhibitory Factor;LIF)を含む培地とこれを含まない培地とをそれぞれ用いて行った。
【0075】
培養後の各ディスクに1mLのPBS溶液を加えてES細胞を洗浄後、さらに5mMのEDTA/PBS溶液1mLを加えた。室温で15分間静置後、セルスクレイパーでゲルから細胞を剥がして、回収された細胞を含むEDTA/PBS溶液を調製した。この溶液5mLをポリスチレン丸底チューブに移し、1300rpm、4℃で5分間遠心して、細胞を回収した。ここにFITC(fluorescein isothiocyanate)ラベルしたマウス抗SSEA−1抗体(BD Pharmingen)5μLを加え、氷上で1時間遮光下で細胞を静置した。この後、1%ウシ血清アルブミン(bovine serum albumin;BSA)を含むPBS溶液1mLを加え、1300rpm、4℃で5分間遠心する洗浄を2回行った。洗浄後の細胞に1%BSAを含むPBS溶液200μLを加え、フローサイトメーター(Becton Dickinson)で細胞表面に結合したFITCラベルしたマウス抗SSEA−1抗体の蛍光値を測定した。コントロールは、比較例のPSディスク上で培養した細胞を上記と同様に処理したものを用意した。前期蛍光値の平均値を図41に示す。
【0076】
コントロールであるPSディスク上のES細胞に関する平均蛍光値と比較すると、本発明であるハイドロゲルからなるディスク上のES細胞に関する平均蛍光値はいずれも高く、特にPVAディスク及びPDMAAmディスク上のES細胞に関する平均蛍光値はコントロールの平均蛍光値の10〜20倍となっていた。これらの結果は、本発明であるハイドロゲルディスク上で培養されたES細胞が高い未分化性を維持していることを示すものである。
【0077】
また、培地中にLIFが存在しない場合には、マイナス電荷を有するPNaAMPSディスクおよびPNaSSディスク上で培養したES細胞の平均蛍光値は、培地中にLIFが存在する場合の平均蛍光値より高いが、電荷が中性であるPVAディスク及びPDMAAmディスク上で培養したES細胞の平均蛍光値は、培地中にLIFが存在する場合とLIFが存在しない場合でほぼ同等であった。
【0078】
以上の実施例および試験例より、PNaAMPSディスク上で培養したマウスES細胞は未分化が維持される傾向が、PSディスク上で培養したマウスES細胞は内胚葉系または中胚葉系の細胞に分化する傾向がみられることが分かる。
【0079】
以上のように、ウイルス感染や異種細胞との接触等の問題を生ずることなく、未分化細胞に酸素と栄養とを十分かつ効率的に補給することができ、ハイドロゲル上で未分化細胞を未分化の状態で培養することができる。
【0080】
なお、本発明に係る足場材料は、前述した実施例に限定されるものではなく、適宜変更することができる。例えば、本発明に係る足場材料を分化細胞(differentiated cell)や前駆細胞(progenitor cell)の培養に用いてもよい。
【特許請求の範囲】
【請求項1】
未分化細胞を未分化の状態で培養するための足場材料であって、ハイドロゲルからなる前記足場材料。
【請求項2】
前記ハイドロゲルが、2−アクリルアミド−2−メチルプロパンスルホン酸、スチレンスルホン酸またはそのスルホン酸基に金属もしくは塩基が付加された塩をモノマー単位として含むハイドロゲル、ジメチルアクリルアミドをモノマー単位として含むハイドロゲル、ビニルアルコールをモノマー単位として含むハイドロゲルまたは2種以上の前記モノマー単位を含むハイドロゲルよりなる群から選ばれるハイドロゲルである、請求項1に記載の足場材料。
【請求項1】
未分化細胞を未分化の状態で培養するための足場材料であって、ハイドロゲルからなる前記足場材料。
【請求項2】
前記ハイドロゲルが、2−アクリルアミド−2−メチルプロパンスルホン酸、スチレンスルホン酸またはそのスルホン酸基に金属もしくは塩基が付加された塩をモノマー単位として含むハイドロゲル、ジメチルアクリルアミドをモノマー単位として含むハイドロゲル、ビニルアルコールをモノマー単位として含むハイドロゲルまたは2種以上の前記モノマー単位を含むハイドロゲルよりなる群から選ばれるハイドロゲルである、請求項1に記載の足場材料。
【図17】


【図36】


【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図37】


【図38】


【図39】


【図40】


【図41】




【図36】


【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図37】


【図38】


【図39】


【図40】


【図41】


【公開番号】特開2010−158180(P2010−158180A)
【公開日】平成22年7月22日(2010.7.22)
【国際特許分類】
【出願番号】特願2009−1057(P2009−1057)
【出願日】平成21年1月6日(2009.1.6)
【出願人】(504173471)国立大学法人北海道大学 (971)
【Fターム(参考)】
【公開日】平成22年7月22日(2010.7.22)
【国際特許分類】
【出願日】平成21年1月6日(2009.1.6)
【出願人】(504173471)国立大学法人北海道大学 (971)
【Fターム(参考)】
[ Back to top ]

