選択結合性物質測定装置及びポリペプチド固定化剤
【課題】マイクロ流路の特定の部位に、抗体等のポリペプチドを的確に固定化した、抗原等の選択結合性物質の測定装置を提供すること。
【解決手段】マイクロ流路内の所望の部位にリンカー構造を介して共有結合によりポリペプチドが結合されて成るイムノアッセイ装置等の選択結合性物質測定装置であって、前記ポリペプチドが、抗体等の、いずれかの生体由来物質と選択的に結合し得るポリペプチドであり、前記リンカーが、ベンゾフェノン構造と、ポリエチレングリコールのような親水性領域と、カルボキシル基をこの順序で含む。
【解決手段】マイクロ流路内の所望の部位にリンカー構造を介して共有結合によりポリペプチドが結合されて成るイムノアッセイ装置等の選択結合性物質測定装置であって、前記ポリペプチドが、抗体等の、いずれかの生体由来物質と選択的に結合し得るポリペプチドであり、前記リンカーが、ベンゾフェノン構造と、ポリエチレングリコールのような親水性領域と、カルボキシル基をこの順序で含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗原や抗体を測定するイムノアッセイ等に用いられる選択結合性物質測定装置及びその作製に有用なポリペプチド固定化剤に関する。
【背景技術】
【0002】
現代生物学の目標の一つに、細胞機能の分子レベルでのメカニズムの解明や細胞の挙動について定量的な記述を行うことがあげられる。細胞群を対象とした分析は数多く行われてきたが、細胞群として一見特定の挙動を見せていても、個々の細胞は多くの異なる特徴を持っていることはよく知られていることである。特定の遺伝子の発現、重要な代謝物やイオン濃度、刺激に対する応答パターンにおける違いは、細胞の不均質性を示す良い例である。また、近年医学において癌診断や癌の予後診断、治療方針の決定は、形態学を基盤とした病理細胞診断学から、細胞内の疾患関連マーカー遺伝子、タンパク質、糖鎖などを検出し、単一細胞レベルで癌細胞の特性を調べ、診断する方法へと研究が進められている(非特許文献1)。ある生物学的な系に存在するタンパク質の総体(プロテオーム)を解析することをプロテオミクスというが、細胞群ではなく単一細胞レベルでのプロテオミクスは、前述したような背景のもとで必須の手法であり、次世代バイオ分析の重要な技術となることが考えられる。
【0003】
従来より、イムノアッセイは、各種疾患の診断等に広く用いられており、標識として酵素や蛍光色素を利用した酵素抗体法(ELISA等)や、蛍光抗体法等が広く用いられている。従来から汎用されているELISA等は、抗体や抗原を固定化する支持体として、マイクロプレートのウェルやマイクロビーズ等を用いている。そして、イムノアッセイ自体は、組織や臓器等の細胞群から出される物質を定量するものである。マイクロプレートやマイクロビーズを用いる従来のイムノアッセイでは、単一の細胞から出される物質を定量することは困難である。
【0004】
本願発明者らは、微量の試料を種々の化学反応に供することが可能な、マイクロ流路チップをこれまでに研究してきた。マイクロ流路チップを用いてイムノアッセイを行えば、単一細胞から出される物質を免疫測定することが可能であると考えられる(非特許文献2)。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】馬場嘉信監修, 細胞工学, 25(8), 862-910 (2006)
【非特許文献2】K. Jang, K. Sato, K. Mawatari, T. Konno, K. Ishihara, and T. Kitamori, Biomaterials,30, 1413-1420 (2009)
【非特許文献3】Y. Iwasaki, K. Ishihara, Anal Bioanal Chem 381:534-546 (2005).
【非特許文献4】G. Dorman, G.D. Prestwich, Biochemistry 33, 19, 5661-5673 (1994).
【発明の概要】
【発明が解決しようとする課題】
【0006】
非特許文献2に記載されている方法では、抗体が物理吸着によりマイクロ流路上に固定化されている。しかしながら、物理吸着では、微細なマイクロ流路の特定の部位に的確に抗体を固定化することが困難である。また、物理吸着は、固定化が確実ではなく、固定化された抗体等の一部が離脱する恐れがある。抗体を固定化する部位は微細であり、従って、固定化される抗体量も少ないので、一部の抗体が離脱すると、イムノアッセイが困難になる可能性がある。
【0007】
従って、本発明の目的は、マイクロ流路の特定の部位に、抗体等のポリペプチドを的確に固定化した、抗原等の選択結合性物質の測定装置を提供することである。
【課題を解決するための手段】
【0008】
本願発明者らは、鋭意研究の結果、フォトリソグラフィーの手法を利用して、共有結合により抗体等をマイクロ流路の特定の部位に固定化することを着想した。フォトリソグラフィーは、半導体装置の製造に多用されている手法であり、この手法によれば、極めて微細なパターニングを行うことが可能であり、しかも、共有結合で結合すれば、固定化抗体等が、微細な固定化部位からはがれて離脱する恐れがない。そして、フォトリソグラフィーによる抗体等の固定化を行う手段を研究した結果、光反応性のベンゾフェノン構造を持つリンカーを用いることにより、効率よく的確に抗体等のポリペプチドをマイクロ流路に共有結合により固定化できることを見出し、本発明を完成した。
【0009】
すなわち、本発明は、マイクロ流路内の所望の部位にリンカー構造を介して共有結合によりポリペプチドが結合されて成る選択結合性物質測定装置であって、前記ポリペプチドが、いずれかの生体由来物質と選択的に結合し得るポリペプチドであり、前記リンカーが下記一般式[I]:
【0010】
【化1】

【0011】
(式[I]中、Aは親水性領域を示し、末端のカルボキシル基は、前記ポリペプチド中のアミノ基とのアミド結合に供され、ベンゾフェノン部分が直接的又は間接的にマイクロ流路との結合に供される)
で示される構造を有する、選択結合性物質測定装置を提供する。
【0012】
また、本発明は、下記一般式[I]:
【0013】
【化2】

【0014】
(式[I]中、Aは親水性領域を示す)
で示される、ポリペプチド固定化剤を提供する。
【発明の効果】
【0015】
本発明により、マイクロ流路内の特定の部分に抗体等が共有結合により的確に固定化された、選択結合性物質測定のための装置が初めて提供された。本発明の装置によれば、マイクロ流路の上流に単一の細胞を収容し、その上流から液を流せば単一細胞から出された物質を測定することが可能である。
【図面の簡単な説明】
【0016】
【図1】実施例で作製したマイクロ流路における、選択露光してリンカーを選択的に結合した領域(A)と露光しなかった領域(B)に、抗体を結合させ、蛍光標識対応抗原を反応させた後の蛍光顕微鏡写真を示す。抗体を結合しなかったマイクロ流路の蛍光顕微鏡写真(C)も併せて示す。
【図2】図1の蛍光顕微鏡写真の蛍光強度の測定結果を示す図である。
【発明を実施するための形態】
【0017】
本発明において、「選択結合」とは、他の物質と特異的に結合することを意味し、主なものとして、抗原抗体反応、レセプターとリガンドの反応、酵素と基質の反応等が挙げられる。「選択結合性物質」とは、このような選択結合を行う物質であり、主な例として、抗体及びその抗原結合性断片(Fab断片やF(ab')2等)、抗原、レセプター、リガンド、酵素、基質等を挙げることができる。本発明の選択結合性物質の代表的なものは、イムノアッセイ装置である。
【0018】
本発明の装置は、マイクロ流路を具備する。マイクロ流路は、通常、基板内に設けられた溝の形態にある。マイクロ流路を具備する基板はマイクロ流路チップと呼ばれており、それ自体は周知である。本発明の装置は、周知のマイクロ流路チップを利用して構築することが可能である。基板を構成する材料としては、ガラスやプラスチック等を挙げることができるが、後述するMPCポリマーをブロッキング剤としてマイクロ流路内面に結合させる場合には、ガラスが好ましい。マイクロ流路の幅は、1000μm未満であり、通常、10μm〜800μm程度、好ましくは100μm〜500μm程度である。マイクロ流路の断面形状は、特に限定されないが、通常、半円形又は半楕円形である。マイクロ流路の長さは、特に限定されないが、通常、0.5cm〜8cm程度、好ましくは1cm〜6cm程度である。
【0019】
本発明の装置では、上記マイクロ流路の内面に、後述するリンカー構造を介して、上記選択結合性物質と特異的に結合するポリペプチドが共有結合により固定化される。「選択結合性物質と特異的に結合するポリペプチド」は、上記した選択結合性物質が特異的に結合する相手方のポリペプチドである。
【0020】
本発明の装置では、基板がプラスチック製の場合には、マイクロ流路の内面に後述するリンカーを直接結合することも可能であるが、非特異吸着を防止するために、マイクロ流路の内面をブロッキング剤で被覆し、該ブロッキング剤にリンカーを結合することが好ましい。この場合、ブロッキング剤は、マイクロ流路の内面に共有結合により結合される。ブロッキング剤としては、MPC(2-メタクリロイロキシエチルフォスホリルコリン)ポリマーが好ましい。MPCポリマー自体は公知であり、これを非特異吸着紡糸のためのブロッキング剤として用いることも公知である(非特許文献3)。なお、本発明でいう、「MPCポリマー」には、2-メタクリロイロキシエチルフォスホリルコリン構造を主体とする(すなわち、モル比で50%超)、MPC共重合体も包含される。好ましいMPCポリマーとして、下記式で表されるPMSi90を挙げることができる。
【0021】
【化3】

【0022】
ここで、nは通常、40〜95、好ましくは50〜90の数、mは通常、5〜60、好ましくは10〜50の数を表す。なお、PMSi90では、MPCとMPTMSi(メタクリルオキシプロピルトリメトキシシラン)のモル比は、90:10になっているが、これに限定されるものではない。
【0023】
MPCポリマーは、エタノール等の親水性有機溶媒を溶媒とし、触媒としてのコハク酸の存在下、ガラス製のマイクロ流路内面と接触させるだけで、MPTMSi部分がガラスと共有結合する。反応は室温下で起き、反応時間は、特に限定されないが、通常、1時間〜3時間程度でよい。また、この際、MPCポリマーの溶液中の濃度は、特に限定されないが、通常、0.01〜1wt%、好ましくは、0.1〜0.3wt%程度である。
【0024】
本発明の装置では、特定の構造のリンカーを介して、上記選択結合性物質と特異的に結合するポリペプチドがマイクロ流路の内面に直接的又は間接的に共有結合により結合される。上記したMPCポリマーがマイクロ流路内面を被覆している場合には、リンカーは、MPCポリマーに共有結合する。
【0025】
本発明で用いられるリンカーは、上記一般式[I]で示される構造を有する。上記一般式[I]において、Aは親水性領域を示す。一般式[I]に示される通り、リンカーは、ベンゾフェノン構造を有する。ベンゾフェノンは化学や生物化学の分野で、光プローブとして広く使われてきた(例えば非特許文献4)。その理由として特筆すべき3つの化学的、生物化学的利点があげられる。1つめに、ベンゾフェノンは、同じく光反応性を有するジアゾエステルやアリルアジド、ジアジリンよりも化学的に安定であること、2つめに、タンパク質へのダメージをほとんど与えない波長領域(350〜360nm)の光で活性化されること、3つめに、溶媒としての水や多量の求核剤があっても選択的に未反応C-Hと反応することである。
【0026】
このように、ベンゾフェノンは、紫外線照射により、有機化合物中のC-H結合と反応して該有機化合物と結合する。すなわち、ベンゾフェノンは、紫外線を照射されると、ケトン部分にベンゾフェノンラジカル(三重項励起状態)が生じ、これが他の有機化合物中のC-H結合を攻撃してC-C結合を形成する。これにより、ベンゾフェノンが該有機化合物と共有結合する。従って、例えば、上記したMPCポリマーに本発明のリンカーを作用させ、紫外線を照射すると、リンカー中のベンゾフェノン部分が、MPCポリマー中のC-H結合と反応してリンカーがMPCポリマーに共有結合する。この反応には、紫外線照射が必要であるので、紫外線を照射した領域においてのみ、上記結合反応が起き、紫外線を照射しなかった領域では上記反応が起きず、リンカーはMPCポリマーに結合しない。従って、紫外線を選択的に照射することにより、任意の部位にのみリンカーを結合することができ、ひいては、その任意の部位にのみ、抗体等のポリペプチドを結合することができる。紫外線の選択的照射は、半導体装置の製造分野で汎用されている、フォトリソグラフィーの際の選択露光の技術を利用することができ、紫外線を照射したい部分のみ紫外線を通すフォトマスクを用いて容易に行うことができる。本発明のリンカーをMPCポリマーに結合する場合、特に限定されないが、紫外線の波長は、好ましくは、350nm〜380nm程度、強度は、通常、100 mW/cm2〜200mW/cm2であり、照射時間は、通常、15秒〜300秒、好ましくは、150秒〜250秒程度である。選択露光する領域は、任意に設定可能であり、例えば、マイクロ流路内の、長さ100μm〜400μm程度の領域の全面を露光することができる。
【0027】
一般式[I]中、Aは、親水性領域であり、リンカーの水に対する溶解性を高める機能を有する。親水性領域は、酸素原子や窒素原子のような、炭素原子よりも電気陰性度の大きな原子を構造中に含むことにより、同じサイズのアルキル基よりも水に対する溶解性の高いものであり、好ましくは、構造中の炭素原子の個数に対する酸素原子及び窒素原子の数の割合が、30%〜60%程度のものである。好ましい具体例として、ポリエチレングリコール及びポリプロピレングリコールから主として構成されるものを挙げることができ、特にポリエチレングリコールから主として成るものが好ましい。ポリエチレングリコールは、医薬化合物の生体内安定性を高めるために広く用いられており、生体物質と不所望の反応を行わないことがわかっており、この点からも好ましい。ポリエチレングリコール等は、ベンゾフェノン構造に直接結合されていてもよいが、アミド結合のような親水性の結合により結合されていてもよい。下記実施例において作製した、好ましいリンカーの構造を下記一般式[II]に示す。
【0028】
【化4】

【0029】
(式[II]中、nは8〜20の数を示す)
【0030】
一般式[I]中の末端のカルボキシル基は、固定化すべき抗体等のポリペプチドの遊離のアミノ基との結合に供するものである。カルボキシル基と、ポリペプチドの遊離のアミノ基との結合方法自体は周知であり、N-ヒドロキシコハク酸イミド(NHS)と1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC)を用いる常法により行うことができる。この方法自体は、周知であり、下記実施例にも具体的に記載されている。
【0031】
上記したリンカーは、例えば、Fmocでアミノ基を保護したFmoc-PEG-COOH(PEGはポリエチレングリコール)を、樹脂ビーズに固定化したトリチルクロライドと反応させて固相化し、次いで、Fmoc基をはずし、これを4-ベンゾイル安息香酸と反応させることにより合成することができる。すなわち、下記の反応スキームにより合成することができる。なお、下記の反応スキームには、下記実施例で合成した、上記一般式[II](nは12)で表されるリンカーが例示されている。なお、下記の反応スキームにおいて、右端の丸いものは、樹脂ビーズを表す。
【0032】
(1) 樹脂固定化トリチルクロライドとFmoc-PEG11-COOH を結合させる。
【0033】
【化5】

【0034】
(2) Fmoc 基を外し(脱保護)、4-ベンゾイル安息香酸と脱水縮合させる。
【0035】
【化6】

【0036】
最後に、樹脂固定化トリチルクロライドを加水分解により除去し、遊離のカルボキシル基とすることにより、一般式[II](n=12)で表されるリンカーを得る。
【0037】
上記した反応スキームは、有機化学合成の常識に従って行うことができ、下記実施例にも具体的に記載されている。
【0038】
なお、上記から明らかなように、上記したリンカーは、ポリペプチド固定化剤として機能しているものであり、本発明は、上記したリンカーであるポリペプチド固定化剤をも提供するものである。
【0039】
本発明の装置は、好ましくは、マイクロ流路の内面に上記のとおりMPCをポリマーを共有結合させ、これに上記したリンカーを、マイクロ流路中の所望の特定部位に、フォトマスクを用いたフォトリソグラフィーの手法により選択的に共有結合させ、次にこれを、上記の通り、固定化すべき抗体のようなポリペプチドと反応させて共有結合することにより製造することができる。具体的な条件は、下記実施例に詳細に記載されている。
【0040】
測定すべき選択的結合性物質を含む試料をマイクロ流路の上流から流し、上記ポリペプチドが固定化された部位で抗原抗体反応のような選択的結合反応を行わせ、その結果を測定することにより、試料中の選択的結合性物質を測定することができる。なお、「測定」には、検出、定量及び半定量のいずれも包含される。選択的結合性物質の測定自体は、公知の方法により行うことができる。例えば、選択的結合性物質が抗原の場合、該抗原をマイクロ流路上に固定化された対応抗体と抗原抗体反応させ、洗浄後、マイクロ流路に固定化された抗原を、蛍光標識した第2抗体と抗原抗体反応させ、洗浄後、蛍光標識を蛍光顕微鏡で観察し、蛍光強度を測定することにより行うことができる(サンドイッチイムノアッセイ)。また、第2抗体が酵素標識されている場合には、該酵素の基質をマイクロ流路に流して反応させ、比色定量することにより行うことができる。マイクロ流路内の比色定量は、熱レンズ顕微鏡(TLM)を用いて行うことができる。熱レンズ顕微鏡は、励起光、プローブ光と呼ばれる2本のレーザー光をマイクロ流路内の物質に照射し、レーザーの照射により生じる液の屈折率の変化(屈折率は液の温度により変化する)を、励起光を変調させてプローブ光の光量変化を同期検出する装置であり、マイクロ流路内の物質を高感度で定量できるものである。熱レンズ顕微鏡は、既に市販されている(マイクロ化学技研株式会社)ので、市販品を好ましく用いることができる。
【0041】
サンドイッチイムノアッセイにより試料中の抗原を測定する場合、固定化抗体と抗原との反応条件は、例えば、室温下で試料を10分間〜60分間静置反応させることにより行うことができる。第2抗体との反応は、例えば濃度100 ng/ml〜1 mg/mlで第2抗体を含む第2抗体溶液を、10分間〜60分間静置反応することにより行うことができる。
【0042】
測定に供される試料は、特に限定されず、測定すべき選択結合性物質を含んでいる可能性がある試料であれば、何ら限定されるものではないが、本発明の装置はマイクロ流路を利用しているので、単一細胞由来の物質の測定に利用可能である。すなわち、マイクロ流路の上流に、単一細胞を収容し、その上流から、生理緩衝液を流し、流れて来た液を試料として上記の通り測定を行うことにより、単一細胞に由来する任意の選択結合性物質を測定することができる。
【0043】
単一細胞に由来する任意の選択結合性物質の例としては、ホルモン、サイトカイン等を例示することができるが、これらに限定されるものではない。また、本発明の装置を用いる場合、必要な試料の量が微量でよいので、これまでにイムノアッセイで分析されている、血液(血清や血漿等)、尿、組織液、ぬぐい液等の体液中の種々の選択結合性物質の測定に用いた場合にも、しばしば貴重である生体試料の使用量が微量ですむという効果がもたらされる。
【0044】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0045】
1. リンカーの合成
上記した反応スキームに従い、上記一般式[II](n=12)で示されるリンカーを合成した。具体的には次のようにして行った。
【0046】
(1) 樹脂ビーズ固定化トリチルクロライド(Resin)とカルボン酸の結合
ガラス秤量瓶をDCM(ジクロロメタン)で洗い、乾燥した。トリチルクロライドResin(ポリスチレンビーズ、メッシュサイズ100-200、ローディング量1.48 mM/g)を104 mg(0.15mM)量り取り容器に加えた。秤量瓶に150 mg(0.18mM)のFmoc-PEG11-COOH(M.W. 839.9)を量り取り、DCM で溶かした。すぐにFmoc-PEG11-COOH に対して4 モル等量のDIEA(N,N-ジイソプロピルエチルアミン)を加えた。Resin を加えた容器に注ぎ、秤量瓶をDCMで洗い、洗浄液も容器に注いだ。1 分間Resin の入った容器を激しく振った後、ロータリーシェーカーの上において6.5 時間攪拌した。その後Resin をDCM/MeOH/DIEA(17:2:1)混合液で3 回, DCMで3回、DMFで3回、DCMで2回洗った。Fmoc 基の脱保護20% piperidine のDMF 溶液を10 ml 用意した。3 ml とって容器に入れ1〜2 分間激しく振った。それをもう一度やり、その後ロータリーシェーカーの上に20分間置いた。
【0047】
(2) 脱水縮合によるアミド結合
4-ベンジル安息香酸(BP-COOH)を113.2 mg(500μM)とった。それとは別の容器にHBTU を189.4 mg(500μM)、HBTUを67.0 mg(500μM)量り取り、DMF(N,N-ジメチルフォルムアミド)で溶かした。その溶液をBP-COOH に加え、さらにResin に加えた。174μL(1 mM)DIEA を加え、激しく振ったのち20 分間ロータリーシェーカーの上で攪拌した。EtOH, DMF, DCM+5%DIEA, DMF, DCMで3回洗浄した。
【0048】
(3) ニンヒドリン反応によるテスト
アミド結合生成反応が十分進行したかどうかをニンヒドリン反応によってチェックした。もし青くなった(アミノ基が残っている)ならば、もう一度アミドカップリング反応を行う。今回は青くならなかったので先へ進んだ。
【0049】
(4) Resin からの切り離し
10%TFA のDCM 溶液を10 ml 調製した。3 ml を加え、5 分間待った(溶液は赤色)。これを3 回繰り返した。溶液をロータリーエバポレーター用ナスフラスコに移した。反応に用いた容器をエタノールでよく洗って、洗浄液もナスフラスコに移した。ナスフラスコ内の気体をアルゴンガスで置換したのち、30〜40分間ロータリーエバポレーターにかけて溶媒を蒸発させた。残滓はやや茶色がかった黄色であった。残滓をイオン交換水1 ml により溶かし、マイクロチューブに分取した。ナスフラスコ内の洗浄液もマイクロチューブに移した。HPLC で精製するが、時間がかかるので-80℃の冷凍庫に保存し、数本ずつ精製を行った。
【0050】
HPLC による精製
得られた粗製リンカーのチューブに20%アセトニトリル+80%水(1%TFA 添加)溶液を加え、高速液体クロマトグラフィー装置(日本分光株式会社)によって精製した。逆相クロマトグラフィーによりグラジエント溶出法を用い、37%アセトニトリルでリンカーが溶出した。溶出液をファルコンチューブに集め、マイクロチューブに分取し、低温トラップと組み合わせた遠心濃縮機(TAITEC)により不要な溶媒を除去した。最終的にリンカーが0.5〜1.0 mg /チューブになるようマイクロチューブに分取し、精製したリンカーは-4℃の冷凍庫に保存した。
【0051】
2.MPCポリマーによる表面修飾
マイクロ流路は、ガラス基板上に設けられた幅500μm、深さ60μm、長さ6cmの、断面形状が半楕円形の溝であり、上部をガラス基板で被覆して密閉した。このマイクロ流路の内面にMPCポリマー(上記したPMSi90)を被覆した。これは具体的に次のようにして行った。マイクロ流路表面に均一にコーティングを行うため、まずマイクロ流路内の洗浄を行った。シリンジポンプで0.1 M水酸化ナトリウム水溶液を流速40μL/min で60分間、エタノールを40μL/min で15分間流した後、エタノール中で超音波洗浄を5 分間行った。次にポリマー溶液の導入を行った。エタノールを溶媒とした0.2wt%(重量パーセント)のPMSi90を1 ml、こはく酸を100μLバイアル瓶に取り混合したのち、混合溶液を0.5 ml/minで2時間マイクロ流路内に流した。その後40μL/min で15分間マイクロ流路内をエタノールで洗浄し、不要な溶媒等を完全にとばすために電気炉を用いて70℃で4時間保持した。代替として、2時間真空乾燥を行ってもよい。次の操作を行う前に、マイクロ流路を水で2時間以上浸漬放置しMPCポリマーを平衡状態に保ち、ポリマーの機能が十分発揮されている環境のもとで実験を行った。
【0052】
3. フォトリソグラフィーによるリンカーの結合
上記1で調製したリンカーを、フォトリソグラフィーの手法により、選択的にMPCポリマーに結合させた。具体的には次のようにして行った。リンカーを30mg/mLの濃度でイオン交換水に溶解し、その4μL(マイクロ流路の体積よりも多い)をマイクロ流路の入口に垂らし、毛管力によりリンカー溶液をマイクロ流路内に導入した。マイクロ流路両端の開放口からの蒸発や溶液漏れを防ぐため、テープで開放口をふさいだ。実験以外の紫外光によるバックグラウンドの増加を防ぐため、チップをアルミホイルで包んだ。すぐにクリーンルームへと移動し、UV 照射を行った。UV 照射を行うための装置としては、マスクアライナー(マスクアライメント装置MA10 型、ミカサ)、UV 発生装置(スポットUV 照射装置SP-9、ウシオ電機)、紫外光を導くための光ファイバーを用いた。石英ガラスにOHPマスクを貼り付け、マスクアライナーにセットした。マスクアライナーは顕微鏡により観察対象を拡大しながらマスクを動かして位置合わせが行える装置である。マスクアライナーを用いてOHP マスクとチップの位置合わせを行うことで、修飾したい場所を正確に決めることができる。UV発生装置により発生するUVは光ファイバーによってマスクアライナーまで導かれている。マスクアライナーにはプリズムがセットされており、プリズムによってUV が曲がり、チップに対して真上からUV が照射されるようになっている。装置によって発生するUV の波長は365 nm、強度は250 mW/cm2で、光ファイバー出口からマイクロ流路チップまでの距離(約4cm)によって強度は減衰し、100 mW/cm2となる。これは紫外線積算光量計UIT-250(ウシオ電機)で強度を測定して確認した。この装置を用い、単一のマイクロ流路内の6箇所(各200μmの長さの領域)を4分間選択露光した。
【0053】
4. カルボキシル基の活性化
1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸(略称EDC、東京化成工業株式会社)を114.8 mg、N-ヒドロキシこはく酸イミド(略称NHS、和光純薬工業株式会社)を114.8 mg、MES、緩衝液(商品名low moisture content、シグマアルドリッチジャパン株式会社)を195.2 mg 電子天秤で秤量し、2mlの水で溶かし、溶液を40μL/minで7分間流した。その後、イオン交換水を40μL/min で3分間流して洗浄した。
【0054】
5. 抗BSA抗体の固定化
次に、抗BSA抗体を結合した。すなわち、4μLの濃度約1.6mg/mLの市販の抗BSA抗体の溶液をマイクロ流路内に導入し、一時間待ち反応を完了させた。マイクロ流路をTris buffered saline, TBS(Tween 20(商品名)添加)によって洗浄し、未反応活性エステルをブロックした(Tris base はアミノ基を持っているため、活性エステルと結合する)。次に、濃度100μg/mlの蛍光(テキサスレッド(商品名))標識BSA をマイクロ流路に導入し、1 時間待って抗体抗原反応を完了させた。その後TBSでマイクロ流路を洗浄した。マイクロ流路を蛍光顕微鏡で観察し、露光時間300ミリ秒で蛍光観察画像を撮影した。
【0055】
比較のため、抗BSA抗体溶液を反応させることなく、蛍光標識BSAを反応させ、同様に蛍光顕微鏡で観察し、蛍光観察画像を撮影し、蛍光強度を測定した。
【0056】
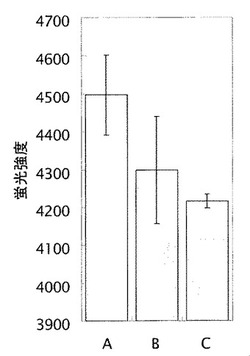
結果を図1に示す。図1中、領域Aは、選択露光した領域、領域Bは、同じマイクロ流路内で選択露光しなかった領域の蛍光観察画像であり、Cは、抗BSA抗体を結合しなかった比較実験の蛍光観察画像である。また、A、B、Cの領域で観察された蛍光強度を図2に示す。
【0057】
図1及び図2に示されるように、選択露光した領域Aでは、選択露光しなかった領域Bや、抗BSA抗体を固定化しなかった別のマイクロ流路内の領域Cよりも蛍光強度が大きく、抗BSA抗体が選択的に結合されたことが確認された。
【技術分野】
【0001】
本発明は、抗原や抗体を測定するイムノアッセイ等に用いられる選択結合性物質測定装置及びその作製に有用なポリペプチド固定化剤に関する。
【背景技術】
【0002】
現代生物学の目標の一つに、細胞機能の分子レベルでのメカニズムの解明や細胞の挙動について定量的な記述を行うことがあげられる。細胞群を対象とした分析は数多く行われてきたが、細胞群として一見特定の挙動を見せていても、個々の細胞は多くの異なる特徴を持っていることはよく知られていることである。特定の遺伝子の発現、重要な代謝物やイオン濃度、刺激に対する応答パターンにおける違いは、細胞の不均質性を示す良い例である。また、近年医学において癌診断や癌の予後診断、治療方針の決定は、形態学を基盤とした病理細胞診断学から、細胞内の疾患関連マーカー遺伝子、タンパク質、糖鎖などを検出し、単一細胞レベルで癌細胞の特性を調べ、診断する方法へと研究が進められている(非特許文献1)。ある生物学的な系に存在するタンパク質の総体(プロテオーム)を解析することをプロテオミクスというが、細胞群ではなく単一細胞レベルでのプロテオミクスは、前述したような背景のもとで必須の手法であり、次世代バイオ分析の重要な技術となることが考えられる。
【0003】
従来より、イムノアッセイは、各種疾患の診断等に広く用いられており、標識として酵素や蛍光色素を利用した酵素抗体法(ELISA等)や、蛍光抗体法等が広く用いられている。従来から汎用されているELISA等は、抗体や抗原を固定化する支持体として、マイクロプレートのウェルやマイクロビーズ等を用いている。そして、イムノアッセイ自体は、組織や臓器等の細胞群から出される物質を定量するものである。マイクロプレートやマイクロビーズを用いる従来のイムノアッセイでは、単一の細胞から出される物質を定量することは困難である。
【0004】
本願発明者らは、微量の試料を種々の化学反応に供することが可能な、マイクロ流路チップをこれまでに研究してきた。マイクロ流路チップを用いてイムノアッセイを行えば、単一細胞から出される物質を免疫測定することが可能であると考えられる(非特許文献2)。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】馬場嘉信監修, 細胞工学, 25(8), 862-910 (2006)
【非特許文献2】K. Jang, K. Sato, K. Mawatari, T. Konno, K. Ishihara, and T. Kitamori, Biomaterials,30, 1413-1420 (2009)
【非特許文献3】Y. Iwasaki, K. Ishihara, Anal Bioanal Chem 381:534-546 (2005).
【非特許文献4】G. Dorman, G.D. Prestwich, Biochemistry 33, 19, 5661-5673 (1994).
【発明の概要】
【発明が解決しようとする課題】
【0006】
非特許文献2に記載されている方法では、抗体が物理吸着によりマイクロ流路上に固定化されている。しかしながら、物理吸着では、微細なマイクロ流路の特定の部位に的確に抗体を固定化することが困難である。また、物理吸着は、固定化が確実ではなく、固定化された抗体等の一部が離脱する恐れがある。抗体を固定化する部位は微細であり、従って、固定化される抗体量も少ないので、一部の抗体が離脱すると、イムノアッセイが困難になる可能性がある。
【0007】
従って、本発明の目的は、マイクロ流路の特定の部位に、抗体等のポリペプチドを的確に固定化した、抗原等の選択結合性物質の測定装置を提供することである。
【課題を解決するための手段】
【0008】
本願発明者らは、鋭意研究の結果、フォトリソグラフィーの手法を利用して、共有結合により抗体等をマイクロ流路の特定の部位に固定化することを着想した。フォトリソグラフィーは、半導体装置の製造に多用されている手法であり、この手法によれば、極めて微細なパターニングを行うことが可能であり、しかも、共有結合で結合すれば、固定化抗体等が、微細な固定化部位からはがれて離脱する恐れがない。そして、フォトリソグラフィーによる抗体等の固定化を行う手段を研究した結果、光反応性のベンゾフェノン構造を持つリンカーを用いることにより、効率よく的確に抗体等のポリペプチドをマイクロ流路に共有結合により固定化できることを見出し、本発明を完成した。
【0009】
すなわち、本発明は、マイクロ流路内の所望の部位にリンカー構造を介して共有結合によりポリペプチドが結合されて成る選択結合性物質測定装置であって、前記ポリペプチドが、いずれかの生体由来物質と選択的に結合し得るポリペプチドであり、前記リンカーが下記一般式[I]:
【0010】
【化1】

【0011】
(式[I]中、Aは親水性領域を示し、末端のカルボキシル基は、前記ポリペプチド中のアミノ基とのアミド結合に供され、ベンゾフェノン部分が直接的又は間接的にマイクロ流路との結合に供される)
で示される構造を有する、選択結合性物質測定装置を提供する。
【0012】
また、本発明は、下記一般式[I]:
【0013】
【化2】

【0014】
(式[I]中、Aは親水性領域を示す)
で示される、ポリペプチド固定化剤を提供する。
【発明の効果】
【0015】
本発明により、マイクロ流路内の特定の部分に抗体等が共有結合により的確に固定化された、選択結合性物質測定のための装置が初めて提供された。本発明の装置によれば、マイクロ流路の上流に単一の細胞を収容し、その上流から液を流せば単一細胞から出された物質を測定することが可能である。
【図面の簡単な説明】
【0016】
【図1】実施例で作製したマイクロ流路における、選択露光してリンカーを選択的に結合した領域(A)と露光しなかった領域(B)に、抗体を結合させ、蛍光標識対応抗原を反応させた後の蛍光顕微鏡写真を示す。抗体を結合しなかったマイクロ流路の蛍光顕微鏡写真(C)も併せて示す。
【図2】図1の蛍光顕微鏡写真の蛍光強度の測定結果を示す図である。
【発明を実施するための形態】
【0017】
本発明において、「選択結合」とは、他の物質と特異的に結合することを意味し、主なものとして、抗原抗体反応、レセプターとリガンドの反応、酵素と基質の反応等が挙げられる。「選択結合性物質」とは、このような選択結合を行う物質であり、主な例として、抗体及びその抗原結合性断片(Fab断片やF(ab')2等)、抗原、レセプター、リガンド、酵素、基質等を挙げることができる。本発明の選択結合性物質の代表的なものは、イムノアッセイ装置である。
【0018】
本発明の装置は、マイクロ流路を具備する。マイクロ流路は、通常、基板内に設けられた溝の形態にある。マイクロ流路を具備する基板はマイクロ流路チップと呼ばれており、それ自体は周知である。本発明の装置は、周知のマイクロ流路チップを利用して構築することが可能である。基板を構成する材料としては、ガラスやプラスチック等を挙げることができるが、後述するMPCポリマーをブロッキング剤としてマイクロ流路内面に結合させる場合には、ガラスが好ましい。マイクロ流路の幅は、1000μm未満であり、通常、10μm〜800μm程度、好ましくは100μm〜500μm程度である。マイクロ流路の断面形状は、特に限定されないが、通常、半円形又は半楕円形である。マイクロ流路の長さは、特に限定されないが、通常、0.5cm〜8cm程度、好ましくは1cm〜6cm程度である。
【0019】
本発明の装置では、上記マイクロ流路の内面に、後述するリンカー構造を介して、上記選択結合性物質と特異的に結合するポリペプチドが共有結合により固定化される。「選択結合性物質と特異的に結合するポリペプチド」は、上記した選択結合性物質が特異的に結合する相手方のポリペプチドである。
【0020】
本発明の装置では、基板がプラスチック製の場合には、マイクロ流路の内面に後述するリンカーを直接結合することも可能であるが、非特異吸着を防止するために、マイクロ流路の内面をブロッキング剤で被覆し、該ブロッキング剤にリンカーを結合することが好ましい。この場合、ブロッキング剤は、マイクロ流路の内面に共有結合により結合される。ブロッキング剤としては、MPC(2-メタクリロイロキシエチルフォスホリルコリン)ポリマーが好ましい。MPCポリマー自体は公知であり、これを非特異吸着紡糸のためのブロッキング剤として用いることも公知である(非特許文献3)。なお、本発明でいう、「MPCポリマー」には、2-メタクリロイロキシエチルフォスホリルコリン構造を主体とする(すなわち、モル比で50%超)、MPC共重合体も包含される。好ましいMPCポリマーとして、下記式で表されるPMSi90を挙げることができる。
【0021】
【化3】

【0022】
ここで、nは通常、40〜95、好ましくは50〜90の数、mは通常、5〜60、好ましくは10〜50の数を表す。なお、PMSi90では、MPCとMPTMSi(メタクリルオキシプロピルトリメトキシシラン)のモル比は、90:10になっているが、これに限定されるものではない。
【0023】
MPCポリマーは、エタノール等の親水性有機溶媒を溶媒とし、触媒としてのコハク酸の存在下、ガラス製のマイクロ流路内面と接触させるだけで、MPTMSi部分がガラスと共有結合する。反応は室温下で起き、反応時間は、特に限定されないが、通常、1時間〜3時間程度でよい。また、この際、MPCポリマーの溶液中の濃度は、特に限定されないが、通常、0.01〜1wt%、好ましくは、0.1〜0.3wt%程度である。
【0024】
本発明の装置では、特定の構造のリンカーを介して、上記選択結合性物質と特異的に結合するポリペプチドがマイクロ流路の内面に直接的又は間接的に共有結合により結合される。上記したMPCポリマーがマイクロ流路内面を被覆している場合には、リンカーは、MPCポリマーに共有結合する。
【0025】
本発明で用いられるリンカーは、上記一般式[I]で示される構造を有する。上記一般式[I]において、Aは親水性領域を示す。一般式[I]に示される通り、リンカーは、ベンゾフェノン構造を有する。ベンゾフェノンは化学や生物化学の分野で、光プローブとして広く使われてきた(例えば非特許文献4)。その理由として特筆すべき3つの化学的、生物化学的利点があげられる。1つめに、ベンゾフェノンは、同じく光反応性を有するジアゾエステルやアリルアジド、ジアジリンよりも化学的に安定であること、2つめに、タンパク質へのダメージをほとんど与えない波長領域(350〜360nm)の光で活性化されること、3つめに、溶媒としての水や多量の求核剤があっても選択的に未反応C-Hと反応することである。
【0026】
このように、ベンゾフェノンは、紫外線照射により、有機化合物中のC-H結合と反応して該有機化合物と結合する。すなわち、ベンゾフェノンは、紫外線を照射されると、ケトン部分にベンゾフェノンラジカル(三重項励起状態)が生じ、これが他の有機化合物中のC-H結合を攻撃してC-C結合を形成する。これにより、ベンゾフェノンが該有機化合物と共有結合する。従って、例えば、上記したMPCポリマーに本発明のリンカーを作用させ、紫外線を照射すると、リンカー中のベンゾフェノン部分が、MPCポリマー中のC-H結合と反応してリンカーがMPCポリマーに共有結合する。この反応には、紫外線照射が必要であるので、紫外線を照射した領域においてのみ、上記結合反応が起き、紫外線を照射しなかった領域では上記反応が起きず、リンカーはMPCポリマーに結合しない。従って、紫外線を選択的に照射することにより、任意の部位にのみリンカーを結合することができ、ひいては、その任意の部位にのみ、抗体等のポリペプチドを結合することができる。紫外線の選択的照射は、半導体装置の製造分野で汎用されている、フォトリソグラフィーの際の選択露光の技術を利用することができ、紫外線を照射したい部分のみ紫外線を通すフォトマスクを用いて容易に行うことができる。本発明のリンカーをMPCポリマーに結合する場合、特に限定されないが、紫外線の波長は、好ましくは、350nm〜380nm程度、強度は、通常、100 mW/cm2〜200mW/cm2であり、照射時間は、通常、15秒〜300秒、好ましくは、150秒〜250秒程度である。選択露光する領域は、任意に設定可能であり、例えば、マイクロ流路内の、長さ100μm〜400μm程度の領域の全面を露光することができる。
【0027】
一般式[I]中、Aは、親水性領域であり、リンカーの水に対する溶解性を高める機能を有する。親水性領域は、酸素原子や窒素原子のような、炭素原子よりも電気陰性度の大きな原子を構造中に含むことにより、同じサイズのアルキル基よりも水に対する溶解性の高いものであり、好ましくは、構造中の炭素原子の個数に対する酸素原子及び窒素原子の数の割合が、30%〜60%程度のものである。好ましい具体例として、ポリエチレングリコール及びポリプロピレングリコールから主として構成されるものを挙げることができ、特にポリエチレングリコールから主として成るものが好ましい。ポリエチレングリコールは、医薬化合物の生体内安定性を高めるために広く用いられており、生体物質と不所望の反応を行わないことがわかっており、この点からも好ましい。ポリエチレングリコール等は、ベンゾフェノン構造に直接結合されていてもよいが、アミド結合のような親水性の結合により結合されていてもよい。下記実施例において作製した、好ましいリンカーの構造を下記一般式[II]に示す。
【0028】
【化4】

【0029】
(式[II]中、nは8〜20の数を示す)
【0030】
一般式[I]中の末端のカルボキシル基は、固定化すべき抗体等のポリペプチドの遊離のアミノ基との結合に供するものである。カルボキシル基と、ポリペプチドの遊離のアミノ基との結合方法自体は周知であり、N-ヒドロキシコハク酸イミド(NHS)と1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC)を用いる常法により行うことができる。この方法自体は、周知であり、下記実施例にも具体的に記載されている。
【0031】
上記したリンカーは、例えば、Fmocでアミノ基を保護したFmoc-PEG-COOH(PEGはポリエチレングリコール)を、樹脂ビーズに固定化したトリチルクロライドと反応させて固相化し、次いで、Fmoc基をはずし、これを4-ベンゾイル安息香酸と反応させることにより合成することができる。すなわち、下記の反応スキームにより合成することができる。なお、下記の反応スキームには、下記実施例で合成した、上記一般式[II](nは12)で表されるリンカーが例示されている。なお、下記の反応スキームにおいて、右端の丸いものは、樹脂ビーズを表す。
【0032】
(1) 樹脂固定化トリチルクロライドとFmoc-PEG11-COOH を結合させる。
【0033】
【化5】

【0034】
(2) Fmoc 基を外し(脱保護)、4-ベンゾイル安息香酸と脱水縮合させる。
【0035】
【化6】

【0036】
最後に、樹脂固定化トリチルクロライドを加水分解により除去し、遊離のカルボキシル基とすることにより、一般式[II](n=12)で表されるリンカーを得る。
【0037】
上記した反応スキームは、有機化学合成の常識に従って行うことができ、下記実施例にも具体的に記載されている。
【0038】
なお、上記から明らかなように、上記したリンカーは、ポリペプチド固定化剤として機能しているものであり、本発明は、上記したリンカーであるポリペプチド固定化剤をも提供するものである。
【0039】
本発明の装置は、好ましくは、マイクロ流路の内面に上記のとおりMPCをポリマーを共有結合させ、これに上記したリンカーを、マイクロ流路中の所望の特定部位に、フォトマスクを用いたフォトリソグラフィーの手法により選択的に共有結合させ、次にこれを、上記の通り、固定化すべき抗体のようなポリペプチドと反応させて共有結合することにより製造することができる。具体的な条件は、下記実施例に詳細に記載されている。
【0040】
測定すべき選択的結合性物質を含む試料をマイクロ流路の上流から流し、上記ポリペプチドが固定化された部位で抗原抗体反応のような選択的結合反応を行わせ、その結果を測定することにより、試料中の選択的結合性物質を測定することができる。なお、「測定」には、検出、定量及び半定量のいずれも包含される。選択的結合性物質の測定自体は、公知の方法により行うことができる。例えば、選択的結合性物質が抗原の場合、該抗原をマイクロ流路上に固定化された対応抗体と抗原抗体反応させ、洗浄後、マイクロ流路に固定化された抗原を、蛍光標識した第2抗体と抗原抗体反応させ、洗浄後、蛍光標識を蛍光顕微鏡で観察し、蛍光強度を測定することにより行うことができる(サンドイッチイムノアッセイ)。また、第2抗体が酵素標識されている場合には、該酵素の基質をマイクロ流路に流して反応させ、比色定量することにより行うことができる。マイクロ流路内の比色定量は、熱レンズ顕微鏡(TLM)を用いて行うことができる。熱レンズ顕微鏡は、励起光、プローブ光と呼ばれる2本のレーザー光をマイクロ流路内の物質に照射し、レーザーの照射により生じる液の屈折率の変化(屈折率は液の温度により変化する)を、励起光を変調させてプローブ光の光量変化を同期検出する装置であり、マイクロ流路内の物質を高感度で定量できるものである。熱レンズ顕微鏡は、既に市販されている(マイクロ化学技研株式会社)ので、市販品を好ましく用いることができる。
【0041】
サンドイッチイムノアッセイにより試料中の抗原を測定する場合、固定化抗体と抗原との反応条件は、例えば、室温下で試料を10分間〜60分間静置反応させることにより行うことができる。第2抗体との反応は、例えば濃度100 ng/ml〜1 mg/mlで第2抗体を含む第2抗体溶液を、10分間〜60分間静置反応することにより行うことができる。
【0042】
測定に供される試料は、特に限定されず、測定すべき選択結合性物質を含んでいる可能性がある試料であれば、何ら限定されるものではないが、本発明の装置はマイクロ流路を利用しているので、単一細胞由来の物質の測定に利用可能である。すなわち、マイクロ流路の上流に、単一細胞を収容し、その上流から、生理緩衝液を流し、流れて来た液を試料として上記の通り測定を行うことにより、単一細胞に由来する任意の選択結合性物質を測定することができる。
【0043】
単一細胞に由来する任意の選択結合性物質の例としては、ホルモン、サイトカイン等を例示することができるが、これらに限定されるものではない。また、本発明の装置を用いる場合、必要な試料の量が微量でよいので、これまでにイムノアッセイで分析されている、血液(血清や血漿等)、尿、組織液、ぬぐい液等の体液中の種々の選択結合性物質の測定に用いた場合にも、しばしば貴重である生体試料の使用量が微量ですむという効果がもたらされる。
【0044】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0045】
1. リンカーの合成
上記した反応スキームに従い、上記一般式[II](n=12)で示されるリンカーを合成した。具体的には次のようにして行った。
【0046】
(1) 樹脂ビーズ固定化トリチルクロライド(Resin)とカルボン酸の結合
ガラス秤量瓶をDCM(ジクロロメタン)で洗い、乾燥した。トリチルクロライドResin(ポリスチレンビーズ、メッシュサイズ100-200、ローディング量1.48 mM/g)を104 mg(0.15mM)量り取り容器に加えた。秤量瓶に150 mg(0.18mM)のFmoc-PEG11-COOH(M.W. 839.9)を量り取り、DCM で溶かした。すぐにFmoc-PEG11-COOH に対して4 モル等量のDIEA(N,N-ジイソプロピルエチルアミン)を加えた。Resin を加えた容器に注ぎ、秤量瓶をDCMで洗い、洗浄液も容器に注いだ。1 分間Resin の入った容器を激しく振った後、ロータリーシェーカーの上において6.5 時間攪拌した。その後Resin をDCM/MeOH/DIEA(17:2:1)混合液で3 回, DCMで3回、DMFで3回、DCMで2回洗った。Fmoc 基の脱保護20% piperidine のDMF 溶液を10 ml 用意した。3 ml とって容器に入れ1〜2 分間激しく振った。それをもう一度やり、その後ロータリーシェーカーの上に20分間置いた。
【0047】
(2) 脱水縮合によるアミド結合
4-ベンジル安息香酸(BP-COOH)を113.2 mg(500μM)とった。それとは別の容器にHBTU を189.4 mg(500μM)、HBTUを67.0 mg(500μM)量り取り、DMF(N,N-ジメチルフォルムアミド)で溶かした。その溶液をBP-COOH に加え、さらにResin に加えた。174μL(1 mM)DIEA を加え、激しく振ったのち20 分間ロータリーシェーカーの上で攪拌した。EtOH, DMF, DCM+5%DIEA, DMF, DCMで3回洗浄した。
【0048】
(3) ニンヒドリン反応によるテスト
アミド結合生成反応が十分進行したかどうかをニンヒドリン反応によってチェックした。もし青くなった(アミノ基が残っている)ならば、もう一度アミドカップリング反応を行う。今回は青くならなかったので先へ進んだ。
【0049】
(4) Resin からの切り離し
10%TFA のDCM 溶液を10 ml 調製した。3 ml を加え、5 分間待った(溶液は赤色)。これを3 回繰り返した。溶液をロータリーエバポレーター用ナスフラスコに移した。反応に用いた容器をエタノールでよく洗って、洗浄液もナスフラスコに移した。ナスフラスコ内の気体をアルゴンガスで置換したのち、30〜40分間ロータリーエバポレーターにかけて溶媒を蒸発させた。残滓はやや茶色がかった黄色であった。残滓をイオン交換水1 ml により溶かし、マイクロチューブに分取した。ナスフラスコ内の洗浄液もマイクロチューブに移した。HPLC で精製するが、時間がかかるので-80℃の冷凍庫に保存し、数本ずつ精製を行った。
【0050】
HPLC による精製
得られた粗製リンカーのチューブに20%アセトニトリル+80%水(1%TFA 添加)溶液を加え、高速液体クロマトグラフィー装置(日本分光株式会社)によって精製した。逆相クロマトグラフィーによりグラジエント溶出法を用い、37%アセトニトリルでリンカーが溶出した。溶出液をファルコンチューブに集め、マイクロチューブに分取し、低温トラップと組み合わせた遠心濃縮機(TAITEC)により不要な溶媒を除去した。最終的にリンカーが0.5〜1.0 mg /チューブになるようマイクロチューブに分取し、精製したリンカーは-4℃の冷凍庫に保存した。
【0051】
2.MPCポリマーによる表面修飾
マイクロ流路は、ガラス基板上に設けられた幅500μm、深さ60μm、長さ6cmの、断面形状が半楕円形の溝であり、上部をガラス基板で被覆して密閉した。このマイクロ流路の内面にMPCポリマー(上記したPMSi90)を被覆した。これは具体的に次のようにして行った。マイクロ流路表面に均一にコーティングを行うため、まずマイクロ流路内の洗浄を行った。シリンジポンプで0.1 M水酸化ナトリウム水溶液を流速40μL/min で60分間、エタノールを40μL/min で15分間流した後、エタノール中で超音波洗浄を5 分間行った。次にポリマー溶液の導入を行った。エタノールを溶媒とした0.2wt%(重量パーセント)のPMSi90を1 ml、こはく酸を100μLバイアル瓶に取り混合したのち、混合溶液を0.5 ml/minで2時間マイクロ流路内に流した。その後40μL/min で15分間マイクロ流路内をエタノールで洗浄し、不要な溶媒等を完全にとばすために電気炉を用いて70℃で4時間保持した。代替として、2時間真空乾燥を行ってもよい。次の操作を行う前に、マイクロ流路を水で2時間以上浸漬放置しMPCポリマーを平衡状態に保ち、ポリマーの機能が十分発揮されている環境のもとで実験を行った。
【0052】
3. フォトリソグラフィーによるリンカーの結合
上記1で調製したリンカーを、フォトリソグラフィーの手法により、選択的にMPCポリマーに結合させた。具体的には次のようにして行った。リンカーを30mg/mLの濃度でイオン交換水に溶解し、その4μL(マイクロ流路の体積よりも多い)をマイクロ流路の入口に垂らし、毛管力によりリンカー溶液をマイクロ流路内に導入した。マイクロ流路両端の開放口からの蒸発や溶液漏れを防ぐため、テープで開放口をふさいだ。実験以外の紫外光によるバックグラウンドの増加を防ぐため、チップをアルミホイルで包んだ。すぐにクリーンルームへと移動し、UV 照射を行った。UV 照射を行うための装置としては、マスクアライナー(マスクアライメント装置MA10 型、ミカサ)、UV 発生装置(スポットUV 照射装置SP-9、ウシオ電機)、紫外光を導くための光ファイバーを用いた。石英ガラスにOHPマスクを貼り付け、マスクアライナーにセットした。マスクアライナーは顕微鏡により観察対象を拡大しながらマスクを動かして位置合わせが行える装置である。マスクアライナーを用いてOHP マスクとチップの位置合わせを行うことで、修飾したい場所を正確に決めることができる。UV発生装置により発生するUVは光ファイバーによってマスクアライナーまで導かれている。マスクアライナーにはプリズムがセットされており、プリズムによってUV が曲がり、チップに対して真上からUV が照射されるようになっている。装置によって発生するUV の波長は365 nm、強度は250 mW/cm2で、光ファイバー出口からマイクロ流路チップまでの距離(約4cm)によって強度は減衰し、100 mW/cm2となる。これは紫外線積算光量計UIT-250(ウシオ電機)で強度を測定して確認した。この装置を用い、単一のマイクロ流路内の6箇所(各200μmの長さの領域)を4分間選択露光した。
【0053】
4. カルボキシル基の活性化
1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸(略称EDC、東京化成工業株式会社)を114.8 mg、N-ヒドロキシこはく酸イミド(略称NHS、和光純薬工業株式会社)を114.8 mg、MES、緩衝液(商品名low moisture content、シグマアルドリッチジャパン株式会社)を195.2 mg 電子天秤で秤量し、2mlの水で溶かし、溶液を40μL/minで7分間流した。その後、イオン交換水を40μL/min で3分間流して洗浄した。
【0054】
5. 抗BSA抗体の固定化
次に、抗BSA抗体を結合した。すなわち、4μLの濃度約1.6mg/mLの市販の抗BSA抗体の溶液をマイクロ流路内に導入し、一時間待ち反応を完了させた。マイクロ流路をTris buffered saline, TBS(Tween 20(商品名)添加)によって洗浄し、未反応活性エステルをブロックした(Tris base はアミノ基を持っているため、活性エステルと結合する)。次に、濃度100μg/mlの蛍光(テキサスレッド(商品名))標識BSA をマイクロ流路に導入し、1 時間待って抗体抗原反応を完了させた。その後TBSでマイクロ流路を洗浄した。マイクロ流路を蛍光顕微鏡で観察し、露光時間300ミリ秒で蛍光観察画像を撮影した。
【0055】
比較のため、抗BSA抗体溶液を反応させることなく、蛍光標識BSAを反応させ、同様に蛍光顕微鏡で観察し、蛍光観察画像を撮影し、蛍光強度を測定した。
【0056】
結果を図1に示す。図1中、領域Aは、選択露光した領域、領域Bは、同じマイクロ流路内で選択露光しなかった領域の蛍光観察画像であり、Cは、抗BSA抗体を結合しなかった比較実験の蛍光観察画像である。また、A、B、Cの領域で観察された蛍光強度を図2に示す。
【0057】
図1及び図2に示されるように、選択露光した領域Aでは、選択露光しなかった領域Bや、抗BSA抗体を固定化しなかった別のマイクロ流路内の領域Cよりも蛍光強度が大きく、抗BSA抗体が選択的に結合されたことが確認された。
【特許請求の範囲】
【請求項1】
マイクロ流路内の所望の部位にリンカー構造を介して共有結合によりポリペプチドが結合されて成る選択結合性物質測定装置であって、前記ポリペプチドが、いずれかの生体由来物質と選択的に結合し得るポリペプチドであり、前記リンカーが下記一般式[I]:
【化1】

(式[I]中、Aは親水性領域を示し、末端のカルボキシル基は、前記ポリペプチド中のアミノ基とのアミド結合に供され、ベンゾフェノン部分が直接的又は間接的にマイクロ流路との結合に供される)
で示される構造を有する、選択結合性物質測定装置。
【請求項2】
前記リンカーが、下記一般式[II]:
【化2】

(式[II]中、nは8〜20の数を示す)
で表される請求項1記載の選択結合性物質測定装置。
【請求項3】
前記ポリペプチドが抗体又は抗原であり、前記選択結合性物質が、該抗体又は抗原と抗原抗体反応する抗原又は抗体であり、前記選択結合性物質測定装置が、イムノアッセイ装置である請求項1又は2記載の装置。
【請求項4】
前記マイクロ流路の内面に、C-H結合を含む有機ブロッキング剤が共有結合され、前記リンカーは、該有機ブロッキング剤と共有結合している請求項1ないし3のいずれか1項に記載の装置。
【請求項5】
前記有機ブロッキング剤がMPCポリマーである請求項4記載の装置。
【請求項6】
前記マイクロ流路内に、単一の細胞が保持され、前記選択結合性物質が、該細胞に由来する物質である請求項1ないし5のいずれか1項に記載の装置。
【請求項7】
下記一般式[I]:
【化3】

(式[I]中、Aは親水性領域を示す)
で示される、ポリペプチド固定化剤。
【請求項8】
前記リンカーが、下記一般式[II]:
【化4】

(式[II]中、nは8〜20の数を示す)
で表される請求項7記載の固定化剤。
【請求項1】
マイクロ流路内の所望の部位にリンカー構造を介して共有結合によりポリペプチドが結合されて成る選択結合性物質測定装置であって、前記ポリペプチドが、いずれかの生体由来物質と選択的に結合し得るポリペプチドであり、前記リンカーが下記一般式[I]:
【化1】

(式[I]中、Aは親水性領域を示し、末端のカルボキシル基は、前記ポリペプチド中のアミノ基とのアミド結合に供され、ベンゾフェノン部分が直接的又は間接的にマイクロ流路との結合に供される)
で示される構造を有する、選択結合性物質測定装置。
【請求項2】
前記リンカーが、下記一般式[II]:
【化2】

(式[II]中、nは8〜20の数を示す)
で表される請求項1記載の選択結合性物質測定装置。
【請求項3】
前記ポリペプチドが抗体又は抗原であり、前記選択結合性物質が、該抗体又は抗原と抗原抗体反応する抗原又は抗体であり、前記選択結合性物質測定装置が、イムノアッセイ装置である請求項1又は2記載の装置。
【請求項4】
前記マイクロ流路の内面に、C-H結合を含む有機ブロッキング剤が共有結合され、前記リンカーは、該有機ブロッキング剤と共有結合している請求項1ないし3のいずれか1項に記載の装置。
【請求項5】
前記有機ブロッキング剤がMPCポリマーである請求項4記載の装置。
【請求項6】
前記マイクロ流路内に、単一の細胞が保持され、前記選択結合性物質が、該細胞に由来する物質である請求項1ないし5のいずれか1項に記載の装置。
【請求項7】
下記一般式[I]:
【化3】

(式[I]中、Aは親水性領域を示す)
で示される、ポリペプチド固定化剤。
【請求項8】
前記リンカーが、下記一般式[II]:
【化4】

(式[II]中、nは8〜20の数を示す)
で表される請求項7記載の固定化剤。
【図2】


【図1】




【図1】


【公開番号】特開2010−237086(P2010−237086A)
【公開日】平成22年10月21日(2010.10.21)
【国際特許分類】
【出願番号】特願2009−86439(P2009−86439)
【出願日】平成21年3月31日(2009.3.31)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(502100415)マイクロ化学技研株式会社 (8)
【公開日】平成22年10月21日(2010.10.21)
【国際特許分類】
【出願日】平成21年3月31日(2009.3.31)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(502100415)マイクロ化学技研株式会社 (8)
[ Back to top ]

