酸化窒素治療及び医生物的応用のための酸化窒素放出粒子
本出願で開示の対象は、酸化窒素を送達するための酸化窒素放出粒子、及びその医生物学的及び薬学的応用におけるこれらの使用に関する。
【発明の詳細な説明】
【技術分野】
【0001】
この発明は、2005年5月27日出願の米国特許仮出願60/685,578の恩恵を主張するものであり、当該出願の開示は引用することにより本明細書に組み込まれているものとする。
本出願で開示の対象は、酸化窒素放出粒子、及び医生物学的及び薬学的応用におけるこれらの使用を提供する。より具体的には、幾つかの実施態様において、本出願で開示した対象物は、制御され、標的を定めた方法で酸化窒素を放出する粒子を提供し、それにより、酸化窒素の治療効果を持続させ、標的細胞及び/又は標的組織への酸化窒素運搬の特異性を改善する。
本発明は国立保健研究所補助金番号ED000708からの助成を、米国政府から得た。従って、米国政府は、本発明の特定の権利を有する。
【背景技術】
【0002】
酸化窒素(NO)の生物学、生理学、及び病理生理学での多面的な役割(Marletta,M.A..,他、Biofactors,2,219-225(1990)を参照のこと)の発見により、制御された酸化窒素放出が可能な酸化窒素供与体の探索(Keefer,L.K.,Chemtech,28,30-35(1998)を参照のこと)が始められた。今日までに、研究者等は、NOは心血管、胃腸、性尿器、呼吸器、及び中心及び末梢神経系におけるある範囲の生物過程を制御するということを発見した(Ignarro,L.J.,Nitric Oxide:Biology and Pathobiology;Academic Press:San Diego,2000;及びIgnarro,L.J.他、Proc.Natl.Acad.Sci.,U.S.A.、84,9265-9269(1987)を参照のこと)。さらに、NOの血管拡張薬としての発見、及び抗生物質及び殺腫瘍性因子としての同定により、NOは魅力的な医薬品の候補になった。例えば、Radomski,M.W.,他, Br.J.Pharmacol.,92,639-646(1987);Albina,J.E.,及びReichner,J.S.; Canc.Metas.Rev.,17,19-53(1998);Nablo,B.J.,他,J. Am.Chem.Soc.,123,9712-9713 2001);Cobbs,C.S.,他,CancerRes.,55,727-730(1955);Jenkins,D.C.,他、Proc.Natl.Acad.Sci.,U.S.A.,92,4392-4396(1955);及びThomsen,L.L.,他、Br.J.Cancer.,72、41-44(1955)を参照のこと。
幾つかの酸化窒素供与体が報告されており、最も有名な供与体はN−ジアゼニウムジオレイン酸塩である。一般的に、N−ジアゼニウムジオレイン酸塩NO供与体は、高圧下でアミンとNOを反応させて合成した小分子であり、また例えば、水溶液中で、自然にNOを発生させるために用いられてきた。Hrabie,J.A.及びKeefer,L.K.,Chem.Rev.,102,1135-1154(2002)を参照のこと。
【発明の開示】
【発明が解決しようとする課題】
【0003】
酸化窒素供与体の活性を検討する、例えば腫瘍細胞を殺す、治療上の戦術は、本技術分野で知られる酸化窒素輸送系が、無差別に酸化窒素を放出又は供与するので、幾分問題を抱えている。従って、酸化窒素輸送系についての技術分野において、酸化窒素の放出又は供与を制御された、及び/又は標的を定めた方法で行い、生理学におけるNOの機能についての向上した理解を促進し、NO関連の治療の開発を提供することが要求されている。
【課題を解決するための手段】
【0004】
幾つかの実施態様において、本発明は、酸化窒素供与体、外部領域、及び一定容積を持つ内部領域であって、少なくともその部分が、
(i)金属クラスター、
(ii)樹木状ネットワーク、
(iii)共凝縮したシリカネットワーク、及び
(iv)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域からなる酸化窒素(NO)放出粒子である。
【0005】
幾つかの実施態様において、前記内部領域は、更に、pH変化に応答する脆弱性リンカー(連結基)、電磁放射に敏感な脆弱性リンカー、酵素作用による分解を受けやすい脆弱性リンカー、疎水性リンカー、両親媒性リンカー、及びこれらの組合せから成る群から選択される有機リンカーを含む。
幾つかの実施態様において、前記NO供与体は、ジアゼニウムジオレイン酸塩、ニトロソアミン、ヒドロキシルニトロソアミン、ニトロソチオール、ヒドロキシルアミン、ヒドロキシウレア、及びこれらの組合せからなる群から選択される。
幾つかの実施態様において、前記NO供与体は、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つに共有結合で結合する。幾つかの実施態様において、前記NO供与体は、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つに封じ込められる。幾つかの実施態様において、前記NO供与体が、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つと、ファンデルワールス相互作用、静電気的相互作用、水素結合、及びこれらの組合せからなる群から選択される非共有結合的相互作用により結合する。
【0006】
幾つかの実施態様において、前記外部領域は、NO放出動特性を修飾する部分、粒子の生体許容性に影響する部分、粒子の生体内分布に影響する部分、粒子の標的への運搬に寄与する部分、粒子の画像又は追跡に寄与する部分、粒子の溶解性に影響する部分、治療薬剤、及びこれらの組合せ、からなる群から選択される1又は2以上の化学部分を含む。
幾つかの実施態様において、前記コアは、金属クラスターであり、この金属クラスターが、金、白金、銀、磁性体、量子ドット、及びこれらの組合せから選択される成分構成材料を含む。幾つかの実施態様において、前記金属クラスターは、単層で保護した金クラスターである。
幾つかの実施態様において、前記コアは、樹木状ネットワークであり、この樹木状ネットワークは、ポリプロピレニミンデンドリマー、ポリアミドアミン(PAMAM)デンドリマー、ポリアリールエーテルデンドリマー、ポリペプチドデンドリマー、ポリエステルデンドリマー、ポリアミドデンドリマー、樹木状ポリグリセロール、及びトリアジンデンドリマーからなる群から選択される。幾つかの実施態様において、前記樹木状ネットワークは、超分枝状である。
【0007】
幾つかの実施態様において、前記コアは、共凝縮したシリカネットワークからなり、この共凝縮したシリカネットワークが、アルコキシシラン及びアミノアルコキシシランからなるシラン混合物の凝縮により合成されたものである。幾つかの実施態様において、前記アルコキシシランは、化学式Si(OR)4(式中、Rはアルキル基を表す。)で表されるテトラアルコキシシランから成り、
前記アミノアルコキシシランが、
(a)化学式 R’’−(NH−R’)n−Si(OR)3(式中、Rはアルキル基、R’はアルキレン基、分枝アルキレン基、又はアラルキレン基、nは1又は2、R’’はアルキル基、シクロアルキル基、アリール基及びアルキルアミンから成る群から選択される。)で表されるアミノアルコキシシラン、
(b)化学式 NH[R’−Si(OR)3]2(式中、Rはアルキル基、R’はアルキレン基を表す。)で表されるアミノアルコキシシラン、
(c)化学式 R’’−N(NONO−X+)−R’−Si(OR)3(式中、Rはアルキル基、R’はアルキレン基又はアラルキレン基、R’’はアルキル基又はアルキルアミン基を表し、X+はNa+及びK+からなる群から選択されるカチオンを表す。)で表される、アミン基がジアゼニウムジオレイン酸塩で置換されたアミノアルコキシシラン、及び
(d)これらの組合せ、
から成る群から選択される。
【0008】
幾つかの実施態様において、前記シラン混合物は、約10モル%〜約99モル%の前記テトラアルコキシシラン、及び約1モル%〜約90モル%の前記アミノアルコキシシランから成る。幾つかの実施態様において、前記シラン混合物は、更に約0モル%〜約20モル%のフッ素化シラン、約0モル%〜約20モル%のカチオン性又はアニオン性シラン、及び約0モル%〜約20モル%のアルキルシランを含む。
幾つかの実施態様において、前記テトラアルコキシシランは、テトラメチルオルソケイ酸塩及びテトラエチルオルソケイ酸塩からなる群から選択される。
幾つかの実施態様において、前記アミノアルコキシシランが、N−(6−アミノヘキシル)アミノメチルトリメトキシシラン、N−(6−アミノヘキシル)アミノプロピルトリメトキシシラン、N−(6−アミノエチル)アミノプロピルトリメトキシシラン、(3−トリメトキシシリルプロピル)ジエチレントリアミン、(アミノエチルアミノメチル)フェネチルトリメトキシシラン、[3−(メチルアミノ)プロピル]トリメトキシシラン、N−ブチルアミノプロピルトリメトキシシラン、N−エチルアミノイソブチルトリメトキシシラン、N−フェニルアミノプロピルトリメトキシシラン、N−シクロヘキシルアミノプロピルトリメトキシシラン、ビス[3−(トリメトキシシリル)プロピル]アミン、及びビス[3−(トリメトキシシリル)プロピル]エチレンジアミンからなる群から選択される。
【0009】
幾つかの実施態様において、前記フッ素化シランは、(ヘプタデカフルオロ−1,1,2,2−テトラヒドロデシル)トリエトキシシラン、(3,3,3−トリフルオロプロピル)トリメトキシシラン及び(ペルフルオロアルキル)エチルトリエトキシシランからなる群から選択される。
幾つかの実施態様において、前記カチオン性又はアニオン性シランは、N−N−ジデシル−N−メチル−N−(3−トリメトキシシリル)アンモニウムクロライド、オクタデシルジメチル−(3−トリメトキシシリルプロピル)アンモニウムクロライド、3−トリヒドロキシシリルプロピルメチルホスホン酸ナトリウム塩及びカルボキシルエチルシラントリオールナトリウム塩からなる群から選択される。
幾つかの実施態様において、前記アルキルシランは、メチルトリメトキシシラン、ブチルトリメトキシシラン、ブチルトリエトキシシラン、プロピルトリメトキシシラン及びオクタデシルトリメトキシシランからなる群から選択される。
【0010】
幾つかの実施態様において、共凝縮したシリカネットワークコア及びNO供与体を含むNO放出粒子は、NO供与体がシリカネットワークの凝縮後に作られる"ポストチャージ法"を用いて形成される。また幾つかの実施態様において、共凝縮シリカネットワークコアを含むNO放出粒子は、NO供与体がシリカネットワークの凝縮前に作られる"プレチャージ法"を用いて形成される。
幾つかの実施態様において、前記有機リンカーは、前記酸化窒素放出粒子に酸化窒素放出のオン/オフ状態を与えることができる官能基を含み、該官能基が、エステル、ヒドラゾン、アセタール、チオプロピオネート、光脆弱性部分、及び酵素分解されるアミノ酸配列からなる群から選択される。
幾つかの実施態様において、前記外部領域は、酸化窒素放出粒子を標的に運搬することができる部分を含む。幾つかの実施態様において、前記標的は、細胞、組織及び器官からなる群から選択される。幾つかの実施態様において、前記細胞は、癌細胞である。
幾つかの実施態様において、前記酸化窒素放出粒子を標的に運搬することができる部分は、抗体/抗原相互作用の原因となるタンパク質、葉酸、グアニジン、トランスフェリン、ホルモン、炭化水素、アミノ酸配列RGDを含むペプチド及びTATペプチドからなる群から選択される。
【0011】
幾つかの実施態様において、前記外部領域は、酸化窒素供与体、(ポリ)エチレンオキシド、(ポリ)ウレタン、N−(2−ヒドロキシプロピル)メタクリルアミドコ高分子、ラクチド/グリコリドコ高分子(例えば、PLGA)、砂糖、蛍光部分、有機染料、MRIコントラスト試薬、チオール、メチル基末端のアルキル鎖、抗菌剤、抗腫瘍治療薬、スルホン酸塩、カルボン酸塩、リン酸塩、カチオン性アミン基、第4級アミン基、及びこれらの組み合わせからなる群から選択される部分を含む。
幾つかの実施態様において、前記粒子の直径は、約1nm〜約1000nmである。幾つかの実施態様において、前記粒子の直径は、約1nm〜約5nmである。幾つかの実施態様において、前記粒子の直径は、約2nm〜約10μmである。
【0012】
幾つかの実施態様において、本発明は、NOを患者に投与するための方法、又は配合を提供する。幾つかの実施態様において、該方法は、有効量のNO放出粒子を患者に投与することからなる方法であり、該粒子は、NO供与体、外部領域、及び一定容積を持つ内部領域からなり、該内部領域は、少なくともその部分が、
(a)金属クラスター、
(b)樹木状ネットワーク、
(c)共凝縮したシリカネットワーク、及び
(d)これらの組合せ、
から成る群から選択されるコアにより満たされる。
幾つかの実施態様において、本発明は、疾患の治療が必要な患者の疾患状態を治療する方法を提供するものであり、この方法は、治療の必要な患者に、NO供与体、外部領域、及び一定容積を持つ内部領域であって、少なくともその部分が、
(a)金属クラスター、
(b)樹木状ネットワーク、
(c)共凝縮したシリカネットワーク、及び
(d)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域からなるNO放出粒子を投与する。
【0013】
幾つかの実施態様において、疾患状態は、癌、心臓血管疾患、微生物感染、血液を医学的デバイスに曝すことにより引き起こされる血小板凝集と血小板接着、細胞異常増殖に起因する病理学的状態、移植拒絶、自己免疫疾患、炎症、血管疾患、瘢痕組織、創傷の収縮、再発狭窄症、痛み、発熱、胃腸疾患、呼吸器疾患、性機能障害、及び性感染症からなる群から選択される。
幾つかの実施態様において、本発明は、NO放出粒子を含む高分子フィルムを提供する。幾つかの実施態様において、高分子フィルムは医学的デバイスを被覆するために用いることができる。幾つかの実施態様において、この医学的デバイスは、動脈ステント、ガイドワイア、カテーテル、トロカール針、骨アンカー、骨ネジ、保護板、股関節又は関節置換、導線、生体センサー、探索子、縫合線、外科的ドレープ、外傷用着衣、及び包帯の中の一つである。
【0014】
幾つかの実施態様において、本発明は、NO放出粒子を含む洗浄剤を提供する。
従って、本発明の目的は、NO放出粒子を提供することである。本発明の他の目的は、特異的細胞及び/又は特異的組織が標的となるようにNO放出粒子を運搬するためのNO放出粒子を提供することである。本発明の更に他の目的は、NO放出粒子からNOの放出を誘導する能力を提供することである。
本発明により全体的又は部分的に扱われ、上記のように本明細書に記載された本出願に開示された対象物の特定の目的、他の目的及び側面は、本明細書で以下に記載するように、添付した実施例と関係して取り上げられた時、記載が進むにつれて明らかとなるであろう。
【発明を実施するための最良の形態】
【0015】
本明細書では以下の略号を用いる:AFM:原子間力顕微鏡;AEAP3:N−(6−アミノメチル)−アミノプロピルトリメトキシシラン;AEMP3:(アミノエチルアミノメチル)−フェネチルトリメトキシシラン;AHAP3:N−(6−アミノヘキシル)−アミノプロピルトリメトキシシラン;AiBN:α,α’−アゾビスイソブチロニトリル;atm:大気圧;BSA:ウシ血清アルブミン;℃:摂氏温度;CFU:コロニー形成率;CP/MAS:交差分極/マジックアングルスピニング;CTAB:セチルトリメチルアンモニウム臭化物;DET3:N−[3−(トリメトキシシリル)プロピル]−ジエチレントリアミン;EtOH:エタノール;FA:葉酸;FITC:フルオレッセインイソチオシアナート;g:グラム;GOx:グルコースオキシダーゼ;h:時間;HPU:親水性ポリウレタン;MAP3:メチルアミノプロピルトリメトキシシラン;MeOH:メタノール;mg:マイクログラム;μm:マイクロメーター;min:分;mL:ミリリットル;mol%:モル%;MPC:単層保護クラスター;MRI:磁気共鳴画像法;MTMOS:メチルトリメトキシシラン;nA:ナノアンペア;NaOMe:ナトリウムメトキシド;nm:ナノメートル;NMR:核磁気共鳴法;NO:酸化窒素(=一酸化窒素);[NO]m:酸化窒素最大放出量;O3:オゾン;OD:吸光度;PAMAM:ポリアミドアミン;pmol:ピコモル;ppb:10億分の1;PPI:ポリプロピレンイミン;ppm:100万分の1;TPU:TECOFLEX(R)ポリウレタン;TEM:透過型電子顕微鏡;TEOS:テトラエチルオルソケイ酸塩;TGA:熱重量分析;TMOS:テトラメチルオルトケイ酸塩;TMRM:テトラメチルローダミン;t[NO]:酸化窒素全量;UV:紫外線;Vis:可視光
【0016】
付随する代表的実施態様を示す実施例を参照として、本出願で開示した対象物を本明細書により詳しく説明する。しかしながら、本出願で開示される対象物を異なる形で実施することができる、また本明細書に示された実施態様によって制限されると解釈すべきではない。むしろ、これらの実施態様は、この開示が充分で完全であり、また当業者に対して実施態様の適用範囲を充分に伝達するように、提供されている。
もし他に定義することがなければ、本明細書で用いた全ての技術的及び科学的用語は、本出願で記載する対象物が関わる、当業者の1人に共通に理解される意味と同じである。全ての刊行物、特許申請、及び本明細書に述べた、他の参考文献は、参照文献として全体が取り込まれている。
明細書及び、クレイムを通して、与えられた化学式又は命名は、全ての光学及び立体異性体、及びこの様な異性体及び混合物が存在するラセミ混合物を範囲内に収める。
【0017】
1.定義
長年にわたる特許法協定に従い、原文の"不定冠詞−ある""定冠詞−その"は、クレイムを含め本出願で用いられる場合、"1又は2以上"を意味する。
本明細書で用いる"両親媒性"という用語は、疎水性領域と親水性領域を持つ化学的成分に対して使われる。
本明細書で用いる"癌腫"という用語は、制御を外れた細胞分裂、及び細胞が転移する、又は他の部位で新しい成長を樹立する力によって引き起こされる疾患を表わす。"悪性"、"悪性腫瘍"、"新生物"、"腫瘍"及びこれらの変異物は、癌腫的な細胞又は癌腫細胞の群を表す。
癌腫の特別なタイプとしては、皮膚癌、結合組織癌、脂肪種、乳癌、肺癌、胃癌、膵臓癌、卵巣癌、子宮頸癌、子宮癌、肛門性器部癌、腎臓癌、膀胱癌、結腸癌、前立腺癌、中枢神経(CNS)癌、網膜癌、血液及びリンパ腫瘍等が挙げられるが、これらに制限されない。
本明細書で用いられるように、"電磁放射線"という用語は、ガンマ線、x線、紫外線、可視光線、赤外線、マイクロ波、レーダー及びラジオ波のような、電気及び磁気波を表すが、これらに限らない。
【0018】
"疎水性"という用語は、水素結合又は静電的相互作用のような非共有結合によって、ある程度まで水撥性、又は水と相互作用しない化学化合物又は化学的成分に対して使われる。ある化合物は強く疎水的であること、又は弱く疎水的であることができる。化合物又は基の計算による誘電率を、化合物又は化学的成分の疎水生成のレベル又は程度を予想するために用いることができる。より低い誘電率を有する化合物又は基は、より疎水性であろう。特に、"疎水性リンカー(連結基)"は、NO放出粒子が水性の環境に長時間おかれた時、NO放出粒子の中の易変性リンカー又はNO供与体を水への暴露から保護する。より疎水的なリンカーは、NO供与体又は易変性リンカーを長期にわたり水から保護する。
"親水性"という用語は、ある程度まで水と相互作用する化合物又は基に対して使われる。
"イオン化しうる"という用語は、特定の化学的環境(例えば、特定のpH)で電気的に中正である(即ち、無荷電である)が、他の化学的環境で(例えば、高い又は低いpHで)イオン化する、又は正又は負の荷電を持つ、基に対して使われる。
【0019】
本明細書で用いる用語"メソ多孔質"は、約20〜500Åの範囲の孔を持つ粒子のような物体を表す。
用語"金属製"は、金属、金属合金、金属塩、及び金属酸化物を表す。従って、金属製という用語は、金、銀、銅、白金、及びチタンのような金属イオンを含む粒子、だけではなく半導体粒子及び磁気性粒子(例えば、酸化鉄を含む粒子)を表すが、これらに制限されない。
"半導体ナノクリスタル"及び"量子ドット"という用語は、本明細書では互換的に使われ、発光性がある(即ち、励起により電磁放射線を放出できる)、無機結晶材料からなり、及び任意に第2の半導体材料の保護膜又は"シェル(殻)"内に含まれている、1又は2以上の第1の半導体材料の内部コア粒子を含む半導体ナノ粒子を表す。半導体のシェルに囲まれた半導体ナノクリスタルコアは、"コア/シェル"半導体ナノ粒子と呼ばれる。周囲のシェル材料は、任意に、コア材料のバンドギャップエネルギーより大きなバンドギャップエネルギーを持つことができて、またコア基質のものに近い原子間隔を持つよう選択されている。
【0020】
コア及び/又はシェルのために適切な半導体材料は、元素周期律表の2及び12族から選択された第1の元素、及び16族から選択された第2の元素を含む材料を含むが、これらに制限されない。この様な材料としては、ZnS,ZnSe,ZnTe,CDs,CdSe,CdTe,HgS,HgSe,HgTe,MgS,MgSe,MgTe,CaS,CaSe,CaTe,SrS,SrSe,SrTe,BaS,BaSe,BaTe,等々が挙げられるがこれらに制限されない。また、適切な半導体材料は元素周期律表13族から選択した第1元素、及び15族から選択した第2の元素を含む材料を含む。この様な材料としては、GaN,GaP,GaAs,GaSb,InN,InP,InAs,InSb,等々が挙げられるが、これらに制限されない。さらに、半導体材料は、(Ge,Si、等々)14族元素を含む材料;PbS,PbSe等々の材料;合金及びこれらの混合物を含む。本明細書で用いるように、元素及び族に番号付けするために、元素と族の周期律表に関する全ての参考文献は、Handbook of Chemistry and Physics,第81版、(CRC出版、2000)において示されたように、新IUPACシステムに従う。
【0021】
"ルミネッセンス(発光)"により、物体から電磁放射線(光)が放出される過程を意味する。系が励起状態から低いエネルギー状態に転移し、対応するエネルギーの放出が光子の形をとる時にルミネッセンスが生ずる。これらのエネルギー状態は、電子的、振動的、回転的、又はこれらのコンビネーションであり得る。ルミネッセンスの原因となる転移は、化学的に系に蓄えられた、又は外部の供給源から系に加えられた、エネルギーの放出を通して刺激される。エネルギーの外部供給源は、化学的、熱的、電気的、磁気的、電磁気的、及び物理的を含め様々なタイプ、又は系を基底状態より高いエネルギー状態に励起させる力のある他のタイプのエネルギー供給源であり得る。例えば、ある系は光の光子を吸収して、電場に置かれて、又は化学的酸化還元反応を通して、励起されうる。ルミネッセンスの間に放出される光子のエネルギーは、低エネルギーのマイクロ波領域から高エネルギーのX−線放射の範囲まであり得る。通常、ルミネッセンスはUVからIR放射の範囲の光子を表す。
"フルオレッセント(蛍光体)"という用語は、電磁放射に曝した後に光を発光する化合物又は化学基に対して使われる。
【0022】
"酸化窒素供与体"又は"NO供与体"という用語は、酸化窒素分子種を供与し、放出し、及び/又は直接又は間接的に移動させ、及び/又はインビボで内部での酸化窒素産生を刺激し、及び/又はインビボで酸化窒素の内部濃度を上昇させ、結果として意図した作用部位に酸化窒素分子種の生物活性が発現されるような、分子種を表す。
"酸化窒素放出性"又は"酸化窒素供与性"と言う用語は、一酸化窒素の3種のレドックス(酸化還元)型(NO+,NO−,NO)のいずれかを供与する、放出する、及び/又は直接又は間接的に移す方法を表す。幾つかの場合、酸化窒素放出性又は供与性により、意図した作用部位での一酸化窒素分子種の生物活性が発現される。
【0023】
本明細書で用いる"微生物感染"という用語は、バクテリア、カビ、ウィルス、及び酵母感染を表す。
本明細書で用いられる"約"という用語は、値又は集団の量、を表す場合、重量、時間、容積、又は 割合は、この様な変位が開示した方法を実行する上で適切であるように、±20%又は±10%、より好ましくは、±5%、さらにより好ましくは、±1%及び、さらに一段と好ましくは、±0.1%特定の値からの変位を包含する。
本明細書で開示した多くの実施態様における、"病人"又は"患者"は、好ましくはヒト患者であるが、本出願で開示した対象物の原理は、本出願で開示した対象物が、哺乳動物を含め、全ての脊椎動物種に対して有効であると理解すべきであり、 これらについては"病畜"又は"患畜(禽)"と言う用語に含まれていると理解すべきである。此の文脈において、哺乳動物は治療が望まれる全ての哺乳動物種を含むと理解すべきである。哺乳動物種としては、馬、雄牛、物、及びネコのような、農業及び家畜動物種がある。
【0024】
本明細書で用いられる用語"アルキル基"は、C1〜20を表し、線状(即ち、"直鎖")、分枝型、又は環状、飽和又は少なくとも部分的に及びある場合は完全に不飽和な(即ち、アルケニル基、及びアルキニル基)炭化水素鎖を含み、例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、tert−ブチル基、ペンチル基、ヘキシル基、オクチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、ヘキセニル基、オクテニル基、ブタジエニル基、プロピニル基、ブチニル基、ペンチニル基、ヘキシニル基、ヘプチニル基、及びアレニル基が含まれる。"分枝型"とは、メチル基、エチル基、又はプロピル基のような低級アルキル基が直鎖型アルキル鎖に付加したアルキル基を表す。分枝型アルキル基の例としては、イソプロピル基、イソブチル基、tert−ブチル基があるが、これらに制限されず、"低級アルキル基"は、1から約8個の炭素原子(即ち、C1〜8アルキル基)、例えば、1,2,3,4,5,6,7,又は8炭素原子を表す。"高級アルキル基"は約10個から20個の炭素原子、例えば10,11,12,13,14,15,16,17,18,19又は20個の炭素原子を有するアルキル基を表す。ある実施態様では、"アルキル基"は、特にC1〜8直鎖アルキル基を表す。他の実施態様において、"アルキル基"は、特にC1〜8分枝型アルキル基を表す。
【0025】
アルキル基は、任意に、同一又は異なる、1又は2以上のアルキル基置換基によって置換される("置換アルキル基")。用語"アルキル基置換基"は、アルキル基、置換アルキル基、ハロ基、アリールアミノ基、アシル基、水酸基、アリールオキシル基、アルコキシル基、アルキルチオ基、アリールチオ基、アラルキルオキシル基、アラルキルチオ基、カルボキシル基、アルコキシカルボニル基、オキソ基、及びシクロアルキル基が挙げられるが、これらに制限されない。任意に、アルキル鎖に沿って1又は2以上の酸素原子、イオウ原子又は置換又は非置換窒素原子を挿入することができ、ここで、窒素置換基は、水素原子、低級アルキル基(本明細書ではまた"アルキルアミノアルキル基と呼ぶ)又はアリール基である。
従って、本明細書で用いられるように、"置換アルキル基"は、本明細書で定義されたアルキル基を含み、ここで、アルキル基の1又は2個以上の原子又は官能基は、他の原子又は官能基で置換され、官能基としては、例えば、アルキル基、置換アルキル基、ハロゲン原子、アリール基、置換アリール基、アルコキシル基、水酸基、ニトロ基、アミノ基、アルキルアミノ基、ジアルキルアミノ基、硫酸塩基、及びメルカプト基が挙げられる。
【0026】
本明細書では、用語"アリール基"は、単一の芳香族環、又は互いに融合した、共有結合で連結した、又は、メチレン基又はエチレン基のような、しかしこれらに制限されない、一般的な基に連結した、多環の芳香族環であることができるような芳香族置換基を表すために用いられる。一般的な連結基としては、またベンゾフェノンにおけるようなカルボニル基、又はジフェニルエーテル基におけるような酸素原子、又はジフェニルアミンにおける窒素原子であることができる。用語"アリール基"は、特に複素環式芳香族化合物を含む。芳香族環(類)は、とりわけフェニル基、ナフチル基、ビフェニル基、ジフェニルエーテル基、ジフェニルアミン基、及びベンゾフェノン基を含む。特別な実施態様において、用語"アリール基"は、約5から約10個までの炭素原子、例えば、5,6,7,8,9又は10個の炭素原子、を含む環状芳香族を意味し、また5及び6員環炭化水素及び複素環式芳香族環を含む。
アリール基は、任意に1又は2個以上のアリール基置換基により置換することができて、これらの置換基は同一でも異なっていることも可能で、ここで、"アリール基置換基"は、アルキル基、置換アルキル基、アリール基、置換アリール基、アラルキル基、水酸基、アルコキシル基、アリールオキシル基、アラルキルオキシル基、カルボキシル基、アシル基、ハロ基、ニトロ基、アルコキシカルボニル基、アリールオキシカルボニル基、アラルコキシカルボニル基、アシルオキシル基、アシルアミノ基、アロイルアミノ基、カルバモイル基、アルキルカルバモイル基、ジアルキルカルバモイル基、アリールチオ基、アルキルチオ基、アルキレン基、及び−NR’R’’基、ここでR’及びR’’は、夫々独立に水素原子、アルキル基、置換アルキル基、アリール基、置換アリール基、及びアラルキル基である。
【0027】
従って、本明細書で用いるように、用語"置換アリール基"は、本明細書において定義したアリール基を含み、このアリール基において、アリール基の1又は2個以上の原子又は官能基は、他の原子又は他の官能基によって置換され、他の官能基としては、例えば、アルキル基、置換アルキル基、ハロゲン原子、アリール基、置換アリール基、アルコキシル基、水酸基、ニトロ基、アミノ基、アルキルアミノ基、ジアルキルアミノ基、硫酸塩、及びメルカプト基が含まれる。
アリール基の特別な例としては、シクロペンタジエニル基、フェニル基、フラン基、チオフェン基、ピロール基、ピラン基、ピリジン基、イミダゾール基、ベンジミダゾール基、イソチアゾール基、イソオキサゾール基、ピラゾール基、ピラジン基、トリアジン基、ピリミジン基、キノリン基、イソキノリン基、インドール基、カルバゾール基、等々がある。
【0028】
"環状基"及び"シクロアルキル基"は、約3個から約10個までの炭素原子、例えば、3,4,5,6,7,8,9又は10個の炭素原子の、非芳香性単環式系又は多環系を表わす。シクロアルキル基は任意に、部分的に不飽和であることができる。また、シクロアルキル基は、任意に本明細書で定義したようなアルキル基、オキソ基、及び/又はアルキレン基で置き換えることができる。環状アルキル鎖に沿って、1又は2以上の酸素原子、イオウ原子、又は置換又は非置換窒素原子を挿入することができ、ここで窒素置換基としては、水素原子、アルキル基、置換アルキル基、アリール基、又は置換アリール基であり、従って、複素環式基を提供する。代表的な単環式のシクロアルキル環としては、シクロペンチル基、シクロヘキシル基、及びシクロヘプチル基がある。多環シクロアルキル環としては、アダマンチル基、オクタヒドロナフチル基、デカリン基、ショウノウ、カンファン、及びノラダマンチルがある。
"アルコキシル基"はアルキル−O−基を表し、ここでアルキル基は前述の通りである。本明細書で用いる用語"アルコキシル基"は、例えば、メトキシル基、エトキシル基、プロポキシル基、イソプロポキシル基、ブトキシル基、t−ブトキシル基、及びペントキシル基を表すことができる。用語"オキシアルキル基"は、"アルコキシル基"と互換性を持って用いることができる。
"アラルキル基"はアリール−アルキルー基を表し、ここでアリール基及びアルキル基は前述の通りであり、また置換アリール基及び置換アルキル基を含む。アラルキル基の例としては、ベンジル基、フェニルエチル基、及びナフチルメチル基がある。
【0029】
"アルキレン基"は、1から約20個までの炭素原子、例えば、1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,又は20個の炭素原子を持つ、直鎖型又は分枝型2価脂肪族炭化水素基を表す。アルキレン基は、直鎖型、分枝型、又は環状であることができる。また、アルキレン基は、任意に不飽和、及び/又は1又は2以上の"アルキル基置換基"により置換されている。アルキレン基に沿って、任意に1又は2以上の酸素原子、イオウ原子、又は置換又は非置換窒素原子を挿入することができて(本明細書ではまた、"アルキルアミノアルキル基と表される)、ここで窒素置換基は前述のアルキル基である。アルキレン基の例としては、メチレン基(−CH2−);エチレン基(−CH2−CH2−);プロピレン基(−(CH2)3−);シクロヘキシレン基(−C6H10−);−CH=CH−CH=CH−基;−CH=CH−CH2−基;−(CH2)q−N(R)−(CH2)r−基、ここで各q及びrは、独立に0から約20までの整数、例えば、0,1,2,3,4,5,6,7,8,9、10、11,12,13,14,15,16,17,18,19又は20、であり、Rは水素原子又は低級アルキル基であり;メチレンジオキシル基(−O−CH2−O−);及びエチレンジオキシル基(−O−(CH2)2−O−)である。アルキレン基は、約2から約3個の炭素原子を有し、さらに6〜20個の炭素原子を持つことができる。
【0030】
"アリーレン基"は、2価のアリール基を表す。アリーレン基の例としては、フェニレンがあり、フェニレン基は、互いにオルト、メタ及びパラ位置、即ち、夫々、に結合に使われる環の炭素原子を持つことができる。
【化1】

アリーレン基はまたナフチレン基であることができる。アリーレン基は、任意に、本明細書で定義した、同一又は異なる1又は2以上の"アリール基置換基"で、置換することができる("置換アリーレン基")。
"アラルキレン基"は、アルキル基及びアリール基を含む2価官能基である。例えば、アラルキレン基は、2個のアルキル基及び1個のアリール基(即ち、−アルキル−アリール−アルキル−)、1個のアルキル基及び1個のアリール基(即ち−アルキル基−アリール基−)、又は2個のアリール基及び1個のアルキル基(即ち、−アリール−アルキル−アリール−)を持つことができる。
【0031】
用語"アミノ基"及び用語"アミン基"は、NR3、NH3、NHR2、及びNH2R基のような窒素含有性官能基を表し、ここでRはアルキル基、分枝型アルキル基、シクロアルキル基、アリール基、アルキレン基、アリーレン基、アラルキレン基であることができる。従って、本明細書で用いる"アミノ基"は、1級アミン基、2級アミン基、又は3級アミン基を表すことができる。幾つかの実施態様において、1個のアミノ基のRは、ジアゼニウムジオレイン酸塩(即ちNONO−)であることができる。
用語"カチオン性アミン基"及び"第4級アミン基"は、付加的な(即ち第4番目)官能基を有するアミノ基を表し、例えば窒素原子に結合した、水素原子又はアルキル基を表す。従って、カチオン性アミン基及び第4級アミン基は、正電荷を担う。
用語"アルキルアミン基"は、−アルキル−NH2−基を表す。
【0032】
用語"カルボニル基"は、−(C=O)−基を表す。
用語"カルボキシル基"は、−COOH基を表し、また用語"カルボン酸塩"は、カルボキシル基、即ち−COO−から作られたアニオンを表す。
本明細書で用いる"ハロ基""ハロゲン化物"又は"ハロゲン原子"はフッ素、塩素、シュウ素及びヨウ素基を表す。
用語"水酸基"及び"ヒドロキシ基"は、−OH基を表す。
用語"ヒドロキシアルキル基"は、−OH基で置換されたアルキル基を表す。
"メルカプト基"又は"チオ基"は、―SH基を表す。
"シリル基"は、ケイ素原子(Si)を含む官能基を表す。
【0033】
本明細書で用いるように、"アルコキシシラン基"はケイ素原子に結合する1,2,3,又は4個のアルコキシ基を含む化合物を表す。例えば、テトラアルコキシシランはSi(OR)4を表し、ここでRはアルキル基である。各アルキル基は、同一又は異なることができる。ある"アルキルシラン基"は、アルコキシ基の1個又は2個以上が、1個のアルキル基に置換されたアルコキシシラン基を表す。従って、アルキルシランは、少なくとも1つのアルキル−Si結合を含む。用語"フッ素化シラン基"は、アルキル基の1個が1又は2以上のフッ素原子により置換されたアルキルシランを表す。用語"カチオン性、又はアニオン性シラン基"は、アルキル基の1個がさらに正(即ちカチオン性)荷電、又は負(即ちアニオン性)荷電を有するアルキル基置換基に置換され、又は特定の環境(即ち、インビボで)で荷電を持つことができる(即ち、イオン化しうる)アルキルシラン基を表す。
用語"シラノール基"は、Si−OH基を表す。
【0034】
II.酸化窒素放出粒子
本出願で開示した対象物は、酸化窒素放出粒子及び医生物学的及び薬学的応用における使用を提供する。多くの実施態様において、本出願で開示した粒子は制御された、及び/又は標的を定めた方法で酸化窒素を放出し、またそれにより酸化窒素の生物作用及び特異性を改善し、及び持続する。幾つかの実施態様において、本出願で開示した酸化窒素放出粒子は、インビボの細胞、及び/又は組織へ酸化窒素を運搬するための新しい踏み台を提供する。従って、本出願で開示した酸化窒素放出粒子は、酸化窒素供与化学及び酸化窒素放出治療に対するユニークなスカフォード(足場)を提供する。
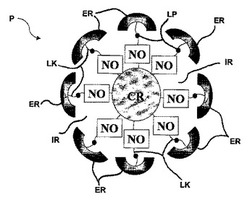
今、図1を参照すると、本出願で開示した粒子Pは、幾つかの実施態様において、コアCR,酸化窒素供与体NO,外部の内側を含む"内部"又は"内部領域"IR、及び"外部"又は"外部領域"ERを含む言葉で記述することができる。以下の本明細書において具体的に記述されるように、内部IRはまた、任意に脆弱性部分又は脆弱性基LPを含む、有機リンカーOLKを含む。
【0035】
外部又は外部領域ERは粒子Pの最外部の化学的機能性として定義できる。幾つかの実施態様において、外部ERは、粒子Pの酸化窒素放出動特性を制御すること、粒子Pの生体適合性を変えること、粒子Pの溶解度を調節すること、NO放出前に意図した場所(例えば、特異的細胞、組織、又は器官)への粒子Pの標的特異的な運搬を提供すること、粒子Pの画像又は追跡を提供すること、又は付加的な治療試薬(即ち、NOに加えて)を供給すること、ができる成分又は複数の成分を含む。この様な外部ERはNO放出粒子Pの機能を制御する、又は"官能基化"すると言うことができる。幾つかの実施態様において、外部領域ERの化学群は、NO放出粒子Pの1以上の機能を制御できる、また外部ERは、"多官能基性"と記述できる。幾つかの実施態様において、粒子Pを通して(例えば、コアCR又は内部IRにおいて)化学的成分又は他の構造的特性を、NO放出動特性、粒子溶解度、標的性、画像、追跡、付加的治療上の力、又は生体適合性に関係する因子又は因子群を制御するために用いることができて、また全粒子Pは、多官能基性と記述することができる。
【0036】
図1に示すように、幾つかの実施態様において、内部領域IRは有機リンカーLKを含む。本明細書で用いるように、用語"有機リンカー"又は"リンカー"は粒子コアと、粒子外部の間のギャップを橋渡しする有機つなぎ綱を表す。幾つかの実施態様において、以下の明細書でより具体的に記述するように、有機リンカーLKは脆弱性基LPを含むことができる。幾つかの実施態様において、有機リンカーLKは、いくらか、又は実質的に疎水性である。幾つかの実施態様において、リンカーLKは、分枝している。幾つかの実施態様において、リンカーLKは、コアCR,外部ER又はNO供与体NOのような粒子Pの他の構成分の1又は2以上と共有結合で結合している。
本出願で開示した対象物の粒子は、如何なる形もとることができる。従って、粒子は、球状、楕円形状、又は無定型であることができる。粒子のサイズと形は、少なくとも部分的には、自然に(即ち、化学組成)又はコアの合成法によって定められる。幾つかの実施態様において、粒子のサイズは、NO放出量又は速度に影響を与えるよう細工できる。
【0037】
幾つかの実施態様において、NO放出粒子はナノ粒子である。幾つかの実施態様において、用語"ナノ粒子"は、約0.5nmから約1000nmまでの間の直径を有する粒子を表すことを意味する。幾つかの実施態様において、ナノ粒子は、約1nmから約500nmまでの間の直径を持つ。幾つかの実施態様において、ナノ粒子は、約2nmから約200nmまでの間の直径を持つ。幾つかの実施態様において、粒子は、約1nmから約50nmまでの間の直径を持つ。
幾つかの実施態様において、粒子は1000nmより大きい。従って、幾つかの実施態様において、粒子はミクロ粒子である。幾つかの実施態様において、粒子は、約25ミクロンまでの直径を持つ。幾つかの実施態様において、粒子は、約100ミクロンまでの直径を持つ。
酸化窒素供与体は、粒子のコア、内部、又は外部の一部であることができる。NO供与体は、コア、内部又は外部の一つをカプセルに包むことができる。NO供与体は、Van der Waals相互作用、静電的相互作用(双曲子間、又は荷電基間の相互作用のような)、水素結合、又はこれらのコンビネーションのような非共有結合を介して、粒子の特定領域と結合することができる。さらに、NO供与体は、コア、内部、又は外部の一つと共有結合で結合できる。NO放出成分のパーセント組成は、希望とする治療結果又は他の結果に対する酸化窒素の有効最大積載量を与えるために、共有結合又はカプセル化によって変えることができる。
【0038】
NO放出成分又はNO供与体は、粒子の適切な標的に出会うまで、多量のNOを貯蔵しつつ、他の粒子記述子を破壊することのない様に設計できる。本明細書の以下に記載するように、リンカーの脆弱性部分を熱により、又はいかなる分解方法によっても、NO放出を開始することができる。従って、NO供与体は、NOを放出しうる如何なる成分でもあることができて、N−ジアゼニウムジオレイン酸塩、ニトロソアミン、ヒドロキシルニトロソアミン、ニトロソチオール、ヒドロキシルアミン、ヒドロキシウレア、金属錯体、有機亜硝酸塩、及び有機硝酸塩が挙げられる。Wang,P.G.,他Nitric Oxide Donors:For Pharmaceutical and Biological Applications;Wiley-VCH:Weinheim,Germany,2005;及びWang,P.G.,他、Chem.Rev.,102,1091-1134(2002)を参照されたい。
【0039】
幾つかの実施態様において、NO供与体は、N−ジアゼニウムジオレイン酸塩(即ち、1−アミノ−置換性デアゼン−1−イウム−1,2−ジオレイン酸塩)である。N−ジアゼニウムジオレイン酸塩は、生物学的条件下で自発的にNOを発生する活性を有するのでNO供与体として特に魅力的である。Hrabie,J.A.,及びKeefer,L.K.,Chem.Rev.,102,1135-1154(2002);及びNapoli,C.及びIgnarro,L.J.,Annu.Rev.Pharmacol.Toxicol.,43,97-123(2003)を参照されたい。以下の反応図1に示すように、幾つかのN−ジアゼニウムジオレイン酸塩化合物は、1級及び2級アミン、ポリアミン、及び2級アミノ酸を包含するある範囲の求核残基を用いて合成されてきた。Hrabie,J.A.,及びKeefer,L.K.,Chem.Rev.,102,1135-1154(2002)を参照されたい。N−ジアゼニウムジオレイン酸塩の合成において、高圧下で1当量のアミン基が2当量の酸化窒素と反応する。塩基(例えば、メトキシドのようなアルコキシド)はアミン窒素よりプロトンを外し、アニオン性の安定化した[N(O)NO]−基を生成する。室温条件下で安定であるが、N−ジアゼニウムジオレイン酸塩は、水溶液性の媒体中で自発的に分解し、pH、温度、及び/又はアミン分子の構造に依存した速度でNOを生成する。例えば、N−ジアゼニウムジオレイン酸塩−修飾プロリン(PROLI/NO)、2−(ジメチルアミノ)−エチルプトレアミン(DMAEP/NO),N,N’−ジメチルヘキサンジアミン(DMHD/NO)及びジエチレントリアミン(DETA/NO)は、pH7.4及び37℃において、2秒から20時間という広範囲なNO放出半減期範囲をもつ小分子NO供与体として開発された。Hrabie,J.A.,及びKeefer,L.K.,Chem.Rev.,102,1135-1154 2002);及びKeefer,L.K.,Annu.Rev.Pharmacol.Toxicol.,43,585-607(2003)を参照されたい。
【0040】
【化2】

反応図1 N−ジアゼニウムジオレイン酸塩より合成及びNO放出。
本明細書において間もなくより詳細に記載するように、幾つかの実施態様において、本出願で開示した粒子の"コア"は、以下からなる群:(a)金属クラスター;(b)樹木状ネットワーク;及び(c)様々なシラン機能性を有する共凝縮したシリカ(即ち、結合したシロキサン)ネットワーク、から選択した材料を含むが、これらに制限されない。
【0041】
II.A. 金属クラスターよりなるコア
幾つかの実施態様において、本出願で開示した粒子は、金属クラスターよりなる。金属クラスターは、更なる官能化のために不活性化又は"保護化"されることができる全ての金属複合体を含むことができる。例えば、保護化された金属複合体は、幾つかの実施態様において、有機高分子又はシリカによって被覆されることによって作られる。金属複合体は、また、有機分子の単層により保護され、ここで、有機分子は、金属複合体の表面で金属原子に配位する、又は金属原子と共有結合又は非共有結合を形成する官能性を持つ。
金属複合体は、金属、金属合金、金属塩、又は金属酸化物であることができる。幾つかの実施態様において、金属複合体は、金、銀、プラチナ、酸化鉄(即ち、FeO,Fe2O3,又はFe3O4)又はCdSe等々のような半導体粒子を含む。幾つかの実施態様において、酸化鉄は、磁鉄鉱(即ち、Fe3O4)である。幾つかの実施態様において、コアは、単層で保護された金クラスターであり、これは、Brust法及びSchulz−Dobrick法を含む、当業者に既知の様々な方法により作ることができる。
【0042】
単層保護のクラスター(MPC)金ナノ粒子、又はMPCs、(Brust,M.,J.Chem.Soc.,Chem.Comm.,801-802(1994)を参照されたい)はこれらのユニークなサイズ(1nmから5nmまで)、安定性、高度に機能的な設計を理由として、多くの注目を集めた。Feldheim,D.L.及びFoss,C.A.,編,Metal Nanoparticles - Synthesis Characterization,and Applications,Marcel Dekker,Inc:New York, p.360(2000)を参照されたい。図2に示すように、MPCsの外部は、望みの官能基を含む他のチオール基と交換することにより、配置を変えることができる。Hostetler,M.I.,他,Langmuir,15, 3782-3789(1999)を参照されたい。
更なる粒子の官能基化により、特異的な抗体―抗原又はリガンドー受容体相互作用を可能にする受容体分子を持つようになり、特異的な組織又は細胞を標的にすることが可能となる。NO放出MPC金ナノ粒子は、そのサイズ及び安定性により、インビボセンサー設計及び創傷治癒の促進、及び/又は皮膚下の血管の拡張に対する局所的クリームを含め、ある範囲の生物医学的及び薬学的応用に適用される。
【0043】
II.B.デンドリマーを含むコア
デンドリマーは、酸化窒素供与体化学に対してユニークなスカフォード(足場)を提供し、ここで多価の樹木状外部は、如何なる数の材料科学又は生物医学的応用に適するよう官能基化することができる。
デンドリマーは密に分枝化した構造を持ち、多くの反応基を持つ高分子である。デンドリティック高分子には、全て、1又は2以上の分枝点を含む、繰り返し単位の幾つかの層、又は生成源がある。超分枝化した樹木状高分子を含め、デンドリマーは、少なくとも2個の反応基を持つ単量体ユニットの縮合反応によって製造される。一般的に、デンドリマーは、末端表面基、内部分枝接合点、及び隣接した分枝接合点を共有結合で結合させる2価のコネクターからなり、内部分枝接合点は、2に等しい、又は2以上の分枝型官能基を持つ。
デンドリマーは、収束的合成又は発散的合成により製造されることができる。デンドリマーの発散合成には、分子生長過程があり、これは、放射状に外側方向に、幾何学的に進行性の階段状の分枝の上に分枝付加が連続することにより起こり、秩序ある配列を作り出す。従って、各樹木状高分子は、コアセル、1又は2層以上の内部セル、及び表面セルの外層を含むということができて、ここで各セルは、単一の分枝接合点を含む。各セルは、化学構造及び分枝官能基性において、同一又は異なることができる。表面分枝セルは、化学的に反応性のある、又は不活性な官能基を含んでもよい。化学的に反応性のある表面官能基は、更に樹木状成長を拡張するため、又は樹木状分子表面を修飾するために用いることができる。化学的に不活性な官能基は、親水性末端に対する疎水性末端の比を調節するため、及び/又は特定の溶媒に対して樹木状高分子の溶解度を向上させるためのような、物理的に樹木状表面を修飾するために用いてもよい。
【0044】
デンドリマーの収束的合成は、デンドロン又はデンドリマーの表面になると予想されるものから始まり、及び焦点又はコアの方向へ放射状に進行する、生長過程を含む。樹木状高分子は、理想的であっても、又は非理想的、即ち不完全又は欠陥的、であってもよい。不完全性は、普通不完全な化学反応、又は不可避の競合的副反応の結果である。実際面では、真の樹木状高分子は、一般的に非理想的、即ちある程度の構造的不完全性を含む。
超分枝型樹木状ネットワークは、高レベルの非理想的不規則分枝を含む樹木状高分子のクラスである。具体的には、超分枝型高分子は、全ての繰り返し単位が分枝接合点を持つとは限らない、相対的に多数の不規則な分枝領域を含む。デンドリマー、デンドロン、ランダムな超分枝型高分子、制御された超分枝型高分子及び樹木状グラフト(移植体)についての、合成及び特徴付けについては、よく知られている。デンドリマー及びデンドロンの例、及びこれらの合成方法は、米国特許番号4,507,466;4,558,120;4,568,737; 4,587,329;4,631,337;4,694,064;4,713,975;4,737,550;4,871,779及び4,857,599に公示されている。超分枝型高分子の例、及びこの合成法は、例えば、米国特許番号5,418,301に公示されている。
【0045】
本出願に開示した粒子のコアスカフォードとしての使用に適切なデンドリマーには、ポリプロピレニミンデンドリマー;ポリアミドアミン(PAMAM)デンドリマー;ポリアリールエーテルデンドリマー;ポリリジンデンドリマー;ポリエステルデンドリマー;ポリアミドデンドリマー;樹木状ポリグリセロール及びトリアジンデンドリマーがある。
幾つかの実施態様において、本出願で開示した対象物は、外部の2級アミン基を含む一連のポリプロピレニミン(PPI)デンドリマー抱合体を提供する。外部の1級アミン基を持つPPIデンドリマーから1級アミン基をアシル化し、また得られたアミド基のカルボニル基を還元して2級アミン基を合成することによって、この2級アミン基含有PPIデンドリマーを合成することができる。あるいは、1級アミン基は、既に2級アミン基を含む官能基でアシル化することができる。例えば、PPIデンドリマーの外部1級アミン基はプロリンでアシル化することができる。
デンドリマーの2級アミン官能基は、強塩基及び気体酸化窒素存在下で、高収率で酸化窒素供与体に変換できる。本明細書が提供するように、デンドリマーサイズ及び表面官能基は、2級アミン基を酸化窒素供与体へのパーセント変換率、及び酸化窒素放出動特性に影響を与える。
【0046】
II.C.共凝縮シリカネットワークを含むコア
二酸化ケイ素から合成した官能基化したセラミック合成物である、無機―有機混成シリカナノ粒子は、分離、生物的標識、診断、及び薬物、遺伝子、及びタンパク質の制御された運搬のための担体システムに関わる応用のために探求されてきた。Lai,C.-Y.,他、J.Am.Chem.Soc.,125,4451-4459(2003);Munoz, B.,他,Chem. Mater.,15,500-503(2003);Roy,I.,他、Proc.Natl.Acad.Sci,U.S.A.,102,279-284(2005);Trewyn,B.G.,他,Nano.Lett.,4,2139-2143 2004);及びYoshitake,H.,New.J.Chem.,29,1107-1117(2005)を参照されたい。シリカ粒子の薬物運搬潜在力は、これらの物理的及び化学的汎用性及び無毒性のために多くの注目を集めた。Sayari,A.,及びHamoudi,S.,,Chem.Mater.,13,3151-3168 (2001);及びStein,A.,他,Adv.Mater.,12,1403-1419(2000)を参照されたい。誘導体を作ることができる分子によって更に官能基化できる、反応性のある有機反応基(例えば、アミン基、カルボン酸塩、チオール基、オレフィン基、ハロゲン化物、及びエポキシド基)で修飾した無機―有機混成シリカの合成が報告されている。Sayari,A.,及びHamoudi.S.,Chem.Mater.,13,3151-3168(2001);及びStein,A..,他、Adv.Mater.,12,1403-1419(2000)を参照されたい。実際、前述の官能基成分を持つ無数のシランカップリング試薬が、薬物及び他の治療薬の(自由なシラノール基を通して)表面グラフト化のために開発された。Anwander.R.他、Stud.Surf.Sci.Catal.,117,135-142(1998)を参照されたい。
【0047】
一例において、Meyerhoff及び共同研究者等はフュームドシリカ(融合シリカ)(無定型粒子、直径0.2〜0.3μm)の表面にアミン官能基化したシリル化試薬をグラフトすることを報告した。Zhang,H.,他,J.Am.Chem.Soc.,125,5015−5024(2003)参照。表面に結合したアミン基は、その後、N−ジアゼニウムジオレイン酸塩NO供与体に変換された。改善した血液適合性を備えて被覆されたシリコンゴム高分子の合成のために、このNO放出シリカは充填物として使われた。
治療上のNO運搬系のようなスカフォールドの有用性は、多くの理由により妨害されたままである。この修飾は、粒子の外部表面に限られているので、NO貯蔵力は、本質的に制限され、NO放出動特性の制御には問題が多く、またNO供与体成分は、生体液中の反応性の化学種(例えば、ラジカル、過酸化物、及び遷移金属)によるコンタミネーションを受けやすい。Keefer,L. K.,Annu.Rev.Pharmacol.Toxicol.,43,585-607(2003);Napoli,C.,及びIgnarro,L.J., Annu.Rev.Pharmacol.Toxicol.,43,97-123(2003);及びZhou,Z.,及びMeyerhoff,M.E., Biomacromolecules,6,780-789(2005)を参照されたい。
【0048】
本出願で開示した対象物の粒子は、共凝縮したシリカネットワークを含むことができて、このネットワークはNO貯蔵力を増加させ、またNO放出動特性の制御力を増したNO運搬システムを提供する。幾つかの実施態様において、本出願で開示したNO放出シリカベースの粒子は、"ワンポット"合成法により製造される。Stein,A.,他,Adv.Mater.12,1403-1419(2000); Hatton, B.,他,Acc.Chem.Res.,38,305-312 2005),Lin,H.-P.,及びMou,C.-Y.,Acc.Chem.Res.,35,927-935(2002)を参照されたい。従って、図3に示すように、無機―有機混成シリカ粒子は、ゾルーゲル工程により製造され、この工程はテトラエチルオルトケイ酸塩(TEOS)、又はジ−又はトリ−アミノアルコキシシランを持つ他のアルコキシシランの共凝縮を伴う。この"ゾルーゲル"工程は、2種類の化学反応:アルコキシシランのアルコキシ基がシラノール(即ち、水酸基がSi原子に付加したもの)になる加水分解反応、その後、2個のシラノール又は1個のシラノール、及びアルコキシシランが反応してシロキサン結合(即ち、Si−O−Si)を形成する、縮合反応、を伴う。
"ワン−ポット"合成法の利点は、N−ジアゼニウムジオレイン酸塩NO供与体前駆体(即ち、ジ−及びトリ−アミノアルコキシシランのアミノ基)が粒子全体に一様に分布することができることであり、他方、表面グラフティング法により作られたアミン基修飾シリカ粒子の場合は、表面だけに分布する。図4A及び図4Bを参照されたい。実際、この直接"ワン−ポット"合成法により、より良い構造的安定性が提供され、またシリカ構造に組み込まれた有機アルコキシシラン量をより直接的に制御することが可能となる。Stein,A.他、Adv.Mater.,12,1403-1419(2000);及びLim,M.H.,及びStein,A.,Chem.Mater.,11,3285-3295(1999)を参照されたい。更に、様々な他の官能基を持つ別なシランが、構造を持つように共凝縮できて、これは、サイズ、溶解度、又は粒子の多孔率に影響を与える。
従って、幾つかの実施態様において、ナノ粒子コアは、アルコキシシラン及びアミノアルコキシシランの共凝縮体から作成した共凝縮シランネットワークを含む。幾つかの実施態様において、アミノアルコキシシランは、さらに酸化窒素との処理による共凝縮の後、官能基化されて、アミン基がN−ジアゼニウムジオレイン酸塩に変化する。図5A参照。幾つかの実施態様において、アミノアルコキシシランは、アルコキシシランとの共凝縮に先立ち酸化窒素で"前処理"又は"プレチャージ(前装填)"される。図5B参照。"プレチャージ"法は、NO供与体でより密集して官能基化した共凝縮シリカ粒子を作り出すために用いることができる。
【0049】
幾つかの実施態様において、アルコキシシランは、化学式Si(OR)4を持つテトラアルコキシシランであり、ここでRはアルキル基である。R基は、同一又は異なることができる。幾つかの実施態様において、テトラアルコキシシランは、テトラメチルオルトケイ酸塩(TMOS)又はテトラエチルオルトケイ酸塩(TEOS)から選択される。
幾つかの実施態様において、アミノアルコキシシランは化学式:
R’’−(NH−R’)n−Si(OR)3
を持ち、ここでRはアルキル基、R’はアルキレン基、分枝型アルキレン基、又はアラルキレン基であり、nは1又は2であり、R’’はアルキル基、シクロアルキル基、アリール基、及びアルキルアミン基からなる群より選択される。幾つかの実施態様において、アミノアルコキシシランは、N−(6−アミノヘキシル)アミノプロピルトリメトキシシラン(AHAP3);N−(6−アミノエチル)アミノプロピルトリメトキシシラン;(3トリメトキシシリルプロピル(ジ−エチレントリアミン(DET3);(アミノエチルアミノメチル)フェネチルトリメトキシシラン(AEMP3);[3−(メチルアミノ)プロピル]トリメトキシシラン;N−ブチルアミノ−プロピルトリメトキシシラン;N−エチルアミノイソブチルトリメトキシシラン;N−フェニルアミノ−プロピルトリメトキシシラン;及びN−シクロヘキシルアミノプロピルトリメトキシシランから選択される。代表的な適切なアミノアルコキシシランの構造を図6に示す。
いくつかの実施態様において、アミノアルコキシシランは化学式:
NH[R’−Si(OR)3]2
を持ち、ここでRはアルキル基であり、またR’はアルキレン基である。従って、いくつかの実施態様において、アミノアルコキシシランは、ビス−[3−(トリメトキシシリル)プロピル]アミン及びビス[(3−トリメトキシシリル)プロピル]エチレンジアミンから選択することができる。
【0050】
いくつかの実施態様において、本明細書で既に述べたように、アミノアルコキシシランは、NO放出のためにプレチャージされ、またアミノ基はジアゼニウムジオレイン酸塩により置換される。従って、いくつかの実施態様において、アミノアルコキシシランは、化学式:
R’’−N(NONO−X+)−R’−Si(OR)3
を持ち、ここでRはアルキル基であり、R’はアルキレン基又はアラルキレン基であり、R’’’はアルキル基又はアルキルアミン基、及びX+はNa+,K+及びLi+からなる群より選択されるカチオンである。
シリカネットワークの組成(即ち、アミノアルコキシシランの量又は化学組成)及びNOチャージ条件(即ち、溶媒及び塩基)を変えて、酸化窒素放出の量及び持続時間を最適にすることができる。従って、幾つかの実施態様において、本出願で開示したシリカ粒子組成を修飾し、シリカ粒子からのNO放出の半減期を調節することができる。
【0051】
幾つかの実施態様において、酸化窒素放出シリカ粒子の疎水性を、共凝縮シリカネットワークに様々な官能基を持つ共凝縮シラン前駆体により調節できる。幾つかの実施態様において、他のシラン前駆体を、アルキルシラン、正電荷を持つシラン、負電荷を持つシラン、及びフッ素化したシランを含む群から選択するが、これらに制限されない。幾つかの実施態様において、他のシラン前駆体を、(ヘプタデカフルオロ−1,1,2,2−テトラヒドロデシル)トリエトキシシラン;(3,3,3−トリフルオロプロピル)トリメトキシシラン;(ペルフルオロアルキル)エチルトリエトキシシラン;N−N−ジデシル−N−メチル−N−(3−トリメトキシシリル)アンモニウムクロライド;オクタデシルジメチル−(3−トリメトキシシリルプロピル)アンモニウムクロライド;3−トリヒドロキシシリルプロピルメチルホスホン酸ナトリウム塩;カルボキシルエチルシラントリオールナトリウム塩;メチルトリメトキシシラン;ブチルトリメトキシシラン;ブチルトリエトキシシラン;プロピルトリメトキシシラン;及びオクタデシルトリメトキシシランから選択することができる。
幾つかの実施態様において、共凝縮シリカネットワークは、約10モル%から約99モル%までの間の濃度のテトラアルコキシシラン;約1モル%から約90モル%の間の濃度のアミノアルコキシシラン;約0モル%から約20モル%までの間の濃度のフッ素化シラン;約0モル%から約20モル%までの間の濃度のカチオン性又はアニオン性シラン;及び約0モル%から約20モル%までの間の濃度のアルキルシランを含む(即ち、上記の濃度の溶液の凝縮から作られる)。
【0052】
幾つかの実施態様において、シリカネットワークの多孔率及びNO放出能は、鋳型構成成分の存在下でシランを共凝縮することで制御できる。この様な鋳型構成成分は、界面活性剤及びミセルを含むことができる。シリカネットワークの凝縮の後、鋳型構成成分は取り除くことができ、シリカに孔が残る。NO放出シリカ粒子内に孔を取り込むと、NO供与体充填に使われる表面積が増加する、又はNO供与体への水の接近性を高めることによりNO放出を増加させる。
例えば、図7は、孔の鋳型としてミセルを用いたメソ多孔質のシリカネットワークの合成の図式的説明である。図7に示すように、ミセルは、制御された溶媒環境中で自己会合し、ミセルロッド、又は多重ロッドのより高度に構造化した配列のような、秩序ある3次元構造を形成する。シランの混合物を含む溶液をミセル溶液に導入することができて、凝縮し、ミセルロッドを取り囲むことができるが、浸透することはできない。シラン混合物の凝縮の後、ミセルは、溶媒抽出により凝縮したシリカより取り除くことができて、シリカ内に孔を残す。
幾つかの実施態様において、本出願で開示した対象物は、官能基化したシリカを提供するが、このシリカを、当業者に既知の様々な化学的カップリング反応により、更に巧妙に作ることができる。幾つかの実施態様において、官能基化したシリカは、アミノ基修飾シリカである。幾つかの実施態様において、官能基化したシリカは、エポキシ基修飾シリカである。
幾つかの実施態様において、本出願で開示したシリカ化学は、ヒドロキシアミン化学と組み合わされる。幾つかの実施態様において、本出願で開示したシリカ化学は、ヒドロキシウレア化学と組み合わされる。
【0053】
III.酸化窒素放出粒子より酸化窒素の誘導放出
制御された、及び/又は標的を定めた輸送技術は、活性試薬の放出速度、及び/又は場所を制御することによって、一般的に、活性試薬の効率及び/又は安全性が増す。幾つかの実施態様において、本出願で開示した酸化窒素放出粒子からの酸化窒素の放出は、要求通り、選択的に作動開始又は停止(即ち誘発)することができる。
幾つかの実施態様において、有機リンカーは"脆弱"部分を含む。幾つかの実施態様において、リンカーの誘導的分解が、NO放出のメカニズム、量、速度、及び持続時間に影響することができる。図1及び8を参照すると、リンカーLKの脆弱部分LPを、外部ERに対して様々な位置A,B又はCに置くことができて、リンカーLKの位置が変わると、さらにNO放出のメカニズム、量、速度、及び持続時間に影響する。例えば、幾つかの実施態様において、図8の位置Aは、図1のNO放出粒子Pの内部IR内のNO供与体NOに隣接することができ;位置Bは、NO供与体NOと外部ERの間の中央に位置することができ;位置Cは、外部ERに近接して位置することができる。従って、幾つかの実施態様において、位置Cにおける脆弱基LPは、粒子Pが置かれた外部条件によって、より早く分解されることが可能であり、言い換えると、粒子Pの内部IRに位置するNO供与体NOを、同じ環境条件により早く曝すことになる。粒子内部IRにより深く、位置A又はB、に置かれた脆弱基LPは、幾つかの実施態様において、持続した、又は遅延した放出動特性を提供する。
【0054】
幾つかの実施態様において、リンカーの"脆弱"部分は、例えば、誘発機構のような、刺激に曝すことにより分解する。幾つかの実施態様において、刺激、又は誘発機構は、pH,光、及び酵素作用を含む群から選択されるが、これらに制限されない。
リンカーの脆弱部分の分解がpHによって誘発されるような実施態様において、リンカーは、エステル基、ヒドラゾン基、アセタール基、及び/又はpH変化に応答する他の有機官能基の様な、官能基を含む。従って、幾つかの実施態様において、リンカーは、あらかじめ定めたpH範囲で分解する。より具体的には、幾つかの実施態様において、リンカーは、エンドサイトシスによる高分子の細胞内移行の結果生ずる細胞構造である、エンドソーム内の増加した酸性pHを利用して、設計される。
幾つかの実施態様において、リンカーの分解は、光露出により誘発される。いくつかの実施態様において、光照射によりリンカー構造が分解する光脆弱成分が様々なリンカー内に作られ、"脆弱"部分が光開裂を受ける。
幾つかの実施態様において、酵素基質がリンカーに組み込まれ、興味のある望みの酵素環境に対する系の特異性を得て、興味のある酵素的経路を通して、リンカーを分解する。
従って、幾つかの実施態様において、リンカーの脆弱性は、NO放出成分からのNO放出の機構、量、速度及び持続時間を制御するための方法として用いることができる。脆弱なリンカーには、エステル、ヒドロゾン、アセタール、チオプロピオン酸塩、光脆弱成分及び酵素分解を受けるアミノ酸配列がある。
【0055】
幾つかの実施態様において、有機リンカーは、疎水性リンカーである。粒子が水溶液性の環境に置かれた時、疎水性リンカーは、例えば、ジアゼニウムジオレイン酸塩のような、NO供与体、及び/又は脆弱性リンカー、を水又はプロトンとの接触から保護する手がかりとして選ぶことができる。従って、疎水性リンカーの長さ、及び正確な化学組成を、NO放出動特性を制御するために利用することができる。用語疎水性は、非常に疎水性な基(即ち、非常に低い誘電率)であるか、又は僅かに疎水性である基(即ち、粒子の内部に水がゆっくり侵入することを許す)を含むことができる。
あるいは、有機リンカーは、両親媒性であり、疎水性基及び親水性基の両者を含む。この様なリンカーは、粒子内部にチャンネルを提供し、それにより、溶媒の脆弱性リンカー又はNO供与体への接近を亢進する。
NO放出は、NO供与体を、ナノ又はミクロ粒子、セル、細胞ゴースト、リポタンパク質、リポソーム、ミセル、微少気泡、微小球体、又は少なくとも部分的に不溶性の又は生物分解可能な性質に作られた粒子、又は合成高分子の様な、担体系内にカプセル化することにより制御できる。この様な系において、体内で担体が分解するに従い、NOは徐々に放出されることができる。一般的に、分解速度は、温度、pHレベル、及び酵素活性のような、患者内の条件により変わる。従って、この様な運搬技術を用いることにより、持続した治療試薬の放出を、長期間維持することができる。
【0056】
IV.酸化窒素放出粒子の更なる官能基化
本明細書に提供したように、本出願で開示した粒子の外部、内部、及び/又はコアを官能基化することにより、生体適合性を与える、薬物動態挙動を変える、及び標的を定める官能基性を伝える、更なる治療成分を加える、及び治療薬としてのNOの運搬及び研究に関する画像力を与えることができる。幾つかの実施態様において、粒子の外部は、1又は2以上の化学的又は生体分子成分により官能基化が可能である。
外部は、一様な、又は変化のある化学組成であることができる。幾つかの実施態様において、粒子の外部の官能基化は、層又は粒子の内部を囲むコーティング(被膜)の付加から成り立つことができる。幾つかの実施態様において、官能基化は、粒子周辺の幾つかの位置に1又は2以上のペンダント(吊り下がり)基の付加を伴うことができる。従って、以下の明細書でより具体的に記述するように、外部は、粒子のターゲッティング(標的狙い)のための1又は2以上のペンダント抗原から成り立つことができる。また、外部は、溶解度に影響を与える、水酸基、チオール基、メチル末端のアルキル鎖、スルホン酸塩、リン酸塩、カルボン酸塩、及びカチオン性又は4級アミン基のような、個々の化学成分から成り立つことができる。更に、外部は、例えば水溶性の改善を与える親水性高分子、又は既知の生体許容性高分子のような、高分子層を含むことができる。高分子層は、生物分解可能高分子であることができて、これはインビボ又はインビトロで用いた時、一定期間の間NO供与体を水から保護する。このような高分子コーティングにより、高分子コーティングが分解されるまでの時間の間、NO放出動特性が影響を受けて、持続的なNO放出が可能となる。本出願で記載した粒子の外部を官能基化するために適切な高分子としては、(ポリ)エチレンオキシド、(ポリ)ウレタン、N−(2−ヒドロキシプロピル)メタクリルアミド共重合体、及びラクチド/グリコリド共重合体(例えば、PLGA)がある。
【0057】
IV.A.酸化窒素の標的を定めた運搬のための酸化窒素放出粒子
いくつかの実施態様において、粒子の更なる官能基化により、特定の細胞、組織、又は器官のターゲッティング(標的狙い)が可能となる。従って、幾つかの実施態様において、本出願で開示した酸化窒素放出粒子を、その表面又は外部に、選択的な認識因子を付加することにより、更に修飾できる。この様な選択的な認識因子としては、小分子リガンド;抗体及び抗体断片の様な生体分子;及びサイトカイン、ホルモン、炭化水素、砂糖、ビタミン、及びペプチドのような他の因子が挙げられるが、これらに制限されない。
特異的ターゲッティングの成分は、全ての場合に要求されるわけではない。幾つかの実施態様において、位置特異的ターゲッティングは、腫瘍脈管構造に伴う亢進した透過性、及び保持効果(EPR)の様な、より受動的方法も含むことができる。位置特異的ターゲッティングは、疾病状態又は特定の器官又は組織に特異的な酵素と接触する場合のみ、NO放出を誘発するリンカーを含むNO放出粒子を用いることにより、行うことができる。最後に、ターゲッティングは、また、粒子の、例えば、局所的に、直接傷へ、又は腫瘍部位へ直接注射することにより、局所的な運搬によって行うことができる。
【0058】
一般的に、粒子が、細胞表面成分を通して細胞を標的とする場合、粒子は、受容体を介したエンドサイトシスにより細胞内に取り込まれる。標的細胞(例えば、腫瘍細胞)の表面に局在する如何なる成分も、本出願で開示した粒子に利用される。例えば、上記の様な細胞表面成分に対する抗体を用いることができる。あるいは、標的成分は、細胞表面上に存在する受容体に向けられたリガンドであることもでき、逆も可能である。
特異的ターゲティング成分(即ち、特定の細胞、組織、又は器官に粒子を向けるために設計した粒子に結合した成分)を用いる粒子の実施態様において、ターゲッティング成分は、任意に粒子の外部と結合する。ターゲッティング成分は、例えば、アミン基、アルコール、カルボン酸塩、イソシアン酸塩、リン酸塩、チオール基、ハロゲン化物、又はエポキシド基のような、外部の有用な反応基を通して、外部に直接結合できる。例えば、標的細胞を認識する成分には必要ではないアミン基を含む、又は誘導化して含むターゲッティング成分は、カルボジイミド化学を用いて、粒子外部上に存在するカルボン酸塩と直接結合することができる。ターゲッティング成分はまた、N−スクシニミジル−3−(2−ピリジルジチオ)プロピオン酸塩(SPDP,Pierce Chemical Company,Rockford,Illinois,United State of Americaより商品として入手可能)のような、短い2価官能性のリンカーにより粒子の外部上の反応基に連結することができる。あるいは、EMD Bioscience,Inc.(La Jolla,California,USA)又はShearwater polymers(Huntsville,Alabama,USA)から商品として入手可能な、ポリエチレングリコール(PEG)−ベースの2価のリンカーより長い2価のリンカーを用いることができる。
【0059】
癌細胞を標的とする使用のためのターゲッティング成分は、腫瘍特異的抗原の周囲に設計できるが、このような腫瘍特異的抗原としては、本出願に開示した対象物に使用される、癌胎児性抗原、前立腺特異抗原、チロシナーゼ、ras、シアル化ルイス抗原、erb、MAGE−1,MAGE−3,BAGE,MN,gp100,gp75,p97,プロテイナーゼ3,粘液素、CD81,CID9,CD63;CD53,CD38,CO−029,CA125,GD2,GM2,及びO−アセチルGD3,M−TAA,M−胎児又はM−泌尿器が挙げられるが、これらに制限されない。あるいは、ターゲッティング成分は、腫瘍抑制因子、サイトカイン、ケモカイン、腫瘍特異的受容体リガンド、受容体、アポトーシス誘導体、又は分化誘導因子の周囲に設計できる。更に、腫瘍成長に血管新生過程が重要とすると、幾つかの実施態様において、ターゲッティング成分は、血管新生と結びついた因子を標的とするよう開発できる。従って、ターゲッティング成分は、血管内皮細胞成長因子(VEGF)のような既知の血管新生因子と相互作用するように設計できる。Brannon-Peppas,L.及びBlanchette,J.O.,Advanced Drug Delivery Reviews,56,1649-1659(2004)を参照されたい。
ターゲッティングのために提供される腫瘍抑制タンパク質には、p16,p21,p27,p53,p73,Rb,Wilms(ウィルム)腫瘍(WT−1),DCC,神経線維腫症タイプ1(NF−1),von Hippel−Lindau(フォンヒッペルリンダウ)(VHL)病腫瘍抑制因子,Maspin(マスピン・転移抑制因子),Brush(ブラッシュ)−1,BRCA−1,BRCA−2,多重腫瘍抑制因子(MTS),ヒト・メラノーマのgp95/p97抗原,腎細胞癌関連G250抗原、KS1/4広汎癌抗原、卵巣癌関連抗原(CA125),前立腺特異的抗原、メラノーマ抗原gp75,CD9,CD63,CD53,CD37,R2,CD81,CO029,TI−1,L6及びSASがあるが、これらに制限されない。勿論、これらは例として示す腫瘍抑制因子であり、本出願で開示した対象物は、当業者に腫瘍抑制因子、又は、腫瘍抑制因子になるであろうと知られている他の如何なる因子とも関連して用いることができることは想像つく。
【0060】
幾つかの実施態様において、腫瘍遺伝子により発現される因子に向けてターゲッティングが行われる。これらの物としては、Srcファミリーのメンバーのような膜関連及び細胞質型両方のチロシンキナーゼ;Mos,成長因子の様な、セリン/スレオニンキナーゼ;及び血小板由来成長因子(PDDG)の様な受容体;rasファミリーメンバーを含む小GTPase(Gタンパク質);サイクリン依存型プロテインキナーゼ(cdk);c−myc、N−myc,及びL−mycを含むmycファミリーのメンバー;及びbcl−2とそのファミリーメンバーがあるが、これらに制限されない。
本出願で開示した粒子によりターゲティングされるサイトカインとしては、IL−1,IL−2,IL−3,IL−4,IL−5,IL−6,IL−7,IL−8,IL−9,IL−10,ILA 1,IL−12,IL−13,IL−14,IL−15,TNF,GM−CSF,β−インターフェロン及びγ−インターフェロンがあるが、これらにより制限されない。ケモカインとしては、M1P1α、M1P1β、及びRANTESがあるが、これらにより制限されない。
標的とされる酵素としては、シトシンデアミナーゼ、ヒポキサンチングアニンホスホリボシルトランスフェラーゼ、ガラクトースー1ーリン酸ウリジルトランスフェラーゼ、フェニルアラニンヒドロキシラーゼ、グルコセルブロシダーゼ、スフィンゴミエリナーゼ、α−L−イズロニダーゼ、グルコース−6−リン酸デヒドロゲナーゼ、HSVチキジンキナーゼ、及びヒトチミジンキナーゼがあるが、これらにより制限されない。
【0061】
本出願で開示された対象物の文脈で使用される受容体、及びこれに関連する関連リガンドとしては、葉酸受容体、アドレナリン作用性の受容体、成長ホルモン受容体、黄体形性ホルモン受容体、エストロゲン受容体、上皮成長因子受容体、繊維芽細胞成長因子受容体、等々が挙げられるが、これらに制限されない。幾つかの実施態様において、ターゲッティング成分は、葉酸、グアニジン、トランスフェリン、炭化水素、及び砂糖からなる群より選択される。幾つかの実施態様において、ターゲッティング成分は、アミノ酸配列RGD及びTATペプチドからなる群から選択されるペプチドである。
例えば、葉酸は、癌細胞を標的とする特に有用なターゲッティング成分であることができる。癌性腫瘍細胞は、その細胞表面に、葉酸受容体の過剰発現がある。葉酸(FA)は、様々な割合の修飾を伴ってナノ粒子外部に結合し、NO放出ナノ粒子のFAを標的とする運搬に寄与する。そのサイズが小さいので、多くの葉酸リガンドが、粒子表面に付加される。Wienerは、葉酸が付加したデンドリマーは、高親和性葉酸受容体(hFR)を欠く対照細胞では葉酸誘導化デンドリマーの顕著な集積はないが、特にhFRを発現する腫瘍細胞の表面及び内部に集積することを報告している。Wiener,E.C.他、Invest. Radiol.,32(12),748-754(1997)を参照されたい。葉酸は、カルボジイミドカップリング反応により、粒子外部のアミン基に付加することができる。
【0062】
葉酸より大きいが、なお相対的に小さいターゲティング成分は、53個のアミノ酸残基を持つ単鎖ペプチドである上皮性成長因子(EGF)である。リンカーSPDPを持つEGFと連結したPAMAMデンドリマーは、ヒト・グリオーマ細胞の細胞表面に結合し、エンドサイトーシスが行われ、リゾソームに集積する。Capala,J.,他、Bioconjugate Chem.,7(1),7-15 (1996)を参照されたい。EGF受容体密度は、正常細胞に比べて、脳腫瘍細胞上では、100倍まで高いので、EGFは、これらの種類の腫瘍細胞には、有用なターゲッティング試薬となる。EGF受容体は、また、乳癌及び直腸癌で過剰発現しているので、これらの細胞でもまたターゲッティング試薬として使われることができる。同様に、繊維芽細胞成長因子受容体(FGFR)は、また相対的に小さなポリペプチド(FGF)と結合し、また乳癌細胞株で高レベル発現することが知られている(特に図1,2及び4)。Penault-Llorca,F.,他、Int.J Cancer,61(2),170-176(1995)を参照されたい。
ホルモンとその受容体としては、成長ホルモン、プロラクチン、胎盤性ラクトゲン、黄体形成ホルモン、卵胞刺激ホルモン、絨毛性ゴナドトロピン、甲状腺刺激ホルモン、レプチン、副腎皮質刺激(ACTH)、アンギオテンシンI,アンギオテンシンII,β−エンドルフィン、β−メラノサイト刺激ホルモン(β−MSH)、コレチストキニン、エンドセリンI,ガラニン、胃炎阻害ホルモン(GIP),グルカゴン、インシュリン、アミリン、リポトロピン、GLP−1(7−37)ニューロフィジン、及びソマトスタチンが挙げられるが、これらに制限されない。
【0063】
本出願で開示した対象物の目論見によると、ナノデバイスのターゲティング構成成分に置かれたビタミン類(脂溶性及び非脂肪可溶性)をある種類の細胞を標的にする為に用いることができて、その細胞は、これらのビタミン類に対する受容体を持つ、又はそうでなければ、これらのビタミン類を取り込む細胞である。ビタミンD及びこの類似体、ビタミンE,ビタミンA等々、又はビタミンC等々の様な、水溶性ビタミンは、この観点から特に好ましい。
様々な生物標的(例えば、感染源、腫瘍細胞、正常細胞)上の抗原又は免疫源(例えば、腫瘍、組織又は感染源特異的抗原)を標的とするために、抗体を作ることができる。本出願で開示した対象物の幾つかの実施態様において、ターゲッティング成分は、抗体又は抗体の抗原結合断片(例えば、Fabユニット)である。従って、"抗体"としては、ポリクロナル抗体、モノクロナル抗体、キメラ抗体、単鎖抗体、Fab断片、及びFab発現ライブラリーが挙げられるが、これらにより制限されない。
【0064】
多くの癌(乳癌HER2腫瘍も含め)の表面に見出される良く研究された抗原の1例として、糖タンパク質p185があり、これは、専ら悪性細胞に発現される。Press,M.F.他、Oncogene5(7)、953-962(1990)を参照されたい。組み換えたヒト化抗−HER2モノクロナル抗体(rhuMabHER2)は、Genentech(South SanFrancisco,California,USA)から、HERCEPTIN(R)の名前で、商品として入手可能である。本出願で開示した対象物の使用のために適切な他の代表的な抗体には、CD14及び前立腺特異的膜抗原(PSMA)に結合するIgC−型抗体である60bca及びJ591(全
て本明細書に参考文献として取り込まれている、Baker,J.R.,Jr.,Biomacromolecules,5,2269-2274(2004)を参照されたい)、及び乳腫瘍細胞株SK−BR−3のErbB2成長因子に結合する、抗体F5及びC1があるが、これらに制限されない。
本明細書に既に記載したように、粒子の持つ標的特異的なNO運搬能は、粒子外部に付加したペンダント(吊り下がった)ターゲティング因子を含む実施態様のみに制限されない。粒子の非外部付加の特性もまた、ターゲティングのために使用される。従って、幾つかの実施態様において、亢進した透過性及び保持(EPR)効果が、ターゲティングのために使われる。このEPR効果は腫瘍の超透過性脈管構造、及び乏しいリンパ排液を原因とする腫瘍ミクロ環境における高分子、及び小粒子の選択的集積である。幾つかの実施態様において、EPRを高めるために、粒子外部を、親水性高分子で塗布し、又は結合させ、粒子の循環半減期を高め、プラズマタンパク質の粒子への付着を阻む。
【0065】
幾つかの実施態様において、ターゲッテング成分は、磁鉄鉱のような磁化成分であることができる。幾つかの実施態様において、粒子のコアは磁鉄鉱を含む。幾つかの実施態様において、磁鉄鉱コアは、さらに、NO供与体を含む、又は含むように官能基化されることができる、共凝縮したシリカネットワークを含むシェルで被覆される。患者に一度投与されると、磁石を利用して磁化粒子をその標的、即ち、NO放出を望む部位、に向けることができる。この様な磁石は、外部(即ち、病人又は患者の外から)から適用できる。
標的を定めた薬剤運搬の、更なる方法の例として、特に、癌治療のための標的狙いの系があり、Brannon-Peppas,L.及びBlanchette,J.O.,Advanced Drug Delivery Reviews,56,1649-1659(2004)及び米国特許番号6,471,968、これらは、本明細書に参考文献として全体が取り込まれている。
【0066】
IV.B 酸化窒素放出粒子の画像
幾つかの実施態様において、NO放出粒子は、インビボ又はインビトロにおいて粒子の画像又は追跡を助ける成分を含むことができる。粒子の追跡は、酸化窒素放出効率を決める上で、疾病を治療する上で、又は粒子のターゲティングの特異性を評価する上で有効であることができる。画像化又は追跡成分は、粒子のコア、内部、又は外部の何れかと結合することが可能である。幾つかの実施態様において、画像化又は追跡成分は、粒子のコア、内部、又は外部の一つと共有結合している。幾つかの実施態様において、追跡試薬又は成分は、例えば、量子ドットコアを持つ粒子の例のように、コアの部分である。
幾つかの実施態様において、画像化試薬の追跡は、蛍光分子、有機染料、又は放射性同位元素の一つである。
幾つかの実施態様において、画像化試薬は、磁気共鳴画像(MRI)コントラスト試薬であることができる。従って、幾つかの実施態様において、粒子の外部は、例えば、通常MRI試薬として使われるGd(III)−ジエチレントリアミンペンタ酢酸(Gd(III)−DTPA)のキレート基である、ジエチレントリアミンペンタ酢酸(DTPA)の様な、常磁性イオンとキレートすることができる基を含むよう官能基化されることは知られている。此の文脈で有用であることができる、他の常磁性イオンとしては、ガドリニウム、マンガン、銅、クロムイオン、鉄、コバルト、エルビウム、ニッケル、ユーロピウム、テクニチウム、インジューム、サマリウム、ジスプロシウム、ルテニウム、イッテルビウム、イットリウム、及びホルミウムイオン、及びこれらのコンビネーションがあるが、これらに制限されない。
【0067】
IV.C.付加的治療試薬
幾つかの実施態様において、1又は2以上の付加的治療試薬を、本出願で記述した粒子のNO供与体と組み合わせて用いることができる。このような付加的試薬は、粒子自体の中に取り込まれることができ;粒子を含む調剤の部分に取り込まれることができ;又は前、後、に分離した薬剤配合物として、又は同時の粒子を含む薬剤配合物として、服用量の部分として取り込まれることができる。このような付加的治療薬剤として、特に、抗癌治療薬、抗菌剤、苦痛緩和剤、抗炎症薬、血管拡張薬、及び免疫抑制剤、さらに、疾患又は治療される状態の軽減を亢進するであろう全ての他の既知の治療薬が挙げられる。
NO放出粒子に付加的治療因子又は薬剤が組み込まれる実施態様において、付加的治療薬は、粒子の外部、内部、又はコアの何れかと関係づけられることができる。例えば、付加的薬剤は、コア又は粒子の内部のリンカー内にカプセル化できる。付加的薬剤は、粒子のコア、内部又は外部に共有結合で結合できる。更に、付加的因子の結合は、放出誘発法と関連させることができて、ここで、脆弱性リンカーを介して付加的薬剤を粒子に繋げることができて、これにより、好ましくは望みの作用部位(例えば、腫瘍細胞など)において、水との接触、pHの上昇、又は酵素的又は光開裂、によって試薬を放出する。
NO放出粒子と組み合わせて用いられる付加的治療薬剤の選択は、様々な因子によると考えられ、考慮する因子としては、疾病の種類、年齢、及び患者の一般的健康状態、疾病進行の激しさ、及び患者の組合せを含む薬剤への許容力が挙げられるが、これらに制限されない。
【0068】
"抗腫瘍"薬又は"化学療法薬"と記載される様々な化合物が、癌治療で用いられる、本出願で開示されたNO放出粒子と組み合わせて、又は組み込まれて用いることができる。この様な化学療法化合物としては、アルキル化剤、DNAインターカレーター、タンパク質合成阻害剤、DNA又はRNA合成阻害剤、DNA塩基類似体、トポイソメラーゼ阻害剤、抗血管新生阻害剤、及びテロメラーゼ阻害剤又はテロマー化DNA結合化合物があるが、これらに制限されない。例えば、適切なアルキル化剤としては、ブスルファン、インプロスルファン及びピポスルファンのようなアルキルスルホン酸塩;ベンゾジゼパ、カルボクオン、ムチュレデパ、及びウレデパのようなアジリジン;アルトゥレタミン、トリエチレンメラミン、トリエチレンホスホラミド、トリエチレンティオホスホラミド、及びトリメチロールメラミンのようなエチレニミン及びメチルメラミン;クロランブシル、クロルナファジン、サイクロホスファミド、エストラムスチン、イホスファミド、メクロレタミン、メクロレタミンオキシド塩酸塩、メルファラン、ノベンビチン、フェネステリン、プレドゥニムスチン、トロホスファミド、及びウラシルマスタードのようなナイトロジェンマスタード;カルムスチン、クロロゾトシン、ホテムスチン、ロムスチン、ニムスチン、及びラニムスチンのようなニトロソウレアが挙げられる。
【0069】
癌の治療に用いられる抗生物質としては、ダクチノマイシン、ダウノルビシン、ドクソルビシン、イダルビシン、ブレオマイシン硫酸塩、マイトマイシン、プリカマイシン、及びストレプトゾシンがある。化学療法抗体謝剤としては、メルカプトプリン、チオグアニン、クラドゥリビン、フルダラビンリン酸塩、フルオロウラシル(5−FU),フロクスウリジン、シタラビン、ペントスタチン、メトトゥレキセート、及びアザチオプリン、アシクロビル、アデニンβ−1−D−アラビノシド、アメトプテリン、アミノプテリン、2−アミノプリン、アフィジコリン、8−アザグアニン、アザセリン、6−アザウラシル、2’−アジド−2’−デオキシヌクレオシド、5−ブロモデオキシシチジン、シトシンβ−1−D−アラビノシド、ジアゾオキシノルロイシン、ジデオキシヌクレオシド、5−フルオロデオキシシチジン、5−フルオロデオキシウリジン、及びヒドロキシウレアがある。
【0070】
化学療法蛋白合成阻害剤としては、アブリン、アウリントリカルボキシル酸、クロランフェニコール、コリシンE3,シクロヘキシミド、ジフテリア毒素、エデニンA,エメチン、エリスロマイシン、エチオニン、フッ化物、5−フルオロトリプトファン、フシジン酸、グアニリルメチレンジホスホン酸塩、及びグアニリルイミドジホスホン酸塩、カナマイシン、カスガマイシン、キロマイシン、及びO−メチルスレオニンがある。更なるタンパク質合成阻害剤としては、モデクシン、ネオマイシン、ノルバリン、パクタマイシン、パラモマイシン、ピューロマイシン、リシン、志賀菌毒素、ショウドマイシン、スパルソマイシン、スペクチノマイシン、ストレプトマイシン、テトラサイクリン、チオストレプトン、及びトリメトプリムがある。DNA合成阻害剤は、本出願で開示した癌治療の一部分として用いることができて、該阻害剤としては、ジメチル硫酸、マイトマイシンC,ナイトロジェン及びサルファーマスタード、等のアルキル化剤;アクリジン色素、アクチノマイシン、アドリアマイシン、アントラセン、ベンゾピレン、エシジュームブロマイド、プロピジュームジイオダイド−インタートワイニングなどのインターカレート薬剤、ディスタマイシン及びネトロプシンのような薬剤がある。トポイソメラーゼ阻害剤、細胞分裂阻害剤、及び、RNA合成阻害剤は、また、本出願で開示した対象物の粒子と組み合わせて、又は組み込むことができて、適切な癌治療を提供するが、トポイソメラーゼ阻害剤としては、クメルマイシン、ナリジクス酸、ンボビオシン、オキソリン酸があり;細胞分裂阻害剤としては、コルセミド、コルヒチン、ビンブラスチン、及びビンクリスチンがあり;RNA合成阻害剤としては、アクチノマイシンD,α−アマニチン、及び、他のカビのアマトキシン、コルディセピン(3’−デオキシアデノシン)、ジクロロリボフラノシルベンジミダゾール、リファンピシン、ストゥレプトバリシン、及びストゥレプトリディジンがある。
【0071】
従って、本出願が記載するNO放出粒子の一部として、又は組み合わせて用いることができる、現代の化学療法薬剤としては、アドリアマイシン、5−フルオロウラシル(5FU),エトポシド、カンプトテシン、アクチノマイシン−D,マイトマイシン、シスプラチン、過酸化水素、カルボプラチン、プロカルバジン、メクロレタミン、シクロホスファミド、イフォスファミド、メルファラン、クロランブシル、ビスルファン、ニトロソウレア、ダクチノマイシン、ダウノルビシン、ドクソルビシン、ブレオマイシン、プリコマイシン、タモクシフェン、タキソール、トランスプラチナム、ビンブラスチン、及びメトトゥレキセート、等々がある。
【0072】
本明細書で用いた様に、用語"抗菌剤"は、バクテリア、カビ、酵母菌、又はヴィールスを殺す、成長を阻害する、又は成長を阻止する如何なる薬剤に対しても用いられる。本出願で開示したNO放出粒子に組み込まれることができて、微生物感染の治療を助ける、又は感染を阻害する適切な抗菌剤には、バンコマイシン、ブレオマイシン、ペントスタチン、ミトキサントロン、マイトマイシン、ダクチノマイシン、プリカマイシン、及びアミカシンがあるが、これらに制限されない。他の抗菌剤としては、2−p−スルファニリーアニリノエタノール、4,4’−スルフィニルージアニリン、4−スルファニルアミドサリチル酸、アセジアスルフォン、アセトスルフォン、アミカシン、アモキシシリン、アンフォテリシンB、アンピシリン、アパルシリン、アピシクリン、アプラマイシン、アルベカシン、アスポキシシリン、アジダムフェニコール、アジスロマイシン、アズトゥレオナム、バシトラシン、バンベルマイシン(複数)、ビアペネム、ブロジモプリム、ブチロシン、カプレオマイシン、カルベニシリン、カルボマイシン、カルモナム、セファドゥロキシル、セファマンドール、セファトリジン、セフブペラゾン、セフクリジン、セフジニル、セフジトレン、セフェピム、セフェタメット、セフィクシム、セフェメノキシム、セフェニノクス、セフォジジム、セフォニシド、セフォペラゾン、セフォラニド、セフォタクシム、セフォテタン、セフォチアム、セフォゾプラン、セフピミゾール、セフピラミド、セフピローム、セフプロジル、セフロクサジン、セフタジジム、セフテラム、セフチブテン、セフトリアクソン、セフゾナム、セファレクシン、セファログリシン、セファロスポリンC、セファラジン、クロランフェニコール、クロルテトラサイクリン、シプロフロクサシン、クラリスロマイシン、クリナフロクサシン、クリンダマイシン、クリンダマイシンリン酸塩、クロモサイクリン、コリスチン、シクラシリン、ダプソン、デメクロサイクリン、ジアシモスルフォン、ジベカシン、ジヒドロストレプトマイシン、ジリスロマイシン、ドキシサイクリン、エノクサシン、エンビオマイシン、エピシリン、エリスロマイシン、フロモクセフ、フォルチマイシン(複数)、ゲンタイマイシン(複数)、グルコスルフォン、ソラスルフォン、グラミシジンS、グラミシジン(複数)、グレパフロクサシン、グアメサイクリン、ヘタシリン、イミペネム、イセパミシン、ホサマイシン、カナマイシン(複数)、ロコマイシン(複数)、リンコマイシン、ロメフロクサシン、ルセンソマイシン、ライムサイクリン、メクロサイクリン、メロペネム、メタサイクリン、ミクロノマイシン、ミデカマイシン(複数)、ミノサイクリン、モクサラクタム、ムピロシン、ナジフロクサシン、ナタマイシン、ネオマイシン、ネチルミシン、ノルフロクサシン、オレアンドマイシン、オキシテトラサイクリン、p−スルファニリルベンジルアミン、パニペネム、パロモマイシン、パズフロクサシン、ペニシリンN,ピパサイクリン、ピペミジン酸、ポリミクシン、プリマイシン、キナシリン、リボスタマイシン、リファミド、リファンピン、リファマイシンSV,リファペンチン、リファキシミン、リストセチン、リティペネム、ロキタマイシン、ロリテトラサイクリン、ロサラマイシン、ロキシスロマイシン、サラゾスルファジミジン、サンサイクリン、シソマイシン、スプラフロクサシン、スペクチノマイシン、スパルマイシン、ストレプトマイシン、スクシスルフォン、スルファクリソイジン、スルファロキシン酸、スルファミドクリソイジン、スルファニル酸、スルフォクソン、テイコプラニン、テマフロクサシン、テモシリン、テトラサイクリン、テトロクソプリム、チアンフェニコール、チアゾールスルフォン、チオストレプトン、チカルシリン、チゲモナム、トブラマイシン、トスフロクサシン、トリメトプリム、トロスペクトマイシン、トロバフロクサシン、ツベラアクチノマイシン、及びバンコマイシンが挙げられる。抗菌薬剤には、また、アンフォテリシンB、アザセリン、カンジシジン(複数)、クロルフェネシン、デルモスタチン(複数)、フィリピン、フンジクロミン、メパルトリシン、ニスタチン、オリゴマイシン(複数)、ペリマイシンA,チュベルシジン、イミダゾール、トリアゾール、及びグリーソフルビンのような、抗カビ薬剤も含まれる。
【0073】
V.治療方法
幾つかの実施態様において、本出願で開示した対象物は、本明細書で定義したように、酸化窒素を患者まで運搬する方法を提供し、この方法は、幾つかの実施態様において、その治療が必要な患者の疾患又は健康状態を治療することを意図するものである。幾つかの実施態様において、本出願で開示した対象物は、患者の特定の部位に、酸化窒素の標的を定めた運搬のための方法を提供する。この様な部位は、特定の細胞、組織、器官であっても良い。従って、本出願で開示した対象物は、任意に少なくとも1つの付加的な治療薬剤と組み合わせて酸化窒素供与体を投与することにより、癌、心血管疾患及び微生物感染を治療する方法;血液を医学的デバイスに曝すことに起因する血小板凝集及び血小板接着を阻害する方法;異常な細胞増殖に起因する病理学的状態を治療する方法;移植拒絶、自己免疫性、炎症性、増殖的、超増殖的、血管疾患;再発狭窄症の予防、及び/又は治療処理を含め、瘢痕組織の減少、又は創傷の収縮のための方法;を提供する。本出願で開示した対象物は、また、炎症、痛み、発熱、胃腸障害、呼吸器障害、性機能障害、及び性的感染症を治療する方法を提供する。
【0074】
V.A.患者
幾つかの実施態様において、本出願で開示した対象物の方法は、本明細書で定義した、患者の治療に有用であることができる。本出願で開示した対象物で治療される患者は、多くの実施態様において、ヒト患者であるが、本出願で開示した対象物の原理により、本出願で開示した対象物は、哺乳動物を含め、全ての脊椎動物種に関して有効であると言うことを理解すべきであり、哺乳動物も用語"患畜"に含まれる事を意図している。此の文脈において、哺乳動物は、治療が望まれる、特に農業及び家庭内の疾患のある、哺乳動物種全てを含むと理解される。
従って、本明細書で用いるように、用語"患者"は全ての無脊椎又は脊椎動物種を表す。本出願で開示した対象物の方法は、温血脊椎動物の治療において特に有用である。従って、本出願で開示された対象物は、哺乳動物及び鳥類に関与する。より具体的には、ヒトのような哺乳動物、及び(シベリアタイガーのように)絶滅の危機にある、(ヒトによる消費のために農場で飼育される動物のように)経済的に重要である、及び/又は例えば、ヒト以外の肉食動物(ネコ及び犬のように)、(豚、ホッグ、及びイノシシのような)スワイン、(畜牛、雄牛、羊、キリン、シカ、ヤギ、バイソン、及びラクダのような)反芻動物、及び馬のように(ペット又は動物園で保持されている動物)ヒトにとって社会的に重要であると言う理由で、重要な哺乳動物の治療、及び/又は診断が提供される。また、動物園で保護されて絶滅の危機にある種類の鳥、及びヒトにとって経済的に重要であるので、ニワトリ、特に例えば七面鳥、チキン、アヒル、ガチョウ、ホロホロ鳥の様な家禽である、家畜としてのニワトリの治療が、提供される。従って、家畜としてのスワイン(豚及びイノシシ)、反芻動物、馬、鶏、等々を含む、がこれらに制限されない、家畜の治療が提供される。
【0075】
V.B.配合剤
本出願で開示した治療組成物は、幾つかの実施態様において、本出願で開示した酸化窒素放出ナノ粒子及び医薬的に許容された担体を含む組成物からなる。適切な組成物としては、抗酸化剤、緩衝液、抗菌剤、殺菌性抗生物質を含む水溶液性及び非水溶液性無菌注射液、及び配合剤を意図した受益者の体液と等張にする溶質;及び懸濁剤及び増粘剤を含むことができる水性及び非水性無菌懸濁物が挙げられる。
幾つかの実施態様において、本出願で開示した治療組成物は、酸化窒素放出ナノ粒子と組み合わせた付加的治療薬剤からなり、ここで付加的治療薬剤は、付加的な希望の治療特性を持つ、又は酸化窒素放出ナノ粒子の治療効果を促進する。付加的治療薬剤は、同一、又は異なる治療組成物で投与される。従って、用語"と組み合わせて"は、活性薬剤を単一組成物としての投与又は1又は2以上の分離した組成物での投与を表すことができる。
本出願で開示した方法において用いられる組成物は、油性又は水溶液性媒体中の懸濁物、溶液、又は乳濁液のような形をとり、懸濁剤、安定剤、及び/又は分散性薬剤のような、製剤用作用物質を含むことができる。あるいは、活性な構成要素は、粉末状であり、使用前に、適切な媒体、例えば無菌パイロジェンフリー水、と共に組成体を作ることができる。
【0076】
治療用組成物は、例えば、密封したアンプル又は水薬ビンのようなコンテナ中に単位用量又は複数用量入れることができて、冷凍条件、又は使用直前に無菌液体担体を加えるだけの凍結乾燥状態で保存できる。
経口投与のために、組成物は、結合薬剤(例えば、前もってゼラチン化されたトウモロコシデンプン、ポリビニルピロリドン、又はヒドロキシプロピルメチルセルロース);増量剤(例えば、ラクトース、微細結晶化セルロース又はカルシウムリン水素酸塩);潤滑剤(例えば、ステアリン酸マグネシウム、滑石、又はシリカ);錠剤分解物質(例えば、ポテトデンプン又はグリコール酸ナトリウムデンプン);又は湿潤剤(例えば、ラウリル硫酸ナトリウム)のような、医薬的に許容された賦形剤を伴って従来型の技術により製造される、例えば、錠剤又はカプセルの形をとることができる。錠剤は、既知の技術により被覆される。例えば、治療薬剤は、ヒドロクロロチアジドと組み合わせて形作られ、また治療薬が標的器官に到着するまで治療薬剤を保護する、腸溶性、又は遅延放出被覆を施されたpHに安定化したコアとして形作られることができる。
経口投与のための液体製剤は、例えば、溶液、シロップ、又は懸濁液の形をとることができる、又は乾燥産物として与えることができて、使用前に水又は他の適切な媒体と伴に調製される。この様な液体製剤は、懸濁剤(例えば、ソルビトールシロップ、セルローズ誘導体又は水素化した食用油);乳化剤(例えば、レシチン又はアカシア);非水溶液性媒体(例えば、アーモンド油、油性エステル、エチルアルコール又は分画した植物油);及び保存剤(例えば、メチル又はプロピル−p−ヒドロキシベンゾエート又はソルビン酸)のような、医薬的に許容された付加物を伴って、従来の技術により製造することができる。この製剤は、また、必要に応じて、緩衝塩、香味料、着色料及び甘味料を含むことができる。経口投与のための製剤は、適切に配合されて、活性化合物の制御された放出を行うことができる。舌下剤投与に対して、組成物は、従来様式で配合される錠剤又はトローチ剤の形をとることができる。
【0077】
化合物をまた、埋め込み、又は注射のための調剤として配合することができる。従って、例えば、化合物は、適切な高分子又は疎水性材料(例えば、許容された油を使った乳濁液として)、又はイオン交換樹脂、又は難溶性誘導体(例えば、難溶性塩として)配合することができる。化合物はまた、直腸の組成物(例えば、座薬、ココアバター又は他のグリセリドのような従来の座薬の塩基を含む滞留浣腸)、クリーム又はローション、又は経皮パッチ中に配合できる。
医薬的配合物はまた、吸入による、噴霧剤としての投与に適切なものを供与する。これらの配合物は、本明細書で記載したNO放出粒子の溶液又は懸濁液を含む。好みの配合物を、小チャンバーに入れることができ、噴霧する。噴霧は、圧縮した空気、又は超音波エネルギーで行うことができて、NO放出粒子を含む複数の液体ドロップ又は固体粒子を作る。例えば、本出願で開示したNO放出粒子は、吸入により投与ができて、嚢胞性線維症に関係する細菌感染を治療する。嚢胞性線維症関連の細菌感染としては、Pseudomonas aeruginosa (P.aeruginosa)感染があるが、これに制限されない。
【0078】
V.C.投与量
本明細書で用いる用語"有効量"は、測定できる生物的応答を作り出すに充分な治療薬組成物(例えば、酸化窒素放出粒子を含む組成物)の量を表す。本出願で開示した対象物の活性組成物中の活性成分の実際の用量レベルは、特定の患者、及び/又は適用に対する好ましい応答を得るに有効な活性化合物を投与するために、変えることができる。選択した用量レベルは、組成物の活性、配合物、投与経路、他の薬剤又は治療との組合せ、治療される健康状態の重篤さ、及び治療を受ける患者の物理的状態及び医療前歴を含めて多くの因子に依存すると考えられる。好ましくは、最小容量を投与し、最小の有効量まで、毒性をもたらさない用量まで用量を増やす。有効量の決定及び修正、及びこの様な修正を何時どの様に行うかについての評価、は医療における当業者に既知である。
本明細書で開示した組成物の投与に対し、齧歯動物モデルへの投与用量に基づきヒト用量へ外挿する従来の方法は、マウス用量をヒト用量へ変換するための変換因子を用いて行うことができる:ヒトkg当たりの用量=マウスkg当たりの用量x12.Freireich他、Cancer Chemother Rep.50,219-244(1966)を参照されたい。薬剤用量はまた、体表面積平方メートル当たりのミリグラムでも得ることができて、その理由は、この方法は、体重を用いるより、ある種の代謝及び排泄機能に対しよい相関をもたらすからである。更に、体表面積は、成人、子供だけでなく異なる動物種への薬剤用量に対する共通分母として用いることができる。Freireich他、Cancer Chemother Rep.50,219-244(1966)を参照されたい。手短に述べると、如何なる与えられた動物種においても、mg/kg用量を等価なmg/sqm用量で表すためには、用量に適切なkmファクターを乗じなさい。成人において、100mg/kgは、100mg/kgx37kg/sqm=3700mg/m2である。
【0079】
配合物と用量に関して更なる手引きとしては、米国特許番号5,326,902;5,234,933;国際公開WO 93/25521; Berkow他、The Merck Manual of Medical Information,Home編,Merck Research Laboratories:Whitehouse Station,New Jersey(1997);Goodman他,Goodman & Gilman's the Pharmacological Basis of Therapeutics,第9版.McGraw-Hill Health Professions Division:New York(1996);Ebadi,CRC Desk Reference of Clinical Pharmacology, CRC Press, Boca Raton, Florida(1998);Katzung,Basic & Clinical Pharmacology,第8版.Lange Medical Books/McGraw-Hill Medical Pub. Division: New York(2001);Remington他,Remington's Pharmaceutical Sciences,第15版.Mack Pub.Co.:Easton,Pennsylvania(1975);及びSpeight他,Avery's Drug Treatment:A Guide to the Properties,Choice,Therapeutic Use and Economic Value of Drugs in Disease Management,第4版.Adis International:Auckland/ Philadelphia(1997);Duch他,Toxicol.Lett.,100-101,255-263(1998)を参照されたい。
【0080】
V.D.投与の経路
本出願で開示した対象物の組成物を患者に投与するに適切な方法には、全身投与、非経口投与(血管内、筋肉内、動脈内投与のような)、経口運搬、舌下運搬、皮下投与、吸入、気管支内導入、外科的な埋め込み、経皮的運搬、局所注射、及び超高速注射/照射があるが、これらに制限されない。適用可能な箇所では、連続的な輸液は、標的部位での薬剤の蓄積を高めることができる(米国特許番号6,180,082を参照されたい)。
本出願で開示した対象物の方法に基づいて使われる薬剤投与の特別な様態は、薬剤、及び/又は使う担体、治療を受ける健康状態の重篤性、及び投与後の活性薬剤の代謝又は除去のメカニズムを含むが、これらに制限されない、多くの因子に依存する。
【0081】
VI.NO放出粒子を含む組成物
幾つかの実施態様において、NO放出粒子を、高分子フィルムに取り込むことができる。この様な取り込みは、高分子表面への粒子の静電気的相互作用を介した、又は高分子表面の反応基への粒子の共有結合による結合による、高分子表面への粒子の物理的な埋め込みでできる。あるいは、粒子は、液体高分子前駆体の溶液に混ぜ合わされ、高分子が硬化した時、高分子マトリクスに取り込まれることができる。重合可能基は、粒子外部を官能基化するために用いることができて、これによって、粒子を重合過程に高分子の中で共―重合化することができる。NO放出粒子を取り込むことができる適切な高分子としては、ポリスチレン、ポリプロピレン、ポリエチレン、ポリテトラフルオロエチレン、及びポリビニリデンのような、ポリオレフィン、さらにポリエステル、ポリエーテル、ポリウレタン等々がある。特に、ポリウレタンは、医学的に区分されたポリウレタンを含むことができる。医学的に区分されたポリウレタンの一般的構造を図9Aに示す。この様なポリウレタンとしては、固い区分、即ち、相対的に硬い部分、及び柔らかい区分、即ち、変化し、相互変換する配置で存在できるより多くの自由度を持つ部分を挙げることができる。医学的に区分されたポリウレタンは、また、高分子に更なる長さ又は重さを加える、アルキレン鎖の様な、1又は2以上の拡張部分を含むことができる。この様なポリウレタンは、また非毒性である。医学的に区分されたポリウレタンの例は、TECOFLEX(R)である。図9Bを参照されたい。
【0082】
NO放出粒子を含む高分子フィルムは、特に外科的道具、生物センサー、及び医学的埋め込み物のような、様々な品物を被覆するために用いることができて、血小板凝集を防ぎ、細菌感染を防ぎ、血管拡張剤として働く。これらの記事は血管の医療用デバイス、尿路の医療用デバイス、胆管の医療用デバイス、胃腸の医療用デバイス、外科的手術部位の配置場所に適合した医療用デバイス、及び皮膚創傷又は皮膚開口の配置場所に適合した医療用デバイスに用いられる。従って、この高分子は、動脈ステント、ガイドワイアー、カテーテル、トロカール針、骨アンカー、骨ネジ、保護メッキ、腰及び関節交換、電気導線、生体センサー、プローブ、縫線、外科用ドレープ、傷用包帯及び包帯を被覆するために用いることができる。
幾つかの実施態様において、被覆されたデバイスは、例えば、ステンレス鋼、ニッケル、チタン、アルミニウム、銅、金、銀、白金、及びこれらのコンビネーションのような金属表面を持つことができる。幾つかの実施態様において、NO放出粒子を含むフィルム又は高分子は、ガラス又は繊維(例えば、布又は紙)のような非金属表面を被覆するために用いることができる。
更に、NO放出粒子を含む高分子は、デバイス自体を作るために用いることができる。例えば、高分子は、血液又は組織の保管用バッグ用に、又は傷用包帯として形作ることができる。
【0083】
更に、NO放出粒子は、抗菌石鹸のような、しかしこれに制限されない、界面活性剤中に取り込まれることができる。例えば、棒石鹸に埋め込まれた粒子の中のNO放出は、使用時に水との接触、及び/又はpHの低下により誘発される。棒石鹸の外部表面は、すり減り、又は溶けるので、棒石鹸中のさらなる粒子が、その後の棒石鹸の使用のために露出される。NO放出粒子は、また液体石鹸中に懸濁できる。この様な石鹸又は界面活性剤は、個人的な衛生のために使われ、又は繊維に対する抗菌処理を提供するために使用できる。この様な、石鹸、又は界面活性剤は、家庭用の表面、又は病院、又は細菌、カビ、又はウィルスに曝される可能性のある、他の医療環境すべての表面を処理するために用いることができる。
【実施例】
【0084】
以下の実施例に含まれることは、本出願で開示した対象物の代表的実施態様を実行する上での、当業者に対する手引きを提供することである。本出願の開示と、一般的な技術レベルを踏まえて、以下の実施例は例を示しただけであり、本出願で開示した対象物の範囲から離れることなく、無数の変化、修飾、改変が可能であることを、当業者は認識することができる。
【0085】
実施例1 アミン基で官能基化した金ナノ粒子の合成
金ナノ粒子を2段階過程でアミン官能基化し、第1段階では、金ナノ粒子コアにBr官能基化したチオールリガンドを交換し、次の段階で、Brとの反応でアミン基を付加する。図2を参照されたい。試料の1H NMRスペクトルが合成の各段階に対して得られ、図10に示す。
より具体的には、水素化ホウソナトリウムの存在下で、水素テトラクロロ金酸塩とヘキサンチオールの反応を経たBrust法により、金ナノ粒子を合成した。Hostetler,M.I.他、Langmuir,14,17-30(1998)を参照されたい。30分後、水を加えて反応を停止させた。ナノ粒子を濾過により集め、アセトニトリルで洗浄し、その後位置交換法により、臭素末端のアルカンチオールを用いて官能基化した。Hostetler,M.I.他、Langmuir,15,3782-3789(1999)を参照されたい。
入ってくる臭素末端リガンド(本明細書の以下に記載する実施例2に合成された11−ブロモ−1−ウンデカンチオール)(Troughton,B.B.他、Langumuir、4,365-385(1988)を参照されたい)を金ナノ粒子のメチレンクロライド溶液に加え(メチル基末端に対する臭素末端の比が3:1のアルカンチオール)、30分間攪拌した。溶媒を回転蒸発により取り除き、金ナノ粒子をアセトニトリルで精製した。リガンド交換の程度を、NMRでモニターし、反応時間、及び/又は臭素―アルカンチオールの濃度を変えることによりコントロールした。次ぎに、臭素官能基化した金ナノ粒子をトルエン、又はメチレンクロライドに溶かしエチレンジアミン、ブチルアミン、ヘキサンジアミン、又はジエチレントリアミンと反応させた。官能基化したナノ粒子のNMRスペクトルにおいて、−CH2Brピークが消えることは、反応の完了を示す(図10を参照のこと)。次ぎに、アミン官能基化した金ナノ粒子をメタノール及びメトキシドナトリウム塩基の溶液に懸濁し、常に攪拌しながら3日間、5気圧NOの圧を掛け、ジアゼニウムジオレイン酸塩NO供与体の合成を進行させた。N−ジアゼニウムジオレイン酸塩修飾の単層で保護されたクラスター(MPCs)を濾過し、過剰なメタノールで洗浄し、使用まで−4℃に保存した。
【0086】
MPC金ナノ粒子のサイズ及び安定性については、熱重量分析(TGA),UV−Visスペクトロスコピー、及び透過型電子顕微鏡(TEM)を用いて、特性を調べた。ヘキサンジアミン修飾金ナノ粒子の有機含量は、約22%であると測定され、22%と言う値は、53個のチオールリガンドで保護された140個の金原子(コア)を含むヘキサンジオール−MPCsについての過去の報告と一致した。Hostetler,M.I.他、Langumuir,14,17-30(1998)を参照されたい。
NOは非常に反応性が高く、金イオウ結合を壊す可能性があるので、(Hrabie,J.A.及びKeefer,L.K.,Chemical Review、102,1135-1154(2002)を参照されたい)高圧NOに曝した後のヘキサンチオール−MPCsの安定性を、TGA及びUV−Visスペクトロスコピーを用いて評価し、ジアゼニウムジオレイン酸塩形成に必要な条件が、ナノ粒子全体性を損ねない事を裏付けた。ナノ粒子の有機含量(TGAで分析)及びUV−Visスペクトルが、NOへの暴露後同じであったことは、単層の安定性に(NOは)殆ど影響を与えないことを示す。透過型電子顕微鏡像により更に、ナノ粒子のコア直径は、アミン誘導体化又はジアゼニウムジオレイン酸塩形成と無関係に、一定(2.1±0.9nm)であることを確認した。これらの研究は、MPC金ナノ粒子の構造的な全体性は、NO供与体の合成、及びNO放出能の導入に必要な条件により損なわれない事を示唆する。
【0087】
実施例2 11−ブロモ−1−ウンデカンチオールの合成
11−ブロモ−1−ウンデカンチオールを、2段階で合成した(図11を参照のこと)。第1に、11−ブロモ−1−ウンデセン(5.0g)をトルエン(50mL)中で、AiBN(1.5g)及びチオ酢酸(10mL)との反応により、チオ酢酸塩に変換した。反応は、Ar気流中で行い、2時間還流した。溶液を過剰な水で洗浄し、回転蒸発により、トルエンを除いた。11−ブロモ−1−ウンデカンチオアセテートを乾燥HClに暴露して、チオ酢酸塩を、チオールに変換した。塩化アセチル(6mL)をAr気流中で、氷浴中の乾燥メタノールに滴下して加えた。この溶液を室温まで温め、反応を約6時間進行させた。塩化メチレン及び水を加え、塩化メチレン層を水で数回洗浄した。溶媒を回転蒸発で除いた。
【0088】
実施例3 酸化窒素放出測定のための一般的手順
本出願で開示したNO放出粒子の酸化窒素放出を、以下の一般的手順に従い測定した。図12を参照し、所定の容量のリン酸緩衝液(PBS)(pH7.4,37℃)を容器、例えば丸底フラスコ、に入れた。容器の入口を窒素ガス、出口を窒素と酸化窒素の混合ガスのため以外密封した。出口を化学発光酸化窒素分析器と溶液により接続した。ジアゼニウムジオレイン酸塩化学種溶液の一部をPBS緩衝液に注入した。化学発光酸化窒素分析器により、NOはオゾン(O3)と反応し、励起NO2*を作り、反応図2に示すように、NO2*は電磁波(hν)を発光することにより、NO量を測定した。
【化3】

反応図2.化学発光によるNOの測定
【0089】
実施例4 アミン誘導化単層により保護された金ナノ粒子からの酸化窒素放出の測定
酸化窒素放出は、リン酸緩衝液塩溶液中で、生理的温度及びpHにおいて、Sievers NOATM 化学発光酸化窒素分析器(Boulder,Colorado,USA)を用いて測定した。以下の表1及び図13に示すように、ジアゼニウムジオレイン酸塩修飾金ナノ粒子からのNO放出は、置換したアミン基リガンドの数、及び/又は化学構造を変えることにより、調節できる。官能基化した単層で保護されたクラスター(MPC)金ナノ粒子からの酸化窒素放出を示す図式を図14に示す。
【表1】

【0090】
実施例5 単層保護の金ナノ粒子からなるNO放出粒子からの結果
表1及び図13を再度参照すると、エチレンジアミンリガンドの濃度を14から21%に上げると、対応して全NO放出量(9750から19,300pmolNO/mgMPC)及びNO放出持続時間(200から300分)の増加をもたらす。特別な操作理論によるなく、NO放出の増加は、アミン基の濃度増加によるNO供与体形成の増加に起因すると言うことが示唆される。ヘキサンチオールMPC対照から、また少量のNO(400pmol/mg)が測定された。しかしながら、このNO放出は、5分間以上の長い時間では無視できるので、ジアゼニウムジオレイン酸塩合成に必要な条件(5気圧NO)で、少量のNOが恐らく疎水性アルキル鎖の間にインターカレートするが、このようなNOは溶液内において急速に放出されることが示唆される。
ジアゼニウムジオレイン酸塩修飾MPCsはまた、暖かい(37℃)の窒素ガス気流中で低レベルのNOを放出するので、熱分解機構の関与が示唆される。しかしながら、NO放出のレベルは、緩衝液中の方が大きいので、N−ジアゼニウムジオレイン酸塩修飾ナノ粒子は、プロトン駆動、及び熱分解の両者を受けることが示唆される。ジアゼニウムジオレイン酸塩修飾MPCSは、窒素中に−4℃で保存すると、14日間まで(研究した最大期間)は、完全なNO放出特性を保持する。
【0091】
ジアゼニウムジオレイン酸塩修飾MPCsからのNO放出はまた、アミン基前駆体構造を変えることで調節される。アルキル鎖を伸ばして、窒素を2から6メチレン基ユニット遠ざけると、NO放出の全量が増加する(表1及び図13d及びfを参照のこと)(エチレンジアミン−及びヘキサンジアミン−修飾MPCsに対し、夫々19,300から87,000pmolNO/mgMPC)ので、NO放出/ジアゼニウムジオレイン酸塩構造関係が示唆される。
実際、半減期データ(表1)より、アミン基の間を離すと、小分子ジアゼニウムジオレイン酸塩に対して報告された分解挙動と類似して、NOの放出もより急速になることが分かる。Hrabie,J.A.,他,J.Org.Chem.,58,1472-1476(1993);Davies,K.M.他,J.Am.Chem.Soc.,123,5473-5481(2001)を参照されたい。
ジエチレントリアミン修飾MPCSからのNO放出の全量(38,000pmolNO/mg)は、エチレンジアミン−及びヘキサンジアミン−修飾MPCsに対して測定した値の間にある。ジエチレントリアミンにおいて、窒素を離すアルキル鎖の長さは短いままである(2メチレンユニット)が、付加的に2級アミン基が存在するので、エチレンジアミンと比較して、NO供与体形成(及び放出能)が増加するのであろう。
2級モノアミン誘導体であるブチルアミン修飾MPCsは、全てのアミン基修飾MPCsの中で最少の全NO放出することで特徴付けられる。アミン基を付加的することによって、ジアゼニウムジオレイン酸塩形成が促進される。Hrabie,J.A.,他、J.Org.Chem.,58,1472-1476(1993);Davies,K.M.,他、J.Am.Chem.Soc.,123, 5473-5481(2001)を参照されたい。特に、アミン基修飾MPCsのジアゼニウムジオレイン酸塩への変換率は、アミン構造に関わりなく、1%以下であると計算された。
【0092】
実施例6 酸化窒素放出デンドリマーの合成
【化4】

反応図3.親油性テイルを持つデンドリマーの一般的手順
ポリプロピレニミンヘキサデカアミンデンドリマー(DAB−Am−16、Aldrich Chemical Company,Milwaukee,Wisconsin, USAより入手可能)(図15を参照のこと)に、NaOMe存在下に、3日間、5気圧の酸化窒素をチャージした。この操作により、0.74モル酸化窒素/モル デンドリマー(2.3%変換率)及び2.3x10−8モル酸化窒素放出がもたらされた。
ポリプロピレニミンテトラヘキサコンタアミンデンドリマー(DAB−Am−64,Aldrich Chemical Company,Milwaukee,Wisconsin, USAより入手可能)(図16を参照のこと)を、NaOMe存在下に、5気圧酸化窒素で、3日間チャージした。この手順により、4.94モル酸化窒素/モル デンドリマー(3.9%変換率)を得た、また1.18x10−8モル 酸化窒素が放出された。
【0093】
DAB−C7−16(以下の反応図4を参照のこと)に、NaOMe/MeOH(反応図5)存在下に、3日間、5気圧の酸化窒素をチャージした。この操作により、12モル酸化窒素/モル デンドリマー(37.9%変換率)を得た、また3.74x10−7モル酸化窒素が放出された。
【化5】

反応図4.DAB−C7−16の合成
【化6】

反応図5.DAB−C7−16ジアゼニウムジオレイン酸塩の合成
【0094】
DAB−C7−64に、NaOMe/MeOH存在下に、3日間、5気圧の酸化窒素をチャージした。この操作により、45モル酸化窒素/モル デンドリマー(35.6%変換率)を得た、また1.48x10−7モル酸化窒素が放出された。
図17に、DAB−C7−16NaOMe/MeOHの場合の、時間の関数として酸化窒素放出を示すグラフを示す。同様に、図18に、DAB−C7−64NaOMe/MeOHに対する時間の関数として酸化窒素放出を示すグラフを示す。
DAB−Ac−16(反応図6)に、NaOMe存在下に、3日間、5気圧の酸化窒素をチャージした。この操作により、0.039モル酸化窒素/モル デンドリマー(0.12%変換率)を得た、また4.95x10−10モル酸化窒素が放出された。
【化7】

反応図6.DAB−Ac−16の合成
【0095】
DAB−Ac−64に、NaOMe存在下に、3日間、5気圧の酸化窒素をチャージした。この操作により、0.22モル酸化窒素/モル デンドリマー(0.17%変換率)を得、また3.75x10−10モル酸化窒素が放出された。
DAB−Pro−16(反応図7)に、NaOMe存在下に、3日間、5気圧の酸化窒素をチャージした。この操作により、42モル酸化窒素/モル デンドリマー(130%変換率)を得た、また1.92x10−7モル酸化窒素が放出された。
【化8】

反応図7.DAB−Pro−16の合成
DAB−Pro−64に、NaOMe存在下に、3日間、5気圧の酸化窒素をチャージした。この操作により、480モル酸化窒素/モル デンドリマー(377%変換)及び4.79x10−7モル酸化窒素放出がもたらされた。
【0096】
実施例7 アミン誘導化デンドリマーから酸化窒素放出の測定
実施例6の記載のように合成されたアミン誘導化デンドリマーからのNO放出は、実施例3に概説された手順に従って測定された。表2に結果をまとめる。
【表2】

【0097】
実施例8 ジアゼニウムジオレイン酸塩化した材料からの酸化窒素放出の測定
多くのNO放出材料からのNO放出を、実施例3に概説した手順に従い測定した。結果を表3に示す。以下の実施例9の記載のように、フュームドシリカ表面をN−(6−アミノヘキシル)−3−アミノプロピルトリメトキシシランにグラフト化し、その後NO気体で2級アミン基のジアゼニウムジオレイン酸塩化を行い、ジアゼニウムジオレイン酸塩化したフュームドシリカ粒子を合成した。
【表3】

【0098】
実施例9 NO放出シリカ粒子への合成ルート
図19を参照して、粒子サイズが薬200nmから約300nmの範囲であるNO放出シリカ粒子を参考文献Zhang,H.他、J.Am.Chem.Soc.,125,5015(2003)に記載された方法に従い合成した。
【0099】
実施例10 NO供与体前駆体の共凝縮に基づくシリカの合成
試薬及び材料:テトラエチルオルトケイ酸塩(TEOS),テトラメチルシラン(TMS),及びナトリウムメトキシド(NaOMe)は、Fluka(Buchs,Switzerland)から購入した。(アミノエチルアミノメチル)フェネチルトリメトキシシラン(AEMP3),N−(6−アミノヘキシル)アミノプロピルトリメトキシシラン(AHAP3),N−(2−アミノエチル)−3−アミノプロピルトリメトキシシラン(AEAP3),及びN−[3−(トリメトキシシリル)プロピル]ジエチレントリアミン(DET3)を含むシランは、Gelest(Tullytown, Pennsylvania, USA)より購入した。N,N−ジメチルホルムアミド(DMF)は、Sigma Chemical Company(St.Louis, Missouri, USA)より購入した。メタノール(MeOH),エタノール(EtOH),トルエン、及びアンモニア溶液(NH4OH、水溶液中30重量%)は、Fisher Scientific(Fair Lawn,NewJersey,USA)より購入した。酸化窒素(NO,99.5%)、アルゴン(Ar),及び窒素(N2)ガスは、AGA Gas(Maumee,Ohio,USA)、又はNational Welders Supply(Raleigh, North Carolina, USA)より得た。他の溶媒及び化学試薬は、分析試薬用の薬品であり、そのまま用いた。Millipore Milli-Q UV Gradient A10 System(Millipore Corporation, Bedford, Massachusetts, USA)を用いて、蒸留水を精製し、最終的に比抵抗値18.2MΩ・cm及び全有機物含量<6ppbを得た。
【0100】
酸化窒素放出シリカナノ粒子の合成:2.78mmol(620μL)TEOSと異なる濃度のAEAP3,AHAP3,AEMP3,又はDET3(0〜20モル%に相当する0〜0.70mmol、バランスTEOS)を10分間混合して、シラン溶液を調製した。このシラン溶液を22mLのEtOH、及び6mLアンモニア(水溶液中30重量%)と混合し、室温で30分間激しく攪拌した。白色沈殿物を遠心(5000rpm、5分間)して集め、EtOHで繰り返し洗浄し、真空中で、一晩乾燥した。
得られたアミン官能基化シリカを、NaOMe(0.32〜0.70mmol;シリカ混合物の2級アミン基に同一当量NaOMeを加える)の存在下に、18mLDMF、及び2mLMeOH中に懸濁し、攪拌棒を備えた10mLバイアル内に入れた。このバイアルをParrビン(200mL)内に置き、インハウスNO反応器と接続し、懸濁液中の酸素を取り除くために、6回Arによりフラッシュした。その後、反応ボトルにNOガスを、5気圧で、チャージし、3日間攪拌しながら密封した。痕跡量のNO分解物を除くために、NOガスをKOHペレット上に2時間保ち精製した。シリカ粒子を取り出す前に、未反応のNOをArにより、反応器から一掃した。N−ジアゼニウムジオレイン酸塩修飾シリカ粒子を、5000rpm、5分間の遠心で集め、エタノールで繰り返し洗浄し、室温で1時間乾燥し、−20℃で、使用まで密封した容器内で貯蔵した。
【0101】
実施例11 官能基化したシリカの特性
固体状態交差分極/マジックアングルスピニング(CP/MAS)29Si核磁気共鳴(NMR)スペクトルを、大広径マグネット(トリプルアクシス パルスフィールドグラディエント 2重共鳴プローブ)を備えたBruker 360MHzDMXスペクトロメーター(Billerica, Massachusetts, USA)を用いて、293Kで得た。シリカ混合粒子(0,10,13,及び17モル%AEAP3,バランスTEOS)を、4mmのローター(二重共鳴振動数71.548MHz)に充填し、8.0kHzの速度で回転させた。化学シフトは、TMS外部標準に相対的に、ppmで測定した。
原子間力顕微鏡(AFM)画像の場合、シリカ粒子を、トルエン中に懸濁し、新たに劈開した雲母表面の上に置き、室温条件で3時間乾燥させた。Ingor Pro(Wavemetrics;Lake Oswergo, Oregon, USA)の下で使われるMFP−3Dソフトウェアで制御された分子力プローブ3D原子間力顕微鏡(Asylum Research;Santa Barbara, California, USA)を用いて、接触法によるAFM画像を空気中で得た。名目的バネ定数0.12N/m−1及び共鳴振動数20kHz(Veeco;Santa Barbara, California, USA)をもつ三角形シリコン窒化物カンティレベールを用いて、高さ/トポグラフィー画像を0.5Hz走査速度で得た。N−ジアゼニウムジオレイン酸塩修飾シリカナノ粒子の酸化窒素放出プロフィールを、Sievers NOA280i化学発光酸化窒素分析器(Boulder, Colorado, USA)を用いて、脱酸素化リン酸緩衝塩液中で、pH3.3,4.3,5.3,6.0、7.4及び9.5で、測定した。シリカより放出した酸化窒素を、反応セルを通過するN2(200mL/min)のガス流により分析器へ移動した。装置をゼロフィルターを通した空気(0ppmNO)及び24.1ppmNO標準ガス(AGA GASより購入したバランスN2)によりキャリブレートした。
Beckman Coulter SA3100 表面積及び孔サイズ分析器(Fullerton, California, USA)でデーターを回収した窒素吸着/脱着等温線(Huh.S., 他、Chem.Mater.,15,4247-4256(2003))により、シリカの表面積及び孔容積を測定した。表面積及び孔容積を、Brunauer−Emmett−Teller(BET)及びBarrett−Joyner−Halenda(BJH)法により計算した。測定前に、全てのシリカ試料を200℃、3時間、脱気した。
【0102】
実施例12 NO供与体前駆体の共凝縮に基づくNO放出シリカナノ粒子の物理的特性
シリカナノ粒子のサイズは、用いるアミノアルコキシシランの種類及び濃度を変えることにより調節できる。異なるシラン組成を持つシリカ球体の接触法原子力間顕微鏡(AFM)画像を、図20A〜20Eに示す。対照(TEOSのみ)シリカ粒子の直径は、250±20nmであった。TEOS溶液に10モル%AHAP3を加えて変えると、粒子の直径は20±2nmに減少する。AEAPS3及びTEOSから合成したシリカ粒子は、対照よりおよそ2倍大きい(d=500±45nm)。AEAP3のモル%が、10より17モル%(バランスTEOS)に増えると、粒子の直径は、92±16nmに減少し、シリカサイズとアミノアルコキシシラン濃度の間の擬線型関係を表す(図20F)。同様なサイズにおける傾向が、調べた各アミノアルコキシシランシステムに見られる。粒子のサイズは、N−ジアゼニウムジオレイン酸塩合成後には変化しないので、シリカ粒子の構造的な全体性は、NO供与体形成及びNO放出能導入に必要な条件により損なわれないことを示す。
【0103】
図21A〜21Cに示すように、固体29Si核磁気共鳴(NMR)を用いて、アミノアルコキシ官能性のシリカネットワークへの導入を確認し、またこのリガンドの表面被覆率(SC)を測定した。交差分極及びマジックアングルスピニング(CP/MAS)技術を用いて、シグナル分解能と感度が上昇した。0から17モル%AEAP3(バランスTEOS)から合成した、対照及びアミン官能基化したシリカ粒子を解析した。TEOS対照シリカの場合、29SiNMRスペクトル中に3本の特徴的なピークが、−90、−101,及び−109ppmに観測され、これらはそれぞれQ2(ゲミナルシラノール;−O2Si(OH)2),Q3(シングルシラノール;−O3Si(OH))及びQ4(シロキサン;−O4Si)シリコンの代表例である。Huh,S.,他、Chem.Mater.,15,4247-4256(2003);及びAlbert,K.,and Bayer,E.J.,J.Chromatogr.,544,345-370(1991)を参照されたい。アミノアルコキシシラン修飾シリカ粒子の場合、5本のピークがスペクトルにおいて観測され、3本の付加的なシリコン化学的環境(図21Aのグラフb〜d)を示す。約−52及び−65PPMの化学シフトにおけるピークは、夫々、T2(−O2Si(OH)R)及びT3(−O3SiR)構造の代表例である(ここでRはアミノエチルアミノプロピル基である)。Huh,S.,他、Chem. Mater.,15,4247-4256(2003);及びAlbert,K.,及びBayer,E.J.,J.Chromatogr.,544,345-370(1991)を参照されたい。Tnバンドが存在することは、アミノアルコキシ基とシリカ骨組みの間に共有結合があることを示唆する。Q2,Q3及びQ4を表わす共鳴線はまた、予期した位置に同定できた。AEAP3含量が10から17モル%に増すと、アミノアルコキシリガンドの表面被覆率[SC=(T2+T3)/(T2+T3+Q2+Q3);Huh,S.,他、Chem.Mater.,15,4247-4256(2003);及びRadu,D.R.,他.J.Am.Chem.Soc.,126,1640-1641(2004)]が、対応して、21から37%に増えた。図21Cを参照されたい。注目すべきことは、各ピークの強度が、交差分極及びプロトン緩和時間の効率に依存するので、これらの構造の定量的解析は複雑である。Bruch,M.D.及びFatumbi,H.O.,J.Chromatogr.A,1021,61-70(2003)を参照されたい。
前記のように、窒素吸着−脱着等温線を用いて、シリカナノ粒子の表面積及び孔容積を見積もった。Huh,S.,他、Chem. Mater.,15,4247-4256(2003)を参照されたい。予期したように、アミン官能基化シリカは、10〜20m2g−1の表面積(SBET)及び0.02〜0.06mL・g−1(p/p0=0.98において)の孔容積を(Vp)もつ非孔性であることが証明された。
【0104】
実施例13 NO供与体前駆体の共凝縮に基づくNO放出シリカナノ粒子の結果
NO全量(t[NO])、NO放出の半減期(t1/2)、NO放出の最大流速[NO]m及び[NO]mに到達するに必要な時間(tm)を、アミノアルコキシシラン構造及び量の関数として見積もった。結果を以下の表4に示す。
【表4】

【0105】
NO放出を、リン酸緩衝塩液(PBS)中で、生理的温度(37℃)及びpH(7.4)において、化学発光酸化窒素分析器を用いて測定した。Beckman,J.S.,及びConger,K.A.,Methods Companion MethodsEnzymol.,7,35-39(1995)を参照されたい。2種類の代表的なシリカナノ粒子(AHAP3及びAEAP3を夫々10及び17モル%、バランスTEOS)のNO放出プロフィールを図22において比較した。注目すべきことに、NO"最大積載量"及び放出速度は、シリカナノ粒子合成に用いたアミン基リガンドの濃度及び化学構造により顕著に影響された。調べた、4種のアミノアルコキシシランシステム(例えば、AEAP3,AHAP3,AEMP3及びDET3)のうちで、AEAP3シリカは、最大量のNOを放出した。AEAP3のモル%を10から17モル%に増すと、対応してt[NO]及び[NO]mが増加した(夫々、145から600nmol/mg及び14から140ppb/mgに)。しかしながら、t1/2及びtmはどちらも、アミノアルコキシシラン濃度が増加すると減少した(10から17モル%AEAP3の増加に対して、それぞれ12から3.4時間及び8.0から2.1時間)。NO放出の持続は、10及び17モル%AEAP3に対して、より少量ではあるが、30時間まで顕著なレベルが続いた。
【0106】
このようなNO放出挙動の一つの可能性として、粒子サイズに帰すことができる。本明細書で記述した幾つかの粒子の直径及び表面積を下記の表5に示す。与えられたアミノアルコキシシランに対して(アミノアルコキシシラン濃度が高くなるにつれて)、粒子の直径が減少するに従い、内部のNO供与体リガンドまでの水拡散距離は小さくなることが予想される。従って、N−ジアゼニウムジオレイン酸塩のNOへの分解は、水の取り込みに従うので、NO放出はより早くなる。とりわけ、これらシリカ粒子のNO放出特性は、小分子N−ジアゼニウムジオレイン酸塩、及び表面グラフティングにより調製されたBO放出シリカの特性と異なる。実際、同様のアミン前駆体(即ち、アミノヘキシルアミノリガンド)を用いて合成したシリカであるが、類似した小分子DMHD/NOのt1/2は0.05時間であり、N−(6−アミノヘキシル)−3−アミノプロピルトリメトキシシラン(Zhang,H.他、J.Am.Chem.Soc.,125、5015-5024(2003)を参照されたい)で合成した、表面グラフトされたシリカNO供与体のt1/2は0.72時間であり、AHAP3シリカのt1/2は0.85時間でありこれらより長い。同様に、"ワンポット"合成で調製したAEAP3ベースのシリカ粒子のt1/2は3.4〜12時間であるのに対し、表面グラフトされたAEAP3シリカ(Zhang,H.他により、2N[2]と呼ばれる)のt1/2は2.4時間と報告されている。Zhang,H.他、J.Am.Chem.Soc.,125、5015-5024(2003)を参照されたい。
【0107】
【表5】

シリカ粒子骨格からのNO放出動特性に対するpHの効果も図23にあるように調べた。小分子N−ジアゼニウムジオレイン酸塩の挙動と一致して(Davies,K.M.他、J.Am.Chem.Soc.,123,5473-5481(2001)を参照されたい)、NO放出は、酸性条件下(pH3.3)で、加速した。反対に、上昇したpH(9.5)では、NO放出はかなり減速し、従って、N−ジアゼニウムジオレイン酸塩の顕著な劣化無しに、NO供与体ナノ粒子を貯蔵及び輸送する簡単な方法を示す。t[NO]は、すべてのpHで同様であったが、NO放出動特性は、低いpHで劇的に上昇した。pH7.4に比べて、pH3.3では、NO放出の最大流量([NO]m)は9倍上昇した。この様な挙動、及びN−ジアゼニウムジオレイン酸塩分解のpH依存性に基づき、シリカ骨格の場合、NO放出の主要な機構はプロトンにより開始されると確認されたように見える。
【0108】
実施例14 NO放出メソ多孔質AEAP3−シリカ粒子の合成における鋳型としてのCTABの使用
セチルトリメチルアンモニウム臭化物(CTAB)を、メソ多孔質AEAP3シリカ合成の際の鋳型として用いた。メソ多孔質シリカを、10モル%AEAP3、を用いて、実施例10に記載したように合成した。更に、AEAP3/TEOS塩溶液は0.01M CTABを含んだ。シラン混合物の凝縮の後、粒子を75℃、24時間、EtOHに溶かした1M HClで処理し、CTABを除いた。メソ多孔質NO放出シリカ粒子の計画された断面図を図24Aに示す。
この粒子を実施例11に記載したように、原子間力顕微鏡を用いて解析した。図24B参照。酸化窒素放出をまた、実施例11に記載したように測定した。37℃における、PBS中、3mgのメソ多孔質粒子に対して、時間(hr)の関数としてNO放出(ppb)を図25に示す。
【0109】
実施例15 プレチャージしたNO供与体の共凝縮に基づくシリカ粒子の合成
NO供与体前駆体("合成後チャージ法"又は単に"ポストチャージ法"とも呼ばれる)の共凝縮で合成されたシリカナノ粒子からのNO放出レベルは、小分子ジアゼニウムジオレイン酸塩からのものより顕著に高いが、ナノ粒子合成に用いられるアミノアルコキシシランの含量は、高濃度のアミノシラン濃度では、粒子が凝集するので、<20モル%に制限された。特別な理論によらずに、この凝集は、アミン基と隣接したシラノール間、及び/又は他のアミン基との水素結合による相互作用に帰することができると信じられる。
アミノアルコキシシラン、及び従って、粒子のNO供与体含量の濃度を増すために、本出願で開示した対象物のシリカナノ粒子を合成するための更なる方法として、ジアゼニウムジオレイン酸塩を含むシランの共凝縮がある。従って、シリカナノ粒子を最初に合成し、その後、ジアゼニウムジオレイン酸塩NO供与体("ポスト合成チャージ法"又は単に"ポストチャージ法"とよばれる)合成に必須なNOガスを装填("チャージ")した、実施例10に記載した方法とは異なり、ジアゼニウムジオレイン酸塩は、シリカナノ粒子の共凝縮前にもまた合成することができる(即ち、"プレチャージ法")。図5B参照。
【0110】
要約すると、適切な量のアミノアルコキシシランをEtOH、MeOH及びNaOMe混合物に溶解して、アミノアルコキシシラン溶液を調製する。攪拌しつつ溶液に、NOを加圧(5気圧、3日間)し、ジアゼニウムジオレイン酸塩修飾アミノアルコキシシランを合成した。TEOSと異なる割合(10〜75モル%、バランスTEOS)のジアゼニウムジオレイン酸塩修飾アミノアルコキシシランシラン溶液を混合して、シラン溶液を調製した。このシラン溶液を、アンモニア触媒存在下で、EtOH溶媒に加えた。得られた白色沈殿を遠心により集め、EtOHで洗浄し、室温で乾燥し、使用まで、−20℃で、密封容器内に保管した。この結果より、アミノアルコキシシランは最初ジアゼニウムジオレイン酸塩に変換され、それにより粒子形成の間にアミン位置と相互作用することから免れるので、プレチャージ法により、凝集を減らすということが示唆される。従って、このアプローチにより、NaOMe及びNOが、アミン前駆体により多く接近することが可能となり、アミノアルコキシシラン前駆体モル数あたりの高いNO収量がもたらされる。
【0111】
実施例16 プレチャージ法のNO供与体の共凝縮で合成された粒子のNO放出特性
実施例15に記載したプレチャージ法により合成したジアゼニウムジオレイン酸塩修飾シリカナノ粒子のNO放出特性を、表6にまとめる。注目すべきことに、全NO放出(t[NO])及びNO放出の最大量([NO]m)は、同一アミノアルコキシシラン濃度で、ポストチャージ法により合成したNO放出シリカと比べて、かなり増加した(表4を参照のこと)。例えば、17モル%AEAP3に対して、t[NO]及び[NO]mは、夫々600から800nmol/mgに、また140ppb/mgから1200ppb/mgに増加した。如何なる理論にこだわることなしに、図5Bに示すように、NO放出の増加は、ジアゼニウムジオレイン酸塩NO供与体がより均一にシリカ粒子上を分布しているためと解釈される。より重要なことは、プレチャージ法では、アミノアルコキシシラン含量を、凝集無しに、45モル%まで増加できて、結果的にt[NO]及び[NO]mが相伴って増加した。
メチル基末端2級アミンを含むアミノアルコキシシランである、メチルアミノプロピル−トリメトキシシラン(MAP3)をまた、NO放出シリカ粒子を合成するために使った。1級アミン基及び水素結合相互作用を除くことで、合成の際用いる溶媒によって、MAP3アミノアルコキシシラン濃度が75モル%まで、及び粒子サイズが80〜400nmの粒子が合成可能である。更に、MAP3濃度を10から75モル%まで増加すると、NO放出特性が増加する(例えば、t[NO]は1600から10200nmol/mg増加した)。更に、MAP3ベースのシリカ粒子のNO放出は、より大きな初期のNO放出バースト、及びより短い全体的NO放出半減期(夫々、33000〜177000ppb/mg、及び〜5分間)で特徴付けられる。
【0112】
【表6】

【0113】
実施例17 卵巣癌研究
NO供与体シリカナノ粒子の殺腫瘍性能を評価するために、不死化正常(T29)及び癌(A2780及びOVCAR−3)ヒト卵巣上皮細胞に対する対照及びNO放出シリカ粒子の細胞毒性を調べた。以下に記載のように、MTT細胞生存率アッセイを行った。3−(4,5−ジメチルチアゾール−2−イル)−2,5−ジフェニルテトラゾリウム臭化物(MTT)増殖アッセイを用いて、OVCAR−3細胞のPYRRO/NOへの相対的感受性を測定した。細胞を6セットの96ウェルマイクロタイタープレートに1〜5x103細胞/ウェルに蒔種し、一晩インキュベートし、幾つかの濃度のNO供与体及び対照ピロリジン溶液で48時間処理した。その後、NO放出培地を除き、MTT溶液に置き換え、細胞を更に4時間、37℃でインキュベートした。MTT除去後、DMSOを加え、マイクロプレートリーダーを用いて、溶液の560nmの吸光度を測定した。
図26に示すように、A2780卵巣上皮腫瘍細胞を様々な用量(0.013〜1.0mg/mL)の対照及びNO放出AHAP3シリカ粒子で48時間処理した。A2780細胞の生存率は、低用量のNO放出AHAP3シリカ処理により減少し、またA2780細胞の増殖は、用量0.50mg/mL[<5%生存率における最小阻害濃度(MIC);0.75mM NOに対応]のNO放出AHAP3シリカにより殆ど完全に阻害された。更に、NO供与体AHAP3シリカのIC50用量(50%阻害濃度)は0.02mg/mL(0.03mM NO)であった。特に、NO放出シリカの阻害濃度は、小分子NO供与体のこれらの値より顕著に低かった(例えば、PYRRO/NOのMIC及びIC50は、夫々4.4及び2mM NOであった。)
【0114】
対照シリカナノ粒子もまた、腫瘍細胞に対して細胞毒性効果を示した(IC50=0.12mg/mL)、しかしながらNO放出対応物より低かった。特別な理論に拠ることなく、1級アミン基は毒性を持つことが知られているので、対照担体の好ましくない細胞毒性は、シリカ構造の表面のフリー1級アミン基に帰すると推量できる。Shi,X.,他、Colloids Surf.A,272,139-150(2006).対照及びNO放出ナノ粒子の1級アミン基による細胞毒性を減らすために、MAP3アミノシラン(2級アミン基のみ含む)を用いて、より生体許容性のある担体を作成した。予期したように、MAP3対照の不死化(T29)及び腫瘍(A2780)細胞に対する細胞毒性は、低かったが、NO放出MAP3シリカは、T29及びA2780両細胞に対し細胞毒性を示した。図27参照。OVCAR−3卵巣アデノカルシノーマ細胞もまた、増加する濃度のNO放出シリカナノ粒子に対し同様な細胞毒性傾向を示した。
ナノ粒子サイズが細胞毒性に対して影響を与えるか調べるために、異なる粒子サイズ(直径80及び350nm、以後夫々s−MAP3及びL−MAP3と表わす)を持つ2種のシリカナノ粒子(75モル%MAP3,バランスTEOS)、を合成した。シリカ直径は、ゾルーゲル過程において溶媒系(例えば、アルコール)を変えることで容易に調節できる。Harris,M.T.,他、J.Non-Cryst.Solids,121,397-403(1990)を参照されたい。合成過程で用いるアルコールの分子量(MW)を増すと、対応して、粒子サイズは増加した(例えば、s−MAP3及びL−MAP3を合成するために、夫々100%(v/v)エタノール及び50/50%(v/v)エタノール/ブタノール混合物を用いた)。T29及びA2780をNO非放出対照MAP3粒子(80nm)、s−MAP3,又はL−MAP3(0.4mg/mL)で48時間処理して、細胞生存率を測定した。図28参照。特に、小直径NO放出シリカ(s−MAP3)は、不死化(T29)及び癌(A2780)細胞に対して細胞毒性を示した(夫々、12±1.1及び5±.2%生存率)。これに対し、大直径NO放出シリカ(L−MAP3)は健康細胞より腫瘍細胞に対して顕著により強い細胞毒性を示した(T29細胞及びA2780細胞に対し、夫々、37±2.0、及び6±1.2%生存率)。T29細胞に対して、より大きなNO運搬担体が低い毒性を示すことは、健康細胞に最小限の効果を持つ殺腫瘍性濃度のNOを放出することができるナノデバイスを開発する上での主要な段階を表す。
【0115】
実施例18 細胞取り込み
NO放出シリカ粒子の細胞内取り込みについて共焦点蛍光顕微鏡を用いて調べた。要約すると、A2780卵巣癌細胞をMET−TEC(R)ガラス底の顕微鏡プレートに〜20%飽和密度に蒔種し、一晩培養した。顕微鏡観察前に、培養緩衝液を廃棄し、A2780癌細胞のミトコンドリアを選択的に染色するために(30分インキュベーション)、100nMテトラメチルローダミン色素(TMRM)を含むKrebs−Henseleitイメージ用緩衝液[10mM N−2−ヒドロキシエチルピペラジン−N’−2エタンスルホン酸(HEPES),pH7.4]に置き変えた。NO放出シリカナノ粒子を3種のシラン前駆体:フルオレッセインイソチオシアン酸塩(FITC)修飾のアミノプロピルトリメトキシシラン(APTMS),ジアゼニウムジオレイン酸塩MAP3,及びTEOS,の共凝縮により蛍光標識した。
Zeissレーザー走査顕微鏡(LSM510;Carl Zeiss, Inc., Oberkochen, Germany)を用いて蛍光測定を行った。TMRMの赤色蛍光(543nmにおけるヘリウム−ネオンレーザー励起)を、5分、60分の時点でモニターし、ミトコンドリアの細胞内位置、及びA2780核の輪郭のマップを作った。図29C及び29Dを参照されたい。イメージ用緩衝液に溶かしたFITC標識NO放出MAP3シリカナノ粒子の100μLを直接顕微鏡台上の細胞に加え、ナノ粒子濃度を0.1mg/mLとした。直ちに、FITC標識シリカナノ粒子の緑色蛍光が520nmに観察でき、A2780癌細胞の輪郭が表れた。共焦点画像を5分間隔で集め、細胞の緑色蛍光ナノ粒子の取り込みをモニターした。図29Aは、FITC標識MAP3シリカ粒子と5分インキュベートした時点での細胞を示す。1時間後、かなりな量のナノ粒子の蓄積が観察された。図29B参照。更に、ミトコンドリア生存の特性である赤色蛍光は、60分後、多くの細胞内で消えた(図29Dを参照のこと)、また細胞のサイズは縮み始め、細胞死を示す。
【0116】
実施例19 抗菌活性研究
Pseudomonas aeruginosa(ATCC#19143, American Type Culture Collecti on Company, Manassas, Virginia, USAより)、グラム陰性日和見病原体の1種、をトリプチソイブロス(TSB)中で、吸光度(ODλ=600nm)約0.2(〜1.0x108コロニー形成単位[CFU]mL,系列稀釈法で確認)まで培養した。細菌を遠心によりペレットにした後、TSB培養液を廃棄し、細菌を無菌リン酸緩衝塩液(PBS,pH7.4)に再懸濁した。PBS中の10倍系列稀釈法により細菌濃度を103CFU/mLに調節した。この細菌懸濁液の一部(200μL)を無菌ミクロピペットバイアル中に分配し、200μLのNO放出45モル%AEAP3シリカナノ粒子(1mg/mL),対照(NO非放出)、AEAP3シリカナノ粒子(1mg/mL)、又は無菌PBS(ブランク)を各バイアルに加えた。37℃1時間インキュべーション後、各懸濁液の100μLをトリプティックソイ栄養寒天培地の上にプレートし、37℃で一晩培養した。次の日、各プレート上にできた細菌のコロニー数をカウントし、代表的栄養プレートの写真撮影をした。図30に示すように、シリカナノ粒子から放出される酸化窒素は、ブランク(図30A)及び対照(NO非放出)シリカナノ粒子(図30B)と比べて、生存細菌の数を劇的に減少させた(図30Cを参照のこと)。定量的には、ブランク及び対照懸濁液を示すプレートに形成したコロニー数はほぼ同数(〜360)であった。NO放出シリカナノ粒子を加えた懸濁液からは、9コロニーだけが形成した。このことは、ブランク及び対照懸濁液に比べて、NO放出ナノ粒子を加えた懸濁液中の生存細菌の数は、98%減少したことを示す。
NO放出シリカナノ粒子の抗細菌活性をより定量的に評価するために、PBS中の系列稀釈により、細菌濃度を103CFU/mLに調節し、培養細菌を対照シリカナノ粒子(NO非放出)、NO放出シリカナノ粒子、又は無菌PBS(ブランク)に曝した。37℃、1時間培養後、懸濁液の100μLをトリプティックソイ栄養寒天培地の上に蒔種し一晩培養した。図31に示すように、シリカナノ粒子から放出されたNOは、生存細菌の数を顕著に減少させた。2mg/mLの濃度で、NO放出粒子は、対照に比べて殺細菌効果を顕著に増した(p=9.5x10−4)。1時間インキュベーション時間内に放出されるNOの量は、化学発光による測定では、約1μモルNOであった。従って、本明細書に示したシリカナノ粒子は、インビトロ殺細菌効果を示し、感染した傷に関する微生物を殺すための幾つかの濃度のNOを運搬するための担体を表わす。
【0117】
実施例20 NO放出の磁性シリカナノ粒子の合成
磁気性NO放出シリカナノ粒子は、図32に示す合成に従って調製した。簡単には、実施例10の方法を変えて、TEOS及び10モル%AHAP3又は17モル%AEAP3を含む溶液中で約20nmから30nmまでの間の直径を持つ磁鉄鉱(Fe3O4)粒子の包含に適用した。シランの共凝縮により、磁鉄鉱粒子は、シリカのシェルで覆われた。この粒子をNO下に置きジアゼニウムジオレイン酸塩を作成した。
磁鉄鉱/シリカAHAP3粒子の原子間力顕微鏡(AFM)像を図33に示す。粒子の直径は、85±11nmと測定された。この粒子のNO放出プロフィールを、図34に示す。磁鉄鉱/シリカ粒子を含むPBS溶液を用いた実験は、磁石を適用すると、粒子の移動を制御できることを示す。
【0118】
実施例21 NO放出シリカナノ粒子を含むポリウレタンフィルム
NO放出シリカナノ粒子は、約3mgから約18mgまでの間のNO放出粒子を、重合化前に500μLのTHF及びエタノールに10mgの1:1(w/w)TECOFLEX(R)ポリウレタン(TPU)/親水性ポリウレタン(HPU)を含む高分子前駆体溶液に加えて作成したポリウレタンフィルムに取り込んだ。
高分子前駆体溶液に6mgのナノ粒子を加えて作成したフィルムを調べて、前記の細菌接着に対する抵抗能を測定した。Marxer,S.M.他、Chem.Mater.、15,4193-4199(2003)を参照されたい。定常的なNO放出を開始するためにこのフィルムを前処理し、その後Pseudomonas aeruginosa(ATCC#19143,American Type Culture Collection Company, Manassas, Virginia, USAより)を含む細胞懸濁液に、37℃で30分間浸した。その後、フィルの表面を水でリンスし、2%グルタルアルデヒド溶液で15分間固定した。表面の画像をZeiss Axiovert200倒立顕微鏡(Carl Zeiss Optical, Chester, Virginia, USA)を用いた位相差顕微鏡研究によって得た。対照フィルム及びNO放出粒子含有フィルムの位相差顕微鏡像を図35A及び35Bに示す。
【0119】
実施例22 NO放出層をもつグルコースセンサー
グルコースオキシダーゼベースのグルコースバイオセンサーにより、グルコースと酸素の間のグルコースオキシダーゼ(GOx)触媒反応により産生した過酸化水素を電気酸化して、血液グルコースを検出できる。図36に図示するように、グルコースセンサーは、NO放出層を持って合成される。センサー3600は、Pt電極3602上にスタックした4層を提供する。最内部の層3604は、25μL MTMOS,6mgグルコースオキシダーゼ(GOx)、100μL EtOH及び50μL H2Oを含む溶液の濃縮により作られる。カバーするGOx層3604は、疎水性TECOFLEX(R)ポリウレタン(TPU)及び親水性ポリウレタン(HPU)前駆体(即ちTPU/HPUブレンド)の1:1(w/w)混合物の重合により調製した保護層3606である。NO放出層3608を、500μL THF/EtOH中に10mg TPU/HPU及び6mgジアゼニウムジオレイン酸塩修飾シリカナノ粒子を含む溶液の重合により調製した。NO放出層3608は、さらに500μL THF/EtOH中に10mg TPU/HPU混合物で調製したTPU/HPUバリアー層3610を重層した。
図36を続けると、挿入図は、NO放出層3608と外部の保護層3610の境界での相互作用を示すもので、ここでジアゼニウムジオレイン酸塩基3622を持つNO放出シリカ粒子3620は酸化窒素3624を放出するが、グルコース分子3626は、GOx−含有層3604への途上NO放出層3608に吸収される。
NO放出層を持つグルコースセンサーの応答を評価するために、2種の対照電極を作成した:保護層及びGOx層のみ持つ対照センサー、及びNO供与体を含まないシリカナノ粒子のみで調製した4層すべてを含むセンサー。様々なセンサーの感度を適用電圧+7V対Ag/AgClを用いて、PBS(0.05M,pH7.4)中で評価した。対照及び2層センサーの感度は、54.5nA/mM(r=0.9980)、NO非放出シリカナノ粒子を持つ4層センサーの感度は、61.3nA/mM(r=0.9938)であり、NO放出層を持つセンサーの感度は、57.9nA/mM(r=0.9989)であった。これらの結果は、NO放出はGOxベースのグルコース検知には干渉しないことを示す。
【0120】
参考文献
以下に記載した参考文献、及び本明細書に引用した全ての参照文献は、これらが補足し、説明し、背景を提供し、又は方法、技術、及び/又は本明細書で使用される化合物を教示する限り、本明細書に参照文献として取り込まれている。本申請に関する全ての引用した特許及び刊行物は、本明細書に参考文献として明示的に取り込まれる。
Albert, K., and Bayer, E. J., J. Chromatogr., 544, 345-370 (1991).
Albina, J. E., and Reichner, J. S., Canc. Metas. Rev., 17, 19-53 (1998).
Anwander, R., et al., Stud. Surf. Sci. Catal., 117, 135-142 (1998).
Baker, J. R., Jr., Biomacromolecules, 5, 2269-2274 (2004).
【0121】
Beckman, J. S., and Conger, K. A., Methods Companion Methods Enzymol., 7, 35-39 (1995).
Brannon-Peppas, L. and Blanchette, J. O., Advanced Drug Delivery Reviews, 56, 1649-1659 (2004).
Bruch, M. D., and Fatunmbi, H. O., J. Chromatogr. A., 1021, 61-71 (2003).
Brust, M., J. of the Chem. Soc., Chem. Comm., 801-802 (1994).
Capala, J., et al., Bioconjugate Chem., 7(1), 7-15 (1996).
Cobbs, C. S., et al., Cancer Res., 55, 727-730 (1995).
Davies, K. M., et al., J. Am. Chem. Soc., 123, 5473-5481 (2001).
Diodati, J. G., et al., Thrombosis and Haemostasis, 70, 654-658 (1993).
Feldheim, D. L. and Foss, C. A., eds, Metal Nanoparticles - Synthesis Characterization, and Applications. Marcel Dekker, Inc: New York, p. 360 (2000).
Freireich et al., Cancer Chemother Rep. 50, 219-244 (1966).
Frost, M. C., et al., Biomaterials, 26,1685-1693 (2005).
Harris, M. T., et al., J. Non-Cryst. Solids, 121, 397-403 (1990).
Hatton, B., et al., Acc. Chem. Res., 38, 305-312 (2005).
Hostetler, M. I., et al., Langmuir, 15, 3782-3789 (1999).
Hostetler, M. I., et al., Langmuir, 14, 17-30 (1998).
Hrabie, J. A., et al., J. Org. Chem., 58, 1472-1476 (1993).
Hrabie, J. A. and Keefer, L. K., Chem. Rev., 102, 1135-1154 (2002).
Huh, S., et al., Chem. Mater., 15, 4247-4256 (2003).
Ignarro, L. J., Nitric Oxide: Biology and Pathobiology; Academic Press: San Diego (2000).
Ignarro, L. J. et al., Proc. Natl. Acad. Sci., U.S.A., 84, 9265-9269 (1987).
Jenkins, D. C., et al., Proc. Natl. Acad. Sci., U.S.A., 92, 4392-4396 (1995).
Keefer, L. K., Annu. Rev. Pharmacol. Toxicol., 43, 585-607 (2003).
Keefer, L. K., Chemtech, 28, 30-35 (1998).
Lai, C.-Y., et al., J. Am. Chem. Soc., 125, 4451-4459 (2003).
Lim, M. H., and Stein, A., Chem. Mater., 11, 3285-3295 (1999).
【0122】
Lin, H.-P., and Mou, C.-Y., Acc. Chem. Res., 35, 927-935 (2002).
MarIetta, M. A., et al., BioFactors, 2, 219-225 (1990).
Marxer, S. M., et al., Chem. Mater., 15, 4193-4199 (2003).
Munoz, B., et al., Chem. Mater., 15, 500-503 (2003).
Nablo, B. J., et al., J. Am. Chem. Soc., 123, 9712-9713 (2001).
Napoli, C. and Ignarro, L. J., Annu. Rev. Pharmacol. Toxicol., 43, 97-123 (2003).
Penault-Llorca, F., et al., Int. J. Cancer, 61(2), 170-176 (1995).
Press, M.F., et al., Oncogene 5(7), 953-962 (1990).
Radomski, M. W., et al., Br. J. of Pharmacology, 101,145-749 (1992).
Radu, D. R., et al., J. Am. Chem. Soc., 126, 1640-1641 (2004).
Roy, I., et al., Proc. Natl. Acad. Sci, U.S.A., 102, 279-284 (2005).
Sayari, A., and Hamoudi, S., Chem. Mater., 13, 3151-3168 (2001).
Shi, X., et al., Colloids Surf. A., 272, 139-150 (2006).
Stein, A., et al., Adv. Mater., 12, 1403-1419 (2000).
Thomsen, L. L., et al., Br. J. Cancer., 72, 41-44 (1995).
Trewyn, B. G., et al., Nano. Lett., 4, 2139-2143 (2004).
Troughton, B. B., et al., Langmuir, 4, 365-385 (1988).
Wang, P. G., et al., Nitric Oxide Donors: For Pharmaceutical and Biological Applications; Wiley-VCH: Weinheim, Germany (2005).
Wang, P. G., et al., Chem. Rev., 102, 1091-1134 (2002).
Wiener, E.C. et al., Invest. Radiol., 32 (12), 748-754 (1997).
Wiener, E.C., et al., Magn. Reson. Med. 31(1), 1-8 (1994).
Yoshitake, H., New. J. Chem., 29, 1107-1117 (2005).
Zhang, H., et al., J. Am. Chem. Soc., 125, 5015-5024 (2003).
Zhou, Z., and Meyerhoff, M. E., Biomacromolecules, 6, 780-789 (2005).
以前に権利主張された対象物の様々な詳細については、本明細書で権利主張した対象物の観点から離れない限り変更されうることは理解されるであろう。さらに、前述の記載は、例示の目的だけに行われ、制限することを目的にしたものではない。
【図面の簡単な説明】
【0123】
【図1】コアCR、内部領域IR,脆弱部分LPを持つリンカーLK、酸化窒素(NO)供与体NO及び外部EPを含む、酸化窒素(NO)放出粒子の図式的説明である。
【図2】本出願で開示したNO放出性単層の保護クラスター(MPC)金ナノ粒子を製造するための合成スキームである。
【図3】アルコキシシラン及びアミノアルコキシシランの混合物からシリカネットワークの共凝縮の後、共凝縮したシリカネットワークをNOガスで処理することによる、NO放出粒子の合成の図式的説明である。
【図4A】表面グラフト法により合成されたN−ジアゼニウムジオレイン酸塩(より濃い球体)修飾シリカ粒子中のNO供与体分布の範囲についての図式的説明である。
【図4B】アルコキシシラン及びアミノアルコキシシランを含むシラン混合物からシリカネットワークの"ワンポット"共凝縮により合成された、N−ジアゼニウムジオレイン酸塩(より濃い球体)−修飾シリカ粒子中のNO供与体分布の範囲についての図式的説明である。
【図5A】シリカネットワークを作るための共凝縮の後に、アミノアルコキシシランがNO気体と反応する、"ポストチャージング"法を用いたNO放出共凝縮シリカ粒子の合成ついての図式的説明である。
【図5B】シリカネットワークを作るための共凝縮に先立って、アミノアルコキシシランがNO気体と反応する、"プレチャージング"法を用いたNO放出共凝縮シリカ粒子の合成ついての図式的説明である。
【図6A】N−(2−アミノエチル)−3−アミノプロピルトリメトキシシラン(AEAP3)の構造である。
【図6B】(アミノエチルアミノメチル)フェネチルトリメトキシシラン(AEMP3)の構造である。
【図6C】N−(6−アミノヘキシル)アミノプロピルトリメトキシシラン(AHAP3)の構造である。
【図6D】N−[3−(トリメトキシシリル)プロピル]ジエチレントリアミン(DET3)の構造である。
【図7】孔形成のために鋳型試薬としてミセルを用いた、メソ多孔質共凝縮シリカネットワークの鋳型合成の図式的説明である。
【図8】図1で既に述べたようなNO放出粒子の部分の図式的説明であり、さらにリンカーLKの脆弱部分LPは粒子外部EPから様々な距離に置くことができることを示す。部位Aは外部から最も遠く、部位Bはリンカーの中央に在り、また部位Cは粒子の外部に最も近い。
【図9A】医学的に分割されたポリウレタンの一般的構造を示す。柔らかいユニットを、影のある長円で示し、固いユニットを影のある矩形で示し、またエキスパンダーユニットを影のある円で示す。
【図9B】TECOFLEX(R)ポリウレタンの構造を示し、n及びn’は整数である。
【図10A】ヘキサンチオール官能基の付いた金ナノ粒子の1H NMRスペクトルである。
【図10B】臭素官能基の付いた金ナノ粒子の1H NMRスペクトルである。−CH2Brピークは3.4ppmに表れる。
【図10C】エチレンジアミン官能基の付いた金ナノ粒子の1H NMRスペクトルである。−CH2NHピークは2.5から3.0ppmに表れる。
【図11】11−ブロモ−1−ウンデカンチオールの2段階合成のスキームを表す。
【図12】酸化窒素測定の解析方法の図式的説明である。
【図13】様々なジアミン誘導化単層保護クラスター(MPC)金ナノ粒子からの酸化窒素放出プロフィールを示すプロットである。ラインaは非誘導化MPC金ナノ粒子の酸化窒素放出プロフィールである。ラインbは14%エチレンジアミン誘導化MPC金ナノ粒子からの酸化窒素放出プロフィールである。ラインcは21%エチレンジアミン誘導化MPC金ナノ粒子からの酸化窒素放出プロフィールである。ラインdは21%エチレンジアミン誘導化MPC金ナノ粒子からの酸化窒素放出プロフィールである。ラインeは21%ジエチレントリアミン誘導化MPC金ナノ粒子からの酸化窒素放出プロフィールである。ラインfは21%ヘキサンジアミン誘導化MPC金ナノ粒子からの酸化窒素放出プロフィールである。
【図14】官能基化単層保護クラスター(MPC)金ナノ粒子から放出されたNOを示す、図式的説明である。
【図15】ポリプロピレニミンヘキサデカアミンデンドリマー(DAB−Am−16)の化学構造の図式的説明である。
【図16】ポリプロピレニミンテトラヘキサコンタアミンデンドリマー(DAB−Am−64)の化学構造の図式的説明である。
【図17】DAB−C7−16 NaOMe/MeOHについて酸化窒素放出プロフィールを示すグラフである。
【図18】DAB−C7−64 NaOMe/MeOHについて酸化窒素放出プロフィールを示すグラフである。
【図19】Zhang、H.他、J.Am.Chem.Soc.,125,5015(2003)に記載された方法によるNO放出シリカ粒子に至る合成ルートである。
【図20A】対照シリカ(TEOSのみ)の接触法原子間力顕微鏡(AFM)画像である。
【図20B】10モル%のAHAP3と一体となったシリカ(バランスTEOS)の接触法原子間力顕微鏡(AFM)画像である。
【図20C】1粒子を示す図29Bからの拡大した原子間力顕微鏡(AFM)画像である。
【図20D】10モル%AEAP3の接触法原子間力顕微鏡(AFM)画像である。
【図20E】雲母表面上の17モル%AEAP3シリカ粒子の接触法原子間力顕微鏡(AFM)画像である。
【図20F】シリカ混合物のAEAP3含量、及び得られる粒子サイズの間の関係を示すグラフである。
【図21A】様々な量のAEAP3:(a)0%AEAP3(対照)、(b)10モル%AEAP3(バランスTEOS),(c)13モル%AEAP3(バランスTEOS);及び17モル%AEAP3(バランスTEOS);と共凝縮したシリカの固体状態29Si交差分極/マジックアングルスピニング(CP/MAS)NMRスペクトルを示すプロットである。
【図21B】AEAP3修飾シリカ混合物の表面のシリコン化学環境に関係する構造を示す図式である。
【図21C】AEAP3修飾シリカ混合物の合成の間、加えられたAEAP3含量に対する、共凝縮したアミンリガンドの%表面開裂(SC)のプロットを示す。
【図22】10モル%AHAP3(破線)及び17モル%AEAP3(実線)を含む共凝縮シリカからのNO放出のNO放出プロフィールである。挿入図は同じ2種類のシリカ型の時間に伴う積算したNO放出のプロットを示す。
【図23】AEAP3を含む共凝縮シリカナノ粒子の37℃におけるpHの関数で表すNO放出のプロットである。挿入図は、積算したNO放出のプロットである。
【図24A】鋳型として界面活性剤セチルトリメチルアンモニウム臭化物(CTAB)を用いた鋳型合成により製造したメソ多孔質NO放出シリカ粒子の断面図を示す図式的説明である。影の領域は、共凝縮シリカネットワークを表し、他方、小さな影のある円は、共凝縮シリカネットワーク内のNO供与体を表す。影のない領域は、シラン凝縮反応後、CTAB鋳型を除去した後に作られた粒子内の孔を表わす。
【図24B】セチルトリメチルアンモニウム臭化物(CTAB)を鋳型として製造したメソ多孔質N−(6−アミノエチル)アミノプロピルトリメトキシシラン(AEAP3)−シリカ粒子の接触法原子間力顕微鏡(AFM)画像である。
【図25】メソ多孔質N−(6−アミノエチル)アミノプロピルトリメトキシシラン(AEAP3)−シリカ(37℃でリン酸緩衝液(PBS)中3mgの粒子)の酸化窒素放出プロフィールを示すプロットである。
【図26】対照(黒色円)、及び45モル%AHAP3との反応で製造したNO放出シリカ(白色円)の卵巣上皮腫瘍細胞に対する細胞毒性を示すグラフである。
【図27】対照(黒色矩形)及びNO放出するMAP3共凝縮(白色円)シリカナノ粒子の正常(不死化、T29)細胞に対する細胞毒性、及び対照(黒色円)及びNO放出するMAP3共凝縮(白色円)シリカナノ粒子の腫瘍(A2780)細胞に対する細胞毒性を示すグラフである。
【図28】正常T29(灰色棒)細胞株及び腫瘍A2780(縞模様棒)細胞株に対する細胞毒性へのシリカ粒子サイズ(75モル%MAP3,バランスTEOS)の効果を示す棒グラフである。対照MAP3処理群と比較して、P<0.001であった。対照MAP3シリカ(角括弧で示す)は、NO非放出性であり、直径80nmであり、s−MAP3シリカは直径80nmであり、L−MAP3シリカは直径350nmである。
【図29A】FITC標識付MAP3シリカナノ粒子とインキュベーション5分後に撮ったA2780卵巣癌細胞のレーザー走査顕微鏡画像である。
【図29B】FITC標識付MAP3シリカナノ粒子とインキュベーション60分後に撮ったA2780卵巣癌細胞のレーザー走査顕微鏡画像である。
【図29C】100nmテトラメチルローダミン(TMRM)ミトコンドリア染色液とインキュベーション5分後に撮ったA2780卵巣癌細胞のレーザー走査顕微鏡画像である。
【図29D】100nmテトラメチルローダミン(TMRM)ミトコンドリア染色液とインキュベーション60分後に撮ったA2780卵巣癌細胞のレーザー走査顕微鏡画像である。
【図30A】無菌リン酸緩衝液(PBS)と37℃でインキュベート後、栄養寒天培地上に形成したP.aeruginosaのコロニーを示す写真である。
【図30B】対照(NO非放出性)AEAP3シリカナノ粒子と37℃でインキュベート後栄養寒天培地に形成したP.aeruginosaのコロニーを示す写真である。
【図30C】NO放出45モル%AEAP3シリカナノ粒子と37℃でインキュベート後栄養寒天培地に形成したP.aeruginosaのコロニーを示す写真である。
【図31】ナノ粒子濃度の関数として、NO放出シリカナノ粒子(45モル%AEAP3,バランスTEOS)のP.aeruginosaに対するインビトロ殺細菌活性を示すプロットである。
【図32】NO供与体を形成できる、アミン基を含む共凝縮シリカ層で覆われた磁鉄鉱コアを持つNO放出ナノ粒子の合成の図式的説明である。
【図33】磁鉄鉱/N−(6−アミノヘキシル)アミノプロピルトリメトキシシラン(AHAP3,10モル%)官能性シリカ粒子の原子間力顕微鏡(AFM)画像である。
【図34】磁鉄鉱/シリカコア粒子(下部の線)の、磁鉄鉱なしの同じシリカ組成のコアを持つ粒子(上部の線)のNO放出プロフィール、と比較したNO放出プロフィールを示すグラフである。挿入図はNO放出積算量のグラフである。
【図35A】対照フィルム(NO非放出ポリウレタン)に対するP.aeruginosa接着(黒色領域)を示す位相差光顕微鏡像である。拡大率はx5.
【図35B】NO放出粒子を含むフィルムに対するP.aeruginosa接着(黒色領域)を示す位相差光顕微鏡像である。拡大率はx5.
【図36】NO放出共凝縮シリカナノ粒子を含む重合したフィルムから作られたNO放出層を持つグルコースセンサーのPt電極を示す構造の図式的説明である。
【技術分野】
【0001】
この発明は、2005年5月27日出願の米国特許仮出願60/685,578の恩恵を主張するものであり、当該出願の開示は引用することにより本明細書に組み込まれているものとする。
本出願で開示の対象は、酸化窒素放出粒子、及び医生物学的及び薬学的応用におけるこれらの使用を提供する。より具体的には、幾つかの実施態様において、本出願で開示した対象物は、制御され、標的を定めた方法で酸化窒素を放出する粒子を提供し、それにより、酸化窒素の治療効果を持続させ、標的細胞及び/又は標的組織への酸化窒素運搬の特異性を改善する。
本発明は国立保健研究所補助金番号ED000708からの助成を、米国政府から得た。従って、米国政府は、本発明の特定の権利を有する。
【背景技術】
【0002】
酸化窒素(NO)の生物学、生理学、及び病理生理学での多面的な役割(Marletta,M.A..,他、Biofactors,2,219-225(1990)を参照のこと)の発見により、制御された酸化窒素放出が可能な酸化窒素供与体の探索(Keefer,L.K.,Chemtech,28,30-35(1998)を参照のこと)が始められた。今日までに、研究者等は、NOは心血管、胃腸、性尿器、呼吸器、及び中心及び末梢神経系におけるある範囲の生物過程を制御するということを発見した(Ignarro,L.J.,Nitric Oxide:Biology and Pathobiology;Academic Press:San Diego,2000;及びIgnarro,L.J.他、Proc.Natl.Acad.Sci.,U.S.A.、84,9265-9269(1987)を参照のこと)。さらに、NOの血管拡張薬としての発見、及び抗生物質及び殺腫瘍性因子としての同定により、NOは魅力的な医薬品の候補になった。例えば、Radomski,M.W.,他, Br.J.Pharmacol.,92,639-646(1987);Albina,J.E.,及びReichner,J.S.; Canc.Metas.Rev.,17,19-53(1998);Nablo,B.J.,他,J. Am.Chem.Soc.,123,9712-9713 2001);Cobbs,C.S.,他,CancerRes.,55,727-730(1955);Jenkins,D.C.,他、Proc.Natl.Acad.Sci.,U.S.A.,92,4392-4396(1955);及びThomsen,L.L.,他、Br.J.Cancer.,72、41-44(1955)を参照のこと。
幾つかの酸化窒素供与体が報告されており、最も有名な供与体はN−ジアゼニウムジオレイン酸塩である。一般的に、N−ジアゼニウムジオレイン酸塩NO供与体は、高圧下でアミンとNOを反応させて合成した小分子であり、また例えば、水溶液中で、自然にNOを発生させるために用いられてきた。Hrabie,J.A.及びKeefer,L.K.,Chem.Rev.,102,1135-1154(2002)を参照のこと。
【発明の開示】
【発明が解決しようとする課題】
【0003】
酸化窒素供与体の活性を検討する、例えば腫瘍細胞を殺す、治療上の戦術は、本技術分野で知られる酸化窒素輸送系が、無差別に酸化窒素を放出又は供与するので、幾分問題を抱えている。従って、酸化窒素輸送系についての技術分野において、酸化窒素の放出又は供与を制御された、及び/又は標的を定めた方法で行い、生理学におけるNOの機能についての向上した理解を促進し、NO関連の治療の開発を提供することが要求されている。
【課題を解決するための手段】
【0004】
幾つかの実施態様において、本発明は、酸化窒素供与体、外部領域、及び一定容積を持つ内部領域であって、少なくともその部分が、
(i)金属クラスター、
(ii)樹木状ネットワーク、
(iii)共凝縮したシリカネットワーク、及び
(iv)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域からなる酸化窒素(NO)放出粒子である。
【0005】
幾つかの実施態様において、前記内部領域は、更に、pH変化に応答する脆弱性リンカー(連結基)、電磁放射に敏感な脆弱性リンカー、酵素作用による分解を受けやすい脆弱性リンカー、疎水性リンカー、両親媒性リンカー、及びこれらの組合せから成る群から選択される有機リンカーを含む。
幾つかの実施態様において、前記NO供与体は、ジアゼニウムジオレイン酸塩、ニトロソアミン、ヒドロキシルニトロソアミン、ニトロソチオール、ヒドロキシルアミン、ヒドロキシウレア、及びこれらの組合せからなる群から選択される。
幾つかの実施態様において、前記NO供与体は、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つに共有結合で結合する。幾つかの実施態様において、前記NO供与体は、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つに封じ込められる。幾つかの実施態様において、前記NO供与体が、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つと、ファンデルワールス相互作用、静電気的相互作用、水素結合、及びこれらの組合せからなる群から選択される非共有結合的相互作用により結合する。
【0006】
幾つかの実施態様において、前記外部領域は、NO放出動特性を修飾する部分、粒子の生体許容性に影響する部分、粒子の生体内分布に影響する部分、粒子の標的への運搬に寄与する部分、粒子の画像又は追跡に寄与する部分、粒子の溶解性に影響する部分、治療薬剤、及びこれらの組合せ、からなる群から選択される1又は2以上の化学部分を含む。
幾つかの実施態様において、前記コアは、金属クラスターであり、この金属クラスターが、金、白金、銀、磁性体、量子ドット、及びこれらの組合せから選択される成分構成材料を含む。幾つかの実施態様において、前記金属クラスターは、単層で保護した金クラスターである。
幾つかの実施態様において、前記コアは、樹木状ネットワークであり、この樹木状ネットワークは、ポリプロピレニミンデンドリマー、ポリアミドアミン(PAMAM)デンドリマー、ポリアリールエーテルデンドリマー、ポリペプチドデンドリマー、ポリエステルデンドリマー、ポリアミドデンドリマー、樹木状ポリグリセロール、及びトリアジンデンドリマーからなる群から選択される。幾つかの実施態様において、前記樹木状ネットワークは、超分枝状である。
【0007】
幾つかの実施態様において、前記コアは、共凝縮したシリカネットワークからなり、この共凝縮したシリカネットワークが、アルコキシシラン及びアミノアルコキシシランからなるシラン混合物の凝縮により合成されたものである。幾つかの実施態様において、前記アルコキシシランは、化学式Si(OR)4(式中、Rはアルキル基を表す。)で表されるテトラアルコキシシランから成り、
前記アミノアルコキシシランが、
(a)化学式 R’’−(NH−R’)n−Si(OR)3(式中、Rはアルキル基、R’はアルキレン基、分枝アルキレン基、又はアラルキレン基、nは1又は2、R’’はアルキル基、シクロアルキル基、アリール基及びアルキルアミンから成る群から選択される。)で表されるアミノアルコキシシラン、
(b)化学式 NH[R’−Si(OR)3]2(式中、Rはアルキル基、R’はアルキレン基を表す。)で表されるアミノアルコキシシラン、
(c)化学式 R’’−N(NONO−X+)−R’−Si(OR)3(式中、Rはアルキル基、R’はアルキレン基又はアラルキレン基、R’’はアルキル基又はアルキルアミン基を表し、X+はNa+及びK+からなる群から選択されるカチオンを表す。)で表される、アミン基がジアゼニウムジオレイン酸塩で置換されたアミノアルコキシシラン、及び
(d)これらの組合せ、
から成る群から選択される。
【0008】
幾つかの実施態様において、前記シラン混合物は、約10モル%〜約99モル%の前記テトラアルコキシシラン、及び約1モル%〜約90モル%の前記アミノアルコキシシランから成る。幾つかの実施態様において、前記シラン混合物は、更に約0モル%〜約20モル%のフッ素化シラン、約0モル%〜約20モル%のカチオン性又はアニオン性シラン、及び約0モル%〜約20モル%のアルキルシランを含む。
幾つかの実施態様において、前記テトラアルコキシシランは、テトラメチルオルソケイ酸塩及びテトラエチルオルソケイ酸塩からなる群から選択される。
幾つかの実施態様において、前記アミノアルコキシシランが、N−(6−アミノヘキシル)アミノメチルトリメトキシシラン、N−(6−アミノヘキシル)アミノプロピルトリメトキシシラン、N−(6−アミノエチル)アミノプロピルトリメトキシシラン、(3−トリメトキシシリルプロピル)ジエチレントリアミン、(アミノエチルアミノメチル)フェネチルトリメトキシシラン、[3−(メチルアミノ)プロピル]トリメトキシシラン、N−ブチルアミノプロピルトリメトキシシラン、N−エチルアミノイソブチルトリメトキシシラン、N−フェニルアミノプロピルトリメトキシシラン、N−シクロヘキシルアミノプロピルトリメトキシシラン、ビス[3−(トリメトキシシリル)プロピル]アミン、及びビス[3−(トリメトキシシリル)プロピル]エチレンジアミンからなる群から選択される。
【0009】
幾つかの実施態様において、前記フッ素化シランは、(ヘプタデカフルオロ−1,1,2,2−テトラヒドロデシル)トリエトキシシラン、(3,3,3−トリフルオロプロピル)トリメトキシシラン及び(ペルフルオロアルキル)エチルトリエトキシシランからなる群から選択される。
幾つかの実施態様において、前記カチオン性又はアニオン性シランは、N−N−ジデシル−N−メチル−N−(3−トリメトキシシリル)アンモニウムクロライド、オクタデシルジメチル−(3−トリメトキシシリルプロピル)アンモニウムクロライド、3−トリヒドロキシシリルプロピルメチルホスホン酸ナトリウム塩及びカルボキシルエチルシラントリオールナトリウム塩からなる群から選択される。
幾つかの実施態様において、前記アルキルシランは、メチルトリメトキシシラン、ブチルトリメトキシシラン、ブチルトリエトキシシラン、プロピルトリメトキシシラン及びオクタデシルトリメトキシシランからなる群から選択される。
【0010】
幾つかの実施態様において、共凝縮したシリカネットワークコア及びNO供与体を含むNO放出粒子は、NO供与体がシリカネットワークの凝縮後に作られる"ポストチャージ法"を用いて形成される。また幾つかの実施態様において、共凝縮シリカネットワークコアを含むNO放出粒子は、NO供与体がシリカネットワークの凝縮前に作られる"プレチャージ法"を用いて形成される。
幾つかの実施態様において、前記有機リンカーは、前記酸化窒素放出粒子に酸化窒素放出のオン/オフ状態を与えることができる官能基を含み、該官能基が、エステル、ヒドラゾン、アセタール、チオプロピオネート、光脆弱性部分、及び酵素分解されるアミノ酸配列からなる群から選択される。
幾つかの実施態様において、前記外部領域は、酸化窒素放出粒子を標的に運搬することができる部分を含む。幾つかの実施態様において、前記標的は、細胞、組織及び器官からなる群から選択される。幾つかの実施態様において、前記細胞は、癌細胞である。
幾つかの実施態様において、前記酸化窒素放出粒子を標的に運搬することができる部分は、抗体/抗原相互作用の原因となるタンパク質、葉酸、グアニジン、トランスフェリン、ホルモン、炭化水素、アミノ酸配列RGDを含むペプチド及びTATペプチドからなる群から選択される。
【0011】
幾つかの実施態様において、前記外部領域は、酸化窒素供与体、(ポリ)エチレンオキシド、(ポリ)ウレタン、N−(2−ヒドロキシプロピル)メタクリルアミドコ高分子、ラクチド/グリコリドコ高分子(例えば、PLGA)、砂糖、蛍光部分、有機染料、MRIコントラスト試薬、チオール、メチル基末端のアルキル鎖、抗菌剤、抗腫瘍治療薬、スルホン酸塩、カルボン酸塩、リン酸塩、カチオン性アミン基、第4級アミン基、及びこれらの組み合わせからなる群から選択される部分を含む。
幾つかの実施態様において、前記粒子の直径は、約1nm〜約1000nmである。幾つかの実施態様において、前記粒子の直径は、約1nm〜約5nmである。幾つかの実施態様において、前記粒子の直径は、約2nm〜約10μmである。
【0012】
幾つかの実施態様において、本発明は、NOを患者に投与するための方法、又は配合を提供する。幾つかの実施態様において、該方法は、有効量のNO放出粒子を患者に投与することからなる方法であり、該粒子は、NO供与体、外部領域、及び一定容積を持つ内部領域からなり、該内部領域は、少なくともその部分が、
(a)金属クラスター、
(b)樹木状ネットワーク、
(c)共凝縮したシリカネットワーク、及び
(d)これらの組合せ、
から成る群から選択されるコアにより満たされる。
幾つかの実施態様において、本発明は、疾患の治療が必要な患者の疾患状態を治療する方法を提供するものであり、この方法は、治療の必要な患者に、NO供与体、外部領域、及び一定容積を持つ内部領域であって、少なくともその部分が、
(a)金属クラスター、
(b)樹木状ネットワーク、
(c)共凝縮したシリカネットワーク、及び
(d)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域からなるNO放出粒子を投与する。
【0013】
幾つかの実施態様において、疾患状態は、癌、心臓血管疾患、微生物感染、血液を医学的デバイスに曝すことにより引き起こされる血小板凝集と血小板接着、細胞異常増殖に起因する病理学的状態、移植拒絶、自己免疫疾患、炎症、血管疾患、瘢痕組織、創傷の収縮、再発狭窄症、痛み、発熱、胃腸疾患、呼吸器疾患、性機能障害、及び性感染症からなる群から選択される。
幾つかの実施態様において、本発明は、NO放出粒子を含む高分子フィルムを提供する。幾つかの実施態様において、高分子フィルムは医学的デバイスを被覆するために用いることができる。幾つかの実施態様において、この医学的デバイスは、動脈ステント、ガイドワイア、カテーテル、トロカール針、骨アンカー、骨ネジ、保護板、股関節又は関節置換、導線、生体センサー、探索子、縫合線、外科的ドレープ、外傷用着衣、及び包帯の中の一つである。
【0014】
幾つかの実施態様において、本発明は、NO放出粒子を含む洗浄剤を提供する。
従って、本発明の目的は、NO放出粒子を提供することである。本発明の他の目的は、特異的細胞及び/又は特異的組織が標的となるようにNO放出粒子を運搬するためのNO放出粒子を提供することである。本発明の更に他の目的は、NO放出粒子からNOの放出を誘導する能力を提供することである。
本発明により全体的又は部分的に扱われ、上記のように本明細書に記載された本出願に開示された対象物の特定の目的、他の目的及び側面は、本明細書で以下に記載するように、添付した実施例と関係して取り上げられた時、記載が進むにつれて明らかとなるであろう。
【発明を実施するための最良の形態】
【0015】
本明細書では以下の略号を用いる:AFM:原子間力顕微鏡;AEAP3:N−(6−アミノメチル)−アミノプロピルトリメトキシシラン;AEMP3:(アミノエチルアミノメチル)−フェネチルトリメトキシシラン;AHAP3:N−(6−アミノヘキシル)−アミノプロピルトリメトキシシラン;AiBN:α,α’−アゾビスイソブチロニトリル;atm:大気圧;BSA:ウシ血清アルブミン;℃:摂氏温度;CFU:コロニー形成率;CP/MAS:交差分極/マジックアングルスピニング;CTAB:セチルトリメチルアンモニウム臭化物;DET3:N−[3−(トリメトキシシリル)プロピル]−ジエチレントリアミン;EtOH:エタノール;FA:葉酸;FITC:フルオレッセインイソチオシアナート;g:グラム;GOx:グルコースオキシダーゼ;h:時間;HPU:親水性ポリウレタン;MAP3:メチルアミノプロピルトリメトキシシラン;MeOH:メタノール;mg:マイクログラム;μm:マイクロメーター;min:分;mL:ミリリットル;mol%:モル%;MPC:単層保護クラスター;MRI:磁気共鳴画像法;MTMOS:メチルトリメトキシシラン;nA:ナノアンペア;NaOMe:ナトリウムメトキシド;nm:ナノメートル;NMR:核磁気共鳴法;NO:酸化窒素(=一酸化窒素);[NO]m:酸化窒素最大放出量;O3:オゾン;OD:吸光度;PAMAM:ポリアミドアミン;pmol:ピコモル;ppb:10億分の1;PPI:ポリプロピレンイミン;ppm:100万分の1;TPU:TECOFLEX(R)ポリウレタン;TEM:透過型電子顕微鏡;TEOS:テトラエチルオルソケイ酸塩;TGA:熱重量分析;TMOS:テトラメチルオルトケイ酸塩;TMRM:テトラメチルローダミン;t[NO]:酸化窒素全量;UV:紫外線;Vis:可視光
【0016】
付随する代表的実施態様を示す実施例を参照として、本出願で開示した対象物を本明細書により詳しく説明する。しかしながら、本出願で開示される対象物を異なる形で実施することができる、また本明細書に示された実施態様によって制限されると解釈すべきではない。むしろ、これらの実施態様は、この開示が充分で完全であり、また当業者に対して実施態様の適用範囲を充分に伝達するように、提供されている。
もし他に定義することがなければ、本明細書で用いた全ての技術的及び科学的用語は、本出願で記載する対象物が関わる、当業者の1人に共通に理解される意味と同じである。全ての刊行物、特許申請、及び本明細書に述べた、他の参考文献は、参照文献として全体が取り込まれている。
明細書及び、クレイムを通して、与えられた化学式又は命名は、全ての光学及び立体異性体、及びこの様な異性体及び混合物が存在するラセミ混合物を範囲内に収める。
【0017】
1.定義
長年にわたる特許法協定に従い、原文の"不定冠詞−ある""定冠詞−その"は、クレイムを含め本出願で用いられる場合、"1又は2以上"を意味する。
本明細書で用いる"両親媒性"という用語は、疎水性領域と親水性領域を持つ化学的成分に対して使われる。
本明細書で用いる"癌腫"という用語は、制御を外れた細胞分裂、及び細胞が転移する、又は他の部位で新しい成長を樹立する力によって引き起こされる疾患を表わす。"悪性"、"悪性腫瘍"、"新生物"、"腫瘍"及びこれらの変異物は、癌腫的な細胞又は癌腫細胞の群を表す。
癌腫の特別なタイプとしては、皮膚癌、結合組織癌、脂肪種、乳癌、肺癌、胃癌、膵臓癌、卵巣癌、子宮頸癌、子宮癌、肛門性器部癌、腎臓癌、膀胱癌、結腸癌、前立腺癌、中枢神経(CNS)癌、網膜癌、血液及びリンパ腫瘍等が挙げられるが、これらに制限されない。
本明細書で用いられるように、"電磁放射線"という用語は、ガンマ線、x線、紫外線、可視光線、赤外線、マイクロ波、レーダー及びラジオ波のような、電気及び磁気波を表すが、これらに限らない。
【0018】
"疎水性"という用語は、水素結合又は静電的相互作用のような非共有結合によって、ある程度まで水撥性、又は水と相互作用しない化学化合物又は化学的成分に対して使われる。ある化合物は強く疎水的であること、又は弱く疎水的であることができる。化合物又は基の計算による誘電率を、化合物又は化学的成分の疎水生成のレベル又は程度を予想するために用いることができる。より低い誘電率を有する化合物又は基は、より疎水性であろう。特に、"疎水性リンカー(連結基)"は、NO放出粒子が水性の環境に長時間おかれた時、NO放出粒子の中の易変性リンカー又はNO供与体を水への暴露から保護する。より疎水的なリンカーは、NO供与体又は易変性リンカーを長期にわたり水から保護する。
"親水性"という用語は、ある程度まで水と相互作用する化合物又は基に対して使われる。
"イオン化しうる"という用語は、特定の化学的環境(例えば、特定のpH)で電気的に中正である(即ち、無荷電である)が、他の化学的環境で(例えば、高い又は低いpHで)イオン化する、又は正又は負の荷電を持つ、基に対して使われる。
【0019】
本明細書で用いる用語"メソ多孔質"は、約20〜500Åの範囲の孔を持つ粒子のような物体を表す。
用語"金属製"は、金属、金属合金、金属塩、及び金属酸化物を表す。従って、金属製という用語は、金、銀、銅、白金、及びチタンのような金属イオンを含む粒子、だけではなく半導体粒子及び磁気性粒子(例えば、酸化鉄を含む粒子)を表すが、これらに制限されない。
"半導体ナノクリスタル"及び"量子ドット"という用語は、本明細書では互換的に使われ、発光性がある(即ち、励起により電磁放射線を放出できる)、無機結晶材料からなり、及び任意に第2の半導体材料の保護膜又は"シェル(殻)"内に含まれている、1又は2以上の第1の半導体材料の内部コア粒子を含む半導体ナノ粒子を表す。半導体のシェルに囲まれた半導体ナノクリスタルコアは、"コア/シェル"半導体ナノ粒子と呼ばれる。周囲のシェル材料は、任意に、コア材料のバンドギャップエネルギーより大きなバンドギャップエネルギーを持つことができて、またコア基質のものに近い原子間隔を持つよう選択されている。
【0020】
コア及び/又はシェルのために適切な半導体材料は、元素周期律表の2及び12族から選択された第1の元素、及び16族から選択された第2の元素を含む材料を含むが、これらに制限されない。この様な材料としては、ZnS,ZnSe,ZnTe,CDs,CdSe,CdTe,HgS,HgSe,HgTe,MgS,MgSe,MgTe,CaS,CaSe,CaTe,SrS,SrSe,SrTe,BaS,BaSe,BaTe,等々が挙げられるがこれらに制限されない。また、適切な半導体材料は元素周期律表13族から選択した第1元素、及び15族から選択した第2の元素を含む材料を含む。この様な材料としては、GaN,GaP,GaAs,GaSb,InN,InP,InAs,InSb,等々が挙げられるが、これらに制限されない。さらに、半導体材料は、(Ge,Si、等々)14族元素を含む材料;PbS,PbSe等々の材料;合金及びこれらの混合物を含む。本明細書で用いるように、元素及び族に番号付けするために、元素と族の周期律表に関する全ての参考文献は、Handbook of Chemistry and Physics,第81版、(CRC出版、2000)において示されたように、新IUPACシステムに従う。
【0021】
"ルミネッセンス(発光)"により、物体から電磁放射線(光)が放出される過程を意味する。系が励起状態から低いエネルギー状態に転移し、対応するエネルギーの放出が光子の形をとる時にルミネッセンスが生ずる。これらのエネルギー状態は、電子的、振動的、回転的、又はこれらのコンビネーションであり得る。ルミネッセンスの原因となる転移は、化学的に系に蓄えられた、又は外部の供給源から系に加えられた、エネルギーの放出を通して刺激される。エネルギーの外部供給源は、化学的、熱的、電気的、磁気的、電磁気的、及び物理的を含め様々なタイプ、又は系を基底状態より高いエネルギー状態に励起させる力のある他のタイプのエネルギー供給源であり得る。例えば、ある系は光の光子を吸収して、電場に置かれて、又は化学的酸化還元反応を通して、励起されうる。ルミネッセンスの間に放出される光子のエネルギーは、低エネルギーのマイクロ波領域から高エネルギーのX−線放射の範囲まであり得る。通常、ルミネッセンスはUVからIR放射の範囲の光子を表す。
"フルオレッセント(蛍光体)"という用語は、電磁放射に曝した後に光を発光する化合物又は化学基に対して使われる。
【0022】
"酸化窒素供与体"又は"NO供与体"という用語は、酸化窒素分子種を供与し、放出し、及び/又は直接又は間接的に移動させ、及び/又はインビボで内部での酸化窒素産生を刺激し、及び/又はインビボで酸化窒素の内部濃度を上昇させ、結果として意図した作用部位に酸化窒素分子種の生物活性が発現されるような、分子種を表す。
"酸化窒素放出性"又は"酸化窒素供与性"と言う用語は、一酸化窒素の3種のレドックス(酸化還元)型(NO+,NO−,NO)のいずれかを供与する、放出する、及び/又は直接又は間接的に移す方法を表す。幾つかの場合、酸化窒素放出性又は供与性により、意図した作用部位での一酸化窒素分子種の生物活性が発現される。
【0023】
本明細書で用いる"微生物感染"という用語は、バクテリア、カビ、ウィルス、及び酵母感染を表す。
本明細書で用いられる"約"という用語は、値又は集団の量、を表す場合、重量、時間、容積、又は 割合は、この様な変位が開示した方法を実行する上で適切であるように、±20%又は±10%、より好ましくは、±5%、さらにより好ましくは、±1%及び、さらに一段と好ましくは、±0.1%特定の値からの変位を包含する。
本明細書で開示した多くの実施態様における、"病人"又は"患者"は、好ましくはヒト患者であるが、本出願で開示した対象物の原理は、本出願で開示した対象物が、哺乳動物を含め、全ての脊椎動物種に対して有効であると理解すべきであり、 これらについては"病畜"又は"患畜(禽)"と言う用語に含まれていると理解すべきである。此の文脈において、哺乳動物は治療が望まれる全ての哺乳動物種を含むと理解すべきである。哺乳動物種としては、馬、雄牛、物、及びネコのような、農業及び家畜動物種がある。
【0024】
本明細書で用いられる用語"アルキル基"は、C1〜20を表し、線状(即ち、"直鎖")、分枝型、又は環状、飽和又は少なくとも部分的に及びある場合は完全に不飽和な(即ち、アルケニル基、及びアルキニル基)炭化水素鎖を含み、例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、tert−ブチル基、ペンチル基、ヘキシル基、オクチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、ヘキセニル基、オクテニル基、ブタジエニル基、プロピニル基、ブチニル基、ペンチニル基、ヘキシニル基、ヘプチニル基、及びアレニル基が含まれる。"分枝型"とは、メチル基、エチル基、又はプロピル基のような低級アルキル基が直鎖型アルキル鎖に付加したアルキル基を表す。分枝型アルキル基の例としては、イソプロピル基、イソブチル基、tert−ブチル基があるが、これらに制限されず、"低級アルキル基"は、1から約8個の炭素原子(即ち、C1〜8アルキル基)、例えば、1,2,3,4,5,6,7,又は8炭素原子を表す。"高級アルキル基"は約10個から20個の炭素原子、例えば10,11,12,13,14,15,16,17,18,19又は20個の炭素原子を有するアルキル基を表す。ある実施態様では、"アルキル基"は、特にC1〜8直鎖アルキル基を表す。他の実施態様において、"アルキル基"は、特にC1〜8分枝型アルキル基を表す。
【0025】
アルキル基は、任意に、同一又は異なる、1又は2以上のアルキル基置換基によって置換される("置換アルキル基")。用語"アルキル基置換基"は、アルキル基、置換アルキル基、ハロ基、アリールアミノ基、アシル基、水酸基、アリールオキシル基、アルコキシル基、アルキルチオ基、アリールチオ基、アラルキルオキシル基、アラルキルチオ基、カルボキシル基、アルコキシカルボニル基、オキソ基、及びシクロアルキル基が挙げられるが、これらに制限されない。任意に、アルキル鎖に沿って1又は2以上の酸素原子、イオウ原子又は置換又は非置換窒素原子を挿入することができ、ここで、窒素置換基は、水素原子、低級アルキル基(本明細書ではまた"アルキルアミノアルキル基と呼ぶ)又はアリール基である。
従って、本明細書で用いられるように、"置換アルキル基"は、本明細書で定義されたアルキル基を含み、ここで、アルキル基の1又は2個以上の原子又は官能基は、他の原子又は官能基で置換され、官能基としては、例えば、アルキル基、置換アルキル基、ハロゲン原子、アリール基、置換アリール基、アルコキシル基、水酸基、ニトロ基、アミノ基、アルキルアミノ基、ジアルキルアミノ基、硫酸塩基、及びメルカプト基が挙げられる。
【0026】
本明細書では、用語"アリール基"は、単一の芳香族環、又は互いに融合した、共有結合で連結した、又は、メチレン基又はエチレン基のような、しかしこれらに制限されない、一般的な基に連結した、多環の芳香族環であることができるような芳香族置換基を表すために用いられる。一般的な連結基としては、またベンゾフェノンにおけるようなカルボニル基、又はジフェニルエーテル基におけるような酸素原子、又はジフェニルアミンにおける窒素原子であることができる。用語"アリール基"は、特に複素環式芳香族化合物を含む。芳香族環(類)は、とりわけフェニル基、ナフチル基、ビフェニル基、ジフェニルエーテル基、ジフェニルアミン基、及びベンゾフェノン基を含む。特別な実施態様において、用語"アリール基"は、約5から約10個までの炭素原子、例えば、5,6,7,8,9又は10個の炭素原子、を含む環状芳香族を意味し、また5及び6員環炭化水素及び複素環式芳香族環を含む。
アリール基は、任意に1又は2個以上のアリール基置換基により置換することができて、これらの置換基は同一でも異なっていることも可能で、ここで、"アリール基置換基"は、アルキル基、置換アルキル基、アリール基、置換アリール基、アラルキル基、水酸基、アルコキシル基、アリールオキシル基、アラルキルオキシル基、カルボキシル基、アシル基、ハロ基、ニトロ基、アルコキシカルボニル基、アリールオキシカルボニル基、アラルコキシカルボニル基、アシルオキシル基、アシルアミノ基、アロイルアミノ基、カルバモイル基、アルキルカルバモイル基、ジアルキルカルバモイル基、アリールチオ基、アルキルチオ基、アルキレン基、及び−NR’R’’基、ここでR’及びR’’は、夫々独立に水素原子、アルキル基、置換アルキル基、アリール基、置換アリール基、及びアラルキル基である。
【0027】
従って、本明細書で用いるように、用語"置換アリール基"は、本明細書において定義したアリール基を含み、このアリール基において、アリール基の1又は2個以上の原子又は官能基は、他の原子又は他の官能基によって置換され、他の官能基としては、例えば、アルキル基、置換アルキル基、ハロゲン原子、アリール基、置換アリール基、アルコキシル基、水酸基、ニトロ基、アミノ基、アルキルアミノ基、ジアルキルアミノ基、硫酸塩、及びメルカプト基が含まれる。
アリール基の特別な例としては、シクロペンタジエニル基、フェニル基、フラン基、チオフェン基、ピロール基、ピラン基、ピリジン基、イミダゾール基、ベンジミダゾール基、イソチアゾール基、イソオキサゾール基、ピラゾール基、ピラジン基、トリアジン基、ピリミジン基、キノリン基、イソキノリン基、インドール基、カルバゾール基、等々がある。
【0028】
"環状基"及び"シクロアルキル基"は、約3個から約10個までの炭素原子、例えば、3,4,5,6,7,8,9又は10個の炭素原子の、非芳香性単環式系又は多環系を表わす。シクロアルキル基は任意に、部分的に不飽和であることができる。また、シクロアルキル基は、任意に本明細書で定義したようなアルキル基、オキソ基、及び/又はアルキレン基で置き換えることができる。環状アルキル鎖に沿って、1又は2以上の酸素原子、イオウ原子、又は置換又は非置換窒素原子を挿入することができ、ここで窒素置換基としては、水素原子、アルキル基、置換アルキル基、アリール基、又は置換アリール基であり、従って、複素環式基を提供する。代表的な単環式のシクロアルキル環としては、シクロペンチル基、シクロヘキシル基、及びシクロヘプチル基がある。多環シクロアルキル環としては、アダマンチル基、オクタヒドロナフチル基、デカリン基、ショウノウ、カンファン、及びノラダマンチルがある。
"アルコキシル基"はアルキル−O−基を表し、ここでアルキル基は前述の通りである。本明細書で用いる用語"アルコキシル基"は、例えば、メトキシル基、エトキシル基、プロポキシル基、イソプロポキシル基、ブトキシル基、t−ブトキシル基、及びペントキシル基を表すことができる。用語"オキシアルキル基"は、"アルコキシル基"と互換性を持って用いることができる。
"アラルキル基"はアリール−アルキルー基を表し、ここでアリール基及びアルキル基は前述の通りであり、また置換アリール基及び置換アルキル基を含む。アラルキル基の例としては、ベンジル基、フェニルエチル基、及びナフチルメチル基がある。
【0029】
"アルキレン基"は、1から約20個までの炭素原子、例えば、1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,又は20個の炭素原子を持つ、直鎖型又は分枝型2価脂肪族炭化水素基を表す。アルキレン基は、直鎖型、分枝型、又は環状であることができる。また、アルキレン基は、任意に不飽和、及び/又は1又は2以上の"アルキル基置換基"により置換されている。アルキレン基に沿って、任意に1又は2以上の酸素原子、イオウ原子、又は置換又は非置換窒素原子を挿入することができて(本明細書ではまた、"アルキルアミノアルキル基と表される)、ここで窒素置換基は前述のアルキル基である。アルキレン基の例としては、メチレン基(−CH2−);エチレン基(−CH2−CH2−);プロピレン基(−(CH2)3−);シクロヘキシレン基(−C6H10−);−CH=CH−CH=CH−基;−CH=CH−CH2−基;−(CH2)q−N(R)−(CH2)r−基、ここで各q及びrは、独立に0から約20までの整数、例えば、0,1,2,3,4,5,6,7,8,9、10、11,12,13,14,15,16,17,18,19又は20、であり、Rは水素原子又は低級アルキル基であり;メチレンジオキシル基(−O−CH2−O−);及びエチレンジオキシル基(−O−(CH2)2−O−)である。アルキレン基は、約2から約3個の炭素原子を有し、さらに6〜20個の炭素原子を持つことができる。
【0030】
"アリーレン基"は、2価のアリール基を表す。アリーレン基の例としては、フェニレンがあり、フェニレン基は、互いにオルト、メタ及びパラ位置、即ち、夫々、に結合に使われる環の炭素原子を持つことができる。
【化1】

アリーレン基はまたナフチレン基であることができる。アリーレン基は、任意に、本明細書で定義した、同一又は異なる1又は2以上の"アリール基置換基"で、置換することができる("置換アリーレン基")。
"アラルキレン基"は、アルキル基及びアリール基を含む2価官能基である。例えば、アラルキレン基は、2個のアルキル基及び1個のアリール基(即ち、−アルキル−アリール−アルキル−)、1個のアルキル基及び1個のアリール基(即ち−アルキル基−アリール基−)、又は2個のアリール基及び1個のアルキル基(即ち、−アリール−アルキル−アリール−)を持つことができる。
【0031】
用語"アミノ基"及び用語"アミン基"は、NR3、NH3、NHR2、及びNH2R基のような窒素含有性官能基を表し、ここでRはアルキル基、分枝型アルキル基、シクロアルキル基、アリール基、アルキレン基、アリーレン基、アラルキレン基であることができる。従って、本明細書で用いる"アミノ基"は、1級アミン基、2級アミン基、又は3級アミン基を表すことができる。幾つかの実施態様において、1個のアミノ基のRは、ジアゼニウムジオレイン酸塩(即ちNONO−)であることができる。
用語"カチオン性アミン基"及び"第4級アミン基"は、付加的な(即ち第4番目)官能基を有するアミノ基を表し、例えば窒素原子に結合した、水素原子又はアルキル基を表す。従って、カチオン性アミン基及び第4級アミン基は、正電荷を担う。
用語"アルキルアミン基"は、−アルキル−NH2−基を表す。
【0032】
用語"カルボニル基"は、−(C=O)−基を表す。
用語"カルボキシル基"は、−COOH基を表し、また用語"カルボン酸塩"は、カルボキシル基、即ち−COO−から作られたアニオンを表す。
本明細書で用いる"ハロ基""ハロゲン化物"又は"ハロゲン原子"はフッ素、塩素、シュウ素及びヨウ素基を表す。
用語"水酸基"及び"ヒドロキシ基"は、−OH基を表す。
用語"ヒドロキシアルキル基"は、−OH基で置換されたアルキル基を表す。
"メルカプト基"又は"チオ基"は、―SH基を表す。
"シリル基"は、ケイ素原子(Si)を含む官能基を表す。
【0033】
本明細書で用いるように、"アルコキシシラン基"はケイ素原子に結合する1,2,3,又は4個のアルコキシ基を含む化合物を表す。例えば、テトラアルコキシシランはSi(OR)4を表し、ここでRはアルキル基である。各アルキル基は、同一又は異なることができる。ある"アルキルシラン基"は、アルコキシ基の1個又は2個以上が、1個のアルキル基に置換されたアルコキシシラン基を表す。従って、アルキルシランは、少なくとも1つのアルキル−Si結合を含む。用語"フッ素化シラン基"は、アルキル基の1個が1又は2以上のフッ素原子により置換されたアルキルシランを表す。用語"カチオン性、又はアニオン性シラン基"は、アルキル基の1個がさらに正(即ちカチオン性)荷電、又は負(即ちアニオン性)荷電を有するアルキル基置換基に置換され、又は特定の環境(即ち、インビボで)で荷電を持つことができる(即ち、イオン化しうる)アルキルシラン基を表す。
用語"シラノール基"は、Si−OH基を表す。
【0034】
II.酸化窒素放出粒子
本出願で開示した対象物は、酸化窒素放出粒子及び医生物学的及び薬学的応用における使用を提供する。多くの実施態様において、本出願で開示した粒子は制御された、及び/又は標的を定めた方法で酸化窒素を放出し、またそれにより酸化窒素の生物作用及び特異性を改善し、及び持続する。幾つかの実施態様において、本出願で開示した酸化窒素放出粒子は、インビボの細胞、及び/又は組織へ酸化窒素を運搬するための新しい踏み台を提供する。従って、本出願で開示した酸化窒素放出粒子は、酸化窒素供与化学及び酸化窒素放出治療に対するユニークなスカフォード(足場)を提供する。
今、図1を参照すると、本出願で開示した粒子Pは、幾つかの実施態様において、コアCR,酸化窒素供与体NO,外部の内側を含む"内部"又は"内部領域"IR、及び"外部"又は"外部領域"ERを含む言葉で記述することができる。以下の本明細書において具体的に記述されるように、内部IRはまた、任意に脆弱性部分又は脆弱性基LPを含む、有機リンカーOLKを含む。
【0035】
外部又は外部領域ERは粒子Pの最外部の化学的機能性として定義できる。幾つかの実施態様において、外部ERは、粒子Pの酸化窒素放出動特性を制御すること、粒子Pの生体適合性を変えること、粒子Pの溶解度を調節すること、NO放出前に意図した場所(例えば、特異的細胞、組織、又は器官)への粒子Pの標的特異的な運搬を提供すること、粒子Pの画像又は追跡を提供すること、又は付加的な治療試薬(即ち、NOに加えて)を供給すること、ができる成分又は複数の成分を含む。この様な外部ERはNO放出粒子Pの機能を制御する、又は"官能基化"すると言うことができる。幾つかの実施態様において、外部領域ERの化学群は、NO放出粒子Pの1以上の機能を制御できる、また外部ERは、"多官能基性"と記述できる。幾つかの実施態様において、粒子Pを通して(例えば、コアCR又は内部IRにおいて)化学的成分又は他の構造的特性を、NO放出動特性、粒子溶解度、標的性、画像、追跡、付加的治療上の力、又は生体適合性に関係する因子又は因子群を制御するために用いることができて、また全粒子Pは、多官能基性と記述することができる。
【0036】
図1に示すように、幾つかの実施態様において、内部領域IRは有機リンカーLKを含む。本明細書で用いるように、用語"有機リンカー"又は"リンカー"は粒子コアと、粒子外部の間のギャップを橋渡しする有機つなぎ綱を表す。幾つかの実施態様において、以下の明細書でより具体的に記述するように、有機リンカーLKは脆弱性基LPを含むことができる。幾つかの実施態様において、有機リンカーLKは、いくらか、又は実質的に疎水性である。幾つかの実施態様において、リンカーLKは、分枝している。幾つかの実施態様において、リンカーLKは、コアCR,外部ER又はNO供与体NOのような粒子Pの他の構成分の1又は2以上と共有結合で結合している。
本出願で開示した対象物の粒子は、如何なる形もとることができる。従って、粒子は、球状、楕円形状、又は無定型であることができる。粒子のサイズと形は、少なくとも部分的には、自然に(即ち、化学組成)又はコアの合成法によって定められる。幾つかの実施態様において、粒子のサイズは、NO放出量又は速度に影響を与えるよう細工できる。
【0037】
幾つかの実施態様において、NO放出粒子はナノ粒子である。幾つかの実施態様において、用語"ナノ粒子"は、約0.5nmから約1000nmまでの間の直径を有する粒子を表すことを意味する。幾つかの実施態様において、ナノ粒子は、約1nmから約500nmまでの間の直径を持つ。幾つかの実施態様において、ナノ粒子は、約2nmから約200nmまでの間の直径を持つ。幾つかの実施態様において、粒子は、約1nmから約50nmまでの間の直径を持つ。
幾つかの実施態様において、粒子は1000nmより大きい。従って、幾つかの実施態様において、粒子はミクロ粒子である。幾つかの実施態様において、粒子は、約25ミクロンまでの直径を持つ。幾つかの実施態様において、粒子は、約100ミクロンまでの直径を持つ。
酸化窒素供与体は、粒子のコア、内部、又は外部の一部であることができる。NO供与体は、コア、内部又は外部の一つをカプセルに包むことができる。NO供与体は、Van der Waals相互作用、静電的相互作用(双曲子間、又は荷電基間の相互作用のような)、水素結合、又はこれらのコンビネーションのような非共有結合を介して、粒子の特定領域と結合することができる。さらに、NO供与体は、コア、内部、又は外部の一つと共有結合で結合できる。NO放出成分のパーセント組成は、希望とする治療結果又は他の結果に対する酸化窒素の有効最大積載量を与えるために、共有結合又はカプセル化によって変えることができる。
【0038】
NO放出成分又はNO供与体は、粒子の適切な標的に出会うまで、多量のNOを貯蔵しつつ、他の粒子記述子を破壊することのない様に設計できる。本明細書の以下に記載するように、リンカーの脆弱性部分を熱により、又はいかなる分解方法によっても、NO放出を開始することができる。従って、NO供与体は、NOを放出しうる如何なる成分でもあることができて、N−ジアゼニウムジオレイン酸塩、ニトロソアミン、ヒドロキシルニトロソアミン、ニトロソチオール、ヒドロキシルアミン、ヒドロキシウレア、金属錯体、有機亜硝酸塩、及び有機硝酸塩が挙げられる。Wang,P.G.,他Nitric Oxide Donors:For Pharmaceutical and Biological Applications;Wiley-VCH:Weinheim,Germany,2005;及びWang,P.G.,他、Chem.Rev.,102,1091-1134(2002)を参照されたい。
【0039】
幾つかの実施態様において、NO供与体は、N−ジアゼニウムジオレイン酸塩(即ち、1−アミノ−置換性デアゼン−1−イウム−1,2−ジオレイン酸塩)である。N−ジアゼニウムジオレイン酸塩は、生物学的条件下で自発的にNOを発生する活性を有するのでNO供与体として特に魅力的である。Hrabie,J.A.,及びKeefer,L.K.,Chem.Rev.,102,1135-1154(2002);及びNapoli,C.及びIgnarro,L.J.,Annu.Rev.Pharmacol.Toxicol.,43,97-123(2003)を参照されたい。以下の反応図1に示すように、幾つかのN−ジアゼニウムジオレイン酸塩化合物は、1級及び2級アミン、ポリアミン、及び2級アミノ酸を包含するある範囲の求核残基を用いて合成されてきた。Hrabie,J.A.,及びKeefer,L.K.,Chem.Rev.,102,1135-1154(2002)を参照されたい。N−ジアゼニウムジオレイン酸塩の合成において、高圧下で1当量のアミン基が2当量の酸化窒素と反応する。塩基(例えば、メトキシドのようなアルコキシド)はアミン窒素よりプロトンを外し、アニオン性の安定化した[N(O)NO]−基を生成する。室温条件下で安定であるが、N−ジアゼニウムジオレイン酸塩は、水溶液性の媒体中で自発的に分解し、pH、温度、及び/又はアミン分子の構造に依存した速度でNOを生成する。例えば、N−ジアゼニウムジオレイン酸塩−修飾プロリン(PROLI/NO)、2−(ジメチルアミノ)−エチルプトレアミン(DMAEP/NO),N,N’−ジメチルヘキサンジアミン(DMHD/NO)及びジエチレントリアミン(DETA/NO)は、pH7.4及び37℃において、2秒から20時間という広範囲なNO放出半減期範囲をもつ小分子NO供与体として開発された。Hrabie,J.A.,及びKeefer,L.K.,Chem.Rev.,102,1135-1154 2002);及びKeefer,L.K.,Annu.Rev.Pharmacol.Toxicol.,43,585-607(2003)を参照されたい。
【0040】
【化2】

反応図1 N−ジアゼニウムジオレイン酸塩より合成及びNO放出。
本明細書において間もなくより詳細に記載するように、幾つかの実施態様において、本出願で開示した粒子の"コア"は、以下からなる群:(a)金属クラスター;(b)樹木状ネットワーク;及び(c)様々なシラン機能性を有する共凝縮したシリカ(即ち、結合したシロキサン)ネットワーク、から選択した材料を含むが、これらに制限されない。
【0041】
II.A. 金属クラスターよりなるコア
幾つかの実施態様において、本出願で開示した粒子は、金属クラスターよりなる。金属クラスターは、更なる官能化のために不活性化又は"保護化"されることができる全ての金属複合体を含むことができる。例えば、保護化された金属複合体は、幾つかの実施態様において、有機高分子又はシリカによって被覆されることによって作られる。金属複合体は、また、有機分子の単層により保護され、ここで、有機分子は、金属複合体の表面で金属原子に配位する、又は金属原子と共有結合又は非共有結合を形成する官能性を持つ。
金属複合体は、金属、金属合金、金属塩、又は金属酸化物であることができる。幾つかの実施態様において、金属複合体は、金、銀、プラチナ、酸化鉄(即ち、FeO,Fe2O3,又はFe3O4)又はCdSe等々のような半導体粒子を含む。幾つかの実施態様において、酸化鉄は、磁鉄鉱(即ち、Fe3O4)である。幾つかの実施態様において、コアは、単層で保護された金クラスターであり、これは、Brust法及びSchulz−Dobrick法を含む、当業者に既知の様々な方法により作ることができる。
【0042】
単層保護のクラスター(MPC)金ナノ粒子、又はMPCs、(Brust,M.,J.Chem.Soc.,Chem.Comm.,801-802(1994)を参照されたい)はこれらのユニークなサイズ(1nmから5nmまで)、安定性、高度に機能的な設計を理由として、多くの注目を集めた。Feldheim,D.L.及びFoss,C.A.,編,Metal Nanoparticles - Synthesis Characterization,and Applications,Marcel Dekker,Inc:New York, p.360(2000)を参照されたい。図2に示すように、MPCsの外部は、望みの官能基を含む他のチオール基と交換することにより、配置を変えることができる。Hostetler,M.I.,他,Langmuir,15, 3782-3789(1999)を参照されたい。
更なる粒子の官能基化により、特異的な抗体―抗原又はリガンドー受容体相互作用を可能にする受容体分子を持つようになり、特異的な組織又は細胞を標的にすることが可能となる。NO放出MPC金ナノ粒子は、そのサイズ及び安定性により、インビボセンサー設計及び創傷治癒の促進、及び/又は皮膚下の血管の拡張に対する局所的クリームを含め、ある範囲の生物医学的及び薬学的応用に適用される。
【0043】
II.B.デンドリマーを含むコア
デンドリマーは、酸化窒素供与体化学に対してユニークなスカフォード(足場)を提供し、ここで多価の樹木状外部は、如何なる数の材料科学又は生物医学的応用に適するよう官能基化することができる。
デンドリマーは密に分枝化した構造を持ち、多くの反応基を持つ高分子である。デンドリティック高分子には、全て、1又は2以上の分枝点を含む、繰り返し単位の幾つかの層、又は生成源がある。超分枝化した樹木状高分子を含め、デンドリマーは、少なくとも2個の反応基を持つ単量体ユニットの縮合反応によって製造される。一般的に、デンドリマーは、末端表面基、内部分枝接合点、及び隣接した分枝接合点を共有結合で結合させる2価のコネクターからなり、内部分枝接合点は、2に等しい、又は2以上の分枝型官能基を持つ。
デンドリマーは、収束的合成又は発散的合成により製造されることができる。デンドリマーの発散合成には、分子生長過程があり、これは、放射状に外側方向に、幾何学的に進行性の階段状の分枝の上に分枝付加が連続することにより起こり、秩序ある配列を作り出す。従って、各樹木状高分子は、コアセル、1又は2層以上の内部セル、及び表面セルの外層を含むということができて、ここで各セルは、単一の分枝接合点を含む。各セルは、化学構造及び分枝官能基性において、同一又は異なることができる。表面分枝セルは、化学的に反応性のある、又は不活性な官能基を含んでもよい。化学的に反応性のある表面官能基は、更に樹木状成長を拡張するため、又は樹木状分子表面を修飾するために用いることができる。化学的に不活性な官能基は、親水性末端に対する疎水性末端の比を調節するため、及び/又は特定の溶媒に対して樹木状高分子の溶解度を向上させるためのような、物理的に樹木状表面を修飾するために用いてもよい。
【0044】
デンドリマーの収束的合成は、デンドロン又はデンドリマーの表面になると予想されるものから始まり、及び焦点又はコアの方向へ放射状に進行する、生長過程を含む。樹木状高分子は、理想的であっても、又は非理想的、即ち不完全又は欠陥的、であってもよい。不完全性は、普通不完全な化学反応、又は不可避の競合的副反応の結果である。実際面では、真の樹木状高分子は、一般的に非理想的、即ちある程度の構造的不完全性を含む。
超分枝型樹木状ネットワークは、高レベルの非理想的不規則分枝を含む樹木状高分子のクラスである。具体的には、超分枝型高分子は、全ての繰り返し単位が分枝接合点を持つとは限らない、相対的に多数の不規則な分枝領域を含む。デンドリマー、デンドロン、ランダムな超分枝型高分子、制御された超分枝型高分子及び樹木状グラフト(移植体)についての、合成及び特徴付けについては、よく知られている。デンドリマー及びデンドロンの例、及びこれらの合成方法は、米国特許番号4,507,466;4,558,120;4,568,737; 4,587,329;4,631,337;4,694,064;4,713,975;4,737,550;4,871,779及び4,857,599に公示されている。超分枝型高分子の例、及びこの合成法は、例えば、米国特許番号5,418,301に公示されている。
【0045】
本出願に開示した粒子のコアスカフォードとしての使用に適切なデンドリマーには、ポリプロピレニミンデンドリマー;ポリアミドアミン(PAMAM)デンドリマー;ポリアリールエーテルデンドリマー;ポリリジンデンドリマー;ポリエステルデンドリマー;ポリアミドデンドリマー;樹木状ポリグリセロール及びトリアジンデンドリマーがある。
幾つかの実施態様において、本出願で開示した対象物は、外部の2級アミン基を含む一連のポリプロピレニミン(PPI)デンドリマー抱合体を提供する。外部の1級アミン基を持つPPIデンドリマーから1級アミン基をアシル化し、また得られたアミド基のカルボニル基を還元して2級アミン基を合成することによって、この2級アミン基含有PPIデンドリマーを合成することができる。あるいは、1級アミン基は、既に2級アミン基を含む官能基でアシル化することができる。例えば、PPIデンドリマーの外部1級アミン基はプロリンでアシル化することができる。
デンドリマーの2級アミン官能基は、強塩基及び気体酸化窒素存在下で、高収率で酸化窒素供与体に変換できる。本明細書が提供するように、デンドリマーサイズ及び表面官能基は、2級アミン基を酸化窒素供与体へのパーセント変換率、及び酸化窒素放出動特性に影響を与える。
【0046】
II.C.共凝縮シリカネットワークを含むコア
二酸化ケイ素から合成した官能基化したセラミック合成物である、無機―有機混成シリカナノ粒子は、分離、生物的標識、診断、及び薬物、遺伝子、及びタンパク質の制御された運搬のための担体システムに関わる応用のために探求されてきた。Lai,C.-Y.,他、J.Am.Chem.Soc.,125,4451-4459(2003);Munoz, B.,他,Chem. Mater.,15,500-503(2003);Roy,I.,他、Proc.Natl.Acad.Sci,U.S.A.,102,279-284(2005);Trewyn,B.G.,他,Nano.Lett.,4,2139-2143 2004);及びYoshitake,H.,New.J.Chem.,29,1107-1117(2005)を参照されたい。シリカ粒子の薬物運搬潜在力は、これらの物理的及び化学的汎用性及び無毒性のために多くの注目を集めた。Sayari,A.,及びHamoudi,S.,,Chem.Mater.,13,3151-3168 (2001);及びStein,A.,他,Adv.Mater.,12,1403-1419(2000)を参照されたい。誘導体を作ることができる分子によって更に官能基化できる、反応性のある有機反応基(例えば、アミン基、カルボン酸塩、チオール基、オレフィン基、ハロゲン化物、及びエポキシド基)で修飾した無機―有機混成シリカの合成が報告されている。Sayari,A.,及びHamoudi.S.,Chem.Mater.,13,3151-3168(2001);及びStein,A..,他、Adv.Mater.,12,1403-1419(2000)を参照されたい。実際、前述の官能基成分を持つ無数のシランカップリング試薬が、薬物及び他の治療薬の(自由なシラノール基を通して)表面グラフト化のために開発された。Anwander.R.他、Stud.Surf.Sci.Catal.,117,135-142(1998)を参照されたい。
【0047】
一例において、Meyerhoff及び共同研究者等はフュームドシリカ(融合シリカ)(無定型粒子、直径0.2〜0.3μm)の表面にアミン官能基化したシリル化試薬をグラフトすることを報告した。Zhang,H.,他,J.Am.Chem.Soc.,125,5015−5024(2003)参照。表面に結合したアミン基は、その後、N−ジアゼニウムジオレイン酸塩NO供与体に変換された。改善した血液適合性を備えて被覆されたシリコンゴム高分子の合成のために、このNO放出シリカは充填物として使われた。
治療上のNO運搬系のようなスカフォールドの有用性は、多くの理由により妨害されたままである。この修飾は、粒子の外部表面に限られているので、NO貯蔵力は、本質的に制限され、NO放出動特性の制御には問題が多く、またNO供与体成分は、生体液中の反応性の化学種(例えば、ラジカル、過酸化物、及び遷移金属)によるコンタミネーションを受けやすい。Keefer,L. K.,Annu.Rev.Pharmacol.Toxicol.,43,585-607(2003);Napoli,C.,及びIgnarro,L.J., Annu.Rev.Pharmacol.Toxicol.,43,97-123(2003);及びZhou,Z.,及びMeyerhoff,M.E., Biomacromolecules,6,780-789(2005)を参照されたい。
【0048】
本出願で開示した対象物の粒子は、共凝縮したシリカネットワークを含むことができて、このネットワークはNO貯蔵力を増加させ、またNO放出動特性の制御力を増したNO運搬システムを提供する。幾つかの実施態様において、本出願で開示したNO放出シリカベースの粒子は、"ワンポット"合成法により製造される。Stein,A.,他,Adv.Mater.12,1403-1419(2000); Hatton, B.,他,Acc.Chem.Res.,38,305-312 2005),Lin,H.-P.,及びMou,C.-Y.,Acc.Chem.Res.,35,927-935(2002)を参照されたい。従って、図3に示すように、無機―有機混成シリカ粒子は、ゾルーゲル工程により製造され、この工程はテトラエチルオルトケイ酸塩(TEOS)、又はジ−又はトリ−アミノアルコキシシランを持つ他のアルコキシシランの共凝縮を伴う。この"ゾルーゲル"工程は、2種類の化学反応:アルコキシシランのアルコキシ基がシラノール(即ち、水酸基がSi原子に付加したもの)になる加水分解反応、その後、2個のシラノール又は1個のシラノール、及びアルコキシシランが反応してシロキサン結合(即ち、Si−O−Si)を形成する、縮合反応、を伴う。
"ワン−ポット"合成法の利点は、N−ジアゼニウムジオレイン酸塩NO供与体前駆体(即ち、ジ−及びトリ−アミノアルコキシシランのアミノ基)が粒子全体に一様に分布することができることであり、他方、表面グラフティング法により作られたアミン基修飾シリカ粒子の場合は、表面だけに分布する。図4A及び図4Bを参照されたい。実際、この直接"ワン−ポット"合成法により、より良い構造的安定性が提供され、またシリカ構造に組み込まれた有機アルコキシシラン量をより直接的に制御することが可能となる。Stein,A.他、Adv.Mater.,12,1403-1419(2000);及びLim,M.H.,及びStein,A.,Chem.Mater.,11,3285-3295(1999)を参照されたい。更に、様々な他の官能基を持つ別なシランが、構造を持つように共凝縮できて、これは、サイズ、溶解度、又は粒子の多孔率に影響を与える。
従って、幾つかの実施態様において、ナノ粒子コアは、アルコキシシラン及びアミノアルコキシシランの共凝縮体から作成した共凝縮シランネットワークを含む。幾つかの実施態様において、アミノアルコキシシランは、さらに酸化窒素との処理による共凝縮の後、官能基化されて、アミン基がN−ジアゼニウムジオレイン酸塩に変化する。図5A参照。幾つかの実施態様において、アミノアルコキシシランは、アルコキシシランとの共凝縮に先立ち酸化窒素で"前処理"又は"プレチャージ(前装填)"される。図5B参照。"プレチャージ"法は、NO供与体でより密集して官能基化した共凝縮シリカ粒子を作り出すために用いることができる。
【0049】
幾つかの実施態様において、アルコキシシランは、化学式Si(OR)4を持つテトラアルコキシシランであり、ここでRはアルキル基である。R基は、同一又は異なることができる。幾つかの実施態様において、テトラアルコキシシランは、テトラメチルオルトケイ酸塩(TMOS)又はテトラエチルオルトケイ酸塩(TEOS)から選択される。
幾つかの実施態様において、アミノアルコキシシランは化学式:
R’’−(NH−R’)n−Si(OR)3
を持ち、ここでRはアルキル基、R’はアルキレン基、分枝型アルキレン基、又はアラルキレン基であり、nは1又は2であり、R’’はアルキル基、シクロアルキル基、アリール基、及びアルキルアミン基からなる群より選択される。幾つかの実施態様において、アミノアルコキシシランは、N−(6−アミノヘキシル)アミノプロピルトリメトキシシラン(AHAP3);N−(6−アミノエチル)アミノプロピルトリメトキシシラン;(3トリメトキシシリルプロピル(ジ−エチレントリアミン(DET3);(アミノエチルアミノメチル)フェネチルトリメトキシシラン(AEMP3);[3−(メチルアミノ)プロピル]トリメトキシシラン;N−ブチルアミノ−プロピルトリメトキシシラン;N−エチルアミノイソブチルトリメトキシシラン;N−フェニルアミノ−プロピルトリメトキシシラン;及びN−シクロヘキシルアミノプロピルトリメトキシシランから選択される。代表的な適切なアミノアルコキシシランの構造を図6に示す。
いくつかの実施態様において、アミノアルコキシシランは化学式:
NH[R’−Si(OR)3]2
を持ち、ここでRはアルキル基であり、またR’はアルキレン基である。従って、いくつかの実施態様において、アミノアルコキシシランは、ビス−[3−(トリメトキシシリル)プロピル]アミン及びビス[(3−トリメトキシシリル)プロピル]エチレンジアミンから選択することができる。
【0050】
いくつかの実施態様において、本明細書で既に述べたように、アミノアルコキシシランは、NO放出のためにプレチャージされ、またアミノ基はジアゼニウムジオレイン酸塩により置換される。従って、いくつかの実施態様において、アミノアルコキシシランは、化学式:
R’’−N(NONO−X+)−R’−Si(OR)3
を持ち、ここでRはアルキル基であり、R’はアルキレン基又はアラルキレン基であり、R’’’はアルキル基又はアルキルアミン基、及びX+はNa+,K+及びLi+からなる群より選択されるカチオンである。
シリカネットワークの組成(即ち、アミノアルコキシシランの量又は化学組成)及びNOチャージ条件(即ち、溶媒及び塩基)を変えて、酸化窒素放出の量及び持続時間を最適にすることができる。従って、幾つかの実施態様において、本出願で開示したシリカ粒子組成を修飾し、シリカ粒子からのNO放出の半減期を調節することができる。
【0051】
幾つかの実施態様において、酸化窒素放出シリカ粒子の疎水性を、共凝縮シリカネットワークに様々な官能基を持つ共凝縮シラン前駆体により調節できる。幾つかの実施態様において、他のシラン前駆体を、アルキルシラン、正電荷を持つシラン、負電荷を持つシラン、及びフッ素化したシランを含む群から選択するが、これらに制限されない。幾つかの実施態様において、他のシラン前駆体を、(ヘプタデカフルオロ−1,1,2,2−テトラヒドロデシル)トリエトキシシラン;(3,3,3−トリフルオロプロピル)トリメトキシシラン;(ペルフルオロアルキル)エチルトリエトキシシラン;N−N−ジデシル−N−メチル−N−(3−トリメトキシシリル)アンモニウムクロライド;オクタデシルジメチル−(3−トリメトキシシリルプロピル)アンモニウムクロライド;3−トリヒドロキシシリルプロピルメチルホスホン酸ナトリウム塩;カルボキシルエチルシラントリオールナトリウム塩;メチルトリメトキシシラン;ブチルトリメトキシシラン;ブチルトリエトキシシラン;プロピルトリメトキシシラン;及びオクタデシルトリメトキシシランから選択することができる。
幾つかの実施態様において、共凝縮シリカネットワークは、約10モル%から約99モル%までの間の濃度のテトラアルコキシシラン;約1モル%から約90モル%の間の濃度のアミノアルコキシシラン;約0モル%から約20モル%までの間の濃度のフッ素化シラン;約0モル%から約20モル%までの間の濃度のカチオン性又はアニオン性シラン;及び約0モル%から約20モル%までの間の濃度のアルキルシランを含む(即ち、上記の濃度の溶液の凝縮から作られる)。
【0052】
幾つかの実施態様において、シリカネットワークの多孔率及びNO放出能は、鋳型構成成分の存在下でシランを共凝縮することで制御できる。この様な鋳型構成成分は、界面活性剤及びミセルを含むことができる。シリカネットワークの凝縮の後、鋳型構成成分は取り除くことができ、シリカに孔が残る。NO放出シリカ粒子内に孔を取り込むと、NO供与体充填に使われる表面積が増加する、又はNO供与体への水の接近性を高めることによりNO放出を増加させる。
例えば、図7は、孔の鋳型としてミセルを用いたメソ多孔質のシリカネットワークの合成の図式的説明である。図7に示すように、ミセルは、制御された溶媒環境中で自己会合し、ミセルロッド、又は多重ロッドのより高度に構造化した配列のような、秩序ある3次元構造を形成する。シランの混合物を含む溶液をミセル溶液に導入することができて、凝縮し、ミセルロッドを取り囲むことができるが、浸透することはできない。シラン混合物の凝縮の後、ミセルは、溶媒抽出により凝縮したシリカより取り除くことができて、シリカ内に孔を残す。
幾つかの実施態様において、本出願で開示した対象物は、官能基化したシリカを提供するが、このシリカを、当業者に既知の様々な化学的カップリング反応により、更に巧妙に作ることができる。幾つかの実施態様において、官能基化したシリカは、アミノ基修飾シリカである。幾つかの実施態様において、官能基化したシリカは、エポキシ基修飾シリカである。
幾つかの実施態様において、本出願で開示したシリカ化学は、ヒドロキシアミン化学と組み合わされる。幾つかの実施態様において、本出願で開示したシリカ化学は、ヒドロキシウレア化学と組み合わされる。
【0053】
III.酸化窒素放出粒子より酸化窒素の誘導放出
制御された、及び/又は標的を定めた輸送技術は、活性試薬の放出速度、及び/又は場所を制御することによって、一般的に、活性試薬の効率及び/又は安全性が増す。幾つかの実施態様において、本出願で開示した酸化窒素放出粒子からの酸化窒素の放出は、要求通り、選択的に作動開始又は停止(即ち誘発)することができる。
幾つかの実施態様において、有機リンカーは"脆弱"部分を含む。幾つかの実施態様において、リンカーの誘導的分解が、NO放出のメカニズム、量、速度、及び持続時間に影響することができる。図1及び8を参照すると、リンカーLKの脆弱部分LPを、外部ERに対して様々な位置A,B又はCに置くことができて、リンカーLKの位置が変わると、さらにNO放出のメカニズム、量、速度、及び持続時間に影響する。例えば、幾つかの実施態様において、図8の位置Aは、図1のNO放出粒子Pの内部IR内のNO供与体NOに隣接することができ;位置Bは、NO供与体NOと外部ERの間の中央に位置することができ;位置Cは、外部ERに近接して位置することができる。従って、幾つかの実施態様において、位置Cにおける脆弱基LPは、粒子Pが置かれた外部条件によって、より早く分解されることが可能であり、言い換えると、粒子Pの内部IRに位置するNO供与体NOを、同じ環境条件により早く曝すことになる。粒子内部IRにより深く、位置A又はB、に置かれた脆弱基LPは、幾つかの実施態様において、持続した、又は遅延した放出動特性を提供する。
【0054】
幾つかの実施態様において、リンカーの"脆弱"部分は、例えば、誘発機構のような、刺激に曝すことにより分解する。幾つかの実施態様において、刺激、又は誘発機構は、pH,光、及び酵素作用を含む群から選択されるが、これらに制限されない。
リンカーの脆弱部分の分解がpHによって誘発されるような実施態様において、リンカーは、エステル基、ヒドラゾン基、アセタール基、及び/又はpH変化に応答する他の有機官能基の様な、官能基を含む。従って、幾つかの実施態様において、リンカーは、あらかじめ定めたpH範囲で分解する。より具体的には、幾つかの実施態様において、リンカーは、エンドサイトシスによる高分子の細胞内移行の結果生ずる細胞構造である、エンドソーム内の増加した酸性pHを利用して、設計される。
幾つかの実施態様において、リンカーの分解は、光露出により誘発される。いくつかの実施態様において、光照射によりリンカー構造が分解する光脆弱成分が様々なリンカー内に作られ、"脆弱"部分が光開裂を受ける。
幾つかの実施態様において、酵素基質がリンカーに組み込まれ、興味のある望みの酵素環境に対する系の特異性を得て、興味のある酵素的経路を通して、リンカーを分解する。
従って、幾つかの実施態様において、リンカーの脆弱性は、NO放出成分からのNO放出の機構、量、速度及び持続時間を制御するための方法として用いることができる。脆弱なリンカーには、エステル、ヒドロゾン、アセタール、チオプロピオン酸塩、光脆弱成分及び酵素分解を受けるアミノ酸配列がある。
【0055】
幾つかの実施態様において、有機リンカーは、疎水性リンカーである。粒子が水溶液性の環境に置かれた時、疎水性リンカーは、例えば、ジアゼニウムジオレイン酸塩のような、NO供与体、及び/又は脆弱性リンカー、を水又はプロトンとの接触から保護する手がかりとして選ぶことができる。従って、疎水性リンカーの長さ、及び正確な化学組成を、NO放出動特性を制御するために利用することができる。用語疎水性は、非常に疎水性な基(即ち、非常に低い誘電率)であるか、又は僅かに疎水性である基(即ち、粒子の内部に水がゆっくり侵入することを許す)を含むことができる。
あるいは、有機リンカーは、両親媒性であり、疎水性基及び親水性基の両者を含む。この様なリンカーは、粒子内部にチャンネルを提供し、それにより、溶媒の脆弱性リンカー又はNO供与体への接近を亢進する。
NO放出は、NO供与体を、ナノ又はミクロ粒子、セル、細胞ゴースト、リポタンパク質、リポソーム、ミセル、微少気泡、微小球体、又は少なくとも部分的に不溶性の又は生物分解可能な性質に作られた粒子、又は合成高分子の様な、担体系内にカプセル化することにより制御できる。この様な系において、体内で担体が分解するに従い、NOは徐々に放出されることができる。一般的に、分解速度は、温度、pHレベル、及び酵素活性のような、患者内の条件により変わる。従って、この様な運搬技術を用いることにより、持続した治療試薬の放出を、長期間維持することができる。
【0056】
IV.酸化窒素放出粒子の更なる官能基化
本明細書に提供したように、本出願で開示した粒子の外部、内部、及び/又はコアを官能基化することにより、生体適合性を与える、薬物動態挙動を変える、及び標的を定める官能基性を伝える、更なる治療成分を加える、及び治療薬としてのNOの運搬及び研究に関する画像力を与えることができる。幾つかの実施態様において、粒子の外部は、1又は2以上の化学的又は生体分子成分により官能基化が可能である。
外部は、一様な、又は変化のある化学組成であることができる。幾つかの実施態様において、粒子の外部の官能基化は、層又は粒子の内部を囲むコーティング(被膜)の付加から成り立つことができる。幾つかの実施態様において、官能基化は、粒子周辺の幾つかの位置に1又は2以上のペンダント(吊り下がり)基の付加を伴うことができる。従って、以下の明細書でより具体的に記述するように、外部は、粒子のターゲッティング(標的狙い)のための1又は2以上のペンダント抗原から成り立つことができる。また、外部は、溶解度に影響を与える、水酸基、チオール基、メチル末端のアルキル鎖、スルホン酸塩、リン酸塩、カルボン酸塩、及びカチオン性又は4級アミン基のような、個々の化学成分から成り立つことができる。更に、外部は、例えば水溶性の改善を与える親水性高分子、又は既知の生体許容性高分子のような、高分子層を含むことができる。高分子層は、生物分解可能高分子であることができて、これはインビボ又はインビトロで用いた時、一定期間の間NO供与体を水から保護する。このような高分子コーティングにより、高分子コーティングが分解されるまでの時間の間、NO放出動特性が影響を受けて、持続的なNO放出が可能となる。本出願で記載した粒子の外部を官能基化するために適切な高分子としては、(ポリ)エチレンオキシド、(ポリ)ウレタン、N−(2−ヒドロキシプロピル)メタクリルアミド共重合体、及びラクチド/グリコリド共重合体(例えば、PLGA)がある。
【0057】
IV.A.酸化窒素の標的を定めた運搬のための酸化窒素放出粒子
いくつかの実施態様において、粒子の更なる官能基化により、特定の細胞、組織、又は器官のターゲッティング(標的狙い)が可能となる。従って、幾つかの実施態様において、本出願で開示した酸化窒素放出粒子を、その表面又は外部に、選択的な認識因子を付加することにより、更に修飾できる。この様な選択的な認識因子としては、小分子リガンド;抗体及び抗体断片の様な生体分子;及びサイトカイン、ホルモン、炭化水素、砂糖、ビタミン、及びペプチドのような他の因子が挙げられるが、これらに制限されない。
特異的ターゲッティングの成分は、全ての場合に要求されるわけではない。幾つかの実施態様において、位置特異的ターゲッティングは、腫瘍脈管構造に伴う亢進した透過性、及び保持効果(EPR)の様な、より受動的方法も含むことができる。位置特異的ターゲッティングは、疾病状態又は特定の器官又は組織に特異的な酵素と接触する場合のみ、NO放出を誘発するリンカーを含むNO放出粒子を用いることにより、行うことができる。最後に、ターゲッティングは、また、粒子の、例えば、局所的に、直接傷へ、又は腫瘍部位へ直接注射することにより、局所的な運搬によって行うことができる。
【0058】
一般的に、粒子が、細胞表面成分を通して細胞を標的とする場合、粒子は、受容体を介したエンドサイトシスにより細胞内に取り込まれる。標的細胞(例えば、腫瘍細胞)の表面に局在する如何なる成分も、本出願で開示した粒子に利用される。例えば、上記の様な細胞表面成分に対する抗体を用いることができる。あるいは、標的成分は、細胞表面上に存在する受容体に向けられたリガンドであることもでき、逆も可能である。
特異的ターゲティング成分(即ち、特定の細胞、組織、又は器官に粒子を向けるために設計した粒子に結合した成分)を用いる粒子の実施態様において、ターゲッティング成分は、任意に粒子の外部と結合する。ターゲッティング成分は、例えば、アミン基、アルコール、カルボン酸塩、イソシアン酸塩、リン酸塩、チオール基、ハロゲン化物、又はエポキシド基のような、外部の有用な反応基を通して、外部に直接結合できる。例えば、標的細胞を認識する成分には必要ではないアミン基を含む、又は誘導化して含むターゲッティング成分は、カルボジイミド化学を用いて、粒子外部上に存在するカルボン酸塩と直接結合することができる。ターゲッティング成分はまた、N−スクシニミジル−3−(2−ピリジルジチオ)プロピオン酸塩(SPDP,Pierce Chemical Company,Rockford,Illinois,United State of Americaより商品として入手可能)のような、短い2価官能性のリンカーにより粒子の外部上の反応基に連結することができる。あるいは、EMD Bioscience,Inc.(La Jolla,California,USA)又はShearwater polymers(Huntsville,Alabama,USA)から商品として入手可能な、ポリエチレングリコール(PEG)−ベースの2価のリンカーより長い2価のリンカーを用いることができる。
【0059】
癌細胞を標的とする使用のためのターゲッティング成分は、腫瘍特異的抗原の周囲に設計できるが、このような腫瘍特異的抗原としては、本出願に開示した対象物に使用される、癌胎児性抗原、前立腺特異抗原、チロシナーゼ、ras、シアル化ルイス抗原、erb、MAGE−1,MAGE−3,BAGE,MN,gp100,gp75,p97,プロテイナーゼ3,粘液素、CD81,CID9,CD63;CD53,CD38,CO−029,CA125,GD2,GM2,及びO−アセチルGD3,M−TAA,M−胎児又はM−泌尿器が挙げられるが、これらに制限されない。あるいは、ターゲッティング成分は、腫瘍抑制因子、サイトカイン、ケモカイン、腫瘍特異的受容体リガンド、受容体、アポトーシス誘導体、又は分化誘導因子の周囲に設計できる。更に、腫瘍成長に血管新生過程が重要とすると、幾つかの実施態様において、ターゲッティング成分は、血管新生と結びついた因子を標的とするよう開発できる。従って、ターゲッティング成分は、血管内皮細胞成長因子(VEGF)のような既知の血管新生因子と相互作用するように設計できる。Brannon-Peppas,L.及びBlanchette,J.O.,Advanced Drug Delivery Reviews,56,1649-1659(2004)を参照されたい。
ターゲッティングのために提供される腫瘍抑制タンパク質には、p16,p21,p27,p53,p73,Rb,Wilms(ウィルム)腫瘍(WT−1),DCC,神経線維腫症タイプ1(NF−1),von Hippel−Lindau(フォンヒッペルリンダウ)(VHL)病腫瘍抑制因子,Maspin(マスピン・転移抑制因子),Brush(ブラッシュ)−1,BRCA−1,BRCA−2,多重腫瘍抑制因子(MTS),ヒト・メラノーマのgp95/p97抗原,腎細胞癌関連G250抗原、KS1/4広汎癌抗原、卵巣癌関連抗原(CA125),前立腺特異的抗原、メラノーマ抗原gp75,CD9,CD63,CD53,CD37,R2,CD81,CO029,TI−1,L6及びSASがあるが、これらに制限されない。勿論、これらは例として示す腫瘍抑制因子であり、本出願で開示した対象物は、当業者に腫瘍抑制因子、又は、腫瘍抑制因子になるであろうと知られている他の如何なる因子とも関連して用いることができることは想像つく。
【0060】
幾つかの実施態様において、腫瘍遺伝子により発現される因子に向けてターゲッティングが行われる。これらの物としては、Srcファミリーのメンバーのような膜関連及び細胞質型両方のチロシンキナーゼ;Mos,成長因子の様な、セリン/スレオニンキナーゼ;及び血小板由来成長因子(PDDG)の様な受容体;rasファミリーメンバーを含む小GTPase(Gタンパク質);サイクリン依存型プロテインキナーゼ(cdk);c−myc、N−myc,及びL−mycを含むmycファミリーのメンバー;及びbcl−2とそのファミリーメンバーがあるが、これらに制限されない。
本出願で開示した粒子によりターゲティングされるサイトカインとしては、IL−1,IL−2,IL−3,IL−4,IL−5,IL−6,IL−7,IL−8,IL−9,IL−10,ILA 1,IL−12,IL−13,IL−14,IL−15,TNF,GM−CSF,β−インターフェロン及びγ−インターフェロンがあるが、これらにより制限されない。ケモカインとしては、M1P1α、M1P1β、及びRANTESがあるが、これらにより制限されない。
標的とされる酵素としては、シトシンデアミナーゼ、ヒポキサンチングアニンホスホリボシルトランスフェラーゼ、ガラクトースー1ーリン酸ウリジルトランスフェラーゼ、フェニルアラニンヒドロキシラーゼ、グルコセルブロシダーゼ、スフィンゴミエリナーゼ、α−L−イズロニダーゼ、グルコース−6−リン酸デヒドロゲナーゼ、HSVチキジンキナーゼ、及びヒトチミジンキナーゼがあるが、これらにより制限されない。
【0061】
本出願で開示された対象物の文脈で使用される受容体、及びこれに関連する関連リガンドとしては、葉酸受容体、アドレナリン作用性の受容体、成長ホルモン受容体、黄体形性ホルモン受容体、エストロゲン受容体、上皮成長因子受容体、繊維芽細胞成長因子受容体、等々が挙げられるが、これらに制限されない。幾つかの実施態様において、ターゲッティング成分は、葉酸、グアニジン、トランスフェリン、炭化水素、及び砂糖からなる群より選択される。幾つかの実施態様において、ターゲッティング成分は、アミノ酸配列RGD及びTATペプチドからなる群から選択されるペプチドである。
例えば、葉酸は、癌細胞を標的とする特に有用なターゲッティング成分であることができる。癌性腫瘍細胞は、その細胞表面に、葉酸受容体の過剰発現がある。葉酸(FA)は、様々な割合の修飾を伴ってナノ粒子外部に結合し、NO放出ナノ粒子のFAを標的とする運搬に寄与する。そのサイズが小さいので、多くの葉酸リガンドが、粒子表面に付加される。Wienerは、葉酸が付加したデンドリマーは、高親和性葉酸受容体(hFR)を欠く対照細胞では葉酸誘導化デンドリマーの顕著な集積はないが、特にhFRを発現する腫瘍細胞の表面及び内部に集積することを報告している。Wiener,E.C.他、Invest. Radiol.,32(12),748-754(1997)を参照されたい。葉酸は、カルボジイミドカップリング反応により、粒子外部のアミン基に付加することができる。
【0062】
葉酸より大きいが、なお相対的に小さいターゲティング成分は、53個のアミノ酸残基を持つ単鎖ペプチドである上皮性成長因子(EGF)である。リンカーSPDPを持つEGFと連結したPAMAMデンドリマーは、ヒト・グリオーマ細胞の細胞表面に結合し、エンドサイトーシスが行われ、リゾソームに集積する。Capala,J.,他、Bioconjugate Chem.,7(1),7-15 (1996)を参照されたい。EGF受容体密度は、正常細胞に比べて、脳腫瘍細胞上では、100倍まで高いので、EGFは、これらの種類の腫瘍細胞には、有用なターゲッティング試薬となる。EGF受容体は、また、乳癌及び直腸癌で過剰発現しているので、これらの細胞でもまたターゲッティング試薬として使われることができる。同様に、繊維芽細胞成長因子受容体(FGFR)は、また相対的に小さなポリペプチド(FGF)と結合し、また乳癌細胞株で高レベル発現することが知られている(特に図1,2及び4)。Penault-Llorca,F.,他、Int.J Cancer,61(2),170-176(1995)を参照されたい。
ホルモンとその受容体としては、成長ホルモン、プロラクチン、胎盤性ラクトゲン、黄体形成ホルモン、卵胞刺激ホルモン、絨毛性ゴナドトロピン、甲状腺刺激ホルモン、レプチン、副腎皮質刺激(ACTH)、アンギオテンシンI,アンギオテンシンII,β−エンドルフィン、β−メラノサイト刺激ホルモン(β−MSH)、コレチストキニン、エンドセリンI,ガラニン、胃炎阻害ホルモン(GIP),グルカゴン、インシュリン、アミリン、リポトロピン、GLP−1(7−37)ニューロフィジン、及びソマトスタチンが挙げられるが、これらに制限されない。
【0063】
本出願で開示した対象物の目論見によると、ナノデバイスのターゲティング構成成分に置かれたビタミン類(脂溶性及び非脂肪可溶性)をある種類の細胞を標的にする為に用いることができて、その細胞は、これらのビタミン類に対する受容体を持つ、又はそうでなければ、これらのビタミン類を取り込む細胞である。ビタミンD及びこの類似体、ビタミンE,ビタミンA等々、又はビタミンC等々の様な、水溶性ビタミンは、この観点から特に好ましい。
様々な生物標的(例えば、感染源、腫瘍細胞、正常細胞)上の抗原又は免疫源(例えば、腫瘍、組織又は感染源特異的抗原)を標的とするために、抗体を作ることができる。本出願で開示した対象物の幾つかの実施態様において、ターゲッティング成分は、抗体又は抗体の抗原結合断片(例えば、Fabユニット)である。従って、"抗体"としては、ポリクロナル抗体、モノクロナル抗体、キメラ抗体、単鎖抗体、Fab断片、及びFab発現ライブラリーが挙げられるが、これらにより制限されない。
【0064】
多くの癌(乳癌HER2腫瘍も含め)の表面に見出される良く研究された抗原の1例として、糖タンパク質p185があり、これは、専ら悪性細胞に発現される。Press,M.F.他、Oncogene5(7)、953-962(1990)を参照されたい。組み換えたヒト化抗−HER2モノクロナル抗体(rhuMabHER2)は、Genentech(South SanFrancisco,California,USA)から、HERCEPTIN(R)の名前で、商品として入手可能である。本出願で開示した対象物の使用のために適切な他の代表的な抗体には、CD14及び前立腺特異的膜抗原(PSMA)に結合するIgC−型抗体である60bca及びJ591(全
て本明細書に参考文献として取り込まれている、Baker,J.R.,Jr.,Biomacromolecules,5,2269-2274(2004)を参照されたい)、及び乳腫瘍細胞株SK−BR−3のErbB2成長因子に結合する、抗体F5及びC1があるが、これらに制限されない。
本明細書に既に記載したように、粒子の持つ標的特異的なNO運搬能は、粒子外部に付加したペンダント(吊り下がった)ターゲティング因子を含む実施態様のみに制限されない。粒子の非外部付加の特性もまた、ターゲティングのために使用される。従って、幾つかの実施態様において、亢進した透過性及び保持(EPR)効果が、ターゲティングのために使われる。このEPR効果は腫瘍の超透過性脈管構造、及び乏しいリンパ排液を原因とする腫瘍ミクロ環境における高分子、及び小粒子の選択的集積である。幾つかの実施態様において、EPRを高めるために、粒子外部を、親水性高分子で塗布し、又は結合させ、粒子の循環半減期を高め、プラズマタンパク質の粒子への付着を阻む。
【0065】
幾つかの実施態様において、ターゲッテング成分は、磁鉄鉱のような磁化成分であることができる。幾つかの実施態様において、粒子のコアは磁鉄鉱を含む。幾つかの実施態様において、磁鉄鉱コアは、さらに、NO供与体を含む、又は含むように官能基化されることができる、共凝縮したシリカネットワークを含むシェルで被覆される。患者に一度投与されると、磁石を利用して磁化粒子をその標的、即ち、NO放出を望む部位、に向けることができる。この様な磁石は、外部(即ち、病人又は患者の外から)から適用できる。
標的を定めた薬剤運搬の、更なる方法の例として、特に、癌治療のための標的狙いの系があり、Brannon-Peppas,L.及びBlanchette,J.O.,Advanced Drug Delivery Reviews,56,1649-1659(2004)及び米国特許番号6,471,968、これらは、本明細書に参考文献として全体が取り込まれている。
【0066】
IV.B 酸化窒素放出粒子の画像
幾つかの実施態様において、NO放出粒子は、インビボ又はインビトロにおいて粒子の画像又は追跡を助ける成分を含むことができる。粒子の追跡は、酸化窒素放出効率を決める上で、疾病を治療する上で、又は粒子のターゲティングの特異性を評価する上で有効であることができる。画像化又は追跡成分は、粒子のコア、内部、又は外部の何れかと結合することが可能である。幾つかの実施態様において、画像化又は追跡成分は、粒子のコア、内部、又は外部の一つと共有結合している。幾つかの実施態様において、追跡試薬又は成分は、例えば、量子ドットコアを持つ粒子の例のように、コアの部分である。
幾つかの実施態様において、画像化試薬の追跡は、蛍光分子、有機染料、又は放射性同位元素の一つである。
幾つかの実施態様において、画像化試薬は、磁気共鳴画像(MRI)コントラスト試薬であることができる。従って、幾つかの実施態様において、粒子の外部は、例えば、通常MRI試薬として使われるGd(III)−ジエチレントリアミンペンタ酢酸(Gd(III)−DTPA)のキレート基である、ジエチレントリアミンペンタ酢酸(DTPA)の様な、常磁性イオンとキレートすることができる基を含むよう官能基化されることは知られている。此の文脈で有用であることができる、他の常磁性イオンとしては、ガドリニウム、マンガン、銅、クロムイオン、鉄、コバルト、エルビウム、ニッケル、ユーロピウム、テクニチウム、インジューム、サマリウム、ジスプロシウム、ルテニウム、イッテルビウム、イットリウム、及びホルミウムイオン、及びこれらのコンビネーションがあるが、これらに制限されない。
【0067】
IV.C.付加的治療試薬
幾つかの実施態様において、1又は2以上の付加的治療試薬を、本出願で記述した粒子のNO供与体と組み合わせて用いることができる。このような付加的試薬は、粒子自体の中に取り込まれることができ;粒子を含む調剤の部分に取り込まれることができ;又は前、後、に分離した薬剤配合物として、又は同時の粒子を含む薬剤配合物として、服用量の部分として取り込まれることができる。このような付加的治療薬剤として、特に、抗癌治療薬、抗菌剤、苦痛緩和剤、抗炎症薬、血管拡張薬、及び免疫抑制剤、さらに、疾患又は治療される状態の軽減を亢進するであろう全ての他の既知の治療薬が挙げられる。
NO放出粒子に付加的治療因子又は薬剤が組み込まれる実施態様において、付加的治療薬は、粒子の外部、内部、又はコアの何れかと関係づけられることができる。例えば、付加的薬剤は、コア又は粒子の内部のリンカー内にカプセル化できる。付加的薬剤は、粒子のコア、内部又は外部に共有結合で結合できる。更に、付加的因子の結合は、放出誘発法と関連させることができて、ここで、脆弱性リンカーを介して付加的薬剤を粒子に繋げることができて、これにより、好ましくは望みの作用部位(例えば、腫瘍細胞など)において、水との接触、pHの上昇、又は酵素的又は光開裂、によって試薬を放出する。
NO放出粒子と組み合わせて用いられる付加的治療薬剤の選択は、様々な因子によると考えられ、考慮する因子としては、疾病の種類、年齢、及び患者の一般的健康状態、疾病進行の激しさ、及び患者の組合せを含む薬剤への許容力が挙げられるが、これらに制限されない。
【0068】
"抗腫瘍"薬又は"化学療法薬"と記載される様々な化合物が、癌治療で用いられる、本出願で開示されたNO放出粒子と組み合わせて、又は組み込まれて用いることができる。この様な化学療法化合物としては、アルキル化剤、DNAインターカレーター、タンパク質合成阻害剤、DNA又はRNA合成阻害剤、DNA塩基類似体、トポイソメラーゼ阻害剤、抗血管新生阻害剤、及びテロメラーゼ阻害剤又はテロマー化DNA結合化合物があるが、これらに制限されない。例えば、適切なアルキル化剤としては、ブスルファン、インプロスルファン及びピポスルファンのようなアルキルスルホン酸塩;ベンゾジゼパ、カルボクオン、ムチュレデパ、及びウレデパのようなアジリジン;アルトゥレタミン、トリエチレンメラミン、トリエチレンホスホラミド、トリエチレンティオホスホラミド、及びトリメチロールメラミンのようなエチレニミン及びメチルメラミン;クロランブシル、クロルナファジン、サイクロホスファミド、エストラムスチン、イホスファミド、メクロレタミン、メクロレタミンオキシド塩酸塩、メルファラン、ノベンビチン、フェネステリン、プレドゥニムスチン、トロホスファミド、及びウラシルマスタードのようなナイトロジェンマスタード;カルムスチン、クロロゾトシン、ホテムスチン、ロムスチン、ニムスチン、及びラニムスチンのようなニトロソウレアが挙げられる。
【0069】
癌の治療に用いられる抗生物質としては、ダクチノマイシン、ダウノルビシン、ドクソルビシン、イダルビシン、ブレオマイシン硫酸塩、マイトマイシン、プリカマイシン、及びストレプトゾシンがある。化学療法抗体謝剤としては、メルカプトプリン、チオグアニン、クラドゥリビン、フルダラビンリン酸塩、フルオロウラシル(5−FU),フロクスウリジン、シタラビン、ペントスタチン、メトトゥレキセート、及びアザチオプリン、アシクロビル、アデニンβ−1−D−アラビノシド、アメトプテリン、アミノプテリン、2−アミノプリン、アフィジコリン、8−アザグアニン、アザセリン、6−アザウラシル、2’−アジド−2’−デオキシヌクレオシド、5−ブロモデオキシシチジン、シトシンβ−1−D−アラビノシド、ジアゾオキシノルロイシン、ジデオキシヌクレオシド、5−フルオロデオキシシチジン、5−フルオロデオキシウリジン、及びヒドロキシウレアがある。
【0070】
化学療法蛋白合成阻害剤としては、アブリン、アウリントリカルボキシル酸、クロランフェニコール、コリシンE3,シクロヘキシミド、ジフテリア毒素、エデニンA,エメチン、エリスロマイシン、エチオニン、フッ化物、5−フルオロトリプトファン、フシジン酸、グアニリルメチレンジホスホン酸塩、及びグアニリルイミドジホスホン酸塩、カナマイシン、カスガマイシン、キロマイシン、及びO−メチルスレオニンがある。更なるタンパク質合成阻害剤としては、モデクシン、ネオマイシン、ノルバリン、パクタマイシン、パラモマイシン、ピューロマイシン、リシン、志賀菌毒素、ショウドマイシン、スパルソマイシン、スペクチノマイシン、ストレプトマイシン、テトラサイクリン、チオストレプトン、及びトリメトプリムがある。DNA合成阻害剤は、本出願で開示した癌治療の一部分として用いることができて、該阻害剤としては、ジメチル硫酸、マイトマイシンC,ナイトロジェン及びサルファーマスタード、等のアルキル化剤;アクリジン色素、アクチノマイシン、アドリアマイシン、アントラセン、ベンゾピレン、エシジュームブロマイド、プロピジュームジイオダイド−インタートワイニングなどのインターカレート薬剤、ディスタマイシン及びネトロプシンのような薬剤がある。トポイソメラーゼ阻害剤、細胞分裂阻害剤、及び、RNA合成阻害剤は、また、本出願で開示した対象物の粒子と組み合わせて、又は組み込むことができて、適切な癌治療を提供するが、トポイソメラーゼ阻害剤としては、クメルマイシン、ナリジクス酸、ンボビオシン、オキソリン酸があり;細胞分裂阻害剤としては、コルセミド、コルヒチン、ビンブラスチン、及びビンクリスチンがあり;RNA合成阻害剤としては、アクチノマイシンD,α−アマニチン、及び、他のカビのアマトキシン、コルディセピン(3’−デオキシアデノシン)、ジクロロリボフラノシルベンジミダゾール、リファンピシン、ストゥレプトバリシン、及びストゥレプトリディジンがある。
【0071】
従って、本出願が記載するNO放出粒子の一部として、又は組み合わせて用いることができる、現代の化学療法薬剤としては、アドリアマイシン、5−フルオロウラシル(5FU),エトポシド、カンプトテシン、アクチノマイシン−D,マイトマイシン、シスプラチン、過酸化水素、カルボプラチン、プロカルバジン、メクロレタミン、シクロホスファミド、イフォスファミド、メルファラン、クロランブシル、ビスルファン、ニトロソウレア、ダクチノマイシン、ダウノルビシン、ドクソルビシン、ブレオマイシン、プリコマイシン、タモクシフェン、タキソール、トランスプラチナム、ビンブラスチン、及びメトトゥレキセート、等々がある。
【0072】
本明細書で用いた様に、用語"抗菌剤"は、バクテリア、カビ、酵母菌、又はヴィールスを殺す、成長を阻害する、又は成長を阻止する如何なる薬剤に対しても用いられる。本出願で開示したNO放出粒子に組み込まれることができて、微生物感染の治療を助ける、又は感染を阻害する適切な抗菌剤には、バンコマイシン、ブレオマイシン、ペントスタチン、ミトキサントロン、マイトマイシン、ダクチノマイシン、プリカマイシン、及びアミカシンがあるが、これらに制限されない。他の抗菌剤としては、2−p−スルファニリーアニリノエタノール、4,4’−スルフィニルージアニリン、4−スルファニルアミドサリチル酸、アセジアスルフォン、アセトスルフォン、アミカシン、アモキシシリン、アンフォテリシンB、アンピシリン、アパルシリン、アピシクリン、アプラマイシン、アルベカシン、アスポキシシリン、アジダムフェニコール、アジスロマイシン、アズトゥレオナム、バシトラシン、バンベルマイシン(複数)、ビアペネム、ブロジモプリム、ブチロシン、カプレオマイシン、カルベニシリン、カルボマイシン、カルモナム、セファドゥロキシル、セファマンドール、セファトリジン、セフブペラゾン、セフクリジン、セフジニル、セフジトレン、セフェピム、セフェタメット、セフィクシム、セフェメノキシム、セフェニノクス、セフォジジム、セフォニシド、セフォペラゾン、セフォラニド、セフォタクシム、セフォテタン、セフォチアム、セフォゾプラン、セフピミゾール、セフピラミド、セフピローム、セフプロジル、セフロクサジン、セフタジジム、セフテラム、セフチブテン、セフトリアクソン、セフゾナム、セファレクシン、セファログリシン、セファロスポリンC、セファラジン、クロランフェニコール、クロルテトラサイクリン、シプロフロクサシン、クラリスロマイシン、クリナフロクサシン、クリンダマイシン、クリンダマイシンリン酸塩、クロモサイクリン、コリスチン、シクラシリン、ダプソン、デメクロサイクリン、ジアシモスルフォン、ジベカシン、ジヒドロストレプトマイシン、ジリスロマイシン、ドキシサイクリン、エノクサシン、エンビオマイシン、エピシリン、エリスロマイシン、フロモクセフ、フォルチマイシン(複数)、ゲンタイマイシン(複数)、グルコスルフォン、ソラスルフォン、グラミシジンS、グラミシジン(複数)、グレパフロクサシン、グアメサイクリン、ヘタシリン、イミペネム、イセパミシン、ホサマイシン、カナマイシン(複数)、ロコマイシン(複数)、リンコマイシン、ロメフロクサシン、ルセンソマイシン、ライムサイクリン、メクロサイクリン、メロペネム、メタサイクリン、ミクロノマイシン、ミデカマイシン(複数)、ミノサイクリン、モクサラクタム、ムピロシン、ナジフロクサシン、ナタマイシン、ネオマイシン、ネチルミシン、ノルフロクサシン、オレアンドマイシン、オキシテトラサイクリン、p−スルファニリルベンジルアミン、パニペネム、パロモマイシン、パズフロクサシン、ペニシリンN,ピパサイクリン、ピペミジン酸、ポリミクシン、プリマイシン、キナシリン、リボスタマイシン、リファミド、リファンピン、リファマイシンSV,リファペンチン、リファキシミン、リストセチン、リティペネム、ロキタマイシン、ロリテトラサイクリン、ロサラマイシン、ロキシスロマイシン、サラゾスルファジミジン、サンサイクリン、シソマイシン、スプラフロクサシン、スペクチノマイシン、スパルマイシン、ストレプトマイシン、スクシスルフォン、スルファクリソイジン、スルファロキシン酸、スルファミドクリソイジン、スルファニル酸、スルフォクソン、テイコプラニン、テマフロクサシン、テモシリン、テトラサイクリン、テトロクソプリム、チアンフェニコール、チアゾールスルフォン、チオストレプトン、チカルシリン、チゲモナム、トブラマイシン、トスフロクサシン、トリメトプリム、トロスペクトマイシン、トロバフロクサシン、ツベラアクチノマイシン、及びバンコマイシンが挙げられる。抗菌薬剤には、また、アンフォテリシンB、アザセリン、カンジシジン(複数)、クロルフェネシン、デルモスタチン(複数)、フィリピン、フンジクロミン、メパルトリシン、ニスタチン、オリゴマイシン(複数)、ペリマイシンA,チュベルシジン、イミダゾール、トリアゾール、及びグリーソフルビンのような、抗カビ薬剤も含まれる。
【0073】
V.治療方法
幾つかの実施態様において、本出願で開示した対象物は、本明細書で定義したように、酸化窒素を患者まで運搬する方法を提供し、この方法は、幾つかの実施態様において、その治療が必要な患者の疾患又は健康状態を治療することを意図するものである。幾つかの実施態様において、本出願で開示した対象物は、患者の特定の部位に、酸化窒素の標的を定めた運搬のための方法を提供する。この様な部位は、特定の細胞、組織、器官であっても良い。従って、本出願で開示した対象物は、任意に少なくとも1つの付加的な治療薬剤と組み合わせて酸化窒素供与体を投与することにより、癌、心血管疾患及び微生物感染を治療する方法;血液を医学的デバイスに曝すことに起因する血小板凝集及び血小板接着を阻害する方法;異常な細胞増殖に起因する病理学的状態を治療する方法;移植拒絶、自己免疫性、炎症性、増殖的、超増殖的、血管疾患;再発狭窄症の予防、及び/又は治療処理を含め、瘢痕組織の減少、又は創傷の収縮のための方法;を提供する。本出願で開示した対象物は、また、炎症、痛み、発熱、胃腸障害、呼吸器障害、性機能障害、及び性的感染症を治療する方法を提供する。
【0074】
V.A.患者
幾つかの実施態様において、本出願で開示した対象物の方法は、本明細書で定義した、患者の治療に有用であることができる。本出願で開示した対象物で治療される患者は、多くの実施態様において、ヒト患者であるが、本出願で開示した対象物の原理により、本出願で開示した対象物は、哺乳動物を含め、全ての脊椎動物種に関して有効であると言うことを理解すべきであり、哺乳動物も用語"患畜"に含まれる事を意図している。此の文脈において、哺乳動物は、治療が望まれる、特に農業及び家庭内の疾患のある、哺乳動物種全てを含むと理解される。
従って、本明細書で用いるように、用語"患者"は全ての無脊椎又は脊椎動物種を表す。本出願で開示した対象物の方法は、温血脊椎動物の治療において特に有用である。従って、本出願で開示された対象物は、哺乳動物及び鳥類に関与する。より具体的には、ヒトのような哺乳動物、及び(シベリアタイガーのように)絶滅の危機にある、(ヒトによる消費のために農場で飼育される動物のように)経済的に重要である、及び/又は例えば、ヒト以外の肉食動物(ネコ及び犬のように)、(豚、ホッグ、及びイノシシのような)スワイン、(畜牛、雄牛、羊、キリン、シカ、ヤギ、バイソン、及びラクダのような)反芻動物、及び馬のように(ペット又は動物園で保持されている動物)ヒトにとって社会的に重要であると言う理由で、重要な哺乳動物の治療、及び/又は診断が提供される。また、動物園で保護されて絶滅の危機にある種類の鳥、及びヒトにとって経済的に重要であるので、ニワトリ、特に例えば七面鳥、チキン、アヒル、ガチョウ、ホロホロ鳥の様な家禽である、家畜としてのニワトリの治療が、提供される。従って、家畜としてのスワイン(豚及びイノシシ)、反芻動物、馬、鶏、等々を含む、がこれらに制限されない、家畜の治療が提供される。
【0075】
V.B.配合剤
本出願で開示した治療組成物は、幾つかの実施態様において、本出願で開示した酸化窒素放出ナノ粒子及び医薬的に許容された担体を含む組成物からなる。適切な組成物としては、抗酸化剤、緩衝液、抗菌剤、殺菌性抗生物質を含む水溶液性及び非水溶液性無菌注射液、及び配合剤を意図した受益者の体液と等張にする溶質;及び懸濁剤及び増粘剤を含むことができる水性及び非水性無菌懸濁物が挙げられる。
幾つかの実施態様において、本出願で開示した治療組成物は、酸化窒素放出ナノ粒子と組み合わせた付加的治療薬剤からなり、ここで付加的治療薬剤は、付加的な希望の治療特性を持つ、又は酸化窒素放出ナノ粒子の治療効果を促進する。付加的治療薬剤は、同一、又は異なる治療組成物で投与される。従って、用語"と組み合わせて"は、活性薬剤を単一組成物としての投与又は1又は2以上の分離した組成物での投与を表すことができる。
本出願で開示した方法において用いられる組成物は、油性又は水溶液性媒体中の懸濁物、溶液、又は乳濁液のような形をとり、懸濁剤、安定剤、及び/又は分散性薬剤のような、製剤用作用物質を含むことができる。あるいは、活性な構成要素は、粉末状であり、使用前に、適切な媒体、例えば無菌パイロジェンフリー水、と共に組成体を作ることができる。
【0076】
治療用組成物は、例えば、密封したアンプル又は水薬ビンのようなコンテナ中に単位用量又は複数用量入れることができて、冷凍条件、又は使用直前に無菌液体担体を加えるだけの凍結乾燥状態で保存できる。
経口投与のために、組成物は、結合薬剤(例えば、前もってゼラチン化されたトウモロコシデンプン、ポリビニルピロリドン、又はヒドロキシプロピルメチルセルロース);増量剤(例えば、ラクトース、微細結晶化セルロース又はカルシウムリン水素酸塩);潤滑剤(例えば、ステアリン酸マグネシウム、滑石、又はシリカ);錠剤分解物質(例えば、ポテトデンプン又はグリコール酸ナトリウムデンプン);又は湿潤剤(例えば、ラウリル硫酸ナトリウム)のような、医薬的に許容された賦形剤を伴って従来型の技術により製造される、例えば、錠剤又はカプセルの形をとることができる。錠剤は、既知の技術により被覆される。例えば、治療薬剤は、ヒドロクロロチアジドと組み合わせて形作られ、また治療薬が標的器官に到着するまで治療薬剤を保護する、腸溶性、又は遅延放出被覆を施されたpHに安定化したコアとして形作られることができる。
経口投与のための液体製剤は、例えば、溶液、シロップ、又は懸濁液の形をとることができる、又は乾燥産物として与えることができて、使用前に水又は他の適切な媒体と伴に調製される。この様な液体製剤は、懸濁剤(例えば、ソルビトールシロップ、セルローズ誘導体又は水素化した食用油);乳化剤(例えば、レシチン又はアカシア);非水溶液性媒体(例えば、アーモンド油、油性エステル、エチルアルコール又は分画した植物油);及び保存剤(例えば、メチル又はプロピル−p−ヒドロキシベンゾエート又はソルビン酸)のような、医薬的に許容された付加物を伴って、従来の技術により製造することができる。この製剤は、また、必要に応じて、緩衝塩、香味料、着色料及び甘味料を含むことができる。経口投与のための製剤は、適切に配合されて、活性化合物の制御された放出を行うことができる。舌下剤投与に対して、組成物は、従来様式で配合される錠剤又はトローチ剤の形をとることができる。
【0077】
化合物をまた、埋め込み、又は注射のための調剤として配合することができる。従って、例えば、化合物は、適切な高分子又は疎水性材料(例えば、許容された油を使った乳濁液として)、又はイオン交換樹脂、又は難溶性誘導体(例えば、難溶性塩として)配合することができる。化合物はまた、直腸の組成物(例えば、座薬、ココアバター又は他のグリセリドのような従来の座薬の塩基を含む滞留浣腸)、クリーム又はローション、又は経皮パッチ中に配合できる。
医薬的配合物はまた、吸入による、噴霧剤としての投与に適切なものを供与する。これらの配合物は、本明細書で記載したNO放出粒子の溶液又は懸濁液を含む。好みの配合物を、小チャンバーに入れることができ、噴霧する。噴霧は、圧縮した空気、又は超音波エネルギーで行うことができて、NO放出粒子を含む複数の液体ドロップ又は固体粒子を作る。例えば、本出願で開示したNO放出粒子は、吸入により投与ができて、嚢胞性線維症に関係する細菌感染を治療する。嚢胞性線維症関連の細菌感染としては、Pseudomonas aeruginosa (P.aeruginosa)感染があるが、これに制限されない。
【0078】
V.C.投与量
本明細書で用いる用語"有効量"は、測定できる生物的応答を作り出すに充分な治療薬組成物(例えば、酸化窒素放出粒子を含む組成物)の量を表す。本出願で開示した対象物の活性組成物中の活性成分の実際の用量レベルは、特定の患者、及び/又は適用に対する好ましい応答を得るに有効な活性化合物を投与するために、変えることができる。選択した用量レベルは、組成物の活性、配合物、投与経路、他の薬剤又は治療との組合せ、治療される健康状態の重篤さ、及び治療を受ける患者の物理的状態及び医療前歴を含めて多くの因子に依存すると考えられる。好ましくは、最小容量を投与し、最小の有効量まで、毒性をもたらさない用量まで用量を増やす。有効量の決定及び修正、及びこの様な修正を何時どの様に行うかについての評価、は医療における当業者に既知である。
本明細書で開示した組成物の投与に対し、齧歯動物モデルへの投与用量に基づきヒト用量へ外挿する従来の方法は、マウス用量をヒト用量へ変換するための変換因子を用いて行うことができる:ヒトkg当たりの用量=マウスkg当たりの用量x12.Freireich他、Cancer Chemother Rep.50,219-244(1966)を参照されたい。薬剤用量はまた、体表面積平方メートル当たりのミリグラムでも得ることができて、その理由は、この方法は、体重を用いるより、ある種の代謝及び排泄機能に対しよい相関をもたらすからである。更に、体表面積は、成人、子供だけでなく異なる動物種への薬剤用量に対する共通分母として用いることができる。Freireich他、Cancer Chemother Rep.50,219-244(1966)を参照されたい。手短に述べると、如何なる与えられた動物種においても、mg/kg用量を等価なmg/sqm用量で表すためには、用量に適切なkmファクターを乗じなさい。成人において、100mg/kgは、100mg/kgx37kg/sqm=3700mg/m2である。
【0079】
配合物と用量に関して更なる手引きとしては、米国特許番号5,326,902;5,234,933;国際公開WO 93/25521; Berkow他、The Merck Manual of Medical Information,Home編,Merck Research Laboratories:Whitehouse Station,New Jersey(1997);Goodman他,Goodman & Gilman's the Pharmacological Basis of Therapeutics,第9版.McGraw-Hill Health Professions Division:New York(1996);Ebadi,CRC Desk Reference of Clinical Pharmacology, CRC Press, Boca Raton, Florida(1998);Katzung,Basic & Clinical Pharmacology,第8版.Lange Medical Books/McGraw-Hill Medical Pub. Division: New York(2001);Remington他,Remington's Pharmaceutical Sciences,第15版.Mack Pub.Co.:Easton,Pennsylvania(1975);及びSpeight他,Avery's Drug Treatment:A Guide to the Properties,Choice,Therapeutic Use and Economic Value of Drugs in Disease Management,第4版.Adis International:Auckland/ Philadelphia(1997);Duch他,Toxicol.Lett.,100-101,255-263(1998)を参照されたい。
【0080】
V.D.投与の経路
本出願で開示した対象物の組成物を患者に投与するに適切な方法には、全身投与、非経口投与(血管内、筋肉内、動脈内投与のような)、経口運搬、舌下運搬、皮下投与、吸入、気管支内導入、外科的な埋め込み、経皮的運搬、局所注射、及び超高速注射/照射があるが、これらに制限されない。適用可能な箇所では、連続的な輸液は、標的部位での薬剤の蓄積を高めることができる(米国特許番号6,180,082を参照されたい)。
本出願で開示した対象物の方法に基づいて使われる薬剤投与の特別な様態は、薬剤、及び/又は使う担体、治療を受ける健康状態の重篤性、及び投与後の活性薬剤の代謝又は除去のメカニズムを含むが、これらに制限されない、多くの因子に依存する。
【0081】
VI.NO放出粒子を含む組成物
幾つかの実施態様において、NO放出粒子を、高分子フィルムに取り込むことができる。この様な取り込みは、高分子表面への粒子の静電気的相互作用を介した、又は高分子表面の反応基への粒子の共有結合による結合による、高分子表面への粒子の物理的な埋め込みでできる。あるいは、粒子は、液体高分子前駆体の溶液に混ぜ合わされ、高分子が硬化した時、高分子マトリクスに取り込まれることができる。重合可能基は、粒子外部を官能基化するために用いることができて、これによって、粒子を重合過程に高分子の中で共―重合化することができる。NO放出粒子を取り込むことができる適切な高分子としては、ポリスチレン、ポリプロピレン、ポリエチレン、ポリテトラフルオロエチレン、及びポリビニリデンのような、ポリオレフィン、さらにポリエステル、ポリエーテル、ポリウレタン等々がある。特に、ポリウレタンは、医学的に区分されたポリウレタンを含むことができる。医学的に区分されたポリウレタンの一般的構造を図9Aに示す。この様なポリウレタンとしては、固い区分、即ち、相対的に硬い部分、及び柔らかい区分、即ち、変化し、相互変換する配置で存在できるより多くの自由度を持つ部分を挙げることができる。医学的に区分されたポリウレタンは、また、高分子に更なる長さ又は重さを加える、アルキレン鎖の様な、1又は2以上の拡張部分を含むことができる。この様なポリウレタンは、また非毒性である。医学的に区分されたポリウレタンの例は、TECOFLEX(R)である。図9Bを参照されたい。
【0082】
NO放出粒子を含む高分子フィルムは、特に外科的道具、生物センサー、及び医学的埋め込み物のような、様々な品物を被覆するために用いることができて、血小板凝集を防ぎ、細菌感染を防ぎ、血管拡張剤として働く。これらの記事は血管の医療用デバイス、尿路の医療用デバイス、胆管の医療用デバイス、胃腸の医療用デバイス、外科的手術部位の配置場所に適合した医療用デバイス、及び皮膚創傷又は皮膚開口の配置場所に適合した医療用デバイスに用いられる。従って、この高分子は、動脈ステント、ガイドワイアー、カテーテル、トロカール針、骨アンカー、骨ネジ、保護メッキ、腰及び関節交換、電気導線、生体センサー、プローブ、縫線、外科用ドレープ、傷用包帯及び包帯を被覆するために用いることができる。
幾つかの実施態様において、被覆されたデバイスは、例えば、ステンレス鋼、ニッケル、チタン、アルミニウム、銅、金、銀、白金、及びこれらのコンビネーションのような金属表面を持つことができる。幾つかの実施態様において、NO放出粒子を含むフィルム又は高分子は、ガラス又は繊維(例えば、布又は紙)のような非金属表面を被覆するために用いることができる。
更に、NO放出粒子を含む高分子は、デバイス自体を作るために用いることができる。例えば、高分子は、血液又は組織の保管用バッグ用に、又は傷用包帯として形作ることができる。
【0083】
更に、NO放出粒子は、抗菌石鹸のような、しかしこれに制限されない、界面活性剤中に取り込まれることができる。例えば、棒石鹸に埋め込まれた粒子の中のNO放出は、使用時に水との接触、及び/又はpHの低下により誘発される。棒石鹸の外部表面は、すり減り、又は溶けるので、棒石鹸中のさらなる粒子が、その後の棒石鹸の使用のために露出される。NO放出粒子は、また液体石鹸中に懸濁できる。この様な石鹸又は界面活性剤は、個人的な衛生のために使われ、又は繊維に対する抗菌処理を提供するために使用できる。この様な、石鹸、又は界面活性剤は、家庭用の表面、又は病院、又は細菌、カビ、又はウィルスに曝される可能性のある、他の医療環境すべての表面を処理するために用いることができる。
【実施例】
【0084】
以下の実施例に含まれることは、本出願で開示した対象物の代表的実施態様を実行する上での、当業者に対する手引きを提供することである。本出願の開示と、一般的な技術レベルを踏まえて、以下の実施例は例を示しただけであり、本出願で開示した対象物の範囲から離れることなく、無数の変化、修飾、改変が可能であることを、当業者は認識することができる。
【0085】
実施例1 アミン基で官能基化した金ナノ粒子の合成
金ナノ粒子を2段階過程でアミン官能基化し、第1段階では、金ナノ粒子コアにBr官能基化したチオールリガンドを交換し、次の段階で、Brとの反応でアミン基を付加する。図2を参照されたい。試料の1H NMRスペクトルが合成の各段階に対して得られ、図10に示す。
より具体的には、水素化ホウソナトリウムの存在下で、水素テトラクロロ金酸塩とヘキサンチオールの反応を経たBrust法により、金ナノ粒子を合成した。Hostetler,M.I.他、Langmuir,14,17-30(1998)を参照されたい。30分後、水を加えて反応を停止させた。ナノ粒子を濾過により集め、アセトニトリルで洗浄し、その後位置交換法により、臭素末端のアルカンチオールを用いて官能基化した。Hostetler,M.I.他、Langmuir,15,3782-3789(1999)を参照されたい。
入ってくる臭素末端リガンド(本明細書の以下に記載する実施例2に合成された11−ブロモ−1−ウンデカンチオール)(Troughton,B.B.他、Langumuir、4,365-385(1988)を参照されたい)を金ナノ粒子のメチレンクロライド溶液に加え(メチル基末端に対する臭素末端の比が3:1のアルカンチオール)、30分間攪拌した。溶媒を回転蒸発により取り除き、金ナノ粒子をアセトニトリルで精製した。リガンド交換の程度を、NMRでモニターし、反応時間、及び/又は臭素―アルカンチオールの濃度を変えることによりコントロールした。次ぎに、臭素官能基化した金ナノ粒子をトルエン、又はメチレンクロライドに溶かしエチレンジアミン、ブチルアミン、ヘキサンジアミン、又はジエチレントリアミンと反応させた。官能基化したナノ粒子のNMRスペクトルにおいて、−CH2Brピークが消えることは、反応の完了を示す(図10を参照のこと)。次ぎに、アミン官能基化した金ナノ粒子をメタノール及びメトキシドナトリウム塩基の溶液に懸濁し、常に攪拌しながら3日間、5気圧NOの圧を掛け、ジアゼニウムジオレイン酸塩NO供与体の合成を進行させた。N−ジアゼニウムジオレイン酸塩修飾の単層で保護されたクラスター(MPCs)を濾過し、過剰なメタノールで洗浄し、使用まで−4℃に保存した。
【0086】
MPC金ナノ粒子のサイズ及び安定性については、熱重量分析(TGA),UV−Visスペクトロスコピー、及び透過型電子顕微鏡(TEM)を用いて、特性を調べた。ヘキサンジアミン修飾金ナノ粒子の有機含量は、約22%であると測定され、22%と言う値は、53個のチオールリガンドで保護された140個の金原子(コア)を含むヘキサンジオール−MPCsについての過去の報告と一致した。Hostetler,M.I.他、Langumuir,14,17-30(1998)を参照されたい。
NOは非常に反応性が高く、金イオウ結合を壊す可能性があるので、(Hrabie,J.A.及びKeefer,L.K.,Chemical Review、102,1135-1154(2002)を参照されたい)高圧NOに曝した後のヘキサンチオール−MPCsの安定性を、TGA及びUV−Visスペクトロスコピーを用いて評価し、ジアゼニウムジオレイン酸塩形成に必要な条件が、ナノ粒子全体性を損ねない事を裏付けた。ナノ粒子の有機含量(TGAで分析)及びUV−Visスペクトルが、NOへの暴露後同じであったことは、単層の安定性に(NOは)殆ど影響を与えないことを示す。透過型電子顕微鏡像により更に、ナノ粒子のコア直径は、アミン誘導体化又はジアゼニウムジオレイン酸塩形成と無関係に、一定(2.1±0.9nm)であることを確認した。これらの研究は、MPC金ナノ粒子の構造的な全体性は、NO供与体の合成、及びNO放出能の導入に必要な条件により損なわれない事を示唆する。
【0087】
実施例2 11−ブロモ−1−ウンデカンチオールの合成
11−ブロモ−1−ウンデカンチオールを、2段階で合成した(図11を参照のこと)。第1に、11−ブロモ−1−ウンデセン(5.0g)をトルエン(50mL)中で、AiBN(1.5g)及びチオ酢酸(10mL)との反応により、チオ酢酸塩に変換した。反応は、Ar気流中で行い、2時間還流した。溶液を過剰な水で洗浄し、回転蒸発により、トルエンを除いた。11−ブロモ−1−ウンデカンチオアセテートを乾燥HClに暴露して、チオ酢酸塩を、チオールに変換した。塩化アセチル(6mL)をAr気流中で、氷浴中の乾燥メタノールに滴下して加えた。この溶液を室温まで温め、反応を約6時間進行させた。塩化メチレン及び水を加え、塩化メチレン層を水で数回洗浄した。溶媒を回転蒸発で除いた。
【0088】
実施例3 酸化窒素放出測定のための一般的手順
本出願で開示したNO放出粒子の酸化窒素放出を、以下の一般的手順に従い測定した。図12を参照し、所定の容量のリン酸緩衝液(PBS)(pH7.4,37℃)を容器、例えば丸底フラスコ、に入れた。容器の入口を窒素ガス、出口を窒素と酸化窒素の混合ガスのため以外密封した。出口を化学発光酸化窒素分析器と溶液により接続した。ジアゼニウムジオレイン酸塩化学種溶液の一部をPBS緩衝液に注入した。化学発光酸化窒素分析器により、NOはオゾン(O3)と反応し、励起NO2*を作り、反応図2に示すように、NO2*は電磁波(hν)を発光することにより、NO量を測定した。
【化3】

反応図2.化学発光によるNOの測定
【0089】
実施例4 アミン誘導化単層により保護された金ナノ粒子からの酸化窒素放出の測定
酸化窒素放出は、リン酸緩衝液塩溶液中で、生理的温度及びpHにおいて、Sievers NOATM 化学発光酸化窒素分析器(Boulder,Colorado,USA)を用いて測定した。以下の表1及び図13に示すように、ジアゼニウムジオレイン酸塩修飾金ナノ粒子からのNO放出は、置換したアミン基リガンドの数、及び/又は化学構造を変えることにより、調節できる。官能基化した単層で保護されたクラスター(MPC)金ナノ粒子からの酸化窒素放出を示す図式を図14に示す。
【表1】

【0090】
実施例5 単層保護の金ナノ粒子からなるNO放出粒子からの結果
表1及び図13を再度参照すると、エチレンジアミンリガンドの濃度を14から21%に上げると、対応して全NO放出量(9750から19,300pmolNO/mgMPC)及びNO放出持続時間(200から300分)の増加をもたらす。特別な操作理論によるなく、NO放出の増加は、アミン基の濃度増加によるNO供与体形成の増加に起因すると言うことが示唆される。ヘキサンチオールMPC対照から、また少量のNO(400pmol/mg)が測定された。しかしながら、このNO放出は、5分間以上の長い時間では無視できるので、ジアゼニウムジオレイン酸塩合成に必要な条件(5気圧NO)で、少量のNOが恐らく疎水性アルキル鎖の間にインターカレートするが、このようなNOは溶液内において急速に放出されることが示唆される。
ジアゼニウムジオレイン酸塩修飾MPCsはまた、暖かい(37℃)の窒素ガス気流中で低レベルのNOを放出するので、熱分解機構の関与が示唆される。しかしながら、NO放出のレベルは、緩衝液中の方が大きいので、N−ジアゼニウムジオレイン酸塩修飾ナノ粒子は、プロトン駆動、及び熱分解の両者を受けることが示唆される。ジアゼニウムジオレイン酸塩修飾MPCSは、窒素中に−4℃で保存すると、14日間まで(研究した最大期間)は、完全なNO放出特性を保持する。
【0091】
ジアゼニウムジオレイン酸塩修飾MPCsからのNO放出はまた、アミン基前駆体構造を変えることで調節される。アルキル鎖を伸ばして、窒素を2から6メチレン基ユニット遠ざけると、NO放出の全量が増加する(表1及び図13d及びfを参照のこと)(エチレンジアミン−及びヘキサンジアミン−修飾MPCsに対し、夫々19,300から87,000pmolNO/mgMPC)ので、NO放出/ジアゼニウムジオレイン酸塩構造関係が示唆される。
実際、半減期データ(表1)より、アミン基の間を離すと、小分子ジアゼニウムジオレイン酸塩に対して報告された分解挙動と類似して、NOの放出もより急速になることが分かる。Hrabie,J.A.,他,J.Org.Chem.,58,1472-1476(1993);Davies,K.M.他,J.Am.Chem.Soc.,123,5473-5481(2001)を参照されたい。
ジエチレントリアミン修飾MPCSからのNO放出の全量(38,000pmolNO/mg)は、エチレンジアミン−及びヘキサンジアミン−修飾MPCsに対して測定した値の間にある。ジエチレントリアミンにおいて、窒素を離すアルキル鎖の長さは短いままである(2メチレンユニット)が、付加的に2級アミン基が存在するので、エチレンジアミンと比較して、NO供与体形成(及び放出能)が増加するのであろう。
2級モノアミン誘導体であるブチルアミン修飾MPCsは、全てのアミン基修飾MPCsの中で最少の全NO放出することで特徴付けられる。アミン基を付加的することによって、ジアゼニウムジオレイン酸塩形成が促進される。Hrabie,J.A.,他、J.Org.Chem.,58,1472-1476(1993);Davies,K.M.,他、J.Am.Chem.Soc.,123, 5473-5481(2001)を参照されたい。特に、アミン基修飾MPCsのジアゼニウムジオレイン酸塩への変換率は、アミン構造に関わりなく、1%以下であると計算された。
【0092】
実施例6 酸化窒素放出デンドリマーの合成
【化4】

反応図3.親油性テイルを持つデンドリマーの一般的手順
ポリプロピレニミンヘキサデカアミンデンドリマー(DAB−Am−16、Aldrich Chemical Company,Milwaukee,Wisconsin, USAより入手可能)(図15を参照のこと)に、NaOMe存在下に、3日間、5気圧の酸化窒素をチャージした。この操作により、0.74モル酸化窒素/モル デンドリマー(2.3%変換率)及び2.3x10−8モル酸化窒素放出がもたらされた。
ポリプロピレニミンテトラヘキサコンタアミンデンドリマー(DAB−Am−64,Aldrich Chemical Company,Milwaukee,Wisconsin, USAより入手可能)(図16を参照のこと)を、NaOMe存在下に、5気圧酸化窒素で、3日間チャージした。この手順により、4.94モル酸化窒素/モル デンドリマー(3.9%変換率)を得た、また1.18x10−8モル 酸化窒素が放出された。
【0093】
DAB−C7−16(以下の反応図4を参照のこと)に、NaOMe/MeOH(反応図5)存在下に、3日間、5気圧の酸化窒素をチャージした。この操作により、12モル酸化窒素/モル デンドリマー(37.9%変換率)を得た、また3.74x10−7モル酸化窒素が放出された。
【化5】

反応図4.DAB−C7−16の合成
【化6】

反応図5.DAB−C7−16ジアゼニウムジオレイン酸塩の合成
【0094】
DAB−C7−64に、NaOMe/MeOH存在下に、3日間、5気圧の酸化窒素をチャージした。この操作により、45モル酸化窒素/モル デンドリマー(35.6%変換率)を得た、また1.48x10−7モル酸化窒素が放出された。
図17に、DAB−C7−16NaOMe/MeOHの場合の、時間の関数として酸化窒素放出を示すグラフを示す。同様に、図18に、DAB−C7−64NaOMe/MeOHに対する時間の関数として酸化窒素放出を示すグラフを示す。
DAB−Ac−16(反応図6)に、NaOMe存在下に、3日間、5気圧の酸化窒素をチャージした。この操作により、0.039モル酸化窒素/モル デンドリマー(0.12%変換率)を得た、また4.95x10−10モル酸化窒素が放出された。
【化7】

反応図6.DAB−Ac−16の合成
【0095】
DAB−Ac−64に、NaOMe存在下に、3日間、5気圧の酸化窒素をチャージした。この操作により、0.22モル酸化窒素/モル デンドリマー(0.17%変換率)を得、また3.75x10−10モル酸化窒素が放出された。
DAB−Pro−16(反応図7)に、NaOMe存在下に、3日間、5気圧の酸化窒素をチャージした。この操作により、42モル酸化窒素/モル デンドリマー(130%変換率)を得た、また1.92x10−7モル酸化窒素が放出された。
【化8】

反応図7.DAB−Pro−16の合成
DAB−Pro−64に、NaOMe存在下に、3日間、5気圧の酸化窒素をチャージした。この操作により、480モル酸化窒素/モル デンドリマー(377%変換)及び4.79x10−7モル酸化窒素放出がもたらされた。
【0096】
実施例7 アミン誘導化デンドリマーから酸化窒素放出の測定
実施例6の記載のように合成されたアミン誘導化デンドリマーからのNO放出は、実施例3に概説された手順に従って測定された。表2に結果をまとめる。
【表2】

【0097】
実施例8 ジアゼニウムジオレイン酸塩化した材料からの酸化窒素放出の測定
多くのNO放出材料からのNO放出を、実施例3に概説した手順に従い測定した。結果を表3に示す。以下の実施例9の記載のように、フュームドシリカ表面をN−(6−アミノヘキシル)−3−アミノプロピルトリメトキシシランにグラフト化し、その後NO気体で2級アミン基のジアゼニウムジオレイン酸塩化を行い、ジアゼニウムジオレイン酸塩化したフュームドシリカ粒子を合成した。
【表3】

【0098】
実施例9 NO放出シリカ粒子への合成ルート
図19を参照して、粒子サイズが薬200nmから約300nmの範囲であるNO放出シリカ粒子を参考文献Zhang,H.他、J.Am.Chem.Soc.,125,5015(2003)に記載された方法に従い合成した。
【0099】
実施例10 NO供与体前駆体の共凝縮に基づくシリカの合成
試薬及び材料:テトラエチルオルトケイ酸塩(TEOS),テトラメチルシラン(TMS),及びナトリウムメトキシド(NaOMe)は、Fluka(Buchs,Switzerland)から購入した。(アミノエチルアミノメチル)フェネチルトリメトキシシラン(AEMP3),N−(6−アミノヘキシル)アミノプロピルトリメトキシシラン(AHAP3),N−(2−アミノエチル)−3−アミノプロピルトリメトキシシラン(AEAP3),及びN−[3−(トリメトキシシリル)プロピル]ジエチレントリアミン(DET3)を含むシランは、Gelest(Tullytown, Pennsylvania, USA)より購入した。N,N−ジメチルホルムアミド(DMF)は、Sigma Chemical Company(St.Louis, Missouri, USA)より購入した。メタノール(MeOH),エタノール(EtOH),トルエン、及びアンモニア溶液(NH4OH、水溶液中30重量%)は、Fisher Scientific(Fair Lawn,NewJersey,USA)より購入した。酸化窒素(NO,99.5%)、アルゴン(Ar),及び窒素(N2)ガスは、AGA Gas(Maumee,Ohio,USA)、又はNational Welders Supply(Raleigh, North Carolina, USA)より得た。他の溶媒及び化学試薬は、分析試薬用の薬品であり、そのまま用いた。Millipore Milli-Q UV Gradient A10 System(Millipore Corporation, Bedford, Massachusetts, USA)を用いて、蒸留水を精製し、最終的に比抵抗値18.2MΩ・cm及び全有機物含量<6ppbを得た。
【0100】
酸化窒素放出シリカナノ粒子の合成:2.78mmol(620μL)TEOSと異なる濃度のAEAP3,AHAP3,AEMP3,又はDET3(0〜20モル%に相当する0〜0.70mmol、バランスTEOS)を10分間混合して、シラン溶液を調製した。このシラン溶液を22mLのEtOH、及び6mLアンモニア(水溶液中30重量%)と混合し、室温で30分間激しく攪拌した。白色沈殿物を遠心(5000rpm、5分間)して集め、EtOHで繰り返し洗浄し、真空中で、一晩乾燥した。
得られたアミン官能基化シリカを、NaOMe(0.32〜0.70mmol;シリカ混合物の2級アミン基に同一当量NaOMeを加える)の存在下に、18mLDMF、及び2mLMeOH中に懸濁し、攪拌棒を備えた10mLバイアル内に入れた。このバイアルをParrビン(200mL)内に置き、インハウスNO反応器と接続し、懸濁液中の酸素を取り除くために、6回Arによりフラッシュした。その後、反応ボトルにNOガスを、5気圧で、チャージし、3日間攪拌しながら密封した。痕跡量のNO分解物を除くために、NOガスをKOHペレット上に2時間保ち精製した。シリカ粒子を取り出す前に、未反応のNOをArにより、反応器から一掃した。N−ジアゼニウムジオレイン酸塩修飾シリカ粒子を、5000rpm、5分間の遠心で集め、エタノールで繰り返し洗浄し、室温で1時間乾燥し、−20℃で、使用まで密封した容器内で貯蔵した。
【0101】
実施例11 官能基化したシリカの特性
固体状態交差分極/マジックアングルスピニング(CP/MAS)29Si核磁気共鳴(NMR)スペクトルを、大広径マグネット(トリプルアクシス パルスフィールドグラディエント 2重共鳴プローブ)を備えたBruker 360MHzDMXスペクトロメーター(Billerica, Massachusetts, USA)を用いて、293Kで得た。シリカ混合粒子(0,10,13,及び17モル%AEAP3,バランスTEOS)を、4mmのローター(二重共鳴振動数71.548MHz)に充填し、8.0kHzの速度で回転させた。化学シフトは、TMS外部標準に相対的に、ppmで測定した。
原子間力顕微鏡(AFM)画像の場合、シリカ粒子を、トルエン中に懸濁し、新たに劈開した雲母表面の上に置き、室温条件で3時間乾燥させた。Ingor Pro(Wavemetrics;Lake Oswergo, Oregon, USA)の下で使われるMFP−3Dソフトウェアで制御された分子力プローブ3D原子間力顕微鏡(Asylum Research;Santa Barbara, California, USA)を用いて、接触法によるAFM画像を空気中で得た。名目的バネ定数0.12N/m−1及び共鳴振動数20kHz(Veeco;Santa Barbara, California, USA)をもつ三角形シリコン窒化物カンティレベールを用いて、高さ/トポグラフィー画像を0.5Hz走査速度で得た。N−ジアゼニウムジオレイン酸塩修飾シリカナノ粒子の酸化窒素放出プロフィールを、Sievers NOA280i化学発光酸化窒素分析器(Boulder, Colorado, USA)を用いて、脱酸素化リン酸緩衝塩液中で、pH3.3,4.3,5.3,6.0、7.4及び9.5で、測定した。シリカより放出した酸化窒素を、反応セルを通過するN2(200mL/min)のガス流により分析器へ移動した。装置をゼロフィルターを通した空気(0ppmNO)及び24.1ppmNO標準ガス(AGA GASより購入したバランスN2)によりキャリブレートした。
Beckman Coulter SA3100 表面積及び孔サイズ分析器(Fullerton, California, USA)でデーターを回収した窒素吸着/脱着等温線(Huh.S., 他、Chem.Mater.,15,4247-4256(2003))により、シリカの表面積及び孔容積を測定した。表面積及び孔容積を、Brunauer−Emmett−Teller(BET)及びBarrett−Joyner−Halenda(BJH)法により計算した。測定前に、全てのシリカ試料を200℃、3時間、脱気した。
【0102】
実施例12 NO供与体前駆体の共凝縮に基づくNO放出シリカナノ粒子の物理的特性
シリカナノ粒子のサイズは、用いるアミノアルコキシシランの種類及び濃度を変えることにより調節できる。異なるシラン組成を持つシリカ球体の接触法原子力間顕微鏡(AFM)画像を、図20A〜20Eに示す。対照(TEOSのみ)シリカ粒子の直径は、250±20nmであった。TEOS溶液に10モル%AHAP3を加えて変えると、粒子の直径は20±2nmに減少する。AEAPS3及びTEOSから合成したシリカ粒子は、対照よりおよそ2倍大きい(d=500±45nm)。AEAP3のモル%が、10より17モル%(バランスTEOS)に増えると、粒子の直径は、92±16nmに減少し、シリカサイズとアミノアルコキシシラン濃度の間の擬線型関係を表す(図20F)。同様なサイズにおける傾向が、調べた各アミノアルコキシシランシステムに見られる。粒子のサイズは、N−ジアゼニウムジオレイン酸塩合成後には変化しないので、シリカ粒子の構造的な全体性は、NO供与体形成及びNO放出能導入に必要な条件により損なわれないことを示す。
【0103】
図21A〜21Cに示すように、固体29Si核磁気共鳴(NMR)を用いて、アミノアルコキシ官能性のシリカネットワークへの導入を確認し、またこのリガンドの表面被覆率(SC)を測定した。交差分極及びマジックアングルスピニング(CP/MAS)技術を用いて、シグナル分解能と感度が上昇した。0から17モル%AEAP3(バランスTEOS)から合成した、対照及びアミン官能基化したシリカ粒子を解析した。TEOS対照シリカの場合、29SiNMRスペクトル中に3本の特徴的なピークが、−90、−101,及び−109ppmに観測され、これらはそれぞれQ2(ゲミナルシラノール;−O2Si(OH)2),Q3(シングルシラノール;−O3Si(OH))及びQ4(シロキサン;−O4Si)シリコンの代表例である。Huh,S.,他、Chem.Mater.,15,4247-4256(2003);及びAlbert,K.,and Bayer,E.J.,J.Chromatogr.,544,345-370(1991)を参照されたい。アミノアルコキシシラン修飾シリカ粒子の場合、5本のピークがスペクトルにおいて観測され、3本の付加的なシリコン化学的環境(図21Aのグラフb〜d)を示す。約−52及び−65PPMの化学シフトにおけるピークは、夫々、T2(−O2Si(OH)R)及びT3(−O3SiR)構造の代表例である(ここでRはアミノエチルアミノプロピル基である)。Huh,S.,他、Chem. Mater.,15,4247-4256(2003);及びAlbert,K.,及びBayer,E.J.,J.Chromatogr.,544,345-370(1991)を参照されたい。Tnバンドが存在することは、アミノアルコキシ基とシリカ骨組みの間に共有結合があることを示唆する。Q2,Q3及びQ4を表わす共鳴線はまた、予期した位置に同定できた。AEAP3含量が10から17モル%に増すと、アミノアルコキシリガンドの表面被覆率[SC=(T2+T3)/(T2+T3+Q2+Q3);Huh,S.,他、Chem.Mater.,15,4247-4256(2003);及びRadu,D.R.,他.J.Am.Chem.Soc.,126,1640-1641(2004)]が、対応して、21から37%に増えた。図21Cを参照されたい。注目すべきことは、各ピークの強度が、交差分極及びプロトン緩和時間の効率に依存するので、これらの構造の定量的解析は複雑である。Bruch,M.D.及びFatumbi,H.O.,J.Chromatogr.A,1021,61-70(2003)を参照されたい。
前記のように、窒素吸着−脱着等温線を用いて、シリカナノ粒子の表面積及び孔容積を見積もった。Huh,S.,他、Chem. Mater.,15,4247-4256(2003)を参照されたい。予期したように、アミン官能基化シリカは、10〜20m2g−1の表面積(SBET)及び0.02〜0.06mL・g−1(p/p0=0.98において)の孔容積を(Vp)もつ非孔性であることが証明された。
【0104】
実施例13 NO供与体前駆体の共凝縮に基づくNO放出シリカナノ粒子の結果
NO全量(t[NO])、NO放出の半減期(t1/2)、NO放出の最大流速[NO]m及び[NO]mに到達するに必要な時間(tm)を、アミノアルコキシシラン構造及び量の関数として見積もった。結果を以下の表4に示す。
【表4】

【0105】
NO放出を、リン酸緩衝塩液(PBS)中で、生理的温度(37℃)及びpH(7.4)において、化学発光酸化窒素分析器を用いて測定した。Beckman,J.S.,及びConger,K.A.,Methods Companion MethodsEnzymol.,7,35-39(1995)を参照されたい。2種類の代表的なシリカナノ粒子(AHAP3及びAEAP3を夫々10及び17モル%、バランスTEOS)のNO放出プロフィールを図22において比較した。注目すべきことに、NO"最大積載量"及び放出速度は、シリカナノ粒子合成に用いたアミン基リガンドの濃度及び化学構造により顕著に影響された。調べた、4種のアミノアルコキシシランシステム(例えば、AEAP3,AHAP3,AEMP3及びDET3)のうちで、AEAP3シリカは、最大量のNOを放出した。AEAP3のモル%を10から17モル%に増すと、対応してt[NO]及び[NO]mが増加した(夫々、145から600nmol/mg及び14から140ppb/mgに)。しかしながら、t1/2及びtmはどちらも、アミノアルコキシシラン濃度が増加すると減少した(10から17モル%AEAP3の増加に対して、それぞれ12から3.4時間及び8.0から2.1時間)。NO放出の持続は、10及び17モル%AEAP3に対して、より少量ではあるが、30時間まで顕著なレベルが続いた。
【0106】
このようなNO放出挙動の一つの可能性として、粒子サイズに帰すことができる。本明細書で記述した幾つかの粒子の直径及び表面積を下記の表5に示す。与えられたアミノアルコキシシランに対して(アミノアルコキシシラン濃度が高くなるにつれて)、粒子の直径が減少するに従い、内部のNO供与体リガンドまでの水拡散距離は小さくなることが予想される。従って、N−ジアゼニウムジオレイン酸塩のNOへの分解は、水の取り込みに従うので、NO放出はより早くなる。とりわけ、これらシリカ粒子のNO放出特性は、小分子N−ジアゼニウムジオレイン酸塩、及び表面グラフティングにより調製されたBO放出シリカの特性と異なる。実際、同様のアミン前駆体(即ち、アミノヘキシルアミノリガンド)を用いて合成したシリカであるが、類似した小分子DMHD/NOのt1/2は0.05時間であり、N−(6−アミノヘキシル)−3−アミノプロピルトリメトキシシラン(Zhang,H.他、J.Am.Chem.Soc.,125、5015-5024(2003)を参照されたい)で合成した、表面グラフトされたシリカNO供与体のt1/2は0.72時間であり、AHAP3シリカのt1/2は0.85時間でありこれらより長い。同様に、"ワンポット"合成で調製したAEAP3ベースのシリカ粒子のt1/2は3.4〜12時間であるのに対し、表面グラフトされたAEAP3シリカ(Zhang,H.他により、2N[2]と呼ばれる)のt1/2は2.4時間と報告されている。Zhang,H.他、J.Am.Chem.Soc.,125、5015-5024(2003)を参照されたい。
【0107】
【表5】

シリカ粒子骨格からのNO放出動特性に対するpHの効果も図23にあるように調べた。小分子N−ジアゼニウムジオレイン酸塩の挙動と一致して(Davies,K.M.他、J.Am.Chem.Soc.,123,5473-5481(2001)を参照されたい)、NO放出は、酸性条件下(pH3.3)で、加速した。反対に、上昇したpH(9.5)では、NO放出はかなり減速し、従って、N−ジアゼニウムジオレイン酸塩の顕著な劣化無しに、NO供与体ナノ粒子を貯蔵及び輸送する簡単な方法を示す。t[NO]は、すべてのpHで同様であったが、NO放出動特性は、低いpHで劇的に上昇した。pH7.4に比べて、pH3.3では、NO放出の最大流量([NO]m)は9倍上昇した。この様な挙動、及びN−ジアゼニウムジオレイン酸塩分解のpH依存性に基づき、シリカ骨格の場合、NO放出の主要な機構はプロトンにより開始されると確認されたように見える。
【0108】
実施例14 NO放出メソ多孔質AEAP3−シリカ粒子の合成における鋳型としてのCTABの使用
セチルトリメチルアンモニウム臭化物(CTAB)を、メソ多孔質AEAP3シリカ合成の際の鋳型として用いた。メソ多孔質シリカを、10モル%AEAP3、を用いて、実施例10に記載したように合成した。更に、AEAP3/TEOS塩溶液は0.01M CTABを含んだ。シラン混合物の凝縮の後、粒子を75℃、24時間、EtOHに溶かした1M HClで処理し、CTABを除いた。メソ多孔質NO放出シリカ粒子の計画された断面図を図24Aに示す。
この粒子を実施例11に記載したように、原子間力顕微鏡を用いて解析した。図24B参照。酸化窒素放出をまた、実施例11に記載したように測定した。37℃における、PBS中、3mgのメソ多孔質粒子に対して、時間(hr)の関数としてNO放出(ppb)を図25に示す。
【0109】
実施例15 プレチャージしたNO供与体の共凝縮に基づくシリカ粒子の合成
NO供与体前駆体("合成後チャージ法"又は単に"ポストチャージ法"とも呼ばれる)の共凝縮で合成されたシリカナノ粒子からのNO放出レベルは、小分子ジアゼニウムジオレイン酸塩からのものより顕著に高いが、ナノ粒子合成に用いられるアミノアルコキシシランの含量は、高濃度のアミノシラン濃度では、粒子が凝集するので、<20モル%に制限された。特別な理論によらずに、この凝集は、アミン基と隣接したシラノール間、及び/又は他のアミン基との水素結合による相互作用に帰することができると信じられる。
アミノアルコキシシラン、及び従って、粒子のNO供与体含量の濃度を増すために、本出願で開示した対象物のシリカナノ粒子を合成するための更なる方法として、ジアゼニウムジオレイン酸塩を含むシランの共凝縮がある。従って、シリカナノ粒子を最初に合成し、その後、ジアゼニウムジオレイン酸塩NO供与体("ポスト合成チャージ法"又は単に"ポストチャージ法"とよばれる)合成に必須なNOガスを装填("チャージ")した、実施例10に記載した方法とは異なり、ジアゼニウムジオレイン酸塩は、シリカナノ粒子の共凝縮前にもまた合成することができる(即ち、"プレチャージ法")。図5B参照。
【0110】
要約すると、適切な量のアミノアルコキシシランをEtOH、MeOH及びNaOMe混合物に溶解して、アミノアルコキシシラン溶液を調製する。攪拌しつつ溶液に、NOを加圧(5気圧、3日間)し、ジアゼニウムジオレイン酸塩修飾アミノアルコキシシランを合成した。TEOSと異なる割合(10〜75モル%、バランスTEOS)のジアゼニウムジオレイン酸塩修飾アミノアルコキシシランシラン溶液を混合して、シラン溶液を調製した。このシラン溶液を、アンモニア触媒存在下で、EtOH溶媒に加えた。得られた白色沈殿を遠心により集め、EtOHで洗浄し、室温で乾燥し、使用まで、−20℃で、密封容器内に保管した。この結果より、アミノアルコキシシランは最初ジアゼニウムジオレイン酸塩に変換され、それにより粒子形成の間にアミン位置と相互作用することから免れるので、プレチャージ法により、凝集を減らすということが示唆される。従って、このアプローチにより、NaOMe及びNOが、アミン前駆体により多く接近することが可能となり、アミノアルコキシシラン前駆体モル数あたりの高いNO収量がもたらされる。
【0111】
実施例16 プレチャージ法のNO供与体の共凝縮で合成された粒子のNO放出特性
実施例15に記載したプレチャージ法により合成したジアゼニウムジオレイン酸塩修飾シリカナノ粒子のNO放出特性を、表6にまとめる。注目すべきことに、全NO放出(t[NO])及びNO放出の最大量([NO]m)は、同一アミノアルコキシシラン濃度で、ポストチャージ法により合成したNO放出シリカと比べて、かなり増加した(表4を参照のこと)。例えば、17モル%AEAP3に対して、t[NO]及び[NO]mは、夫々600から800nmol/mgに、また140ppb/mgから1200ppb/mgに増加した。如何なる理論にこだわることなしに、図5Bに示すように、NO放出の増加は、ジアゼニウムジオレイン酸塩NO供与体がより均一にシリカ粒子上を分布しているためと解釈される。より重要なことは、プレチャージ法では、アミノアルコキシシラン含量を、凝集無しに、45モル%まで増加できて、結果的にt[NO]及び[NO]mが相伴って増加した。
メチル基末端2級アミンを含むアミノアルコキシシランである、メチルアミノプロピル−トリメトキシシラン(MAP3)をまた、NO放出シリカ粒子を合成するために使った。1級アミン基及び水素結合相互作用を除くことで、合成の際用いる溶媒によって、MAP3アミノアルコキシシラン濃度が75モル%まで、及び粒子サイズが80〜400nmの粒子が合成可能である。更に、MAP3濃度を10から75モル%まで増加すると、NO放出特性が増加する(例えば、t[NO]は1600から10200nmol/mg増加した)。更に、MAP3ベースのシリカ粒子のNO放出は、より大きな初期のNO放出バースト、及びより短い全体的NO放出半減期(夫々、33000〜177000ppb/mg、及び〜5分間)で特徴付けられる。
【0112】
【表6】

【0113】
実施例17 卵巣癌研究
NO供与体シリカナノ粒子の殺腫瘍性能を評価するために、不死化正常(T29)及び癌(A2780及びOVCAR−3)ヒト卵巣上皮細胞に対する対照及びNO放出シリカ粒子の細胞毒性を調べた。以下に記載のように、MTT細胞生存率アッセイを行った。3−(4,5−ジメチルチアゾール−2−イル)−2,5−ジフェニルテトラゾリウム臭化物(MTT)増殖アッセイを用いて、OVCAR−3細胞のPYRRO/NOへの相対的感受性を測定した。細胞を6セットの96ウェルマイクロタイタープレートに1〜5x103細胞/ウェルに蒔種し、一晩インキュベートし、幾つかの濃度のNO供与体及び対照ピロリジン溶液で48時間処理した。その後、NO放出培地を除き、MTT溶液に置き換え、細胞を更に4時間、37℃でインキュベートした。MTT除去後、DMSOを加え、マイクロプレートリーダーを用いて、溶液の560nmの吸光度を測定した。
図26に示すように、A2780卵巣上皮腫瘍細胞を様々な用量(0.013〜1.0mg/mL)の対照及びNO放出AHAP3シリカ粒子で48時間処理した。A2780細胞の生存率は、低用量のNO放出AHAP3シリカ処理により減少し、またA2780細胞の増殖は、用量0.50mg/mL[<5%生存率における最小阻害濃度(MIC);0.75mM NOに対応]のNO放出AHAP3シリカにより殆ど完全に阻害された。更に、NO供与体AHAP3シリカのIC50用量(50%阻害濃度)は0.02mg/mL(0.03mM NO)であった。特に、NO放出シリカの阻害濃度は、小分子NO供与体のこれらの値より顕著に低かった(例えば、PYRRO/NOのMIC及びIC50は、夫々4.4及び2mM NOであった。)
【0114】
対照シリカナノ粒子もまた、腫瘍細胞に対して細胞毒性効果を示した(IC50=0.12mg/mL)、しかしながらNO放出対応物より低かった。特別な理論に拠ることなく、1級アミン基は毒性を持つことが知られているので、対照担体の好ましくない細胞毒性は、シリカ構造の表面のフリー1級アミン基に帰すると推量できる。Shi,X.,他、Colloids Surf.A,272,139-150(2006).対照及びNO放出ナノ粒子の1級アミン基による細胞毒性を減らすために、MAP3アミノシラン(2級アミン基のみ含む)を用いて、より生体許容性のある担体を作成した。予期したように、MAP3対照の不死化(T29)及び腫瘍(A2780)細胞に対する細胞毒性は、低かったが、NO放出MAP3シリカは、T29及びA2780両細胞に対し細胞毒性を示した。図27参照。OVCAR−3卵巣アデノカルシノーマ細胞もまた、増加する濃度のNO放出シリカナノ粒子に対し同様な細胞毒性傾向を示した。
ナノ粒子サイズが細胞毒性に対して影響を与えるか調べるために、異なる粒子サイズ(直径80及び350nm、以後夫々s−MAP3及びL−MAP3と表わす)を持つ2種のシリカナノ粒子(75モル%MAP3,バランスTEOS)、を合成した。シリカ直径は、ゾルーゲル過程において溶媒系(例えば、アルコール)を変えることで容易に調節できる。Harris,M.T.,他、J.Non-Cryst.Solids,121,397-403(1990)を参照されたい。合成過程で用いるアルコールの分子量(MW)を増すと、対応して、粒子サイズは増加した(例えば、s−MAP3及びL−MAP3を合成するために、夫々100%(v/v)エタノール及び50/50%(v/v)エタノール/ブタノール混合物を用いた)。T29及びA2780をNO非放出対照MAP3粒子(80nm)、s−MAP3,又はL−MAP3(0.4mg/mL)で48時間処理して、細胞生存率を測定した。図28参照。特に、小直径NO放出シリカ(s−MAP3)は、不死化(T29)及び癌(A2780)細胞に対して細胞毒性を示した(夫々、12±1.1及び5±.2%生存率)。これに対し、大直径NO放出シリカ(L−MAP3)は健康細胞より腫瘍細胞に対して顕著により強い細胞毒性を示した(T29細胞及びA2780細胞に対し、夫々、37±2.0、及び6±1.2%生存率)。T29細胞に対して、より大きなNO運搬担体が低い毒性を示すことは、健康細胞に最小限の効果を持つ殺腫瘍性濃度のNOを放出することができるナノデバイスを開発する上での主要な段階を表す。
【0115】
実施例18 細胞取り込み
NO放出シリカ粒子の細胞内取り込みについて共焦点蛍光顕微鏡を用いて調べた。要約すると、A2780卵巣癌細胞をMET−TEC(R)ガラス底の顕微鏡プレートに〜20%飽和密度に蒔種し、一晩培養した。顕微鏡観察前に、培養緩衝液を廃棄し、A2780癌細胞のミトコンドリアを選択的に染色するために(30分インキュベーション)、100nMテトラメチルローダミン色素(TMRM)を含むKrebs−Henseleitイメージ用緩衝液[10mM N−2−ヒドロキシエチルピペラジン−N’−2エタンスルホン酸(HEPES),pH7.4]に置き変えた。NO放出シリカナノ粒子を3種のシラン前駆体:フルオレッセインイソチオシアン酸塩(FITC)修飾のアミノプロピルトリメトキシシラン(APTMS),ジアゼニウムジオレイン酸塩MAP3,及びTEOS,の共凝縮により蛍光標識した。
Zeissレーザー走査顕微鏡(LSM510;Carl Zeiss, Inc., Oberkochen, Germany)を用いて蛍光測定を行った。TMRMの赤色蛍光(543nmにおけるヘリウム−ネオンレーザー励起)を、5分、60分の時点でモニターし、ミトコンドリアの細胞内位置、及びA2780核の輪郭のマップを作った。図29C及び29Dを参照されたい。イメージ用緩衝液に溶かしたFITC標識NO放出MAP3シリカナノ粒子の100μLを直接顕微鏡台上の細胞に加え、ナノ粒子濃度を0.1mg/mLとした。直ちに、FITC標識シリカナノ粒子の緑色蛍光が520nmに観察でき、A2780癌細胞の輪郭が表れた。共焦点画像を5分間隔で集め、細胞の緑色蛍光ナノ粒子の取り込みをモニターした。図29Aは、FITC標識MAP3シリカ粒子と5分インキュベートした時点での細胞を示す。1時間後、かなりな量のナノ粒子の蓄積が観察された。図29B参照。更に、ミトコンドリア生存の特性である赤色蛍光は、60分後、多くの細胞内で消えた(図29Dを参照のこと)、また細胞のサイズは縮み始め、細胞死を示す。
【0116】
実施例19 抗菌活性研究
Pseudomonas aeruginosa(ATCC#19143, American Type Culture Collecti on Company, Manassas, Virginia, USAより)、グラム陰性日和見病原体の1種、をトリプチソイブロス(TSB)中で、吸光度(ODλ=600nm)約0.2(〜1.0x108コロニー形成単位[CFU]mL,系列稀釈法で確認)まで培養した。細菌を遠心によりペレットにした後、TSB培養液を廃棄し、細菌を無菌リン酸緩衝塩液(PBS,pH7.4)に再懸濁した。PBS中の10倍系列稀釈法により細菌濃度を103CFU/mLに調節した。この細菌懸濁液の一部(200μL)を無菌ミクロピペットバイアル中に分配し、200μLのNO放出45モル%AEAP3シリカナノ粒子(1mg/mL),対照(NO非放出)、AEAP3シリカナノ粒子(1mg/mL)、又は無菌PBS(ブランク)を各バイアルに加えた。37℃1時間インキュべーション後、各懸濁液の100μLをトリプティックソイ栄養寒天培地の上にプレートし、37℃で一晩培養した。次の日、各プレート上にできた細菌のコロニー数をカウントし、代表的栄養プレートの写真撮影をした。図30に示すように、シリカナノ粒子から放出される酸化窒素は、ブランク(図30A)及び対照(NO非放出)シリカナノ粒子(図30B)と比べて、生存細菌の数を劇的に減少させた(図30Cを参照のこと)。定量的には、ブランク及び対照懸濁液を示すプレートに形成したコロニー数はほぼ同数(〜360)であった。NO放出シリカナノ粒子を加えた懸濁液からは、9コロニーだけが形成した。このことは、ブランク及び対照懸濁液に比べて、NO放出ナノ粒子を加えた懸濁液中の生存細菌の数は、98%減少したことを示す。
NO放出シリカナノ粒子の抗細菌活性をより定量的に評価するために、PBS中の系列稀釈により、細菌濃度を103CFU/mLに調節し、培養細菌を対照シリカナノ粒子(NO非放出)、NO放出シリカナノ粒子、又は無菌PBS(ブランク)に曝した。37℃、1時間培養後、懸濁液の100μLをトリプティックソイ栄養寒天培地の上に蒔種し一晩培養した。図31に示すように、シリカナノ粒子から放出されたNOは、生存細菌の数を顕著に減少させた。2mg/mLの濃度で、NO放出粒子は、対照に比べて殺細菌効果を顕著に増した(p=9.5x10−4)。1時間インキュベーション時間内に放出されるNOの量は、化学発光による測定では、約1μモルNOであった。従って、本明細書に示したシリカナノ粒子は、インビトロ殺細菌効果を示し、感染した傷に関する微生物を殺すための幾つかの濃度のNOを運搬するための担体を表わす。
【0117】
実施例20 NO放出の磁性シリカナノ粒子の合成
磁気性NO放出シリカナノ粒子は、図32に示す合成に従って調製した。簡単には、実施例10の方法を変えて、TEOS及び10モル%AHAP3又は17モル%AEAP3を含む溶液中で約20nmから30nmまでの間の直径を持つ磁鉄鉱(Fe3O4)粒子の包含に適用した。シランの共凝縮により、磁鉄鉱粒子は、シリカのシェルで覆われた。この粒子をNO下に置きジアゼニウムジオレイン酸塩を作成した。
磁鉄鉱/シリカAHAP3粒子の原子間力顕微鏡(AFM)像を図33に示す。粒子の直径は、85±11nmと測定された。この粒子のNO放出プロフィールを、図34に示す。磁鉄鉱/シリカ粒子を含むPBS溶液を用いた実験は、磁石を適用すると、粒子の移動を制御できることを示す。
【0118】
実施例21 NO放出シリカナノ粒子を含むポリウレタンフィルム
NO放出シリカナノ粒子は、約3mgから約18mgまでの間のNO放出粒子を、重合化前に500μLのTHF及びエタノールに10mgの1:1(w/w)TECOFLEX(R)ポリウレタン(TPU)/親水性ポリウレタン(HPU)を含む高分子前駆体溶液に加えて作成したポリウレタンフィルムに取り込んだ。
高分子前駆体溶液に6mgのナノ粒子を加えて作成したフィルムを調べて、前記の細菌接着に対する抵抗能を測定した。Marxer,S.M.他、Chem.Mater.、15,4193-4199(2003)を参照されたい。定常的なNO放出を開始するためにこのフィルムを前処理し、その後Pseudomonas aeruginosa(ATCC#19143,American Type Culture Collection Company, Manassas, Virginia, USAより)を含む細胞懸濁液に、37℃で30分間浸した。その後、フィルの表面を水でリンスし、2%グルタルアルデヒド溶液で15分間固定した。表面の画像をZeiss Axiovert200倒立顕微鏡(Carl Zeiss Optical, Chester, Virginia, USA)を用いた位相差顕微鏡研究によって得た。対照フィルム及びNO放出粒子含有フィルムの位相差顕微鏡像を図35A及び35Bに示す。
【0119】
実施例22 NO放出層をもつグルコースセンサー
グルコースオキシダーゼベースのグルコースバイオセンサーにより、グルコースと酸素の間のグルコースオキシダーゼ(GOx)触媒反応により産生した過酸化水素を電気酸化して、血液グルコースを検出できる。図36に図示するように、グルコースセンサーは、NO放出層を持って合成される。センサー3600は、Pt電極3602上にスタックした4層を提供する。最内部の層3604は、25μL MTMOS,6mgグルコースオキシダーゼ(GOx)、100μL EtOH及び50μL H2Oを含む溶液の濃縮により作られる。カバーするGOx層3604は、疎水性TECOFLEX(R)ポリウレタン(TPU)及び親水性ポリウレタン(HPU)前駆体(即ちTPU/HPUブレンド)の1:1(w/w)混合物の重合により調製した保護層3606である。NO放出層3608を、500μL THF/EtOH中に10mg TPU/HPU及び6mgジアゼニウムジオレイン酸塩修飾シリカナノ粒子を含む溶液の重合により調製した。NO放出層3608は、さらに500μL THF/EtOH中に10mg TPU/HPU混合物で調製したTPU/HPUバリアー層3610を重層した。
図36を続けると、挿入図は、NO放出層3608と外部の保護層3610の境界での相互作用を示すもので、ここでジアゼニウムジオレイン酸塩基3622を持つNO放出シリカ粒子3620は酸化窒素3624を放出するが、グルコース分子3626は、GOx−含有層3604への途上NO放出層3608に吸収される。
NO放出層を持つグルコースセンサーの応答を評価するために、2種の対照電極を作成した:保護層及びGOx層のみ持つ対照センサー、及びNO供与体を含まないシリカナノ粒子のみで調製した4層すべてを含むセンサー。様々なセンサーの感度を適用電圧+7V対Ag/AgClを用いて、PBS(0.05M,pH7.4)中で評価した。対照及び2層センサーの感度は、54.5nA/mM(r=0.9980)、NO非放出シリカナノ粒子を持つ4層センサーの感度は、61.3nA/mM(r=0.9938)であり、NO放出層を持つセンサーの感度は、57.9nA/mM(r=0.9989)であった。これらの結果は、NO放出はGOxベースのグルコース検知には干渉しないことを示す。
【0120】
参考文献
以下に記載した参考文献、及び本明細書に引用した全ての参照文献は、これらが補足し、説明し、背景を提供し、又は方法、技術、及び/又は本明細書で使用される化合物を教示する限り、本明細書に参照文献として取り込まれている。本申請に関する全ての引用した特許及び刊行物は、本明細書に参考文献として明示的に取り込まれる。
Albert, K., and Bayer, E. J., J. Chromatogr., 544, 345-370 (1991).
Albina, J. E., and Reichner, J. S., Canc. Metas. Rev., 17, 19-53 (1998).
Anwander, R., et al., Stud. Surf. Sci. Catal., 117, 135-142 (1998).
Baker, J. R., Jr., Biomacromolecules, 5, 2269-2274 (2004).
【0121】
Beckman, J. S., and Conger, K. A., Methods Companion Methods Enzymol., 7, 35-39 (1995).
Brannon-Peppas, L. and Blanchette, J. O., Advanced Drug Delivery Reviews, 56, 1649-1659 (2004).
Bruch, M. D., and Fatunmbi, H. O., J. Chromatogr. A., 1021, 61-71 (2003).
Brust, M., J. of the Chem. Soc., Chem. Comm., 801-802 (1994).
Capala, J., et al., Bioconjugate Chem., 7(1), 7-15 (1996).
Cobbs, C. S., et al., Cancer Res., 55, 727-730 (1995).
Davies, K. M., et al., J. Am. Chem. Soc., 123, 5473-5481 (2001).
Diodati, J. G., et al., Thrombosis and Haemostasis, 70, 654-658 (1993).
Feldheim, D. L. and Foss, C. A., eds, Metal Nanoparticles - Synthesis Characterization, and Applications. Marcel Dekker, Inc: New York, p. 360 (2000).
Freireich et al., Cancer Chemother Rep. 50, 219-244 (1966).
Frost, M. C., et al., Biomaterials, 26,1685-1693 (2005).
Harris, M. T., et al., J. Non-Cryst. Solids, 121, 397-403 (1990).
Hatton, B., et al., Acc. Chem. Res., 38, 305-312 (2005).
Hostetler, M. I., et al., Langmuir, 15, 3782-3789 (1999).
Hostetler, M. I., et al., Langmuir, 14, 17-30 (1998).
Hrabie, J. A., et al., J. Org. Chem., 58, 1472-1476 (1993).
Hrabie, J. A. and Keefer, L. K., Chem. Rev., 102, 1135-1154 (2002).
Huh, S., et al., Chem. Mater., 15, 4247-4256 (2003).
Ignarro, L. J., Nitric Oxide: Biology and Pathobiology; Academic Press: San Diego (2000).
Ignarro, L. J. et al., Proc. Natl. Acad. Sci., U.S.A., 84, 9265-9269 (1987).
Jenkins, D. C., et al., Proc. Natl. Acad. Sci., U.S.A., 92, 4392-4396 (1995).
Keefer, L. K., Annu. Rev. Pharmacol. Toxicol., 43, 585-607 (2003).
Keefer, L. K., Chemtech, 28, 30-35 (1998).
Lai, C.-Y., et al., J. Am. Chem. Soc., 125, 4451-4459 (2003).
Lim, M. H., and Stein, A., Chem. Mater., 11, 3285-3295 (1999).
【0122】
Lin, H.-P., and Mou, C.-Y., Acc. Chem. Res., 35, 927-935 (2002).
MarIetta, M. A., et al., BioFactors, 2, 219-225 (1990).
Marxer, S. M., et al., Chem. Mater., 15, 4193-4199 (2003).
Munoz, B., et al., Chem. Mater., 15, 500-503 (2003).
Nablo, B. J., et al., J. Am. Chem. Soc., 123, 9712-9713 (2001).
Napoli, C. and Ignarro, L. J., Annu. Rev. Pharmacol. Toxicol., 43, 97-123 (2003).
Penault-Llorca, F., et al., Int. J. Cancer, 61(2), 170-176 (1995).
Press, M.F., et al., Oncogene 5(7), 953-962 (1990).
Radomski, M. W., et al., Br. J. of Pharmacology, 101,145-749 (1992).
Radu, D. R., et al., J. Am. Chem. Soc., 126, 1640-1641 (2004).
Roy, I., et al., Proc. Natl. Acad. Sci, U.S.A., 102, 279-284 (2005).
Sayari, A., and Hamoudi, S., Chem. Mater., 13, 3151-3168 (2001).
Shi, X., et al., Colloids Surf. A., 272, 139-150 (2006).
Stein, A., et al., Adv. Mater., 12, 1403-1419 (2000).
Thomsen, L. L., et al., Br. J. Cancer., 72, 41-44 (1995).
Trewyn, B. G., et al., Nano. Lett., 4, 2139-2143 (2004).
Troughton, B. B., et al., Langmuir, 4, 365-385 (1988).
Wang, P. G., et al., Nitric Oxide Donors: For Pharmaceutical and Biological Applications; Wiley-VCH: Weinheim, Germany (2005).
Wang, P. G., et al., Chem. Rev., 102, 1091-1134 (2002).
Wiener, E.C. et al., Invest. Radiol., 32 (12), 748-754 (1997).
Wiener, E.C., et al., Magn. Reson. Med. 31(1), 1-8 (1994).
Yoshitake, H., New. J. Chem., 29, 1107-1117 (2005).
Zhang, H., et al., J. Am. Chem. Soc., 125, 5015-5024 (2003).
Zhou, Z., and Meyerhoff, M. E., Biomacromolecules, 6, 780-789 (2005).
以前に権利主張された対象物の様々な詳細については、本明細書で権利主張した対象物の観点から離れない限り変更されうることは理解されるであろう。さらに、前述の記載は、例示の目的だけに行われ、制限することを目的にしたものではない。
【図面の簡単な説明】
【0123】
【図1】コアCR、内部領域IR,脆弱部分LPを持つリンカーLK、酸化窒素(NO)供与体NO及び外部EPを含む、酸化窒素(NO)放出粒子の図式的説明である。
【図2】本出願で開示したNO放出性単層の保護クラスター(MPC)金ナノ粒子を製造するための合成スキームである。
【図3】アルコキシシラン及びアミノアルコキシシランの混合物からシリカネットワークの共凝縮の後、共凝縮したシリカネットワークをNOガスで処理することによる、NO放出粒子の合成の図式的説明である。
【図4A】表面グラフト法により合成されたN−ジアゼニウムジオレイン酸塩(より濃い球体)修飾シリカ粒子中のNO供与体分布の範囲についての図式的説明である。
【図4B】アルコキシシラン及びアミノアルコキシシランを含むシラン混合物からシリカネットワークの"ワンポット"共凝縮により合成された、N−ジアゼニウムジオレイン酸塩(より濃い球体)−修飾シリカ粒子中のNO供与体分布の範囲についての図式的説明である。
【図5A】シリカネットワークを作るための共凝縮の後に、アミノアルコキシシランがNO気体と反応する、"ポストチャージング"法を用いたNO放出共凝縮シリカ粒子の合成ついての図式的説明である。
【図5B】シリカネットワークを作るための共凝縮に先立って、アミノアルコキシシランがNO気体と反応する、"プレチャージング"法を用いたNO放出共凝縮シリカ粒子の合成ついての図式的説明である。
【図6A】N−(2−アミノエチル)−3−アミノプロピルトリメトキシシラン(AEAP3)の構造である。
【図6B】(アミノエチルアミノメチル)フェネチルトリメトキシシラン(AEMP3)の構造である。
【図6C】N−(6−アミノヘキシル)アミノプロピルトリメトキシシラン(AHAP3)の構造である。
【図6D】N−[3−(トリメトキシシリル)プロピル]ジエチレントリアミン(DET3)の構造である。
【図7】孔形成のために鋳型試薬としてミセルを用いた、メソ多孔質共凝縮シリカネットワークの鋳型合成の図式的説明である。
【図8】図1で既に述べたようなNO放出粒子の部分の図式的説明であり、さらにリンカーLKの脆弱部分LPは粒子外部EPから様々な距離に置くことができることを示す。部位Aは外部から最も遠く、部位Bはリンカーの中央に在り、また部位Cは粒子の外部に最も近い。
【図9A】医学的に分割されたポリウレタンの一般的構造を示す。柔らかいユニットを、影のある長円で示し、固いユニットを影のある矩形で示し、またエキスパンダーユニットを影のある円で示す。
【図9B】TECOFLEX(R)ポリウレタンの構造を示し、n及びn’は整数である。
【図10A】ヘキサンチオール官能基の付いた金ナノ粒子の1H NMRスペクトルである。
【図10B】臭素官能基の付いた金ナノ粒子の1H NMRスペクトルである。−CH2Brピークは3.4ppmに表れる。
【図10C】エチレンジアミン官能基の付いた金ナノ粒子の1H NMRスペクトルである。−CH2NHピークは2.5から3.0ppmに表れる。
【図11】11−ブロモ−1−ウンデカンチオールの2段階合成のスキームを表す。
【図12】酸化窒素測定の解析方法の図式的説明である。
【図13】様々なジアミン誘導化単層保護クラスター(MPC)金ナノ粒子からの酸化窒素放出プロフィールを示すプロットである。ラインaは非誘導化MPC金ナノ粒子の酸化窒素放出プロフィールである。ラインbは14%エチレンジアミン誘導化MPC金ナノ粒子からの酸化窒素放出プロフィールである。ラインcは21%エチレンジアミン誘導化MPC金ナノ粒子からの酸化窒素放出プロフィールである。ラインdは21%エチレンジアミン誘導化MPC金ナノ粒子からの酸化窒素放出プロフィールである。ラインeは21%ジエチレントリアミン誘導化MPC金ナノ粒子からの酸化窒素放出プロフィールである。ラインfは21%ヘキサンジアミン誘導化MPC金ナノ粒子からの酸化窒素放出プロフィールである。
【図14】官能基化単層保護クラスター(MPC)金ナノ粒子から放出されたNOを示す、図式的説明である。
【図15】ポリプロピレニミンヘキサデカアミンデンドリマー(DAB−Am−16)の化学構造の図式的説明である。
【図16】ポリプロピレニミンテトラヘキサコンタアミンデンドリマー(DAB−Am−64)の化学構造の図式的説明である。
【図17】DAB−C7−16 NaOMe/MeOHについて酸化窒素放出プロフィールを示すグラフである。
【図18】DAB−C7−64 NaOMe/MeOHについて酸化窒素放出プロフィールを示すグラフである。
【図19】Zhang、H.他、J.Am.Chem.Soc.,125,5015(2003)に記載された方法によるNO放出シリカ粒子に至る合成ルートである。
【図20A】対照シリカ(TEOSのみ)の接触法原子間力顕微鏡(AFM)画像である。
【図20B】10モル%のAHAP3と一体となったシリカ(バランスTEOS)の接触法原子間力顕微鏡(AFM)画像である。
【図20C】1粒子を示す図29Bからの拡大した原子間力顕微鏡(AFM)画像である。
【図20D】10モル%AEAP3の接触法原子間力顕微鏡(AFM)画像である。
【図20E】雲母表面上の17モル%AEAP3シリカ粒子の接触法原子間力顕微鏡(AFM)画像である。
【図20F】シリカ混合物のAEAP3含量、及び得られる粒子サイズの間の関係を示すグラフである。
【図21A】様々な量のAEAP3:(a)0%AEAP3(対照)、(b)10モル%AEAP3(バランスTEOS),(c)13モル%AEAP3(バランスTEOS);及び17モル%AEAP3(バランスTEOS);と共凝縮したシリカの固体状態29Si交差分極/マジックアングルスピニング(CP/MAS)NMRスペクトルを示すプロットである。
【図21B】AEAP3修飾シリカ混合物の表面のシリコン化学環境に関係する構造を示す図式である。
【図21C】AEAP3修飾シリカ混合物の合成の間、加えられたAEAP3含量に対する、共凝縮したアミンリガンドの%表面開裂(SC)のプロットを示す。
【図22】10モル%AHAP3(破線)及び17モル%AEAP3(実線)を含む共凝縮シリカからのNO放出のNO放出プロフィールである。挿入図は同じ2種類のシリカ型の時間に伴う積算したNO放出のプロットを示す。
【図23】AEAP3を含む共凝縮シリカナノ粒子の37℃におけるpHの関数で表すNO放出のプロットである。挿入図は、積算したNO放出のプロットである。
【図24A】鋳型として界面活性剤セチルトリメチルアンモニウム臭化物(CTAB)を用いた鋳型合成により製造したメソ多孔質NO放出シリカ粒子の断面図を示す図式的説明である。影の領域は、共凝縮シリカネットワークを表し、他方、小さな影のある円は、共凝縮シリカネットワーク内のNO供与体を表す。影のない領域は、シラン凝縮反応後、CTAB鋳型を除去した後に作られた粒子内の孔を表わす。
【図24B】セチルトリメチルアンモニウム臭化物(CTAB)を鋳型として製造したメソ多孔質N−(6−アミノエチル)アミノプロピルトリメトキシシラン(AEAP3)−シリカ粒子の接触法原子間力顕微鏡(AFM)画像である。
【図25】メソ多孔質N−(6−アミノエチル)アミノプロピルトリメトキシシラン(AEAP3)−シリカ(37℃でリン酸緩衝液(PBS)中3mgの粒子)の酸化窒素放出プロフィールを示すプロットである。
【図26】対照(黒色円)、及び45モル%AHAP3との反応で製造したNO放出シリカ(白色円)の卵巣上皮腫瘍細胞に対する細胞毒性を示すグラフである。
【図27】対照(黒色矩形)及びNO放出するMAP3共凝縮(白色円)シリカナノ粒子の正常(不死化、T29)細胞に対する細胞毒性、及び対照(黒色円)及びNO放出するMAP3共凝縮(白色円)シリカナノ粒子の腫瘍(A2780)細胞に対する細胞毒性を示すグラフである。
【図28】正常T29(灰色棒)細胞株及び腫瘍A2780(縞模様棒)細胞株に対する細胞毒性へのシリカ粒子サイズ(75モル%MAP3,バランスTEOS)の効果を示す棒グラフである。対照MAP3処理群と比較して、P<0.001であった。対照MAP3シリカ(角括弧で示す)は、NO非放出性であり、直径80nmであり、s−MAP3シリカは直径80nmであり、L−MAP3シリカは直径350nmである。
【図29A】FITC標識付MAP3シリカナノ粒子とインキュベーション5分後に撮ったA2780卵巣癌細胞のレーザー走査顕微鏡画像である。
【図29B】FITC標識付MAP3シリカナノ粒子とインキュベーション60分後に撮ったA2780卵巣癌細胞のレーザー走査顕微鏡画像である。
【図29C】100nmテトラメチルローダミン(TMRM)ミトコンドリア染色液とインキュベーション5分後に撮ったA2780卵巣癌細胞のレーザー走査顕微鏡画像である。
【図29D】100nmテトラメチルローダミン(TMRM)ミトコンドリア染色液とインキュベーション60分後に撮ったA2780卵巣癌細胞のレーザー走査顕微鏡画像である。
【図30A】無菌リン酸緩衝液(PBS)と37℃でインキュベート後、栄養寒天培地上に形成したP.aeruginosaのコロニーを示す写真である。
【図30B】対照(NO非放出性)AEAP3シリカナノ粒子と37℃でインキュベート後栄養寒天培地に形成したP.aeruginosaのコロニーを示す写真である。
【図30C】NO放出45モル%AEAP3シリカナノ粒子と37℃でインキュベート後栄養寒天培地に形成したP.aeruginosaのコロニーを示す写真である。
【図31】ナノ粒子濃度の関数として、NO放出シリカナノ粒子(45モル%AEAP3,バランスTEOS)のP.aeruginosaに対するインビトロ殺細菌活性を示すプロットである。
【図32】NO供与体を形成できる、アミン基を含む共凝縮シリカ層で覆われた磁鉄鉱コアを持つNO放出ナノ粒子の合成の図式的説明である。
【図33】磁鉄鉱/N−(6−アミノヘキシル)アミノプロピルトリメトキシシラン(AHAP3,10モル%)官能性シリカ粒子の原子間力顕微鏡(AFM)画像である。
【図34】磁鉄鉱/シリカコア粒子(下部の線)の、磁鉄鉱なしの同じシリカ組成のコアを持つ粒子(上部の線)のNO放出プロフィール、と比較したNO放出プロフィールを示すグラフである。挿入図はNO放出積算量のグラフである。
【図35A】対照フィルム(NO非放出ポリウレタン)に対するP.aeruginosa接着(黒色領域)を示す位相差光顕微鏡像である。拡大率はx5.
【図35B】NO放出粒子を含むフィルムに対するP.aeruginosa接着(黒色領域)を示す位相差光顕微鏡像である。拡大率はx5.
【図36】NO放出共凝縮シリカナノ粒子を含む重合したフィルムから作られたNO放出層を持つグルコースセンサーのPt電極を示す構造の図式的説明である。
【特許請求の範囲】
【請求項1】
(a)酸化窒素供与体、
(b)一定容積を持つ内部領域であって、少なくともその部分が、
(i)金属クラスター、
(ii)樹木状ネットワーク、
(iii)共凝縮したシリカネットワーク、及び
(iv)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域、及び
(c)外部領域、
からなる酸化窒素放出粒子。
【請求項2】
前記内部領域が、更に、
(a)pH変化に応答する脆弱性リンカー、
(b)電磁放射に敏感な脆弱性リンカー、
(c)酵素作用による分解を受けやすい脆弱性リンカー、
(d)疎水性リンカー、
(e)両親媒性リンカー、及び
(f)これらの組合せ、
から成る群から選択される有機リンカーを含む請求項1に記載の酸化窒素放出粒子。
【請求項3】
前記酸化窒素供与体が、ジアゼニウムジオレイン酸塩、ニトロソアミン、ヒドロキシルニトロソアミン、ニトロソチオール、ヒドロキシルアミン、ヒドロキシウレア、及びこれらの組合せからなる群から選択される請求項1に記載の酸化窒素放出ナノ粒子。
【請求項4】
前記酸化窒素供与体が、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つに共有結合で結合する請求項1に記載の酸化窒素放出粒子。
【請求項5】
前記酸化窒素供与体が、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つに封じ込められる請求項1に記載の酸化窒素放出粒子。
【請求項6】
前記酸化窒素供与体が、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つと、ファンデルワールス相互作用、静電気的相互作用、水素結合、及びこれらの組合せからなる群から選択される非共有結合的相互作用により結合する請求項1に記載の酸化窒素放出粒子。
【請求項7】
前記外部領域が、
(a)酸化窒素放出動特性を修飾する部分、
(b)粒子の生体許容性に影響する部分、
(c)粒子の生体内分布に影響する部分、
(d)粒子の標的への運搬に寄与する部分、
(e)粒子の画像又は追跡に寄与する部分、
(f)粒子の溶解性に影響する部分、
(g)治療薬剤、及び
(h)これらの組合せ、
からなる群から選択される1又は2以上の化学部分を含む請求項1に記載の酸化窒素放出粒子。
【請求項8】
前記コアが、金属クラスターであり、この金属クラスターが、金、白金、銀、磁性体、量子ドット、及びこれらの組合せから選択される成分構成材料を含む請求項1に記載の酸化窒素放出粒子。
【請求項9】
前記金属クラスターが、単層で保護した金クラスターである請求項8に記載の酸化窒素放出粒子。
【請求項10】
前記コアが、樹木状ネットワークであり、この樹木状ネットワークが、
(a)ポリプロピレニミンデンドリマー、
(b)ポリアミドアミン(PAMAM)デンドリマー、
(c)ポリアリールエーテルデンドリマー、
(d)ポリペプチドデンドリマー、
(e)ポリエステルデンドリマー、
(f)ポリアミドデンドリマー、
(g)樹木状ポリグリセロール、及び
(h)トリアジンデンドリマー、
からなる群から選択される請求項1に記載の酸化窒素放出粒子。
【請求項11】
前記樹木状ネットワークが、超分枝状である請求項10に記載の酸化窒素放出粒子。
【請求項12】
前記コアが、共凝縮したシリカネットワークからなり、この共凝縮したシリカネットワークが、アルコキシシラン及びアミノアルコキシシランからなるシラン混合物の凝縮により合成されたものである請求項1に記載の酸化窒素放出粒子。
【請求項13】
前記アルコキシシランが、化学式Si(OR)4(式中、Rはアルキル基を表す。)で表されるテトラアルコキシシランから成り、
前記アミノアルコキシシランが、
(a)化学式 R’’−(NH−R’)n−Si(OR)3(式中、Rはアルキル基、R’はアルキレン基、分枝アルキレン基、又はアラルキレン基、nは1又は2、R’’はアルキル基、シクロアルキル基、アリール基及びアルキルアミンから成る群から選択される。)で表されるアミノアルコキシシラン、
(b)化学式 NH[R’−Si(OR)3]2(式中、Rはアルキル基、R’はアルキレン基を表す。)で表されるアミノアルコキシシラン、
(c)化学式 R’’−N(NONO−X+)−R’−Si(OR)3(式中、Rはアルキル基、R’はアルキレン基又はアラルキレン基、R’’はアルキル基又はアルキルアミン基を表し、X+はNa+及びK+からなる群から選択されるカチオンを表す。)で表される、アミン基がジアゼニウムジオレイン酸塩で置換されたアミノアルコキシシラン、及び
(d)これらの組合せ、
から成る群から選択される請求項12に記載の酸化窒素放出粒子。
【請求項14】
前記シラン混合物が、10モル%〜99モル%の前記テトラアルコキシシラン、及び1モル%〜90モル%の前記アミノアルコキシシランから成る請求項13に記載の酸化窒素放出粒子。
【請求項15】
前記シラン混合物が、更に0モル%〜20モル%のフッ素化シラン、0モル%〜20モル%のカチオン性又はアニオン性シラン、及び0モル%〜20モル%のアルキルシランを含む請求項14に記載の酸化窒素放出粒子。
【請求項16】
前記テトラアルコキシシランが、テトラメチルオルソケイ酸塩及びテトラエチルオルソケイ酸塩からなる群から選択される請求項13に記載の酸化窒素放出粒子。
【請求項17】
前記アミノアルコキシシランが、N−(6−アミノヘキシル)アミノメチルトリメトキシシラン、N−(6−アミノヘキシル)アミノプロピルトリメトキシシラン、N−(6−アミノエチル)アミノプロピルトリメトキシシラン、(3−トリメトキシシリルプロピル)ジエチレントリアミン、(アミノエチルアミノメチル)フェネチルトリメトキシシラン、[3−(メチルアミノ)プロピル]トリメトキシシラン、N−ブチルアミノプロピルトリメトキシシラン、N−エチルアミノイソブチルトリメトキシシラン、N−フェニルアミノプロピルトリメトキシシラン、N−シクロヘキシルアミノプロピルトリメトキシシラン、ビス[3−(トリメトキシシリル)プロピル]アミン、及びビス[3−(トリメトキシシリル)プロピル]エチレンジアミンからなる群から選択される請求項13に記載の酸化窒素放出粒子。
【請求項18】
前記フッ素化シランが、(ヘプタデカフルオロ−1,1,2,2−テトラヒドロデシル)トリエトキシシラン、(3,3,3−トリフルオロプロピル)トリメトキシシラン及び(ペルフルオロアルキル)エチルトリエトキシシランからなる群から選択される請求項15に記載の酸化窒素放出粒子。
【請求項19】
前記カチオン性又はアニオン性シランが、N−N−ジデシル−N−メチル−N−(3−トリメトキシシリル)アンモニウムクロライド、オクタデシルジメチル−(3−トリメトキシシリルプロピル)アンモニウムクロライド、3−トリヒドロキシシリルプロピルメチルホスホン酸ナトリウム塩及びカルボキシルエチルシラントリオールナトリウム塩からなる群から選択される請求項15に記載の酸化窒素放出粒子。
【請求項20】
前記アルキルシランが、メチルトリメトキシシラン、ブチルトリメトキシシラン、ブチルトリエトキシシラン、プロピルトリメトキシシラン及びオクタデシルトリメトキシシランからなる群から選択される請求項15に記載の酸化窒素放出粒子。
【請求項21】
前記コアが、共凝縮シリカネットワークからなり、この共凝縮シリカネットワークが、アルコキシシラン及びアミノアルコキシシランからなるシラン混合物の凝縮により合成され、
前記NO供与体が、
(a)前記酸化窒素供与体が、シラン混合物の共凝縮の後で形成されるポストチャージ法、及び
(b)前記酸化窒素供与体が、シラン混合物の共凝縮の前に前記アミノアルコキシシランから形成されるプレチャージ法、
から選択される方法で形成される請求項1に記載の酸化窒素放出粒子。
【請求項22】
前記リンカーが、前記酸化窒素放出粒子に酸化窒素放出のオン/オフ状態を与えることができる官能基を含み、該官能基が、エステル、ヒドラゾン、アセタール、チオプロピオネート、光脆弱性部分、及び酵素分解されるアミノ酸配列からなる群から選択される請求項2に記載の酸化窒素放出粒子。
【請求項23】
前記外部領域が、酸化窒素放出粒子を標的に運搬することができる部分を含む請求項7に記載の酸化窒素放出粒子。
【請求項24】
前記標的が、細胞、組織及び器官からなる群から選択される請求項23に記載の酸化窒素放出粒子。
【請求項25】
前記細胞が、癌細胞である請求項24に記載の酸化窒素放出粒子。
【請求項26】
前記酸化窒素放出粒子を標的に運搬することができる部分が、抗体/抗原相互作用の原因となるタンパク質、葉酸、グアニジン、トランスフェリン、ホルモン、炭化水素、アミノ酸配列RGDを含むペプチド及びTATペプチドからなる群から選択される請求項23に記載の酸化窒素放出粒子。
【請求項27】
前記外部領域が、酸化窒素供与体、(ポリ)エチレンオキシド、(ポリ)ウレタン、N−(2−ヒドロキシプロピル)メタクリルアミドコ高分子、ラクチド/グリコリドコ高分子(例えば、PLGA)、砂糖、蛍光部分、有機染料、MRIコントラスト試薬、チオール、メチル基末端のアルキル鎖、抗菌剤、抗腫瘍治療薬、スルホン酸塩、カルボン酸塩、リン酸塩、カチオン性アミン基、第4級アミン基、及びこれらの組み合わせからなる群から選択される部分を含む請求項7に記載の酸化窒素放出粒子。
【請求項28】
前記粒子の直径が、1nm〜1000nmである請求項1に記載の酸化窒素放出粒子。
【請求項29】
前記粒子の直径が、1nm〜5nmである請求項9に記載の酸化窒素放出粒子。
【請求項30】
前記粒子の直径が、2nm〜10μmである請求項12に記載の酸化窒素放出粒子。
【請求項31】
患者に酸化窒素を運搬する方法であって、
(a)以下から成る酸化窒素放出粒子を提供する段階、及び
(i)酸化窒素供与体、
(ii)一定容積を持つ内部領域であって、少なくともその部分が、
(1)金属クラスター、
(2)樹木状ネットワーク、
(3)共凝縮したシリカネットワーク、及び
(4)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域、及び
(iii)外部領域、
(b)有効量の酸化窒素放出粒子を患者に投与する段階からなる方法。
【請求項32】
前記内部領域が、更に、
(a)pH変化に応答する脆弱性リンカー、
(b)電磁放射に敏感な脆弱性リンカー、
(c)酵素作用による分解を受けやすい脆弱性リンカー、
(d)疎水性リンカー、
(e)両親媒性リンカー、及び
(f)これらの組合せ、
から成る群から選択される有機リンカーを含む請求項31に記載の方法。
【請求項33】
前記酸化窒素供与体が、ジアゼニウムジオレイン酸塩、ニトロソアミン、ヒドロキシルニトロソアミン、ニトロソチオール、ヒドロキシルアミン、及びヒドロキシウレアからなる群から選択される請求項31に記載の方法。
【請求項34】
前記酸化窒素供与体が、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つに共有結合で結合する請求項31に記載の方法。
【請求項35】
前記酸化窒素供与体が、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つに封じ込められる請求項31に記載の方法。
【請求項36】
前記酸化窒素供与体が、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つと、ファンデルワールス相互作用、静電気的相互作用、水素結合、及びこれらの組合せからなる群から選択される非共有結合的相互作用により結合する請求項31に記載の方法。
【請求項37】
前記外部領域が、
(a)酸化窒素放出動特性を修飾する成分、
(b)粒子の生体許容性に影響する成分、
(c)粒子の生体内分布に影響する成分、
(d)粒子の標的への運搬に寄与する成分、
(e)粒子の画像又は追跡に寄与する成分、
(f)粒子の溶解性に影響する成分、
(g)治療薬剤、及び
(h)これらの組合せ、
からなる群から選択される1又は2以上の化学成分を含む請求項31に記載の方法。
【請求項38】
前記コアが、金属クラスターであり、この金属クラスターが、金、白金、銀、磁性体、量子ドット、及びこれらの組合せから選択される成分構成材料を含む請求項31に記載の方法。
【請求項39】
前記金属クラスターが、単層で保護した金クラスターである請求項38に記載の方法。
【請求項40】
前記コアが、樹木状ネットワークであり、この樹木状ネットワークが、
(a)ポリプロピレニミンデンドリマー、
(b)ポリアミドアミン(PAMAM)デンドリマー、
(c)ポリアリールエーテルデンドリマー、
(d)ポリペプチドデンドリマー、
(e)ポリエステルデンドリマー、
(f)ポリアミドデンドリマー、
(g)樹木状ポリグリセロール、及び
(h)トリアジンデンドリマー、
からなる群から選択される請求項31に記載の方法。
【請求項41】
前記樹木状ネットワークが、超分枝状である請求項40に記載の方法。
【請求項42】
前記コアが、共凝縮したシリカネットワークからなり、この共凝縮したシリカネットワークが、アルコキシシラン及びアミノアルコキシシランからなるシラン混合物の凝縮により合成されたものである請求項31に記載の方法。
【請求項43】
前記アルコキシシランが、化学式Si(OR)4(式中、Rはアルキル基を表す。)で表されるテトラアルコキシシランから成り、
前記アミノアルコキシシランが、
(a)化学式 R’’−(NH−R’)n−Si(OR)3(式中、Rはアルキル基、R’はアルキレン基、分枝アルキレン基、又はアラルキレン基、nは1又は2、R’’はアルキル基、シクロアルキル基、アリール基及びアルキルアミンから成る群から選択される。)で表されるアミノアルコキシシラン、
(b)化学式 NH[R’−Si(OR)3]2(式中、Rはアルキル基、R’はアルキレン基を表す。)で表されるアミノアルコキシシラン、
(c)化学式 R’’−N(NONO−X+)−R’−Si(OR)3(式中、Rはアルキル基、R’はアルキレン基又はアラルキレン基、R’’はアルキル基又はアルキルアミン基を表し、X+はNa+及びK+からなる群から選択されるカチオンを表す。)で表される、アミン基がジアゼニウムジオレイン酸塩で置換されたアミノアルコキシシラン、及び
(d)これらの組合せ、
から成る群から選択される請求項42に記載の方法。
【請求項44】
前記シラン混合物が、10モル%〜99モル%の前記テトラアルコキシシラン、及び1モル%〜90モル%の前記アミノアルコキシシランから成る請求項43に記載の方法。
【請求項45】
前記シラン混合物が、更に0モル%〜20モル%のフッ素化シラン、0モル%〜20モル%のカチオン性又はアニオン性シラン、及び0モル%〜20モル%のアルキルシランを含む請求項44に記載の方法。
【請求項46】
前記テトラアルコキシシランが、テトラメチルオルソケイ酸塩及びテトラエチルオルソケイ酸塩からなる群から選択される請求項43に記載の方法。
【請求項47】
前記アミノアルコキシシランが、N−(6−アミノヘキシル)アミノメチルトリメトキシシラン、N−(6−アミノヘキシル)アミノプロピルトリメトキシシラン、N−(6−アミノエチル)アミノプロピルトリメトキシシラン、(3−トリメトキシシリルプロピル)ジエチレントリアミン、(アミノエチルアミノメチル)フェネチルトリメトキシシラン、[3−(メチルアミノ)プロピル]トリメトキシシラン、N−ブチルアミノプロピルトリメトキシシラン、N−エチルアミノイソブチルトリメトキシシラン、N−フェニルアミノプロピルトリメトキシシラン、N−シクロヘキシルアミノプロピルトリメトキシシラン、ビス[3−(トリメトキシシリル)プロピル]アミン、及びビス[3−(トリメトキシシリル)プロピル]エチレンジアミンからなる群から選択される請求項43に記載の方法。
【請求項48】
前記フッ素化シランが、(ヘプタデカフルオロ−1,1,2,2−テトラヒドロデシル)トリエトキシシラン、(3,3,3−トリフルオロプロピル)トリメトキシシラン及び(ペルフルオロアルキル)エチルトリエトキシシランからなる群から選択される請求項45に記載の方法。
【請求項49】
前記カチオン性又はアニオン性シランが、N−N−ジデシル−N−メチル−N−(3−トリメトキシシリル)アンモニウムクロライド、オクタデシルジメチル−(3−トリメトキシシリルプロピル)アンモニウムクロライド、3−トリヒドロキシシリルプロピルメチルホスホン酸ナトリウム塩及びカルボキシルエチルシラントリオールナトリウム塩からなる群から選択される請求項45に記載の方法。
【請求項50】
前記アルキルシランが、メチルトリメトキシシラン、ブチルトリメトキシシラン、ブチルトリエトキシシラン、プロピルトリメトキシシラン及びオクタデシルトリメトキシシランからなる群から選択される請求項45に記載の方法。
【請求項51】
前記コアが、共凝縮シリカネットワークからなり、この共凝縮シリカネットワークが、アルコキシシラン及びアミノアルコキシシランからなるシラン混合物の凝縮により合成され、
前記NO供与体が、
(a)前記酸化窒素供与体が、シラン混合物の共凝縮の後で形成されるポストチャージ法、及び
(b)前記酸化窒素供与体が、シラン混合物の共凝縮の前に前記アミノアルコキシシランから形成されるプレチャージ法、
から選択される方法で形成される請求項31に記載の方法。
【請求項52】
前記リンカーが、前記酸化窒素放出粒子に酸化窒素放出のオン/オフ状態を与えることができる官能基を含み、該官能基が、エステル、ヒドラゾン、アセタール、チオプロピオネート、光脆弱性部分、及び酵素分解されるアミノ酸配列からなる群から選択される請求項32に記載の方法。
【請求項53】
前記外部領域が、酸化窒素放出粒子を標的に運搬することができる部分を含む請求項37に記載の方法。
【請求項54】
前記標的が、細胞、組織及び器官からなる群から選択される請求項53に記載の方法。
【請求項55】
前記細胞が、癌細胞である請求項54に記載の方法。
【請求項56】
前記酸化窒素放出粒子を標的に運搬することができる部分が、抗体/抗原相互作用の原因となるタンパク質、葉酸、グアニジン、トランスフェリン、ホルモン、炭化水素、アミノ酸配列RGDを含むペプチド及びTATペプチドからなる群から選択される請求項53に記載の方法。
【請求項57】
前記外部領域が、酸化窒素供与体、(ポリ)エチレンオキシド、(ポリ)ウレタン、N−(2−ヒドロキシプロピル)メタクリルアミドコ高分子、ラクチド/グリコリドコ高分子(例えば、PLGA)、砂糖、蛍光部分、有機染料、MRIコントラスト試薬、チオール、メチル基末端のアルキル鎖、抗菌剤、抗腫瘍治療薬、スルホン酸塩、カルボン酸塩、リン酸塩、カチオン性アミン基、第4級アミン基、及びこれらの組み合わせからなる群から選択される部分を含む請求項37に記載の方法。
【請求項58】
前記コアが磁鉄鉱からなり、前記方法が標的に磁鉄鉱コアの磁性特性を介して酸化窒素放出粒子を導く段階を含み、前記標的が、細胞、組織及び器官からなる群から選択される請求項38に記載の方法。
【請求項59】
治療が必要な患者の疾患状態を治療する方法であって、
(a)以下から成る酸化窒素放出粒子を提供する段階、及び
(i)酸化窒素供与体、
(ii)一定容積を持つ内部領域であって、少なくともその部分が、
(1)金属クラスター、
(2)樹木状ネットワーク、
(3)共凝縮したシリカネットワーク、及び
(4)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域、及び
(iii)外部領域、
(b)有効量の酸化窒素放出粒子を患者に投与する段階からなる方法。
【請求項60】
前記疾患状態が、癌、心臓血管疾患、微生物感染、血液を医学的デバイスに曝すことにより引き起こされる血小板凝集と血小板接着、細胞異常増殖に起因する病理学的状態、移植拒絶、自己免疫疾患、炎症、血管疾患、瘢痕組織、創傷の収縮、再発狭窄症、痛み、発熱、胃腸疾患、呼吸器疾患、性機能障害、及び性感染症からなる群から選択される請求項59に記載の方法。
【請求項61】
前記酸化窒素放出粒子が、更に、患者の標的に向けて粒子を運搬することができる標的部分を含み、該標的が細胞、組織又は器官からなる請求項59に記載の方法。
【請求項62】
(a)以下からなる酸化窒素放出粒子、及び
(i)酸化窒素供与体、
(ii)一定容積を持つ内部領域であって、少なくともその部分が、
(1)金属クラスター、
(2)樹木状ネットワーク、
(3)共凝縮したシリカネットワーク、及び
(4)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域、及び
(iii)外部領域、
(b)医薬的に許容された担体、
からなる医薬配合物。
【請求項63】
前記配合物が、経口配合物、静脈内配合物及び局所的配合物からなる群から選択される請求項62に記載の配合物。
【請求項64】
有機高分子及び該酸化窒素放出粒子からなる酸化窒素放出高分子フィルムであって、該酸化窒素放出粒子が、
(a)酸化窒素供与体、
(b)一定容積を持つ内部領域であって、少なくともその部分が、
(i)金属クラスター、
(ii)樹木状ネットワーク、
(iii)共凝縮したシリカネットワーク、及び
(iv)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域、及び
(c)外部領域、
からなる酸化窒素放出高分子フィルム。
【請求項65】
前記有機高分子がポリウレタンである請求項64に記載の酸化窒素放出高分子フィルム。
【請求項66】
酸化窒素放出フィルムからなる医用デバイスであって、該酸化窒素放出高分子フィルムが有機高分子及び該酸化窒素放出粒子からなり、該酸化窒素放出粒子が、
(a)酸化窒素供与体、
(b)一定容積を持つ内部領域であって、少なくともその部分が、
(i)金属クラスター、
(ii)樹木状ネットワーク、
(iii)共凝縮したシリカネットワーク、及び
(iv)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域、及び
(c)外部領域、
からなる医用デバイス。
【請求項67】
前記医用デバイスの1又は2以上の表面が前記酸化窒素放出フィルムで被覆された請求項66に記載の医用デバイス。
【請求項68】
動脈ステント、ガイドワイア、カテーテル、トロカール針、骨アンカー、骨ネジ、保護板、股関節又は関節置換、導線、生体センサー、探索子、縫合線、外科的ドレープ、外傷用着衣、及び包帯からなる群から選択される請求項66に記載の医用デバイス。
【請求項69】
(a)酸化窒素供与体、
(b)一定容積を持つ内部領域であって、少なくともその部分が、
(i)金属クラスター、
(ii)樹木状ネットワーク、
(iii)共凝縮したシリカネットワーク、及び
(iv)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域、及び
(c)外部領域、
からなる酸化窒素放出粒子を含む洗浄剤。
【請求項1】
(a)酸化窒素供与体、
(b)一定容積を持つ内部領域であって、少なくともその部分が、
(i)金属クラスター、
(ii)樹木状ネットワーク、
(iii)共凝縮したシリカネットワーク、及び
(iv)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域、及び
(c)外部領域、
からなる酸化窒素放出粒子。
【請求項2】
前記内部領域が、更に、
(a)pH変化に応答する脆弱性リンカー、
(b)電磁放射に敏感な脆弱性リンカー、
(c)酵素作用による分解を受けやすい脆弱性リンカー、
(d)疎水性リンカー、
(e)両親媒性リンカー、及び
(f)これらの組合せ、
から成る群から選択される有機リンカーを含む請求項1に記載の酸化窒素放出粒子。
【請求項3】
前記酸化窒素供与体が、ジアゼニウムジオレイン酸塩、ニトロソアミン、ヒドロキシルニトロソアミン、ニトロソチオール、ヒドロキシルアミン、ヒドロキシウレア、及びこれらの組合せからなる群から選択される請求項1に記載の酸化窒素放出ナノ粒子。
【請求項4】
前記酸化窒素供与体が、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つに共有結合で結合する請求項1に記載の酸化窒素放出粒子。
【請求項5】
前記酸化窒素供与体が、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つに封じ込められる請求項1に記載の酸化窒素放出粒子。
【請求項6】
前記酸化窒素供与体が、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つと、ファンデルワールス相互作用、静電気的相互作用、水素結合、及びこれらの組合せからなる群から選択される非共有結合的相互作用により結合する請求項1に記載の酸化窒素放出粒子。
【請求項7】
前記外部領域が、
(a)酸化窒素放出動特性を修飾する部分、
(b)粒子の生体許容性に影響する部分、
(c)粒子の生体内分布に影響する部分、
(d)粒子の標的への運搬に寄与する部分、
(e)粒子の画像又は追跡に寄与する部分、
(f)粒子の溶解性に影響する部分、
(g)治療薬剤、及び
(h)これらの組合せ、
からなる群から選択される1又は2以上の化学部分を含む請求項1に記載の酸化窒素放出粒子。
【請求項8】
前記コアが、金属クラスターであり、この金属クラスターが、金、白金、銀、磁性体、量子ドット、及びこれらの組合せから選択される成分構成材料を含む請求項1に記載の酸化窒素放出粒子。
【請求項9】
前記金属クラスターが、単層で保護した金クラスターである請求項8に記載の酸化窒素放出粒子。
【請求項10】
前記コアが、樹木状ネットワークであり、この樹木状ネットワークが、
(a)ポリプロピレニミンデンドリマー、
(b)ポリアミドアミン(PAMAM)デンドリマー、
(c)ポリアリールエーテルデンドリマー、
(d)ポリペプチドデンドリマー、
(e)ポリエステルデンドリマー、
(f)ポリアミドデンドリマー、
(g)樹木状ポリグリセロール、及び
(h)トリアジンデンドリマー、
からなる群から選択される請求項1に記載の酸化窒素放出粒子。
【請求項11】
前記樹木状ネットワークが、超分枝状である請求項10に記載の酸化窒素放出粒子。
【請求項12】
前記コアが、共凝縮したシリカネットワークからなり、この共凝縮したシリカネットワークが、アルコキシシラン及びアミノアルコキシシランからなるシラン混合物の凝縮により合成されたものである請求項1に記載の酸化窒素放出粒子。
【請求項13】
前記アルコキシシランが、化学式Si(OR)4(式中、Rはアルキル基を表す。)で表されるテトラアルコキシシランから成り、
前記アミノアルコキシシランが、
(a)化学式 R’’−(NH−R’)n−Si(OR)3(式中、Rはアルキル基、R’はアルキレン基、分枝アルキレン基、又はアラルキレン基、nは1又は2、R’’はアルキル基、シクロアルキル基、アリール基及びアルキルアミンから成る群から選択される。)で表されるアミノアルコキシシラン、
(b)化学式 NH[R’−Si(OR)3]2(式中、Rはアルキル基、R’はアルキレン基を表す。)で表されるアミノアルコキシシラン、
(c)化学式 R’’−N(NONO−X+)−R’−Si(OR)3(式中、Rはアルキル基、R’はアルキレン基又はアラルキレン基、R’’はアルキル基又はアルキルアミン基を表し、X+はNa+及びK+からなる群から選択されるカチオンを表す。)で表される、アミン基がジアゼニウムジオレイン酸塩で置換されたアミノアルコキシシラン、及び
(d)これらの組合せ、
から成る群から選択される請求項12に記載の酸化窒素放出粒子。
【請求項14】
前記シラン混合物が、10モル%〜99モル%の前記テトラアルコキシシラン、及び1モル%〜90モル%の前記アミノアルコキシシランから成る請求項13に記載の酸化窒素放出粒子。
【請求項15】
前記シラン混合物が、更に0モル%〜20モル%のフッ素化シラン、0モル%〜20モル%のカチオン性又はアニオン性シラン、及び0モル%〜20モル%のアルキルシランを含む請求項14に記載の酸化窒素放出粒子。
【請求項16】
前記テトラアルコキシシランが、テトラメチルオルソケイ酸塩及びテトラエチルオルソケイ酸塩からなる群から選択される請求項13に記載の酸化窒素放出粒子。
【請求項17】
前記アミノアルコキシシランが、N−(6−アミノヘキシル)アミノメチルトリメトキシシラン、N−(6−アミノヘキシル)アミノプロピルトリメトキシシラン、N−(6−アミノエチル)アミノプロピルトリメトキシシラン、(3−トリメトキシシリルプロピル)ジエチレントリアミン、(アミノエチルアミノメチル)フェネチルトリメトキシシラン、[3−(メチルアミノ)プロピル]トリメトキシシラン、N−ブチルアミノプロピルトリメトキシシラン、N−エチルアミノイソブチルトリメトキシシラン、N−フェニルアミノプロピルトリメトキシシラン、N−シクロヘキシルアミノプロピルトリメトキシシラン、ビス[3−(トリメトキシシリル)プロピル]アミン、及びビス[3−(トリメトキシシリル)プロピル]エチレンジアミンからなる群から選択される請求項13に記載の酸化窒素放出粒子。
【請求項18】
前記フッ素化シランが、(ヘプタデカフルオロ−1,1,2,2−テトラヒドロデシル)トリエトキシシラン、(3,3,3−トリフルオロプロピル)トリメトキシシラン及び(ペルフルオロアルキル)エチルトリエトキシシランからなる群から選択される請求項15に記載の酸化窒素放出粒子。
【請求項19】
前記カチオン性又はアニオン性シランが、N−N−ジデシル−N−メチル−N−(3−トリメトキシシリル)アンモニウムクロライド、オクタデシルジメチル−(3−トリメトキシシリルプロピル)アンモニウムクロライド、3−トリヒドロキシシリルプロピルメチルホスホン酸ナトリウム塩及びカルボキシルエチルシラントリオールナトリウム塩からなる群から選択される請求項15に記載の酸化窒素放出粒子。
【請求項20】
前記アルキルシランが、メチルトリメトキシシラン、ブチルトリメトキシシラン、ブチルトリエトキシシラン、プロピルトリメトキシシラン及びオクタデシルトリメトキシシランからなる群から選択される請求項15に記載の酸化窒素放出粒子。
【請求項21】
前記コアが、共凝縮シリカネットワークからなり、この共凝縮シリカネットワークが、アルコキシシラン及びアミノアルコキシシランからなるシラン混合物の凝縮により合成され、
前記NO供与体が、
(a)前記酸化窒素供与体が、シラン混合物の共凝縮の後で形成されるポストチャージ法、及び
(b)前記酸化窒素供与体が、シラン混合物の共凝縮の前に前記アミノアルコキシシランから形成されるプレチャージ法、
から選択される方法で形成される請求項1に記載の酸化窒素放出粒子。
【請求項22】
前記リンカーが、前記酸化窒素放出粒子に酸化窒素放出のオン/オフ状態を与えることができる官能基を含み、該官能基が、エステル、ヒドラゾン、アセタール、チオプロピオネート、光脆弱性部分、及び酵素分解されるアミノ酸配列からなる群から選択される請求項2に記載の酸化窒素放出粒子。
【請求項23】
前記外部領域が、酸化窒素放出粒子を標的に運搬することができる部分を含む請求項7に記載の酸化窒素放出粒子。
【請求項24】
前記標的が、細胞、組織及び器官からなる群から選択される請求項23に記載の酸化窒素放出粒子。
【請求項25】
前記細胞が、癌細胞である請求項24に記載の酸化窒素放出粒子。
【請求項26】
前記酸化窒素放出粒子を標的に運搬することができる部分が、抗体/抗原相互作用の原因となるタンパク質、葉酸、グアニジン、トランスフェリン、ホルモン、炭化水素、アミノ酸配列RGDを含むペプチド及びTATペプチドからなる群から選択される請求項23に記載の酸化窒素放出粒子。
【請求項27】
前記外部領域が、酸化窒素供与体、(ポリ)エチレンオキシド、(ポリ)ウレタン、N−(2−ヒドロキシプロピル)メタクリルアミドコ高分子、ラクチド/グリコリドコ高分子(例えば、PLGA)、砂糖、蛍光部分、有機染料、MRIコントラスト試薬、チオール、メチル基末端のアルキル鎖、抗菌剤、抗腫瘍治療薬、スルホン酸塩、カルボン酸塩、リン酸塩、カチオン性アミン基、第4級アミン基、及びこれらの組み合わせからなる群から選択される部分を含む請求項7に記載の酸化窒素放出粒子。
【請求項28】
前記粒子の直径が、1nm〜1000nmである請求項1に記載の酸化窒素放出粒子。
【請求項29】
前記粒子の直径が、1nm〜5nmである請求項9に記載の酸化窒素放出粒子。
【請求項30】
前記粒子の直径が、2nm〜10μmである請求項12に記載の酸化窒素放出粒子。
【請求項31】
患者に酸化窒素を運搬する方法であって、
(a)以下から成る酸化窒素放出粒子を提供する段階、及び
(i)酸化窒素供与体、
(ii)一定容積を持つ内部領域であって、少なくともその部分が、
(1)金属クラスター、
(2)樹木状ネットワーク、
(3)共凝縮したシリカネットワーク、及び
(4)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域、及び
(iii)外部領域、
(b)有効量の酸化窒素放出粒子を患者に投与する段階からなる方法。
【請求項32】
前記内部領域が、更に、
(a)pH変化に応答する脆弱性リンカー、
(b)電磁放射に敏感な脆弱性リンカー、
(c)酵素作用による分解を受けやすい脆弱性リンカー、
(d)疎水性リンカー、
(e)両親媒性リンカー、及び
(f)これらの組合せ、
から成る群から選択される有機リンカーを含む請求項31に記載の方法。
【請求項33】
前記酸化窒素供与体が、ジアゼニウムジオレイン酸塩、ニトロソアミン、ヒドロキシルニトロソアミン、ニトロソチオール、ヒドロキシルアミン、及びヒドロキシウレアからなる群から選択される請求項31に記載の方法。
【請求項34】
前記酸化窒素供与体が、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つに共有結合で結合する請求項31に記載の方法。
【請求項35】
前記酸化窒素供与体が、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つに封じ込められる請求項31に記載の方法。
【請求項36】
前記酸化窒素供与体が、前記内部領域、前記外部領域、前記コア、及びこれらの組合せの一つと、ファンデルワールス相互作用、静電気的相互作用、水素結合、及びこれらの組合せからなる群から選択される非共有結合的相互作用により結合する請求項31に記載の方法。
【請求項37】
前記外部領域が、
(a)酸化窒素放出動特性を修飾する成分、
(b)粒子の生体許容性に影響する成分、
(c)粒子の生体内分布に影響する成分、
(d)粒子の標的への運搬に寄与する成分、
(e)粒子の画像又は追跡に寄与する成分、
(f)粒子の溶解性に影響する成分、
(g)治療薬剤、及び
(h)これらの組合せ、
からなる群から選択される1又は2以上の化学成分を含む請求項31に記載の方法。
【請求項38】
前記コアが、金属クラスターであり、この金属クラスターが、金、白金、銀、磁性体、量子ドット、及びこれらの組合せから選択される成分構成材料を含む請求項31に記載の方法。
【請求項39】
前記金属クラスターが、単層で保護した金クラスターである請求項38に記載の方法。
【請求項40】
前記コアが、樹木状ネットワークであり、この樹木状ネットワークが、
(a)ポリプロピレニミンデンドリマー、
(b)ポリアミドアミン(PAMAM)デンドリマー、
(c)ポリアリールエーテルデンドリマー、
(d)ポリペプチドデンドリマー、
(e)ポリエステルデンドリマー、
(f)ポリアミドデンドリマー、
(g)樹木状ポリグリセロール、及び
(h)トリアジンデンドリマー、
からなる群から選択される請求項31に記載の方法。
【請求項41】
前記樹木状ネットワークが、超分枝状である請求項40に記載の方法。
【請求項42】
前記コアが、共凝縮したシリカネットワークからなり、この共凝縮したシリカネットワークが、アルコキシシラン及びアミノアルコキシシランからなるシラン混合物の凝縮により合成されたものである請求項31に記載の方法。
【請求項43】
前記アルコキシシランが、化学式Si(OR)4(式中、Rはアルキル基を表す。)で表されるテトラアルコキシシランから成り、
前記アミノアルコキシシランが、
(a)化学式 R’’−(NH−R’)n−Si(OR)3(式中、Rはアルキル基、R’はアルキレン基、分枝アルキレン基、又はアラルキレン基、nは1又は2、R’’はアルキル基、シクロアルキル基、アリール基及びアルキルアミンから成る群から選択される。)で表されるアミノアルコキシシラン、
(b)化学式 NH[R’−Si(OR)3]2(式中、Rはアルキル基、R’はアルキレン基を表す。)で表されるアミノアルコキシシラン、
(c)化学式 R’’−N(NONO−X+)−R’−Si(OR)3(式中、Rはアルキル基、R’はアルキレン基又はアラルキレン基、R’’はアルキル基又はアルキルアミン基を表し、X+はNa+及びK+からなる群から選択されるカチオンを表す。)で表される、アミン基がジアゼニウムジオレイン酸塩で置換されたアミノアルコキシシラン、及び
(d)これらの組合せ、
から成る群から選択される請求項42に記載の方法。
【請求項44】
前記シラン混合物が、10モル%〜99モル%の前記テトラアルコキシシラン、及び1モル%〜90モル%の前記アミノアルコキシシランから成る請求項43に記載の方法。
【請求項45】
前記シラン混合物が、更に0モル%〜20モル%のフッ素化シラン、0モル%〜20モル%のカチオン性又はアニオン性シラン、及び0モル%〜20モル%のアルキルシランを含む請求項44に記載の方法。
【請求項46】
前記テトラアルコキシシランが、テトラメチルオルソケイ酸塩及びテトラエチルオルソケイ酸塩からなる群から選択される請求項43に記載の方法。
【請求項47】
前記アミノアルコキシシランが、N−(6−アミノヘキシル)アミノメチルトリメトキシシラン、N−(6−アミノヘキシル)アミノプロピルトリメトキシシラン、N−(6−アミノエチル)アミノプロピルトリメトキシシラン、(3−トリメトキシシリルプロピル)ジエチレントリアミン、(アミノエチルアミノメチル)フェネチルトリメトキシシラン、[3−(メチルアミノ)プロピル]トリメトキシシラン、N−ブチルアミノプロピルトリメトキシシラン、N−エチルアミノイソブチルトリメトキシシラン、N−フェニルアミノプロピルトリメトキシシラン、N−シクロヘキシルアミノプロピルトリメトキシシラン、ビス[3−(トリメトキシシリル)プロピル]アミン、及びビス[3−(トリメトキシシリル)プロピル]エチレンジアミンからなる群から選択される請求項43に記載の方法。
【請求項48】
前記フッ素化シランが、(ヘプタデカフルオロ−1,1,2,2−テトラヒドロデシル)トリエトキシシラン、(3,3,3−トリフルオロプロピル)トリメトキシシラン及び(ペルフルオロアルキル)エチルトリエトキシシランからなる群から選択される請求項45に記載の方法。
【請求項49】
前記カチオン性又はアニオン性シランが、N−N−ジデシル−N−メチル−N−(3−トリメトキシシリル)アンモニウムクロライド、オクタデシルジメチル−(3−トリメトキシシリルプロピル)アンモニウムクロライド、3−トリヒドロキシシリルプロピルメチルホスホン酸ナトリウム塩及びカルボキシルエチルシラントリオールナトリウム塩からなる群から選択される請求項45に記載の方法。
【請求項50】
前記アルキルシランが、メチルトリメトキシシラン、ブチルトリメトキシシラン、ブチルトリエトキシシラン、プロピルトリメトキシシラン及びオクタデシルトリメトキシシランからなる群から選択される請求項45に記載の方法。
【請求項51】
前記コアが、共凝縮シリカネットワークからなり、この共凝縮シリカネットワークが、アルコキシシラン及びアミノアルコキシシランからなるシラン混合物の凝縮により合成され、
前記NO供与体が、
(a)前記酸化窒素供与体が、シラン混合物の共凝縮の後で形成されるポストチャージ法、及び
(b)前記酸化窒素供与体が、シラン混合物の共凝縮の前に前記アミノアルコキシシランから形成されるプレチャージ法、
から選択される方法で形成される請求項31に記載の方法。
【請求項52】
前記リンカーが、前記酸化窒素放出粒子に酸化窒素放出のオン/オフ状態を与えることができる官能基を含み、該官能基が、エステル、ヒドラゾン、アセタール、チオプロピオネート、光脆弱性部分、及び酵素分解されるアミノ酸配列からなる群から選択される請求項32に記載の方法。
【請求項53】
前記外部領域が、酸化窒素放出粒子を標的に運搬することができる部分を含む請求項37に記載の方法。
【請求項54】
前記標的が、細胞、組織及び器官からなる群から選択される請求項53に記載の方法。
【請求項55】
前記細胞が、癌細胞である請求項54に記載の方法。
【請求項56】
前記酸化窒素放出粒子を標的に運搬することができる部分が、抗体/抗原相互作用の原因となるタンパク質、葉酸、グアニジン、トランスフェリン、ホルモン、炭化水素、アミノ酸配列RGDを含むペプチド及びTATペプチドからなる群から選択される請求項53に記載の方法。
【請求項57】
前記外部領域が、酸化窒素供与体、(ポリ)エチレンオキシド、(ポリ)ウレタン、N−(2−ヒドロキシプロピル)メタクリルアミドコ高分子、ラクチド/グリコリドコ高分子(例えば、PLGA)、砂糖、蛍光部分、有機染料、MRIコントラスト試薬、チオール、メチル基末端のアルキル鎖、抗菌剤、抗腫瘍治療薬、スルホン酸塩、カルボン酸塩、リン酸塩、カチオン性アミン基、第4級アミン基、及びこれらの組み合わせからなる群から選択される部分を含む請求項37に記載の方法。
【請求項58】
前記コアが磁鉄鉱からなり、前記方法が標的に磁鉄鉱コアの磁性特性を介して酸化窒素放出粒子を導く段階を含み、前記標的が、細胞、組織及び器官からなる群から選択される請求項38に記載の方法。
【請求項59】
治療が必要な患者の疾患状態を治療する方法であって、
(a)以下から成る酸化窒素放出粒子を提供する段階、及び
(i)酸化窒素供与体、
(ii)一定容積を持つ内部領域であって、少なくともその部分が、
(1)金属クラスター、
(2)樹木状ネットワーク、
(3)共凝縮したシリカネットワーク、及び
(4)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域、及び
(iii)外部領域、
(b)有効量の酸化窒素放出粒子を患者に投与する段階からなる方法。
【請求項60】
前記疾患状態が、癌、心臓血管疾患、微生物感染、血液を医学的デバイスに曝すことにより引き起こされる血小板凝集と血小板接着、細胞異常増殖に起因する病理学的状態、移植拒絶、自己免疫疾患、炎症、血管疾患、瘢痕組織、創傷の収縮、再発狭窄症、痛み、発熱、胃腸疾患、呼吸器疾患、性機能障害、及び性感染症からなる群から選択される請求項59に記載の方法。
【請求項61】
前記酸化窒素放出粒子が、更に、患者の標的に向けて粒子を運搬することができる標的部分を含み、該標的が細胞、組織又は器官からなる請求項59に記載の方法。
【請求項62】
(a)以下からなる酸化窒素放出粒子、及び
(i)酸化窒素供与体、
(ii)一定容積を持つ内部領域であって、少なくともその部分が、
(1)金属クラスター、
(2)樹木状ネットワーク、
(3)共凝縮したシリカネットワーク、及び
(4)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域、及び
(iii)外部領域、
(b)医薬的に許容された担体、
からなる医薬配合物。
【請求項63】
前記配合物が、経口配合物、静脈内配合物及び局所的配合物からなる群から選択される請求項62に記載の配合物。
【請求項64】
有機高分子及び該酸化窒素放出粒子からなる酸化窒素放出高分子フィルムであって、該酸化窒素放出粒子が、
(a)酸化窒素供与体、
(b)一定容積を持つ内部領域であって、少なくともその部分が、
(i)金属クラスター、
(ii)樹木状ネットワーク、
(iii)共凝縮したシリカネットワーク、及び
(iv)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域、及び
(c)外部領域、
からなる酸化窒素放出高分子フィルム。
【請求項65】
前記有機高分子がポリウレタンである請求項64に記載の酸化窒素放出高分子フィルム。
【請求項66】
酸化窒素放出フィルムからなる医用デバイスであって、該酸化窒素放出高分子フィルムが有機高分子及び該酸化窒素放出粒子からなり、該酸化窒素放出粒子が、
(a)酸化窒素供与体、
(b)一定容積を持つ内部領域であって、少なくともその部分が、
(i)金属クラスター、
(ii)樹木状ネットワーク、
(iii)共凝縮したシリカネットワーク、及び
(iv)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域、及び
(c)外部領域、
からなる医用デバイス。
【請求項67】
前記医用デバイスの1又は2以上の表面が前記酸化窒素放出フィルムで被覆された請求項66に記載の医用デバイス。
【請求項68】
動脈ステント、ガイドワイア、カテーテル、トロカール針、骨アンカー、骨ネジ、保護板、股関節又は関節置換、導線、生体センサー、探索子、縫合線、外科的ドレープ、外傷用着衣、及び包帯からなる群から選択される請求項66に記載の医用デバイス。
【請求項69】
(a)酸化窒素供与体、
(b)一定容積を持つ内部領域であって、少なくともその部分が、
(i)金属クラスター、
(ii)樹木状ネットワーク、
(iii)共凝縮したシリカネットワーク、及び
(iv)これらの組合せ、
から成る群から選択されるコアにより満たされた内部領域、及び
(c)外部領域、
からなる酸化窒素放出粒子を含む洗浄剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【公表番号】特表2008−545714(P2008−545714A)
【公表日】平成20年12月18日(2008.12.18)
【国際特許分類】
【出願番号】特願2008−513811(P2008−513811)
【出願日】平成18年5月30日(2006.5.30)
【国際出願番号】PCT/US2006/020781
【国際公開番号】WO2006/128121
【国際公開日】平成18年11月30日(2006.11.30)
【出願人】(501345323)ザ ユニバーシティ オブ ノース カロライナ アット チャペル ヒル (52)
【氏名又は名称原語表記】THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL
【住所又は居所原語表記】308 Bynum Hall,Campus Box 4105,Chapel Hill,North Carolina 27599−4105, United States of America
【Fターム(参考)】
【公表日】平成20年12月18日(2008.12.18)
【国際特許分類】
【出願日】平成18年5月30日(2006.5.30)
【国際出願番号】PCT/US2006/020781
【国際公開番号】WO2006/128121
【国際公開日】平成18年11月30日(2006.11.30)
【出願人】(501345323)ザ ユニバーシティ オブ ノース カロライナ アット チャペル ヒル (52)
【氏名又は名称原語表記】THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL
【住所又は居所原語表記】308 Bynum Hall,Campus Box 4105,Chapel Hill,North Carolina 27599−4105, United States of America
【Fターム(参考)】
[ Back to top ]

