銅イオン応答性プロモーター
【課題】形質転換体において効率的に機能するコンディショナルプロモーター、及びそれを用いる遺伝子機能の解析法及び化合物のスクリーニング法を提供することを目的とする。
【解決手段】特定の塩基配列からなるDNA、1又は複数の塩基が欠失、置換又は付加された当該DNA、又は特定の塩基配列と相補的な塩基配列とストリンジェントな条件下でハイブリダイズするDNAを含む、銅イオン応答性プロモーターを提供する。
【解決手段】特定の塩基配列からなるDNA、1又は複数の塩基が欠失、置換又は付加された当該DNA、又は特定の塩基配列と相補的な塩基配列とストリンジェントな条件下でハイブリダイズするDNAを含む、銅イオン応答性プロモーターを提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は銅イオンに対する応答性を示すプロモーター、当該プロモーターを有する発現ベクター、当該発現ベクターを含む形質転換体、及び当該形質転換体を用いる遺伝子の機能解析方法および化合物のスクリーニング方法に関する。
【背景技術】
【0002】
白癬は国内における患者数が2000万人以上と推定される非常に患者数の多い難治性の表在性真菌症であり、その感染制御は重要な課題である。しかしながら、感染制御対策を講じるために必要とされる白癬菌の感染メカニズムや薬剤標的分子等に関する知見は、細菌に比べて限られている。
【0003】
その原因として、白癬菌においては、遺伝子破壊をはじめとする分子生物学的手法が容易に行えないことが挙げられる。近年、部位特異的遺伝子導入を白癬菌において比較的高い効率で行う方法が報告され、白癬菌の遺伝子破壊株が作製できるようになった(非特許文献1)。しかしながら、感染制御に関して有用な遺伝子の多くが含まれる、菌の発育に必須の遺伝子については、原理的に遺伝子破壊株を作製することが困難であるため、解析することができない。
【0004】
菌の生育に必須の遺伝子について解析を行うためには標的遺伝子の発現を人為的に調節するシステム、即ち遺伝子発現調節系が必要である。遺伝子発現調節系は標的遺伝子の上流に、転写活性の制御が可能なプロモーター(コンディショナルプロモーター)を導入し、標的遺伝子の発現を制御しようとするものである。カンジダ・アルビカンス(Candida albicans)(特許文献1)、アスペルギルス・フミガタス(Aspergillus fumigatus)(特許文献2)等の病原真菌においては、遺伝子発現調節系が構築されており、生存に必須な遺伝子が幾つか見出されている。
【0005】
そして、近年、クリプトコックス・ネオフォルマンス(Cryptococcus neoformans)(非特許文献2)やヒストプラスマ・カプスラーツム(Histoplasma capsulatum)(非特許文献3)において、銅イオン応答性のコンディショナルプロモーターが単離されている。さらに、クリプトコックス・ネオフォルマンスにおいては発現調節系が構築され、遺伝子の生存必須性の解析に使用されている(非特許文献4及び5)。
【0006】
しかし、真菌の遺伝子発現プロセスは複雑であり、ある属において機能するコンディショナルプロモーターが他の属においては必ずしも効率よく機能するとは限らない。また、白癬菌における分子生物学的な実験の実施は容易ではなく、白癬菌において効率的に機能するコンディショナルプロモーターは見出されていない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特表2003-523197
【特許文献2】特表2005-522980
【非特許文献】
【0008】
【非特許文献1】Alshahni MM, Yamada T, Takatori K, Sawada T, Makimura K., Insights into a nonhomologous integration pathway in the dermatophyte Trichophyton mentagrophytes: efficient targeted gene disruption by use of mutants lacking ligase IV., Microbiol Immunol. 2011 Jan;55(1):34-43.
【非特許文献2】Ory JJ, Griffith CL, Doering TL., An efficiently regulated promoter system for Cryptococcus neoformans utilizing the CTR4 promoter., Yeast. 2004 Aug;21(11):919-26.
【非特許文献3】Gebhart D, Bahrami AK, Sil A., Identification of a copper-inducible promoter for use in ectopic expression in the fungal pathogen Histoplasma capsulatum., Eukaryot Cell. 2006 Jun;5(6):935-44.
【非特許文献4】Methee Chayakulkeeree, Thomas H. Rude, Dena L. Toffaletti, and John R., Fatty Acid Synthesis Is Essential for Survival of Cryptococcus neoformans and a Potential Fungicidal Target., Antimicrobial Agents and Chemotherapy, 2007; 51: 3537-3545.
【非特許文献5】Tricia A. Missall and Jennifer K. Lodge., Thioredoxin Reductase Is Essential for Viability in the Fungal Pathogen Cryptococcus neoformans., Eukaryotic Cell. 2005; 4: 487-489.
【非特許文献6】Yamada T, Makimura K, Hisajima T, Ishihara Y, Umeda Y, Abe Shigeru., Enhanced gene replacements in Ku80 disruption mutants of the dermatophyte, Trichophyton mentagrophytes., FEMS Microbiol. Lett. 2009 Jul;298:208-217.
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、白癬菌において効率的に機能する発現調節系を提供することを目的とする。
【課題を解決するための手段】
【0010】
上記の事情に鑑み、本発明者らは、白癬菌由来の銅イオン応答性プロモーターの探索に着手した。鋭意検討の結果、銅イオン応答性プロモーターが白癬菌に存在することを明らかにし、当該プロモーター配列を明らかにすることに成功した。かかる知見に基づいて本発明を完成させた。
【0011】
本発明は(1)の銅イオン応答性プロモーターを提供する。
(1)以下の(a)、(b)、及び(c)からなる群から選択されるDNAを含む、銅イオン応答性プロモーター:
(a)配列番号1又は2の塩基配列からなるDNA、
(b)配列番号1又は2の塩基配列において1又は複数の塩基が欠失、置換、又は付加された塩基配列からなり、かつ銅イオン応答性プロモーターとして機能するDNA、及び
(c)配列番号1又は2の塩基配列と相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつ銅イオン応答性プロモーターとして機能するDNA。
【0012】
別の側面によれば、本発明は(2)の融合遺伝子を提供する。
(2)(1)に記載のプロモーターの下流に、以下の(a)、(b)、及び(c)からなる群から選択されるDNAを連結した融合遺伝子:
(a)宿主細胞の構造遺伝子のDNA、
(b)宿主細胞の構造遺伝子に対するアンチセンス配列からなるDNA、及び
(c)外来性の構造遺伝子のDNA。
【0013】
別の側面によれば、本発明は(3)の発現ベクターを提供する。
(3)(1)に記載のプロモーター又は(2)に記載の融合遺伝子を含む発現ベクター。
別の側面によれば、本発明は(4)〜(6)の形質転換体を提供する。
【0014】
(4)(3)に記載の発現ベクターを含む形質転換体。
(5)発現ベクターが真菌細胞に導入された(4)に記載の形質転換体。
(6)真菌細胞が白癬菌に由来する、(5)に記載の形質転換体。
【0015】
別の側面によれば、本発明は(7)の遺伝子の機能解析方法を提供する。
(7)以下の(a)、(b)、及び(c)を含む、遺伝子の機能解析方法:
(a)(4)〜(6)のいずれかに記載の形質転換体を培養培地中で培養する工程、
(b)前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御する工程、及び
(c)形質転換体と形質転換されていない宿主の表現型を比較し、表現型の変化に基づいて遺伝子の機能を判断する工程。
【0016】
別の側面によれば、本発明は(8)及び(9)の化合物のスクリーニング方法を提供する。
(8)以下の(a)、(b)、(c)、及び(d)を含む、化合物のスクリーニング方法:
(a)(4)〜(6)のいずれかに記載の形質転換体を培養培地中で培養する工程、
(b)前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御して、遺伝子産物の発現量を致死的でないレベルに低下させる工程、
(c)試験化合物を形質転換体と接触させる工程、及び
(d)試験化合物の処理による形質転換体の表現型の変化に基づいて、銅イオン応答性プロモーターによって発現が制御される遺伝子の機能に対する試験化合物の影響を判断する工程。
【0017】
(9)試験化合物が形質転換体の増殖を阻止するかどうかを判断することにより試験化合物の影響を判断する、(8)に記載のスクリーニング方法。
別の側面によれば、本発明は(10)及び(11)の遺伝子又はタンパク質の同定方法を提供する。
【0018】
(10)以下の(a)、(b)、(c)、及び(d)を含む、試験化合物が作用する遺伝子又はタンパク質の同定方法:
(a)請求項4〜6のいずれか1項に記載の1種類又は複数種類の形質転換体を培養培地中で培養する工程、
(b)前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御して、遺伝子産物の発現量を致死的でないレベルに低下させる工程、
(c)試験化合物を形質転換体と接触させる工程、及び
(d)試験化合物で処理された形質転換体の表現型と、試験化合物で処理された形質転換されていない宿主株の表現型を比較することにより、試験化合物が作用する遺伝子又はタンパク質を同定する工程。
【0019】
(11)試験化合物で処理された形質転換されていない宿主株の増殖に比べて、試験化合物で処理された形質転換体の増殖が阻止されるかどうかを判断することにより、試験化合物が作用する遺伝子又はタンパク質を同定する、(10)に記載の遺伝子又はタンパク質の同定方法。
【発明の効果】
【0020】
本発明により提供される銅イオン応答性プロモーターによれば、当該プロモーターの下流に連結された遺伝子の発現を銅イオンによって制御することが可能となる。さらに、形質転換体の表現型の変化に基づいた遺伝子機能の解析並びに当該遺伝子の機能に影響する化合物のスクリーニングが可能である。
【図面の簡単な説明】
【0021】
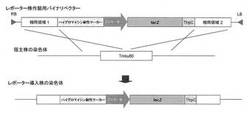
【図1】β−ガラクトシダーゼレポーターアッセイに用いる形質転換体を作製するための、バイナリベクターの物理地図と相同組換えの模式図である。
【図2】β−ガラクトシダーゼレポーターアッセイの結果を示す図である。硫酸銅_10μM:硫酸銅(II)10μMを培地に添加、硫酸銅_100μM:硫酸銅(II)100μMを培地に添加。
【図3】Tmerg1発現調節株作製用のバイナリベクターの物理地図と相同組換えの模式図である。
【図4】Tmerg1発現調節株の生育の様子を示す写真である。BCS_10μM:バソクプロイン二硫酸塩10μMを培地に添加、硫酸銅_10μM:硫酸銅(II)10μMを培地に添加、硫酸銅_100μM:硫酸銅(II)100μMを培地に添加。
【発明を実施するための形態】
【0022】
以下、本発明をより詳細に説明する。
本発明は、銅イオン応答性プロモーターを提供する。本発明の銅イオン応答性プロモーターは、銅イオンに応答してプロモーター活性が制御されるいずれのプロモーターであってもよい。そのようなプロモーターは、好ましくは:
(a)配列番号1又は2の塩基配列からなるDNA、
(b)配列番号1又は2の塩基配列において1又は複数の塩基が欠失、置換、又は付加された塩基配列からなり、かつ銅イオン応答性プロモーターとして機能するDNA、及び
(c)配列番号1又は2の塩基配列と相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつ銅イオン応答性プロモーターとして機能するDNA、
からなる群から選択されるDNAを含む。
【0023】
配列番号1の塩基配列は、トリコフィトン・ルブラムCBS118892株における構造遺伝子TERG_01401の開始コドンの上流1283 bpに由来する。ここで、TERG_01401は銅イオントランスポーターをコードする遺伝子(以下、ctr4ということもある)のトリコフィトン・ルブラムにおけるホモログである。配列番号1の塩基配列とクリプトコックス・ネオフォルマンス由来ctr4遺伝子の開始コドン上流1300 bpの塩基配列との間に高い相同性は認められなかった。
【0024】
また、配列番号2の塩基配列は、トリコフィトン・ルブラムCBS118892株における構造遺伝子TERG_07477の開始コドンの上流1290 bpに由来する。ここで、TERG_07477は銅イオン排出ポンプをコードする遺伝子(以下、crp1ということもある)のトリコフィトン・ルブラムにおけるホモログである。配列番号2に記載の塩基配列とヒストプラスマ・カプスラーツム由来crp1遺伝子の開始コドンの上流1300 bpの塩基配列との間に高い相同性は認められなかった。
【0025】
本発明の銅イオン応答性プロモーターの活性は、銅イオンにより制御される。銅イオンは、例えば硫酸銅(II)、塩化銅(I)、及び塩化銅(II)等により供給することができる。銅イオンの濃度は、銅イオン応答性プロモーターの活性を制御するために有効な濃度であればよく、例えば、1nM〜1mM、好ましくは100nM〜500μM、より好ましくは100nM〜300μM、さらに好ましくは100nM〜100μMである。具体例としては、ctr4プロモーターの活性を制御する銅イオンの濃度は、例えば1nM〜1mM、好ましくは100nM〜500μM、より好ましくは100nM〜100μMである。また、crp1プロモーターの活性を制御する銅イオンの濃度は、例えば1nM〜1mM、好ましくは100nM〜500μM、より好ましくは100nM〜100μMである。
【0026】
本発明のプロモーターは、銅イオン応答性を有する限り、トリコフィトン・ルブラム以外の他の生物種に由来するものであってもよい。即ち、配列番号1又は2の塩基配列と類似する他の生物種由来の転写制御領域に存在する塩基配列が、銅イオン応答性を示す限り、本発明の銅イオン応答性プロモーターとして使用可能である。そのようなプロモーターとして、例えば、配列番号1又は2の塩基配列において1又は複数の塩基が欠失、置換、又は付加された塩基配列からなる、銅イオン応答性プロモーターとして機能するDNAが挙げられる。
【0027】
本明細書でいう複数の塩基とは、2以上の塩基をいうが、好ましくは2〜10個の塩基、より好ましくは2〜5個の塩基、さらに好ましくは2〜3個の塩基を意味する。
本明細書でいうストリンジェントな条件とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。そのような条件の例としては、配列番号1又は2の配列と相同性の高いDNAが、配列番号1又は2の塩基配列と相補的な塩基配列からなるDNAとハイブリダイズし、それより低い相同性のDNAが前記相補的な塩基配列からなるDNAとハイブリダイズしない条件が挙げられる。本明細書でいう相同性が高いとは、相同性が60%以上、好ましくは70%以上、より好ましくは80%以上、さらに好ましくは90%以上、特に好ましくは95%以上を意味する。ストリンジェントな条件の具体例としては、68℃、0.1×SSC、0.1%SDSといった条件が挙げられる。
【0028】
本発明の銅イオン応答性プロモーターは、標的遺伝子と連結させることができる。本明細書でいう標的遺伝子とは、銅イオン応答性プロモーターによって発現が制御される遺伝子をいう。このように銅イオン応答性プロモーターと標的遺伝子が連結したDNAを融合遺伝子という。ここで、標的遺伝子は、銅イオン応答性プロモーターによって発現が制御される限り、当該プロモーターとどの位置で連結させてもよい。例えば、標的遺伝子は、当該プロモーターの下流、好ましくは当該プロモーターの直後に連結させることができる。本発明の銅イオン応答性プロモーターと標的遺伝子の連結は、当該技術分野における公知の方法に従って行うことができる。本発明における標的遺伝子としては、宿主細胞が元来保有している構造遺伝子、宿主細胞の構造遺伝子に対するアンチセンス配列、及び外来性の構造遺伝子等を用いることができる。
【0029】
上記の宿主細胞が元来保有している構造遺伝子としては、宿主の生存、生育、薬剤耐性、感染性等において重要な遺伝子が挙げられる。その構造遺伝子の機能は、未知であっても既知であってもよい。本発明においては、機能が未知であるが宿主の生存、生育、薬剤耐性、感染性等に必須の構造遺伝子を用いることができる。また、機能が既知の構造遺伝子の具体例としては、スクワレンエポキシダーゼが挙げられる。
【0030】
宿主細胞の構造遺伝子に対するアンチセンス配列としては、上記宿主細胞の構造遺伝子のアンチセンス配列が挙げられる。具体例として、スクワレンエポキシダーゼ遺伝子のアンチセンス配列が挙げられる。
【0031】
上記外来性の構造遺伝子としては、レポーター遺伝子:β―ガラクトシダーゼ遺伝子(lacZ)、ルシフェラーゼ遺伝子、緑色蛍光タンパク質遺伝子、β―グルクロニダーゼ遺伝子、クロラムフェニコールアセチルトランスフェラーゼ遺伝子等が挙げられる。例えば、標的遺伝子としてレポーター遺伝子を適用すれば、銅イオン応答性プロモーターが導入された形質転換体において、当該プロモーターが銅イオン応答性を示すことを評価する上で便利である。
【0032】
本発明の別の側面によれば、銅イオン応答性プロモーター又は融合遺伝子を含む発現ベクターが提供される。本発明の発現ベクターの作製に用いる基礎となるベクターは、新たに作製してもよいが、当該技術分野において入手可能なベクターを用いて作製するのが簡便である。当該技術分野において入手可能なベクターとしては、宿主細胞内で自律複製可能なプラスミド型ベクター、又は宿主染色体中に組込み可能な染色体導入型ベクターが挙げられる。具体的には、大腸菌由来プラスミドベクター(pUC118、pCR2.1、pBR322、pBlueScript等)、バイナリベクター(pAg1、pBIN19、pGREEN等)が挙げられる。本発明の発現ベクターは、本発明の銅イオン応答性プロモーター又は融合遺伝子を上記した基礎となるベクターに挿入することによって得ることができる。このような挿入は、当業者に公知の方法に従って行うことができる。
【0033】
本発明の発現ベクターは、本発明の銅イオン応答性プロモーター及び融合遺伝子に加えて、発現ベクターを導入する宿主細胞のゲノムにおける一部の領域と相同な領域を有していてもよい。このような相同領域を有することによって、本発明の銅イオン応答性プロモーター又は融合遺伝子を相同組換えにより宿主染色体に部位特異的に組み込むことが可能になる。
【0034】
上記の相同な領域は、本発明の発現ベクター中に、1つ又は複数個、具体的には2つ存在させることができる。そして、その長さは300 bp以上であることが好ましく、具体的には1000 bp〜2000 bp程度である。
【0035】
本発明の発現ベクターは、銅イオン応答性プロモーター、標的遺伝子、相同領域の他、選択マーカー遺伝子、リコンビナーゼ認識配列等を含むことができる。選択マーカー遺伝子としては、カナマイシン耐性遺伝子、アンピシリン耐性遺伝子、ハイグロマイシン耐性遺伝子、ネオマイシン耐性遺伝子等が挙げられる。また、リコンビナーゼ認識配列としては、Creリコンビナーゼ認識配列、Flpリコンビナーゼ認識配列等が挙げられる。
【0036】
本発明の別の側面によれば、本発明の発現ベクターが導入された形質転換体が提供される。当該形質転換体は、適当な宿主に本発明の発現ベクターを導入することにより得ることができる。本明細書でいう宿主とは、標的遺伝子を発現できる細胞であればよい。例えば、微生物、動物細胞、昆虫細胞、及び植物細胞等が挙げられるが、微生物が好ましい。微生物としては真菌が好ましく、具体的には、白癬菌、コクシジオイデス(Coccidioides)属、パラコクシジオイデス(Paracoccidioides)属、ヒストプラスマ(Histoplasma)属、ブラストマイセス(Blastomyces)属、及びアスペルギルス(Aspergillus)属等真菌が挙げられる。本明細書でいう白癬菌とは、ヒト又は動物に感染する皮膚糸状菌を指す。白癬菌の例としては、トリコフィトン(Trichophyton)属、ミクロスポラム(Microsporum)属、エピデルモフィトン(Epidermophyton)属等真菌が挙げられる。より具体的には、トリコフィトン・ルブラム、トリコフィトン・メンタグロフィテス、トリコフィトン・トンズランス、トリコフィトン・ビオラセウム、トリコフィトン・ベルコサム、ミクロスポラム・カニス、ミクロスポラム・ギプセウム、エピデルモフィトン・フロコスム等が挙げられる。また、トリコフィトン・メンタグロフィテス(Trichophyton mentagrophytes)は、複数の異なる菌種からなるコンプレックスであり、これまでに3種の有性世代が確認されている。当該3種の有性世代名は、アルスロデルマ・ベンハミエ(Arthroderma benhamiae)、アルスロデルマ・バンブルゼミイ(Arthroderma vanbreuseghemii)、アルスロデルマ・シミイ(Arthroderma simii)である。
【0037】
真菌に導入された本発明の発現ベクターは、染色体中に組込まれた形で維持される。本発明の発現ベクターの宿主への導入は、当業者間でよく知られた方法によって行うことができる。例えば、宿主として真菌を用いる場合は、アグロバクテリウム法、ポリエチレングリコール(PEG)法、エレクトロポレーション法等を用いて発現ベクターを導入することができる。
【0038】
本発明の発現ベクターは、上記真菌に導入するのみならず、大腸菌(Escherichia coli)及びアグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)等の細菌に導入して形質転換体を得ることができる。細菌を宿主とする場合は、本発明の発現ベクターは宿主細胞内で自己複製されて維持されることが望ましい。細菌細胞内への発現ベクターの導入には、カルシウムイオンを用いる方法、及びエレクトロポレーション法等を用いることができる。
【0039】
本発明の銅イオン応答性プロモーターと標的遺伝子の融合遺伝子が宿主の染色体に組込まれたか否かの確認は、PCR法及びサザンブロットハイブリダイゼーション法等により行うことができる。
【0040】
本発明の別の側面によれば、本発明の形質転換体を用いる遺伝子の機能解析方法が提供される。当該方法は、(a)本発明の銅イオン応答性プロモーター及びその下流に連結された標的遺伝子を含む形質転換体を培養培地中で培養する工程;(b)前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御する工程;(c)形質転換体と形質転換されていない宿主の表現型を比較し、表現型の変化に基づいて遺伝子の機能を判断する工程;を含む。
【0041】
形質転換体の培養は、いずれの培養培地、例えば、液体培地、及び固体培地等、当業者間で知られているいずれの培養培地を用いて行うことができる。銅イオン応答性プロモーターのプロモーター活性の制御を的確に行う観点から、銅イオンを含まない培地成分から培地を調製することが好ましい。このような培地として、例えば合成培地であるRPMI1640が市販品として入手可能である。また、このような培地に銅イオンのキレート剤を添加し、銅イオンがより厳密に除去された培地を調製することもできる。一方、サブローデキストロース培地等の非合成培地も形質転換体の培養に用いることができる。しかし、銅イオンを含有しているため、銅イオンのキレート剤を併用し、銅イオンを除去する必要がある。
【0042】
本明細書でいう銅イオンのキレート剤としては、バソクプロイン二硫酸塩(bathocuproine disulfonate, BCS)、テトラチオモリブデート、塩酸トリエンチン、D−ペニシラミン、及びエチレンジアミン四酢酸等が挙げられる。銅イオンのキレート剤は、銅イオンが除去されるのに有効な濃度、例えば、1 nM〜1 mM、好ましくは1μM〜100μMで培養培地に添加することができる。そして、形質転換体の接種量、培養温度、及び培養時間等のその他の培養条件は、当業者が適宜設定することが可能である。
【0043】
上記のような培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御することができる。これにより、銅イオン応答性プロモーターのプロモーター活性を任意に制御することが可能となる。ここでいう銅イオンとして、例えば、硫酸銅(II)、塩化銅(I)、及び塩化銅(II)等を使用することができる。そして、銅イオン濃度は、銅イオン応答性プロモーターのプロモーター活性を制御するために有効な濃度であればよい。例えば、培養培地中の銅イオン濃度は、1nM〜1mM、好ましくは100nM〜500μM、より好ましくは100nM〜300μM、さらに好ましくは100nM〜100μMに調節することができる。具体例としては、ctr4プロモーターの活性を制御する銅イオンの濃度は、例えば1nM〜1mM、好ましくは100nM〜500μM、より好ましくは100nM〜100μMである。また、crp1プロモーターの活性を制御する銅イオンの濃度は、例えば1nM〜1mM、好ましくは100nM〜500μM、より好ましくは100nM〜100μMである。
【0044】
銅イオンによる銅イオン応答性プロモーターの活性制御の一態様として、例えば、Pctr4を含む形質転換体の培養において、形質転換体と銅イオンを接触させることによって、Pctr4のプロモーター活性を阻害することができる。そして、培養培地からキレート剤を用いて銅イオンを除去することにより、Pctr4のプロモーター活性を活性化することができる。このようなPctr4によって発現が制御されている標的遺伝子及び当該遺伝子産物も、銅イオンによって発現が阻害され、銅イオンの除去によって発現が活性化される。
【0045】
銅イオンによる銅イオン応答性プロモーターの活性制御の別の態様として、Pcrp1を含む形質転換体の培養においては、上記のPctr4を含む形質転換体とは逆の制御を行うことができる。即ち、Pcrp1のプロモーター活性は、銅イオンにより活性化され、銅イオンの除去によって活性阻害を受ける。このようなPcrp1によって発現が制御されている標的遺伝子及び当該遺伝子産物も、銅イオンによって発現が活性化され、銅イオンの除去によって発現が阻害される。
【0046】
銅イオン応答性プロモーターを含有する形質転換体を上記のように培養し、形質転換されていない宿主と表現型を比較し、表現型の変化に基づいて遺伝子の機能を判断する。本明細書でいう表現型とは、発育(例えば、発育形態及び発育速度等)、プロテアーゼ等の病原因子産生能、薬剤感受性等を意味する。
【0047】
本発明の方法は、生存に必須の遺伝子の機能を解析することにおいて特に有効である。一般的に、生存に必須の遺伝子の発現を完全に破壊すると菌が死滅する可能性が高いため、このような遺伝子の機能解析は困難であった。本発明によれば、培地中の銅イオン濃度によって銅イオン応答性プロモーターの活性を制御できるため、当該プロモーターによって制御されている標的遺伝子の発現を任意に制御することができる。すなわち、プロモーター活性が活性化された条件においては生育可能なレベルの遺伝子発現量を供給し、プロモーター活性が抑制された条件においては遺伝子発現を致死的なレベル又は致死的でないレベルに低下させることができる。その低下率は各遺伝子毎で異なるが、形質転換されていない宿主における構造遺伝子の発現量に対して、例えば20%以上、好ましくは30%以上、より好ましくは40%以上にすることができる。
【0048】
より具体的には、遺伝子発現の致死的なレベルにおける構造遺伝子の発現の低下率は、形質転換されていない宿主における構造遺伝子の発現量に対して、例えば80%以上、好ましくは90%以上、より好ましくは99%以上である。一方、遺伝子発現の致死的でないレベルにおける構造遺伝子の発現の低下率は、形質転換されていない宿主における構造遺伝子の発現量に対して、例えば20〜70%、好ましくは30〜70%、より好ましくは40〜70%である。
【0049】
表現型の変化に基づく標的遺伝子の機能の判断は、例えば、形質転換されていない宿主に比べて形質転換体の発育、例えば発育速度が変化している場合には、銅イオン応答性プロモーターによって発現制御を受けている構造遺伝子(標的遺伝子)が発育に重要な役割を担っていると判断することができる。
【0050】
本発明の別の側面によれば、化合物のスクリーニング方法が提供される。当該スクリーニング方法は、本発明の銅イオン応答性プロモーター及びその下流に連結された標的遺伝子を含む形質転換体を培養培地中で培養する工程;前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御して、遺伝子産物の発現量を致死的でないレベルに低下させる工程;試験化合物を形質転換体と接触させる工程;試験化合物の処理による形質転換体の表現型の変化に基づいて、銅イオン応答性プロモーターによって発現が制御される遺伝子の機能に対する試験化合物の影響を判断する工程を含む。
【0051】
当該スクリーニング方法の利点は、形質転換体は生存に必須な標的遺伝子の発現が特異的に低下されているため、標的遺伝子に対して活性を有する化合物に対する感受性が高くなっている。即ち、標的遺伝子に対して有効である化合物を高感度で検出することが可能となり、構造活性相関についてより広い情報を得ることができる。
【0052】
本発明のスクリーニング方法の一態様としては、本発明の銅イオン応答性プロモーター及びその下流に連結された標的遺伝子を含む形質転換体を培養培地中で培養する工程;前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御して、遺伝子産物の発現量を致死的でないレベルに低下させる工程;試験化合物を形質転換体と接触させる工程;試験化合物の処理による形質転換体の表現型の変化に基づいて、銅イオン応答性プロモーターによって発現が制御される遺伝子の機能に対する試験化合物の影響を判断する工程;試験化合物で処理された形質転換体の表現型と、試験化合物で処理された形質転換されていない宿主株の表現型を比較することにより、試験化合物が作用する遺伝子又はタンパク質を同定する工程を含む。
【0053】
前記スクリーニング方法においては、抗真菌活性を有するが作用する遺伝子又はタンパク質が未知あるいは推測されているに過ぎない化合物を試験化合物として用いることができる。即ち、銅イオンと接触させた条件において、宿主株と比較して形質転換体が試験化合物に対して高い感受性を示すことを指標として、当該化合物が作用する遺伝子又はタンパク質を同定することができる。
【0054】
ここで、「高い感受性」とは、宿主株と比較して、形質転換体の試験化合物に対する感受性が、例えば、4倍以上、好ましくは8倍以上高くなることをいう。
【実施例】
【0055】
実施例により本発明を具体的に説明するが、本発明の範囲はこれに限定されるものではない。
【実施例1】
【0056】
銅イオン応答性プロモーターの単離
(1-1)トリコフィトン・ルブラムCBS118892株におけるctr4ホモログのプロモーター
トリコフィトン・ルブラムCBS118892株から銅イオン応答性プロモーターを取得することを試みた。トリコフィトン・ルブラムCBS118892株については、ゲノムの全塩基配列が公開されている(http://www.broadinstitute.org/)ので、当該ゲノムの塩基配列を利用した。クリプトコックス・ネオフォルマンスに由来する公知のctr4遺伝子の配列を用いて、トリコフィトン・ルブラムCBS118892株のゲノム全塩基配列に対してホモロジー検索を実施した。その結果、トリコフィトン・ルブラムCBS118892株におけるctr4ホモログとしてTERG_01401(配列番号10)が同定された。
【0057】
TERG_01401の開始コドン上流約1300 bpを当該遺伝子の転写制御領域(プロモーター)と推定し、当該転写制御領域の遺伝子を増幅させるためにトリコフィトン・ルブラムCBS118892株から調製したトータルDNAを鋳型として、PCRを行った。PCRによって増幅された1283 bpの遺伝子(配列番号1)を回収した。当該遺伝子を以降の実験に用いた。
【0058】
(1-2)トリコフィトン・ルブラムCBS118892株におけるcrp1ホモログのプロモーター
上記(1-1)と同様に、ヒストプラスマ・カプスラーツムに由来する公知のcrp1遺伝子の配列を用いて、トリコフィトン・ルブラムCBS118892株のゲノム全塩基配列に対してホモロジー検索を実施した。その結果、トリコフィトン・ルブラムCBS118892株におけるcrp1ホモログとしてTERG_07477(配列番号11)が同定された。
【0059】
TERG_07477の開始コドン上流約1300 bpを当該遺伝子の転写制御領域(プロモーター)と推定し、当該転写制御領域の遺伝子を増幅させるためにトリコフィトン・ルブラムCBS118892株から調製したトータルDNAを鋳型として、PCRを行った。PCRによって増幅された1290 bpの遺伝子(配列番号2)を回収した。当該遺伝子を以降の実験に用いた。
【0060】
なお、トリコフィトン・ルブラムは、上記のクリプトコックス・ネオフォルマンスやヒストプラスマ・カプスラーツム等の真菌とは系統学的に離れているため、これら真菌の銅イオン応答性のコンディショナルプロモーターの配列と高い相同性を有する配列は、トリコフィトン・ルブラムのゲノムの転写制御領域内からは見出すことができなかった。
【実施例2】
【0061】
β−ガラクトシダーゼレポーターアッセイ
実施例1において単離されたTERG_01401の開始コドン上流1283 bp(配列番号1)、及びTERG_07477の開始コドン上流1290 bp(配列番号2)が銅イオン応答性を有するプロモーターとして機能するか否かを確認するため、β−ガラクトシダーゼレポーターアッセイを行った。
【0062】
(2-1)レポーターカセットの作製
<Pctr4-lacZ-TtrpCの作製>
3個のDNA断片:配列番号1のDNA断片、別途PCR法により増幅したlacZ遺伝子のDNA断片(配列番号12)、及び別途PCR法により増幅した、3個のHAタグを付したアスペルギルス・ニドランス由来のトリプトファン合成酵素遺伝子の3'-非翻訳領域(3HA-TtrpC)のDNA断片(配列番号13)をこの順序で連結させた。DNA断片の連結は、Overlap Extension PCR(OE-PCR)法を用いて行った。このようにして、レポーターカセット「Pctr4-lacZ-TtrpC」(配列番号3)を得た。
【0063】
上記のレポーターカセットの作製においては、5'-末端にBamHI認識配列が付加されたフォワードプライマー(配列番号14)及びリバースプライマー(配列番号15)をPCRで用いたため、レポーターカセットの5'-末端及び3'-末端にはBamHI認識配列が付加されている。
【0064】
上記のレポーターカセットを、Mighty Cloning Kit (Blunt End) (TaKaRa)を用いる平滑化末端ライゲーション法によって、クローニングベクターpUC118(TaKaRa)のHincIIサイトに導入した。
【0065】
レポーターカセットが導入されたpUC118を回収し、そしてBamHI(Roche)で処理することによって完全に消化した。当該消化物を0.8%アガロースゲル電気泳動に供した後、レポーターカセットに該当する5.1 kbpのDNA断片をゲルから切り出し、QIAquick Gel Extraction Kit (QIAGEN)を用いて精製した。
【0066】
<Pcrp1-lacZ-TtrpCの作製>
3個のDNA断片:配列番号2のDNA断片、別途PCR法により増幅したlacZ遺伝子のDNA断片(配列番号12)、及び別途PCR法により増幅した、3HA-TtrpCのDNA断片(配列番号13)を、OE-PCR法を用いてこの順序で連結させた。このようにして得られたレポーターカセット「Pcrp1-lacZ-TtrpC」(配列番号4)を、上記Pctr4-lacZ-TtrpCにおけるものと同様にして、平滑化末端ライゲーション法によってpUC118のHincIIサイトに導入し、回収した。回収したpUC118をBamHIで完全に消化し、当該消化物を0.8%アガロースゲル電気泳動に供し、レポーターカセットに該当する5.1 kbpのDNA断片をゲルから切り出し、QIAquick Gel Extraction Kit (QIAGEN)を用いて精製した。
【0067】
(2-2)バイナリベクターの作製
本実施例において宿主株として用いるトリコフィトン・メンタグロフィテスTIMM2789株(有性世代名アルスロデルマ・バンブルゼミイ)のlig4遺伝子欠損株(TmL28株)を形質転換するためのバイナリベクターを作製した。非特許文献6で報告されているpAg1-Tmku80/Tを基にレポーター株作製用のバイナリベクターを作製した。pAg1-Tmku80/Tは、pAg1(Mol Genet Genomics. 2003 Feb;268(5):645-55.)を基に作製された、宿主株のTmku80遺伝子周辺における相同組換えに利用する相同領域及びハイグロマイシン耐性マーカーカセットが導入されたバイナリベクターである。
【0068】
pAg1-Tmku80/Tを非特許文献6に記載された方法に従って作製した。pAg1-Tmku80/TをBamHI(Roche)により完全に消化し、0.8%アガロースゲル電気泳動に供した後、DNA断片をゲルから切り出し、QIAquick Gel Extraction Kit (QIAGEN)で精製した。ライゲーション反応時におけるセルフライゲーションを防ぐために、BamHI処理されたpAg1-Tmku80/Tの5'-末端及び3'-末端をShrimp Alkaline Phosphatase (Roche)を用いて脱リン酸化した。
【0069】
そして、当該5'-末端及び3'-末端が脱リン酸化されたpAg1-Tmku80/Tと上記(2-1)において作製したBamHI処理末端を有するレポーターカセットPctr4-lacZ-TtrpCを、Ligation high (TOYOBO)を用いて連結し、レポーター株作製用バイナリベクター「pAg1-Tmku80/Pctr4-lacZ-TtrpC」を得た。
【0070】
同様にして、5'-末端及び3'-末端が脱リン酸化されたpAg1-Tmku80/Tと上記(2-1)において作製したBamHI処理末端を有するレポーターカセットPcrp1-lacZ-TtrpCを連結し、レポーター株作製用バイナリベクター「pAg1-Tmku80/Pcrp1-lacZ-TtrpC」を得た。
【0071】
(2-3)宿主株の形質転換
上記(2-2)において作製したレポーター株作製用バイナリベクターpAg1-Tmku80/Pctr4-lacZ-TtrpC又はpAg1-Tmku80/Pcrp1-lacZ-TtrpCを用いて、アグロバクテリウム法により宿主株を形質転換した。宿主株として、トリコフィトン・メンタグロフィテスTIMM2789株(有性世代名アルスロデルマ・バンブルゼミイ)のlig4遺伝子欠損株(TmL28株)を用いた。TmL28株では、部位特異的相同組換えが比較的高い効率で起こることが非特許文献1において報告されている。具体的には以下のようにしてTmL28株を形質転換した。
【0072】
上記(2-2)において作製した、レポーター株作製用バイナリベクターpAg1-Tmku80/Pctr4-lacZ-TtrpC又はpAg1-Tmku80/Pcrp1-lacZ-TtrpCをエレクトロポレーション法によりアグロバクテリウム・ツメファシエンスEHA105株(Trans Res 1993; 2: 208-218.)に導入した。形質転換操作後の菌液を50μg/mLのカナマイシン(和光純薬)を含む2×YT寒天培地に接種し、カナマイシン耐性を指標にアグロバクテリウム形質転換体を選抜した。
【0073】
そして、TmL28株を改変型1/10サブローグルコース寒天培地上で28℃、約10日間培養し、TmL28株の小分生子を回収した。改変型1/10サブローグルコース寒天培地の組成は、Bacto peptone(日本BD) 0.2%、グルコース(和光純薬)0.1%、KH2PO4(和光純薬) 0.1%、MgSO4・7H2O(和光純薬) 0.1%、Bacto agar(日本BD) 1.5%、pH未調整である。
【0074】
アグロバクテリウム法による白癬菌細胞内への遺伝子導入はMedical Mycology 2009, 47, 485-494.に記載の方法に従って行った。以下に概要を記した。アグロバクテリウム形質転換体とTmL28株の小分生子を混合し、アセトシリンゴン含有アグロバクテリウム最小培地上で28℃、48時間共培養した。共培養の後、100μg/mL〜300μg/mLのハイグロマイシン(和光純薬)を含むサブローデキストロース寒天培地(日本BD)で培養し、ハイグロマイシン耐性を指標に選抜し、Pctr4-lacZ-TtrpCレポーターカセットが導入された形質転換体、及びPcrp1-lacZ-TtrpCレポーターカセットが導入された形質転換体を得た(図1)。
【0075】
(2-4)β−ガラクトシダーゼ活性の測定
硫酸銅(II)(和光純薬)を無添加、10μM、又は100μM添加したMOPS緩衝RPMI1640液体培地(シグマ)に、上記(2-3)において得られた形質転換体を1×105cells/mLとなるように接種し、28℃で5日間培養した。それぞれの培養条件の菌体を集菌し、液体窒素で凍結した。菌体を液体窒素凍結下でマルチビーズショッカー(安井器械)を用いて破砕した。破砕物にβ−メルカプトエタノール添加Z-buffer(100mM リン酸ナトリウム pH 7.0, 50mM β−メルカプトエタノール, 10mM KCl, 1mM MgSO4) を添加して可溶性タンパク質画分を抽出し、セルフリーを調製した。セルフリー中のタンパク質濃度は、660nm Protein Assayキット(Pierce)を用いて、BSAをスタンダードとして測定した。
【0076】
セルフリー中のβ−ガラクトシダーゼ活性は96ウェルマイクロプレート中で測定した。20μLのセルフリー及び100μLの0.8mg/mL o-nitrophenyl-β-D-galactopyranoside(ONPG)をウェルに添加し、30℃で約30分反応させた。マルチスキャンFCマイクロプレートリーダー(Thermo Scientific)で405nmの吸光度を測定した。β−ガラクトシダーゼ活性の測定値は測定サンプルのタンパク質濃度及び反応時間で除して標準化した。
【0077】
図2に示されるように、Pctr4-lacZ-TtrpCレポーターカセットが導入された形質転換体においては、硫酸銅(II)濃度依存的にタンパク質当たりのβ−ガラクトシダーゼ活性が低下した。このことは、Pctr4が硫酸銅(II)濃度依存的にレポーター遺伝子であるβ−ガラクトシダーゼ遺伝子(lacZ)の発現を抑制したことを意味する。
【0078】
一方、Pcrp1-lacZ-TtrpCレポーターカセットが導入された形質転換体においては、硫酸銅(II)濃度依存的にβ−ガラクトシダーゼ活性が上昇した。このことは、Pcrp1が硫酸銅(II)濃度依存的にレポーター遺伝子であるβ−ガラクトシダーゼ遺伝子(lacZ)の発現を誘導したことを意味する。
【0079】
したがって、Pctr4(配列番号1)及びPcrp1(配列番号2)は、白癬菌細胞内において、銅イオン応答性プロモーターとして機能することが見出された。
【実施例3】
【0080】
宿主遺伝子の発現調節株の作製と評価
実施例2において銅イオン応答性が確認された配列番号1に記載のプロモーターを、宿主株(TmL28株)の構造遺伝子の5'-非翻訳領域に挿入することにより発現調節株を作製した。そして、発現調節株において、標的遺伝子の発現が銅イオンによって制御されること、及びその際の表現型について評価した。具体的な実験について説明する。
【0081】
本実施例においては、標的遺伝子として、スクワレンエポキシダーゼ遺伝子(erg1)のTmL28株におけるホモログであるTmerg1構造遺伝子のDNA配列を選択した。スクワレンエポキシダーゼは、真菌においてエルゴステロール生合成系を担う酵素の一つであり、当該酵素の阻害剤は優れた生育阻害作用を有する抗白癬菌剤として臨床的に広く使用されている。
【0082】
(3-1)Tmerg1構造遺伝子を含む約4600 bpの領域の塩基配列の決定
宿主として用いたTmL28株については、ゲノム全塩基配列は解読されていない。そこで、Tmerg1遺伝子の開始コドンの上流約2000 bp及び下流約2000 bp(Tmerg1構造遺伝子の全長を含む)を含む領域の配列を決定することを試みた。
【0083】
まず、配列が公開されている(http://www.broadinstitute.org/)トリコフィトン・メンタグロフィテスCBS 112371株(有性世代名アルスロデルマ・ベンハミエ)の配列情報を基に、erg1構造遺伝子(ARB_06092)の上流に存在する構造遺伝子ARB_06091及び下流に存在する構造遺伝子ARB_06093に対するプライマーを設計し(配列番号16、17)、TmL28株のゲノムDNAを鋳型としてTmerg1遺伝子の開始コドンの上流約2000 bp及び下流約2000 bpを含む領域(5.4kbp)をPCRにより増幅した。続いて、増幅産物をテンプレートとして、アルスロデルマ・ベンハミエCBS 112371株のerg1構造遺伝子(ARB_06092)の配列を基にプライマーを設計し、サイクルシーケンス反応を行った。決定された配列を基にプライマーを新たに設計し、当該プライマーを用いてサイクルシーケンス反応及び塩基配列の決定を行った。当該操作を繰り返し、上述のとおり、Tmerg1構造遺伝子を含む約4600 bpの領域の塩基配列(配列番号5)を決定した。この際に用いたプライマーの配列を配列番号18〜26に示した。
【0084】
(3-2)バイナリベクターの作製
TmL28株のゲノムDNAを鋳型としてPCRを行い、Tmerg1の開始コドン上流約2000 bp領域(upstream Homologus Region, HR1)(配列番号6)、及びTmerg1の開始コドン下流約2000 bp領域(downstream Homologus Region, HR2; Tmerg1の構造遺伝子の全長を含む)(配列番号7)を相同組換えに用いる相同領域として増幅した。
【0085】
増幅されたHR1の5'-末端及び3'-末端にはSpeI認識配列が付加されている。増幅されたHR1を、Mighty Cloning Kit (Blunt End) (TaKaRa)を用いる平滑末端ライゲーション法によって、pUC118のHincIIサイトに挿入した。
【0086】
上記(2-1)と同様の条件でOE-PCR法を用いて、配列番号1のDNA断片とHR-2のDNA断片をこの順序で連結し、本発明の銅イオン応答性プロモーターとTmerg1構造遺伝子の融合遺伝子を含む断片「Pctr4-HR2」(配列番号8)を得た。Pctr4-HR2の5'-末端にはKpnI認識配列が、3'-末端にはSacI認識配列が付加されている。Pctr4-HR2を、Mighty Cloning Kit (Blunt End) (TaKaRa)を用いる平滑化末端ライゲーション法によって、pUC118のHincIIサイトに挿入した。
【0087】
pAg1バイナリベクターに選択マーカー遺伝子としてハイグロマイシン耐性マーカーカセット(配列番号9)を組込んだバイナリベクターpAg1-hph(Medical Mycology 2009, 47, 485-494.)を基にTmerg1発現調節株作製用のバイナリベクターを作製した。まず、pAg1-hphをKpnI(Roche)及びSacI(Roche)で完全に消化し、0.8%アガロースゲル電気泳動に供した後、DNA断片をゲルから切り出し、QIAquick Gel Extraction Kit (QIAGEN)で精製した。
【0088】
上記において作製したPctr4-HR2が挿入されたpUC118ベクターをKpnI及びSacIで完全に消化し、切り出されたPctr4-HR2を0.8%アガロースゲル電気泳動に供することにより分離し、ゲルから回収した。回収したPctr4-HR2をQIAquick Gel Extraction Kit (QIAGEN)で精製した。当該Pctr4-HR2をKpnI及びSacIで完全消化したpAg1-hphとライゲーションして「pAg1-hph/Pctr4-HR2」を得た。
【0089】
上記pAg1-hph/Pctr4-HR2をSpeIで完全に消化し、0.8%アガロースゲル電気泳動に供した後、DNA断片をゲルから回収し、QIAquick Gel Extraction Kit (QIAGEN)で精製した。
上記において作製したHR1を挿入したpUC118ベクターをSpeI(Roche)で完全に消化し、切り出したHR1を0.8%アガロースゲル電気泳動に供することにより分離し、ゲルから回収した。回収したHR1をQIAquick Gel Extraction Kit (QIAGEN)で精製した。当該HR1をSpeIで完全に消化したpAg1-hph/Pctr4-HR2とライゲーションした。
【0090】
以上のようにして、Tmerg1発現調節株作製用のバイナリベクター「pAg1-hph/Pctr4-HR2/HR1」を得た。
(3-3)宿主株の形質転換
上記(3-2)において得られたバイナリベクターpAg1-hph/Pctr4-HR2/HR1を用いて、実施例2と同様にアグロバクテリウム法によりTmL28株を形質転換し、ハイグロマイシンを含む選択培地を用いて形質転換体を選抜した。その結果、Tmerg1遺伝子の上流に配列番号1の銅イオン応答性プロモーターが導入された形質転換体「Tmerg1発現調節株」が得られた(図3)。
【0091】
Tmerg1発現調節株を10μMのBCS(和光純薬)、10μMの硫酸銅(II)、又は100μMの硫酸銅(II)を添加したMOPS緩衝RPMI1640寒天培地に3×103cells/spotで接種し、28℃で4日間培養し、発育状態を観察した(図4)。対照として、形質転換していないTmL28株も同様に培養し、発育状態を観察した。
【0092】
図4に示されるように、10μM又は100μMの硫酸銅(II)を添加した培地におけるTmerg1発現調節株の発育は、10μMのBCSを添加した培地における発育に比べて、顕著に阻害された。また、硫酸銅(II)の濃度が高いほど強く発育が強く阻害された。一方、形質転換していないTmL28株は、いずれの培地においても同程度の発育を示すことが確認された。
【0093】
これらの結果から、銅イオン応答性プロモーターによってTmerg1遺伝子の発現が抑制された結果、形質転換体の発育が阻害されたことが示された。
【実施例4】
【0094】
遺伝子発現を致死的でないレベルに抑制した条件で行う薬剤感受性試験
実施例3において作製したTmerg1発現調節株を用いて、Tmerg1遺伝子の発現を致死的でないレベルに抑制した条件において各種抗真菌活性化合物に対する感受性を評価した。
【0095】
(4-1)Tmerg1遺伝子の発現を抑制するために培地に添加する銅イオン濃度の検討
まず、Tmerg1遺伝子の発現を致死的でないレベルに抑制するために培地に添加する銅イオン濃度について検討した。Tmerg1発現調節株をMOPS緩衝RPMI 1640液体培地において培養する際に、硫酸銅(II)を1μM、10μM並びに50μMの濃度で添加し、28℃で4日間静置培養した。培養後、Tmerg1発現調節株の発育を目視判定により評価した。その結果、硫酸銅(II)を10μM並びに50μMの濃度で培地に添加した場合においては、Tmerg1発現調節株の発育は著しく抑制され、薬剤感受性試験には不適と考えられた。一方、1μMの濃度で添加した場合は十分な発育が観察された。したがって、薬剤感受性試験は硫酸銅(II)を1μMの濃度で培地に添加した条件で行うこととした。また、前記培養条件では宿主株TmL28の発育に対する明確な抑制作用は観察されなかった。
【0096】
(4-2)薬剤感受性試験
TmL28株及びTmerg1発現調節株の各種抗真菌活性化合物に対する薬剤感受性をミクロ液体希釈法を用いて測定した。試験化合物は以下に示す濃度範囲で2倍希釈系列を作製した。
【0097】
テルビナフィン(東京化成工業) :0.098〜0.000048μg/mL
リラナフタート(CGeneTech) :0.098〜0.000048μg/mL
イトラコナゾール(シグマ) :0.78〜0.00038μg/mL
アモロルフィン(東京化成工業) :0.78〜0.00038μg/mL
グリセオフルビン(シグマ) :6.25〜0.0031μg/mL
アムホテリシンB(Fluka) :6.25〜0.0031μg/mL
96ウェルプレートの各ウェルにMOPS緩衝RPMI 1640液体培地(硫酸銅(II)を終濃度1μMとなるように添加)、試験化合物及び菌液(終濃度:1×103cells/mL)を分注し(全量200μL)、28℃で4日間静置培養した。培養後、TmL28株及びTmerg1発現調節株の発育を目視判定により評価した。発育コントロールと比較して80%以上の発育阻止作用が観察されたウェルの最小濃度を最小発育阻止濃度(MIC)として判定した。
【0098】
薬剤感受性試験の結果として、TmL28株及びTmerg1発現調節株に対する各試験化合物のMICを表1に示した。
【0099】
【表1】

【0100】
Tmerg1発現調節株に対するテルビナフィン及びリラナフタートのMICは、TmL28株と比較して、それぞれ1/8及び1/32に低下した。これは、TmL28株と比較して、Tmerg1発現調節株のテルビナフィン及びリラナフタートに対する感受性が、それぞれ8倍、32倍高くなったことを意味する。一方、他の試験化合物のMICは両株間で顕著な差は見られなかった。ここで、テルビナフィン及びリラナフタートの作用機作はスクアレンエポキシダーゼ(erg1)阻害、イトラコナゾールの作用機作はラノステロール14α-デメチラーゼ(erg11)阻害、アモロルフィンの作用機作はC-8ステロールイソメラーゼ(erg2)阻害及びC-14ステロールリダクターゼ(erg24)阻害、グリセオフルビンの作用機作は微小管の機能阻害、アムホテリシンの作用機作は真菌細胞膜に対する直接的障害作用とされている。したがって、本結果より、erg1遺伝子の発現が抑制された条件においては、当該遺伝子の機能を阻害するような化合物に対する感受性が特異的に高くなることが示された。
【0101】
この実施例の結果より、本発明の方法は、標的遺伝子の機能を阻害するような化合物を高感度でスクリーニングするための優れた方法であることが明らかである。そして、erg1遺伝子以外の様々な遺伝子を標的遺伝子とする発現調節株を作製すれば、これら遺伝子の機能を阻害するような化合物を高感度でスクリーニングすることができることも理解できる。
【0102】
さらに、抗真菌活性を有するが作用機構が未知又は推測されているに過ぎない試験化合物が作用する遺伝子又はタンパク質を同定することにも、本発明を利用できることが理解できる。例えば、様々な遺伝子を標的遺伝子とする発現調節株を作製し、試験化合物で処理された発現調節株の表現型と、同様に処理された形質転換されていない宿主株の表現型を比較し、発現調節株が試験化合物に対して高い感受性を示すことを指標として、試験化合物が作用する遺伝子又はタンパク質を同定することができる。
【技術分野】
【0001】
本発明は銅イオンに対する応答性を示すプロモーター、当該プロモーターを有する発現ベクター、当該発現ベクターを含む形質転換体、及び当該形質転換体を用いる遺伝子の機能解析方法および化合物のスクリーニング方法に関する。
【背景技術】
【0002】
白癬は国内における患者数が2000万人以上と推定される非常に患者数の多い難治性の表在性真菌症であり、その感染制御は重要な課題である。しかしながら、感染制御対策を講じるために必要とされる白癬菌の感染メカニズムや薬剤標的分子等に関する知見は、細菌に比べて限られている。
【0003】
その原因として、白癬菌においては、遺伝子破壊をはじめとする分子生物学的手法が容易に行えないことが挙げられる。近年、部位特異的遺伝子導入を白癬菌において比較的高い効率で行う方法が報告され、白癬菌の遺伝子破壊株が作製できるようになった(非特許文献1)。しかしながら、感染制御に関して有用な遺伝子の多くが含まれる、菌の発育に必須の遺伝子については、原理的に遺伝子破壊株を作製することが困難であるため、解析することができない。
【0004】
菌の生育に必須の遺伝子について解析を行うためには標的遺伝子の発現を人為的に調節するシステム、即ち遺伝子発現調節系が必要である。遺伝子発現調節系は標的遺伝子の上流に、転写活性の制御が可能なプロモーター(コンディショナルプロモーター)を導入し、標的遺伝子の発現を制御しようとするものである。カンジダ・アルビカンス(Candida albicans)(特許文献1)、アスペルギルス・フミガタス(Aspergillus fumigatus)(特許文献2)等の病原真菌においては、遺伝子発現調節系が構築されており、生存に必須な遺伝子が幾つか見出されている。
【0005】
そして、近年、クリプトコックス・ネオフォルマンス(Cryptococcus neoformans)(非特許文献2)やヒストプラスマ・カプスラーツム(Histoplasma capsulatum)(非特許文献3)において、銅イオン応答性のコンディショナルプロモーターが単離されている。さらに、クリプトコックス・ネオフォルマンスにおいては発現調節系が構築され、遺伝子の生存必須性の解析に使用されている(非特許文献4及び5)。
【0006】
しかし、真菌の遺伝子発現プロセスは複雑であり、ある属において機能するコンディショナルプロモーターが他の属においては必ずしも効率よく機能するとは限らない。また、白癬菌における分子生物学的な実験の実施は容易ではなく、白癬菌において効率的に機能するコンディショナルプロモーターは見出されていない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特表2003-523197
【特許文献2】特表2005-522980
【非特許文献】
【0008】
【非特許文献1】Alshahni MM, Yamada T, Takatori K, Sawada T, Makimura K., Insights into a nonhomologous integration pathway in the dermatophyte Trichophyton mentagrophytes: efficient targeted gene disruption by use of mutants lacking ligase IV., Microbiol Immunol. 2011 Jan;55(1):34-43.
【非特許文献2】Ory JJ, Griffith CL, Doering TL., An efficiently regulated promoter system for Cryptococcus neoformans utilizing the CTR4 promoter., Yeast. 2004 Aug;21(11):919-26.
【非特許文献3】Gebhart D, Bahrami AK, Sil A., Identification of a copper-inducible promoter for use in ectopic expression in the fungal pathogen Histoplasma capsulatum., Eukaryot Cell. 2006 Jun;5(6):935-44.
【非特許文献4】Methee Chayakulkeeree, Thomas H. Rude, Dena L. Toffaletti, and John R., Fatty Acid Synthesis Is Essential for Survival of Cryptococcus neoformans and a Potential Fungicidal Target., Antimicrobial Agents and Chemotherapy, 2007; 51: 3537-3545.
【非特許文献5】Tricia A. Missall and Jennifer K. Lodge., Thioredoxin Reductase Is Essential for Viability in the Fungal Pathogen Cryptococcus neoformans., Eukaryotic Cell. 2005; 4: 487-489.
【非特許文献6】Yamada T, Makimura K, Hisajima T, Ishihara Y, Umeda Y, Abe Shigeru., Enhanced gene replacements in Ku80 disruption mutants of the dermatophyte, Trichophyton mentagrophytes., FEMS Microbiol. Lett. 2009 Jul;298:208-217.
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、白癬菌において効率的に機能する発現調節系を提供することを目的とする。
【課題を解決するための手段】
【0010】
上記の事情に鑑み、本発明者らは、白癬菌由来の銅イオン応答性プロモーターの探索に着手した。鋭意検討の結果、銅イオン応答性プロモーターが白癬菌に存在することを明らかにし、当該プロモーター配列を明らかにすることに成功した。かかる知見に基づいて本発明を完成させた。
【0011】
本発明は(1)の銅イオン応答性プロモーターを提供する。
(1)以下の(a)、(b)、及び(c)からなる群から選択されるDNAを含む、銅イオン応答性プロモーター:
(a)配列番号1又は2の塩基配列からなるDNA、
(b)配列番号1又は2の塩基配列において1又は複数の塩基が欠失、置換、又は付加された塩基配列からなり、かつ銅イオン応答性プロモーターとして機能するDNA、及び
(c)配列番号1又は2の塩基配列と相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつ銅イオン応答性プロモーターとして機能するDNA。
【0012】
別の側面によれば、本発明は(2)の融合遺伝子を提供する。
(2)(1)に記載のプロモーターの下流に、以下の(a)、(b)、及び(c)からなる群から選択されるDNAを連結した融合遺伝子:
(a)宿主細胞の構造遺伝子のDNA、
(b)宿主細胞の構造遺伝子に対するアンチセンス配列からなるDNA、及び
(c)外来性の構造遺伝子のDNA。
【0013】
別の側面によれば、本発明は(3)の発現ベクターを提供する。
(3)(1)に記載のプロモーター又は(2)に記載の融合遺伝子を含む発現ベクター。
別の側面によれば、本発明は(4)〜(6)の形質転換体を提供する。
【0014】
(4)(3)に記載の発現ベクターを含む形質転換体。
(5)発現ベクターが真菌細胞に導入された(4)に記載の形質転換体。
(6)真菌細胞が白癬菌に由来する、(5)に記載の形質転換体。
【0015】
別の側面によれば、本発明は(7)の遺伝子の機能解析方法を提供する。
(7)以下の(a)、(b)、及び(c)を含む、遺伝子の機能解析方法:
(a)(4)〜(6)のいずれかに記載の形質転換体を培養培地中で培養する工程、
(b)前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御する工程、及び
(c)形質転換体と形質転換されていない宿主の表現型を比較し、表現型の変化に基づいて遺伝子の機能を判断する工程。
【0016】
別の側面によれば、本発明は(8)及び(9)の化合物のスクリーニング方法を提供する。
(8)以下の(a)、(b)、(c)、及び(d)を含む、化合物のスクリーニング方法:
(a)(4)〜(6)のいずれかに記載の形質転換体を培養培地中で培養する工程、
(b)前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御して、遺伝子産物の発現量を致死的でないレベルに低下させる工程、
(c)試験化合物を形質転換体と接触させる工程、及び
(d)試験化合物の処理による形質転換体の表現型の変化に基づいて、銅イオン応答性プロモーターによって発現が制御される遺伝子の機能に対する試験化合物の影響を判断する工程。
【0017】
(9)試験化合物が形質転換体の増殖を阻止するかどうかを判断することにより試験化合物の影響を判断する、(8)に記載のスクリーニング方法。
別の側面によれば、本発明は(10)及び(11)の遺伝子又はタンパク質の同定方法を提供する。
【0018】
(10)以下の(a)、(b)、(c)、及び(d)を含む、試験化合物が作用する遺伝子又はタンパク質の同定方法:
(a)請求項4〜6のいずれか1項に記載の1種類又は複数種類の形質転換体を培養培地中で培養する工程、
(b)前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御して、遺伝子産物の発現量を致死的でないレベルに低下させる工程、
(c)試験化合物を形質転換体と接触させる工程、及び
(d)試験化合物で処理された形質転換体の表現型と、試験化合物で処理された形質転換されていない宿主株の表現型を比較することにより、試験化合物が作用する遺伝子又はタンパク質を同定する工程。
【0019】
(11)試験化合物で処理された形質転換されていない宿主株の増殖に比べて、試験化合物で処理された形質転換体の増殖が阻止されるかどうかを判断することにより、試験化合物が作用する遺伝子又はタンパク質を同定する、(10)に記載の遺伝子又はタンパク質の同定方法。
【発明の効果】
【0020】
本発明により提供される銅イオン応答性プロモーターによれば、当該プロモーターの下流に連結された遺伝子の発現を銅イオンによって制御することが可能となる。さらに、形質転換体の表現型の変化に基づいた遺伝子機能の解析並びに当該遺伝子の機能に影響する化合物のスクリーニングが可能である。
【図面の簡単な説明】
【0021】
【図1】β−ガラクトシダーゼレポーターアッセイに用いる形質転換体を作製するための、バイナリベクターの物理地図と相同組換えの模式図である。
【図2】β−ガラクトシダーゼレポーターアッセイの結果を示す図である。硫酸銅_10μM:硫酸銅(II)10μMを培地に添加、硫酸銅_100μM:硫酸銅(II)100μMを培地に添加。
【図3】Tmerg1発現調節株作製用のバイナリベクターの物理地図と相同組換えの模式図である。
【図4】Tmerg1発現調節株の生育の様子を示す写真である。BCS_10μM:バソクプロイン二硫酸塩10μMを培地に添加、硫酸銅_10μM:硫酸銅(II)10μMを培地に添加、硫酸銅_100μM:硫酸銅(II)100μMを培地に添加。
【発明を実施するための形態】
【0022】
以下、本発明をより詳細に説明する。
本発明は、銅イオン応答性プロモーターを提供する。本発明の銅イオン応答性プロモーターは、銅イオンに応答してプロモーター活性が制御されるいずれのプロモーターであってもよい。そのようなプロモーターは、好ましくは:
(a)配列番号1又は2の塩基配列からなるDNA、
(b)配列番号1又は2の塩基配列において1又は複数の塩基が欠失、置換、又は付加された塩基配列からなり、かつ銅イオン応答性プロモーターとして機能するDNA、及び
(c)配列番号1又は2の塩基配列と相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつ銅イオン応答性プロモーターとして機能するDNA、
からなる群から選択されるDNAを含む。
【0023】
配列番号1の塩基配列は、トリコフィトン・ルブラムCBS118892株における構造遺伝子TERG_01401の開始コドンの上流1283 bpに由来する。ここで、TERG_01401は銅イオントランスポーターをコードする遺伝子(以下、ctr4ということもある)のトリコフィトン・ルブラムにおけるホモログである。配列番号1の塩基配列とクリプトコックス・ネオフォルマンス由来ctr4遺伝子の開始コドン上流1300 bpの塩基配列との間に高い相同性は認められなかった。
【0024】
また、配列番号2の塩基配列は、トリコフィトン・ルブラムCBS118892株における構造遺伝子TERG_07477の開始コドンの上流1290 bpに由来する。ここで、TERG_07477は銅イオン排出ポンプをコードする遺伝子(以下、crp1ということもある)のトリコフィトン・ルブラムにおけるホモログである。配列番号2に記載の塩基配列とヒストプラスマ・カプスラーツム由来crp1遺伝子の開始コドンの上流1300 bpの塩基配列との間に高い相同性は認められなかった。
【0025】
本発明の銅イオン応答性プロモーターの活性は、銅イオンにより制御される。銅イオンは、例えば硫酸銅(II)、塩化銅(I)、及び塩化銅(II)等により供給することができる。銅イオンの濃度は、銅イオン応答性プロモーターの活性を制御するために有効な濃度であればよく、例えば、1nM〜1mM、好ましくは100nM〜500μM、より好ましくは100nM〜300μM、さらに好ましくは100nM〜100μMである。具体例としては、ctr4プロモーターの活性を制御する銅イオンの濃度は、例えば1nM〜1mM、好ましくは100nM〜500μM、より好ましくは100nM〜100μMである。また、crp1プロモーターの活性を制御する銅イオンの濃度は、例えば1nM〜1mM、好ましくは100nM〜500μM、より好ましくは100nM〜100μMである。
【0026】
本発明のプロモーターは、銅イオン応答性を有する限り、トリコフィトン・ルブラム以外の他の生物種に由来するものであってもよい。即ち、配列番号1又は2の塩基配列と類似する他の生物種由来の転写制御領域に存在する塩基配列が、銅イオン応答性を示す限り、本発明の銅イオン応答性プロモーターとして使用可能である。そのようなプロモーターとして、例えば、配列番号1又は2の塩基配列において1又は複数の塩基が欠失、置換、又は付加された塩基配列からなる、銅イオン応答性プロモーターとして機能するDNAが挙げられる。
【0027】
本明細書でいう複数の塩基とは、2以上の塩基をいうが、好ましくは2〜10個の塩基、より好ましくは2〜5個の塩基、さらに好ましくは2〜3個の塩基を意味する。
本明細書でいうストリンジェントな条件とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。そのような条件の例としては、配列番号1又は2の配列と相同性の高いDNAが、配列番号1又は2の塩基配列と相補的な塩基配列からなるDNAとハイブリダイズし、それより低い相同性のDNAが前記相補的な塩基配列からなるDNAとハイブリダイズしない条件が挙げられる。本明細書でいう相同性が高いとは、相同性が60%以上、好ましくは70%以上、より好ましくは80%以上、さらに好ましくは90%以上、特に好ましくは95%以上を意味する。ストリンジェントな条件の具体例としては、68℃、0.1×SSC、0.1%SDSといった条件が挙げられる。
【0028】
本発明の銅イオン応答性プロモーターは、標的遺伝子と連結させることができる。本明細書でいう標的遺伝子とは、銅イオン応答性プロモーターによって発現が制御される遺伝子をいう。このように銅イオン応答性プロモーターと標的遺伝子が連結したDNAを融合遺伝子という。ここで、標的遺伝子は、銅イオン応答性プロモーターによって発現が制御される限り、当該プロモーターとどの位置で連結させてもよい。例えば、標的遺伝子は、当該プロモーターの下流、好ましくは当該プロモーターの直後に連結させることができる。本発明の銅イオン応答性プロモーターと標的遺伝子の連結は、当該技術分野における公知の方法に従って行うことができる。本発明における標的遺伝子としては、宿主細胞が元来保有している構造遺伝子、宿主細胞の構造遺伝子に対するアンチセンス配列、及び外来性の構造遺伝子等を用いることができる。
【0029】
上記の宿主細胞が元来保有している構造遺伝子としては、宿主の生存、生育、薬剤耐性、感染性等において重要な遺伝子が挙げられる。その構造遺伝子の機能は、未知であっても既知であってもよい。本発明においては、機能が未知であるが宿主の生存、生育、薬剤耐性、感染性等に必須の構造遺伝子を用いることができる。また、機能が既知の構造遺伝子の具体例としては、スクワレンエポキシダーゼが挙げられる。
【0030】
宿主細胞の構造遺伝子に対するアンチセンス配列としては、上記宿主細胞の構造遺伝子のアンチセンス配列が挙げられる。具体例として、スクワレンエポキシダーゼ遺伝子のアンチセンス配列が挙げられる。
【0031】
上記外来性の構造遺伝子としては、レポーター遺伝子:β―ガラクトシダーゼ遺伝子(lacZ)、ルシフェラーゼ遺伝子、緑色蛍光タンパク質遺伝子、β―グルクロニダーゼ遺伝子、クロラムフェニコールアセチルトランスフェラーゼ遺伝子等が挙げられる。例えば、標的遺伝子としてレポーター遺伝子を適用すれば、銅イオン応答性プロモーターが導入された形質転換体において、当該プロモーターが銅イオン応答性を示すことを評価する上で便利である。
【0032】
本発明の別の側面によれば、銅イオン応答性プロモーター又は融合遺伝子を含む発現ベクターが提供される。本発明の発現ベクターの作製に用いる基礎となるベクターは、新たに作製してもよいが、当該技術分野において入手可能なベクターを用いて作製するのが簡便である。当該技術分野において入手可能なベクターとしては、宿主細胞内で自律複製可能なプラスミド型ベクター、又は宿主染色体中に組込み可能な染色体導入型ベクターが挙げられる。具体的には、大腸菌由来プラスミドベクター(pUC118、pCR2.1、pBR322、pBlueScript等)、バイナリベクター(pAg1、pBIN19、pGREEN等)が挙げられる。本発明の発現ベクターは、本発明の銅イオン応答性プロモーター又は融合遺伝子を上記した基礎となるベクターに挿入することによって得ることができる。このような挿入は、当業者に公知の方法に従って行うことができる。
【0033】
本発明の発現ベクターは、本発明の銅イオン応答性プロモーター及び融合遺伝子に加えて、発現ベクターを導入する宿主細胞のゲノムにおける一部の領域と相同な領域を有していてもよい。このような相同領域を有することによって、本発明の銅イオン応答性プロモーター又は融合遺伝子を相同組換えにより宿主染色体に部位特異的に組み込むことが可能になる。
【0034】
上記の相同な領域は、本発明の発現ベクター中に、1つ又は複数個、具体的には2つ存在させることができる。そして、その長さは300 bp以上であることが好ましく、具体的には1000 bp〜2000 bp程度である。
【0035】
本発明の発現ベクターは、銅イオン応答性プロモーター、標的遺伝子、相同領域の他、選択マーカー遺伝子、リコンビナーゼ認識配列等を含むことができる。選択マーカー遺伝子としては、カナマイシン耐性遺伝子、アンピシリン耐性遺伝子、ハイグロマイシン耐性遺伝子、ネオマイシン耐性遺伝子等が挙げられる。また、リコンビナーゼ認識配列としては、Creリコンビナーゼ認識配列、Flpリコンビナーゼ認識配列等が挙げられる。
【0036】
本発明の別の側面によれば、本発明の発現ベクターが導入された形質転換体が提供される。当該形質転換体は、適当な宿主に本発明の発現ベクターを導入することにより得ることができる。本明細書でいう宿主とは、標的遺伝子を発現できる細胞であればよい。例えば、微生物、動物細胞、昆虫細胞、及び植物細胞等が挙げられるが、微生物が好ましい。微生物としては真菌が好ましく、具体的には、白癬菌、コクシジオイデス(Coccidioides)属、パラコクシジオイデス(Paracoccidioides)属、ヒストプラスマ(Histoplasma)属、ブラストマイセス(Blastomyces)属、及びアスペルギルス(Aspergillus)属等真菌が挙げられる。本明細書でいう白癬菌とは、ヒト又は動物に感染する皮膚糸状菌を指す。白癬菌の例としては、トリコフィトン(Trichophyton)属、ミクロスポラム(Microsporum)属、エピデルモフィトン(Epidermophyton)属等真菌が挙げられる。より具体的には、トリコフィトン・ルブラム、トリコフィトン・メンタグロフィテス、トリコフィトン・トンズランス、トリコフィトン・ビオラセウム、トリコフィトン・ベルコサム、ミクロスポラム・カニス、ミクロスポラム・ギプセウム、エピデルモフィトン・フロコスム等が挙げられる。また、トリコフィトン・メンタグロフィテス(Trichophyton mentagrophytes)は、複数の異なる菌種からなるコンプレックスであり、これまでに3種の有性世代が確認されている。当該3種の有性世代名は、アルスロデルマ・ベンハミエ(Arthroderma benhamiae)、アルスロデルマ・バンブルゼミイ(Arthroderma vanbreuseghemii)、アルスロデルマ・シミイ(Arthroderma simii)である。
【0037】
真菌に導入された本発明の発現ベクターは、染色体中に組込まれた形で維持される。本発明の発現ベクターの宿主への導入は、当業者間でよく知られた方法によって行うことができる。例えば、宿主として真菌を用いる場合は、アグロバクテリウム法、ポリエチレングリコール(PEG)法、エレクトロポレーション法等を用いて発現ベクターを導入することができる。
【0038】
本発明の発現ベクターは、上記真菌に導入するのみならず、大腸菌(Escherichia coli)及びアグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)等の細菌に導入して形質転換体を得ることができる。細菌を宿主とする場合は、本発明の発現ベクターは宿主細胞内で自己複製されて維持されることが望ましい。細菌細胞内への発現ベクターの導入には、カルシウムイオンを用いる方法、及びエレクトロポレーション法等を用いることができる。
【0039】
本発明の銅イオン応答性プロモーターと標的遺伝子の融合遺伝子が宿主の染色体に組込まれたか否かの確認は、PCR法及びサザンブロットハイブリダイゼーション法等により行うことができる。
【0040】
本発明の別の側面によれば、本発明の形質転換体を用いる遺伝子の機能解析方法が提供される。当該方法は、(a)本発明の銅イオン応答性プロモーター及びその下流に連結された標的遺伝子を含む形質転換体を培養培地中で培養する工程;(b)前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御する工程;(c)形質転換体と形質転換されていない宿主の表現型を比較し、表現型の変化に基づいて遺伝子の機能を判断する工程;を含む。
【0041】
形質転換体の培養は、いずれの培養培地、例えば、液体培地、及び固体培地等、当業者間で知られているいずれの培養培地を用いて行うことができる。銅イオン応答性プロモーターのプロモーター活性の制御を的確に行う観点から、銅イオンを含まない培地成分から培地を調製することが好ましい。このような培地として、例えば合成培地であるRPMI1640が市販品として入手可能である。また、このような培地に銅イオンのキレート剤を添加し、銅イオンがより厳密に除去された培地を調製することもできる。一方、サブローデキストロース培地等の非合成培地も形質転換体の培養に用いることができる。しかし、銅イオンを含有しているため、銅イオンのキレート剤を併用し、銅イオンを除去する必要がある。
【0042】
本明細書でいう銅イオンのキレート剤としては、バソクプロイン二硫酸塩(bathocuproine disulfonate, BCS)、テトラチオモリブデート、塩酸トリエンチン、D−ペニシラミン、及びエチレンジアミン四酢酸等が挙げられる。銅イオンのキレート剤は、銅イオンが除去されるのに有効な濃度、例えば、1 nM〜1 mM、好ましくは1μM〜100μMで培養培地に添加することができる。そして、形質転換体の接種量、培養温度、及び培養時間等のその他の培養条件は、当業者が適宜設定することが可能である。
【0043】
上記のような培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御することができる。これにより、銅イオン応答性プロモーターのプロモーター活性を任意に制御することが可能となる。ここでいう銅イオンとして、例えば、硫酸銅(II)、塩化銅(I)、及び塩化銅(II)等を使用することができる。そして、銅イオン濃度は、銅イオン応答性プロモーターのプロモーター活性を制御するために有効な濃度であればよい。例えば、培養培地中の銅イオン濃度は、1nM〜1mM、好ましくは100nM〜500μM、より好ましくは100nM〜300μM、さらに好ましくは100nM〜100μMに調節することができる。具体例としては、ctr4プロモーターの活性を制御する銅イオンの濃度は、例えば1nM〜1mM、好ましくは100nM〜500μM、より好ましくは100nM〜100μMである。また、crp1プロモーターの活性を制御する銅イオンの濃度は、例えば1nM〜1mM、好ましくは100nM〜500μM、より好ましくは100nM〜100μMである。
【0044】
銅イオンによる銅イオン応答性プロモーターの活性制御の一態様として、例えば、Pctr4を含む形質転換体の培養において、形質転換体と銅イオンを接触させることによって、Pctr4のプロモーター活性を阻害することができる。そして、培養培地からキレート剤を用いて銅イオンを除去することにより、Pctr4のプロモーター活性を活性化することができる。このようなPctr4によって発現が制御されている標的遺伝子及び当該遺伝子産物も、銅イオンによって発現が阻害され、銅イオンの除去によって発現が活性化される。
【0045】
銅イオンによる銅イオン応答性プロモーターの活性制御の別の態様として、Pcrp1を含む形質転換体の培養においては、上記のPctr4を含む形質転換体とは逆の制御を行うことができる。即ち、Pcrp1のプロモーター活性は、銅イオンにより活性化され、銅イオンの除去によって活性阻害を受ける。このようなPcrp1によって発現が制御されている標的遺伝子及び当該遺伝子産物も、銅イオンによって発現が活性化され、銅イオンの除去によって発現が阻害される。
【0046】
銅イオン応答性プロモーターを含有する形質転換体を上記のように培養し、形質転換されていない宿主と表現型を比較し、表現型の変化に基づいて遺伝子の機能を判断する。本明細書でいう表現型とは、発育(例えば、発育形態及び発育速度等)、プロテアーゼ等の病原因子産生能、薬剤感受性等を意味する。
【0047】
本発明の方法は、生存に必須の遺伝子の機能を解析することにおいて特に有効である。一般的に、生存に必須の遺伝子の発現を完全に破壊すると菌が死滅する可能性が高いため、このような遺伝子の機能解析は困難であった。本発明によれば、培地中の銅イオン濃度によって銅イオン応答性プロモーターの活性を制御できるため、当該プロモーターによって制御されている標的遺伝子の発現を任意に制御することができる。すなわち、プロモーター活性が活性化された条件においては生育可能なレベルの遺伝子発現量を供給し、プロモーター活性が抑制された条件においては遺伝子発現を致死的なレベル又は致死的でないレベルに低下させることができる。その低下率は各遺伝子毎で異なるが、形質転換されていない宿主における構造遺伝子の発現量に対して、例えば20%以上、好ましくは30%以上、より好ましくは40%以上にすることができる。
【0048】
より具体的には、遺伝子発現の致死的なレベルにおける構造遺伝子の発現の低下率は、形質転換されていない宿主における構造遺伝子の発現量に対して、例えば80%以上、好ましくは90%以上、より好ましくは99%以上である。一方、遺伝子発現の致死的でないレベルにおける構造遺伝子の発現の低下率は、形質転換されていない宿主における構造遺伝子の発現量に対して、例えば20〜70%、好ましくは30〜70%、より好ましくは40〜70%である。
【0049】
表現型の変化に基づく標的遺伝子の機能の判断は、例えば、形質転換されていない宿主に比べて形質転換体の発育、例えば発育速度が変化している場合には、銅イオン応答性プロモーターによって発現制御を受けている構造遺伝子(標的遺伝子)が発育に重要な役割を担っていると判断することができる。
【0050】
本発明の別の側面によれば、化合物のスクリーニング方法が提供される。当該スクリーニング方法は、本発明の銅イオン応答性プロモーター及びその下流に連結された標的遺伝子を含む形質転換体を培養培地中で培養する工程;前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御して、遺伝子産物の発現量を致死的でないレベルに低下させる工程;試験化合物を形質転換体と接触させる工程;試験化合物の処理による形質転換体の表現型の変化に基づいて、銅イオン応答性プロモーターによって発現が制御される遺伝子の機能に対する試験化合物の影響を判断する工程を含む。
【0051】
当該スクリーニング方法の利点は、形質転換体は生存に必須な標的遺伝子の発現が特異的に低下されているため、標的遺伝子に対して活性を有する化合物に対する感受性が高くなっている。即ち、標的遺伝子に対して有効である化合物を高感度で検出することが可能となり、構造活性相関についてより広い情報を得ることができる。
【0052】
本発明のスクリーニング方法の一態様としては、本発明の銅イオン応答性プロモーター及びその下流に連結された標的遺伝子を含む形質転換体を培養培地中で培養する工程;前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御して、遺伝子産物の発現量を致死的でないレベルに低下させる工程;試験化合物を形質転換体と接触させる工程;試験化合物の処理による形質転換体の表現型の変化に基づいて、銅イオン応答性プロモーターによって発現が制御される遺伝子の機能に対する試験化合物の影響を判断する工程;試験化合物で処理された形質転換体の表現型と、試験化合物で処理された形質転換されていない宿主株の表現型を比較することにより、試験化合物が作用する遺伝子又はタンパク質を同定する工程を含む。
【0053】
前記スクリーニング方法においては、抗真菌活性を有するが作用する遺伝子又はタンパク質が未知あるいは推測されているに過ぎない化合物を試験化合物として用いることができる。即ち、銅イオンと接触させた条件において、宿主株と比較して形質転換体が試験化合物に対して高い感受性を示すことを指標として、当該化合物が作用する遺伝子又はタンパク質を同定することができる。
【0054】
ここで、「高い感受性」とは、宿主株と比較して、形質転換体の試験化合物に対する感受性が、例えば、4倍以上、好ましくは8倍以上高くなることをいう。
【実施例】
【0055】
実施例により本発明を具体的に説明するが、本発明の範囲はこれに限定されるものではない。
【実施例1】
【0056】
銅イオン応答性プロモーターの単離
(1-1)トリコフィトン・ルブラムCBS118892株におけるctr4ホモログのプロモーター
トリコフィトン・ルブラムCBS118892株から銅イオン応答性プロモーターを取得することを試みた。トリコフィトン・ルブラムCBS118892株については、ゲノムの全塩基配列が公開されている(http://www.broadinstitute.org/)ので、当該ゲノムの塩基配列を利用した。クリプトコックス・ネオフォルマンスに由来する公知のctr4遺伝子の配列を用いて、トリコフィトン・ルブラムCBS118892株のゲノム全塩基配列に対してホモロジー検索を実施した。その結果、トリコフィトン・ルブラムCBS118892株におけるctr4ホモログとしてTERG_01401(配列番号10)が同定された。
【0057】
TERG_01401の開始コドン上流約1300 bpを当該遺伝子の転写制御領域(プロモーター)と推定し、当該転写制御領域の遺伝子を増幅させるためにトリコフィトン・ルブラムCBS118892株から調製したトータルDNAを鋳型として、PCRを行った。PCRによって増幅された1283 bpの遺伝子(配列番号1)を回収した。当該遺伝子を以降の実験に用いた。
【0058】
(1-2)トリコフィトン・ルブラムCBS118892株におけるcrp1ホモログのプロモーター
上記(1-1)と同様に、ヒストプラスマ・カプスラーツムに由来する公知のcrp1遺伝子の配列を用いて、トリコフィトン・ルブラムCBS118892株のゲノム全塩基配列に対してホモロジー検索を実施した。その結果、トリコフィトン・ルブラムCBS118892株におけるcrp1ホモログとしてTERG_07477(配列番号11)が同定された。
【0059】
TERG_07477の開始コドン上流約1300 bpを当該遺伝子の転写制御領域(プロモーター)と推定し、当該転写制御領域の遺伝子を増幅させるためにトリコフィトン・ルブラムCBS118892株から調製したトータルDNAを鋳型として、PCRを行った。PCRによって増幅された1290 bpの遺伝子(配列番号2)を回収した。当該遺伝子を以降の実験に用いた。
【0060】
なお、トリコフィトン・ルブラムは、上記のクリプトコックス・ネオフォルマンスやヒストプラスマ・カプスラーツム等の真菌とは系統学的に離れているため、これら真菌の銅イオン応答性のコンディショナルプロモーターの配列と高い相同性を有する配列は、トリコフィトン・ルブラムのゲノムの転写制御領域内からは見出すことができなかった。
【実施例2】
【0061】
β−ガラクトシダーゼレポーターアッセイ
実施例1において単離されたTERG_01401の開始コドン上流1283 bp(配列番号1)、及びTERG_07477の開始コドン上流1290 bp(配列番号2)が銅イオン応答性を有するプロモーターとして機能するか否かを確認するため、β−ガラクトシダーゼレポーターアッセイを行った。
【0062】
(2-1)レポーターカセットの作製
<Pctr4-lacZ-TtrpCの作製>
3個のDNA断片:配列番号1のDNA断片、別途PCR法により増幅したlacZ遺伝子のDNA断片(配列番号12)、及び別途PCR法により増幅した、3個のHAタグを付したアスペルギルス・ニドランス由来のトリプトファン合成酵素遺伝子の3'-非翻訳領域(3HA-TtrpC)のDNA断片(配列番号13)をこの順序で連結させた。DNA断片の連結は、Overlap Extension PCR(OE-PCR)法を用いて行った。このようにして、レポーターカセット「Pctr4-lacZ-TtrpC」(配列番号3)を得た。
【0063】
上記のレポーターカセットの作製においては、5'-末端にBamHI認識配列が付加されたフォワードプライマー(配列番号14)及びリバースプライマー(配列番号15)をPCRで用いたため、レポーターカセットの5'-末端及び3'-末端にはBamHI認識配列が付加されている。
【0064】
上記のレポーターカセットを、Mighty Cloning Kit (Blunt End) (TaKaRa)を用いる平滑化末端ライゲーション法によって、クローニングベクターpUC118(TaKaRa)のHincIIサイトに導入した。
【0065】
レポーターカセットが導入されたpUC118を回収し、そしてBamHI(Roche)で処理することによって完全に消化した。当該消化物を0.8%アガロースゲル電気泳動に供した後、レポーターカセットに該当する5.1 kbpのDNA断片をゲルから切り出し、QIAquick Gel Extraction Kit (QIAGEN)を用いて精製した。
【0066】
<Pcrp1-lacZ-TtrpCの作製>
3個のDNA断片:配列番号2のDNA断片、別途PCR法により増幅したlacZ遺伝子のDNA断片(配列番号12)、及び別途PCR法により増幅した、3HA-TtrpCのDNA断片(配列番号13)を、OE-PCR法を用いてこの順序で連結させた。このようにして得られたレポーターカセット「Pcrp1-lacZ-TtrpC」(配列番号4)を、上記Pctr4-lacZ-TtrpCにおけるものと同様にして、平滑化末端ライゲーション法によってpUC118のHincIIサイトに導入し、回収した。回収したpUC118をBamHIで完全に消化し、当該消化物を0.8%アガロースゲル電気泳動に供し、レポーターカセットに該当する5.1 kbpのDNA断片をゲルから切り出し、QIAquick Gel Extraction Kit (QIAGEN)を用いて精製した。
【0067】
(2-2)バイナリベクターの作製
本実施例において宿主株として用いるトリコフィトン・メンタグロフィテスTIMM2789株(有性世代名アルスロデルマ・バンブルゼミイ)のlig4遺伝子欠損株(TmL28株)を形質転換するためのバイナリベクターを作製した。非特許文献6で報告されているpAg1-Tmku80/Tを基にレポーター株作製用のバイナリベクターを作製した。pAg1-Tmku80/Tは、pAg1(Mol Genet Genomics. 2003 Feb;268(5):645-55.)を基に作製された、宿主株のTmku80遺伝子周辺における相同組換えに利用する相同領域及びハイグロマイシン耐性マーカーカセットが導入されたバイナリベクターである。
【0068】
pAg1-Tmku80/Tを非特許文献6に記載された方法に従って作製した。pAg1-Tmku80/TをBamHI(Roche)により完全に消化し、0.8%アガロースゲル電気泳動に供した後、DNA断片をゲルから切り出し、QIAquick Gel Extraction Kit (QIAGEN)で精製した。ライゲーション反応時におけるセルフライゲーションを防ぐために、BamHI処理されたpAg1-Tmku80/Tの5'-末端及び3'-末端をShrimp Alkaline Phosphatase (Roche)を用いて脱リン酸化した。
【0069】
そして、当該5'-末端及び3'-末端が脱リン酸化されたpAg1-Tmku80/Tと上記(2-1)において作製したBamHI処理末端を有するレポーターカセットPctr4-lacZ-TtrpCを、Ligation high (TOYOBO)を用いて連結し、レポーター株作製用バイナリベクター「pAg1-Tmku80/Pctr4-lacZ-TtrpC」を得た。
【0070】
同様にして、5'-末端及び3'-末端が脱リン酸化されたpAg1-Tmku80/Tと上記(2-1)において作製したBamHI処理末端を有するレポーターカセットPcrp1-lacZ-TtrpCを連結し、レポーター株作製用バイナリベクター「pAg1-Tmku80/Pcrp1-lacZ-TtrpC」を得た。
【0071】
(2-3)宿主株の形質転換
上記(2-2)において作製したレポーター株作製用バイナリベクターpAg1-Tmku80/Pctr4-lacZ-TtrpC又はpAg1-Tmku80/Pcrp1-lacZ-TtrpCを用いて、アグロバクテリウム法により宿主株を形質転換した。宿主株として、トリコフィトン・メンタグロフィテスTIMM2789株(有性世代名アルスロデルマ・バンブルゼミイ)のlig4遺伝子欠損株(TmL28株)を用いた。TmL28株では、部位特異的相同組換えが比較的高い効率で起こることが非特許文献1において報告されている。具体的には以下のようにしてTmL28株を形質転換した。
【0072】
上記(2-2)において作製した、レポーター株作製用バイナリベクターpAg1-Tmku80/Pctr4-lacZ-TtrpC又はpAg1-Tmku80/Pcrp1-lacZ-TtrpCをエレクトロポレーション法によりアグロバクテリウム・ツメファシエンスEHA105株(Trans Res 1993; 2: 208-218.)に導入した。形質転換操作後の菌液を50μg/mLのカナマイシン(和光純薬)を含む2×YT寒天培地に接種し、カナマイシン耐性を指標にアグロバクテリウム形質転換体を選抜した。
【0073】
そして、TmL28株を改変型1/10サブローグルコース寒天培地上で28℃、約10日間培養し、TmL28株の小分生子を回収した。改変型1/10サブローグルコース寒天培地の組成は、Bacto peptone(日本BD) 0.2%、グルコース(和光純薬)0.1%、KH2PO4(和光純薬) 0.1%、MgSO4・7H2O(和光純薬) 0.1%、Bacto agar(日本BD) 1.5%、pH未調整である。
【0074】
アグロバクテリウム法による白癬菌細胞内への遺伝子導入はMedical Mycology 2009, 47, 485-494.に記載の方法に従って行った。以下に概要を記した。アグロバクテリウム形質転換体とTmL28株の小分生子を混合し、アセトシリンゴン含有アグロバクテリウム最小培地上で28℃、48時間共培養した。共培養の後、100μg/mL〜300μg/mLのハイグロマイシン(和光純薬)を含むサブローデキストロース寒天培地(日本BD)で培養し、ハイグロマイシン耐性を指標に選抜し、Pctr4-lacZ-TtrpCレポーターカセットが導入された形質転換体、及びPcrp1-lacZ-TtrpCレポーターカセットが導入された形質転換体を得た(図1)。
【0075】
(2-4)β−ガラクトシダーゼ活性の測定
硫酸銅(II)(和光純薬)を無添加、10μM、又は100μM添加したMOPS緩衝RPMI1640液体培地(シグマ)に、上記(2-3)において得られた形質転換体を1×105cells/mLとなるように接種し、28℃で5日間培養した。それぞれの培養条件の菌体を集菌し、液体窒素で凍結した。菌体を液体窒素凍結下でマルチビーズショッカー(安井器械)を用いて破砕した。破砕物にβ−メルカプトエタノール添加Z-buffer(100mM リン酸ナトリウム pH 7.0, 50mM β−メルカプトエタノール, 10mM KCl, 1mM MgSO4) を添加して可溶性タンパク質画分を抽出し、セルフリーを調製した。セルフリー中のタンパク質濃度は、660nm Protein Assayキット(Pierce)を用いて、BSAをスタンダードとして測定した。
【0076】
セルフリー中のβ−ガラクトシダーゼ活性は96ウェルマイクロプレート中で測定した。20μLのセルフリー及び100μLの0.8mg/mL o-nitrophenyl-β-D-galactopyranoside(ONPG)をウェルに添加し、30℃で約30分反応させた。マルチスキャンFCマイクロプレートリーダー(Thermo Scientific)で405nmの吸光度を測定した。β−ガラクトシダーゼ活性の測定値は測定サンプルのタンパク質濃度及び反応時間で除して標準化した。
【0077】
図2に示されるように、Pctr4-lacZ-TtrpCレポーターカセットが導入された形質転換体においては、硫酸銅(II)濃度依存的にタンパク質当たりのβ−ガラクトシダーゼ活性が低下した。このことは、Pctr4が硫酸銅(II)濃度依存的にレポーター遺伝子であるβ−ガラクトシダーゼ遺伝子(lacZ)の発現を抑制したことを意味する。
【0078】
一方、Pcrp1-lacZ-TtrpCレポーターカセットが導入された形質転換体においては、硫酸銅(II)濃度依存的にβ−ガラクトシダーゼ活性が上昇した。このことは、Pcrp1が硫酸銅(II)濃度依存的にレポーター遺伝子であるβ−ガラクトシダーゼ遺伝子(lacZ)の発現を誘導したことを意味する。
【0079】
したがって、Pctr4(配列番号1)及びPcrp1(配列番号2)は、白癬菌細胞内において、銅イオン応答性プロモーターとして機能することが見出された。
【実施例3】
【0080】
宿主遺伝子の発現調節株の作製と評価
実施例2において銅イオン応答性が確認された配列番号1に記載のプロモーターを、宿主株(TmL28株)の構造遺伝子の5'-非翻訳領域に挿入することにより発現調節株を作製した。そして、発現調節株において、標的遺伝子の発現が銅イオンによって制御されること、及びその際の表現型について評価した。具体的な実験について説明する。
【0081】
本実施例においては、標的遺伝子として、スクワレンエポキシダーゼ遺伝子(erg1)のTmL28株におけるホモログであるTmerg1構造遺伝子のDNA配列を選択した。スクワレンエポキシダーゼは、真菌においてエルゴステロール生合成系を担う酵素の一つであり、当該酵素の阻害剤は優れた生育阻害作用を有する抗白癬菌剤として臨床的に広く使用されている。
【0082】
(3-1)Tmerg1構造遺伝子を含む約4600 bpの領域の塩基配列の決定
宿主として用いたTmL28株については、ゲノム全塩基配列は解読されていない。そこで、Tmerg1遺伝子の開始コドンの上流約2000 bp及び下流約2000 bp(Tmerg1構造遺伝子の全長を含む)を含む領域の配列を決定することを試みた。
【0083】
まず、配列が公開されている(http://www.broadinstitute.org/)トリコフィトン・メンタグロフィテスCBS 112371株(有性世代名アルスロデルマ・ベンハミエ)の配列情報を基に、erg1構造遺伝子(ARB_06092)の上流に存在する構造遺伝子ARB_06091及び下流に存在する構造遺伝子ARB_06093に対するプライマーを設計し(配列番号16、17)、TmL28株のゲノムDNAを鋳型としてTmerg1遺伝子の開始コドンの上流約2000 bp及び下流約2000 bpを含む領域(5.4kbp)をPCRにより増幅した。続いて、増幅産物をテンプレートとして、アルスロデルマ・ベンハミエCBS 112371株のerg1構造遺伝子(ARB_06092)の配列を基にプライマーを設計し、サイクルシーケンス反応を行った。決定された配列を基にプライマーを新たに設計し、当該プライマーを用いてサイクルシーケンス反応及び塩基配列の決定を行った。当該操作を繰り返し、上述のとおり、Tmerg1構造遺伝子を含む約4600 bpの領域の塩基配列(配列番号5)を決定した。この際に用いたプライマーの配列を配列番号18〜26に示した。
【0084】
(3-2)バイナリベクターの作製
TmL28株のゲノムDNAを鋳型としてPCRを行い、Tmerg1の開始コドン上流約2000 bp領域(upstream Homologus Region, HR1)(配列番号6)、及びTmerg1の開始コドン下流約2000 bp領域(downstream Homologus Region, HR2; Tmerg1の構造遺伝子の全長を含む)(配列番号7)を相同組換えに用いる相同領域として増幅した。
【0085】
増幅されたHR1の5'-末端及び3'-末端にはSpeI認識配列が付加されている。増幅されたHR1を、Mighty Cloning Kit (Blunt End) (TaKaRa)を用いる平滑末端ライゲーション法によって、pUC118のHincIIサイトに挿入した。
【0086】
上記(2-1)と同様の条件でOE-PCR法を用いて、配列番号1のDNA断片とHR-2のDNA断片をこの順序で連結し、本発明の銅イオン応答性プロモーターとTmerg1構造遺伝子の融合遺伝子を含む断片「Pctr4-HR2」(配列番号8)を得た。Pctr4-HR2の5'-末端にはKpnI認識配列が、3'-末端にはSacI認識配列が付加されている。Pctr4-HR2を、Mighty Cloning Kit (Blunt End) (TaKaRa)を用いる平滑化末端ライゲーション法によって、pUC118のHincIIサイトに挿入した。
【0087】
pAg1バイナリベクターに選択マーカー遺伝子としてハイグロマイシン耐性マーカーカセット(配列番号9)を組込んだバイナリベクターpAg1-hph(Medical Mycology 2009, 47, 485-494.)を基にTmerg1発現調節株作製用のバイナリベクターを作製した。まず、pAg1-hphをKpnI(Roche)及びSacI(Roche)で完全に消化し、0.8%アガロースゲル電気泳動に供した後、DNA断片をゲルから切り出し、QIAquick Gel Extraction Kit (QIAGEN)で精製した。
【0088】
上記において作製したPctr4-HR2が挿入されたpUC118ベクターをKpnI及びSacIで完全に消化し、切り出されたPctr4-HR2を0.8%アガロースゲル電気泳動に供することにより分離し、ゲルから回収した。回収したPctr4-HR2をQIAquick Gel Extraction Kit (QIAGEN)で精製した。当該Pctr4-HR2をKpnI及びSacIで完全消化したpAg1-hphとライゲーションして「pAg1-hph/Pctr4-HR2」を得た。
【0089】
上記pAg1-hph/Pctr4-HR2をSpeIで完全に消化し、0.8%アガロースゲル電気泳動に供した後、DNA断片をゲルから回収し、QIAquick Gel Extraction Kit (QIAGEN)で精製した。
上記において作製したHR1を挿入したpUC118ベクターをSpeI(Roche)で完全に消化し、切り出したHR1を0.8%アガロースゲル電気泳動に供することにより分離し、ゲルから回収した。回収したHR1をQIAquick Gel Extraction Kit (QIAGEN)で精製した。当該HR1をSpeIで完全に消化したpAg1-hph/Pctr4-HR2とライゲーションした。
【0090】
以上のようにして、Tmerg1発現調節株作製用のバイナリベクター「pAg1-hph/Pctr4-HR2/HR1」を得た。
(3-3)宿主株の形質転換
上記(3-2)において得られたバイナリベクターpAg1-hph/Pctr4-HR2/HR1を用いて、実施例2と同様にアグロバクテリウム法によりTmL28株を形質転換し、ハイグロマイシンを含む選択培地を用いて形質転換体を選抜した。その結果、Tmerg1遺伝子の上流に配列番号1の銅イオン応答性プロモーターが導入された形質転換体「Tmerg1発現調節株」が得られた(図3)。
【0091】
Tmerg1発現調節株を10μMのBCS(和光純薬)、10μMの硫酸銅(II)、又は100μMの硫酸銅(II)を添加したMOPS緩衝RPMI1640寒天培地に3×103cells/spotで接種し、28℃で4日間培養し、発育状態を観察した(図4)。対照として、形質転換していないTmL28株も同様に培養し、発育状態を観察した。
【0092】
図4に示されるように、10μM又は100μMの硫酸銅(II)を添加した培地におけるTmerg1発現調節株の発育は、10μMのBCSを添加した培地における発育に比べて、顕著に阻害された。また、硫酸銅(II)の濃度が高いほど強く発育が強く阻害された。一方、形質転換していないTmL28株は、いずれの培地においても同程度の発育を示すことが確認された。
【0093】
これらの結果から、銅イオン応答性プロモーターによってTmerg1遺伝子の発現が抑制された結果、形質転換体の発育が阻害されたことが示された。
【実施例4】
【0094】
遺伝子発現を致死的でないレベルに抑制した条件で行う薬剤感受性試験
実施例3において作製したTmerg1発現調節株を用いて、Tmerg1遺伝子の発現を致死的でないレベルに抑制した条件において各種抗真菌活性化合物に対する感受性を評価した。
【0095】
(4-1)Tmerg1遺伝子の発現を抑制するために培地に添加する銅イオン濃度の検討
まず、Tmerg1遺伝子の発現を致死的でないレベルに抑制するために培地に添加する銅イオン濃度について検討した。Tmerg1発現調節株をMOPS緩衝RPMI 1640液体培地において培養する際に、硫酸銅(II)を1μM、10μM並びに50μMの濃度で添加し、28℃で4日間静置培養した。培養後、Tmerg1発現調節株の発育を目視判定により評価した。その結果、硫酸銅(II)を10μM並びに50μMの濃度で培地に添加した場合においては、Tmerg1発現調節株の発育は著しく抑制され、薬剤感受性試験には不適と考えられた。一方、1μMの濃度で添加した場合は十分な発育が観察された。したがって、薬剤感受性試験は硫酸銅(II)を1μMの濃度で培地に添加した条件で行うこととした。また、前記培養条件では宿主株TmL28の発育に対する明確な抑制作用は観察されなかった。
【0096】
(4-2)薬剤感受性試験
TmL28株及びTmerg1発現調節株の各種抗真菌活性化合物に対する薬剤感受性をミクロ液体希釈法を用いて測定した。試験化合物は以下に示す濃度範囲で2倍希釈系列を作製した。
【0097】
テルビナフィン(東京化成工業) :0.098〜0.000048μg/mL
リラナフタート(CGeneTech) :0.098〜0.000048μg/mL
イトラコナゾール(シグマ) :0.78〜0.00038μg/mL
アモロルフィン(東京化成工業) :0.78〜0.00038μg/mL
グリセオフルビン(シグマ) :6.25〜0.0031μg/mL
アムホテリシンB(Fluka) :6.25〜0.0031μg/mL
96ウェルプレートの各ウェルにMOPS緩衝RPMI 1640液体培地(硫酸銅(II)を終濃度1μMとなるように添加)、試験化合物及び菌液(終濃度:1×103cells/mL)を分注し(全量200μL)、28℃で4日間静置培養した。培養後、TmL28株及びTmerg1発現調節株の発育を目視判定により評価した。発育コントロールと比較して80%以上の発育阻止作用が観察されたウェルの最小濃度を最小発育阻止濃度(MIC)として判定した。
【0098】
薬剤感受性試験の結果として、TmL28株及びTmerg1発現調節株に対する各試験化合物のMICを表1に示した。
【0099】
【表1】

【0100】
Tmerg1発現調節株に対するテルビナフィン及びリラナフタートのMICは、TmL28株と比較して、それぞれ1/8及び1/32に低下した。これは、TmL28株と比較して、Tmerg1発現調節株のテルビナフィン及びリラナフタートに対する感受性が、それぞれ8倍、32倍高くなったことを意味する。一方、他の試験化合物のMICは両株間で顕著な差は見られなかった。ここで、テルビナフィン及びリラナフタートの作用機作はスクアレンエポキシダーゼ(erg1)阻害、イトラコナゾールの作用機作はラノステロール14α-デメチラーゼ(erg11)阻害、アモロルフィンの作用機作はC-8ステロールイソメラーゼ(erg2)阻害及びC-14ステロールリダクターゼ(erg24)阻害、グリセオフルビンの作用機作は微小管の機能阻害、アムホテリシンの作用機作は真菌細胞膜に対する直接的障害作用とされている。したがって、本結果より、erg1遺伝子の発現が抑制された条件においては、当該遺伝子の機能を阻害するような化合物に対する感受性が特異的に高くなることが示された。
【0101】
この実施例の結果より、本発明の方法は、標的遺伝子の機能を阻害するような化合物を高感度でスクリーニングするための優れた方法であることが明らかである。そして、erg1遺伝子以外の様々な遺伝子を標的遺伝子とする発現調節株を作製すれば、これら遺伝子の機能を阻害するような化合物を高感度でスクリーニングすることができることも理解できる。
【0102】
さらに、抗真菌活性を有するが作用機構が未知又は推測されているに過ぎない試験化合物が作用する遺伝子又はタンパク質を同定することにも、本発明を利用できることが理解できる。例えば、様々な遺伝子を標的遺伝子とする発現調節株を作製し、試験化合物で処理された発現調節株の表現型と、同様に処理された形質転換されていない宿主株の表現型を比較し、発現調節株が試験化合物に対して高い感受性を示すことを指標として、試験化合物が作用する遺伝子又はタンパク質を同定することができる。
【特許請求の範囲】
【請求項1】
以下の(a)、(b)、及び(c)からなる群から選択されるDNAを含む、銅イオン応答性プロモーター:
(a)配列番号1又は2の塩基配列からなるDNA、
(b)配列番号1又は2の塩基配列において1又は複数の塩基が欠失、置換、又は付加された塩基配列からなり、かつ銅イオン応答性プロモーターとして機能するDNA、及び
(c)配列番号1又は2の塩基配列と相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつ銅イオン応答性プロモーターとして機能するDNA。
【請求項2】
請求項1に記載のプロモーターの下流に、以下の(a)、(b)、及び(c)からなる群から選択されるDNAを連結した融合遺伝子:
(a)宿主細胞の構造遺伝子のDNA、
(b)宿主細胞の構造遺伝子に対するアンチセンス配列からなるDNA、及び
(c)外来性の構造遺伝子のDNA。
【請求項3】
請求項1に記載のプロモーター又は請求項2に記載の融合遺伝子を含む発現ベクター。
【請求項4】
請求項3に記載の発現ベクターを含む形質転換体。
【請求項5】
発現ベクターが真菌細胞に導入された請求項4に記載の形質転換体。
【請求項6】
真菌細胞が白癬菌に由来する、請求項5に記載の形質転換体。
【請求項7】
以下の(a)、(b)、及び(c)を含む、遺伝子の機能解析方法:
(a)請求項4〜6のいずれか1項に記載の形質転換体を培養培地中で培養する工程、
(b)前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御する工程、及び
(c)形質転換体と形質転換されていない宿主の表現型を比較し、表現型の変化に基づいて遺伝子の機能を判断する工程。
【請求項8】
以下の(a)、(b)、(c)、及び(d)を含む、化合物のスクリーニング方法:
(a)請求項4〜6のいずれか1項に記載の形質転換体を培養培地中で培養する工程、
(b)前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御して、遺伝子産物の発現量を致死的でないレベルに低下させる工程、
(c)試験化合物を形質転換体と接触させる工程、及び
(d)試験化合物の処理による形質転換体の表現型の変化に基づいて、銅イオン応答性プロモーターによって発現が制御される遺伝子の機能に対する試験化合物の影響を判断する工程。
【請求項9】
試験化合物が形質転換体の増殖を阻止するかどうかを判断することにより試験化合物の影響を判断する、請求項8に記載のスクリーニング方法。
【請求項10】
以下の(a)、(b)、(c)、及び(d)を含む、試験化合物が作用する遺伝子又はタンパク質の同定方法:
(a)請求項4〜6のいずれか1項に記載の1種類又は複数種類の形質転換体を培養培地中で培養する工程、
(b)前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御して、遺伝子産物の発現量を致死的でないレベルに低下させる工程、
(c)試験化合物を形質転換体と接触させる工程、及び
(d)試験化合物で処理された形質転換体の表現型と、試験化合物で処理された形質転換されていない宿主株の表現型を比較することにより、試験化合物が作用する遺伝子又はタンパク質を同定する工程。
【請求項11】
試験化合物で処理された形質転換されていない宿主株の増殖に比べて、試験化合物で処理された形質転換体の増殖が阻止されるかどうかを判断することにより、試験化合物が作用する遺伝子又はタンパク質を同定する、請求項10に記載の遺伝子又はタンパク質の同定方法。
【請求項1】
以下の(a)、(b)、及び(c)からなる群から選択されるDNAを含む、銅イオン応答性プロモーター:
(a)配列番号1又は2の塩基配列からなるDNA、
(b)配列番号1又は2の塩基配列において1又は複数の塩基が欠失、置換、又は付加された塩基配列からなり、かつ銅イオン応答性プロモーターとして機能するDNA、及び
(c)配列番号1又は2の塩基配列と相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつ銅イオン応答性プロモーターとして機能するDNA。
【請求項2】
請求項1に記載のプロモーターの下流に、以下の(a)、(b)、及び(c)からなる群から選択されるDNAを連結した融合遺伝子:
(a)宿主細胞の構造遺伝子のDNA、
(b)宿主細胞の構造遺伝子に対するアンチセンス配列からなるDNA、及び
(c)外来性の構造遺伝子のDNA。
【請求項3】
請求項1に記載のプロモーター又は請求項2に記載の融合遺伝子を含む発現ベクター。
【請求項4】
請求項3に記載の発現ベクターを含む形質転換体。
【請求項5】
発現ベクターが真菌細胞に導入された請求項4に記載の形質転換体。
【請求項6】
真菌細胞が白癬菌に由来する、請求項5に記載の形質転換体。
【請求項7】
以下の(a)、(b)、及び(c)を含む、遺伝子の機能解析方法:
(a)請求項4〜6のいずれか1項に記載の形質転換体を培養培地中で培養する工程、
(b)前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御する工程、及び
(c)形質転換体と形質転換されていない宿主の表現型を比較し、表現型の変化に基づいて遺伝子の機能を判断する工程。
【請求項8】
以下の(a)、(b)、(c)、及び(d)を含む、化合物のスクリーニング方法:
(a)請求項4〜6のいずれか1項に記載の形質転換体を培養培地中で培養する工程、
(b)前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御して、遺伝子産物の発現量を致死的でないレベルに低下させる工程、
(c)試験化合物を形質転換体と接触させる工程、及び
(d)試験化合物の処理による形質転換体の表現型の変化に基づいて、銅イオン応答性プロモーターによって発現が制御される遺伝子の機能に対する試験化合物の影響を判断する工程。
【請求項9】
試験化合物が形質転換体の増殖を阻止するかどうかを判断することにより試験化合物の影響を判断する、請求項8に記載のスクリーニング方法。
【請求項10】
以下の(a)、(b)、(c)、及び(d)を含む、試験化合物が作用する遺伝子又はタンパク質の同定方法:
(a)請求項4〜6のいずれか1項に記載の1種類又は複数種類の形質転換体を培養培地中で培養する工程、
(b)前記培養培地中の銅イオン濃度を調節することにより、形質転換体と銅イオンの接触を制御して、遺伝子産物の発現量を致死的でないレベルに低下させる工程、
(c)試験化合物を形質転換体と接触させる工程、及び
(d)試験化合物で処理された形質転換体の表現型と、試験化合物で処理された形質転換されていない宿主株の表現型を比較することにより、試験化合物が作用する遺伝子又はタンパク質を同定する工程。
【請求項11】
試験化合物で処理された形質転換されていない宿主株の増殖に比べて、試験化合物で処理された形質転換体の増殖が阻止されるかどうかを判断することにより、試験化合物が作用する遺伝子又はタンパク質を同定する、請求項10に記載の遺伝子又はタンパク質の同定方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−99317(P2013−99317A)
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願番号】特願2012−126239(P2012−126239)
【出願日】平成24年6月1日(2012.6.1)
【出願人】(399086263)学校法人帝京大学 (21)
【出願人】(000124269)科研製薬株式会社 (18)
【Fターム(参考)】
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願日】平成24年6月1日(2012.6.1)
【出願人】(399086263)学校法人帝京大学 (21)
【出願人】(000124269)科研製薬株式会社 (18)
【Fターム(参考)】
[ Back to top ]

