関節リウマチ治療剤
【課題】関節特異性が高く、免疫力低下等の副作用が小さい新規の関節リウマチ治療薬を提供する。
【解決手段】スカベンジャー受容体タイプAの全部又は一部を含み且つリガンド結合活性を有するポリペプチドを有効成分として含有する関節リウマチ治療剤が、関節特異的に作用する関節リウマチ治療薬として提供される。当該ポリペプチドは、コラーゲン様ドメイン及び/又はαヘリカル・コイルドコイル・ドメインを含むものであることが好ましい。
【解決手段】スカベンジャー受容体タイプAの全部又は一部を含み且つリガンド結合活性を有するポリペプチドを有効成分として含有する関節リウマチ治療剤が、関節特異的に作用する関節リウマチ治療薬として提供される。当該ポリペプチドは、コラーゲン様ドメイン及び/又はαヘリカル・コイルドコイル・ドメインを含むものであることが好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は関節リウマチ治療剤に関し、さらに詳細には、スカベンジャー受容体タイプAに由来するポリペプチドを有効成分として含有する関節リウマチ治療剤に関する。本発明の関節リウマチ治療剤は、関節特異性が特に高いものである。
【背景技術】
【0002】
従来より、関節リウマチの治療薬として非ステロイド性抗炎症薬、ステロイド剤、抗リウマチ薬、免疫抑制剤等の各種医薬が使用されている(特許文献1)。さらに近年、腫瘍壊死因子−α(TNF−α)、インターロイキン−1(IL−1)、インターロイキン−6(IL−6)といった炎症性サイトカインを標的とした生物学的製剤(サイトカイン阻害剤)が開発され、関節リウマチの治療に応用されている。例えば、TNF−α阻害剤として抗TNF−α抗体や可溶性TNF−α受容体を、IL−6阻害剤として抗IL−6受容体抗体を、IL−1阻害剤としてIL−1受容体アンタゴニストをそれぞれ有効成分とする生物学的製剤が開発されている。これらの製剤の関節リウマチに対する効果は急速かつ劇的であり、多くの関節リウマチ患者において高い治療成績を収めている。
【0003】
一方で、これらの炎症性サイトカインを標的としたサイトカイン阻害剤の問題点も指摘されている。すなわち、これらのサイトカインは関節特異的ではなく生理機能全体に関係するものであるので、その抑制によって患者の免疫力が低下し、感染症や癌の発症リスクが高まるおそれがある。また、滑膜細胞の増殖を完全に抑制することはできず、骨破壊の進行を遅らせるにとどまる。このような背景の下、関節特異的に作用する関節リウマチ治療薬が求められている。
【特許文献1】特開2007−326824公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
上記現状に鑑み、本発明は関節特異的に作用する新規の関節リウマチ治療薬を提供することを目的とする。
【課題を解決するための手段】
【0005】
上記した課題を解決するための請求項1に記載の発明は、スカベンジャー受容体クラスAの全部又は一部を含み且つリガンド結合活性を有するポリペプチドを有効成分として含有する関節リウマチ治療剤である。
【0006】
本発明の関節リウマチ治療剤は、スカベンジャー受容体クラスAの全部又は一部を含むポリペプチドを有効成分とするものであり、且つ当該ポリペプチドはリガンド結合活性を有するものである。本発明の関節リウマチ治療剤は、スカベンジャー受容体クラスAの作用を利用するものであるので、関節特異性が高い。そのため、免疫力低下の副作用が小さく、感染症等の発症リスクを低く抑えることができる。また、本発明の関節リウマチ治療剤は滑膜細胞の増殖抑制作用が特に高く、骨破壊の進行を高度に抑制することができる。
【0007】
「スカベンジャー受容体クラスAの全部又は一部を含むポリペプチド」としては、例えば、以下の(a)〜(c)が挙げられる。
(a)スカベンジャー受容体Aの全部からなるポリペプチド(スカベンジャー受容体Aの全長、スカベンジャー受容体Aそのもの)、
(b)スカベンジャー受容体Aの一部からなるポリペプチド(スカベンジャー受容体Aの部分断片)、
(c)上記(a)又は(b)に他のポリペプチド・タンパク質等が付加したもの。
さらに(c)の具体例としては、(a)又は(b)と他のタンパク質との融合タンパク質が挙げられる。
【0008】
前記ポリペプチドがコラーゲン様ドメインを含むものである構成が好ましい(請求項2)。
【0009】
前記ポリペプチドがαヘリカル・コイルドコイル・ドメインを含むものである構成が好ましい(請求項3)。
【0010】
前記スカベンジャー受容体クラスAは、配列番号2で表されるアミノ酸配列、又は当該アミノ酸配列において1若しくは数個のアミノ酸残基が欠失、置換若しくは付加されたアミノ酸配列からなるものであってもよい(請求項4)。
【発明の効果】
【0011】
本発明の関節リウマチ治療剤は関節特異性が高いので、免疫力低下の副作用が小さく、感染症等の発症リスクを低く抑えることができる。さらに、本発明の関節リウマチ治療剤は滑膜細胞の増殖抑制作用が特に高く、骨破壊の進行を高度に抑制することができる。
【発明を実施するための最良の形態】
【0012】
以下、本発明を実施するための最良の形態について詳細に説明する。
【0013】
まず、スカベンジャー受容体について説明する。スカベンジャー受容体(以下、「SCR」と略記することがある。)とは、変性した低密度リポタンパク質(変性LDL)を認識する受容体群の総称である。SCRは動脈硬化に関与する受容体として児玉らによって精製され、その遺伝子構造も明らかにされている(Proc. Natl. Acad. Sci. USA, 85, 9238-9242, 1988、及びNature, 353, 531-535, 1990)。SCRは構造的特徴により3つのクラスA〜Cに分類されている。このうち、スカベンジャー受容体クラスA(以下、「SCR−A」と略記することがある。)は最初に見出されたSCRであり、主にマクロファージ系細胞に発現している。さらに、SCR−Aには選択的スプライシングによって生じる4種のアイソフォーム(タイプI,タイプII,タイプIII,MACRO)が知られている。
【0014】
スカベンジャー受容体クラスA(SCR−A)は、分子量約8万の糖タンパク質(サブユニット)3個がホモ三量体を形成した構造を有する複合タンパク質である。SCR−AはそのN末端側が細胞内、C末端側が細胞外に位置している。SCR−AのタイプI(SCR−AI)は、N末端から順に細胞内ドメイン、膜貫通ドメイン、スペーサードメイン、αヘリカル・コイルドコイル・ドメイン、コラーゲン様ドメイン、及びシステインリッチドメインの各ドメインから構成されている(図1)。SCR−AのタイプII(SCR−AII)は、システインリッチドメインを欠いている以外はSCR−AIと同様の構造を有する。SCR−Aのリガンド結合活性にはLys/Argクラスターを含むコラーゲン様ドメインが重要な役割を果たしており、このドメインは負の電荷を有するリガンドと相互作用することが知られている。すなわち、負の電荷を有する巨大分子、例えば、核酸、糖鎖、修飾タンパク質、高分子合成物などの広範囲な分子がSCR−Aのリガンドとなり得る。なお、本明細書においては、複合タンパク質とそのサブユニットを特に区別して呼ぶことはしない。例えば、本明細書では「SCR−A」という用語を「三量体を形成したSCR−A」と「SCR−Aのサブユニット」のいずれの意味にも用いる。
【0015】
SCR−Aのアミノ酸配列はヒトと他の哺乳動物との間で高い相同性を有している。例えばタイプIの場合、ヒト−ウシ間で73%、ヒト−マウス間で72%、ヒト−チンパンジー間で96%、ヒト−サル間で95%、ヒト−ウマ間で80%、ヒト−ウサギ間で80%の相同性を示す。このことから、SCR−Aは少なくとも哺乳動物では共通の働きをしていることが強く示唆される。
【0016】
他のタイプに分類されるSCR−Aも、SCR−AIやSCR−AIIと類似する構造を有しており、コラーゲン様ドメインとαヘリカル・コイルドコイル・ドメインを有する点で共通している。
【0017】
本発明の関節リウマチ治療剤の有効成分は、スカベンジャー受容体タイプA(SCR−A)の全部又は一部を含み且つリガンド結合活性を有するポリペプチドである。まず、「SCR−Aの全部又は一部を含むポリペプチド」を取得する方法としては、例えば、該ポリペプチドをコードする遺伝子を構築し、該遺伝子を発現させる遺伝子工学的手法が挙げられる。該遺伝子は、例えば、SCR−AのcDNAを元に構築することができる。SCR−AのcDNAを取得する方法としては、当該技術分野で一般に用いられている方法を適用することができる。例えば、マクロファージからRNAを抽出・精製し、逆転写反応によって1本鎖cDNA、さらにDNA合成反応によって2本鎖cDNAを得ることができる。なお、種々の動物からSCR−AのcDNAがすでに単離されており、それらの塩基配列情報が入手可能であるので、当該情報を参考にしてプライマーやプローブを設計することができる。ここで、ヒトSCR−AIIのcDNAの塩基配列と対応するアミノ酸配列を配列番号1に、アミノ酸配列のみを配列番号2に示す。配列番号2において、アミノ酸番号1(Met)〜50(Lys)が細胞内ドメイン、アミノ酸番号51(Ala)〜76(Leu)が膜貫通ドメイン、アミノ酸番号77(Lys)〜451(Leu)が細胞外ドメインに相当する。さらに、細胞外ドメインのうち、アミノ酸番号171(Asn)〜255(Arg)がαヘリカル・コイルドコイル・ドメイン、アミノ酸番号273(Gly)〜341(Gly)がコラーゲン様ドメインに相当する。
【0018】
さらに、マウスSCR−AIIのcDNAの塩基配列と対応するアミノ酸配列を配列番号3に、アミノ酸配列のみを配列番号4に示す。配列番号4において、アミノ酸番号1(Met)〜55(Lys)が細胞内ドメイン、アミノ酸番号56(Ala)〜78(Ala)が膜貫通ドメイン、アミノ酸番号79(Gln)〜354(Val)が細胞外ドメインに相当する。さらに、細胞外ドメインのうち、アミノ酸番号175(Asn)〜259(Arg)がαヘリカル・コイルドコイル・ドメイン、アミノ酸番号277(Gly)〜348(Val)がコラーゲン様ドメインに相当する。
【0019】
上述したように、「SCR−Aの全部又は一部を含むポリペプチド」としては、例えば、以下の(a)〜(c):
(a)SCR−Aの全部からなるポリペプチド(SCR−Aの全長、SCR−Aそのもの)、
(b)SCR−Aの一部からなるポリペプチド(SCR−Aの部分断片)、
(c)上記(a)又は(b)に他のポリペプチド・タンパク質等が付加したもの、
が挙げられる。
【0020】
(a)のポリペプチドを採用する場合には、所望のSCR−Aの全長をコードするcDNAを取得し、これを発現させればよい。一方、(b)のポリペプチドを採用する場合には、所望のSCR−Aの一部をコードするcDNAを取得し、これを発現させればよい。好ましい実施形態では、コラーゲン様ドメイン及び/又はαヘリカル・コイルドコイル・ドメインを含むポリペプチドが採用される。この好ましい実施形態のポリペプチドは、リガンド結合活性を確実に保持できる。例えば、配列番号5に示すアミノ酸配列からなるポリペプチドは、マウスSCR−AIIのコラーゲン様ドメインとαヘリカル・コイルドコイル・ドメインの両方を含んでいる。すなわち、配列番号5のアミノ酸配列は、配列番号4のアミノ酸番号97(Asp)〜354(Val)に相当する。図2に当該ポリペプチドのドメイン構造を模式的に示す。
【0021】
(c)のポリペプチドを採用する場合には、付加するポリペプチド・タンパク質等によって様々な機能を付与することができる。例えば、血中半減期を長くする目的で、(a)又は(b)のポリペプチドと免疫グロブリンFc領域との融合タンパク質とすることができる。また、可溶性の付与を目的として、(a)又は(b)のポリペプチドと分子シャペロンとの融合タンパク質とすることができる。なお本実施形態においても、コラーゲン様ドメイン及び/又はαヘリカル・コイルドコイル・ドメインを含むものであることが好ましい。
【0022】
他の実施形態では、「SCR−Aの全部又は一部を含むポリペプチド」におけるSCR−Aが、配列番号2で表されるアミノ酸配列、又は当該アミノ酸配列において1若しくは数個のアミノ酸残基が欠失、置換若しくは付加されたアミノ酸配列からなるものである。換言すれば、ヒトSCR−AIIと実質的に同一とみなせるタンパク質の全部又は一部を含むポリペプチドである。
【0023】
本発明において、SCR−Aの全部又は一部を含むポリペプチドは、リガンド結合活性を有する必要がある。上述したように、負の電荷を持つ広範囲な巨大分子(核酸、糖鎖、修飾タンパク質、高分子合成物など)がリガンドとなり得る。例えば、アセチル化LDL(AcLDL)、酸化LDL(OxLDL)、フコイダン、ポリイノシン酸(Poly I)、デキストラン硫酸、リポ多糖(LPS)、ムチンがリガンドの例として挙げられる。リガンド結合活性の有無は公知の方法で調べることができ、例えば、標識化合物を用いた競合アッセイによって調べることができる。
【0024】
cDNAを発現させる方法としては、公知の方法をそのまま適用することができる。例えば、所望のポリペプチドをコードするcDNAを適宜の発現ベクターに組み込む。さらに該ベクターを適宜の宿主細胞に導入して所望のポリペプチドを生産できる形質転換体を作成する。そして、該形質転換体を培養し、その培養物から所望のポリペプチドを採取することができる。ポリペプチドの精製についても、タンパク質精製に通常用いられている方法をそのまま適用することができ、各種のクロマトグラフィー、塩析、濃縮、膜分離等の手法を適宜組み合わせて精製することができる。
【0025】
本発明の関節リウマチ治療剤の投与経路としては特に限定はなく、経口投与と非経口投与のいずれでもよいが、有効成分がポリペプチドであることを考慮すると非経口投与、特に注射による投与が好ましい。例えば、皮下、静脈内、筋肉内、あるいは患部への直接投与を採用することができる。他の非経口投与経路、例えば、経皮的投与(パッチ剤等)や直腸内投与(坐剤等)を採用してもよい。一方、経口的に投与する場合は、錠剤、カプセル剤、散剤、細粒剤、液剤、トローチ剤、ゼリー剤等の剤型を採用することができる。これらの投与経路や剤型は、それぞれ単独で又は組み合わせて使用することができる。また、これらの製剤には必要に応じて、安定化剤、防腐剤、賦形剤、崩壊剤、結合剤、滑沢剤等の添加剤が用いられる。例えば、凍結乾燥注射剤とする場合には、原薬となる上記ポリペプチドにアルブミン、アミノ酸、ポリオール、糖類などからなる安定化剤や賦形剤を添加して調製した薬液を無菌ろ過し、無菌充填及び凍結乾燥を行えばよい。
【0026】
本発明の関節リウマチ治療剤の投与量は、投与の目的や患者の状況(例えば、性別、年齢、体重等)に応じて適宜選択すればよい。例えば、成人の場合、経口投与で1日あたり1mg〜1000mg程度、好ましくは15mg〜150mg程度、非経口投与で1日あたり0.1mg〜100mg程度、好ましくは1.5mg〜15mg程度投与すればよい。
【0027】
本発明の関節リウマチ治療剤は、従来の関節リウマチ治療薬と併用することができる。例えば、非ステロイド性抗炎症薬、ステロイド剤、抗リウマチ薬、免疫抑制剤等の関節リウマチ治療剤、さらに、炎症性サイトカイン(TNF−α、IL−1、IL−6等)の阻害剤との併用が可能である。
【0028】
以下に、実施例をもって本発明をさらに具体的に説明するが、本発明はこれらの実施例に限定されるものではない。
【実施例】
【0029】
1.マウス由来マクロファージスカベンジャー受容体タイプAの一部を含むポリペプチド(可溶性SCR)の作成
【0030】
マウスマクロファージより調製したmRNAを鋳型として逆転写反応を行い、cDNAを調製した。このcDNAを鋳型とし、配列番号6と7で表されるオリゴヌクレオチドをプライマー対としてPCRを行い、マウス由来スカベンジャー受容体タイプA細胞外ドメインの一部(可溶性SCR)をコードする遺伝子を含むDNA断片を取得した。当該可溶性SCRのドメイン構造を図2に、アミノ酸配列を配列番号5に示す。
【0031】
取得した増幅DNA断片をpFLAG−CMV3ベクター(シグマアルドリッチ社)のマルチクローニングサイトに挿入し、可溶性SCRを発現する哺乳動物細胞発現用ベクターを構築した。この際、タグとしてのFLAG配列が可溶性SCRのC末端側に融合されるように発現ベクターを設計した。この発現ベクターをCHO−K1細胞にトランスフェクトし、可溶性SCRを発現する形質転換細胞をクローニングした。この形質転換細胞を2%牛胎児血清、500μg/mL G418、50units/mLペニシリン、50μg/mLストレプトマイシンを含むOpti−MEM培地(インビトロジェン社)を用いて、37℃、5%CO2下で培養した。
【0032】
形質転換細胞のコンディションメディウムを回収し、遠心後の上清に硫酸アンモニウム(50%飽和)を加えた。遠心後の沈殿物をトリス−塩酸緩衝液に再溶解し、同緩衝液に対して透析を行った。この透析試料を抗FLAG抗体(M1)が架橋されたアガロースビーズを充填したカラムにアプライした。カラムを洗浄後、結合したタンパク質を溶出した。この溶出画分をPBSに対して透析し、可溶性SCR標品とした。本画分における可溶性SCRの純度を銀染色によるSDS−PAGEにて確認した。調製した可溶性SCR標品のエンドトキシン濃度をパイロジェントシングルテスト(Cambrex Bio Science Walkersville社)を用いて測定し、エンドトキシン濃度が0.05EU/mL以下であることを確認した。
【0033】
2.マウス関節炎モデルを用いた可溶性SCRの関節リウマチ治療効果の評価
コラーゲン誘導関節炎(collagen induced arthritis; CIA)モデルマウスを用いて、可溶性SCRのCIA抑制効果を評価した。
【0034】
完全フロイントアジュバント(CFA;Chondrex社製#7008;1mg/mL)1mLとウシコラーゲン(Bovine Collagen;Chondrex社製#20022)1mLを氷上にて約15分間混合し、CFAエマルジョンを作成した。6週齢のDBA/1Jマウス(雌)を18匹準備し、各マウスについて、尾の付け根から2cm程度離れた箇所にCFAエマルジョン100μLを皮下注射した。そのまま21日間飼育した。
【0035】
不完全フロイントアジュバント(IFA;Chondrex社製#7002;1mg/mL)1mLとウシコラーゲン(Bovine Collagen;Chondrex社製#20022)1mLを氷上にて約15分間混合し、IFAエマルジョンを作成した。飼育21日目の各マウスについて、尾の付け根から2cm程度離れた箇所にIFAエマルジョン100μLを皮下注射した。この時点で各マウスを2群(投与群とコントロール群)に分けた。
【0036】
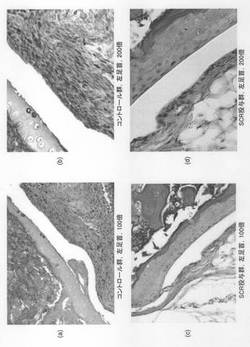
投与群のマウス(8匹)について、SCR5μg(0.031μg/μLの希釈液160μL)を隔日で28日間腹腔内投与した(計100μg)。一方、SCR精製時に透析を行っているため、この透析外液であるPBSをコントロールとして用いることとし、コントロール群のマウス(10匹)については、透析外液を同様に希釈した溶液160μLを用いて隔日で28日間腹腔内投与した。この間、2日おきに関節の腫脹・発赤の状態を目視観察し、関節炎の発症率と関節炎スコアーを算出した(図3,4)。関節炎の発症率については、四肢のうち一箇所でも関節炎が発症した場合に「発症」と判定した。また関節炎スコアーについては、関節炎のないものを0として、両手首、足首について完全な腫脹・発赤を1点、不完全な腫脹・発赤を0.5点、各手指、趾について0.1点として評価し、それらを加算して関節炎スコアーとした。28日目のSCR投与終了後、各群のマウスの代表例(関節炎スコアーの中央値にある一個体)の左足首について関節炎の発症状態を組織化学的に調べた(図5)。
【0037】
図3にIFAエマルジョンの皮下注射後の日数と関節炎の発症率との関係を示す。コントロール群ではIFAエマルジョンの皮下注射後、12日後に100%の頻度で関節炎を発症したのに対し、SCR投与群では18日後に100%の頻度で関節炎を発症した。すなわち、SCRの投与により関節炎の発症を遅延させる効果があることが示された。
【0038】
図4にIFAエマルジョンの皮下注射後の日数と関節炎スコアーとの関係を示す。すなわち、コントロール群では、IFAエマルジョンの皮下注射後、26−28日後に関節炎スコアーが「3.6」に達したのに対し、SCR投与群では26日後に「2.7」、28日後には「2.3」と低い値を示し、有意に関節炎の抑制がみられた。
【0039】
図5(a)〜(d)に関節組織染色の結果(写真)を示す。(a)と(b)はコントロール群の結果、(c)と(d)はSCR投与群の結果である。すなわち、コントロール群のマウスでは滑膜細胞の増殖、炎症細胞浸潤、骨破壊が見られたが、SCR投与群のマウスでは滑膜細胞の増殖や炎症細胞浸潤が少なく、骨破壊が抑制されていた。
【0040】
さらに各群のマウスについて、体重の変化をグラフ化した(図6)。その結果、SCR投与群の方が常に高い体重を保っており、炎症性の痩せが抑制されていると考えられた。
【図面の簡単な説明】
【0041】
【図1】SCR−AIのドメイン構造を模式的に表す説明図である。
【図2】実施例で作成した可溶性SCRのドメイン構造を模式的に表す説明図である。
【図3】IFAエマルジョン皮下注射後の日数と関節炎の発症率との関係を表すグラフである。
【図4】IFAエマルジョン皮下注射後の日数と関節炎スコアーとの関係を表すグラフである。
【図5】関節組織染色の結果を表す写真であり、(a)と(b)はコントロール群の結果、(c)と(d)はSCR投与群の結果を表す。
【図6】IFAエマルジョン皮下注射後の日数と体重の変化との関係を表すグラフである。
【技術分野】
【0001】
本発明は関節リウマチ治療剤に関し、さらに詳細には、スカベンジャー受容体タイプAに由来するポリペプチドを有効成分として含有する関節リウマチ治療剤に関する。本発明の関節リウマチ治療剤は、関節特異性が特に高いものである。
【背景技術】
【0002】
従来より、関節リウマチの治療薬として非ステロイド性抗炎症薬、ステロイド剤、抗リウマチ薬、免疫抑制剤等の各種医薬が使用されている(特許文献1)。さらに近年、腫瘍壊死因子−α(TNF−α)、インターロイキン−1(IL−1)、インターロイキン−6(IL−6)といった炎症性サイトカインを標的とした生物学的製剤(サイトカイン阻害剤)が開発され、関節リウマチの治療に応用されている。例えば、TNF−α阻害剤として抗TNF−α抗体や可溶性TNF−α受容体を、IL−6阻害剤として抗IL−6受容体抗体を、IL−1阻害剤としてIL−1受容体アンタゴニストをそれぞれ有効成分とする生物学的製剤が開発されている。これらの製剤の関節リウマチに対する効果は急速かつ劇的であり、多くの関節リウマチ患者において高い治療成績を収めている。
【0003】
一方で、これらの炎症性サイトカインを標的としたサイトカイン阻害剤の問題点も指摘されている。すなわち、これらのサイトカインは関節特異的ではなく生理機能全体に関係するものであるので、その抑制によって患者の免疫力が低下し、感染症や癌の発症リスクが高まるおそれがある。また、滑膜細胞の増殖を完全に抑制することはできず、骨破壊の進行を遅らせるにとどまる。このような背景の下、関節特異的に作用する関節リウマチ治療薬が求められている。
【特許文献1】特開2007−326824公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
上記現状に鑑み、本発明は関節特異的に作用する新規の関節リウマチ治療薬を提供することを目的とする。
【課題を解決するための手段】
【0005】
上記した課題を解決するための請求項1に記載の発明は、スカベンジャー受容体クラスAの全部又は一部を含み且つリガンド結合活性を有するポリペプチドを有効成分として含有する関節リウマチ治療剤である。
【0006】
本発明の関節リウマチ治療剤は、スカベンジャー受容体クラスAの全部又は一部を含むポリペプチドを有効成分とするものであり、且つ当該ポリペプチドはリガンド結合活性を有するものである。本発明の関節リウマチ治療剤は、スカベンジャー受容体クラスAの作用を利用するものであるので、関節特異性が高い。そのため、免疫力低下の副作用が小さく、感染症等の発症リスクを低く抑えることができる。また、本発明の関節リウマチ治療剤は滑膜細胞の増殖抑制作用が特に高く、骨破壊の進行を高度に抑制することができる。
【0007】
「スカベンジャー受容体クラスAの全部又は一部を含むポリペプチド」としては、例えば、以下の(a)〜(c)が挙げられる。
(a)スカベンジャー受容体Aの全部からなるポリペプチド(スカベンジャー受容体Aの全長、スカベンジャー受容体Aそのもの)、
(b)スカベンジャー受容体Aの一部からなるポリペプチド(スカベンジャー受容体Aの部分断片)、
(c)上記(a)又は(b)に他のポリペプチド・タンパク質等が付加したもの。
さらに(c)の具体例としては、(a)又は(b)と他のタンパク質との融合タンパク質が挙げられる。
【0008】
前記ポリペプチドがコラーゲン様ドメインを含むものである構成が好ましい(請求項2)。
【0009】
前記ポリペプチドがαヘリカル・コイルドコイル・ドメインを含むものである構成が好ましい(請求項3)。
【0010】
前記スカベンジャー受容体クラスAは、配列番号2で表されるアミノ酸配列、又は当該アミノ酸配列において1若しくは数個のアミノ酸残基が欠失、置換若しくは付加されたアミノ酸配列からなるものであってもよい(請求項4)。
【発明の効果】
【0011】
本発明の関節リウマチ治療剤は関節特異性が高いので、免疫力低下の副作用が小さく、感染症等の発症リスクを低く抑えることができる。さらに、本発明の関節リウマチ治療剤は滑膜細胞の増殖抑制作用が特に高く、骨破壊の進行を高度に抑制することができる。
【発明を実施するための最良の形態】
【0012】
以下、本発明を実施するための最良の形態について詳細に説明する。
【0013】
まず、スカベンジャー受容体について説明する。スカベンジャー受容体(以下、「SCR」と略記することがある。)とは、変性した低密度リポタンパク質(変性LDL)を認識する受容体群の総称である。SCRは動脈硬化に関与する受容体として児玉らによって精製され、その遺伝子構造も明らかにされている(Proc. Natl. Acad. Sci. USA, 85, 9238-9242, 1988、及びNature, 353, 531-535, 1990)。SCRは構造的特徴により3つのクラスA〜Cに分類されている。このうち、スカベンジャー受容体クラスA(以下、「SCR−A」と略記することがある。)は最初に見出されたSCRであり、主にマクロファージ系細胞に発現している。さらに、SCR−Aには選択的スプライシングによって生じる4種のアイソフォーム(タイプI,タイプII,タイプIII,MACRO)が知られている。
【0014】
スカベンジャー受容体クラスA(SCR−A)は、分子量約8万の糖タンパク質(サブユニット)3個がホモ三量体を形成した構造を有する複合タンパク質である。SCR−AはそのN末端側が細胞内、C末端側が細胞外に位置している。SCR−AのタイプI(SCR−AI)は、N末端から順に細胞内ドメイン、膜貫通ドメイン、スペーサードメイン、αヘリカル・コイルドコイル・ドメイン、コラーゲン様ドメイン、及びシステインリッチドメインの各ドメインから構成されている(図1)。SCR−AのタイプII(SCR−AII)は、システインリッチドメインを欠いている以外はSCR−AIと同様の構造を有する。SCR−Aのリガンド結合活性にはLys/Argクラスターを含むコラーゲン様ドメインが重要な役割を果たしており、このドメインは負の電荷を有するリガンドと相互作用することが知られている。すなわち、負の電荷を有する巨大分子、例えば、核酸、糖鎖、修飾タンパク質、高分子合成物などの広範囲な分子がSCR−Aのリガンドとなり得る。なお、本明細書においては、複合タンパク質とそのサブユニットを特に区別して呼ぶことはしない。例えば、本明細書では「SCR−A」という用語を「三量体を形成したSCR−A」と「SCR−Aのサブユニット」のいずれの意味にも用いる。
【0015】
SCR−Aのアミノ酸配列はヒトと他の哺乳動物との間で高い相同性を有している。例えばタイプIの場合、ヒト−ウシ間で73%、ヒト−マウス間で72%、ヒト−チンパンジー間で96%、ヒト−サル間で95%、ヒト−ウマ間で80%、ヒト−ウサギ間で80%の相同性を示す。このことから、SCR−Aは少なくとも哺乳動物では共通の働きをしていることが強く示唆される。
【0016】
他のタイプに分類されるSCR−Aも、SCR−AIやSCR−AIIと類似する構造を有しており、コラーゲン様ドメインとαヘリカル・コイルドコイル・ドメインを有する点で共通している。
【0017】
本発明の関節リウマチ治療剤の有効成分は、スカベンジャー受容体タイプA(SCR−A)の全部又は一部を含み且つリガンド結合活性を有するポリペプチドである。まず、「SCR−Aの全部又は一部を含むポリペプチド」を取得する方法としては、例えば、該ポリペプチドをコードする遺伝子を構築し、該遺伝子を発現させる遺伝子工学的手法が挙げられる。該遺伝子は、例えば、SCR−AのcDNAを元に構築することができる。SCR−AのcDNAを取得する方法としては、当該技術分野で一般に用いられている方法を適用することができる。例えば、マクロファージからRNAを抽出・精製し、逆転写反応によって1本鎖cDNA、さらにDNA合成反応によって2本鎖cDNAを得ることができる。なお、種々の動物からSCR−AのcDNAがすでに単離されており、それらの塩基配列情報が入手可能であるので、当該情報を参考にしてプライマーやプローブを設計することができる。ここで、ヒトSCR−AIIのcDNAの塩基配列と対応するアミノ酸配列を配列番号1に、アミノ酸配列のみを配列番号2に示す。配列番号2において、アミノ酸番号1(Met)〜50(Lys)が細胞内ドメイン、アミノ酸番号51(Ala)〜76(Leu)が膜貫通ドメイン、アミノ酸番号77(Lys)〜451(Leu)が細胞外ドメインに相当する。さらに、細胞外ドメインのうち、アミノ酸番号171(Asn)〜255(Arg)がαヘリカル・コイルドコイル・ドメイン、アミノ酸番号273(Gly)〜341(Gly)がコラーゲン様ドメインに相当する。
【0018】
さらに、マウスSCR−AIIのcDNAの塩基配列と対応するアミノ酸配列を配列番号3に、アミノ酸配列のみを配列番号4に示す。配列番号4において、アミノ酸番号1(Met)〜55(Lys)が細胞内ドメイン、アミノ酸番号56(Ala)〜78(Ala)が膜貫通ドメイン、アミノ酸番号79(Gln)〜354(Val)が細胞外ドメインに相当する。さらに、細胞外ドメインのうち、アミノ酸番号175(Asn)〜259(Arg)がαヘリカル・コイルドコイル・ドメイン、アミノ酸番号277(Gly)〜348(Val)がコラーゲン様ドメインに相当する。
【0019】
上述したように、「SCR−Aの全部又は一部を含むポリペプチド」としては、例えば、以下の(a)〜(c):
(a)SCR−Aの全部からなるポリペプチド(SCR−Aの全長、SCR−Aそのもの)、
(b)SCR−Aの一部からなるポリペプチド(SCR−Aの部分断片)、
(c)上記(a)又は(b)に他のポリペプチド・タンパク質等が付加したもの、
が挙げられる。
【0020】
(a)のポリペプチドを採用する場合には、所望のSCR−Aの全長をコードするcDNAを取得し、これを発現させればよい。一方、(b)のポリペプチドを採用する場合には、所望のSCR−Aの一部をコードするcDNAを取得し、これを発現させればよい。好ましい実施形態では、コラーゲン様ドメイン及び/又はαヘリカル・コイルドコイル・ドメインを含むポリペプチドが採用される。この好ましい実施形態のポリペプチドは、リガンド結合活性を確実に保持できる。例えば、配列番号5に示すアミノ酸配列からなるポリペプチドは、マウスSCR−AIIのコラーゲン様ドメインとαヘリカル・コイルドコイル・ドメインの両方を含んでいる。すなわち、配列番号5のアミノ酸配列は、配列番号4のアミノ酸番号97(Asp)〜354(Val)に相当する。図2に当該ポリペプチドのドメイン構造を模式的に示す。
【0021】
(c)のポリペプチドを採用する場合には、付加するポリペプチド・タンパク質等によって様々な機能を付与することができる。例えば、血中半減期を長くする目的で、(a)又は(b)のポリペプチドと免疫グロブリンFc領域との融合タンパク質とすることができる。また、可溶性の付与を目的として、(a)又は(b)のポリペプチドと分子シャペロンとの融合タンパク質とすることができる。なお本実施形態においても、コラーゲン様ドメイン及び/又はαヘリカル・コイルドコイル・ドメインを含むものであることが好ましい。
【0022】
他の実施形態では、「SCR−Aの全部又は一部を含むポリペプチド」におけるSCR−Aが、配列番号2で表されるアミノ酸配列、又は当該アミノ酸配列において1若しくは数個のアミノ酸残基が欠失、置換若しくは付加されたアミノ酸配列からなるものである。換言すれば、ヒトSCR−AIIと実質的に同一とみなせるタンパク質の全部又は一部を含むポリペプチドである。
【0023】
本発明において、SCR−Aの全部又は一部を含むポリペプチドは、リガンド結合活性を有する必要がある。上述したように、負の電荷を持つ広範囲な巨大分子(核酸、糖鎖、修飾タンパク質、高分子合成物など)がリガンドとなり得る。例えば、アセチル化LDL(AcLDL)、酸化LDL(OxLDL)、フコイダン、ポリイノシン酸(Poly I)、デキストラン硫酸、リポ多糖(LPS)、ムチンがリガンドの例として挙げられる。リガンド結合活性の有無は公知の方法で調べることができ、例えば、標識化合物を用いた競合アッセイによって調べることができる。
【0024】
cDNAを発現させる方法としては、公知の方法をそのまま適用することができる。例えば、所望のポリペプチドをコードするcDNAを適宜の発現ベクターに組み込む。さらに該ベクターを適宜の宿主細胞に導入して所望のポリペプチドを生産できる形質転換体を作成する。そして、該形質転換体を培養し、その培養物から所望のポリペプチドを採取することができる。ポリペプチドの精製についても、タンパク質精製に通常用いられている方法をそのまま適用することができ、各種のクロマトグラフィー、塩析、濃縮、膜分離等の手法を適宜組み合わせて精製することができる。
【0025】
本発明の関節リウマチ治療剤の投与経路としては特に限定はなく、経口投与と非経口投与のいずれでもよいが、有効成分がポリペプチドであることを考慮すると非経口投与、特に注射による投与が好ましい。例えば、皮下、静脈内、筋肉内、あるいは患部への直接投与を採用することができる。他の非経口投与経路、例えば、経皮的投与(パッチ剤等)や直腸内投与(坐剤等)を採用してもよい。一方、経口的に投与する場合は、錠剤、カプセル剤、散剤、細粒剤、液剤、トローチ剤、ゼリー剤等の剤型を採用することができる。これらの投与経路や剤型は、それぞれ単独で又は組み合わせて使用することができる。また、これらの製剤には必要に応じて、安定化剤、防腐剤、賦形剤、崩壊剤、結合剤、滑沢剤等の添加剤が用いられる。例えば、凍結乾燥注射剤とする場合には、原薬となる上記ポリペプチドにアルブミン、アミノ酸、ポリオール、糖類などからなる安定化剤や賦形剤を添加して調製した薬液を無菌ろ過し、無菌充填及び凍結乾燥を行えばよい。
【0026】
本発明の関節リウマチ治療剤の投与量は、投与の目的や患者の状況(例えば、性別、年齢、体重等)に応じて適宜選択すればよい。例えば、成人の場合、経口投与で1日あたり1mg〜1000mg程度、好ましくは15mg〜150mg程度、非経口投与で1日あたり0.1mg〜100mg程度、好ましくは1.5mg〜15mg程度投与すればよい。
【0027】
本発明の関節リウマチ治療剤は、従来の関節リウマチ治療薬と併用することができる。例えば、非ステロイド性抗炎症薬、ステロイド剤、抗リウマチ薬、免疫抑制剤等の関節リウマチ治療剤、さらに、炎症性サイトカイン(TNF−α、IL−1、IL−6等)の阻害剤との併用が可能である。
【0028】
以下に、実施例をもって本発明をさらに具体的に説明するが、本発明はこれらの実施例に限定されるものではない。
【実施例】
【0029】
1.マウス由来マクロファージスカベンジャー受容体タイプAの一部を含むポリペプチド(可溶性SCR)の作成
【0030】
マウスマクロファージより調製したmRNAを鋳型として逆転写反応を行い、cDNAを調製した。このcDNAを鋳型とし、配列番号6と7で表されるオリゴヌクレオチドをプライマー対としてPCRを行い、マウス由来スカベンジャー受容体タイプA細胞外ドメインの一部(可溶性SCR)をコードする遺伝子を含むDNA断片を取得した。当該可溶性SCRのドメイン構造を図2に、アミノ酸配列を配列番号5に示す。
【0031】
取得した増幅DNA断片をpFLAG−CMV3ベクター(シグマアルドリッチ社)のマルチクローニングサイトに挿入し、可溶性SCRを発現する哺乳動物細胞発現用ベクターを構築した。この際、タグとしてのFLAG配列が可溶性SCRのC末端側に融合されるように発現ベクターを設計した。この発現ベクターをCHO−K1細胞にトランスフェクトし、可溶性SCRを発現する形質転換細胞をクローニングした。この形質転換細胞を2%牛胎児血清、500μg/mL G418、50units/mLペニシリン、50μg/mLストレプトマイシンを含むOpti−MEM培地(インビトロジェン社)を用いて、37℃、5%CO2下で培養した。
【0032】
形質転換細胞のコンディションメディウムを回収し、遠心後の上清に硫酸アンモニウム(50%飽和)を加えた。遠心後の沈殿物をトリス−塩酸緩衝液に再溶解し、同緩衝液に対して透析を行った。この透析試料を抗FLAG抗体(M1)が架橋されたアガロースビーズを充填したカラムにアプライした。カラムを洗浄後、結合したタンパク質を溶出した。この溶出画分をPBSに対して透析し、可溶性SCR標品とした。本画分における可溶性SCRの純度を銀染色によるSDS−PAGEにて確認した。調製した可溶性SCR標品のエンドトキシン濃度をパイロジェントシングルテスト(Cambrex Bio Science Walkersville社)を用いて測定し、エンドトキシン濃度が0.05EU/mL以下であることを確認した。
【0033】
2.マウス関節炎モデルを用いた可溶性SCRの関節リウマチ治療効果の評価
コラーゲン誘導関節炎(collagen induced arthritis; CIA)モデルマウスを用いて、可溶性SCRのCIA抑制効果を評価した。
【0034】
完全フロイントアジュバント(CFA;Chondrex社製#7008;1mg/mL)1mLとウシコラーゲン(Bovine Collagen;Chondrex社製#20022)1mLを氷上にて約15分間混合し、CFAエマルジョンを作成した。6週齢のDBA/1Jマウス(雌)を18匹準備し、各マウスについて、尾の付け根から2cm程度離れた箇所にCFAエマルジョン100μLを皮下注射した。そのまま21日間飼育した。
【0035】
不完全フロイントアジュバント(IFA;Chondrex社製#7002;1mg/mL)1mLとウシコラーゲン(Bovine Collagen;Chondrex社製#20022)1mLを氷上にて約15分間混合し、IFAエマルジョンを作成した。飼育21日目の各マウスについて、尾の付け根から2cm程度離れた箇所にIFAエマルジョン100μLを皮下注射した。この時点で各マウスを2群(投与群とコントロール群)に分けた。
【0036】
投与群のマウス(8匹)について、SCR5μg(0.031μg/μLの希釈液160μL)を隔日で28日間腹腔内投与した(計100μg)。一方、SCR精製時に透析を行っているため、この透析外液であるPBSをコントロールとして用いることとし、コントロール群のマウス(10匹)については、透析外液を同様に希釈した溶液160μLを用いて隔日で28日間腹腔内投与した。この間、2日おきに関節の腫脹・発赤の状態を目視観察し、関節炎の発症率と関節炎スコアーを算出した(図3,4)。関節炎の発症率については、四肢のうち一箇所でも関節炎が発症した場合に「発症」と判定した。また関節炎スコアーについては、関節炎のないものを0として、両手首、足首について完全な腫脹・発赤を1点、不完全な腫脹・発赤を0.5点、各手指、趾について0.1点として評価し、それらを加算して関節炎スコアーとした。28日目のSCR投与終了後、各群のマウスの代表例(関節炎スコアーの中央値にある一個体)の左足首について関節炎の発症状態を組織化学的に調べた(図5)。
【0037】
図3にIFAエマルジョンの皮下注射後の日数と関節炎の発症率との関係を示す。コントロール群ではIFAエマルジョンの皮下注射後、12日後に100%の頻度で関節炎を発症したのに対し、SCR投与群では18日後に100%の頻度で関節炎を発症した。すなわち、SCRの投与により関節炎の発症を遅延させる効果があることが示された。
【0038】
図4にIFAエマルジョンの皮下注射後の日数と関節炎スコアーとの関係を示す。すなわち、コントロール群では、IFAエマルジョンの皮下注射後、26−28日後に関節炎スコアーが「3.6」に達したのに対し、SCR投与群では26日後に「2.7」、28日後には「2.3」と低い値を示し、有意に関節炎の抑制がみられた。
【0039】
図5(a)〜(d)に関節組織染色の結果(写真)を示す。(a)と(b)はコントロール群の結果、(c)と(d)はSCR投与群の結果である。すなわち、コントロール群のマウスでは滑膜細胞の増殖、炎症細胞浸潤、骨破壊が見られたが、SCR投与群のマウスでは滑膜細胞の増殖や炎症細胞浸潤が少なく、骨破壊が抑制されていた。
【0040】
さらに各群のマウスについて、体重の変化をグラフ化した(図6)。その結果、SCR投与群の方が常に高い体重を保っており、炎症性の痩せが抑制されていると考えられた。
【図面の簡単な説明】
【0041】
【図1】SCR−AIのドメイン構造を模式的に表す説明図である。
【図2】実施例で作成した可溶性SCRのドメイン構造を模式的に表す説明図である。
【図3】IFAエマルジョン皮下注射後の日数と関節炎の発症率との関係を表すグラフである。
【図4】IFAエマルジョン皮下注射後の日数と関節炎スコアーとの関係を表すグラフである。
【図5】関節組織染色の結果を表す写真であり、(a)と(b)はコントロール群の結果、(c)と(d)はSCR投与群の結果を表す。
【図6】IFAエマルジョン皮下注射後の日数と体重の変化との関係を表すグラフである。
【特許請求の範囲】
【請求項1】
スカベンジャー受容体クラスAの全部又は一部を含み且つリガンド結合活性を有するポリペプチドを有効成分として含有する関節リウマチ治療剤。
【請求項2】
前記ポリペプチドは、コラーゲン様ドメインを含むものである請求項1に記載の関節リウマチ治療剤。
【請求項3】
前記ポリペプチドは、αヘリカル・コイルドコイル・ドメインを含むものである請求項1又は2に記載の関節リウマチ治療剤。
【請求項4】
前記スカベンジャー受容体クラスAは、配列番号2で表されるアミノ酸配列、又は当該アミノ酸配列において1若しくは数個のアミノ酸残基が欠失、置換若しくは付加されたアミノ酸配列からなるものである請求項1〜3のいずれかに記載の関節リウマチ治療剤。
【請求項1】
スカベンジャー受容体クラスAの全部又は一部を含み且つリガンド結合活性を有するポリペプチドを有効成分として含有する関節リウマチ治療剤。
【請求項2】
前記ポリペプチドは、コラーゲン様ドメインを含むものである請求項1に記載の関節リウマチ治療剤。
【請求項3】
前記ポリペプチドは、αヘリカル・コイルドコイル・ドメインを含むものである請求項1又は2に記載の関節リウマチ治療剤。
【請求項4】
前記スカベンジャー受容体クラスAは、配列番号2で表されるアミノ酸配列、又は当該アミノ酸配列において1若しくは数個のアミノ酸残基が欠失、置換若しくは付加されたアミノ酸配列からなるものである請求項1〜3のいずれかに記載の関節リウマチ治療剤。
【図1】


【図2】


【図3】


【図4】


【図6】


【図5】




【図2】


【図3】


【図4】


【図6】


【図5】


【公開番号】特開2011−93804(P2011−93804A)
【公開日】平成23年5月12日(2011.5.12)
【国際特許分類】
【出願番号】特願2008−32226(P2008−32226)
【出願日】平成20年2月13日(2008.2.13)
【出願人】(504322611)学校法人 京都産業大学 (27)
【Fターム(参考)】
【公開日】平成23年5月12日(2011.5.12)
【国際特許分類】
【出願日】平成20年2月13日(2008.2.13)
【出願人】(504322611)学校法人 京都産業大学 (27)
【Fターム(参考)】
[ Back to top ]

