関節リウマチ疾患の検査方法および検査用キット
【課題】本発明は、関節リウマチ(RA)疾患の検査方法に関し、簡便かつ再現性の高い疾患マーカーを解明し、効果的な検査方法を提供することを課題とする。さらには、本発明はRA疾患について、簡便かつ再現性の高い検査用キットを提供することを課題とする。
【解決手段】採取した血液中のIL−17FをRA疾患の診断用および治療効果判定用のマーカーとし、被験者の血液中のIL−17F量を測定することによる。具体的には、免疫学的手法により、IL−17F量を測定することによる。RA疾患検査用キットは、少なくとも、抗IL−17F抗体を固着させた固相担体を含む。
【解決手段】採取した血液中のIL−17FをRA疾患の診断用および治療効果判定用のマーカーとし、被験者の血液中のIL−17F量を測定することによる。具体的には、免疫学的手法により、IL−17F量を測定することによる。RA疾患検査用キットは、少なくとも、抗IL−17F抗体を固着させた固相担体を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、関節リウマチ(Rheumatoid Arthritis; RA)疾患の検査方法に関する。より詳しくは、関節リウマチ疾患のマーカーとして、血液中のIL−17F量を測定することを特徴とする関節リウマチの検査方法に関する。さらには、本発明は関節リウマチ疾患の検査用キットに関する。
【背景技術】
【0002】
関節リウマチ(以下、単に「RA]という場合がある。)は関節内の軟骨や骨の破壊を引き起こす慢性炎症性疾患であり、自己免疫疾患の1種である。わが国においては、成人の約1%が影響を受けているといわれている。RAはどの年齢でも発症するが、30歳代から50歳代で発症する場合が多い。病因は不明であるが、微生物の関与など何らかの原因により、関節腔の内面を覆っている滑膜細胞の増殖が起こるといわれている。また、関節の血管が増加し、血管内から関節滑膜組織にリンパ球、マクロファージなどの白血球が遊走し、関節局所で免疫応答が起こり、リンパ球やマクロファージが産生するサイトカインの作用等により炎症反応が引き起こされ、軟骨・骨の破壊が進行するといわれている。
【0003】
RAの診断基準のひとつとして、DAS28とEULAR改善基準がある。DAS(disease activity score)は、ヨーロッパリウマチ連盟(European League Against Rheumatism;EULAR)が推奨する評価方法である。DASにより、1)Ritchie関節指数、2)腫脹関節、3)患者による全般健康状態(VAS(visual analog scale)による)、4)赤血球沈降速度(ESR)またはC−反応性タンパク質(CRP)、の4項目を測定し、公式により算出し、疾患の活動性の絶対値を算出する。従来のDASは煩雑であるため、DASの関節評価を28関節のみに絞り込んだ基準をDAS28という。EULAR改善基準は、このDASが基本となっている。治療前に対する治療後のDAS値の二つを組合わせて、治療効果を反応良好(good)、中等度反応(moderate)、反応なし(no response)の3段階で評価している(http://www.imaginex.jp/doctor/doc3/kijun/html/kijun_3_2.html)。
【0004】
従来、インターロイキン17A(以下、IL−17A)およびその産生CD4+T細胞であるTh17細胞が、RAなどの自己免疫疾患と関連するとの報告が数多くなされている。IL−17FはIL−17Aと同じIL−17サイトカインファミリーに存在することから、抗IL−17A抗体や抗IL−17F抗体を投与し、IL−17AやIL−17Fの発現を抑制することで、RA疾患の治療に応用するというアイデアが開示されている(特許文献1、2)。しかしながら、ヒトRA症例における統計学的に有意なデータはない。
【0005】
一方で、RAにおけるIL−17Aの存在およびその病原性に疑問を呈する報告がいくつかなされている。RA症例における血清中および関節液中のIL−17Aは、主にmRNAレベルでの解析ではあるが、非炎症性疾患である変形性関節疾患も比べて高値であると報告されている(非特許文献1、2)。しかしながら、100例を超えるRA症例を集めた最新の研究によると、血清および関節液中のTh17細胞は健常者と比較しても増加しておらず、むしろIFN−γを産生するTh1細胞の比率が増加していたとの報告がなされている(非特許文献3)。
【0006】
上記のような再現性の乏しさの原因として、1)従来の報告の多くは、IL−17AはmRNAの発現を測定しており、タンパク質レベル、かつ統計学的に有意なレベルで実際にIL−17Aを測定したという報告がないこと、2)IL−17Aが上昇しているとのデータのほとんどはマウス関節モデルに由来しており、ヒトとマウスでIL−17Aの産生パターンや機能に差があることが予想されること、3)IL−17ファミリーの他のサイトカインが、ヒトにおいて重要な役割を担っている可能性があること、などの3点が考えられる。
【0007】
RA疾患について、従来のDAS28やEULAR改善基準によると、患者自身の主観的な判断が必要とされるが、患者自身の痛み等に対する評価は、個人によってばらつきがあるため、客観的な効果を判定するのが困難である。RA疾患の診断および治療による予後の推定のために、より簡便で再現性の高い疾患マーカーの解明や、検査方法の開発が望まれている。
【特許文献1】国際公開2007/149032号パンフレット
【特許文献2】国際公開2008/047134号パンフレット
【非特許文献1】Ziolkowska, M. et al., J. Immunol, 164, 2832-2838 (2000)
【非特許文献2】Kotake, S. et al., J. Clin Invest, 103, 1345-1352 (1999)
【非特許文献3】Yamada, H. et al., Ann Rheum Dis (2007)
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明は、RA疾患の検査方法に関し、簡便かつ再現性の高い疾患マーカーを解明し、効果的な検査方法を提供することを課題とする。さらには、本発明はRA疾患について、簡便かつ再現性の高い検査用キットを提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するために、ヒトリウマチ性疾患症例の患者についてIL−17AおよびIL−17Fのタンパク質の発現量に着目した結果、RA疾患患者において驚くべきことにIL−17Fの明らかな上昇を観察した。一方、IL−17Aについては、有意な発現を観察することはできなかった。そこで、IL−17Fの発現量について、鋭意研究を重ねた結果、採取した血液中のIL−17FがRA疾患の診断マーカーおよび治療薬の投与効果に関するマーカーとなりうることを見出し、RA疾患の検査方法としてIL−17F量を測定する本発明を完成した。
【0010】
すなわち、本発明は以下よりなる。
1.採取した血液中のIL−17F量を測定することを特徴とするRA疾患の検査方法。
2.以下の工程を含む、前項1に記載のRA疾患の検査方法:
1)採取した血液から血清を分離取得し、検査用検体とする工程;
2)検査用検体中のIL−17F量を測定する工程。
3.IL−17F量の測定が、免疫学的手法により測定される、前項1または2に記載のRA疾患の検査方法。
4.免疫学的手法が、ELISA法である前項3に記載のRA疾患の検査方法。
5.RA疾患の検査が、RA疾患の診断またはRA治療薬の治療効果の判定のために行われる前項1〜4のいずれか1に記載のRA疾患の検査方法。
6.RA治療薬の治療効果を判定するために行われる検査が、RA治療薬の投与前および投与後に採取した各血液中のIL−17F量を測定し、各血液中のIL−17F量を比較することを特徴とする、前項5に記載のRA疾患の検査方法。
7.RA治療薬の治療効果を判定するために行われる検査が、以下の工程を含む前項6に記載の検査方法:
1)RA治療薬の投与前および投与後に採取した各血液から血清を分離取得し、各検査用検体とする工程;
2)各検査用検体中のIL−17F量を測定する工程;
3)上記2)で得られた結果をもとに、RA治療薬の投与前および投与後の各検査用検体中のIL−17F量比を算出する工程。
8.少なくとも、IL−17Fを捕捉しうる抗体を固着させた固相担体を含む、前項1〜7にいずれか1に記載の関節リウマチ疾患の検査方法に使用する関節リウマチ疾患検査用キット。
【発明の効果】
【0011】
本発明の、血液中のIL−17F量を測定するRA疾患の検査方法は再現性があり、従来の検査方法に比べて信頼性が高く、かつ簡易に検査することができる。また、本発明の方法を用いてRA治療薬による治療効果の判定を行うと、患者自身の痛み等に対する主観的な判断を必要としないので、客観的に効果を判定することができ、非常に有用である。
【発明を実施するための最良の形態】
【0012】
本発明のRA疾患の検査方法は、採取した血液中に含まれるIL−17F量を測定することによる。本発明の検査方法において、被験検体は、被験者から採取した血液が挙げられ、好ましくは該血液から分離取得した血清を検査用検体とすることができる。血清の取得方法は特に限定されず、自体公知の方法、例えば血液から臨床検査用検体として取得する血清の分離方法に準じることができる。具体的には、血液検体を静置した後の上清や、遠心分離したときの上清などから取得することができる。好ましくは、例えば、採取した血液を試験管等に採り、室温で10分間3500rpmで遠心分離して得られる上清の血清を検査用検体とすることができる。
【0013】
本発明のRA疾患の検査方法は、血液検体由来の検体を検査することができる点で、関節液を採取して検査する方法に比べて、検体の取得が容易であり、通常の臨床検査に使用する検査用検体を用いることができる点で有利である。関節液は、侵襲的方法により採取されるので、痛みを伴うなどの患者負担が大きく、また出血や感染症などの合併症も危惧されることから、関節液を検査するのは、ルーチン的な検査方法としてはあまり好ましくないが、血清などの血液由来検体を検査用検体としてIL−17Fを測定する本発明の検査方法によると、上述の問題点が解消され、RAの検査を有利に行うことができる。
【0014】
本発明において、IL−17F量は、IL−17Fの発現量をいい、IL−17Fタンパク質の量を意味する。従来の報告の多くは、IL−17AのmRNAの発現量を測定していたが、測定結果に再現性がないことが問題であった。また、IL−17Aのタンパク質レベルについては、本発明者らの知る限り、統計学的に有意な測定結果の報告はなかった。
【0015】
本発明において、IL−17Fのタンパク質量の測定方法は、特に限定されないが、免疫学的手法によることができる。例えば、抗IL−17F抗体を用いてIL−17Fとの抗原抗体反応を利用して測定する方法が挙げられる。固相担体に抗IL−17F抗体を固着し、検査用検体を固相担体と接触させて検体中のIL−17Fを抗IL−17F抗体で捕捉し、捕捉したIL−17Fを、標識物質を用いて測定する方法が挙げられる。あるいは、抗IL−17F抗体に対する抗体(例えば、抗IL−17F抗体が、抗マウス抗体の場合には、抗マウス抗体に対する抗体など)を固相担体に予め固着しておき、別途、検査用検体と抗IL−17F抗体を反応させて形成させた免疫複合体を固相担体で捕捉し、該捕捉した免疫複合体を標識物質を用いて測定することもできる。具体的には、酵素免疫定量法(Enzyme-linked immunosorbent assay:ELISA法)やイムノブロッティング法などを用いることができる。
【0016】
測定に使用される固相担体は、例えばポリスチレン、ポリエチレン、ポリプロピレン、ポリ塩化ビニル、ポリエステル、ポリアクリル酸エステル、ナイロン、ポリアセタール、フッ素樹脂等の合成樹脂、セルロース、アガロース等の多糖類、ガラス、金属などの材質が挙げられる。固相担体の形状としては、例えばマイクロプレート状、球状、繊維状、棒状、盤状、容器状、セル、試験管等の種々の形状とすることができる。
【0017】
抗体の固着(固相化)は、公知の方法によることができ、例えば化学結合法や物理的吸着法によることができる。化学的結合法としては、例えばグルタルアルデヒドを用いる方法、N-スクシニイミジル-4-(N-マレイミドメチル)シクロヘキサン-1-カルボキシレートおよびN-スクシニイミジル-2-マレイミドアセテートなどを用いるマレイミド法、1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸などを用いるカルボジイミド法が挙げられる。その他、マレイミドベンゾイル-N-ヒドロキシサクシニミドエステル法、N-サクシミジル-3-(2-ピリジルジチオ)プロピオン酸法、ビスジアゾ化ベンジジン法、ジパルミチルリジン法が挙げられる。
【0018】
標識物質は、免疫学的測定法に使用可能であれば特に限定されない。具体的には、酵素、蛍光物質、発光物質、放射性物質、金属キレート等を使用することができる。好ましい標識酵素としては、例えばペルオキシダーゼ、アルカリホスファターゼ、β-D-ガラクトシダーゼ、リンゴ酸デヒドロゲナーゼ、ブドウ球菌ヌクレアーゼ、デルタ-5-ステロイドイソメラーゼ、α-グリセロールホスフェートデヒドロゲナーゼ、トリオースホスフェートイソメラーゼ、西洋わさびペルオキシダーゼ、アスパラギナーゼ、グルコースオキシダーゼ、リボヌクレアーゼ、ウレアーゼ、カタラーゼ、グルコース−6−ホスフェートデヒドロゲナーゼ、グルコアミラーゼ、およびアセチルコリンエステラーゼ等が挙げられる。好ましい蛍光物質としては、例えばフルオレセインイソチアネート、フィコビリプロテイン、ローダミン、フィコエリトリン、フィコシアニン、アロフィコシアニン、およびオルトフタルアルデヒド等が挙げられる。好ましい発光物質としてはイソルミノール、ルシゲニン、ルミノール、芳香族アクリジニウムエステル、イミダゾール、アクリジニウム塩およびその修飾エステル、ルシフェリン、ルシフェラーゼ、やエクオリン等が挙げられる。そして好ましい放射性物質としては、125I、127I、131I、14C、3H、32P、または35S等が挙げられる。
【0019】
前記標識物質を抗体に結合させる手法は公知である。具体的には、直接標識と間接標識を利用することが利用できる。直接標識としては、架橋剤によって抗体、あるいは抗体断片と標識とを化学的に共有結合する方法が一般的である。架橋剤としては、N,N'-オルトフェニレンジマレイミド、4-(N-マレイミドメチル)シクロヘキサン酸・N-スクシンイミドエステル、6-マレイミドヘキサン酸・N-スクシンイミドエステル、4,4'-ジチオピリジン、その他公知の架橋剤を利用することができる。これらの架橋剤と酵素および抗体との反応は、それぞれの架橋剤の性質に応じて既知の方法に従って行えばよい。この他、抗体にビオチン、ジニトロフェニル、ピリドキサールまたはフルオレサミンのような低分子ハプテンを結合させておき、これを認識する結合成分によって間接的に標識する方法を採用することもできる。ビオチンに対してはアビジンやストレプトアビジンが認識リガンドとして利用される。一方、ジニトロフェニル、ピリドキサールまたはフルオレサミンについては、これらのハプテンを認識する抗体が標識される。抗体を標識する場合、西洋わさびペルオキシダーゼを標識化酵素として用いることができる。本酵素は多くの基質と反応することができ、過ヨウ素酸法によって容易に抗体に結合させることができるので有利である。
【0020】
抗IL−17F抗体は、IL−17Fタンパク質を検出しうる抗体であればよく、ポリクローナル抗体であって、モノクローナル抗体であってもよいし、場合によっては、抗体のフラグメント、例えばFab'、Fab、F(ab')2を用いることができる。これらの抗体は、自体公知の方法により作製することができる。
また、ポリクローナル抗体、モノクローナル抗体にかかわらず同様の処理により標識抗体を得ることができる。
【0021】
標識化剤が酵素である場合には、その活性を測定するために基質、必要により発色剤が用いられる。酵素としてペルオキシダーゼを用いる場合には、基質溶液としてH2O2を用い、発色剤として2,2'-アジノ-ジ-[3-エチルベンズチアゾリンスルホン酸]アンモニウム塩(ABTS)、5-アミノサリチル酸、オルトフェニレンジアミン、4-アミノアンチピリン、3,3',5,5'-テトラメチルベンジジン等を使用することができる。酵素にアルカリホスファターゼを用いる場合は、基質としてオルトニトロフェニルホスフェート、パラニトロフェニルリン酸等を使用することができる。酵素にβ-D-ガラクトシダーゼを用いる場合は基質としてフルオレセイン-ジ-(β-D-ガラクトピラノシド)、4-メチルウンベリフェニル-β-D-ガラクトピラノシド等を使用することができる。標識物質の検出方法は、標識物質の種類に応じて、適宜選択することができる。
【0022】
本発明のRA疾患の検査方法では、採取した血液中のIL−17FをRA疾患のマーカーとする。本発明の検査方法により得られたIL−17F量の測定結果からRA疾患を診断することができ、さらには、RA治療薬の治療効果の判定を行うことができる。
【0023】
本発明の検査方法により、リウマチ性疾患症例であるRAや、他の代表的なリウマチ性疾患症例である全身性エリテマトーデス(SLE)、多発性筋炎・皮膚筋炎(PM/DM)や全身性硬化症(SSc)と診断された患者について、IL−17Fを測定し、および本発明の検査方法に準じる方法で、同様にIL−17Aを測定した。その結果、RA患者において、IL−17F量は健常人や他のリウマチ性疾患症例の患者に比べて有意に高値であった。一方、RA患者におけるIL−17Aは、IL−17Fに比べてごくわずかな量しか測定できなかった(実施例1および実施例2参照)。これにより、採取した血液中のIL−17F量を検出マーカーとして、RA疾患の診断を行うことができる。
【0024】
ここで、RA治療薬の治療効果を判定するために行われる検査は、本発明の方法によりRA治療薬の投与前後に採取した各血液中のIL−17F量を測定し、各血液中のIL−17F量を比較することを特徴とする。
具体的には、以下の工程を含む方法による。
1)RA治療薬の投与前および投与後に採取した各血液から血清を分離取得し、各検査用検体とする工程;
2)各検査用検体中のIL−17F量を測定する工程;
3)上記2)で得られた結果をもとに、RA治療薬の投与前および投与後の各検査用検体中のIL−17F量比を算出する工程。
【0025】
上記検査方法により得られたRA疾患治療薬を投与した前後でのIL−17量の比と、治療効果の評価は密接に関係することが判明した。例えば、DAS28とEULAR改善基準での評価とIL−17F測定結果との関係は、CRPやMMP−3など、従来、関節リウマチの活動性をみる指標とされてきた他のマーカーでの結果に比べて、治療効果の程度をより反映していることが確認された(実施例3参照)。
【0026】
ここで、RA治療薬としては、自体公知の治療薬および今後開発されるすべての治療薬を含めることができる。自体公知のRA治療薬としては、例えば生物学的製剤、非ステロイド性抗炎症薬(消炎鎮痛薬)、ステロイド薬、免疫抑制剤が挙げられる。生物学的製剤としては、キメラ型抗TNF−α抗体製剤、可溶性TNFレセプターや、完全ヒト型抗TNF−α抗体製剤、抗IL−6レセプター抗体製剤などが挙げられる。非ステロイド性抗炎症薬としては、プロスタグランジン産生抑制剤が挙げられ、関節の痛みや腫れを軽減化させることはできるが、疾患事態の進行や骨や関節の破壊を抑制することは困難といわれている。ステロイド薬は、優れた抗炎症効果により、RA疾患の特効薬として利用されているが、その副作用も問題である。免疫抑制剤は、RA疾患患者の免疫異常を改善させることによりRAの炎症を抑制し、寛解導入を目的とするもので、RAの進行を阻止する可能性があることから疾患修飾性抗リウマチ薬ともいわれている。効果発現までに時間を要することから遅効性抗リウマチ薬とも呼ばれている。上記のように、RA治療薬は多種類存在するが、治療薬の効果の程度を判定し、最も効果的な治療薬を選択するためにも、本発明の検査方法は、有用である。
【0027】
本発明は、RA疾患検査用キットにも及ぶ。本発明のRA疾患検査用キットは、本発明の検査方法を簡便に実施するためのキットであればよく、特に限定されない。具体的には、少なくとも、IL−17Fを捕捉しうる抗体を固着させた固相担体を含み、標識化合物若しくは標識抗体のほか、標識検出用の試薬等を含めることができる。さらに検査に使用する器具等も含めることができる。キットの構成として使用可能な抗体、標識物質、固相担体等については、上記検査方法で説明した内容をそのまま適用することができる。標識検出用の試薬は、標識化剤が酵素である場合には、その活性を測定するための基質、必要により発色剤を含めることができる。これらについても、上記測定方法で説明した内容をそのまま適用することができる。さらには、必要に応じて、緩衝液などを含めても良い。
【実施例】
【0028】
以下、本発明の理解を深めるために実施例を示して本発明を具体的に説明するが、これらは本発明の範囲を限定するものではないことはいうまでもない。
【0029】
(実施例1)IL−17F量と疾患との関係について
インフォーム・ドコンセントにより承諾を得た157名の被験者から採血し、血清中のIL−17Fタンパク質およびIL−17Aタンパク質の量を測定し、各タンパク質と疾患との関係を調べた。
【0030】
被験者157名の内訳は、変形性関節症(OA)14名、RA66名、全身性エリテマトーデス(SLE)32名、多発性筋炎/皮膚筋炎(PM/DM)22名、強皮症(SSc)22名、健康人23名であり、性別、平均年齢は表1のとおりであった。下記被験者のうち、健康人以外については、米国リウマチ学会(American College of Rheumatology)の基準を満たしていたので、リウマチ性疾患患者として検討を行った。
【表1】

【0031】
上記被験者から採血した血液を血清分離用試験管に採り、室温で10分間3500rpmで遠心分離して上清を得、検査用検体(血清)とした。
【0032】
各被験者の血清中のIL−17FおよびIL−17Aの量は、サンドイッチ法酵素免疫測定(ELISA)キット(R&D Systems社、Cat. No. DY1335およびCat. No. DY317)を用い、それぞれ当該キットの添付文書に記載の方法に従って測定した。使用した標識は、西洋ワサビペルオキシダーゼであり、発色反応の基質として、テトラメチルベンジン(TMB)(eBioscience社製)基質溶液を使用した。発色反応は、室温にて20分行い、1Mリン酸溶液を加えて反応を停止した。各反応は、96穴マイクロプレート(Nunc社)を用いて行った。マイクロプレートリーダー(Bio-Rad Laboratories社、 Model550)を用いて、波長450nmの吸光度で発色度を測定し、各タンパク質を定量した。ここで、各反応系でのタンパク質の最小検出レベルは、IL−17Fが20pg/mlであり、IL−17Aが4pg/mlであった。また、IL−17FとIL−17Aの交差反応は認められなかった。
【0033】
測定結果を、図1(A,B)および表2に示した。
【表2】

【0034】
以上の結果、IL−17F量は、RAにおいて統計学的に高値を示したが、健康人では最も低く、RA以外の各リウマチ性疾患患者においても、RAに比べて有意に低い値であった。一方、IL−17Aはすべての被験者において、IL−17Fに比べて、わずかな量しか検出されず、健康人およびOAを除くリウマチ性疾患患者では、やや高値を示したが、RAとの差は顕著ではなかった。
IL−17Fについて、他の炎症マーカーであるC−反応性タンパク質(CRP)と、リウマチ因子(RF)との相関性を調べ、図2(A,B)に示した。CRPおよびRFは、臨床検査結果より得た値を参照した。その結果、IL−17Fは、CRPとは有意な相関関係を認めなかったが(rs=0.13)、RFとは有意な相関を認め(rs=0.30)、IL−17Fは単なる炎症マーカーではないことが確認された。
以上の結果より、IL−17Fは、RAの新規バイオマーカーとなりうることが示唆された。
【0035】
(実施例2)血清中のIL−17F量について
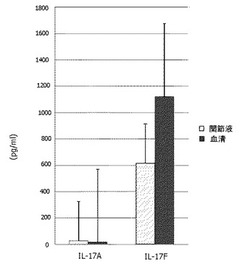
RA患者6名より、血清およびRA患部である関節液を得、これらの検体に含まれるIL−17FおよびIL−17Aの量を測定した。検査用検体である血清は、実施例1と同手法により取得した。関節液は、19ゲージ針をつけた10mlのディスポーザブルシリンジを用いて、罹患膝・肩・肘関節より無菌的に採取した。IL−17FおよびIL−17Aは、実施例1と同手法により測定した。
【0036】
測定結果を、図3に示した。この図からも、IL−17Fの測定値はIL−17Aに比べて高く、IL−17Fのタンパク質の発現量がRA患者では多いことが確認された。さらに、IL−17Fは、関節液よりも血清に多く発現していることが確認された。以上の結果より、血液由来の検体について、IL−17Fを感度良く測定できることが示唆された。
【0037】
(実施例3)IL−17F量でのRA疾患治療薬投与による治療効果の評価
RA疾患患者に、RA疾患治療薬である抗TNF−α製剤を投与したときの治療効果を、IL−17F量の測定により確認した。
実施例1のRA患者のうち40名について、抗TNF−α製剤であるインフリキシマブ製剤(Infliximab(IFX))またはエタネルセプト製剤(Etanercept(ETN))を投与した。各製剤の投与前後に採血し、実施例1と同手法により血清を得、検査用検体とした。各検査用検体について、IL−17Fの他、CRP、MMP−3およびPFの測定を行った。IL−17Fについては、実施例1と同手法により測定し、その他の各因子については通常の臨床検査と同手法により測定した。
ここで、インフリキシマブ製剤は、抗TNF−αマウス・ヒトキメラ型モノクローナル抗体製剤であり、エタネルセプト製剤は、完全ヒト型可溶性TNF−α/LT−αレセプター製剤である。また、これら各生物学的製剤は各添付文書および日本リウマチ学会より示されているガイドラインに基づいて投与された。
【0038】
抗TNF−α製剤投与前の各因子の測定値を1としたときの、投与後の各因子の相対値を算出した。また、各患者について、RA疾患治療薬投与後のEULAR改善基準(http://www.imaginex.jp/doctor/doc3/kijun/html/kijun_3_2.html)による3段階の評価(良好(good)、中等度(moderate)、反応なし(no response))も行った。その結果、IL−17F量の相対値とEULAR改善基準による評価結果が、他の因子に比べて相関性を示すことが確認された(図4)。
【産業上の利用可能性】
【0039】
以上詳述したように、本発明のRA疾患の検査方法で測定した結果は再現性があり、従来の検査方法に比べて、信頼性が高く、かつ簡易に検査することができる。また、RA治療薬の治療効果の判定の場合、従来のDAS28とEULAR改善基準での患者自身の主観的な判断が必要とされるが、患者自身の痛み等に対する評価は、個人によってばらつきがあるため、客観的な効果を判定するのが容易ではなかったのに対し、本発明の方法を用いて治療効果の判定を行うと、信頼性が高く容易に検査可能である他、客観的に効果を判定することができ、非常に有用である。
【0040】
従って、本発明の検査方法は、IL−17F量を高い信頼性で容易に測定することができるので有用である。臨床検査用に取得した検査用検体(血清)を用いることができるので、多くの検査用検体についても、高い信頼性で容易に検査することができる。また、RA治療薬の治療効果の判定に、本発明の検査方法を使用する場合は、治療効果を客観的に判断することができる。これにより、例えば抗TNA−α抗体製剤などの高価な治療薬を投与しても、治療効果が認められない場合などは、他の治療方法を早期に模索することができ、患者自身にとっても有用のみならず、医療経済を考慮しても優れた効果を有する。
【図面の簡単な説明】
【0041】
【図1】各被験者の血清中のIL−17AおよびIL−17F各タンパク質の測定結果を示す図である。(実施例1)
【図2】各被験者の血清中のIL−17F量と、他のマーカーであるリウマチ因子(RF)や炎症マーカーであるCRPとの相関性を示す図である。(実施例1)
【図3】RA疾患患者の血清および関節液中のIL−17AおよびIL−17F量を測定した結果を示す図である。(実施例2)
【図4】RA疾患患者に、RA疾患治療薬である抗TNF−α製剤を投与したときの、IL−17F、CRP、MMP−3値を測定した結果を示し、EULAR改善基準による治療効果との関係を示した図である。(実施例3)
【技術分野】
【0001】
本発明は、関節リウマチ(Rheumatoid Arthritis; RA)疾患の検査方法に関する。より詳しくは、関節リウマチ疾患のマーカーとして、血液中のIL−17F量を測定することを特徴とする関節リウマチの検査方法に関する。さらには、本発明は関節リウマチ疾患の検査用キットに関する。
【背景技術】
【0002】
関節リウマチ(以下、単に「RA]という場合がある。)は関節内の軟骨や骨の破壊を引き起こす慢性炎症性疾患であり、自己免疫疾患の1種である。わが国においては、成人の約1%が影響を受けているといわれている。RAはどの年齢でも発症するが、30歳代から50歳代で発症する場合が多い。病因は不明であるが、微生物の関与など何らかの原因により、関節腔の内面を覆っている滑膜細胞の増殖が起こるといわれている。また、関節の血管が増加し、血管内から関節滑膜組織にリンパ球、マクロファージなどの白血球が遊走し、関節局所で免疫応答が起こり、リンパ球やマクロファージが産生するサイトカインの作用等により炎症反応が引き起こされ、軟骨・骨の破壊が進行するといわれている。
【0003】
RAの診断基準のひとつとして、DAS28とEULAR改善基準がある。DAS(disease activity score)は、ヨーロッパリウマチ連盟(European League Against Rheumatism;EULAR)が推奨する評価方法である。DASにより、1)Ritchie関節指数、2)腫脹関節、3)患者による全般健康状態(VAS(visual analog scale)による)、4)赤血球沈降速度(ESR)またはC−反応性タンパク質(CRP)、の4項目を測定し、公式により算出し、疾患の活動性の絶対値を算出する。従来のDASは煩雑であるため、DASの関節評価を28関節のみに絞り込んだ基準をDAS28という。EULAR改善基準は、このDASが基本となっている。治療前に対する治療後のDAS値の二つを組合わせて、治療効果を反応良好(good)、中等度反応(moderate)、反応なし(no response)の3段階で評価している(http://www.imaginex.jp/doctor/doc3/kijun/html/kijun_3_2.html)。
【0004】
従来、インターロイキン17A(以下、IL−17A)およびその産生CD4+T細胞であるTh17細胞が、RAなどの自己免疫疾患と関連するとの報告が数多くなされている。IL−17FはIL−17Aと同じIL−17サイトカインファミリーに存在することから、抗IL−17A抗体や抗IL−17F抗体を投与し、IL−17AやIL−17Fの発現を抑制することで、RA疾患の治療に応用するというアイデアが開示されている(特許文献1、2)。しかしながら、ヒトRA症例における統計学的に有意なデータはない。
【0005】
一方で、RAにおけるIL−17Aの存在およびその病原性に疑問を呈する報告がいくつかなされている。RA症例における血清中および関節液中のIL−17Aは、主にmRNAレベルでの解析ではあるが、非炎症性疾患である変形性関節疾患も比べて高値であると報告されている(非特許文献1、2)。しかしながら、100例を超えるRA症例を集めた最新の研究によると、血清および関節液中のTh17細胞は健常者と比較しても増加しておらず、むしろIFN−γを産生するTh1細胞の比率が増加していたとの報告がなされている(非特許文献3)。
【0006】
上記のような再現性の乏しさの原因として、1)従来の報告の多くは、IL−17AはmRNAの発現を測定しており、タンパク質レベル、かつ統計学的に有意なレベルで実際にIL−17Aを測定したという報告がないこと、2)IL−17Aが上昇しているとのデータのほとんどはマウス関節モデルに由来しており、ヒトとマウスでIL−17Aの産生パターンや機能に差があることが予想されること、3)IL−17ファミリーの他のサイトカインが、ヒトにおいて重要な役割を担っている可能性があること、などの3点が考えられる。
【0007】
RA疾患について、従来のDAS28やEULAR改善基準によると、患者自身の主観的な判断が必要とされるが、患者自身の痛み等に対する評価は、個人によってばらつきがあるため、客観的な効果を判定するのが困難である。RA疾患の診断および治療による予後の推定のために、より簡便で再現性の高い疾患マーカーの解明や、検査方法の開発が望まれている。
【特許文献1】国際公開2007/149032号パンフレット
【特許文献2】国際公開2008/047134号パンフレット
【非特許文献1】Ziolkowska, M. et al., J. Immunol, 164, 2832-2838 (2000)
【非特許文献2】Kotake, S. et al., J. Clin Invest, 103, 1345-1352 (1999)
【非特許文献3】Yamada, H. et al., Ann Rheum Dis (2007)
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明は、RA疾患の検査方法に関し、簡便かつ再現性の高い疾患マーカーを解明し、効果的な検査方法を提供することを課題とする。さらには、本発明はRA疾患について、簡便かつ再現性の高い検査用キットを提供することを課題とする。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するために、ヒトリウマチ性疾患症例の患者についてIL−17AおよびIL−17Fのタンパク質の発現量に着目した結果、RA疾患患者において驚くべきことにIL−17Fの明らかな上昇を観察した。一方、IL−17Aについては、有意な発現を観察することはできなかった。そこで、IL−17Fの発現量について、鋭意研究を重ねた結果、採取した血液中のIL−17FがRA疾患の診断マーカーおよび治療薬の投与効果に関するマーカーとなりうることを見出し、RA疾患の検査方法としてIL−17F量を測定する本発明を完成した。
【0010】
すなわち、本発明は以下よりなる。
1.採取した血液中のIL−17F量を測定することを特徴とするRA疾患の検査方法。
2.以下の工程を含む、前項1に記載のRA疾患の検査方法:
1)採取した血液から血清を分離取得し、検査用検体とする工程;
2)検査用検体中のIL−17F量を測定する工程。
3.IL−17F量の測定が、免疫学的手法により測定される、前項1または2に記載のRA疾患の検査方法。
4.免疫学的手法が、ELISA法である前項3に記載のRA疾患の検査方法。
5.RA疾患の検査が、RA疾患の診断またはRA治療薬の治療効果の判定のために行われる前項1〜4のいずれか1に記載のRA疾患の検査方法。
6.RA治療薬の治療効果を判定するために行われる検査が、RA治療薬の投与前および投与後に採取した各血液中のIL−17F量を測定し、各血液中のIL−17F量を比較することを特徴とする、前項5に記載のRA疾患の検査方法。
7.RA治療薬の治療効果を判定するために行われる検査が、以下の工程を含む前項6に記載の検査方法:
1)RA治療薬の投与前および投与後に採取した各血液から血清を分離取得し、各検査用検体とする工程;
2)各検査用検体中のIL−17F量を測定する工程;
3)上記2)で得られた結果をもとに、RA治療薬の投与前および投与後の各検査用検体中のIL−17F量比を算出する工程。
8.少なくとも、IL−17Fを捕捉しうる抗体を固着させた固相担体を含む、前項1〜7にいずれか1に記載の関節リウマチ疾患の検査方法に使用する関節リウマチ疾患検査用キット。
【発明の効果】
【0011】
本発明の、血液中のIL−17F量を測定するRA疾患の検査方法は再現性があり、従来の検査方法に比べて信頼性が高く、かつ簡易に検査することができる。また、本発明の方法を用いてRA治療薬による治療効果の判定を行うと、患者自身の痛み等に対する主観的な判断を必要としないので、客観的に効果を判定することができ、非常に有用である。
【発明を実施するための最良の形態】
【0012】
本発明のRA疾患の検査方法は、採取した血液中に含まれるIL−17F量を測定することによる。本発明の検査方法において、被験検体は、被験者から採取した血液が挙げられ、好ましくは該血液から分離取得した血清を検査用検体とすることができる。血清の取得方法は特に限定されず、自体公知の方法、例えば血液から臨床検査用検体として取得する血清の分離方法に準じることができる。具体的には、血液検体を静置した後の上清や、遠心分離したときの上清などから取得することができる。好ましくは、例えば、採取した血液を試験管等に採り、室温で10分間3500rpmで遠心分離して得られる上清の血清を検査用検体とすることができる。
【0013】
本発明のRA疾患の検査方法は、血液検体由来の検体を検査することができる点で、関節液を採取して検査する方法に比べて、検体の取得が容易であり、通常の臨床検査に使用する検査用検体を用いることができる点で有利である。関節液は、侵襲的方法により採取されるので、痛みを伴うなどの患者負担が大きく、また出血や感染症などの合併症も危惧されることから、関節液を検査するのは、ルーチン的な検査方法としてはあまり好ましくないが、血清などの血液由来検体を検査用検体としてIL−17Fを測定する本発明の検査方法によると、上述の問題点が解消され、RAの検査を有利に行うことができる。
【0014】
本発明において、IL−17F量は、IL−17Fの発現量をいい、IL−17Fタンパク質の量を意味する。従来の報告の多くは、IL−17AのmRNAの発現量を測定していたが、測定結果に再現性がないことが問題であった。また、IL−17Aのタンパク質レベルについては、本発明者らの知る限り、統計学的に有意な測定結果の報告はなかった。
【0015】
本発明において、IL−17Fのタンパク質量の測定方法は、特に限定されないが、免疫学的手法によることができる。例えば、抗IL−17F抗体を用いてIL−17Fとの抗原抗体反応を利用して測定する方法が挙げられる。固相担体に抗IL−17F抗体を固着し、検査用検体を固相担体と接触させて検体中のIL−17Fを抗IL−17F抗体で捕捉し、捕捉したIL−17Fを、標識物質を用いて測定する方法が挙げられる。あるいは、抗IL−17F抗体に対する抗体(例えば、抗IL−17F抗体が、抗マウス抗体の場合には、抗マウス抗体に対する抗体など)を固相担体に予め固着しておき、別途、検査用検体と抗IL−17F抗体を反応させて形成させた免疫複合体を固相担体で捕捉し、該捕捉した免疫複合体を標識物質を用いて測定することもできる。具体的には、酵素免疫定量法(Enzyme-linked immunosorbent assay:ELISA法)やイムノブロッティング法などを用いることができる。
【0016】
測定に使用される固相担体は、例えばポリスチレン、ポリエチレン、ポリプロピレン、ポリ塩化ビニル、ポリエステル、ポリアクリル酸エステル、ナイロン、ポリアセタール、フッ素樹脂等の合成樹脂、セルロース、アガロース等の多糖類、ガラス、金属などの材質が挙げられる。固相担体の形状としては、例えばマイクロプレート状、球状、繊維状、棒状、盤状、容器状、セル、試験管等の種々の形状とすることができる。
【0017】
抗体の固着(固相化)は、公知の方法によることができ、例えば化学結合法や物理的吸着法によることができる。化学的結合法としては、例えばグルタルアルデヒドを用いる方法、N-スクシニイミジル-4-(N-マレイミドメチル)シクロヘキサン-1-カルボキシレートおよびN-スクシニイミジル-2-マレイミドアセテートなどを用いるマレイミド法、1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸などを用いるカルボジイミド法が挙げられる。その他、マレイミドベンゾイル-N-ヒドロキシサクシニミドエステル法、N-サクシミジル-3-(2-ピリジルジチオ)プロピオン酸法、ビスジアゾ化ベンジジン法、ジパルミチルリジン法が挙げられる。
【0018】
標識物質は、免疫学的測定法に使用可能であれば特に限定されない。具体的には、酵素、蛍光物質、発光物質、放射性物質、金属キレート等を使用することができる。好ましい標識酵素としては、例えばペルオキシダーゼ、アルカリホスファターゼ、β-D-ガラクトシダーゼ、リンゴ酸デヒドロゲナーゼ、ブドウ球菌ヌクレアーゼ、デルタ-5-ステロイドイソメラーゼ、α-グリセロールホスフェートデヒドロゲナーゼ、トリオースホスフェートイソメラーゼ、西洋わさびペルオキシダーゼ、アスパラギナーゼ、グルコースオキシダーゼ、リボヌクレアーゼ、ウレアーゼ、カタラーゼ、グルコース−6−ホスフェートデヒドロゲナーゼ、グルコアミラーゼ、およびアセチルコリンエステラーゼ等が挙げられる。好ましい蛍光物質としては、例えばフルオレセインイソチアネート、フィコビリプロテイン、ローダミン、フィコエリトリン、フィコシアニン、アロフィコシアニン、およびオルトフタルアルデヒド等が挙げられる。好ましい発光物質としてはイソルミノール、ルシゲニン、ルミノール、芳香族アクリジニウムエステル、イミダゾール、アクリジニウム塩およびその修飾エステル、ルシフェリン、ルシフェラーゼ、やエクオリン等が挙げられる。そして好ましい放射性物質としては、125I、127I、131I、14C、3H、32P、または35S等が挙げられる。
【0019】
前記標識物質を抗体に結合させる手法は公知である。具体的には、直接標識と間接標識を利用することが利用できる。直接標識としては、架橋剤によって抗体、あるいは抗体断片と標識とを化学的に共有結合する方法が一般的である。架橋剤としては、N,N'-オルトフェニレンジマレイミド、4-(N-マレイミドメチル)シクロヘキサン酸・N-スクシンイミドエステル、6-マレイミドヘキサン酸・N-スクシンイミドエステル、4,4'-ジチオピリジン、その他公知の架橋剤を利用することができる。これらの架橋剤と酵素および抗体との反応は、それぞれの架橋剤の性質に応じて既知の方法に従って行えばよい。この他、抗体にビオチン、ジニトロフェニル、ピリドキサールまたはフルオレサミンのような低分子ハプテンを結合させておき、これを認識する結合成分によって間接的に標識する方法を採用することもできる。ビオチンに対してはアビジンやストレプトアビジンが認識リガンドとして利用される。一方、ジニトロフェニル、ピリドキサールまたはフルオレサミンについては、これらのハプテンを認識する抗体が標識される。抗体を標識する場合、西洋わさびペルオキシダーゼを標識化酵素として用いることができる。本酵素は多くの基質と反応することができ、過ヨウ素酸法によって容易に抗体に結合させることができるので有利である。
【0020】
抗IL−17F抗体は、IL−17Fタンパク質を検出しうる抗体であればよく、ポリクローナル抗体であって、モノクローナル抗体であってもよいし、場合によっては、抗体のフラグメント、例えばFab'、Fab、F(ab')2を用いることができる。これらの抗体は、自体公知の方法により作製することができる。
また、ポリクローナル抗体、モノクローナル抗体にかかわらず同様の処理により標識抗体を得ることができる。
【0021】
標識化剤が酵素である場合には、その活性を測定するために基質、必要により発色剤が用いられる。酵素としてペルオキシダーゼを用いる場合には、基質溶液としてH2O2を用い、発色剤として2,2'-アジノ-ジ-[3-エチルベンズチアゾリンスルホン酸]アンモニウム塩(ABTS)、5-アミノサリチル酸、オルトフェニレンジアミン、4-アミノアンチピリン、3,3',5,5'-テトラメチルベンジジン等を使用することができる。酵素にアルカリホスファターゼを用いる場合は、基質としてオルトニトロフェニルホスフェート、パラニトロフェニルリン酸等を使用することができる。酵素にβ-D-ガラクトシダーゼを用いる場合は基質としてフルオレセイン-ジ-(β-D-ガラクトピラノシド)、4-メチルウンベリフェニル-β-D-ガラクトピラノシド等を使用することができる。標識物質の検出方法は、標識物質の種類に応じて、適宜選択することができる。
【0022】
本発明のRA疾患の検査方法では、採取した血液中のIL−17FをRA疾患のマーカーとする。本発明の検査方法により得られたIL−17F量の測定結果からRA疾患を診断することができ、さらには、RA治療薬の治療効果の判定を行うことができる。
【0023】
本発明の検査方法により、リウマチ性疾患症例であるRAや、他の代表的なリウマチ性疾患症例である全身性エリテマトーデス(SLE)、多発性筋炎・皮膚筋炎(PM/DM)や全身性硬化症(SSc)と診断された患者について、IL−17Fを測定し、および本発明の検査方法に準じる方法で、同様にIL−17Aを測定した。その結果、RA患者において、IL−17F量は健常人や他のリウマチ性疾患症例の患者に比べて有意に高値であった。一方、RA患者におけるIL−17Aは、IL−17Fに比べてごくわずかな量しか測定できなかった(実施例1および実施例2参照)。これにより、採取した血液中のIL−17F量を検出マーカーとして、RA疾患の診断を行うことができる。
【0024】
ここで、RA治療薬の治療効果を判定するために行われる検査は、本発明の方法によりRA治療薬の投与前後に採取した各血液中のIL−17F量を測定し、各血液中のIL−17F量を比較することを特徴とする。
具体的には、以下の工程を含む方法による。
1)RA治療薬の投与前および投与後に採取した各血液から血清を分離取得し、各検査用検体とする工程;
2)各検査用検体中のIL−17F量を測定する工程;
3)上記2)で得られた結果をもとに、RA治療薬の投与前および投与後の各検査用検体中のIL−17F量比を算出する工程。
【0025】
上記検査方法により得られたRA疾患治療薬を投与した前後でのIL−17量の比と、治療効果の評価は密接に関係することが判明した。例えば、DAS28とEULAR改善基準での評価とIL−17F測定結果との関係は、CRPやMMP−3など、従来、関節リウマチの活動性をみる指標とされてきた他のマーカーでの結果に比べて、治療効果の程度をより反映していることが確認された(実施例3参照)。
【0026】
ここで、RA治療薬としては、自体公知の治療薬および今後開発されるすべての治療薬を含めることができる。自体公知のRA治療薬としては、例えば生物学的製剤、非ステロイド性抗炎症薬(消炎鎮痛薬)、ステロイド薬、免疫抑制剤が挙げられる。生物学的製剤としては、キメラ型抗TNF−α抗体製剤、可溶性TNFレセプターや、完全ヒト型抗TNF−α抗体製剤、抗IL−6レセプター抗体製剤などが挙げられる。非ステロイド性抗炎症薬としては、プロスタグランジン産生抑制剤が挙げられ、関節の痛みや腫れを軽減化させることはできるが、疾患事態の進行や骨や関節の破壊を抑制することは困難といわれている。ステロイド薬は、優れた抗炎症効果により、RA疾患の特効薬として利用されているが、その副作用も問題である。免疫抑制剤は、RA疾患患者の免疫異常を改善させることによりRAの炎症を抑制し、寛解導入を目的とするもので、RAの進行を阻止する可能性があることから疾患修飾性抗リウマチ薬ともいわれている。効果発現までに時間を要することから遅効性抗リウマチ薬とも呼ばれている。上記のように、RA治療薬は多種類存在するが、治療薬の効果の程度を判定し、最も効果的な治療薬を選択するためにも、本発明の検査方法は、有用である。
【0027】
本発明は、RA疾患検査用キットにも及ぶ。本発明のRA疾患検査用キットは、本発明の検査方法を簡便に実施するためのキットであればよく、特に限定されない。具体的には、少なくとも、IL−17Fを捕捉しうる抗体を固着させた固相担体を含み、標識化合物若しくは標識抗体のほか、標識検出用の試薬等を含めることができる。さらに検査に使用する器具等も含めることができる。キットの構成として使用可能な抗体、標識物質、固相担体等については、上記検査方法で説明した内容をそのまま適用することができる。標識検出用の試薬は、標識化剤が酵素である場合には、その活性を測定するための基質、必要により発色剤を含めることができる。これらについても、上記測定方法で説明した内容をそのまま適用することができる。さらには、必要に応じて、緩衝液などを含めても良い。
【実施例】
【0028】
以下、本発明の理解を深めるために実施例を示して本発明を具体的に説明するが、これらは本発明の範囲を限定するものではないことはいうまでもない。
【0029】
(実施例1)IL−17F量と疾患との関係について
インフォーム・ドコンセントにより承諾を得た157名の被験者から採血し、血清中のIL−17Fタンパク質およびIL−17Aタンパク質の量を測定し、各タンパク質と疾患との関係を調べた。
【0030】
被験者157名の内訳は、変形性関節症(OA)14名、RA66名、全身性エリテマトーデス(SLE)32名、多発性筋炎/皮膚筋炎(PM/DM)22名、強皮症(SSc)22名、健康人23名であり、性別、平均年齢は表1のとおりであった。下記被験者のうち、健康人以外については、米国リウマチ学会(American College of Rheumatology)の基準を満たしていたので、リウマチ性疾患患者として検討を行った。
【表1】

【0031】
上記被験者から採血した血液を血清分離用試験管に採り、室温で10分間3500rpmで遠心分離して上清を得、検査用検体(血清)とした。
【0032】
各被験者の血清中のIL−17FおよびIL−17Aの量は、サンドイッチ法酵素免疫測定(ELISA)キット(R&D Systems社、Cat. No. DY1335およびCat. No. DY317)を用い、それぞれ当該キットの添付文書に記載の方法に従って測定した。使用した標識は、西洋ワサビペルオキシダーゼであり、発色反応の基質として、テトラメチルベンジン(TMB)(eBioscience社製)基質溶液を使用した。発色反応は、室温にて20分行い、1Mリン酸溶液を加えて反応を停止した。各反応は、96穴マイクロプレート(Nunc社)を用いて行った。マイクロプレートリーダー(Bio-Rad Laboratories社、 Model550)を用いて、波長450nmの吸光度で発色度を測定し、各タンパク質を定量した。ここで、各反応系でのタンパク質の最小検出レベルは、IL−17Fが20pg/mlであり、IL−17Aが4pg/mlであった。また、IL−17FとIL−17Aの交差反応は認められなかった。
【0033】
測定結果を、図1(A,B)および表2に示した。
【表2】

【0034】
以上の結果、IL−17F量は、RAにおいて統計学的に高値を示したが、健康人では最も低く、RA以外の各リウマチ性疾患患者においても、RAに比べて有意に低い値であった。一方、IL−17Aはすべての被験者において、IL−17Fに比べて、わずかな量しか検出されず、健康人およびOAを除くリウマチ性疾患患者では、やや高値を示したが、RAとの差は顕著ではなかった。
IL−17Fについて、他の炎症マーカーであるC−反応性タンパク質(CRP)と、リウマチ因子(RF)との相関性を調べ、図2(A,B)に示した。CRPおよびRFは、臨床検査結果より得た値を参照した。その結果、IL−17Fは、CRPとは有意な相関関係を認めなかったが(rs=0.13)、RFとは有意な相関を認め(rs=0.30)、IL−17Fは単なる炎症マーカーではないことが確認された。
以上の結果より、IL−17Fは、RAの新規バイオマーカーとなりうることが示唆された。
【0035】
(実施例2)血清中のIL−17F量について
RA患者6名より、血清およびRA患部である関節液を得、これらの検体に含まれるIL−17FおよびIL−17Aの量を測定した。検査用検体である血清は、実施例1と同手法により取得した。関節液は、19ゲージ針をつけた10mlのディスポーザブルシリンジを用いて、罹患膝・肩・肘関節より無菌的に採取した。IL−17FおよびIL−17Aは、実施例1と同手法により測定した。
【0036】
測定結果を、図3に示した。この図からも、IL−17Fの測定値はIL−17Aに比べて高く、IL−17Fのタンパク質の発現量がRA患者では多いことが確認された。さらに、IL−17Fは、関節液よりも血清に多く発現していることが確認された。以上の結果より、血液由来の検体について、IL−17Fを感度良く測定できることが示唆された。
【0037】
(実施例3)IL−17F量でのRA疾患治療薬投与による治療効果の評価
RA疾患患者に、RA疾患治療薬である抗TNF−α製剤を投与したときの治療効果を、IL−17F量の測定により確認した。
実施例1のRA患者のうち40名について、抗TNF−α製剤であるインフリキシマブ製剤(Infliximab(IFX))またはエタネルセプト製剤(Etanercept(ETN))を投与した。各製剤の投与前後に採血し、実施例1と同手法により血清を得、検査用検体とした。各検査用検体について、IL−17Fの他、CRP、MMP−3およびPFの測定を行った。IL−17Fについては、実施例1と同手法により測定し、その他の各因子については通常の臨床検査と同手法により測定した。
ここで、インフリキシマブ製剤は、抗TNF−αマウス・ヒトキメラ型モノクローナル抗体製剤であり、エタネルセプト製剤は、完全ヒト型可溶性TNF−α/LT−αレセプター製剤である。また、これら各生物学的製剤は各添付文書および日本リウマチ学会より示されているガイドラインに基づいて投与された。
【0038】
抗TNF−α製剤投与前の各因子の測定値を1としたときの、投与後の各因子の相対値を算出した。また、各患者について、RA疾患治療薬投与後のEULAR改善基準(http://www.imaginex.jp/doctor/doc3/kijun/html/kijun_3_2.html)による3段階の評価(良好(good)、中等度(moderate)、反応なし(no response))も行った。その結果、IL−17F量の相対値とEULAR改善基準による評価結果が、他の因子に比べて相関性を示すことが確認された(図4)。
【産業上の利用可能性】
【0039】
以上詳述したように、本発明のRA疾患の検査方法で測定した結果は再現性があり、従来の検査方法に比べて、信頼性が高く、かつ簡易に検査することができる。また、RA治療薬の治療効果の判定の場合、従来のDAS28とEULAR改善基準での患者自身の主観的な判断が必要とされるが、患者自身の痛み等に対する評価は、個人によってばらつきがあるため、客観的な効果を判定するのが容易ではなかったのに対し、本発明の方法を用いて治療効果の判定を行うと、信頼性が高く容易に検査可能である他、客観的に効果を判定することができ、非常に有用である。
【0040】
従って、本発明の検査方法は、IL−17F量を高い信頼性で容易に測定することができるので有用である。臨床検査用に取得した検査用検体(血清)を用いることができるので、多くの検査用検体についても、高い信頼性で容易に検査することができる。また、RA治療薬の治療効果の判定に、本発明の検査方法を使用する場合は、治療効果を客観的に判断することができる。これにより、例えば抗TNA−α抗体製剤などの高価な治療薬を投与しても、治療効果が認められない場合などは、他の治療方法を早期に模索することができ、患者自身にとっても有用のみならず、医療経済を考慮しても優れた効果を有する。
【図面の簡単な説明】
【0041】
【図1】各被験者の血清中のIL−17AおよびIL−17F各タンパク質の測定結果を示す図である。(実施例1)
【図2】各被験者の血清中のIL−17F量と、他のマーカーであるリウマチ因子(RF)や炎症マーカーであるCRPとの相関性を示す図である。(実施例1)
【図3】RA疾患患者の血清および関節液中のIL−17AおよびIL−17F量を測定した結果を示す図である。(実施例2)
【図4】RA疾患患者に、RA疾患治療薬である抗TNF−α製剤を投与したときの、IL−17F、CRP、MMP−3値を測定した結果を示し、EULAR改善基準による治療効果との関係を示した図である。(実施例3)
【特許請求の範囲】
【請求項1】
採取した血液中のIL−17F量を測定することを特徴とする関節リウマチ疾患の検査方法。
【請求項2】
以下の工程を含む、請求項1に記載の関節リウマチ疾患の検査方法:
1)採取した血液から血清を分離取得し、検査用検体とする工程;
2)検査用検体中のIL−17F量を測定する工程。
【請求項3】
IL−17F量の測定が、免疫学的手法により測定される、請求項1または2に記載の関節リウマチ疾患の検査方法。
【請求項4】
免疫学的手法が、ELISA法である請求項3に記載の関節リウマチ疾患の検査方法。
【請求項5】
関節リウマチ疾患の検査が、関節リウマチ疾患の診断または関節リウマチ治療薬の治療効果の判定のために行われる請求項1〜4のいずれか1に記載の関節リウマチ疾患の検査方法。
【請求項6】
関節リウマチ治療薬の治療効果を判定するために行われる検査が、関節リウマチ治療薬の投与前および投与後に採取した各血液中のIL−17F量を測定し、各血液中のIL−17F量を比較することを特徴とする、請求項5に記載の関節リウマチ疾患の検査方法。
【請求項7】
関節リウマチ治療薬の治療効果を判定するために行われる検査が、以下の工程を含む請求項6に記載の検査方法:
1)関節リウマチ治療薬の投与前および投与後に採取した各血液から血清を分離取得し、各検査用検体とする工程;
2)各検査用検体中のIL−17F量を測定する工程;
3)上記2)で得られた結果をもとに、関節リウマチ治療薬の投与前および投与後の各検査用検体中のIL−17F量比を算出する工程。
【請求項8】
少なくとも、IL−17Fを捕捉しうる抗体を固着させた固相担体を含む、請求項1〜7にいずれか1に記載の関節リウマチ疾患の検査方法に使用する関節リウマチ疾患検査用キット。
【請求項1】
採取した血液中のIL−17F量を測定することを特徴とする関節リウマチ疾患の検査方法。
【請求項2】
以下の工程を含む、請求項1に記載の関節リウマチ疾患の検査方法:
1)採取した血液から血清を分離取得し、検査用検体とする工程;
2)検査用検体中のIL−17F量を測定する工程。
【請求項3】
IL−17F量の測定が、免疫学的手法により測定される、請求項1または2に記載の関節リウマチ疾患の検査方法。
【請求項4】
免疫学的手法が、ELISA法である請求項3に記載の関節リウマチ疾患の検査方法。
【請求項5】
関節リウマチ疾患の検査が、関節リウマチ疾患の診断または関節リウマチ治療薬の治療効果の判定のために行われる請求項1〜4のいずれか1に記載の関節リウマチ疾患の検査方法。
【請求項6】
関節リウマチ治療薬の治療効果を判定するために行われる検査が、関節リウマチ治療薬の投与前および投与後に採取した各血液中のIL−17F量を測定し、各血液中のIL−17F量を比較することを特徴とする、請求項5に記載の関節リウマチ疾患の検査方法。
【請求項7】
関節リウマチ治療薬の治療効果を判定するために行われる検査が、以下の工程を含む請求項6に記載の検査方法:
1)関節リウマチ治療薬の投与前および投与後に採取した各血液から血清を分離取得し、各検査用検体とする工程;
2)各検査用検体中のIL−17F量を測定する工程;
3)上記2)で得られた結果をもとに、関節リウマチ治療薬の投与前および投与後の各検査用検体中のIL−17F量比を算出する工程。
【請求項8】
少なくとも、IL−17Fを捕捉しうる抗体を固着させた固相担体を含む、請求項1〜7にいずれか1に記載の関節リウマチ疾患の検査方法に使用する関節リウマチ疾患検査用キット。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2010−71833(P2010−71833A)
【公開日】平成22年4月2日(2010.4.2)
【国際特許分類】
【出願番号】特願2008−240279(P2008−240279)
【出願日】平成20年9月19日(2008.9.19)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度文部科学省、科学技術総合研究委託事業「先端融合領域イノベーション創出拠点の形成」プログラム、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504132272)国立大学法人京都大学 (1,269)
【出願人】(000006677)アステラス製薬株式会社 (274)
【公開日】平成22年4月2日(2010.4.2)
【国際特許分類】
【出願日】平成20年9月19日(2008.9.19)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度文部科学省、科学技術総合研究委託事業「先端融合領域イノベーション創出拠点の形成」プログラム、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504132272)国立大学法人京都大学 (1,269)
【出願人】(000006677)アステラス製薬株式会社 (274)
[ Back to top ]

