難溶性薬物の新規な固体分散体
【課題】
これまで、難溶性薬物の水への溶解度を向上させるため、難溶性薬物とポリマーによって固体分散体を形成させることが行われている。しかし、難溶性薬物のうち、いったん高い溶解度を示す難溶性薬物であっても、経時的に溶解度の低下を起こすものがある。経時的に水への溶解度維持性が低い難溶性薬物の溶解度を長時間にわたって維持することによって、薬物の体内への吸収性を向上させることが求められている。
【解決手段】
溶解度維持性が低い難溶性薬物を溶出向上ポリマーと溶解抑制ポリマーの2種のポリマーからなる固体分散体とすることによって、該難溶性薬物の溶解度を向上させ、かつ長時間にわって該難溶性薬物の溶解度を維持し、吸収性のよい医薬組成物を提供することができる。
これまで、難溶性薬物の水への溶解度を向上させるため、難溶性薬物とポリマーによって固体分散体を形成させることが行われている。しかし、難溶性薬物のうち、いったん高い溶解度を示す難溶性薬物であっても、経時的に溶解度の低下を起こすものがある。経時的に水への溶解度維持性が低い難溶性薬物の溶解度を長時間にわたって維持することによって、薬物の体内への吸収性を向上させることが求められている。
【解決手段】
溶解度維持性が低い難溶性薬物を溶出向上ポリマーと溶解抑制ポリマーの2種のポリマーからなる固体分散体とすることによって、該難溶性薬物の溶解度を向上させ、かつ長時間にわって該難溶性薬物の溶解度を維持し、吸収性のよい医薬組成物を提供することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、難溶性薬物のうち固体分散体を形成させても該難溶性薬物の再析出により、直ちに溶解度が低下する難溶性薬物、則ち溶解度維持性が低い難溶性薬物の溶解性を向上させた新規な固体分散体及びその製造方法、難溶性薬物の溶解度向上を維持する方法、その固体分散体を含有する医薬品に関する。
【背景技術】
【0002】
従来より、水に難溶性の薬物が開発されていたが、近年、新規に開発中の薬物のほとんどが難溶性の薬物である。難溶性薬物の医薬品を開発するにあたって、人への吸収性を高めるため水への溶解度を向上することが求められており、これまで種々の方法が提案されてきた。例えば、薬物結晶をナノサイズに粉砕することによって表面積を増加させる方法、界面活性剤を添加させる方法、包接分子と薬物の包接化合物を形成させる方法、薬物を非結晶化する方法、薬物を溶解速度の高い結晶形とする方法、高分子などと薬物から固体分散体を形成させる方法などが挙げられる。
【0003】
これらの方法のうち、固体分散体を形成させる方法として、共沈法、噴霧乾燥法、混合粉砕法、溶融法、メカノケミカル法などが知られている。しかし、薬物は固体分散体を形成しても、溶解度が向上するか否かは、薬物固有の特性であり溶解度が向上しない薬物も多い。例えば、アスタキサンチン、β−カロテンなどは、固体分散体中の薬物の非晶質化がX−RDやDSCで確認されても溶解度は高くはならない。
【0004】
また、固体分散体を形成した薬物において、溶解度は一時的には増加するものの、急激に溶解度が低下する薬物(水への溶解度維持性が低い難溶性薬物)も多い。これらの薬物は、固体分散体状の場合は溶解度が高いが、水溶液中に溶出したあと、水での溶解度が低いことと結晶化への速度が速いため、容易に薬物の結晶が再析出するからである。
【0005】
濃度増大ポリマーと安定化ポリマーの2種類のポリマーと低溶解度の薬物を含む固体分散体(引用文献1)、セルロースポリマー組成物中にセルロースポリマーと低溶解度の薬物を含む固体分散体を含む医薬組成物(引用文献2)が開示されている。前述の文献は、薬物の水への溶解度を向上させるポリマーと固体分散体の湿度による安定化を向上させるポリマーの組み合わせであり、薬物の溶解度の経時変化についての記載はない。後述の文献は、固体分散体部分は薬物と1種類のポリマーからなり、その薬物の固体分散体を別の1種のポリマーの中に包含しており、2種類のポリマーからなる薬物の固体分散体ではない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2000−229887号公報
【特許文献2】特開2000−229888号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
水への溶解度維持性が低い難溶性薬物に関して、薬物の結晶系よりも溶解度が高く、かつ水溶液中で高い溶解度を長時間維持する難溶性薬物を含む固体分散体組成物を提供する。
【課題を解決するための手段】
【0008】
水への溶解度維持性が低い難溶性薬物を溶解度向上ポリマーと溶出抑制ポリマーの2種類のポリマーからなる固体分散を形成させることによって、水中への薬物の溶解度を長時間持続することができる。
【発明の効果】
【0009】
本発明により、水への溶解度維持性が低い難溶性薬物を溶解度向上ポリマーと溶出抑制ポリマーの2種類のポリマーからなる固体分散は、難溶性薬物の溶解度を向上させ、かつ溶解度を消化管で吸収されるまで長時間に渡って溶解度を維持することができる。
溶出性を改善する事によってバイオアベイラビリティーの向上のみならず、固体差変動・食事の影響などを減少させるため、患者への服薬コンプライアンス向上を行うことができる。
【図面の簡単な説明】
【0010】
【図1】実施例1〜2、比較例1〜4の溶出試験の結果を示す。
【図2】実施例3〜4、比較例4
【図3】実施例3、比較例4のX−RDチャートを示す。
【発明を実施するための形態】
【0011】
本発明の水への溶解度維持性が低い難溶性薬物の固体分散体組成物について以下に述べる。
本発明の固体分散体は、難溶性薬物、溶出向上ポリマー及び溶出抑制ポリマーからなる。本発明の固体分散体の構造は、溶出向上ポリマー中に難溶性薬物と溶出抑制ポリマーが、分子レベルで固溶した状態である。そのため、(1)後述の粉末X線構造解析によって結晶が実質的に確認されないこと、(2)熱分析によって難溶性薬物結晶特有の吸熱ピークが確認されないことから同定することができる。なお、本発明において特に記載がない場合、「薬物」又は「難溶性薬物」は水への溶解度維持性が低い難溶性薬物をさし、「2種のポリマー」は溶出向上ポリマーと溶出抑制ポリマーをさす。
【0012】
本発明の水への溶解度維持性が低い難溶性薬物は、結晶状態で水への溶解度が0.1mg/ml以下の薬物である。溶解度維持性が低いとは、水に分散させたときの最大溶解度のピークが10分以内にあり、その後溶解度が1/10〜3/4に低下することである。具体的には、難溶性薬物と溶出向上ポリマーからなる固体分散体が後述の溶解度試験において、10分以内のピークの最大溶解度に対して30〜60分後の溶解度が3/4以下、好ましくは2/3以下、より好ましくは1/2以下の薬物である。
【0013】
本発明の難溶性薬物としては、例えば、バルサルタン、シンバスタチン、ランソプラゾール、オランザピン、オメプラゾール、エゼチミブ、リスペリドン、ピオグリタゾン、アリピプラゾール、カンデサルタンシレキセチル、イルベサルタン、ドセタキセル、セレコキシブ、オルメサルタンメドキソミル、エファビレンツ、フェノフィブラート、シプロフロキサシン、テルミサルタン、タクロリムス、モメタゾンフランカルボン酸エステル、ミコフェノール酸モフェチル、ラタノプロスト、レボチロキシンナトリウム、クラリスロマイシン、リトナビル、シクロスポリン、ニフェジピン、パクリタキセル、タダラフィル、デキサメタゾン、ビカルタミド、カルベジロール、ジプラシドン、フィナステリド、グリメピリド、レトロゾール、ロラタジン、ナプロキセン、デュタステリド、ジピリダモール、クロトリマゾール、オキシカルバゼピン、パリカルシトール、フェロジピン、カルシポトリオール、メロキシカム、セフィキシム、エンタカポン、イソトレチノイン、グリクラジド、ウルソデオキシコール酸、ジオスミン、フロセミド、オルリスタット、シロスタゾール、イトラコナゾール、グリベンクラミド、硝酸イソソルビド、ボセンタン、スピロノラクトン、セフジニル、ロラゼパム、メタキサロン、ケトコナゾール、メトトレキセート、エキセメスタン、ネビボロール、イミキモド、エトリコキシブ、レバミピド、アルファカルシドール、トレチノイン、ソラフェニブトシル酸塩、ジアゼパム、クロナゼパム、ロバスタチン、フェニトイン、ネビラピン、パリペリドン、プランルカスト、ビサコジル、カルシトリオール、シロリムス、アトバコン、ブロマゼパム、レフルノミド、アミスルプリド、ナテグリニド、ゾピクロン、ニセルゴリン、セフジトレンピボキシル、モサプリド、ヒドロキシジン、アプレピタント、メゲストロール、トラセミド、スルファサラジン、エプロサルタン、クロルタリドン、グリピジド、アセクロフェナク、ミコフェノール酸、エトドラク、フェルビナク、ピロキシカム、ルビプロストン、メフェナム酸、ジアセレイン、プログアニル、ハロペリドール、タモキシフェンクエン酸塩、ニモジピン、ツロブテロール、ノルフロキサシン、ピメクロリムス、エノキソロン、ロキシスロマイシン、エプラレスタット、ベザフィブラート、リファキシミン、スルピリド、アシトレチン、スピラマイシン、シルニジピン、ジドロゲステロン、ブロチゾラム、ニソルジピン、マニジピン、ノスカピン、ポサコナゾール、マキサカルシトール、ジフルコルトロン、ベルテポルフィン、スルファジアジン、ラバチニブ、ロルメタゼパム、エチゾラム、クレマスチン、ナブメトン、ロルノキシカム、エストリオール、シネパゼド、フルオロメトロン、ユビデカレノン、トリアゾラム、アルベンダゾール、レボカバスチン、コレスチラミン、ブロモクリプチン、ミトタン、イブプロフェン、インドメタシン、フルタミド、ゲフィチニブ、ラマトロバン、ラフチジン、ピモベンダン、セラトロダスト、アゼルニジピン、エベロリムス、メキタジン、ミトタン、ザフィルルカスト、アンピロキシカム、エバスチン、モサプリドクエン酸塩などが挙げられる。今後新規に見いだされる医薬合成物を含む。
【0014】
本発明の固体分散体に用いる難溶性薬物は、無水物、水和物、溶媒和物、医薬品に許容される塩の形態のいずれでも用いることができる。原料として用いる難溶性薬物は、製造上で単分子またはナノ粒子サイズに分散させるため、いずれの形態のものを用いてもよい。結晶、非晶質のいずれでも混合物でもよく、結晶としては公知の結晶多形のうち、いずれを用いてもよい。
【0015】
本発明の溶出向上ポリマーは、医薬品の分野で一般に結合剤やコーティング剤に用いられているポリマーのうち、水に溶解するポリマーである。溶出向上ポリマーとしては、セルロース系ポリマー、合成高分子モノポリマー、合成高分子コポリマー、天然高分子があげられる。溶出抑制ポリマーは、水への溶解度が0.1〜1000mg/mlのものを用いることができる。
【0016】
セルロース系ポリマーには、非イオン性セルロース系ポリマーとイオン性セルロース系ポリマーがあり、非イオン性セルロース系ポリマーとしては、例えば、ヒプロメロース(信越化学工業(株)製:TC−5E、TC−5R、メトローズ60SHなど)、ヒドロキシプロピルセルロース(日本曹達社製:NISSO HPC−L、HPC−SSLなど)、ヒドロキシエチルメチルセルロース、ヒドロキシプロピルメチルセルロースアセテート、ヒドロキシエチルセルロースアセテートなどがあげられる。
【0017】
イオン性セルロース系ポリマーとしては、例えば、ヒドロキシプロピルメチルセルロースアセテートサクシネート(信越化学工業(株)製:信越AQOAT−AS−LF,AS−MF,AS−HGなど)、ヒドロキシプロピルメチルセルロースサクシネート、ヒドロキシプロピルセルロースアセテートサクシネート、ヒドロキシエチルメチルセルロースサクシネート、ヒドロキシエチルセルロースアセテートサクシネート、ヒドロキシプロピルメチルセルロースフタレート(信越化学工業(株)製:HP−50,HP−55など)、ヒドロキシエチルメチルセルロースアセテートサクシネート、ヒドロキシエチルメチルセルロースアセテートフタレート、カルボキシエチルセルロース、エチルカルボキシメチルセルロース、カルボキシメチルセルロース、カルボキシメチルエチルセルロース、セルロースアセテートフタレート、メチルセルロースアセテートフタレート、エチルセルロースアセテートフタレート、ヒドロキシプロピルセルロースアセテートフタレート、ヒドロキシプロピルメチルセルロースアセテートフタレート、ヒドロキシプロピルセルロースアセテートフタレートサクシネート、ヒドロキシプロピルメチルセルロースアセテートサクシネートフタレート、ヒドロキシプロピルメチルセルロースサクシネートフタレート、セルロースプロピオネートフタレート、ヒドロキシプロピルセルロースブチレートフタレート、セルロースアセテートトリメリテート、メチルセルロースアセテートトリメリテート、エチルセルロースアセテートトリメリテート、ヒドロキシプロピルセルロースアセテートトリメリテート、ヒドロキシプロピルメチルセルロースアセテートトリメリテート、ヒドロキシプロピルセルロースアセテートトリメリテートサクシネート、セルロースプロピオネートトリメリテート、セルロースブチレートトリメリテート、セルロースアセテートテレフタレート、セルロースアセテートイソフタレート、セルロースアセテートピリジンカルボキシレート、サリチル酸セルロースアセテート、ヒドロキシプロピルサリチル酸セルロースアセテート、エチル安息香酸セルロースアセテート、ヒドロキシプロピルエチル安息香酸セルロースアセテート、エチルフタル酸セルロースアセテート、エチルニコチン酸セルロースアセテート、エチルピコリン酸セルロースアセテートなどである。
【0018】
合成高分子モノポリマーとしては、例えば、ポリビニルピロリドン(BASF社製:Kollodon K30、K90、K17など)、架橋型ポリビニルピロリドン、ポリエチレングルコール(三洋化成工業(株)製:マクロゴール4000,6000,20000など)、ポリビニルアルコール、ポリビニルアセテートフタレート、ポリビニルアセタールジエチルアミノアセテート、カルボキシビニルポリマーなどである。
【0019】
合成高分子コポリマーとしては、例えば、メタクリル酸コポリマー(Rohm社製:オイドラギットL100、L100−55、S100、L30D−55など)、アミノアルキルメタアクリレートコポリマー(Rohm社製:オイドラギットE100、RS100など)、ポリビニルアルコールポリビニルアセタートコポリマー、ポリエチレングリコールポリプロピレングリコールコポリマー、ポリエチレンポリビニルアルコールコポリマー、ポリビニルピロリドンコポリマー(BASF社製:Kollodon VA64、SRなど)などである。
【0020】
上述、溶出向上ポリマーのうち、好ましくはヒプロメロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロースフタレート、ヒドロキシプロピルメチルセルロースアセテートサクシネート、ポリビニルピロリドン、ポリビニルピロリドンコポリマー、メタクリル酸コポリマーである。
【0021】
本発明の溶出抑制ポリマーは、医薬品の分野で一般に薬剤に徐放性を付与するコーティング剤などとして用いられているポリマーである。例えば、アラビアゴム、寒天、グアーガム、穀物ゴム、デキストラン、カゼイン、ペクチン、カラゲーニン、ワックス、セラック、水素添加植物性油、ヒドロキシプロピルセルロース(日本曹達製:HPC−SSL,−SLLなど)、ヒドロキシエチルセルロース(HEC)、ヒドロキシプロピルメチルセルロース(信越化学製:TC−5シリーズなど)、カルボキシメチルセルロースナトリウム、ポリ(エチレン)オキシド、アルキルセルロース、エチルセルロース(ダウケミカル製:エトセルなど)、メチルセルロース(信越化学製:メトローズ SM−25,−100など)、カルボキシメチルセルロース(CMC)、カルボキシメチルエチルセルロース(フロイント産業製:CMEC)、ポリエチレングリコール、ポリビニルピロリドン、酢酸セルロース、酢酸酪酸セルロース、酢酸フタル酸セルロース、酢酸トリメリト酸セルロース、ポリ酢酸フタル酸ビニル、フタル酸ヒドロキシプロピルメチルセルロース、酢酸コハク酸ヒドロキシプロピルメチルセルロース、ポリアセタールジエチルアミノ酢酸ビニル、ポリ(メタクリル酸アルキル)、ポリ(酢酸ビニル)、アクリル酸またはメタクリル酸とこれらそれぞれのエステルから誘導されたポリマー、およびアクリル酸またはメタクリル酸とこれらそれぞれのエステルから誘導されたコポリマー(例えば、Rohm社製:オイドラギットRL100、RLP0、RL30D、RS100、RSP0、RS30D、NE30D、E100,EPO,L100,L100−55,L30D−55,S100など)、ポリビニルアルコールポリエチレングリコールグラフトコポリマー(BASF製:コリコートIR)、ポリビニルアセタールジエチルアミノアセテート(三菱化学フーズ製:AEA)などがあげられる。好ましくは、エチルセルロース、オイドラギット、CMEC、AEA、コリコートIRである。溶出抑制ポリマーは、水への溶解度が0.001〜1mg/mlのものを用いることができる。
【0022】
本発明において、難溶性薬物と溶出向上ポリマーの配合比は1:0.1〜1:10であり、好ましくは1:0.2〜1:5であり、より好ましくは1:0.5〜3である。同範囲より難溶性薬物に対して、溶出向上ポリマーの割合が少ないと難溶性薬物の非結晶化が起こらないため溶出性が向上せず、溶出向上ポリマーの割合が多いと難溶性薬物の水への接触面が少なくなり溶出性が向上しない。
【0023】
本発明において、溶出向上ポリマーと溶出抑制ポリマーの配合比は1:0.01〜1:1であり、好ましくは1:0.05〜1:1であり、より好ましくは1:0.1〜0.5である。同範囲より溶出向上ポリマーに対して、溶出抑制ポリマーの割合が少ないと難溶性薬物の溶解度の長時間の維持が生じず短時間に溶解度が減少し、溶出抑制ポリマーの割合が多いと難溶性薬物の被膜効果が高くなり溶出性が向上しない。
【0024】
本発明の固体分散体組成物は、水への溶解度維持性が低い難溶性薬物の結晶体に対して、2倍以上、好ましくは4倍以上、より好ましくは6倍以上の溶解度を有する。本発明の固体分散体組成物は、水への溶解度維持性が低い難溶性薬物と溶出促進ポリマーからなる固体分散体に対して、1.2倍以上、好ましくは1.5倍以上、より好ましくは2倍以上、最も好ましくは3倍以上の水への溶解度維持性が低い難溶性薬物の溶解度を有する。なお、ここでの溶解度は後述の溶出試験の30分又60分後の溶解度である。
【0025】
本発明の固体分散体は、X−RD(X'Pert−MPD型、フィリップス社製)により難溶性薬物の結晶が実質的に確認されず、また、DSC(Thermo plus DSC8230、(株)リガク製)により、難溶性薬物の結晶転移の吸熱ピークが確認されない。これらより難溶性薬物の固体分散体は、単分子及び/又は結晶として物性が発現しない程度の粒子サイズでポリマー相からなる2種類のポリマー中に分散していると想定される。
【0026】
本発明の固体分散体は、薬物の結晶体及び難溶性薬物と溶出向上ポリマーからなる固体分散体よりも薬物の水への溶解度が高く、高濃度を維持する。溶出向上ポリマーと形成してなる固体分散体の薬物の溶解度は、0〜10分で薬物の溶解度が最大となり、以降溶解度が低下し、溶解度が最大溶解度に対して1/10〜3/4に低下する。本発明の固体分散体は、このような溶解度の低下を起こさず、溶出試験で最大溶解度を少なくとも60分後まで維持することができる。消化器官、特に小腸上部において薬物の吸収性を向上させるためには、最大溶解度の維持を60分程度まで維持するのが好ましい。
【0027】
難溶性薬物と溶出向上ポリマーからなる固体分散体の薬物溶解度が、一時的に増加するのは、水溶液中で薬物が過溶解状態にあるため、薬物結晶の再析出を起こすものと考えられる。本発明において、溶出抑制ポリマーの添加によって溶解度を維持することができるのは、薬物の溶解平衡の増加ではなく、薬物の結晶析出速度の低下が原因と考えられる。難溶性薬物と溶出向上ポリマーからなる固体分散体に溶出抑制ポリマーを物理混合したあとでは、溶出度の低下を生じることから確認される。
【0028】
本発明の固体分散体の製造方法を以下に述べる。
本発明の固体分散体は、一般的に薬物の固体分散体を製造する方法によって製造することができる。例えば、溶媒法、溶融法、メカノケミカル法などがあげられ、好ましくは溶媒法である。
【0029】
溶媒法は、薬物、2種類のポリマー、必要に応じてその他の医薬添加成分とを有機溶媒に懸濁又は溶解させた後、溶媒の除去または析出させることによって製造する。
溶媒を除去する方法としては、エバポレーション法、噴霧法、ろ過法、凍結乾燥法などがあげられる。噴霧法には流動層法、噴霧乾燥法、転動層法、攪拌法、超臨界法などがあり、溶媒を短時間で除去できることから、難溶性薬物と溶出向上ポリマー及び溶出抑制ポリマーが溶媒中と同様に分子分散状態での固体分散体を均一に得ることができるため、噴霧法が好ましい。噴霧法のうち、溶媒を瞬時に除去し、大量に連続生産可能であること、粒径や嵩密度など所望の粉体物性を得られやすいことから噴霧乾燥法が好ましい。
【0030】
溶媒の除去にかかる時間は、短いほうが好ましく120分以内、好ましくは60分以内、より好ましくは10分以内、さらに好ましくは5分以内、最も好ましくは2分以内である。溶媒の除去に要する時間が短いほど、薬物とポリマーの分子分散度合いが高いので好ましい。本発明の固体分散体の形成に要する時間が長いと、難溶性薬物の微細結晶やポリマーの巣などが形成されやすくなる。ここでの溶媒の除去にかかる時間とは本発明の難溶性薬物の固体分散体の固形物が得られる時間であって、溶媒は一部残留していてもよい。残留している溶媒は後述の2次乾燥で除去することができる。
【0031】
用いる溶媒は、医薬的に許容される溶媒であればよく、難溶性薬物が溶解する溶媒、例えば、エタノール、メタノール、2−プロパノール、アセトン、2−ブタノン、メチルイソブチルケトン、テトラヒドロフラン(THF)、テトラヒドロピラン、1,4−ジオキサン、ジエチルエーテル、ジイソプロピルエーテル、t−ブチルメチルエーテル、ヘキサン、ヘプタン、トルエン、アセトニトリル、塩化メチレン、クロロホルム、四塩化炭素、酢酸メチル、酢酸エチル、酢酸ブチル、酢酸、蟻酸、N,N−ジメチルホルムアミド(DMF)、N,N−ジメチルアセトアミド(DMAc)、ジメチルスルホキシド(DMSO)、水などがあげられ、これらを所望の難溶性薬物の固体分散体の性質にあわせて、1種の溶媒又は2種以上の混合溶媒として用いる事ができる。
【0032】
溶媒法のうち析出させる方法は共沈法である。難溶性薬物と本発明の2種のポリマーを溶媒に溶解又は懸濁させ、溶解した難溶性薬物及び/又は2種のポリマーが不溶な溶媒の添加や、温度の低下などで溶解濃度を下げることによって析出させる。
【0033】
エバポレーション法による製造方法について詳細に記載する。難溶性薬物と2種類のポリマーを溶媒に溶解又は懸濁させる。この時の濃度は、固形分0.2〜40重量%であり、好ましくは1〜20重量%である。次いで減圧下又は常圧下で溶媒を除去する。このときの温度は、溶媒が留去できる温度であって蒸留時間から適度に選ぶことができ、−10〜120℃、好ましくは0〜100℃である。
【0034】
噴霧乾燥法による製造方法について詳細に記載する。難溶性薬物と2種類のポリマーを有機溶媒に溶解又は懸濁させる。この時の濃度は、噴霧乾燥できる濃度であればよく、固形分は0.1〜80重量%であり、好ましくは0.5〜50重量%である。ついで噴霧乾燥により溶媒の除去と造粒を同時に行う。噴霧乾燥機としては、円盤式またはノズル式(例えば、加圧ノズル、2流体ノズル、4流体ノズル)の噴霧乾燥機を用いる。噴霧乾燥の際の温度としては、入口温度が約20〜150℃であり、出口温度が約0〜85℃が好ましい。
【0035】
なお、エバポレーション法や噴霧乾燥法などの溶媒法によって、難溶性薬物固体分散体を得、残留溶媒のさらなる除去が必要であった場合、2次乾燥を行うことができる。2次乾燥は、難溶性薬物固体分散体を安定に維持できる方法であれば、通常医薬品の製造で用いられている乾燥方法で行うことができる。
【0036】
溶融法は、難溶性薬物と2種類のポリマー、必要に応じてその他の医薬添加成分とを、いずれかの成分が溶融する温度以上に加熱し、融解したのち冷却することによって難溶性薬物固体分散体を製造する方法である。使用する機械や温度、常法に従って任意に選択することができる。機械としてはエクストルーダーなどがあげられる。このとき融点を下げるため溶媒を添加してもよく、溶融後に溶媒を除去する。
【0037】
メカノケミカル法は、難溶性薬物と2種類のポリマー、必要に応じてその他の医薬添加成分とを同時に粉砕・衝撃を与えることによって難溶性薬物固体分散体を製造する方法である。使用する機械や温度、粉砕条件は常法に従って任意に選択することができる。
【0038】
このようにして得られた難溶性薬物固体分散体は、錠剤への混合性や溶出性、徐放性、苦味マスキングのために医薬品に使用可能な添加剤を用いて、乾式造粒や湿式造粒を行うことができる。難溶性薬物固体分散体の粒子径や嵩密度の違いで医薬添加物との混合性が劣る場合は、ローラーコンパクターなどで厚密化を行い、粒子径や嵩密度を大きくすることができる。
【0039】
難溶性薬物固体分散体及び/又は難溶性薬物固体分散体含有粒子に医薬添加物を混合し、錠剤、カプセル、散剤、液剤、乳剤もしくは懸濁剤などの経口型の医薬組成物を得る。また、非経口剤として、注射剤、坐剤、点眼剤、吸入剤、皮膚外用剤などの医薬組成物も得ることができる。これらの製造方法は公知の方法を用いることができる。
【0040】
医薬添加物としては、結合剤(例えば、カルメロース、ヒドロキシプロピルセルロース、アルギン酸、ゼラチン、部分α化澱粉、ポピドン、アラビアガム、プルラン、デキストリンなど)、賦形剤(例えば、スターチ、D−マンニトール、乳糖、トレハロース、結晶セルロース、メタケイ酸アルミン酸マグネシウム、リン酸水素カルシウム、ハイドロタルサイト、無水ケイ酸など)、崩壊剤(例えば、クロスポビドン、クロスカルメロースナトリウム、低置換度ヒドロキシプロピルセルロースなど)、界面活性剤(例えばポリオキシエチレン硬化ひまし油、ポリオキシエチレンポリオキシプロピレングリコール、ソルビタン脂肪酸エステル、ポリソルベート、脂肪酸グリセリンエステル、ラウリル硫酸ナトリウムなど)、滑沢剤(ショ糖脂肪酸エステル、ステアリン酸マグネシウム、タルク、フマル酸ステアリルナトリウムなど)、酸味料(例えば、クエン酸、酒石酸、リンゴ酸、アスコルビン酸など)、発泡剤(例えば炭酸水素ナトリウム、炭酸ナトリウムなど)、甘味剤(例えば、サッカリンナトリウム、グリチルリチン二カリウム、アスパルテーム、ステビア、ソーマチンなど)、香料(例えば、レモン油、オレンジ油、メントールなど)、着色剤(例えば、食用赤色2号、食用青色2号、食用黄色5号、食用レーキ色素、三二酸化鉄、アスタキサンチンなど)、安定化剤(例えば、エデト酸ナトリウム、トコフェロール、トコトリエノール、シクロデキストリンなど)、矯味剤、着香剤などがあげられる。
【0041】
本発明の難溶性薬物固体分散体からなる医薬組成物は、難溶性薬物の溶解濃度向上により、投与量を減らしても、従来の結晶難溶性薬物と同等のAUCが期待できる。
【実施例】
【0042】
以下に、本発明を実施例により説明するが、これらの実施例は本発明の範囲を限定するものではない。
【0043】
[実施例1] 溶媒留去法
結晶エキセメスタン(RPG Life Sciences 社製)10mgとヒドロキシプロピルメチルセルロースフタレート(信越化学工業(株)製:HPMCP HP−55)10mgとエチルセルロース(ダウケミカル社製)2mgを50mlのナス型フラスコに入れ、ジクロロメタンとメタノールの8:2溶液30mlを加えて常温で溶解させた。アスピレーター減圧下、温度37℃で溶媒を留去した後、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体を得た。
【0044】
[実施例2] 溶媒留去法
結晶エキセメスタン10mgとヒドロキシプロピルメチルセルロースフタレート10mgとメタクリル酸コポリマー(オイドラギットRS:Rohm社製)2mgを50mlのナス型フラスコに入れ、ジクロロメタンとメタノールの8:2溶液30mlを加えて常温で溶解させた。アスピレーター減圧下、温度37℃で溶媒を留去した後、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体を得た。
【0045】
[比較例1]
結晶エキセメスタン10mgを50mlのナス型フラスコに入れ、ジクロロメタンとメタノールの8:2溶液30mlを加えて常温で溶解させた。アスピレーター減圧下、温度37℃で溶媒を留去した後、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの非晶質体を得た。
【0046】
[比較例2]
結晶エキセメスタン10mgとヒドロキシプロピルメチルセルロースフタレート10mgを50mlのナス型フラスコに入れ、ジクロロメタンとメタノールの8:2溶液30mlを加えて常温で溶解させた。アスピレーター減圧下、温度37℃で溶媒を留去した後、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体を得た。
【0047】
[比較例3]
結晶エキセメスタン10mgとメタクリル酸コオリマー(オイドラギットL100−55:Rohm社製)10mgを50mlのナス型フラスコに入れ、ジクロロメタンとメタノールの8:2溶液30mlを加えて常温で溶解させた。アスピレーター減圧下、温度37℃で溶媒を留去した後、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体を得た。
【0048】
(溶出試験)
前述の実験で得た試料の薬物10mg相当を含むナス型フラスコを37℃の温浴に浸し、37℃の崩壊試験液第2液(pH6.8)40ml溶液を加えてフラスコ口をパラフィン紙で閉じ、100回/分で震盪させながら、経時的に水溶液を採取し、水溶液エキセメスタン濃度を測定した。採取した溶液を0.45μmのフィルターで篩過したのち、その溶液1mlをメタノールで10mlに希釈し、HPLC(日立製)測定により定量して溶解濃度を求めた。
比較例4は結晶エキセメスタン粉末である。
【0049】
[表1] 溶出試験結果

単位はμg/mlである。
【0050】
比較例1と4より、エキセメスタンは単独で非晶質化しても溶解度が40μm/ml以下と溶解性が改善されない。比較例2と3より、エキセメスタンと溶出向上ポリマーからなる固体分散体は、5分で溶解度がピークを迎えるが、その後溶解度が大きく低下している。対して、本発明の実施例1と実施例2の溶出向上ポリマーと溶出抑制ポリマーからなるエキセメスタンの固体分散体は、30分後においても溶解度が高く、結晶エキセメスタン対して6倍以上であり、エキセメスタン固体分散体に対して2倍以上である。
【0051】
[実施例3] 噴霧乾燥
結晶エキセメスタン100mgとヒドロキシプロピルメチルセルロースフタレート300mgとエチルセルロース50mgをジクロロメタンとメタノールの8:2溶液17.5mlを加えて常温で溶解させた。ついで、入熱温度80℃、排熱温度50℃、噴霧速度6ml/分で噴霧乾燥を行ったのち、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体の粉末を得た。
【0052】
[実施例4] 噴霧乾燥
結晶エキセメスタン100mgとヒドロキシプロピルメチルセルロースフタレート300mgとエチルセルロース200mgをジクロロメタンとメタノールの8:2溶液30mlを加えて常温で溶解させた。ついで、入熱温度80℃、排熱温度50℃、噴霧速度6ml/分で噴霧乾燥を行ったのち、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体の粉末を得た。
【0053】
[比較例5] 物理混合
結晶エキセメスタン20mgとヒドロキシプロピルメチルセルロースフタレート60mgとエチルセルロース10mgをビニール袋に入れて混合し、エキセメスタンの混合粉末を得た。
【0054】
[比較例6] 噴霧乾燥
結晶エキセメスタン100mgとヒドロキシプロピルメチルセルロースフタレート300mgをジクロロメタンとメタノールの8:2溶液20mlを加えて常温で溶解させた。ついで、入熱温度80℃、排熱温度50℃、噴霧速度6ml/分で噴霧乾燥を行ったのち、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体の粉末を得た。
【0055】
[比較例7] 噴霧乾燥と混合
結晶エキセメスタン100mgとヒドロキシプロピルメチルセルロースフタレート300mgをジクロロメタンとメタノールの8:2溶液30mlを加えて常温で溶解させた。ついで、入熱温度80℃、排熱温度50℃、噴霧速度6ml/分で噴霧乾燥を行ったのち、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体の粉末を得た。この粉末200mgにエチルセルロース25mgを混合し、エキセメスタンの混合粉末を得た。
【0056】
(溶出試験)
前述の実験で得た試料の薬物7.5mg相当をナス型フラスコに入れて37℃の温浴に浸し、37℃の崩壊試験液第2液30ml溶液を加えてフラスコ口をパラフィン紙で閉じ、100回/分で震盪させながら、経時的に水溶液を採取し、水溶液のエキセメスタン濃度を測定した。採取した溶液を0.45μmのフィルターで篩過したのち、その溶液1mlをメタノールで10mlに希釈し、HPLC測定により定量して溶解濃度を求めた。
結果を表2、図2に示す。比較例4は結晶エキセメスタン粉末である。
【0057】
[表2] 溶出試験結果

単位はμg/mlである。
【0058】
本発明のエキセメスタン固体分散体の実施例3と実施例4は、溶出試験の2〜30分の間において、比較例4の結晶エキセメスタンに対して6倍以上の溶解度を維持している。比較例1の結晶エキセメスタンと比較例2の結晶エキセメスタンとポリマーの物理混合品の溶解度に差はなく、単なるポリマーの混合は溶解度の向上に効果がない。比較例6のエキセメスタンとヒドロキシプロピルメチルセルロースフタレートとの固体分散体は、2分後に溶解度の一時的な上昇が見られるが5分以降ではその半分程度に溶解度が低下した。比較例6の固体分散体にエチルセルロースを添加した比較例7の溶解度は、実施例3や4の半部以下であった。
【0059】
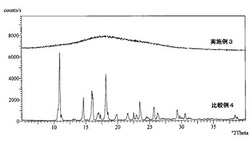
実施例3〜4、比較例6〜7については、X'Pert−MPD型(フィリップス社製)によりX線測定(X−RD)により、エキセメスタンの結晶ピークが表れず、固体分散体を形成していることを確認した。実施例3と比較例4のX−RDパターンを図3に示す。比較例4の結晶エキセメスタンはピークが顕著に表れているが、実施例3の固体分散体は明確なピークがないハローパターンを示している。
【0060】
以上の結果より、エチルセルロースの効果はエキセメスタン溶解平衡の増加効果ではなく、溶出向上ポリマーであるヒドロキシプロピルセルロースフタレートンと溶出抑制ポリマーのエチルセルロースとエキセメスタの3成分が固体分散体を形成していることが、エキセメスタンの再析出による溶解度の低下を防止し、溶解度を長時間にわたって維持していることがわかる。
【技術分野】
【0001】
本発明は、難溶性薬物のうち固体分散体を形成させても該難溶性薬物の再析出により、直ちに溶解度が低下する難溶性薬物、則ち溶解度維持性が低い難溶性薬物の溶解性を向上させた新規な固体分散体及びその製造方法、難溶性薬物の溶解度向上を維持する方法、その固体分散体を含有する医薬品に関する。
【背景技術】
【0002】
従来より、水に難溶性の薬物が開発されていたが、近年、新規に開発中の薬物のほとんどが難溶性の薬物である。難溶性薬物の医薬品を開発するにあたって、人への吸収性を高めるため水への溶解度を向上することが求められており、これまで種々の方法が提案されてきた。例えば、薬物結晶をナノサイズに粉砕することによって表面積を増加させる方法、界面活性剤を添加させる方法、包接分子と薬物の包接化合物を形成させる方法、薬物を非結晶化する方法、薬物を溶解速度の高い結晶形とする方法、高分子などと薬物から固体分散体を形成させる方法などが挙げられる。
【0003】
これらの方法のうち、固体分散体を形成させる方法として、共沈法、噴霧乾燥法、混合粉砕法、溶融法、メカノケミカル法などが知られている。しかし、薬物は固体分散体を形成しても、溶解度が向上するか否かは、薬物固有の特性であり溶解度が向上しない薬物も多い。例えば、アスタキサンチン、β−カロテンなどは、固体分散体中の薬物の非晶質化がX−RDやDSCで確認されても溶解度は高くはならない。
【0004】
また、固体分散体を形成した薬物において、溶解度は一時的には増加するものの、急激に溶解度が低下する薬物(水への溶解度維持性が低い難溶性薬物)も多い。これらの薬物は、固体分散体状の場合は溶解度が高いが、水溶液中に溶出したあと、水での溶解度が低いことと結晶化への速度が速いため、容易に薬物の結晶が再析出するからである。
【0005】
濃度増大ポリマーと安定化ポリマーの2種類のポリマーと低溶解度の薬物を含む固体分散体(引用文献1)、セルロースポリマー組成物中にセルロースポリマーと低溶解度の薬物を含む固体分散体を含む医薬組成物(引用文献2)が開示されている。前述の文献は、薬物の水への溶解度を向上させるポリマーと固体分散体の湿度による安定化を向上させるポリマーの組み合わせであり、薬物の溶解度の経時変化についての記載はない。後述の文献は、固体分散体部分は薬物と1種類のポリマーからなり、その薬物の固体分散体を別の1種のポリマーの中に包含しており、2種類のポリマーからなる薬物の固体分散体ではない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2000−229887号公報
【特許文献2】特開2000−229888号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
水への溶解度維持性が低い難溶性薬物に関して、薬物の結晶系よりも溶解度が高く、かつ水溶液中で高い溶解度を長時間維持する難溶性薬物を含む固体分散体組成物を提供する。
【課題を解決するための手段】
【0008】
水への溶解度維持性が低い難溶性薬物を溶解度向上ポリマーと溶出抑制ポリマーの2種類のポリマーからなる固体分散を形成させることによって、水中への薬物の溶解度を長時間持続することができる。
【発明の効果】
【0009】
本発明により、水への溶解度維持性が低い難溶性薬物を溶解度向上ポリマーと溶出抑制ポリマーの2種類のポリマーからなる固体分散は、難溶性薬物の溶解度を向上させ、かつ溶解度を消化管で吸収されるまで長時間に渡って溶解度を維持することができる。
溶出性を改善する事によってバイオアベイラビリティーの向上のみならず、固体差変動・食事の影響などを減少させるため、患者への服薬コンプライアンス向上を行うことができる。
【図面の簡単な説明】
【0010】
【図1】実施例1〜2、比較例1〜4の溶出試験の結果を示す。
【図2】実施例3〜4、比較例4
【図3】実施例3、比較例4のX−RDチャートを示す。
【発明を実施するための形態】
【0011】
本発明の水への溶解度維持性が低い難溶性薬物の固体分散体組成物について以下に述べる。
本発明の固体分散体は、難溶性薬物、溶出向上ポリマー及び溶出抑制ポリマーからなる。本発明の固体分散体の構造は、溶出向上ポリマー中に難溶性薬物と溶出抑制ポリマーが、分子レベルで固溶した状態である。そのため、(1)後述の粉末X線構造解析によって結晶が実質的に確認されないこと、(2)熱分析によって難溶性薬物結晶特有の吸熱ピークが確認されないことから同定することができる。なお、本発明において特に記載がない場合、「薬物」又は「難溶性薬物」は水への溶解度維持性が低い難溶性薬物をさし、「2種のポリマー」は溶出向上ポリマーと溶出抑制ポリマーをさす。
【0012】
本発明の水への溶解度維持性が低い難溶性薬物は、結晶状態で水への溶解度が0.1mg/ml以下の薬物である。溶解度維持性が低いとは、水に分散させたときの最大溶解度のピークが10分以内にあり、その後溶解度が1/10〜3/4に低下することである。具体的には、難溶性薬物と溶出向上ポリマーからなる固体分散体が後述の溶解度試験において、10分以内のピークの最大溶解度に対して30〜60分後の溶解度が3/4以下、好ましくは2/3以下、より好ましくは1/2以下の薬物である。
【0013】
本発明の難溶性薬物としては、例えば、バルサルタン、シンバスタチン、ランソプラゾール、オランザピン、オメプラゾール、エゼチミブ、リスペリドン、ピオグリタゾン、アリピプラゾール、カンデサルタンシレキセチル、イルベサルタン、ドセタキセル、セレコキシブ、オルメサルタンメドキソミル、エファビレンツ、フェノフィブラート、シプロフロキサシン、テルミサルタン、タクロリムス、モメタゾンフランカルボン酸エステル、ミコフェノール酸モフェチル、ラタノプロスト、レボチロキシンナトリウム、クラリスロマイシン、リトナビル、シクロスポリン、ニフェジピン、パクリタキセル、タダラフィル、デキサメタゾン、ビカルタミド、カルベジロール、ジプラシドン、フィナステリド、グリメピリド、レトロゾール、ロラタジン、ナプロキセン、デュタステリド、ジピリダモール、クロトリマゾール、オキシカルバゼピン、パリカルシトール、フェロジピン、カルシポトリオール、メロキシカム、セフィキシム、エンタカポン、イソトレチノイン、グリクラジド、ウルソデオキシコール酸、ジオスミン、フロセミド、オルリスタット、シロスタゾール、イトラコナゾール、グリベンクラミド、硝酸イソソルビド、ボセンタン、スピロノラクトン、セフジニル、ロラゼパム、メタキサロン、ケトコナゾール、メトトレキセート、エキセメスタン、ネビボロール、イミキモド、エトリコキシブ、レバミピド、アルファカルシドール、トレチノイン、ソラフェニブトシル酸塩、ジアゼパム、クロナゼパム、ロバスタチン、フェニトイン、ネビラピン、パリペリドン、プランルカスト、ビサコジル、カルシトリオール、シロリムス、アトバコン、ブロマゼパム、レフルノミド、アミスルプリド、ナテグリニド、ゾピクロン、ニセルゴリン、セフジトレンピボキシル、モサプリド、ヒドロキシジン、アプレピタント、メゲストロール、トラセミド、スルファサラジン、エプロサルタン、クロルタリドン、グリピジド、アセクロフェナク、ミコフェノール酸、エトドラク、フェルビナク、ピロキシカム、ルビプロストン、メフェナム酸、ジアセレイン、プログアニル、ハロペリドール、タモキシフェンクエン酸塩、ニモジピン、ツロブテロール、ノルフロキサシン、ピメクロリムス、エノキソロン、ロキシスロマイシン、エプラレスタット、ベザフィブラート、リファキシミン、スルピリド、アシトレチン、スピラマイシン、シルニジピン、ジドロゲステロン、ブロチゾラム、ニソルジピン、マニジピン、ノスカピン、ポサコナゾール、マキサカルシトール、ジフルコルトロン、ベルテポルフィン、スルファジアジン、ラバチニブ、ロルメタゼパム、エチゾラム、クレマスチン、ナブメトン、ロルノキシカム、エストリオール、シネパゼド、フルオロメトロン、ユビデカレノン、トリアゾラム、アルベンダゾール、レボカバスチン、コレスチラミン、ブロモクリプチン、ミトタン、イブプロフェン、インドメタシン、フルタミド、ゲフィチニブ、ラマトロバン、ラフチジン、ピモベンダン、セラトロダスト、アゼルニジピン、エベロリムス、メキタジン、ミトタン、ザフィルルカスト、アンピロキシカム、エバスチン、モサプリドクエン酸塩などが挙げられる。今後新規に見いだされる医薬合成物を含む。
【0014】
本発明の固体分散体に用いる難溶性薬物は、無水物、水和物、溶媒和物、医薬品に許容される塩の形態のいずれでも用いることができる。原料として用いる難溶性薬物は、製造上で単分子またはナノ粒子サイズに分散させるため、いずれの形態のものを用いてもよい。結晶、非晶質のいずれでも混合物でもよく、結晶としては公知の結晶多形のうち、いずれを用いてもよい。
【0015】
本発明の溶出向上ポリマーは、医薬品の分野で一般に結合剤やコーティング剤に用いられているポリマーのうち、水に溶解するポリマーである。溶出向上ポリマーとしては、セルロース系ポリマー、合成高分子モノポリマー、合成高分子コポリマー、天然高分子があげられる。溶出抑制ポリマーは、水への溶解度が0.1〜1000mg/mlのものを用いることができる。
【0016】
セルロース系ポリマーには、非イオン性セルロース系ポリマーとイオン性セルロース系ポリマーがあり、非イオン性セルロース系ポリマーとしては、例えば、ヒプロメロース(信越化学工業(株)製:TC−5E、TC−5R、メトローズ60SHなど)、ヒドロキシプロピルセルロース(日本曹達社製:NISSO HPC−L、HPC−SSLなど)、ヒドロキシエチルメチルセルロース、ヒドロキシプロピルメチルセルロースアセテート、ヒドロキシエチルセルロースアセテートなどがあげられる。
【0017】
イオン性セルロース系ポリマーとしては、例えば、ヒドロキシプロピルメチルセルロースアセテートサクシネート(信越化学工業(株)製:信越AQOAT−AS−LF,AS−MF,AS−HGなど)、ヒドロキシプロピルメチルセルロースサクシネート、ヒドロキシプロピルセルロースアセテートサクシネート、ヒドロキシエチルメチルセルロースサクシネート、ヒドロキシエチルセルロースアセテートサクシネート、ヒドロキシプロピルメチルセルロースフタレート(信越化学工業(株)製:HP−50,HP−55など)、ヒドロキシエチルメチルセルロースアセテートサクシネート、ヒドロキシエチルメチルセルロースアセテートフタレート、カルボキシエチルセルロース、エチルカルボキシメチルセルロース、カルボキシメチルセルロース、カルボキシメチルエチルセルロース、セルロースアセテートフタレート、メチルセルロースアセテートフタレート、エチルセルロースアセテートフタレート、ヒドロキシプロピルセルロースアセテートフタレート、ヒドロキシプロピルメチルセルロースアセテートフタレート、ヒドロキシプロピルセルロースアセテートフタレートサクシネート、ヒドロキシプロピルメチルセルロースアセテートサクシネートフタレート、ヒドロキシプロピルメチルセルロースサクシネートフタレート、セルロースプロピオネートフタレート、ヒドロキシプロピルセルロースブチレートフタレート、セルロースアセテートトリメリテート、メチルセルロースアセテートトリメリテート、エチルセルロースアセテートトリメリテート、ヒドロキシプロピルセルロースアセテートトリメリテート、ヒドロキシプロピルメチルセルロースアセテートトリメリテート、ヒドロキシプロピルセルロースアセテートトリメリテートサクシネート、セルロースプロピオネートトリメリテート、セルロースブチレートトリメリテート、セルロースアセテートテレフタレート、セルロースアセテートイソフタレート、セルロースアセテートピリジンカルボキシレート、サリチル酸セルロースアセテート、ヒドロキシプロピルサリチル酸セルロースアセテート、エチル安息香酸セルロースアセテート、ヒドロキシプロピルエチル安息香酸セルロースアセテート、エチルフタル酸セルロースアセテート、エチルニコチン酸セルロースアセテート、エチルピコリン酸セルロースアセテートなどである。
【0018】
合成高分子モノポリマーとしては、例えば、ポリビニルピロリドン(BASF社製:Kollodon K30、K90、K17など)、架橋型ポリビニルピロリドン、ポリエチレングルコール(三洋化成工業(株)製:マクロゴール4000,6000,20000など)、ポリビニルアルコール、ポリビニルアセテートフタレート、ポリビニルアセタールジエチルアミノアセテート、カルボキシビニルポリマーなどである。
【0019】
合成高分子コポリマーとしては、例えば、メタクリル酸コポリマー(Rohm社製:オイドラギットL100、L100−55、S100、L30D−55など)、アミノアルキルメタアクリレートコポリマー(Rohm社製:オイドラギットE100、RS100など)、ポリビニルアルコールポリビニルアセタートコポリマー、ポリエチレングリコールポリプロピレングリコールコポリマー、ポリエチレンポリビニルアルコールコポリマー、ポリビニルピロリドンコポリマー(BASF社製:Kollodon VA64、SRなど)などである。
【0020】
上述、溶出向上ポリマーのうち、好ましくはヒプロメロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロースフタレート、ヒドロキシプロピルメチルセルロースアセテートサクシネート、ポリビニルピロリドン、ポリビニルピロリドンコポリマー、メタクリル酸コポリマーである。
【0021】
本発明の溶出抑制ポリマーは、医薬品の分野で一般に薬剤に徐放性を付与するコーティング剤などとして用いられているポリマーである。例えば、アラビアゴム、寒天、グアーガム、穀物ゴム、デキストラン、カゼイン、ペクチン、カラゲーニン、ワックス、セラック、水素添加植物性油、ヒドロキシプロピルセルロース(日本曹達製:HPC−SSL,−SLLなど)、ヒドロキシエチルセルロース(HEC)、ヒドロキシプロピルメチルセルロース(信越化学製:TC−5シリーズなど)、カルボキシメチルセルロースナトリウム、ポリ(エチレン)オキシド、アルキルセルロース、エチルセルロース(ダウケミカル製:エトセルなど)、メチルセルロース(信越化学製:メトローズ SM−25,−100など)、カルボキシメチルセルロース(CMC)、カルボキシメチルエチルセルロース(フロイント産業製:CMEC)、ポリエチレングリコール、ポリビニルピロリドン、酢酸セルロース、酢酸酪酸セルロース、酢酸フタル酸セルロース、酢酸トリメリト酸セルロース、ポリ酢酸フタル酸ビニル、フタル酸ヒドロキシプロピルメチルセルロース、酢酸コハク酸ヒドロキシプロピルメチルセルロース、ポリアセタールジエチルアミノ酢酸ビニル、ポリ(メタクリル酸アルキル)、ポリ(酢酸ビニル)、アクリル酸またはメタクリル酸とこれらそれぞれのエステルから誘導されたポリマー、およびアクリル酸またはメタクリル酸とこれらそれぞれのエステルから誘導されたコポリマー(例えば、Rohm社製:オイドラギットRL100、RLP0、RL30D、RS100、RSP0、RS30D、NE30D、E100,EPO,L100,L100−55,L30D−55,S100など)、ポリビニルアルコールポリエチレングリコールグラフトコポリマー(BASF製:コリコートIR)、ポリビニルアセタールジエチルアミノアセテート(三菱化学フーズ製:AEA)などがあげられる。好ましくは、エチルセルロース、オイドラギット、CMEC、AEA、コリコートIRである。溶出抑制ポリマーは、水への溶解度が0.001〜1mg/mlのものを用いることができる。
【0022】
本発明において、難溶性薬物と溶出向上ポリマーの配合比は1:0.1〜1:10であり、好ましくは1:0.2〜1:5であり、より好ましくは1:0.5〜3である。同範囲より難溶性薬物に対して、溶出向上ポリマーの割合が少ないと難溶性薬物の非結晶化が起こらないため溶出性が向上せず、溶出向上ポリマーの割合が多いと難溶性薬物の水への接触面が少なくなり溶出性が向上しない。
【0023】
本発明において、溶出向上ポリマーと溶出抑制ポリマーの配合比は1:0.01〜1:1であり、好ましくは1:0.05〜1:1であり、より好ましくは1:0.1〜0.5である。同範囲より溶出向上ポリマーに対して、溶出抑制ポリマーの割合が少ないと難溶性薬物の溶解度の長時間の維持が生じず短時間に溶解度が減少し、溶出抑制ポリマーの割合が多いと難溶性薬物の被膜効果が高くなり溶出性が向上しない。
【0024】
本発明の固体分散体組成物は、水への溶解度維持性が低い難溶性薬物の結晶体に対して、2倍以上、好ましくは4倍以上、より好ましくは6倍以上の溶解度を有する。本発明の固体分散体組成物は、水への溶解度維持性が低い難溶性薬物と溶出促進ポリマーからなる固体分散体に対して、1.2倍以上、好ましくは1.5倍以上、より好ましくは2倍以上、最も好ましくは3倍以上の水への溶解度維持性が低い難溶性薬物の溶解度を有する。なお、ここでの溶解度は後述の溶出試験の30分又60分後の溶解度である。
【0025】
本発明の固体分散体は、X−RD(X'Pert−MPD型、フィリップス社製)により難溶性薬物の結晶が実質的に確認されず、また、DSC(Thermo plus DSC8230、(株)リガク製)により、難溶性薬物の結晶転移の吸熱ピークが確認されない。これらより難溶性薬物の固体分散体は、単分子及び/又は結晶として物性が発現しない程度の粒子サイズでポリマー相からなる2種類のポリマー中に分散していると想定される。
【0026】
本発明の固体分散体は、薬物の結晶体及び難溶性薬物と溶出向上ポリマーからなる固体分散体よりも薬物の水への溶解度が高く、高濃度を維持する。溶出向上ポリマーと形成してなる固体分散体の薬物の溶解度は、0〜10分で薬物の溶解度が最大となり、以降溶解度が低下し、溶解度が最大溶解度に対して1/10〜3/4に低下する。本発明の固体分散体は、このような溶解度の低下を起こさず、溶出試験で最大溶解度を少なくとも60分後まで維持することができる。消化器官、特に小腸上部において薬物の吸収性を向上させるためには、最大溶解度の維持を60分程度まで維持するのが好ましい。
【0027】
難溶性薬物と溶出向上ポリマーからなる固体分散体の薬物溶解度が、一時的に増加するのは、水溶液中で薬物が過溶解状態にあるため、薬物結晶の再析出を起こすものと考えられる。本発明において、溶出抑制ポリマーの添加によって溶解度を維持することができるのは、薬物の溶解平衡の増加ではなく、薬物の結晶析出速度の低下が原因と考えられる。難溶性薬物と溶出向上ポリマーからなる固体分散体に溶出抑制ポリマーを物理混合したあとでは、溶出度の低下を生じることから確認される。
【0028】
本発明の固体分散体の製造方法を以下に述べる。
本発明の固体分散体は、一般的に薬物の固体分散体を製造する方法によって製造することができる。例えば、溶媒法、溶融法、メカノケミカル法などがあげられ、好ましくは溶媒法である。
【0029】
溶媒法は、薬物、2種類のポリマー、必要に応じてその他の医薬添加成分とを有機溶媒に懸濁又は溶解させた後、溶媒の除去または析出させることによって製造する。
溶媒を除去する方法としては、エバポレーション法、噴霧法、ろ過法、凍結乾燥法などがあげられる。噴霧法には流動層法、噴霧乾燥法、転動層法、攪拌法、超臨界法などがあり、溶媒を短時間で除去できることから、難溶性薬物と溶出向上ポリマー及び溶出抑制ポリマーが溶媒中と同様に分子分散状態での固体分散体を均一に得ることができるため、噴霧法が好ましい。噴霧法のうち、溶媒を瞬時に除去し、大量に連続生産可能であること、粒径や嵩密度など所望の粉体物性を得られやすいことから噴霧乾燥法が好ましい。
【0030】
溶媒の除去にかかる時間は、短いほうが好ましく120分以内、好ましくは60分以内、より好ましくは10分以内、さらに好ましくは5分以内、最も好ましくは2分以内である。溶媒の除去に要する時間が短いほど、薬物とポリマーの分子分散度合いが高いので好ましい。本発明の固体分散体の形成に要する時間が長いと、難溶性薬物の微細結晶やポリマーの巣などが形成されやすくなる。ここでの溶媒の除去にかかる時間とは本発明の難溶性薬物の固体分散体の固形物が得られる時間であって、溶媒は一部残留していてもよい。残留している溶媒は後述の2次乾燥で除去することができる。
【0031】
用いる溶媒は、医薬的に許容される溶媒であればよく、難溶性薬物が溶解する溶媒、例えば、エタノール、メタノール、2−プロパノール、アセトン、2−ブタノン、メチルイソブチルケトン、テトラヒドロフラン(THF)、テトラヒドロピラン、1,4−ジオキサン、ジエチルエーテル、ジイソプロピルエーテル、t−ブチルメチルエーテル、ヘキサン、ヘプタン、トルエン、アセトニトリル、塩化メチレン、クロロホルム、四塩化炭素、酢酸メチル、酢酸エチル、酢酸ブチル、酢酸、蟻酸、N,N−ジメチルホルムアミド(DMF)、N,N−ジメチルアセトアミド(DMAc)、ジメチルスルホキシド(DMSO)、水などがあげられ、これらを所望の難溶性薬物の固体分散体の性質にあわせて、1種の溶媒又は2種以上の混合溶媒として用いる事ができる。
【0032】
溶媒法のうち析出させる方法は共沈法である。難溶性薬物と本発明の2種のポリマーを溶媒に溶解又は懸濁させ、溶解した難溶性薬物及び/又は2種のポリマーが不溶な溶媒の添加や、温度の低下などで溶解濃度を下げることによって析出させる。
【0033】
エバポレーション法による製造方法について詳細に記載する。難溶性薬物と2種類のポリマーを溶媒に溶解又は懸濁させる。この時の濃度は、固形分0.2〜40重量%であり、好ましくは1〜20重量%である。次いで減圧下又は常圧下で溶媒を除去する。このときの温度は、溶媒が留去できる温度であって蒸留時間から適度に選ぶことができ、−10〜120℃、好ましくは0〜100℃である。
【0034】
噴霧乾燥法による製造方法について詳細に記載する。難溶性薬物と2種類のポリマーを有機溶媒に溶解又は懸濁させる。この時の濃度は、噴霧乾燥できる濃度であればよく、固形分は0.1〜80重量%であり、好ましくは0.5〜50重量%である。ついで噴霧乾燥により溶媒の除去と造粒を同時に行う。噴霧乾燥機としては、円盤式またはノズル式(例えば、加圧ノズル、2流体ノズル、4流体ノズル)の噴霧乾燥機を用いる。噴霧乾燥の際の温度としては、入口温度が約20〜150℃であり、出口温度が約0〜85℃が好ましい。
【0035】
なお、エバポレーション法や噴霧乾燥法などの溶媒法によって、難溶性薬物固体分散体を得、残留溶媒のさらなる除去が必要であった場合、2次乾燥を行うことができる。2次乾燥は、難溶性薬物固体分散体を安定に維持できる方法であれば、通常医薬品の製造で用いられている乾燥方法で行うことができる。
【0036】
溶融法は、難溶性薬物と2種類のポリマー、必要に応じてその他の医薬添加成分とを、いずれかの成分が溶融する温度以上に加熱し、融解したのち冷却することによって難溶性薬物固体分散体を製造する方法である。使用する機械や温度、常法に従って任意に選択することができる。機械としてはエクストルーダーなどがあげられる。このとき融点を下げるため溶媒を添加してもよく、溶融後に溶媒を除去する。
【0037】
メカノケミカル法は、難溶性薬物と2種類のポリマー、必要に応じてその他の医薬添加成分とを同時に粉砕・衝撃を与えることによって難溶性薬物固体分散体を製造する方法である。使用する機械や温度、粉砕条件は常法に従って任意に選択することができる。
【0038】
このようにして得られた難溶性薬物固体分散体は、錠剤への混合性や溶出性、徐放性、苦味マスキングのために医薬品に使用可能な添加剤を用いて、乾式造粒や湿式造粒を行うことができる。難溶性薬物固体分散体の粒子径や嵩密度の違いで医薬添加物との混合性が劣る場合は、ローラーコンパクターなどで厚密化を行い、粒子径や嵩密度を大きくすることができる。
【0039】
難溶性薬物固体分散体及び/又は難溶性薬物固体分散体含有粒子に医薬添加物を混合し、錠剤、カプセル、散剤、液剤、乳剤もしくは懸濁剤などの経口型の医薬組成物を得る。また、非経口剤として、注射剤、坐剤、点眼剤、吸入剤、皮膚外用剤などの医薬組成物も得ることができる。これらの製造方法は公知の方法を用いることができる。
【0040】
医薬添加物としては、結合剤(例えば、カルメロース、ヒドロキシプロピルセルロース、アルギン酸、ゼラチン、部分α化澱粉、ポピドン、アラビアガム、プルラン、デキストリンなど)、賦形剤(例えば、スターチ、D−マンニトール、乳糖、トレハロース、結晶セルロース、メタケイ酸アルミン酸マグネシウム、リン酸水素カルシウム、ハイドロタルサイト、無水ケイ酸など)、崩壊剤(例えば、クロスポビドン、クロスカルメロースナトリウム、低置換度ヒドロキシプロピルセルロースなど)、界面活性剤(例えばポリオキシエチレン硬化ひまし油、ポリオキシエチレンポリオキシプロピレングリコール、ソルビタン脂肪酸エステル、ポリソルベート、脂肪酸グリセリンエステル、ラウリル硫酸ナトリウムなど)、滑沢剤(ショ糖脂肪酸エステル、ステアリン酸マグネシウム、タルク、フマル酸ステアリルナトリウムなど)、酸味料(例えば、クエン酸、酒石酸、リンゴ酸、アスコルビン酸など)、発泡剤(例えば炭酸水素ナトリウム、炭酸ナトリウムなど)、甘味剤(例えば、サッカリンナトリウム、グリチルリチン二カリウム、アスパルテーム、ステビア、ソーマチンなど)、香料(例えば、レモン油、オレンジ油、メントールなど)、着色剤(例えば、食用赤色2号、食用青色2号、食用黄色5号、食用レーキ色素、三二酸化鉄、アスタキサンチンなど)、安定化剤(例えば、エデト酸ナトリウム、トコフェロール、トコトリエノール、シクロデキストリンなど)、矯味剤、着香剤などがあげられる。
【0041】
本発明の難溶性薬物固体分散体からなる医薬組成物は、難溶性薬物の溶解濃度向上により、投与量を減らしても、従来の結晶難溶性薬物と同等のAUCが期待できる。
【実施例】
【0042】
以下に、本発明を実施例により説明するが、これらの実施例は本発明の範囲を限定するものではない。
【0043】
[実施例1] 溶媒留去法
結晶エキセメスタン(RPG Life Sciences 社製)10mgとヒドロキシプロピルメチルセルロースフタレート(信越化学工業(株)製:HPMCP HP−55)10mgとエチルセルロース(ダウケミカル社製)2mgを50mlのナス型フラスコに入れ、ジクロロメタンとメタノールの8:2溶液30mlを加えて常温で溶解させた。アスピレーター減圧下、温度37℃で溶媒を留去した後、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体を得た。
【0044】
[実施例2] 溶媒留去法
結晶エキセメスタン10mgとヒドロキシプロピルメチルセルロースフタレート10mgとメタクリル酸コポリマー(オイドラギットRS:Rohm社製)2mgを50mlのナス型フラスコに入れ、ジクロロメタンとメタノールの8:2溶液30mlを加えて常温で溶解させた。アスピレーター減圧下、温度37℃で溶媒を留去した後、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体を得た。
【0045】
[比較例1]
結晶エキセメスタン10mgを50mlのナス型フラスコに入れ、ジクロロメタンとメタノールの8:2溶液30mlを加えて常温で溶解させた。アスピレーター減圧下、温度37℃で溶媒を留去した後、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの非晶質体を得た。
【0046】
[比較例2]
結晶エキセメスタン10mgとヒドロキシプロピルメチルセルロースフタレート10mgを50mlのナス型フラスコに入れ、ジクロロメタンとメタノールの8:2溶液30mlを加えて常温で溶解させた。アスピレーター減圧下、温度37℃で溶媒を留去した後、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体を得た。
【0047】
[比較例3]
結晶エキセメスタン10mgとメタクリル酸コオリマー(オイドラギットL100−55:Rohm社製)10mgを50mlのナス型フラスコに入れ、ジクロロメタンとメタノールの8:2溶液30mlを加えて常温で溶解させた。アスピレーター減圧下、温度37℃で溶媒を留去した後、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体を得た。
【0048】
(溶出試験)
前述の実験で得た試料の薬物10mg相当を含むナス型フラスコを37℃の温浴に浸し、37℃の崩壊試験液第2液(pH6.8)40ml溶液を加えてフラスコ口をパラフィン紙で閉じ、100回/分で震盪させながら、経時的に水溶液を採取し、水溶液エキセメスタン濃度を測定した。採取した溶液を0.45μmのフィルターで篩過したのち、その溶液1mlをメタノールで10mlに希釈し、HPLC(日立製)測定により定量して溶解濃度を求めた。
比較例4は結晶エキセメスタン粉末である。
【0049】
[表1] 溶出試験結果

単位はμg/mlである。
【0050】
比較例1と4より、エキセメスタンは単独で非晶質化しても溶解度が40μm/ml以下と溶解性が改善されない。比較例2と3より、エキセメスタンと溶出向上ポリマーからなる固体分散体は、5分で溶解度がピークを迎えるが、その後溶解度が大きく低下している。対して、本発明の実施例1と実施例2の溶出向上ポリマーと溶出抑制ポリマーからなるエキセメスタンの固体分散体は、30分後においても溶解度が高く、結晶エキセメスタン対して6倍以上であり、エキセメスタン固体分散体に対して2倍以上である。
【0051】
[実施例3] 噴霧乾燥
結晶エキセメスタン100mgとヒドロキシプロピルメチルセルロースフタレート300mgとエチルセルロース50mgをジクロロメタンとメタノールの8:2溶液17.5mlを加えて常温で溶解させた。ついで、入熱温度80℃、排熱温度50℃、噴霧速度6ml/分で噴霧乾燥を行ったのち、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体の粉末を得た。
【0052】
[実施例4] 噴霧乾燥
結晶エキセメスタン100mgとヒドロキシプロピルメチルセルロースフタレート300mgとエチルセルロース200mgをジクロロメタンとメタノールの8:2溶液30mlを加えて常温で溶解させた。ついで、入熱温度80℃、排熱温度50℃、噴霧速度6ml/分で噴霧乾燥を行ったのち、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体の粉末を得た。
【0053】
[比較例5] 物理混合
結晶エキセメスタン20mgとヒドロキシプロピルメチルセルロースフタレート60mgとエチルセルロース10mgをビニール袋に入れて混合し、エキセメスタンの混合粉末を得た。
【0054】
[比較例6] 噴霧乾燥
結晶エキセメスタン100mgとヒドロキシプロピルメチルセルロースフタレート300mgをジクロロメタンとメタノールの8:2溶液20mlを加えて常温で溶解させた。ついで、入熱温度80℃、排熱温度50℃、噴霧速度6ml/分で噴霧乾燥を行ったのち、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体の粉末を得た。
【0055】
[比較例7] 噴霧乾燥と混合
結晶エキセメスタン100mgとヒドロキシプロピルメチルセルロースフタレート300mgをジクロロメタンとメタノールの8:2溶液30mlを加えて常温で溶解させた。ついで、入熱温度80℃、排熱温度50℃、噴霧速度6ml/分で噴霧乾燥を行ったのち、1晩、減圧下(5Torr以下)、40℃で乾燥し、エキセメスタンの固体分散体の粉末を得た。この粉末200mgにエチルセルロース25mgを混合し、エキセメスタンの混合粉末を得た。
【0056】
(溶出試験)
前述の実験で得た試料の薬物7.5mg相当をナス型フラスコに入れて37℃の温浴に浸し、37℃の崩壊試験液第2液30ml溶液を加えてフラスコ口をパラフィン紙で閉じ、100回/分で震盪させながら、経時的に水溶液を採取し、水溶液のエキセメスタン濃度を測定した。採取した溶液を0.45μmのフィルターで篩過したのち、その溶液1mlをメタノールで10mlに希釈し、HPLC測定により定量して溶解濃度を求めた。
結果を表2、図2に示す。比較例4は結晶エキセメスタン粉末である。
【0057】
[表2] 溶出試験結果

単位はμg/mlである。
【0058】
本発明のエキセメスタン固体分散体の実施例3と実施例4は、溶出試験の2〜30分の間において、比較例4の結晶エキセメスタンに対して6倍以上の溶解度を維持している。比較例1の結晶エキセメスタンと比較例2の結晶エキセメスタンとポリマーの物理混合品の溶解度に差はなく、単なるポリマーの混合は溶解度の向上に効果がない。比較例6のエキセメスタンとヒドロキシプロピルメチルセルロースフタレートとの固体分散体は、2分後に溶解度の一時的な上昇が見られるが5分以降ではその半分程度に溶解度が低下した。比較例6の固体分散体にエチルセルロースを添加した比較例7の溶解度は、実施例3や4の半部以下であった。
【0059】
実施例3〜4、比較例6〜7については、X'Pert−MPD型(フィリップス社製)によりX線測定(X−RD)により、エキセメスタンの結晶ピークが表れず、固体分散体を形成していることを確認した。実施例3と比較例4のX−RDパターンを図3に示す。比較例4の結晶エキセメスタンはピークが顕著に表れているが、実施例3の固体分散体は明確なピークがないハローパターンを示している。
【0060】
以上の結果より、エチルセルロースの効果はエキセメスタン溶解平衡の増加効果ではなく、溶出向上ポリマーであるヒドロキシプロピルセルロースフタレートンと溶出抑制ポリマーのエチルセルロースとエキセメスタの3成分が固体分散体を形成していることが、エキセメスタンの再析出による溶解度の低下を防止し、溶解度を長時間にわたって維持していることがわかる。
【特許請求の範囲】
【請求項1】
難溶性薬物、溶出向上ポリマー及び溶出抑制ポリマーからなる固体分散体組成物。
【請求項2】
難溶性薬物が水への溶解度維持性が低い難溶性薬物である請求項1の組成物。
【請求項3】
難溶性薬物の水に対して溶解度が0.0001〜0.1mg/mlである請求項1〜2のいずれか1項に記載の組成物。
【請求項4】
難溶性薬物と溶出向上ポリマーの配合比が1:0.1〜1:10であり、溶出向上ポリマーと溶出抑制ポリマーの配合比が1:0.1〜1:1である請求項1〜3のいずれかに記載の組成物。
【請求項5】
溶出向上ポリマーがセルロース系ポリマー、合成高分子モノポリマー、合成高分子コポリマー、天然高分子のうち水に溶解するポリマーの一種以上からなる請求項1〜4のいずれか1項に記載の組成物。
【請求項6】
溶出向上ポリマーの水への溶解度が、0.1〜1000mg/mlである請求項1〜5のいずれか1項に記載の組成物。
【請求項7】
溶出抑制ポリマーが、水にほとんど溶解しないポリマーの一種以上からなる請求項1〜6のいずれか1項に記載の組成物。
【請求項8】
溶出抑制ポリマーの水への溶解度が、0.001〜1mg/mlである請求項1〜7のいずれか1項に記載の組成物。
【請求項9】
難溶性薬物の水への溶解度が、該難溶性薬物の結晶物の水への溶解度に対し、溶出試験の30分後において2倍以上である請求項1〜8のいずれか1項に記載の組成物。
【請求項10】
難溶性薬物の水への溶解度が、該難溶性薬物と溶出向上ポリマーからなる固体分散体の該難溶性薬物の水への溶解度に対し、溶出試験の30分後において1.2倍以上である請求項1〜9のいずれか1項に記載の組成物。
【請求項11】
難溶性薬物の水への溶解試験の10分以内の最大溶解度に対して、60分後の該難溶性薬物の溶解度が0.7〜1.3倍である請求項1〜10のいずれか1項に記載の組成物。
【請求項12】
請求項1〜11のいずれか1項に記載の組成物を含む医薬品。
【請求項1】
難溶性薬物、溶出向上ポリマー及び溶出抑制ポリマーからなる固体分散体組成物。
【請求項2】
難溶性薬物が水への溶解度維持性が低い難溶性薬物である請求項1の組成物。
【請求項3】
難溶性薬物の水に対して溶解度が0.0001〜0.1mg/mlである請求項1〜2のいずれか1項に記載の組成物。
【請求項4】
難溶性薬物と溶出向上ポリマーの配合比が1:0.1〜1:10であり、溶出向上ポリマーと溶出抑制ポリマーの配合比が1:0.1〜1:1である請求項1〜3のいずれかに記載の組成物。
【請求項5】
溶出向上ポリマーがセルロース系ポリマー、合成高分子モノポリマー、合成高分子コポリマー、天然高分子のうち水に溶解するポリマーの一種以上からなる請求項1〜4のいずれか1項に記載の組成物。
【請求項6】
溶出向上ポリマーの水への溶解度が、0.1〜1000mg/mlである請求項1〜5のいずれか1項に記載の組成物。
【請求項7】
溶出抑制ポリマーが、水にほとんど溶解しないポリマーの一種以上からなる請求項1〜6のいずれか1項に記載の組成物。
【請求項8】
溶出抑制ポリマーの水への溶解度が、0.001〜1mg/mlである請求項1〜7のいずれか1項に記載の組成物。
【請求項9】
難溶性薬物の水への溶解度が、該難溶性薬物の結晶物の水への溶解度に対し、溶出試験の30分後において2倍以上である請求項1〜8のいずれか1項に記載の組成物。
【請求項10】
難溶性薬物の水への溶解度が、該難溶性薬物と溶出向上ポリマーからなる固体分散体の該難溶性薬物の水への溶解度に対し、溶出試験の30分後において1.2倍以上である請求項1〜9のいずれか1項に記載の組成物。
【請求項11】
難溶性薬物の水への溶解試験の10分以内の最大溶解度に対して、60分後の該難溶性薬物の溶解度が0.7〜1.3倍である請求項1〜10のいずれか1項に記載の組成物。
【請求項12】
請求項1〜11のいずれか1項に記載の組成物を含む医薬品。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2013−103899(P2013−103899A)
【公開日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願番号】特願2011−248107(P2011−248107)
【出願日】平成23年11月11日(2011.11.11)
【出願人】(390011877)富士化学工業株式会社 (53)
【Fターム(参考)】
【公開日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願日】平成23年11月11日(2011.11.11)
【出願人】(390011877)富士化学工業株式会社 (53)
【Fターム(参考)】
[ Back to top ]

