高分子電解質、高分子電解質膜、燃料電池、及びイオン性材料
【課題】燃料電池などに用いられる高分子電解質の側鎖のメソゲンがビフェニルであると、より高いプロトン伝導を有することができず、また主鎖がアクリル基であると、薄膜化ができず、高い発電性能を有することができないという課題がある。
【解決手段】燃料電池などに用いられる高分子電解質の側鎖のビフェニルを2,2’−ビピリジンに変更し、メソゲン同士のスタッキングを促進することで、プロトンのネットワーク形成を促進させ、プロトン伝導度を向上させる。また、主鎖をアクリル若しくはメタクリル骨格からフェニレン骨格に変更することで剛直な骨格を得、薄膜化が可能となり、発電性能を向上させる。
【解決手段】燃料電池などに用いられる高分子電解質の側鎖のビフェニルを2,2’−ビピリジンに変更し、メソゲン同士のスタッキングを促進することで、プロトンのネットワーク形成を促進させ、プロトン伝導度を向上させる。また、主鎖をアクリル若しくはメタクリル骨格からフェニレン骨格に変更することで剛直な骨格を得、薄膜化が可能となり、発電性能を向上させる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、高分子電解質、高分子電解質膜、燃料電池、及びイオン性材料に関し、例えば耐久性に優れ、低加湿特性に優れた高分子電解質に好適なものである。
【背景技術】
【0002】
固体高分子形燃料電池(以下、PEFC)は、環境負荷ガスの放出を削減できる動力源として、燃料電池自動車、定置用コジェネレーション、携帯電話の電源として研究開発が進められている。PEFCでは、電池内でのプロトンの伝導が起こることによって発電反応が進行する。PEFCにおけるプロトン伝導には水の存在は必須であり、それゆえPEFCの発電反応を進行させるためには加湿器が必要となる。燃料電池を車両などに適用する場合、車載性の観点からは加湿は小さいことが望まれるため、低加湿下でもプロトン伝導が良好に行われる電解質が求められている。ナフィオン(登録商標、デュポン社製)、アシプレックス(登録商標、旭化成株式会社製)に代表されるフッ素系樹脂電解質は、低加湿下におけるプロトン伝導性に優れており、PEFCに汎用されている材料である。
【0003】
しかしながら、フッ素系樹脂電解質は、フッ素からなる高分子材料であるため、リサイクル製という面で問題を有する。燃料電池自動車の普及を考えた場合、リサイクルできるかどうかという問題は重要であり、リサイクルができない材料の環境への負荷は無視することができない。更に、フッ素系樹脂電解質を単独で電解質膜として適用した場合、耐久性の点で問題がある。従って、フッ素系樹脂電解質の代替材料の必要性が高まってきている。
【0004】
この代替材料として炭化水素系電解質の開発が近年行われてきている。炭化水素系材料は、一般的にフッ素系樹脂電解質よりも耐久性に優れ、フッ素系樹脂電解質の代替として期待される。炭化水素系電解質を用いて、低加湿で高いプロトン伝導性を有するために、例えば下記特許文献1では、液晶骨格を有する材料を用いてスルホン酸基のネットワークを形成させ、低加湿で高いプロトン伝導性を発現させることが記載されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2003−55337号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、前記特許文献1に記載されるスルホン酸型液晶モノマー材料を高分子量化したスルホン化液晶ポリマー材料は、側鎖のメソゲンがビフェニルであり、ビフェニルはオルソ位の水素原子同士が電子反発を起こし、2つの環がねじれるためにメソゲン同士のスタッキングが不安定になる。それに伴い、酸基のネットワーク形成が阻害され、より高いプロトン伝導度が達成できなくなることが懸念される。また、主鎖がメタクリル基、若しくはアクリル骨格のため、薄膜化による性能向上が望みにくい。
本発明の目的は、上記問題を解決するものであって、側鎖のメソゲンのスタッキングを促進させ、また薄膜化を可能とするため主鎖に剛直な骨格を用いることでプロトン伝導度の優れた高分子電解質、高分子電解質膜、燃料電池、及びイオン性材料を提供することである。
【課題を解決するための手段】
【0007】
本発明者等は、上記目的を達成するべく鋭意研究を行った結果、側鎖のメソゲンを2,2’−ビピリジン骨格に変更し、主鎖をフェニレン骨格に変更した高分子電解質膜材料に着目した。
本発明のうち請求項1に記載の高分子電解質は、下記1式で表される高分子単位を有することを特徴とする高分子電解質である。但し、A1、A2はアルキル基−(CH2)m−であり、mは1以上の整数であり、Bはプロトン酸基であり、nは10〜10000の整数である。
【0008】
【化1】

【0009】
また、本発明のうち請求項2に記載の高分子電解質は、前記プロトン酸基Bが、スルホン酸基、又はホスホン酸基であることを特徴とする請求項1に記載の高分子電解質である。
また、本発明のうち請求項3に記載の高分子電解質膜は、請求項1又は2に記載の高分子電解質を用いることを特徴とする高分子電解質膜である。
【0010】
また、本発明のうち請求項4に記載の燃料電池は、請求項1又は2に記載の高分子電解質及び請求項3に記載の高分子電解質膜の何れか一方又は双方を用いることを特徴とする燃料電池である。
また、本発明のうち請求項5に記載のイオン性材料は、下記2式で表されるポリマー化可能な基を有することを特徴とするイオン性材料である。但し、A1、A2はアルキル基−(CH2)m−であり、mは1以上の整数であり、Bはプロトン酸基であり、A1、A2は夫々独立して塩素原子、臭気原子、又はヨウ素原子の何れかである。
【0011】
【化2】

【発明の効果】
【0012】
本発明のうち請求項1に記載の発明は、前記1式で表される高分子単位を有することを特徴とし、高いプロトン伝導度を有し、且つ薄膜化が可能で、高い発電性能を有する高分子電解質を提供できるという顕著な効果を奏する。
本発明のうち請求項2に記載の発明は、前記プロトン酸基Bが、スルホン酸基、又はホスホン酸基であることを特徴とする高分子電解質であり、プロトンの解離を促進させ、プロトン伝導度を向上することができるという顕著な効果を奏する。
【0013】
本発明のうち請求項3に記載の発明は、請求項1又は2に記載の高分子電解質から構成されることを特徴とする高分子電解質膜であり、高いプロトン伝導度、発電性能を兼ね備えた高分子電解質膜を提供することができるという顕著な効果を奏する。
本発明のうち請求項4に記載の発明は、請求項1又は2に記載の高分子電解質及び請求項3に記載の高分子電解質膜の何れか一方又は双方を用いることを特徴とする燃料電池であり、高い発電性能を備えた燃料電池を提供することができるという顕著な効果を奏する。
【図面の簡単な説明】
【0014】
【図1】ベンゼン環のπスタック概念図である。
【図2】ビフェニルの構造図である。
【図3】2,2’−ビピリジンの構造図である。
【図4】本発明の高分子電解質膜の両面に電極触媒層を形成した膜電極結合体の断面図である。
【図5】図4の膜電極接合体を装着した燃料電池の単セルの構成を示す分解図である。
【発明を実施するための形態】
【0015】
以下、本発明の実施形態について図面を用いて説明する。
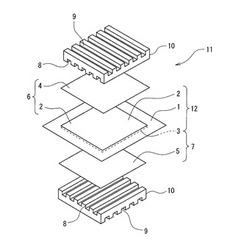
図4は、本発明の高分子電解質膜1の両面の夫々に空気極側電極触媒層2及び燃料極側電極触媒層3を形成した膜電極接合体12の断面図である。図5は、図4の膜電極接合体12を装着した燃料電池の単セル11の分解図であり、図中の符号4は空気極側ガス拡散層、符号5は燃料極側ガス拡散層、符号6は空気極、符号7は燃料極、符号8はガス流路、符号9は冷却水流路、符号10はセパレータである。
【0016】
以下に、本発明のイオン伝導性高分子及びそれを用いた膜電極結合体について説明する。なお、本発明は、以下に記載する各実施形態の限定されるものではなく、当業者の知識に基づいて設計の変更などの変形を加えることも可能であり、そのような変形が加えられた実施形態も本発明の範囲に含まれうるものである。
芳香族化合物は、一般的に芳香環上に非局在化したπ電子同士が相互作用することで、図1に示すように、芳香環の面と面を重ね合わせるように分子間でのスタック(πスタック)を形成することが知られている。この図では、上下のベンゼン環の炭素原子同士が互いに重なり合う配座の例を示している。液晶分子のメソゲンは、このスタックの形成を利用し、秩序構造を形成している。即ち、液晶分子が集合体を形成する上では、スタックの形成の促進が重要である。
【0017】
本発明では、連結基を介してメソゲンにプロトン酸基が結合しており、メソゲンのネットワークが直接プロトンのネットワークになりうる。従って、メソゲンのスタックの形成を更に促進することで、分子内のプロトンの輸送を効率よく行うことができ、プロトン伝導度を向上することができる。
通常、メソゲンとして用いられることが多いビフェニルは、図2に示すように、ベンゼン環同士が結合している炭素の隣(オルソ位)の炭素に結合した水素同士が電子反発を起こし、隣り合う環同士が約50°ねじれることが知られている。よりスタックを形成しやすくするためには、このねじれを解消してやる必要がある。
【0018】
本発明の高分子電解質は、メソゲンのビフェニルを2,2’−ビピリジンに変更している。2,2’−ビピリジンは、図3に示すように、ビフェニルのオルソ位の水素をそれぞれの環から1つずつなくした構造をしており、ビフェニルのような水素同士の電子反発を起こすことがないため、隣り合う環同士のねじれは殆ど起こらず、環同士はほぼ同一平面上にある。加えて、ピリジン環の窒素原子が隣の環のオルソ位の水素と水素結合を形成し、このねじれのない平面的な構造を安定化させることができる。
【0019】
以下に、本発明の燃料電池の薄膜化可能で耐久性に優れた高分子電解質膜の製造方法について説明する。なお、本発明は、以下に記載する各実施形態に限定されるものではなく、当業者の知識に基づいて設計の変更などの変形を加えることも可能であり、そのような変形が加えられた実施形態も本発明の範囲に含まれうるものである。
【0020】
[化合物の合成]
前記2式中のA1、A2、Bは、前記1式で定義されたものと同義であり、X1及びX2は夫々独立して塩素原子、臭素原子、又はヨウ素原子の何れかである。X1及びX2は同一であっても、異なっていてもよいが、同一であることが好ましい。
前記2式のモノマー製造方法は特に限定されないが、例えばA1がエチレン基−(CH2)2−、A2がプロピレン基−(CH2)3−、及びBがスルホン酸基である場合、以下のようにして合成できる。まず、4,4’ジヒドロキシ−2,2’−ビピリジンを用意し(合成はJournal of Medicinal Chemistry, 44, 1396(2001)を参照)、これと無機塩基及びプロパンスルトンを反応させることにより、下記3式を得ることができる。
【0021】
【化3】

【0022】
この際の反応条件は、特に限定されるものではないが、反応温度は25〜80℃が好ましい。反応時間は10〜48時間で行うのが好ましい。反応は、大気雰囲気下でも窒素雰囲気下でも問題ない。反応溶媒としては、良溶媒であることが望ましく、より好ましくは、アルコール系溶媒であることが望ましい。アルコール系溶媒としては、例えばエタノール、メタノール、1−プロパノール、2−プロパノール、1−ブタノールが挙げられる。
【0023】
塩基としては、強塩基であることが望ましく、例えば水酸化ナトリウム、水酸化カリウムなどが挙げられる。塩基の量は4,4’−ジヒドロキシ−2,2’−ビピリジン100モル%に対して、50〜100モル%であることが好ましく、70〜90モル%であることがより好ましい。
次に、下記4式で示される化合物を用意する。ここで、Xは夫々塩基原子、臭素原子、又はヨウ素原子の何れかである。
【0024】
【化4】

【0025】
前記3式で示される化合物を無機塩基で処理し、前記4式に示される化合物を反応させることで、下記5式に示されるモノマー化合物を得ることができる。
【0026】
【化5】

【0027】
この際の反応条件は、特に限定されるものではないが、反応温度は25〜80℃が好ましい。反応時間は10〜48時間で行うのが好ましい。反応は、大気雰囲気下でも窒素雰囲気下でも問題ない。反応溶媒としては、良溶媒であることが望ましく、より好ましくは、極性の高い溶媒であることが望ましい。極性の高い溶媒としては、例えばジメチルスルホキシド、ジメチルホルムアミド、ジメチルアセトアミド、N−メチルピロリドンなどが挙げられる。
【0028】
塩基としては、強塩基であることが望ましく、例えば水酸化ナトリウム、水酸化カリウムなどが挙げられる。塩基の量は前記4式に示される化合物100モル%に対して、50〜100モル%であることが好ましく、80〜100モル%であることがより好ましい。
このモノマーの重合は、特に限定されるものではないが、特定の触媒の存在下に反応させることが好ましい。この際使用される触媒は、遷移金属化合物を含む触媒系であり、この触媒系としては、配位子成分、配位子が配位された遷移金属錯体、及び還元剤を必須成分とし、更に、重合速度を上げるために塩を添加してもよい。
【0029】
配位子成分としては、トリフェニルホスフィン、2,2’−ビピリジン、1,5−シクロオクタジェン、又は1,3−ビス(ジフェニルホスフィノ)プロパンなどが挙げられる。これらのうち、トリフェニルホスフィン、2,2’−ビピリジンが好ましい。前記配位子成分である化合物は、1種単独で用いてもよく、2種以上を併用してもよい。配位子成分は、前記モノマー100モル%に対して、1〜100モル%であることが好ましく、1〜20モル%であることがより好ましい。
【0030】
配位子が配位された遷移金属錯体としては、例えば塩化ニッケルビス(トリフェニルホスフィン)、臭化ニッケルビル(トリフェニルホスフィン)、ヨウ化ニッケルビス(トリフェニルホスフィン)、硝酸ニッケルビス(トリフェニルホスフィン)、塩化ニッケル(2,2’−ビピリジン)、臭化ニッケル(2,2’−ビピリジン)、ビス(1,5−シクロオクタジェン)ニッケル、テトラキス(トリフェニルホスフィン)ニッケル、テトラキス(トリフェニルホスファイト)ニッケル、又はテトラキス(トリフェニルホスフィン)パラジウムなどが挙げられる。これらのうち、塩化ニッケルビス(トリフェニルホスフィン)、塩化ニッケル(2,2’−ビピリジン)が好ましい。遷移金属錯体は、前記モノマー100モル%に対して、1〜100モル%であることが好ましく、1〜20モル%であることがより好ましい。
【0031】
前記触媒系に使用することができる還元剤としては、例えば鉄、亜鉛、マンガン、アルミニウム、マグネシウム、ナトリウム、又はカルシウムなどが挙げられる。これらのうち、亜鉛、マグネシウム、マンガンが好ましい。これらの還元剤は、有機酸などの酸に接触させることにより、より活性化して用いることができる。還元剤は、前記モノマー100モル%に対して、1〜100モル%であることが好ましく、10〜30モル%であることがより好ましい。
【0032】
また、前記触媒系において使用できる塩としては、フッ化ナトリウム、塩化ナトリウム、臭化ナトリウム、ヨウ化ナトリウム、硫酸ナトリウムなどのナトリウム化合物;フッ化カリウム、塩化カリウム、臭化カリウム、ヨウ化カリウム、硫酸カリウムなどのカリウム化合物;フッ化テトラエチルアンモニウム、塩化テトラエチルアンモニウム、臭化テトラエチルアンモニウム、ヨウ化テトラエチルアンモニウム、硫酸テトラエチルアンモニウムなどのアンモニウム化合物が挙げられる。これらのうち、臭化ナトリウム、ヨウ化ナトリウム、臭化カリウム、臭化テトラエチルアンモニウム、ヨウ化テトラエチルアンモニウムが好ましい。塩は、前記モノマー100モル%に対して、1〜100モル%であることが好ましく、10〜30モル%であることがより好ましい。
【0033】
また、重合の際に用いられる触媒としては、例えばテトラヒドロフラン、シクロヘキサノン、ジメチルスルホキシド、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン、γ−ブチロラクトン、N,N−ジメチルイミダゾリジノンなどが挙げられる。これらのうち、テトラヒドロフラン、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン、N,N−ジメチルイミダゾリジノンが好ましい。これらの重合溶媒は、十分に乾燥してか用いることが好ましい。
【0034】
重合の際の重合温度及び重合時間は、特に限定されるものではなく、分子量、重合の濃度などによって適宜設定すればよい。例えば、重量平均分子量が10〜50万の重合体を得ることを目的とする場合、反応効率の点から、重合温度が好ましくは25〜80℃、より好ましくは40〜70℃、重合時間が好ましくは8〜40時間、より好ましくは16〜32時間で重合が行われる。重合の際の重合圧力は、特に限定されず、加圧下、常圧(大気圧)下、減圧下の何れかでよく、場合により適宜設定すればよいが、常圧下であることが好ましい。
【0035】
このようにして得られた高分子電解質を用いて高分子電解質膜を製造する方法としては、特に限定されないが、例えば、本発明のポリフェニレン系電解質を溶剤に溶解して溶液とした後、キャスティングにより、基材上に塗布し、フィルム状に形成する方法や、所定のギャップに制御されたアプリケータを用いて塗工、成膜する方法、ダイコータを用いて成膜する方法などが挙げられる。
【0036】
成膜にあたっては粘度を10〜10000Pa・sとすることが好ましく、10〜1000Pa・sとすることがより好ましい。この粘度範囲内であると、溶剤の残留量が少なく、また溶液を乾燥する際に多量の気泡が発生する確率が低いことと、レベリング効果により厚みのむらが低減できるため、安定したプロトン伝導性が確保される。
この際の電解質濃度は、分子量にもよるが、通常、2.5〜50質量%、好ましくは7〜25質量%である。この濃度範囲内であれば、成膜性に優れる。
【0037】
また、この際に用いられる溶媒としては、例えばN−メチル−2−ピロリドン、N,N−ジメチルホルムアミド、γ−ブチルラクトン、N,N−ジメチルアセトアミド、ジメチルスルホキシド、ジメチル尿素、ジメチルイミダゾリジノンなどの非プロトン系極性溶剤、メタノール、エタノール、プロピルアルコール、iso−プロピルアルコール、sec−ブチルアルコール、tert−ブチルアルコールなどのアルコール系溶媒及びアセトン、メチルエチルケトン、シクロヘキサノンなどのケトン系溶媒などが挙げられる。これらの溶媒は、単独で用いてもよく、或いは2種以上混合させてもよい。また、これらの溶媒に水を添加したものを用いてもよい。
【0038】
粘度を調整したポリマー溶液は、例えば、基材にキャストされる。キャストする基材としては、金属材料、ガラス、セラミックス、プラスチックなどが挙げられる。基材の形状は特に限定されるものではない。
基材上に形成されたフィルムは、好ましくは25〜140℃、0.1〜24時間、加熱することにより、高分子電解質膜を得ることができる。
実施例及び比較例について示す。以下、本発明を実施例により詳細に説明するが、本発明はこれに限定されるものではない。
【0039】
[3式の合成]
窒素雰囲気下、4,4’−ジヒドロキシ−2,2’−ビピリジン94g(0.5mol)、プロパンスルトンを61g(0.5mol)及び水酸化ナトリウム16g(0.4mol)、メタノールを200ml加え、48時間攪拌した。その後、ジエチルエーテルで再沈殿させ、濾過した。濾過物をメタノールで洗い込み、前記3式を得た。
[6式の合成]
窒素雰囲気下、前記3式166g(0.5mol)、2−(2,5−ジクロロフェニル)−1−ブロモエタン127g(0.5mol)及び水酸化ナトリウム20g(0.5mol)、ジメチルスルホキシドを200ml加え、48時間攪拌した。その後、メタノールで再沈殿させ、濾過した。濾過物をメタノールで洗い込み、下記6式を得た。
【0040】
【化6】

【0041】
[実施例1]
[7式の合成]
窒素雰囲気下、前記6式7.6g(15mmol)、トリフェニルホスフィン1.5g(5.6mmol)、ヨウ化ナトリウム0.3g(2mmol)、亜鉛1.3g(20mmol)、ビス(トリフェニルホスフィン)ニッケル(II)ジクロリド0.31g(0.48mmol)を加え、溶媒として20mlのジメチルホルムアミドを加え、60℃で24時間攪拌した。反応物をメタノールで再沈し、固体を濾別した後、濃塩酸でプロトンフォームした。更に純水で濾液のpHが7になるまで洗浄した後、固体を減圧乾燥し、下記7式を得た。
【0042】
【化7】

【0043】
以下、本発明を比較例により詳細に説明するが、本発明はこれらに限定されるものではない。
[9−ブロモ−1−デセンの合成]
500mlの三角フラスコにベンゼン100ml及びピリジン1.0gを加え、9−デセン−1−オール25g(0.16mol)を溶解した。次に、三臭化リン43.2g(0.16mol)を溶解させたベンゼン溶液100mlを氷冷下でゆっくりと滴下した後、室温で18時間攪拌した。その後、反応液を氷水中に注ぎ、ジエチルエーテル300mlで抽出した。ここで得たエーテル−ベンゼン混合液は無水硫酸ナトリウムで一晩脱水した。吸引濾過により硫酸ナトリウムを除き、エーテル−ベンゼンを減圧除去し、残渣を減圧蒸留して目的物9−ブロモ−1−デセンを得た。
【0044】
[4−(9−デセニルオキシフェニル)フェノールの合成]
水酸化ナトリウム3.40g(0.08mol)を100mlのエタノールに溶解させた。この溶液を、4,4’−ビフェノール14.9g(0.08mol)を溶解させた100mlエタノールに少量ずつ加え、エタノールを減圧除去した。残渣を150mlジメチルホルムアミドに窒素気流下で加温して溶解させた(A液)。前述のようにして調整した9−ブロモ−1−デセン15.8g(0.072mol)、フェノチアジン0.1gを30mlのDMFに溶解させた(B液)。窒素雰囲気下でよく撹拌しながら、A液にB液を30分程度かけて加え、40℃で24時間反応させた。反応終了後、反応液を冷却し、300mlの10%冷却塩酸で洗浄した後、300mlのエーテルで抽出し、次いで100mlの冷蒸留水で洗浄した。エーテル層は無水硫酸ナトリウムで一晩脱水する。残渣に300mlのヘキサンを加え、濾過により沈殿物を得る。次いで200mlのベンゼンを加え、ベンゼン可溶部分を、ベンゼンを用いたカラムクロマトグラフィーで精製して4−(9−デセニルオキシフェニル)フェノールを得た。
【0045】
[3−[6−(9−デセニルオキシ)ビフェニルオキシ]プロピルスルホン酸の合成]
ジメチルホルムアミド30ml中に重合禁止剤フェノチアジン0.05gを溶解させた。そこへ、1,8−ジアザビシクロ[5,4,0]−7−ウンデンセン(DBU)1.22g(0.008mol)と4−(9−デセニルオキシフェニル)フェノール0.65g(0.002mol)、3−ブロモプロパンスルホン酸ナトリウム1.8g(0.008mol)を溶解させ、窒素雰囲気下、50℃で48時間撹拌した。反応終了後、溶媒を濃縮し、ジエチルエーテルを加え、濾過することにより沈殿を得た。次に、沈殿を蒸留水でよく洗浄した。次に、洗浄後の沈殿を6mol/LのHCl中で24時間撹拌後、遠心分離機により沈殿を得て、この沈殿をジエチルエーテルで洗浄後、乾燥して3−[6−(9−デセニルオキシ)ビフェニルオキシ]プロピルスルホン酸を得た。
【0046】
[比較例1]
[3−[6−(9−デセニルオキシ)ビフェニルオキシ]プロピルスルホン酸の高分子量化]
窒素雰囲気下、3−[6−(9−デセニルオキシ)ビフェニルオキシ]プロプルスルホン酸を488mg(1mmol)、開始剤であるAIBNを6.6mg(0.04mmol)加え、ジメチルスルホキシドを4.8ml加えた。その後、60℃で60時間熱重合して高分子量化させた。その後、アセトンで再沈殿させ、ポリマーを得た。
【0047】
[ポリマーの製膜]
前記7式、3−[6−(9−デセニルオキシ)ビフェニルオキシ]プロピルスルホン酸ポリマーをジメチルスルホキシドに溶解させ、ガラスにキャストし、45℃で12時間、80℃で12時間、80℃で1時間真空乾燥させることで、膜を得た。
[薄膜化]
前記7式で表わされるポリマー膜は、3−[6−(9−デセニルオキシ)ビフェニルオキシ]プロピルスルホン酸ポリマーから得られる膜に比較して、薄膜化しても膜電極接合体が作製できる機械強度を有していた。
【0048】
[プロトン伝導度の測定]
解質膜の交流抵抗は、10mm幅の短冊状のプロトン伝導膜試料の表面に、白金線を押し当て、恒温恒湿装置中に試料を保持し、白金線間の交流インピーダンス測定から求めた。すなわち、温度80℃、相対湿度30%の環境下でインピーダンスを測定した。実施例1のプロトン伝導度は、比較例1と比べて大きく向上した。
【産業上の利用可能性】
【0049】
本発明は、電気自動車、燃料電池自動車などの自動車、ノートパソコン、携帯電話、携帯情報端末などのモバイル機器、家庭用発電装置などの発電源として用いられる固体高分子形燃料電池を構成する高分子電解質膜として利用できる。
【符号の説明】
【0050】
1 高分子電解質
2 空気極側電極触媒層
3 燃料極側電極触媒層
4 空気極側ガス拡散層
5 燃料極側ガス拡散層
6 空気極
7 燃料極
8 ガス流路
9 冷却水流路
10 セパレータ
11 単セル
12 膜電極結合体
【技術分野】
【0001】
本発明は、高分子電解質、高分子電解質膜、燃料電池、及びイオン性材料に関し、例えば耐久性に優れ、低加湿特性に優れた高分子電解質に好適なものである。
【背景技術】
【0002】
固体高分子形燃料電池(以下、PEFC)は、環境負荷ガスの放出を削減できる動力源として、燃料電池自動車、定置用コジェネレーション、携帯電話の電源として研究開発が進められている。PEFCでは、電池内でのプロトンの伝導が起こることによって発電反応が進行する。PEFCにおけるプロトン伝導には水の存在は必須であり、それゆえPEFCの発電反応を進行させるためには加湿器が必要となる。燃料電池を車両などに適用する場合、車載性の観点からは加湿は小さいことが望まれるため、低加湿下でもプロトン伝導が良好に行われる電解質が求められている。ナフィオン(登録商標、デュポン社製)、アシプレックス(登録商標、旭化成株式会社製)に代表されるフッ素系樹脂電解質は、低加湿下におけるプロトン伝導性に優れており、PEFCに汎用されている材料である。
【0003】
しかしながら、フッ素系樹脂電解質は、フッ素からなる高分子材料であるため、リサイクル製という面で問題を有する。燃料電池自動車の普及を考えた場合、リサイクルできるかどうかという問題は重要であり、リサイクルができない材料の環境への負荷は無視することができない。更に、フッ素系樹脂電解質を単独で電解質膜として適用した場合、耐久性の点で問題がある。従って、フッ素系樹脂電解質の代替材料の必要性が高まってきている。
【0004】
この代替材料として炭化水素系電解質の開発が近年行われてきている。炭化水素系材料は、一般的にフッ素系樹脂電解質よりも耐久性に優れ、フッ素系樹脂電解質の代替として期待される。炭化水素系電解質を用いて、低加湿で高いプロトン伝導性を有するために、例えば下記特許文献1では、液晶骨格を有する材料を用いてスルホン酸基のネットワークを形成させ、低加湿で高いプロトン伝導性を発現させることが記載されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2003−55337号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、前記特許文献1に記載されるスルホン酸型液晶モノマー材料を高分子量化したスルホン化液晶ポリマー材料は、側鎖のメソゲンがビフェニルであり、ビフェニルはオルソ位の水素原子同士が電子反発を起こし、2つの環がねじれるためにメソゲン同士のスタッキングが不安定になる。それに伴い、酸基のネットワーク形成が阻害され、より高いプロトン伝導度が達成できなくなることが懸念される。また、主鎖がメタクリル基、若しくはアクリル骨格のため、薄膜化による性能向上が望みにくい。
本発明の目的は、上記問題を解決するものであって、側鎖のメソゲンのスタッキングを促進させ、また薄膜化を可能とするため主鎖に剛直な骨格を用いることでプロトン伝導度の優れた高分子電解質、高分子電解質膜、燃料電池、及びイオン性材料を提供することである。
【課題を解決するための手段】
【0007】
本発明者等は、上記目的を達成するべく鋭意研究を行った結果、側鎖のメソゲンを2,2’−ビピリジン骨格に変更し、主鎖をフェニレン骨格に変更した高分子電解質膜材料に着目した。
本発明のうち請求項1に記載の高分子電解質は、下記1式で表される高分子単位を有することを特徴とする高分子電解質である。但し、A1、A2はアルキル基−(CH2)m−であり、mは1以上の整数であり、Bはプロトン酸基であり、nは10〜10000の整数である。
【0008】
【化1】

【0009】
また、本発明のうち請求項2に記載の高分子電解質は、前記プロトン酸基Bが、スルホン酸基、又はホスホン酸基であることを特徴とする請求項1に記載の高分子電解質である。
また、本発明のうち請求項3に記載の高分子電解質膜は、請求項1又は2に記載の高分子電解質を用いることを特徴とする高分子電解質膜である。
【0010】
また、本発明のうち請求項4に記載の燃料電池は、請求項1又は2に記載の高分子電解質及び請求項3に記載の高分子電解質膜の何れか一方又は双方を用いることを特徴とする燃料電池である。
また、本発明のうち請求項5に記載のイオン性材料は、下記2式で表されるポリマー化可能な基を有することを特徴とするイオン性材料である。但し、A1、A2はアルキル基−(CH2)m−であり、mは1以上の整数であり、Bはプロトン酸基であり、A1、A2は夫々独立して塩素原子、臭気原子、又はヨウ素原子の何れかである。
【0011】
【化2】

【発明の効果】
【0012】
本発明のうち請求項1に記載の発明は、前記1式で表される高分子単位を有することを特徴とし、高いプロトン伝導度を有し、且つ薄膜化が可能で、高い発電性能を有する高分子電解質を提供できるという顕著な効果を奏する。
本発明のうち請求項2に記載の発明は、前記プロトン酸基Bが、スルホン酸基、又はホスホン酸基であることを特徴とする高分子電解質であり、プロトンの解離を促進させ、プロトン伝導度を向上することができるという顕著な効果を奏する。
【0013】
本発明のうち請求項3に記載の発明は、請求項1又は2に記載の高分子電解質から構成されることを特徴とする高分子電解質膜であり、高いプロトン伝導度、発電性能を兼ね備えた高分子電解質膜を提供することができるという顕著な効果を奏する。
本発明のうち請求項4に記載の発明は、請求項1又は2に記載の高分子電解質及び請求項3に記載の高分子電解質膜の何れか一方又は双方を用いることを特徴とする燃料電池であり、高い発電性能を備えた燃料電池を提供することができるという顕著な効果を奏する。
【図面の簡単な説明】
【0014】
【図1】ベンゼン環のπスタック概念図である。
【図2】ビフェニルの構造図である。
【図3】2,2’−ビピリジンの構造図である。
【図4】本発明の高分子電解質膜の両面に電極触媒層を形成した膜電極結合体の断面図である。
【図5】図4の膜電極接合体を装着した燃料電池の単セルの構成を示す分解図である。
【発明を実施するための形態】
【0015】
以下、本発明の実施形態について図面を用いて説明する。
図4は、本発明の高分子電解質膜1の両面の夫々に空気極側電極触媒層2及び燃料極側電極触媒層3を形成した膜電極接合体12の断面図である。図5は、図4の膜電極接合体12を装着した燃料電池の単セル11の分解図であり、図中の符号4は空気極側ガス拡散層、符号5は燃料極側ガス拡散層、符号6は空気極、符号7は燃料極、符号8はガス流路、符号9は冷却水流路、符号10はセパレータである。
【0016】
以下に、本発明のイオン伝導性高分子及びそれを用いた膜電極結合体について説明する。なお、本発明は、以下に記載する各実施形態の限定されるものではなく、当業者の知識に基づいて設計の変更などの変形を加えることも可能であり、そのような変形が加えられた実施形態も本発明の範囲に含まれうるものである。
芳香族化合物は、一般的に芳香環上に非局在化したπ電子同士が相互作用することで、図1に示すように、芳香環の面と面を重ね合わせるように分子間でのスタック(πスタック)を形成することが知られている。この図では、上下のベンゼン環の炭素原子同士が互いに重なり合う配座の例を示している。液晶分子のメソゲンは、このスタックの形成を利用し、秩序構造を形成している。即ち、液晶分子が集合体を形成する上では、スタックの形成の促進が重要である。
【0017】
本発明では、連結基を介してメソゲンにプロトン酸基が結合しており、メソゲンのネットワークが直接プロトンのネットワークになりうる。従って、メソゲンのスタックの形成を更に促進することで、分子内のプロトンの輸送を効率よく行うことができ、プロトン伝導度を向上することができる。
通常、メソゲンとして用いられることが多いビフェニルは、図2に示すように、ベンゼン環同士が結合している炭素の隣(オルソ位)の炭素に結合した水素同士が電子反発を起こし、隣り合う環同士が約50°ねじれることが知られている。よりスタックを形成しやすくするためには、このねじれを解消してやる必要がある。
【0018】
本発明の高分子電解質は、メソゲンのビフェニルを2,2’−ビピリジンに変更している。2,2’−ビピリジンは、図3に示すように、ビフェニルのオルソ位の水素をそれぞれの環から1つずつなくした構造をしており、ビフェニルのような水素同士の電子反発を起こすことがないため、隣り合う環同士のねじれは殆ど起こらず、環同士はほぼ同一平面上にある。加えて、ピリジン環の窒素原子が隣の環のオルソ位の水素と水素結合を形成し、このねじれのない平面的な構造を安定化させることができる。
【0019】
以下に、本発明の燃料電池の薄膜化可能で耐久性に優れた高分子電解質膜の製造方法について説明する。なお、本発明は、以下に記載する各実施形態に限定されるものではなく、当業者の知識に基づいて設計の変更などの変形を加えることも可能であり、そのような変形が加えられた実施形態も本発明の範囲に含まれうるものである。
【0020】
[化合物の合成]
前記2式中のA1、A2、Bは、前記1式で定義されたものと同義であり、X1及びX2は夫々独立して塩素原子、臭素原子、又はヨウ素原子の何れかである。X1及びX2は同一であっても、異なっていてもよいが、同一であることが好ましい。
前記2式のモノマー製造方法は特に限定されないが、例えばA1がエチレン基−(CH2)2−、A2がプロピレン基−(CH2)3−、及びBがスルホン酸基である場合、以下のようにして合成できる。まず、4,4’ジヒドロキシ−2,2’−ビピリジンを用意し(合成はJournal of Medicinal Chemistry, 44, 1396(2001)を参照)、これと無機塩基及びプロパンスルトンを反応させることにより、下記3式を得ることができる。
【0021】
【化3】

【0022】
この際の反応条件は、特に限定されるものではないが、反応温度は25〜80℃が好ましい。反応時間は10〜48時間で行うのが好ましい。反応は、大気雰囲気下でも窒素雰囲気下でも問題ない。反応溶媒としては、良溶媒であることが望ましく、より好ましくは、アルコール系溶媒であることが望ましい。アルコール系溶媒としては、例えばエタノール、メタノール、1−プロパノール、2−プロパノール、1−ブタノールが挙げられる。
【0023】
塩基としては、強塩基であることが望ましく、例えば水酸化ナトリウム、水酸化カリウムなどが挙げられる。塩基の量は4,4’−ジヒドロキシ−2,2’−ビピリジン100モル%に対して、50〜100モル%であることが好ましく、70〜90モル%であることがより好ましい。
次に、下記4式で示される化合物を用意する。ここで、Xは夫々塩基原子、臭素原子、又はヨウ素原子の何れかである。
【0024】
【化4】

【0025】
前記3式で示される化合物を無機塩基で処理し、前記4式に示される化合物を反応させることで、下記5式に示されるモノマー化合物を得ることができる。
【0026】
【化5】

【0027】
この際の反応条件は、特に限定されるものではないが、反応温度は25〜80℃が好ましい。反応時間は10〜48時間で行うのが好ましい。反応は、大気雰囲気下でも窒素雰囲気下でも問題ない。反応溶媒としては、良溶媒であることが望ましく、より好ましくは、極性の高い溶媒であることが望ましい。極性の高い溶媒としては、例えばジメチルスルホキシド、ジメチルホルムアミド、ジメチルアセトアミド、N−メチルピロリドンなどが挙げられる。
【0028】
塩基としては、強塩基であることが望ましく、例えば水酸化ナトリウム、水酸化カリウムなどが挙げられる。塩基の量は前記4式に示される化合物100モル%に対して、50〜100モル%であることが好ましく、80〜100モル%であることがより好ましい。
このモノマーの重合は、特に限定されるものではないが、特定の触媒の存在下に反応させることが好ましい。この際使用される触媒は、遷移金属化合物を含む触媒系であり、この触媒系としては、配位子成分、配位子が配位された遷移金属錯体、及び還元剤を必須成分とし、更に、重合速度を上げるために塩を添加してもよい。
【0029】
配位子成分としては、トリフェニルホスフィン、2,2’−ビピリジン、1,5−シクロオクタジェン、又は1,3−ビス(ジフェニルホスフィノ)プロパンなどが挙げられる。これらのうち、トリフェニルホスフィン、2,2’−ビピリジンが好ましい。前記配位子成分である化合物は、1種単独で用いてもよく、2種以上を併用してもよい。配位子成分は、前記モノマー100モル%に対して、1〜100モル%であることが好ましく、1〜20モル%であることがより好ましい。
【0030】
配位子が配位された遷移金属錯体としては、例えば塩化ニッケルビス(トリフェニルホスフィン)、臭化ニッケルビル(トリフェニルホスフィン)、ヨウ化ニッケルビス(トリフェニルホスフィン)、硝酸ニッケルビス(トリフェニルホスフィン)、塩化ニッケル(2,2’−ビピリジン)、臭化ニッケル(2,2’−ビピリジン)、ビス(1,5−シクロオクタジェン)ニッケル、テトラキス(トリフェニルホスフィン)ニッケル、テトラキス(トリフェニルホスファイト)ニッケル、又はテトラキス(トリフェニルホスフィン)パラジウムなどが挙げられる。これらのうち、塩化ニッケルビス(トリフェニルホスフィン)、塩化ニッケル(2,2’−ビピリジン)が好ましい。遷移金属錯体は、前記モノマー100モル%に対して、1〜100モル%であることが好ましく、1〜20モル%であることがより好ましい。
【0031】
前記触媒系に使用することができる還元剤としては、例えば鉄、亜鉛、マンガン、アルミニウム、マグネシウム、ナトリウム、又はカルシウムなどが挙げられる。これらのうち、亜鉛、マグネシウム、マンガンが好ましい。これらの還元剤は、有機酸などの酸に接触させることにより、より活性化して用いることができる。還元剤は、前記モノマー100モル%に対して、1〜100モル%であることが好ましく、10〜30モル%であることがより好ましい。
【0032】
また、前記触媒系において使用できる塩としては、フッ化ナトリウム、塩化ナトリウム、臭化ナトリウム、ヨウ化ナトリウム、硫酸ナトリウムなどのナトリウム化合物;フッ化カリウム、塩化カリウム、臭化カリウム、ヨウ化カリウム、硫酸カリウムなどのカリウム化合物;フッ化テトラエチルアンモニウム、塩化テトラエチルアンモニウム、臭化テトラエチルアンモニウム、ヨウ化テトラエチルアンモニウム、硫酸テトラエチルアンモニウムなどのアンモニウム化合物が挙げられる。これらのうち、臭化ナトリウム、ヨウ化ナトリウム、臭化カリウム、臭化テトラエチルアンモニウム、ヨウ化テトラエチルアンモニウムが好ましい。塩は、前記モノマー100モル%に対して、1〜100モル%であることが好ましく、10〜30モル%であることがより好ましい。
【0033】
また、重合の際に用いられる触媒としては、例えばテトラヒドロフラン、シクロヘキサノン、ジメチルスルホキシド、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン、γ−ブチロラクトン、N,N−ジメチルイミダゾリジノンなどが挙げられる。これらのうち、テトラヒドロフラン、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン、N,N−ジメチルイミダゾリジノンが好ましい。これらの重合溶媒は、十分に乾燥してか用いることが好ましい。
【0034】
重合の際の重合温度及び重合時間は、特に限定されるものではなく、分子量、重合の濃度などによって適宜設定すればよい。例えば、重量平均分子量が10〜50万の重合体を得ることを目的とする場合、反応効率の点から、重合温度が好ましくは25〜80℃、より好ましくは40〜70℃、重合時間が好ましくは8〜40時間、より好ましくは16〜32時間で重合が行われる。重合の際の重合圧力は、特に限定されず、加圧下、常圧(大気圧)下、減圧下の何れかでよく、場合により適宜設定すればよいが、常圧下であることが好ましい。
【0035】
このようにして得られた高分子電解質を用いて高分子電解質膜を製造する方法としては、特に限定されないが、例えば、本発明のポリフェニレン系電解質を溶剤に溶解して溶液とした後、キャスティングにより、基材上に塗布し、フィルム状に形成する方法や、所定のギャップに制御されたアプリケータを用いて塗工、成膜する方法、ダイコータを用いて成膜する方法などが挙げられる。
【0036】
成膜にあたっては粘度を10〜10000Pa・sとすることが好ましく、10〜1000Pa・sとすることがより好ましい。この粘度範囲内であると、溶剤の残留量が少なく、また溶液を乾燥する際に多量の気泡が発生する確率が低いことと、レベリング効果により厚みのむらが低減できるため、安定したプロトン伝導性が確保される。
この際の電解質濃度は、分子量にもよるが、通常、2.5〜50質量%、好ましくは7〜25質量%である。この濃度範囲内であれば、成膜性に優れる。
【0037】
また、この際に用いられる溶媒としては、例えばN−メチル−2−ピロリドン、N,N−ジメチルホルムアミド、γ−ブチルラクトン、N,N−ジメチルアセトアミド、ジメチルスルホキシド、ジメチル尿素、ジメチルイミダゾリジノンなどの非プロトン系極性溶剤、メタノール、エタノール、プロピルアルコール、iso−プロピルアルコール、sec−ブチルアルコール、tert−ブチルアルコールなどのアルコール系溶媒及びアセトン、メチルエチルケトン、シクロヘキサノンなどのケトン系溶媒などが挙げられる。これらの溶媒は、単独で用いてもよく、或いは2種以上混合させてもよい。また、これらの溶媒に水を添加したものを用いてもよい。
【0038】
粘度を調整したポリマー溶液は、例えば、基材にキャストされる。キャストする基材としては、金属材料、ガラス、セラミックス、プラスチックなどが挙げられる。基材の形状は特に限定されるものではない。
基材上に形成されたフィルムは、好ましくは25〜140℃、0.1〜24時間、加熱することにより、高分子電解質膜を得ることができる。
実施例及び比較例について示す。以下、本発明を実施例により詳細に説明するが、本発明はこれに限定されるものではない。
【0039】
[3式の合成]
窒素雰囲気下、4,4’−ジヒドロキシ−2,2’−ビピリジン94g(0.5mol)、プロパンスルトンを61g(0.5mol)及び水酸化ナトリウム16g(0.4mol)、メタノールを200ml加え、48時間攪拌した。その後、ジエチルエーテルで再沈殿させ、濾過した。濾過物をメタノールで洗い込み、前記3式を得た。
[6式の合成]
窒素雰囲気下、前記3式166g(0.5mol)、2−(2,5−ジクロロフェニル)−1−ブロモエタン127g(0.5mol)及び水酸化ナトリウム20g(0.5mol)、ジメチルスルホキシドを200ml加え、48時間攪拌した。その後、メタノールで再沈殿させ、濾過した。濾過物をメタノールで洗い込み、下記6式を得た。
【0040】
【化6】

【0041】
[実施例1]
[7式の合成]
窒素雰囲気下、前記6式7.6g(15mmol)、トリフェニルホスフィン1.5g(5.6mmol)、ヨウ化ナトリウム0.3g(2mmol)、亜鉛1.3g(20mmol)、ビス(トリフェニルホスフィン)ニッケル(II)ジクロリド0.31g(0.48mmol)を加え、溶媒として20mlのジメチルホルムアミドを加え、60℃で24時間攪拌した。反応物をメタノールで再沈し、固体を濾別した後、濃塩酸でプロトンフォームした。更に純水で濾液のpHが7になるまで洗浄した後、固体を減圧乾燥し、下記7式を得た。
【0042】
【化7】

【0043】
以下、本発明を比較例により詳細に説明するが、本発明はこれらに限定されるものではない。
[9−ブロモ−1−デセンの合成]
500mlの三角フラスコにベンゼン100ml及びピリジン1.0gを加え、9−デセン−1−オール25g(0.16mol)を溶解した。次に、三臭化リン43.2g(0.16mol)を溶解させたベンゼン溶液100mlを氷冷下でゆっくりと滴下した後、室温で18時間攪拌した。その後、反応液を氷水中に注ぎ、ジエチルエーテル300mlで抽出した。ここで得たエーテル−ベンゼン混合液は無水硫酸ナトリウムで一晩脱水した。吸引濾過により硫酸ナトリウムを除き、エーテル−ベンゼンを減圧除去し、残渣を減圧蒸留して目的物9−ブロモ−1−デセンを得た。
【0044】
[4−(9−デセニルオキシフェニル)フェノールの合成]
水酸化ナトリウム3.40g(0.08mol)を100mlのエタノールに溶解させた。この溶液を、4,4’−ビフェノール14.9g(0.08mol)を溶解させた100mlエタノールに少量ずつ加え、エタノールを減圧除去した。残渣を150mlジメチルホルムアミドに窒素気流下で加温して溶解させた(A液)。前述のようにして調整した9−ブロモ−1−デセン15.8g(0.072mol)、フェノチアジン0.1gを30mlのDMFに溶解させた(B液)。窒素雰囲気下でよく撹拌しながら、A液にB液を30分程度かけて加え、40℃で24時間反応させた。反応終了後、反応液を冷却し、300mlの10%冷却塩酸で洗浄した後、300mlのエーテルで抽出し、次いで100mlの冷蒸留水で洗浄した。エーテル層は無水硫酸ナトリウムで一晩脱水する。残渣に300mlのヘキサンを加え、濾過により沈殿物を得る。次いで200mlのベンゼンを加え、ベンゼン可溶部分を、ベンゼンを用いたカラムクロマトグラフィーで精製して4−(9−デセニルオキシフェニル)フェノールを得た。
【0045】
[3−[6−(9−デセニルオキシ)ビフェニルオキシ]プロピルスルホン酸の合成]
ジメチルホルムアミド30ml中に重合禁止剤フェノチアジン0.05gを溶解させた。そこへ、1,8−ジアザビシクロ[5,4,0]−7−ウンデンセン(DBU)1.22g(0.008mol)と4−(9−デセニルオキシフェニル)フェノール0.65g(0.002mol)、3−ブロモプロパンスルホン酸ナトリウム1.8g(0.008mol)を溶解させ、窒素雰囲気下、50℃で48時間撹拌した。反応終了後、溶媒を濃縮し、ジエチルエーテルを加え、濾過することにより沈殿を得た。次に、沈殿を蒸留水でよく洗浄した。次に、洗浄後の沈殿を6mol/LのHCl中で24時間撹拌後、遠心分離機により沈殿を得て、この沈殿をジエチルエーテルで洗浄後、乾燥して3−[6−(9−デセニルオキシ)ビフェニルオキシ]プロピルスルホン酸を得た。
【0046】
[比較例1]
[3−[6−(9−デセニルオキシ)ビフェニルオキシ]プロピルスルホン酸の高分子量化]
窒素雰囲気下、3−[6−(9−デセニルオキシ)ビフェニルオキシ]プロプルスルホン酸を488mg(1mmol)、開始剤であるAIBNを6.6mg(0.04mmol)加え、ジメチルスルホキシドを4.8ml加えた。その後、60℃で60時間熱重合して高分子量化させた。その後、アセトンで再沈殿させ、ポリマーを得た。
【0047】
[ポリマーの製膜]
前記7式、3−[6−(9−デセニルオキシ)ビフェニルオキシ]プロピルスルホン酸ポリマーをジメチルスルホキシドに溶解させ、ガラスにキャストし、45℃で12時間、80℃で12時間、80℃で1時間真空乾燥させることで、膜を得た。
[薄膜化]
前記7式で表わされるポリマー膜は、3−[6−(9−デセニルオキシ)ビフェニルオキシ]プロピルスルホン酸ポリマーから得られる膜に比較して、薄膜化しても膜電極接合体が作製できる機械強度を有していた。
【0048】
[プロトン伝導度の測定]
解質膜の交流抵抗は、10mm幅の短冊状のプロトン伝導膜試料の表面に、白金線を押し当て、恒温恒湿装置中に試料を保持し、白金線間の交流インピーダンス測定から求めた。すなわち、温度80℃、相対湿度30%の環境下でインピーダンスを測定した。実施例1のプロトン伝導度は、比較例1と比べて大きく向上した。
【産業上の利用可能性】
【0049】
本発明は、電気自動車、燃料電池自動車などの自動車、ノートパソコン、携帯電話、携帯情報端末などのモバイル機器、家庭用発電装置などの発電源として用いられる固体高分子形燃料電池を構成する高分子電解質膜として利用できる。
【符号の説明】
【0050】
1 高分子電解質
2 空気極側電極触媒層
3 燃料極側電極触媒層
4 空気極側ガス拡散層
5 燃料極側ガス拡散層
6 空気極
7 燃料極
8 ガス流路
9 冷却水流路
10 セパレータ
11 単セル
12 膜電極結合体
【特許請求の範囲】
【請求項1】
下記1式で表される高分子単位を有することを特徴とする高分子電解質。但し、A1、A2はアルキル基−(CH2)m−であり、mは1以上の整数であり、Bはプロトン酸基であり、nは10〜10000の整数である。
【化1】

【請求項2】
前記プロトン酸基Bが、スルホン酸基、又はホスホン酸基であることを特徴とする請求項1に記載の高分子電解質。
【請求項3】
請求項1又は2に記載の高分子電解質を用いることを特徴とする高分子電解質膜。
【請求項4】
請求項1又は2に記載の高分子電解質及び請求項3に記載の高分子電解質膜の何れか一方又は双方を用いることを特徴とする燃料電池。
【請求項5】
下記2式で表されるポリマー化可能な基を有することを特徴とするイオン性材料。但し、A1、A2はアルキル基−(CH2)m−であり、mは1以上の整数であり、Bはプロトン酸基であり、A1、A2は夫々独立して塩素原子、臭気原子、又はヨウ素原子の何れかである。
【化2】

【請求項1】
下記1式で表される高分子単位を有することを特徴とする高分子電解質。但し、A1、A2はアルキル基−(CH2)m−であり、mは1以上の整数であり、Bはプロトン酸基であり、nは10〜10000の整数である。
【化1】

【請求項2】
前記プロトン酸基Bが、スルホン酸基、又はホスホン酸基であることを特徴とする請求項1に記載の高分子電解質。
【請求項3】
請求項1又は2に記載の高分子電解質を用いることを特徴とする高分子電解質膜。
【請求項4】
請求項1又は2に記載の高分子電解質及び請求項3に記載の高分子電解質膜の何れか一方又は双方を用いることを特徴とする燃料電池。
【請求項5】
下記2式で表されるポリマー化可能な基を有することを特徴とするイオン性材料。但し、A1、A2はアルキル基−(CH2)m−であり、mは1以上の整数であり、Bはプロトン酸基であり、A1、A2は夫々独立して塩素原子、臭気原子、又はヨウ素原子の何れかである。
【化2】

【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−67692(P2013−67692A)
【公開日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願番号】特願2011−205773(P2011−205773)
【出願日】平成23年9月21日(2011.9.21)
【出願人】(000003193)凸版印刷株式会社 (10,630)
【Fターム(参考)】
【公開日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願日】平成23年9月21日(2011.9.21)
【出願人】(000003193)凸版印刷株式会社 (10,630)
【Fターム(参考)】
[ Back to top ]

