E2EPFUCP−VHL相互作用及びその用途
【課題】UCPの活性またはレベルの調節を通じてVHLの活性またはレベルを増加させたり減少させたりすることにより、癌細胞の増殖または転移を阻害したり、血管の生成を増加させたりする方法の提供。
【解決手段】UCPのmRNAに相補的に結合する小さな干渉RNA(RNAi)、アンチセンスオリゴヌクレオチド、およびポリヌクレオチド;ペプチド、ペプチドミメティックス、抗体;ならびに低分子化合物からなる群より選択されたUCPの活性抑制剤。血管生成増加は、遺伝子伝達体によってUCP遺伝子が過発現して内因性VHLが減少してHIF−1αが安定化し、これによってHIF−1α安定化に基づくVEGF活性化が増強されることによってなされる。
【解決手段】UCPのmRNAに相補的に結合する小さな干渉RNA(RNAi)、アンチセンスオリゴヌクレオチド、およびポリヌクレオチド;ペプチド、ペプチドミメティックス、抗体;ならびに低分子化合物からなる群より選択されたUCPの活性抑制剤。血管生成増加は、遺伝子伝達体によってUCP遺伝子が過発現して内因性VHLが減少してHIF−1αが安定化し、これによってHIF−1α安定化に基づくVEGF活性化が増強されることによってなされる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、E2EPFUCP−VHL相互作用及びその用途に関するもので、より詳細には、UCPの活性調節を通じてVHLの活性または発現量を増加させたり減少させたりすることで、癌細胞の増殖または転移を阻害したり血管の生成を増加させたりする方法に関するものである。UCPの活性抑制は、UCPのmRNAに相補的に結合する小さな干渉RNA(RNAi)、アンチセンスオリゴヌクレオチド、ポリヌクレオチド;ペプチド、ペプチドミメティックス、抗体;および低分子化合物からなる群より選択されたUCPの活性抑制剤を通じてなされる。同時に、血管生成増加は、遺伝子伝達体によってUCP遺伝子が過発現して、細胞内VHL濃度の減少させ、HIF−1αの安定化による血管生成因子(VEGF)の発現促進する、HIF−1αの安定化を誘導することによりなされる。
【背景技術】
【0002】
E2EPF−UCP(E2 Endemic pemphigus foliaceus ubiqitin carrier protein)は、ヒトの角質細胞から最初に分離され、E2ユビキチン結合酵素群(ubiquitin conjugating enzyme family)に属するタンパク質で、試験管内でE3ユビキチンリガーゼのE2ユビキチン伝達体(ubiquitin carrier)タンパク質に機能したり、UCP単独でE3ユビキチンリガーゼ活性を示したりするタンパク質で、自己/多重ユビキチン化(auto/multiubiquitination)を起こすことが知られている(Liu Z.等,JBC,1992年,第267巻,15829−15835頁;Liu Z.等,JBC,1996年,第271巻,2817−2822頁;Baboshina OV and Haas AL.,JBC,1996年,第271巻,2823−2831頁)。また、UCPの塩基配列は、乳癌の予後因子として報告され(Mutter GL and Baak JPA.,J Clin Pathol.,2005年,第58(1)巻,1−6頁;米国特許6703204号)、卵巣癌を含む各種癌組織で正常組織と比較して約5倍程度過発現していることが知られている(Welsh JB等,PNAS USA,2001年,第98巻,1176−81頁;Wagner KW,Oncogene,2004年,第23巻,6621−6629頁)。しかし、UCPの特異的な基質、細胞内機能及び癌発生、進行、転移、血管生成との相関性は解明されていない。
【0003】
癌抑制遺伝子であるVHL(von Hippel−Lindau)の変異は、腎臓癌、中枢神経系及び網膜の血管芽細胞腫(hemangioblastoma)の発生と密接に連携している(Kaelin WG Jr.,Nat Rev Cancer,2002年,第2巻,673−682頁;Curr Opi Gen Dev,2003年,第13巻,56−60頁;Trends Mol Med,2004年,第10巻,146−149頁;Trends Mol Med,2004年,第10巻,466−472頁)。癌細胞にVHLを過発現させると、癌細胞の成長が阻害される(Gene Ther,2003年,第10巻,2081−2089頁)。VHLタンパク質は、Elongin B及びC、Rbx1、Cullin2とともに多重複合体(multiple complex)を成して、E3ユビキチンリガーゼ活性を示す(Nat Rev Cancer,2002年,第2巻,673−682頁;Curr Opi Gen Dev,2003年,第13巻,56−60頁;Trends Mol Med,2004年,第10巻,146−149頁;Trends Mol Med,2004年,第10巻,466−472頁)。ここで、VHLは基質タンパク質を認知する機能を遂行する(Nat Rev Cancer,2002年,第2巻,673−682頁;Curr Opi Gen Dev,2003年,第13巻,56−60頁;Trends Mol Med,2004年,第10巻,146−149頁;Trends Mol Med,2004年,第10巻,466−472頁)。VHLE3ユビキチンリガーゼの代表的な基質は、HIF1α及びHIF2αであり、これらは酸素が存在する場合プロリン水酸化酵素(proline hydroxylase)によって水酸化(hydroxylation)され、水産化されたHIFαはVHLと結合した後、VHLE3ユビキチンリガーゼによってユビキチン化(ubiquitylation)され、26Sプロテアゾームによって分解される(Nat Rev Cancer,2002年,第2巻,673−682頁;Curr Opi Gen Dev,2003年,第13巻,56−60頁;Trends Mol Med,2004年,第10巻,146−149頁;Trends Mol Med,2004年,第10巻,466−472頁)。また、HIF1αあるいはHIF2αは、HIF1βと結合して、HIF1あるいはHIF2転写調節因子として作用して酸素濃度による細胞の恒常性を維持するが、HIF1αあるいはHIF2αは低酸素条件で安定化して(HIFα等のプロリン水酸化が起きず、VHLE3ユビキチンリガーゼによって分解されないからである)、それらによって転写が活性化される遺伝子は、VEGF、アンジオポイエチン2、エリスロポイエチン、GLUT1等のような遺伝子である(Nat Med,2003年,第9巻,677−684頁)。VEGFは、血管生成に重要な細胞成長因子である(Nat,1992年,第359巻,843−845頁;Nat,1992年,第359巻,845−848頁)。癌細胞は、血管を通じた酸素と営養分の供給なしには増殖することができないので、HIF−VEGF経路は癌の増殖、転移及び血管生成に関与して(PNAS USA,1997年,第94巻,8104−8109頁;Can Res,2000年,第60巻,4010−4015頁)、HIF阻害剤及びVEGFの経路を遮断する物質は、抗癌剤として開発されていて(Ophthalmology,2002年,第109巻,1745−1751頁)、一部は実際に実用化(例,Avastin)されている(Proc Am Soc Clin Oncol,2002年,第21巻,15頁)。
【0004】
前記のようにVEGFの活性を抑制する物質で抗癌剤を開発することとは反対に、VEGFの活性を増加させて虚血性疾患(ischemic diseases)など血管疾患を治療する研究も活発に進行中である。虚血性疾患は、血液の流れが塞がれて起きる心血管疾患を含み、虚血性心筋梗塞(myocardial ischemia)及び虚血性末梢血管疾患(peripheral vascular disease)がこれに該当します。詰まった血液の流れを円滑にするためにVEGF遺伝子など新しい血管を誘導する遺伝子が、前記虚血性疾患治療に使用されていて(Yla−Herttuala S and Alitalo K.Nat Med.,2003年,第9(6)巻,694−701頁;Khan TA等,Gene Ther.,2003年,第10(4)巻,285−91頁)、VEGFは、動物モデルで新しい血管生成を誘導することが確認された(Leung DW等,Science.1989年,第8;246(4935)巻,1306−9頁;Dvorak HF等,Am J Pathol.,1995年,第146(5)巻,1029−39頁)。また、VEGFを導入したアデノウイルス遺伝子伝達体(Ad.VEGF)の効能が、虚血性心筋及び筋肉細胞モデルを対象に実験された結果、血管が大きく増加することが確認され(Mkinen K等,Mol.Ther.2002年,第6巻,127−133頁)、モデル動物で4週間VEGF発現を誘導した時に生成された血管は、その後、またVEGF発現を誘導しなくても消失しないで、組織の機能も向上することが観察された(Dor Y等,EMBO J.2002年,第21巻,1939−1947頁)。VEGFが導入されたアデノウイルスベクターでは、心臓冠状動脈閉塞症及び末梢血管不失(閉塞)症の遺伝子治療のための第1〜3相臨床実験が遂行されていて(Maekimen K等,Mol Ther,2002年,第6巻,127−133頁;Stewart DJ等,Circulation,2002年,第106巻,23−26頁;Rajagopalan S等,J Am Coll Cardil,2003年,第41巻,1604頁)、HIF1αが導入されたアデノウイルスベクターでは、心筋虚血の遺伝子治療のための第1相臨床試験が実施されている(Vincent KA等,Circulation,2000年,第102巻,2255−2261頁)。前記のように、HIF−1α及びVEGF遺伝子を使用した虚血性疾患の遺伝子治療の臨床試験が実施されているが、UCPを使用してHIF−1αを安定化させてVEGF遺伝子発現を促進する血管生成促進実験に対しては報告されたことがない。
【0005】
癌生成及び転移に関与する遺伝子の発現を抑制する方法に関する特許では、細胞にペプチドまたはその機能的類似体を提供して癌を治療する内容を記載した国際公開特許WO2003/029292号、VEGFに結合して腫瘍成長を抑制する核酸リガンドに関する内容を記載した国際公開特許WO1998/18480号、抗−VEGF抗体を使用してVEGFの作用を抑制する内容を記載した国際公開特許WO98/45331号等がある。しかし、前記の方法は、効率の面で限界があるため、より効果的な方法が求められている。大韓民国公開特許第2005−0012082号は、siRNAを使用して老化細胞の機能を回復する方法を記載していて、国際公開特許WO2003/006477号とWO2004/015107号は、siRNAを使用して遺伝子を不活性化させる内容を記載しているが、siRNAの具体的な抗癌活性に関しては記載していない。
【0006】
以上のことに鑑みて、本発明者等は、UCPがVHLに特異的に結合して、UCPの過発現が癌抑制タンパク質であるVHLのユビキチン・プロテアーゼ媒介タンパク質分解(ubiquitin−mediated proteasomal degradation)を起こし、それによるHIF−1αの安定化とVEGFの発現が増加されることを実験的に立証した。さらに、UCPの発現を抑制するsiRNAを使用して癌細胞の成長、浸透過程でUCPの機能を解明して、マウスモデルを通じて前記UCP発現抑制方法が抗癌効果及び癌転移抑制効果を示すことを確認した。また一方で、UCPがVEGFを含む血管生成因子(angiogenic factor)の発現を増加させ、UCPを過発現させた細胞培養液にVEGF量が増加されていてこの培養液がHUVEC(human umbilical vascular endothelial cell)の増殖を促進して、虚血性血管疾患の遺伝子治療に有用に使用され得ることを確認した。
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、E2EPFUCP(ubiquitin carrier protein)の機能と癌発生、進行及び転移過程、血管生成での相関性を解明して、UCP活性を減少させることで癌細胞の増殖及び転移を有意に阻害する方法を提供することである。
【0008】
また、UCPの活性を増加させて、血管生成因子である活性があるVEGFの発現を誘導して、虚血性疾患を治療する方法を提供することである。
【課題を解決するための手段】
【0009】
前記目的を達成するために、本発明は薬学的有効量のUCPの活性抑制剤を個体に投与する工程を含み、UCPの活性抑制またはUCPの発現量現象を通じてVHL(von Hippel−Lindau)の活性または発現量を増加させて、HIFの安定性を減少させ、VEGFの発現を抑制する方法を提供する。
【0010】
また、本発明は、合成UCP−siRNAオリゴヌクレオチド、UCP−siRNA発現ベクター及びそれを製造する方法を提供する。
【0011】
また、本発明は、UCP活性抑制剤を有効成分として含む抗癌剤を提供する。
【0012】
また、本発明は、UCPの活性増加を通じてVHLの活性または発現量を減少させてHIFの安定性を増加させ、VEGFの発現を促進する方法を提供する。
【0013】
また、本発明は、UCPの活性増加剤、UCP発現ベクターまたはUCPタンパク質を有効成分として含むVEGF発現促進剤を提供する。
【0014】
また、本発明は、UCPの活性増加剤、UCP発現ベクターまたはUCPタンパク質を有効成分として含む新生血管促進剤を提供する。
【0015】
また、UCP発現または活性または発現量調節剤をスクリーニングする方法及びスクリーニングに使用する細胞株を提供する。
【0016】
同時に、本発明は、癌患者の診断試料からUCPの発現程度を測定して、癌の診断および予後評価方法とそのための診断キットを提供する。
【0017】
以下、本発明を詳しく説明する。
【0018】
1.本発明は、UCPの活性減少を通じてVHLの活性または発現量を増加させてHIFの安定性を減少させ、VEGFの発現を抑制する方法を提供する。
【0019】
本発明者等は、UCPがVHL、HIF−1α及びVEGFとどのような連関性を有するのかを観察した。
【0020】
まず、UCPがVHLと結合するだけでなく(図4ないし図7)VHLと複合体をなすElongin B、Elongin C、Rbx1及びCullin 2とは結合しないで、VHLと特異的に結合することを確認した(図7及び図8b参照)。UCP存在下でVHL、HIF−1α及びHIF−1αの標的分子であるVEGF mRNAの発現増減の有無を調査した結果、UCPが過発現される場合、VHL、HIF−1αのmRNA発現量には変化がなく、VEGF mRNAの発現量は増加したが(図11参照)、これは、UCPがVHLとHIF−1αの翻訳後(post−translation)工程に作用してVHLタンパク質量を減少させ、それによってVHLによるHIF−1αの分解減少及び細胞内HIF−1αタンパク質濃度増加で、VEGFの転写が活性化したことを示す。HIF−1αの影響を受けるHRE(hypoxia response element)−lucを使用したレポーター分析の結果、低酸素と正常酸素条件すべてでUCP濃度に依存的にHRE−lucの活性が増加すること、すなわち、HIF−1αが安定化されることを確認した(図10及び図15b参照)。
【0021】
以上で確認されたUCPによるVHLの細胞内濃度減少が、ユビキチン媒介タンパク質分解(ubiquitin−mediated proteolysis)によることなのかどうかを確認するために、VHLがUCPによってユビキチン化になるかどうかを細胞内および細胞外で調査した。UCP変異体を製作して試験管内で自動ユビキチン分析を通じてUCP活性が消失したことを確認し(図14参照)、UCPによるVHLの細胞内濃度減少がUCP酵素活性依存的であることを確認した(図12参照)。UCPのE3ユビキチンリガーゼ活性によってVHLが多重ユビキチン化されることを観察した(図13、14、16及び17参照)。前記の結果は、UCPがVHLのユビキチン媒介タンパク質分解を誘導することを意味する。また、UCPはE2ユビキチン伝達機能及びE3ユビキチンリガーゼ活性を一緒に有している。
【0022】
すなわち、本発明者等は、UCPがHIF1α及びHIF2αをユビキチン化および分解するVHLE3ユビキチンリガーゼ複合体の一構成成分で、VHLタンパク質を特異的にユビキチン化および分解するE3ユビキチンリガーゼであることを明らかにして(図9ないし図14、図16及び図17参照)、UCPが過発現されるとVHLタンパク質分解を誘導し(図9ないし図14参照)、HIF1α及びHIF2αの安定性を増加させることにより(図9ないし図14及び図41ないし図45参照)、HIF1α及びHIF2αによって調節される血管生成因子であるVEGF(vescular endothelial growth factor)の発現を増加させるという事実を確認した(図11及び図24参照)。また、UCPの活性欠失は、VHLの細胞内濃度を増加させてHIFの安定性を減少させ、癌細胞の増殖及び転移を抑制することを確認した(図23ないし図29、図32ないし図39及び図41ないし図45参照)。
【0023】
UCPの活性抑制は、UCP遺伝子転写抑制剤、転写されたUCPmRNAの翻訳抑制剤、またはUCPタンパク質の機能抑制材を使用して成り立つ。
【0024】
UCPの活性抑制剤は、UCPのmRNAに相補的に結合するアンチセンスオリゴヌクレオチド、UCP遺伝子に特異的な小さな干渉RNA、活性がないUCP類似タンパク質またはその断片、UCPタンパク質に結合するペプチド、UCPに特異的な抗体、UCPのmRNAに転写または翻訳を抑制する化合物、またはUCPの機能を抑制する化合物であり得る。
【0025】
UCPタンパク質の機能抑制剤は、UCPの酵素活性あるいはUCP−VHLタンパク質結合を遮断する低分子化合物、ペプチド、またはタンパク質であり得る。
【0026】
本発明で転写抑制剤は、UCP転写を抑制するタンパク質または化合物であり得、それらの調節作用は、UCPプロモーターに結合する転写因子または、エンハンサー(enhancer)によって媒介される。
【0027】
mRNAの翻訳抑制剤は、低分子化合物、アンチセンス核酸配列またはRNAiテクニックを使用して製造されたRNA、siRNAなどを使用できる。
【0028】
これを具体的に下記に詳しく記載する。
【0029】
1)RNAi
RNA干渉(RNAi)は、UCP遺伝子に対応する二本鎖RNA(dsRNA)を細胞または有機体に導入することで、対応するmRNAの分解が起きる転写後遺伝子サイレンシングメカニズム(post−transcriptional gene silencing mechanism)である。前記RNAiは、遺伝子サイレンシングに特異性及び効率性を示すので、RNAレベルで標的遺伝子のノックアウト(knockout)または「ノックダウン(knockdown)」を作る非常に強力な方法である。RNAiは、ヒトの胚芽腎臓(embryonic kidney)及びHeLa細胞を含んだヒト細胞で成功的であることが確認された(Elbashir等,Nature May,2001年,第24;411(6836)巻,494−8頁)。
【0030】
遺伝子サイレンシングでのRNAi技術は、標準分子生物学方法を使用する。不活性化させる標的遺伝子の配列に対応するdsRNAは、標準方法、例えばT7 RNA重合酵素を使用した鋳型DNAの2本鎖同時転写によって生成することができる。RNAiに使用されるdsRNAの生成キットは、商業的に販売される製品(例えば、New England Biolabs,Inc.社の製品)を使用することができる。dsRNAまたはdsRNAを製造するように処理されたプラスミドのトランスフェクション方法は、従来公知の技術である。
【0031】
2)アンチセンス核酸配列
UCPをコードする核酸に対してアンチセンスである核酸分子を阻害剤に使用することができる。「アンチセンス」核酸は、UCPをコードする「センス」核酸に相補的な、例えば二本鎖cDNA分子のコード鎖に相補的やmRNA配列に相補的な核酸配列を含む。したがって、アンチセンス核酸は、センス核酸と水素結合を形成することができる。前記アンチセンス核酸は、全体UCPコード鎖または単にそれらの一部(例:コード領域)に相補的なことがある。前記アンチセンス核酸分子は、UCP mRNAの全体コード領域に相補的なことがあるが、UCP mRNAのコードまたは非コード領域の単に一部(例:翻訳開始部)にのみ、アンチセンスであるオリゴヌクレオチドがさらに好ましい。アンチセンスオリゴヌクレオチドは、例えば約5ないし50ヌクレオチドの長さであり得る。アンチセンス核酸は、公知の方法を使用した化学合成及び酵素結合反応を使用して構成することができる。化学合成法、例えば文献[Tetrahedron Lett.,1991年,第32巻,30005−30008頁]に記載しているように、アセトニトリルの中からテトラエチルチウラムジスルフィドで硫化させるホスホアミダート化学のような方法によって非常に容易に製造することができる。前記アンチセンス核酸の生成に使用することができる変形ヌクレオチドの例としては、5−フルオロウラシル、5−ブロモウラシル、5−クロロウラシル、5−ヨードウラシル、ハイポキサンチン、キサンチン、4−アセチルシトシン、5−(カルボキシヒドロキシルメチル)ウラシル、1−メチルイノシン、2,2−ジメチルグアニン、2−メチルアデニン、2−メチルグアニン、3−メチルシトシン、5−メチルシトシン、N6−アデニン、5−カルボキシルメチルアミノメチル−2−チオウリジン、3−(3−アミノ−3−N−2−カルボキシプロピル)ウラシル、5’−メトキシカルボキシメチルウラシル、5−メトキシウラシル、2−メチルチオ−N6−イソペンテニルアデニン、1−メチルグアニン、7−メチルグアニン、5−メチルアミノメチルウラシル、5−メトキシアミノメチル−2−チオウラシル、ベータ−D−マンノシルケオシン、2−チオウラシル、4−チオウラシル、5−メチルウラシル、ウラシル−5−オキシ酢酸メチルエステル、ウラシル−5−オキシ酢酸(v)、2,6−ジアミノプリン、5−メチル−2−チオウラシル、ウラシル−5−オキシ酢酸(v)、シュードウラシル、ケオシン、2−チオシトシン、5−カルボキシメチルアミノメチルウラシル、ジヒドロウラシル、ベータ−D−ガルラクトシルケオシン、イノシン、N6−イソペンテニルアデニル、5−メチル−2−チオウラシル、(acp3)w及びワイブトキソシンが挙げられる。必要によって、前記アンチセンス核酸は、発現ベクターを使用して生物学的に生成することができる。
【0032】
UCPタンパク質の機能を抑制する物質では、前記タンパク質に結合するペプチド、抗体、化合物及びペプチドミメティックスなどを使用することができる。
【0033】
1)ペプチドミメティックス(Peptide Mimetics)
UCPポリペプチドのタンパク質結合ドメインを抑制したミメティックス(例、ペプチドまたは非ペプチド性薬剤)を製作して、元来のUCPポリペプチドがVHLに結合することを抑制することができる(欧州特許出願EP 0412765号及びEP 0031080号)。
【0034】
非加水分解性ペプチド類似体の主要残基としては、β−ターン・ジペプチドコア(Nagai等,Tetrahedron Lett,1985年,第26巻,647頁)、ケトメチレンシュードペプチド類(Ewenson等,J Med Chem,1986年,第29巻,295頁;及びEwenson等,in Peptides:Structure and Function(Proceedings of the 9th American Peptide Symposium)Pierce Chemical Co.Rockland,IL,1985年)、アゼピン(Huffman等,in Peptides:Chemistry and Biology,G.R.Marshall ed.,ESCOM Publisher:Leiden,Netherlands,1988年)、ベンゾジアゼピン(Freidinger等,in Peptides;Chemistry and Biology,G.R.Marshall ed.,ESCOM Publisher:Leiden,Netherlands,1988年)、β−アミノアルコール(Gordon等,Biochem Biophys Res Commun,1985年,第126巻,419頁)及び置換ガンマーラクタム丸(Garvey等,in Peptides:Chemistry and Biology,G.R.Marshell ed.,ESCOM Publisher:Leiden,Netherlands,1988年)を使用して生成することができる。
【0035】
2.本発明は、UCP−siRNAオリゴマー、その発現ベクター及びそれを製造する方法を提供する。
【0036】
UCP−siRNAを含むプラスミド形態の発現ベクターは、H1プロモーター、UCP−siRNA及び転写終了配列である五つのT塩基(T5)で構成される。RNAは、UCPmRNA塩基配列内で選択される17ないし25merのセンス配列に相補的に結合されるアンチセンス配列で構成され配列番号6で記載することが好ましいが、これに限定されるものではない。
【0037】
本発明者等は、配列番号5で記載されるUCPのmRNAに相補的な配列であり、好ましくは配列番号5で記載されてUCPmRNA配列中615−633に該当する部分をH1プロモーターによって発現されるように、pSuperプラスミドベクターにクローニングして組換えベクターを製作した。細胞内で伝達及び発現を願う遺伝子を提供するアデノウイルス製作用pShuttleベクターに、前記で製作されたpSuperプラスミドベクターを制限酵素で処理してH1プロモーター、UCP−siRNA、転写終了配列である五つのT塩基(T5)まで含むアデノウイルス製作用UCP−siRNA発現ベクターを製作した。本発明でUCP−siRNAを発現させるためのベクターは、pSuperベクターやpShuttleベクターに制限されず、UCP−siRNAを発現させるためのプロモーターは、H1プロモーターに制限されない。例えば、U6プロモーター、CMVプロモーターなどの哺乳動物細胞で遺伝子発現を誘導することができる発現ベクターを使用することができる。前記発現ベクターを使用してアデノウイルスベクターを組換えした後、実施例2の方法でアデノウイルス粒子を作ってそれを細胞や個体に注入してsiRNAが発現されるようにした。アデノウイルスベクターのみならず、アデノ随伴ウイルス、レトロウイルス、ワクシニアウイルス、及び癌細胞溶解性ウイルスからなる群より選択されるウイルス性ベクターを使用することができる。
【0038】
3.本発明は、UCP活性抑制剤を有効成分として含む抗癌剤を提供する。
【0039】
本発明の組成物は、組成物総重量に対して前記有効成分を0.0001ないし50重量%で含む。
【0040】
本発明の組成物は、前記有効成分にさらに同一または類似の機能を示す有効成分を1種以上含むことができる。
【0041】
本発明の組成物は、投与のために前記記載した有効成分以外にさらに薬剤学的に許容可能な担体を1種以上含んで製造することができる。薬剤学的に許容可能な担体は、食塩水、滅菌水、リンゲル液、緩衝食塩水、デキストロース溶液、マルトデキストリン溶液、グリセロール、エチルアルコール、リポソーム及びそれら成分の中で1成分以上を混合して使用することができ、必要によって抗酸化剤、緩衝液、静菌剤など他の通常の添加剤を添加することができる。また希釈剤、分散剤、界面活性剤、結合剤及び滑剤を付加的に添加して水溶液、懸濁液、乳濁液などのような注射用剤形、丸薬、カプセル、顆粒または錠剤に製剤化することができ、標的器官に特異的に作用するように標的器官特異的抗体またはその他リガンドを前記担体と結合させて使用することができる。さらに当該技術分野の適正な方法でまたはレミングトンの文献(Remington's Pharmaceutical Science(最近版)、Mack Publishing Company、Easton PA)に開示されている方法を使用して各疾患によってまたは成分によって好ましく製剤化することができる。
【0042】
本発明の抗癌剤の投与方法は、特別にそれに制限されるものではないが、目的とする方法によって非経口投与(例えば静脈内、皮下、腹腔内または局所に適用)したり経口投与したりすることができ、非経口投与が好ましく、静脈内注射による投与がさらに好ましい。投与量は、患者の体重、年齢、性別、健康状態、食餌、投与時間、投与方法、排泄率及び疾患の重症度等によってその範囲が多様である。一日投与量は、化合物の場合、約0.1ないし100mg/kgで、好ましくは0.5ないし10mg/kgであり、一日一回ないし数回に分けて投与することがさらに好ましい。
【0043】
本発明のsiRNAまたはsiRNA発現ベクターをマウスに静脈内注射によって投与して毒性実験を遂行した結果、毒性試験による50%致死量(LD50)は、少なくとも1,000mg/kg以上の安全な物質であると判断される。
【0044】
本発明のUCP活性抑制剤を使用して増殖を抑制することができる癌細胞は、UCPが過発現されている癌細胞であり、好ましくは卵巣癌、胆道癌、肝癌、大腸癌、胃癌、乳癌、腎臓癌、前立腺癌及び皮膚癌細胞を含む。
【0045】
本発明者等は、UCPのmRNAに相補的に結合する小さな干渉RNA(UCP−siRNA)を製作してそれを癌細胞株に注入してUCPの発現を抑制した結果、UCP−siRNAによってUCPの発現が抑制されるとVHLの濃度が増加して(図23ないし図31及び図41ないし図45)、細胞の成長率が有意に減少し(図23ないし図29及び図41ないし図46)、浸透分析(invasion assay)で細胞株の転移能力の変化を測定した結果、細胞の浸透率が有意に減少したことが示された(図23ないし図29、図41ないし図45)。それとともに、腫瘍細胞をヌードマウスの皮下に注射して直径が約3mmの腫瘍が生成された時、UCP−siRNAをコードするアデノウイルスを注入した結果、腫瘍成長及び転移抑制効果が著しく示されることを確認した(図32ないし図39及び図41ないし図45)。
【0046】
それにより、UCPが癌の成長及び転移に重要な役割を遂行していて、UCPの発現を阻害することで癌の成長及び転移を抑制することができることを確認した。
【0047】
4.本発明は、UCPの活性増加を通じてVHLの活性または発現量を減少させて、HIFαの安定性を増加させ、VEGFの発現を促進する方法を提供する。
【0048】
前記のように、本発明のUCPが過発現されるとVHLタンパク質分解を誘導して(図9ないし図15参照)、VHLE3ユビキチンリガーゼの基質であるHIF1α及びHIF2αの安定性を増加させることで(図9ないし図15、図23ないし図39及び図41ないし図45参照)、HIF1α及びHIF2αによって調節される血管生成因子であるVEGFの発現を増加させる(図11及び図24参照)。発現したVEGFは、細胞培養液で検出され(図47a)、検出されたVEGFはHUVECの増殖を促進する(図47b)。したがって、UCPの活性を増加させることで活性があるVEGFの発現も増加させることができる。これは、UCPプロモーターに作用してUCP mRNAの発現を誘導する薬剤、UCPの発現を誘導するプラスミドまたはウイルス遺伝子伝達体を通じて行われる。
【0049】
5.本発明は、UCPの活性増加剤、UCP遺伝子が導入された発現ベクターまたはUCPタンパク質を有効成分として含むVEGF発現促進剤を提供する。
【0050】
UCP活性増加剤は、UCPプロモーターに作用してUCP mRNAの発現を誘導する薬剤(例:大韓民国特許公開2003−0013795号、菌株から抽出した物質をプロモーター発現誘導剤に使用)、UCPの発現を誘導するプラスミド(例:大韓民国特許10−0375890号、誘導性ジンクフィンガー発現ベクター及びそれを使用した標的遺伝子発現の人為的調節方法)または、ウイルス遺伝子伝達体(例:大韓民国特許公開 2001−0006460号、細胞自滅死誘導タンパク質を発現させる遺伝子伝達運搬体)を含む。
【0051】
前記のように、UCP遺伝子が過発現されるとVEGFの発現を促進するので、UCP過発現と類似の効果を示すことができる方法、すなわちUCPタンパク質を直接投入したりUCP発現プラスミドを投入したりして個体内で発現されるようにすることで、VEGF発現を促進することができる。
【0052】
6.本発明は、UCPの活性増加剤、UCP遺伝子が導入された発現ベクターまたはUCPタンパク質を有効成分として含む血管新生促進剤を提供する。本発明のUCPは、過発現されるとHIF−1α及びCD31タンパク質量を増加させて(図34)VEGFの発現を増加させて(図11及び図24参照)、ヒトの血管細胞の増殖を促進させた(図47b参照)。CD31は、VEGFのような因子によって血管生成が増加される場合に示される血管細胞のマーカーである。
【0053】
VEGFの発現増加が虚血性血管疾患(ischemic vascular disease)の治療に効果的であるという事実はよく知られているので(Yla−Herttuala S and Alitalo K.Nat Med.,2003年,第9(6)巻 、694−701頁;Khan TA等,Gene Ther.2003年,第10(4)巻,285−91頁)、VEGFの発現を増加させるUCP遺伝子が導入された発現ベクターを有効成分として含む血管新生促進剤は、血管きち虚弱であることに起因して四肢切断手術を受けなければならないひどい四肢虚血(critical limb ischemia,CLI)患者等、手術が可能ではない冠状動脈疾患(coronary artery disease,CAD)患者等で起きる血管系疾患を治療するのに使用され得るだろう。また、UCPは血流の供給が不足して生じる痴ほう症、筋萎縮性側索硬化症(amyotrophic lateral sclerosis,ALS)、糖尿性神経障害(diabetic neuropathy)、脳卒中(stroke)患者を含む難治性疾患を有している人々の遺伝子治療に有用に使用することができる。
【0054】
7.本発明は、
1)VHLを発現する細胞株を使用してUCPの活性を阻害する物質を捜す工程、あるいは
2)UCPの転写調節に関与する転写因子を捜す工程、
3)前記転写因子を調節する物質を選抜(screening)する工程、及び
4)前記物質がUCP遺伝子の発現を調節する活性を示すかどうかを確認する工程からなるUCP活性調節剤(活性抑制剤あるいは増加剤)をスクリーニングする方法を提供する。
【0055】
具体的に、
1)UCP及びVHL発現細胞株に被検化合物を処理する工程、
2)工程1の細胞株のVHL活性を測定する工程、及び
3)工程2の結果と対照群の結果を比較してVHL活性を有意に変化させる化合物を選別する工程を含むUCP活性調節剤をスクリーニングする方法。
【0056】
1)UCP及びVHL発現細胞株に被検化合物を処理する工程、
2)工程1の細胞株のユビキチン化されたVHLの量を測定する工程、及び
3)工程2の結果と対照群の結果を比較してユビキチン化されたVHLの量を有意に変化させる化合物を選別する工程を含むUCP活性調節剤をスクリーニングする方法。
【0057】
1)UCP及びHIF発現細胞株に被検化合物を処理する工程、
2)工程1の細胞株のHIF活性を測定する工程、及び
3)工程2の結果と対照群の結果を比較してHIF活性を有意に変化させる化合物を選別する工程を含むUCP活性調節剤をスクリーニングする方法。及び、
【0058】
1)UCP及びHIF発現細胞株に被検化合物を処理する工程、
2)工程1の細胞株のユビキチン化されたHIFの量を測定する工程、及び
3)工程2の結果と対照群の結果を比較してユビキチン化されたHIFの量を有意に変化させる化合物を選別する工程を含むUCP活性調節剤をスクリーニングする方法を提供する。
【0059】
UCPの発現抑制によるVHLの活性回復は、癌細胞株の増殖速度を抑制した(図45、図35、図42、図45、図46a及び図46c参照)。
【0060】
前記スクリーニング方法でUCP活性調節候補物質が、UCP遺伝子の発現またはタンパク質活性を抑制あるいは増加するかどうかを決定する工程で、RNA−RNA、DNA−DNA、DNA−RNA、RNA−タンパク質、RNA−化合物、DNA−タンパク質、DNA−化合物、タンパク質−タンパク質またはタンパク質−化合物間の反応有無を確認するのに使用される通常的な方法を使用することができる。
【0061】
例えば、タンパク質−化合物、タンパク質−タンパク質、RNA−RNA、DNA−DNA、DNA−RNA、RNA−タンパク質、RNA−化合物、DNA−タンパク質、DNA−化合物間の反応確認は、生体外(in vitro)で前記遺伝子と活性調節候補物質との間の結合有無を確認するための混成化試験、哺乳類細胞と抑制候補物質とを反応させた後、ノーザンブロット分析、反定量的・定量的PCR、リアルタイムPCRなどを通じたUCP遺伝子の発現率測定方法または、UCP遺伝子にリポーター遺伝子を連結させて細胞内に導入した後、抑制候補物質と反応させてリポーター遺伝子の発現率を測定する方法などを使用することができる。
【0062】
また、タンパク質−タンパク質、タンパク質−化合物間の反応確認は、生体内・生体外でUCPタンパク質と活性調節候補物質を反応させた後、活性を測定する方法、VHLあるいはGFP−VHL発現する細胞株を使用して細胞の増殖を測定する方法、酵母二重混成法(yeast two−hybrid)、UCPタンパク質に結合するファージディスプレイペプチドクローン(phage−displayed peptide clone)の検索、天然物及び化学物質ライブラリーなどを使用したHTS(high throughput screening)、細胞基盤スクリーニング(cell−based screening)または、DNAアレイ(DNA array)を使用するスクリーニング法などを使用することができる。
【0063】
前記スクリーニング方法で、UCP発現あるいは活性調節候補物質は、通常的な選定方式にしたがってUCP酵素活性あるいは発現抑制あるいは増加の可能性を有していることが推定されたり、または無作為的に選定された個別的な核酸、タンパク質、その他抽出物または天然物などを挙げられる。
【0064】
本発明のスクリーニング方法を通じて修得した、遺伝子発現あるいはタンパク質安定性を抑制あるいは増加させる活性を示す候補物質は、抗癌剤または新生血管促進剤候補物質になることができる。このような候補物質は、以後の抗癌剤または新生血管誘導剤開発過程で先導物質として作用するようになり、先導物質がUCP遺伝子またはそれから発現されるタンパク質の機能抑制あるいは増加効果を示すようにその構造を変形させて最適化することで、新しい抗癌剤または新生血管促進剤を開発することができる。
【0065】
8.本発明は、患者の診断試料でUCPの発現程度を測定して癌の診断および予後評価方法とそのための診断キットを提供する。
【0066】
1)患者の診断試料でUCPの発現を測定する工程を含む癌診断方法を提供する。
【0067】
前記診断試料から正常以上に上昇したUCPの発現検出は、患者が癌にかかったことを意味する。前記診断方法でUCPの発現を測定する工程は、前記スクリーニング方法でUCP遺伝子の発現またはタンパク質活性を決定する工程と同一な方法を使用することができる。
【0068】
2)癌で治療を受けたり現在受けている個体の診断試料でUCPの発現を測定したりする工程を含む癌治療法の効果を評価する方法を提供する。
【0069】
前記診断試料で正常UCPの発現検出は、癌治療が成功的だったことを意味して、診断試料からの正常以上に上昇したUCPの検出は、治療を継続しなければならないということを意味する。
【0070】
3)個体の診断試料でUCPの発現を測定する工程を含む癌にかかった個体の予後を評価する方法を提供する。
【0071】
前記工程で正常UCPの発現検出は予後が良いということを意味し、診断試料での正常以上に上昇したUCPの検出は予後が良くないということを意味する。
【0072】
4)本発明の癌診断キットは、UCPと反応する一つ以上の物質及び反応生成物検出用試薬とそれに対する指示事項を付加的に含むことができる。例えば、UCPと反応する一つ以上の物質は、UCPのRNAまたはDNAに相補的なRNAまたはDNA及びUCPタンパク質に結合する抗体であり得、反応生成物検出用試薬は、核酸またはタンパク質標識及び発色試薬であり得る。
【図面の簡単な説明】
【0073】
【図1】プラスミド形態のUCP−siRNA発現ベクターの概路図とUCP−siRNA配列である。
【図2】Ad.F−UCPベクター製作過程を示した模式図である。
【図3】Ad.UCP−siRNAベクター製作過程を示した模式図である。
【図4】UCPがVHLと細胞内でお互いに特異的に結合していることを示すウエスタンブロット写真である。
【図5】UCPがVHLと細胞内でお互いに特異的に結合していることを示すウエスタンブロット写真である。
【図6】UCPがVHLと細胞内でお互いに特異的に結合していることを示すウエスタンブロット写真である。
【図7】VHLがElongin B、C、Rbx1とともにVHLE3ユビキチンリガーゼ活性を示す複合体を形成するが、UCPはVHLE3リガーゼ複合体に存在しないで、VHLと独立的な複合体を形成していることを示すウエスタンブロット写真である。
【図8】図8aは、CKAI細胞株にUCPを過発現させた時VHLタンパク質が分解されることで示してくれるウエスタンブロット写真である。図8bは、CAKI細胞株にUCPを過発現させた時VHLと結合複合体を成すことを示したウエスタンブロット写真である。
【図9】UCPを過発現させた時、細胞内VHLタンパク質が26Sプロテアゾーム(proteasome)によって分解されることによってHIF−1αが安定化されることを示すウエスタンブロット写真である。
【図10】低酸素反応要素(hypoxia response element, HRE)の調節下にある時、リポーター遺伝子の活性を調査したもので、UCPを過発現させた細胞でHIF−1αタンパク質増加によってHRE−リポーターの活性が増加することを示すグラフである。
【図11】UCPがVHL、HIF−1αのmRNA発現量には影響を与えないが、HIF−1αタンパク質の安定化を通じて血管生成促進因子(vascular endothelial growth factor,VEGF)の発現を増加させることを示すノーザンブロット写真である。
【図12】VHLタンパク質の減少が、UCP酵素活性依存的に現れるということを示したウエスタンブロット写真である。
【図13】培養細胞と試験管内でUCPによるVHLの多重ユビキチン化(multiubiquitination)を示したウエスタンブロット写真である。
【図14】培養細胞と試験管内でUCPによるVHLの多重ユビキチン化(multiubiquitination)を示したウエスタンブロット写真である。
【図15】図15aは、UCPを過発現させた細胞を正常酸素及び低酸素条件で培養した時、UCP発現量に依存的にVHLタンパク質は減少してHIF−1αタンパク質は増加することを示すウエスタンブロット写真である。図15bは、図15aの条件で低酸素反応要素(HRE)の調節下にある時、リポーター遺伝子の活性を調査したもので、UCPを過発現させた細胞でHIF−1αタンパク質増加によってHRE−リポーターの活性が増加することを示すグラフである。
【図16】野生型UCPは、酵素活性が存在するが、95番目システインがセリンに置換された突然変異UCPmは、酵素活性がないということを示すウエスタンブロット写真である。
【図17】野生型UCPは、VHLを試験管内で多重ユビキチン化(multiubiquitination)させるが、突然変異UCPmは影響を与えることができないということを示すウエスタンブロット写真である。
【図18】UCPがVHLタンパク質のみを特異的に分解させるということを示すウエスタンブロット写真である。
【図19】UCPがVHLタンパク質のみを特異的に分解させるということを示すウエスタンブロット写真である。
【図20】アデノウイルス遺伝子伝達体(Ad.F−UCP)を使用してUCPをマウスの肝に伝達した時、VHLタンパク質が減少して、HIF−1αタンパク質が増加することを示すウエスタンブロット写真である。
【図21】図20の実験条件で免疫組織化学染色したマウスの肝組織を示す写真である。
【図22】ヒトの肝臓癌、転移性胆道癌、大腸癌、転移性大腸癌、乳癌細胞でUCPとHIF−1αが共に高い発現を見せて、VHLの発現は抑制されていることを示す免疫組織化学染色法で示した写真である。
【図23】各種癌細胞株でUCPとVHLタンパク質の発現量が逆比例することを示すウエスタンブロット写真である。
【図24】UCP発現が低くVHLが過発現されたCAKI腎臓癌細胞にAd.F−UCPを使用してUCPを過発現させた時、VHLタンパク質の発現が消失してHIF−1αタンパク質発現量が増加されて、それによってVEGFの発現が増加することを示すウエスタンブロット写真及びノーザンブロット写真である。
【図25】CAKI腎臓癌細胞にAd.F−UCPを使用してUCPを過発現させた場合、癌細胞の増殖が促進されることを示すグラフである。
【図26】CAKI腎臓癌細胞にUCPを過発現させた場合、癌細胞の浸透が増加することを示すグラフである。
【図27】黒色腫細胞株C8161でUCP−siRNAを発現するアデノウイルスベクターを使用してUCPタンパク質の発現を遮断した場合、VHLタンパク質の発現が増加して、HIF−1αタンパク質発現量が減少することを示すウエスタンブロット写真である。
【図28】Ad.UCP−siRNAを使用してUCPタンパク質の発現を遮断した場合、ヒトの黒色腫癌細胞(C8161)の増殖が阻害されることを示すグラフである。
【図29】UCPタンパク質の発現を遮断した時、ヒトの黒色腫癌細胞(C8161)の浸透が阻害されることを示すグラフである。
【図30】胆道癌細胞株Ck−K1でUCP−siRNAを発現するアデノウイルスベクターを使用してUCPタンパク質の発現を遮断した場合、VHLタンパク質の発現が増加して、HIF−1αタンパク質発現量が減少することを示すウエスタンブロット写真である。
【図31】図31aは、Ad.UCP−siRNAで生成されるUCP−siRNAと異なるUCPmRNAを標的とする二次UCP−siRNAもまたUCPの発現を抑制することができるということを示したウエスタンブロット写真である。図31bは、突然変異UCPを使用して前記製作されたUCP−siRNAが、UCPの核酸配列を特異的に認識してUCP発現を抑制するということを示すウエスタンブロット写真である。
【図32】ヒトの黒色腫癌細胞(C8161)にAd.F−UCPを導入した後、癌細胞をヌードマウスの皮下に移植すると、癌細胞の増殖が促進されることを示すグラフである。
【図33】皮下移植21日後にマウスから摘出した癌塊(tumor nodule)を示す写真である。
【図34】摘出した癌塊の組織セクションを作った後、F−UCP、HIF−1α及び血管細胞のマーカーであるCD31の発現を免疫組織化学染色法で示した写真である。
【図35】ヒトの黒色腫癌細胞(C8161)をヌードマウスの皮下に移植して癌塊を形成させた後、UCPの発現を遮断するAd.UCP−siRNAアデノウイルスを注入した後、癌細胞の成長が有意に阻害されることを示すグラフである。
【図36】ヒトの黒色腫癌細胞をヌードマウスの皮下に移植した後、Ad.F−UCPを癌組織に直接注射した後、癌転移でUCPの効果を検証したもので、UCPが過発現されると癌の肺転移が増加することを示すグラフである。
【図37】図36のマウスの肺に転移した黒色腫癌細胞を示す組織染色写真である。
【図38】ヒトの黒色腫癌細胞にAd.F−UCPあるいはAd.UCP−siRNAを導入した後、癌細胞をヌードマウスの尾静脈内に注射した後、癌転移でUCPの効果を検証したもので、UCPが過発現されると癌の肺転移が増加して、UCPタンパク質発現を遮断すると癌の肺転移が抑制されることを示すグラフ、及び移植した後4週後に摘出したマウスの肺組織を染色した写真である。
【図39】図38の試験でAd.UCP−siRNAによるUCP欠失がマウスの肺で黒色腫癌細胞の転移を抑制することを示したH&E染色写真である。
【図40】図40aは、図32ないし図34の実験でF−UCPとGFPを発現するアデノウイルスの遺伝体(genome)が、腫瘍細胞中に21日後にも存在するということを示すサザンブロット写真である。図40bは、図32ないし図34の実験でF−UCPとGFPを発現するアデノウイルスが、腫瘍細胞中に21日後にもF−UCP及びGFP発現を維持するということを示すRT−PCR写真である。
【図41】HA−VHL発現786−0腎臓細胞株を使用して、UCPがVHLを媒介してHIF−2αの量を調節することを示すウエスタンブロット写真である。
【図42】Ad.UCP−siRNAによってUCPの発現が抑制されてVHLの機能が回復すると、HA−VHL発現786−0細胞株の成長が抑制されることを示すグラフである。
【図43】Ad.HIF−2α−siRNAとAd.UCP−siRNAによってHIF−2αの発現が抑制されると、すべての786−0細胞株の浸透能が低下することを示すグラフである。
【図44】786−0細胞株で作ったマウス腫瘍モデルで、Ad.HIF−2α−siRNA処理群の場合にのみ癌の増殖が抑制されることを示すグラフである。
【図45】HA−VHL発現細胞株のマウス腫瘍モデルで、Ad.F−UCP処理群の場合には癌の増殖が早くなり、Ad.HIF−2α−siRNAとAd.UCP−siRNAの処理群では増殖速度が抑制されることを示すグラフである。
【図46】図46a及び図46cは、HA−VHLの発現が高い細胞株の増殖速度の変化を使用して、UCPを抑制する阻害剤を探索することができることを示すグラフである。図46bは、UCPの発現抑制によるGFP−VHLの発現増加を示すウエスタン写真である。
【図47】図47aは、UCP発現増加によって細胞培養液中にVEGFが増加することを示すグラフである。図47bは、図47aの条件で獲得した細胞培養液でHUVECを培養した時、UCP過発現細胞培養液がヒトの血管細胞(HUVEC)の増殖を促進するということを示すグラフである。
【発明を実施するための形態】
【0074】
以下、本発明を実施例によって詳しく説明する。
【0075】
但し、下記実施例は本発明を例示するだけのものであって、本発明の内容が下記実施例によって限定されるものではない。
【実施例】
【0076】
実施例1:細胞内でUCPとVHL間の相互作用検証
UCPとVHL間の相互作用検証のために次のような発現ベクターを製作して使用した。Flag−UCPは、ヒト遺伝体機能研究事業団(韓国バイオテクノロジー研究院)から提供を受けたUCP含有発現ベクター(pDESTtm27GST−UCP)を鋳型にして、PCR方法で得られた切片をNotI/BamHIでpCMV Tag1(Stratagene)にクローニングして製作した。PCR条件は、下記のとおりである。DNA重合酵素(pfu polymerase(Vent),New England Bioscience,米国)を使用してプライマー対(配列番号1:Sense:5’−tccgcggccgcatgaactccaacgtggagaa−3’、配列番号2:Antisense:5’−accggatccctacagccgccgcagcgccc−3’)と鋳型を94℃で4分間変性させて、94℃で1分、55℃で1分及び72℃で1分間30回反応させて、72℃で5分間伸長(extension)させて反応を終結した。GST−Rbx1、GST−Elongin BとGST−Elongin Cは、BamHI/NotIでpEBGベクターにクローニングし、GST−VHLは、BamHI/SpeIでpEBG ベクターにクローニングした。Flag−VHLは韓国バイオテクノロジー研究院のジョ・サヨン博士から提供受けて使用した。
【0077】
本発明に使用した抗体中のマウス抗UCP抗体は、本発明者等が直接製作して使用した。その過程を説明すると、pET28aベクターにUCPをBamHI/NotIにクローニングしてBL21大腸菌でタンパク質を合成した。His−Resinを使用して大腸菌からHis−UCPだけを純粋分離して、それをBalb/c(メス、6週齢)にFluidアジュバント(CHEMICON)とともに週1回ずつ総4回兔疫して血清を得て、プロテインA(SIGMA)で濃縮して、以下の実験に使用した。
【0078】
Flag−UCPを常に発現するHEK293細胞株(293−F−UCP)は、ネオマイシン分解遺伝子を含むFlag−UCP発現ベクター(pCMV Tag1−Flag−UCP)をカルシウムホスファート方法で細胞内に導入して、1mg/mlのネオマイシンが含まれたLDMEM(10%牛胎児血清、100μg/mlストレプトマイシン、100unit/mlペニシリン含有)で選択培養して得た細胞集落でFlag−UCP発現を確認して使用した。
【0079】
実施例1−1:過発現体系を使用したUCPとVHLの相互結合検証
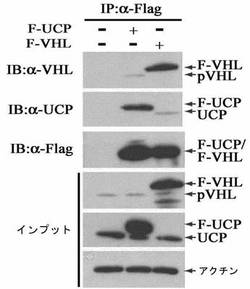
過発現されたUCPと内因性VHL間の結合及び過発現されたVHLと内因性UCP間の結合有無は、HEK293T細胞株にFlag−UCP及びFlag−VHLを過発現させて、Flag−ゲルで免疫沈降反応を実施した後、内因性UCPとVHLの抗体としてウエスタンブロットを実施することで確認した。詳しく説明すると、HEK293T細胞株にFlag−UCPとFlag−VHL発現ベクターをカルシウムホスファート方法で各々細胞内に導入した。集める12時間前に10μMのMG132を処理して細胞を集めて−70℃で冷凍後、細胞破砕溶液(50mM Tris,0.5mM EDTA, 0.1%NP−40,0.5mM PMSF)で破砕した。そこにマウス抗Flag抗体(Sigma)が結合されているアガロースゲルを添加して免疫沈降反応を4℃で2時間実施した。それをSDS−試料緩衝液(62.5mM Tris,2%SDS,5%ベータ−メルカプトエタノール,10%グリセロール,0.01%ブロモフェノールブルー)と混合して95℃で5分間沸かした後、12.5%ポリアクリルアミド電気泳動を遂行した。分離したタンパク質をPVDF膜に移動させた後、膜を5%脱脂粉乳が含まれたPBST(0.05%Tween20を含んだリン酸緩衝溶液)で1時間ブロッキングして、マウス抗Flag抗体(Sigma)とマウス抗UCP抗体及びマウス抗VHL抗体(Pharmingen)として各々室温で一時間反応させた。反応後、残余抗体はPBSTで充分に洗浄してホースラディッシュペルオキシダーゼが標識されたウサギ抗マウス抗体で室温で一時間さらに反応させた後、ECL溶液で反応有無を確認した。併せて各群の細胞破砕液も一緒に前記方法のようにウエスタンブロットを実施した。その結果、Flag−UCPとVHLの結合及びFlag−VHLとUCP間の結合を確認することができた。
【0080】
実施例1−2:内因性UCPとVHL間の結合有無検証
内因性UCPとVHL間の結合有無を調べるために、VHLとUCPの発現が両方存在するHLK3及びCk−K1癌細胞株で実施した。5枚の100mm皿にHDMEM(4.5g/lグルコース、10%牛胎児血清、100μg/mlストレプトマイシン、100unit/mlペニシリン含有)で培養されたHLK3及びCk−K1癌細胞株を集めて−70℃で冷凍後、細胞破砕溶液(50mM Tris,0.5mM EDTA,0.1%NP−40,0.5mM PMSF)で破砕した。細胞破砕液にマウス抗VHL抗体あるいはマウス抗UCP抗体と対照群としてマウス兔疫グロブリンを各々10μgを添加して、プロテインAゲルとともに4℃で2時間免疫沈降反応実施した。それをマウス抗UCP抗体あるいはマウス抗VHL抗体として前記記述した方法と同様にウエスタンブロットを実施した。その結果、細胞内で内因性UCPとVHLが結合していることが分かった(図5)。
【0081】
実施例1−3:UCPとVHL間の結合の特異性調査
VHLは、Elongin B、Elongin C、Rbx1 Cullin 2等と複合体を成し、E3ユビキチンリガーゼ活性を示し、この酵素の代表的な基質は、HIF−1αである(Nat Rev Cancer,2002年,第2巻,673−682頁)。前記VHLと結合することが示されたUCPのVHL複合体の他の分子との結合可能性の有無を試験した。Flag−UCPが常に発現されるHEK293細胞(293−F−UCP)に GST−Rbx1、GST−Elongin B、GST−Elongin C、GST−VHL及びGST発現ベクターを各々カルシウムホスファート方法で各々細胞内に導入した。集める12時間前に10μmのMG132で処理して細胞を集めて−70℃で冷凍後、細胞破砕溶液(50mM Tris、0.5mM EDTA、0.1%NP−40、0.5mM PMSF)で破砕した。そこにGST−セパロース(Amersham)を添加してGST pull−downを4℃で2時間実施して、マウス抗Flag抗体として前記のような方法でウエスタンブロットを実施した。その結果、UCPはVHLと特異的に結合することが分かった(図6)。
【0082】
また、細胞内でUCPとVHL間の結合性は、スクロース密度勾配遠心分離法によって二分子の移動様相を通じて確認した。100mm培養皿10枚のCAKI腎臓癌細胞株あるいはHepG2肝臓癌細胞株を集めて−70℃に冷凍させた後、0.5mlの細胞破砕溶液(50mM Tris,0.5mM EDTA,50mM KCl,10%グリセロール,1mM DTT,0.5% NP−40,0.5mM PMSF)に溶解して準備した。10mlの5%から20%までのスクロース線形密度勾配溶液に上の細胞破砕液をのせて35000rpmで16時間超高速遠心分離を実施した後、それを各0.5mlずつ20個の区画に分けてマウス抗UCP抗体、マウス抗VHL抗体、ウサギ抗Elongin B、Elongin C、Rbx1抗体(Santa Cruz)として前記方法と同様にウエスタンブロットを実施した。その結果、CAKI細胞株でUCPはVHL E3リガーゼ複合体(VHL、Elongin B、Elongin C、Rbx1等の複合体、分画10−12)には存在せず、free VHLが分画2−4で検出された(図7、CAKI cell)。HepG2細胞に由来したUCPは、VHL E3リガーゼ複合体分画(10−12)に存在せず、VHLと一緒に沈降した(図7、HepG2細胞株、分画4−5)。
【0083】
実施例1−4:UCP過発現によるVHL−UCP結合複合体形成
内因性VHLの発現が高いが、内因性UCPの発現が検出されないCAKI細胞株にF−UCPを過発現させた時、UCP−VHLの結合複合体形成を観察するために次のような実験を実施した。100mm皿5枚のCAKI細胞株に10ugのF/UCPプラスミドまたはmockベクタープラスミドをカルシウムホスファート方法として形質転換して48時間後に細胞を集めて前記実施例1−3で記述したようにスクロース密度勾配を実施してウエスタンブロット方法で複合体形成を観察した結果、UCPを過発現させない場合に2−4の分画でみられたfree VHL分子が、UCPが過発現されると4−5の分画に移動してUCP−VHL結合複合体を形成することが分かった(図8)。
【0084】
以上の結果は、UCPは特異的にVHLと結合して、UCP−VHL結合体とVHLE3ユビキチンリガーゼ複合体がお互いに独立的に存在するということを提示している。
【0085】
実施例2:UCPがVHLタンパク質安定性に及ぼす効果の調査
UCPによるVHLの細胞内タンパク質濃度の減少は、VHLのユビキチン媒介タンパク質分解によって招来され、HIF−1αの安定化をもたらすようになると思慮され、それを検証した。
【0086】
HRE−lucレポーター遺伝子は、VEGF発現調節部位に由来した5個のHREをSV40 TATAを含むpGL3−ルシフェラーゼベクター(Promega)に挿入して製造された(Mol Ther.,2004年,第10巻,938−949頁)。
【0087】
本実験のためにFlag−UCPの活性部位である95番目システインをセリンに置換した突然変異Flag−UCPmをPCR法で製作した。PCR反応条件は、DNA重合酵素(pfuポリメラーゼ(Vent),New England Bioscience,米国)を使用して前記に記載したプライマー対と鋳型(配列番号3:internal sense:5’−AAA GGC GAG ATC AGC GTC AAC GTG CTC AAG−3’、配列番号4:internal antisense:5’−CTT GAG CAC GTT GAC GCT GAT CTC GCC ATT−3’)を94℃で4分間変性させて、94℃で1分、55℃で1分及び72℃で1分間30回反応させて、72℃で5分間伸長して反応を終結した。
【0088】
またHA−VHLを常に発現する293細胞株は、ネオマイシン分解遺伝子を含む発現ベクター(pCDNA/HA−VHL)をカルシウムホスファート方法で細胞内で導入して、1mg/mlのネオマイシンが含まれたLDMEM培地で選択培養して得た細胞集落でHA−VHL発現を確認して使用した。
【0089】
実施例2−1:UCPによるVHLの安定性減少効果の検証
HEK293T細胞株にFlag−UCPを10μg、15μgずつ各々カルシウムホスファート方法で導入させて集める12時間前に、10μmのMG132(26Sプロテアゾーム阻害剤)で処理したり処理しない群を各々集めて−70℃で冷凍後、細胞破砕溶液(50mM Tris,0.5mM EDTA,50mM KCl、10%グリセロール,1mM DTT,0.5% NP−40,0.5mM PMSF)に溶解して準備した。これをマウス抗Flag抗体、マウス抗VHL抗体、マウス抗HIF−1α(Phamingen)抗体及びマウス抗β−アクチン抗体(Sigma)として前記方法と同様にウエスタンブロットを実施した。その結果、UCPの発現が増加するほどVHLの濃度は減少し、この現象は、MG132によって阻害され、HIF−1αの転写活性はUCP濃度依存的に高かった(図9及び図10)。この結果は、UCPがVHLを26Sプロテアゾーム分解経路で分解させるということを示している。
【0090】
UCPによるVHL発現量減少がタンパク質水準(post−translation)であることを証明するために、Flag−UCP存在下でVHLのmRNA濃度をノーザンブロットで確認した。同時に、HIF−1α及びHIF−1αの標的分子であるVEGFのmRNAの発現増減有無も調査した。F−UCPが、5、10、15μgずつ導入されたHEK293細胞株からRNaseyキット(Qiagen)を使用して全体RNAを分離した。各25μgのRNAをホルマリンアガロースゲルで電気泳動して分離した後、ナイロン膜に移して吸着させた後、ノーザンブロットに使用した。RNP1633(Amersham/Pharmacia)でVHL、HIF−1α、VEGF、アクチンcDNAを[32P]dCTP放射能で各々標識させた後、65℃で16時間RNAが付着しているナイロン膜と各々反応させて残余放射能標識プローブは、充分に洗浄して除去した。前記の膜を、BAS1500(Fuji)ホスホイメージ分析機で分析した。その結果、F−UCPは、VHL、HIF−1αの転写を調節しないことが分かり、F−UCPによってVEGFの転写が増加されたことが分かった(図11)。
【0091】
前記の結果は、翻訳後(post−translation)の工程でUCPがHIF−1αを分解させるVHLタンパク質量を減少させて、結果的に細胞内HIF−1αタンパク質濃度が増加してVEGFの転写を活性化させるということを示している。
【0092】
実施例2−2:Hypoxia条件でUCPによるVHLの細胞内濃度変化の検証
低酸素条件(hypoxia;1%O2)及び正常酸素条件(normoxia;20%O2)でUCPによるVHLのタンパク質濃度減少現象を調べるために次のような実験を実施した。
【0093】
293/HA−VHL細胞株にFlag−UCPを発現した時のVHLの細胞内濃度変化を、Normoxia条件とHypoxia条件で検証した。293/HA−VHL細胞株にFlag−UCPを10μg、15μgずつ各々カルシウムホスファート方法で導入させて24時間後、低酸素条件の細胞は細胞を集める前約12時間低酸素チェンバーに放置しておいた後、細胞を集めて−70℃に冷凍させた後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗HAエピトープ(Roche)抗体、マウス抗Flag抗体、マウス抗HIF−1α(Phamingen)抗体及びマウス抗β−アクチン抗体(Sigma)として前記方法と同様にウエスタンブロットを実施した。その結果、Flag−UCPの発現が高いほどVHLの細胞内濃度は、正常酸素条件と低酸素条件で共に低くなることが分かり、それによるHIF−1αの安定化を確認することができた(図15a)。
【0094】
UCPによるHIF−1αの安定化現象をHRE−lucを使用したレポーター分析で再度確認した。6ウェルプレートに培養したHEK293細胞株に、HRE−lucと各々5μg、10μgのF−UCPを一緒に導入して、Hypoxia条件の細胞は細胞を集める前約16時間低酸素チェンバーに放置しておいた後、細胞を集めた。−70℃に冷凍させた後、リポーター細胞破砕溶液(Promega)に溶解した後、ルシフェラーゼ(luciferase)の基質であるルミノール(luminol)を添加してルシフェラーゼの活性有無を測定した。その結果、F−UCPの濃度に依存的にHRE−lucの活性が高くなることが分かった(図15b)。この結果は、UCPが細胞内HIF−1αを調節するVHLの細胞内濃度を低酸素及び正常酸素条件の両方で減少させるということを示している。
【0095】
実施例2−3:UCPのAuto−ubiquitination(E2/E3)酵素活性検証
UCPは、E2ユビキチン結合酵素として知られていて、E3ユビキチンリガーゼ活性も有している。UCPの95番目アミノ酸であるシステインは、E2ファミリーによく保存されていて、酵素の活性に重要なことが報告されている(EMBO J,2003年,第22巻,5241−5250頁)。それで、本発明者等は、UCPによるVHLの細胞内濃度調節でE2酵素活性が重要な役割を担当しているのかどうかを調べようとした。それのために野生型のGST−UCPと95番システインをセリンに置換した突然変異GST−UCPmを、各々E.coliで発現させて純粋分離した。E1供給源として786−0細胞株(American Type Culture Collection)の細胞破砕液(S−100)を使用して、各々のタンパク質をユビキチン化緩衝溶液(50mM Tris,1mM ATP,10mM creatine phosphate,10μg creatine phosphokinase,0.5mM DTT,5mM MgCl2,1μg ubiquitin aldehyde,1μg His−ubiquitin)に混ぜて37℃で1時間反応させた後、GST−pull downした。ユビキチン化UCPを抗−His抗体としてウエスタンブロットして確認した結果、野生型GST−UCPでのみAuto−ubiquitinationが確認された(図16)。
【0096】
実施例2−4:UCPの酵素活性とUCPによるVHLタンパク質分解との関連性の調査
Flag−UCPとFlag−UCPmを各々濃度別で(5,10,15μg)HEK293細胞株に導入して48時間の後に細胞を集めて−70℃に冷凍させた後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗VHL抗体、マウス抗Flag抗体及びマウス抗アクチン抗体として前記方法と同様にウエスタンブロットを実施した。その結果、Flag−UCPによっては濃度依存的にVHLの量が減少したが、Flag−UCPmによっては変化がなかった。ゆえに、UCPのよるVHLタンパク質分解でUCPの酵素活性が必須であるということが分かった(図12)。
【0097】
実施例3:UCPによるVHLの多重ユビキチン化検証
以上で確認されたUCPによるVHLの細胞内濃度減少が、ユビキチン媒介タンパク質分解(ubiquitin−mediated proteolysis)によることなのかどうかを確認するために、VHLが多重ユビキチン化されるかどうかを調査した。それのためにHis−Ub発現ベクターを使用したIn vivo及びIn vitro VHLユビキチン化分析とE1を使用した酵素反応を実施した。そのために、UCP及びUCPmをEcoR1/NotIでpGEX4T−1ベクターにクローニングして大腸菌DH5αで発現させて、GST−セパロースカラムを使用してGST−UCP、GST−UCPmを分離し、Flag−VHLをHEK293に導入させて発現させた後、それからFlag−アガロースゲル免疫沈降法を使用して、Flag−VHLのみを純粋分離した。
【0098】
実施例3−1:UCPによるインビボVHLユビキチン化検証
HEK293細胞株に先にHis−Ub発現ベクターをカルシウムホスファート方法で導入して培養させた後、同量の細胞を100mm培養皿に分けて培養した後、そこに図9に提示したFlag−VHL、Flag−VHLとGST−UCP、Falg−VHLとGST発現ベクターを再びカルシウムホスファート方法で導入させた。集める12時間前に10μMのMG132を処理して細胞を集めて、すぐdenatured lysis buffer(50mM Tris,1%SDS,4M Urea)を添加して超音波粉砕機で細胞を破砕した。用意した細胞破砕溶液にフラッグ抗体が結合されたアガロースゲルを添加して、室温で2時間免疫沈降反応を実施した。これをマウス抗Ub抗体で前記記述と同様にウエスタンブロットを実施して、併せて免疫沈降反応前の細胞破砕溶液の一部を取ってマウス抗GST抗体、マウス抗Flag抗体として同一なウエスタンブロットを実施した。その結果、UCPによるFlag−VHLの多重ユビキチン化を観察することができた(図13)。
【0099】
実施例3−2:UCPによるインビトロVHLユビキチン化検証
1μgのE1(ウサギ、Sigma)と純粋分離したGST−UCP及びGST−UCPm、Flag−VHLタンパク質を各々前記のユビキチン化緩衝溶液に混ぜて37℃で1時間反応させた後、Ni2+−NTAレジンで4℃で2時間沈降させて、それを各々マウス抗Flag抗体、マウス抗GST抗体でウエスタンブロットを実施した。また、Ni2+−NTA(QIAGEN,ドイツ)pull−downさせる前の反応後試料から1/10を取って抗Flag抗体、マウス抗GST抗体でウエスタンブロットを実施した。その結果、UCPによるVHLの直接的なユビキチン化が試験管内で起きることが分かった(図14)。
【0100】
より明確にUCPによるVHLユビキチン化を検証するために、1μgのE1と純粋分離したGST−UCP及びGST−UCPm、Flag−VHLタンパク質を各々前記のユビキチン化緩衝溶液に混ぜて37℃で1時間反応させた後、それを各々マウス抗Flag抗体、マウス抗His抗体及びマウス抗GST抗体でウエスタンブロットを実施した。また、反応溶液をAnti−Flag−アガロースとNi2+−NTAレジンで各々4℃で2時間沈降させて、それを各々マウス抗Flag抗体、マウス抗His抗体及びマウス抗GST抗体でウエスタンブロットを実施した。その結果、野生型UCPによるVHLの直接的なユビキチン化が、試験管内で起きることが分かった(図17a、b)。
【0101】
前記の結果は、UCPがE2ユビキチン結合酵素及びE3ユビキチンリガーゼとして機能して、VHLのユビキチン化を増加させてタンパク質分解を誘導するということを示している。言いかえると、UCPはE2及びE3酵素活性を共に有していることを示す。
【0102】
実施例4:VHL安定性でのUCPの特異性検証
UCPとVHLの相互作用によるVHLのタンパク質濃度減少現象がVHL以外の他のタンパク質でも起きるのか、あるいはVHLの場合にのみ特異的に起きるかどうかを次のように検証した。言いかえれると、UCPが特異的にVHLのみをユビキチン化させて分解を誘導するのかどうかを調査した。そのために、GST−UbcH5CとGST−CDC34は、BamHI/NotIで処理してpEBGベクターにクローニングして製作した。
【0103】
実施例4−1:UCPがElongin B及びCとRbx1の安定性に及ぼす効果の調査
10μgのFlag−UCP発現ベクターをカルシウムホスファート方法で導入させたりあるいは導入しないHEK293T細胞を−70℃に冷凍後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗Flag抗体、マウス抗VHL抗体、ウサギ抗Elongin B、ウサギ抗Elongin C抗体、ウサギ抗Rbx1抗体及びマウス抗β−アクチン抗体として前記方法と同様にウエスタンブロットを実施した結果、VHLのタンパク質濃度は、UCPによって顕著に減少し、Elongin B、Elongin Cは若干の減少があることがみうけられた(図18a)。Elongin B、Cの濃度が若干減少する現象は、VHL.Elongin B、Elongin Cがお互いに複合体を形成して各々のタンパク質の安定性に影響を与えることが報告されたように(PNAS USA,2000年,第97巻,8507−8512頁)、VHLの濃度が顕著に減少することで遊離Elongin B、Elongin Cの半減期が減少して現れることであると推定された。
【0104】
実施例4−2:UCPがSOCS1及びMDM2安定性に及ぼす効果の調査
Elongin B、Cは、SOCS1(suppressor of cytokine signaling 1)と複合体を形成してSOCS1の分解を阻害する(Genes& Development,1998年,第12巻,3872−3881頁)。また、SOCS1は、Elongin B、C、Cul2と複合体を形成してVHLE3ユビキチンリガーゼと類似のE3ユビキチンリガーゼ活性を示す(JBC275,2000年,14005−14008頁)。このような理由で、UCPがSOCS1の分解を誘導するかどうかを調査した。HEK293細胞株にFlag−VHL及びFlag−SOCS1発現ベクターを各々カルシウムホスファート方法で導入させて、それを6ウェルプレートに各々均一に分けて培養して24時間後、GST−UCP及びGST発現ベクターを再び各々同一方法で導入させた。24時間後に細胞を集めて−70℃に冷凍させた後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗Flag抗体、マウス抗GST抗体、マウス抗アクチン抗体を使用して前述したウエスタンブロット方法を実施した。その結果、UCPはSOCS1の安定性には影響を及ぼさず、VHLの細胞内濃度のみを減少させたことが示された(図18b)。
【0105】
MDM2は、RINGフィンガー(finger)構造を有するタンパク質で、MDM2自体及びp53のユビキチン化を誘導する(JBC,2000年,第275巻,8945−8951頁)。Ubc5HC、E2−25K等のE2酵素は、MDM2のautoubiquitinationを誘導する(JBC,2004年,第279巻,42169−42181頁)。このような理由で、UCPがE2酵素としてMDM2の細胞内タンパク質濃度を調節することができるかどうかを、JSHC肝臓癌細胞株でUbcH5Cを陽性対照にして試験してみた。100mm培養皿に用意したJSHCにGST−UbcH5c、GST−UCP及びGST発現ベクターを各10μgずつカルシウムホスファート方法で導入させて、48時間後、細胞を集めて免疫沈殿緩衝液(50mM Tris,150mM NaCl,1%NP−40,0.5%デオキシコール酸,0.1%SDS)で破砕した。これをマウス抗MDM2抗体(Pharmingen)、マウス抗GST、マウス抗アクチンを使用して前記記述したウエスタンブロット方法を実施した。その結果、UbcH5Cは、MDM2タンパク質の濃度を減少させた一方、UCPはMDM2の濃度に影響を及ぼさなかった(図18c)。
【0106】
実施例4−3:ユビキチン供与E2酵素及びRbx1によるVHLの安定性の調査
Rbx1は、Elongin B、Cがない場合、試験管内でVHLのユビキチン化を誘導するが、Elongin B、Cがある場合、Ubc5Hによって誘導されるVHLをユビキチン化させない(JBC,2002年,第277巻,30338−30393頁)。CDC34は、Skp1−Cul1とタンパク質複合体を形成して、E3ユビキチンリガーゼ活性を示すが、この複合体は構造的にVHLE3ユビキチンリガーゼと類似で(Curr Biol,1999年,第9巻,1180−1182頁)、CDC34は、複合体としてF−boxタンパク質であるCDC4を試験管内でユビキチン化する(JBC,2002年,第277巻,30338−30393頁)。293/HA−VHL細胞株にGST−Rbx1、GST−UbcH5C、GST−CDC34、GST−UCP発現ベクターを各々カルシウムホスファート方法で導入させて細胞を集めて、前記細胞破砕溶液で破砕した。各々の破砕液をマウス抗HA抗体、マウス抗GST抗体として前述した方法と同様にウエスタンブロットを実施した。また、GST−pull down分析を通じて各分子とVHLとの間の結合有無も確認した。その結果、GST−Rbx1、GST−UbcH5CはVHLと結合はするが、濃度には影響を与えず、CDC34はHA−VHLと結合せず、安定性に何らの影響も及ぼさず、GST−UCPだけがHA−VHLの細胞内濃度を減少させることが分かった(図19)。
【0107】
この結果は、UCPが特異的にVHLのユビキチン媒介タンパク質分解(ubiquitin−mediated proteolysis)を誘導するということを示している。
【0108】
実施例5:マウスの肝組織でUCPによるVHLの発現減少現象検証
培養細胞で確認されたUCPによるVHLタンパク質分解が生体内でも起きるのかを調べるために、F−UCP発現アデノウイルスベクター(Ad.F−UCP)を製作してマウスの尾静脈内に注射して肝でUCP、VHL及びHIF−1αの発現変化を検討した。
【0109】
具体的に、各2×108個のAd.F−UCP及び対照ウイルスとしてAd.GFPを6週齢のメスBalb/c マウスの尾静脈内に注射して、PBSも同一に注射した(実験群当り3匹)。3日後に肝を摘出して液体窒素が入った乳鉢で組織をすり下ろして準備し、同時に凍結組織切片を準備した。
【0110】
液体窒素で粉で準備した組織をmammalian proteome extraction kit(Calbiochem,米国)を使用して、ウエスタンブロットのための細胞破砕液を製造した。準備した試料として、抗Flag、抗UCP、抗VHL、抗HIF−1α抗体で前述のようにウエスタンブロットを実施した。その結果、UCPの過発現によるVHLの減少とHIF−1αの増加を確認することができた(図20)。また、マウスの肝組織には内因性UCPがほとんど発現されていないことが分かった。
【0111】
また、Flag、VHL及びHIF−1αに対する前記の肝組織スライスの免疫組織化学染色を実施した。各組織切片が付着したスライドを1%牛胎児血清が入っている、PBSで室温で1時間ブロッキングして、各抗体が含まれた0.1%牛胎児血清PBSで37℃で1時間反応させた。以後、PBSTで5分間3回洗浄してロダミンが結合されている抗マウスIgGが含まれている0.1%牛胎児血清PBSで室温で30分間反応させて、再び、以後PBSTで5分間3回洗浄して残余抗体を充分に除去した。組織で各抗体の反応有無は、蛍光顕微鏡で確認した。その結果、Flag−UCPが発現された時にVHLの発現が減少し、HIF−1α発現は増加していることを確認することができた(図21)。ゆえに、Flag−UCPによるVHLタンパク質減少は、培養細胞と生体内で同一に現れることが分かった。
【0112】
実施例5−1:癌患者組織でUCP、VHL、HIF−1αの発現様相の調査
肝臓癌、大腸癌、乳癌患者の組織が植えられているTissue arrayスライド(www.tissue−array.com,SuperBioChips Lab)を対象にして、UCP、VHL、HIF−1αの各抗体で前述のように免疫組織化学染色を実施した。その結果、UCPはHIF−1αとともに原発性癌患者組織と転移性癌組織の両方で発現が高く示された一方、VHLの発現は低く示された(図22)。癌患者の組織で酸素が円滑に供給される部位でも、UCPとHIF−1αの発現が高く示されることは、正常な酸素条件でUCPによるVHLの発現減少が、HIF−1αの発現は高く維持させて癌の増殖と転移の役割をしていることを暗示している。
【0113】
実施例6:癌細胞成長及び浸透(転移)でのUCPの機能解明
以上で得た結果は、UCPが癌抑制タンパク質中のひとつであるVHLの分解を促進させるということを示している。このような現象は、癌の進行及び転移にUCPが重要な役割を担当していることがあり得るという仮説を可能にして、治療用分子標的としての使用可能性もともに提示している。ゆえに、本発明者等は各種癌細胞でのUCP発現とVHL発現様相を調査して、UCP過発現及び抑制による癌細胞の増殖及び浸透(転移)効果を試験してみた。
【0114】
実施例6−1:各種癌細胞でUCPとVHLの発現様相比較
7種の肝臓癌細胞株(ATCC,SNU368,SNU709ソウル大学校医科大学癌研究所韓国細胞株銀行)、胆道癌細胞株(Ck−K1)(全北医大キン・デゴン教授)、7種の胃癌細胞株(ソウル大学校医科大学癌研究所韓国細胞株銀行)、皮膚癌細胞株(C8161)(韓国生命工学研究院、リー・ジョンヒョン博士)、大腸癌細胞株(HCT116)(ATCC)、肺癌細胞株(A549)(ATCC)、骨肉腫細胞株(U2OS)(ATCC)、前立腺癌細胞株(PC3)(ATCC)、腎臓癌細胞株(CAKI)(ATCC)と正常繊維芽細胞株MRC5及びIMR90(ATCC)等をHDMEM(4.5g/lグルコース、10%牛胎児血清、100unit/mlペニシリン、100μg/mlストレプトマイシン含有)含有100mm培養皿に細胞数106で24時間正常酸素条件で培養して準備した後、細胞を集めて−70℃に冷凍させた後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗UCP抗体、マウス抗VHL抗体、マウス抗アクチン(actin)抗体を使用して前述したウエスタンブロット方法を実施した。その結果、HLK3肝臓癌細胞株を除き、すべての細胞株でUCP水準とVHL水準が逆比例で存在した(図23)。HIF−1α水準がUCP水準と正比例して存在しなかったが、UCPが検出される15種の細胞株中12種の細胞株でHIF−1αが検出された。この結果は、UCPの発現が正常酸素条件でHIF−1α安定性を調節しているということを提示する。
【0115】
実施例6−2:UCPが癌細胞の増殖及び浸透に及ぼす影響
腎臓癌細胞株CAKIにFlag−UCPを含むアデノウイルス(Ad.F−UCP,50,100multiplicity of infection:MOI)及び対照ウイルスとしてGFPを含むアデノウイルス(Ad.GFP,100MOI)を感染させて48時間後、細胞を集めて−70℃に冷凍させた後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗Flag抗体、マウス抗VHL抗体、マウス抗HIF−1α抗体、マウス抗p21抗体、マウス抗アクチンp27抗体、マウス抗アクチン抗体を使用して、前述したウエスタンブロット方法を実施し、VEGF mRNAの変化は、VEGF、アクチンcDNAを[32P]dCTP放射能で標識させて前述した方法と同様にノーザンブロットを実施することで確認した。その結果、VHLの発現が高い腎臓癌細胞株CAKIでUCPが過発現になる場合、VHLの濃度が減少し、それによってHIF−1αとVEGFの濃度は増加することが示された(図24)。p21、p27タンパク質水準は、変化しないとみられ、UCPはVHL−HIF経路に特異的に作用すること示した(図24)。
【0116】
腎臓癌細胞株CAKIに各々Ad.F−UCPとAd.GFPを50MOIずつ感染させて、また対照群としてPBSを処理して16時間後にウェルプレートに100個ずつの細胞を植えて、2日間隔で細胞数をヘマサイトメーターを使用して測定してみた時、UCPが過発現するにつれて細胞の成長率が約2倍以上増加することが示された(図25)。併せて、CAKI細胞株の転移能力の変化を湿潤能測定(invasion assay)として測定してみた。各々Ad.F−UCPとAd.GFPを50MOIずつ感染させて、また対照群として、PBSを処理して16時間後、マトリゲル(Matrigel, BD)がコーティングされたトランスウェル(Trans well,Costar)に104個の細胞を入れて、24時間HDMEM(4.5g/lグルコース,10%FBS,100μgペニシリン/ストレプトマイシン)で培養した後、Trans wellを通過した細胞をヘマトキシリン・エオシン染色法で染色してその数を測定した。その結果、UCPが過量存在する場合、浸透率が対照群と比較して3倍程度増加したことが示された(図26)。
【0117】
実施例6−3:siRNAを使用したUCPのタンパク質合成の遮断が癌細胞の増殖及び浸透に及ぼす影響
肺に転移を誘導する皮膚癌C8161細胞株は、UCPの発現が高いことが先の実験で示された(図23)。本発明者等は、UCPの発現を抑制するためにUCPに対するsiRNAを考案してUCP−siRNAを含むアデノウイルスを製作した。UCP−siRNA塩基配列は、UCPmRNA配列中の配列番号6で記載される615−633塩基部分を、H1プロモーターによって発現されるようにpSuperプラスミドベクター(OligoEngine,米国)のHind III/Bgl II部位にクローニングして製作した。細胞内に伝達及び発現を願う遺伝子を提供するアデノウイルス製作用pShuttle(BD Bioscience,米国)ベクターに、前記製作されたpSuperプラスミドベクターをXbaI/HindIIIで処理して、H1プロモーターでT5転写終了配列を含むDNA切片をクローニングすることで製作した(pShuttle/UCP−siRNA)。以後、アデノウイルス遺伝子を含んでいるpAdEasy−1とE.coli BJ5183菌株に同時に形質導入することで組換えを遂行した。作られたUCP−siRNAを含むアデノウイルスベクターを使用して実施例5と同じ方法でアデノウイルス粒子を作った。また、対照ウイルスとして配列番号7で記載されるCon−siRNAを、上記と同一な方法で製作して使用した(Ad.Con−siRNA)。
【0118】
皮膚癌細胞株C8161にAd.F−UCP、Ad.UCP−siRNA、対照ウイルスとしてAd.GFP、Ad.Con−siRNAを各々50MOIずつ感染させて48時間後、細胞を集めて−70℃に冷凍させた後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗Flag抗体、マウス抗VHL抗体、マウス抗HIF−1α抗体、マウス抗p21抗体、マウス抗アクチンp27抗体、マウス抗アクチン抗体を使用して前記記述したウエスタンブロット方法を実施した。その結果、UCPの発現が高いほどHIF−1αの発現が高くなり、UCPの発現を抑制した場合、VHLの濃度が増加することを観察することができ、p21及びp27水準は変化がなかった(図27)。
【0119】
皮膚癌細胞株C8161にAd.F−UCP、Ad.UCP−siRNA、対照ウイルスとしてAd.GFP、Ad.Con−siRNAを各々50MOIずつ感染させ、また、対照群としてPBSを処理して16時間後、ウェルプレートに100個ずつの細胞を植えて2日間隔で細胞成長数をヘマサイトメーターを使用して測定してみた時、UCPが過発現になるにつれて細胞の成長率が約2倍増加することが示され、UCPの発現抑制は細胞の成長率を約2倍減少させることが示された(図28)。
【0120】
あわせて、UCPによるC8161細胞株の転移能力の変化をインベージョン・アッセイで測定してみた。前記と同一に処理されたC8161細胞を16時間後、Matrigel(BD,米国)がコーティングされたトランスウェル(Costar,米国)に104個の細胞を入れて24時間HDMEM(10%牛胎児血清、100μgペニシリン、ストレプトマイシン添加)で培養した後、トランスウェルを通過した細胞をヘマトキシリン・エオシン染色法で染色してその数を測定した。その結果、UCP過発現によって細胞の浸透率が対照群と比較して3倍程度増加し、UCP発現を抑制した場合は73%程度減少したことが示された(図29)。
【0121】
以上の結果は、UCPは癌の成長及び転移に重要な役割を遂行していて、UCPの発現を阻害することで癌の成長及び転移を抑制することができるということを示している。
【0122】
実施例6−4:胆道癌細胞株Ck−K1でのUCP−siRNAの効果
皮膚癌C8161細胞株で示されたUCPの効果が胆道癌細胞株(Ck−K1)でも再現されるのかどうか下記のように調査した。
【0123】
Ck−K1細胞株にAd.F−UCP、Ad.UCP−siRNA、対照ウイルスとしてAd.GFP、Ad.Control−siRNAを各々50MOIずつ感染させて48時間後、細胞を集めて−70℃に冷凍させた後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗Flag抗体、マウス抗VHL抗体、マウス抗HIF−1α抗体、マウス抗アクチン抗体を使用して前記記述したウエスタンブロット方法を実施した。その結果、Ck−K1細胞株でもUCPの発現が高いほどHIF−1αの発現が高くなり、UCPの発現を抑制した場合、VHLの濃度が増加することを観察することができた(図30)。
【0124】
実施例7:Ad.UCP−siRNA作動特異性検証
前記使用されたUCP−siRNAが細胞内UCPのみを特異的に抑制するということを検証するために、下記のような実験を実施した。
【0125】
実施例7−1:二次UCPsiRNAオリゴマー及びControl siRNAオリゴマーの製作
本発明者等は、UCPの272−290位置のmRNA配列sense 5’−AUGGCGAGAUCUGCGUCAATT−3’(配列番号8)、antisense 5’−UUGACGCAGAUCUCGCCAUTT−3’(配列番号9)(三千里製薬、韓国)を各々製作した後、RNase free D.Wに20μM/mlになるように溶解して、annealing buffer(20mM KCl,6mM HEPES−KOH、pH7.5、0.2mM MgCl2)に最終濃度が8μMになるように混ぜた後、90℃で2分間denaturation後、ゆっくり温度を下げながらアニーリングして−70℃に保管しながら使用した。Control siRNA場合は、sense 5’−AAGGAGACGAGCAAGAGAATT−3’(配列番号10)、antisense 5’−UUCUCUUGCUCGUCUCCUUTT−3’(配列番号11、Ref:Chen Z等,Nature,2005年,第436巻,725−730頁)(三千里製薬、韓国)を使用して、前記の方法で製作した。
【0126】
C8161細胞にAd.UCP−siRNAとAd.Control−siRNAは各々50MOIずつ感染させて、前記UCP−siRNAオリゴマーは200nM、400nMの濃度で、Control siRNAオリゴマーの場合は400nMの濃度でリポフェクタミン2000で形質転換させて48時間後、細胞を集めてウエスタンブロットを実施した。その結果、二次UCP−siRNAオリゴマーは、UCPの発現を効果的に抑制することができることを確認した(図31a)。
【0127】
実施例7−2:F−UCPsilent mutant(SM)実験
UCP−siRNA標的配列のアミノ酸は変化させないで、塩基配列を(AAG AAG CTG GCG GCC AAG AAA −> AAA AAA TTA GCA GCT AAA AAG)変換させた突然変異F−UCP(SM)(配列番号12)は、野生型F−UCPを鋳型にしてPCR方法で得られた突然変異した切片をpCMV taq1 ベクター(Stratagene,米国)のNotI/BamHIサイトにクローニングして製作した。
【0128】
293HA/VHL細胞株にF−UCPとF−UCP(SM)をpSuperUCP−siRNA及びpSuper Con−siRNAと共に形質転換して、48時間後に細胞を集めてウエスタンブロットを実施してUCP−siRNAの作動性有無を観察した。その結果、UCP−siRNAは野生型F−UCPの発現は抑制したが、突然変異F−UCP(SM)の発現には何らの影響を与えることができなかった(図31b)。また、UCPの発現抑制によるHA−VHL発現増加とHIF−1αの減少現象も、野生型のF−UCPでのみ示された。この結果は、前記製作されたUCP−siRNAがUCPの核酸特定部位のみを特異的に認識して分解するということを示し、innate immune体系を誘導して起きる現象ではないことを示している。
【0129】
実施例8:マウス腫瘍モデルでUCPが癌成長及び癌転移に及ぼす効果の調査
【0130】
実施例8−1:マウスモデルでUCPによるC8161癌細胞の増殖効果の調査
5×105個のC8161細胞にAd.F−UCPとAd.GFPを各100MOIずつ感染させたりリン酸緩衝液で処理した後、各々のC8161細胞を6週齢のメスのヌードマウスのお互いに異なる部位の皮下に注射した(各群当りマウス3匹、2site injection/mouse)。マウスに移植されたC8161癌細胞の成長変化を21日間、腫瘍の大きさを測定して調査した。腫瘍の大きさは、「横2×縦2/2=腫瘍体積(mm3)」公式を使用して計算した。その結果、UCPによって腫瘍の大きさが対照群と比較して約4倍以上増加することが分かった(図32及び33)。
【0131】
UCPによるHIF−1αと血管生成の増加を確認するために、摘出した腫瘍を凍結組織ブロックを作って切片を準備して、マウス抗Flag抗体、マウス抗HIF−1α抗体、マウス抗CD31抗体(Phamingen,米国)に対する免疫組織化学染色を前述の方法と同一に実施した。Ad.F−UCPを感染させた癌塊で、HIF−1αとCD31の発現が対照群と比較して増加していることを確認することができた(図34)。この実験で21日間、アデノウイルスベクター遺伝体が腫瘍に存在するのかどうかを、次のような実験を通じて確認した。100MOIのAd.F−UCP、Ad.GFP及び処理しないC8161細胞を(5×105/site)ヌードマウスに皮下注射して、21日後に腫瘍を分離して次のような方法でジェノミックDNAを分離した。Phenol/Chloroform方法でDNAを分離して100%エチルアルコールでジェノミックDNAを回収した。以後、アデノウイルスタイプ5ジェノミックDNAをHindIII処理して得た約2kbの切片を、プローブにしてサザンブロットを実施した。その結果、アデノウイルス核酸は、21日間腫瘍細胞中に存在することが分かった(図40a)。上のように得られた腫瘍からRneasy mini kit(Qiagen,ドイツ)プロトコルによって全体RNAを分離した。Flag/UCPの確認のために5’−ATGAACTCCAACGTGGAGAA−3’(配列番号13)、5’−CTACAGCCGCCGCAGCGC−3’(配列番号14)のプライマーセットを使用し、GFP確認のために5’−AAGGAGAAAACTTTTCACT−3’(配列番号15)、5’−TAATGGTCTGCTAGTTGAAC−3’(配列番号16)のプライマーセットを使用してRT−PCRを遂行した。その結果、腫瘍細胞中にF−UCPとGFPのmRNAが存在していたことを確認することができた(図40b)。
【0132】
実施例8−2:腫瘍が形成されたヌードマウスモデルでのAd.UCP−siRNAウイルスの抗癌効果
UCP−siRNAによるC8161細胞のUCP発現阻害が腫瘍の成長に及ぼす効果を検証するために、5×105個のC8161細胞をヌードマウスの皮下に注射して、2週間後腫瘍が平均直径3mmになった時、各々109個pfu(plaque−forming unit)の精製されたAd.UCP−siRNAまたはAd.Con−siRNAウイルスを含むまたは含まないホスファート緩衝溶液100μlを腫瘍塊に直接一度注射して以後、腫瘍の大きさを17日間測定した。C8161でUCPの発現に低下による腫瘍成長抑制効果が顕著に示された(図35)。
【0133】
実施例8−3:ヒト黒色腫細胞でUCPが癌転移に及ぼす効果の調査
C8161癌細胞(106cell/100μl in PBS)を ヌードマウス(メス、5W、Balb/c、N=8)の腹中央に皮下注射して1週間後、腫瘍の平均直径が約3mmになった時、各ウイルス(PBS、Ad.F−UCP、Ad.GFP)を109pfuになるように50μlのPBSに溶解して腫瘍の中央部に注射した。約9週後に肺を摘出して、Bouin's solutionに固定及びH&E染色して転移された腫瘍の有無を観察した。その結果、UCPを過発現させたグループでは、転移が顕著に増加したことが分かった(図36、37)。
【0134】
ヒト黒色腫細胞C8161(5×105個)にAd.F−UCP、Ad.GFP、Ad.UCP−siRNA、Ad.GFP−siRNA(配列番号17)を100MOIずつ感染させた後、リン酸緩衝液で処理した各々のC8161細胞を6週齢のメスヌードマウスの尾静脈に注射した。ここで、PBSのみをヌードマウスの尾静脈に注射した。癌細胞をマウスに注射してから4週後、マウスの肺を摘出して水で洗浄して、Bouin's solution(SIGMA)で固定した。摘出した肺器官の様子(図39)と肺の表面に転移した癌塊(>直径2mm)を顕微鏡下でカウントした後、平均値を図38に示した。
【0135】
その結果、PBS(C8161含)、Ad.GFP、Ad.GFP−siRNAで処理した癌細胞の場合、肺に転移した転移癌が17、22、23個が観察された一方、PBSのみを注射した場合は転移癌が一つも観察されなかったが、これは肺転移癌は癌細胞注入によって発生したことを示している。
【0136】
一方、Ad.F−UCPを使用してUCPを過発現させた場合、肺転移癌は約6〜8倍増加した一方、Ad.UCP−siRNAを使用してUCPの発現を抑制した場合には、肺転移癌が約6〜7倍減少した。前記結果は、UCPが癌転移に陽性因子として作用してUCP発現を低めたり、活性を制御すると癌の転移を抑制することができることを示している。
【0137】
前記の結果は、UCPがマウス腫瘍モデルで癌細胞の増殖及び転移を増加させて、UCPの機能を制御すると、癌細胞の増殖及び転移が阻害されることを示すもので、UCPが癌治療のための分子マーカーに有用に活用され得ることが確認された。
【0138】
実施例9:UCPのVHL−HIF経路調節の特異性調査
VHLが欠如している腎臓癌細胞株、786−0は、HIF−2αが過発現されていて(Nat,1999年,第399巻,271−299頁)、UCPの発現も高い(図41)。この細胞株をHA−VHLを常に発現するように操作して(Invitrogenで販売されているpCDNAベクターにHA−VHL遺伝子を導入させた発現ベクターpCDNA−HA−VHLで形質転換)UCPの効果を調査した。また、この実験のためにHIF−2αのmRNA配列86−104まで5’−GGAGACGGAGGTGTTCTAT−3’の配列を含むAd.HIF2α−siRNA(配列番号18)を前述したとおり製作した。
【0139】
実施例9−1:HA−VHL発現細胞株でUCPの効果
HA−VHL細胞株及び対照群細胞株に50MOIの各々のウイルスベクターを(Ad.F−UCP、Ad.GFP、Ad.UCP−siRNA、Ad.Con−siRNA、Ad.HIF−2α−siRNA)感染させた後、UCP、VHL、HIF−2α、GLUT1(HIF−1α及びHIF−2αによってその発現が誘導される遺伝子、GLUT1抗体、Santa Cruz,米国)の各々タンパク質の発現変化様相をウエスタンブロットで確認した。その結果、VHLの発現がない対照群細胞株ではUCPの発現変化によるVHLの変化もなく、HIF−2α、及びGLUT1の発現変化もなかった。しかし、HA−VHL発現細胞株では、UCPの発現によってVHLの発現が逆に変化し、それによってHIF−2α、及びGLUT1もUCPの発現変化様相と同一に変化した(図41)。
【0140】
前述したとおり各々のウイルスを処理して二つの細胞株間の増殖速度の差を試験した。その結果、対照細胞株では各ウイルス処理群間に変化がなかったが、HA−VHL発現細胞株ではAd.UCP−siRNA処理による細胞増殖阻害効果が示された(図42)。
【0141】
また、各々のウイルスによる浸透能の変化を試験した時、対照細胞株ではAd.HIF−2α−siRNAを処理した群で浸透能が減少し、HA−VHL発現細胞株ではAd.UCP−siRNA、Ad.HIF−2α−siRNA処理群で浸透能が減少した(図43)。
【0142】
これらの結果は、以下のことを示唆する:i) VHLは培養中でHIF−2αレベルに非依存的に細胞の成長を調節する;ii) HIF−2αは培養中で細胞の浸透能を調節するが、細胞の成長は調節しない;およびiii) UCPはVHLを通じて細胞の成長を調節し、VHL−HIF経路を通じて細胞の浸透を調節する。
【0143】
実施例9−2:マウス腫瘍モデルでUCP発現調節によるVHLの抗癌効果
各ウイルス(Mock、Ad.F/UCP、Ad.GFP、Ad.UCP−siRNA、Ad.Con−siRNA、Ad.HIF−2α−siRNA)をHA−VHL発現細胞株と対照細胞株に各々2時間感染させて(100MOI)16時間後に細胞を集めて、107cell/100μlのPBSに懸濁してヌードマウス(メス、5W、Balb/c、N=5)の右側太ももの皮下に注射した。時間の経過による腫瘍の成長を観察した時、Ad.HIF−2α−siRNAは対照細胞株とHA−VHL発現細胞株全て腫瘍抑制効果を示し、Ad.UCP−siRNAはHA−VHL細胞株で腫瘍抑制効果を示した(図44、45)。以上の結果は、UCPがVHLを通じて癌細胞増殖を調節して、VHL−HIF経路を通じて癌細胞の浸透を調節することを示している。これは、UCPがVHL−HIFの経路を特異に調節する上位分子であり、VHLの抗癌効果を効果的に示すためにはUCPの発現抑制が必要だということを示している。
【0144】
実施例10:UCP阻害剤探索(High Throughput Screening、HTS)のための細胞株の製作
以上でUCPは、VHL−HIF経路を調節して癌細胞の増殖及び転移を促進させることが示され、実際にUCPの抑制はVHLの発現の増加による癌細胞増殖抑制効果(抗癌効果)を示した(図41、42)。それで、本発明者等は、786−O及びHA−VHLが発現するように考案された(pCDNA−HA−VHLで形質転換)786−0細胞株(786−O−HA−VHL)を、UCPを特異的に抑制する阻害剤を捜すcell−based HTS assayに使用することができるかどうかを下記のように調査した。
【0145】
786−O及び786−O−HA−VHL細胞株を96ウェルプレートに103cell/wellの個数で植えて、Ad.UCP−siRNAとAd.Control−siRNAを各々200MOIから2倍ずつ希釈して0.39MOIまで希釈して感染させた後、48時間目にWST−1(Roche、ドイツ)で細胞増殖速度の変化を測定した。そこにHA−VHLを発現しない786−0対照細胞株にAd.UCP−siRNAを同じ方法で処理してUCP抑制剤特異性を試験した。その結果、HA−VHLが発現される細胞株ではUCPの抑制による細胞増殖抑制効果が示されたが、対照細胞株及び対照ウイルスでは示されなかった(図46a)。
【0146】
また他のcell based assayの方法として、GFP−VHL融合タンパク質を発現するように(Invitrogenで販売されるpCDNAベクターにGFP−VHL融合遺伝子を挿入したpCNA−GFP−VHL発現ベクターで形質転換)Huh−7−GFL−VHL肝臓癌細胞株を製作した。この細胞株でUCPの発現が阻害されることによるGFP−VHLの増加をウエスタンブロットで確認することができる(図46b)。
【0147】
Huh−7−GFL−VHL細胞株を96ウエルプレートに103cell/wellの数で植えて、Ad.UCP−siRNAを200MOIから2倍ずつ希釈して3.13MOIまで希釈して感染させた後、48時間にWST−1(Roche、ドイツ)で細胞増殖速度の変化を測定した。その結果、UCP発現の抑制とVHL発現増加による細胞増殖抑制効果を確認することができた(図46c)。
【0148】
ゆえに、前記の786−O、786−O−HA−VHL及びHuh−7−GFP−VHL細胞株は、選択的にUCPの酵素活性及びUCP−VHL相互作用を阻害する抑制剤を探索するのに有用に使用することができる。
【0149】
実施例11:UCPが血管細胞増殖に及ぼす影響
前記の結果は、UCPの過発現によってHIF−1αが安定化されて、VEGFの発現を促進させることができることを提示した。VEGFは血管生成を促進させる因子なので、UCP遺伝子が虚血性疾患を治療するのに有用な遺伝子なのかを調べるためにUCPを過発現した細胞培養液にVEGF量が増加されているのかどうか、増加しているのならUCP過発現細胞培養液が果たして対照群と比較してHUVEC(human umbilical vascular endothelial cell、Cambrex,米国)の増殖を促進させることができるかどうかを調査した。
【0150】
具体的に、HeLa細胞株にAd.F−UCP(50,200MOI)、Ad.GFP(200MOI)を各々感染あるいは感染させない細胞の培養上澄み液(Serum free media,Opti−MEM,Invitrogen)を48時間後に集めた。VEGFを検出するELISAキット(TiterZyme EIA kit、Assay designs,米国)を使用して、この上澄み液に分泌したVEGFの存在を確認した。その結果、UCPを過発現させた細胞培養液中にVEGFが、対照群と比較して3倍多く存在していることが分かった(図47a)。この上澄み液中に存在するVEGFが血管生成を促進することができる生物学的活性を有しているかどうかを下記のように調査した。HeLa細胞株にAd.F−UCP、Ad.GFPを各々200MOIずつ感染あるいは感染させない細胞の培養上澄み液(Serum free media,Opti−MEM,Invitrogen)を形質導入48時間後に集めた。これを96ウエルプレートに(3×103/well)に用意したHUVEC細胞に処理して、時間による細胞増殖変化をWST−1法で測定した。その結果、UCP発現群は対照群と比較して、HUVEC細胞の増殖速度が約2倍増加した(図47b)。この結果は、UCPの発現の増加を誘導して血管形成を促進させることができるということを示していて、虚血性疾患の治療にUCPの活用が可能であることを提示している。
【産業上の利用可能性】
【0151】
前記で詳しくみたように、UCP発現が増加すると癌抑制タンパク質であるVHLにユビキチン化が起こりプロテオゾームによってVHLが分解され、それによってHIF−1αが安定化されて活性がある血管生成促進因子(VEGF)の増加が誘導されることが分かった。したがって、癌細胞でのUCP活性の抑制またはUCPの欠失は、VHLの細胞内濃度を増加させて、HIF−1αの分解を促進して癌の増殖及び転移を抑制するので、本発明のUCPの活性抑制剤は、抗癌剤に使用することができる。また、UCPの過発現はVHLを分解させて、それによってHIF−1αが安定化されて血管生成促進因子VEGFの増加が誘導されるので、弱い血管生成に起因して四肢切断手術を受けなければならないひどい四肢虚血(CLI)患者、手術が可能ではない冠状動脈疾患(CAD)患者、血流の供給が不実で生じる痴ほう症、筋萎縮性側索硬化症(ALS)、糖尿性神経障害、脳卒中患者を含む難治性疾患を有している人々の遺伝子治療に有用に使用することができる。
【0152】
以上、本発明内容の特定部分を詳しく記述したが、当業界の通常の知識を有した者において、このような具体的技術は単に好ましい実施様態であるだけであり、それによって本発明の範囲が制限されるものではないことは、明白だろう。したがって、本発明の実質的な範囲は、添付された請求項とそれらの等価物によって定義されるといえる。
【配列表フリーテキスト】
【0153】
配列番号1及び2は、Flag−UCP製作のための正方向及び逆方向プライマーである。
配列番号3及び4は、Flag−UCPm製作のための正方向及び逆方向プライマーである。
配列番号5は、UCPcDNA配列である。
配列番号6は、UCP−siRNAを発現するDNA配列である。
配列番号7は、control−siRNAを発現するDNA配列である。
配列番号8及び9は、UCPmRNA(272−290)のセンス及びアンチセンス配列である。
配列番号10及び11は、Control siRNAのセンス及びアンチセンス配列である。
配列番号12は、F−UCP(Silent Mutation)配列である。
配列番号13及び14は、Flag/UCP確認用プライマー配列である。
配列番号15及び16は、GFP確認用プライマー配列である。
配列番号17は、GFP−siRNAを発現するDNA配列である。
配列番号18は、HIF2 alpha−siRNAを発現するDNA配列である。
【技術分野】
【0001】
本発明は、E2EPFUCP−VHL相互作用及びその用途に関するもので、より詳細には、UCPの活性調節を通じてVHLの活性または発現量を増加させたり減少させたりすることで、癌細胞の増殖または転移を阻害したり血管の生成を増加させたりする方法に関するものである。UCPの活性抑制は、UCPのmRNAに相補的に結合する小さな干渉RNA(RNAi)、アンチセンスオリゴヌクレオチド、ポリヌクレオチド;ペプチド、ペプチドミメティックス、抗体;および低分子化合物からなる群より選択されたUCPの活性抑制剤を通じてなされる。同時に、血管生成増加は、遺伝子伝達体によってUCP遺伝子が過発現して、細胞内VHL濃度の減少させ、HIF−1αの安定化による血管生成因子(VEGF)の発現促進する、HIF−1αの安定化を誘導することによりなされる。
【背景技術】
【0002】
E2EPF−UCP(E2 Endemic pemphigus foliaceus ubiqitin carrier protein)は、ヒトの角質細胞から最初に分離され、E2ユビキチン結合酵素群(ubiquitin conjugating enzyme family)に属するタンパク質で、試験管内でE3ユビキチンリガーゼのE2ユビキチン伝達体(ubiquitin carrier)タンパク質に機能したり、UCP単独でE3ユビキチンリガーゼ活性を示したりするタンパク質で、自己/多重ユビキチン化(auto/multiubiquitination)を起こすことが知られている(Liu Z.等,JBC,1992年,第267巻,15829−15835頁;Liu Z.等,JBC,1996年,第271巻,2817−2822頁;Baboshina OV and Haas AL.,JBC,1996年,第271巻,2823−2831頁)。また、UCPの塩基配列は、乳癌の予後因子として報告され(Mutter GL and Baak JPA.,J Clin Pathol.,2005年,第58(1)巻,1−6頁;米国特許6703204号)、卵巣癌を含む各種癌組織で正常組織と比較して約5倍程度過発現していることが知られている(Welsh JB等,PNAS USA,2001年,第98巻,1176−81頁;Wagner KW,Oncogene,2004年,第23巻,6621−6629頁)。しかし、UCPの特異的な基質、細胞内機能及び癌発生、進行、転移、血管生成との相関性は解明されていない。
【0003】
癌抑制遺伝子であるVHL(von Hippel−Lindau)の変異は、腎臓癌、中枢神経系及び網膜の血管芽細胞腫(hemangioblastoma)の発生と密接に連携している(Kaelin WG Jr.,Nat Rev Cancer,2002年,第2巻,673−682頁;Curr Opi Gen Dev,2003年,第13巻,56−60頁;Trends Mol Med,2004年,第10巻,146−149頁;Trends Mol Med,2004年,第10巻,466−472頁)。癌細胞にVHLを過発現させると、癌細胞の成長が阻害される(Gene Ther,2003年,第10巻,2081−2089頁)。VHLタンパク質は、Elongin B及びC、Rbx1、Cullin2とともに多重複合体(multiple complex)を成して、E3ユビキチンリガーゼ活性を示す(Nat Rev Cancer,2002年,第2巻,673−682頁;Curr Opi Gen Dev,2003年,第13巻,56−60頁;Trends Mol Med,2004年,第10巻,146−149頁;Trends Mol Med,2004年,第10巻,466−472頁)。ここで、VHLは基質タンパク質を認知する機能を遂行する(Nat Rev Cancer,2002年,第2巻,673−682頁;Curr Opi Gen Dev,2003年,第13巻,56−60頁;Trends Mol Med,2004年,第10巻,146−149頁;Trends Mol Med,2004年,第10巻,466−472頁)。VHLE3ユビキチンリガーゼの代表的な基質は、HIF1α及びHIF2αであり、これらは酸素が存在する場合プロリン水酸化酵素(proline hydroxylase)によって水酸化(hydroxylation)され、水産化されたHIFαはVHLと結合した後、VHLE3ユビキチンリガーゼによってユビキチン化(ubiquitylation)され、26Sプロテアゾームによって分解される(Nat Rev Cancer,2002年,第2巻,673−682頁;Curr Opi Gen Dev,2003年,第13巻,56−60頁;Trends Mol Med,2004年,第10巻,146−149頁;Trends Mol Med,2004年,第10巻,466−472頁)。また、HIF1αあるいはHIF2αは、HIF1βと結合して、HIF1あるいはHIF2転写調節因子として作用して酸素濃度による細胞の恒常性を維持するが、HIF1αあるいはHIF2αは低酸素条件で安定化して(HIFα等のプロリン水酸化が起きず、VHLE3ユビキチンリガーゼによって分解されないからである)、それらによって転写が活性化される遺伝子は、VEGF、アンジオポイエチン2、エリスロポイエチン、GLUT1等のような遺伝子である(Nat Med,2003年,第9巻,677−684頁)。VEGFは、血管生成に重要な細胞成長因子である(Nat,1992年,第359巻,843−845頁;Nat,1992年,第359巻,845−848頁)。癌細胞は、血管を通じた酸素と営養分の供給なしには増殖することができないので、HIF−VEGF経路は癌の増殖、転移及び血管生成に関与して(PNAS USA,1997年,第94巻,8104−8109頁;Can Res,2000年,第60巻,4010−4015頁)、HIF阻害剤及びVEGFの経路を遮断する物質は、抗癌剤として開発されていて(Ophthalmology,2002年,第109巻,1745−1751頁)、一部は実際に実用化(例,Avastin)されている(Proc Am Soc Clin Oncol,2002年,第21巻,15頁)。
【0004】
前記のようにVEGFの活性を抑制する物質で抗癌剤を開発することとは反対に、VEGFの活性を増加させて虚血性疾患(ischemic diseases)など血管疾患を治療する研究も活発に進行中である。虚血性疾患は、血液の流れが塞がれて起きる心血管疾患を含み、虚血性心筋梗塞(myocardial ischemia)及び虚血性末梢血管疾患(peripheral vascular disease)がこれに該当します。詰まった血液の流れを円滑にするためにVEGF遺伝子など新しい血管を誘導する遺伝子が、前記虚血性疾患治療に使用されていて(Yla−Herttuala S and Alitalo K.Nat Med.,2003年,第9(6)巻,694−701頁;Khan TA等,Gene Ther.,2003年,第10(4)巻,285−91頁)、VEGFは、動物モデルで新しい血管生成を誘導することが確認された(Leung DW等,Science.1989年,第8;246(4935)巻,1306−9頁;Dvorak HF等,Am J Pathol.,1995年,第146(5)巻,1029−39頁)。また、VEGFを導入したアデノウイルス遺伝子伝達体(Ad.VEGF)の効能が、虚血性心筋及び筋肉細胞モデルを対象に実験された結果、血管が大きく増加することが確認され(Mkinen K等,Mol.Ther.2002年,第6巻,127−133頁)、モデル動物で4週間VEGF発現を誘導した時に生成された血管は、その後、またVEGF発現を誘導しなくても消失しないで、組織の機能も向上することが観察された(Dor Y等,EMBO J.2002年,第21巻,1939−1947頁)。VEGFが導入されたアデノウイルスベクターでは、心臓冠状動脈閉塞症及び末梢血管不失(閉塞)症の遺伝子治療のための第1〜3相臨床実験が遂行されていて(Maekimen K等,Mol Ther,2002年,第6巻,127−133頁;Stewart DJ等,Circulation,2002年,第106巻,23−26頁;Rajagopalan S等,J Am Coll Cardil,2003年,第41巻,1604頁)、HIF1αが導入されたアデノウイルスベクターでは、心筋虚血の遺伝子治療のための第1相臨床試験が実施されている(Vincent KA等,Circulation,2000年,第102巻,2255−2261頁)。前記のように、HIF−1α及びVEGF遺伝子を使用した虚血性疾患の遺伝子治療の臨床試験が実施されているが、UCPを使用してHIF−1αを安定化させてVEGF遺伝子発現を促進する血管生成促進実験に対しては報告されたことがない。
【0005】
癌生成及び転移に関与する遺伝子の発現を抑制する方法に関する特許では、細胞にペプチドまたはその機能的類似体を提供して癌を治療する内容を記載した国際公開特許WO2003/029292号、VEGFに結合して腫瘍成長を抑制する核酸リガンドに関する内容を記載した国際公開特許WO1998/18480号、抗−VEGF抗体を使用してVEGFの作用を抑制する内容を記載した国際公開特許WO98/45331号等がある。しかし、前記の方法は、効率の面で限界があるため、より効果的な方法が求められている。大韓民国公開特許第2005−0012082号は、siRNAを使用して老化細胞の機能を回復する方法を記載していて、国際公開特許WO2003/006477号とWO2004/015107号は、siRNAを使用して遺伝子を不活性化させる内容を記載しているが、siRNAの具体的な抗癌活性に関しては記載していない。
【0006】
以上のことに鑑みて、本発明者等は、UCPがVHLに特異的に結合して、UCPの過発現が癌抑制タンパク質であるVHLのユビキチン・プロテアーゼ媒介タンパク質分解(ubiquitin−mediated proteasomal degradation)を起こし、それによるHIF−1αの安定化とVEGFの発現が増加されることを実験的に立証した。さらに、UCPの発現を抑制するsiRNAを使用して癌細胞の成長、浸透過程でUCPの機能を解明して、マウスモデルを通じて前記UCP発現抑制方法が抗癌効果及び癌転移抑制効果を示すことを確認した。また一方で、UCPがVEGFを含む血管生成因子(angiogenic factor)の発現を増加させ、UCPを過発現させた細胞培養液にVEGF量が増加されていてこの培養液がHUVEC(human umbilical vascular endothelial cell)の増殖を促進して、虚血性血管疾患の遺伝子治療に有用に使用され得ることを確認した。
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、E2EPFUCP(ubiquitin carrier protein)の機能と癌発生、進行及び転移過程、血管生成での相関性を解明して、UCP活性を減少させることで癌細胞の増殖及び転移を有意に阻害する方法を提供することである。
【0008】
また、UCPの活性を増加させて、血管生成因子である活性があるVEGFの発現を誘導して、虚血性疾患を治療する方法を提供することである。
【課題を解決するための手段】
【0009】
前記目的を達成するために、本発明は薬学的有効量のUCPの活性抑制剤を個体に投与する工程を含み、UCPの活性抑制またはUCPの発現量現象を通じてVHL(von Hippel−Lindau)の活性または発現量を増加させて、HIFの安定性を減少させ、VEGFの発現を抑制する方法を提供する。
【0010】
また、本発明は、合成UCP−siRNAオリゴヌクレオチド、UCP−siRNA発現ベクター及びそれを製造する方法を提供する。
【0011】
また、本発明は、UCP活性抑制剤を有効成分として含む抗癌剤を提供する。
【0012】
また、本発明は、UCPの活性増加を通じてVHLの活性または発現量を減少させてHIFの安定性を増加させ、VEGFの発現を促進する方法を提供する。
【0013】
また、本発明は、UCPの活性増加剤、UCP発現ベクターまたはUCPタンパク質を有効成分として含むVEGF発現促進剤を提供する。
【0014】
また、本発明は、UCPの活性増加剤、UCP発現ベクターまたはUCPタンパク質を有効成分として含む新生血管促進剤を提供する。
【0015】
また、UCP発現または活性または発現量調節剤をスクリーニングする方法及びスクリーニングに使用する細胞株を提供する。
【0016】
同時に、本発明は、癌患者の診断試料からUCPの発現程度を測定して、癌の診断および予後評価方法とそのための診断キットを提供する。
【0017】
以下、本発明を詳しく説明する。
【0018】
1.本発明は、UCPの活性減少を通じてVHLの活性または発現量を増加させてHIFの安定性を減少させ、VEGFの発現を抑制する方法を提供する。
【0019】
本発明者等は、UCPがVHL、HIF−1α及びVEGFとどのような連関性を有するのかを観察した。
【0020】
まず、UCPがVHLと結合するだけでなく(図4ないし図7)VHLと複合体をなすElongin B、Elongin C、Rbx1及びCullin 2とは結合しないで、VHLと特異的に結合することを確認した(図7及び図8b参照)。UCP存在下でVHL、HIF−1α及びHIF−1αの標的分子であるVEGF mRNAの発現増減の有無を調査した結果、UCPが過発現される場合、VHL、HIF−1αのmRNA発現量には変化がなく、VEGF mRNAの発現量は増加したが(図11参照)、これは、UCPがVHLとHIF−1αの翻訳後(post−translation)工程に作用してVHLタンパク質量を減少させ、それによってVHLによるHIF−1αの分解減少及び細胞内HIF−1αタンパク質濃度増加で、VEGFの転写が活性化したことを示す。HIF−1αの影響を受けるHRE(hypoxia response element)−lucを使用したレポーター分析の結果、低酸素と正常酸素条件すべてでUCP濃度に依存的にHRE−lucの活性が増加すること、すなわち、HIF−1αが安定化されることを確認した(図10及び図15b参照)。
【0021】
以上で確認されたUCPによるVHLの細胞内濃度減少が、ユビキチン媒介タンパク質分解(ubiquitin−mediated proteolysis)によることなのかどうかを確認するために、VHLがUCPによってユビキチン化になるかどうかを細胞内および細胞外で調査した。UCP変異体を製作して試験管内で自動ユビキチン分析を通じてUCP活性が消失したことを確認し(図14参照)、UCPによるVHLの細胞内濃度減少がUCP酵素活性依存的であることを確認した(図12参照)。UCPのE3ユビキチンリガーゼ活性によってVHLが多重ユビキチン化されることを観察した(図13、14、16及び17参照)。前記の結果は、UCPがVHLのユビキチン媒介タンパク質分解を誘導することを意味する。また、UCPはE2ユビキチン伝達機能及びE3ユビキチンリガーゼ活性を一緒に有している。
【0022】
すなわち、本発明者等は、UCPがHIF1α及びHIF2αをユビキチン化および分解するVHLE3ユビキチンリガーゼ複合体の一構成成分で、VHLタンパク質を特異的にユビキチン化および分解するE3ユビキチンリガーゼであることを明らかにして(図9ないし図14、図16及び図17参照)、UCPが過発現されるとVHLタンパク質分解を誘導し(図9ないし図14参照)、HIF1α及びHIF2αの安定性を増加させることにより(図9ないし図14及び図41ないし図45参照)、HIF1α及びHIF2αによって調節される血管生成因子であるVEGF(vescular endothelial growth factor)の発現を増加させるという事実を確認した(図11及び図24参照)。また、UCPの活性欠失は、VHLの細胞内濃度を増加させてHIFの安定性を減少させ、癌細胞の増殖及び転移を抑制することを確認した(図23ないし図29、図32ないし図39及び図41ないし図45参照)。
【0023】
UCPの活性抑制は、UCP遺伝子転写抑制剤、転写されたUCPmRNAの翻訳抑制剤、またはUCPタンパク質の機能抑制材を使用して成り立つ。
【0024】
UCPの活性抑制剤は、UCPのmRNAに相補的に結合するアンチセンスオリゴヌクレオチド、UCP遺伝子に特異的な小さな干渉RNA、活性がないUCP類似タンパク質またはその断片、UCPタンパク質に結合するペプチド、UCPに特異的な抗体、UCPのmRNAに転写または翻訳を抑制する化合物、またはUCPの機能を抑制する化合物であり得る。
【0025】
UCPタンパク質の機能抑制剤は、UCPの酵素活性あるいはUCP−VHLタンパク質結合を遮断する低分子化合物、ペプチド、またはタンパク質であり得る。
【0026】
本発明で転写抑制剤は、UCP転写を抑制するタンパク質または化合物であり得、それらの調節作用は、UCPプロモーターに結合する転写因子または、エンハンサー(enhancer)によって媒介される。
【0027】
mRNAの翻訳抑制剤は、低分子化合物、アンチセンス核酸配列またはRNAiテクニックを使用して製造されたRNA、siRNAなどを使用できる。
【0028】
これを具体的に下記に詳しく記載する。
【0029】
1)RNAi
RNA干渉(RNAi)は、UCP遺伝子に対応する二本鎖RNA(dsRNA)を細胞または有機体に導入することで、対応するmRNAの分解が起きる転写後遺伝子サイレンシングメカニズム(post−transcriptional gene silencing mechanism)である。前記RNAiは、遺伝子サイレンシングに特異性及び効率性を示すので、RNAレベルで標的遺伝子のノックアウト(knockout)または「ノックダウン(knockdown)」を作る非常に強力な方法である。RNAiは、ヒトの胚芽腎臓(embryonic kidney)及びHeLa細胞を含んだヒト細胞で成功的であることが確認された(Elbashir等,Nature May,2001年,第24;411(6836)巻,494−8頁)。
【0030】
遺伝子サイレンシングでのRNAi技術は、標準分子生物学方法を使用する。不活性化させる標的遺伝子の配列に対応するdsRNAは、標準方法、例えばT7 RNA重合酵素を使用した鋳型DNAの2本鎖同時転写によって生成することができる。RNAiに使用されるdsRNAの生成キットは、商業的に販売される製品(例えば、New England Biolabs,Inc.社の製品)を使用することができる。dsRNAまたはdsRNAを製造するように処理されたプラスミドのトランスフェクション方法は、従来公知の技術である。
【0031】
2)アンチセンス核酸配列
UCPをコードする核酸に対してアンチセンスである核酸分子を阻害剤に使用することができる。「アンチセンス」核酸は、UCPをコードする「センス」核酸に相補的な、例えば二本鎖cDNA分子のコード鎖に相補的やmRNA配列に相補的な核酸配列を含む。したがって、アンチセンス核酸は、センス核酸と水素結合を形成することができる。前記アンチセンス核酸は、全体UCPコード鎖または単にそれらの一部(例:コード領域)に相補的なことがある。前記アンチセンス核酸分子は、UCP mRNAの全体コード領域に相補的なことがあるが、UCP mRNAのコードまたは非コード領域の単に一部(例:翻訳開始部)にのみ、アンチセンスであるオリゴヌクレオチドがさらに好ましい。アンチセンスオリゴヌクレオチドは、例えば約5ないし50ヌクレオチドの長さであり得る。アンチセンス核酸は、公知の方法を使用した化学合成及び酵素結合反応を使用して構成することができる。化学合成法、例えば文献[Tetrahedron Lett.,1991年,第32巻,30005−30008頁]に記載しているように、アセトニトリルの中からテトラエチルチウラムジスルフィドで硫化させるホスホアミダート化学のような方法によって非常に容易に製造することができる。前記アンチセンス核酸の生成に使用することができる変形ヌクレオチドの例としては、5−フルオロウラシル、5−ブロモウラシル、5−クロロウラシル、5−ヨードウラシル、ハイポキサンチン、キサンチン、4−アセチルシトシン、5−(カルボキシヒドロキシルメチル)ウラシル、1−メチルイノシン、2,2−ジメチルグアニン、2−メチルアデニン、2−メチルグアニン、3−メチルシトシン、5−メチルシトシン、N6−アデニン、5−カルボキシルメチルアミノメチル−2−チオウリジン、3−(3−アミノ−3−N−2−カルボキシプロピル)ウラシル、5’−メトキシカルボキシメチルウラシル、5−メトキシウラシル、2−メチルチオ−N6−イソペンテニルアデニン、1−メチルグアニン、7−メチルグアニン、5−メチルアミノメチルウラシル、5−メトキシアミノメチル−2−チオウラシル、ベータ−D−マンノシルケオシン、2−チオウラシル、4−チオウラシル、5−メチルウラシル、ウラシル−5−オキシ酢酸メチルエステル、ウラシル−5−オキシ酢酸(v)、2,6−ジアミノプリン、5−メチル−2−チオウラシル、ウラシル−5−オキシ酢酸(v)、シュードウラシル、ケオシン、2−チオシトシン、5−カルボキシメチルアミノメチルウラシル、ジヒドロウラシル、ベータ−D−ガルラクトシルケオシン、イノシン、N6−イソペンテニルアデニル、5−メチル−2−チオウラシル、(acp3)w及びワイブトキソシンが挙げられる。必要によって、前記アンチセンス核酸は、発現ベクターを使用して生物学的に生成することができる。
【0032】
UCPタンパク質の機能を抑制する物質では、前記タンパク質に結合するペプチド、抗体、化合物及びペプチドミメティックスなどを使用することができる。
【0033】
1)ペプチドミメティックス(Peptide Mimetics)
UCPポリペプチドのタンパク質結合ドメインを抑制したミメティックス(例、ペプチドまたは非ペプチド性薬剤)を製作して、元来のUCPポリペプチドがVHLに結合することを抑制することができる(欧州特許出願EP 0412765号及びEP 0031080号)。
【0034】
非加水分解性ペプチド類似体の主要残基としては、β−ターン・ジペプチドコア(Nagai等,Tetrahedron Lett,1985年,第26巻,647頁)、ケトメチレンシュードペプチド類(Ewenson等,J Med Chem,1986年,第29巻,295頁;及びEwenson等,in Peptides:Structure and Function(Proceedings of the 9th American Peptide Symposium)Pierce Chemical Co.Rockland,IL,1985年)、アゼピン(Huffman等,in Peptides:Chemistry and Biology,G.R.Marshall ed.,ESCOM Publisher:Leiden,Netherlands,1988年)、ベンゾジアゼピン(Freidinger等,in Peptides;Chemistry and Biology,G.R.Marshall ed.,ESCOM Publisher:Leiden,Netherlands,1988年)、β−アミノアルコール(Gordon等,Biochem Biophys Res Commun,1985年,第126巻,419頁)及び置換ガンマーラクタム丸(Garvey等,in Peptides:Chemistry and Biology,G.R.Marshell ed.,ESCOM Publisher:Leiden,Netherlands,1988年)を使用して生成することができる。
【0035】
2.本発明は、UCP−siRNAオリゴマー、その発現ベクター及びそれを製造する方法を提供する。
【0036】
UCP−siRNAを含むプラスミド形態の発現ベクターは、H1プロモーター、UCP−siRNA及び転写終了配列である五つのT塩基(T5)で構成される。RNAは、UCPmRNA塩基配列内で選択される17ないし25merのセンス配列に相補的に結合されるアンチセンス配列で構成され配列番号6で記載することが好ましいが、これに限定されるものではない。
【0037】
本発明者等は、配列番号5で記載されるUCPのmRNAに相補的な配列であり、好ましくは配列番号5で記載されてUCPmRNA配列中615−633に該当する部分をH1プロモーターによって発現されるように、pSuperプラスミドベクターにクローニングして組換えベクターを製作した。細胞内で伝達及び発現を願う遺伝子を提供するアデノウイルス製作用pShuttleベクターに、前記で製作されたpSuperプラスミドベクターを制限酵素で処理してH1プロモーター、UCP−siRNA、転写終了配列である五つのT塩基(T5)まで含むアデノウイルス製作用UCP−siRNA発現ベクターを製作した。本発明でUCP−siRNAを発現させるためのベクターは、pSuperベクターやpShuttleベクターに制限されず、UCP−siRNAを発現させるためのプロモーターは、H1プロモーターに制限されない。例えば、U6プロモーター、CMVプロモーターなどの哺乳動物細胞で遺伝子発現を誘導することができる発現ベクターを使用することができる。前記発現ベクターを使用してアデノウイルスベクターを組換えした後、実施例2の方法でアデノウイルス粒子を作ってそれを細胞や個体に注入してsiRNAが発現されるようにした。アデノウイルスベクターのみならず、アデノ随伴ウイルス、レトロウイルス、ワクシニアウイルス、及び癌細胞溶解性ウイルスからなる群より選択されるウイルス性ベクターを使用することができる。
【0038】
3.本発明は、UCP活性抑制剤を有効成分として含む抗癌剤を提供する。
【0039】
本発明の組成物は、組成物総重量に対して前記有効成分を0.0001ないし50重量%で含む。
【0040】
本発明の組成物は、前記有効成分にさらに同一または類似の機能を示す有効成分を1種以上含むことができる。
【0041】
本発明の組成物は、投与のために前記記載した有効成分以外にさらに薬剤学的に許容可能な担体を1種以上含んで製造することができる。薬剤学的に許容可能な担体は、食塩水、滅菌水、リンゲル液、緩衝食塩水、デキストロース溶液、マルトデキストリン溶液、グリセロール、エチルアルコール、リポソーム及びそれら成分の中で1成分以上を混合して使用することができ、必要によって抗酸化剤、緩衝液、静菌剤など他の通常の添加剤を添加することができる。また希釈剤、分散剤、界面活性剤、結合剤及び滑剤を付加的に添加して水溶液、懸濁液、乳濁液などのような注射用剤形、丸薬、カプセル、顆粒または錠剤に製剤化することができ、標的器官に特異的に作用するように標的器官特異的抗体またはその他リガンドを前記担体と結合させて使用することができる。さらに当該技術分野の適正な方法でまたはレミングトンの文献(Remington's Pharmaceutical Science(最近版)、Mack Publishing Company、Easton PA)に開示されている方法を使用して各疾患によってまたは成分によって好ましく製剤化することができる。
【0042】
本発明の抗癌剤の投与方法は、特別にそれに制限されるものではないが、目的とする方法によって非経口投与(例えば静脈内、皮下、腹腔内または局所に適用)したり経口投与したりすることができ、非経口投与が好ましく、静脈内注射による投与がさらに好ましい。投与量は、患者の体重、年齢、性別、健康状態、食餌、投与時間、投与方法、排泄率及び疾患の重症度等によってその範囲が多様である。一日投与量は、化合物の場合、約0.1ないし100mg/kgで、好ましくは0.5ないし10mg/kgであり、一日一回ないし数回に分けて投与することがさらに好ましい。
【0043】
本発明のsiRNAまたはsiRNA発現ベクターをマウスに静脈内注射によって投与して毒性実験を遂行した結果、毒性試験による50%致死量(LD50)は、少なくとも1,000mg/kg以上の安全な物質であると判断される。
【0044】
本発明のUCP活性抑制剤を使用して増殖を抑制することができる癌細胞は、UCPが過発現されている癌細胞であり、好ましくは卵巣癌、胆道癌、肝癌、大腸癌、胃癌、乳癌、腎臓癌、前立腺癌及び皮膚癌細胞を含む。
【0045】
本発明者等は、UCPのmRNAに相補的に結合する小さな干渉RNA(UCP−siRNA)を製作してそれを癌細胞株に注入してUCPの発現を抑制した結果、UCP−siRNAによってUCPの発現が抑制されるとVHLの濃度が増加して(図23ないし図31及び図41ないし図45)、細胞の成長率が有意に減少し(図23ないし図29及び図41ないし図46)、浸透分析(invasion assay)で細胞株の転移能力の変化を測定した結果、細胞の浸透率が有意に減少したことが示された(図23ないし図29、図41ないし図45)。それとともに、腫瘍細胞をヌードマウスの皮下に注射して直径が約3mmの腫瘍が生成された時、UCP−siRNAをコードするアデノウイルスを注入した結果、腫瘍成長及び転移抑制効果が著しく示されることを確認した(図32ないし図39及び図41ないし図45)。
【0046】
それにより、UCPが癌の成長及び転移に重要な役割を遂行していて、UCPの発現を阻害することで癌の成長及び転移を抑制することができることを確認した。
【0047】
4.本発明は、UCPの活性増加を通じてVHLの活性または発現量を減少させて、HIFαの安定性を増加させ、VEGFの発現を促進する方法を提供する。
【0048】
前記のように、本発明のUCPが過発現されるとVHLタンパク質分解を誘導して(図9ないし図15参照)、VHLE3ユビキチンリガーゼの基質であるHIF1α及びHIF2αの安定性を増加させることで(図9ないし図15、図23ないし図39及び図41ないし図45参照)、HIF1α及びHIF2αによって調節される血管生成因子であるVEGFの発現を増加させる(図11及び図24参照)。発現したVEGFは、細胞培養液で検出され(図47a)、検出されたVEGFはHUVECの増殖を促進する(図47b)。したがって、UCPの活性を増加させることで活性があるVEGFの発現も増加させることができる。これは、UCPプロモーターに作用してUCP mRNAの発現を誘導する薬剤、UCPの発現を誘導するプラスミドまたはウイルス遺伝子伝達体を通じて行われる。
【0049】
5.本発明は、UCPの活性増加剤、UCP遺伝子が導入された発現ベクターまたはUCPタンパク質を有効成分として含むVEGF発現促進剤を提供する。
【0050】
UCP活性増加剤は、UCPプロモーターに作用してUCP mRNAの発現を誘導する薬剤(例:大韓民国特許公開2003−0013795号、菌株から抽出した物質をプロモーター発現誘導剤に使用)、UCPの発現を誘導するプラスミド(例:大韓民国特許10−0375890号、誘導性ジンクフィンガー発現ベクター及びそれを使用した標的遺伝子発現の人為的調節方法)または、ウイルス遺伝子伝達体(例:大韓民国特許公開 2001−0006460号、細胞自滅死誘導タンパク質を発現させる遺伝子伝達運搬体)を含む。
【0051】
前記のように、UCP遺伝子が過発現されるとVEGFの発現を促進するので、UCP過発現と類似の効果を示すことができる方法、すなわちUCPタンパク質を直接投入したりUCP発現プラスミドを投入したりして個体内で発現されるようにすることで、VEGF発現を促進することができる。
【0052】
6.本発明は、UCPの活性増加剤、UCP遺伝子が導入された発現ベクターまたはUCPタンパク質を有効成分として含む血管新生促進剤を提供する。本発明のUCPは、過発現されるとHIF−1α及びCD31タンパク質量を増加させて(図34)VEGFの発現を増加させて(図11及び図24参照)、ヒトの血管細胞の増殖を促進させた(図47b参照)。CD31は、VEGFのような因子によって血管生成が増加される場合に示される血管細胞のマーカーである。
【0053】
VEGFの発現増加が虚血性血管疾患(ischemic vascular disease)の治療に効果的であるという事実はよく知られているので(Yla−Herttuala S and Alitalo K.Nat Med.,2003年,第9(6)巻 、694−701頁;Khan TA等,Gene Ther.2003年,第10(4)巻,285−91頁)、VEGFの発現を増加させるUCP遺伝子が導入された発現ベクターを有効成分として含む血管新生促進剤は、血管きち虚弱であることに起因して四肢切断手術を受けなければならないひどい四肢虚血(critical limb ischemia,CLI)患者等、手術が可能ではない冠状動脈疾患(coronary artery disease,CAD)患者等で起きる血管系疾患を治療するのに使用され得るだろう。また、UCPは血流の供給が不足して生じる痴ほう症、筋萎縮性側索硬化症(amyotrophic lateral sclerosis,ALS)、糖尿性神経障害(diabetic neuropathy)、脳卒中(stroke)患者を含む難治性疾患を有している人々の遺伝子治療に有用に使用することができる。
【0054】
7.本発明は、
1)VHLを発現する細胞株を使用してUCPの活性を阻害する物質を捜す工程、あるいは
2)UCPの転写調節に関与する転写因子を捜す工程、
3)前記転写因子を調節する物質を選抜(screening)する工程、及び
4)前記物質がUCP遺伝子の発現を調節する活性を示すかどうかを確認する工程からなるUCP活性調節剤(活性抑制剤あるいは増加剤)をスクリーニングする方法を提供する。
【0055】
具体的に、
1)UCP及びVHL発現細胞株に被検化合物を処理する工程、
2)工程1の細胞株のVHL活性を測定する工程、及び
3)工程2の結果と対照群の結果を比較してVHL活性を有意に変化させる化合物を選別する工程を含むUCP活性調節剤をスクリーニングする方法。
【0056】
1)UCP及びVHL発現細胞株に被検化合物を処理する工程、
2)工程1の細胞株のユビキチン化されたVHLの量を測定する工程、及び
3)工程2の結果と対照群の結果を比較してユビキチン化されたVHLの量を有意に変化させる化合物を選別する工程を含むUCP活性調節剤をスクリーニングする方法。
【0057】
1)UCP及びHIF発現細胞株に被検化合物を処理する工程、
2)工程1の細胞株のHIF活性を測定する工程、及び
3)工程2の結果と対照群の結果を比較してHIF活性を有意に変化させる化合物を選別する工程を含むUCP活性調節剤をスクリーニングする方法。及び、
【0058】
1)UCP及びHIF発現細胞株に被検化合物を処理する工程、
2)工程1の細胞株のユビキチン化されたHIFの量を測定する工程、及び
3)工程2の結果と対照群の結果を比較してユビキチン化されたHIFの量を有意に変化させる化合物を選別する工程を含むUCP活性調節剤をスクリーニングする方法を提供する。
【0059】
UCPの発現抑制によるVHLの活性回復は、癌細胞株の増殖速度を抑制した(図45、図35、図42、図45、図46a及び図46c参照)。
【0060】
前記スクリーニング方法でUCP活性調節候補物質が、UCP遺伝子の発現またはタンパク質活性を抑制あるいは増加するかどうかを決定する工程で、RNA−RNA、DNA−DNA、DNA−RNA、RNA−タンパク質、RNA−化合物、DNA−タンパク質、DNA−化合物、タンパク質−タンパク質またはタンパク質−化合物間の反応有無を確認するのに使用される通常的な方法を使用することができる。
【0061】
例えば、タンパク質−化合物、タンパク質−タンパク質、RNA−RNA、DNA−DNA、DNA−RNA、RNA−タンパク質、RNA−化合物、DNA−タンパク質、DNA−化合物間の反応確認は、生体外(in vitro)で前記遺伝子と活性調節候補物質との間の結合有無を確認するための混成化試験、哺乳類細胞と抑制候補物質とを反応させた後、ノーザンブロット分析、反定量的・定量的PCR、リアルタイムPCRなどを通じたUCP遺伝子の発現率測定方法または、UCP遺伝子にリポーター遺伝子を連結させて細胞内に導入した後、抑制候補物質と反応させてリポーター遺伝子の発現率を測定する方法などを使用することができる。
【0062】
また、タンパク質−タンパク質、タンパク質−化合物間の反応確認は、生体内・生体外でUCPタンパク質と活性調節候補物質を反応させた後、活性を測定する方法、VHLあるいはGFP−VHL発現する細胞株を使用して細胞の増殖を測定する方法、酵母二重混成法(yeast two−hybrid)、UCPタンパク質に結合するファージディスプレイペプチドクローン(phage−displayed peptide clone)の検索、天然物及び化学物質ライブラリーなどを使用したHTS(high throughput screening)、細胞基盤スクリーニング(cell−based screening)または、DNAアレイ(DNA array)を使用するスクリーニング法などを使用することができる。
【0063】
前記スクリーニング方法で、UCP発現あるいは活性調節候補物質は、通常的な選定方式にしたがってUCP酵素活性あるいは発現抑制あるいは増加の可能性を有していることが推定されたり、または無作為的に選定された個別的な核酸、タンパク質、その他抽出物または天然物などを挙げられる。
【0064】
本発明のスクリーニング方法を通じて修得した、遺伝子発現あるいはタンパク質安定性を抑制あるいは増加させる活性を示す候補物質は、抗癌剤または新生血管促進剤候補物質になることができる。このような候補物質は、以後の抗癌剤または新生血管誘導剤開発過程で先導物質として作用するようになり、先導物質がUCP遺伝子またはそれから発現されるタンパク質の機能抑制あるいは増加効果を示すようにその構造を変形させて最適化することで、新しい抗癌剤または新生血管促進剤を開発することができる。
【0065】
8.本発明は、患者の診断試料でUCPの発現程度を測定して癌の診断および予後評価方法とそのための診断キットを提供する。
【0066】
1)患者の診断試料でUCPの発現を測定する工程を含む癌診断方法を提供する。
【0067】
前記診断試料から正常以上に上昇したUCPの発現検出は、患者が癌にかかったことを意味する。前記診断方法でUCPの発現を測定する工程は、前記スクリーニング方法でUCP遺伝子の発現またはタンパク質活性を決定する工程と同一な方法を使用することができる。
【0068】
2)癌で治療を受けたり現在受けている個体の診断試料でUCPの発現を測定したりする工程を含む癌治療法の効果を評価する方法を提供する。
【0069】
前記診断試料で正常UCPの発現検出は、癌治療が成功的だったことを意味して、診断試料からの正常以上に上昇したUCPの検出は、治療を継続しなければならないということを意味する。
【0070】
3)個体の診断試料でUCPの発現を測定する工程を含む癌にかかった個体の予後を評価する方法を提供する。
【0071】
前記工程で正常UCPの発現検出は予後が良いということを意味し、診断試料での正常以上に上昇したUCPの検出は予後が良くないということを意味する。
【0072】
4)本発明の癌診断キットは、UCPと反応する一つ以上の物質及び反応生成物検出用試薬とそれに対する指示事項を付加的に含むことができる。例えば、UCPと反応する一つ以上の物質は、UCPのRNAまたはDNAに相補的なRNAまたはDNA及びUCPタンパク質に結合する抗体であり得、反応生成物検出用試薬は、核酸またはタンパク質標識及び発色試薬であり得る。
【図面の簡単な説明】
【0073】
【図1】プラスミド形態のUCP−siRNA発現ベクターの概路図とUCP−siRNA配列である。
【図2】Ad.F−UCPベクター製作過程を示した模式図である。
【図3】Ad.UCP−siRNAベクター製作過程を示した模式図である。
【図4】UCPがVHLと細胞内でお互いに特異的に結合していることを示すウエスタンブロット写真である。
【図5】UCPがVHLと細胞内でお互いに特異的に結合していることを示すウエスタンブロット写真である。
【図6】UCPがVHLと細胞内でお互いに特異的に結合していることを示すウエスタンブロット写真である。
【図7】VHLがElongin B、C、Rbx1とともにVHLE3ユビキチンリガーゼ活性を示す複合体を形成するが、UCPはVHLE3リガーゼ複合体に存在しないで、VHLと独立的な複合体を形成していることを示すウエスタンブロット写真である。
【図8】図8aは、CKAI細胞株にUCPを過発現させた時VHLタンパク質が分解されることで示してくれるウエスタンブロット写真である。図8bは、CAKI細胞株にUCPを過発現させた時VHLと結合複合体を成すことを示したウエスタンブロット写真である。
【図9】UCPを過発現させた時、細胞内VHLタンパク質が26Sプロテアゾーム(proteasome)によって分解されることによってHIF−1αが安定化されることを示すウエスタンブロット写真である。
【図10】低酸素反応要素(hypoxia response element, HRE)の調節下にある時、リポーター遺伝子の活性を調査したもので、UCPを過発現させた細胞でHIF−1αタンパク質増加によってHRE−リポーターの活性が増加することを示すグラフである。
【図11】UCPがVHL、HIF−1αのmRNA発現量には影響を与えないが、HIF−1αタンパク質の安定化を通じて血管生成促進因子(vascular endothelial growth factor,VEGF)の発現を増加させることを示すノーザンブロット写真である。
【図12】VHLタンパク質の減少が、UCP酵素活性依存的に現れるということを示したウエスタンブロット写真である。
【図13】培養細胞と試験管内でUCPによるVHLの多重ユビキチン化(multiubiquitination)を示したウエスタンブロット写真である。
【図14】培養細胞と試験管内でUCPによるVHLの多重ユビキチン化(multiubiquitination)を示したウエスタンブロット写真である。
【図15】図15aは、UCPを過発現させた細胞を正常酸素及び低酸素条件で培養した時、UCP発現量に依存的にVHLタンパク質は減少してHIF−1αタンパク質は増加することを示すウエスタンブロット写真である。図15bは、図15aの条件で低酸素反応要素(HRE)の調節下にある時、リポーター遺伝子の活性を調査したもので、UCPを過発現させた細胞でHIF−1αタンパク質増加によってHRE−リポーターの活性が増加することを示すグラフである。
【図16】野生型UCPは、酵素活性が存在するが、95番目システインがセリンに置換された突然変異UCPmは、酵素活性がないということを示すウエスタンブロット写真である。
【図17】野生型UCPは、VHLを試験管内で多重ユビキチン化(multiubiquitination)させるが、突然変異UCPmは影響を与えることができないということを示すウエスタンブロット写真である。
【図18】UCPがVHLタンパク質のみを特異的に分解させるということを示すウエスタンブロット写真である。
【図19】UCPがVHLタンパク質のみを特異的に分解させるということを示すウエスタンブロット写真である。
【図20】アデノウイルス遺伝子伝達体(Ad.F−UCP)を使用してUCPをマウスの肝に伝達した時、VHLタンパク質が減少して、HIF−1αタンパク質が増加することを示すウエスタンブロット写真である。
【図21】図20の実験条件で免疫組織化学染色したマウスの肝組織を示す写真である。
【図22】ヒトの肝臓癌、転移性胆道癌、大腸癌、転移性大腸癌、乳癌細胞でUCPとHIF−1αが共に高い発現を見せて、VHLの発現は抑制されていることを示す免疫組織化学染色法で示した写真である。
【図23】各種癌細胞株でUCPとVHLタンパク質の発現量が逆比例することを示すウエスタンブロット写真である。
【図24】UCP発現が低くVHLが過発現されたCAKI腎臓癌細胞にAd.F−UCPを使用してUCPを過発現させた時、VHLタンパク質の発現が消失してHIF−1αタンパク質発現量が増加されて、それによってVEGFの発現が増加することを示すウエスタンブロット写真及びノーザンブロット写真である。
【図25】CAKI腎臓癌細胞にAd.F−UCPを使用してUCPを過発現させた場合、癌細胞の増殖が促進されることを示すグラフである。
【図26】CAKI腎臓癌細胞にUCPを過発現させた場合、癌細胞の浸透が増加することを示すグラフである。
【図27】黒色腫細胞株C8161でUCP−siRNAを発現するアデノウイルスベクターを使用してUCPタンパク質の発現を遮断した場合、VHLタンパク質の発現が増加して、HIF−1αタンパク質発現量が減少することを示すウエスタンブロット写真である。
【図28】Ad.UCP−siRNAを使用してUCPタンパク質の発現を遮断した場合、ヒトの黒色腫癌細胞(C8161)の増殖が阻害されることを示すグラフである。
【図29】UCPタンパク質の発現を遮断した時、ヒトの黒色腫癌細胞(C8161)の浸透が阻害されることを示すグラフである。
【図30】胆道癌細胞株Ck−K1でUCP−siRNAを発現するアデノウイルスベクターを使用してUCPタンパク質の発現を遮断した場合、VHLタンパク質の発現が増加して、HIF−1αタンパク質発現量が減少することを示すウエスタンブロット写真である。
【図31】図31aは、Ad.UCP−siRNAで生成されるUCP−siRNAと異なるUCPmRNAを標的とする二次UCP−siRNAもまたUCPの発現を抑制することができるということを示したウエスタンブロット写真である。図31bは、突然変異UCPを使用して前記製作されたUCP−siRNAが、UCPの核酸配列を特異的に認識してUCP発現を抑制するということを示すウエスタンブロット写真である。
【図32】ヒトの黒色腫癌細胞(C8161)にAd.F−UCPを導入した後、癌細胞をヌードマウスの皮下に移植すると、癌細胞の増殖が促進されることを示すグラフである。
【図33】皮下移植21日後にマウスから摘出した癌塊(tumor nodule)を示す写真である。
【図34】摘出した癌塊の組織セクションを作った後、F−UCP、HIF−1α及び血管細胞のマーカーであるCD31の発現を免疫組織化学染色法で示した写真である。
【図35】ヒトの黒色腫癌細胞(C8161)をヌードマウスの皮下に移植して癌塊を形成させた後、UCPの発現を遮断するAd.UCP−siRNAアデノウイルスを注入した後、癌細胞の成長が有意に阻害されることを示すグラフである。
【図36】ヒトの黒色腫癌細胞をヌードマウスの皮下に移植した後、Ad.F−UCPを癌組織に直接注射した後、癌転移でUCPの効果を検証したもので、UCPが過発現されると癌の肺転移が増加することを示すグラフである。
【図37】図36のマウスの肺に転移した黒色腫癌細胞を示す組織染色写真である。
【図38】ヒトの黒色腫癌細胞にAd.F−UCPあるいはAd.UCP−siRNAを導入した後、癌細胞をヌードマウスの尾静脈内に注射した後、癌転移でUCPの効果を検証したもので、UCPが過発現されると癌の肺転移が増加して、UCPタンパク質発現を遮断すると癌の肺転移が抑制されることを示すグラフ、及び移植した後4週後に摘出したマウスの肺組織を染色した写真である。
【図39】図38の試験でAd.UCP−siRNAによるUCP欠失がマウスの肺で黒色腫癌細胞の転移を抑制することを示したH&E染色写真である。
【図40】図40aは、図32ないし図34の実験でF−UCPとGFPを発現するアデノウイルスの遺伝体(genome)が、腫瘍細胞中に21日後にも存在するということを示すサザンブロット写真である。図40bは、図32ないし図34の実験でF−UCPとGFPを発現するアデノウイルスが、腫瘍細胞中に21日後にもF−UCP及びGFP発現を維持するということを示すRT−PCR写真である。
【図41】HA−VHL発現786−0腎臓細胞株を使用して、UCPがVHLを媒介してHIF−2αの量を調節することを示すウエスタンブロット写真である。
【図42】Ad.UCP−siRNAによってUCPの発現が抑制されてVHLの機能が回復すると、HA−VHL発現786−0細胞株の成長が抑制されることを示すグラフである。
【図43】Ad.HIF−2α−siRNAとAd.UCP−siRNAによってHIF−2αの発現が抑制されると、すべての786−0細胞株の浸透能が低下することを示すグラフである。
【図44】786−0細胞株で作ったマウス腫瘍モデルで、Ad.HIF−2α−siRNA処理群の場合にのみ癌の増殖が抑制されることを示すグラフである。
【図45】HA−VHL発現細胞株のマウス腫瘍モデルで、Ad.F−UCP処理群の場合には癌の増殖が早くなり、Ad.HIF−2α−siRNAとAd.UCP−siRNAの処理群では増殖速度が抑制されることを示すグラフである。
【図46】図46a及び図46cは、HA−VHLの発現が高い細胞株の増殖速度の変化を使用して、UCPを抑制する阻害剤を探索することができることを示すグラフである。図46bは、UCPの発現抑制によるGFP−VHLの発現増加を示すウエスタン写真である。
【図47】図47aは、UCP発現増加によって細胞培養液中にVEGFが増加することを示すグラフである。図47bは、図47aの条件で獲得した細胞培養液でHUVECを培養した時、UCP過発現細胞培養液がヒトの血管細胞(HUVEC)の増殖を促進するということを示すグラフである。
【発明を実施するための形態】
【0074】
以下、本発明を実施例によって詳しく説明する。
【0075】
但し、下記実施例は本発明を例示するだけのものであって、本発明の内容が下記実施例によって限定されるものではない。
【実施例】
【0076】
実施例1:細胞内でUCPとVHL間の相互作用検証
UCPとVHL間の相互作用検証のために次のような発現ベクターを製作して使用した。Flag−UCPは、ヒト遺伝体機能研究事業団(韓国バイオテクノロジー研究院)から提供を受けたUCP含有発現ベクター(pDESTtm27GST−UCP)を鋳型にして、PCR方法で得られた切片をNotI/BamHIでpCMV Tag1(Stratagene)にクローニングして製作した。PCR条件は、下記のとおりである。DNA重合酵素(pfu polymerase(Vent),New England Bioscience,米国)を使用してプライマー対(配列番号1:Sense:5’−tccgcggccgcatgaactccaacgtggagaa−3’、配列番号2:Antisense:5’−accggatccctacagccgccgcagcgccc−3’)と鋳型を94℃で4分間変性させて、94℃で1分、55℃で1分及び72℃で1分間30回反応させて、72℃で5分間伸長(extension)させて反応を終結した。GST−Rbx1、GST−Elongin BとGST−Elongin Cは、BamHI/NotIでpEBGベクターにクローニングし、GST−VHLは、BamHI/SpeIでpEBG ベクターにクローニングした。Flag−VHLは韓国バイオテクノロジー研究院のジョ・サヨン博士から提供受けて使用した。
【0077】
本発明に使用した抗体中のマウス抗UCP抗体は、本発明者等が直接製作して使用した。その過程を説明すると、pET28aベクターにUCPをBamHI/NotIにクローニングしてBL21大腸菌でタンパク質を合成した。His−Resinを使用して大腸菌からHis−UCPだけを純粋分離して、それをBalb/c(メス、6週齢)にFluidアジュバント(CHEMICON)とともに週1回ずつ総4回兔疫して血清を得て、プロテインA(SIGMA)で濃縮して、以下の実験に使用した。
【0078】
Flag−UCPを常に発現するHEK293細胞株(293−F−UCP)は、ネオマイシン分解遺伝子を含むFlag−UCP発現ベクター(pCMV Tag1−Flag−UCP)をカルシウムホスファート方法で細胞内に導入して、1mg/mlのネオマイシンが含まれたLDMEM(10%牛胎児血清、100μg/mlストレプトマイシン、100unit/mlペニシリン含有)で選択培養して得た細胞集落でFlag−UCP発現を確認して使用した。
【0079】
実施例1−1:過発現体系を使用したUCPとVHLの相互結合検証
過発現されたUCPと内因性VHL間の結合及び過発現されたVHLと内因性UCP間の結合有無は、HEK293T細胞株にFlag−UCP及びFlag−VHLを過発現させて、Flag−ゲルで免疫沈降反応を実施した後、内因性UCPとVHLの抗体としてウエスタンブロットを実施することで確認した。詳しく説明すると、HEK293T細胞株にFlag−UCPとFlag−VHL発現ベクターをカルシウムホスファート方法で各々細胞内に導入した。集める12時間前に10μMのMG132を処理して細胞を集めて−70℃で冷凍後、細胞破砕溶液(50mM Tris,0.5mM EDTA, 0.1%NP−40,0.5mM PMSF)で破砕した。そこにマウス抗Flag抗体(Sigma)が結合されているアガロースゲルを添加して免疫沈降反応を4℃で2時間実施した。それをSDS−試料緩衝液(62.5mM Tris,2%SDS,5%ベータ−メルカプトエタノール,10%グリセロール,0.01%ブロモフェノールブルー)と混合して95℃で5分間沸かした後、12.5%ポリアクリルアミド電気泳動を遂行した。分離したタンパク質をPVDF膜に移動させた後、膜を5%脱脂粉乳が含まれたPBST(0.05%Tween20を含んだリン酸緩衝溶液)で1時間ブロッキングして、マウス抗Flag抗体(Sigma)とマウス抗UCP抗体及びマウス抗VHL抗体(Pharmingen)として各々室温で一時間反応させた。反応後、残余抗体はPBSTで充分に洗浄してホースラディッシュペルオキシダーゼが標識されたウサギ抗マウス抗体で室温で一時間さらに反応させた後、ECL溶液で反応有無を確認した。併せて各群の細胞破砕液も一緒に前記方法のようにウエスタンブロットを実施した。その結果、Flag−UCPとVHLの結合及びFlag−VHLとUCP間の結合を確認することができた。
【0080】
実施例1−2:内因性UCPとVHL間の結合有無検証
内因性UCPとVHL間の結合有無を調べるために、VHLとUCPの発現が両方存在するHLK3及びCk−K1癌細胞株で実施した。5枚の100mm皿にHDMEM(4.5g/lグルコース、10%牛胎児血清、100μg/mlストレプトマイシン、100unit/mlペニシリン含有)で培養されたHLK3及びCk−K1癌細胞株を集めて−70℃で冷凍後、細胞破砕溶液(50mM Tris,0.5mM EDTA,0.1%NP−40,0.5mM PMSF)で破砕した。細胞破砕液にマウス抗VHL抗体あるいはマウス抗UCP抗体と対照群としてマウス兔疫グロブリンを各々10μgを添加して、プロテインAゲルとともに4℃で2時間免疫沈降反応実施した。それをマウス抗UCP抗体あるいはマウス抗VHL抗体として前記記述した方法と同様にウエスタンブロットを実施した。その結果、細胞内で内因性UCPとVHLが結合していることが分かった(図5)。
【0081】
実施例1−3:UCPとVHL間の結合の特異性調査
VHLは、Elongin B、Elongin C、Rbx1 Cullin 2等と複合体を成し、E3ユビキチンリガーゼ活性を示し、この酵素の代表的な基質は、HIF−1αである(Nat Rev Cancer,2002年,第2巻,673−682頁)。前記VHLと結合することが示されたUCPのVHL複合体の他の分子との結合可能性の有無を試験した。Flag−UCPが常に発現されるHEK293細胞(293−F−UCP)に GST−Rbx1、GST−Elongin B、GST−Elongin C、GST−VHL及びGST発現ベクターを各々カルシウムホスファート方法で各々細胞内に導入した。集める12時間前に10μmのMG132で処理して細胞を集めて−70℃で冷凍後、細胞破砕溶液(50mM Tris、0.5mM EDTA、0.1%NP−40、0.5mM PMSF)で破砕した。そこにGST−セパロース(Amersham)を添加してGST pull−downを4℃で2時間実施して、マウス抗Flag抗体として前記のような方法でウエスタンブロットを実施した。その結果、UCPはVHLと特異的に結合することが分かった(図6)。
【0082】
また、細胞内でUCPとVHL間の結合性は、スクロース密度勾配遠心分離法によって二分子の移動様相を通じて確認した。100mm培養皿10枚のCAKI腎臓癌細胞株あるいはHepG2肝臓癌細胞株を集めて−70℃に冷凍させた後、0.5mlの細胞破砕溶液(50mM Tris,0.5mM EDTA,50mM KCl,10%グリセロール,1mM DTT,0.5% NP−40,0.5mM PMSF)に溶解して準備した。10mlの5%から20%までのスクロース線形密度勾配溶液に上の細胞破砕液をのせて35000rpmで16時間超高速遠心分離を実施した後、それを各0.5mlずつ20個の区画に分けてマウス抗UCP抗体、マウス抗VHL抗体、ウサギ抗Elongin B、Elongin C、Rbx1抗体(Santa Cruz)として前記方法と同様にウエスタンブロットを実施した。その結果、CAKI細胞株でUCPはVHL E3リガーゼ複合体(VHL、Elongin B、Elongin C、Rbx1等の複合体、分画10−12)には存在せず、free VHLが分画2−4で検出された(図7、CAKI cell)。HepG2細胞に由来したUCPは、VHL E3リガーゼ複合体分画(10−12)に存在せず、VHLと一緒に沈降した(図7、HepG2細胞株、分画4−5)。
【0083】
実施例1−4:UCP過発現によるVHL−UCP結合複合体形成
内因性VHLの発現が高いが、内因性UCPの発現が検出されないCAKI細胞株にF−UCPを過発現させた時、UCP−VHLの結合複合体形成を観察するために次のような実験を実施した。100mm皿5枚のCAKI細胞株に10ugのF/UCPプラスミドまたはmockベクタープラスミドをカルシウムホスファート方法として形質転換して48時間後に細胞を集めて前記実施例1−3で記述したようにスクロース密度勾配を実施してウエスタンブロット方法で複合体形成を観察した結果、UCPを過発現させない場合に2−4の分画でみられたfree VHL分子が、UCPが過発現されると4−5の分画に移動してUCP−VHL結合複合体を形成することが分かった(図8)。
【0084】
以上の結果は、UCPは特異的にVHLと結合して、UCP−VHL結合体とVHLE3ユビキチンリガーゼ複合体がお互いに独立的に存在するということを提示している。
【0085】
実施例2:UCPがVHLタンパク質安定性に及ぼす効果の調査
UCPによるVHLの細胞内タンパク質濃度の減少は、VHLのユビキチン媒介タンパク質分解によって招来され、HIF−1αの安定化をもたらすようになると思慮され、それを検証した。
【0086】
HRE−lucレポーター遺伝子は、VEGF発現調節部位に由来した5個のHREをSV40 TATAを含むpGL3−ルシフェラーゼベクター(Promega)に挿入して製造された(Mol Ther.,2004年,第10巻,938−949頁)。
【0087】
本実験のためにFlag−UCPの活性部位である95番目システインをセリンに置換した突然変異Flag−UCPmをPCR法で製作した。PCR反応条件は、DNA重合酵素(pfuポリメラーゼ(Vent),New England Bioscience,米国)を使用して前記に記載したプライマー対と鋳型(配列番号3:internal sense:5’−AAA GGC GAG ATC AGC GTC AAC GTG CTC AAG−3’、配列番号4:internal antisense:5’−CTT GAG CAC GTT GAC GCT GAT CTC GCC ATT−3’)を94℃で4分間変性させて、94℃で1分、55℃で1分及び72℃で1分間30回反応させて、72℃で5分間伸長して反応を終結した。
【0088】
またHA−VHLを常に発現する293細胞株は、ネオマイシン分解遺伝子を含む発現ベクター(pCDNA/HA−VHL)をカルシウムホスファート方法で細胞内で導入して、1mg/mlのネオマイシンが含まれたLDMEM培地で選択培養して得た細胞集落でHA−VHL発現を確認して使用した。
【0089】
実施例2−1:UCPによるVHLの安定性減少効果の検証
HEK293T細胞株にFlag−UCPを10μg、15μgずつ各々カルシウムホスファート方法で導入させて集める12時間前に、10μmのMG132(26Sプロテアゾーム阻害剤)で処理したり処理しない群を各々集めて−70℃で冷凍後、細胞破砕溶液(50mM Tris,0.5mM EDTA,50mM KCl、10%グリセロール,1mM DTT,0.5% NP−40,0.5mM PMSF)に溶解して準備した。これをマウス抗Flag抗体、マウス抗VHL抗体、マウス抗HIF−1α(Phamingen)抗体及びマウス抗β−アクチン抗体(Sigma)として前記方法と同様にウエスタンブロットを実施した。その結果、UCPの発現が増加するほどVHLの濃度は減少し、この現象は、MG132によって阻害され、HIF−1αの転写活性はUCP濃度依存的に高かった(図9及び図10)。この結果は、UCPがVHLを26Sプロテアゾーム分解経路で分解させるということを示している。
【0090】
UCPによるVHL発現量減少がタンパク質水準(post−translation)であることを証明するために、Flag−UCP存在下でVHLのmRNA濃度をノーザンブロットで確認した。同時に、HIF−1α及びHIF−1αの標的分子であるVEGFのmRNAの発現増減有無も調査した。F−UCPが、5、10、15μgずつ導入されたHEK293細胞株からRNaseyキット(Qiagen)を使用して全体RNAを分離した。各25μgのRNAをホルマリンアガロースゲルで電気泳動して分離した後、ナイロン膜に移して吸着させた後、ノーザンブロットに使用した。RNP1633(Amersham/Pharmacia)でVHL、HIF−1α、VEGF、アクチンcDNAを[32P]dCTP放射能で各々標識させた後、65℃で16時間RNAが付着しているナイロン膜と各々反応させて残余放射能標識プローブは、充分に洗浄して除去した。前記の膜を、BAS1500(Fuji)ホスホイメージ分析機で分析した。その結果、F−UCPは、VHL、HIF−1αの転写を調節しないことが分かり、F−UCPによってVEGFの転写が増加されたことが分かった(図11)。
【0091】
前記の結果は、翻訳後(post−translation)の工程でUCPがHIF−1αを分解させるVHLタンパク質量を減少させて、結果的に細胞内HIF−1αタンパク質濃度が増加してVEGFの転写を活性化させるということを示している。
【0092】
実施例2−2:Hypoxia条件でUCPによるVHLの細胞内濃度変化の検証
低酸素条件(hypoxia;1%O2)及び正常酸素条件(normoxia;20%O2)でUCPによるVHLのタンパク質濃度減少現象を調べるために次のような実験を実施した。
【0093】
293/HA−VHL細胞株にFlag−UCPを発現した時のVHLの細胞内濃度変化を、Normoxia条件とHypoxia条件で検証した。293/HA−VHL細胞株にFlag−UCPを10μg、15μgずつ各々カルシウムホスファート方法で導入させて24時間後、低酸素条件の細胞は細胞を集める前約12時間低酸素チェンバーに放置しておいた後、細胞を集めて−70℃に冷凍させた後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗HAエピトープ(Roche)抗体、マウス抗Flag抗体、マウス抗HIF−1α(Phamingen)抗体及びマウス抗β−アクチン抗体(Sigma)として前記方法と同様にウエスタンブロットを実施した。その結果、Flag−UCPの発現が高いほどVHLの細胞内濃度は、正常酸素条件と低酸素条件で共に低くなることが分かり、それによるHIF−1αの安定化を確認することができた(図15a)。
【0094】
UCPによるHIF−1αの安定化現象をHRE−lucを使用したレポーター分析で再度確認した。6ウェルプレートに培養したHEK293細胞株に、HRE−lucと各々5μg、10μgのF−UCPを一緒に導入して、Hypoxia条件の細胞は細胞を集める前約16時間低酸素チェンバーに放置しておいた後、細胞を集めた。−70℃に冷凍させた後、リポーター細胞破砕溶液(Promega)に溶解した後、ルシフェラーゼ(luciferase)の基質であるルミノール(luminol)を添加してルシフェラーゼの活性有無を測定した。その結果、F−UCPの濃度に依存的にHRE−lucの活性が高くなることが分かった(図15b)。この結果は、UCPが細胞内HIF−1αを調節するVHLの細胞内濃度を低酸素及び正常酸素条件の両方で減少させるということを示している。
【0095】
実施例2−3:UCPのAuto−ubiquitination(E2/E3)酵素活性検証
UCPは、E2ユビキチン結合酵素として知られていて、E3ユビキチンリガーゼ活性も有している。UCPの95番目アミノ酸であるシステインは、E2ファミリーによく保存されていて、酵素の活性に重要なことが報告されている(EMBO J,2003年,第22巻,5241−5250頁)。それで、本発明者等は、UCPによるVHLの細胞内濃度調節でE2酵素活性が重要な役割を担当しているのかどうかを調べようとした。それのために野生型のGST−UCPと95番システインをセリンに置換した突然変異GST−UCPmを、各々E.coliで発現させて純粋分離した。E1供給源として786−0細胞株(American Type Culture Collection)の細胞破砕液(S−100)を使用して、各々のタンパク質をユビキチン化緩衝溶液(50mM Tris,1mM ATP,10mM creatine phosphate,10μg creatine phosphokinase,0.5mM DTT,5mM MgCl2,1μg ubiquitin aldehyde,1μg His−ubiquitin)に混ぜて37℃で1時間反応させた後、GST−pull downした。ユビキチン化UCPを抗−His抗体としてウエスタンブロットして確認した結果、野生型GST−UCPでのみAuto−ubiquitinationが確認された(図16)。
【0096】
実施例2−4:UCPの酵素活性とUCPによるVHLタンパク質分解との関連性の調査
Flag−UCPとFlag−UCPmを各々濃度別で(5,10,15μg)HEK293細胞株に導入して48時間の後に細胞を集めて−70℃に冷凍させた後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗VHL抗体、マウス抗Flag抗体及びマウス抗アクチン抗体として前記方法と同様にウエスタンブロットを実施した。その結果、Flag−UCPによっては濃度依存的にVHLの量が減少したが、Flag−UCPmによっては変化がなかった。ゆえに、UCPのよるVHLタンパク質分解でUCPの酵素活性が必須であるということが分かった(図12)。
【0097】
実施例3:UCPによるVHLの多重ユビキチン化検証
以上で確認されたUCPによるVHLの細胞内濃度減少が、ユビキチン媒介タンパク質分解(ubiquitin−mediated proteolysis)によることなのかどうかを確認するために、VHLが多重ユビキチン化されるかどうかを調査した。それのためにHis−Ub発現ベクターを使用したIn vivo及びIn vitro VHLユビキチン化分析とE1を使用した酵素反応を実施した。そのために、UCP及びUCPmをEcoR1/NotIでpGEX4T−1ベクターにクローニングして大腸菌DH5αで発現させて、GST−セパロースカラムを使用してGST−UCP、GST−UCPmを分離し、Flag−VHLをHEK293に導入させて発現させた後、それからFlag−アガロースゲル免疫沈降法を使用して、Flag−VHLのみを純粋分離した。
【0098】
実施例3−1:UCPによるインビボVHLユビキチン化検証
HEK293細胞株に先にHis−Ub発現ベクターをカルシウムホスファート方法で導入して培養させた後、同量の細胞を100mm培養皿に分けて培養した後、そこに図9に提示したFlag−VHL、Flag−VHLとGST−UCP、Falg−VHLとGST発現ベクターを再びカルシウムホスファート方法で導入させた。集める12時間前に10μMのMG132を処理して細胞を集めて、すぐdenatured lysis buffer(50mM Tris,1%SDS,4M Urea)を添加して超音波粉砕機で細胞を破砕した。用意した細胞破砕溶液にフラッグ抗体が結合されたアガロースゲルを添加して、室温で2時間免疫沈降反応を実施した。これをマウス抗Ub抗体で前記記述と同様にウエスタンブロットを実施して、併せて免疫沈降反応前の細胞破砕溶液の一部を取ってマウス抗GST抗体、マウス抗Flag抗体として同一なウエスタンブロットを実施した。その結果、UCPによるFlag−VHLの多重ユビキチン化を観察することができた(図13)。
【0099】
実施例3−2:UCPによるインビトロVHLユビキチン化検証
1μgのE1(ウサギ、Sigma)と純粋分離したGST−UCP及びGST−UCPm、Flag−VHLタンパク質を各々前記のユビキチン化緩衝溶液に混ぜて37℃で1時間反応させた後、Ni2+−NTAレジンで4℃で2時間沈降させて、それを各々マウス抗Flag抗体、マウス抗GST抗体でウエスタンブロットを実施した。また、Ni2+−NTA(QIAGEN,ドイツ)pull−downさせる前の反応後試料から1/10を取って抗Flag抗体、マウス抗GST抗体でウエスタンブロットを実施した。その結果、UCPによるVHLの直接的なユビキチン化が試験管内で起きることが分かった(図14)。
【0100】
より明確にUCPによるVHLユビキチン化を検証するために、1μgのE1と純粋分離したGST−UCP及びGST−UCPm、Flag−VHLタンパク質を各々前記のユビキチン化緩衝溶液に混ぜて37℃で1時間反応させた後、それを各々マウス抗Flag抗体、マウス抗His抗体及びマウス抗GST抗体でウエスタンブロットを実施した。また、反応溶液をAnti−Flag−アガロースとNi2+−NTAレジンで各々4℃で2時間沈降させて、それを各々マウス抗Flag抗体、マウス抗His抗体及びマウス抗GST抗体でウエスタンブロットを実施した。その結果、野生型UCPによるVHLの直接的なユビキチン化が、試験管内で起きることが分かった(図17a、b)。
【0101】
前記の結果は、UCPがE2ユビキチン結合酵素及びE3ユビキチンリガーゼとして機能して、VHLのユビキチン化を増加させてタンパク質分解を誘導するということを示している。言いかえると、UCPはE2及びE3酵素活性を共に有していることを示す。
【0102】
実施例4:VHL安定性でのUCPの特異性検証
UCPとVHLの相互作用によるVHLのタンパク質濃度減少現象がVHL以外の他のタンパク質でも起きるのか、あるいはVHLの場合にのみ特異的に起きるかどうかを次のように検証した。言いかえれると、UCPが特異的にVHLのみをユビキチン化させて分解を誘導するのかどうかを調査した。そのために、GST−UbcH5CとGST−CDC34は、BamHI/NotIで処理してpEBGベクターにクローニングして製作した。
【0103】
実施例4−1:UCPがElongin B及びCとRbx1の安定性に及ぼす効果の調査
10μgのFlag−UCP発現ベクターをカルシウムホスファート方法で導入させたりあるいは導入しないHEK293T細胞を−70℃に冷凍後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗Flag抗体、マウス抗VHL抗体、ウサギ抗Elongin B、ウサギ抗Elongin C抗体、ウサギ抗Rbx1抗体及びマウス抗β−アクチン抗体として前記方法と同様にウエスタンブロットを実施した結果、VHLのタンパク質濃度は、UCPによって顕著に減少し、Elongin B、Elongin Cは若干の減少があることがみうけられた(図18a)。Elongin B、Cの濃度が若干減少する現象は、VHL.Elongin B、Elongin Cがお互いに複合体を形成して各々のタンパク質の安定性に影響を与えることが報告されたように(PNAS USA,2000年,第97巻,8507−8512頁)、VHLの濃度が顕著に減少することで遊離Elongin B、Elongin Cの半減期が減少して現れることであると推定された。
【0104】
実施例4−2:UCPがSOCS1及びMDM2安定性に及ぼす効果の調査
Elongin B、Cは、SOCS1(suppressor of cytokine signaling 1)と複合体を形成してSOCS1の分解を阻害する(Genes& Development,1998年,第12巻,3872−3881頁)。また、SOCS1は、Elongin B、C、Cul2と複合体を形成してVHLE3ユビキチンリガーゼと類似のE3ユビキチンリガーゼ活性を示す(JBC275,2000年,14005−14008頁)。このような理由で、UCPがSOCS1の分解を誘導するかどうかを調査した。HEK293細胞株にFlag−VHL及びFlag−SOCS1発現ベクターを各々カルシウムホスファート方法で導入させて、それを6ウェルプレートに各々均一に分けて培養して24時間後、GST−UCP及びGST発現ベクターを再び各々同一方法で導入させた。24時間後に細胞を集めて−70℃に冷凍させた後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗Flag抗体、マウス抗GST抗体、マウス抗アクチン抗体を使用して前述したウエスタンブロット方法を実施した。その結果、UCPはSOCS1の安定性には影響を及ぼさず、VHLの細胞内濃度のみを減少させたことが示された(図18b)。
【0105】
MDM2は、RINGフィンガー(finger)構造を有するタンパク質で、MDM2自体及びp53のユビキチン化を誘導する(JBC,2000年,第275巻,8945−8951頁)。Ubc5HC、E2−25K等のE2酵素は、MDM2のautoubiquitinationを誘導する(JBC,2004年,第279巻,42169−42181頁)。このような理由で、UCPがE2酵素としてMDM2の細胞内タンパク質濃度を調節することができるかどうかを、JSHC肝臓癌細胞株でUbcH5Cを陽性対照にして試験してみた。100mm培養皿に用意したJSHCにGST−UbcH5c、GST−UCP及びGST発現ベクターを各10μgずつカルシウムホスファート方法で導入させて、48時間後、細胞を集めて免疫沈殿緩衝液(50mM Tris,150mM NaCl,1%NP−40,0.5%デオキシコール酸,0.1%SDS)で破砕した。これをマウス抗MDM2抗体(Pharmingen)、マウス抗GST、マウス抗アクチンを使用して前記記述したウエスタンブロット方法を実施した。その結果、UbcH5Cは、MDM2タンパク質の濃度を減少させた一方、UCPはMDM2の濃度に影響を及ぼさなかった(図18c)。
【0106】
実施例4−3:ユビキチン供与E2酵素及びRbx1によるVHLの安定性の調査
Rbx1は、Elongin B、Cがない場合、試験管内でVHLのユビキチン化を誘導するが、Elongin B、Cがある場合、Ubc5Hによって誘導されるVHLをユビキチン化させない(JBC,2002年,第277巻,30338−30393頁)。CDC34は、Skp1−Cul1とタンパク質複合体を形成して、E3ユビキチンリガーゼ活性を示すが、この複合体は構造的にVHLE3ユビキチンリガーゼと類似で(Curr Biol,1999年,第9巻,1180−1182頁)、CDC34は、複合体としてF−boxタンパク質であるCDC4を試験管内でユビキチン化する(JBC,2002年,第277巻,30338−30393頁)。293/HA−VHL細胞株にGST−Rbx1、GST−UbcH5C、GST−CDC34、GST−UCP発現ベクターを各々カルシウムホスファート方法で導入させて細胞を集めて、前記細胞破砕溶液で破砕した。各々の破砕液をマウス抗HA抗体、マウス抗GST抗体として前述した方法と同様にウエスタンブロットを実施した。また、GST−pull down分析を通じて各分子とVHLとの間の結合有無も確認した。その結果、GST−Rbx1、GST−UbcH5CはVHLと結合はするが、濃度には影響を与えず、CDC34はHA−VHLと結合せず、安定性に何らの影響も及ぼさず、GST−UCPだけがHA−VHLの細胞内濃度を減少させることが分かった(図19)。
【0107】
この結果は、UCPが特異的にVHLのユビキチン媒介タンパク質分解(ubiquitin−mediated proteolysis)を誘導するということを示している。
【0108】
実施例5:マウスの肝組織でUCPによるVHLの発現減少現象検証
培養細胞で確認されたUCPによるVHLタンパク質分解が生体内でも起きるのかを調べるために、F−UCP発現アデノウイルスベクター(Ad.F−UCP)を製作してマウスの尾静脈内に注射して肝でUCP、VHL及びHIF−1αの発現変化を検討した。
【0109】
具体的に、各2×108個のAd.F−UCP及び対照ウイルスとしてAd.GFPを6週齢のメスBalb/c マウスの尾静脈内に注射して、PBSも同一に注射した(実験群当り3匹)。3日後に肝を摘出して液体窒素が入った乳鉢で組織をすり下ろして準備し、同時に凍結組織切片を準備した。
【0110】
液体窒素で粉で準備した組織をmammalian proteome extraction kit(Calbiochem,米国)を使用して、ウエスタンブロットのための細胞破砕液を製造した。準備した試料として、抗Flag、抗UCP、抗VHL、抗HIF−1α抗体で前述のようにウエスタンブロットを実施した。その結果、UCPの過発現によるVHLの減少とHIF−1αの増加を確認することができた(図20)。また、マウスの肝組織には内因性UCPがほとんど発現されていないことが分かった。
【0111】
また、Flag、VHL及びHIF−1αに対する前記の肝組織スライスの免疫組織化学染色を実施した。各組織切片が付着したスライドを1%牛胎児血清が入っている、PBSで室温で1時間ブロッキングして、各抗体が含まれた0.1%牛胎児血清PBSで37℃で1時間反応させた。以後、PBSTで5分間3回洗浄してロダミンが結合されている抗マウスIgGが含まれている0.1%牛胎児血清PBSで室温で30分間反応させて、再び、以後PBSTで5分間3回洗浄して残余抗体を充分に除去した。組織で各抗体の反応有無は、蛍光顕微鏡で確認した。その結果、Flag−UCPが発現された時にVHLの発現が減少し、HIF−1α発現は増加していることを確認することができた(図21)。ゆえに、Flag−UCPによるVHLタンパク質減少は、培養細胞と生体内で同一に現れることが分かった。
【0112】
実施例5−1:癌患者組織でUCP、VHL、HIF−1αの発現様相の調査
肝臓癌、大腸癌、乳癌患者の組織が植えられているTissue arrayスライド(www.tissue−array.com,SuperBioChips Lab)を対象にして、UCP、VHL、HIF−1αの各抗体で前述のように免疫組織化学染色を実施した。その結果、UCPはHIF−1αとともに原発性癌患者組織と転移性癌組織の両方で発現が高く示された一方、VHLの発現は低く示された(図22)。癌患者の組織で酸素が円滑に供給される部位でも、UCPとHIF−1αの発現が高く示されることは、正常な酸素条件でUCPによるVHLの発現減少が、HIF−1αの発現は高く維持させて癌の増殖と転移の役割をしていることを暗示している。
【0113】
実施例6:癌細胞成長及び浸透(転移)でのUCPの機能解明
以上で得た結果は、UCPが癌抑制タンパク質中のひとつであるVHLの分解を促進させるということを示している。このような現象は、癌の進行及び転移にUCPが重要な役割を担当していることがあり得るという仮説を可能にして、治療用分子標的としての使用可能性もともに提示している。ゆえに、本発明者等は各種癌細胞でのUCP発現とVHL発現様相を調査して、UCP過発現及び抑制による癌細胞の増殖及び浸透(転移)効果を試験してみた。
【0114】
実施例6−1:各種癌細胞でUCPとVHLの発現様相比較
7種の肝臓癌細胞株(ATCC,SNU368,SNU709ソウル大学校医科大学癌研究所韓国細胞株銀行)、胆道癌細胞株(Ck−K1)(全北医大キン・デゴン教授)、7種の胃癌細胞株(ソウル大学校医科大学癌研究所韓国細胞株銀行)、皮膚癌細胞株(C8161)(韓国生命工学研究院、リー・ジョンヒョン博士)、大腸癌細胞株(HCT116)(ATCC)、肺癌細胞株(A549)(ATCC)、骨肉腫細胞株(U2OS)(ATCC)、前立腺癌細胞株(PC3)(ATCC)、腎臓癌細胞株(CAKI)(ATCC)と正常繊維芽細胞株MRC5及びIMR90(ATCC)等をHDMEM(4.5g/lグルコース、10%牛胎児血清、100unit/mlペニシリン、100μg/mlストレプトマイシン含有)含有100mm培養皿に細胞数106で24時間正常酸素条件で培養して準備した後、細胞を集めて−70℃に冷凍させた後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗UCP抗体、マウス抗VHL抗体、マウス抗アクチン(actin)抗体を使用して前述したウエスタンブロット方法を実施した。その結果、HLK3肝臓癌細胞株を除き、すべての細胞株でUCP水準とVHL水準が逆比例で存在した(図23)。HIF−1α水準がUCP水準と正比例して存在しなかったが、UCPが検出される15種の細胞株中12種の細胞株でHIF−1αが検出された。この結果は、UCPの発現が正常酸素条件でHIF−1α安定性を調節しているということを提示する。
【0115】
実施例6−2:UCPが癌細胞の増殖及び浸透に及ぼす影響
腎臓癌細胞株CAKIにFlag−UCPを含むアデノウイルス(Ad.F−UCP,50,100multiplicity of infection:MOI)及び対照ウイルスとしてGFPを含むアデノウイルス(Ad.GFP,100MOI)を感染させて48時間後、細胞を集めて−70℃に冷凍させた後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗Flag抗体、マウス抗VHL抗体、マウス抗HIF−1α抗体、マウス抗p21抗体、マウス抗アクチンp27抗体、マウス抗アクチン抗体を使用して、前述したウエスタンブロット方法を実施し、VEGF mRNAの変化は、VEGF、アクチンcDNAを[32P]dCTP放射能で標識させて前述した方法と同様にノーザンブロットを実施することで確認した。その結果、VHLの発現が高い腎臓癌細胞株CAKIでUCPが過発現になる場合、VHLの濃度が減少し、それによってHIF−1αとVEGFの濃度は増加することが示された(図24)。p21、p27タンパク質水準は、変化しないとみられ、UCPはVHL−HIF経路に特異的に作用すること示した(図24)。
【0116】
腎臓癌細胞株CAKIに各々Ad.F−UCPとAd.GFPを50MOIずつ感染させて、また対照群としてPBSを処理して16時間後にウェルプレートに100個ずつの細胞を植えて、2日間隔で細胞数をヘマサイトメーターを使用して測定してみた時、UCPが過発現するにつれて細胞の成長率が約2倍以上増加することが示された(図25)。併せて、CAKI細胞株の転移能力の変化を湿潤能測定(invasion assay)として測定してみた。各々Ad.F−UCPとAd.GFPを50MOIずつ感染させて、また対照群として、PBSを処理して16時間後、マトリゲル(Matrigel, BD)がコーティングされたトランスウェル(Trans well,Costar)に104個の細胞を入れて、24時間HDMEM(4.5g/lグルコース,10%FBS,100μgペニシリン/ストレプトマイシン)で培養した後、Trans wellを通過した細胞をヘマトキシリン・エオシン染色法で染色してその数を測定した。その結果、UCPが過量存在する場合、浸透率が対照群と比較して3倍程度増加したことが示された(図26)。
【0117】
実施例6−3:siRNAを使用したUCPのタンパク質合成の遮断が癌細胞の増殖及び浸透に及ぼす影響
肺に転移を誘導する皮膚癌C8161細胞株は、UCPの発現が高いことが先の実験で示された(図23)。本発明者等は、UCPの発現を抑制するためにUCPに対するsiRNAを考案してUCP−siRNAを含むアデノウイルスを製作した。UCP−siRNA塩基配列は、UCPmRNA配列中の配列番号6で記載される615−633塩基部分を、H1プロモーターによって発現されるようにpSuperプラスミドベクター(OligoEngine,米国)のHind III/Bgl II部位にクローニングして製作した。細胞内に伝達及び発現を願う遺伝子を提供するアデノウイルス製作用pShuttle(BD Bioscience,米国)ベクターに、前記製作されたpSuperプラスミドベクターをXbaI/HindIIIで処理して、H1プロモーターでT5転写終了配列を含むDNA切片をクローニングすることで製作した(pShuttle/UCP−siRNA)。以後、アデノウイルス遺伝子を含んでいるpAdEasy−1とE.coli BJ5183菌株に同時に形質導入することで組換えを遂行した。作られたUCP−siRNAを含むアデノウイルスベクターを使用して実施例5と同じ方法でアデノウイルス粒子を作った。また、対照ウイルスとして配列番号7で記載されるCon−siRNAを、上記と同一な方法で製作して使用した(Ad.Con−siRNA)。
【0118】
皮膚癌細胞株C8161にAd.F−UCP、Ad.UCP−siRNA、対照ウイルスとしてAd.GFP、Ad.Con−siRNAを各々50MOIずつ感染させて48時間後、細胞を集めて−70℃に冷凍させた後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗Flag抗体、マウス抗VHL抗体、マウス抗HIF−1α抗体、マウス抗p21抗体、マウス抗アクチンp27抗体、マウス抗アクチン抗体を使用して前記記述したウエスタンブロット方法を実施した。その結果、UCPの発現が高いほどHIF−1αの発現が高くなり、UCPの発現を抑制した場合、VHLの濃度が増加することを観察することができ、p21及びp27水準は変化がなかった(図27)。
【0119】
皮膚癌細胞株C8161にAd.F−UCP、Ad.UCP−siRNA、対照ウイルスとしてAd.GFP、Ad.Con−siRNAを各々50MOIずつ感染させ、また、対照群としてPBSを処理して16時間後、ウェルプレートに100個ずつの細胞を植えて2日間隔で細胞成長数をヘマサイトメーターを使用して測定してみた時、UCPが過発現になるにつれて細胞の成長率が約2倍増加することが示され、UCPの発現抑制は細胞の成長率を約2倍減少させることが示された(図28)。
【0120】
あわせて、UCPによるC8161細胞株の転移能力の変化をインベージョン・アッセイで測定してみた。前記と同一に処理されたC8161細胞を16時間後、Matrigel(BD,米国)がコーティングされたトランスウェル(Costar,米国)に104個の細胞を入れて24時間HDMEM(10%牛胎児血清、100μgペニシリン、ストレプトマイシン添加)で培養した後、トランスウェルを通過した細胞をヘマトキシリン・エオシン染色法で染色してその数を測定した。その結果、UCP過発現によって細胞の浸透率が対照群と比較して3倍程度増加し、UCP発現を抑制した場合は73%程度減少したことが示された(図29)。
【0121】
以上の結果は、UCPは癌の成長及び転移に重要な役割を遂行していて、UCPの発現を阻害することで癌の成長及び転移を抑制することができるということを示している。
【0122】
実施例6−4:胆道癌細胞株Ck−K1でのUCP−siRNAの効果
皮膚癌C8161細胞株で示されたUCPの効果が胆道癌細胞株(Ck−K1)でも再現されるのかどうか下記のように調査した。
【0123】
Ck−K1細胞株にAd.F−UCP、Ad.UCP−siRNA、対照ウイルスとしてAd.GFP、Ad.Control−siRNAを各々50MOIずつ感染させて48時間後、細胞を集めて−70℃に冷凍させた後、前記の細胞破砕溶液に溶解して準備した。これをマウス抗Flag抗体、マウス抗VHL抗体、マウス抗HIF−1α抗体、マウス抗アクチン抗体を使用して前記記述したウエスタンブロット方法を実施した。その結果、Ck−K1細胞株でもUCPの発現が高いほどHIF−1αの発現が高くなり、UCPの発現を抑制した場合、VHLの濃度が増加することを観察することができた(図30)。
【0124】
実施例7:Ad.UCP−siRNA作動特異性検証
前記使用されたUCP−siRNAが細胞内UCPのみを特異的に抑制するということを検証するために、下記のような実験を実施した。
【0125】
実施例7−1:二次UCPsiRNAオリゴマー及びControl siRNAオリゴマーの製作
本発明者等は、UCPの272−290位置のmRNA配列sense 5’−AUGGCGAGAUCUGCGUCAATT−3’(配列番号8)、antisense 5’−UUGACGCAGAUCUCGCCAUTT−3’(配列番号9)(三千里製薬、韓国)を各々製作した後、RNase free D.Wに20μM/mlになるように溶解して、annealing buffer(20mM KCl,6mM HEPES−KOH、pH7.5、0.2mM MgCl2)に最終濃度が8μMになるように混ぜた後、90℃で2分間denaturation後、ゆっくり温度を下げながらアニーリングして−70℃に保管しながら使用した。Control siRNA場合は、sense 5’−AAGGAGACGAGCAAGAGAATT−3’(配列番号10)、antisense 5’−UUCUCUUGCUCGUCUCCUUTT−3’(配列番号11、Ref:Chen Z等,Nature,2005年,第436巻,725−730頁)(三千里製薬、韓国)を使用して、前記の方法で製作した。
【0126】
C8161細胞にAd.UCP−siRNAとAd.Control−siRNAは各々50MOIずつ感染させて、前記UCP−siRNAオリゴマーは200nM、400nMの濃度で、Control siRNAオリゴマーの場合は400nMの濃度でリポフェクタミン2000で形質転換させて48時間後、細胞を集めてウエスタンブロットを実施した。その結果、二次UCP−siRNAオリゴマーは、UCPの発現を効果的に抑制することができることを確認した(図31a)。
【0127】
実施例7−2:F−UCPsilent mutant(SM)実験
UCP−siRNA標的配列のアミノ酸は変化させないで、塩基配列を(AAG AAG CTG GCG GCC AAG AAA −> AAA AAA TTA GCA GCT AAA AAG)変換させた突然変異F−UCP(SM)(配列番号12)は、野生型F−UCPを鋳型にしてPCR方法で得られた突然変異した切片をpCMV taq1 ベクター(Stratagene,米国)のNotI/BamHIサイトにクローニングして製作した。
【0128】
293HA/VHL細胞株にF−UCPとF−UCP(SM)をpSuperUCP−siRNA及びpSuper Con−siRNAと共に形質転換して、48時間後に細胞を集めてウエスタンブロットを実施してUCP−siRNAの作動性有無を観察した。その結果、UCP−siRNAは野生型F−UCPの発現は抑制したが、突然変異F−UCP(SM)の発現には何らの影響を与えることができなかった(図31b)。また、UCPの発現抑制によるHA−VHL発現増加とHIF−1αの減少現象も、野生型のF−UCPでのみ示された。この結果は、前記製作されたUCP−siRNAがUCPの核酸特定部位のみを特異的に認識して分解するということを示し、innate immune体系を誘導して起きる現象ではないことを示している。
【0129】
実施例8:マウス腫瘍モデルでUCPが癌成長及び癌転移に及ぼす効果の調査
【0130】
実施例8−1:マウスモデルでUCPによるC8161癌細胞の増殖効果の調査
5×105個のC8161細胞にAd.F−UCPとAd.GFPを各100MOIずつ感染させたりリン酸緩衝液で処理した後、各々のC8161細胞を6週齢のメスのヌードマウスのお互いに異なる部位の皮下に注射した(各群当りマウス3匹、2site injection/mouse)。マウスに移植されたC8161癌細胞の成長変化を21日間、腫瘍の大きさを測定して調査した。腫瘍の大きさは、「横2×縦2/2=腫瘍体積(mm3)」公式を使用して計算した。その結果、UCPによって腫瘍の大きさが対照群と比較して約4倍以上増加することが分かった(図32及び33)。
【0131】
UCPによるHIF−1αと血管生成の増加を確認するために、摘出した腫瘍を凍結組織ブロックを作って切片を準備して、マウス抗Flag抗体、マウス抗HIF−1α抗体、マウス抗CD31抗体(Phamingen,米国)に対する免疫組織化学染色を前述の方法と同一に実施した。Ad.F−UCPを感染させた癌塊で、HIF−1αとCD31の発現が対照群と比較して増加していることを確認することができた(図34)。この実験で21日間、アデノウイルスベクター遺伝体が腫瘍に存在するのかどうかを、次のような実験を通じて確認した。100MOIのAd.F−UCP、Ad.GFP及び処理しないC8161細胞を(5×105/site)ヌードマウスに皮下注射して、21日後に腫瘍を分離して次のような方法でジェノミックDNAを分離した。Phenol/Chloroform方法でDNAを分離して100%エチルアルコールでジェノミックDNAを回収した。以後、アデノウイルスタイプ5ジェノミックDNAをHindIII処理して得た約2kbの切片を、プローブにしてサザンブロットを実施した。その結果、アデノウイルス核酸は、21日間腫瘍細胞中に存在することが分かった(図40a)。上のように得られた腫瘍からRneasy mini kit(Qiagen,ドイツ)プロトコルによって全体RNAを分離した。Flag/UCPの確認のために5’−ATGAACTCCAACGTGGAGAA−3’(配列番号13)、5’−CTACAGCCGCCGCAGCGC−3’(配列番号14)のプライマーセットを使用し、GFP確認のために5’−AAGGAGAAAACTTTTCACT−3’(配列番号15)、5’−TAATGGTCTGCTAGTTGAAC−3’(配列番号16)のプライマーセットを使用してRT−PCRを遂行した。その結果、腫瘍細胞中にF−UCPとGFPのmRNAが存在していたことを確認することができた(図40b)。
【0132】
実施例8−2:腫瘍が形成されたヌードマウスモデルでのAd.UCP−siRNAウイルスの抗癌効果
UCP−siRNAによるC8161細胞のUCP発現阻害が腫瘍の成長に及ぼす効果を検証するために、5×105個のC8161細胞をヌードマウスの皮下に注射して、2週間後腫瘍が平均直径3mmになった時、各々109個pfu(plaque−forming unit)の精製されたAd.UCP−siRNAまたはAd.Con−siRNAウイルスを含むまたは含まないホスファート緩衝溶液100μlを腫瘍塊に直接一度注射して以後、腫瘍の大きさを17日間測定した。C8161でUCPの発現に低下による腫瘍成長抑制効果が顕著に示された(図35)。
【0133】
実施例8−3:ヒト黒色腫細胞でUCPが癌転移に及ぼす効果の調査
C8161癌細胞(106cell/100μl in PBS)を ヌードマウス(メス、5W、Balb/c、N=8)の腹中央に皮下注射して1週間後、腫瘍の平均直径が約3mmになった時、各ウイルス(PBS、Ad.F−UCP、Ad.GFP)を109pfuになるように50μlのPBSに溶解して腫瘍の中央部に注射した。約9週後に肺を摘出して、Bouin's solutionに固定及びH&E染色して転移された腫瘍の有無を観察した。その結果、UCPを過発現させたグループでは、転移が顕著に増加したことが分かった(図36、37)。
【0134】
ヒト黒色腫細胞C8161(5×105個)にAd.F−UCP、Ad.GFP、Ad.UCP−siRNA、Ad.GFP−siRNA(配列番号17)を100MOIずつ感染させた後、リン酸緩衝液で処理した各々のC8161細胞を6週齢のメスヌードマウスの尾静脈に注射した。ここで、PBSのみをヌードマウスの尾静脈に注射した。癌細胞をマウスに注射してから4週後、マウスの肺を摘出して水で洗浄して、Bouin's solution(SIGMA)で固定した。摘出した肺器官の様子(図39)と肺の表面に転移した癌塊(>直径2mm)を顕微鏡下でカウントした後、平均値を図38に示した。
【0135】
その結果、PBS(C8161含)、Ad.GFP、Ad.GFP−siRNAで処理した癌細胞の場合、肺に転移した転移癌が17、22、23個が観察された一方、PBSのみを注射した場合は転移癌が一つも観察されなかったが、これは肺転移癌は癌細胞注入によって発生したことを示している。
【0136】
一方、Ad.F−UCPを使用してUCPを過発現させた場合、肺転移癌は約6〜8倍増加した一方、Ad.UCP−siRNAを使用してUCPの発現を抑制した場合には、肺転移癌が約6〜7倍減少した。前記結果は、UCPが癌転移に陽性因子として作用してUCP発現を低めたり、活性を制御すると癌の転移を抑制することができることを示している。
【0137】
前記の結果は、UCPがマウス腫瘍モデルで癌細胞の増殖及び転移を増加させて、UCPの機能を制御すると、癌細胞の増殖及び転移が阻害されることを示すもので、UCPが癌治療のための分子マーカーに有用に活用され得ることが確認された。
【0138】
実施例9:UCPのVHL−HIF経路調節の特異性調査
VHLが欠如している腎臓癌細胞株、786−0は、HIF−2αが過発現されていて(Nat,1999年,第399巻,271−299頁)、UCPの発現も高い(図41)。この細胞株をHA−VHLを常に発現するように操作して(Invitrogenで販売されているpCDNAベクターにHA−VHL遺伝子を導入させた発現ベクターpCDNA−HA−VHLで形質転換)UCPの効果を調査した。また、この実験のためにHIF−2αのmRNA配列86−104まで5’−GGAGACGGAGGTGTTCTAT−3’の配列を含むAd.HIF2α−siRNA(配列番号18)を前述したとおり製作した。
【0139】
実施例9−1:HA−VHL発現細胞株でUCPの効果
HA−VHL細胞株及び対照群細胞株に50MOIの各々のウイルスベクターを(Ad.F−UCP、Ad.GFP、Ad.UCP−siRNA、Ad.Con−siRNA、Ad.HIF−2α−siRNA)感染させた後、UCP、VHL、HIF−2α、GLUT1(HIF−1α及びHIF−2αによってその発現が誘導される遺伝子、GLUT1抗体、Santa Cruz,米国)の各々タンパク質の発現変化様相をウエスタンブロットで確認した。その結果、VHLの発現がない対照群細胞株ではUCPの発現変化によるVHLの変化もなく、HIF−2α、及びGLUT1の発現変化もなかった。しかし、HA−VHL発現細胞株では、UCPの発現によってVHLの発現が逆に変化し、それによってHIF−2α、及びGLUT1もUCPの発現変化様相と同一に変化した(図41)。
【0140】
前述したとおり各々のウイルスを処理して二つの細胞株間の増殖速度の差を試験した。その結果、対照細胞株では各ウイルス処理群間に変化がなかったが、HA−VHL発現細胞株ではAd.UCP−siRNA処理による細胞増殖阻害効果が示された(図42)。
【0141】
また、各々のウイルスによる浸透能の変化を試験した時、対照細胞株ではAd.HIF−2α−siRNAを処理した群で浸透能が減少し、HA−VHL発現細胞株ではAd.UCP−siRNA、Ad.HIF−2α−siRNA処理群で浸透能が減少した(図43)。
【0142】
これらの結果は、以下のことを示唆する:i) VHLは培養中でHIF−2αレベルに非依存的に細胞の成長を調節する;ii) HIF−2αは培養中で細胞の浸透能を調節するが、細胞の成長は調節しない;およびiii) UCPはVHLを通じて細胞の成長を調節し、VHL−HIF経路を通じて細胞の浸透を調節する。
【0143】
実施例9−2:マウス腫瘍モデルでUCP発現調節によるVHLの抗癌効果
各ウイルス(Mock、Ad.F/UCP、Ad.GFP、Ad.UCP−siRNA、Ad.Con−siRNA、Ad.HIF−2α−siRNA)をHA−VHL発現細胞株と対照細胞株に各々2時間感染させて(100MOI)16時間後に細胞を集めて、107cell/100μlのPBSに懸濁してヌードマウス(メス、5W、Balb/c、N=5)の右側太ももの皮下に注射した。時間の経過による腫瘍の成長を観察した時、Ad.HIF−2α−siRNAは対照細胞株とHA−VHL発現細胞株全て腫瘍抑制効果を示し、Ad.UCP−siRNAはHA−VHL細胞株で腫瘍抑制効果を示した(図44、45)。以上の結果は、UCPがVHLを通じて癌細胞増殖を調節して、VHL−HIF経路を通じて癌細胞の浸透を調節することを示している。これは、UCPがVHL−HIFの経路を特異に調節する上位分子であり、VHLの抗癌効果を効果的に示すためにはUCPの発現抑制が必要だということを示している。
【0144】
実施例10:UCP阻害剤探索(High Throughput Screening、HTS)のための細胞株の製作
以上でUCPは、VHL−HIF経路を調節して癌細胞の増殖及び転移を促進させることが示され、実際にUCPの抑制はVHLの発現の増加による癌細胞増殖抑制効果(抗癌効果)を示した(図41、42)。それで、本発明者等は、786−O及びHA−VHLが発現するように考案された(pCDNA−HA−VHLで形質転換)786−0細胞株(786−O−HA−VHL)を、UCPを特異的に抑制する阻害剤を捜すcell−based HTS assayに使用することができるかどうかを下記のように調査した。
【0145】
786−O及び786−O−HA−VHL細胞株を96ウェルプレートに103cell/wellの個数で植えて、Ad.UCP−siRNAとAd.Control−siRNAを各々200MOIから2倍ずつ希釈して0.39MOIまで希釈して感染させた後、48時間目にWST−1(Roche、ドイツ)で細胞増殖速度の変化を測定した。そこにHA−VHLを発現しない786−0対照細胞株にAd.UCP−siRNAを同じ方法で処理してUCP抑制剤特異性を試験した。その結果、HA−VHLが発現される細胞株ではUCPの抑制による細胞増殖抑制効果が示されたが、対照細胞株及び対照ウイルスでは示されなかった(図46a)。
【0146】
また他のcell based assayの方法として、GFP−VHL融合タンパク質を発現するように(Invitrogenで販売されるpCDNAベクターにGFP−VHL融合遺伝子を挿入したpCNA−GFP−VHL発現ベクターで形質転換)Huh−7−GFL−VHL肝臓癌細胞株を製作した。この細胞株でUCPの発現が阻害されることによるGFP−VHLの増加をウエスタンブロットで確認することができる(図46b)。
【0147】
Huh−7−GFL−VHL細胞株を96ウエルプレートに103cell/wellの数で植えて、Ad.UCP−siRNAを200MOIから2倍ずつ希釈して3.13MOIまで希釈して感染させた後、48時間にWST−1(Roche、ドイツ)で細胞増殖速度の変化を測定した。その結果、UCP発現の抑制とVHL発現増加による細胞増殖抑制効果を確認することができた(図46c)。
【0148】
ゆえに、前記の786−O、786−O−HA−VHL及びHuh−7−GFP−VHL細胞株は、選択的にUCPの酵素活性及びUCP−VHL相互作用を阻害する抑制剤を探索するのに有用に使用することができる。
【0149】
実施例11:UCPが血管細胞増殖に及ぼす影響
前記の結果は、UCPの過発現によってHIF−1αが安定化されて、VEGFの発現を促進させることができることを提示した。VEGFは血管生成を促進させる因子なので、UCP遺伝子が虚血性疾患を治療するのに有用な遺伝子なのかを調べるためにUCPを過発現した細胞培養液にVEGF量が増加されているのかどうか、増加しているのならUCP過発現細胞培養液が果たして対照群と比較してHUVEC(human umbilical vascular endothelial cell、Cambrex,米国)の増殖を促進させることができるかどうかを調査した。
【0150】
具体的に、HeLa細胞株にAd.F−UCP(50,200MOI)、Ad.GFP(200MOI)を各々感染あるいは感染させない細胞の培養上澄み液(Serum free media,Opti−MEM,Invitrogen)を48時間後に集めた。VEGFを検出するELISAキット(TiterZyme EIA kit、Assay designs,米国)を使用して、この上澄み液に分泌したVEGFの存在を確認した。その結果、UCPを過発現させた細胞培養液中にVEGFが、対照群と比較して3倍多く存在していることが分かった(図47a)。この上澄み液中に存在するVEGFが血管生成を促進することができる生物学的活性を有しているかどうかを下記のように調査した。HeLa細胞株にAd.F−UCP、Ad.GFPを各々200MOIずつ感染あるいは感染させない細胞の培養上澄み液(Serum free media,Opti−MEM,Invitrogen)を形質導入48時間後に集めた。これを96ウエルプレートに(3×103/well)に用意したHUVEC細胞に処理して、時間による細胞増殖変化をWST−1法で測定した。その結果、UCP発現群は対照群と比較して、HUVEC細胞の増殖速度が約2倍増加した(図47b)。この結果は、UCPの発現の増加を誘導して血管形成を促進させることができるということを示していて、虚血性疾患の治療にUCPの活用が可能であることを提示している。
【産業上の利用可能性】
【0151】
前記で詳しくみたように、UCP発現が増加すると癌抑制タンパク質であるVHLにユビキチン化が起こりプロテオゾームによってVHLが分解され、それによってHIF−1αが安定化されて活性がある血管生成促進因子(VEGF)の増加が誘導されることが分かった。したがって、癌細胞でのUCP活性の抑制またはUCPの欠失は、VHLの細胞内濃度を増加させて、HIF−1αの分解を促進して癌の増殖及び転移を抑制するので、本発明のUCPの活性抑制剤は、抗癌剤に使用することができる。また、UCPの過発現はVHLを分解させて、それによってHIF−1αが安定化されて血管生成促進因子VEGFの増加が誘導されるので、弱い血管生成に起因して四肢切断手術を受けなければならないひどい四肢虚血(CLI)患者、手術が可能ではない冠状動脈疾患(CAD)患者、血流の供給が不実で生じる痴ほう症、筋萎縮性側索硬化症(ALS)、糖尿性神経障害、脳卒中患者を含む難治性疾患を有している人々の遺伝子治療に有用に使用することができる。
【0152】
以上、本発明内容の特定部分を詳しく記述したが、当業界の通常の知識を有した者において、このような具体的技術は単に好ましい実施様態であるだけであり、それによって本発明の範囲が制限されるものではないことは、明白だろう。したがって、本発明の実質的な範囲は、添付された請求項とそれらの等価物によって定義されるといえる。
【配列表フリーテキスト】
【0153】
配列番号1及び2は、Flag−UCP製作のための正方向及び逆方向プライマーである。
配列番号3及び4は、Flag−UCPm製作のための正方向及び逆方向プライマーである。
配列番号5は、UCPcDNA配列である。
配列番号6は、UCP−siRNAを発現するDNA配列である。
配列番号7は、control−siRNAを発現するDNA配列である。
配列番号8及び9は、UCPmRNA(272−290)のセンス及びアンチセンス配列である。
配列番号10及び11は、Control siRNAのセンス及びアンチセンス配列である。
配列番号12は、F−UCP(Silent Mutation)配列である。
配列番号13及び14は、Flag/UCP確認用プライマー配列である。
配列番号15及び16は、GFP確認用プライマー配列である。
配列番号17は、GFP−siRNAを発現するDNA配列である。
配列番号18は、HIF2 alpha−siRNAを発現するDNA配列である。
【特許請求の範囲】
【請求項1】
薬学的有効量のUCP(ubiquitin carrier protein)の活性抑制剤を個体に投与する工程を含む、UCPの活性抑制または欠失を通じてVHLの活性または発現量を増加させる方法。
【請求項2】
薬学的有効量のUCPの活性抑制剤を個体に投与する工程を含む、UCPの活性抑制または欠失を通じてHIFの安定性を減少させる方法。
【請求項3】
薬学的有効量のUCPの活性抑制剤を個体に投与する工程を含む、UCPの活性抑制を通じてVEGFの発現を抑制する方法。
【請求項4】
前記UCPの活性抑制剤が、UCPのmRNAに相補的に結合するアンチセンスオリゴヌクレオチド、UCP遺伝子に特異的な小さな干渉RNA、活性がないUCP類似タンパク質またはその断片、UCPタンパク質に結合するペプチド、UCPに特異的な抗体、UCPの転写またはUCPのmRNAの翻訳を抑制する化合物、およびUCPの機能を抑制する化合物からなる群より選択されることを特徴とする、請求項1〜3のいずれか一項記載の方法。
【請求項5】
小さな干渉RNAが配列番号6および配列番号8で記載されることを特徴とする、請求項4記載の方法。
【請求項6】
UCPの活性抑制剤を有効成分として含む抗癌剤。
【請求項7】
前記UCPの活性抑制剤が、UCPのmRNAに相補的に結合するアンチセンスオリゴヌクレオチド、UCP遺伝子に特異的な小さな干渉RNA、活性がないUCP類似タンパク質またはその断片、UCPタンパク質に結合するペプチド、UCPに特異的な抗体、UCPの転写またはUCPのmRNAの翻訳を抑制する化合物、およびUCPの機能を抑制する化合物からなる群より選択されることを特徴とする、請求項6記載の抗癌剤。
【請求項8】
小さな干渉RNAが配列番号6および配列番号8で記載されることを特徴とする、請求項7記載の抗癌剤。
【請求項9】
薬学的有効量のUCPの活性増加剤を個体に投与する工程を含む、UCPの活性または発現量の増加を通じてVHLの活性または発現量を減少させる方法。
【請求項10】
薬学的有効量のUCPの活性増加剤を個体に投与する工程を含む、UCPの活性または発現量の増加を通じてHIFの安定性を増加させる方法。
【請求項11】
薬学的有効量のUCPの活性増加剤を個体に投与する工程を含む、UCPの活性または発現量の増加を通じてVEGFの発現を促進する方法。
【請求項12】
UCPの活性または発現量の増加が、UCPプロモーターに作用してUCPmRNAの発現を誘導する薬剤、およびUCPの発現を誘導するプラスミドまたはウイルス遺伝子伝達体を使用することを特徴とする、請求項9〜11のいずれか一項記載の方法。
【請求項13】
UCPの活性増加剤、UCP遺伝子が導入された発現ベクター、またはUCPタンパク質を有効成分として含む、VEGF発現促進剤。
【請求項14】
UCPの活性増加剤、UCP遺伝子が導入された発現ベクター、またはUCPタンパク質を有効成分として含む、新生血管促進剤。
【請求項15】
UCPの活性増加剤が、UCPプロモーターに作用してUCPmRNAの発現を誘導する薬剤、UCPの発現を誘導するプラスミドまたはウイルス遺伝子伝達体であることを特徴とする、請求項13または請求項14記載の促進剤。
【請求項16】
1)UCPの転写調節に関与する転写因子を捜す工程、
2)前記転写因子を調節する物質を選抜(screening)する工程、及び
3)前記物質がUCP遺伝子の発現を調節する活性を示すかどうかを確認する工程
を含む、UCP活性調節剤をスクリーニングする方法。
【請求項17】
個体の診断試料中でUCPと反応する一つ以上の物質を使用してUCPの発現を測定する工程を含む、癌の診断、治療、および予後評価方法。
【請求項18】
UCPと反応する一つ以上の物質が、抗体またはUCP遺伝子に相補的な核酸であることを特徴とする、請求項17記載の癌の診断、治療、および予後評価方法。
【請求項19】
1)UCP及びVHL発現細胞株に被検化合物を処理する工程、
2)工程1)の細胞株のVHL活性を測定する工程、及び
3)工程2)の結果と対照群の結果とを比較して、VHL活性を有意に変化させる化合物を選別する工程
を含む、UCP活性調節剤をスクリーニングする方法。
【請求項20】
1)UCP及びVHL発現細胞株に被検化合物を処理する工程、
2)工程1)の細胞株のユビキチン化されたVHLの量を測定する工程、及び
3)工程2)の結果と対照群の結果とを比較して、ユビキチン化されたVHLの量を有意に変化させる化合物を選別する工程
を含む、UCP活性調節剤をスクリーニングする方法。
【請求項21】
細胞株が、786−O、786−O−HA−VHL、およびHuh−7−GFP−VHL細胞株からなる群より選択されることを特徴とする、請求項19または請求項20記載の方法。
【請求項22】
1)UCP及びHIF発現細胞株に被検化合物を処理する工程、
2)工程1)の細胞株のHIFの活性を測定する工程、及び
3)工程2)の結果と対照群の結果とを比較して、HIF活性を有意に変化させる化合物を選別する工程
を含む、UCP活性調節剤をスクリーニングする方法。
【請求項23】
1)UCP及びHIF発現細胞株に被検化合物を処理する工程、
2)工程1)の細胞株のユビキチン化されたHIFの量を測定する工程、及び
3)工程2)の結果と対照群の結果を比較して、ユビキチン化されたHIFの量を有意に変化させる化合物を選別する工程
を含む、UCP活性調節剤をスクリーニングする方法。
【請求項24】
UCPと反応する一つ以上の物質を含む癌診断キット。
【請求項25】
UCPと反応する一つ以上の物質が、抗体またはUCP遺伝子に相補的な核酸であることを特徴とする、請求項24記載の癌診断キット。
【請求項26】
1)配列番号6で記載される塩基配列をプラスミドにクローニングする工程、及び
2)前記プラスミドをウイルス性発現ベクターに導入する工程
を含む、UCP−siRNA発現ベクターの製造方法。
【請求項27】
前記ウイルス性発現ベクターが、アデノ随伴ウイルス、レトロウイルス、ワクシニアウイルス、及び癌細胞溶解性ウイルスからなる群より選択されることを特徴とする、請求項26記載のUCP−siRNA発現ベクターの製造方法。
【請求項1】
薬学的有効量のUCP(ubiquitin carrier protein)の活性抑制剤を個体に投与する工程を含む、UCPの活性抑制または欠失を通じてVHLの活性または発現量を増加させる方法。
【請求項2】
薬学的有効量のUCPの活性抑制剤を個体に投与する工程を含む、UCPの活性抑制または欠失を通じてHIFの安定性を減少させる方法。
【請求項3】
薬学的有効量のUCPの活性抑制剤を個体に投与する工程を含む、UCPの活性抑制を通じてVEGFの発現を抑制する方法。
【請求項4】
前記UCPの活性抑制剤が、UCPのmRNAに相補的に結合するアンチセンスオリゴヌクレオチド、UCP遺伝子に特異的な小さな干渉RNA、活性がないUCP類似タンパク質またはその断片、UCPタンパク質に結合するペプチド、UCPに特異的な抗体、UCPの転写またはUCPのmRNAの翻訳を抑制する化合物、およびUCPの機能を抑制する化合物からなる群より選択されることを特徴とする、請求項1〜3のいずれか一項記載の方法。
【請求項5】
小さな干渉RNAが配列番号6および配列番号8で記載されることを特徴とする、請求項4記載の方法。
【請求項6】
UCPの活性抑制剤を有効成分として含む抗癌剤。
【請求項7】
前記UCPの活性抑制剤が、UCPのmRNAに相補的に結合するアンチセンスオリゴヌクレオチド、UCP遺伝子に特異的な小さな干渉RNA、活性がないUCP類似タンパク質またはその断片、UCPタンパク質に結合するペプチド、UCPに特異的な抗体、UCPの転写またはUCPのmRNAの翻訳を抑制する化合物、およびUCPの機能を抑制する化合物からなる群より選択されることを特徴とする、請求項6記載の抗癌剤。
【請求項8】
小さな干渉RNAが配列番号6および配列番号8で記載されることを特徴とする、請求項7記載の抗癌剤。
【請求項9】
薬学的有効量のUCPの活性増加剤を個体に投与する工程を含む、UCPの活性または発現量の増加を通じてVHLの活性または発現量を減少させる方法。
【請求項10】
薬学的有効量のUCPの活性増加剤を個体に投与する工程を含む、UCPの活性または発現量の増加を通じてHIFの安定性を増加させる方法。
【請求項11】
薬学的有効量のUCPの活性増加剤を個体に投与する工程を含む、UCPの活性または発現量の増加を通じてVEGFの発現を促進する方法。
【請求項12】
UCPの活性または発現量の増加が、UCPプロモーターに作用してUCPmRNAの発現を誘導する薬剤、およびUCPの発現を誘導するプラスミドまたはウイルス遺伝子伝達体を使用することを特徴とする、請求項9〜11のいずれか一項記載の方法。
【請求項13】
UCPの活性増加剤、UCP遺伝子が導入された発現ベクター、またはUCPタンパク質を有効成分として含む、VEGF発現促進剤。
【請求項14】
UCPの活性増加剤、UCP遺伝子が導入された発現ベクター、またはUCPタンパク質を有効成分として含む、新生血管促進剤。
【請求項15】
UCPの活性増加剤が、UCPプロモーターに作用してUCPmRNAの発現を誘導する薬剤、UCPの発現を誘導するプラスミドまたはウイルス遺伝子伝達体であることを特徴とする、請求項13または請求項14記載の促進剤。
【請求項16】
1)UCPの転写調節に関与する転写因子を捜す工程、
2)前記転写因子を調節する物質を選抜(screening)する工程、及び
3)前記物質がUCP遺伝子の発現を調節する活性を示すかどうかを確認する工程
を含む、UCP活性調節剤をスクリーニングする方法。
【請求項17】
個体の診断試料中でUCPと反応する一つ以上の物質を使用してUCPの発現を測定する工程を含む、癌の診断、治療、および予後評価方法。
【請求項18】
UCPと反応する一つ以上の物質が、抗体またはUCP遺伝子に相補的な核酸であることを特徴とする、請求項17記載の癌の診断、治療、および予後評価方法。
【請求項19】
1)UCP及びVHL発現細胞株に被検化合物を処理する工程、
2)工程1)の細胞株のVHL活性を測定する工程、及び
3)工程2)の結果と対照群の結果とを比較して、VHL活性を有意に変化させる化合物を選別する工程
を含む、UCP活性調節剤をスクリーニングする方法。
【請求項20】
1)UCP及びVHL発現細胞株に被検化合物を処理する工程、
2)工程1)の細胞株のユビキチン化されたVHLの量を測定する工程、及び
3)工程2)の結果と対照群の結果とを比較して、ユビキチン化されたVHLの量を有意に変化させる化合物を選別する工程
を含む、UCP活性調節剤をスクリーニングする方法。
【請求項21】
細胞株が、786−O、786−O−HA−VHL、およびHuh−7−GFP−VHL細胞株からなる群より選択されることを特徴とする、請求項19または請求項20記載の方法。
【請求項22】
1)UCP及びHIF発現細胞株に被検化合物を処理する工程、
2)工程1)の細胞株のHIFの活性を測定する工程、及び
3)工程2)の結果と対照群の結果とを比較して、HIF活性を有意に変化させる化合物を選別する工程
を含む、UCP活性調節剤をスクリーニングする方法。
【請求項23】
1)UCP及びHIF発現細胞株に被検化合物を処理する工程、
2)工程1)の細胞株のユビキチン化されたHIFの量を測定する工程、及び
3)工程2)の結果と対照群の結果を比較して、ユビキチン化されたHIFの量を有意に変化させる化合物を選別する工程
を含む、UCP活性調節剤をスクリーニングする方法。
【請求項24】
UCPと反応する一つ以上の物質を含む癌診断キット。
【請求項25】
UCPと反応する一つ以上の物質が、抗体またはUCP遺伝子に相補的な核酸であることを特徴とする、請求項24記載の癌診断キット。
【請求項26】
1)配列番号6で記載される塩基配列をプラスミドにクローニングする工程、及び
2)前記プラスミドをウイルス性発現ベクターに導入する工程
を含む、UCP−siRNA発現ベクターの製造方法。
【請求項27】
前記ウイルス性発現ベクターが、アデノ随伴ウイルス、レトロウイルス、ワクシニアウイルス、及び癌細胞溶解性ウイルスからなる群より選択されることを特徴とする、請求項26記載のUCP−siRNA発現ベクターの製造方法。
【図39】


【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図40】


【図41】


【図42】


【図43】


【図44】


【図45】


【図46】


【図47】




【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図40】


【図41】


【図42】


【図43】


【図44】


【図45】


【図46】


【図47】


【公開番号】特開2012−67096(P2012−67096A)
【公開日】平成24年4月5日(2012.4.5)
【国際特許分類】
【出願番号】特願2011−186682(P2011−186682)
【出願日】平成23年8月30日(2011.8.30)
【分割の表示】特願2008−539939(P2008−539939)の分割
【原出願日】平成18年11月13日(2006.11.13)
【出願人】(508139457)コリア リサーチ インスティテュート オブ バイオサイエンス アンド バイオテクノロジー (19)
【Fターム(参考)】
【公開日】平成24年4月5日(2012.4.5)
【国際特許分類】
【出願日】平成23年8月30日(2011.8.30)
【分割の表示】特願2008−539939(P2008−539939)の分割
【原出願日】平成18年11月13日(2006.11.13)
【出願人】(508139457)コリア リサーチ インスティテュート オブ バイオサイエンス アンド バイオテクノロジー (19)
【Fターム(参考)】
[ Back to top ]

