L−アミノ酸または核酸の製造方法
【課題】微生物を用いてL−アミノ酸又は核酸の結晶を析出させながら培地に蓄積させる発酵生産における生産性を向上させる。
【解決手段】L−アミノ酸又は核酸の生産能を有する微生物を攪拌翼を備えた発酵槽中の液体培地で培養し、必要に応じて種晶を培地に添加して当該培地中にL−アミノ酸または核酸の結晶を生成、蓄積させ、培養物からL−アミノ酸又は核酸の結晶を採取するL−アミノ酸又は核酸の製造法において、攪拌翼の動力密度を結晶析出後又は種晶添加後に2.4kW/m3以下に制御する。
【解決手段】L−アミノ酸又は核酸の生産能を有する微生物を攪拌翼を備えた発酵槽中の液体培地で培養し、必要に応じて種晶を培地に添加して当該培地中にL−アミノ酸または核酸の結晶を生成、蓄積させ、培養物からL−アミノ酸又は核酸の結晶を採取するL−アミノ酸又は核酸の製造法において、攪拌翼の動力密度を結晶析出後又は種晶添加後に2.4kW/m3以下に制御する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は発酵工業に関し、微生物を利用した発酵法によりL−アミノ酸または核酸を析出させながら培養する方法である。
【背景技術】
【0002】
L−アミノ酸は、L−アミノ酸生産能を有するコリネ型細菌又は腸内細菌科に属するアミノ酸生産菌を用いて発酵法により工業生産されている。これらのアミノ酸生産菌としては、生産性を向上させるために、自然界から分離した菌株または該菌株の人工変異株、あるいは遺伝子組換えによりL−アミノ酸生合成酵素が増強された組換え体等が用いられている。
【0003】
例えば、L−トリプトファン発酵においては、アントラニル酸合成酵素活性、ホスホグリセリン酸デヒドロゲナーゼ活性、トリプトファンシンターゼ活性が増強された細菌(特許文献1)、及びトリプトファンオペロンが増幅された細菌が挙げられる(特許文献2〜4)。
【0004】
また、L−グルタミン酸発酵においては、グルタミン酸デヒドロゲナーゼ遺伝子(gdh)、イソクエン酸デヒドロゲナーゼ遺伝子(icdA)、アコニット酸ヒドラターゼ遺伝子(acnA, acnB)、及びクエン酸シンターゼ遺伝子(gltA)を増強することによって、L−グルタミン酸の生産能を増加させる技術が挙げられる(特許文献5)。
【0005】
また、L−スレオニン発酵においては、アスパルトキナーゼIII遺伝子(lysC)、アスパラギン酸セミアルデヒドデヒドロゲナーゼ遺伝子(asd)、thrオペロンにコードされるアスパルトキナーゼI遺伝子(thrA)、ホモセリンキナーゼ遺伝子(thrB)、スレオニンシンターゼ遺伝子(thrC)を強化した微生物(特許文献6)等が挙げられる。
【0006】
上述のような微生物の育種や製造法の改良により、L−アミノ酸の生産能はかなり高まっているが、今後の需要の一層の増大に応えるためには、さらに安価かつ効率的なL−アミノ酸の製造法の開発が求められている。
【0007】
一方、培養液中に蓄積するL−アミノ酸を晶析せしめながら発酵を行う方法が知られている(特許文献7、8)。また、L−グルタミン酸については、L−グルタミン酸を析出させながら蓄積させることができる微生物を用いてL−グルタミン酸を製造する方法が開示されている(特許文献9)。また、平均粒子径が1〜120μmのアミノ酸の結晶を培地に添加する晶析発酵法も知られている(特許文献10)。
【0008】
しかしながら、上記方法では通常の結晶を析出させない発酵と比べて生産性が十分でなく、さらなる改良が求められていた。
【特許文献1】WO94/08031号
【特許文献2】特開昭57-71397号
【特許文献3】特開昭62-244382号
【特許文献4】米国特許第4,371,614号
【特許文献5】特開昭63-214189号
【特許文献6】特開2001-346578号
【特許文献7】特開昭62-288号
【特許文献8】欧州特許公報第1078989号
【特許文献9】米国特許第6905819号
【特許文献10】WO06/109830号
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、微生物を用いてL−アミノ酸又は核酸の結晶を析出させながら培地に蓄積させる発酵生産における生産性の向上を目的とする。
【課題を解決するための手段】
【0010】
通常、発酵過程における攪拌翼の動力密度の低下は、発酵に悪影響を与えることが想定される。しかしながら、本発明者は鋭意研究の結果、L−アミノ酸または核酸を析出させながら蓄積させる発酵において、攪拌翼の動力密度を、結晶析出後、又は種晶添加後に一定以下に制御することによって、L−アミノ酸の生産性が向上することを見出し、本発明を完成するに至った。
【0011】
すなわち、本発明は以下のとおりである。
(1)L−アミノ酸又は核酸の生産能を有する微生物を攪拌翼を備えた発酵槽中の液体培地で培養し、必要に応じて種晶を培地に添加して当該培中にL−アミノ酸または核酸の結晶を生成、蓄積させ、培養物からL−アミノ酸又は核酸の結晶を採取するL−アミノ酸又は核酸の製造法において、攪拌翼の動力密度を結晶析出後又は種晶添加後に2.4kW/m3以下に制御することを特徴とする方法。
(2)上記結晶析出後又は種晶添加後の攪拌翼の動力密度が0.5kW/m3以上であることを特徴とする前記方法。
(3)結晶析出前又は種晶添加前の攪拌翼の動力密度が3.0kW/m3以上で制御しながら培養することを特徴とする前記方法。
(4)前記微生物が腸内細菌科に属する微生物である、前記方法。
(5)前記微生物がコリネ型細菌、又はバチルス属細菌である、前記方法。
(6)前記L−アミノ酸が、L−トリプトファン、L−フェニルアラニン、L−チロシン、L−イソロイシン、L−バリン、L−ロイシン、L−グルタミン酸、L−グルタミン、L−スレオニン、L−システイン、L−シスチンまたはその誘導体から選択される1種又は2種以上のL−アミノ酸である前記の方法。
(7)前記核酸が、イノシン、アデノシン、グアノシン、キサントシン、イノシン酸、アデニル酸、グアニル酸、キサンチル酸またはそれらの誘導体から選択される1種又は2種以上の核酸である前記方法。
【発明の効果】
【0012】
本発明によれば、L−アミノ酸又は核酸生産能を有する微生物を用いた発酵法によるL−アミノ酸又は核酸の生産法において、L−アミノ酸又は核酸の生産性を向上させることが可能となる。L−アミノ酸又は核酸の生産性には、対糖収率の向上、及び/又は生産速度の向上が含まれる。
【発明を実施するための最良の形態】
【0013】
<1>本発明の製造法
本発明の方法は、L−アミノ酸又は核酸の生産能を有する微生物を攪拌翼を備えた発酵槽中の液体培地で培養し、必要に応じて種晶を培地に添加して当該培地中にL−アミノ酸または核酸の結晶を生成、蓄積させ、培養物からL−アミノ酸又は核酸の結晶を採取するL−アミノ酸又は核酸の製造法において、攪拌翼の動力密度(単位発酵液当たりの動力)を結晶析出後あるいは種晶添加後に2.4kW/m3以下に制御することを特徴とする方法である。
【0014】
本発明において、「L−アミノ酸」は、微生物を用いた発酵法において培地中に析出し
ながら蓄積するものであれば特に制限されないが、L−アミノ酸の種類は特に制限されないが、L−リジン、L−オルニチン、L−アルギニン、L−ヒスチジン、L−シトルリンのような塩基性アミノ酸、L−イソロイシン、L−アラニン、L−バリン、L−ロイシン、L−グリシンのような脂肪族アミノ酸、L−スレオニン、L−セリンのようなヒドロキシモノアミノカルボン酸であるアミノ酸、L−プロリンのような環式アミノ酸、L−フェニルアラニン、L−チロシン、L−トリプトファンのような芳香族アミノ酸、L−システイン、L−シスチン、L−メチオニンのような含硫アミノ酸、L−グルタミン酸、L−アスパラギン酸等のような酸性アミノ酸、及びL−グルタミン、L−アスパラギン等のような側鎖にアミド基を持つアミノ酸が挙げられる。
好ましくは疎水性アミノ酸、酸性アミノ酸、及び側鎖にアミド基を持つアミノ酸が挙げられる。特に好ましくは、疎水性アミノ酸としては、脂肪族アミノ酸であるL−バリン、L−ロイシン、L−イソロイシン、芳香族アミノ酸であるL−トリプトファン、L−フェニルアラニン、L−チロシンが、酸性アミノ酸としてはL−グルタミン酸、L−アスパラギン酸が、側鎖にアミド基を持つアミノ酸としてはL−グルタミン、L−アスパラギン等が挙げられる。
また、本発明のL−アミノ酸には上記アミノ酸を出発物質として得られるL−アミノ酸誘導体も含まれ、GABA、p-ヒドロキシ-D-フェニルグリシン、DOPA、コハク酸、リンゴ酸、ピルビン酸が挙げられる。
本発明により製造されるL−アミノ酸又は核酸は、1種でもよく、2種又はそれ以上であってもよい。
【0015】
本発明において、「核酸」は、微生物を用いた発酵法において培地中に析出しながら蓄積するものであれば特に制限されない。核酸としては、プリンヌクレオシド、プリンヌクレオチドなどが挙げられる。プリンヌクレオシドには、イノシン、キサントシン、グアノシン、アデノシンなどが含まれ、プリンヌクレオチドには、プリンヌクレオシドの5’−燐酸エステル、例えばイノシン酸(イノシン−5’−リン酸。以下「IMP」ともいう)、キサンチル酸(キサントシン−5’−リン酸。以下「XMP」ともいう)、グアニル酸(グアノシン−5’−モノリン酸。以下「GMP」ともいう)、アデニル酸(アデノシン−5’−モノリン酸。以下「AMP」ともいう)などが含まれる。また、本発明の核酸には、上記核酸を出発物質として得られる核酸誘導体も含まれ、Ara-U(ウラシルアラビノシド)、ZVA(Z-バラシクロビル)等が挙げられる。なお、本発明において上記のL−アミノ酸、核酸またはそれらの誘導体を「目的物質」と表現することがある
【0016】
攪拌翼とは、発酵槽中の液体培地を攪拌するためのものであり、形状は特に問わない。通常は、攪拌翼は軸と、軸に設けられた翼(ブレード)からなるが、翼又はその一部が軸を構成するものであってもよい。また、通常、攪拌翼は軸を中心にして回転するが、他の形式で作動するものであっもよい。翼の形状としては、タービン形、パドル形、プロペラ形、アンカー形、リボン形等を用いることが出来るが、これらに制限されない。また、翼の枚数、各々の翼の配置も、特に制限されない。攪拌翼は、モーター等の動力機から軸に動力が伝えられて作動する。攪拌翼については、例えば、化学工学便覧 化学工学協会編
改訂四版 1310〜1311ページ 丸善株式会社)を参照できる。
【0017】
本発明において、攪拌翼の動力密度とは、単位発酵液当たりの攪拌翼の動力である。攪拌翼の動力は、発酵液を攪拌したときの動力機の動力(出力)から、発酵槽が空の状態で攪拌したときの動力機の動力(出力)を差し引くことにより算出される。動力は、具体的には例えば、動力機がモータであれば、モータに流れる電流とモータの効率から計算することよって算出することができる。また、モータに流れる電流と、動力との関係を示す検量線を作成しておき、その検量線を用いて電流から換算することによっても、動力を測定することができる。さらに、トルクメータ又はトルクセンサ等のトルクを測定する機器を用いて攪拌翼にかかるトルクを測定し、その値から以下の式によって動力を算出すること
ができる。
【0018】
動力P [kW]=T×2×π×n/1000
T:トルク[N・m]
n:攪拌翼の回転数[/s]
【0019】
上記のようにして測定される動力値を培地液量で割った値が攪拌翼の動力密度である。
【0020】
本発明において、攪拌翼の動力密度は、結晶析出後又は種晶添加後に2.4kW/m3以下になるように制御することが好ましい。攪拌翼の動力密度は、より好ましくは、2.0kW/m3以下、特に好ましくは、1.5kW/m3以下、最も好ましくは、1.0kW/m3以下に制御することが好ましい。なお、攪拌翼の動力密度の下限は、微生物の物質生産、あるいは微生物の生育を低下させない限り特に制限されないが、0.4 kW/m3以上、好ましくは0.5kW/m3以上、さらに好ましくは0.6kW/m3以上、最も好ましくは0.7kW/m3以上に制御することが好ましい。
【0021】
結晶析出後又は種晶添加後に、攪拌翼の動力密度は上記範囲となるように制御されるが、発酵終了まで連続的に制御されることが好ましい。また、攪拌翼の動力密度が実質的に上記範囲に制御されていれば、一時的に上記範囲を超えることがあってもよい。具体的には、結晶析出後又は種晶添加後、発酵終了又は目的物質の蓄積が頭打になるまでの期間の50%以上、好ましくは70%以上、より好ましくは90%以上で、攪拌翼の動力密度が上記範囲を満たしていれば、攪拌翼の動力密度は実質的に制御されている。
【0022】
結晶析出前又は種晶添加前は、攪拌翼の動力密度は結晶析出後又は種晶添加前上記範囲よりも高いことが好ましく、好ましくは2.6kW/m3以上、より好ましくは2.8kW/m3以上、特に好ましくは3.0kW/m3以上である。尚、攪拌翼の動力密度が実質的にこの範囲に制御されていれば、一時的に上記範囲を下回ることがあってもよい。具体的には、発酵開始、又は後述の目的物質生産期から結晶析出又は種晶添加までの期間の50%以上、好ましくは70%以上、より好ましくは90%以上で、攪拌翼の動力密度が上記範囲を満たしていれば、攪拌翼の動力密度は実質的に制御されている。
【0023】
本発明において、目的物質の結晶は、目的物質の蓄積がその飽和溶解度を超えると、又は過飽和の状態を超えると、自然に析出する。したがって、微生物が培地中に飽和溶解度を超える量の目的物質を蓄積する能力がある場合には、目的物質を析出させるための操作は不要であるが、目的物質の析出を促進するために、結晶を添加してもよい。種晶とは、このような目的で、必要に応じて培地中に添加する結晶を意味する。種晶は、結晶を促進させる効果があれば、目的物質に限られないが、望ましくは目的物質、例えばL−トリプトファン発酵であればL−トリプトファンが望ましい。
【0024】
添加する種晶の濃度は、目的物質を生産する微生物が、発酵工程で培地内に結晶を析出する能力を有する場合には、0.5g/L以上、好ましくは1g/L以上、より好ましくは5g/L以上、さらに好ましくは10g/L以上の種晶を培地中に添加することが好ましい。
【0025】
微生物が、培地中に飽和溶解度を超える量の目的物質を蓄積する能力がない場合、目的物質の濃度が飽和溶解度以上となるような量の目的物質を培地に添加する必要がある。その場合に添加する目的物質は、溶液であっても、粉体又は結晶であってもよいが、少なくとも種晶として結晶を含むことが好ましい。その場合、種晶の量は10g/L以上、好ましくは20g/L、より好ましくは30g/L、さらに好ましくは50g/L以上であることが好ましい。
【0026】
また、いずれの場合も、種晶を添加する濃度の上限は、微生物の物質生産、あるいは微生物の生育を著しく低下させる濃度でなければいずれでもよいが、100g/L以下、好ましく
は90g/L以下、より好ましくは80g/L以下、特に好ましくは70g/L以下の種晶であることが好適である。
【0027】
種晶を添加する時期は、目的物質を生産する能力を有する微生物を培地に接種する前、あるいは微生物を培地に接種した後の培養期間中のいずれの時期でもよいが、好ましくは微生物を培地に接種した後で、培地中の目的物質濃度が飽和溶解度に達する前後から培地中に目的物質の結晶が析出する前、より好ましくは培地中の目的物質濃度が過飽和にあるときであって、培地中に目的物質の結晶が析出する前をあげることが出来る。培養時間で示すと培養開始、又は後述の目的物質生産期の開始点から 5時間後、望ましくは10時間後、望ましくは15時間、さらに望ましくは20時間後、最も好ましくは25時間後に添加することが望ましい。また、目的物質の全培養時間、又は目的物質生産期から培養終了までの時間を1としたとき、全体の0.2、好ましくは0.3、さらに好ましくは0.4経過した時点で種晶を添加することが好ましい。
【0028】
ここで飽和溶解度とは、液体培地が目的物質で飽和しているときの液体培地に溶解している目的物質の濃度を意味する。すなわち目的物質の過飽和が解消した時に定常となる目的物質の濃度を意味する。
各L−アミノ酸及び核酸の溶解度は、表1、2の通りであり、これらの濃度に達する前後に、種晶を添加することが好ましい。
【0029】
【表1】

【0030】
【表2】

【0031】
本発明において、結晶析出後とは、培養液中に目的物質の飽和溶解度を超えて、目的物質の結晶が析出した後を意味する。なお、本発明においては、結晶析出前、又は種晶添加前は、攪拌翼の動力は結晶析出後、又は種晶添加後よりも高いことが望ましい。なお、結晶析出前、又は種晶添加前の攪拌翼の動力は、微生物の生育に好適な範囲であればいずれでもよいが、2.4kW/m3以上、好ましくは2.6kW/m3以上、より好ましくは2.8kW/m3以上、さらに好ましくは3.0kW/m3以上、もっとも好ましくは3.2 kW/m3以上に制御することが望ましい。
【0032】
また、本発明の方法は、目的物質生産能を持つ微生物を増殖させる段階(増殖期)と、目的物質を産生させる段階(目的物質生産期)を含んでいてもよい。その場合、増殖期に微生物を十分に生育させて、目的物質生産期に目的物質を最大限蓄積させることが好ましい。また、目的物質の析出、又は種晶の添加の時期は、増殖期の最終段階、又は目的物質生産期であることが好ましい。種晶の添加は、一度に行ってもよく、2回又は3回以上に分けて添加してもよく、さらには連続的に行ってもよい。
本発明における「増殖期」とは、炭素源が主に菌体生育に使用されている時期、すなわち微生物が対数的に増殖している時期を意味し、本発明における「L−アミノ酸生産期」とは、培養開始から10時間以降、好ましくは15時間以降、特に好ましくは20時間以降炭素源が主にL−アミノ酸生産に用いられている時期を意味する。
増殖期の攪拌翼の動力は、微生物の生育に好適な範囲であれば特に制限されず、具体的には、前記した結晶析出前、又は種晶添加前の攪拌翼の動力と同様である。
【0033】
本発明で用いられる培地は、栄養源として炭素源、窒素源とを含んでいればいずれでもよい。また、本発明の方法は、回分培養(batch culture)、流加培養(Fed−batch culture)、連続培養法(continuous culture)のいずれも用いることができる。
ここで本発明において、上記流加培養とは、培養中の容器に培地を連続的又は間欠的に流加し、培養終了時までその培地を容器から抜き取らない培養方法をいう。また、連続培養とは、培養中の容器に培地を連続的又は間欠的に流加するとともに、容器から培地(通常、流加する培地と当量)を抜き取る方法をいう。また、「初発培地」とは、流加培養又は連続培養において流加培地を流加させる前の回分培養(batch培養)に用いる培地のことを意味し、「流加培地」とは、流加培養又は連続培養を行う際に発酵槽に供給する培地のことを意味する。流加培地は、微生物の生育に必要な成分の全てを含んでいてもよいが、一部のみを含むものであってもよい。また、本発明において「発酵培地」とは、発酵槽中の培地を意味し、この発酵培地から目的物質が回収される。また、本発明において、「発酵槽」とは、目的物質生産を行う器を意味し、その形状は問わず、発酵タンクを用いてもジャーファーメンターを用いてもよい。また、その容量は目的物質を生成・回収できる容量であればいずれでもよい。
【0034】
本発明に用いられる培地に含まれる炭素源としては、グルコース、グリセロール、フラクトース、スクロース、マルトース、マンノース、ガラクトース、澱粉加水分解物、糖蜜等の糖類が使用でき、特にグルコース、スクロースが好ましい。その他、酢酸、クエン酸等の有機酸、エタノール、メタノール等のアルコール類も単独あるいは他の炭素源と併用して用いることができる。また、炭素源となる原料としては、ケインモラセス、ビートモラセス、ハイテストモラセス、シトラスモラセス、転化糖を用いてもよいし、セルロース、デンプン、コーン、シリアル、タピオカ等の天然原料の加水分解物を用いてもよい。また培養液中に溶存した二酸化炭素も炭素源として使用出来る。これらの炭素源が初発培地にも流加培地にも用いることができる。培地中にこれらの炭素源を1種のみ含んでいてもよいし、2種以上含んでいてもよい。また、初発培地、流加培地とも、同じ炭素源を用いてもよいし、流加培地の炭素源を初発培地と変更してもよい。例えば、初発培地の炭素源をグルコースとし、流加培地の炭素源をスクロースとする場合である。
【0035】
本発明の培地中に含まれる窒素源としては、アンモニア、硫酸アンモニウム、炭酸アンモニウム、塩化アンモニウム、リン酸アンモニウム、酢酸アンモニウム、ウレア等のアンモニウム塩または硝酸塩等が使用することができ、pH調整に用いられるアンモニアガス、アンモニア水も窒素源として利用できる。また、ペプトン、酵母エキス、肉エキス、麦芽エキス、コーンスティープリカー、大豆加水分解物等も利用出来る。培地中にこれらの窒素源を1種のみ含んでいてもよいし、2種以上含んでいてもよい。これらの窒素源は、初発培地にも流加培地にも用いることができる。また、初発培地、流加培地とも、同じ窒素源を用いてもよいし、流加培地の窒素源を初発培地と変更してもよい。
また本発明の培地には、炭素源、窒素源の他にリン酸源を含んでいることが好ましい。リン酸源としては、リン酸2水素カリウム、リン酸水素2カリウム、ピロリン酸などのリン酸ポリマー等が利用出来る。
【0036】
また本発明の培地には、炭素源、窒素源の他に、増殖促進因子(増殖促進効果を持つ栄養素)を含んでいてもよい。増殖促進因子とは、微量金属類、アミノ酸、ビタミン、脂肪酸、核酸、更にこれらのものを含有するペプトン、カザミノ酸、酵母エキス、大豆たん白分解物等が使用できる。特に芳香族アミノ酸、分岐鎖アミノ酸の場合、生合成系が共通しているので、微生物が後述のように、目的アミノ酸以外の生合成が弱化されている場合がある。このような場合、生合成系が弱化されたアミノ酸を培地中に添加することが好ましい。例えば目的アミノ酸がL−トリプトファンの場合、L−フェニルアラニン及び/またはチロシン、目的アミノ酸がL−フェニルアラニンの場合、L−トリプトファン及び/またはL−チロシンを添加することが望ましい(WO2003048374号パンフレット)。
【0037】
微量金属類としては、鉄、マンガン、マグネシウム、カルシウム等が挙げられ、ビタミンとしては、ビタミンB1、ビタミンB2、ビタミンB6、ニコチン酸、ニコチン酸アミド、ビタミンB12、ピリドキシン、パントテン酸等が挙げられる。これらの増殖促進因子は初発培地に含まれていてもよいし、流加培地に含まれていてもよい。
【0038】
また本発明の培地には、生育にアミノ酸などを要求する栄養要求性変異株を使用する場合には要求される栄養素を補添することが好ましい。特に本発明に用いることができるL−アミノ酸生産菌は、後述のようにL−アミノ酸生合成経路が強化されており、L−アミノ酸分解能が弱化されているものが多いので、L−リジン、L−ホモセリン、L−イソロイシン、L−メチオニンから選ばれる1種又は2種以上を添加することが望ましい。核酸生産菌についても同様に、必要な物質を培地に添加することが好ましい。
【0039】
初発培地と流加培地は、培地組成が同じであってもよく、異なっていてもよい。さらには、流加培地の流加が多段階で行われる場合、各々の流加培地の組成は同じであってもよく、異なっていてもよい。
【0040】
培養は、発酵温度20〜45℃、特に好ましくは30〜42℃で通気培養を行うことが好ましい。発酵槽に供給する気体としては、空気の他に高濃度酸素を空気と同時に供給し、供給気体中の酸素濃度を上げることもできる (特公平05-048117号公報、特公平5-39594号公報参照)。
酸素供給量は、培地中の酸素濃度が2〜4ppmになるような量で良く、酸素濃度40%〜100%の高濃度酸素と、空気との混合ガスを1/10〜1.5/1VVM供給することが好ましい。高濃度酸素は、酸素濃縮器を用いて調製することができる。ここで、酸素濃縮器としては、PSA式、酸素富化膜式があり、液体酸素を蒸発器で気化させ、若しくは直接発酵槽に供給する方法を用いることが出来る。
【0041】
また、pHを5〜9に制御し、通気培養を行う。培養中にpHが下がる場合には、例えば、炭酸カルシウムを加えるか、アンモニアガス、アンモニア水等のアルカリで中和する
。尚、目的アミノ酸が酸性アミノ酸、例えばL−グルタミン酸の場合には、pHは3〜9、好ましくは3〜5で行うことが望ましい。このような条件下で、好ましくは10時間〜120時間程度培養することにより、培養液中に著量の目的物質が蓄積される。蓄積される目的物質の濃度は野生株より高く、培地中から採取・回収できる濃度であればいずれでもよいが、L−アミノ酸の場合は、50g/L以上、好ましくは75g/L以上、さらに好ましくは100g/L以上、核酸の場合は50g/L以上、好ましくは75g/L以上、さらに好ましくは100g/L以上であることが好ましい。
【0042】
培養終了後の培養液から目的物質を採取する方法は、公知の回収方法に従って行えばよい。例えば、培地中に析出した目的物質は、遠心分離又は濾過等により回収することができる。また、培地中に析出した目的物質は、培地中に溶解している目的物質を晶析した後に、併せて単離してもよい。
【0043】
本発明においては、目的物質蓄積を一定以上に保つために、微生物の培養を種培養と本培養とに分けて行ってもよく、種培養をフラスコ等を用いたしんとう培養、又は回分培養で行い、本培養を流加培養、回分培養又は連続培養で行ってもよく、種培養、本培養ともに回分培養で行ってもよい。また、種培養及び本培養に先立って、1回、2回又はそれ以上の前培養を行い、順次スケールアップしてもよい。
【0044】
これらの培養法の場合、予定した目的物質濃度に到達したときに、目的物質を一部引き抜いて、新たに培地を添加して繰り返し培養を行ってもよい。新たに添加する培地とは、炭素源及び増殖促進効果を持つ栄養素(増殖促進因子)を含む培地が好ましい。炭素源としては、グルコース、スクロース、フルクトース、増殖促進因子としては、窒素源、リン酸、アミノ酸等が好ましい。窒素源としては、アンモニア、硫酸アンモニウム、炭酸アンモニウム、塩化アンモニウム、リン酸アンモニウム、酢酸アンモニウム、ウレア等のアンモニウム塩または硝酸塩等が使用することができる。またリン酸源としては、リン酸2水素カリウム、リン酸水素2カリウムが使用でき、アミノ酸としては、栄養要求性変異株を使用する場合には要求される栄養素を補添することが好ましい。
【0045】
本発明において、流加培養あるいは、連続培養を行う際には、一時的に糖や栄養源の供給が停止するように間欠的に流加培地を流加してもよい。また、流加を行う時間の最大で30%以下、望ましくは20%以下、特に望ましくは10%以下で流加培地の供給を停止することが好ましい。流加培養液を間欠的に流加させる場合には、流加培地を一定時間添加し、2回目以降の添加はある添加期に先行する添加停止期において発酵培地中の炭素源が枯渇するときのpH上昇または溶存酸素濃度の上昇がコンピューターで検出されるときに開始するように制御を行い、培養槽内の基質濃度を常に自動的に低レベルに維持してもよい(米国特許5,912,113号明細書)。
【0046】
炭素源としては、グルコース、スクロース、フルクトース、増殖促進因子としては、窒素源、リン酸、アミノ酸等が好ましい。窒素源としては、アンモニア、硫酸アンモニウム、炭酸アンモニウム、塩化アンモニウム、リン酸アンモニウム、酢酸アンモニウム、ウレア等のアンモニウム塩または硝酸塩等が使用することができる。またリン酸源としては、リン酸2水素カリウム、リン酸水素2カリウムが使用でき、アミノ酸としては、栄養要求性変異株を使用する場合には要求される栄養素を補添することが好ましい。また、流加培地は1種でもよく、2種以上の培地を混合してもよい。2種以上の流加培地を用いる場合、それらの培地は混合して1つのフィード缶により流加させてもよいし、複数のフィード缶で流加させてもよい。
【0047】
また、流加培養を行う際に、糖の量が、流加培養液あるいは発酵培地全体の炭素源量として、30g/Lを超えない程度で流加させることが好ましく、20g/L以下、10g/L以下で制御
することが好ましい。特に、微生物の対数増終了時以降に、糖濃度が前記濃度範囲となるように制御することが好ましい。炭素源の流加速度は、米国特許5,912,113号明細書記載の方法を用いて制御することが出来る。また、糖とリン酸が菌体生育の制限因子となる濃度で糖とリン酸を流加することが好ましく、流加培養液に含まれるリン酸の量としては、P/C ratioで2以下、好ましくは1.5以下、さらに好ましくは1以下である(米国特許5,763,230号明細書参照)。
【0048】
本発明で連続培養法を用いる場合には、引き抜きは流加と同時に行ってもよいし、一部引き抜いたあとで流加を行ってもよい。また培養液をL−アミノ酸と細胞を含んだまま引き抜いて、細胞だけ発酵槽に戻す菌体を再利用する連続培養法でもよい(フランス特許2669935号明細書参照)。連続的あるいは間欠的に栄養源を流加する方法は流加培養と同様の方法が用いられる。
【0049】
ここで、培養液を間欠的に引き抜く場合には、予定したL−アミノ酸濃度に到達したときに、L−アミノ酸を一部引き抜いて、新たに培地を流加して培養を行う。また、添加する培地の量は、最終的に引き抜く前の培養液量と同量になるように培養することが好ましい。ここで同量とは、引き抜く前の培養液量と93〜107%の程度の量を意味する。
【0050】
培養液を連続的に引き抜く場合には、栄養培地を流加させると同時に、あるいは流加させたあとに開始することが望ましく、例えば開始時間としては最大で流加を始めた5時間後、望ましくは3時間後、さらに望ましくは最大で1時間後である。また引き抜く培養液量としては、流加させる量と同量で引き抜くことが好ましい。
【0051】
菌体を再利用する連続培養法とは、予定した目的物質濃度に達したときに、発酵培地を間欠的にあるいは連続して引き抜き、目的物質のみを取り出し、菌体を含むろ過残留物若しくは遠心上澄み液を発酵槽中に再循環させる方法であり、例えばフランス特許2669935号明細書を参照にして実施することができる。
【0052】
また、本発明の晶析方法で析出した結晶は、培養途中で発酵槽から引き抜いてもよい。具体的には、発酵槽で本発明の方法を用いて、晶析発酵を行い、目的物質、菌体を含む発酵液を発酵液から引抜、アミノ酸の結晶を遠心処理・濃縮し、結晶を取り出し、発酵液を発酵槽に戻す方法により、生産性を高める方法を用いることが出来る。例えば、図1に記載の装置で、アミノ酸、菌体を含む発酵液をラインAから循環させ、アミノ酸の結晶を遠心処理Bで濃縮しラインCより引抜き、発酵液をラインDより発酵槽に戻す方法を用いることが出来る。この際、菌体は発酵槽に戻しても、戻さなくてもよい。結晶の遠心分離処理には、液体サイクロン(特開平5-92944)を用いると好適である。
【0053】
さらに、核酸の製造法においては、本発明の方法により製造されたイノシン又はグアノシンに、プリンヌクレオシドホスホリラーゼおよびホスホリボシルトランスフェラーゼを作用させることにより、5’−イノシン酸あるいは5’−グアニル酸が得られる。
【0054】
また、本発明の微生物を用いて生産されたプリンヌクレオシドに、ホスホトランスフェラーゼを作用させることによってリン酸化し、プリンヌクレオチド(ヌクレオシド−5’−燐酸エステル)を生産することも可能である。(特開2000-295996)例えば、エシェリヒア・コリのイノシングアノシンキナーゼをコードする遺伝子を導入したエシェリヒア属細菌を用いるプリンヌクレオチドの製造法(WO91/08286号パンフレット)、エキシグオバクテリウム・アセチリカムのイノシングアノシンキナーゼをコードする遺伝子を導入したコリネバクテリウム・アンモニアゲネスを用いたプリンヌクレオチドの製造法(WO96/30501号パンフレット)を採用することができる。
【0055】
また、本発明の微生物を用いて生産されたプリンヌクレオシドに、ポリ燐酸、フェニル燐酸、カルバミル燐酸からなる群より選択された燐酸供与体と、ヌクレオシド−5’−燐酸エステルを生成する能力を有する微生物や、酸性フォスファターゼ(EC 3.1.3.2)を作用させることによって、プリンヌクレオチド(ヌクレオシド−5’−燐酸エステル)を生産することも可能である。ヌクレオシド−5’−燐酸エステルを生成する能力を有する微生物は、プリンヌクレオシドをプリンヌクレオチドに変換する能力を有するものであれば特に制限されないが、例えば、国際公開パンフレットWO9637603号に記載されたような微生物が挙げられる。
【0056】
また、特開平07−231793に開示されているようなエシェリヒア・ブラッタエ(Escherichia blattae)JCM 1650、セラチア・フィカリア(Serratia ficaria)ATCC 33105、クレブシエラ・プランティコラ(Klebsiella planticola)IFO 14939 (ATCC 33531)、クレブシエラ・ニューモニエ(Klebsiella pneumoniae)IFO 3318 (ATCC 8724)、クレブシエラ・テリゲナ(Klebsiella terrigena)IFO 14941 (ATCC 33257)、モルガネラ・モルガニ(Morganella morganii)IFO 3168、エンテロバクター・アエロゲネス(Enterobacter aerogenes)IFO 12010、エンテロバクター・アエロゲネス IFO 13534 (ATCC 13048)、クロモバクテリウム・フルヴィアティレ(Chromobacterium fluviatile)IAM 13652、クロモバクテリウム・ヴィオラセウム(Chromobacterium violaceum)IFO 12614、セデセア・ラパゲイ(Cedecea lapagei)JCM 1684、セデセア・ダヴィシエ(Cedecea davisiae)JCM 1685、セデセア・ネテリ(Cedecea neteri)JCM 5909などを用いることもできる。
【0057】
酸性フォスファターゼとしては、例えば、特開2002-000289に開示されているようなものを用いることができ、より好ましくはヌクレオシドに対する親和性が上昇した酸性フォスファターゼ(特開平10-201481参照)やヌクレオチダーゼ活性が低下した変異型酸性フォスファターゼ(WO9637603参照)、燐酸エステル加水分解活性が低下した変異型酸性フォスファターゼ(特開2001-245676)などを用いることができる。
【0058】
本発明の微生物を用いて生産されたプリンヌクレオシドを化学的にリン酸化することにより、プリンヌクレオチドを得ることも可能である。(Bulletin of the Chemical Society of Japan 42,3505)また、微生物が有しているATP再生系を利用して、本発明のXMP生産能を有する微生物とXMPアミナーゼ活性を共役させることによってGMPを得る方法、イノシンキナーゼを共役させることによってIMPを得る方法も採用できる(Biosci.Biotech.Biochem.,51,840(1997) 特開昭63-230094)
【0059】
上記プリンヌクレオチドの製造に用いる、本発明の方法により製造されたイノシン又はグアノシン、又はプリンヌクレオシドは、精製されたものであってもよいが、プリンヌクレオシドの発酵液又はプリンヌクレオシドを含む粗精製物であってもよい。
<2>本発明に用いることが出来る微生物
【0060】
本発明に用いる微生物は、L−アミノ酸又は核酸生産能を有し、液体培地で培養したときに培地にL−アミノ酸又は核酸を蓄積させることができる微生物であれば、特に制限されない。蓄積するL−アミノ酸又は核酸の量は、培地から回収できる程度に蓄積できればいずれでもよいが、目的物質を培地中に晶析できる能力を有することが好ましく、例えば前記表1、2に記載された以上の濃度の目的物質を蓄積できることが望ましい。
【0061】
L−グルタミン酸を含む水溶液のpHを低下させると、L−グルタミン酸はγ−カルボキシル基のpKa(4.25)付近で溶解度は著しく減少し、等電点(pH3.2)で溶解度は最も低くなる。培地組成によっても異なるが、通常には、L−グルタミン酸は約30℃においては、pH3.2では10〜20g/L、pH4.0では30〜40g/L、pH4.7では50〜60g/L溶解する。
【0062】
本発明に用いる微生物又はそれを育種するための親株としては、エシェリヒア属細菌、パントエア属細菌を代表とする腸内細菌科に属する微生物や、コリネ型細菌等を用いることができる。また、メタノールからL−アミノ酸を生産できる、メチロフィラス属細菌、メチロバチルス属細菌などのメタノール資化性細菌を用いてもよい。その他の腸内細菌科に属する微生物としては、エンテロバクター(Enterobacter)属、、クレブシエラ(Klebsiella)属、セラチア(Serratia)属、エルビニア(Erwinia)属、サルモネラ(Salmonella)属、モルガネラ(Morganella)属などのγ−プロテオバクテリアに属する腸内細菌が挙げられ、またその他の微生物としては、アリサイクロバチルス(Alicyclobacillus)属細菌、バチルス(Bacillus)属細菌、サッカロマイセス属やキャンディダ属等に属する酵母などが挙げられる。
【0063】
エシェリヒア属細菌としては、ナイトハルトらの著書(Neidhardt,F.C.et.al., Escherichia coli and Salmonella Typhimurium, American Society for Microbiology, Washington D.C.,1208, table 1)に挙げられるもの、例えばエシェリヒア・コリ等が利用できる。エシェリヒア・コリの野生株としては、例えばK12株又はその誘導体、エシェリヒア・コリ MG1655株(ATCC No.47076)、及びW3110株(ATCC No.27325)等が挙げられる。これらを入手するには、例えばアメリカン・タイプ・カルチャー・コレクション(ATCC)より分譲を受けることができる(住所 ATCC, Address: P.O. Box 1549, Manassas, VA 20108, 1,United States of America)。
【0064】
また、エンテロバクター属細菌としては、エンテロバクター・アグロメランス(Enterobacter agglomerans)、エンテロバクター・アエロゲネス(Enterobacter aerogenes)等、パントエア属細菌としてはパントエア・アナナティス(Pantoea ananatis)が挙げられる。尚、近年、エンテロバクター・アグロメランスは、16S rRNAの塩基配列解析などにより、パントエア・アグロメランス(Pantoea agglomerans)又はパントエア・アナナティス(Pantoea ananatis)、パントエア・スチューアルティ(Pantoea stewartii)等に再分類されているものがある。本発明においては、腸内細菌科に分類されるものであれば、エンテロバクター属又はパントエア属のいずれに属するものであってもよい。パントエア・アナナティスを遺伝子工学的手法を用いて育種する場合には、パントエア・アナナティスAJ13355株(FERM BP-6614)、AJ13356株(FERM BP-6615)、AJ13601株(FERM BP-7207)及びそれらの誘導体を用いることができる。これらの株は、分離された当時はエンテロバクター・アグロメランスと同定され、エンテロバクター・アグロメランスとして寄託されたが、上記のとおり、16S rRNAの塩基配列解析などにより、パントエア・アナナティスに再分類されている。
【0065】
メチロフィラス属細菌として具体的には、メチロフィラス・メチロトロファスが挙げられ、代表的な株としてはAS1株(NCIMB10515)等が挙げられる。メチロフィラス・メチロトロファスAS1株はナショナル・コレクション・オブ・インダストゥリアル・アンド・マリン・バクテリア(National Collections of Industrial and Marine Bacteria、住所 NCIMB Lts., Torry Research Station 135, Abbey Road, Aberdeen AB9 8DG, United Kingdom)から入手可能である。
【0066】
メチロバチラス属細菌として具体的には、メチロバチラス・グリコゲネス(Methylobacillus glycogenes)、メチロバチラス・フラゲラタム(Methylobacillu flagellatum)等が挙げられる。メチロバチラス・グリコゲネスとしては、T-11株(NCIMB 11375)、ATCC 21276株、 ATCC 21371株、ATR80株(Appl. Microbiol. Biotechnol., (1994)、42巻, p67-72に記載)、A513株(Appl. Microbiol. Biotechnol., (1994)、42巻, p67-72に記載)等が挙げられる。メチロバチラス・グリコゲネスNCIMB 11375株は、ナショナル・コレクション・オブ・インダストゥリアル・アンド・マリン・バクテリア(National Collections of Industrial and Marine Bacteria、住所 NCIMB Lts., Torry Research Station 135, A
bbey Road, Aberdeen AB9 8DG, United Kingdom)から入手可能である。また、メチロバチラス・フラゲラタムとしては、KT株(Arch. Microbiol., (1988), 149巻、p441-446に記載)等が挙げられる。
【0067】
コリネ型細菌としては、バージーズ・マニュアル・オブ・デターミネイティブ・バクテリオロジー(Bergey's Manual of Determinative Bacteriology)第8版599頁(1974)に定義されている一群の微生物であり、好気性,グラム陽性,非抗酸性,胞子形成能を有しない桿菌に分類される微生物が利用できる。なお、コリネ型細菌は、従来ブレビバクテリウム属に分類されていたが現在はコリネバクテリウム属細菌として統合された細菌(Int.J. Syst. Bacteriol., 41, 255 (1991))、及びコリネバクテリウム属と非常に近縁なブレビバクテリウム属細菌及びミクロバテリウム属細菌を含む。
【0068】
このようなコリネ型細菌の例として以下のものが挙げられる。
コリネバクテリウム・アセトアシドフィラム
コリネバクテリウム・アセトグルタミカム
コリネバクテリウム・アルカノリティカム
コリネバクテリウム・カルナエ
コリネバクテリウム・グルタミカム
コリネバクテリウム・リリウム
コリネバクテリウム・メラセコーラ
コリネバクテリウム・サーモアミノゲネス(コリネバクテリウム・エフィシェンス)
コリネバクテリウム・ハーキュリス
ブレビバクテリウム・ディバリカタム
ブレビバクテリウム・フラバム
ブレビバクテリウム・インマリオフィラム
ブレビバクテリウム・ラクトファーメンタム
ブレビバクテリウム・ロゼウム
ブレビバクテリウム・サッカロリティカム
ブレビバクテリウム・チオゲニタリス
コリネバクテリウム・アンモニアゲネス
ブレビバクテリウム・アルバム
ブレビバクテリウム・セリヌム
ミクロバクテリウム・アンモニアフィラム
【0069】
具体的には、下記のような菌株を例示することができる。
コリネバクテリウム・アセトアシドフィラム ATCC13870
コリネバクテリウム・アセトグルタミカム ATCC15806
コリネバクテリウム・アルカノリティカム ATCC21511
コリネバクテリウム・カルナエ ATCC15991
コリネバクテリウム・グルタミカム ATCC13020, ATCC13032, ATCC13060
コリネバクテリウム・リリウム ATCC15990
コリネバクテリウム・メラセコーラ ATCC17965
コリネバクテリウム・エッフィシエンス AJ12340(FERM BP-1539)
コリネバクテリウム・ハーキュリス ATCC13868
ブレビバクテリウム・ディバリカタム ATCC14020
ブレビバクテリウム・フラバム ATCC13826, ATCC14067, AJ12418(FERM BP-2205)
ブレビバクテリウム・インマリオフィラム ATCC14068
ブレビバクテリウム・ラクトファーメンタム ATCC13869(コリネバクテリウム・グルタミカムATCC13869)
ブレビバクテリウム・ロゼウム ATCC13825
ブレビバクテリウム・サッカロリティカム ATCC14066
ブレビバクテリウム・チオゲニタリス ATCC19240
コリネバクテリウム・アンモニアゲネス ATCC6871、ATCC6872
ブレビバクテリウム・アルバム ATCC15111
ブレビバクテリウム・セリヌム ATCC15112
ミクロバクテリウム・アンモニアフィラム ATCC15354
【0070】
これらを入手するには、例えばアメリカン・タイプ・カルチャー・コレクションより分譲を受けることができる(住所 P.O. Box 1549, Manassas, VA 2010812301 Parklawn Drive, Rockville, Maryland 20852, United States of America)。すなわち、菌株毎に対応する登録番号が付与されており、この登録番号を利用して分譲を受けることができる。各菌株に対応する登録番号はアメリカン・タイプ・カルチャー・コレクションのカタログに記載されている(http://www.atcc.org/参照)。また、AJ12340株は、1987年10月27日付けで通商産業省工業技術院生命工学工業技術研究所(現独立行政法人産業技術総合研究所 特許生物寄託センター)(〒305-5466 日本国茨城県つくば市東1丁目1番地1 中央第6)にFERM BP-1539の受託番号でブダペスト条約に基づいて寄託されている。また、AJ12418株は、1989年1月5日付けで通商産業省工業技術院生命工学工業技術研究所にFERM BP-2205の受託番号でブダペスト条約に基づいて寄託されている。
【0071】
バチルス属細菌を用いるときは、バチルス属細菌としては、バチルス・ズブチリス、バチルス・アミロリケファシエンス、バチルス・プミルス等が挙げられる。
バチルス・ズブチリスとしては、バチルス・ズブチリス168 Marburg(ATCC6051)、バチルス・ズブチリスPY79(Plasmid, 1984, 12, 1-9)等が、バチルス・アミロリケファシエンスとしては、バチルス・アミロリケファシエンスT(ATCC23842)、及びバチルス・アミロリケファシエンスN(ATCC23845)等が挙げられる。また、バチルス・プミルスとしては、バチルス・プミルス Gottheil No.3218(ATCC No.21005)(米国特許第3,616,206号)等が挙げられる。
【0072】
以下、上述したような親株にL−アミノ酸又は核酸生産能を付与する方法について述べる。
【0073】
L−アミノ酸又は核酸生産能を付与するには、栄養要求性変異株、アナログ耐性株又は代謝制御変異株の取得や、L−アミノ酸又は核酸の生合成系酵素の発現が増強された組換え株の創製等、従来、コリネ型細菌又はエシェリヒア属細菌等の育種に採用されてきた方法を適用することができる(アミノ酸発酵、(株)学会出版センター、1986年5月30日初版発行、第77〜100頁参照)。ここで、L−アミノ酸生産菌の育種において、付与される栄養要求性、アナログ耐性、代謝制御変異等の性質は、単独でもよく、2種又は3種以上であってもよい。また、発現が増強されるL−アミノ酸生合成系酵素も、単独であっても、2種又は3種以上であってもよい。さらに、栄養要求性、アナログ耐性、代謝制御変異等の性質の付与と、生合成系酵素の増強が組み合わされてもよい。
【0074】
L−アミノ酸又は核酸生産能を有する栄養要求性変異株、L−アミノ酸又は核酸のアナログ耐性株、又は代謝制御変異株を取得するには、親株又は野生株を通常の変異処理、すなわちX線や紫外線の照射、またはN−メチル−N'−ニトロ−N−ニトロソグアニジン等の変異剤処理などによって処理し、得られた変異株の中から、栄養要求性、アナログ耐性、又は代謝制御変異を示し、かつL−アミノ酸生産能を有するものを選択することによって得ることができる。
【0075】
L−アミノ酸生産能を有する栄養要求性変異株、L−アミノ酸のアナログ耐性株、又は
代謝制御変異株は、親株又は野生株を通常の変異処理、すなわちX線や紫外線の照射、またはN−メチル−N'−ニトロ−N−ニトロソグアニジン(NTG)、エチルメタンスルフォネート(EMS)等の変異剤処理などによって処理し、得られた変異株の中から、栄養要求性、アナログ耐性、又は代謝制御変異を示し、かつL−アミノ酸生産能を有するものを選択することによって得ることができる。
以下、具体的にL−アミノ酸生産能を付与する方法とアミノ酸生産菌について例示する。
【0076】
L−トリプトファン、L−フェニルアラニン、L−チロシンは共に芳香族アミノ酸で生合成系が共通しており、芳香族アミノ酸の生合成系酵素をコードする遺伝子としては、デオキシアラビノ−ヘプツロン酸リン酸シンターゼ(aroG)、3−デヒドロキネートシンターゼ(aroB)、シキミ酸デヒドロゲナーゼ(aroE)、シキミ酸キナーゼ(aroL)、5−エノール酸ピルビンシキミ酸3−リン酸シンターゼ(aroA)、コリスミ酸シンターゼ(aroC)が挙げられる(欧州出願公開763127号明細書)。また、これらの遺伝子はチロシンリプレッサー(tyrR)によって制御されることが知られており、tyrR遺伝子を欠損させることによって、芳香族アミノ酸の生合成系酵素活性を上昇してもよい(欧州特許763127号明細書参照)。尚、酵素名の後のカッコ内は、遺伝子名である(以下の記載においても同様)。
また、それぞれのアミノ酸生産能を強化する場合、目的とする芳香族アミノ酸以外の生合成系を弱化させてもよい。例えば、目的アミノ酸がL−トリプトファンの場合、L−フェニルアラニン生合成系、L−チロシン生合成系を弱化させてもよい(US4,371,614)。
【0077】
また、3−デオキシ−D−アラビノヘプツロン酸−7−リン酸シンターゼ(aroF、aroG)は、芳香族アミノ酸によるフィードバック阻害を受けるので、フィードバック阻害を受けないように改変してもよい。例えば、aroFの場合、N末端より147位のL−アスパラギン酸または181位のL−セリンが他のアミノ酸残基に、aroGの場合、N末端より146位のL−アスパラギン酸、147位のL−メチオニン、150位のL−プロリンもしくは202位のL−アラニンの1アミノ酸残基、または157位のL−メチオニン及び219位のL−アラニンの2アミノ酸残基を他のアミノ酸に置換した変異型aroF、aroG遺伝子を宿主に導入することによって、芳香族生産アミノ酸生産菌を得ることができる(EP0488424)。
【0078】
また、分岐鎖アミノ酸の合成に関与する遺伝子として、ilvGMEDAオペロンが挙げられるが、同オペロンは、L−バリン及び/又はL−イソロイシン及び/又はL−ロイシンによるオペロンの発現調節(アテニュエーション)を受けるので、アテニュエーションに必要な領域が除去又は変異されたilvGMEDAオペロンを微生物に保持させることによって、これらのL−アミノ酸の生産性を向上させることができる。
【0079】
芳香族アミノ酸、分岐鎖アミノ酸はそれぞれ生合成系が共通しており、目的とするL−アミノ酸以外の芳香族アミノ酸、分岐鎖アミノ酸に固有の生合成系を弱化した株を用いることが好ましい。例えば、目的アミノ酸がL−トリプトファンの場合、L−フェニルアラニン、L−チロシン固有の生合成系を弱化すること、目的アミノ酸がL−フェニルアラニンの場合、L−トリプトファン、L−チロシン固有の生合成系を弱化すること、目的アミノ酸がL−バリンの場合、L−ロイシン、L−イソロイシン固有の生合成系を弱化すること、目的アミノ酸がL−イソロイシンの場合、L−バリン、L−ロイシン固有の生合成系を弱化すること、目的アミノ酸がL−ロイシンの場合、L−バリン、L−イソロイシン固有の生合成系を弱化することによって、目的L−アミノ酸を効率よく生産する菌株を得ることができる。生合成系を弱化することは、それぞれその生合成系の酵素をコードする遺伝子に変異を導入すること、また合成培地中で弱化したい生合成系により合成されるL−アミノ酸を要求する株を、同L−アミノ酸を含有する合成培地を用いて取得することにより達成できる。
以下に、L−アミノ酸生産能を付与する方法及び本発明で使用することのできるL−ア
ミノ酸生産能が付与された微生物を例示する。
【0080】
L−トリプトファン生産菌
L−トリプトファン生産菌又はそれを誘導するための親株の例としては、変異trpS遺伝子によりコードされるトリプトファニル-tRNAシンテターゼが欠損したE. coli JP4735/pMU3028 (DSM10122)及びJP6015/pMU91 (DSM10123) (米国特許第5,756,345号)、セリンによるフィードバック阻害を受けないフォスフォグリセリレートデヒドロゲナーゼをコードするserAアレル及びトリプトファンによるフィードバック阻害を受けないアントラニレートシンターゼをコードするtrpEアレルを有するE. coli SV164 (pGH5) (米国特許第6,180,373号)、トリプトファナーゼが欠損したE. coli AGX17 (pGX44) (NRRL B-12263)及びAGX6(pGX50)aroP (NRRL B-12264) (米国特許第4,371,614号)、フォスフォエノールピルビン酸生産能が増大したE. coli AGX17/pGX50,pACKG4-pps (WO9708333, 米国特許第6,319,696号)などのエシェリヒア属に属する株が挙げられるが、これらに限定されない。yedA遺伝子またはyddG遺伝子にコードされるタンパク質の活性が増大したエシェリヒア属に属するL−トリプトファン生産菌も使用できる(米国特許出願公開2003/0148473 A1及び2003/0157667
A1)。
【0081】
L−トリプトファン生産菌又はそれを誘導するための親株の例としては、アントラニレートシンターゼ(trpE)、フォスフォグリセレートデヒドロゲナーゼ(serA)、及び、トリプトファンシンターゼ(trpAB)から選ばれる酵素の活性の一種以上が増大した株も挙げられる。アントラニレートシンターゼ及びフォスフォグリセレートデヒドロゲナーゼは共にL−トリプトファン及びL−セリンによるフィードバック阻害を受けるので、フィードバック阻害を解除する変異をこれらの酵素に導入してもよい。このような変異を有する株の具体例としては、脱感作型アントラニレートシンターゼを保持するE. coli SV164、及び、フィードバック阻害が解除されたフォスフォグリセレートデヒドロゲナーゼをコードする変異serA遺伝子を含むプラスミドpGH5 (WO 94/08031)をE. coli SV164に導入することにより得られた形質転換株が挙げられる。
【0082】
また、L−トリプトファン生産菌又はそれを誘導するための親株の例として、3−フォスフォセリンフォスファターゼ(serB)活性を増大した株(US4,371,614)、フォスフォエノールピルビン酸カルボキシキナーゼ(pckA)を増大した株(WO2004/090125)、マレートシンターゼ・イソシトレートリアーゼ・イソシトレートデヒドロゲナーゼキナーゼ/フォスファターゼオペロン(aceオペロン)が構成的に発現するか、又は同オペロンの発現が強化された株(WO2005/103275)が挙げられる。
【0083】
L−トリプトファン生産菌又はそれを誘導するための親株の例としては、阻害解除型アントラニレートシンターゼをコードする遺伝子を含むトリプトファンオペロンが導入された株(特開昭57-71397号, 特開昭62-244382号, 米国特許第4,371,614号)も挙げられる。さらに、トリプトファンオペロン(trpBA)中のトリプトファンシンターゼをコードする遺伝子の発現を増大させることによりL−トリプトファン生産能を付与してもよい。トリプトファンシンターゼは、それぞれtrpA及びtrpB遺伝子によりコードされるα及びβサブユニットからなる。さらに、イソシトレートリアーゼ−マレートシンターゼオペロンの発現を増大させることによりL−トリプトファン生産能を改良してもよい(WO2005/103275)。
【0084】
コリネ型細菌としてはサルフアグアニジンに耐性株であるコリネバクテリウム・グルタミクムAJ12118(FERM BP-478 特許01681002号)、トリプトファンオペロンが導入されたコリネ型細菌(特開S63240794号公報)、コリネ型細菌由来のシキミ酸キナ−ゼをコ−ドする遺伝子を導入したコリネ型細菌(特開01994749号公報)を用いることができる。
【0085】
L−フェニルアラニン生産菌
L−フェニルアラニン生産菌又はそれを誘導するための親株の例としては、E.coli AJ12739 (tyrA::Tn10, tyrR) (VKPM B-8197)、変異型pheA34遺伝子を保持するE.coli HW1089
(ATCC 55371) (米国特許第 5,354,672号)、E. coli MWEC101-b (KR8903681)、E.coli NRRL B-12141, NRRL B-12145, NRRL B-12146及びNRRL B-12147 (米国特許第4,407,952号)などのエシェリヒア属に属する株が挙げられるが、これらに限定されない。また、親株として、E. coli K-12 [W3110 (tyrA)/pPHAB] (FERM BP-3566)、E. coli K-12 [W3110 (tyrA)/pPHAD] (FERM BP-12659)、E. coli K-12 [W3110 (tyrA)/pPHATerm] (FERM BP-12662)及びAJ 12604と命名されたE. coli K-12 [W3110 (tyrA)/pBR-aroG4, pACMAB] (FERM BP-3579)も使用できる(EP 488424 B1)。さらに、yedA遺伝子またはyddG遺伝子にコードされるタンパク質の活性が増大したエシェリヒア属に属するL−フェニルアラニン生産菌も使用できる(米国特許出願公開2003/0148473 A1及び2003/0157667 A1)。
【0086】
コリネ型細菌のフェニルアラニン生産菌としては、ホスホエノールピルビン酸カルボキシラーゼまたはピルビン酸キナーゼ活性が低下したCornebacterium glutamicum BPS-13株
(FERM BP-1777, K77 (FERM BP-2062) 及び K78 (FERM BP-2063)(欧州特許公開公報331145号 JP 02303495)、チロシン要求性株(JP 05049489)等を使用することができる。
【0087】
また、フェニルアラニン生産菌としては、副生物を細胞内に取り込むように改変すること、例えば、L−トリプトファンの取り込み遺伝子tnaB,mtrや、L−チロシンの取り込み遺伝子であるtyrPの発現量を向上させることによっても、効率よくL−フェニルアラニンを生産する菌株を取得することができる(EP1484410)。
【0088】
L−チロシン生産菌
チロシン生産菌としては、チロシンによる阻害を受けない脱感作型のプレフェン酸デヒドラターゼ遺伝子(tyrA)を有するエシェリヒア属細菌(欧州特許出願公開1616940号公報)が挙げられる。
【0089】
L−バリン生産菌
L−バリン生産菌又はそれを誘導するための親株の例としては、ilvGMEDAオペロンを過剰発現するように改変された株(米国特許第5,998,178号)が挙げられるが、これらに限定されない。ilvGMEDAオペロンのアテニュエーションに必要な領域を除去し、生産されるL−バリンによりオペロンの発現が減衰しないようにすることが好ましい。さらに、オペロンのilvA遺伝子が破壊され、スレオニンデアミナーゼ活性が減少することが好ましい。
【0090】
本発明のL−バリン生産菌を誘導するための親株の例としては、アミノアシルt-RNAシンテターゼに変異を有する変異株(米国特許第5,658,766号)も挙げられる。例えば、イソロイシンtRNAシンテターゼをコードするileS 遺伝子に変異を有するE. coli VL1970が使用できる。E. coli VL1970は、1988年6月24日、ルシアン・ナショナル・コレクション・オブ・インダストリアル・マイクロオルガニズムズ(VKPM) (1 Dorozhny proezd., 1 Moscow 117545, Russia)に、受託番号VKPM B-4411で寄託されている。
さらに、生育にリポ酸を要求する、及び/または、H+-ATPaseを欠失している変異株(WO96/06926)を親株として用いることができる。
【0091】
コリネ型細菌のL−バリン生産菌としては、例えば、L−バリン酸生合成に関与する酵素をコードする遺伝子の発現が増強するように改変した菌株を挙げることができる。L−バリン酸生合成に関与する酵素としては、例えば、ilvBNCオペロンによりコードされる酵素、すなわちilvBNによりコードされるアセトヒドロキシ酸シンターゼやivlCによりコードされるイソメロリダクターゼ(国際公開パンフレットWO00/50624号)が挙げられる。尚、ilvBNCオペロンは、L−バリン及び/又はL−イソロイシン及び/又はL−ロイシンによる
オペロンの発現調節を受けるので、生成するL−バリンによる発現抑制を解除するためにアテニュエーションを解除することが望ましい。
【0092】
L−バリン生産能を有するコリネ型細菌としては、L−バリン産生を減少させる物質代謝経路に関与する、少なくとも1種の酵素の活性を低下あるいは欠損させることにより行ってもよい。例えば、L−ロイシン合成に関与するスレオニンデヒドラターゼやD-パントセナート合成に関与する酵素の活性を低下させることが考えられる(国際公開パンフレットWO0050624号)。
【0093】
L−バリン生産能を付与する別の方法として、アミノ酸アナログなどへの耐性を付与する方法も挙げられる。
例えば、L−イソロイシンおよびL−メチオニン要求性,ならびにD−リボ−ス,プリンリボヌクレオシドまたはピリミジンリボヌクレオシドに耐性を有し,かつL−バリン生産能を有する変異株(FERM P-1841、FERM P-29、特公昭53-025034) や、ポリケトイド類に耐性を有する変異株(FERM P-1763、FERM P-1764、特公平06-065314) 、更には酢酸を唯一の炭素源とする培地でL−バリン耐性を示し、且つグルコースを唯一の炭素源とする培地でピルビン酸アナログ(-フルオロピルビン酸等)に感受性を有する変異株(FERM BP-3006、FERM BP-3007、特許3006929号)が挙げられる。
【0094】
L−イソロイシン生産菌
L−イソロイシン生産菌又はそれを誘導するための親株の例としては、6−ジメチルアミノプリンに耐性を有する変異株(特開平5-304969号)、チアイソロイシン、イソロイシンヒドロキサメートなどのイソロイシンアナログに耐性を有する変異株、さらにDL−エチオニン及び/またはアルギニンヒドロキサメートに耐性を有する変異株(特開平5-130882号).が挙げられるが、これらに限定されない。さらに、スレオニンデアミナーゼ、アセトヒドロキシ酸シンターゼなどのL−イソロイシン生合成に関与するタンパク質をコードする遺伝子で形質転換された組換え株もまた親株として使用できる(特開平2-458号, FR 0356739, 及び米国特許第5,998,178号)。
【0095】
コリネ型細菌のL−イソロイシン生産菌としては、分岐鎖アミノ酸排出タンパク質をコードするbrnE遺伝子を増幅したコリネ型細菌(特開2001-169788)、L−リジン生産菌とのプロトプラスト融合によりL−イソロイシン生産能を付与したコリネ型細菌(特開昭62-74293)、ホモセリンデヒドロゲナーゼを強化したコリネ型細菌(特開昭62-91193)、スレオニンハイドロキサメート耐性株(特開昭62-195293)、α−ケトマロン耐性株(特開昭61-15695)、メチルリジン耐性株(特開昭61-15696)が挙げられる。
【0096】
L−ロイシン生産菌
L−ロイシン生産菌又はそれを誘導するための親株の例としては、ロイシン耐性のE. coil株 (例えば、57株 (VKPM B-7386, 米国特許第6,124,121号))またはβ−2−チエニルアラニン、3−ヒドロキシロイシン、4−アザロイシン、5,5,5-トリフルオロロイシンなどのロイシンアナログ耐性のE. coli株(特公昭62-34397号及び特開平8-70879号)、WO96/06926に記載された遺伝子工学的方法で得られたE. coli株、E. coli H-9068 (特開平8-70879号)などのエシェリヒア属に属する株が挙げられるが、これらに限定されない。
【0097】
本発明の細菌は、L−ロイシン生合成に関与する遺伝子の1種以上の発現が増大されることにより改良されていてもよい。このような遺伝子の例としては、好ましくはL−ロイシンによるフィードバック阻害が解除されたイソプロピルマレートシンターゼをコードする変異leuA遺伝子(米国特許第6,403,342号)に代表される、leuABCDオペロンの遺伝子が挙げられる。さらに、本発明の細菌は、細菌の細胞からL−アミノ酸を排出するタンパク質をコードする遺伝子の1種以上の発現が増大されることにより改良されていてもよい。こ
のような遺伝子の例としては、b2682遺伝子及びb2683遺伝子(ygaZH遺伝子) (EP 1239041 A2)が挙げられる。
【0098】
コリネ型細菌のL−ロイシン生産菌としては、2−チアゾールアラニンかつβ−ハイドロキシロイシン耐性株(特開平8−266295)、バリンアナログ耐性株(特開昭63−248392)、バリン要求性株(特公昭38−4395)、S−(2−アミノエチル)−L−システイン(AEC)耐性株(特公昭51−37347)、フェニルアラニン、バリン、イソロイシン要求性株(特公昭54−36233)が挙げられる。
【0099】
L−グルタミン酸生産菌
L−グルタミン酸生産菌として好適な菌株は、例えば、L−グルタミン酸生合成に関与する酵素をコードする遺伝子の発現が増強するように改変する方法を挙げることができる。L−グルタミン酸生合成に関与する酵素としては、かかる遺伝子の例としては、グルタメートデヒドロゲナーゼ(gdhA)、グルタミンシンテターゼ(glnA)、グルタメートシンテターゼ(gltAB)、イソシトレートデヒドロゲナーゼ(icdA)、アコニテートヒドラターゼ(acnA, acnB)、シトレートシンターゼ(gltA)、フォスフォエノールピルベートカルボシラーゼ(ppc)、ピルベートデヒドロゲナーゼ(aceEF, lpdA)、ピルベートキナーゼ(pykA, pykF)、フォスフォエノールピルベートシンターゼ(ppsA)、エノラーゼ(eno)、フォスフォグリセロムターゼ(pgmA, pgmI)、フォスフォグリセレートキナーゼ(pgk)、グリセルアルデヒド-3-フォスフェートデヒドロゲナーゼ(gapA)、トリオースフォスフェートイソメラーゼ(tpiA)、フルクトースビスフォスフェートアルドラーゼ(fbp)、フォスフォフルクトキナーゼ(pfkA, pfkB)、グルコースフォスフェートイソメラーゼ(pgi)、メチルクエン酸シンターゼ(prpC)などが挙げられるがこれらに限定されない。
【0100】
シトレートシンテターゼ遺伝子、フォスフォエノールピルベートカルボキシラーゼ遺伝子、イソクエン酸デヒドロゲナーゼ、ピルベートデヒドロゲナーゼ及び/またはグルタメートデヒドロゲナーゼ遺伝子の発現が増大するように改変された株の例としては、EP1078989A、EP955368A及びEP952221A、EP1033407Aに開示されたものが挙げられる。
【0101】
L−グルタミン酸生産能を付与するための改変は、L−グルタミン酸の生合成経路から分岐して他の化合物を生成する反応を触媒する酵素の活性を低下または欠損させることにより行ってもよい。L−グルタミン酸の生合成経路から分岐してL−グルタミン酸以外の化合物を生成する反応を触媒する酵素としては、イソクエン酸リアーゼ、α−ケトグルタル酸デヒドロゲナーゼ、アセトヒドロキシ酸シンターゼ、アセト乳酸シンターゼ、ギ酸アセチルトランスフェラーゼ、乳酸デヒドロゲナーゼ、グルタミン酸デカルボキシラーゼ、1−ピロリン5−カルボキシレートデヒドロゲナーゼなどが挙げられる。
【0102】
例えば、α−ケトグルタル酸デヒドロゲナーゼ活性を低下させるには該酵素のE1oサブユニットをコードするsucA(odhA)遺伝子を用いて改変すればよい。α−ケトグルタル酸デヒドロゲナーゼ活性が低下した株として、例えば、以下の株が挙げられる。
ブレビバクテリウム・ラクトファーメンタムΔS株(国際公開95/34672号パンフレット)
ブレビバクテリウム・ラクトファーメンタムAJ12821(FERMBP−4172;フランス特許公報9401748号明細書参照)
ブレビバクテリウム・フラバムAJ12822 (FERMBP−4173;フランス特許公報9401748号明細書参照)
コリネバクテリウム・グルタミカムAJ12823(FERMBP−4174;フランス特許公報9401748号明細書参照)
パントエア・アナナティスAJ13601 (FERM BP-7207)
クレブシエラ・プランティコーラAJ13410株(FERM BP-6617)
パントエア・アナナティスAJ13355 (FERM BP-6614)
が挙げられる。
ここで、パントエア・アナナティスAJ13356は、αKGDH-E1サブユニット遺伝子(sucA)の破壊によりα-ケトグルタレートデヒドロゲナーゼ活性が欠損している。この株は、単離された時には、エンテロバクター・アグロメランスと同定され、エンテロバクター・アグロメランスAJ13356として寄託された。しかし、16S rRNAの塩基配列などに基づき、パントエア・アナナティスに再分類された。AJ13356は、上記寄託機関にエンテロバクター・アグロメランスとして寄託されているが、本明細書では、パントエア・アナナティスとして記載する。
【0103】
さらにコリネ型細菌にL−グルタミン酸生産能を付与する方法として、yggB遺伝子(NCgl 1221;NP_600492. Reports small-conductance.[gi:19552490];WO2006/070944)を増幅する方法、コード領域内に変異を導入した変異型yggB遺伝子を導入する方法を用いることも可能である。
【0104】
本発明の製造法に使用する微生物は、D-キシロース5−リン酸−ホスホケトラーゼ及び/又はフルクトース6-リン酸ホスホケトラーゼ活性を増強するように改変された微生物でもよい。
D-キシロース5−リン酸−ホスホケトラーゼ活性及びフルクトース6-リン酸ホスホケトラーゼ活性はいずれか一方を活性化してもよいし、両方を活性化してもよい。
【0105】
L−グルタミン酸生産能を付与または増強する別の方法として、有機酸アナログや呼吸阻害剤などへの耐性を付与する方法や細胞壁合成阻害剤に対する感受性を付与する方法も挙げられる。例えば、モノフルオロ酢酸耐性を付与する方法(特開昭50-113209)、アデニン耐性またはチミン耐性を付与する方法(特開昭57-065198)、ウレアーゼを弱化させる方法(特開昭52-038088)、マロン酸耐性を付与する方法(特開昭52-038088)、ベンゾピロンまたはナフトキノン類への耐性を付与する方法(特開昭56-1889)、HOQNO耐性を付与する方法(特開昭56-140895)、α-ケトマロン酸耐性を付与する方法(特開昭57-2689)、グアニジン耐性を付与する方法(特開昭56-35981)、ペニシリンに対する感受性を付与する方法(特開平4-88994)などが挙げられる。
【0106】
このような耐性菌の具体例としては、下記のような菌株が挙げられる。
ブレビバクテリウム・フラバムAJ3949(FERM BP-2632;特開昭50-113209参照)
コリネバクテリウム・グルタミカムAJ11628 (FERM P-5736;特開昭57-065198参照)
ブレビバクテリウム・フラバムAJ11355(FERM P-5007;特開昭56-1889号公報参照)
コリネバクテリウム・グルタミカムAJ11368(FERM P-5020;特開昭56-1889号公報参照)
ブレビバクテリウム・フラバムAJ11217(FERM P-4318;特開昭57-2689号公報参照)
コリネバクテリウム・グルタミカムAJ11218(FERM P-4319;特開昭57-2689号公報参照)
ブレビバクテリウム・フラバムAJ11564(FERM P-5472;特開昭56-140895公報参照)
ブレビバクテリウム・フラバムAJ11439(FERM P-5136;特開昭56-35981号公報参照)
コリネバクテリウム・グルタミカムH7684(FERM BP-3004;特開平04-88994号公報参照)
ブレビバクテリウム・ラクトファーメンタムAJ11426(FERM P-5123;特開平56-048890号公報参照)
コリネバクテリウム・グルタミカムAJ11440(FERM P-5137;特開平56-048890号公報参照)
ブレビバクテリウム・ラクトファーメンタムAJ11796(FERM P-6402;特開平58-158192号公報参照)
【0107】
L−スレオニン生産菌
本発明に用いられるL−スレオニン生産菌として好ましいものとしては、L−スレオニ
ン生合成系酵素を強化した腸内細菌科に属する細菌が挙げられる。L−スレオニン生合成系酵素をコードする遺伝子としては、アスパルトキナーゼIII遺伝子(lysC)、アスパラギン酸セミアルデヒドデヒドロゲナーゼ遺伝子(asd)、thrオペロンにコードされるアスパルトキナーゼI遺伝子(thrA)、ホモセリンキナーゼ遺伝子(thrB)、スレオニンシンターゼ遺伝子(thrC)が挙げられる。これらの遺伝子は2種類以上導入してもよい。L−スレオニン生合成系遺伝子は、スレオニン分解が抑制された腸内細菌科に属する細菌に導入してもよい。スレオニン分解が抑制されたエシェリヒア属細菌としては、例えば、スレオニンデヒドロゲナーゼ活性が欠損したTDH6株(特開2001-346578号)等が挙げられる。
【0108】
L−スレオニン生合成系酵素は、最終産物のL−スレオニンによって酵素活性が抑制される。従って、L−スレオニン生産菌を構築するためには、L−スレオニンによるフィードバック阻害を受けないようにL−スレオニン生合成系遺伝子を改変することが望ましい。また、上記thrA、thrB、thrC遺伝子は、スレオニンオペロンを構成しているが、スレオニンオペロンは、アテニュエーター構造を形成しており、スレオニンオペロンの発現は、培養液中のイソロイシン、スレオニンにより阻害を受け、また、アテニュエーションにより発現が抑制される。このアテニュエーションの解除又は低減は、アテニュエーション領域のリーダー配列あるいは、アテニュエーターを除去することにより達成出来る(Lynn, S. P., Burton, W. S., Donohue, T. J., Gould, R. M., Gumport, R. I., and Gardner,
J. F. J. Mol. Biol. 194:59-69 (1987); 国際公開第02/26993号パンフレット; 国際公開第2005/049808号パンフレット参照)。
【0109】
スレオニンオペロンの上流には、固有のプロモーターが存在するが、非固有(non-native)のプロモーターに置換してもよいし(WO98/04715号パンフレット参照)、スレオニン生合成関与遺伝子の発現がラムダファージのリプレッサーおよびプロモーターにより支配されるようなスレオニンオペロンを構築してもよい(欧州特許第0593792号明細書参照)。また、L−スレオニンによるフィ−ドバック阻害を受けないようにエシェリヒア属細菌を改変するために、α−アミノ−β−ヒドロキシ吉草酸(AHV)に耐性な菌株を選抜することによっても得られる。
【0110】
このようにL−スレオニンによるフィ−ドバック阻害を受けないように改変されたスレオニンオペロンは、宿主内でコピー数が上昇しているか、あるいは強力なプロモーターに連結し、発現量が増大していることが好ましい。コピー数の上昇は、プラスミドによる増幅の他、トランスポゾン、Mu−ファージ等でゲノム上にスレオニンオペロンを転移させることによっても達成出来る。
【0111】
また、アスパルトキナ−ゼIII遺伝子(lysC)は、L−リジンによるフィ−ドバック阻害を受けないように改変した遺伝子を用いることが望ましい。このようなフィ−ドバック阻害を受けないように改変したlysC遺伝子は、米国特許5,932,453号明細書に記載の方法により取得できる。
【0112】
L−スレオニン生合成系酵素以外にも、解糖系、TCA回路、呼吸鎖に関する遺伝子や遺伝子の発現を制御する遺伝子、糖の取り込み遺伝子を強化することも好適である。これらのL−スレオニン生産に効果がある遺伝子としては、トランスヒドロナーゼ遺伝子(pntAB)(欧州特許733712号明細書)、ホスホエノールピルビン酸カルボキシラーゼ遺伝子(pepC)(国際公開95/06114号パンフレット)、ホスホエノールピルビン酸シンターゼ遺伝子(pps)(欧州特許877090号明細書)、コリネ型細菌あるいはバチルス属細菌のピルビン酸カルボキシラーゼ遺伝子(国際公開99/18228号パンフレット、欧州出願公開1092776号明細書)が挙げられる。
【0113】
また、L−スレオニンに耐性を付与する遺伝子、及び/又はL−ホモセリンに耐性を付
与する遺伝子の発現を強化することや、宿主にL−スレオニン耐性、及び/又はL−ホモセリン耐性を付与することも好適である。耐性を付与する遺伝子としては、rhtA遺伝子(Res. Microbiol. 154:123−135 (2003))、rhtB遺伝子(欧州特許出願公開第0994190号明細書)、rhtC遺伝子(欧州特許出願公開第1013765号明細書)、yfiK、yeaS遺伝子(欧州特許出願公開第1016710号明細書)が挙げられる。また宿主にL−スレオニン耐性を付与する方法は、欧州特許出願公開第0994190号明細書や、国際公開第90/04636号パンフレット記載の方法を参照出来る。
【0114】
L−スレオニン生産菌として、エシェリヒア・コリVKPM B-3996株(米国特許第5,175,107号明細書参照)を例示することが出来る。このVKPM B-3996株は、1987年11月19日にロシアン・ナショナル・コレクション・オブ・インダストリアル・マイクロオーガニズム(Russian National Collection of Industrial Microorganisms (VKPM), GNII Genetika)(住所:Russia, 117545 Moscow, 1 Dorozhny proezd. 1)に登録番号VKPM B-3996のもとに寄託されている。また、このVKPM B-3996株は、ストレプトマイシン耐性マーカーを有する広域ベクタープラスミドpAYC32(Chistorerdov, A. Y., and Tsygankov, Y.
D. Plasmid, 16, 161-167 (1986)を参照のこと)にスレオニン生合成系遺伝子(スレオニンオペロン:thrABC)を挿入して得られたプラスミドpVIC40(国際公開第90/04636号パンフレット)を保持している。このpVIC40においては、スレオニンオペロン中のthrAがコードするアスパルトキナーゼI−ホモセリンデヒドロゲナーゼIの、L−スレオニンによるフィードバック阻害が解除されている。
【0115】
また、エシェリヒア・コリVKPM B-5318株(欧州特許第0593792号明細書参照)も好適なL−スレオニン生産菌として例示することができる。VKPM B-5318株は、1990年5月3日にロシアン・ナショナル・コレクション・オブ・インダストリアル・マイクロオーガニズム(Russian National Collection of Industrial Microorganisms (VKPM), GNII Genetika )に登録番号VKPM B-5318のもとに寄託されている。またこのVKPM B-5318株は、イソロイシン非要求性菌株であり、ラムダファージの温度感受性C1リプレッサー、PRプロモーターおよびCroタンパク質のN末端部分の下流に、本来持つ転写調節領域であるアテニュエーター領域を欠失したスレオニンオペロンすなわちスレオニン生合成関与遺伝子が位置し、スレオニン生合成関与遺伝子の発現がラムダファージのリプレッサーおよびプロモーターにより支配されるように構築された組換えプラスミドDNAを保持している。
【0116】
L−グルタミン生産菌
育種によってL−グルタミン生産能を付与するための方法としては、例えば、L−グルタミン生合成に関与する酵素をコードする遺伝子の発現が増強するように改変する方法を挙げることができる。例えば、L−グルタミン酸生合成に関与する酵素としては、グルタミンシンテターゼ、グルタミン酸デヒドロゲナーゼが挙げられる(特開2002-300887)。
【0117】
L−グルタミン生産能を付与するための改変は、L−グルタミンの生合成経路から分岐して他の化合物を生成する反応を触媒する酵素の活性を低下または欠損させることにより行ってもよい。例えば、細胞内のグルタミナーゼ活性を低下させることが考えられる(特開2004-187684)。
【0118】
育種によってL−グルタミン生産能を付与または増強するには、アミノ酸アナログなどへの耐性を付与する方法も挙げられる。6-ジアゾ-5-オキソ-ノルロイシン耐性を付与する方法(特開平3-232497)、プリンアナログ耐性および/またはメチオニンスルホキサイド耐性を付与する方法(特開昭61-202694)、α-ケトマロン酸耐性を付与する方法(特開昭56-151495)、グルタミン酸を含有するペプチドに耐性を付与する方法(特開平2-186994)などが挙げられる。
【0119】
L−グルタミン生産能を有するコリネ型細菌の具体例としては、下記のような菌株が挙げられる。
ブレビバクテリウム・フラバムAJ11573(FERM P-5492特開昭56-151495公報参照)
ブレビバクテリウム・フラバムAJ12210(FERM P-8123;特開昭61-202694公報参照)
ブレビバクテリウム・フラバムAJ12212(FERM P-8123;特開昭61-202694公報参照)
ブレビバクテリウム・フラバムAJ12418(FERM-BP2205;特開平2-186994公報参照)
ブレビバクテリウム・フラバムDH18(FERM P-11116;特開平3-232497公報参照)
コリネバクテリウム・メラセコラDH344(FERM P-11117;特開平3-232497公報参照)
コリネバクテリウム・グルタミカムAJ11574(FERM P-5493;特開昭56-151495公報参照)
【0120】
L−システイン生産菌
L−システイン生産菌の例としては、フィードバック阻害耐性のセリンアセチルトランスフェラーゼをコードする異なるcysEアレルで形質転換されたE. coli JM15(米国特許第6,218,168号、ロシア特許出願第2003121601号)、細胞に毒性の物質を排出するのに適したタンパク質をコードする過剰発現遺伝子を有するE. coli W3110 (米国特許第5,972,663号)、システインデスルフォヒドラーゼ活性が低下したE. coli株 (JP11155571A2)、cysB遺伝子によりコードされる正のシステインレギュロンの転写制御因子の活性が上昇したE. coli W3110 (WO0127307A1)などのエシェリヒア属に属する株が挙げられるが、これらに限定されない。
【0121】
また、本発明に用いるL−アミノ酸生産菌は、固有の生合成系酵素をコードする遺伝子以外に、糖の取り込み、糖代謝(解糖系)、エネルギー代謝に関与する遺伝子が増幅されていてもよい。
【0122】
糖代謝に関与する遺伝子としては、解糖系酵素をコードする遺伝子や糖の取り込み遺伝子が挙げられ、グルコース6−リン酸イソメラーゼ遺伝子(pgi;国際公開第01/02542号パンフレット)、ホスホエノールピルビン酸シンターゼ遺伝子(pps; 欧州出願公開877090号明細書)、ホスホグルコムターゼ遺伝子(pgm;国際公開03/04598号パンフレット)、フルクトース二リン酸アルドラーゼ遺伝子(fbp;国際公開03/04664号パンフレット)、ピルビン酸キナーゼ遺伝子(pykF;国際公開03/008609号パンフレット)、トランスアルドラーゼ遺伝子(talB;国際公開03/008611号パンフレット)、フマラーゼ遺伝子(fum;国際公開01/02545号パンフレット)、ホスホエノールピルビン酸シンターゼ遺伝子(pps;欧州出願公開877090号パンフレット)、non-PTSシュクロース取り込み遺伝子遺伝子(csc;欧州出願公開149911号パンフレット)、シュクロース資化性遺伝子(scrABオペロン;国際公開第90/04636号パンフレット)が挙げられる。
【0123】
エネルギー代謝に関与する遺伝子としては、トランスヒドロゲナーゼ遺伝子(pntAB;米国特許 5,830,716号明細書)、チトクロムbo型オキシダーゼ(cytochrome bo type oxidase)遺伝子(cyoB 欧州特許出願公開1070376号明細書)が挙げられる。
【0124】
次に、微生物に核酸生産能を付与する方法と核酸生産菌について例示する。
核酸生産能を有する細菌微生物は、上記のような細菌微生物に、例えば、プリンヌクレオシド要求性、又はさらにプリンアナログ等の薬剤に対する耐性を付与することにより、取得することが出来る(特公昭38−23099、特公昭54−17033、特公昭55−45199、特公昭57−14160、特公昭57−41915、特公昭59−42895参照)。例えば、栄養要求性及び薬剤耐性を持つバチルス属細菌は、N-メチル-N’-ニトロ-N-ニトロソグアニジン(NTG)、またはEMS(エタンメタンスルフォネート)等の通常の変異処理に用いられている変異剤による処理によって取得することが出来る。
【0125】
プリンヌクレオシドを生産するバチルス属細菌としては、以下のものが挙げられる。
バチルス属に属するイノシン生産株の具体例として、バチルス・ズブチリスKMBS16株を使用することができる。同菌株は、プリンオペロンリプレッサーをコードするpurR遺伝子の欠損(purR::spc)、スクシニル−AMPシンターゼをコードするpurA遺伝子の欠損(purA::erm)、およびプリンヌクレオシドホスホリラーゼをコードするdeoD遺伝子の欠損(deoD::kan)が導入された、既知のバチルス・ズブチリスtrpC2株(168 Marburg)の誘導体である(特開2004-242610、US2004166575A1)。また、バチルス・ズブチリス菌株AJ3772(FERM P-2555)(特開昭62-014794)等を使用することもできる。
【0126】
グアノシン生産能を有するバチルス属細菌としては、IMP脱水素酵素の活性が上昇したバチルス属細菌(特開平3-58787)、プリンアナログ耐性又はデコイニン耐性遺伝子が組み込まれているベクターをアデニン要求性変異株に導入したバチルス属細菌(特公平4-28357)等が挙げられる。
【0127】
またプリンヌクレオチドを生産するバチルス属細菌としては、以下のものが挙げられる。
イノシン酸生産菌としては、バチルス・ズブチリスのフォスファターゼ活性が弱化したイノシン生産株が報告されている(Uchida, K. et al., Agr. Biol. Chem., 1961, 25, 804-805、Fujimoto, M. Uchida, K., Agr. Biol. Chem., 1965, 29, 249-259)。グアニル酸生産菌としては、アデニン要求性を有しさらにデコイニンまたはメチオニンスルフォキシドに耐性を有し、かつ5’−グアニル酸(グアノシン−5’−モノリン酸、以下「GMP」ともいう)生産能を有するバチルス属の変異株が挙げられる(特公昭56−12438号公報)。
【0128】
また、キサンチル酸生産菌は、コリネバクテリウム・アンモニアゲネス(Corynebacterium ammmoniagenes)を中心とするコリネ型細菌の育種に用いたられる方法を使用して構築することができる。例えば、PRPP amidotransferaseを強化株(特開平8-168383)、脂肪族アミノ酸耐性株(特開平4-262790)、デヒドロプロリン耐性株(韓国特許公開公報2003-56490)を取得することによって、キサンチル酸生産菌を構築することができる。
【0129】
また、プリン系物質生産能を有するバチルス属細菌を育種する方法として、以下の方法が挙げられる。プリンヌクレオシド及びプリンヌクレオチドに共通のプリン生合成に関与する酵素、すなわちプリン生合成酵素の細胞内での活性を上昇させる方法が挙げられる。該酵素の細胞内での活性は、バチルス属細菌の非改変株、例えば野生型のバチルス属細菌よりも上昇させることが好ましい。「活性が上昇する」とは、例えば、細胞当たりの酵素分子の数が増加した場合や、酵素分子当たりの比活性が上昇した場合などが該当する。例えば、前記酵素の遺伝子の発現量を上昇させることにより活性を上昇させることができる。前記プリン生合成に関与する酵素としては、たとえばホスホリボシルピロリン酸アミドトランスフェラーゼ、ホスホリボシルピロリン酸シンセターゼ(PRPP synthetase [EC:2.7.6.1])などが挙げられる
【0130】
ペントースリン酸系に取り込まれたグルコースなどの糖源が代謝により生成したカタボライトの一部は、リブロース−5−リン酸を経由して、リボース−5−リン酸となる。生合成されたリボース−5−リン酸より、プリンヌクレオシド、ヒスチジン、およびトリプトファン生合成の不可欠な前駆物質であるホスホリボシルピロリン酸(PRPP)が生成される。具体的には、リボース−5−リン酸は、ホスホリボシルピロリン酸シンセターゼによりPRPPに転換される。したがって、ホスホリボシルピロリン酸シンセターゼの活性が上昇するように改変することにより、バチルス属細菌にプリン系物質生産能を付与又は増強することができる。
【0131】
「ホスホリボシルピロリン酸シンセターゼの活性が上昇する」とは、ホスホリボシルピ
ロリン酸シンセターゼの活性が野生株又は親株等の非改変株に対して増加していることをいう。ホスホリボシルピロリン酸シンセターゼの活性は例えば、Switzer等の方法(Methods Enzymol., 1978, 51, 3-11)、Roth等の方法(Methods Enzymol., 1978, 51, 12-17)により、測定することができる。ホスホリボシルピロリン酸シンセターゼの活性が上昇したバチルス属細菌は、例えば、特開2004-242610号公報に記載の方法と同様にして、プラスミドを用いる方法や染色体上に組込む方法などにより、ホスホリボシルピロリン酸シンセターゼをコードする遺伝子をバチルス属細菌で高発現させることにより作製することができる。
【0132】
一方、プリンヌクレオシド、ヒスチジン、およびトリプトファン生合成に不可欠な前駆物質であるPRPPが生成されると、その一部は、プリン生合成に関与する酵素群によりプリンヌクレオチド、プリンヌクレオシドへと変換される。そのような酵素群をコードする遺伝子としては、バチルス・ズブチリスのプリンオペロン、具体的にはpurEKB-purC(orf)QLF-purMNH(J)-purDオペロンの遺伝子(Ebbole DJ and Zalkin H, J. Biol. Chem., 1987, 262, 17, 8274-87)(現在では、purEKBCSQLFMNHDとも呼ばれる:Bacillus subtilis and
Its Closest Relatives, Editor in Chief: A.L. Sonenshein, ASM Press, Washington D.C., 2002。Genbank Accession No.NC_000964)、およびエシェリヒア・コリのpurレギュロンの遺伝子(Escherichia and Salmonella, Second Edition, Editor in Chief: F.C. Neidhardt, ASM Press, Washington D.C., 1996)が例示される。
【0133】
したがって、これらの遺伝子の発現を増強することにより、プリン系物質生産能を付与又は増強することもできる。なお、本発明に用いることが出来るプリンオペロン遺伝子はこれらのものには限定されず、他の微生物や動植物由来の遺伝子も利用することも出来る。
【0134】
プリンオペロンの発現量を増大させる方法としては、プラスミドを用いる方法や染色体上に組込む方法などにより、プリンオペロン遺伝子をバチルス属細菌で高発現させる方法が挙げられる。
【0135】
プリンオペロンの発現量を増大させる第2の方法として、プリンオペロン固有のプロモーターをより強力なプロモーターに置換することや、固有のプロモーターの-35、-10領域をコンセンサス配列に置換することが挙げられる。
【0136】
例えば、バチルス・ズブチリス(B. subtilis 168 Marburg株; ATCC6051)では、プリンオペロンの-35配列はコンセンサス配列(TTGACA)であるが、-10配列はTAAGATであり、コンセンサス配列TATAATとは異なっている(Ebbole, D. J. and H. Zalikn, J. Biol. Chem., 1987, 262, 8274-8287)。したがって、-10配列(TAAGAT)をコンセンサス配列にすること、あるいはコンセンサス配列に近づけることにより、TATAAT、またはTATGAT、もしくはTAAAATとなるように改変することで、プリンオペロンの転写活性を上昇させることができる。なお、プロモーター配列の置換は、下記の遺伝子置換と同様の方法で行うことが出来る。
【0137】
プリンオペロンの発現量を増大させる第3の方法として、プリンオペロンのリプレッサーの発現量を低下させる方法も挙げられる(USP6,284,495号)。「プリンオペロンのリプレッサーの発現」とは、プリンオペロン遺伝子の転写、及び転写産物の翻訳の両方を含む。また、「発現量を低下させる」とは、発現量が、非改変株、例えば野生型のバチルス属細菌における発現量よりも低いこと、及び、発現が実質的に消失していることを含む。
【0138】
プリンペオペロンのリプレッサー(プリンリプレッサー)の発現量を低下させるためには、例えば、バチルス属細菌を紫外線照射またはNTGもしくはEMS等の通常変異処理
に用いられている変異剤によって処理し、プリンリプレッサーの発現量が低下した変異株を選択する方法を採用することができる。
【0139】
また、プリンリプレッサーの発現量が低下したバチルス属細菌は、変異処理の他に、例えば、遺伝子組換え法を用いた相同組換え法(Experiments in Molecular Genetics, Cold Spring Harbor Laboratory press (1972); Matsuyama, S. and Mizushima, S., J. Bacteriol., 1985, 162, 1196-1202)により、染色体上のプリンリプレッサーをコードする遺伝子(purR;GenBank Accession NC_000964(コード領域は塩基番号54439〜55293)を、正常に機能しない遺伝子(以下、「破壊型遺伝子」ということがある)で置換することによって得ることができる。
【0140】
さらに、プリン系物質の細胞内への取り込みを弱化することによっても、プリン系物質生産能を強化することができる。例えば、プリンヌクレオシドの細胞内へ取り込みは、プリンヌクレオシドの細胞内への取り込みに関与する反応を遮断することによって弱化することができる。上記プリンヌクレオシドの細胞内への取り込みに関与する反応は、たとえばヌクレオシドパーミアーゼに触媒される反応である。
【0141】
さらに、プリンヌクレオシドを製造する場合には、プリンヌクレオシド生産能を増強させるためにプリン系物質を分解する酵素の活性を低下させてもよい。このような酵素として、例えば、プリンヌクレオシドホスホリラーゼが挙げられる。
【0142】
PRPPから、プリン生合成に関与する酵素群により生合成されたプリンヌクレオチドは、脱リン酸化されて、プリンヌクレオシドに変換される。プリンヌクレオシドを効率的に蓄積せしめるためには、プリンヌクレオシドを更に分解してヒポキサンチン等とするプリンヌクレオシドホスホリラーゼの活性を低下させることが好ましい。すなわち、イノシンをはじめとするプリンヌクレオシドを基質とするプリンヌクレオシドホスホリラーゼを弱化、あるいは欠損させるように改変することが望ましい。
【0143】
プリンヌクレオシドホスホリラーゼ活性の低下は、具体的には、バチルス属細菌でプリンヌクレオシドホスホリラーゼをコードするdeoD遺伝子とpupG遺伝子を破壊することによって達成することができる。本発明のバチルス属細菌は、上記のようなdeoD遺伝子とpupG遺伝子を単独、または同時に破壊するように改変されたものであってもよい。deoD遺伝子、pupG遺伝子は、例えばバチルス属由来の遺伝子(deoD;Genbank Accession No. NC_000964(コード領域は2134672-2135370), pupG;Genbank Accession No. NC_000964(コード領域は2445610-2446422)が利用できる。
【0144】
また、プリン系物質生産能を増強させるために、サクシニル−AMPシンターゼの活性を低下させてもよい。サクシニル−AMPシンターゼをコードする遺伝子としては、purA遺伝子が挙げられる。purA遺伝子としては、例えば、GenBank Accession No. NC_000964(コード領域は相補鎖の塩基番号4153460-4155749)で登録されている塩基配列を有するものが挙げられる。
【0145】
さらに、プリン系物質生産能を増強させるために、イノシンモノリン酸(IMP)脱水素酵素の活性を低下させてもよい。IMP脱水素酵素をコードする遺伝子としては、guaB遺伝子が挙げられる。guaB遺伝子としては、例えば、GenBank Accession No.NC_000964(コード領域は15913-17376)で登録されている塩基配列を有するものが挙げられる。
【0146】
また、プリン系物質生産能を増強させる方法として、プリン系物質を排出する活性を有するタンパク質をコードする遺伝子を増幅することが考えられる。このような遺伝子が増幅された細菌としては、例えば、rhtA遺伝子を増幅したバチルス属細菌が挙げられる(特
開2003-219876)。
【0147】
遺伝子組換えによる微生物に育種において使用する遺伝子は、上述した遺伝子情報を持つ遺伝子や、公知の配列を有する遺伝子に限られず、コードされるタンパク質の機能が損なわれない限り、その遺伝子のホモログや人為的な改変体等、保存的変異を有する遺伝子も使用することができる。すなわち、公知のタンパク質のアミノ酸配列において、1若しくは数個の位置での1若しくは数個のアミノ酸の置換、欠失、挿入又は付加等を含む配列を有するタンパク質をコードする遺伝子であっもよい。
【0148】
ここで、「1若しくは数個」とは、アミノ酸残基のタンパク質の立体構造における位置やアミノ酸残基の種類によっても異なるが、具体的には好ましくは1〜20個、より好ましくは1〜10個、さらに好ましくは1〜5個を意味する。また、保存的変異とは、置換部位が芳香族アミノ酸である場合には、Phe、Trp、Tyr間で、置換部位が疎水性アミノ酸である場合には、Leu、Ile、Val間で、極性アミノ酸である場合には、Gln、Asn間で、塩基性アミノ酸である場合には、Lys、Arg、His間で、酸性アミノ酸である場合には、Asp、Glu間で、ヒドロキシル基を持つアミノ酸である場合には、Ser、Thr間でお互いに置換する変異である。保存的変異の代表的なものは、保存的置換であり、保存的置換とみなされる置換としては、具体的には、AlaからSer又はThrへの置換、ArgからGln、His又はLysへの置換、AsnからGlu、Gln、Lys、His又はAspへの置換、AspからAsn、Glu又はGlnへの置換、CysからSer又はAlaへの置換、GlnからAsn、Glu、Lys、His、Asp又はArgへの置換、GluからGly、Asn、Gln、Lys又はAspへの置換、GlyからProへの置換、HisからAsn、Lys、Gln、Arg又はTyrへの置換、IleからLeu、Met、Val又はPheへの置換、LeuからIle、Met、Val又はPheへの置換、LysからAsn、Glu、Gln、His又はArgへの置換、MetからIle、Leu、Val又はPheへの置換、PheからTrp、Tyr、Met、Ile又はLeuへの置換、SerからThr又はAlaへの置換、ThrからSer又はAlaへの置換、TrpからPhe又はTyrへの置換、TyrからHis、Phe又はTrpへの置換、及び、ValからMet、Ile又はLeuへの置換が挙げられる。また、上記のようなアミノ酸の置換、欠失、挿入、付加、または逆位等には、遺伝子が由来する微生物の個体差、種の違いに基づく場合などの天然に生じる変異(mutant又はvariant)によって生じるものも含まれる。このような遺伝子は、例えば、部位特異的変異法によって、コードされるタンパク質の特定の部位のアミノ酸残基が置換、欠失、挿入または付加を含むように公知の遺伝子の塩基配列を改変することによって取得することができる。
【0149】
さらに、上記のような保存的変異を有する遺伝子は、コードされるアミノ酸配列全体に対して、80%以上、好ましくは90%以上、より好ましくは95%以上、特に好ましくは97%以上の相同性を有し、かつ、野生型タンパク質と同等の機能を有するタンパク質をコードする遺伝子であってもよい。
また、遺伝子の配列におけるそれぞれのコドンは、遺伝子が導入される宿主で使用しやすいコドンに置換したものでもよい。
【0150】
保存的変異を有する遺伝子は、変異剤処理等、通常変異処理に用いられる方法によって取得されたものであってもよい。
【0151】
また、遺伝子は、公知の遺伝子配列の相補配列又はその相補配列から調製され得るプローブとストリンジェントな条件下でハイブリダイズし、公知の遺伝子産物と同等の機能を有するタンパク質をコードするDNAであってもよい。ここで、「ストリンジェントな条件」とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。一例を示せば、相同性が高いDNA同士、例えば80%以上、好ましくは90%以上、より好ましくは95%以上、特に好ましくは97%以上の相同性を有するDNA同士がハイブリダイズし、それより相同性が低いDNA同士がハイブリダイズしない条件、あるいは通常のサザンハイブリダイゼーションの洗いの条件である60℃、1×SSC、0.1% SDS、好まし
くは、0.1×SSC、0.1% SDS、さらに好ましくは、68℃、0.1×SSC、0.1% SDSに相当する塩濃度、温度で、1回、より好ましくは2〜3回洗浄する条件が挙げられる。
【0152】
プローブとしては、遺伝子の相補配列の一部を用いることもできる。そのようなプローブは、公知の遺伝子配列に基づいて作製したオリゴヌクレオチドをプライマーとし、これらの塩基配列を含むDNA断片を鋳型とするPCRによって作製することができる。例えば、プローブとして、300 bp程度の長さのDNA断片を用いる場合には、ハイブリダイゼーションの洗いの条件は、50℃、2×SSC、0.1% SDSが挙げられる。
【実施例】
【0153】
以下、実施例を挙げて本発明を具体的に説明する。ただし、本発明は以下の実施例に限定されない。
【0154】
〔実施例1〕L−トリプトファンの製造
L−トリプトファン生産菌として、E. coli No.202(国際公開第2005/103275号パンフレット参照)を用いた。同菌株は、L−トリプトファン生産菌SV164株(国際公開第94/08031号パンフレット)の染色体上に、ホスホグリセレートデヒドロゲナーゼ遺伝子(serA。プラスミドpGH5に由来する。国際公開第94/08031号パンフレット参照)、及び、脱感作型trpE遺伝子(E. coli MTR#2株由来。米国特許第4,371,614号明細書参照)を含むtrpオペロン(プラスミドpGX100由来)を挿入して得られた菌株である。
E. coli No.202のグリセロールストックを、LB-アガロースプレート培地(トリプトン1%、酵母抽出液0.5%、塩化ナトリウム0.5%、アガロース1.5%)に1エーゼ植菌し、30℃で24時間、静地培養した。
【0155】
前述の培養液を500ml坂口フラスコに入れた50mlのLB培地(トリプトン1%、酵母抽出液0.5%、塩化ナトリウム0.5%)に10μl接種し、30℃で8時間、振盪下(114回転/分)で前培養した。
【0156】
前述の前培養液0.9mlを、下記組成を有する300mlの種培地に接種した。全容1Lの小型発酵槽を用いて、30℃で約14時間、攪拌翼の動力密度を4.4 kW/m3で、滅菌フィルターにより滅菌した圧縮空気を1vvm通気しながら培養した。また、培養中温度は30℃に保持し、pHはアンモニアガスで6.5に保持した。
【0157】
〔種培地組成〕
グルコース 10g/L
KH2PO4 1g/L
(NH4)2SO4 2.5g/L
MgSO4・7H2O 0.5g/L
FeSO4・7H2O 10mg/L
MnSO4・4H2O 10mg/L
大豆加水分解物 0.4g/L
L−メチオニン 50mg/L
L−フェニルアラニン 125mg/L
L−チロシン 125mg/L
ビタミンB1 5mg/L
ピリドキシン 30mg/L
【0158】
下記組成を有する300mlの主培養培地を準備し、それぞれに種培養液30mlを接種した。全容1Lの小型発酵槽を用いて、31℃、4.4kW/m3の撹拌下で、滅菌フィルターにより滅菌した圧縮空気を1vvm通気しながら主培養を実施した。また、培養期間中温度は31℃に保持し
、pHはアンモニアガスで6.7に保持した。培養中、700g/Lのグルコース溶液を適宜流加することによって、小型発酵槽内の糖濃度を5〜20g/Lに調節した。また、23時間目に、L−トリプトファンの結晶を10g (33g/L) 添加し、攪拌翼の動力密度を2.4kW/m3、5.5 kW/m3、9.9kW/m3、15.5kW/m3に変えた4条件で培養を行った。
【0159】
〔主培養培地組成〕
グルコース 15g/L
KH2PO4 1g/L
(NH4)2SO4 1g/L
大豆加水分解物 0.75g/L
NaCl 0.5g/L
MgSO4・7H2O 0.3g/L
CaCl2・2H2O 14.7mg/L
FeSO4・7HO 10mg/L
MnSO4・4H2O 7.5mg/L
L−メチオニン 0.3g/L
L−フェニルアラニン 1g/L
ビタミンB1 5mg/L
ピリドキシン 36.5mg/L
NH4Cl 3.13g/L
KOH 1g/L
【0160】
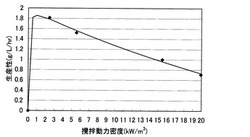
培養46時間後に、培地中のL−トリプトファン濃度を測定し、生産速度を算出した結果を図2に示す。なお、生産速度は、攪拌動力密度15.5kW/m3での生産性を1としたときの相対値で記載した。
【0161】
〔参考例2〕L−グルタミン酸生産菌の構築
エシェリヒア・コリ由来のgltA遺伝子、ppc遺伝子およびgdhA遺伝子を有するプラスミド(RSFCPG(欧州出願公開1233068号明細書)のgltA遺伝子のORF以外の部分を増幅するプライマー1(配列番号1)とプライマー2(配列番号2)を設計した。このプライマーを用いて、RSFCPGを鋳型にPCRを行い、約14.9kbの断片を取得した。一方、プライマー3(配列番号3)とプライマー4(配列番号4)を用い、E. coli W3110株の染色体DNAを鋳型としてPCRを行い、メチルクエン酸シンターゼ遺伝子(prpC)を含む約1.2kbの断片を取得した。両PCR産物をそれぞれBglII、KpnIで処理し、ライゲーション後、E. coli JM109株を形質転換した。出現したコロニーを全て集菌し、混合物としてプラスミドを抽出した。このプラスミド混合物でクエン酸シンターゼ(CS)欠損株であるE. coli ME8330株を形質転換し、50mg/Lウラシル、5mg/Lチアミン-HClを含有するM9最少培地(グルコース5 g、硫酸マグネシウム2mM、リン酸一カリウム3g、塩化ナトリウム0.5g 、塩化アンモニウム1g リン酸2ナトリウム6g を純水1Lに含む培地)に塗布した。出現した株よりプラスミドを抽出し、これをRSFPPGとした。パントエア・アナナティスSC17sucA株にL−グルタミン酸生産プラスミドRSFPPGを導入し、L−グルタミン酸生産菌SC17sucA/RSFPPG(本菌株を「NA1株」と呼ぶ)を構築した。
【0162】
上記SC17sucA株は、低pHでL−グルタミン酸及び炭素源を含む培地で増殖できる株として自然界より単離されたAJ13355株から、粘液質低生産変異株(SC17)を取得し、同株のsucA遺伝子を破壊することによって得られた株である(米国特許第6,596,517号)。SC17sucA株は、プライベートナンバーAJ417が付与され、平成16年2月26日に経済産業省工業技術院生命工学工業技術研究所(現名称、産業技術総合研究所特許生物寄託センター、郵便番号305-8566 茨城県つくば市東1丁目1番地1中央第6)に受託番号FERM BP-08646として寄託されている。
【0163】
〔実施例2〕L−グルタミン酸の生産
グルタミン酸生産菌パントエア・アナナティスNA1のグリセロールストックを、LBGM9-アガロースプレート培地(トリプトン1%、酵母抽出液0.5%、塩化ナトリウム1.05%、グルコース0.5%、硫酸マグネシウム7水和物0.05%、リン酸水素2ナトリウム12水和物1.72%、リン酸2水素カリウム0.3%、塩化アンモニウム0.1%、アガロース2%、テトラサイクリン塩酸塩25 mg/L)に1エーゼ植菌し、34℃で24時間、静地培養する。
【0164】
前述の前培養菌シャーレ1枚分を、下記組成を有する300mlの培地に接種した。全容1Lの小型発酵槽を用いて攪拌翼の動力密度3.3 kW/m3で、滅菌フィルターにより滅菌した圧縮空気を1vvm通気しながら培養する。また、培養中温度は34℃に保持し、pHはアンモニアガスで4.7に保持する。培養20時間目で、700g/Lのスクロース溶液を適宜流加することによって、小型発酵槽内の糖濃度を5〜20g/Lに調節する。また、培養20時間目に、L−グルタミン酸のα晶を20g添加し、攪拌の動力密度を5.5kW/m3、15.5kW/m3、19.9 kW/m3分に変えた条件と、2.4 kW/m3以下に制御した4条件で培養を行う。
【0165】
〔培地組成〕
スクロース 100g/L
MgSO4・7H2O 0.4g/L
(NH4)2SO4 5g/L
KH2PO4 6g/L
Yeast Extract 6g/L
NaCl 1.5g/L
FeSO4・7H2O 20mg/L
MnSO4・4H2O 20mg/L
L−リジン塩酸塩 0.6g/L
DL−メチオニン 0.6g/L
ジアミノピメリン酸 0.6g/L
CaCl2・2H2O 2.64mg/L
ZnSO4・7H2O 0.72mg/L
CuSO4・5H2O 0.64mg/L
CoCl2・6H2O 0.72mg/L
H3BO3 0.4mg/L
Na2MoO4・2H2O 1.2mg/L
テトラサイクリン塩酸塩 25mg/L
【0166】
〔実施例3〕L−フェニルアラニンの生産
L−フェニルアラニン生産菌として、E. coli AJ12741株(特許第3225597号公報、以下、「R/GAL株」と記載することがある。)を用いる。同株は、tyrR、tyrA遺伝子を欠失したエシェリヒア・コリK-12のW3110株に、フィードバック阻害が解除された3−デオキシ−D−アラビノヘプツロン酸−7−リン酸シンターゼをコードするaroG4遺伝子、コリスミン酸ムターゼ−プレフェン酸デヒドラターゼをコードするpheA遺伝子、及びシキミ酸キナーゼをコードするaroL遺伝子を導入した株である。同株は、独立行政法人 産業技術総合研究所 特許生物寄託センター(住所 〒305-5466 日本国茨城県つくば市東1丁目1番地1 中央第6郵便番号305-8566)に、受託番号FERM BP-4796で寄託されている。
【0167】
AJ12741株のグリセロールストックを、LBG-アガロースプレート培地(トリプトン1%、酵母抽出液0.5%、塩化ナトリウム1%、アガロース1.5%)に1エーゼ植菌し、35℃で24時間、静地培養する。
【0168】
前述の前培養菌をシャーレ1枚分、表5に示した組成を有する300mlの培地に種接種した。全容1Lの小型発酵槽を用いて、約16時間、攪拌翼の動力密度3.3 kW/m3、滅菌フィルターにより滅菌した圧縮空気を1vvm通気しながら培養する。また、培養中温度は35℃に保持し、pHはアンモニアガスで6.5に保持する。
【0169】
〔種培地組成〕
グルコース 40g/L
MgSO4 1g/L
(NH4)2SO4 16g/L
KH2PO4 1g/L
Yeast Extract 2g/L
FeSO4・7H2O 10mg/L
MnSO4・4H2O 8mg/L
L−チロシン 1g/L
アンピシリンナトリウム 100mg/L
【0170】
下記組成を有する300mlの主培養培地を準備し、種培養液30mlを接種する。全容1Lの小型発酵槽を用いて、35℃、攪拌翼の動力密度3.3 kW/m3の撹拌下で、滅菌フィルターにより滅菌した圧縮空気を1vvm通気しながら主培養を実施する。また、培養期間中温度は35℃に保持し、pHはアンモニアガスで6.5に保持した。培養中、500g/Lのグルコース溶液を適宜流加することによって、小型発酵槽内の糖濃度を5〜20g/Lに調節する。また、24時間目に、L−フェニルアラニンの結晶を20g添加し、攪拌翼の動力密度を5.5 kW/m3、 15.5 kW/m3、19.9 kW/m3に変えた条件と、2.4 kW/m3以下で制御した4条件で培養を行う。
【0171】
〔主培養培地組成〕
グルコース 40g/L
MgSO4 1g/L
(NH4)2SO4 16g/L
KH2PO4 2g/L
Yeast Extract 8g/L
FeSO4・7H2O 10mg/L
MnSO4・4H2O 8mg/L
L−チロシン 1.4g/L
アンピシリンナトリウム 100mg/L
【0172】
〔実施例4〕イノシン及び/またはグアノシンの生産
イノシン及びグアノシンを生産するバチルス・アミロリケァシエンス(B. amyloliquefaciens)AJ1991株(ATCC No. 19222、VKPM B-8994。米国特許第3,575,809号参照)のグリセロールストックを、LBG-アガロースプレート培地(トリプトン1%、酵母抽出液0.5%、塩化ナトリウム1%、アガロース1.5%)に1エーゼ植菌し、34℃で24時間、静地培養する。
前述の前培養菌を、500ml坂口フラスコに入れた下記組成の培地50mlに1白金耳接種し、34℃で16時間、振盪下(115回転/分)で前培養する。
【0173】
〔種培地組成〕
グルコース 30g/L
NH4Cl 3g/L
KH2PO4 0.5g/L
MgSO4・7H2O 0.4g/L
FeSO4・7H2O 10mg/L
MnSO4・4H2O 10mg/L
大豆加水分解物 1.2g/L
Yeast Extract 0.5g/L
リボ核酸 5g/L
【0174】
下記組成を有する300mlの主培養培地を準備し、種培養液15mlを接種した。全容1Lの小型発酵槽を用いて、34℃、攪拌翼の動力密度3.3kW/m3の撹拌下で、滅菌フィルターにより滅菌した圧縮空気を1vvm通気しながら主培養を実施した。また、培養期間中温度は34℃に保持し、pHはアンモニアガスで6.5に保持した。培養中、500g/Lのグルコース溶液を適宜流加することによって、小型発酵槽内の糖濃度を5〜20g/Lに調節した。また、、24時間目に、グアノシン結晶を0.8g添加し、攪拌翼の動力密度を5.5 kW/m3、 15.5 kW/m3、19.9 kW/m3に変えた条件と、2.4 kW/m3以下で制御した4条件で培養を行う。
【0175】
〔主培養培地組成〕
グルコース 200g/L
NH4Cl 2.5g/L
KH2PO4 1.3g/L
MgSO4・7H2O 1.5g/L
FeSO4・7H2O 10mg/L
MnSO4・4H2O 10mg/L
大豆加水分解物 1.3g/L
リボ核酸 1.24g/L
KCl 15g/L
DL−メチオニン 50mg/L
【図面の簡単な説明】
【0176】
【図1】発酵装置の概要を示す図。発酵槽からの目的物質の採取を示す。
【図2】攪拌翼の攪拌動力とL−トリプトファンの生産速度を示す図。
【技術分野】
【0001】
本発明は発酵工業に関し、微生物を利用した発酵法によりL−アミノ酸または核酸を析出させながら培養する方法である。
【背景技術】
【0002】
L−アミノ酸は、L−アミノ酸生産能を有するコリネ型細菌又は腸内細菌科に属するアミノ酸生産菌を用いて発酵法により工業生産されている。これらのアミノ酸生産菌としては、生産性を向上させるために、自然界から分離した菌株または該菌株の人工変異株、あるいは遺伝子組換えによりL−アミノ酸生合成酵素が増強された組換え体等が用いられている。
【0003】
例えば、L−トリプトファン発酵においては、アントラニル酸合成酵素活性、ホスホグリセリン酸デヒドロゲナーゼ活性、トリプトファンシンターゼ活性が増強された細菌(特許文献1)、及びトリプトファンオペロンが増幅された細菌が挙げられる(特許文献2〜4)。
【0004】
また、L−グルタミン酸発酵においては、グルタミン酸デヒドロゲナーゼ遺伝子(gdh)、イソクエン酸デヒドロゲナーゼ遺伝子(icdA)、アコニット酸ヒドラターゼ遺伝子(acnA, acnB)、及びクエン酸シンターゼ遺伝子(gltA)を増強することによって、L−グルタミン酸の生産能を増加させる技術が挙げられる(特許文献5)。
【0005】
また、L−スレオニン発酵においては、アスパルトキナーゼIII遺伝子(lysC)、アスパラギン酸セミアルデヒドデヒドロゲナーゼ遺伝子(asd)、thrオペロンにコードされるアスパルトキナーゼI遺伝子(thrA)、ホモセリンキナーゼ遺伝子(thrB)、スレオニンシンターゼ遺伝子(thrC)を強化した微生物(特許文献6)等が挙げられる。
【0006】
上述のような微生物の育種や製造法の改良により、L−アミノ酸の生産能はかなり高まっているが、今後の需要の一層の増大に応えるためには、さらに安価かつ効率的なL−アミノ酸の製造法の開発が求められている。
【0007】
一方、培養液中に蓄積するL−アミノ酸を晶析せしめながら発酵を行う方法が知られている(特許文献7、8)。また、L−グルタミン酸については、L−グルタミン酸を析出させながら蓄積させることができる微生物を用いてL−グルタミン酸を製造する方法が開示されている(特許文献9)。また、平均粒子径が1〜120μmのアミノ酸の結晶を培地に添加する晶析発酵法も知られている(特許文献10)。
【0008】
しかしながら、上記方法では通常の結晶を析出させない発酵と比べて生産性が十分でなく、さらなる改良が求められていた。
【特許文献1】WO94/08031号
【特許文献2】特開昭57-71397号
【特許文献3】特開昭62-244382号
【特許文献4】米国特許第4,371,614号
【特許文献5】特開昭63-214189号
【特許文献6】特開2001-346578号
【特許文献7】特開昭62-288号
【特許文献8】欧州特許公報第1078989号
【特許文献9】米国特許第6905819号
【特許文献10】WO06/109830号
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、微生物を用いてL−アミノ酸又は核酸の結晶を析出させながら培地に蓄積させる発酵生産における生産性の向上を目的とする。
【課題を解決するための手段】
【0010】
通常、発酵過程における攪拌翼の動力密度の低下は、発酵に悪影響を与えることが想定される。しかしながら、本発明者は鋭意研究の結果、L−アミノ酸または核酸を析出させながら蓄積させる発酵において、攪拌翼の動力密度を、結晶析出後、又は種晶添加後に一定以下に制御することによって、L−アミノ酸の生産性が向上することを見出し、本発明を完成するに至った。
【0011】
すなわち、本発明は以下のとおりである。
(1)L−アミノ酸又は核酸の生産能を有する微生物を攪拌翼を備えた発酵槽中の液体培地で培養し、必要に応じて種晶を培地に添加して当該培中にL−アミノ酸または核酸の結晶を生成、蓄積させ、培養物からL−アミノ酸又は核酸の結晶を採取するL−アミノ酸又は核酸の製造法において、攪拌翼の動力密度を結晶析出後又は種晶添加後に2.4kW/m3以下に制御することを特徴とする方法。
(2)上記結晶析出後又は種晶添加後の攪拌翼の動力密度が0.5kW/m3以上であることを特徴とする前記方法。
(3)結晶析出前又は種晶添加前の攪拌翼の動力密度が3.0kW/m3以上で制御しながら培養することを特徴とする前記方法。
(4)前記微生物が腸内細菌科に属する微生物である、前記方法。
(5)前記微生物がコリネ型細菌、又はバチルス属細菌である、前記方法。
(6)前記L−アミノ酸が、L−トリプトファン、L−フェニルアラニン、L−チロシン、L−イソロイシン、L−バリン、L−ロイシン、L−グルタミン酸、L−グルタミン、L−スレオニン、L−システイン、L−シスチンまたはその誘導体から選択される1種又は2種以上のL−アミノ酸である前記の方法。
(7)前記核酸が、イノシン、アデノシン、グアノシン、キサントシン、イノシン酸、アデニル酸、グアニル酸、キサンチル酸またはそれらの誘導体から選択される1種又は2種以上の核酸である前記方法。
【発明の効果】
【0012】
本発明によれば、L−アミノ酸又は核酸生産能を有する微生物を用いた発酵法によるL−アミノ酸又は核酸の生産法において、L−アミノ酸又は核酸の生産性を向上させることが可能となる。L−アミノ酸又は核酸の生産性には、対糖収率の向上、及び/又は生産速度の向上が含まれる。
【発明を実施するための最良の形態】
【0013】
<1>本発明の製造法
本発明の方法は、L−アミノ酸又は核酸の生産能を有する微生物を攪拌翼を備えた発酵槽中の液体培地で培養し、必要に応じて種晶を培地に添加して当該培地中にL−アミノ酸または核酸の結晶を生成、蓄積させ、培養物からL−アミノ酸又は核酸の結晶を採取するL−アミノ酸又は核酸の製造法において、攪拌翼の動力密度(単位発酵液当たりの動力)を結晶析出後あるいは種晶添加後に2.4kW/m3以下に制御することを特徴とする方法である。
【0014】
本発明において、「L−アミノ酸」は、微生物を用いた発酵法において培地中に析出し
ながら蓄積するものであれば特に制限されないが、L−アミノ酸の種類は特に制限されないが、L−リジン、L−オルニチン、L−アルギニン、L−ヒスチジン、L−シトルリンのような塩基性アミノ酸、L−イソロイシン、L−アラニン、L−バリン、L−ロイシン、L−グリシンのような脂肪族アミノ酸、L−スレオニン、L−セリンのようなヒドロキシモノアミノカルボン酸であるアミノ酸、L−プロリンのような環式アミノ酸、L−フェニルアラニン、L−チロシン、L−トリプトファンのような芳香族アミノ酸、L−システイン、L−シスチン、L−メチオニンのような含硫アミノ酸、L−グルタミン酸、L−アスパラギン酸等のような酸性アミノ酸、及びL−グルタミン、L−アスパラギン等のような側鎖にアミド基を持つアミノ酸が挙げられる。
好ましくは疎水性アミノ酸、酸性アミノ酸、及び側鎖にアミド基を持つアミノ酸が挙げられる。特に好ましくは、疎水性アミノ酸としては、脂肪族アミノ酸であるL−バリン、L−ロイシン、L−イソロイシン、芳香族アミノ酸であるL−トリプトファン、L−フェニルアラニン、L−チロシンが、酸性アミノ酸としてはL−グルタミン酸、L−アスパラギン酸が、側鎖にアミド基を持つアミノ酸としてはL−グルタミン、L−アスパラギン等が挙げられる。
また、本発明のL−アミノ酸には上記アミノ酸を出発物質として得られるL−アミノ酸誘導体も含まれ、GABA、p-ヒドロキシ-D-フェニルグリシン、DOPA、コハク酸、リンゴ酸、ピルビン酸が挙げられる。
本発明により製造されるL−アミノ酸又は核酸は、1種でもよく、2種又はそれ以上であってもよい。
【0015】
本発明において、「核酸」は、微生物を用いた発酵法において培地中に析出しながら蓄積するものであれば特に制限されない。核酸としては、プリンヌクレオシド、プリンヌクレオチドなどが挙げられる。プリンヌクレオシドには、イノシン、キサントシン、グアノシン、アデノシンなどが含まれ、プリンヌクレオチドには、プリンヌクレオシドの5’−燐酸エステル、例えばイノシン酸(イノシン−5’−リン酸。以下「IMP」ともいう)、キサンチル酸(キサントシン−5’−リン酸。以下「XMP」ともいう)、グアニル酸(グアノシン−5’−モノリン酸。以下「GMP」ともいう)、アデニル酸(アデノシン−5’−モノリン酸。以下「AMP」ともいう)などが含まれる。また、本発明の核酸には、上記核酸を出発物質として得られる核酸誘導体も含まれ、Ara-U(ウラシルアラビノシド)、ZVA(Z-バラシクロビル)等が挙げられる。なお、本発明において上記のL−アミノ酸、核酸またはそれらの誘導体を「目的物質」と表現することがある
【0016】
攪拌翼とは、発酵槽中の液体培地を攪拌するためのものであり、形状は特に問わない。通常は、攪拌翼は軸と、軸に設けられた翼(ブレード)からなるが、翼又はその一部が軸を構成するものであってもよい。また、通常、攪拌翼は軸を中心にして回転するが、他の形式で作動するものであっもよい。翼の形状としては、タービン形、パドル形、プロペラ形、アンカー形、リボン形等を用いることが出来るが、これらに制限されない。また、翼の枚数、各々の翼の配置も、特に制限されない。攪拌翼は、モーター等の動力機から軸に動力が伝えられて作動する。攪拌翼については、例えば、化学工学便覧 化学工学協会編
改訂四版 1310〜1311ページ 丸善株式会社)を参照できる。
【0017】
本発明において、攪拌翼の動力密度とは、単位発酵液当たりの攪拌翼の動力である。攪拌翼の動力は、発酵液を攪拌したときの動力機の動力(出力)から、発酵槽が空の状態で攪拌したときの動力機の動力(出力)を差し引くことにより算出される。動力は、具体的には例えば、動力機がモータであれば、モータに流れる電流とモータの効率から計算することよって算出することができる。また、モータに流れる電流と、動力との関係を示す検量線を作成しておき、その検量線を用いて電流から換算することによっても、動力を測定することができる。さらに、トルクメータ又はトルクセンサ等のトルクを測定する機器を用いて攪拌翼にかかるトルクを測定し、その値から以下の式によって動力を算出すること
ができる。
【0018】
動力P [kW]=T×2×π×n/1000
T:トルク[N・m]
n:攪拌翼の回転数[/s]
【0019】
上記のようにして測定される動力値を培地液量で割った値が攪拌翼の動力密度である。
【0020】
本発明において、攪拌翼の動力密度は、結晶析出後又は種晶添加後に2.4kW/m3以下になるように制御することが好ましい。攪拌翼の動力密度は、より好ましくは、2.0kW/m3以下、特に好ましくは、1.5kW/m3以下、最も好ましくは、1.0kW/m3以下に制御することが好ましい。なお、攪拌翼の動力密度の下限は、微生物の物質生産、あるいは微生物の生育を低下させない限り特に制限されないが、0.4 kW/m3以上、好ましくは0.5kW/m3以上、さらに好ましくは0.6kW/m3以上、最も好ましくは0.7kW/m3以上に制御することが好ましい。
【0021】
結晶析出後又は種晶添加後に、攪拌翼の動力密度は上記範囲となるように制御されるが、発酵終了まで連続的に制御されることが好ましい。また、攪拌翼の動力密度が実質的に上記範囲に制御されていれば、一時的に上記範囲を超えることがあってもよい。具体的には、結晶析出後又は種晶添加後、発酵終了又は目的物質の蓄積が頭打になるまでの期間の50%以上、好ましくは70%以上、より好ましくは90%以上で、攪拌翼の動力密度が上記範囲を満たしていれば、攪拌翼の動力密度は実質的に制御されている。
【0022】
結晶析出前又は種晶添加前は、攪拌翼の動力密度は結晶析出後又は種晶添加前上記範囲よりも高いことが好ましく、好ましくは2.6kW/m3以上、より好ましくは2.8kW/m3以上、特に好ましくは3.0kW/m3以上である。尚、攪拌翼の動力密度が実質的にこの範囲に制御されていれば、一時的に上記範囲を下回ることがあってもよい。具体的には、発酵開始、又は後述の目的物質生産期から結晶析出又は種晶添加までの期間の50%以上、好ましくは70%以上、より好ましくは90%以上で、攪拌翼の動力密度が上記範囲を満たしていれば、攪拌翼の動力密度は実質的に制御されている。
【0023】
本発明において、目的物質の結晶は、目的物質の蓄積がその飽和溶解度を超えると、又は過飽和の状態を超えると、自然に析出する。したがって、微生物が培地中に飽和溶解度を超える量の目的物質を蓄積する能力がある場合には、目的物質を析出させるための操作は不要であるが、目的物質の析出を促進するために、結晶を添加してもよい。種晶とは、このような目的で、必要に応じて培地中に添加する結晶を意味する。種晶は、結晶を促進させる効果があれば、目的物質に限られないが、望ましくは目的物質、例えばL−トリプトファン発酵であればL−トリプトファンが望ましい。
【0024】
添加する種晶の濃度は、目的物質を生産する微生物が、発酵工程で培地内に結晶を析出する能力を有する場合には、0.5g/L以上、好ましくは1g/L以上、より好ましくは5g/L以上、さらに好ましくは10g/L以上の種晶を培地中に添加することが好ましい。
【0025】
微生物が、培地中に飽和溶解度を超える量の目的物質を蓄積する能力がない場合、目的物質の濃度が飽和溶解度以上となるような量の目的物質を培地に添加する必要がある。その場合に添加する目的物質は、溶液であっても、粉体又は結晶であってもよいが、少なくとも種晶として結晶を含むことが好ましい。その場合、種晶の量は10g/L以上、好ましくは20g/L、より好ましくは30g/L、さらに好ましくは50g/L以上であることが好ましい。
【0026】
また、いずれの場合も、種晶を添加する濃度の上限は、微生物の物質生産、あるいは微生物の生育を著しく低下させる濃度でなければいずれでもよいが、100g/L以下、好ましく
は90g/L以下、より好ましくは80g/L以下、特に好ましくは70g/L以下の種晶であることが好適である。
【0027】
種晶を添加する時期は、目的物質を生産する能力を有する微生物を培地に接種する前、あるいは微生物を培地に接種した後の培養期間中のいずれの時期でもよいが、好ましくは微生物を培地に接種した後で、培地中の目的物質濃度が飽和溶解度に達する前後から培地中に目的物質の結晶が析出する前、より好ましくは培地中の目的物質濃度が過飽和にあるときであって、培地中に目的物質の結晶が析出する前をあげることが出来る。培養時間で示すと培養開始、又は後述の目的物質生産期の開始点から 5時間後、望ましくは10時間後、望ましくは15時間、さらに望ましくは20時間後、最も好ましくは25時間後に添加することが望ましい。また、目的物質の全培養時間、又は目的物質生産期から培養終了までの時間を1としたとき、全体の0.2、好ましくは0.3、さらに好ましくは0.4経過した時点で種晶を添加することが好ましい。
【0028】
ここで飽和溶解度とは、液体培地が目的物質で飽和しているときの液体培地に溶解している目的物質の濃度を意味する。すなわち目的物質の過飽和が解消した時に定常となる目的物質の濃度を意味する。
各L−アミノ酸及び核酸の溶解度は、表1、2の通りであり、これらの濃度に達する前後に、種晶を添加することが好ましい。
【0029】
【表1】

【0030】
【表2】

【0031】
本発明において、結晶析出後とは、培養液中に目的物質の飽和溶解度を超えて、目的物質の結晶が析出した後を意味する。なお、本発明においては、結晶析出前、又は種晶添加前は、攪拌翼の動力は結晶析出後、又は種晶添加後よりも高いことが望ましい。なお、結晶析出前、又は種晶添加前の攪拌翼の動力は、微生物の生育に好適な範囲であればいずれでもよいが、2.4kW/m3以上、好ましくは2.6kW/m3以上、より好ましくは2.8kW/m3以上、さらに好ましくは3.0kW/m3以上、もっとも好ましくは3.2 kW/m3以上に制御することが望ましい。
【0032】
また、本発明の方法は、目的物質生産能を持つ微生物を増殖させる段階(増殖期)と、目的物質を産生させる段階(目的物質生産期)を含んでいてもよい。その場合、増殖期に微生物を十分に生育させて、目的物質生産期に目的物質を最大限蓄積させることが好ましい。また、目的物質の析出、又は種晶の添加の時期は、増殖期の最終段階、又は目的物質生産期であることが好ましい。種晶の添加は、一度に行ってもよく、2回又は3回以上に分けて添加してもよく、さらには連続的に行ってもよい。
本発明における「増殖期」とは、炭素源が主に菌体生育に使用されている時期、すなわち微生物が対数的に増殖している時期を意味し、本発明における「L−アミノ酸生産期」とは、培養開始から10時間以降、好ましくは15時間以降、特に好ましくは20時間以降炭素源が主にL−アミノ酸生産に用いられている時期を意味する。
増殖期の攪拌翼の動力は、微生物の生育に好適な範囲であれば特に制限されず、具体的には、前記した結晶析出前、又は種晶添加前の攪拌翼の動力と同様である。
【0033】
本発明で用いられる培地は、栄養源として炭素源、窒素源とを含んでいればいずれでもよい。また、本発明の方法は、回分培養(batch culture)、流加培養(Fed−batch culture)、連続培養法(continuous culture)のいずれも用いることができる。
ここで本発明において、上記流加培養とは、培養中の容器に培地を連続的又は間欠的に流加し、培養終了時までその培地を容器から抜き取らない培養方法をいう。また、連続培養とは、培養中の容器に培地を連続的又は間欠的に流加するとともに、容器から培地(通常、流加する培地と当量)を抜き取る方法をいう。また、「初発培地」とは、流加培養又は連続培養において流加培地を流加させる前の回分培養(batch培養)に用いる培地のことを意味し、「流加培地」とは、流加培養又は連続培養を行う際に発酵槽に供給する培地のことを意味する。流加培地は、微生物の生育に必要な成分の全てを含んでいてもよいが、一部のみを含むものであってもよい。また、本発明において「発酵培地」とは、発酵槽中の培地を意味し、この発酵培地から目的物質が回収される。また、本発明において、「発酵槽」とは、目的物質生産を行う器を意味し、その形状は問わず、発酵タンクを用いてもジャーファーメンターを用いてもよい。また、その容量は目的物質を生成・回収できる容量であればいずれでもよい。
【0034】
本発明に用いられる培地に含まれる炭素源としては、グルコース、グリセロール、フラクトース、スクロース、マルトース、マンノース、ガラクトース、澱粉加水分解物、糖蜜等の糖類が使用でき、特にグルコース、スクロースが好ましい。その他、酢酸、クエン酸等の有機酸、エタノール、メタノール等のアルコール類も単独あるいは他の炭素源と併用して用いることができる。また、炭素源となる原料としては、ケインモラセス、ビートモラセス、ハイテストモラセス、シトラスモラセス、転化糖を用いてもよいし、セルロース、デンプン、コーン、シリアル、タピオカ等の天然原料の加水分解物を用いてもよい。また培養液中に溶存した二酸化炭素も炭素源として使用出来る。これらの炭素源が初発培地にも流加培地にも用いることができる。培地中にこれらの炭素源を1種のみ含んでいてもよいし、2種以上含んでいてもよい。また、初発培地、流加培地とも、同じ炭素源を用いてもよいし、流加培地の炭素源を初発培地と変更してもよい。例えば、初発培地の炭素源をグルコースとし、流加培地の炭素源をスクロースとする場合である。
【0035】
本発明の培地中に含まれる窒素源としては、アンモニア、硫酸アンモニウム、炭酸アンモニウム、塩化アンモニウム、リン酸アンモニウム、酢酸アンモニウム、ウレア等のアンモニウム塩または硝酸塩等が使用することができ、pH調整に用いられるアンモニアガス、アンモニア水も窒素源として利用できる。また、ペプトン、酵母エキス、肉エキス、麦芽エキス、コーンスティープリカー、大豆加水分解物等も利用出来る。培地中にこれらの窒素源を1種のみ含んでいてもよいし、2種以上含んでいてもよい。これらの窒素源は、初発培地にも流加培地にも用いることができる。また、初発培地、流加培地とも、同じ窒素源を用いてもよいし、流加培地の窒素源を初発培地と変更してもよい。
また本発明の培地には、炭素源、窒素源の他にリン酸源を含んでいることが好ましい。リン酸源としては、リン酸2水素カリウム、リン酸水素2カリウム、ピロリン酸などのリン酸ポリマー等が利用出来る。
【0036】
また本発明の培地には、炭素源、窒素源の他に、増殖促進因子(増殖促進効果を持つ栄養素)を含んでいてもよい。増殖促進因子とは、微量金属類、アミノ酸、ビタミン、脂肪酸、核酸、更にこれらのものを含有するペプトン、カザミノ酸、酵母エキス、大豆たん白分解物等が使用できる。特に芳香族アミノ酸、分岐鎖アミノ酸の場合、生合成系が共通しているので、微生物が後述のように、目的アミノ酸以外の生合成が弱化されている場合がある。このような場合、生合成系が弱化されたアミノ酸を培地中に添加することが好ましい。例えば目的アミノ酸がL−トリプトファンの場合、L−フェニルアラニン及び/またはチロシン、目的アミノ酸がL−フェニルアラニンの場合、L−トリプトファン及び/またはL−チロシンを添加することが望ましい(WO2003048374号パンフレット)。
【0037】
微量金属類としては、鉄、マンガン、マグネシウム、カルシウム等が挙げられ、ビタミンとしては、ビタミンB1、ビタミンB2、ビタミンB6、ニコチン酸、ニコチン酸アミド、ビタミンB12、ピリドキシン、パントテン酸等が挙げられる。これらの増殖促進因子は初発培地に含まれていてもよいし、流加培地に含まれていてもよい。
【0038】
また本発明の培地には、生育にアミノ酸などを要求する栄養要求性変異株を使用する場合には要求される栄養素を補添することが好ましい。特に本発明に用いることができるL−アミノ酸生産菌は、後述のようにL−アミノ酸生合成経路が強化されており、L−アミノ酸分解能が弱化されているものが多いので、L−リジン、L−ホモセリン、L−イソロイシン、L−メチオニンから選ばれる1種又は2種以上を添加することが望ましい。核酸生産菌についても同様に、必要な物質を培地に添加することが好ましい。
【0039】
初発培地と流加培地は、培地組成が同じであってもよく、異なっていてもよい。さらには、流加培地の流加が多段階で行われる場合、各々の流加培地の組成は同じであってもよく、異なっていてもよい。
【0040】
培養は、発酵温度20〜45℃、特に好ましくは30〜42℃で通気培養を行うことが好ましい。発酵槽に供給する気体としては、空気の他に高濃度酸素を空気と同時に供給し、供給気体中の酸素濃度を上げることもできる (特公平05-048117号公報、特公平5-39594号公報参照)。
酸素供給量は、培地中の酸素濃度が2〜4ppmになるような量で良く、酸素濃度40%〜100%の高濃度酸素と、空気との混合ガスを1/10〜1.5/1VVM供給することが好ましい。高濃度酸素は、酸素濃縮器を用いて調製することができる。ここで、酸素濃縮器としては、PSA式、酸素富化膜式があり、液体酸素を蒸発器で気化させ、若しくは直接発酵槽に供給する方法を用いることが出来る。
【0041】
また、pHを5〜9に制御し、通気培養を行う。培養中にpHが下がる場合には、例えば、炭酸カルシウムを加えるか、アンモニアガス、アンモニア水等のアルカリで中和する
。尚、目的アミノ酸が酸性アミノ酸、例えばL−グルタミン酸の場合には、pHは3〜9、好ましくは3〜5で行うことが望ましい。このような条件下で、好ましくは10時間〜120時間程度培養することにより、培養液中に著量の目的物質が蓄積される。蓄積される目的物質の濃度は野生株より高く、培地中から採取・回収できる濃度であればいずれでもよいが、L−アミノ酸の場合は、50g/L以上、好ましくは75g/L以上、さらに好ましくは100g/L以上、核酸の場合は50g/L以上、好ましくは75g/L以上、さらに好ましくは100g/L以上であることが好ましい。
【0042】
培養終了後の培養液から目的物質を採取する方法は、公知の回収方法に従って行えばよい。例えば、培地中に析出した目的物質は、遠心分離又は濾過等により回収することができる。また、培地中に析出した目的物質は、培地中に溶解している目的物質を晶析した後に、併せて単離してもよい。
【0043】
本発明においては、目的物質蓄積を一定以上に保つために、微生物の培養を種培養と本培養とに分けて行ってもよく、種培養をフラスコ等を用いたしんとう培養、又は回分培養で行い、本培養を流加培養、回分培養又は連続培養で行ってもよく、種培養、本培養ともに回分培養で行ってもよい。また、種培養及び本培養に先立って、1回、2回又はそれ以上の前培養を行い、順次スケールアップしてもよい。
【0044】
これらの培養法の場合、予定した目的物質濃度に到達したときに、目的物質を一部引き抜いて、新たに培地を添加して繰り返し培養を行ってもよい。新たに添加する培地とは、炭素源及び増殖促進効果を持つ栄養素(増殖促進因子)を含む培地が好ましい。炭素源としては、グルコース、スクロース、フルクトース、増殖促進因子としては、窒素源、リン酸、アミノ酸等が好ましい。窒素源としては、アンモニア、硫酸アンモニウム、炭酸アンモニウム、塩化アンモニウム、リン酸アンモニウム、酢酸アンモニウム、ウレア等のアンモニウム塩または硝酸塩等が使用することができる。またリン酸源としては、リン酸2水素カリウム、リン酸水素2カリウムが使用でき、アミノ酸としては、栄養要求性変異株を使用する場合には要求される栄養素を補添することが好ましい。
【0045】
本発明において、流加培養あるいは、連続培養を行う際には、一時的に糖や栄養源の供給が停止するように間欠的に流加培地を流加してもよい。また、流加を行う時間の最大で30%以下、望ましくは20%以下、特に望ましくは10%以下で流加培地の供給を停止することが好ましい。流加培養液を間欠的に流加させる場合には、流加培地を一定時間添加し、2回目以降の添加はある添加期に先行する添加停止期において発酵培地中の炭素源が枯渇するときのpH上昇または溶存酸素濃度の上昇がコンピューターで検出されるときに開始するように制御を行い、培養槽内の基質濃度を常に自動的に低レベルに維持してもよい(米国特許5,912,113号明細書)。
【0046】
炭素源としては、グルコース、スクロース、フルクトース、増殖促進因子としては、窒素源、リン酸、アミノ酸等が好ましい。窒素源としては、アンモニア、硫酸アンモニウム、炭酸アンモニウム、塩化アンモニウム、リン酸アンモニウム、酢酸アンモニウム、ウレア等のアンモニウム塩または硝酸塩等が使用することができる。またリン酸源としては、リン酸2水素カリウム、リン酸水素2カリウムが使用でき、アミノ酸としては、栄養要求性変異株を使用する場合には要求される栄養素を補添することが好ましい。また、流加培地は1種でもよく、2種以上の培地を混合してもよい。2種以上の流加培地を用いる場合、それらの培地は混合して1つのフィード缶により流加させてもよいし、複数のフィード缶で流加させてもよい。
【0047】
また、流加培養を行う際に、糖の量が、流加培養液あるいは発酵培地全体の炭素源量として、30g/Lを超えない程度で流加させることが好ましく、20g/L以下、10g/L以下で制御
することが好ましい。特に、微生物の対数増終了時以降に、糖濃度が前記濃度範囲となるように制御することが好ましい。炭素源の流加速度は、米国特許5,912,113号明細書記載の方法を用いて制御することが出来る。また、糖とリン酸が菌体生育の制限因子となる濃度で糖とリン酸を流加することが好ましく、流加培養液に含まれるリン酸の量としては、P/C ratioで2以下、好ましくは1.5以下、さらに好ましくは1以下である(米国特許5,763,230号明細書参照)。
【0048】
本発明で連続培養法を用いる場合には、引き抜きは流加と同時に行ってもよいし、一部引き抜いたあとで流加を行ってもよい。また培養液をL−アミノ酸と細胞を含んだまま引き抜いて、細胞だけ発酵槽に戻す菌体を再利用する連続培養法でもよい(フランス特許2669935号明細書参照)。連続的あるいは間欠的に栄養源を流加する方法は流加培養と同様の方法が用いられる。
【0049】
ここで、培養液を間欠的に引き抜く場合には、予定したL−アミノ酸濃度に到達したときに、L−アミノ酸を一部引き抜いて、新たに培地を流加して培養を行う。また、添加する培地の量は、最終的に引き抜く前の培養液量と同量になるように培養することが好ましい。ここで同量とは、引き抜く前の培養液量と93〜107%の程度の量を意味する。
【0050】
培養液を連続的に引き抜く場合には、栄養培地を流加させると同時に、あるいは流加させたあとに開始することが望ましく、例えば開始時間としては最大で流加を始めた5時間後、望ましくは3時間後、さらに望ましくは最大で1時間後である。また引き抜く培養液量としては、流加させる量と同量で引き抜くことが好ましい。
【0051】
菌体を再利用する連続培養法とは、予定した目的物質濃度に達したときに、発酵培地を間欠的にあるいは連続して引き抜き、目的物質のみを取り出し、菌体を含むろ過残留物若しくは遠心上澄み液を発酵槽中に再循環させる方法であり、例えばフランス特許2669935号明細書を参照にして実施することができる。
【0052】
また、本発明の晶析方法で析出した結晶は、培養途中で発酵槽から引き抜いてもよい。具体的には、発酵槽で本発明の方法を用いて、晶析発酵を行い、目的物質、菌体を含む発酵液を発酵液から引抜、アミノ酸の結晶を遠心処理・濃縮し、結晶を取り出し、発酵液を発酵槽に戻す方法により、生産性を高める方法を用いることが出来る。例えば、図1に記載の装置で、アミノ酸、菌体を含む発酵液をラインAから循環させ、アミノ酸の結晶を遠心処理Bで濃縮しラインCより引抜き、発酵液をラインDより発酵槽に戻す方法を用いることが出来る。この際、菌体は発酵槽に戻しても、戻さなくてもよい。結晶の遠心分離処理には、液体サイクロン(特開平5-92944)を用いると好適である。
【0053】
さらに、核酸の製造法においては、本発明の方法により製造されたイノシン又はグアノシンに、プリンヌクレオシドホスホリラーゼおよびホスホリボシルトランスフェラーゼを作用させることにより、5’−イノシン酸あるいは5’−グアニル酸が得られる。
【0054】
また、本発明の微生物を用いて生産されたプリンヌクレオシドに、ホスホトランスフェラーゼを作用させることによってリン酸化し、プリンヌクレオチド(ヌクレオシド−5’−燐酸エステル)を生産することも可能である。(特開2000-295996)例えば、エシェリヒア・コリのイノシングアノシンキナーゼをコードする遺伝子を導入したエシェリヒア属細菌を用いるプリンヌクレオチドの製造法(WO91/08286号パンフレット)、エキシグオバクテリウム・アセチリカムのイノシングアノシンキナーゼをコードする遺伝子を導入したコリネバクテリウム・アンモニアゲネスを用いたプリンヌクレオチドの製造法(WO96/30501号パンフレット)を採用することができる。
【0055】
また、本発明の微生物を用いて生産されたプリンヌクレオシドに、ポリ燐酸、フェニル燐酸、カルバミル燐酸からなる群より選択された燐酸供与体と、ヌクレオシド−5’−燐酸エステルを生成する能力を有する微生物や、酸性フォスファターゼ(EC 3.1.3.2)を作用させることによって、プリンヌクレオチド(ヌクレオシド−5’−燐酸エステル)を生産することも可能である。ヌクレオシド−5’−燐酸エステルを生成する能力を有する微生物は、プリンヌクレオシドをプリンヌクレオチドに変換する能力を有するものであれば特に制限されないが、例えば、国際公開パンフレットWO9637603号に記載されたような微生物が挙げられる。
【0056】
また、特開平07−231793に開示されているようなエシェリヒア・ブラッタエ(Escherichia blattae)JCM 1650、セラチア・フィカリア(Serratia ficaria)ATCC 33105、クレブシエラ・プランティコラ(Klebsiella planticola)IFO 14939 (ATCC 33531)、クレブシエラ・ニューモニエ(Klebsiella pneumoniae)IFO 3318 (ATCC 8724)、クレブシエラ・テリゲナ(Klebsiella terrigena)IFO 14941 (ATCC 33257)、モルガネラ・モルガニ(Morganella morganii)IFO 3168、エンテロバクター・アエロゲネス(Enterobacter aerogenes)IFO 12010、エンテロバクター・アエロゲネス IFO 13534 (ATCC 13048)、クロモバクテリウム・フルヴィアティレ(Chromobacterium fluviatile)IAM 13652、クロモバクテリウム・ヴィオラセウム(Chromobacterium violaceum)IFO 12614、セデセア・ラパゲイ(Cedecea lapagei)JCM 1684、セデセア・ダヴィシエ(Cedecea davisiae)JCM 1685、セデセア・ネテリ(Cedecea neteri)JCM 5909などを用いることもできる。
【0057】
酸性フォスファターゼとしては、例えば、特開2002-000289に開示されているようなものを用いることができ、より好ましくはヌクレオシドに対する親和性が上昇した酸性フォスファターゼ(特開平10-201481参照)やヌクレオチダーゼ活性が低下した変異型酸性フォスファターゼ(WO9637603参照)、燐酸エステル加水分解活性が低下した変異型酸性フォスファターゼ(特開2001-245676)などを用いることができる。
【0058】
本発明の微生物を用いて生産されたプリンヌクレオシドを化学的にリン酸化することにより、プリンヌクレオチドを得ることも可能である。(Bulletin of the Chemical Society of Japan 42,3505)また、微生物が有しているATP再生系を利用して、本発明のXMP生産能を有する微生物とXMPアミナーゼ活性を共役させることによってGMPを得る方法、イノシンキナーゼを共役させることによってIMPを得る方法も採用できる(Biosci.Biotech.Biochem.,51,840(1997) 特開昭63-230094)
【0059】
上記プリンヌクレオチドの製造に用いる、本発明の方法により製造されたイノシン又はグアノシン、又はプリンヌクレオシドは、精製されたものであってもよいが、プリンヌクレオシドの発酵液又はプリンヌクレオシドを含む粗精製物であってもよい。
<2>本発明に用いることが出来る微生物
【0060】
本発明に用いる微生物は、L−アミノ酸又は核酸生産能を有し、液体培地で培養したときに培地にL−アミノ酸又は核酸を蓄積させることができる微生物であれば、特に制限されない。蓄積するL−アミノ酸又は核酸の量は、培地から回収できる程度に蓄積できればいずれでもよいが、目的物質を培地中に晶析できる能力を有することが好ましく、例えば前記表1、2に記載された以上の濃度の目的物質を蓄積できることが望ましい。
【0061】
L−グルタミン酸を含む水溶液のpHを低下させると、L−グルタミン酸はγ−カルボキシル基のpKa(4.25)付近で溶解度は著しく減少し、等電点(pH3.2)で溶解度は最も低くなる。培地組成によっても異なるが、通常には、L−グルタミン酸は約30℃においては、pH3.2では10〜20g/L、pH4.0では30〜40g/L、pH4.7では50〜60g/L溶解する。
【0062】
本発明に用いる微生物又はそれを育種するための親株としては、エシェリヒア属細菌、パントエア属細菌を代表とする腸内細菌科に属する微生物や、コリネ型細菌等を用いることができる。また、メタノールからL−アミノ酸を生産できる、メチロフィラス属細菌、メチロバチルス属細菌などのメタノール資化性細菌を用いてもよい。その他の腸内細菌科に属する微生物としては、エンテロバクター(Enterobacter)属、、クレブシエラ(Klebsiella)属、セラチア(Serratia)属、エルビニア(Erwinia)属、サルモネラ(Salmonella)属、モルガネラ(Morganella)属などのγ−プロテオバクテリアに属する腸内細菌が挙げられ、またその他の微生物としては、アリサイクロバチルス(Alicyclobacillus)属細菌、バチルス(Bacillus)属細菌、サッカロマイセス属やキャンディダ属等に属する酵母などが挙げられる。
【0063】
エシェリヒア属細菌としては、ナイトハルトらの著書(Neidhardt,F.C.et.al., Escherichia coli and Salmonella Typhimurium, American Society for Microbiology, Washington D.C.,1208, table 1)に挙げられるもの、例えばエシェリヒア・コリ等が利用できる。エシェリヒア・コリの野生株としては、例えばK12株又はその誘導体、エシェリヒア・コリ MG1655株(ATCC No.47076)、及びW3110株(ATCC No.27325)等が挙げられる。これらを入手するには、例えばアメリカン・タイプ・カルチャー・コレクション(ATCC)より分譲を受けることができる(住所 ATCC, Address: P.O. Box 1549, Manassas, VA 20108, 1,United States of America)。
【0064】
また、エンテロバクター属細菌としては、エンテロバクター・アグロメランス(Enterobacter agglomerans)、エンテロバクター・アエロゲネス(Enterobacter aerogenes)等、パントエア属細菌としてはパントエア・アナナティス(Pantoea ananatis)が挙げられる。尚、近年、エンテロバクター・アグロメランスは、16S rRNAの塩基配列解析などにより、パントエア・アグロメランス(Pantoea agglomerans)又はパントエア・アナナティス(Pantoea ananatis)、パントエア・スチューアルティ(Pantoea stewartii)等に再分類されているものがある。本発明においては、腸内細菌科に分類されるものであれば、エンテロバクター属又はパントエア属のいずれに属するものであってもよい。パントエア・アナナティスを遺伝子工学的手法を用いて育種する場合には、パントエア・アナナティスAJ13355株(FERM BP-6614)、AJ13356株(FERM BP-6615)、AJ13601株(FERM BP-7207)及びそれらの誘導体を用いることができる。これらの株は、分離された当時はエンテロバクター・アグロメランスと同定され、エンテロバクター・アグロメランスとして寄託されたが、上記のとおり、16S rRNAの塩基配列解析などにより、パントエア・アナナティスに再分類されている。
【0065】
メチロフィラス属細菌として具体的には、メチロフィラス・メチロトロファスが挙げられ、代表的な株としてはAS1株(NCIMB10515)等が挙げられる。メチロフィラス・メチロトロファスAS1株はナショナル・コレクション・オブ・インダストゥリアル・アンド・マリン・バクテリア(National Collections of Industrial and Marine Bacteria、住所 NCIMB Lts., Torry Research Station 135, Abbey Road, Aberdeen AB9 8DG, United Kingdom)から入手可能である。
【0066】
メチロバチラス属細菌として具体的には、メチロバチラス・グリコゲネス(Methylobacillus glycogenes)、メチロバチラス・フラゲラタム(Methylobacillu flagellatum)等が挙げられる。メチロバチラス・グリコゲネスとしては、T-11株(NCIMB 11375)、ATCC 21276株、 ATCC 21371株、ATR80株(Appl. Microbiol. Biotechnol., (1994)、42巻, p67-72に記載)、A513株(Appl. Microbiol. Biotechnol., (1994)、42巻, p67-72に記載)等が挙げられる。メチロバチラス・グリコゲネスNCIMB 11375株は、ナショナル・コレクション・オブ・インダストゥリアル・アンド・マリン・バクテリア(National Collections of Industrial and Marine Bacteria、住所 NCIMB Lts., Torry Research Station 135, A
bbey Road, Aberdeen AB9 8DG, United Kingdom)から入手可能である。また、メチロバチラス・フラゲラタムとしては、KT株(Arch. Microbiol., (1988), 149巻、p441-446に記載)等が挙げられる。
【0067】
コリネ型細菌としては、バージーズ・マニュアル・オブ・デターミネイティブ・バクテリオロジー(Bergey's Manual of Determinative Bacteriology)第8版599頁(1974)に定義されている一群の微生物であり、好気性,グラム陽性,非抗酸性,胞子形成能を有しない桿菌に分類される微生物が利用できる。なお、コリネ型細菌は、従来ブレビバクテリウム属に分類されていたが現在はコリネバクテリウム属細菌として統合された細菌(Int.J. Syst. Bacteriol., 41, 255 (1991))、及びコリネバクテリウム属と非常に近縁なブレビバクテリウム属細菌及びミクロバテリウム属細菌を含む。
【0068】
このようなコリネ型細菌の例として以下のものが挙げられる。
コリネバクテリウム・アセトアシドフィラム
コリネバクテリウム・アセトグルタミカム
コリネバクテリウム・アルカノリティカム
コリネバクテリウム・カルナエ
コリネバクテリウム・グルタミカム
コリネバクテリウム・リリウム
コリネバクテリウム・メラセコーラ
コリネバクテリウム・サーモアミノゲネス(コリネバクテリウム・エフィシェンス)
コリネバクテリウム・ハーキュリス
ブレビバクテリウム・ディバリカタム
ブレビバクテリウム・フラバム
ブレビバクテリウム・インマリオフィラム
ブレビバクテリウム・ラクトファーメンタム
ブレビバクテリウム・ロゼウム
ブレビバクテリウム・サッカロリティカム
ブレビバクテリウム・チオゲニタリス
コリネバクテリウム・アンモニアゲネス
ブレビバクテリウム・アルバム
ブレビバクテリウム・セリヌム
ミクロバクテリウム・アンモニアフィラム
【0069】
具体的には、下記のような菌株を例示することができる。
コリネバクテリウム・アセトアシドフィラム ATCC13870
コリネバクテリウム・アセトグルタミカム ATCC15806
コリネバクテリウム・アルカノリティカム ATCC21511
コリネバクテリウム・カルナエ ATCC15991
コリネバクテリウム・グルタミカム ATCC13020, ATCC13032, ATCC13060
コリネバクテリウム・リリウム ATCC15990
コリネバクテリウム・メラセコーラ ATCC17965
コリネバクテリウム・エッフィシエンス AJ12340(FERM BP-1539)
コリネバクテリウム・ハーキュリス ATCC13868
ブレビバクテリウム・ディバリカタム ATCC14020
ブレビバクテリウム・フラバム ATCC13826, ATCC14067, AJ12418(FERM BP-2205)
ブレビバクテリウム・インマリオフィラム ATCC14068
ブレビバクテリウム・ラクトファーメンタム ATCC13869(コリネバクテリウム・グルタミカムATCC13869)
ブレビバクテリウム・ロゼウム ATCC13825
ブレビバクテリウム・サッカロリティカム ATCC14066
ブレビバクテリウム・チオゲニタリス ATCC19240
コリネバクテリウム・アンモニアゲネス ATCC6871、ATCC6872
ブレビバクテリウム・アルバム ATCC15111
ブレビバクテリウム・セリヌム ATCC15112
ミクロバクテリウム・アンモニアフィラム ATCC15354
【0070】
これらを入手するには、例えばアメリカン・タイプ・カルチャー・コレクションより分譲を受けることができる(住所 P.O. Box 1549, Manassas, VA 2010812301 Parklawn Drive, Rockville, Maryland 20852, United States of America)。すなわち、菌株毎に対応する登録番号が付与されており、この登録番号を利用して分譲を受けることができる。各菌株に対応する登録番号はアメリカン・タイプ・カルチャー・コレクションのカタログに記載されている(http://www.atcc.org/参照)。また、AJ12340株は、1987年10月27日付けで通商産業省工業技術院生命工学工業技術研究所(現独立行政法人産業技術総合研究所 特許生物寄託センター)(〒305-5466 日本国茨城県つくば市東1丁目1番地1 中央第6)にFERM BP-1539の受託番号でブダペスト条約に基づいて寄託されている。また、AJ12418株は、1989年1月5日付けで通商産業省工業技術院生命工学工業技術研究所にFERM BP-2205の受託番号でブダペスト条約に基づいて寄託されている。
【0071】
バチルス属細菌を用いるときは、バチルス属細菌としては、バチルス・ズブチリス、バチルス・アミロリケファシエンス、バチルス・プミルス等が挙げられる。
バチルス・ズブチリスとしては、バチルス・ズブチリス168 Marburg(ATCC6051)、バチルス・ズブチリスPY79(Plasmid, 1984, 12, 1-9)等が、バチルス・アミロリケファシエンスとしては、バチルス・アミロリケファシエンスT(ATCC23842)、及びバチルス・アミロリケファシエンスN(ATCC23845)等が挙げられる。また、バチルス・プミルスとしては、バチルス・プミルス Gottheil No.3218(ATCC No.21005)(米国特許第3,616,206号)等が挙げられる。
【0072】
以下、上述したような親株にL−アミノ酸又は核酸生産能を付与する方法について述べる。
【0073】
L−アミノ酸又は核酸生産能を付与するには、栄養要求性変異株、アナログ耐性株又は代謝制御変異株の取得や、L−アミノ酸又は核酸の生合成系酵素の発現が増強された組換え株の創製等、従来、コリネ型細菌又はエシェリヒア属細菌等の育種に採用されてきた方法を適用することができる(アミノ酸発酵、(株)学会出版センター、1986年5月30日初版発行、第77〜100頁参照)。ここで、L−アミノ酸生産菌の育種において、付与される栄養要求性、アナログ耐性、代謝制御変異等の性質は、単独でもよく、2種又は3種以上であってもよい。また、発現が増強されるL−アミノ酸生合成系酵素も、単独であっても、2種又は3種以上であってもよい。さらに、栄養要求性、アナログ耐性、代謝制御変異等の性質の付与と、生合成系酵素の増強が組み合わされてもよい。
【0074】
L−アミノ酸又は核酸生産能を有する栄養要求性変異株、L−アミノ酸又は核酸のアナログ耐性株、又は代謝制御変異株を取得するには、親株又は野生株を通常の変異処理、すなわちX線や紫外線の照射、またはN−メチル−N'−ニトロ−N−ニトロソグアニジン等の変異剤処理などによって処理し、得られた変異株の中から、栄養要求性、アナログ耐性、又は代謝制御変異を示し、かつL−アミノ酸生産能を有するものを選択することによって得ることができる。
【0075】
L−アミノ酸生産能を有する栄養要求性変異株、L−アミノ酸のアナログ耐性株、又は
代謝制御変異株は、親株又は野生株を通常の変異処理、すなわちX線や紫外線の照射、またはN−メチル−N'−ニトロ−N−ニトロソグアニジン(NTG)、エチルメタンスルフォネート(EMS)等の変異剤処理などによって処理し、得られた変異株の中から、栄養要求性、アナログ耐性、又は代謝制御変異を示し、かつL−アミノ酸生産能を有するものを選択することによって得ることができる。
以下、具体的にL−アミノ酸生産能を付与する方法とアミノ酸生産菌について例示する。
【0076】
L−トリプトファン、L−フェニルアラニン、L−チロシンは共に芳香族アミノ酸で生合成系が共通しており、芳香族アミノ酸の生合成系酵素をコードする遺伝子としては、デオキシアラビノ−ヘプツロン酸リン酸シンターゼ(aroG)、3−デヒドロキネートシンターゼ(aroB)、シキミ酸デヒドロゲナーゼ(aroE)、シキミ酸キナーゼ(aroL)、5−エノール酸ピルビンシキミ酸3−リン酸シンターゼ(aroA)、コリスミ酸シンターゼ(aroC)が挙げられる(欧州出願公開763127号明細書)。また、これらの遺伝子はチロシンリプレッサー(tyrR)によって制御されることが知られており、tyrR遺伝子を欠損させることによって、芳香族アミノ酸の生合成系酵素活性を上昇してもよい(欧州特許763127号明細書参照)。尚、酵素名の後のカッコ内は、遺伝子名である(以下の記載においても同様)。
また、それぞれのアミノ酸生産能を強化する場合、目的とする芳香族アミノ酸以外の生合成系を弱化させてもよい。例えば、目的アミノ酸がL−トリプトファンの場合、L−フェニルアラニン生合成系、L−チロシン生合成系を弱化させてもよい(US4,371,614)。
【0077】
また、3−デオキシ−D−アラビノヘプツロン酸−7−リン酸シンターゼ(aroF、aroG)は、芳香族アミノ酸によるフィードバック阻害を受けるので、フィードバック阻害を受けないように改変してもよい。例えば、aroFの場合、N末端より147位のL−アスパラギン酸または181位のL−セリンが他のアミノ酸残基に、aroGの場合、N末端より146位のL−アスパラギン酸、147位のL−メチオニン、150位のL−プロリンもしくは202位のL−アラニンの1アミノ酸残基、または157位のL−メチオニン及び219位のL−アラニンの2アミノ酸残基を他のアミノ酸に置換した変異型aroF、aroG遺伝子を宿主に導入することによって、芳香族生産アミノ酸生産菌を得ることができる(EP0488424)。
【0078】
また、分岐鎖アミノ酸の合成に関与する遺伝子として、ilvGMEDAオペロンが挙げられるが、同オペロンは、L−バリン及び/又はL−イソロイシン及び/又はL−ロイシンによるオペロンの発現調節(アテニュエーション)を受けるので、アテニュエーションに必要な領域が除去又は変異されたilvGMEDAオペロンを微生物に保持させることによって、これらのL−アミノ酸の生産性を向上させることができる。
【0079】
芳香族アミノ酸、分岐鎖アミノ酸はそれぞれ生合成系が共通しており、目的とするL−アミノ酸以外の芳香族アミノ酸、分岐鎖アミノ酸に固有の生合成系を弱化した株を用いることが好ましい。例えば、目的アミノ酸がL−トリプトファンの場合、L−フェニルアラニン、L−チロシン固有の生合成系を弱化すること、目的アミノ酸がL−フェニルアラニンの場合、L−トリプトファン、L−チロシン固有の生合成系を弱化すること、目的アミノ酸がL−バリンの場合、L−ロイシン、L−イソロイシン固有の生合成系を弱化すること、目的アミノ酸がL−イソロイシンの場合、L−バリン、L−ロイシン固有の生合成系を弱化すること、目的アミノ酸がL−ロイシンの場合、L−バリン、L−イソロイシン固有の生合成系を弱化することによって、目的L−アミノ酸を効率よく生産する菌株を得ることができる。生合成系を弱化することは、それぞれその生合成系の酵素をコードする遺伝子に変異を導入すること、また合成培地中で弱化したい生合成系により合成されるL−アミノ酸を要求する株を、同L−アミノ酸を含有する合成培地を用いて取得することにより達成できる。
以下に、L−アミノ酸生産能を付与する方法及び本発明で使用することのできるL−ア
ミノ酸生産能が付与された微生物を例示する。
【0080】
L−トリプトファン生産菌
L−トリプトファン生産菌又はそれを誘導するための親株の例としては、変異trpS遺伝子によりコードされるトリプトファニル-tRNAシンテターゼが欠損したE. coli JP4735/pMU3028 (DSM10122)及びJP6015/pMU91 (DSM10123) (米国特許第5,756,345号)、セリンによるフィードバック阻害を受けないフォスフォグリセリレートデヒドロゲナーゼをコードするserAアレル及びトリプトファンによるフィードバック阻害を受けないアントラニレートシンターゼをコードするtrpEアレルを有するE. coli SV164 (pGH5) (米国特許第6,180,373号)、トリプトファナーゼが欠損したE. coli AGX17 (pGX44) (NRRL B-12263)及びAGX6(pGX50)aroP (NRRL B-12264) (米国特許第4,371,614号)、フォスフォエノールピルビン酸生産能が増大したE. coli AGX17/pGX50,pACKG4-pps (WO9708333, 米国特許第6,319,696号)などのエシェリヒア属に属する株が挙げられるが、これらに限定されない。yedA遺伝子またはyddG遺伝子にコードされるタンパク質の活性が増大したエシェリヒア属に属するL−トリプトファン生産菌も使用できる(米国特許出願公開2003/0148473 A1及び2003/0157667
A1)。
【0081】
L−トリプトファン生産菌又はそれを誘導するための親株の例としては、アントラニレートシンターゼ(trpE)、フォスフォグリセレートデヒドロゲナーゼ(serA)、及び、トリプトファンシンターゼ(trpAB)から選ばれる酵素の活性の一種以上が増大した株も挙げられる。アントラニレートシンターゼ及びフォスフォグリセレートデヒドロゲナーゼは共にL−トリプトファン及びL−セリンによるフィードバック阻害を受けるので、フィードバック阻害を解除する変異をこれらの酵素に導入してもよい。このような変異を有する株の具体例としては、脱感作型アントラニレートシンターゼを保持するE. coli SV164、及び、フィードバック阻害が解除されたフォスフォグリセレートデヒドロゲナーゼをコードする変異serA遺伝子を含むプラスミドpGH5 (WO 94/08031)をE. coli SV164に導入することにより得られた形質転換株が挙げられる。
【0082】
また、L−トリプトファン生産菌又はそれを誘導するための親株の例として、3−フォスフォセリンフォスファターゼ(serB)活性を増大した株(US4,371,614)、フォスフォエノールピルビン酸カルボキシキナーゼ(pckA)を増大した株(WO2004/090125)、マレートシンターゼ・イソシトレートリアーゼ・イソシトレートデヒドロゲナーゼキナーゼ/フォスファターゼオペロン(aceオペロン)が構成的に発現するか、又は同オペロンの発現が強化された株(WO2005/103275)が挙げられる。
【0083】
L−トリプトファン生産菌又はそれを誘導するための親株の例としては、阻害解除型アントラニレートシンターゼをコードする遺伝子を含むトリプトファンオペロンが導入された株(特開昭57-71397号, 特開昭62-244382号, 米国特許第4,371,614号)も挙げられる。さらに、トリプトファンオペロン(trpBA)中のトリプトファンシンターゼをコードする遺伝子の発現を増大させることによりL−トリプトファン生産能を付与してもよい。トリプトファンシンターゼは、それぞれtrpA及びtrpB遺伝子によりコードされるα及びβサブユニットからなる。さらに、イソシトレートリアーゼ−マレートシンターゼオペロンの発現を増大させることによりL−トリプトファン生産能を改良してもよい(WO2005/103275)。
【0084】
コリネ型細菌としてはサルフアグアニジンに耐性株であるコリネバクテリウム・グルタミクムAJ12118(FERM BP-478 特許01681002号)、トリプトファンオペロンが導入されたコリネ型細菌(特開S63240794号公報)、コリネ型細菌由来のシキミ酸キナ−ゼをコ−ドする遺伝子を導入したコリネ型細菌(特開01994749号公報)を用いることができる。
【0085】
L−フェニルアラニン生産菌
L−フェニルアラニン生産菌又はそれを誘導するための親株の例としては、E.coli AJ12739 (tyrA::Tn10, tyrR) (VKPM B-8197)、変異型pheA34遺伝子を保持するE.coli HW1089
(ATCC 55371) (米国特許第 5,354,672号)、E. coli MWEC101-b (KR8903681)、E.coli NRRL B-12141, NRRL B-12145, NRRL B-12146及びNRRL B-12147 (米国特許第4,407,952号)などのエシェリヒア属に属する株が挙げられるが、これらに限定されない。また、親株として、E. coli K-12 [W3110 (tyrA)/pPHAB] (FERM BP-3566)、E. coli K-12 [W3110 (tyrA)/pPHAD] (FERM BP-12659)、E. coli K-12 [W3110 (tyrA)/pPHATerm] (FERM BP-12662)及びAJ 12604と命名されたE. coli K-12 [W3110 (tyrA)/pBR-aroG4, pACMAB] (FERM BP-3579)も使用できる(EP 488424 B1)。さらに、yedA遺伝子またはyddG遺伝子にコードされるタンパク質の活性が増大したエシェリヒア属に属するL−フェニルアラニン生産菌も使用できる(米国特許出願公開2003/0148473 A1及び2003/0157667 A1)。
【0086】
コリネ型細菌のフェニルアラニン生産菌としては、ホスホエノールピルビン酸カルボキシラーゼまたはピルビン酸キナーゼ活性が低下したCornebacterium glutamicum BPS-13株
(FERM BP-1777, K77 (FERM BP-2062) 及び K78 (FERM BP-2063)(欧州特許公開公報331145号 JP 02303495)、チロシン要求性株(JP 05049489)等を使用することができる。
【0087】
また、フェニルアラニン生産菌としては、副生物を細胞内に取り込むように改変すること、例えば、L−トリプトファンの取り込み遺伝子tnaB,mtrや、L−チロシンの取り込み遺伝子であるtyrPの発現量を向上させることによっても、効率よくL−フェニルアラニンを生産する菌株を取得することができる(EP1484410)。
【0088】
L−チロシン生産菌
チロシン生産菌としては、チロシンによる阻害を受けない脱感作型のプレフェン酸デヒドラターゼ遺伝子(tyrA)を有するエシェリヒア属細菌(欧州特許出願公開1616940号公報)が挙げられる。
【0089】
L−バリン生産菌
L−バリン生産菌又はそれを誘導するための親株の例としては、ilvGMEDAオペロンを過剰発現するように改変された株(米国特許第5,998,178号)が挙げられるが、これらに限定されない。ilvGMEDAオペロンのアテニュエーションに必要な領域を除去し、生産されるL−バリンによりオペロンの発現が減衰しないようにすることが好ましい。さらに、オペロンのilvA遺伝子が破壊され、スレオニンデアミナーゼ活性が減少することが好ましい。
【0090】
本発明のL−バリン生産菌を誘導するための親株の例としては、アミノアシルt-RNAシンテターゼに変異を有する変異株(米国特許第5,658,766号)も挙げられる。例えば、イソロイシンtRNAシンテターゼをコードするileS 遺伝子に変異を有するE. coli VL1970が使用できる。E. coli VL1970は、1988年6月24日、ルシアン・ナショナル・コレクション・オブ・インダストリアル・マイクロオルガニズムズ(VKPM) (1 Dorozhny proezd., 1 Moscow 117545, Russia)に、受託番号VKPM B-4411で寄託されている。
さらに、生育にリポ酸を要求する、及び/または、H+-ATPaseを欠失している変異株(WO96/06926)を親株として用いることができる。
【0091】
コリネ型細菌のL−バリン生産菌としては、例えば、L−バリン酸生合成に関与する酵素をコードする遺伝子の発現が増強するように改変した菌株を挙げることができる。L−バリン酸生合成に関与する酵素としては、例えば、ilvBNCオペロンによりコードされる酵素、すなわちilvBNによりコードされるアセトヒドロキシ酸シンターゼやivlCによりコードされるイソメロリダクターゼ(国際公開パンフレットWO00/50624号)が挙げられる。尚、ilvBNCオペロンは、L−バリン及び/又はL−イソロイシン及び/又はL−ロイシンによる
オペロンの発現調節を受けるので、生成するL−バリンによる発現抑制を解除するためにアテニュエーションを解除することが望ましい。
【0092】
L−バリン生産能を有するコリネ型細菌としては、L−バリン産生を減少させる物質代謝経路に関与する、少なくとも1種の酵素の活性を低下あるいは欠損させることにより行ってもよい。例えば、L−ロイシン合成に関与するスレオニンデヒドラターゼやD-パントセナート合成に関与する酵素の活性を低下させることが考えられる(国際公開パンフレットWO0050624号)。
【0093】
L−バリン生産能を付与する別の方法として、アミノ酸アナログなどへの耐性を付与する方法も挙げられる。
例えば、L−イソロイシンおよびL−メチオニン要求性,ならびにD−リボ−ス,プリンリボヌクレオシドまたはピリミジンリボヌクレオシドに耐性を有し,かつL−バリン生産能を有する変異株(FERM P-1841、FERM P-29、特公昭53-025034) や、ポリケトイド類に耐性を有する変異株(FERM P-1763、FERM P-1764、特公平06-065314) 、更には酢酸を唯一の炭素源とする培地でL−バリン耐性を示し、且つグルコースを唯一の炭素源とする培地でピルビン酸アナログ(-フルオロピルビン酸等)に感受性を有する変異株(FERM BP-3006、FERM BP-3007、特許3006929号)が挙げられる。
【0094】
L−イソロイシン生産菌
L−イソロイシン生産菌又はそれを誘導するための親株の例としては、6−ジメチルアミノプリンに耐性を有する変異株(特開平5-304969号)、チアイソロイシン、イソロイシンヒドロキサメートなどのイソロイシンアナログに耐性を有する変異株、さらにDL−エチオニン及び/またはアルギニンヒドロキサメートに耐性を有する変異株(特開平5-130882号).が挙げられるが、これらに限定されない。さらに、スレオニンデアミナーゼ、アセトヒドロキシ酸シンターゼなどのL−イソロイシン生合成に関与するタンパク質をコードする遺伝子で形質転換された組換え株もまた親株として使用できる(特開平2-458号, FR 0356739, 及び米国特許第5,998,178号)。
【0095】
コリネ型細菌のL−イソロイシン生産菌としては、分岐鎖アミノ酸排出タンパク質をコードするbrnE遺伝子を増幅したコリネ型細菌(特開2001-169788)、L−リジン生産菌とのプロトプラスト融合によりL−イソロイシン生産能を付与したコリネ型細菌(特開昭62-74293)、ホモセリンデヒドロゲナーゼを強化したコリネ型細菌(特開昭62-91193)、スレオニンハイドロキサメート耐性株(特開昭62-195293)、α−ケトマロン耐性株(特開昭61-15695)、メチルリジン耐性株(特開昭61-15696)が挙げられる。
【0096】
L−ロイシン生産菌
L−ロイシン生産菌又はそれを誘導するための親株の例としては、ロイシン耐性のE. coil株 (例えば、57株 (VKPM B-7386, 米国特許第6,124,121号))またはβ−2−チエニルアラニン、3−ヒドロキシロイシン、4−アザロイシン、5,5,5-トリフルオロロイシンなどのロイシンアナログ耐性のE. coli株(特公昭62-34397号及び特開平8-70879号)、WO96/06926に記載された遺伝子工学的方法で得られたE. coli株、E. coli H-9068 (特開平8-70879号)などのエシェリヒア属に属する株が挙げられるが、これらに限定されない。
【0097】
本発明の細菌は、L−ロイシン生合成に関与する遺伝子の1種以上の発現が増大されることにより改良されていてもよい。このような遺伝子の例としては、好ましくはL−ロイシンによるフィードバック阻害が解除されたイソプロピルマレートシンターゼをコードする変異leuA遺伝子(米国特許第6,403,342号)に代表される、leuABCDオペロンの遺伝子が挙げられる。さらに、本発明の細菌は、細菌の細胞からL−アミノ酸を排出するタンパク質をコードする遺伝子の1種以上の発現が増大されることにより改良されていてもよい。こ
のような遺伝子の例としては、b2682遺伝子及びb2683遺伝子(ygaZH遺伝子) (EP 1239041 A2)が挙げられる。
【0098】
コリネ型細菌のL−ロイシン生産菌としては、2−チアゾールアラニンかつβ−ハイドロキシロイシン耐性株(特開平8−266295)、バリンアナログ耐性株(特開昭63−248392)、バリン要求性株(特公昭38−4395)、S−(2−アミノエチル)−L−システイン(AEC)耐性株(特公昭51−37347)、フェニルアラニン、バリン、イソロイシン要求性株(特公昭54−36233)が挙げられる。
【0099】
L−グルタミン酸生産菌
L−グルタミン酸生産菌として好適な菌株は、例えば、L−グルタミン酸生合成に関与する酵素をコードする遺伝子の発現が増強するように改変する方法を挙げることができる。L−グルタミン酸生合成に関与する酵素としては、かかる遺伝子の例としては、グルタメートデヒドロゲナーゼ(gdhA)、グルタミンシンテターゼ(glnA)、グルタメートシンテターゼ(gltAB)、イソシトレートデヒドロゲナーゼ(icdA)、アコニテートヒドラターゼ(acnA, acnB)、シトレートシンターゼ(gltA)、フォスフォエノールピルベートカルボシラーゼ(ppc)、ピルベートデヒドロゲナーゼ(aceEF, lpdA)、ピルベートキナーゼ(pykA, pykF)、フォスフォエノールピルベートシンターゼ(ppsA)、エノラーゼ(eno)、フォスフォグリセロムターゼ(pgmA, pgmI)、フォスフォグリセレートキナーゼ(pgk)、グリセルアルデヒド-3-フォスフェートデヒドロゲナーゼ(gapA)、トリオースフォスフェートイソメラーゼ(tpiA)、フルクトースビスフォスフェートアルドラーゼ(fbp)、フォスフォフルクトキナーゼ(pfkA, pfkB)、グルコースフォスフェートイソメラーゼ(pgi)、メチルクエン酸シンターゼ(prpC)などが挙げられるがこれらに限定されない。
【0100】
シトレートシンテターゼ遺伝子、フォスフォエノールピルベートカルボキシラーゼ遺伝子、イソクエン酸デヒドロゲナーゼ、ピルベートデヒドロゲナーゼ及び/またはグルタメートデヒドロゲナーゼ遺伝子の発現が増大するように改変された株の例としては、EP1078989A、EP955368A及びEP952221A、EP1033407Aに開示されたものが挙げられる。
【0101】
L−グルタミン酸生産能を付与するための改変は、L−グルタミン酸の生合成経路から分岐して他の化合物を生成する反応を触媒する酵素の活性を低下または欠損させることにより行ってもよい。L−グルタミン酸の生合成経路から分岐してL−グルタミン酸以外の化合物を生成する反応を触媒する酵素としては、イソクエン酸リアーゼ、α−ケトグルタル酸デヒドロゲナーゼ、アセトヒドロキシ酸シンターゼ、アセト乳酸シンターゼ、ギ酸アセチルトランスフェラーゼ、乳酸デヒドロゲナーゼ、グルタミン酸デカルボキシラーゼ、1−ピロリン5−カルボキシレートデヒドロゲナーゼなどが挙げられる。
【0102】
例えば、α−ケトグルタル酸デヒドロゲナーゼ活性を低下させるには該酵素のE1oサブユニットをコードするsucA(odhA)遺伝子を用いて改変すればよい。α−ケトグルタル酸デヒドロゲナーゼ活性が低下した株として、例えば、以下の株が挙げられる。
ブレビバクテリウム・ラクトファーメンタムΔS株(国際公開95/34672号パンフレット)
ブレビバクテリウム・ラクトファーメンタムAJ12821(FERMBP−4172;フランス特許公報9401748号明細書参照)
ブレビバクテリウム・フラバムAJ12822 (FERMBP−4173;フランス特許公報9401748号明細書参照)
コリネバクテリウム・グルタミカムAJ12823(FERMBP−4174;フランス特許公報9401748号明細書参照)
パントエア・アナナティスAJ13601 (FERM BP-7207)
クレブシエラ・プランティコーラAJ13410株(FERM BP-6617)
パントエア・アナナティスAJ13355 (FERM BP-6614)
が挙げられる。
ここで、パントエア・アナナティスAJ13356は、αKGDH-E1サブユニット遺伝子(sucA)の破壊によりα-ケトグルタレートデヒドロゲナーゼ活性が欠損している。この株は、単離された時には、エンテロバクター・アグロメランスと同定され、エンテロバクター・アグロメランスAJ13356として寄託された。しかし、16S rRNAの塩基配列などに基づき、パントエア・アナナティスに再分類された。AJ13356は、上記寄託機関にエンテロバクター・アグロメランスとして寄託されているが、本明細書では、パントエア・アナナティスとして記載する。
【0103】
さらにコリネ型細菌にL−グルタミン酸生産能を付与する方法として、yggB遺伝子(NCgl 1221;NP_600492. Reports small-conductance.[gi:19552490];WO2006/070944)を増幅する方法、コード領域内に変異を導入した変異型yggB遺伝子を導入する方法を用いることも可能である。
【0104】
本発明の製造法に使用する微生物は、D-キシロース5−リン酸−ホスホケトラーゼ及び/又はフルクトース6-リン酸ホスホケトラーゼ活性を増強するように改変された微生物でもよい。
D-キシロース5−リン酸−ホスホケトラーゼ活性及びフルクトース6-リン酸ホスホケトラーゼ活性はいずれか一方を活性化してもよいし、両方を活性化してもよい。
【0105】
L−グルタミン酸生産能を付与または増強する別の方法として、有機酸アナログや呼吸阻害剤などへの耐性を付与する方法や細胞壁合成阻害剤に対する感受性を付与する方法も挙げられる。例えば、モノフルオロ酢酸耐性を付与する方法(特開昭50-113209)、アデニン耐性またはチミン耐性を付与する方法(特開昭57-065198)、ウレアーゼを弱化させる方法(特開昭52-038088)、マロン酸耐性を付与する方法(特開昭52-038088)、ベンゾピロンまたはナフトキノン類への耐性を付与する方法(特開昭56-1889)、HOQNO耐性を付与する方法(特開昭56-140895)、α-ケトマロン酸耐性を付与する方法(特開昭57-2689)、グアニジン耐性を付与する方法(特開昭56-35981)、ペニシリンに対する感受性を付与する方法(特開平4-88994)などが挙げられる。
【0106】
このような耐性菌の具体例としては、下記のような菌株が挙げられる。
ブレビバクテリウム・フラバムAJ3949(FERM BP-2632;特開昭50-113209参照)
コリネバクテリウム・グルタミカムAJ11628 (FERM P-5736;特開昭57-065198参照)
ブレビバクテリウム・フラバムAJ11355(FERM P-5007;特開昭56-1889号公報参照)
コリネバクテリウム・グルタミカムAJ11368(FERM P-5020;特開昭56-1889号公報参照)
ブレビバクテリウム・フラバムAJ11217(FERM P-4318;特開昭57-2689号公報参照)
コリネバクテリウム・グルタミカムAJ11218(FERM P-4319;特開昭57-2689号公報参照)
ブレビバクテリウム・フラバムAJ11564(FERM P-5472;特開昭56-140895公報参照)
ブレビバクテリウム・フラバムAJ11439(FERM P-5136;特開昭56-35981号公報参照)
コリネバクテリウム・グルタミカムH7684(FERM BP-3004;特開平04-88994号公報参照)
ブレビバクテリウム・ラクトファーメンタムAJ11426(FERM P-5123;特開平56-048890号公報参照)
コリネバクテリウム・グルタミカムAJ11440(FERM P-5137;特開平56-048890号公報参照)
ブレビバクテリウム・ラクトファーメンタムAJ11796(FERM P-6402;特開平58-158192号公報参照)
【0107】
L−スレオニン生産菌
本発明に用いられるL−スレオニン生産菌として好ましいものとしては、L−スレオニ
ン生合成系酵素を強化した腸内細菌科に属する細菌が挙げられる。L−スレオニン生合成系酵素をコードする遺伝子としては、アスパルトキナーゼIII遺伝子(lysC)、アスパラギン酸セミアルデヒドデヒドロゲナーゼ遺伝子(asd)、thrオペロンにコードされるアスパルトキナーゼI遺伝子(thrA)、ホモセリンキナーゼ遺伝子(thrB)、スレオニンシンターゼ遺伝子(thrC)が挙げられる。これらの遺伝子は2種類以上導入してもよい。L−スレオニン生合成系遺伝子は、スレオニン分解が抑制された腸内細菌科に属する細菌に導入してもよい。スレオニン分解が抑制されたエシェリヒア属細菌としては、例えば、スレオニンデヒドロゲナーゼ活性が欠損したTDH6株(特開2001-346578号)等が挙げられる。
【0108】
L−スレオニン生合成系酵素は、最終産物のL−スレオニンによって酵素活性が抑制される。従って、L−スレオニン生産菌を構築するためには、L−スレオニンによるフィードバック阻害を受けないようにL−スレオニン生合成系遺伝子を改変することが望ましい。また、上記thrA、thrB、thrC遺伝子は、スレオニンオペロンを構成しているが、スレオニンオペロンは、アテニュエーター構造を形成しており、スレオニンオペロンの発現は、培養液中のイソロイシン、スレオニンにより阻害を受け、また、アテニュエーションにより発現が抑制される。このアテニュエーションの解除又は低減は、アテニュエーション領域のリーダー配列あるいは、アテニュエーターを除去することにより達成出来る(Lynn, S. P., Burton, W. S., Donohue, T. J., Gould, R. M., Gumport, R. I., and Gardner,
J. F. J. Mol. Biol. 194:59-69 (1987); 国際公開第02/26993号パンフレット; 国際公開第2005/049808号パンフレット参照)。
【0109】
スレオニンオペロンの上流には、固有のプロモーターが存在するが、非固有(non-native)のプロモーターに置換してもよいし(WO98/04715号パンフレット参照)、スレオニン生合成関与遺伝子の発現がラムダファージのリプレッサーおよびプロモーターにより支配されるようなスレオニンオペロンを構築してもよい(欧州特許第0593792号明細書参照)。また、L−スレオニンによるフィ−ドバック阻害を受けないようにエシェリヒア属細菌を改変するために、α−アミノ−β−ヒドロキシ吉草酸(AHV)に耐性な菌株を選抜することによっても得られる。
【0110】
このようにL−スレオニンによるフィ−ドバック阻害を受けないように改変されたスレオニンオペロンは、宿主内でコピー数が上昇しているか、あるいは強力なプロモーターに連結し、発現量が増大していることが好ましい。コピー数の上昇は、プラスミドによる増幅の他、トランスポゾン、Mu−ファージ等でゲノム上にスレオニンオペロンを転移させることによっても達成出来る。
【0111】
また、アスパルトキナ−ゼIII遺伝子(lysC)は、L−リジンによるフィ−ドバック阻害を受けないように改変した遺伝子を用いることが望ましい。このようなフィ−ドバック阻害を受けないように改変したlysC遺伝子は、米国特許5,932,453号明細書に記載の方法により取得できる。
【0112】
L−スレオニン生合成系酵素以外にも、解糖系、TCA回路、呼吸鎖に関する遺伝子や遺伝子の発現を制御する遺伝子、糖の取り込み遺伝子を強化することも好適である。これらのL−スレオニン生産に効果がある遺伝子としては、トランスヒドロナーゼ遺伝子(pntAB)(欧州特許733712号明細書)、ホスホエノールピルビン酸カルボキシラーゼ遺伝子(pepC)(国際公開95/06114号パンフレット)、ホスホエノールピルビン酸シンターゼ遺伝子(pps)(欧州特許877090号明細書)、コリネ型細菌あるいはバチルス属細菌のピルビン酸カルボキシラーゼ遺伝子(国際公開99/18228号パンフレット、欧州出願公開1092776号明細書)が挙げられる。
【0113】
また、L−スレオニンに耐性を付与する遺伝子、及び/又はL−ホモセリンに耐性を付
与する遺伝子の発現を強化することや、宿主にL−スレオニン耐性、及び/又はL−ホモセリン耐性を付与することも好適である。耐性を付与する遺伝子としては、rhtA遺伝子(Res. Microbiol. 154:123−135 (2003))、rhtB遺伝子(欧州特許出願公開第0994190号明細書)、rhtC遺伝子(欧州特許出願公開第1013765号明細書)、yfiK、yeaS遺伝子(欧州特許出願公開第1016710号明細書)が挙げられる。また宿主にL−スレオニン耐性を付与する方法は、欧州特許出願公開第0994190号明細書や、国際公開第90/04636号パンフレット記載の方法を参照出来る。
【0114】
L−スレオニン生産菌として、エシェリヒア・コリVKPM B-3996株(米国特許第5,175,107号明細書参照)を例示することが出来る。このVKPM B-3996株は、1987年11月19日にロシアン・ナショナル・コレクション・オブ・インダストリアル・マイクロオーガニズム(Russian National Collection of Industrial Microorganisms (VKPM), GNII Genetika)(住所:Russia, 117545 Moscow, 1 Dorozhny proezd. 1)に登録番号VKPM B-3996のもとに寄託されている。また、このVKPM B-3996株は、ストレプトマイシン耐性マーカーを有する広域ベクタープラスミドpAYC32(Chistorerdov, A. Y., and Tsygankov, Y.
D. Plasmid, 16, 161-167 (1986)を参照のこと)にスレオニン生合成系遺伝子(スレオニンオペロン:thrABC)を挿入して得られたプラスミドpVIC40(国際公開第90/04636号パンフレット)を保持している。このpVIC40においては、スレオニンオペロン中のthrAがコードするアスパルトキナーゼI−ホモセリンデヒドロゲナーゼIの、L−スレオニンによるフィードバック阻害が解除されている。
【0115】
また、エシェリヒア・コリVKPM B-5318株(欧州特許第0593792号明細書参照)も好適なL−スレオニン生産菌として例示することができる。VKPM B-5318株は、1990年5月3日にロシアン・ナショナル・コレクション・オブ・インダストリアル・マイクロオーガニズム(Russian National Collection of Industrial Microorganisms (VKPM), GNII Genetika )に登録番号VKPM B-5318のもとに寄託されている。またこのVKPM B-5318株は、イソロイシン非要求性菌株であり、ラムダファージの温度感受性C1リプレッサー、PRプロモーターおよびCroタンパク質のN末端部分の下流に、本来持つ転写調節領域であるアテニュエーター領域を欠失したスレオニンオペロンすなわちスレオニン生合成関与遺伝子が位置し、スレオニン生合成関与遺伝子の発現がラムダファージのリプレッサーおよびプロモーターにより支配されるように構築された組換えプラスミドDNAを保持している。
【0116】
L−グルタミン生産菌
育種によってL−グルタミン生産能を付与するための方法としては、例えば、L−グルタミン生合成に関与する酵素をコードする遺伝子の発現が増強するように改変する方法を挙げることができる。例えば、L−グルタミン酸生合成に関与する酵素としては、グルタミンシンテターゼ、グルタミン酸デヒドロゲナーゼが挙げられる(特開2002-300887)。
【0117】
L−グルタミン生産能を付与するための改変は、L−グルタミンの生合成経路から分岐して他の化合物を生成する反応を触媒する酵素の活性を低下または欠損させることにより行ってもよい。例えば、細胞内のグルタミナーゼ活性を低下させることが考えられる(特開2004-187684)。
【0118】
育種によってL−グルタミン生産能を付与または増強するには、アミノ酸アナログなどへの耐性を付与する方法も挙げられる。6-ジアゾ-5-オキソ-ノルロイシン耐性を付与する方法(特開平3-232497)、プリンアナログ耐性および/またはメチオニンスルホキサイド耐性を付与する方法(特開昭61-202694)、α-ケトマロン酸耐性を付与する方法(特開昭56-151495)、グルタミン酸を含有するペプチドに耐性を付与する方法(特開平2-186994)などが挙げられる。
【0119】
L−グルタミン生産能を有するコリネ型細菌の具体例としては、下記のような菌株が挙げられる。
ブレビバクテリウム・フラバムAJ11573(FERM P-5492特開昭56-151495公報参照)
ブレビバクテリウム・フラバムAJ12210(FERM P-8123;特開昭61-202694公報参照)
ブレビバクテリウム・フラバムAJ12212(FERM P-8123;特開昭61-202694公報参照)
ブレビバクテリウム・フラバムAJ12418(FERM-BP2205;特開平2-186994公報参照)
ブレビバクテリウム・フラバムDH18(FERM P-11116;特開平3-232497公報参照)
コリネバクテリウム・メラセコラDH344(FERM P-11117;特開平3-232497公報参照)
コリネバクテリウム・グルタミカムAJ11574(FERM P-5493;特開昭56-151495公報参照)
【0120】
L−システイン生産菌
L−システイン生産菌の例としては、フィードバック阻害耐性のセリンアセチルトランスフェラーゼをコードする異なるcysEアレルで形質転換されたE. coli JM15(米国特許第6,218,168号、ロシア特許出願第2003121601号)、細胞に毒性の物質を排出するのに適したタンパク質をコードする過剰発現遺伝子を有するE. coli W3110 (米国特許第5,972,663号)、システインデスルフォヒドラーゼ活性が低下したE. coli株 (JP11155571A2)、cysB遺伝子によりコードされる正のシステインレギュロンの転写制御因子の活性が上昇したE. coli W3110 (WO0127307A1)などのエシェリヒア属に属する株が挙げられるが、これらに限定されない。
【0121】
また、本発明に用いるL−アミノ酸生産菌は、固有の生合成系酵素をコードする遺伝子以外に、糖の取り込み、糖代謝(解糖系)、エネルギー代謝に関与する遺伝子が増幅されていてもよい。
【0122】
糖代謝に関与する遺伝子としては、解糖系酵素をコードする遺伝子や糖の取り込み遺伝子が挙げられ、グルコース6−リン酸イソメラーゼ遺伝子(pgi;国際公開第01/02542号パンフレット)、ホスホエノールピルビン酸シンターゼ遺伝子(pps; 欧州出願公開877090号明細書)、ホスホグルコムターゼ遺伝子(pgm;国際公開03/04598号パンフレット)、フルクトース二リン酸アルドラーゼ遺伝子(fbp;国際公開03/04664号パンフレット)、ピルビン酸キナーゼ遺伝子(pykF;国際公開03/008609号パンフレット)、トランスアルドラーゼ遺伝子(talB;国際公開03/008611号パンフレット)、フマラーゼ遺伝子(fum;国際公開01/02545号パンフレット)、ホスホエノールピルビン酸シンターゼ遺伝子(pps;欧州出願公開877090号パンフレット)、non-PTSシュクロース取り込み遺伝子遺伝子(csc;欧州出願公開149911号パンフレット)、シュクロース資化性遺伝子(scrABオペロン;国際公開第90/04636号パンフレット)が挙げられる。
【0123】
エネルギー代謝に関与する遺伝子としては、トランスヒドロゲナーゼ遺伝子(pntAB;米国特許 5,830,716号明細書)、チトクロムbo型オキシダーゼ(cytochrome bo type oxidase)遺伝子(cyoB 欧州特許出願公開1070376号明細書)が挙げられる。
【0124】
次に、微生物に核酸生産能を付与する方法と核酸生産菌について例示する。
核酸生産能を有する細菌微生物は、上記のような細菌微生物に、例えば、プリンヌクレオシド要求性、又はさらにプリンアナログ等の薬剤に対する耐性を付与することにより、取得することが出来る(特公昭38−23099、特公昭54−17033、特公昭55−45199、特公昭57−14160、特公昭57−41915、特公昭59−42895参照)。例えば、栄養要求性及び薬剤耐性を持つバチルス属細菌は、N-メチル-N’-ニトロ-N-ニトロソグアニジン(NTG)、またはEMS(エタンメタンスルフォネート)等の通常の変異処理に用いられている変異剤による処理によって取得することが出来る。
【0125】
プリンヌクレオシドを生産するバチルス属細菌としては、以下のものが挙げられる。
バチルス属に属するイノシン生産株の具体例として、バチルス・ズブチリスKMBS16株を使用することができる。同菌株は、プリンオペロンリプレッサーをコードするpurR遺伝子の欠損(purR::spc)、スクシニル−AMPシンターゼをコードするpurA遺伝子の欠損(purA::erm)、およびプリンヌクレオシドホスホリラーゼをコードするdeoD遺伝子の欠損(deoD::kan)が導入された、既知のバチルス・ズブチリスtrpC2株(168 Marburg)の誘導体である(特開2004-242610、US2004166575A1)。また、バチルス・ズブチリス菌株AJ3772(FERM P-2555)(特開昭62-014794)等を使用することもできる。
【0126】
グアノシン生産能を有するバチルス属細菌としては、IMP脱水素酵素の活性が上昇したバチルス属細菌(特開平3-58787)、プリンアナログ耐性又はデコイニン耐性遺伝子が組み込まれているベクターをアデニン要求性変異株に導入したバチルス属細菌(特公平4-28357)等が挙げられる。
【0127】
またプリンヌクレオチドを生産するバチルス属細菌としては、以下のものが挙げられる。
イノシン酸生産菌としては、バチルス・ズブチリスのフォスファターゼ活性が弱化したイノシン生産株が報告されている(Uchida, K. et al., Agr. Biol. Chem., 1961, 25, 804-805、Fujimoto, M. Uchida, K., Agr. Biol. Chem., 1965, 29, 249-259)。グアニル酸生産菌としては、アデニン要求性を有しさらにデコイニンまたはメチオニンスルフォキシドに耐性を有し、かつ5’−グアニル酸(グアノシン−5’−モノリン酸、以下「GMP」ともいう)生産能を有するバチルス属の変異株が挙げられる(特公昭56−12438号公報)。
【0128】
また、キサンチル酸生産菌は、コリネバクテリウム・アンモニアゲネス(Corynebacterium ammmoniagenes)を中心とするコリネ型細菌の育種に用いたられる方法を使用して構築することができる。例えば、PRPP amidotransferaseを強化株(特開平8-168383)、脂肪族アミノ酸耐性株(特開平4-262790)、デヒドロプロリン耐性株(韓国特許公開公報2003-56490)を取得することによって、キサンチル酸生産菌を構築することができる。
【0129】
また、プリン系物質生産能を有するバチルス属細菌を育種する方法として、以下の方法が挙げられる。プリンヌクレオシド及びプリンヌクレオチドに共通のプリン生合成に関与する酵素、すなわちプリン生合成酵素の細胞内での活性を上昇させる方法が挙げられる。該酵素の細胞内での活性は、バチルス属細菌の非改変株、例えば野生型のバチルス属細菌よりも上昇させることが好ましい。「活性が上昇する」とは、例えば、細胞当たりの酵素分子の数が増加した場合や、酵素分子当たりの比活性が上昇した場合などが該当する。例えば、前記酵素の遺伝子の発現量を上昇させることにより活性を上昇させることができる。前記プリン生合成に関与する酵素としては、たとえばホスホリボシルピロリン酸アミドトランスフェラーゼ、ホスホリボシルピロリン酸シンセターゼ(PRPP synthetase [EC:2.7.6.1])などが挙げられる
【0130】
ペントースリン酸系に取り込まれたグルコースなどの糖源が代謝により生成したカタボライトの一部は、リブロース−5−リン酸を経由して、リボース−5−リン酸となる。生合成されたリボース−5−リン酸より、プリンヌクレオシド、ヒスチジン、およびトリプトファン生合成の不可欠な前駆物質であるホスホリボシルピロリン酸(PRPP)が生成される。具体的には、リボース−5−リン酸は、ホスホリボシルピロリン酸シンセターゼによりPRPPに転換される。したがって、ホスホリボシルピロリン酸シンセターゼの活性が上昇するように改変することにより、バチルス属細菌にプリン系物質生産能を付与又は増強することができる。
【0131】
「ホスホリボシルピロリン酸シンセターゼの活性が上昇する」とは、ホスホリボシルピ
ロリン酸シンセターゼの活性が野生株又は親株等の非改変株に対して増加していることをいう。ホスホリボシルピロリン酸シンセターゼの活性は例えば、Switzer等の方法(Methods Enzymol., 1978, 51, 3-11)、Roth等の方法(Methods Enzymol., 1978, 51, 12-17)により、測定することができる。ホスホリボシルピロリン酸シンセターゼの活性が上昇したバチルス属細菌は、例えば、特開2004-242610号公報に記載の方法と同様にして、プラスミドを用いる方法や染色体上に組込む方法などにより、ホスホリボシルピロリン酸シンセターゼをコードする遺伝子をバチルス属細菌で高発現させることにより作製することができる。
【0132】
一方、プリンヌクレオシド、ヒスチジン、およびトリプトファン生合成に不可欠な前駆物質であるPRPPが生成されると、その一部は、プリン生合成に関与する酵素群によりプリンヌクレオチド、プリンヌクレオシドへと変換される。そのような酵素群をコードする遺伝子としては、バチルス・ズブチリスのプリンオペロン、具体的にはpurEKB-purC(orf)QLF-purMNH(J)-purDオペロンの遺伝子(Ebbole DJ and Zalkin H, J. Biol. Chem., 1987, 262, 17, 8274-87)(現在では、purEKBCSQLFMNHDとも呼ばれる:Bacillus subtilis and
Its Closest Relatives, Editor in Chief: A.L. Sonenshein, ASM Press, Washington D.C., 2002。Genbank Accession No.NC_000964)、およびエシェリヒア・コリのpurレギュロンの遺伝子(Escherichia and Salmonella, Second Edition, Editor in Chief: F.C. Neidhardt, ASM Press, Washington D.C., 1996)が例示される。
【0133】
したがって、これらの遺伝子の発現を増強することにより、プリン系物質生産能を付与又は増強することもできる。なお、本発明に用いることが出来るプリンオペロン遺伝子はこれらのものには限定されず、他の微生物や動植物由来の遺伝子も利用することも出来る。
【0134】
プリンオペロンの発現量を増大させる方法としては、プラスミドを用いる方法や染色体上に組込む方法などにより、プリンオペロン遺伝子をバチルス属細菌で高発現させる方法が挙げられる。
【0135】
プリンオペロンの発現量を増大させる第2の方法として、プリンオペロン固有のプロモーターをより強力なプロモーターに置換することや、固有のプロモーターの-35、-10領域をコンセンサス配列に置換することが挙げられる。
【0136】
例えば、バチルス・ズブチリス(B. subtilis 168 Marburg株; ATCC6051)では、プリンオペロンの-35配列はコンセンサス配列(TTGACA)であるが、-10配列はTAAGATであり、コンセンサス配列TATAATとは異なっている(Ebbole, D. J. and H. Zalikn, J. Biol. Chem., 1987, 262, 8274-8287)。したがって、-10配列(TAAGAT)をコンセンサス配列にすること、あるいはコンセンサス配列に近づけることにより、TATAAT、またはTATGAT、もしくはTAAAATとなるように改変することで、プリンオペロンの転写活性を上昇させることができる。なお、プロモーター配列の置換は、下記の遺伝子置換と同様の方法で行うことが出来る。
【0137】
プリンオペロンの発現量を増大させる第3の方法として、プリンオペロンのリプレッサーの発現量を低下させる方法も挙げられる(USP6,284,495号)。「プリンオペロンのリプレッサーの発現」とは、プリンオペロン遺伝子の転写、及び転写産物の翻訳の両方を含む。また、「発現量を低下させる」とは、発現量が、非改変株、例えば野生型のバチルス属細菌における発現量よりも低いこと、及び、発現が実質的に消失していることを含む。
【0138】
プリンペオペロンのリプレッサー(プリンリプレッサー)の発現量を低下させるためには、例えば、バチルス属細菌を紫外線照射またはNTGもしくはEMS等の通常変異処理
に用いられている変異剤によって処理し、プリンリプレッサーの発現量が低下した変異株を選択する方法を採用することができる。
【0139】
また、プリンリプレッサーの発現量が低下したバチルス属細菌は、変異処理の他に、例えば、遺伝子組換え法を用いた相同組換え法(Experiments in Molecular Genetics, Cold Spring Harbor Laboratory press (1972); Matsuyama, S. and Mizushima, S., J. Bacteriol., 1985, 162, 1196-1202)により、染色体上のプリンリプレッサーをコードする遺伝子(purR;GenBank Accession NC_000964(コード領域は塩基番号54439〜55293)を、正常に機能しない遺伝子(以下、「破壊型遺伝子」ということがある)で置換することによって得ることができる。
【0140】
さらに、プリン系物質の細胞内への取り込みを弱化することによっても、プリン系物質生産能を強化することができる。例えば、プリンヌクレオシドの細胞内へ取り込みは、プリンヌクレオシドの細胞内への取り込みに関与する反応を遮断することによって弱化することができる。上記プリンヌクレオシドの細胞内への取り込みに関与する反応は、たとえばヌクレオシドパーミアーゼに触媒される反応である。
【0141】
さらに、プリンヌクレオシドを製造する場合には、プリンヌクレオシド生産能を増強させるためにプリン系物質を分解する酵素の活性を低下させてもよい。このような酵素として、例えば、プリンヌクレオシドホスホリラーゼが挙げられる。
【0142】
PRPPから、プリン生合成に関与する酵素群により生合成されたプリンヌクレオチドは、脱リン酸化されて、プリンヌクレオシドに変換される。プリンヌクレオシドを効率的に蓄積せしめるためには、プリンヌクレオシドを更に分解してヒポキサンチン等とするプリンヌクレオシドホスホリラーゼの活性を低下させることが好ましい。すなわち、イノシンをはじめとするプリンヌクレオシドを基質とするプリンヌクレオシドホスホリラーゼを弱化、あるいは欠損させるように改変することが望ましい。
【0143】
プリンヌクレオシドホスホリラーゼ活性の低下は、具体的には、バチルス属細菌でプリンヌクレオシドホスホリラーゼをコードするdeoD遺伝子とpupG遺伝子を破壊することによって達成することができる。本発明のバチルス属細菌は、上記のようなdeoD遺伝子とpupG遺伝子を単独、または同時に破壊するように改変されたものであってもよい。deoD遺伝子、pupG遺伝子は、例えばバチルス属由来の遺伝子(deoD;Genbank Accession No. NC_000964(コード領域は2134672-2135370), pupG;Genbank Accession No. NC_000964(コード領域は2445610-2446422)が利用できる。
【0144】
また、プリン系物質生産能を増強させるために、サクシニル−AMPシンターゼの活性を低下させてもよい。サクシニル−AMPシンターゼをコードする遺伝子としては、purA遺伝子が挙げられる。purA遺伝子としては、例えば、GenBank Accession No. NC_000964(コード領域は相補鎖の塩基番号4153460-4155749)で登録されている塩基配列を有するものが挙げられる。
【0145】
さらに、プリン系物質生産能を増強させるために、イノシンモノリン酸(IMP)脱水素酵素の活性を低下させてもよい。IMP脱水素酵素をコードする遺伝子としては、guaB遺伝子が挙げられる。guaB遺伝子としては、例えば、GenBank Accession No.NC_000964(コード領域は15913-17376)で登録されている塩基配列を有するものが挙げられる。
【0146】
また、プリン系物質生産能を増強させる方法として、プリン系物質を排出する活性を有するタンパク質をコードする遺伝子を増幅することが考えられる。このような遺伝子が増幅された細菌としては、例えば、rhtA遺伝子を増幅したバチルス属細菌が挙げられる(特
開2003-219876)。
【0147】
遺伝子組換えによる微生物に育種において使用する遺伝子は、上述した遺伝子情報を持つ遺伝子や、公知の配列を有する遺伝子に限られず、コードされるタンパク質の機能が損なわれない限り、その遺伝子のホモログや人為的な改変体等、保存的変異を有する遺伝子も使用することができる。すなわち、公知のタンパク質のアミノ酸配列において、1若しくは数個の位置での1若しくは数個のアミノ酸の置換、欠失、挿入又は付加等を含む配列を有するタンパク質をコードする遺伝子であっもよい。
【0148】
ここで、「1若しくは数個」とは、アミノ酸残基のタンパク質の立体構造における位置やアミノ酸残基の種類によっても異なるが、具体的には好ましくは1〜20個、より好ましくは1〜10個、さらに好ましくは1〜5個を意味する。また、保存的変異とは、置換部位が芳香族アミノ酸である場合には、Phe、Trp、Tyr間で、置換部位が疎水性アミノ酸である場合には、Leu、Ile、Val間で、極性アミノ酸である場合には、Gln、Asn間で、塩基性アミノ酸である場合には、Lys、Arg、His間で、酸性アミノ酸である場合には、Asp、Glu間で、ヒドロキシル基を持つアミノ酸である場合には、Ser、Thr間でお互いに置換する変異である。保存的変異の代表的なものは、保存的置換であり、保存的置換とみなされる置換としては、具体的には、AlaからSer又はThrへの置換、ArgからGln、His又はLysへの置換、AsnからGlu、Gln、Lys、His又はAspへの置換、AspからAsn、Glu又はGlnへの置換、CysからSer又はAlaへの置換、GlnからAsn、Glu、Lys、His、Asp又はArgへの置換、GluからGly、Asn、Gln、Lys又はAspへの置換、GlyからProへの置換、HisからAsn、Lys、Gln、Arg又はTyrへの置換、IleからLeu、Met、Val又はPheへの置換、LeuからIle、Met、Val又はPheへの置換、LysからAsn、Glu、Gln、His又はArgへの置換、MetからIle、Leu、Val又はPheへの置換、PheからTrp、Tyr、Met、Ile又はLeuへの置換、SerからThr又はAlaへの置換、ThrからSer又はAlaへの置換、TrpからPhe又はTyrへの置換、TyrからHis、Phe又はTrpへの置換、及び、ValからMet、Ile又はLeuへの置換が挙げられる。また、上記のようなアミノ酸の置換、欠失、挿入、付加、または逆位等には、遺伝子が由来する微生物の個体差、種の違いに基づく場合などの天然に生じる変異(mutant又はvariant)によって生じるものも含まれる。このような遺伝子は、例えば、部位特異的変異法によって、コードされるタンパク質の特定の部位のアミノ酸残基が置換、欠失、挿入または付加を含むように公知の遺伝子の塩基配列を改変することによって取得することができる。
【0149】
さらに、上記のような保存的変異を有する遺伝子は、コードされるアミノ酸配列全体に対して、80%以上、好ましくは90%以上、より好ましくは95%以上、特に好ましくは97%以上の相同性を有し、かつ、野生型タンパク質と同等の機能を有するタンパク質をコードする遺伝子であってもよい。
また、遺伝子の配列におけるそれぞれのコドンは、遺伝子が導入される宿主で使用しやすいコドンに置換したものでもよい。
【0150】
保存的変異を有する遺伝子は、変異剤処理等、通常変異処理に用いられる方法によって取得されたものであってもよい。
【0151】
また、遺伝子は、公知の遺伝子配列の相補配列又はその相補配列から調製され得るプローブとストリンジェントな条件下でハイブリダイズし、公知の遺伝子産物と同等の機能を有するタンパク質をコードするDNAであってもよい。ここで、「ストリンジェントな条件」とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。一例を示せば、相同性が高いDNA同士、例えば80%以上、好ましくは90%以上、より好ましくは95%以上、特に好ましくは97%以上の相同性を有するDNA同士がハイブリダイズし、それより相同性が低いDNA同士がハイブリダイズしない条件、あるいは通常のサザンハイブリダイゼーションの洗いの条件である60℃、1×SSC、0.1% SDS、好まし
くは、0.1×SSC、0.1% SDS、さらに好ましくは、68℃、0.1×SSC、0.1% SDSに相当する塩濃度、温度で、1回、より好ましくは2〜3回洗浄する条件が挙げられる。
【0152】
プローブとしては、遺伝子の相補配列の一部を用いることもできる。そのようなプローブは、公知の遺伝子配列に基づいて作製したオリゴヌクレオチドをプライマーとし、これらの塩基配列を含むDNA断片を鋳型とするPCRによって作製することができる。例えば、プローブとして、300 bp程度の長さのDNA断片を用いる場合には、ハイブリダイゼーションの洗いの条件は、50℃、2×SSC、0.1% SDSが挙げられる。
【実施例】
【0153】
以下、実施例を挙げて本発明を具体的に説明する。ただし、本発明は以下の実施例に限定されない。
【0154】
〔実施例1〕L−トリプトファンの製造
L−トリプトファン生産菌として、E. coli No.202(国際公開第2005/103275号パンフレット参照)を用いた。同菌株は、L−トリプトファン生産菌SV164株(国際公開第94/08031号パンフレット)の染色体上に、ホスホグリセレートデヒドロゲナーゼ遺伝子(serA。プラスミドpGH5に由来する。国際公開第94/08031号パンフレット参照)、及び、脱感作型trpE遺伝子(E. coli MTR#2株由来。米国特許第4,371,614号明細書参照)を含むtrpオペロン(プラスミドpGX100由来)を挿入して得られた菌株である。
E. coli No.202のグリセロールストックを、LB-アガロースプレート培地(トリプトン1%、酵母抽出液0.5%、塩化ナトリウム0.5%、アガロース1.5%)に1エーゼ植菌し、30℃で24時間、静地培養した。
【0155】
前述の培養液を500ml坂口フラスコに入れた50mlのLB培地(トリプトン1%、酵母抽出液0.5%、塩化ナトリウム0.5%)に10μl接種し、30℃で8時間、振盪下(114回転/分)で前培養した。
【0156】
前述の前培養液0.9mlを、下記組成を有する300mlの種培地に接種した。全容1Lの小型発酵槽を用いて、30℃で約14時間、攪拌翼の動力密度を4.4 kW/m3で、滅菌フィルターにより滅菌した圧縮空気を1vvm通気しながら培養した。また、培養中温度は30℃に保持し、pHはアンモニアガスで6.5に保持した。
【0157】
〔種培地組成〕
グルコース 10g/L
KH2PO4 1g/L
(NH4)2SO4 2.5g/L
MgSO4・7H2O 0.5g/L
FeSO4・7H2O 10mg/L
MnSO4・4H2O 10mg/L
大豆加水分解物 0.4g/L
L−メチオニン 50mg/L
L−フェニルアラニン 125mg/L
L−チロシン 125mg/L
ビタミンB1 5mg/L
ピリドキシン 30mg/L
【0158】
下記組成を有する300mlの主培養培地を準備し、それぞれに種培養液30mlを接種した。全容1Lの小型発酵槽を用いて、31℃、4.4kW/m3の撹拌下で、滅菌フィルターにより滅菌した圧縮空気を1vvm通気しながら主培養を実施した。また、培養期間中温度は31℃に保持し
、pHはアンモニアガスで6.7に保持した。培養中、700g/Lのグルコース溶液を適宜流加することによって、小型発酵槽内の糖濃度を5〜20g/Lに調節した。また、23時間目に、L−トリプトファンの結晶を10g (33g/L) 添加し、攪拌翼の動力密度を2.4kW/m3、5.5 kW/m3、9.9kW/m3、15.5kW/m3に変えた4条件で培養を行った。
【0159】
〔主培養培地組成〕
グルコース 15g/L
KH2PO4 1g/L
(NH4)2SO4 1g/L
大豆加水分解物 0.75g/L
NaCl 0.5g/L
MgSO4・7H2O 0.3g/L
CaCl2・2H2O 14.7mg/L
FeSO4・7HO 10mg/L
MnSO4・4H2O 7.5mg/L
L−メチオニン 0.3g/L
L−フェニルアラニン 1g/L
ビタミンB1 5mg/L
ピリドキシン 36.5mg/L
NH4Cl 3.13g/L
KOH 1g/L
【0160】
培養46時間後に、培地中のL−トリプトファン濃度を測定し、生産速度を算出した結果を図2に示す。なお、生産速度は、攪拌動力密度15.5kW/m3での生産性を1としたときの相対値で記載した。
【0161】
〔参考例2〕L−グルタミン酸生産菌の構築
エシェリヒア・コリ由来のgltA遺伝子、ppc遺伝子およびgdhA遺伝子を有するプラスミド(RSFCPG(欧州出願公開1233068号明細書)のgltA遺伝子のORF以外の部分を増幅するプライマー1(配列番号1)とプライマー2(配列番号2)を設計した。このプライマーを用いて、RSFCPGを鋳型にPCRを行い、約14.9kbの断片を取得した。一方、プライマー3(配列番号3)とプライマー4(配列番号4)を用い、E. coli W3110株の染色体DNAを鋳型としてPCRを行い、メチルクエン酸シンターゼ遺伝子(prpC)を含む約1.2kbの断片を取得した。両PCR産物をそれぞれBglII、KpnIで処理し、ライゲーション後、E. coli JM109株を形質転換した。出現したコロニーを全て集菌し、混合物としてプラスミドを抽出した。このプラスミド混合物でクエン酸シンターゼ(CS)欠損株であるE. coli ME8330株を形質転換し、50mg/Lウラシル、5mg/Lチアミン-HClを含有するM9最少培地(グルコース5 g、硫酸マグネシウム2mM、リン酸一カリウム3g、塩化ナトリウム0.5g 、塩化アンモニウム1g リン酸2ナトリウム6g を純水1Lに含む培地)に塗布した。出現した株よりプラスミドを抽出し、これをRSFPPGとした。パントエア・アナナティスSC17sucA株にL−グルタミン酸生産プラスミドRSFPPGを導入し、L−グルタミン酸生産菌SC17sucA/RSFPPG(本菌株を「NA1株」と呼ぶ)を構築した。
【0162】
上記SC17sucA株は、低pHでL−グルタミン酸及び炭素源を含む培地で増殖できる株として自然界より単離されたAJ13355株から、粘液質低生産変異株(SC17)を取得し、同株のsucA遺伝子を破壊することによって得られた株である(米国特許第6,596,517号)。SC17sucA株は、プライベートナンバーAJ417が付与され、平成16年2月26日に経済産業省工業技術院生命工学工業技術研究所(現名称、産業技術総合研究所特許生物寄託センター、郵便番号305-8566 茨城県つくば市東1丁目1番地1中央第6)に受託番号FERM BP-08646として寄託されている。
【0163】
〔実施例2〕L−グルタミン酸の生産
グルタミン酸生産菌パントエア・アナナティスNA1のグリセロールストックを、LBGM9-アガロースプレート培地(トリプトン1%、酵母抽出液0.5%、塩化ナトリウム1.05%、グルコース0.5%、硫酸マグネシウム7水和物0.05%、リン酸水素2ナトリウム12水和物1.72%、リン酸2水素カリウム0.3%、塩化アンモニウム0.1%、アガロース2%、テトラサイクリン塩酸塩25 mg/L)に1エーゼ植菌し、34℃で24時間、静地培養する。
【0164】
前述の前培養菌シャーレ1枚分を、下記組成を有する300mlの培地に接種した。全容1Lの小型発酵槽を用いて攪拌翼の動力密度3.3 kW/m3で、滅菌フィルターにより滅菌した圧縮空気を1vvm通気しながら培養する。また、培養中温度は34℃に保持し、pHはアンモニアガスで4.7に保持する。培養20時間目で、700g/Lのスクロース溶液を適宜流加することによって、小型発酵槽内の糖濃度を5〜20g/Lに調節する。また、培養20時間目に、L−グルタミン酸のα晶を20g添加し、攪拌の動力密度を5.5kW/m3、15.5kW/m3、19.9 kW/m3分に変えた条件と、2.4 kW/m3以下に制御した4条件で培養を行う。
【0165】
〔培地組成〕
スクロース 100g/L
MgSO4・7H2O 0.4g/L
(NH4)2SO4 5g/L
KH2PO4 6g/L
Yeast Extract 6g/L
NaCl 1.5g/L
FeSO4・7H2O 20mg/L
MnSO4・4H2O 20mg/L
L−リジン塩酸塩 0.6g/L
DL−メチオニン 0.6g/L
ジアミノピメリン酸 0.6g/L
CaCl2・2H2O 2.64mg/L
ZnSO4・7H2O 0.72mg/L
CuSO4・5H2O 0.64mg/L
CoCl2・6H2O 0.72mg/L
H3BO3 0.4mg/L
Na2MoO4・2H2O 1.2mg/L
テトラサイクリン塩酸塩 25mg/L
【0166】
〔実施例3〕L−フェニルアラニンの生産
L−フェニルアラニン生産菌として、E. coli AJ12741株(特許第3225597号公報、以下、「R/GAL株」と記載することがある。)を用いる。同株は、tyrR、tyrA遺伝子を欠失したエシェリヒア・コリK-12のW3110株に、フィードバック阻害が解除された3−デオキシ−D−アラビノヘプツロン酸−7−リン酸シンターゼをコードするaroG4遺伝子、コリスミン酸ムターゼ−プレフェン酸デヒドラターゼをコードするpheA遺伝子、及びシキミ酸キナーゼをコードするaroL遺伝子を導入した株である。同株は、独立行政法人 産業技術総合研究所 特許生物寄託センター(住所 〒305-5466 日本国茨城県つくば市東1丁目1番地1 中央第6郵便番号305-8566)に、受託番号FERM BP-4796で寄託されている。
【0167】
AJ12741株のグリセロールストックを、LBG-アガロースプレート培地(トリプトン1%、酵母抽出液0.5%、塩化ナトリウム1%、アガロース1.5%)に1エーゼ植菌し、35℃で24時間、静地培養する。
【0168】
前述の前培養菌をシャーレ1枚分、表5に示した組成を有する300mlの培地に種接種した。全容1Lの小型発酵槽を用いて、約16時間、攪拌翼の動力密度3.3 kW/m3、滅菌フィルターにより滅菌した圧縮空気を1vvm通気しながら培養する。また、培養中温度は35℃に保持し、pHはアンモニアガスで6.5に保持する。
【0169】
〔種培地組成〕
グルコース 40g/L
MgSO4 1g/L
(NH4)2SO4 16g/L
KH2PO4 1g/L
Yeast Extract 2g/L
FeSO4・7H2O 10mg/L
MnSO4・4H2O 8mg/L
L−チロシン 1g/L
アンピシリンナトリウム 100mg/L
【0170】
下記組成を有する300mlの主培養培地を準備し、種培養液30mlを接種する。全容1Lの小型発酵槽を用いて、35℃、攪拌翼の動力密度3.3 kW/m3の撹拌下で、滅菌フィルターにより滅菌した圧縮空気を1vvm通気しながら主培養を実施する。また、培養期間中温度は35℃に保持し、pHはアンモニアガスで6.5に保持した。培養中、500g/Lのグルコース溶液を適宜流加することによって、小型発酵槽内の糖濃度を5〜20g/Lに調節する。また、24時間目に、L−フェニルアラニンの結晶を20g添加し、攪拌翼の動力密度を5.5 kW/m3、 15.5 kW/m3、19.9 kW/m3に変えた条件と、2.4 kW/m3以下で制御した4条件で培養を行う。
【0171】
〔主培養培地組成〕
グルコース 40g/L
MgSO4 1g/L
(NH4)2SO4 16g/L
KH2PO4 2g/L
Yeast Extract 8g/L
FeSO4・7H2O 10mg/L
MnSO4・4H2O 8mg/L
L−チロシン 1.4g/L
アンピシリンナトリウム 100mg/L
【0172】
〔実施例4〕イノシン及び/またはグアノシンの生産
イノシン及びグアノシンを生産するバチルス・アミロリケァシエンス(B. amyloliquefaciens)AJ1991株(ATCC No. 19222、VKPM B-8994。米国特許第3,575,809号参照)のグリセロールストックを、LBG-アガロースプレート培地(トリプトン1%、酵母抽出液0.5%、塩化ナトリウム1%、アガロース1.5%)に1エーゼ植菌し、34℃で24時間、静地培養する。
前述の前培養菌を、500ml坂口フラスコに入れた下記組成の培地50mlに1白金耳接種し、34℃で16時間、振盪下(115回転/分)で前培養する。
【0173】
〔種培地組成〕
グルコース 30g/L
NH4Cl 3g/L
KH2PO4 0.5g/L
MgSO4・7H2O 0.4g/L
FeSO4・7H2O 10mg/L
MnSO4・4H2O 10mg/L
大豆加水分解物 1.2g/L
Yeast Extract 0.5g/L
リボ核酸 5g/L
【0174】
下記組成を有する300mlの主培養培地を準備し、種培養液15mlを接種した。全容1Lの小型発酵槽を用いて、34℃、攪拌翼の動力密度3.3kW/m3の撹拌下で、滅菌フィルターにより滅菌した圧縮空気を1vvm通気しながら主培養を実施した。また、培養期間中温度は34℃に保持し、pHはアンモニアガスで6.5に保持した。培養中、500g/Lのグルコース溶液を適宜流加することによって、小型発酵槽内の糖濃度を5〜20g/Lに調節した。また、、24時間目に、グアノシン結晶を0.8g添加し、攪拌翼の動力密度を5.5 kW/m3、 15.5 kW/m3、19.9 kW/m3に変えた条件と、2.4 kW/m3以下で制御した4条件で培養を行う。
【0175】
〔主培養培地組成〕
グルコース 200g/L
NH4Cl 2.5g/L
KH2PO4 1.3g/L
MgSO4・7H2O 1.5g/L
FeSO4・7H2O 10mg/L
MnSO4・4H2O 10mg/L
大豆加水分解物 1.3g/L
リボ核酸 1.24g/L
KCl 15g/L
DL−メチオニン 50mg/L
【図面の簡単な説明】
【0176】
【図1】発酵装置の概要を示す図。発酵槽からの目的物質の採取を示す。
【図2】攪拌翼の攪拌動力とL−トリプトファンの生産速度を示す図。
【特許請求の範囲】
【請求項1】
L−アミノ酸又は核酸の生産能を有する微生物を攪拌翼を備えた発酵槽中の液体培地で培養し、必要に応じて種晶を培地に添加して当該培中にL−アミノ酸または核酸の結晶を生成、蓄積させ、培養物からL−アミノ酸又は核酸の結晶を採取するL−アミノ酸又は核酸の製造法において、攪拌翼の動力密度を結晶析出後又は種晶添加後に2.4kW/m3以下に制御することを特徴とする方法。
【請求項2】
上記結晶析出後又は種晶添加後の攪拌翼の動力密度が0.5kW/m3以上であることを特徴とする請求項1に記載の方法。
【請求項3】
結晶析出前又は種晶添加前の攪拌翼の動力密度が3.0kW/m3以上で制御しながら培養することを特徴とする請求項1に記載の方法。
【請求項4】
前記微生物が腸内細菌科に属する微生物である、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記微生物がコリネ型細菌、又はバチルス属細菌である、請求項1〜3のいずれか一項に記載の方法。
【請求項6】
前記L−アミノ酸が、L−トリプトファン、L−フェニルアラニン、L−チロシン、L−イソロイシン、L−バリン、L−ロイシン、L−グルタミン酸、L−グルタミン、L−スレオニン、L−システイン、L−シスチンまたはその誘導体から選択される1種又は2種以上のL−アミノ酸である請求項1〜5のいずれか一項に記載の方法。
【請求項7】
前記核酸が、イノシン、アデノシン、グアノシン、キサントシン、イノシン酸、アデニル酸、グアニル酸、キサンチル酸またはそれらの誘導体から選択される1種又は2種以上の核酸である請求項1〜6のいずれか一項に記載の方法。
【請求項1】
L−アミノ酸又は核酸の生産能を有する微生物を攪拌翼を備えた発酵槽中の液体培地で培養し、必要に応じて種晶を培地に添加して当該培中にL−アミノ酸または核酸の結晶を生成、蓄積させ、培養物からL−アミノ酸又は核酸の結晶を採取するL−アミノ酸又は核酸の製造法において、攪拌翼の動力密度を結晶析出後又は種晶添加後に2.4kW/m3以下に制御することを特徴とする方法。
【請求項2】
上記結晶析出後又は種晶添加後の攪拌翼の動力密度が0.5kW/m3以上であることを特徴とする請求項1に記載の方法。
【請求項3】
結晶析出前又は種晶添加前の攪拌翼の動力密度が3.0kW/m3以上で制御しながら培養することを特徴とする請求項1に記載の方法。
【請求項4】
前記微生物が腸内細菌科に属する微生物である、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記微生物がコリネ型細菌、又はバチルス属細菌である、請求項1〜3のいずれか一項に記載の方法。
【請求項6】
前記L−アミノ酸が、L−トリプトファン、L−フェニルアラニン、L−チロシン、L−イソロイシン、L−バリン、L−ロイシン、L−グルタミン酸、L−グルタミン、L−スレオニン、L−システイン、L−シスチンまたはその誘導体から選択される1種又は2種以上のL−アミノ酸である請求項1〜5のいずれか一項に記載の方法。
【請求項7】
前記核酸が、イノシン、アデノシン、グアノシン、キサントシン、イノシン酸、アデニル酸、グアニル酸、キサンチル酸またはそれらの誘導体から選択される1種又は2種以上の核酸である請求項1〜6のいずれか一項に記載の方法。
【図1】


【図2】




【図2】


【公開番号】特開2010−110216(P2010−110216A)
【公開日】平成22年5月20日(2010.5.20)
【国際特許分類】
【出願番号】特願2007−39843(P2007−39843)
【出願日】平成19年2月20日(2007.2.20)
【出願人】(000000066)味の素株式会社 (887)
【Fターム(参考)】
【公開日】平成22年5月20日(2010.5.20)
【国際特許分類】
【出願日】平成19年2月20日(2007.2.20)
【出願人】(000000066)味の素株式会社 (887)
【Fターム(参考)】
[ Back to top ]

