dC、mdC及び/又はhmdCを測定する方法
【課題】迅速かつ超高感度にdC、mdC、及び/又はhmdCを測定する方法の提供。
【解決手段】dC、mdC及び/又はhmdCを測定する方法であって、内部標準、及び、100ng以下のDNA断片あるいは細胞100〜1000個から調製されたDNA断片を含むサンプルを、液体クロマトグラフィー−質量分析に供し、液体クロマトグラフィーの移動相は、pH6.0〜8.0の緩衝液に対してlogP値−0.7〜−0.3の有機溶媒を10〜30%(v/v)の範囲内とし、デオキシリボースの開裂に基づいて測定するdC、mdC及び/又はhmdCを測定する方法。
【解決手段】dC、mdC及び/又はhmdCを測定する方法であって、内部標準、及び、100ng以下のDNA断片あるいは細胞100〜1000個から調製されたDNA断片を含むサンプルを、液体クロマトグラフィー−質量分析に供し、液体クロマトグラフィーの移動相は、pH6.0〜8.0の緩衝液に対してlogP値−0.7〜−0.3の有機溶媒を10〜30%(v/v)の範囲内とし、デオキシリボースの開裂に基づいて測定するdC、mdC及び/又はhmdCを測定する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、dC、mdC及び/又はhmdCを測定する方法に関する。更に詳しくは、dC、mdC及びhmdCを一斉測定する方法に関する。
【背景技術】
【0002】
DNAのデオキシシトシンのメチル化やヒドロキシメチル化は、動物の初期発生、インプリンティング、細胞分化、がん化および老化等によって変化し(いわゆるエピジェネティック変化)、遺伝子発現と深い関わりがある。
【0003】
一方で、遺伝子の発現順序や細胞の分化の過程を研究し再生医療に活用しようという試みが、近年一層活発化している。胚性幹細胞(以下、ES細胞とも称する。)や誘導多能性幹細胞(以下、iPS細胞とも称する)分野においては、エピジェネティック変化に着目し、多能性の獲得メカニズムや分化のメカニズムが研究されている。
【0004】
以上のような背景に鑑み、下記特許文献1においては、定量的PCR法を利用してゲノム中の特定の遺伝子のメチル化の程度を決定する方法が開示されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特表2009−508475号公報
【非特許文献】
【0006】
【非特許文献1】Globisch D et al.,PLoS One 5(12),e15367(2010).
【非特許文献2】Ko M et al.,Nature 468,839−843(2010).
【発明の開示】
【発明が解決しようとする課題】
【0007】
本願明細書において、デオキシシトシンはdCとも称する。5−メチルデオキシシトシンはmdCとも称する。5−ヒドロキシメチルデオキシシトシンはhmdCとも称する。
ゲノムDNA中のdCのメチル化やヒドロキシメチル化の程度は、動物の初期発生、インプリンティング、細胞分化、がん化および老化等によって変化し、遺伝子発現と深い関わりがある。dCのメチル化/ヒドロキシメチル化は遺伝子配列が関与しない遺伝情報の発現制御模様を示すと考えられる。従って、dC、mdC、及びhmdCを迅速かつ超高感度に測定する方法の開発が望まれている。更には、その測定結果を利用して、dCのメチル化、ヒドロキシメチル化の割合を知ることが重要であると考えられる。
【0008】
感度良く、そして短い時間での分析が可能になれば、生命現象・病態のより深い理解、新規薬物の探索が可能となる。また、量が少ない極めて貴重なサンプル(例えば、卵子・受精卵等の初期胚発生段階のサンプル、ES細胞および病理生検)の研究においては超高感度の分析が要求される。
【0009】
上記特許文献1においては、特定の遺伝子のメチル化の程度を知る方法の開示があるが、ゲノム全体におけるDNAのメチル化の把握が困難であったばかりでなく、ヒドロキシメチル化を測定できないという問題があった。その上、PCR法を利用するがゆえに解析には時間がかかってしまうという問題があった。
【0010】
非特許文献1に記載の分析方法は溶媒濃度の変化を利用するため1サンプルの分析に95分も要し、産業応用を考えると極めて非効率的であった。また、1回の分析時間が非常に長いので、破壊分析を積極的に利用する契機の提供がないばかりでなく、産業応用の面で上記PCR法に対して有利な側面が提供されていなかった。
【0011】
本願発明者らは鋭意研究し、受精卵及びサル/マウス胚性幹細胞及びその分化段階における量的なエピジェネティック変化について解析した結果、迅速かつ超高感度にdC、mdC、及び/又はhmdCを測定する方法を確立するに至った。更には、dC、mdC、及びhmdCを一斉測定する方法を確立するに至った。
【0012】
よって、迅速かつ超高感度にdC、mdC、及び/又はhmdCを測定する方法を提供することを、本発明が解決すべき課題とする。更に、dC、mdC、及びhmdCを一斉測定する方法を提供することを本発明が解決すべき課題とする。
【課題を解決するための手段】
【0013】
(第1発明)
上記課題を解決するための本願第1発明の構成は、
dC、mdC及び/又はhmdCを測定する方法であって、
内部標準、及び、100ng以下のDNA断片あるいは細胞100〜1000個から調製されたDNA断片を含むサンプルを、
液体クロマトグラフィー−質量分析に供し、
液体クロマトグラフィーの移動相は、pH6.0〜8.0の緩衝液に対してlogP値−0.7〜−0.3の有機溶媒を10〜30%(v/v)の範囲内とし、
デオキシリボースの開裂に基づいて測定することを特徴とするdC、mdC及び/又はhmdCを測定する方法である。
【0014】
本願第1発明はdC、mdC及び/又はhmdCを測定する方法であるので、DNA断片の量が0となることはない。1回の測定に供されるDNA断片の量の下限は本来的には限定されるものではないが、現実の測定においては、使用する分析機器の定量限界の影響を受けうる。
【0015】
(第2発明)
上記課題を解決するための本願第2発明の構成は、
前記dC、mdC及び/又はhmdCを測定する方法であって、
液体クロマトグラフィーの移動相の溶媒濃度を一定にする第1発明に記載のdC、mdC及び/又はhmdCを測定する方法である。
【発明の効果】
【0016】
本発明により、破壊分析の利点を生かし、迅速かつ超高感度にdC、mdC、及び/又はhmdCを測定する方法が提供される。好ましくは、迅速かつ超高感度にdC、mdC、及びhmdCを一斉測定する方法が提供される。従来の測定方法に比べて測定時間の著しい短縮に成功し、かつ、量が少ない極めて貴重なサンプルの有効な解析が可能となった。
【0017】
特に、溶媒濃度を一定にして測定を行う場合、第1に、より好ましいdC、mdC、hmdCの分離状態を実現できる。第2に、各回の分析前のカラム平衡化を省略することができ、単位時間当たりより多くのサンプルを解析可能である。
【0018】
本発明の測定は定量的に行うことができるので、DNA断片の由来の解析に役立つ。例えば、特定のDNAをプローブなどにより吊り上げてDNA断片を調製した場合、当該特定のDNAについてのdC、mdC及び/又はhmdCの測定が可能である。エピジェネティック変化をより広い視点から解析できる。また、例えば、細胞のゲノムDNAからDNA断片を調製すれば、特定の遺伝子についてのエピジェネティック変化を捉えるのではなく、細胞のゲノムDNA全体のdCのメチル化やヒドロキシメチル化の程度を知ることができる。
【0019】
特定の遺伝子のエピジェネティック変化のみならず、例えばゲノムDNA全体のdCのメチル化やヒドロキシメチル化の程度を知ることは、ES/iPS細胞のクオリティーコントロール、がんの悪性度・進行度合いの評価、神経変性疾患およびその他の老化関連疾患のリスク評価において重要であると推測される。実際、臨床調査において白血病患者から採取した白血球ゲノムDNAの多くでdCのメチル化/ヒドロキシメチル化に異常が見られることが報告されている(非特許文献2)。
【0020】
また、タンパク質の機能解析において、そのタンパク質を大量に合成する必要がある場合、宿主としてはハエ由来細胞などのDNAメチル化が起こらない、あるいは起こりにくい細胞系を用いることがある。これらは研究者の経験によるところが大きいが、本測定法を用いれば、プラスミドDNAのメチル化レベルを測定することにより、最適な宿主、あるいは最適なプラスミドベクターを定量的に選定することができる。
【図面の簡単な説明】
【0021】
【図1】マウスES細胞100個又は1000個からゲノムDNA抽出をした場合でも、mdCが定量可能であることを示す図である。
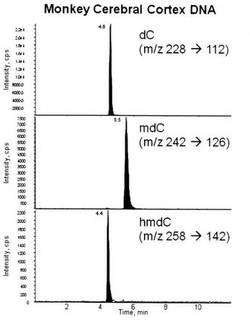
【図2】本実施例(サル大脳皮質)に係る測定での、dC、mdC、及びhmdCの保持時間を示す図である。
【図3】本実施例に係る、サルの各組織のゲノムDNA中のdCのメチル化の程度を示す。
【図4】本実施例に係る、サルの各組織のゲノムDNA中のdCのヒドロキシメチル化の程度を示す。
【図5】本実施例に係る、マウスの各組織のゲノムDNA中のdCのメチル化の程度を示す。
【図6】本実施例に係る、マウスの各組織のゲノムDNA中のdCのヒドロキシメチル化の程度を示す。
【図7】移動相の体積比条件を変化させた場合のdCピーク、mdCピーク、hmdCピークの分離状態を示す。
【発明を実施するための形態】
【0022】
以下に、本発明を実施するための形態を、最良の形態を含めて説明する。
【0023】
〔DNA抽出・断片化〕
本発明は迅速かつ超高感度にdC、mdC、及び/又はhmdCを測定可能であり、dCのメチル化/ヒドロキシメチル化の割合を解析するのに適している。また、デオキシリボースの開裂を捉えてdC、mdC、hmdCを測定するため、抽出したDNAをデオキシアデニン(以下、dAとも称する。)、デオキシグアニン(以下、dGとも称する。)、デオキシシトシン、チミン(以下、Tとも称する。)等の1残基単位に断片化することが好ましい。
【0024】
よって、本発明のDNA断片とは、例えばdC、mdC、hmdC等、1残基単位に調製されたDNA残基をいう。DNA断片を含むサンプルには、夾雑物が含まれていても構わない。
【0025】
DNAの断片化の方法は特に限定されない。トータルdCに対するメチル化、ヒドロキシメチル化の割合を維持できるDNAの断片化の方法が好ましく、後述の実施例におけるような酵素法を好ましく例示できる。
【0026】
本発明に用いるDNA断片の由来は特に限定されず、動物、植物、微生物等に由来するDNA断片を限定なく用いることができる。例えば、生殖・内分泌に関与する細胞(乳腺細胞、卵原細胞、子宮上皮細胞、セルトリ細胞等)、皮膚に関与する細胞(上皮細胞、線維芽細胞、血管内皮細胞及び平滑筋細胞等)、血管に関与する細胞(血管内皮細胞、平滑筋細胞及び線維芽細胞等)、筋肉に関与する細胞(筋肉細胞等)、脂肪に関与する細胞(脂肪細胞等)、神経に関与する細胞(脳や脊髄などの中枢神経系や末梢神経系の神経細胞等)、肝臓に関与する細胞(肝細胞等)、膵臓に関与する細胞(膵ラ島細胞等)、腎臓に関与する細胞(腎上皮細胞、近位尿細管上皮細胞及びメサンギウム細胞等)、肺・気管支に関与する細胞(上皮細胞、線維芽細胞、血管内皮細胞及び平滑筋細胞等)、目に関与する細胞(視細胞、角膜上皮細胞及び角膜内皮細胞等)、前立腺に関与する細胞(上皮細胞、間質細胞及び平滑筋細胞等)、骨に関与する細胞(骨芽細胞、骨細胞及び破骨細胞等)、軟骨に関与する細胞(軟骨芽細胞及び軟骨細胞等)、歯に関与する細胞(歯根膜細胞及び骨芽細胞等)、血液に関与する細胞(白血球及び赤血球等)、及び幹細胞{例えば、骨髄未分化間葉系幹細胞、骨格筋幹細胞、造血系幹細胞、神経幹細胞、肝幹細胞(oval cell、small hepatocyte等)、脂肪組織幹細胞、胚性幹(ES)細胞、誘導多能性幹(iPS)細胞、表皮幹細胞、腸管幹細胞、精子幹細胞、胚生殖幹(EG)細胞、膵臓幹細胞(膵管上皮幹細胞等)、白血球系幹細胞、リンパ球系幹細胞、角膜系幹細胞、前駆細胞(脂肪前駆細胞、血管内皮前駆細胞、軟骨前駆細胞、リンパ球系前駆細胞、NK前駆細胞等)等}等が挙げられる。また、昆虫細胞として、カイコ細胞(BmN細胞及びBoMo細胞等)、クワコ細胞、サクサン細胞、シンジュサン細胞、ヨトウガ細胞(Sf9細胞及びSf21細胞等)、クワゴマダラヒトリ細胞、ハマキムシ細胞、ショウジョウバエ細胞、センチニクバエ細胞、ヒトスジシマカ細胞、アゲハチョウ細胞、ワモンゴキブリ細胞及びイラクサキンウワバ細胞(Tn−5細胞、HIGH
FIVE細胞及びMG1細胞等)等が挙げられる。また、植物は、細胞やカルスなどのほか、表皮組織、柔組織、師管・師部繊維等の師部組織、道管・仮道管・木部繊維等の木部組織、茎、塊茎、葉、根、塊根、穂木、蕾、花、花弁、雌ずい、雄ずい、葯、花粉、子房、果実、さや、さく果、種子、繊維、胚珠等が挙げられる。その他、上述した組織パラフィン切片に由来するDNA断片を用いることも可能である。また、酵母、線虫およびハエのようなDNAのメチル化が起こらない、あるいは起こりにくいと考えられている生物についても分析対象となり得る。
【0027】
抽出操作を適宜工夫することにより、特定の遺伝子をコードするDNA、ゲノムDNA、ミトコンドリアDNA、プラスミドDNA等から調製したDNA断片を測定対象とすることができる。測定対象としては、ゲノムDNA、特定の遺伝子をコードするDNAから調製したDNA断片が好ましく、ゲノムDNAから調製したDNA断片が特に好ましい。
【0028】
DNAの抽出方法は特に限定されず、一般に用いられている手法を採用することができる。例えば、フェノール−クロロホルム法やスピンカラム法、アルカリ法等を採用することができる。特定遺伝子のプロモーター領域を組み込んだプラスミドDNAを用いれば、遺伝子導入した細胞内での特定プロモーター領域のメチル化動態を定量するモデル実験系を構築することができる。DNA抽出の対象の量が微量である場合、市販されている微量サンプルDNA抽出用キットを用いることができる。
【0029】
抽出、必要により断片化の工程を経て調製されたDNA断片を含むサンプルは、すぐに液体クロマトグラフィー−質量分析に供しても良いし、サンプルを安定に保存できる条件で保存してもよい。即ち、所定期間サンプルを保存した後に液体クロマトグラフィー−質量分析を行っても良い。好ましいサンプルの保存方法としては、乾燥状態あるいは溶液状態での−80℃凍結保存等が挙げられる。
【0030】
DNA断片を含むサンプルの形状は特に限定されないが、液体クロマトグラフィーに供する際は溶液状態であることが好ましい。
【0031】
〔液体クロマトグラフィー−質量分析〕
本発明において1回の測定に供されるDNA断片の量は、100ng以下、好ましくは10ng以下、より好ましくは2ng以下、あるいは、細胞100〜1000個から調製されたDNA断片全量、好ましくは、細胞100〜200個から調製されたDNA断片全量である。
【0032】
本発明において、1回の測定に供されるDNA断片の量の下限は本来的には限定されるものではないが、現実の測定においては、使用する分析機器の定量限界の影響を受けうる。仮に下限値を例示するならば、1回の測定に供されるDNA断片の量は、0.1〜100ngであり、好ましくは0.1〜10ngであり、より好ましくは0.1〜2ng、あるいは、細胞100〜1000個から調製されたDNA断片全量、好ましくは、細胞100〜200個から調製されたDNA断片全量である。
【0033】
本発明において内部標準とは、dC、mdC、又はhmdCの同定や定量に用いるものをいう。測定するdC、mdC、及び/又はhmdCの安定同位体を内部標準として使用することが好ましい。安定同位体として、13C、2H、15Nなどの原子を1以上含むdC、mdC、又はhmdCが例示される。これらの安定同位体は、質量分析の検出質量が変化する。内部標準を添加する工程は特に限定されないが、DNAの断片化後に添加することが好ましい。
【0034】
液体クロマトグラフィー−質量分析の装置構成は、液体クロマトグラフィーを行った後、質量分析を行うのであれば特に限定されない。例えば、液体クロマトグラフィー機器と質量分析機器とを結合したLC−MS、LC−MS/MSによる分析の他、液体クロマトグラフィーによりサンプルを分画した後、特定の画分を質量分析に供する分析も含まれる。好ましくは液体クロマトグラフィー機器と質量分析機器を結合した分析であり、より好ましくはLC−MS/MSによる分析である。
【0035】
質量分析でのイオン化法は特に限定されず、ESI―MS、CI―MS、MALDI−TOF−MS、APCI−MS等が含まれる。好ましくは、ESI−MSである。これらの質量分析は、MS/MSとすることが好ましい。イオン化を伴う質量分析において、当該イオン化は、LC−MSやLC−MS/MSにおけるインターフェイスに組み込むことができる。
【0036】
本発明においては、dC、mdC及び/又はhmdCを測定するにあたって、デオキシリボース部位の開裂を捉える。DNAに含まれる、DNA断片たるdA、dG、dC(mdC、hmdC)、T等の各残基は、デオキシリボースを包含する。例えばESI−MSもしくはESI−MS/MSのポジティブイオン化モードで測定した場合、デオキシリボース部位に相当する−116の開裂を捉えることができる。例え夾雑物がdC、mdC、hmdCと同じ保持時間で液体クロマトグラフィー機器から溶出しても、デオキシリボース部位の開裂を捉えることで、DNA断片であると同定することができる。ただし、夾雑物がDNA断片のイオン化を阻害する場合等、測定に悪影響を与える場合もありえるので、液体クロマトグラフィーの移動相は後述の組成を採用することが好ましい。
【0037】
測定に際し、dC、mdC、hmdCの内部標準等により予め検量線を作成しておけば、一度の分析でdC、mdC、hmdCの各含有量が一斉測定できる。
【0038】
質量分析は破壊分析であり、高感度を実現することができ、微量サンプルの解析に適している。また、デオキシリボースというDNA残基に特徴的な部位の開裂を捉えるので、短時間かつ簡便に標的物質の同定・定量が可能となる。上記特許文献1に記載のPCR法は、目的遺伝子を単離した後、更に目的遺伝子を増幅して定量するため、一回の測定に長時間を要するが、本発明は、DNA断片を含むサンプルを調製するだけでよく、その上一回の測定が短時間ですむ。
【0039】
液体クロマトグラフィーとは、HPLC又はUPLCを指す。
【0040】
液体クロマトグラフィーを実施するのは、質量分析に供するためにサンプルを分画することが主目的である。よって、必ずしもdC、mdC、hmdCを単離する必要はない。サンプルを質量分析に供し、dC、mdC、及び/又はhmdCが定量可能な程度に分画されることが好ましい。より少ないDNA断片量でdC、mdC、及び/又はhmdCの定量ができるように分画することが、より好ましい。
【0041】
dC、mdC、及び/又はhmdCの測定には、質量分析を利用する。DNA断片を含むサンプルに夾雑物が含まれる場合、当該夾雑物の存在により質量分析が妨げられる(例えば、測定の再現性が失われる、定量限界が引き上げられる等)場合があるが、特定m/zの選択的イオンモニタリングでは夾雑物が検出できない場合が多い。液体クロマトグラフィーにはUV−VIS検出器、蛍光検出器等の検出器を組み込むことが可能であるので、これらの検出器を利用してカラムから溶出されるdC、mdC及び/又はhmdCと夾雑物とを、dC、mdC及び/又はhmdCの定量を妨げない程度に分離できたか確認できる。
【0042】
移動相はpH6.0〜8.0の緩衝液とlogP値−0.7〜−0.3の有機溶媒を組み合わせることが好ましい。
【0043】
移動相の混合比は、上記緩衝液に対して上記有機溶媒10〜30%(v/v)、好ましくは15〜25%(v/v)、より好ましくは20%(v/v)である。
【0044】
本発明において「pH6.0〜8.0の緩衝液に対してlogP値−0.7〜−0.3の有機溶媒を10〜30%(v/v)の範囲内」とするとは、移動相全量中、pH6.0〜8.0の緩衝液は90〜70%(v/v)とすることができ、対応してlogP値−0.7〜−0.3の有機溶媒は10〜30%(v/v)とすることができることを意味する。この溶媒組成であれば、カラムから溶出されるdC、mdC及び/又はhmdCと夾雑物とを、dC、mdC及び/又はhmdCの測定、好ましくは定量を妨げない程度に分離することができる。特に、後述する好ましい担体を利用すると、分離効果は一層顕著になる。
【0045】
本発明においては、dC、mdC及び/又はhmdCの測定中に、上記範囲内でグラジエントをかけても良いし、溶媒濃度を一定として測定を行っても良いし、これらを組み合わせても良い。好ましくは、上記混合比の範囲内の特定の値で溶媒濃度を一定とする。
【0046】
ここで言う「溶媒濃度を一定とする」とは、測定前のカラムの平衡化を省略できる程度までグラジエント範囲を狭くすることを含む概念である。このように移動相の条件を設定した結果、例え1つのサンプルしか測定しなくても、好ましいdC、mdC、hmdCの分離状態を実現できる。更に、2以上のDNA断片を含むサンプルを連続分析でき、単位時間当たりの分析数を増やすことができる。
【0047】
上記溶媒濃度を一定とする手段は特に限定されず、混合後の溶媒を用いて液体クロマトグラフィーを行っても良いし、混合前の複数の溶媒を用い、液体クロマトグラフィー機器に混合させても良い。当然に、dC、mdC及び/又はhmdCを測定していないときは、溶媒、溶媒組成ともに上記記載に限定されない。
【0048】
上記緩衝液を調製するための緩衝剤は特に限定されないが、例えば、ギ酸アンモニウム、酢酸アンモニウムを用いることができ、これらを組み合わせて用いることもできる。好ましくはギ酸アンモニウムである。
【0049】
上記有機溶媒としては、例えば、メタノール、アセトニトリル、があり、これらを組み合わせて用いることもできる。好ましくはメタノールである。
【0050】
好ましい移動相の組み合わせとして、メタノール/10mMギ酸アンモニウム水溶液を例示することができる。
【0051】
液体クロマトグラフィーの担体(HPLC等カラムを用いる場合はカラム充填物)は特に限定されないが、疎水性のものを用いることが好ましい。例えば、ODSを含む炭素数8〜30の炭化水素−Si結合物、フェニル−Si結合物等が好ましく、カルバモイル−Si結合物、アミノアルキル―Si結合物等も使用可能である。好ましくは、ODSである。
【0052】
液体クロマトグラフィーに用いるカラムの担体充填部位の断面積は限定されないが好ましくは0.8〜47.8mm2であり、より好ましくは16.0〜17.0mm2である。カラムの担体充填部位の長さは特に限定されないが、好ましくは500〜2500mmであり、より好ましくは700〜800mmである。カラムを決定するに際しては、分析機器の特性を考慮して、適宜好ましい担体、断面積と長さを組み合わせることができる。
【0053】
液体クロマトグラフィーにおける流量は特に限定されないが、0.2〜1.0mL/minが好ましく、より好ましくは0.25〜0.35mL/minである。
【0054】
液体クロマトグラフィー−質量分析に供したサンプルのトータルdCに対するメチル化、ヒドロキシメチル化の割合は、例えば下記「数1」に示す式で求めることができる。式中、dC等の単位は質量、mol、残基数など適宜選択すればよい。
【0055】
【数1】

ほかに、dGはdCと相補的な塩基であることを利用し、dG量に対するmdC、hmdC量を求めることで、dCのメチル化、ヒドロキシメチル化の程度を求めることもできる。これらのように、サンプルのトータルdCに対するメチル化、ヒドロキシメチル化の割合は、分析者が適当な計算式を用いて求めることができる。
【実施例】
【0056】
以下、本発明の実施例を説明する。本発明の技術的範囲は以下の実施例に限定されない。
【0057】
−実施例1−
〔DNA抽出〕
(i)比較的多い量の抽出対象を抽出に使用できる場合
サルの大脳皮質、小脳、子宮、心臓、筋肉、腎臓、卵巣、肝臓、肺、及び小腸、マウスの大脳皮質、筋肉、心臓、膀胱、腎臓、肝臓、肺、胃、副腎、すい臓、大腸、小腸、及び精巣をDNA抽出対象として準備した。
【0058】
以上の各DNA抽出対象について、サル大脳皮質1連、サル小脳1連、サル子宮3連、サル心臓3連、サル筋肉3連、サル腎臓3連、サル卵巣4連、サル肝臓3連、サル肺3連、サル小腸3連、マウス大脳皮質4連、マウス筋肉4連、マウス心臓4連、マウス膀胱4連、マウス腎臓4連、マウス肝臓4連、マウス肺4連、マウス胃4連、マウス副腎4連、マウスすい臓4連、マウス大腸4連、マウス小腸4連、マウス精巣4連、それぞれ測定を行った。以下においては、各組織の測定結果などは平均値を記載する。
【0059】
準備した上述の各DNA抽出対象からスピンカラム法によってゲノムDNAを抽出した。ゲノムDNAの抽出量の測定のため、DNA濃度の測定には分光光度計を使用し、260nmにおける吸光度を測定することにより定量した(A2601.0=50ng/μL)。
【0060】
調製したゲノムDNAから1〜2ngを新しいマイクロチューブに分注したものを遠心濃縮した後、以下の「DNA断片化」工程に使用した。
【0061】
(ii)抽出対象量が制限される場合(細胞100個、又は1000個)
MACHEREY−NAGEL社製NucleoSpin(登録商標)TissueXSを用いて、マウスES細胞(ES−D3株、米国ATCCより購入)100個又は1000個を1連として各2連、DNA抽出をスピンカラム法により行った。抽出したゲノムDNAの全量を以下の「DNA断片化」工程に使用した。以下においては、各細胞数における測定結果などは平均値を記載する。
【0062】
〔DNA断片化〕
上記「DNA抽出」工程で用意したゲノムDNAを、マイクロチューブを用いて、2−メルカプトエタノール(10mM)および硫酸亜鉛(1mM)を含む酢酸ナトリウム緩衝液(30mM、pH5.3)100μL中で和光純薬工業社製のヌクレアーゼP1(4U)およびアルカリフォスファターゼ(3U)存在下、37℃、3時間インキュベートした。
【0063】
その後、トリス−塩酸緩衝液(0.5M、pH8.5)を20μL加えて、さらに3時間インキュベートした。
【0064】
その後、反応液に対して5倍量のエタノールを加えて十分混和することにより、酵素反応を停止した。
【0065】
続いて、酵素反応を停止した混液を10,000×g、室温で5分間遠心分離し、上清を新しいマイクロチューブに分注した。
【0066】
分注した上清を遠心濃縮により完全にドライアップ後、内部標準(15N3−dCおよびmdC−d3)を含む蒸留水(100μL)に再溶解したものをLC−MS/MSサンプル溶液とした。
【0067】
〔LC−MS/MS分析〕
定量解析にはトリプル四重極LC−MS/MSシステム(API4000、AB Sciex社製)を使用した。また、測定条件は以下の通りである。
サンプル注入量:60μL
カラム:TOSOH社製TSKgel ODS−100V 3μm(ODSカラム)
カラムサイズ:4.6mmφ×750mm
移動相1:メタノール
移動相2:10mMギ酸アンモニウム(pH6.6)
移動相の体積比:移動相1:移動相2(20:80)固定
流量:0.3mL/min
インターフェイス(イオン化):ESI
MS測定モード:ポジティブイオンモード
総分析時間:7.0分
LC−MS/MSの定量限界は、dC5.4pg(相関係数r=0.9998)、mdC57.8fg(r=0.9996)、hmdC15.4fg(r=0.9997)であった。即ち、超高感度の測定を実現した。
【0068】
図2(MSクロマトグラム)に示すとおり、dCは保持時間約4.6分、mdCは保持時間約5.5分、hmdCは保持時間約4.4分に検出された。検出・定量は、内部標準を利用して行った。その際、デオキシリボースの開裂を示す分子量−116を捉えた。
【0069】
dCのメチル化の程度は「Methyl(%)=mdC質量×100/(mdC質量+dC質量+hmdC質量)」によって計算した。
【0070】
メチル化の計算結果は、サル大脳皮質4.62%、サル小脳4.72%、サル子宮3.92%、サル心臓3.80%、サル筋肉3.76%、サル腎臓3.96%、サル卵巣3.77%、サル肝臓3.79%、サル肺4.06%、サル小腸3.94%(以上の結果の棒グラフを図3に示す。)、マウス大脳皮質3.78%、マウス筋肉3.10%、マウス心臓3.08%、マウス膀胱3.04%、マウス腎臓3.28%、マウス肝臓3.25%、マウス肺3.18%、マウス胃3.07%、マウス副腎3.87%、マウスすい臓2.86%、マウス大腸3.27%、マウス小腸3.58%、マウス精巣3.23%(以上の結果の棒グラフを図5に示す。)、マウスES細胞2.91%であった。
【0071】
dCのヒドロキシメチル化の程度は「Hydroxymethyl(%)=hmdC質量×100/(mdC質量+dC質量+hmdC質量)」によって計算した。
【0072】
ヒドロキシメチル化の計算結果は、サル大脳皮質1.17%、サル小脳0.95%、サル子宮0.31%、サル心臓0.26%、サル筋肉0.23%、サル腎臓0.21%、サル卵巣0.17%、サル肝臓0.17%、サル肺0.10%、サル小腸0.08%(以上の結果の棒グラフを図4に示す。)、マウス大脳皮質0.61%、マウス筋肉0.17%、マウス心臓0.16%、マウス膀胱0.16%、マウス腎臓0.15%、マウス肝臓0.13%、マウス肺0.13%、マウス胃0.10%、マウス副腎0.09%、マウスすい臓0.07%、マウス大腸0.06%、マウス小腸0.05%、マウス精巣0.05%(以上の結果の棒グラフを図6に示す。)、マウスES細胞0.25%であった。
【0073】
本実施例においては、1つのサンプルについてdC、mdC、及びhmdCの一斉解析に成功した。更に、測定1回あたりの時間は7.0分であり、短時間かつ超高感度の測定を実現した。短時間で分析ができるので、単位時間当たりの測定サンプル数を大幅に増やすことが可能である。
【0074】
−実施例2−
LC−MS/MS分析における、溶媒濃度とdC、mdC及びhmdC各ピークの分離について検討した。
【0075】
測定にはdC、mdC及びhmdC標品の混合液を用いた。LC−MS/MS分析は、「移動相の体積比」以外は実施例1と同様とした。移動相の体積比を以下の(A)〜(F)として分析を行った。
(A)移動相1:移動相2(0:100)固定
(B)移動相1:移動相2(10:90)固定
(C)移動相1:移動相2(20:80)固定
(D)移動相1:移動相2(30:70)固定
(E)移動相1:移動相2(40:60)固定
(F)移動相1:移動相2(50:50)固定
測定結果を図7に示す。図7においては、実線のピークがhmdCピークであり、破線のピークがdCピークであり、一点鎖線のピークがmdCピークである。ピークの検出順序は図2を参照できる。
【0076】
体積比(B)〜体積比(D)において、各ピークが良好に分離され、かつ、1回の分析時間を短時間とすることができた。
【0077】
体積比(A)では1回の分析に時間がかかりすぎてしまう。また、ピークの分離も良くない。体積比(E)及び体積比(F)では各ピークの分離が十分でなかった。
【0078】
−実施例3−
DNA断片を含むサンプルの連続分析について検討を行った。
【0079】
実施例1のLC−MS/MS分析において、UV−VIS検出器では保持時間10分までdC、mdC、及びhmdCの定量を妨げる夾雑物が検出された。
【0080】
サンプルの連続分析では、夾雑物をdC、mdC、及び/又はhmdCの定量を妨げないように溶出させる必要があるため、1サイクルの分析時間は確実を期して12分とした。
【0081】
本実施例のLC−MS/MS分析は移動相の体積比を固定しているので、毎回の分析前のカラム平衡化を省略できる。
【0082】
よって、実施例1のLC−MS/MS分析と同じ条件で、12分を1サイクルとして、DNA断片を含むサンプルの連続分析を行うことができた。連続分析の各回で、dC、mdC、及びhmdCの一斉解析に成功した。
【産業上の利用可能性】
【0083】
本発明により、迅速かつ超高感度にdC、mdC、及び/又はhmdCを測定する方法が提供される。更に、dC、mdC、及びhmdCを一斉測定する方法が提供される。
【技術分野】
【0001】
本発明は、dC、mdC及び/又はhmdCを測定する方法に関する。更に詳しくは、dC、mdC及びhmdCを一斉測定する方法に関する。
【背景技術】
【0002】
DNAのデオキシシトシンのメチル化やヒドロキシメチル化は、動物の初期発生、インプリンティング、細胞分化、がん化および老化等によって変化し(いわゆるエピジェネティック変化)、遺伝子発現と深い関わりがある。
【0003】
一方で、遺伝子の発現順序や細胞の分化の過程を研究し再生医療に活用しようという試みが、近年一層活発化している。胚性幹細胞(以下、ES細胞とも称する。)や誘導多能性幹細胞(以下、iPS細胞とも称する)分野においては、エピジェネティック変化に着目し、多能性の獲得メカニズムや分化のメカニズムが研究されている。
【0004】
以上のような背景に鑑み、下記特許文献1においては、定量的PCR法を利用してゲノム中の特定の遺伝子のメチル化の程度を決定する方法が開示されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特表2009−508475号公報
【非特許文献】
【0006】
【非特許文献1】Globisch D et al.,PLoS One 5(12),e15367(2010).
【非特許文献2】Ko M et al.,Nature 468,839−843(2010).
【発明の開示】
【発明が解決しようとする課題】
【0007】
本願明細書において、デオキシシトシンはdCとも称する。5−メチルデオキシシトシンはmdCとも称する。5−ヒドロキシメチルデオキシシトシンはhmdCとも称する。
ゲノムDNA中のdCのメチル化やヒドロキシメチル化の程度は、動物の初期発生、インプリンティング、細胞分化、がん化および老化等によって変化し、遺伝子発現と深い関わりがある。dCのメチル化/ヒドロキシメチル化は遺伝子配列が関与しない遺伝情報の発現制御模様を示すと考えられる。従って、dC、mdC、及びhmdCを迅速かつ超高感度に測定する方法の開発が望まれている。更には、その測定結果を利用して、dCのメチル化、ヒドロキシメチル化の割合を知ることが重要であると考えられる。
【0008】
感度良く、そして短い時間での分析が可能になれば、生命現象・病態のより深い理解、新規薬物の探索が可能となる。また、量が少ない極めて貴重なサンプル(例えば、卵子・受精卵等の初期胚発生段階のサンプル、ES細胞および病理生検)の研究においては超高感度の分析が要求される。
【0009】
上記特許文献1においては、特定の遺伝子のメチル化の程度を知る方法の開示があるが、ゲノム全体におけるDNAのメチル化の把握が困難であったばかりでなく、ヒドロキシメチル化を測定できないという問題があった。その上、PCR法を利用するがゆえに解析には時間がかかってしまうという問題があった。
【0010】
非特許文献1に記載の分析方法は溶媒濃度の変化を利用するため1サンプルの分析に95分も要し、産業応用を考えると極めて非効率的であった。また、1回の分析時間が非常に長いので、破壊分析を積極的に利用する契機の提供がないばかりでなく、産業応用の面で上記PCR法に対して有利な側面が提供されていなかった。
【0011】
本願発明者らは鋭意研究し、受精卵及びサル/マウス胚性幹細胞及びその分化段階における量的なエピジェネティック変化について解析した結果、迅速かつ超高感度にdC、mdC、及び/又はhmdCを測定する方法を確立するに至った。更には、dC、mdC、及びhmdCを一斉測定する方法を確立するに至った。
【0012】
よって、迅速かつ超高感度にdC、mdC、及び/又はhmdCを測定する方法を提供することを、本発明が解決すべき課題とする。更に、dC、mdC、及びhmdCを一斉測定する方法を提供することを本発明が解決すべき課題とする。
【課題を解決するための手段】
【0013】
(第1発明)
上記課題を解決するための本願第1発明の構成は、
dC、mdC及び/又はhmdCを測定する方法であって、
内部標準、及び、100ng以下のDNA断片あるいは細胞100〜1000個から調製されたDNA断片を含むサンプルを、
液体クロマトグラフィー−質量分析に供し、
液体クロマトグラフィーの移動相は、pH6.0〜8.0の緩衝液に対してlogP値−0.7〜−0.3の有機溶媒を10〜30%(v/v)の範囲内とし、
デオキシリボースの開裂に基づいて測定することを特徴とするdC、mdC及び/又はhmdCを測定する方法である。
【0014】
本願第1発明はdC、mdC及び/又はhmdCを測定する方法であるので、DNA断片の量が0となることはない。1回の測定に供されるDNA断片の量の下限は本来的には限定されるものではないが、現実の測定においては、使用する分析機器の定量限界の影響を受けうる。
【0015】
(第2発明)
上記課題を解決するための本願第2発明の構成は、
前記dC、mdC及び/又はhmdCを測定する方法であって、
液体クロマトグラフィーの移動相の溶媒濃度を一定にする第1発明に記載のdC、mdC及び/又はhmdCを測定する方法である。
【発明の効果】
【0016】
本発明により、破壊分析の利点を生かし、迅速かつ超高感度にdC、mdC、及び/又はhmdCを測定する方法が提供される。好ましくは、迅速かつ超高感度にdC、mdC、及びhmdCを一斉測定する方法が提供される。従来の測定方法に比べて測定時間の著しい短縮に成功し、かつ、量が少ない極めて貴重なサンプルの有効な解析が可能となった。
【0017】
特に、溶媒濃度を一定にして測定を行う場合、第1に、より好ましいdC、mdC、hmdCの分離状態を実現できる。第2に、各回の分析前のカラム平衡化を省略することができ、単位時間当たりより多くのサンプルを解析可能である。
【0018】
本発明の測定は定量的に行うことができるので、DNA断片の由来の解析に役立つ。例えば、特定のDNAをプローブなどにより吊り上げてDNA断片を調製した場合、当該特定のDNAについてのdC、mdC及び/又はhmdCの測定が可能である。エピジェネティック変化をより広い視点から解析できる。また、例えば、細胞のゲノムDNAからDNA断片を調製すれば、特定の遺伝子についてのエピジェネティック変化を捉えるのではなく、細胞のゲノムDNA全体のdCのメチル化やヒドロキシメチル化の程度を知ることができる。
【0019】
特定の遺伝子のエピジェネティック変化のみならず、例えばゲノムDNA全体のdCのメチル化やヒドロキシメチル化の程度を知ることは、ES/iPS細胞のクオリティーコントロール、がんの悪性度・進行度合いの評価、神経変性疾患およびその他の老化関連疾患のリスク評価において重要であると推測される。実際、臨床調査において白血病患者から採取した白血球ゲノムDNAの多くでdCのメチル化/ヒドロキシメチル化に異常が見られることが報告されている(非特許文献2)。
【0020】
また、タンパク質の機能解析において、そのタンパク質を大量に合成する必要がある場合、宿主としてはハエ由来細胞などのDNAメチル化が起こらない、あるいは起こりにくい細胞系を用いることがある。これらは研究者の経験によるところが大きいが、本測定法を用いれば、プラスミドDNAのメチル化レベルを測定することにより、最適な宿主、あるいは最適なプラスミドベクターを定量的に選定することができる。
【図面の簡単な説明】
【0021】
【図1】マウスES細胞100個又は1000個からゲノムDNA抽出をした場合でも、mdCが定量可能であることを示す図である。
【図2】本実施例(サル大脳皮質)に係る測定での、dC、mdC、及びhmdCの保持時間を示す図である。
【図3】本実施例に係る、サルの各組織のゲノムDNA中のdCのメチル化の程度を示す。
【図4】本実施例に係る、サルの各組織のゲノムDNA中のdCのヒドロキシメチル化の程度を示す。
【図5】本実施例に係る、マウスの各組織のゲノムDNA中のdCのメチル化の程度を示す。
【図6】本実施例に係る、マウスの各組織のゲノムDNA中のdCのヒドロキシメチル化の程度を示す。
【図7】移動相の体積比条件を変化させた場合のdCピーク、mdCピーク、hmdCピークの分離状態を示す。
【発明を実施するための形態】
【0022】
以下に、本発明を実施するための形態を、最良の形態を含めて説明する。
【0023】
〔DNA抽出・断片化〕
本発明は迅速かつ超高感度にdC、mdC、及び/又はhmdCを測定可能であり、dCのメチル化/ヒドロキシメチル化の割合を解析するのに適している。また、デオキシリボースの開裂を捉えてdC、mdC、hmdCを測定するため、抽出したDNAをデオキシアデニン(以下、dAとも称する。)、デオキシグアニン(以下、dGとも称する。)、デオキシシトシン、チミン(以下、Tとも称する。)等の1残基単位に断片化することが好ましい。
【0024】
よって、本発明のDNA断片とは、例えばdC、mdC、hmdC等、1残基単位に調製されたDNA残基をいう。DNA断片を含むサンプルには、夾雑物が含まれていても構わない。
【0025】
DNAの断片化の方法は特に限定されない。トータルdCに対するメチル化、ヒドロキシメチル化の割合を維持できるDNAの断片化の方法が好ましく、後述の実施例におけるような酵素法を好ましく例示できる。
【0026】
本発明に用いるDNA断片の由来は特に限定されず、動物、植物、微生物等に由来するDNA断片を限定なく用いることができる。例えば、生殖・内分泌に関与する細胞(乳腺細胞、卵原細胞、子宮上皮細胞、セルトリ細胞等)、皮膚に関与する細胞(上皮細胞、線維芽細胞、血管内皮細胞及び平滑筋細胞等)、血管に関与する細胞(血管内皮細胞、平滑筋細胞及び線維芽細胞等)、筋肉に関与する細胞(筋肉細胞等)、脂肪に関与する細胞(脂肪細胞等)、神経に関与する細胞(脳や脊髄などの中枢神経系や末梢神経系の神経細胞等)、肝臓に関与する細胞(肝細胞等)、膵臓に関与する細胞(膵ラ島細胞等)、腎臓に関与する細胞(腎上皮細胞、近位尿細管上皮細胞及びメサンギウム細胞等)、肺・気管支に関与する細胞(上皮細胞、線維芽細胞、血管内皮細胞及び平滑筋細胞等)、目に関与する細胞(視細胞、角膜上皮細胞及び角膜内皮細胞等)、前立腺に関与する細胞(上皮細胞、間質細胞及び平滑筋細胞等)、骨に関与する細胞(骨芽細胞、骨細胞及び破骨細胞等)、軟骨に関与する細胞(軟骨芽細胞及び軟骨細胞等)、歯に関与する細胞(歯根膜細胞及び骨芽細胞等)、血液に関与する細胞(白血球及び赤血球等)、及び幹細胞{例えば、骨髄未分化間葉系幹細胞、骨格筋幹細胞、造血系幹細胞、神経幹細胞、肝幹細胞(oval cell、small hepatocyte等)、脂肪組織幹細胞、胚性幹(ES)細胞、誘導多能性幹(iPS)細胞、表皮幹細胞、腸管幹細胞、精子幹細胞、胚生殖幹(EG)細胞、膵臓幹細胞(膵管上皮幹細胞等)、白血球系幹細胞、リンパ球系幹細胞、角膜系幹細胞、前駆細胞(脂肪前駆細胞、血管内皮前駆細胞、軟骨前駆細胞、リンパ球系前駆細胞、NK前駆細胞等)等}等が挙げられる。また、昆虫細胞として、カイコ細胞(BmN細胞及びBoMo細胞等)、クワコ細胞、サクサン細胞、シンジュサン細胞、ヨトウガ細胞(Sf9細胞及びSf21細胞等)、クワゴマダラヒトリ細胞、ハマキムシ細胞、ショウジョウバエ細胞、センチニクバエ細胞、ヒトスジシマカ細胞、アゲハチョウ細胞、ワモンゴキブリ細胞及びイラクサキンウワバ細胞(Tn−5細胞、HIGH
FIVE細胞及びMG1細胞等)等が挙げられる。また、植物は、細胞やカルスなどのほか、表皮組織、柔組織、師管・師部繊維等の師部組織、道管・仮道管・木部繊維等の木部組織、茎、塊茎、葉、根、塊根、穂木、蕾、花、花弁、雌ずい、雄ずい、葯、花粉、子房、果実、さや、さく果、種子、繊維、胚珠等が挙げられる。その他、上述した組織パラフィン切片に由来するDNA断片を用いることも可能である。また、酵母、線虫およびハエのようなDNAのメチル化が起こらない、あるいは起こりにくいと考えられている生物についても分析対象となり得る。
【0027】
抽出操作を適宜工夫することにより、特定の遺伝子をコードするDNA、ゲノムDNA、ミトコンドリアDNA、プラスミドDNA等から調製したDNA断片を測定対象とすることができる。測定対象としては、ゲノムDNA、特定の遺伝子をコードするDNAから調製したDNA断片が好ましく、ゲノムDNAから調製したDNA断片が特に好ましい。
【0028】
DNAの抽出方法は特に限定されず、一般に用いられている手法を採用することができる。例えば、フェノール−クロロホルム法やスピンカラム法、アルカリ法等を採用することができる。特定遺伝子のプロモーター領域を組み込んだプラスミドDNAを用いれば、遺伝子導入した細胞内での特定プロモーター領域のメチル化動態を定量するモデル実験系を構築することができる。DNA抽出の対象の量が微量である場合、市販されている微量サンプルDNA抽出用キットを用いることができる。
【0029】
抽出、必要により断片化の工程を経て調製されたDNA断片を含むサンプルは、すぐに液体クロマトグラフィー−質量分析に供しても良いし、サンプルを安定に保存できる条件で保存してもよい。即ち、所定期間サンプルを保存した後に液体クロマトグラフィー−質量分析を行っても良い。好ましいサンプルの保存方法としては、乾燥状態あるいは溶液状態での−80℃凍結保存等が挙げられる。
【0030】
DNA断片を含むサンプルの形状は特に限定されないが、液体クロマトグラフィーに供する際は溶液状態であることが好ましい。
【0031】
〔液体クロマトグラフィー−質量分析〕
本発明において1回の測定に供されるDNA断片の量は、100ng以下、好ましくは10ng以下、より好ましくは2ng以下、あるいは、細胞100〜1000個から調製されたDNA断片全量、好ましくは、細胞100〜200個から調製されたDNA断片全量である。
【0032】
本発明において、1回の測定に供されるDNA断片の量の下限は本来的には限定されるものではないが、現実の測定においては、使用する分析機器の定量限界の影響を受けうる。仮に下限値を例示するならば、1回の測定に供されるDNA断片の量は、0.1〜100ngであり、好ましくは0.1〜10ngであり、より好ましくは0.1〜2ng、あるいは、細胞100〜1000個から調製されたDNA断片全量、好ましくは、細胞100〜200個から調製されたDNA断片全量である。
【0033】
本発明において内部標準とは、dC、mdC、又はhmdCの同定や定量に用いるものをいう。測定するdC、mdC、及び/又はhmdCの安定同位体を内部標準として使用することが好ましい。安定同位体として、13C、2H、15Nなどの原子を1以上含むdC、mdC、又はhmdCが例示される。これらの安定同位体は、質量分析の検出質量が変化する。内部標準を添加する工程は特に限定されないが、DNAの断片化後に添加することが好ましい。
【0034】
液体クロマトグラフィー−質量分析の装置構成は、液体クロマトグラフィーを行った後、質量分析を行うのであれば特に限定されない。例えば、液体クロマトグラフィー機器と質量分析機器とを結合したLC−MS、LC−MS/MSによる分析の他、液体クロマトグラフィーによりサンプルを分画した後、特定の画分を質量分析に供する分析も含まれる。好ましくは液体クロマトグラフィー機器と質量分析機器を結合した分析であり、より好ましくはLC−MS/MSによる分析である。
【0035】
質量分析でのイオン化法は特に限定されず、ESI―MS、CI―MS、MALDI−TOF−MS、APCI−MS等が含まれる。好ましくは、ESI−MSである。これらの質量分析は、MS/MSとすることが好ましい。イオン化を伴う質量分析において、当該イオン化は、LC−MSやLC−MS/MSにおけるインターフェイスに組み込むことができる。
【0036】
本発明においては、dC、mdC及び/又はhmdCを測定するにあたって、デオキシリボース部位の開裂を捉える。DNAに含まれる、DNA断片たるdA、dG、dC(mdC、hmdC)、T等の各残基は、デオキシリボースを包含する。例えばESI−MSもしくはESI−MS/MSのポジティブイオン化モードで測定した場合、デオキシリボース部位に相当する−116の開裂を捉えることができる。例え夾雑物がdC、mdC、hmdCと同じ保持時間で液体クロマトグラフィー機器から溶出しても、デオキシリボース部位の開裂を捉えることで、DNA断片であると同定することができる。ただし、夾雑物がDNA断片のイオン化を阻害する場合等、測定に悪影響を与える場合もありえるので、液体クロマトグラフィーの移動相は後述の組成を採用することが好ましい。
【0037】
測定に際し、dC、mdC、hmdCの内部標準等により予め検量線を作成しておけば、一度の分析でdC、mdC、hmdCの各含有量が一斉測定できる。
【0038】
質量分析は破壊分析であり、高感度を実現することができ、微量サンプルの解析に適している。また、デオキシリボースというDNA残基に特徴的な部位の開裂を捉えるので、短時間かつ簡便に標的物質の同定・定量が可能となる。上記特許文献1に記載のPCR法は、目的遺伝子を単離した後、更に目的遺伝子を増幅して定量するため、一回の測定に長時間を要するが、本発明は、DNA断片を含むサンプルを調製するだけでよく、その上一回の測定が短時間ですむ。
【0039】
液体クロマトグラフィーとは、HPLC又はUPLCを指す。
【0040】
液体クロマトグラフィーを実施するのは、質量分析に供するためにサンプルを分画することが主目的である。よって、必ずしもdC、mdC、hmdCを単離する必要はない。サンプルを質量分析に供し、dC、mdC、及び/又はhmdCが定量可能な程度に分画されることが好ましい。より少ないDNA断片量でdC、mdC、及び/又はhmdCの定量ができるように分画することが、より好ましい。
【0041】
dC、mdC、及び/又はhmdCの測定には、質量分析を利用する。DNA断片を含むサンプルに夾雑物が含まれる場合、当該夾雑物の存在により質量分析が妨げられる(例えば、測定の再現性が失われる、定量限界が引き上げられる等)場合があるが、特定m/zの選択的イオンモニタリングでは夾雑物が検出できない場合が多い。液体クロマトグラフィーにはUV−VIS検出器、蛍光検出器等の検出器を組み込むことが可能であるので、これらの検出器を利用してカラムから溶出されるdC、mdC及び/又はhmdCと夾雑物とを、dC、mdC及び/又はhmdCの定量を妨げない程度に分離できたか確認できる。
【0042】
移動相はpH6.0〜8.0の緩衝液とlogP値−0.7〜−0.3の有機溶媒を組み合わせることが好ましい。
【0043】
移動相の混合比は、上記緩衝液に対して上記有機溶媒10〜30%(v/v)、好ましくは15〜25%(v/v)、より好ましくは20%(v/v)である。
【0044】
本発明において「pH6.0〜8.0の緩衝液に対してlogP値−0.7〜−0.3の有機溶媒を10〜30%(v/v)の範囲内」とするとは、移動相全量中、pH6.0〜8.0の緩衝液は90〜70%(v/v)とすることができ、対応してlogP値−0.7〜−0.3の有機溶媒は10〜30%(v/v)とすることができることを意味する。この溶媒組成であれば、カラムから溶出されるdC、mdC及び/又はhmdCと夾雑物とを、dC、mdC及び/又はhmdCの測定、好ましくは定量を妨げない程度に分離することができる。特に、後述する好ましい担体を利用すると、分離効果は一層顕著になる。
【0045】
本発明においては、dC、mdC及び/又はhmdCの測定中に、上記範囲内でグラジエントをかけても良いし、溶媒濃度を一定として測定を行っても良いし、これらを組み合わせても良い。好ましくは、上記混合比の範囲内の特定の値で溶媒濃度を一定とする。
【0046】
ここで言う「溶媒濃度を一定とする」とは、測定前のカラムの平衡化を省略できる程度までグラジエント範囲を狭くすることを含む概念である。このように移動相の条件を設定した結果、例え1つのサンプルしか測定しなくても、好ましいdC、mdC、hmdCの分離状態を実現できる。更に、2以上のDNA断片を含むサンプルを連続分析でき、単位時間当たりの分析数を増やすことができる。
【0047】
上記溶媒濃度を一定とする手段は特に限定されず、混合後の溶媒を用いて液体クロマトグラフィーを行っても良いし、混合前の複数の溶媒を用い、液体クロマトグラフィー機器に混合させても良い。当然に、dC、mdC及び/又はhmdCを測定していないときは、溶媒、溶媒組成ともに上記記載に限定されない。
【0048】
上記緩衝液を調製するための緩衝剤は特に限定されないが、例えば、ギ酸アンモニウム、酢酸アンモニウムを用いることができ、これらを組み合わせて用いることもできる。好ましくはギ酸アンモニウムである。
【0049】
上記有機溶媒としては、例えば、メタノール、アセトニトリル、があり、これらを組み合わせて用いることもできる。好ましくはメタノールである。
【0050】
好ましい移動相の組み合わせとして、メタノール/10mMギ酸アンモニウム水溶液を例示することができる。
【0051】
液体クロマトグラフィーの担体(HPLC等カラムを用いる場合はカラム充填物)は特に限定されないが、疎水性のものを用いることが好ましい。例えば、ODSを含む炭素数8〜30の炭化水素−Si結合物、フェニル−Si結合物等が好ましく、カルバモイル−Si結合物、アミノアルキル―Si結合物等も使用可能である。好ましくは、ODSである。
【0052】
液体クロマトグラフィーに用いるカラムの担体充填部位の断面積は限定されないが好ましくは0.8〜47.8mm2であり、より好ましくは16.0〜17.0mm2である。カラムの担体充填部位の長さは特に限定されないが、好ましくは500〜2500mmであり、より好ましくは700〜800mmである。カラムを決定するに際しては、分析機器の特性を考慮して、適宜好ましい担体、断面積と長さを組み合わせることができる。
【0053】
液体クロマトグラフィーにおける流量は特に限定されないが、0.2〜1.0mL/minが好ましく、より好ましくは0.25〜0.35mL/minである。
【0054】
液体クロマトグラフィー−質量分析に供したサンプルのトータルdCに対するメチル化、ヒドロキシメチル化の割合は、例えば下記「数1」に示す式で求めることができる。式中、dC等の単位は質量、mol、残基数など適宜選択すればよい。
【0055】
【数1】

ほかに、dGはdCと相補的な塩基であることを利用し、dG量に対するmdC、hmdC量を求めることで、dCのメチル化、ヒドロキシメチル化の程度を求めることもできる。これらのように、サンプルのトータルdCに対するメチル化、ヒドロキシメチル化の割合は、分析者が適当な計算式を用いて求めることができる。
【実施例】
【0056】
以下、本発明の実施例を説明する。本発明の技術的範囲は以下の実施例に限定されない。
【0057】
−実施例1−
〔DNA抽出〕
(i)比較的多い量の抽出対象を抽出に使用できる場合
サルの大脳皮質、小脳、子宮、心臓、筋肉、腎臓、卵巣、肝臓、肺、及び小腸、マウスの大脳皮質、筋肉、心臓、膀胱、腎臓、肝臓、肺、胃、副腎、すい臓、大腸、小腸、及び精巣をDNA抽出対象として準備した。
【0058】
以上の各DNA抽出対象について、サル大脳皮質1連、サル小脳1連、サル子宮3連、サル心臓3連、サル筋肉3連、サル腎臓3連、サル卵巣4連、サル肝臓3連、サル肺3連、サル小腸3連、マウス大脳皮質4連、マウス筋肉4連、マウス心臓4連、マウス膀胱4連、マウス腎臓4連、マウス肝臓4連、マウス肺4連、マウス胃4連、マウス副腎4連、マウスすい臓4連、マウス大腸4連、マウス小腸4連、マウス精巣4連、それぞれ測定を行った。以下においては、各組織の測定結果などは平均値を記載する。
【0059】
準備した上述の各DNA抽出対象からスピンカラム法によってゲノムDNAを抽出した。ゲノムDNAの抽出量の測定のため、DNA濃度の測定には分光光度計を使用し、260nmにおける吸光度を測定することにより定量した(A2601.0=50ng/μL)。
【0060】
調製したゲノムDNAから1〜2ngを新しいマイクロチューブに分注したものを遠心濃縮した後、以下の「DNA断片化」工程に使用した。
【0061】
(ii)抽出対象量が制限される場合(細胞100個、又は1000個)
MACHEREY−NAGEL社製NucleoSpin(登録商標)TissueXSを用いて、マウスES細胞(ES−D3株、米国ATCCより購入)100個又は1000個を1連として各2連、DNA抽出をスピンカラム法により行った。抽出したゲノムDNAの全量を以下の「DNA断片化」工程に使用した。以下においては、各細胞数における測定結果などは平均値を記載する。
【0062】
〔DNA断片化〕
上記「DNA抽出」工程で用意したゲノムDNAを、マイクロチューブを用いて、2−メルカプトエタノール(10mM)および硫酸亜鉛(1mM)を含む酢酸ナトリウム緩衝液(30mM、pH5.3)100μL中で和光純薬工業社製のヌクレアーゼP1(4U)およびアルカリフォスファターゼ(3U)存在下、37℃、3時間インキュベートした。
【0063】
その後、トリス−塩酸緩衝液(0.5M、pH8.5)を20μL加えて、さらに3時間インキュベートした。
【0064】
その後、反応液に対して5倍量のエタノールを加えて十分混和することにより、酵素反応を停止した。
【0065】
続いて、酵素反応を停止した混液を10,000×g、室温で5分間遠心分離し、上清を新しいマイクロチューブに分注した。
【0066】
分注した上清を遠心濃縮により完全にドライアップ後、内部標準(15N3−dCおよびmdC−d3)を含む蒸留水(100μL)に再溶解したものをLC−MS/MSサンプル溶液とした。
【0067】
〔LC−MS/MS分析〕
定量解析にはトリプル四重極LC−MS/MSシステム(API4000、AB Sciex社製)を使用した。また、測定条件は以下の通りである。
サンプル注入量:60μL
カラム:TOSOH社製TSKgel ODS−100V 3μm(ODSカラム)
カラムサイズ:4.6mmφ×750mm
移動相1:メタノール
移動相2:10mMギ酸アンモニウム(pH6.6)
移動相の体積比:移動相1:移動相2(20:80)固定
流量:0.3mL/min
インターフェイス(イオン化):ESI
MS測定モード:ポジティブイオンモード
総分析時間:7.0分
LC−MS/MSの定量限界は、dC5.4pg(相関係数r=0.9998)、mdC57.8fg(r=0.9996)、hmdC15.4fg(r=0.9997)であった。即ち、超高感度の測定を実現した。
【0068】
図2(MSクロマトグラム)に示すとおり、dCは保持時間約4.6分、mdCは保持時間約5.5分、hmdCは保持時間約4.4分に検出された。検出・定量は、内部標準を利用して行った。その際、デオキシリボースの開裂を示す分子量−116を捉えた。
【0069】
dCのメチル化の程度は「Methyl(%)=mdC質量×100/(mdC質量+dC質量+hmdC質量)」によって計算した。
【0070】
メチル化の計算結果は、サル大脳皮質4.62%、サル小脳4.72%、サル子宮3.92%、サル心臓3.80%、サル筋肉3.76%、サル腎臓3.96%、サル卵巣3.77%、サル肝臓3.79%、サル肺4.06%、サル小腸3.94%(以上の結果の棒グラフを図3に示す。)、マウス大脳皮質3.78%、マウス筋肉3.10%、マウス心臓3.08%、マウス膀胱3.04%、マウス腎臓3.28%、マウス肝臓3.25%、マウス肺3.18%、マウス胃3.07%、マウス副腎3.87%、マウスすい臓2.86%、マウス大腸3.27%、マウス小腸3.58%、マウス精巣3.23%(以上の結果の棒グラフを図5に示す。)、マウスES細胞2.91%であった。
【0071】
dCのヒドロキシメチル化の程度は「Hydroxymethyl(%)=hmdC質量×100/(mdC質量+dC質量+hmdC質量)」によって計算した。
【0072】
ヒドロキシメチル化の計算結果は、サル大脳皮質1.17%、サル小脳0.95%、サル子宮0.31%、サル心臓0.26%、サル筋肉0.23%、サル腎臓0.21%、サル卵巣0.17%、サル肝臓0.17%、サル肺0.10%、サル小腸0.08%(以上の結果の棒グラフを図4に示す。)、マウス大脳皮質0.61%、マウス筋肉0.17%、マウス心臓0.16%、マウス膀胱0.16%、マウス腎臓0.15%、マウス肝臓0.13%、マウス肺0.13%、マウス胃0.10%、マウス副腎0.09%、マウスすい臓0.07%、マウス大腸0.06%、マウス小腸0.05%、マウス精巣0.05%(以上の結果の棒グラフを図6に示す。)、マウスES細胞0.25%であった。
【0073】
本実施例においては、1つのサンプルについてdC、mdC、及びhmdCの一斉解析に成功した。更に、測定1回あたりの時間は7.0分であり、短時間かつ超高感度の測定を実現した。短時間で分析ができるので、単位時間当たりの測定サンプル数を大幅に増やすことが可能である。
【0074】
−実施例2−
LC−MS/MS分析における、溶媒濃度とdC、mdC及びhmdC各ピークの分離について検討した。
【0075】
測定にはdC、mdC及びhmdC標品の混合液を用いた。LC−MS/MS分析は、「移動相の体積比」以外は実施例1と同様とした。移動相の体積比を以下の(A)〜(F)として分析を行った。
(A)移動相1:移動相2(0:100)固定
(B)移動相1:移動相2(10:90)固定
(C)移動相1:移動相2(20:80)固定
(D)移動相1:移動相2(30:70)固定
(E)移動相1:移動相2(40:60)固定
(F)移動相1:移動相2(50:50)固定
測定結果を図7に示す。図7においては、実線のピークがhmdCピークであり、破線のピークがdCピークであり、一点鎖線のピークがmdCピークである。ピークの検出順序は図2を参照できる。
【0076】
体積比(B)〜体積比(D)において、各ピークが良好に分離され、かつ、1回の分析時間を短時間とすることができた。
【0077】
体積比(A)では1回の分析に時間がかかりすぎてしまう。また、ピークの分離も良くない。体積比(E)及び体積比(F)では各ピークの分離が十分でなかった。
【0078】
−実施例3−
DNA断片を含むサンプルの連続分析について検討を行った。
【0079】
実施例1のLC−MS/MS分析において、UV−VIS検出器では保持時間10分までdC、mdC、及びhmdCの定量を妨げる夾雑物が検出された。
【0080】
サンプルの連続分析では、夾雑物をdC、mdC、及び/又はhmdCの定量を妨げないように溶出させる必要があるため、1サイクルの分析時間は確実を期して12分とした。
【0081】
本実施例のLC−MS/MS分析は移動相の体積比を固定しているので、毎回の分析前のカラム平衡化を省略できる。
【0082】
よって、実施例1のLC−MS/MS分析と同じ条件で、12分を1サイクルとして、DNA断片を含むサンプルの連続分析を行うことができた。連続分析の各回で、dC、mdC、及びhmdCの一斉解析に成功した。
【産業上の利用可能性】
【0083】
本発明により、迅速かつ超高感度にdC、mdC、及び/又はhmdCを測定する方法が提供される。更に、dC、mdC、及びhmdCを一斉測定する方法が提供される。
【特許請求の範囲】
【請求項1】
dC、mdC及び/又はhmdCを測定する方法であって、
内部標準、及び、100ng以下のDNA断片あるいは細胞100〜1000個から調製されたDNA断片を含むサンプルを、
液体クロマトグラフィー−質量分析に供し、
液体クロマトグラフィーの移動相は、pH6.0〜8.0の緩衝液に対してlogP値−0.7〜−0.3の有機溶媒を10〜30%(v/v)の範囲内とし、
デオキシリボースの開裂に基づいて測定することを特徴とするdC、mdC及び/又はhmdCを測定する方法。
【請求項2】
前記dC、mdC及び/又はhmdCを測定する方法であって、
液体クロマトグラフィーの移動相の溶媒濃度を一定にすることを特徴とする請求項1に記載のdC、mdC及び/又はhmdCを測定する方法。
【請求項1】
dC、mdC及び/又はhmdCを測定する方法であって、
内部標準、及び、100ng以下のDNA断片あるいは細胞100〜1000個から調製されたDNA断片を含むサンプルを、
液体クロマトグラフィー−質量分析に供し、
液体クロマトグラフィーの移動相は、pH6.0〜8.0の緩衝液に対してlogP値−0.7〜−0.3の有機溶媒を10〜30%(v/v)の範囲内とし、
デオキシリボースの開裂に基づいて測定することを特徴とするdC、mdC及び/又はhmdCを測定する方法。
【請求項2】
前記dC、mdC及び/又はhmdCを測定する方法であって、
液体クロマトグラフィーの移動相の溶媒濃度を一定にすることを特徴とする請求項1に記載のdC、mdC及び/又はhmdCを測定する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−233794(P2012−233794A)
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願番号】特願2011−102765(P2011−102765)
【出願日】平成23年5月2日(2011.5.2)
【出願人】(599002043)学校法人 名城大学 (142)
【出願人】(593006630)学校法人立命館 (359)
【Fターム(参考)】
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願日】平成23年5月2日(2011.5.2)
【出願人】(599002043)学校法人 名城大学 (142)
【出願人】(593006630)学校法人立命館 (359)
【Fターム(参考)】
[ Back to top ]

