α−グリコシルアントシアニン
【課題】アントシアニンそのものを化学的に改変することにより、安定性及び薬理作用が強化されたアントシアニンを提供することを課題とする。
【解決手段】アントシアニンと糖とを含有する溶液に所定の糖転移酵素を作用させることにより、アントシアニンにD−グルコース残基が等モル以上α結合しているα−グリコシルアントシアニン含有組成物を得ることができる。アントシアニンとしてはデルフィニジン-3-o-ルチノシドあるいはシアニジン-3-o-グルコシドなどを用いることができる。
【解決手段】アントシアニンと糖とを含有する溶液に所定の糖転移酵素を作用させることにより、アントシアニンにD−グルコース残基が等モル以上α結合しているα−グリコシルアントシアニン含有組成物を得ることができる。アントシアニンとしてはデルフィニジン-3-o-ルチノシドあるいはシアニジン-3-o-グルコシドなどを用いることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はα−グリコシルアントシアニンを含有する組成物及びその製造法に関する。更に詳細には、アントシアニンを糖の共存下、所定の糖転移酵素を作用させて得られるα−グリコシルアントシアニンを含有する組成物に関する。
【背景技術】
【0002】
従来から、アントシアニンは安全性が高いことから飲食品の着色に多く用いられている。また以前から欧州では、主にブルーベリーのアントシアニンが医薬品として用いられている。昨今国内でもアントシアニンの機能性に注目が集まってきた。例えば、色素以外の利用法として、アントシアニンが抗酸化、視覚改善などの効果を有することが報告されている。しかしながら、アントシアニンは熱や光に不安定であることが知られており、光分解や空気酸化によるアントシアニンの分解・変色・褪色が問題となっていた。
【0003】
この様な背景の中、アントシアニン色素の変色や褪色に対する対処方法が以前から検討されてきている。対処方法として、従来から、主に安定化組成物を加える方法、例えば、植物抽出物を添加する方法、糖類を加える方法、フラボノイド類を加える方法、有機酸類を加える方法、ビタミン類などを加える方法などが検討されている。糖類を加える方法としては、ニゲロオリゴ糖、マルトオリゴ糖及びパノースに、アントシアニン色素など天然色素の退色防止効果についての報告がある(特許文献1参照)。
【0004】
しかし、本出願人がこれまで検討した結果、フィチン酸以外には、カシスなどの非アシル化アントシアニンを十分に安定化する安定化剤は見出せなかった(特許文献2参照)。またフィチン酸においては、ミネラルの吸収を妨げる作用があり、栄養面から見ると、安定化剤として必ずしも好ましいものとは言えない。
【特許文献1】特開2000-336354号公報
【特許文献2】WO01/48091号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
これまでのアントシアニンの安定化方法はいずれもアントシアニンに他の物質を加える方法であり、上記のように実用面からみても一定の限界がある。そこで他の物質を加えなくてもよいように、アントシアニンそのものを化学的に改変して、より安定性が高く且つ薬理作用が強化されたアントシアニンを製造することが考えられる。しかしながらこのような課題を解決するための製造方法はまだ見出されていない。したがってアントシアニンそのものを化学的に改変することにより安定性及び薬理作用が強化されたアントシアニンを製造する方法の開発が望まれていた。
【課題を解決するための手段】
【0006】
本発明者らは上記課題を達成するために鋭意研究を重ねた結果、アントシアニンと糖とを含有する溶液に所定の糖転移酵素を作用させることにより、アントシアニンにD−グルコース残基が等モル以上α結合しているα−グリコシルアントシアニンが得られることを見出し、本発明を完成するに至った。そして特にカシスなどを由来とする安定性の悪い非アシル化アントシアニンであっても、これから得られたα−グリコシルアントシアニンには、原料のアントシアニンと比べて安定性の向上が見出されただけではなく、薬理作用も向上していることを見出した。
【図面の簡単な説明】
【0007】
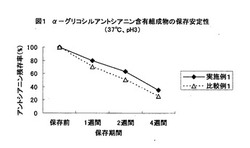
【図1】α−グリコシルアントシアニン含有組成物の保存安定性(37℃、pH3)
【図2】α−グリコシルアントシアニン含有組成物の保存安定性(37℃、pH4)
【図3】α−グリコシルアントシアニン含有組成物の保存安定性(37℃、pH5)
【発明を実施するための最良の形態】
【0008】
本発明においてアントシアニンとは、式[3]に示される骨格を有するアントシアニジンと、それに糖が結合して配糖体となったものの総称である。
【化2】

アグリコンであるアントシアニジンとしては、例えばシアニジン(Cyanidin)、デルフィニジン(Delphinidin)、ペラルゴニジン(Pelargonidin)、ペオニジン(Peonidin)、ペチュニジン(Petunidin)、マルビジン(Malvidin)などがある。アントシアニンは例えば、上記アントシアニジンにグルコースが配糖体として結合している場合はアントシアニジングルコシドと呼ぶ。また、アントシアニンに見いだされる糖としては単糖類であるグルコース以外に、ガラクトース、アラビノースや2糖類であるルチノース、ソフォロースなどがある。
【0009】
本発明に用いるアントシアニンは特に限定されるものではなく、アントシアニンを含有する各種植物の抽出物、またはそれらの精製物等を用いることができる。製造法としては、主に紫サツマイモ、赤キャベツ、赤ゴメ、エルダーベリー、ブドウ果汁あるいは果皮、ブドウ果皮、紫トウモロコシ、赤ダイコン、シソ、赤米、カシス、カウベリー、グースベリー、クランベリー、サーモンベリー、スィムブルーベリー、ストロベリー、ダークスィートチェリー、チェリー、ハイビスカス、ハクルベリー、ブラックベリー、ブルーベリー、プラム、ホワートルベリー、ボイセンベリー、マルベリー、紫イモ、紫ヤマイモ、ラズベリー、レッドカーラント、ローガンベリーなどアントシアニンを多く含む物から抽出されることができる。後記実施例で述べているカシスアントシアニンに含まれる、シアニジン-3-O-グルコシド(以下C3Gと略記)、シアニジン-3-O-ルチノシド(以下C3Rと略記)、デルフィニジン-3-O-グルコシド(以下D3Gと略記)、デルフィニジン-3-O-ルチノシド(以下D3Rと略記)などが挙げられる。特にこの4種類のアントシアニンにおける酵素反応の特異性は見られなかったので、他のアントシアニンに対しても同様の酵素反応性があるものと思われる。
【0010】
本発明に用いる糖は、一般式Cn(H2O)mという一般式を有する化合物であり、糖転移酵素によってアントシアニンにD−グルコース残基を等モル以上α結合できるものであればよい。α−グルコシル結合を有する糖類であり、例えばマルトオリゴ糖、デキストリン、シクロデキストリン、アミロース、アミロペクチン、澱粉質、澱粉分解物および加工澱粉などが使用できる。
【0011】
本発明に用いる糖転移酵素は、糖の種類に応じて適宜選択することになる。またアントシアニンを分解するものであってはならない。
例えば糖としてマルトース、マルトトリオース、マルトテトラオースなどのマルトオリゴ糖、またはDE10乃至70の澱粉部分加水分解物などを使用する場合には、α−グルコシダーゼ(EC3.2.1.20)を使用する。糖としてデキストリン、シクロデキストリンまたはDE1以下の澱粉糊化物からDE約60の澱粉部分加水分解物を使用する場合には、シクロマルトデキストリングルカノトランスフェラーゼ(EC2.4.1.19)を使用する。糖としてDE1以下の澱粉糊化物からDE約30のデキストリン、澱粉部分加水分解物などを使用する場合には、α−アミラーゼ(EC3.2.1.1)を使用する。
α−グルコシダーゼはブタの肝臓、ソバの種子などの動植物組織由来の酵素、または、ムコール(Mucor)属、ペニシリウム(Penicil l ium)属などに属するカビ、またはサッカロミセス(Sacch a romyces)属などに属する酵母などの微生物を栄養培地で培養し得られる培養物由来の酵素が、シクロマルトデキストリングルカノトランスフェラーゼは、バチルス(Bacillus)属、クレブシーラ(Klebsiella)属などに属する細菌培養物由来の酵素が、α−アミラーゼはバチルス属などに属する細菌、または、アスペルギルス(Aspergillus)属などに属するカビ培養由来の酵素などが適宜選択できる。
これらの糖転移酵素は、アントシアニンをα−グリコシル化する活性が検出されれば、必ずしも精製された酵素である必要はない。未精製の細菌培養物または精製段階の粗酵素であっても、本発明の製造方法に使用し得る。これらの酵素は、当該分野で公知の方法に従って細菌の培養液から生成され得る。これらの酵素は、市販のものであってもよい。
【0012】
酵素反応時の各種条件は、糖転移酵素が作用してα−グリコシルアントシアニンが効率よく生成できる範囲であれば特に限定されるものではない。
反応時の温度とpHとしては、糖転移酵素が作用してα−グリコシルアントシアニンが生成すればよく、通常10乃至50℃、pH3乃至7から選ばれる。
酵素量と反応時間としては、経済性の点から、通常は約3乃至24時間で反応を終了するように酵素量が選ばれる。
反応に際しては、アントシアニンをできるだけ高濃度に含有させて反応させるのが工業的に有利である。
例えば、約0.1(w/v)%以上、望ましくは約0.2乃至2.0(w/v)%のアントシアニンと適量の糖とを含有するアントシアニン高含有液をpH4乃至6とする。アントシアニンは中性から塩基性領域に長時間放置すると分解することが知られており、さらに加温により分解が促進されることが知られているので、アントシアニンが分解せず、糖転移酵素の作用しうるだけの低温、具体的には約20乃至40℃に維持し、これに糖転移酵素を作用させると、アントシアニンにグルコースが等モル以上結合したα−グリコシルアントシアニンが高濃度に生成される。
この際、反応溶液中のアントシアニンは分解しやすいので、これを防ぐため、できるだけ遮光、嫌気下に維持するのが望ましい。
【0013】
このようにして得られた反応液は、通常は複数のα−グリコシルアントシアニンを含有するものであり、例えばそのままα−グリコシルアントシアニン含有組成物として使用することができる。あるいは特定の種類のα−グリコシルアントシアニンのみを分離・精製して単一の高純度製品として使用することもできる。
本発明のα−グリコシルアントシアニンを生成せしめた反応液の精製法は、反応液を例えば、カラムクロマトグラフ法以外にも、必要に応じて他のクロマトグラフ法、樹脂吸着法や膜分離法などを適宜組み合わせて行うことが可能である。中でも、ODSシリカゲルを用いたクロマトグラフ法が最も好ましい。また、必要に応じて予め陽イオン交換樹脂などにアントシアニン成分を吸着させた後、溶出させることにより、予備精製を行ったものを同様に精製してもよい。
【0014】
本明細書においてアントシアニン含有量は、WO01/01798号公報に記載してあると同様に、含まれるアントシアニンの各成分の含有量を合計したものであり、HPLCによるアントシアニンのピーク面積比によって算出する。
すなわち、最初に、重量既知のアントシアニン標品をHPLCで分析し、520nmにおけるピーク面積から検量線を作成し、各アントシアニン成分の含量を求める。さらに、各成分の含量をピーク面積で除した応答係数、即ちmg/ピーク面積を得る。次に、アントシアニン含有サンプルをHPLC分析し、それぞれの成分のピーク面積に標品から求めた応答係数を乗じて、それぞれの成分含有量を計算し、注入量との比からアントシアニン含有量を重量(w/w)%として求める。
糖転移反応により生成されたα−グリコシルアントシアニンの各成分の含有量は、上記と同様にHPLC分析を行い、得られたピーク面積を反応基質として供されたアントシアニンより作成された検量線に当てはめて、基質アントシアニン当量として算出する。
本発明のα−グリコシルアントシアニン含有組成物中の固形分当たりのα−グリコシルアントシアニンの含有量は、上記の算出方法によって得られたα−グリコシルアントシアニンの各成分の含有量の合計の固形分当たりの割合を意味する。そして組成物中のα−グリコシルアントシアニンの含有量は反応条件により異なるが、固形分当たり0.05〜90質量%含有させることが可能であり、実用的にも好ましい。
【0015】
本発明のα−グリコシルアントシアニンあるいはこれらを含有する組成物は、試験例1及び試験例2で開示しているように、優れた保存安定性を有するとともに、抗酸化能も向上している。したがって各種飲食品に適宜配合して使用することができる。あるいは抗酸化剤として油性飲食品の酸化防止等に利用できる。また今後各種の生理活性物質としての利用も期待される。
【実施例】
【0016】
以下、本発明を製造例及び試験例によりさらに具体的に説明するが、本発明はこれらによりなんら限定されるものではない。
【0017】
製造例1 カシス抽出物の調製
市販のカシス濃縮果汁を水で希釈し、Bx.10になるように調製した。この希釈果汁を濾紙で濾過して固形物を除去した後、荷電型逆浸透膜(日東電工社製:商品名NTR−7410)により膜分離を行った。濃縮液が循環しなくなるまで分離を実施し、再度水を添加して希釈した後、再度分離を継続し、濃縮液が循環しなくなった段階で分離を終了した。濃縮液をスプレードライして粉末状のカシス抽出物(アントシアニン含有量22.3重量%)を得た。得られたカシス抽出物を下記の試験例において、アントシアニンとして使用し、本発明の組成物のアントシアニン安定化作用の指標として、アントシアニンの残存量の評価を行い、アントシアニン残存率を算出した。
【0018】
実施例1 α−グリコシルアントシアニン含有組成物の調製
デキストリン1重量部を100mM酢酸緩衝液(pH6)98重量部に混合し加温溶解させ冷却後、製造例1で得られたカシス抽出物1重量部を混合し、これにバチルス・マセランス(Bacillus macerans)由来のシクロマルトデキストリングルカノトランスフェラーゼ(EC2.4.1.19)(天野エンザイム株式会社製)をデキストリングラム当たり300単位加え、pH5、20℃に維持し攪拌しつつ、遮光下で23時間反応させた。反応液をHPLC分析したところ、アントシアニンの約25%がα−グリコシルアントシアニンに転換していた。反応液に10%蟻酸を10重量部加え酵素を失活させ、α−グリコシルアントシアニン含有組成物を得た(実施例1)。
比較例として、上記のシクロマルトデキストリングルカノトランスフェラーゼを加える代わりに、シクロマルトデキストリングルカノトランスフェラーゼを加えずに他は実施例と同様にしてサンプルを得た(比較例1)。
【0019】
実施例2 α−グリコシルアントシアニンの分析
実施例1で得られたα−グリコシルアントシアニン含有組成物を下記の条件でLCMS分析を行った。分析の結果、観測されたイオンのm/zを表1に示す。
LCMS測定の詳細
装置 HP1100シリーズ(Hewlett Packard社製)
カラム Capcell pak UG120(資生堂)
カラム温度 40℃
移動相 A:5%蟻酸
B:アセトニトリル
グラジエント条件 時間
(分) %A %B
0.0 95.0 5.0
20.0 20.0 80.0
25.0 20.0 80.0
25.1 95.0 5.0
35.0 95.0 5.0
流速 0.2ml/分
イオン化法 ESI
測定モード ポジティブモード
走査範囲(m/z) 200〜1000
キャピラリー温度 350℃
キャピラリー電圧 4000V
ネブライザー 40psi
【0020】
【表1】

【0021】
製造例1由来の、反応基質として供されたアントシアニン成分であるD3G、D3R、C3G、C3Rはそれぞれ保持時間16.5分にm/z465、17.5分にm/z611、18.8分にm/z449、19.4分にm/z595のイオン化分子(M+)として検出された。保持時間16.4分にイオン化分子(M+)と考えられるイオンがm/z789、m/z627に観測され、それぞれ分子量は789、627と推測され、D3Gのα−マルトシル体(グルコース残基が2倍量モル結合したもの)、α−グルコシル体(グルコース残基が等モル結合したもの)であると推定された。保持時間17.2分にイオン化分子(M+)と考えられるイオンがm/z93 5、m/z773に観測され、それぞれ分子量は93 5、773と推測され、D3Rのα−マルトシル体、α−グルコシル体であると推定された。保持時間18.5分にイオン化分子(M+)と考えられるイオンがm/z93 5、m/z773、m/z611に観測され、それぞれ分子量は93 5、773、611と推測され、C3Gのα−マルトトリオシル体(グルコース残基が3倍量モル結合したもの)、α−マルトシル体、α−グルコシル体であると推定された。保持時間19.1分にイオン化分子(M+)と考えられるイオンがm/z919、m/z757に観測され、それぞれ分子量は919、757と推測され、C3Rのα−マルトシル体、α−グルコシル体であると推定された。
上記結果から、カシス抽出物中の4種のアントシアニン、D3G、D3R、C3G、C3R由来のα−グルコシルアントシアニン、α−マルトシルアントシアニン、α−マルトトリオシルアントシアニンなどのα−グリコシルアントシアニンが生成されていることが推定された。
また実施例1で得られたα−グリコシルアントシアニン含有組成物中の固形分当たりのα−グリコシルアントシアニンの含有量は7.5%であった。
【0022】
実施例3 C3Rのα−グリコシル体の調製
デキストリン1重量部を100mM酢酸緩衝液(pH6)98重量部に混合し加温溶解させ冷却後、C3R(常磐植物化学研究所製)1重量部を混合し、これにバチルス・マセランス(Bacillus macerans)由来のシクロマルトデキストリングルカノトランスフェラーゼ(EC2.4.1.19)(天野エンザイム株式会社)をデキストリングラム当たり300単位加え、pH5、20℃に維持し攪拌しつつ、遮光下で18時間反応させた。反応液をHPLC分析したところ、C3Rの約25%がα−グリコシルC3Rに転換していた。反応液に10%蟻酸を10重量部加え酵素を失活させた。
本反応液をDevelosil ODS-HG-5カラム(野村化学社製、ID4.6ラ250mm、5・香jを用い、下記溶出条件で分画、精製した。
カラム温度 40℃
移動相 A:5%蟻酸
B:アセトニトリル
グラジエント条件 時間
(分) %A %B
0.0 93.0 7.0
15.0 85.0 15.0
15.1 20.0 80.0
20.0 20. 0 80.0
20.1 93.0 7.0
25.0 93.0 7.0
流速 1.0ml/分
検出器 520nm
保持時間が14.3−14.8分のα−グリコシルC3R画分を採取した。分取作業を繰り返し実施し、回収したα−グリコシルC3R画分を固相抽出カートリッジOasis HLB Extraction Cartridge(Waters社製)に吸着させた。10%蟻酸を通液、洗浄してグルコースなどの夾雑物を除去した後、10%蟻酸を含むアセトン溶液を通液しα−グリコシルC3R画分を溶出、採取し、減圧濃縮した。HPLC分析により単一ピークであることを確認し、精製α−グリコシルC3R画分を調製することが出来た。
【0023】
実施例4 α−グリコシルC3Rの分析
実施例3で得られたα−グリコシルC3RのNMR分析を行った。装置はBruker Avance 500 NMR spectrometer (Bruker Biospin社製)を使用し、観測周波数を1H:500.13MHz、13C:125.77MHzとし、測定溶媒は重メタノール/重トリフルオロ酢酸(19/1(v/v))を用いた。内部標準として、TMS(tetramethylsilane)を用いた。
結果は表2にまとめた。
【0024】
【表2】

【0025】
表2の結果から、グルコース残基の4位の炭素にのみ、大きなケミカルシフト変化が見出されたことから、糖転移したグルコースの結合は、C3Rの糖部分ルチノース残基のうち、グルコース残基の4位の炭素の水酸基にエーテル結合しているものと判断される。
本結果と実施例2の結果から、アントシアニンと糖とを含有する溶液にシクロマルトデキストリングルカノトランスフェラーゼを作用させて生成されるアントシアニジン3-0-グルコシドにグルコース残基が等モル以上結合したα−グリコシルアントシアニンは式[1]で 、アントシアニジン3-0-ルチノシドにグルコース残基が等モル以上結合したα−グリコシルアントシアニンは式[2]で示される。nは結合したグルコース残基の数を表しており、0〜15から選ばれる整数で示される構造を有しているものと判断される。すなわち、α−グルコシル体の場合はn=0、α−マルトシル体の場合はn=1、α−マルトトリオシル体の場合はn=2である。さらにnが3〜15のα−グリコシルアントシアニンが生成しているものと推定される。
【0026】
試験例1 α−グリコシルアントシアニン含有組成物の抗酸化能評価(ORAC法)
実施例1で得られたα−グリコシルアントシアニン含有組成物の抗酸化能を評価するにあたり、ORAC法を用いてビタミンE様物質Trolox(6-Hydroxy-2,5,7,8-tetrametylchroman-2-carboxylic acid)をスタンダードとし、ラジカルによる蛍光退色の防止作用を指標に抗酸化能を評価した。
実施例1で得られたα−グリコシルアントシアニン含有組成物および比較例1のサンプルをアセトン・水・酢酸混液で抽出後、75mMリン酸カリウム緩衝液(pH7.4)で適宜希釈した。コントロールには、バッファーを用いた。
ラジカルによる酸化耐性を定量するための濃度既知スタンダードとして、ビタミンE様物質Troloxを上記バッファーで希釈し、2.5・、5・、10・溶液を調製した。96穴培養プレートに同Trolox溶液及び希釈サンプルをそれぞれ50・/穴加えた。ここに、上記バッファーで126 nMに調製したフルオレセイン溶液を100・/穴加えた。なお、ブランクとして緩衝液のみ150・/穴加えた。
蛍光プレートリーダーで37℃、15分間プレインキュベーションを行い、この間、485 nmの波長で励起し、538 nmの波長で検出を行った。15分後、ラジカルとして、上記バッファーで51.2 mMに調製したAAPH (2,2’-Azobis (2-amidinopropane) dihydrochloride)を50・ずつ全穴に加えた。再度、蛍光プレートリーダーにより、上記波長で37 ℃、70分間、経時的に測定を行った。スタンダード及びサンプルのそれぞれの測定値からブランクの測定値を引き、試料1gあたりのTroloxのマイクロモル数(μmole TE/g)に換算し、抗酸化能を評価した。
結果は表3に示した。実施例1、比較例1ともに、抗酸化能を示した。比較例1に比べて実施例1は高い抗酸化能を示すことが認められた。
【0027】
【表3】

【0028】
試験例2 α−グリコシルアントシアニン含有組成物の37℃における保存安定性
実施例1で得られたα−グリコシルアントシアニン含有組成物および比較例1のサンプ
ルの一部を採取し、5N水酸化ナトリウム溶液でpH4およびpH5に調整した。pH未調整の溶液(pH3)、pHを調整した各溶液(pH4およびpH5)を37℃の4週間の安定性試験に供した。アントシアニンの含有量はHPLC分析により算出し、保存前のアントシアニン含有量を100としたアントシアニン残存率を算出した。
結果を図1、2、3に示す。各pHにおいて、比較例1に比べ実施例1は残存率が高かった。特に、pH3では、比較例1の残存率は26%に対し、実施例1の残存率は35%であった。
【技術分野】
【0001】
本発明はα−グリコシルアントシアニンを含有する組成物及びその製造法に関する。更に詳細には、アントシアニンを糖の共存下、所定の糖転移酵素を作用させて得られるα−グリコシルアントシアニンを含有する組成物に関する。
【背景技術】
【0002】
従来から、アントシアニンは安全性が高いことから飲食品の着色に多く用いられている。また以前から欧州では、主にブルーベリーのアントシアニンが医薬品として用いられている。昨今国内でもアントシアニンの機能性に注目が集まってきた。例えば、色素以外の利用法として、アントシアニンが抗酸化、視覚改善などの効果を有することが報告されている。しかしながら、アントシアニンは熱や光に不安定であることが知られており、光分解や空気酸化によるアントシアニンの分解・変色・褪色が問題となっていた。
【0003】
この様な背景の中、アントシアニン色素の変色や褪色に対する対処方法が以前から検討されてきている。対処方法として、従来から、主に安定化組成物を加える方法、例えば、植物抽出物を添加する方法、糖類を加える方法、フラボノイド類を加える方法、有機酸類を加える方法、ビタミン類などを加える方法などが検討されている。糖類を加える方法としては、ニゲロオリゴ糖、マルトオリゴ糖及びパノースに、アントシアニン色素など天然色素の退色防止効果についての報告がある(特許文献1参照)。
【0004】
しかし、本出願人がこれまで検討した結果、フィチン酸以外には、カシスなどの非アシル化アントシアニンを十分に安定化する安定化剤は見出せなかった(特許文献2参照)。またフィチン酸においては、ミネラルの吸収を妨げる作用があり、栄養面から見ると、安定化剤として必ずしも好ましいものとは言えない。
【特許文献1】特開2000-336354号公報
【特許文献2】WO01/48091号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
これまでのアントシアニンの安定化方法はいずれもアントシアニンに他の物質を加える方法であり、上記のように実用面からみても一定の限界がある。そこで他の物質を加えなくてもよいように、アントシアニンそのものを化学的に改変して、より安定性が高く且つ薬理作用が強化されたアントシアニンを製造することが考えられる。しかしながらこのような課題を解決するための製造方法はまだ見出されていない。したがってアントシアニンそのものを化学的に改変することにより安定性及び薬理作用が強化されたアントシアニンを製造する方法の開発が望まれていた。
【課題を解決するための手段】
【0006】
本発明者らは上記課題を達成するために鋭意研究を重ねた結果、アントシアニンと糖とを含有する溶液に所定の糖転移酵素を作用させることにより、アントシアニンにD−グルコース残基が等モル以上α結合しているα−グリコシルアントシアニンが得られることを見出し、本発明を完成するに至った。そして特にカシスなどを由来とする安定性の悪い非アシル化アントシアニンであっても、これから得られたα−グリコシルアントシアニンには、原料のアントシアニンと比べて安定性の向上が見出されただけではなく、薬理作用も向上していることを見出した。
【図面の簡単な説明】
【0007】
【図1】α−グリコシルアントシアニン含有組成物の保存安定性(37℃、pH3)
【図2】α−グリコシルアントシアニン含有組成物の保存安定性(37℃、pH4)
【図3】α−グリコシルアントシアニン含有組成物の保存安定性(37℃、pH5)
【発明を実施するための最良の形態】
【0008】
本発明においてアントシアニンとは、式[3]に示される骨格を有するアントシアニジンと、それに糖が結合して配糖体となったものの総称である。
【化2】

アグリコンであるアントシアニジンとしては、例えばシアニジン(Cyanidin)、デルフィニジン(Delphinidin)、ペラルゴニジン(Pelargonidin)、ペオニジン(Peonidin)、ペチュニジン(Petunidin)、マルビジン(Malvidin)などがある。アントシアニンは例えば、上記アントシアニジンにグルコースが配糖体として結合している場合はアントシアニジングルコシドと呼ぶ。また、アントシアニンに見いだされる糖としては単糖類であるグルコース以外に、ガラクトース、アラビノースや2糖類であるルチノース、ソフォロースなどがある。
【0009】
本発明に用いるアントシアニンは特に限定されるものではなく、アントシアニンを含有する各種植物の抽出物、またはそれらの精製物等を用いることができる。製造法としては、主に紫サツマイモ、赤キャベツ、赤ゴメ、エルダーベリー、ブドウ果汁あるいは果皮、ブドウ果皮、紫トウモロコシ、赤ダイコン、シソ、赤米、カシス、カウベリー、グースベリー、クランベリー、サーモンベリー、スィムブルーベリー、ストロベリー、ダークスィートチェリー、チェリー、ハイビスカス、ハクルベリー、ブラックベリー、ブルーベリー、プラム、ホワートルベリー、ボイセンベリー、マルベリー、紫イモ、紫ヤマイモ、ラズベリー、レッドカーラント、ローガンベリーなどアントシアニンを多く含む物から抽出されることができる。後記実施例で述べているカシスアントシアニンに含まれる、シアニジン-3-O-グルコシド(以下C3Gと略記)、シアニジン-3-O-ルチノシド(以下C3Rと略記)、デルフィニジン-3-O-グルコシド(以下D3Gと略記)、デルフィニジン-3-O-ルチノシド(以下D3Rと略記)などが挙げられる。特にこの4種類のアントシアニンにおける酵素反応の特異性は見られなかったので、他のアントシアニンに対しても同様の酵素反応性があるものと思われる。
【0010】
本発明に用いる糖は、一般式Cn(H2O)mという一般式を有する化合物であり、糖転移酵素によってアントシアニンにD−グルコース残基を等モル以上α結合できるものであればよい。α−グルコシル結合を有する糖類であり、例えばマルトオリゴ糖、デキストリン、シクロデキストリン、アミロース、アミロペクチン、澱粉質、澱粉分解物および加工澱粉などが使用できる。
【0011】
本発明に用いる糖転移酵素は、糖の種類に応じて適宜選択することになる。またアントシアニンを分解するものであってはならない。
例えば糖としてマルトース、マルトトリオース、マルトテトラオースなどのマルトオリゴ糖、またはDE10乃至70の澱粉部分加水分解物などを使用する場合には、α−グルコシダーゼ(EC3.2.1.20)を使用する。糖としてデキストリン、シクロデキストリンまたはDE1以下の澱粉糊化物からDE約60の澱粉部分加水分解物を使用する場合には、シクロマルトデキストリングルカノトランスフェラーゼ(EC2.4.1.19)を使用する。糖としてDE1以下の澱粉糊化物からDE約30のデキストリン、澱粉部分加水分解物などを使用する場合には、α−アミラーゼ(EC3.2.1.1)を使用する。
α−グルコシダーゼはブタの肝臓、ソバの種子などの動植物組織由来の酵素、または、ムコール(Mucor)属、ペニシリウム(Penicil l ium)属などに属するカビ、またはサッカロミセス(Sacch a romyces)属などに属する酵母などの微生物を栄養培地で培養し得られる培養物由来の酵素が、シクロマルトデキストリングルカノトランスフェラーゼは、バチルス(Bacillus)属、クレブシーラ(Klebsiella)属などに属する細菌培養物由来の酵素が、α−アミラーゼはバチルス属などに属する細菌、または、アスペルギルス(Aspergillus)属などに属するカビ培養由来の酵素などが適宜選択できる。
これらの糖転移酵素は、アントシアニンをα−グリコシル化する活性が検出されれば、必ずしも精製された酵素である必要はない。未精製の細菌培養物または精製段階の粗酵素であっても、本発明の製造方法に使用し得る。これらの酵素は、当該分野で公知の方法に従って細菌の培養液から生成され得る。これらの酵素は、市販のものであってもよい。
【0012】
酵素反応時の各種条件は、糖転移酵素が作用してα−グリコシルアントシアニンが効率よく生成できる範囲であれば特に限定されるものではない。
反応時の温度とpHとしては、糖転移酵素が作用してα−グリコシルアントシアニンが生成すればよく、通常10乃至50℃、pH3乃至7から選ばれる。
酵素量と反応時間としては、経済性の点から、通常は約3乃至24時間で反応を終了するように酵素量が選ばれる。
反応に際しては、アントシアニンをできるだけ高濃度に含有させて反応させるのが工業的に有利である。
例えば、約0.1(w/v)%以上、望ましくは約0.2乃至2.0(w/v)%のアントシアニンと適量の糖とを含有するアントシアニン高含有液をpH4乃至6とする。アントシアニンは中性から塩基性領域に長時間放置すると分解することが知られており、さらに加温により分解が促進されることが知られているので、アントシアニンが分解せず、糖転移酵素の作用しうるだけの低温、具体的には約20乃至40℃に維持し、これに糖転移酵素を作用させると、アントシアニンにグルコースが等モル以上結合したα−グリコシルアントシアニンが高濃度に生成される。
この際、反応溶液中のアントシアニンは分解しやすいので、これを防ぐため、できるだけ遮光、嫌気下に維持するのが望ましい。
【0013】
このようにして得られた反応液は、通常は複数のα−グリコシルアントシアニンを含有するものであり、例えばそのままα−グリコシルアントシアニン含有組成物として使用することができる。あるいは特定の種類のα−グリコシルアントシアニンのみを分離・精製して単一の高純度製品として使用することもできる。
本発明のα−グリコシルアントシアニンを生成せしめた反応液の精製法は、反応液を例えば、カラムクロマトグラフ法以外にも、必要に応じて他のクロマトグラフ法、樹脂吸着法や膜分離法などを適宜組み合わせて行うことが可能である。中でも、ODSシリカゲルを用いたクロマトグラフ法が最も好ましい。また、必要に応じて予め陽イオン交換樹脂などにアントシアニン成分を吸着させた後、溶出させることにより、予備精製を行ったものを同様に精製してもよい。
【0014】
本明細書においてアントシアニン含有量は、WO01/01798号公報に記載してあると同様に、含まれるアントシアニンの各成分の含有量を合計したものであり、HPLCによるアントシアニンのピーク面積比によって算出する。
すなわち、最初に、重量既知のアントシアニン標品をHPLCで分析し、520nmにおけるピーク面積から検量線を作成し、各アントシアニン成分の含量を求める。さらに、各成分の含量をピーク面積で除した応答係数、即ちmg/ピーク面積を得る。次に、アントシアニン含有サンプルをHPLC分析し、それぞれの成分のピーク面積に標品から求めた応答係数を乗じて、それぞれの成分含有量を計算し、注入量との比からアントシアニン含有量を重量(w/w)%として求める。
糖転移反応により生成されたα−グリコシルアントシアニンの各成分の含有量は、上記と同様にHPLC分析を行い、得られたピーク面積を反応基質として供されたアントシアニンより作成された検量線に当てはめて、基質アントシアニン当量として算出する。
本発明のα−グリコシルアントシアニン含有組成物中の固形分当たりのα−グリコシルアントシアニンの含有量は、上記の算出方法によって得られたα−グリコシルアントシアニンの各成分の含有量の合計の固形分当たりの割合を意味する。そして組成物中のα−グリコシルアントシアニンの含有量は反応条件により異なるが、固形分当たり0.05〜90質量%含有させることが可能であり、実用的にも好ましい。
【0015】
本発明のα−グリコシルアントシアニンあるいはこれらを含有する組成物は、試験例1及び試験例2で開示しているように、優れた保存安定性を有するとともに、抗酸化能も向上している。したがって各種飲食品に適宜配合して使用することができる。あるいは抗酸化剤として油性飲食品の酸化防止等に利用できる。また今後各種の生理活性物質としての利用も期待される。
【実施例】
【0016】
以下、本発明を製造例及び試験例によりさらに具体的に説明するが、本発明はこれらによりなんら限定されるものではない。
【0017】
製造例1 カシス抽出物の調製
市販のカシス濃縮果汁を水で希釈し、Bx.10になるように調製した。この希釈果汁を濾紙で濾過して固形物を除去した後、荷電型逆浸透膜(日東電工社製:商品名NTR−7410)により膜分離を行った。濃縮液が循環しなくなるまで分離を実施し、再度水を添加して希釈した後、再度分離を継続し、濃縮液が循環しなくなった段階で分離を終了した。濃縮液をスプレードライして粉末状のカシス抽出物(アントシアニン含有量22.3重量%)を得た。得られたカシス抽出物を下記の試験例において、アントシアニンとして使用し、本発明の組成物のアントシアニン安定化作用の指標として、アントシアニンの残存量の評価を行い、アントシアニン残存率を算出した。
【0018】
実施例1 α−グリコシルアントシアニン含有組成物の調製
デキストリン1重量部を100mM酢酸緩衝液(pH6)98重量部に混合し加温溶解させ冷却後、製造例1で得られたカシス抽出物1重量部を混合し、これにバチルス・マセランス(Bacillus macerans)由来のシクロマルトデキストリングルカノトランスフェラーゼ(EC2.4.1.19)(天野エンザイム株式会社製)をデキストリングラム当たり300単位加え、pH5、20℃に維持し攪拌しつつ、遮光下で23時間反応させた。反応液をHPLC分析したところ、アントシアニンの約25%がα−グリコシルアントシアニンに転換していた。反応液に10%蟻酸を10重量部加え酵素を失活させ、α−グリコシルアントシアニン含有組成物を得た(実施例1)。
比較例として、上記のシクロマルトデキストリングルカノトランスフェラーゼを加える代わりに、シクロマルトデキストリングルカノトランスフェラーゼを加えずに他は実施例と同様にしてサンプルを得た(比較例1)。
【0019】
実施例2 α−グリコシルアントシアニンの分析
実施例1で得られたα−グリコシルアントシアニン含有組成物を下記の条件でLCMS分析を行った。分析の結果、観測されたイオンのm/zを表1に示す。
LCMS測定の詳細
装置 HP1100シリーズ(Hewlett Packard社製)
カラム Capcell pak UG120(資生堂)
カラム温度 40℃
移動相 A:5%蟻酸
B:アセトニトリル
グラジエント条件 時間
(分) %A %B
0.0 95.0 5.0
20.0 20.0 80.0
25.0 20.0 80.0
25.1 95.0 5.0
35.0 95.0 5.0
流速 0.2ml/分
イオン化法 ESI
測定モード ポジティブモード
走査範囲(m/z) 200〜1000
キャピラリー温度 350℃
キャピラリー電圧 4000V
ネブライザー 40psi
【0020】
【表1】

【0021】
製造例1由来の、反応基質として供されたアントシアニン成分であるD3G、D3R、C3G、C3Rはそれぞれ保持時間16.5分にm/z465、17.5分にm/z611、18.8分にm/z449、19.4分にm/z595のイオン化分子(M+)として検出された。保持時間16.4分にイオン化分子(M+)と考えられるイオンがm/z789、m/z627に観測され、それぞれ分子量は789、627と推測され、D3Gのα−マルトシル体(グルコース残基が2倍量モル結合したもの)、α−グルコシル体(グルコース残基が等モル結合したもの)であると推定された。保持時間17.2分にイオン化分子(M+)と考えられるイオンがm/z93 5、m/z773に観測され、それぞれ分子量は93 5、773と推測され、D3Rのα−マルトシル体、α−グルコシル体であると推定された。保持時間18.5分にイオン化分子(M+)と考えられるイオンがm/z93 5、m/z773、m/z611に観測され、それぞれ分子量は93 5、773、611と推測され、C3Gのα−マルトトリオシル体(グルコース残基が3倍量モル結合したもの)、α−マルトシル体、α−グルコシル体であると推定された。保持時間19.1分にイオン化分子(M+)と考えられるイオンがm/z919、m/z757に観測され、それぞれ分子量は919、757と推測され、C3Rのα−マルトシル体、α−グルコシル体であると推定された。
上記結果から、カシス抽出物中の4種のアントシアニン、D3G、D3R、C3G、C3R由来のα−グルコシルアントシアニン、α−マルトシルアントシアニン、α−マルトトリオシルアントシアニンなどのα−グリコシルアントシアニンが生成されていることが推定された。
また実施例1で得られたα−グリコシルアントシアニン含有組成物中の固形分当たりのα−グリコシルアントシアニンの含有量は7.5%であった。
【0022】
実施例3 C3Rのα−グリコシル体の調製
デキストリン1重量部を100mM酢酸緩衝液(pH6)98重量部に混合し加温溶解させ冷却後、C3R(常磐植物化学研究所製)1重量部を混合し、これにバチルス・マセランス(Bacillus macerans)由来のシクロマルトデキストリングルカノトランスフェラーゼ(EC2.4.1.19)(天野エンザイム株式会社)をデキストリングラム当たり300単位加え、pH5、20℃に維持し攪拌しつつ、遮光下で18時間反応させた。反応液をHPLC分析したところ、C3Rの約25%がα−グリコシルC3Rに転換していた。反応液に10%蟻酸を10重量部加え酵素を失活させた。
本反応液をDevelosil ODS-HG-5カラム(野村化学社製、ID4.6ラ250mm、5・香jを用い、下記溶出条件で分画、精製した。
カラム温度 40℃
移動相 A:5%蟻酸
B:アセトニトリル
グラジエント条件 時間
(分) %A %B
0.0 93.0 7.0
15.0 85.0 15.0
15.1 20.0 80.0
20.0 20. 0 80.0
20.1 93.0 7.0
25.0 93.0 7.0
流速 1.0ml/分
検出器 520nm
保持時間が14.3−14.8分のα−グリコシルC3R画分を採取した。分取作業を繰り返し実施し、回収したα−グリコシルC3R画分を固相抽出カートリッジOasis HLB Extraction Cartridge(Waters社製)に吸着させた。10%蟻酸を通液、洗浄してグルコースなどの夾雑物を除去した後、10%蟻酸を含むアセトン溶液を通液しα−グリコシルC3R画分を溶出、採取し、減圧濃縮した。HPLC分析により単一ピークであることを確認し、精製α−グリコシルC3R画分を調製することが出来た。
【0023】
実施例4 α−グリコシルC3Rの分析
実施例3で得られたα−グリコシルC3RのNMR分析を行った。装置はBruker Avance 500 NMR spectrometer (Bruker Biospin社製)を使用し、観測周波数を1H:500.13MHz、13C:125.77MHzとし、測定溶媒は重メタノール/重トリフルオロ酢酸(19/1(v/v))を用いた。内部標準として、TMS(tetramethylsilane)を用いた。
結果は表2にまとめた。
【0024】
【表2】

【0025】
表2の結果から、グルコース残基の4位の炭素にのみ、大きなケミカルシフト変化が見出されたことから、糖転移したグルコースの結合は、C3Rの糖部分ルチノース残基のうち、グルコース残基の4位の炭素の水酸基にエーテル結合しているものと判断される。
本結果と実施例2の結果から、アントシアニンと糖とを含有する溶液にシクロマルトデキストリングルカノトランスフェラーゼを作用させて生成されるアントシアニジン3-0-グルコシドにグルコース残基が等モル以上結合したα−グリコシルアントシアニンは式[1]で 、アントシアニジン3-0-ルチノシドにグルコース残基が等モル以上結合したα−グリコシルアントシアニンは式[2]で示される。nは結合したグルコース残基の数を表しており、0〜15から選ばれる整数で示される構造を有しているものと判断される。すなわち、α−グルコシル体の場合はn=0、α−マルトシル体の場合はn=1、α−マルトトリオシル体の場合はn=2である。さらにnが3〜15のα−グリコシルアントシアニンが生成しているものと推定される。
【0026】
試験例1 α−グリコシルアントシアニン含有組成物の抗酸化能評価(ORAC法)
実施例1で得られたα−グリコシルアントシアニン含有組成物の抗酸化能を評価するにあたり、ORAC法を用いてビタミンE様物質Trolox(6-Hydroxy-2,5,7,8-tetrametylchroman-2-carboxylic acid)をスタンダードとし、ラジカルによる蛍光退色の防止作用を指標に抗酸化能を評価した。
実施例1で得られたα−グリコシルアントシアニン含有組成物および比較例1のサンプルをアセトン・水・酢酸混液で抽出後、75mMリン酸カリウム緩衝液(pH7.4)で適宜希釈した。コントロールには、バッファーを用いた。
ラジカルによる酸化耐性を定量するための濃度既知スタンダードとして、ビタミンE様物質Troloxを上記バッファーで希釈し、2.5・、5・、10・溶液を調製した。96穴培養プレートに同Trolox溶液及び希釈サンプルをそれぞれ50・/穴加えた。ここに、上記バッファーで126 nMに調製したフルオレセイン溶液を100・/穴加えた。なお、ブランクとして緩衝液のみ150・/穴加えた。
蛍光プレートリーダーで37℃、15分間プレインキュベーションを行い、この間、485 nmの波長で励起し、538 nmの波長で検出を行った。15分後、ラジカルとして、上記バッファーで51.2 mMに調製したAAPH (2,2’-Azobis (2-amidinopropane) dihydrochloride)を50・ずつ全穴に加えた。再度、蛍光プレートリーダーにより、上記波長で37 ℃、70分間、経時的に測定を行った。スタンダード及びサンプルのそれぞれの測定値からブランクの測定値を引き、試料1gあたりのTroloxのマイクロモル数(μmole TE/g)に換算し、抗酸化能を評価した。
結果は表3に示した。実施例1、比較例1ともに、抗酸化能を示した。比較例1に比べて実施例1は高い抗酸化能を示すことが認められた。
【0027】
【表3】

【0028】
試験例2 α−グリコシルアントシアニン含有組成物の37℃における保存安定性
実施例1で得られたα−グリコシルアントシアニン含有組成物および比較例1のサンプ
ルの一部を採取し、5N水酸化ナトリウム溶液でpH4およびpH5に調整した。pH未調整の溶液(pH3)、pHを調整した各溶液(pH4およびpH5)を37℃の4週間の安定性試験に供した。アントシアニンの含有量はHPLC分析により算出し、保存前のアントシアニン含有量を100としたアントシアニン残存率を算出した。
結果を図1、2、3に示す。各pHにおいて、比較例1に比べ実施例1は残存率が高かった。特に、pH3では、比較例1の残存率は26%に対し、実施例1の残存率は35%であった。
【特許請求の範囲】
【請求項1】
アントシアニンにD−グルコース残基が等モル以上α結合しているα−グリコシルアントシアニン。
【請求項2】
式[1]あるいは式[2]で表される4G−α−D−グリコシルアントシアニン。
【化1】

(式中、nは0〜15の整数を表す。
またR1及びR2が以下の組み合わせである。
R1 R2
――――――――――
OH H
OH OH
H H
OCH3 H
OCH3 OH
OCH3 OCH3 )
【請求項3】
アントシアニンと糖とを含有する溶液に糖転移酵素を作用させてα−グリコシルアントシアニンを生成せしめ、これを採取することを特徴とする、アントシアニンにD−グルコース残基が等モル以上α結合しているα−グリコシルアントシアニンの製造方法。
【請求項4】
アントシアニンが、下記の成分(1)〜(2)の1種以上を含有するものである請求項3記載の製造方法。
(1)アントシアニジン3-0-グルコシド
(2)アントシアニジン3-0-ルチノシド
【請求項5】
アントシアニジンがシアニジン、デルフィニジン、ペラルゴニジン、ペオニジン、ペチュニジン、マルビジンから選択される1種以上である請求項4記載の製造方法。
【請求項6】
糖がα−グルコシル結合を有する糖類である請求項3記載の製造方法。
【請求項7】
α−グルコシル結合を有する糖類が、マルトオリゴ糖、デキストリン、シクロデキストリン、アミロース、アミロペクチン、澱粉質、澱粉分解物および加工澱粉から選択される1種以上である請求項6記載の製造方法。
【請求項8】
糖転移酵素が、シクロマルトデキストリングルカノトランスフェラーゼ(EC2.4.1.19)、α−アミラーゼ(EC3.2.1.1)、α−グルコシダーゼ(EC3.2.1.20)から選択される1種以上である請求項3記載の製造方法。
【請求項9】
請求項3〜8記載の製造方法によって得られたα−グリコシルアントシアニン。
【請求項10】
請求項3〜8記載の製造方法によって得られた、α−グリコシルアントシアニンを固形分当たり0.05〜90質量%含有してなるα−グリコシルアントシアニン含有組成物。
【請求項11】
請求項1、2又は請求項9記載のα−グリコシルアントシアニン、あるいは請求項10記載の組成物を含有せしめた飲食品。
【請求項12】
請求項1、2又は請求項9記載のα−グリコシルアントシアニン、あるいは請求項10記載の組成物を含有せしめた酸化防止剤。
【請求項1】
アントシアニンにD−グルコース残基が等モル以上α結合しているα−グリコシルアントシアニン。
【請求項2】
式[1]あるいは式[2]で表される4G−α−D−グリコシルアントシアニン。
【化1】

(式中、nは0〜15の整数を表す。
またR1及びR2が以下の組み合わせである。
R1 R2
――――――――――
OH H
OH OH
H H
OCH3 H
OCH3 OH
OCH3 OCH3 )
【請求項3】
アントシアニンと糖とを含有する溶液に糖転移酵素を作用させてα−グリコシルアントシアニンを生成せしめ、これを採取することを特徴とする、アントシアニンにD−グルコース残基が等モル以上α結合しているα−グリコシルアントシアニンの製造方法。
【請求項4】
アントシアニンが、下記の成分(1)〜(2)の1種以上を含有するものである請求項3記載の製造方法。
(1)アントシアニジン3-0-グルコシド
(2)アントシアニジン3-0-ルチノシド
【請求項5】
アントシアニジンがシアニジン、デルフィニジン、ペラルゴニジン、ペオニジン、ペチュニジン、マルビジンから選択される1種以上である請求項4記載の製造方法。
【請求項6】
糖がα−グルコシル結合を有する糖類である請求項3記載の製造方法。
【請求項7】
α−グルコシル結合を有する糖類が、マルトオリゴ糖、デキストリン、シクロデキストリン、アミロース、アミロペクチン、澱粉質、澱粉分解物および加工澱粉から選択される1種以上である請求項6記載の製造方法。
【請求項8】
糖転移酵素が、シクロマルトデキストリングルカノトランスフェラーゼ(EC2.4.1.19)、α−アミラーゼ(EC3.2.1.1)、α−グルコシダーゼ(EC3.2.1.20)から選択される1種以上である請求項3記載の製造方法。
【請求項9】
請求項3〜8記載の製造方法によって得られたα−グリコシルアントシアニン。
【請求項10】
請求項3〜8記載の製造方法によって得られた、α−グリコシルアントシアニンを固形分当たり0.05〜90質量%含有してなるα−グリコシルアントシアニン含有組成物。
【請求項11】
請求項1、2又は請求項9記載のα−グリコシルアントシアニン、あるいは請求項10記載の組成物を含有せしめた飲食品。
【請求項12】
請求項1、2又は請求項9記載のα−グリコシルアントシアニン、あるいは請求項10記載の組成物を含有せしめた酸化防止剤。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2011−51933(P2011−51933A)
【公開日】平成23年3月17日(2011.3.17)
【国際特許分類】
【出願番号】特願2009−202451(P2009−202451)
【出願日】平成21年9月2日(2009.9.2)
【出願人】(000006091)明治製菓株式会社 (180)
【Fターム(参考)】
【公開日】平成23年3月17日(2011.3.17)
【国際特許分類】
【出願日】平成21年9月2日(2009.9.2)
【出願人】(000006091)明治製菓株式会社 (180)
【Fターム(参考)】
[ Back to top ]

