α−2−アドレナリンアゴニスト成分を含有する組成物
【課題】α2アドレナリンアゴニスト成分の有効性を高める。
【解決手段】α2アドレナリンアゴニスト成分の有効性を高めるのに有用な組成物は、担体成分、α2アドレナリンアゴニスト成分、α2アドレナリンアゴニスト成分の可溶化を促進する溶解度向上成分を含有する。一態様において、α2アドレナリンアゴニスト成分はα2アドレナリンアゴニストを包含する。他の一態様において、溶解度向上成分はポビドンまたはポリビニルアルコールを包含する。
【解決手段】α2アドレナリンアゴニスト成分の有効性を高めるのに有用な組成物は、担体成分、α2アドレナリンアゴニスト成分、α2アドレナリンアゴニスト成分の可溶化を促進する溶解度向上成分を含有する。一態様において、α2アドレナリンアゴニスト成分はα2アドレナリンアゴニストを包含する。他の一態様において、溶解度向上成分はポビドンまたはポリビニルアルコールを包含する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、α−2−アドレナリンアゴニスト成分を含有する組成物に関する。本発明は特に、α−2−アドレナリンアゴニスト成分が、処置有効濃度において向上した溶解度を有する組成物に関し、ここで、αアドレナリン成分を含有する溶液は、与えられたpHおよび濃度において、より酸性のpHおよびより高い濃度でαアドレナリン成分を含有する第2の溶液と実質的に同様の有効性を示す。
【背景技術】
【0002】
α−2−アドレナリンアゴニスト成分は、α−2−アドレナリン受容体に対して作用するまたは結合して処置効果を与えるのに有効な、化合物、イオン、複合体等のような化学物質を包含する。本発明において「α−2−アドレナリンアゴニスト成分」なる用語は、アゴニスト自体、およびあらゆるその先駆物質、塩、エステル、代謝物および組合せを意味する。
【0003】
α−2−アドレナリンアゴニスト成分を含有する組成物を調製する際の課題の1つは、そのような成分をより有効にすることである。例えば、液体組成物中のα−2−アドレナリンアゴニスト成分は、そのような組成物の液体担体に溶解性であることによって有益である場合が多い。そのような溶解性は、均質かつ正確な投与を助長する。
【0004】
さらに、ディスペンスまたは投与されたα−2−アドレナリンアゴニスト成分は、例えば、細胞膜または脂質二重層を通過する効果的なまたは増加した生体内拡散のために、生物学的系または環境において溶解性であるのが有利である。より高いpKa(約7より高いpKa)を有するいくつかのα−2−アドレナリンアゴニスト成分(例えばブリモニジンを包含する)は、そのような環境中の溶液にあるとき、中性ないしアルカリ性の生物学的環境では主に非荷電であるから、そのpKaに近いかまたはより高いpH値において脂質膜を通って極めてよく分散する傾向がある。この高いpHではより疎水性であるので、より細胞膜に浸透し易い。
【0005】
しかし、約7を越えるpHでは、対抗因子が生じる。そのような同じα−2−アドレナリンアゴニスト成分のいくつかは、中性ないしアルカリ性生物学的pH値の水溶液中では溶解性が低下する傾向を示す。そのような水溶性低下は、処置効果をもたらすために細胞膜に浸透する溶液中の利用可能な活性剤が少なくなることを意味する。すなわち、可溶性化合物がその非荷電状態の故に細胞膜により浸透し易くなるとしても、処置効果提供のために溶液中に存在する該成分は少なくなる。すなわち、約7.0を越えるpHでα−2−アドレナリンアゴニスト成分が沈殿することにより、α−2−アドレナリンアゴニスト成分の有効性が低下し、および/または一定用量での処置効果の変動が大きくなりうるという恐れがある。
【0006】
さらに、可溶化されたα−2−アドレナリンアゴニスト成分は、不溶性α−2−アドレナリンアゴニスト成分に優る他の利点をも提供し、その例は、α−2−アドレナリンアゴニスト成分と相互作用する組織の刺激の軽減である。
【0007】
α−2−アドレナリンアゴニストの1つであるブリモニジンは、眼用0.2%水溶液としてALPHAGAN(登録商標)の名称で市販されている。この溶液は0.2%ブリモニジンタートレートを含有し、0.05%塩化ベンザルコニウムを保存剤として含有するクエン酸緩衝液中にpH6.5で製剤化されている。
【0008】
ブリモニジンはまた、眼用0.15%溶液としてALPHAGAN P(登録商標)の名称でも市販されている。この溶液はpH7.2で製剤化され、カルボキシメチルセルロースおよび0.005%の安定化オキシクロロ保存剤(PURITE、登録商標)を含有する。
【0009】
Katzら、J. Glaucoma 11:119(2002年4月)、Twelve-Month Evaluation of Brimonidine Purite Versus Brimonidine in Patients with Glaucoma or Ocular Hypertensionには、眼圧降下のために局所投与した場合、0.15%ブリモニジンと保存剤PURITE(登録商標)を含有する製剤は、0.2%ブリモニジンを含有する製剤と同様の効果を示すことが開示されている。該文献を引用により本発明の開示の一部とする。
【発明の概要】
【発明が解決しようとする課題】
【0010】
高い有効性を持ちながら副作用(全身的副作用を包含する)の発生は少ないα−2−アドレナリンアゴニスト成分を含有する新規組成物が依然として必要とされている。
【課題を解決するための手段】
【0011】
本発明は、活性剤をより効果的に標的細胞または組織にデリバーすることのできる新規α−2−アドレナリンアゴニスト成分含有組成物を見出したことに基づく。この有効性向上には、溶解性と中性またはアルカリ性pHとの2つの因子が寄与しうる。本発明においてpH値は室温で測定される値であると理解される。
【0012】
一態様において、本発明の組成物は、組成物、および好ましくは、組成物を投与または導入する環境(例えばヒトの眼のような生物学的環境)におけるα−2−アドレナリンアゴニスト成分の可溶化を少なくとも促進または補助するのに有効なある種の物質を含有する。好ましくは、本発明によるα−2−アドレナリンアゴニスト成分の水溶性は、標的細胞または組織への処置効果の、確実で一貫性のある提供を促進する。
【0013】
他の一態様においては、本発明は、α−2−アドレナリンアゴニスト成分を含有する水溶液であって、約7.0を越えるpH、好ましくはpH約7.0〜8.5、より好ましくはpH約7.2〜8.2または7.2、より一層好ましくはpH約7.5〜8.0または7.7を持つものに関する。この態様において、水溶液は場合により、α−2−アドレナリンアゴニスト成分の可溶化を少なくとも促進または補助するのに有効な物質または物質混合物を含有しうる。あるいは、溶液はそのような外部からの可溶化物質を含まず、前記pH値を有する水溶液中の可溶性α−2−アドレナリンアゴニスト成分を含有するか、またはそれから本質的に成っていてよい。この態様において、中性またはアルカリ性のpHが、より容易なα−2−アゴニスト成分の細胞膜通過を可能にする。
【0014】
すなわち、可溶性α−2−アドレナリンアゴニスト成分のpHが約7.0を越える場合、脂質膜を通過しての該成分の輸送が促進される。また、αアドレナリン成分が可溶である故に、α−2−アドレナリンアゴニスト用量が信頼性および再現性を持つようになる。
【0015】
ある種のα−2−アドレナリン成分は望ましくない副作用を有することが知られている。例えば、クロニジンおよびチザニジンは、全身的投与により、呼吸器および心血管抑制ならびに鎮静作用を示すことがわかっている。したがって、通常用いられるよりも少ない有効用量で有効性を維持することのできるα−2−アドレナリンアゴニスト製剤は明らかに有利である。
【0016】
本発明の他の一態様においては、保存剤を含有するα−2−アドレナリンアゴニスト成分含有組成物は、実質的な利点を提供することがわかった。その利点とは例えば、α−2−アドレナリンアゴニスト成分との、および/または組成物投与対象患者との望ましくない相互作用を低減しながら、保存剤の有効性を維持するということである。好ましくは、αアドレナリン成分はブリモニジンである。
【0017】
本発明の組成物は好ましくは、従来のα−2−アドレナリンアゴニスト成分の有効性を向上または維持し、かつ従来の製剤にはなかった更なる利点を提供する。このことは、α−2−アドレナリンアゴニスト成分を水溶液中に維持し、なおかつ約7.0を越えるpH、好ましくはpH約7.0〜8.5、より好ましくはpH約7.2〜8.2または7.2、より一層好ましくはpH約7.5〜8.0またはpH約7.7を保つことによって達成される。α−2−アドレナリンアゴニスト成分の膜透過性を高めることによって、投与製剤中のα−2−アゴニスト(特にブリモニジンであるが、これに限定されない)の濃度を低下することができ、それによって全身的副作用を軽減することができる(特に製剤を全身的投与する場合)。
【0018】
本発明のいくつかの態様の範囲内において、局所眼用製剤中のブリモニジン(その薬学的に許容しうる塩、例えばタートレートを包含する)の濃度を0.2%(w/v)未満(好ましくは約0.01〜0.1%(w/v))に低下して、pH約6.6〜6.8の0.2%ブリモニジンタートレート製剤であるALPHAGAN(登録商標)と同じかまたは実質的に同等の効果を保つことができる。他の一態様においては、約7.0を超えるpH(好ましくはpH約7.2〜7.7)でブリモニジン濃度を好ましくは約0.01〜0.15%(w/v)としても、2製剤間に有効性の実質的な相異はない。
【0019】
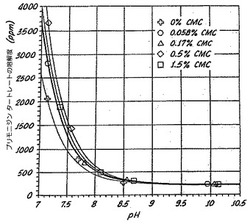
図1に示すように、代表的なα−2−アドレナリンアゴニストである5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンタートレートの溶解度は、水溶液のpHの上昇につれて低下する。5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンのpKaは約7.4である。溶液をよりアルカリ性にすると、溶液中の大多数の分子が電気的に中性となり、従ってより疎水性となる。
【0020】
図1に示すように、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンの異なる溶液はすべて、pH上昇につれて溶解度が低下するという共通の傾向を示す。十字形でプロットした曲線は、カルボキシメチルセルロース(CMC)を加えていない活性剤含有水溶液のものである。上記のような溶液は本発明のある種の態様の範囲内のものである。
【0021】
一態様において、α−2−アドレナリンアゴニスト成分の有効性を、α−2−アドレナリンアゴニスト成分の溶解度の向上によって、好ましくは中性よりも高いpH値で向上する。本発明のこの態様において、本発明は、α−2−アドレナリンアゴニスト成分に加えて、溶解度向上成分(SEC)を、α−2−アドレナリンアゴニスト成分の溶解度を与えられたpHで向上するのに有効な量で含有する。このようなSECは、好ましくはアニオン性であり、より好ましくはポリマーである。一態様において、SECはセルロース誘導体であり、他の一態様においてSECはセルロース誘導体またはシクロデキストリンではない。
【0022】
本発明のこの態様において、α−2−アドレナリンアゴニスト成分は、本発明の組成物(例えばpHが約7またはそれ以上のもの)において、SEC不含有の実質的に同じ組成物におけるよりも溶解度が高い。他の一態様において、本発明の組成物のα−2−アドレナリンアゴニスト成分は、SEC不含有の同様の組成物中のα−2−アドレナリンアゴニスト成分と比較して、組成物を投与する中性またはアルカリ性の生物学的環境における溶解度がより高い。この後者の性質は、α−2−アドレナリンアゴニスト成分をその作用部位に局所的にデリバーする場合に特に顕著である。
【0023】
本発明において使用するα−2−アドレナリンアゴニスト成分は、イミノ−イミダゾリン、イミダゾリン、イミダゾール、アゼピン、チアジン、オキサゾリン、グアニジン、カテコールアミン、それらの生物学的適合性塩およびエステル並びに混合物を包含する。好ましくは、α−2−アドレナリンアゴニスト成分は、キノキサリン成分を包含する。キノキサリン成分は、キノキサリン、その生物学的適合性塩、エステル、他の誘導体等、およびそれらの混合物を包含する。キノキサリン誘導体の非制限的な例は、(2−イミダゾリン−2−イルアミノ)キノキサリン、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリン、およびそれらの生物学的適合性塩およびエステル、好ましくは、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンのタートレート等、およびそれらの混合物である。以下、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンのタートレートは、「ブリモニジンタートレート」と称する。
【0024】
好ましい態様において、先に挙げたようなα−2−アドレナリンアゴニスト成分は、1つまたはそれ以上の他のアドレナリン受容体における活性との関連で、α−2A−アドレナリン受容体、α−2B−アドレナリン受容体および/またはα−2D−アドレナリン受容体に選択的である。好ましくは、α−2−アドレナリンアゴニスト成分は、α−1−アドレナリン受容体におけるその活性と比較して、α−2A−アドレナリン受容体、α−2B−アドレナリン受容体および/またはα−2D−アドレナリン受容体に選択的である。
【0025】
一態様において、α−2−アドレナリンアゴニスト成分は、本発明の組成物中において少なくとも約30%が非荷電であり、好ましくは少なくとも約50%が非荷電である。当業者は理解するであろうが、pKaはイオン化定数の負の対数(または化合物が50%イオン化されるときのpH)であり、本願において非荷電の化合物の割合を示すときは(例えば、少なくとも30%または50%非荷電、のように)、化学量論量基準での化合物について示す。
【0026】
より一層好ましくは、可溶性α−2−アドレナリンアゴニスト成分はまた、組成物を投与する生物学的環境において少なくとも約30%非荷電または少なくとも約50%非荷電である。
【0027】
α−2−アドレナリンアゴニスト成分をSECと共に製剤化する場合、SECは、非イオン性またはポリアニオン性成分を包含しうる。本明細書において使用する「ポリアニオン性成分」という用語は、化学物質、例えば、イオン荷電された種、例えば、複数の孤立(discrete)アニオン電荷を有するイオン荷電ポリマー物質を意味する。非イオン性SECは、ポリビニルアルコール(PVA)、ポリビニルピロリドン(ポビドン)並びに種々のガムおよび他の非イオン性剤を包含しうる。
【0028】
好ましい態様において、SECは、複数のアニオン電荷を有するポリマー物質およびその混合物から選択しうるポリアニオン性成分である。
【0029】
特に有用なポリアニオン性成分は、アクリル酸から誘導するアニオン性ポリマー(アクリル酸、アクリレート等、およびそれらの混合物から誘導するポリマーを包含する)、メタクリル酸から誘導するアニオン性ポリマー(メタクリル酸、メタクリレート等、およびそれらの混合物から誘導するポリマーを包含する)、アルギン酸から誘導するアニオン性ポリマー(アルギン酸、アルギネート等、およびそれらの混合物から誘導するポリマー包含する)、アミノ酸から誘導するアニオン性ポリマー(アミノ酸、アミノ酸塩等、およびそれらの混合物のポリマーを包含する)等、およびそれらの混合物から選択する。非常に効果的なポリアニオン性成分は、アニオン性セルロース誘導体およびそれらの混合物、特にカルボキシメチルセルロースおよびその誘導体から選択する。
【0030】
好ましくは、ポリアニオン性成分は、α−2−アドレナリン成分の溶解性と相互作用するかもしくは該溶解性に影響を及ぼすか、または該溶解性を高めるのに充分にアニオン性である。この相互作用は、α−2−アドレナリン成分を、処置に有効な濃度において実質的に充分に可溶性にするのに充分であるのが好ましい。組成物におけるSECの量は、好ましくは約0.1〜30%(w/v)、より好ましくは約0.2〜10%(w/v)、さらに好ましくは約0.2〜0.6%(w/v)である。
【0031】
組成物は、担体成分、例えば水性液体担体成分をも含有しうる。一態様において、組成物のpHは約7.0を越え、好ましくは約7.0〜8.5、より好ましくは約7.2〜8.2、より一層好ましくは約7.5〜8.0である。また、本発明の組成物は好ましくは眼科学的に許容しうる。
【0032】
他の好ましい一態様において、組成物を投与する患者に少なくとも1つの処置利益を与えるのに有効な量のα−2−アドレナリンアゴニスト成分、α−2−アドレナリンアゴニスト成分の溶解度を向上させるのに有効な量のアニオン性セルロース誘導体、および水性液体担体成分を含有する組成物を提供する。α−2−アドレナリンアゴニスト成分は、好ましくは、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンのタートレートを含んで成る。アニオン性セルロース誘導体は、好ましくは、カルボキシメチルセルロースを含んで成る。組成物におけるアニオン性セルロース誘導体の濃度は、約0.2〜0.6%(w/v)でなければならない。
【0033】
本発明の組成物の好ましい態様において、組成物は5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンまたはその塩もしくはエステルを含有する。該α−2−アドレナリンアゴニストの濃度は、0.2%未満、好ましくは0.2〜約0.001%(w/v)、より好ましくは約0.15%(w/v)またはそれ以下、より一層好ましくは0.15〜約0.001%(w/v)、最も好ましくは約0.1%(w/v)またはそれ以下である。
【0034】
また、本発明の組成物の好ましい態様は、中性またはアルカリ性pHの水溶液を含んで成る。組成物のpHは好ましくは室温で約7.0もしくはそれ以上、または室温で約7.2もしくはそれ以上、より好ましくは室温で約7.5もしくはそれ以上、最も好ましくは室温で約7.7もしくはそれ以上である。
【0035】
好ましい態様において、本発明の組成物は眼科学的に許容し得、例えば、該組成物は、組成物を投与するヒトまたは動物の眼を実質的に害しうる有害なまたは毒性の性質を有さない。
【0036】
本発明の一態様において、複合体が組成物において形成されうる。一態様において、複合体は、少なくとも1つのキノキサリン成分から誘導されるモノマー単位を有する。好ましい態様においては、本発明の複合体はダイマーである。特に好ましい態様において、複合体は、ブロモニジンタートレートの複合体、特にダイマーである。
【0037】
本発明の他の広い一態様において、α−2−アドレナリンアゴニスト成分、および組成物の保存を少なくとも助長するのに有効な量の保存剤成分を含んで成る組成物を提供する。好ましくは、保存剤成分は、生物学的に許容され、化学的に安定であり、組成物中のα−2−アドレナリンアゴニスト成分または組成物を投与する患者に実質的にまたは有意に不利な影響を与えないオキシ−クロロ成分、例えば、化合物、イオン、複合体等を包含する。そのような組成物は、組成物において、または組成物を投与する患者において、シクロデキストリンを実質的に含有しないのが好ましい。
【0038】
文脈、本明細書および当業者の知識から明らかなように、本明細書に記載されるあらゆる特徴、または特徴の組合せは、そのような組合せに含まれる特徴が相互に矛盾しないことを条件として、本発明に含まれる。本明細書中で数値範囲を示す場合、それはその範囲内の個々の値をすべて開示するものであり、すなわちそのような値のすべての列挙の省略に過ぎないと理解すべきである。
本発明の他の利点および局面は、下記の詳細な説明および特許請求の範囲から明らかである。
【図面の簡単な説明】
【0039】
【図1】種々のカルボキシメチルセルロース濃度の室温の水溶液中における可溶性ブリモニジンタートレートをpHに対してプロットしたグラフである。
【発明を実施するための形態】
【0040】
α−2−アドレナリンアゴニスト成分を含有する処置有効性の組成物を提供する。本発明の組成物は、中性またはアルカリ性pHで調製する利点を提供する。すなわち、実質的に非荷電の、より脂溶性の形態で活性剤の製剤を提供する。α−2−アドレナリンアゴニスト成分が細胞膜をより通過し易いので、本発明の組成物は、酸性pHで調製された組成物と比較して、同等の効果を有するか、または向上した効果を有する。
【0041】
本発明の組成物の各性状は必然的に処置に有効である。処置に有効でない組成物は特許請求の範囲に包含されることを意図しない。「処置に有効」とは、組成物が処方または指示されたように使用されたときに、プラセボと比較して統計学的に有意な医学的有益効果を示すことができることを意味する。したがって、眼圧降下のために使用するよう処方された組成物は、指示通りに使用されたときに統計学的に有意な眼圧降下作用を示す組成物をさすことが意図される。
【0042】
一態様において、本発明は、α−2−アドレナリンアゴニスト成分が少なくとも30%非荷電、少なくとも40%非荷電、少なくとも50%非荷電または少なくとも60%非荷電であるようなpHの水溶液中で製剤化した該αアドレナリン成分を含有する組成物、例えば局所眼用組成物を意図する。
【0043】
特に好ましい態様においては、本発明は、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンまたはその塩を含有する組成物に関し、ここで溶液を0.2%(w/v)未満の濃度で調製する。組成物中の活性成分濃度は、好ましくは0.2〜約0.001%(w/v)、より好ましくは約0.15%(w/v)またはそれ以下、より一層好ましくは0.15〜約0.001%(w/v)、最も好ましくは約0.1%(w/v)またはそれ以下である。
【0044】
本発明のこの態様のさらなる好ましい側面として、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンまたはその塩は、pHが室温で約7.0を越えるか、または室温で約7.2もしくはそれ以上、より好ましくは室温で約7.5もしくはそれ以上、最も好ましくは室温で約7.7もしくはそれ以上である水溶液中に存在する。
【0045】
他の一態様において、本発明の組成物中のα−2−アドレナリンアゴニスト成分を、より可溶性とし(特に中性ないしアルカリ性のpH値で)、処置剤としてより効果的に利用しうる。本発明の組成物中に使用するSECは、荷電α−2−アドレナリンアゴニスト成分、非荷電α−2−アドレナリンアゴニスト成分またはその両方を可溶化するのに有効でありうる。本発明の組成物は液体担体成分を含有し、液体(例えば水性液体)溶液の性質を有する。
【0046】
α−2−アドレナリンアゴニスト成分は、α2受容体のα2A、α2Bまたはα2Cサブタイプの少なくとも1つに対する刺激活性を有する。そのような1つまたはそれ以上のサブタイプにおける活性は好ましくは、α1アドレナリン受容体サブタイプにおける活性よりも少なくとも10倍大きい。より一層好ましくは、α2受容体における活性は、α1受容体における活性の少なくとも50倍、または少なくとも100倍、または少なくとも1000倍大きい。α−2−アゴニストの例は、キシラジン、デトミジン、メデトミジン、クロニジン、ブリモニジン、チザニジン、ロフェキシジン、グアンファシン、グアナベンズ・アセテート、およびデクスメデトミジンを包含するが、それらに限定されない。
【0047】
α−2−アドレナリンアゴニスト成分は、pHが7を越える本発明組成物に可溶である。一態様において、本発明組成物はαアドレナリンアゴニスト成分を室温でのその水溶性の限界またはほぼ限界で含有し、pH7またはそれ以下の同様の組成物中のより高濃度の該αアドレナリンアゴニスト成分に匹敵する有効性を維持する。
【0048】
好ましい一態様において、α−2−アドレナリンアゴニスト成分は本発明の組成物中で少なくとも1つのSECと組み合わせるので、SEC不含有組成物中の同じα−2−アドレナリンアゴニスト成分と比較して、同等の濃度において、pHが7を越える本発明組成物(例えばpHが約7.2、約7.4、約7.7および約8.0の本発明組成物であるが、それらに限定されない)中で溶解性が向上している。
【0049】
好ましい組成物は、pH約7.7で約0.1%(w/v)のブリモニジンを含有する。より一層好ましくは、そのような組成物はSECをも含有する。SECは任意のSECから選択しうるが、好ましいSECはカルボキシメチルセルロース、ポリビニルアルコールまたはポリビニルピロリドンを包含する。
【0050】
他の一態様において、α−2−アドレナリンアゴニスト成分は、pH約7〜10の範囲の本発明組成物中において、SEC不含有の同様の組成物中の同じα−2−アドレナリンアゴニスト成分と比較して、同等の濃度で、向上した溶解性を示す。より一層好ましくは、本発明の組成物中のα−2−アドレナリンアゴニスト成分はそのような向上した溶解性を、約7.0を越えるpHで、好ましくはpH約7.0〜8.5で、より好ましくはpH約7.2〜8.2で、より一層好ましくはpH約7.5〜8.0で、またはpH約7.7で示す。
【0051】
いかなる理論または作用メカニズムによる限定をも意図するものではないが、可溶化されたα−2−アドレナリンアゴニスト成分は、非可溶化α−2−アドレナリンアゴニスト成分と比較して、脂質膜をより容易に通過することができると考えられる。更に、非荷電α−2−アドレナリンアゴニスト成分は荷電したものよりも、脂質膜をより容易に通過できるとも考えられる。
【0052】
一態様において、SECはα−2−アドレナリンアゴニスト成分を、それを処置有効濃度で導入する生物学的環境において、可溶化することができる。本発明の組成物を導入する生物学的環境は、好ましくは約7〜9のpHを有する。例えば、SECおよびα−2−アドレナリンアゴニスト成分を含んで成る組成物を、約7のpHを有する眼の表面に局所投与することができ、ここで、α−2−アドレナリンアゴニスト成分は投与された領域で実質的に可溶である。さらに、一態様において、投与領域における可溶性α−2−アドレナリンアゴニスト成分は、SECの存在または他の理由で、可溶性でないα−2−アドレナリンアゴニスト成分より容易に、生体脂質膜を通って拡散しうる。水溶液中のα−2−アドレナリンアゴニスト成分の溶解性の維持は、好ましくは、α−2−アドレナリンアゴニスト成分と接触または相互作用する感受性組織への刺激を低減させる。
【0053】
本発明の組成物中の可溶性α−2−アドレナリンアゴニスト成分は、当然、処置有効濃度でデリバーすることが可能でなければならない。可溶性α−2−アドレナリンアゴニスト成分を極く低濃度で含有する溶液を調製することは明らかに可能であるが、そのような溶液は、投与する哺乳動物に利益を与えるのに有効でないなら処置に有用ではない。好ましくは、本発明の組成物は、同じα−2−アドレナリンアゴニスト成分を含有するpH7.0未満の製剤と実質的に同等であるか、またはそれ以上の処置効果を提供することができる。より一層好ましくは、本発明の組成物は、同じα−2−アドレナリンアゴニスト成分を含有するpH7.0未満の製剤と実質的に同等であるか、またはそれ以上の処置効果を提供することができ、かつ、活性剤を低pH製剤よりも低濃度で含有する。
【0054】
好ましい一態様において、有用なα−2−アドレナリンアゴニスト成分は、SECの存在により利益を受け、安定化または可溶化されるように選択する。この態様において、α−2−アドレナリンアゴニスト成分は、SECの存在によって、向上した見掛溶解性、好ましくは向上した見掛水溶性を付与される。
【0055】
α−2−アドレナリンアゴニスト成分の例は、アミンを含む分子である。α−2−アドレナリンアゴニスト成分は、好ましくは約7より大きい、より好ましくは約7〜9のpKaを有するアミン含有分子である。
【0056】
α−2−アドレナリンアゴニスト成分は、α−2−アドレナリンアゴニストを包含する。本明細書において「α−2−アドレナリンアゴニスト」なる用語は、1つまたはそれ以上のα2Aアドレナリン受容体、α2Bアドレナリン受容体およびα2Cアドレナリン受容体に結合し、それを活性化する化学物質、例えば、化合物、塩、エステル、イオン、複合体等を包含する。そのようなGタンパク質結合受容体は、刺激を受けると多くの細胞シグナル機能を果たし、1つまたはそれ以上が、例えば、神経伝達物質ノルエピネフリンのシナプス前放出の抑制に関与しうる。理論による制限を意図するものではないが、考えられるのは、1つまたはそれ以上のα2受容体サブタイプの刺激の結果、標的ニューロンへのカルシウム流入が抑制される、すなわち神経伝達物質放出が阻害される、ということである。このシナプス前ニューロンにおけるノルエピネフリン抑制は、痛み応答の発生または伝播の抑制による鎮痛に関与するようである。
【0057】
α2受容体は主としてシナプス前部に見られるが、シナプス後およびシナプス外部並びに末梢およびCNSニューロンにも存在しうる。
【0058】
本発明のα−2−アドレナリンアゴニストは、α−2−アドレナリンアゴニスト受容体に結合して、作用する細胞のシナプス前部でニューロンのノルエピネフリンの放出の減少または抑制を引き起しうる。さらに、それらは、例えばサイクリックAMPのβ−アドレナリン受容体刺激形成を阻害することによって、シナプス後的にもα−2−アドレナリン受容体に作用しうる。
【0059】
α−2−アドレナリンアゴニストは、神経保護活性を有する化合物も包含する。例えば、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンは、神経保護活性を有するα−2−アドレナリンアゴニストである。神経保護メカニズムはまだ完全にはわかっていない。
【0060】
本発明を、以下に示す特定の群および化合物に限定するものではないが、本発明で有用な代表的α−2−アドレナリンアゴニストを以下に示す:クロニジン、アプラクロニジンを包含するイミノ−イミダゾリン;ナファゾリン、キシメタゾリン、テトラヒドロゾリンおよびトラマゾリンを包含するイミダゾリン;デトミジン、メデトミジンおよびデクスメデトミジンを包含するイミダゾール;B−HT 920(6−アリル−2−アミノ−5,6,7,8−テトラヒドロ−4H−チアゾロ[4,5−d]−アゼピン)およびB−HT 933を包含するアゼピン;キシラジンを包含するチアジン;リルメニジンを包含するオキサゾリン;グアナベンズおよびグアンファシンを包含するグアニジン;カテコールアミン等;およびそれらの塩、エステルおよび誘導体。
【0061】
特に有用なα−2−アドレナリンアゴニストは、キノキサリン成分を包含する。一態様において、キノキサリン成分は、キノキサリン、その誘導体およびそれらの混合物を包含する。好ましくは、キノキサリンの誘導体は、(2−イミダゾリン−2−イルアミノ)キノキサリンを包含する。より好ましくは、キノキサリンの誘導体は、5−ハライド−6−(2−イミダゾリン−2−イルアミノ)キノキサリンを包含する。5−ハライド−6−(2−イミダゾリン−2−イルアミノ)キノキサリンの「ハライド」は、フッ素、塩素、沃素、好ましくは臭素であり、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンを形成することができる。さらに好ましくは、本発明で使用するキノキサリンの誘導体は、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンのタートレートまたはブリモニジンタートレートを包含する。
【0062】
他の有用なキノキサリン誘導体もよく知られている。例えば、有用なキノキサリン誘導体は、Burkeらの米国特許第5703077号に開示されているキノキサリン誘導体を包含する。Danielwiczらの米国特許3890319号も参照できる。BurkeらおよびDanielwiczらの特許に開示されている内容は、それぞれ、本発明の開示の一部を構成するものとする。
【0063】
キノキサリンおよびその誘導体、例えばブリモニジンタートレートは、アミンを含有し、7より大きい、好ましくは約7.5〜9のpKaを有するのが好ましい。
【0064】
α−2−アドレナリンアゴニストとして作用する前記化合物の類似体も特に本発明に含まれるものとする。
【0065】
好ましくは、本発明のα−2−アドレナリンアゴニストは、α−2A−アドレナリン受容体、α−2B−アドレナリン受容体および/またはα−2C−アドレナリン受容体を活性化するのに有効である。
【0066】
一態様において、本発明の組成物中でα−2−アドレナリンアゴニスト成分は少なくとも約30%非荷電であり、好ましくは少なくとも約50%非荷電である。当業者は理解するであろうが、pKaはイオン化定数の負の対数(または化合物が50%イオン化されるときのpH)であり、本発明において非荷電化合物の割合を言うとき(例えば、少なくとも30%または50%非荷電、というように)、化学量論に基づく化合物についてのものである。
【0067】
好ましくは、本発明組成物の可溶性α−2−アドレナリンアゴニスト成分は、組成物を投与する生物学的環境において少なくとも約30%非荷電または少なくとも約50%非荷電である。
理論または作用機序による制限を意図するわけではないが、非荷電形態の本発明のα−2−アドレナリン化合物は、膜脂質二重層を通過し易いと考えられる。
【0068】
SECを伴う態様において、任意の好適なSEC(またはSECの組合せ)を本発明に使用することができる。一態様において、SECは非荷電SEC、例えばピロリドン成分、ポリビニルアルコール(PVA)、非荷電セルロース誘導体、Pemlin、カルボマー、Carbopol等を包含するが、それらに限定されない。ピロリドン成分の例は、ポリビニルピロリニドン(ポビドン)およびその誘導体である。さらなる態様において、SECはポリアニオン性成分を包含する。有用なポリアニオン性成分は、低溶解性α−2−アドレナリンアゴニスト成分の見掛溶解性、好ましくは水溶性を増加させるのに有効であり、および/またはα−2−アドレナリンアゴニスト成分の安定性を増加させ、および/またはα−2−アドレナリンアゴニスト成分の好ましくない副作用を減少させる物質を包含するがそれらに限定されない。さらに、ポリアニオン性成分は、使用濃度において眼科学的に局所処置に許容されるのが好ましい。さらに、ポリアニオン性成分は、3またはそれ以上のアニオン(または負)電荷を有するのが好ましい。ポリアニオン性成分がポリマー物質である場合、ポリマー物質の各反復単位が孤立アニオン電荷を有するのが好ましい。特に有用なアニオン性成分は、水溶性、例えば、α−2−アドレナリン成分を含有する液体水性媒体のような有用な液体水性媒体中に、使用される濃度およびpHで可溶のアニオン性成分である。
【0069】
ポリアニオン性成分は、α−2−アドレナリンアゴニスト成分の荷電または極性部分とイオン相互作用または静電相互作用するのに充分にアニオン性であるのが好ましい。そのような相互作用は、ある種の製剤のα−2−アドレナリンアゴニスト成分を可溶化し、および/またはそのようなα−2−アドレナリンアゴニスト成分を担体成分(例えば液体媒体)に可溶性に維持するのに好ましいと考えられる。
【0070】
ポリアニオン性成分は、複数のアニオン電荷を有する1つまたはそれ以上のポリマー物質も包含する。その例は下記のものである:
金属カルボキシメチルスターチ、
金属カルボキシメチルヒドロキシエチルスターチ、
加水分解ポリアクリルアミドおよびポリアクリロニトリル、
ヘパリン、
1つまたはそれ以上の下記物質のホモポリマー及びコポリマー:
アクリル酸およびメタクリル酸、
アクリル酸金属塩およびメタクリル酸金属塩、
アルギン酸、
アルギン酸金属塩、
ビニルスルホン酸、
ビニルスルホン酸金属塩、
アミノ酸、例えば、アスパラギン酸、グルタミン酸等、
アミノ酸の金属塩、
p−スチレンスルホン酸、
p−スチレンスルホン酸金属塩、
2−メタクリロイルオキシエチルスルホン酸、
2−メタクリロイルオキシエチルスルホン酸金属塩、
3−メタクリロイルオキシ−2−ヒドロキシプロピルスルホン酸、
3−メタクリロイルオキシ−2−ヒドロキシプロピルスルホン酸金属塩、
2−アクリルアミド−2−メチルプロパンスルホン酸、
2−アクリルアミド−2−メチルプロパンスルホン酸金属塩、
アリルスルホン酸、
アリルスルホン酸金属塩等。
「金属」は、アルカリおよびアルカリ土類金属、例えばNa、K、Ca等を意味する。
【0071】
他の態様において、ポリアニオン性成分は、高いpH、例えば約7またはそれ以上のpHにおいて、イオン化形態で存在する傾向があるアニオン性多糖を包含する。本発明に使用しうるアニオン性多糖の例を以下に示す。
【0072】
ポリデキストロースは、哺乳動物によって部分的にのみ代謝される、デキストロースのランダム結合縮合ポリマーである。このポリマーは、少量の結合ソルビトール、クエン酸およびグルコースを含有することができる。ナトリウムコンドロイチンスルフェートとしても知られているコンドロイチン硫酸は、ヒト組織の全ての部分、特に、軟骨、骨、腱、靱帯および血管壁に見られるムコ多糖である。このムコ多糖は、サメの軟骨から抽出され精製される。カラゲーニンは、反復ガラクトース単位および3,6アンヒドロガラクトース単位を有する線状多糖であり、該単位はいずれも、硫酸化されているかまたは硫酸化されていなくてよく、交互1−3およびβ1−4グリコシド結合によって結合している。カラゲーニンは、紅藻およびトチャカの数種から加熱抽出されるヒドロコロイドである。麦芽デキストリンは、水の存在下での、澱粉と酸および/または酵素との反応によって形成される水溶性グルコースポリマーである。
【0073】
本発明で有用であることが見い出された他のアニオン性多糖は、親水性コロイド物質であり、天然ゴム、例えば、ゲラン(gellan)ゴム、アルギン酸塩ゴム、即ち、アルギン酸のアンモニウムおよびアルカリ金属塩、およびそれらの混合物を包含する。さらに、脱アセチルキチンの通称であるキトサンも有用である。キチンは、ポリ−(N−アセチル−D−グルコサミン)を含んで成る天然産物である。ゲランゴムは、細胞外ヘテロ多糖を産生するシュードモナスエロデアの発酵によって産生される。アルギネートおよびキトサンは、例えばProtan,Inc.,Commack,N.Y.から乾燥粉末として入手できる。ゲランゴムは、例えばKelco Devision of Merk & Co.,Inc.,San Diego,Californiaから入手できる。
【0074】
一般に、アルギン酸塩は、アルギン酸アルカリ金属塩、例えば、アルギン酸のナトリウム、カリウム、リチウム、ルビジウムおよびセシウム塩ならびにアンモニウム塩、および有機塩基の可溶性アルギン酸塩、例えば、モノ−、ジ−またはトリ−エタノールアミンアルギネート、アルギン酸アニリン等を包含するどのような水溶性アルギン酸塩であってもよい。一般に、組成物の合計重量に基づいて、約0.2〜1重量%、好ましくは約0.5〜3.0重量%のゲラン、アルギン酸塩またはキトサンイオン性多糖を使用して、本発明のゲル組成物を得る。
【0075】
一態様において、アニオン性多糖は環化されている。より好ましくは、環化アニオン性多糖は10未満のモノマー単位を有する。さらに好ましくは、環化多糖は6未満のモノマー単位を有する。
【0076】
環化アニオン性多糖の特に有用な群は、シクロデキストリンである。シクロデキストリン群の例は、以下のものであるがそれらに限定されない:α−シクロデキストロリン、α−シクロデキストリンの誘導体、β−シクロデキストリン、β−シクロデキストリンの誘導体、γ−シクロデキストリン、γ−シクロデキストリンの誘導体、カルボキシメチル−β−シクロデキストリン、カルボキシメチルエチル−β−シクロデキストリン、ジエチル−β−シクロデキストリン、ジメチル−β−シクロデキストリン、メチル−β−シクロデキストリン、ランダムメチル−β−シクロデキストリン、グルコシル−β−シクロデキストリン、マルトシル−β−シクロデキストリン、ヒドロキシエチル−β−シクロデキストリン、ヒドロキシプロピル−β−シクロデキストリン、スルホブチルエーテル−β−シクロデキストリン等、およびそれらの混合物。スルホブチルエーテル−β−シクロデキストリンは、本発明において好ましい環化アニオン性多糖である。本発明に使用するSEC(前記シクロデキストリンを包含する)は、使用濃度において、哺乳動物(ヒトを包含する)に非毒性であるように調製するのが有利である。
【0077】
シクロデキストリンに関連して本明細書で使用する「誘導体」なる用語は、シクロデキストリン成分として機能し、例えば、本明細書に記載したように、活性成分の溶解性および/または安定性を増し、および/または活性成分の好ましくない副作用を減少し、および/または活性成分との包接化合物を形成するのに充分な、シクロデキストリンの特徴的化学構造を有する、あらゆる置換されたまたは修飾(改質)された化合物を意味する。
【0078】
シクロデキストリンおよび/またはそれらの誘導体をSECとして使用することができるが、本発明の一態様は、シクロデキストリン以外のSECおよび/またはそれらの誘導体も包含する。
【0079】
特に有用で、好ましい種類のポリアニオン性成分は、アニオン性セルロース誘導体を包含する。アニオン性セルロース誘導体は、金属カルボキシメチルセルロース、金属カルボキシメチルヒドロキシエチルセルロースおよびヒドロキシプロピルメチルセルロース並びにそれらの誘導体を包含する。
【0080】
本発明のポリアニオン性成分は、多くの場合、例えば固体状態で対イオン(特に該SECの孤立アニオン電荷の数にほぼ等しい複数の孤立カチオン)との組合せとして、非荷電状態で存在することができるので、電荷を持つとき、ポリアニオン性成分は電気的に中性となる。
【0081】
ポリアニオン性成分は眼用に許容されるのが好ましいので、非イオン化ポリアニオン性成分と会合する金属は、使用される濃度において眼用に許容されるのが好ましい。特に有用な金属は、アルカリ金属、例えばナトリウムおよびカリウム、アルカリ土類金属、例えばカルシウムおよびマグネシウム、およびそれらの混合物を包含する。
【0082】
ナトリウムは、非イオン化ポリアニオン性成分中で対イオンとして作用することのできる極めて有用な金属である。非イオン化状態においてH+および金属カチオン以外のカチオンと結合するポリアニオン性成分を、本発明に使用することができる。
【0083】
SECの使用を伴う本発明の態様において、SECの量は、α−2−アドレナリンアゴニスト成分の溶解度が少なくともいくらか増加する限りは限定的でなく、生物学的に許容される量で存在する。そのような量は、本発明の組成物において、および/またはヒトまたは動物への投与後に、所望の作用をするのに有効な量でなければならない。一態様において、SEC、好ましくはポリアニオン性成分の量は、本発明の組成物におけるα−2−アドレナリンアゴニスト成分の大部分の量、より好ましくは実質的に全ての量の可溶化を補助するのに充分な量である。有用な一態様において、本発明の組成物におけるポリアニオン性成分の量は、組成物の約0.1〜30%(w/v)またはそれ以上である。好ましくは、ポリアニオン性成分の量は、約0.2〜10%(w/v)である。より好ましくは、ポリアニオン性成分の量は、約0.2〜0.6%(w/v)である。
【0084】
さらに好ましくは、ポリアニオン性成分はカルボキシメチルセルロースであり、組成物中に約0.2〜0.6%(w/v)で存在する。本発明の組成物におけるカルボキシメチルセルロースの特に有効な濃度は、約0.5%である。
【0085】
一態様において、SEC、例えばカルボキシメチルセルロースは、組成物中にα−2−アドレナリンアゴニスト成分を可溶化するのを助長する。SECは、イオン化α−2−アドレナリンアゴニスト成分の可溶化を助長することができるが、本発明のこの態様で使用するSECは、中性またはアルカリ性pHでα−2−アドレナリンアゴニスト成分の可溶化を助長するのが好ましい。例えば、一態様において、カルボキシメチルセルロースは、イオン化α−2−アドレナリンアゴニスト成分を可溶化するのを助長することができる。他の態様において、カルボキシメチルセルロースは、実質的に非荷電分のα−2−アドレナリンアゴニスト成分を可溶化するのを助長することができる。好ましい態様において、カルボキシメチルセルロースは、組成物中でイオン化ブリモニジンタートレートを可溶化するのを助長する。より好ましくは、カルボキシメチルセルロースは、組成物中で実質的非荷電分のブリモニジンタートレートを可溶化するのを助長する。
【0086】
本発明の組成物は、組成物の保存を助長する保存剤成分も含有することができる。好ましい態様において、本発明の組成物は、組成物中の(即ちポリアニオン性成分の存在下)で保存剤として有効であり、組成物をヒトまたは動物に投与した場合に好ましくは低下した毒性を有する(より好ましくは実質的に毒性を有さない)ように選択した少なくとも1つの保存剤成分を含有する。
【0087】
組成物、好ましくは組成物中のα−2−アドレナリンアゴニスト成分の保存を助長する本発明の保存剤成分は、約1%(w/v)未満または約0.8%(w/v)未満の濃度において有効であるのが好ましく、500ppm(w/v)またはそれ以下、例えば約10ppm(w/v)またはそれ以下から約200ppm(w/v)までであってよい。本発明の保存剤成分は、好ましくは、塩化ベンザルコニウムよりも少ない程度でポリアニオン性成分と複合体を形成する保存剤成分を包含するが、それらに限定されない。
【0088】
本発明の保存剤成分の非常に有用な例は、酸化保存剤成分、例えば、オキシ−クロロおよびオキシ−ボレート成分、過酸化物、過酸塩、過酸等のような酸化保存剤およびそれらの混合物であるが、それらに限定されない。本発明の保存剤として有用なオキシ−クロロ成分の例は、次亜塩素酸塩成分、例えば次亜塩素酸塩;塩素酸塩成分、例えば塩素酸塩;過塩素酸塩成分、例えば過塩素酸塩;および亜塩素酸成分を包含する。亜塩素酸塩成分の例は、安定化二酸化塩素(SCD)、亜塩素酸金属塩等、例えば亜塩素酸のアルカリ金属およびアルカル土類金属塩等およびそれらの混合物を包含する。工業グレード(またはUSP(米国薬局方)グレード)亜塩素酸ナトリウムは、極めて有用な保存剤成分である。多くの亜塩素酸塩成分、例えばSCDの正確な化学組成は、充分には理解されていない。ある種の亜塩素酸塩成分の製造は、McNicholasの米国特許第3278447号に開示されており、そこに開示されている内容は全体として本発明の開示の一部を構成するものとする。有用なSCD製品の特定の例は、Rio Linda Chemical Company,Inc.から商標名Dura Klorで市販されているもの、およびInternational Dioxide,Inc.から商標名Anthium Dioxideで市販されているものを包含する。特に有用なSCDは、Allergan Inc.からPurite(登録商標)として市販されている製品である。
【0089】
酸化保存剤成分の他の例は、パーオキシ成分を包含する。例えば、ジエチレントリアミンペンタ(メチレンホスホン酸)または1−ヒドロキシエチリデン−1,1−ジホスホン酸のような過酸化水素安定剤で安定化した微量のパーオキシ成分は、眼環境において使用するように設計された成分中で使用する保存剤として使用することができる。さらに、水中で加水分解して過酸化水素を生成する限り、実質的にいかなるパーオキシ成分も使用することができる。有効量の過酸化水素を発生するそのような過酸化水素源の例は、過硼酸ナトリウム十水化物、過酸化ナトリウムおよび過酸化尿素を包含する。有機パーオキシ化合物の過酢酸は、本発明の系を使用して安定化されないことがあることがわかっている。例えば、Martinらの米国特許第5725887号参照(そこに開示の内容は本発明の開示の一部を構成するものとする)。
【0090】
酸化保存剤成分以外の保存剤を組成物に含ませることができる。保存剤の選択は、投与経路に依存する。1つの経路によって投与される組成物に好適な保存剤は、他の経路による該組成物の投与を不可能にする不利な特性を有する場合がある。鼻および眼用組成物について、好ましい保存剤は、第四級アンモニウム化合物、特に、「塩化ベンザルコニウム」として総称的に知られているアルキルベンジルジメチルアンモニウム化合物の混合物等、「セトリミド」と称されるデシルトリメチルアンモニウムブロミド、ドデシルトリメチルアンモニウムブロミドおよびテトラデシルトリメチルアンモニウムブロミドを含有する混合物、BDB、保存性ポリクオタニウム−1(Polyquad(登録商標)の名称で市販されている)、並びにビグアニド保存剤(例えばポリヘキサメチレンビグアニド(「PHMB」))を包含するが、それらに限定されない。
【0091】
しかし、吸入によって投与する組成物については、好ましい保存剤はクロロブタノール等である。特に直腸投与する組成物に使用する他の保存剤は、p−ヒドロキシ安息香酸のアルキルエステルおよびそれらの混合物、例えば、「Nipastat」の商品名で市販されているメチル、エチル、プロピル、ブチルエステル等の混合物を包含する。
【0092】
本発明の他の広い局面において、α−2−アドレナリンアゴニスト成分、組成物の保存を少なくとも助長するのに有効な量、好ましくは保存するのに有効な量の保存剤成分、および液体担体成分を含んで成る組成物を提供する。好ましくは、保存剤成分は、オキシ−クロロ成分またはPHMBを含む。そのような化合物は、グラム陽性細菌、グラム陰性細菌または真菌の増殖を防止するのに有効でなければならず、好ましくは、(1)組成物中のα−2−アドレナリンアゴニスト成分または組成物を投与する患者に実質的にまたは有意に不利な影響を与えず、(2)実質的に生物学的に許容され、化学的に安定である。そのような本発明の組成物は、α−2−アドレナリンアゴニスト成分、オキシ−クロロ成分、第四級アンモニウム化合物またはビグアニド(例えばPHMB)、および液体担体成分を含んで成り、好ましくはシクロデキストリンを実質的に含有しない。
【0093】
本発明で有用な担体成分は、非毒性であり、本発明の組成物、本発明の組成物の使用、または組成物を投与されるヒトまたは動物に、実質的に不利な影響を与えないように選択する。
【0094】
一態様において、担体成分は液体担体である。好ましい態様において、担体成分は液体水性担体成分である。特に有用な水性液体担体成分は、生理食塩水、例えば、従来の生理食塩水または従来の緩衝生理食塩水から誘導される。水性液体担体は、好ましくは約6〜9または約10、より好ましくは約6〜8、さらに好ましくは約7.5のpHを有する。液体媒体は、例えば少なくとも約200mOsmol/kg、より好ましくは約200〜400mOsmol/kgの眼用に許容される浸透圧レベルを有するのが好ましい。特に有用な態様において、担体成分のモル浸透圧濃度または浸透圧は、眼、特にヒトの眼の表面の液体の浸透圧と実質的に等張である。
【0095】
一態様において、SECおよびα−2−アドレナリンアゴニスト成分を含有する担体成分は、25℃において約0.01センチポイズ(cps)より大きい、より好ましくは25℃において約1cpsより大きい、さらに好ましくは25℃において約10cpsより大きい粘度を有する。好ましい態様において、組成物は、25℃において約50cpsの粘度を有し、従来の緩衝生理食塩水、カルボキシメチルセルロースおよびブリモニジンタートレートを含んで成る。
【0096】
水性液体担体成分のpH、従って組成物のpHを所望範囲に維持することを確実にするために、水性液体担体成分は、少なくとも1つの緩衝剤成分を含有する。あらゆる好適な緩衝剤成分を使用することができるが、有意な量のガス、例えば二酸化塩素またはCO2を発生し得ない緩衝剤を選択するのが好ましい。緩衝剤成分は無機であるのが好ましい。アルカリ金属およびアルカリ土類金属塩緩衝剤成分を本発明に使用するのが有利である。
【0097】
あらゆる好適な眼用に許容される浸透圧調節成分を使用することができるが、但し、そのような成分は、液体水性担体成分の他の成分と相溶性であり、本発明の組成物を投与するヒトまたは動物を害しうる有害なまたは毒性の特性を有してはならない。有用な浸透圧調節成分の例は、塩化ナトリウム、塩化カリウム、マンニトール、デキストロース、グリセリン、プロピレングリコールおよびそれらの混合物を包含する。一態様において、浸透圧調節成分は、無機塩およびそれらの混合物から選択する。
【0098】
本発明の組成物は、好ましくは、水性液体または非水性液体中の溶液または懸濁液として、または水中油または油中水の液体エマルジョンとして存在し得る。本発明の組成物は、1つまたはそれ以上の付加成分、例えば、稀釈剤、香味剤、界面活性剤、増粘剤、潤滑剤、および同じ一般的なタイプの組成物に一般に使用される付加成分等を含有することができる。
【0099】
水性懸濁液の形態である場合の本発明の組成物は、水性懸濁液の製造に好適な賦形剤を含有することができる。そのような賦形剤は、沈殿防止剤、例えば、アルギン酸ナトリウム、トラガカントゴムおよびアカシアゴムであるが、それらに限定されない。分散または湿潤剤は、天然ホスファチド、例えば、レシチン、または、エチレンオキシドと長鎖脂肪族アルコールとの縮合生成物、例えばヘプタデカエチレンオキシセタノール、またはエチレンオキシドと、脂肪酸およびヘキシトールから誘導される部分エステルとの縮合生成物、例えばポリオキシエチレンソルビトールモノオレエート、またはエチレンオキシドと、脂肪酸およびヘキシトール無水物から誘導される部分エステルとの縮合生成物、例えばポリオキシエチレンソルビタンモノオレエート等、およびそれらの混合物を包含しうる。この態様の本発明の水性懸濁液は、1つまたはそれ以上の着色剤、1つまたはそれ以上の香味剤、および1つまたはそれ以上の甘味剤、例えば、スクロース、サッカリン等、およびそれらの混合物も含有することができる。
【0100】
油状懸濁液の形態である場合の本発明の組成物は、植物油、例えば、オリーブ油、ゴマ油またはココナツ油、または流動パラフィンのような鉱油中で調製することができる。そのような懸濁液は、増粘剤、例えば、蜜蝋、硬質パラフィンまたはセチルアルコールを含有することができる。前記のような甘味剤、および香味剤を添加して、嗜好性経口製剤を得ることができる。
【0101】
本発明の組成物は、水中油エマルジョンの形態にすることもできる。油相は、植物油、例えば、オリーブ油または落花生油、または鉱油、例えば流動パラフィン等、およびそれらに混合物であってよい。好適な乳化剤は、天然ゴム、例えば、アカシアゴムまたはトラガカントゴム、天然ホスファチド、例えば、大豆レシチン、および脂肪酸およびヘキシトール無水物から誘導されるエステルまたは部分エステル、例えば、ソルビタンモノオレエート、および該部分エステルとエチレンオキシドとの縮合生成物、例えばポリオキシエチレンソルビタンモノオレエートである。エマルジョンは、甘味剤および香味剤も含有することができる。
【0102】
シロップ剤またはエリキシル剤の形態である場合の本発明の組成物は、本明細書に記載したような甘味剤を使用して処方することができる。そのような組成物は、粘滑剤、香味剤および着色剤も含有することができる。
【0103】
特定のヒトまたは動物についての特定の投与量レベルは、使用する活性成分の活性、年齢、体重、全身的健康状態、性別、食事、投与時刻、製剤pH、投与経路、排泄速度、薬剤組合せ、および治療を受けている特定の疾患の重症度を包含する種々の要因に依存する。5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンについて、本発明の組成物中の処置有効用量は、0.2%(w/v)未満、例えば約0.15%(w/v)または約0.1%(w/v)もしくはそれ以下の濃度でデリバーする。そのような組成物のpHは7.0よりも大きく、一態様においては用量が約0.15%でpHが約7.2であり、他の一態様においては用量が約0.1%でpHが約7.7である。
【0104】
本発明の1つの局面において、本発明の組成物中に複合体を形成する。一態様において、複合体は、キノキサリン成分のモノマー単位を少なくとも1つ有する。キノキサリン成分の例は、キノキサリン、(2−イミダゾリン−2−イルアミノ)キノキサリン、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリン、それらの塩、それらのエステル、それらの他の誘導体等、およびそれらの混合物を包含する。例えば、一態様において、本発明の複合体は、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンモノマー単位の結合体(conjugation)を包含してよい。他の態様において、複合体は、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンモノマー単位とブリモニジンタートレートモノマー単位との結合体を包含してよい。
【0105】
この局面の好ましい態様において、本発明の複合体はダイマーである。例えば、本発明のダイマーは、キノキサリンおよび5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンを含みうる。好ましくは、本発明のダイマーは、2つのブリモニジンタートレートモノマー単位を有する。
【0106】
本発明のこの局面を理論または作用機序により制限することを意図するものではないが、酸化保存剤成分のような過酸化物形成剤または強酸化剤(例えば、オキシ−クロロ成分、過酸化物、過酸塩、過酸等およびそれらの混合物)は、複合体、好ましくはα−2−アドレナリンアゴニスト成分の複合体の形成を促進すると考えられる。例えば、ブリモニジンタートレートモノマー単位のダイマーは、亜塩素酸塩、好ましくは安定化二酸化塩素の存在下に形成されると考えられる。
【0107】
さらに、モノマーまたはモノマーサブユニットを結合した状態に維持する働きをして複合体(好ましくはオリゴマー、より好ましくはダイマー)を形成するモノマー間の相互作用は、共有結合、イオン結合、疎水性結合、静電結合、水素結合、他の化学的および/または物理的相互作用等、およびそれらの組合せを包含すると考えられるが、それらに限定されない。そのような複合体は、液体、例えば水性液体媒体において解離することができる。一態様において、モノマーまたはモノマーサブユニットは、共有結合以外の結合によって結合される。一態様において、モノマーまたはモノマーサブユニットは、静電結合または静電力によって結合される。
下記の非限定的な実施例は、本発明のある種の局面を説明するものである。
【実施例1】
【0108】
ブリモニジンタートレートは、約7.78のpKaを有する。水性製剤(眼用溶液)におけるブリモニジンタートレートのpH−溶解度プロフィールを、23℃において約5〜8のpHで確認した(表1)。示したもの以外のアドレナリンアゴニスト濃度を、それら濃度が処置活性を有する限り、本発明の組成物に使用しうることが理解される。同様に、温度も幾分変化させることができ、例えば、室温において溶解度曲線を得ることができる。
【0109】
製剤賦形剤を調製するのに、先ずポリビニルアルコール(PVA)を水に溶解した。継続的に撹拌しながら、精製水の必要合計量の約1/3にPVAを添加した。スラリーを20〜30分間撹拌し、次に、継続的に撹拌しながら80〜95℃に加熱した。80〜90℃の温度に到達してから1時間以内に、混合物を熱源から外し、さらに10分間撹拌して、均質性を確実にした(パートI)。ブリモニジンタートレート以外の眼用溶液の他の成分を、精製水の必要合計量の1/3を含有する別の容器において溶解させた(パートII)。次に、数回の洗浄容量の精製水を使用して、PVA混合物(パートI)をパートIIに定量的に移した。pHの調節を行わずに、精製水を使用して溶液を最終容量に調節した。
【0110】
ブリモニジンタートレートを計量し、前記の製剤賦形剤5mLを含有する10mLの試験管に入れた。次に、稀水酸化ナトリウムおよび/または稀塩酸を使用して、各試料のpHを所望の値に調節した。撹拌プレート上のラックに試料を配置し、高速で撹拌して、2日間にわたる均質混合を行った;仕切板をラックと撹拌プレートに間に配置して、撹拌プレートから試料への熱拡散を防止した。試験中、実験室の温度を監視し、23±1℃であることを確認した。
【0111】
2日間の撹拌の終了時に、各試料のpH値を測定し、次に、約1mLの各試料をミクロ遠心管(ポリプロピレン)に入れ、4000rpmで10分間遠心分離した。上澄みを1μmフィルターユニット(Whatman、13mm、PTFE)で濾過した。濾液の初めの3〜4滴を捨て、残りの濾液を採取し、HPLC移動相で定量的に稀釈した。次に、ブリモニジンタートレートアッセイ用のHPLCカラム(Dupont Zorbax、250mm x 4.6mm、5μm)に稀釈試料を直接注入して、ブリモニジンタートレートの量を定量した。0.5%ブリモニジンタートレートの対照を、同じ製剤賦形剤中、pH6.3〜6.5で調製し、遠心分離および濾過の前(非処理)および後(処理済)にアッセイに付した。このようにすることによって、試料調製のこれらの2つの段階におけるブリモニジンタートレートの潜在的損失を評価した。再現性を確実にするために、連続する日に試験を繰り返した。
【0112】
【表1】

【0113】
製剤賦形剤におけるブリモニジンタートレートの溶解度データを表2に示す。これらの結果は、ブリモニジンタートレートの溶解度はpHに高依存性であり、pH5〜8において2桁を越える範囲に及ぶことを示している。pHが増加すると共に、溶解度は急激に減少する。処理および非処理対照についての結果は極めて似ており、遠心分離および濾過はブリモニジンタートレートの有意な損失を生じないことを示している。連続する日に得た2つの溶解度プロフィールは、一致している。
【0114】
【表2】

a 遠心分離および濾過のために試料採取する前に、2日間撹拌した後に測定。
b 試料重量に基づく理論濃度を示す。試料溶液は透明であり、全てのブリモニジンタートレートが溶解したことを示す。
c 遠心分離および濾過段階の前の、対照におけるブリモニジンタートレートの濃度。
d 遠心分離および濾過段階の後の、対照におけるブリモニジンタートレートの濃度。
e %w/v。
【実施例2】
【0115】
SECを含有する液体製剤およびSECを含有しない液体製剤における、ブリモニジンタートレートの溶解度に対するpHの影響を調べた。特に、種々のpH条件におけるブリモニジンタートレートの溶解度に対する、種々の濃度のSECであるナトリウムカルボキシメチルセルロース(CMC)の存在または不存在の影響を調べた。ブリモニジンタートレートを使用して試験したCMCの種々の濃度は、0%、0.056%、0.17%、0.5%、1.5%(w/v)であった(表3)。
【0116】
試験した試料は、等張化成分、緩衝剤成分および安定化二酸化塩素(Purite(商標))も含有していた(表3)。ナトリウムカルボキシメチルセルロース、塩化ナトリウム、塩化カリウム、塩化カルシウム二水化物および塩化マグネシウム六水化物は、USPグレードであった。硼酸および硼酸ナトリウム十水化物はNFグレードであった。
【0117】
【表3】

a Allergan,Inc.から商品名Purite(商標)として市販。
【0118】
各試料(1〜5)を、約7〜10のpHにした。試料溶液を含むバイアルを実験用回転器に配置し、約21℃で15日間にわたって平衡化させた。0.45μmの孔サイズを有する25mm直径のポリスルホンセルロースアセテートシリンジ型フィルターを使用して、試料溶液を濾過した。濾過した溶液を、溶液中のブリモニジンタートレート量についてアッセイに付した。
【0119】
通常のHPLCおよび検出法を使用して、可溶性ブリモニジンタートレートの濃度を検出し、測定した(表4)。各CMC濃度に関して、溶解度をpHに対してプロットした。実験データポイントは、非線形最小二乗法ルーチン(nonlinear least squares routine)(Deltagraph バージョン4.0、DeltaPoint Inc.)を使用する改良Henderson−Hasselbalch式に適合させた(図1)。R5値は、実験値と理論式との統計学的適合度が0.991より大であることを示す。
【0120】
【表4】

【0121】
図1は、ブリモニジンタートレートの溶解度が、特定pHでCMC濃度の関数として増加することを明らかに示している。例えば、pH7.5において、0%CMCの試料は1000ppmのブリモニジンタートレートを生じ、0.056%CMCは1300ppm、0.17%CMCは1300ppm、0.5%は1600ppmを生じた。pH7.5において、1.5%CMCを含有する試料は、約1400ppmを生じ、これは、0.5%のCMCを含有する同じ溶液より少ない。現在のところ、この観察結果の原因は解明されていない。それでも、ブリモニジンタートレートは、1.5%CMCを含有する溶液において、CMCを含有しない溶液におけるより高い溶解性を示す。
【0122】
それでも、ブリモニジンタートレートは、1.5%CMCを含有する溶液において、CMCを含有しない溶液におけるより明らかに高い溶解性を示す。
CMCは、生物学的環境、例えば、角膜の生物学的環境においても、ブリモニジンタートレートを可溶化するのに有効である。
【実施例3】
【0123】
亜塩素酸塩を含有する組成物を入れた試験管に、ブリモニジンタートレートを添加する。該試験管を、10日間にわたって平衡化させる。尿素のようなカオトロピック剤の存在下または不存在下にサイズ排除カラムを用いるHPLCによって、試験管から得た試料を分析する。溶液中のブリモニジンの見掛分子量から、ブリモニジンタートレートモノマー単位の一部が結合してダイマーを形成したのが観察される。
【実施例4】
【0124】
ブリモニジンタートレートを、PURITE(登録商標)を保存剤として含有する水溶液中、pH7.2および濃度0.15%(w/v)で眼に局所的にデリバーするために製剤化した。この製剤の眼圧降下作用をヒト臨床患者においてALPHAGAN(登録商標)の作用と比較して測定した。ALPHAGAN(登録商標)は、0.05%塩化ベンザルコニウムを保存剤として含有するクエン酸緩衝液中のpH6.5の眼用局所水溶液中に製剤化された0.2%ブリモニジンタートレートを含有する。0.2%(w/v)ブリモニジンタートレートおよびPURITE(登録商標)保存剤を含有する第3の製剤も対照として使用した。
【0125】
3製剤のうちの1つを12箇月間にわたり1日3回、各患眼に1滴ずつの用量で投与するように、緑内障または高眼圧と診断されたヒト患者381人を、ランダムに振り分けた。2週間、6週間、3箇月、6箇月、9箇月および12箇月後の時点で眼圧(IOP)を測定する。
【0126】
12箇月の期間の終了時に、試験結果によると、ALPHAGAN(登録商標)(pH6.5で調製された0.2%ブリモニジン)と比較して、pH7.2で調製した活性成分含量が25%少ない溶液(0.15%ブリモニジン)の眼圧降下効果に有意な差はなかった。一方、より高濃度のブリモニジン(0.2%)と比較して、0.15%ブリモニジンを投与した患者が報告した副作用(例えばアレルギー性結膜炎、口渇、結膜充血および眼の分泌物)の発生率は低かった。この差は、PURITE(登録商標)を含有する0.2%ブリモニジン溶液では見られないので、保存剤の違いに起因するものではない。
【実施例5】
【0127】
下記のpH7.7の0.1%ブリモニジンタートレート溶液を調製した。
【表5】

【実施例6】
【0128】
実施例5に示すようにpH7.7の0.1%(w/v)ブリモニジンタートレート含有局所眼用水溶液(「BP0.1%」を調製し、高IOPのヒト臨床患者において試験し、ALPHAGAN(登録商標)(0.05%塩化ベンザルコニウムを保存剤として含有するpH6.5のクエン酸緩衝眼用局所水溶液中の0.2%ブリモニジンタートレート)の効果と比較した。
【0129】
2溶液の一方を1日3回患眼に1滴ずつ投与するよう、ヒト臨床患者433人をランダムに振り分けた。眼圧をベースライン(0日目)、3週間、6週間および3箇月後の時点で測定する。
【0130】
結果は次の通りであった:
ベースライン
時間0でのIOPは2群とも同じであった(24.7mmHg)。2時間後のIOP(〜23mmHg)および8時間後のIOP(〜22mmHg)は、2群とも同様であった。
【0131】
ベースライン後の、時間0でのIOP
ベースライン測定後、3箇月間の追跡期間中の時間0での平均IOP範囲は次の通りであった:
・20.7〜21.4mmHg(BP0.1%)
・21.0〜21.7mmHg(ALPHAGAN、登録商標)
【0132】
ベースライン後、日周IOP
ベースライン後の時点の結果は、処置群間で概ね同様であった。3箇月後において、時間0、2時間後および8時間後の日周IOP群平均の範囲は次の通りであった:
・17.2〜21.4mmHg(BP0.1%)
・17.6〜21.7mmHg(ALPHAGAN、登録商標)
【0133】
試験期間にわたり、BP0.1%製剤とALPHAGAN(登録商標)製剤との実質的に同様の効果を患者が経験したことを、本試験は示している。このような結果は全く予想外であった。一方、BP0.1%は活性成分ブリモニジンタートレートをALPHAGAN(登録商標)製剤の50%量しか含有しないためであろうが、報告された副作用(例えば口渇、無力および眼の痒み)の発生数は、BP0.1%群ではALPHAGAN(登録商標)群よりも少なかった。
【実施例7】
【0134】
次表に従って別のpH7.7の0.1%ブリモニジンタートレート溶液を調製しうる。

【実施例8】
【0135】
次表に従って別のpH7.7の0.1%ブリモニジンタートレート溶液を調製しうる。

【0136】
理解されるであろうが、ナトリウム塩は他の金属陽イオン(例えばカリウムまたはカルシウム)の塩で置き替えうる。浸透圧調節剤を使用する場合、これは塩または非イオン性浸透圧調節剤(例えばグリセリン)でありうる。緩衝剤は、選択したpHで適当な緩衝能を有する任意の剤から成りうる。上記濃度は例として示すもので、より広い局面において本発明を制限するものではない。
【0137】
種々の特定の実施例および態様に関して本発明を説明したが、本発明はそれらに限定されず、当業者が特許請求の範囲内で変更を加えて実施しうると理解されるものとする。
【技術分野】
【0001】
本発明は、α−2−アドレナリンアゴニスト成分を含有する組成物に関する。本発明は特に、α−2−アドレナリンアゴニスト成分が、処置有効濃度において向上した溶解度を有する組成物に関し、ここで、αアドレナリン成分を含有する溶液は、与えられたpHおよび濃度において、より酸性のpHおよびより高い濃度でαアドレナリン成分を含有する第2の溶液と実質的に同様の有効性を示す。
【背景技術】
【0002】
α−2−アドレナリンアゴニスト成分は、α−2−アドレナリン受容体に対して作用するまたは結合して処置効果を与えるのに有効な、化合物、イオン、複合体等のような化学物質を包含する。本発明において「α−2−アドレナリンアゴニスト成分」なる用語は、アゴニスト自体、およびあらゆるその先駆物質、塩、エステル、代謝物および組合せを意味する。
【0003】
α−2−アドレナリンアゴニスト成分を含有する組成物を調製する際の課題の1つは、そのような成分をより有効にすることである。例えば、液体組成物中のα−2−アドレナリンアゴニスト成分は、そのような組成物の液体担体に溶解性であることによって有益である場合が多い。そのような溶解性は、均質かつ正確な投与を助長する。
【0004】
さらに、ディスペンスまたは投与されたα−2−アドレナリンアゴニスト成分は、例えば、細胞膜または脂質二重層を通過する効果的なまたは増加した生体内拡散のために、生物学的系または環境において溶解性であるのが有利である。より高いpKa(約7より高いpKa)を有するいくつかのα−2−アドレナリンアゴニスト成分(例えばブリモニジンを包含する)は、そのような環境中の溶液にあるとき、中性ないしアルカリ性の生物学的環境では主に非荷電であるから、そのpKaに近いかまたはより高いpH値において脂質膜を通って極めてよく分散する傾向がある。この高いpHではより疎水性であるので、より細胞膜に浸透し易い。
【0005】
しかし、約7を越えるpHでは、対抗因子が生じる。そのような同じα−2−アドレナリンアゴニスト成分のいくつかは、中性ないしアルカリ性生物学的pH値の水溶液中では溶解性が低下する傾向を示す。そのような水溶性低下は、処置効果をもたらすために細胞膜に浸透する溶液中の利用可能な活性剤が少なくなることを意味する。すなわち、可溶性化合物がその非荷電状態の故に細胞膜により浸透し易くなるとしても、処置効果提供のために溶液中に存在する該成分は少なくなる。すなわち、約7.0を越えるpHでα−2−アドレナリンアゴニスト成分が沈殿することにより、α−2−アドレナリンアゴニスト成分の有効性が低下し、および/または一定用量での処置効果の変動が大きくなりうるという恐れがある。
【0006】
さらに、可溶化されたα−2−アドレナリンアゴニスト成分は、不溶性α−2−アドレナリンアゴニスト成分に優る他の利点をも提供し、その例は、α−2−アドレナリンアゴニスト成分と相互作用する組織の刺激の軽減である。
【0007】
α−2−アドレナリンアゴニストの1つであるブリモニジンは、眼用0.2%水溶液としてALPHAGAN(登録商標)の名称で市販されている。この溶液は0.2%ブリモニジンタートレートを含有し、0.05%塩化ベンザルコニウムを保存剤として含有するクエン酸緩衝液中にpH6.5で製剤化されている。
【0008】
ブリモニジンはまた、眼用0.15%溶液としてALPHAGAN P(登録商標)の名称でも市販されている。この溶液はpH7.2で製剤化され、カルボキシメチルセルロースおよび0.005%の安定化オキシクロロ保存剤(PURITE、登録商標)を含有する。
【0009】
Katzら、J. Glaucoma 11:119(2002年4月)、Twelve-Month Evaluation of Brimonidine Purite Versus Brimonidine in Patients with Glaucoma or Ocular Hypertensionには、眼圧降下のために局所投与した場合、0.15%ブリモニジンと保存剤PURITE(登録商標)を含有する製剤は、0.2%ブリモニジンを含有する製剤と同様の効果を示すことが開示されている。該文献を引用により本発明の開示の一部とする。
【発明の概要】
【発明が解決しようとする課題】
【0010】
高い有効性を持ちながら副作用(全身的副作用を包含する)の発生は少ないα−2−アドレナリンアゴニスト成分を含有する新規組成物が依然として必要とされている。
【課題を解決するための手段】
【0011】
本発明は、活性剤をより効果的に標的細胞または組織にデリバーすることのできる新規α−2−アドレナリンアゴニスト成分含有組成物を見出したことに基づく。この有効性向上には、溶解性と中性またはアルカリ性pHとの2つの因子が寄与しうる。本発明においてpH値は室温で測定される値であると理解される。
【0012】
一態様において、本発明の組成物は、組成物、および好ましくは、組成物を投与または導入する環境(例えばヒトの眼のような生物学的環境)におけるα−2−アドレナリンアゴニスト成分の可溶化を少なくとも促進または補助するのに有効なある種の物質を含有する。好ましくは、本発明によるα−2−アドレナリンアゴニスト成分の水溶性は、標的細胞または組織への処置効果の、確実で一貫性のある提供を促進する。
【0013】
他の一態様においては、本発明は、α−2−アドレナリンアゴニスト成分を含有する水溶液であって、約7.0を越えるpH、好ましくはpH約7.0〜8.5、より好ましくはpH約7.2〜8.2または7.2、より一層好ましくはpH約7.5〜8.0または7.7を持つものに関する。この態様において、水溶液は場合により、α−2−アドレナリンアゴニスト成分の可溶化を少なくとも促進または補助するのに有効な物質または物質混合物を含有しうる。あるいは、溶液はそのような外部からの可溶化物質を含まず、前記pH値を有する水溶液中の可溶性α−2−アドレナリンアゴニスト成分を含有するか、またはそれから本質的に成っていてよい。この態様において、中性またはアルカリ性のpHが、より容易なα−2−アゴニスト成分の細胞膜通過を可能にする。
【0014】
すなわち、可溶性α−2−アドレナリンアゴニスト成分のpHが約7.0を越える場合、脂質膜を通過しての該成分の輸送が促進される。また、αアドレナリン成分が可溶である故に、α−2−アドレナリンアゴニスト用量が信頼性および再現性を持つようになる。
【0015】
ある種のα−2−アドレナリン成分は望ましくない副作用を有することが知られている。例えば、クロニジンおよびチザニジンは、全身的投与により、呼吸器および心血管抑制ならびに鎮静作用を示すことがわかっている。したがって、通常用いられるよりも少ない有効用量で有効性を維持することのできるα−2−アドレナリンアゴニスト製剤は明らかに有利である。
【0016】
本発明の他の一態様においては、保存剤を含有するα−2−アドレナリンアゴニスト成分含有組成物は、実質的な利点を提供することがわかった。その利点とは例えば、α−2−アドレナリンアゴニスト成分との、および/または組成物投与対象患者との望ましくない相互作用を低減しながら、保存剤の有効性を維持するということである。好ましくは、αアドレナリン成分はブリモニジンである。
【0017】
本発明の組成物は好ましくは、従来のα−2−アドレナリンアゴニスト成分の有効性を向上または維持し、かつ従来の製剤にはなかった更なる利点を提供する。このことは、α−2−アドレナリンアゴニスト成分を水溶液中に維持し、なおかつ約7.0を越えるpH、好ましくはpH約7.0〜8.5、より好ましくはpH約7.2〜8.2または7.2、より一層好ましくはpH約7.5〜8.0またはpH約7.7を保つことによって達成される。α−2−アドレナリンアゴニスト成分の膜透過性を高めることによって、投与製剤中のα−2−アゴニスト(特にブリモニジンであるが、これに限定されない)の濃度を低下することができ、それによって全身的副作用を軽減することができる(特に製剤を全身的投与する場合)。
【0018】
本発明のいくつかの態様の範囲内において、局所眼用製剤中のブリモニジン(その薬学的に許容しうる塩、例えばタートレートを包含する)の濃度を0.2%(w/v)未満(好ましくは約0.01〜0.1%(w/v))に低下して、pH約6.6〜6.8の0.2%ブリモニジンタートレート製剤であるALPHAGAN(登録商標)と同じかまたは実質的に同等の効果を保つことができる。他の一態様においては、約7.0を超えるpH(好ましくはpH約7.2〜7.7)でブリモニジン濃度を好ましくは約0.01〜0.15%(w/v)としても、2製剤間に有効性の実質的な相異はない。
【0019】
図1に示すように、代表的なα−2−アドレナリンアゴニストである5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンタートレートの溶解度は、水溶液のpHの上昇につれて低下する。5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンのpKaは約7.4である。溶液をよりアルカリ性にすると、溶液中の大多数の分子が電気的に中性となり、従ってより疎水性となる。
【0020】
図1に示すように、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンの異なる溶液はすべて、pH上昇につれて溶解度が低下するという共通の傾向を示す。十字形でプロットした曲線は、カルボキシメチルセルロース(CMC)を加えていない活性剤含有水溶液のものである。上記のような溶液は本発明のある種の態様の範囲内のものである。
【0021】
一態様において、α−2−アドレナリンアゴニスト成分の有効性を、α−2−アドレナリンアゴニスト成分の溶解度の向上によって、好ましくは中性よりも高いpH値で向上する。本発明のこの態様において、本発明は、α−2−アドレナリンアゴニスト成分に加えて、溶解度向上成分(SEC)を、α−2−アドレナリンアゴニスト成分の溶解度を与えられたpHで向上するのに有効な量で含有する。このようなSECは、好ましくはアニオン性であり、より好ましくはポリマーである。一態様において、SECはセルロース誘導体であり、他の一態様においてSECはセルロース誘導体またはシクロデキストリンではない。
【0022】
本発明のこの態様において、α−2−アドレナリンアゴニスト成分は、本発明の組成物(例えばpHが約7またはそれ以上のもの)において、SEC不含有の実質的に同じ組成物におけるよりも溶解度が高い。他の一態様において、本発明の組成物のα−2−アドレナリンアゴニスト成分は、SEC不含有の同様の組成物中のα−2−アドレナリンアゴニスト成分と比較して、組成物を投与する中性またはアルカリ性の生物学的環境における溶解度がより高い。この後者の性質は、α−2−アドレナリンアゴニスト成分をその作用部位に局所的にデリバーする場合に特に顕著である。
【0023】
本発明において使用するα−2−アドレナリンアゴニスト成分は、イミノ−イミダゾリン、イミダゾリン、イミダゾール、アゼピン、チアジン、オキサゾリン、グアニジン、カテコールアミン、それらの生物学的適合性塩およびエステル並びに混合物を包含する。好ましくは、α−2−アドレナリンアゴニスト成分は、キノキサリン成分を包含する。キノキサリン成分は、キノキサリン、その生物学的適合性塩、エステル、他の誘導体等、およびそれらの混合物を包含する。キノキサリン誘導体の非制限的な例は、(2−イミダゾリン−2−イルアミノ)キノキサリン、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリン、およびそれらの生物学的適合性塩およびエステル、好ましくは、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンのタートレート等、およびそれらの混合物である。以下、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンのタートレートは、「ブリモニジンタートレート」と称する。
【0024】
好ましい態様において、先に挙げたようなα−2−アドレナリンアゴニスト成分は、1つまたはそれ以上の他のアドレナリン受容体における活性との関連で、α−2A−アドレナリン受容体、α−2B−アドレナリン受容体および/またはα−2D−アドレナリン受容体に選択的である。好ましくは、α−2−アドレナリンアゴニスト成分は、α−1−アドレナリン受容体におけるその活性と比較して、α−2A−アドレナリン受容体、α−2B−アドレナリン受容体および/またはα−2D−アドレナリン受容体に選択的である。
【0025】
一態様において、α−2−アドレナリンアゴニスト成分は、本発明の組成物中において少なくとも約30%が非荷電であり、好ましくは少なくとも約50%が非荷電である。当業者は理解するであろうが、pKaはイオン化定数の負の対数(または化合物が50%イオン化されるときのpH)であり、本願において非荷電の化合物の割合を示すときは(例えば、少なくとも30%または50%非荷電、のように)、化学量論量基準での化合物について示す。
【0026】
より一層好ましくは、可溶性α−2−アドレナリンアゴニスト成分はまた、組成物を投与する生物学的環境において少なくとも約30%非荷電または少なくとも約50%非荷電である。
【0027】
α−2−アドレナリンアゴニスト成分をSECと共に製剤化する場合、SECは、非イオン性またはポリアニオン性成分を包含しうる。本明細書において使用する「ポリアニオン性成分」という用語は、化学物質、例えば、イオン荷電された種、例えば、複数の孤立(discrete)アニオン電荷を有するイオン荷電ポリマー物質を意味する。非イオン性SECは、ポリビニルアルコール(PVA)、ポリビニルピロリドン(ポビドン)並びに種々のガムおよび他の非イオン性剤を包含しうる。
【0028】
好ましい態様において、SECは、複数のアニオン電荷を有するポリマー物質およびその混合物から選択しうるポリアニオン性成分である。
【0029】
特に有用なポリアニオン性成分は、アクリル酸から誘導するアニオン性ポリマー(アクリル酸、アクリレート等、およびそれらの混合物から誘導するポリマーを包含する)、メタクリル酸から誘導するアニオン性ポリマー(メタクリル酸、メタクリレート等、およびそれらの混合物から誘導するポリマーを包含する)、アルギン酸から誘導するアニオン性ポリマー(アルギン酸、アルギネート等、およびそれらの混合物から誘導するポリマー包含する)、アミノ酸から誘導するアニオン性ポリマー(アミノ酸、アミノ酸塩等、およびそれらの混合物のポリマーを包含する)等、およびそれらの混合物から選択する。非常に効果的なポリアニオン性成分は、アニオン性セルロース誘導体およびそれらの混合物、特にカルボキシメチルセルロースおよびその誘導体から選択する。
【0030】
好ましくは、ポリアニオン性成分は、α−2−アドレナリン成分の溶解性と相互作用するかもしくは該溶解性に影響を及ぼすか、または該溶解性を高めるのに充分にアニオン性である。この相互作用は、α−2−アドレナリン成分を、処置に有効な濃度において実質的に充分に可溶性にするのに充分であるのが好ましい。組成物におけるSECの量は、好ましくは約0.1〜30%(w/v)、より好ましくは約0.2〜10%(w/v)、さらに好ましくは約0.2〜0.6%(w/v)である。
【0031】
組成物は、担体成分、例えば水性液体担体成分をも含有しうる。一態様において、組成物のpHは約7.0を越え、好ましくは約7.0〜8.5、より好ましくは約7.2〜8.2、より一層好ましくは約7.5〜8.0である。また、本発明の組成物は好ましくは眼科学的に許容しうる。
【0032】
他の好ましい一態様において、組成物を投与する患者に少なくとも1つの処置利益を与えるのに有効な量のα−2−アドレナリンアゴニスト成分、α−2−アドレナリンアゴニスト成分の溶解度を向上させるのに有効な量のアニオン性セルロース誘導体、および水性液体担体成分を含有する組成物を提供する。α−2−アドレナリンアゴニスト成分は、好ましくは、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンのタートレートを含んで成る。アニオン性セルロース誘導体は、好ましくは、カルボキシメチルセルロースを含んで成る。組成物におけるアニオン性セルロース誘導体の濃度は、約0.2〜0.6%(w/v)でなければならない。
【0033】
本発明の組成物の好ましい態様において、組成物は5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンまたはその塩もしくはエステルを含有する。該α−2−アドレナリンアゴニストの濃度は、0.2%未満、好ましくは0.2〜約0.001%(w/v)、より好ましくは約0.15%(w/v)またはそれ以下、より一層好ましくは0.15〜約0.001%(w/v)、最も好ましくは約0.1%(w/v)またはそれ以下である。
【0034】
また、本発明の組成物の好ましい態様は、中性またはアルカリ性pHの水溶液を含んで成る。組成物のpHは好ましくは室温で約7.0もしくはそれ以上、または室温で約7.2もしくはそれ以上、より好ましくは室温で約7.5もしくはそれ以上、最も好ましくは室温で約7.7もしくはそれ以上である。
【0035】
好ましい態様において、本発明の組成物は眼科学的に許容し得、例えば、該組成物は、組成物を投与するヒトまたは動物の眼を実質的に害しうる有害なまたは毒性の性質を有さない。
【0036】
本発明の一態様において、複合体が組成物において形成されうる。一態様において、複合体は、少なくとも1つのキノキサリン成分から誘導されるモノマー単位を有する。好ましい態様においては、本発明の複合体はダイマーである。特に好ましい態様において、複合体は、ブロモニジンタートレートの複合体、特にダイマーである。
【0037】
本発明の他の広い一態様において、α−2−アドレナリンアゴニスト成分、および組成物の保存を少なくとも助長するのに有効な量の保存剤成分を含んで成る組成物を提供する。好ましくは、保存剤成分は、生物学的に許容され、化学的に安定であり、組成物中のα−2−アドレナリンアゴニスト成分または組成物を投与する患者に実質的にまたは有意に不利な影響を与えないオキシ−クロロ成分、例えば、化合物、イオン、複合体等を包含する。そのような組成物は、組成物において、または組成物を投与する患者において、シクロデキストリンを実質的に含有しないのが好ましい。
【0038】
文脈、本明細書および当業者の知識から明らかなように、本明細書に記載されるあらゆる特徴、または特徴の組合せは、そのような組合せに含まれる特徴が相互に矛盾しないことを条件として、本発明に含まれる。本明細書中で数値範囲を示す場合、それはその範囲内の個々の値をすべて開示するものであり、すなわちそのような値のすべての列挙の省略に過ぎないと理解すべきである。
本発明の他の利点および局面は、下記の詳細な説明および特許請求の範囲から明らかである。
【図面の簡単な説明】
【0039】
【図1】種々のカルボキシメチルセルロース濃度の室温の水溶液中における可溶性ブリモニジンタートレートをpHに対してプロットしたグラフである。
【発明を実施するための形態】
【0040】
α−2−アドレナリンアゴニスト成分を含有する処置有効性の組成物を提供する。本発明の組成物は、中性またはアルカリ性pHで調製する利点を提供する。すなわち、実質的に非荷電の、より脂溶性の形態で活性剤の製剤を提供する。α−2−アドレナリンアゴニスト成分が細胞膜をより通過し易いので、本発明の組成物は、酸性pHで調製された組成物と比較して、同等の効果を有するか、または向上した効果を有する。
【0041】
本発明の組成物の各性状は必然的に処置に有効である。処置に有効でない組成物は特許請求の範囲に包含されることを意図しない。「処置に有効」とは、組成物が処方または指示されたように使用されたときに、プラセボと比較して統計学的に有意な医学的有益効果を示すことができることを意味する。したがって、眼圧降下のために使用するよう処方された組成物は、指示通りに使用されたときに統計学的に有意な眼圧降下作用を示す組成物をさすことが意図される。
【0042】
一態様において、本発明は、α−2−アドレナリンアゴニスト成分が少なくとも30%非荷電、少なくとも40%非荷電、少なくとも50%非荷電または少なくとも60%非荷電であるようなpHの水溶液中で製剤化した該αアドレナリン成分を含有する組成物、例えば局所眼用組成物を意図する。
【0043】
特に好ましい態様においては、本発明は、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンまたはその塩を含有する組成物に関し、ここで溶液を0.2%(w/v)未満の濃度で調製する。組成物中の活性成分濃度は、好ましくは0.2〜約0.001%(w/v)、より好ましくは約0.15%(w/v)またはそれ以下、より一層好ましくは0.15〜約0.001%(w/v)、最も好ましくは約0.1%(w/v)またはそれ以下である。
【0044】
本発明のこの態様のさらなる好ましい側面として、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンまたはその塩は、pHが室温で約7.0を越えるか、または室温で約7.2もしくはそれ以上、より好ましくは室温で約7.5もしくはそれ以上、最も好ましくは室温で約7.7もしくはそれ以上である水溶液中に存在する。
【0045】
他の一態様において、本発明の組成物中のα−2−アドレナリンアゴニスト成分を、より可溶性とし(特に中性ないしアルカリ性のpH値で)、処置剤としてより効果的に利用しうる。本発明の組成物中に使用するSECは、荷電α−2−アドレナリンアゴニスト成分、非荷電α−2−アドレナリンアゴニスト成分またはその両方を可溶化するのに有効でありうる。本発明の組成物は液体担体成分を含有し、液体(例えば水性液体)溶液の性質を有する。
【0046】
α−2−アドレナリンアゴニスト成分は、α2受容体のα2A、α2Bまたはα2Cサブタイプの少なくとも1つに対する刺激活性を有する。そのような1つまたはそれ以上のサブタイプにおける活性は好ましくは、α1アドレナリン受容体サブタイプにおける活性よりも少なくとも10倍大きい。より一層好ましくは、α2受容体における活性は、α1受容体における活性の少なくとも50倍、または少なくとも100倍、または少なくとも1000倍大きい。α−2−アゴニストの例は、キシラジン、デトミジン、メデトミジン、クロニジン、ブリモニジン、チザニジン、ロフェキシジン、グアンファシン、グアナベンズ・アセテート、およびデクスメデトミジンを包含するが、それらに限定されない。
【0047】
α−2−アドレナリンアゴニスト成分は、pHが7を越える本発明組成物に可溶である。一態様において、本発明組成物はαアドレナリンアゴニスト成分を室温でのその水溶性の限界またはほぼ限界で含有し、pH7またはそれ以下の同様の組成物中のより高濃度の該αアドレナリンアゴニスト成分に匹敵する有効性を維持する。
【0048】
好ましい一態様において、α−2−アドレナリンアゴニスト成分は本発明の組成物中で少なくとも1つのSECと組み合わせるので、SEC不含有組成物中の同じα−2−アドレナリンアゴニスト成分と比較して、同等の濃度において、pHが7を越える本発明組成物(例えばpHが約7.2、約7.4、約7.7および約8.0の本発明組成物であるが、それらに限定されない)中で溶解性が向上している。
【0049】
好ましい組成物は、pH約7.7で約0.1%(w/v)のブリモニジンを含有する。より一層好ましくは、そのような組成物はSECをも含有する。SECは任意のSECから選択しうるが、好ましいSECはカルボキシメチルセルロース、ポリビニルアルコールまたはポリビニルピロリドンを包含する。
【0050】
他の一態様において、α−2−アドレナリンアゴニスト成分は、pH約7〜10の範囲の本発明組成物中において、SEC不含有の同様の組成物中の同じα−2−アドレナリンアゴニスト成分と比較して、同等の濃度で、向上した溶解性を示す。より一層好ましくは、本発明の組成物中のα−2−アドレナリンアゴニスト成分はそのような向上した溶解性を、約7.0を越えるpHで、好ましくはpH約7.0〜8.5で、より好ましくはpH約7.2〜8.2で、より一層好ましくはpH約7.5〜8.0で、またはpH約7.7で示す。
【0051】
いかなる理論または作用メカニズムによる限定をも意図するものではないが、可溶化されたα−2−アドレナリンアゴニスト成分は、非可溶化α−2−アドレナリンアゴニスト成分と比較して、脂質膜をより容易に通過することができると考えられる。更に、非荷電α−2−アドレナリンアゴニスト成分は荷電したものよりも、脂質膜をより容易に通過できるとも考えられる。
【0052】
一態様において、SECはα−2−アドレナリンアゴニスト成分を、それを処置有効濃度で導入する生物学的環境において、可溶化することができる。本発明の組成物を導入する生物学的環境は、好ましくは約7〜9のpHを有する。例えば、SECおよびα−2−アドレナリンアゴニスト成分を含んで成る組成物を、約7のpHを有する眼の表面に局所投与することができ、ここで、α−2−アドレナリンアゴニスト成分は投与された領域で実質的に可溶である。さらに、一態様において、投与領域における可溶性α−2−アドレナリンアゴニスト成分は、SECの存在または他の理由で、可溶性でないα−2−アドレナリンアゴニスト成分より容易に、生体脂質膜を通って拡散しうる。水溶液中のα−2−アドレナリンアゴニスト成分の溶解性の維持は、好ましくは、α−2−アドレナリンアゴニスト成分と接触または相互作用する感受性組織への刺激を低減させる。
【0053】
本発明の組成物中の可溶性α−2−アドレナリンアゴニスト成分は、当然、処置有効濃度でデリバーすることが可能でなければならない。可溶性α−2−アドレナリンアゴニスト成分を極く低濃度で含有する溶液を調製することは明らかに可能であるが、そのような溶液は、投与する哺乳動物に利益を与えるのに有効でないなら処置に有用ではない。好ましくは、本発明の組成物は、同じα−2−アドレナリンアゴニスト成分を含有するpH7.0未満の製剤と実質的に同等であるか、またはそれ以上の処置効果を提供することができる。より一層好ましくは、本発明の組成物は、同じα−2−アドレナリンアゴニスト成分を含有するpH7.0未満の製剤と実質的に同等であるか、またはそれ以上の処置効果を提供することができ、かつ、活性剤を低pH製剤よりも低濃度で含有する。
【0054】
好ましい一態様において、有用なα−2−アドレナリンアゴニスト成分は、SECの存在により利益を受け、安定化または可溶化されるように選択する。この態様において、α−2−アドレナリンアゴニスト成分は、SECの存在によって、向上した見掛溶解性、好ましくは向上した見掛水溶性を付与される。
【0055】
α−2−アドレナリンアゴニスト成分の例は、アミンを含む分子である。α−2−アドレナリンアゴニスト成分は、好ましくは約7より大きい、より好ましくは約7〜9のpKaを有するアミン含有分子である。
【0056】
α−2−アドレナリンアゴニスト成分は、α−2−アドレナリンアゴニストを包含する。本明細書において「α−2−アドレナリンアゴニスト」なる用語は、1つまたはそれ以上のα2Aアドレナリン受容体、α2Bアドレナリン受容体およびα2Cアドレナリン受容体に結合し、それを活性化する化学物質、例えば、化合物、塩、エステル、イオン、複合体等を包含する。そのようなGタンパク質結合受容体は、刺激を受けると多くの細胞シグナル機能を果たし、1つまたはそれ以上が、例えば、神経伝達物質ノルエピネフリンのシナプス前放出の抑制に関与しうる。理論による制限を意図するものではないが、考えられるのは、1つまたはそれ以上のα2受容体サブタイプの刺激の結果、標的ニューロンへのカルシウム流入が抑制される、すなわち神経伝達物質放出が阻害される、ということである。このシナプス前ニューロンにおけるノルエピネフリン抑制は、痛み応答の発生または伝播の抑制による鎮痛に関与するようである。
【0057】
α2受容体は主としてシナプス前部に見られるが、シナプス後およびシナプス外部並びに末梢およびCNSニューロンにも存在しうる。
【0058】
本発明のα−2−アドレナリンアゴニストは、α−2−アドレナリンアゴニスト受容体に結合して、作用する細胞のシナプス前部でニューロンのノルエピネフリンの放出の減少または抑制を引き起しうる。さらに、それらは、例えばサイクリックAMPのβ−アドレナリン受容体刺激形成を阻害することによって、シナプス後的にもα−2−アドレナリン受容体に作用しうる。
【0059】
α−2−アドレナリンアゴニストは、神経保護活性を有する化合物も包含する。例えば、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンは、神経保護活性を有するα−2−アドレナリンアゴニストである。神経保護メカニズムはまだ完全にはわかっていない。
【0060】
本発明を、以下に示す特定の群および化合物に限定するものではないが、本発明で有用な代表的α−2−アドレナリンアゴニストを以下に示す:クロニジン、アプラクロニジンを包含するイミノ−イミダゾリン;ナファゾリン、キシメタゾリン、テトラヒドロゾリンおよびトラマゾリンを包含するイミダゾリン;デトミジン、メデトミジンおよびデクスメデトミジンを包含するイミダゾール;B−HT 920(6−アリル−2−アミノ−5,6,7,8−テトラヒドロ−4H−チアゾロ[4,5−d]−アゼピン)およびB−HT 933を包含するアゼピン;キシラジンを包含するチアジン;リルメニジンを包含するオキサゾリン;グアナベンズおよびグアンファシンを包含するグアニジン;カテコールアミン等;およびそれらの塩、エステルおよび誘導体。
【0061】
特に有用なα−2−アドレナリンアゴニストは、キノキサリン成分を包含する。一態様において、キノキサリン成分は、キノキサリン、その誘導体およびそれらの混合物を包含する。好ましくは、キノキサリンの誘導体は、(2−イミダゾリン−2−イルアミノ)キノキサリンを包含する。より好ましくは、キノキサリンの誘導体は、5−ハライド−6−(2−イミダゾリン−2−イルアミノ)キノキサリンを包含する。5−ハライド−6−(2−イミダゾリン−2−イルアミノ)キノキサリンの「ハライド」は、フッ素、塩素、沃素、好ましくは臭素であり、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンを形成することができる。さらに好ましくは、本発明で使用するキノキサリンの誘導体は、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンのタートレートまたはブリモニジンタートレートを包含する。
【0062】
他の有用なキノキサリン誘導体もよく知られている。例えば、有用なキノキサリン誘導体は、Burkeらの米国特許第5703077号に開示されているキノキサリン誘導体を包含する。Danielwiczらの米国特許3890319号も参照できる。BurkeらおよびDanielwiczらの特許に開示されている内容は、それぞれ、本発明の開示の一部を構成するものとする。
【0063】
キノキサリンおよびその誘導体、例えばブリモニジンタートレートは、アミンを含有し、7より大きい、好ましくは約7.5〜9のpKaを有するのが好ましい。
【0064】
α−2−アドレナリンアゴニストとして作用する前記化合物の類似体も特に本発明に含まれるものとする。
【0065】
好ましくは、本発明のα−2−アドレナリンアゴニストは、α−2A−アドレナリン受容体、α−2B−アドレナリン受容体および/またはα−2C−アドレナリン受容体を活性化するのに有効である。
【0066】
一態様において、本発明の組成物中でα−2−アドレナリンアゴニスト成分は少なくとも約30%非荷電であり、好ましくは少なくとも約50%非荷電である。当業者は理解するであろうが、pKaはイオン化定数の負の対数(または化合物が50%イオン化されるときのpH)であり、本発明において非荷電化合物の割合を言うとき(例えば、少なくとも30%または50%非荷電、というように)、化学量論に基づく化合物についてのものである。
【0067】
好ましくは、本発明組成物の可溶性α−2−アドレナリンアゴニスト成分は、組成物を投与する生物学的環境において少なくとも約30%非荷電または少なくとも約50%非荷電である。
理論または作用機序による制限を意図するわけではないが、非荷電形態の本発明のα−2−アドレナリン化合物は、膜脂質二重層を通過し易いと考えられる。
【0068】
SECを伴う態様において、任意の好適なSEC(またはSECの組合せ)を本発明に使用することができる。一態様において、SECは非荷電SEC、例えばピロリドン成分、ポリビニルアルコール(PVA)、非荷電セルロース誘導体、Pemlin、カルボマー、Carbopol等を包含するが、それらに限定されない。ピロリドン成分の例は、ポリビニルピロリニドン(ポビドン)およびその誘導体である。さらなる態様において、SECはポリアニオン性成分を包含する。有用なポリアニオン性成分は、低溶解性α−2−アドレナリンアゴニスト成分の見掛溶解性、好ましくは水溶性を増加させるのに有効であり、および/またはα−2−アドレナリンアゴニスト成分の安定性を増加させ、および/またはα−2−アドレナリンアゴニスト成分の好ましくない副作用を減少させる物質を包含するがそれらに限定されない。さらに、ポリアニオン性成分は、使用濃度において眼科学的に局所処置に許容されるのが好ましい。さらに、ポリアニオン性成分は、3またはそれ以上のアニオン(または負)電荷を有するのが好ましい。ポリアニオン性成分がポリマー物質である場合、ポリマー物質の各反復単位が孤立アニオン電荷を有するのが好ましい。特に有用なアニオン性成分は、水溶性、例えば、α−2−アドレナリン成分を含有する液体水性媒体のような有用な液体水性媒体中に、使用される濃度およびpHで可溶のアニオン性成分である。
【0069】
ポリアニオン性成分は、α−2−アドレナリンアゴニスト成分の荷電または極性部分とイオン相互作用または静電相互作用するのに充分にアニオン性であるのが好ましい。そのような相互作用は、ある種の製剤のα−2−アドレナリンアゴニスト成分を可溶化し、および/またはそのようなα−2−アドレナリンアゴニスト成分を担体成分(例えば液体媒体)に可溶性に維持するのに好ましいと考えられる。
【0070】
ポリアニオン性成分は、複数のアニオン電荷を有する1つまたはそれ以上のポリマー物質も包含する。その例は下記のものである:
金属カルボキシメチルスターチ、
金属カルボキシメチルヒドロキシエチルスターチ、
加水分解ポリアクリルアミドおよびポリアクリロニトリル、
ヘパリン、
1つまたはそれ以上の下記物質のホモポリマー及びコポリマー:
アクリル酸およびメタクリル酸、
アクリル酸金属塩およびメタクリル酸金属塩、
アルギン酸、
アルギン酸金属塩、
ビニルスルホン酸、
ビニルスルホン酸金属塩、
アミノ酸、例えば、アスパラギン酸、グルタミン酸等、
アミノ酸の金属塩、
p−スチレンスルホン酸、
p−スチレンスルホン酸金属塩、
2−メタクリロイルオキシエチルスルホン酸、
2−メタクリロイルオキシエチルスルホン酸金属塩、
3−メタクリロイルオキシ−2−ヒドロキシプロピルスルホン酸、
3−メタクリロイルオキシ−2−ヒドロキシプロピルスルホン酸金属塩、
2−アクリルアミド−2−メチルプロパンスルホン酸、
2−アクリルアミド−2−メチルプロパンスルホン酸金属塩、
アリルスルホン酸、
アリルスルホン酸金属塩等。
「金属」は、アルカリおよびアルカリ土類金属、例えばNa、K、Ca等を意味する。
【0071】
他の態様において、ポリアニオン性成分は、高いpH、例えば約7またはそれ以上のpHにおいて、イオン化形態で存在する傾向があるアニオン性多糖を包含する。本発明に使用しうるアニオン性多糖の例を以下に示す。
【0072】
ポリデキストロースは、哺乳動物によって部分的にのみ代謝される、デキストロースのランダム結合縮合ポリマーである。このポリマーは、少量の結合ソルビトール、クエン酸およびグルコースを含有することができる。ナトリウムコンドロイチンスルフェートとしても知られているコンドロイチン硫酸は、ヒト組織の全ての部分、特に、軟骨、骨、腱、靱帯および血管壁に見られるムコ多糖である。このムコ多糖は、サメの軟骨から抽出され精製される。カラゲーニンは、反復ガラクトース単位および3,6アンヒドロガラクトース単位を有する線状多糖であり、該単位はいずれも、硫酸化されているかまたは硫酸化されていなくてよく、交互1−3およびβ1−4グリコシド結合によって結合している。カラゲーニンは、紅藻およびトチャカの数種から加熱抽出されるヒドロコロイドである。麦芽デキストリンは、水の存在下での、澱粉と酸および/または酵素との反応によって形成される水溶性グルコースポリマーである。
【0073】
本発明で有用であることが見い出された他のアニオン性多糖は、親水性コロイド物質であり、天然ゴム、例えば、ゲラン(gellan)ゴム、アルギン酸塩ゴム、即ち、アルギン酸のアンモニウムおよびアルカリ金属塩、およびそれらの混合物を包含する。さらに、脱アセチルキチンの通称であるキトサンも有用である。キチンは、ポリ−(N−アセチル−D−グルコサミン)を含んで成る天然産物である。ゲランゴムは、細胞外ヘテロ多糖を産生するシュードモナスエロデアの発酵によって産生される。アルギネートおよびキトサンは、例えばProtan,Inc.,Commack,N.Y.から乾燥粉末として入手できる。ゲランゴムは、例えばKelco Devision of Merk & Co.,Inc.,San Diego,Californiaから入手できる。
【0074】
一般に、アルギン酸塩は、アルギン酸アルカリ金属塩、例えば、アルギン酸のナトリウム、カリウム、リチウム、ルビジウムおよびセシウム塩ならびにアンモニウム塩、および有機塩基の可溶性アルギン酸塩、例えば、モノ−、ジ−またはトリ−エタノールアミンアルギネート、アルギン酸アニリン等を包含するどのような水溶性アルギン酸塩であってもよい。一般に、組成物の合計重量に基づいて、約0.2〜1重量%、好ましくは約0.5〜3.0重量%のゲラン、アルギン酸塩またはキトサンイオン性多糖を使用して、本発明のゲル組成物を得る。
【0075】
一態様において、アニオン性多糖は環化されている。より好ましくは、環化アニオン性多糖は10未満のモノマー単位を有する。さらに好ましくは、環化多糖は6未満のモノマー単位を有する。
【0076】
環化アニオン性多糖の特に有用な群は、シクロデキストリンである。シクロデキストリン群の例は、以下のものであるがそれらに限定されない:α−シクロデキストロリン、α−シクロデキストリンの誘導体、β−シクロデキストリン、β−シクロデキストリンの誘導体、γ−シクロデキストリン、γ−シクロデキストリンの誘導体、カルボキシメチル−β−シクロデキストリン、カルボキシメチルエチル−β−シクロデキストリン、ジエチル−β−シクロデキストリン、ジメチル−β−シクロデキストリン、メチル−β−シクロデキストリン、ランダムメチル−β−シクロデキストリン、グルコシル−β−シクロデキストリン、マルトシル−β−シクロデキストリン、ヒドロキシエチル−β−シクロデキストリン、ヒドロキシプロピル−β−シクロデキストリン、スルホブチルエーテル−β−シクロデキストリン等、およびそれらの混合物。スルホブチルエーテル−β−シクロデキストリンは、本発明において好ましい環化アニオン性多糖である。本発明に使用するSEC(前記シクロデキストリンを包含する)は、使用濃度において、哺乳動物(ヒトを包含する)に非毒性であるように調製するのが有利である。
【0077】
シクロデキストリンに関連して本明細書で使用する「誘導体」なる用語は、シクロデキストリン成分として機能し、例えば、本明細書に記載したように、活性成分の溶解性および/または安定性を増し、および/または活性成分の好ましくない副作用を減少し、および/または活性成分との包接化合物を形成するのに充分な、シクロデキストリンの特徴的化学構造を有する、あらゆる置換されたまたは修飾(改質)された化合物を意味する。
【0078】
シクロデキストリンおよび/またはそれらの誘導体をSECとして使用することができるが、本発明の一態様は、シクロデキストリン以外のSECおよび/またはそれらの誘導体も包含する。
【0079】
特に有用で、好ましい種類のポリアニオン性成分は、アニオン性セルロース誘導体を包含する。アニオン性セルロース誘導体は、金属カルボキシメチルセルロース、金属カルボキシメチルヒドロキシエチルセルロースおよびヒドロキシプロピルメチルセルロース並びにそれらの誘導体を包含する。
【0080】
本発明のポリアニオン性成分は、多くの場合、例えば固体状態で対イオン(特に該SECの孤立アニオン電荷の数にほぼ等しい複数の孤立カチオン)との組合せとして、非荷電状態で存在することができるので、電荷を持つとき、ポリアニオン性成分は電気的に中性となる。
【0081】
ポリアニオン性成分は眼用に許容されるのが好ましいので、非イオン化ポリアニオン性成分と会合する金属は、使用される濃度において眼用に許容されるのが好ましい。特に有用な金属は、アルカリ金属、例えばナトリウムおよびカリウム、アルカリ土類金属、例えばカルシウムおよびマグネシウム、およびそれらの混合物を包含する。
【0082】
ナトリウムは、非イオン化ポリアニオン性成分中で対イオンとして作用することのできる極めて有用な金属である。非イオン化状態においてH+および金属カチオン以外のカチオンと結合するポリアニオン性成分を、本発明に使用することができる。
【0083】
SECの使用を伴う本発明の態様において、SECの量は、α−2−アドレナリンアゴニスト成分の溶解度が少なくともいくらか増加する限りは限定的でなく、生物学的に許容される量で存在する。そのような量は、本発明の組成物において、および/またはヒトまたは動物への投与後に、所望の作用をするのに有効な量でなければならない。一態様において、SEC、好ましくはポリアニオン性成分の量は、本発明の組成物におけるα−2−アドレナリンアゴニスト成分の大部分の量、より好ましくは実質的に全ての量の可溶化を補助するのに充分な量である。有用な一態様において、本発明の組成物におけるポリアニオン性成分の量は、組成物の約0.1〜30%(w/v)またはそれ以上である。好ましくは、ポリアニオン性成分の量は、約0.2〜10%(w/v)である。より好ましくは、ポリアニオン性成分の量は、約0.2〜0.6%(w/v)である。
【0084】
さらに好ましくは、ポリアニオン性成分はカルボキシメチルセルロースであり、組成物中に約0.2〜0.6%(w/v)で存在する。本発明の組成物におけるカルボキシメチルセルロースの特に有効な濃度は、約0.5%である。
【0085】
一態様において、SEC、例えばカルボキシメチルセルロースは、組成物中にα−2−アドレナリンアゴニスト成分を可溶化するのを助長する。SECは、イオン化α−2−アドレナリンアゴニスト成分の可溶化を助長することができるが、本発明のこの態様で使用するSECは、中性またはアルカリ性pHでα−2−アドレナリンアゴニスト成分の可溶化を助長するのが好ましい。例えば、一態様において、カルボキシメチルセルロースは、イオン化α−2−アドレナリンアゴニスト成分を可溶化するのを助長することができる。他の態様において、カルボキシメチルセルロースは、実質的に非荷電分のα−2−アドレナリンアゴニスト成分を可溶化するのを助長することができる。好ましい態様において、カルボキシメチルセルロースは、組成物中でイオン化ブリモニジンタートレートを可溶化するのを助長する。より好ましくは、カルボキシメチルセルロースは、組成物中で実質的非荷電分のブリモニジンタートレートを可溶化するのを助長する。
【0086】
本発明の組成物は、組成物の保存を助長する保存剤成分も含有することができる。好ましい態様において、本発明の組成物は、組成物中の(即ちポリアニオン性成分の存在下)で保存剤として有効であり、組成物をヒトまたは動物に投与した場合に好ましくは低下した毒性を有する(より好ましくは実質的に毒性を有さない)ように選択した少なくとも1つの保存剤成分を含有する。
【0087】
組成物、好ましくは組成物中のα−2−アドレナリンアゴニスト成分の保存を助長する本発明の保存剤成分は、約1%(w/v)未満または約0.8%(w/v)未満の濃度において有効であるのが好ましく、500ppm(w/v)またはそれ以下、例えば約10ppm(w/v)またはそれ以下から約200ppm(w/v)までであってよい。本発明の保存剤成分は、好ましくは、塩化ベンザルコニウムよりも少ない程度でポリアニオン性成分と複合体を形成する保存剤成分を包含するが、それらに限定されない。
【0088】
本発明の保存剤成分の非常に有用な例は、酸化保存剤成分、例えば、オキシ−クロロおよびオキシ−ボレート成分、過酸化物、過酸塩、過酸等のような酸化保存剤およびそれらの混合物であるが、それらに限定されない。本発明の保存剤として有用なオキシ−クロロ成分の例は、次亜塩素酸塩成分、例えば次亜塩素酸塩;塩素酸塩成分、例えば塩素酸塩;過塩素酸塩成分、例えば過塩素酸塩;および亜塩素酸成分を包含する。亜塩素酸塩成分の例は、安定化二酸化塩素(SCD)、亜塩素酸金属塩等、例えば亜塩素酸のアルカリ金属およびアルカル土類金属塩等およびそれらの混合物を包含する。工業グレード(またはUSP(米国薬局方)グレード)亜塩素酸ナトリウムは、極めて有用な保存剤成分である。多くの亜塩素酸塩成分、例えばSCDの正確な化学組成は、充分には理解されていない。ある種の亜塩素酸塩成分の製造は、McNicholasの米国特許第3278447号に開示されており、そこに開示されている内容は全体として本発明の開示の一部を構成するものとする。有用なSCD製品の特定の例は、Rio Linda Chemical Company,Inc.から商標名Dura Klorで市販されているもの、およびInternational Dioxide,Inc.から商標名Anthium Dioxideで市販されているものを包含する。特に有用なSCDは、Allergan Inc.からPurite(登録商標)として市販されている製品である。
【0089】
酸化保存剤成分の他の例は、パーオキシ成分を包含する。例えば、ジエチレントリアミンペンタ(メチレンホスホン酸)または1−ヒドロキシエチリデン−1,1−ジホスホン酸のような過酸化水素安定剤で安定化した微量のパーオキシ成分は、眼環境において使用するように設計された成分中で使用する保存剤として使用することができる。さらに、水中で加水分解して過酸化水素を生成する限り、実質的にいかなるパーオキシ成分も使用することができる。有効量の過酸化水素を発生するそのような過酸化水素源の例は、過硼酸ナトリウム十水化物、過酸化ナトリウムおよび過酸化尿素を包含する。有機パーオキシ化合物の過酢酸は、本発明の系を使用して安定化されないことがあることがわかっている。例えば、Martinらの米国特許第5725887号参照(そこに開示の内容は本発明の開示の一部を構成するものとする)。
【0090】
酸化保存剤成分以外の保存剤を組成物に含ませることができる。保存剤の選択は、投与経路に依存する。1つの経路によって投与される組成物に好適な保存剤は、他の経路による該組成物の投与を不可能にする不利な特性を有する場合がある。鼻および眼用組成物について、好ましい保存剤は、第四級アンモニウム化合物、特に、「塩化ベンザルコニウム」として総称的に知られているアルキルベンジルジメチルアンモニウム化合物の混合物等、「セトリミド」と称されるデシルトリメチルアンモニウムブロミド、ドデシルトリメチルアンモニウムブロミドおよびテトラデシルトリメチルアンモニウムブロミドを含有する混合物、BDB、保存性ポリクオタニウム−1(Polyquad(登録商標)の名称で市販されている)、並びにビグアニド保存剤(例えばポリヘキサメチレンビグアニド(「PHMB」))を包含するが、それらに限定されない。
【0091】
しかし、吸入によって投与する組成物については、好ましい保存剤はクロロブタノール等である。特に直腸投与する組成物に使用する他の保存剤は、p−ヒドロキシ安息香酸のアルキルエステルおよびそれらの混合物、例えば、「Nipastat」の商品名で市販されているメチル、エチル、プロピル、ブチルエステル等の混合物を包含する。
【0092】
本発明の他の広い局面において、α−2−アドレナリンアゴニスト成分、組成物の保存を少なくとも助長するのに有効な量、好ましくは保存するのに有効な量の保存剤成分、および液体担体成分を含んで成る組成物を提供する。好ましくは、保存剤成分は、オキシ−クロロ成分またはPHMBを含む。そのような化合物は、グラム陽性細菌、グラム陰性細菌または真菌の増殖を防止するのに有効でなければならず、好ましくは、(1)組成物中のα−2−アドレナリンアゴニスト成分または組成物を投与する患者に実質的にまたは有意に不利な影響を与えず、(2)実質的に生物学的に許容され、化学的に安定である。そのような本発明の組成物は、α−2−アドレナリンアゴニスト成分、オキシ−クロロ成分、第四級アンモニウム化合物またはビグアニド(例えばPHMB)、および液体担体成分を含んで成り、好ましくはシクロデキストリンを実質的に含有しない。
【0093】
本発明で有用な担体成分は、非毒性であり、本発明の組成物、本発明の組成物の使用、または組成物を投与されるヒトまたは動物に、実質的に不利な影響を与えないように選択する。
【0094】
一態様において、担体成分は液体担体である。好ましい態様において、担体成分は液体水性担体成分である。特に有用な水性液体担体成分は、生理食塩水、例えば、従来の生理食塩水または従来の緩衝生理食塩水から誘導される。水性液体担体は、好ましくは約6〜9または約10、より好ましくは約6〜8、さらに好ましくは約7.5のpHを有する。液体媒体は、例えば少なくとも約200mOsmol/kg、より好ましくは約200〜400mOsmol/kgの眼用に許容される浸透圧レベルを有するのが好ましい。特に有用な態様において、担体成分のモル浸透圧濃度または浸透圧は、眼、特にヒトの眼の表面の液体の浸透圧と実質的に等張である。
【0095】
一態様において、SECおよびα−2−アドレナリンアゴニスト成分を含有する担体成分は、25℃において約0.01センチポイズ(cps)より大きい、より好ましくは25℃において約1cpsより大きい、さらに好ましくは25℃において約10cpsより大きい粘度を有する。好ましい態様において、組成物は、25℃において約50cpsの粘度を有し、従来の緩衝生理食塩水、カルボキシメチルセルロースおよびブリモニジンタートレートを含んで成る。
【0096】
水性液体担体成分のpH、従って組成物のpHを所望範囲に維持することを確実にするために、水性液体担体成分は、少なくとも1つの緩衝剤成分を含有する。あらゆる好適な緩衝剤成分を使用することができるが、有意な量のガス、例えば二酸化塩素またはCO2を発生し得ない緩衝剤を選択するのが好ましい。緩衝剤成分は無機であるのが好ましい。アルカリ金属およびアルカリ土類金属塩緩衝剤成分を本発明に使用するのが有利である。
【0097】
あらゆる好適な眼用に許容される浸透圧調節成分を使用することができるが、但し、そのような成分は、液体水性担体成分の他の成分と相溶性であり、本発明の組成物を投与するヒトまたは動物を害しうる有害なまたは毒性の特性を有してはならない。有用な浸透圧調節成分の例は、塩化ナトリウム、塩化カリウム、マンニトール、デキストロース、グリセリン、プロピレングリコールおよびそれらの混合物を包含する。一態様において、浸透圧調節成分は、無機塩およびそれらの混合物から選択する。
【0098】
本発明の組成物は、好ましくは、水性液体または非水性液体中の溶液または懸濁液として、または水中油または油中水の液体エマルジョンとして存在し得る。本発明の組成物は、1つまたはそれ以上の付加成分、例えば、稀釈剤、香味剤、界面活性剤、増粘剤、潤滑剤、および同じ一般的なタイプの組成物に一般に使用される付加成分等を含有することができる。
【0099】
水性懸濁液の形態である場合の本発明の組成物は、水性懸濁液の製造に好適な賦形剤を含有することができる。そのような賦形剤は、沈殿防止剤、例えば、アルギン酸ナトリウム、トラガカントゴムおよびアカシアゴムであるが、それらに限定されない。分散または湿潤剤は、天然ホスファチド、例えば、レシチン、または、エチレンオキシドと長鎖脂肪族アルコールとの縮合生成物、例えばヘプタデカエチレンオキシセタノール、またはエチレンオキシドと、脂肪酸およびヘキシトールから誘導される部分エステルとの縮合生成物、例えばポリオキシエチレンソルビトールモノオレエート、またはエチレンオキシドと、脂肪酸およびヘキシトール無水物から誘導される部分エステルとの縮合生成物、例えばポリオキシエチレンソルビタンモノオレエート等、およびそれらの混合物を包含しうる。この態様の本発明の水性懸濁液は、1つまたはそれ以上の着色剤、1つまたはそれ以上の香味剤、および1つまたはそれ以上の甘味剤、例えば、スクロース、サッカリン等、およびそれらの混合物も含有することができる。
【0100】
油状懸濁液の形態である場合の本発明の組成物は、植物油、例えば、オリーブ油、ゴマ油またはココナツ油、または流動パラフィンのような鉱油中で調製することができる。そのような懸濁液は、増粘剤、例えば、蜜蝋、硬質パラフィンまたはセチルアルコールを含有することができる。前記のような甘味剤、および香味剤を添加して、嗜好性経口製剤を得ることができる。
【0101】
本発明の組成物は、水中油エマルジョンの形態にすることもできる。油相は、植物油、例えば、オリーブ油または落花生油、または鉱油、例えば流動パラフィン等、およびそれらに混合物であってよい。好適な乳化剤は、天然ゴム、例えば、アカシアゴムまたはトラガカントゴム、天然ホスファチド、例えば、大豆レシチン、および脂肪酸およびヘキシトール無水物から誘導されるエステルまたは部分エステル、例えば、ソルビタンモノオレエート、および該部分エステルとエチレンオキシドとの縮合生成物、例えばポリオキシエチレンソルビタンモノオレエートである。エマルジョンは、甘味剤および香味剤も含有することができる。
【0102】
シロップ剤またはエリキシル剤の形態である場合の本発明の組成物は、本明細書に記載したような甘味剤を使用して処方することができる。そのような組成物は、粘滑剤、香味剤および着色剤も含有することができる。
【0103】
特定のヒトまたは動物についての特定の投与量レベルは、使用する活性成分の活性、年齢、体重、全身的健康状態、性別、食事、投与時刻、製剤pH、投与経路、排泄速度、薬剤組合せ、および治療を受けている特定の疾患の重症度を包含する種々の要因に依存する。5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンについて、本発明の組成物中の処置有効用量は、0.2%(w/v)未満、例えば約0.15%(w/v)または約0.1%(w/v)もしくはそれ以下の濃度でデリバーする。そのような組成物のpHは7.0よりも大きく、一態様においては用量が約0.15%でpHが約7.2であり、他の一態様においては用量が約0.1%でpHが約7.7である。
【0104】
本発明の1つの局面において、本発明の組成物中に複合体を形成する。一態様において、複合体は、キノキサリン成分のモノマー単位を少なくとも1つ有する。キノキサリン成分の例は、キノキサリン、(2−イミダゾリン−2−イルアミノ)キノキサリン、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリン、それらの塩、それらのエステル、それらの他の誘導体等、およびそれらの混合物を包含する。例えば、一態様において、本発明の複合体は、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンモノマー単位の結合体(conjugation)を包含してよい。他の態様において、複合体は、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンモノマー単位とブリモニジンタートレートモノマー単位との結合体を包含してよい。
【0105】
この局面の好ましい態様において、本発明の複合体はダイマーである。例えば、本発明のダイマーは、キノキサリンおよび5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンを含みうる。好ましくは、本発明のダイマーは、2つのブリモニジンタートレートモノマー単位を有する。
【0106】
本発明のこの局面を理論または作用機序により制限することを意図するものではないが、酸化保存剤成分のような過酸化物形成剤または強酸化剤(例えば、オキシ−クロロ成分、過酸化物、過酸塩、過酸等およびそれらの混合物)は、複合体、好ましくはα−2−アドレナリンアゴニスト成分の複合体の形成を促進すると考えられる。例えば、ブリモニジンタートレートモノマー単位のダイマーは、亜塩素酸塩、好ましくは安定化二酸化塩素の存在下に形成されると考えられる。
【0107】
さらに、モノマーまたはモノマーサブユニットを結合した状態に維持する働きをして複合体(好ましくはオリゴマー、より好ましくはダイマー)を形成するモノマー間の相互作用は、共有結合、イオン結合、疎水性結合、静電結合、水素結合、他の化学的および/または物理的相互作用等、およびそれらの組合せを包含すると考えられるが、それらに限定されない。そのような複合体は、液体、例えば水性液体媒体において解離することができる。一態様において、モノマーまたはモノマーサブユニットは、共有結合以外の結合によって結合される。一態様において、モノマーまたはモノマーサブユニットは、静電結合または静電力によって結合される。
下記の非限定的な実施例は、本発明のある種の局面を説明するものである。
【実施例1】
【0108】
ブリモニジンタートレートは、約7.78のpKaを有する。水性製剤(眼用溶液)におけるブリモニジンタートレートのpH−溶解度プロフィールを、23℃において約5〜8のpHで確認した(表1)。示したもの以外のアドレナリンアゴニスト濃度を、それら濃度が処置活性を有する限り、本発明の組成物に使用しうることが理解される。同様に、温度も幾分変化させることができ、例えば、室温において溶解度曲線を得ることができる。
【0109】
製剤賦形剤を調製するのに、先ずポリビニルアルコール(PVA)を水に溶解した。継続的に撹拌しながら、精製水の必要合計量の約1/3にPVAを添加した。スラリーを20〜30分間撹拌し、次に、継続的に撹拌しながら80〜95℃に加熱した。80〜90℃の温度に到達してから1時間以内に、混合物を熱源から外し、さらに10分間撹拌して、均質性を確実にした(パートI)。ブリモニジンタートレート以外の眼用溶液の他の成分を、精製水の必要合計量の1/3を含有する別の容器において溶解させた(パートII)。次に、数回の洗浄容量の精製水を使用して、PVA混合物(パートI)をパートIIに定量的に移した。pHの調節を行わずに、精製水を使用して溶液を最終容量に調節した。
【0110】
ブリモニジンタートレートを計量し、前記の製剤賦形剤5mLを含有する10mLの試験管に入れた。次に、稀水酸化ナトリウムおよび/または稀塩酸を使用して、各試料のpHを所望の値に調節した。撹拌プレート上のラックに試料を配置し、高速で撹拌して、2日間にわたる均質混合を行った;仕切板をラックと撹拌プレートに間に配置して、撹拌プレートから試料への熱拡散を防止した。試験中、実験室の温度を監視し、23±1℃であることを確認した。
【0111】
2日間の撹拌の終了時に、各試料のpH値を測定し、次に、約1mLの各試料をミクロ遠心管(ポリプロピレン)に入れ、4000rpmで10分間遠心分離した。上澄みを1μmフィルターユニット(Whatman、13mm、PTFE)で濾過した。濾液の初めの3〜4滴を捨て、残りの濾液を採取し、HPLC移動相で定量的に稀釈した。次に、ブリモニジンタートレートアッセイ用のHPLCカラム(Dupont Zorbax、250mm x 4.6mm、5μm)に稀釈試料を直接注入して、ブリモニジンタートレートの量を定量した。0.5%ブリモニジンタートレートの対照を、同じ製剤賦形剤中、pH6.3〜6.5で調製し、遠心分離および濾過の前(非処理)および後(処理済)にアッセイに付した。このようにすることによって、試料調製のこれらの2つの段階におけるブリモニジンタートレートの潜在的損失を評価した。再現性を確実にするために、連続する日に試験を繰り返した。
【0112】
【表1】

【0113】
製剤賦形剤におけるブリモニジンタートレートの溶解度データを表2に示す。これらの結果は、ブリモニジンタートレートの溶解度はpHに高依存性であり、pH5〜8において2桁を越える範囲に及ぶことを示している。pHが増加すると共に、溶解度は急激に減少する。処理および非処理対照についての結果は極めて似ており、遠心分離および濾過はブリモニジンタートレートの有意な損失を生じないことを示している。連続する日に得た2つの溶解度プロフィールは、一致している。
【0114】
【表2】

a 遠心分離および濾過のために試料採取する前に、2日間撹拌した後に測定。
b 試料重量に基づく理論濃度を示す。試料溶液は透明であり、全てのブリモニジンタートレートが溶解したことを示す。
c 遠心分離および濾過段階の前の、対照におけるブリモニジンタートレートの濃度。
d 遠心分離および濾過段階の後の、対照におけるブリモニジンタートレートの濃度。
e %w/v。
【実施例2】
【0115】
SECを含有する液体製剤およびSECを含有しない液体製剤における、ブリモニジンタートレートの溶解度に対するpHの影響を調べた。特に、種々のpH条件におけるブリモニジンタートレートの溶解度に対する、種々の濃度のSECであるナトリウムカルボキシメチルセルロース(CMC)の存在または不存在の影響を調べた。ブリモニジンタートレートを使用して試験したCMCの種々の濃度は、0%、0.056%、0.17%、0.5%、1.5%(w/v)であった(表3)。
【0116】
試験した試料は、等張化成分、緩衝剤成分および安定化二酸化塩素(Purite(商標))も含有していた(表3)。ナトリウムカルボキシメチルセルロース、塩化ナトリウム、塩化カリウム、塩化カルシウム二水化物および塩化マグネシウム六水化物は、USPグレードであった。硼酸および硼酸ナトリウム十水化物はNFグレードであった。
【0117】
【表3】

a Allergan,Inc.から商品名Purite(商標)として市販。
【0118】
各試料(1〜5)を、約7〜10のpHにした。試料溶液を含むバイアルを実験用回転器に配置し、約21℃で15日間にわたって平衡化させた。0.45μmの孔サイズを有する25mm直径のポリスルホンセルロースアセテートシリンジ型フィルターを使用して、試料溶液を濾過した。濾過した溶液を、溶液中のブリモニジンタートレート量についてアッセイに付した。
【0119】
通常のHPLCおよび検出法を使用して、可溶性ブリモニジンタートレートの濃度を検出し、測定した(表4)。各CMC濃度に関して、溶解度をpHに対してプロットした。実験データポイントは、非線形最小二乗法ルーチン(nonlinear least squares routine)(Deltagraph バージョン4.0、DeltaPoint Inc.)を使用する改良Henderson−Hasselbalch式に適合させた(図1)。R5値は、実験値と理論式との統計学的適合度が0.991より大であることを示す。
【0120】
【表4】

【0121】
図1は、ブリモニジンタートレートの溶解度が、特定pHでCMC濃度の関数として増加することを明らかに示している。例えば、pH7.5において、0%CMCの試料は1000ppmのブリモニジンタートレートを生じ、0.056%CMCは1300ppm、0.17%CMCは1300ppm、0.5%は1600ppmを生じた。pH7.5において、1.5%CMCを含有する試料は、約1400ppmを生じ、これは、0.5%のCMCを含有する同じ溶液より少ない。現在のところ、この観察結果の原因は解明されていない。それでも、ブリモニジンタートレートは、1.5%CMCを含有する溶液において、CMCを含有しない溶液におけるより高い溶解性を示す。
【0122】
それでも、ブリモニジンタートレートは、1.5%CMCを含有する溶液において、CMCを含有しない溶液におけるより明らかに高い溶解性を示す。
CMCは、生物学的環境、例えば、角膜の生物学的環境においても、ブリモニジンタートレートを可溶化するのに有効である。
【実施例3】
【0123】
亜塩素酸塩を含有する組成物を入れた試験管に、ブリモニジンタートレートを添加する。該試験管を、10日間にわたって平衡化させる。尿素のようなカオトロピック剤の存在下または不存在下にサイズ排除カラムを用いるHPLCによって、試験管から得た試料を分析する。溶液中のブリモニジンの見掛分子量から、ブリモニジンタートレートモノマー単位の一部が結合してダイマーを形成したのが観察される。
【実施例4】
【0124】
ブリモニジンタートレートを、PURITE(登録商標)を保存剤として含有する水溶液中、pH7.2および濃度0.15%(w/v)で眼に局所的にデリバーするために製剤化した。この製剤の眼圧降下作用をヒト臨床患者においてALPHAGAN(登録商標)の作用と比較して測定した。ALPHAGAN(登録商標)は、0.05%塩化ベンザルコニウムを保存剤として含有するクエン酸緩衝液中のpH6.5の眼用局所水溶液中に製剤化された0.2%ブリモニジンタートレートを含有する。0.2%(w/v)ブリモニジンタートレートおよびPURITE(登録商標)保存剤を含有する第3の製剤も対照として使用した。
【0125】
3製剤のうちの1つを12箇月間にわたり1日3回、各患眼に1滴ずつの用量で投与するように、緑内障または高眼圧と診断されたヒト患者381人を、ランダムに振り分けた。2週間、6週間、3箇月、6箇月、9箇月および12箇月後の時点で眼圧(IOP)を測定する。
【0126】
12箇月の期間の終了時に、試験結果によると、ALPHAGAN(登録商標)(pH6.5で調製された0.2%ブリモニジン)と比較して、pH7.2で調製した活性成分含量が25%少ない溶液(0.15%ブリモニジン)の眼圧降下効果に有意な差はなかった。一方、より高濃度のブリモニジン(0.2%)と比較して、0.15%ブリモニジンを投与した患者が報告した副作用(例えばアレルギー性結膜炎、口渇、結膜充血および眼の分泌物)の発生率は低かった。この差は、PURITE(登録商標)を含有する0.2%ブリモニジン溶液では見られないので、保存剤の違いに起因するものではない。
【実施例5】
【0127】
下記のpH7.7の0.1%ブリモニジンタートレート溶液を調製した。
【表5】

【実施例6】
【0128】
実施例5に示すようにpH7.7の0.1%(w/v)ブリモニジンタートレート含有局所眼用水溶液(「BP0.1%」を調製し、高IOPのヒト臨床患者において試験し、ALPHAGAN(登録商標)(0.05%塩化ベンザルコニウムを保存剤として含有するpH6.5のクエン酸緩衝眼用局所水溶液中の0.2%ブリモニジンタートレート)の効果と比較した。
【0129】
2溶液の一方を1日3回患眼に1滴ずつ投与するよう、ヒト臨床患者433人をランダムに振り分けた。眼圧をベースライン(0日目)、3週間、6週間および3箇月後の時点で測定する。
【0130】
結果は次の通りであった:
ベースライン
時間0でのIOPは2群とも同じであった(24.7mmHg)。2時間後のIOP(〜23mmHg)および8時間後のIOP(〜22mmHg)は、2群とも同様であった。
【0131】
ベースライン後の、時間0でのIOP
ベースライン測定後、3箇月間の追跡期間中の時間0での平均IOP範囲は次の通りであった:
・20.7〜21.4mmHg(BP0.1%)
・21.0〜21.7mmHg(ALPHAGAN、登録商標)
【0132】
ベースライン後、日周IOP
ベースライン後の時点の結果は、処置群間で概ね同様であった。3箇月後において、時間0、2時間後および8時間後の日周IOP群平均の範囲は次の通りであった:
・17.2〜21.4mmHg(BP0.1%)
・17.6〜21.7mmHg(ALPHAGAN、登録商標)
【0133】
試験期間にわたり、BP0.1%製剤とALPHAGAN(登録商標)製剤との実質的に同様の効果を患者が経験したことを、本試験は示している。このような結果は全く予想外であった。一方、BP0.1%は活性成分ブリモニジンタートレートをALPHAGAN(登録商標)製剤の50%量しか含有しないためであろうが、報告された副作用(例えば口渇、無力および眼の痒み)の発生数は、BP0.1%群ではALPHAGAN(登録商標)群よりも少なかった。
【実施例7】
【0134】
次表に従って別のpH7.7の0.1%ブリモニジンタートレート溶液を調製しうる。

【実施例8】
【0135】
次表に従って別のpH7.7の0.1%ブリモニジンタートレート溶液を調製しうる。

【0136】
理解されるであろうが、ナトリウム塩は他の金属陽イオン(例えばカリウムまたはカルシウム)の塩で置き替えうる。浸透圧調節剤を使用する場合、これは塩または非イオン性浸透圧調節剤(例えばグリセリン)でありうる。緩衝剤は、選択したpHで適当な緩衝能を有する任意の剤から成りうる。上記濃度は例として示すもので、より広い局面において本発明を制限するものではない。
【0137】
種々の特定の実施例および態様に関して本発明を説明したが、本発明はそれらに限定されず、当業者が特許請求の範囲内で変更を加えて実施しうると理解されるものとする。
【特許請求の範囲】
【請求項1】
5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリン、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンの塩、および5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンのエステルから成る群から選択するα2アドレナリンアゴニスト約0.1%(w/v)、並びに非イオン性の溶解度向上成分(SEC)を含有する溶液を含んで成り、約7.7のpHを有する、処置に有効な水性眼用組成物。
【請求項2】
5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンタートレート約0.1%(w/v)を含有する請求項1に記載の組成物。
【請求項3】
5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンタートレート0.1%(w/v)を含有する請求項1に記載の組成物。
【請求項4】
SECがポビドンを含んで成る請求項3に記載の組成物。
【請求項5】
SECがポリビニルアルコールを含んで成る請求項3に記載の組成物。
【請求項6】
保存剤をも含有する請求項1に記載の組成物。
【請求項7】
保存剤を、第四級アンモニウム保存剤、酸化保存剤およびビグアニド保存剤から成る群から選択する請求項6に記載の組成物。
【請求項8】
保存剤が第四級アンモニウム保存剤である請求項7に記載の組成物。
【請求項9】
保存剤がポリクオタニウム−1である請求項8に記載の組成物。
【請求項10】
保存剤が塩化ベンザルコニウムである請求項8に記載の組成物。
【請求項11】
保存剤がセトリミドである請求項8に記載の組成物。
【請求項12】
保存剤がBDBである請求項8に記載の組成物。
【請求項13】
保存剤が酸化保存剤である請求項7に記載の組成物。
【請求項14】
保存剤を、オキシ−クロロおよびオキシ−ボレート保存剤から成る群から選択する請求項13に記載の組成物。
【請求項15】
保存剤がビグアニド保存剤を含んで成る請求項7に記載の組成物。
【請求項16】
ビグアニド保存剤がPHMBを含んで成る請求項15に記載の組成物。
【請求項17】
ブリモニジンタートレート約0.10%、非イオン性SEC、およびオキシ−クロロ保存剤を含有する、pH約7.7の、処置に有効な水性眼用組成物。
【請求項18】
溶解度向上成分を、ポビドンおよびポリビニルから成る群から選択する請求項17に記載の組成物。
【請求項19】
ブリモニジンタートレート約0.10%、非イオン性SEC、および第四級アンモニウム保存剤を含有する、pH約7.7の、処置に有効な水性眼用組成物。
【請求項20】
溶解度向上成分を、ポビドンおよびポリビニルから成る群から選択する請求項19に記載の組成物。
【請求項21】
ブリモニジンタートレート約0.10%、非イオン性SEC、およびビグアニド保存剤を含有する、pH約7.7の、処置に有効な水性眼用組成物。
【請求項22】
溶解度向上成分を、ポビドンおよびポリビニルから成る群から選択する請求項21に記載の組成物。
【請求項1】
5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリン、5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンの塩、および5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンのエステルから成る群から選択するα2アドレナリンアゴニスト約0.1%(w/v)、並びに非イオン性の溶解度向上成分(SEC)を含有する溶液を含んで成り、約7.7のpHを有する、処置に有効な水性眼用組成物。
【請求項2】
5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンタートレート約0.1%(w/v)を含有する請求項1に記載の組成物。
【請求項3】
5−ブロモ−6−(2−イミダゾリン−2−イルアミノ)キノキサリンタートレート0.1%(w/v)を含有する請求項1に記載の組成物。
【請求項4】
SECがポビドンを含んで成る請求項3に記載の組成物。
【請求項5】
SECがポリビニルアルコールを含んで成る請求項3に記載の組成物。
【請求項6】
保存剤をも含有する請求項1に記載の組成物。
【請求項7】
保存剤を、第四級アンモニウム保存剤、酸化保存剤およびビグアニド保存剤から成る群から選択する請求項6に記載の組成物。
【請求項8】
保存剤が第四級アンモニウム保存剤である請求項7に記載の組成物。
【請求項9】
保存剤がポリクオタニウム−1である請求項8に記載の組成物。
【請求項10】
保存剤が塩化ベンザルコニウムである請求項8に記載の組成物。
【請求項11】
保存剤がセトリミドである請求項8に記載の組成物。
【請求項12】
保存剤がBDBである請求項8に記載の組成物。
【請求項13】
保存剤が酸化保存剤である請求項7に記載の組成物。
【請求項14】
保存剤を、オキシ−クロロおよびオキシ−ボレート保存剤から成る群から選択する請求項13に記載の組成物。
【請求項15】
保存剤がビグアニド保存剤を含んで成る請求項7に記載の組成物。
【請求項16】
ビグアニド保存剤がPHMBを含んで成る請求項15に記載の組成物。
【請求項17】
ブリモニジンタートレート約0.10%、非イオン性SEC、およびオキシ−クロロ保存剤を含有する、pH約7.7の、処置に有効な水性眼用組成物。
【請求項18】
溶解度向上成分を、ポビドンおよびポリビニルから成る群から選択する請求項17に記載の組成物。
【請求項19】
ブリモニジンタートレート約0.10%、非イオン性SEC、および第四級アンモニウム保存剤を含有する、pH約7.7の、処置に有効な水性眼用組成物。
【請求項20】
溶解度向上成分を、ポビドンおよびポリビニルから成る群から選択する請求項19に記載の組成物。
【請求項21】
ブリモニジンタートレート約0.10%、非イオン性SEC、およびビグアニド保存剤を含有する、pH約7.7の、処置に有効な水性眼用組成物。
【請求項22】
溶解度向上成分を、ポビドンおよびポリビニルから成る群から選択する請求項21に記載の組成物。
【図1】




【公開番号】特開2012−246304(P2012−246304A)
【公開日】平成24年12月13日(2012.12.13)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−180411(P2012−180411)
【出願日】平成24年8月16日(2012.8.16)
【分割の表示】特願2007−530000(P2007−530000)の分割
【原出願日】平成17年8月19日(2005.8.19)
【出願人】(591018268)アラーガン、インコーポレイテッド (293)
【氏名又は名称原語表記】ALLERGAN,INCORPORATED
【Fターム(参考)】
【公開日】平成24年12月13日(2012.12.13)
【国際特許分類】
【出願番号】特願2012−180411(P2012−180411)
【出願日】平成24年8月16日(2012.8.16)
【分割の表示】特願2007−530000(P2007−530000)の分割
【原出願日】平成17年8月19日(2005.8.19)
【出願人】(591018268)アラーガン、インコーポレイテッド (293)
【氏名又は名称原語表記】ALLERGAN,INCORPORATED
【Fターム(参考)】
[ Back to top ]

