αヒドロキシル有機酸の塩、キレートおよび/または遊離酸の医薬組成物、および関連したプロセスおよび方法
αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸、塩またはキレートの有効量を含む、哺乳動物への投与用の単離された医薬組成物の製造方法であって、αヒドロキシ有機酸の少なくとも一つの天然に存在する形と、一定量の塩基とを、水溶液であって、αヒドロキシル有機酸の全含量が、その溶液の約0.5%w/w〜約35%w/wになる水溶液中において、存在するαヒドロキシル有機酸の実質的に全ての形を加水分解する一定時間混合し、その溶液を約6.9〜約7.6のpHへと中和して、αヒドロキシル有機酸の実質的に全ての天然に存在する形の遊離酸、遊離酸の塩またはキレートを生じ、そして場合により、その溶液を凍結乾燥させて、単離された医薬組成物を製造することを含む方法を記載する。これら方法によって製造される組成物を、開示し且つ請求の範囲に記載する。DNA修復を促進する、免疫応答を促進する、炎症を制御する、または腫瘍の進行を阻害する方法であって、本明細書中に記載の方法によって製造された組成物の有効量を投与することを含む方法を記載する。
【発明の詳細な説明】
【背景技術】
【0001】
優先権は、本明細書中にそのまま援用される、2005年3月16日出願の米国仮出願第60/662,446号より示される。
【技術分野】
【0002】
本発明は、天然に存在するαヒドロキシル有機酸の実質的に全ての形を変換して、各々の該当する遊離酸、塩またはキレートにする、例えば、植物材料中のキナ酸をキレート形にする方法;および増加した生物学的効力を示すが、毒性を減少している改善された医薬組成物であって、各々の該当する遊離酸、塩またはキレートが、実質的に存在する形である医薬組成物の関連した製造に関する。
【0003】
ウンカリア・トメントサ(Uncaria tomentosa)および他の「キャッツクロー(Cat's Claw)」種は、アカネ科(Rubiaceae)、シンコノイデエ(cinchonoideae)亜科および Uncaria 属に属する。これらタイプの植物は、熱帯地域で成長し、フック様とげでよじ登る木性つるから成る。医学史的慣例による二つの主な種は、Uncaria tomentosa およびウンカリア・ギアネンシス(Uncaria guianensis)である。歴史的に、この科の植物に由来することが判明した化合物について二つの主な化学的クラスがある。それらは、1932年に初めて記載されたシンコナ(chinchona)樹皮中のキナ酸のような、遊離酸、塩またはエステルとしてとして天然に存在する有機酸、または1952年に抽出されたキニーネのような、シンコナ樹皮中のアルカロイドである。したがって、アルカロイドおよび有機酸類似体が、それら Uncaria 種中できわめて一般的に見出されるということは、驚くべきことではない。
【0004】
Cat's Claw 抽出物での主な医学史的慣例は、樹皮または他の植物部分を焚き火で沸点付近の温度に加熱することから発展してきたが、樹皮は、水中に一晩入れられる。翌朝、部分蒸発した抽出物を、普通にお茶として飲む。
【0005】
Cat's Claw は、歴史的伝統的薬剤として何千年も用いられていることが周知の植物であるが、その場合、それは南米原産である。Ashinka Indians は、水中の樹皮を焚き火で一晩沸騰させることで調合物を調製後、その混合物を植物部分から傾瀉し、そして得られた抽出物を毎日吸い飲みして、感染、炎症性障害、そして精神状態をも制御するのに役立てた。最近の公報は、Uncaria tomentosa(cat's claw)抽出物が、オゾンに誘発される肺炎症からマウスを防御するということを報告している(Cisneros, F.J., et al., J. Ethnopharmacol., 15;96(3):355(Jan. 2005)。
【0006】
エステル/CAE
Cat's Claw 製品の市販製剤は、アルカロイド含量かまたはカルボキシアルキルエステル(CAE)含量に基づく製剤を標準化することに集中してきた。2005年11月15日発行の米国特許第6,964,784号は、既知の uncaria 抽出物の生物活性成分の単離、精製および識別に及んでいる。uncaria 抽出物の生物活性成分として具体的に識別されているのは、キナ酸を含有するカルボキシアルキルエステル(CAE)として以前に包括的に識別されたキナ酸エステルを含めたキナ酸錯体である。単離された生物活性成分は、キナ酸エステル類似体、好ましくは、キナ酸ラクトンとして識別されている。
【0007】
Sheng, Y., et al., は、同様に、An Active Ingredient of Cat's Claw Water Extracts Identification and Efficacy Of Quinic Acid と称する報告を公表したが、ここにおいて、uncaria の活性成分は、キナ酸、すなわち、遊離酸それ自体として、更には、初期の包括的記載にカルボキシアルキルエステル(CAE)として包含されたキナ酸エステルとして化学的に定義された。J. Ethnopharmacol., 15;96(3):577(Jan. 2005)。
【0008】
遊離酸および塩
2004年10月21日出願の、2005年8月11日公開の米国出願公開第20050176825号は、uncaria の水抽出の生物活性成分の単離、精製および構造的識別に関する。その開示は、生物活性成分は、以前に、キナ酸ラクトンおよび他の関連キナ酸エステルとして識別されたが、その生物活性成分は、アンモニア処理されたキナ酸を含めた、キナ酸およびキナ酸塩それ自体として解明されるということを認めている。しかしながら、アンモニアキレートは、基本的に、アンモニア塩の生成に付随して最少量で存在しうる人工産物として識別されるにすぎない。
【0009】
Akesson, C., et al., は、Quinic Acid is a Biologically Active Component of the Uncaria Tomentosa Extract C-Med 100 と称する報告を公表したが、ここにおいて、キナ酸は、uncaria 抽出物の不可欠な生物活性成分として識別されているが、著者らは、それが、おそらくは、遊離酸形で天然に存在することはないということを認めている。新規な塩、キレートまたは加水分解性エステルは、単純なアンモニウム塩よりもむしろ好ましく示されるということが仮定される。更に、著者らは、エステル、キレートまたは塩の形のキナ酸同等物の含量が、in vivo 生物作用に有意に寄与しうるということを指摘している。Int. Immunopharmacol., 5(1):219(2005)。
【0010】
Cat's Claw 抽出物もキナ酸も、アルツハイマーなどの神経変性疾患に関連したβアミロイド斑を減少させることが以前に示された。米国特許第6,346,280号および米国出願公開第20010055630号および同第20010047032号。しかしながら、これら開示は、βアミロイド体および神経変性疾患に限定されているが、免疫過程、抗炎症過程、抗腫瘍過程およびDNA修復過程への一般的な論及を全く包含していなかった。
【0011】
しかしながら、米国食品医薬品局(FDA)の科学者によって最近公表されたように、「未知の物質の存在が、cat's claw[uncaria]抽出物の作用全体に重要な役割を有するということは、考察すべき重要な因子であると考えられる」。Valerio, LG, et al., Toxicological Aspects of the South American Herbs Cat's Claw (Uncaria tomentosa), Toxicol. Rev., 24(1):11(2005)。
【発明の開示】
【0012】
本発明は、キナ酸のような、遊離酸または塩またはキレートまたはエステルとして天然に存在するαヒドロキシ有機酸の生物活性成分の組成物であって、しかもヒトジャーカットT細胞におけるNF−κB活性化を、1.25mg/mlまたはそれ未満の用量で、最大 in vitro 応答の最低50%に阻害しうる、および/またはマイトジェン(ConA)の存在下において in vitro で培養された脾臓細胞の成長停止を、2mg/mlまたはそれ未満の用量で引き起こしうる、および/または処置のための十分な量での全身投与で、免疫、抗炎症、抗腫瘍またはDNA修復を促進する、αヒドロキシ有機酸の生物活性成分の組成物に関する。
【0013】
本発明は、更に、遊離酸、または塩またはキレートまたはエステルとして存在するαヒドロキシ有機酸を含有する植物抽出物の変換方法であって、しかもその抽出物の、強塩基、例えば、約1M NaOHまたは10%未満のアンモニア(例えば、約0.8%〜10%)または双方での約2時間(約15分間〜約4時間)の処理によって遊離酸かまたは塩かまたはキレート化した形へと変換されうるし且つその抽出物の強塩基処理後に、≧約0.5%(gm/100gm)の遊離有機酸または塩またはキレート形、例えば、キナ酸を含有する;そしてジャーカットT細胞におけるNF−κB活性化を、1.25mg/mlまたはそれ未満の用量で、最大 in vitro 応答の最低50%に阻害しうる;またはマイトジェン(ConA)の存在下において in vitro で培養された脾臓細胞の成長停止を、2mg/mlまたはそれ未満の用量で引き起こしうる;および全身処置が、免疫、抗炎症、抗腫瘍またはDNA修復を促進するのに十分な量である、αヒドロキシ有機酸を含有する植物抽出物の変換方法に関する。
【0014】
更に、本発明は、投与用に有効な医薬組成物中のキナ酸それ自体、または他の天然に存在する塩、キレートまたはエステルの形での化合物に関するが、それは、シキミ酸経路によって温血動物の体外で生産されることだけに制限される;およびDNA修復の体内過程を促進することによって、DNA損傷の排除およびその健康上の結果を増加させることができる;および食物源中に少量で広く存在するものであり;そしてそれは、DNA修復および老化を防止する良好な健康状態の維持に不可欠である、すなわち、老化を防止する良好な健康状態の維持に不可欠なビタミンDNAとして現在識別されているものである。
【0015】
本発明は、更に、飲食によるヒト消費後に、≧1mg/kgの有効量が24時間以内に与えられて、免疫過程、抗炎症過程、抗腫瘍過程またはDNA修復過程を促進するのに十分であるようになる≧0.5gm/100gmの量で、キナ酸、その塩またはキレートを含有する食物または植物組成物に関する。
【0016】
本発明は、更に、本発明の方法によって製造される組成物;または≧0.5%w/wのキナ酸またはその塩を含有する組成物;または凍結乾燥された全てのそれら組成物であって、(a)ヒトジャーカットT細胞におけるNF−κB活性化を、1.25mg/mlまたはそれ未満の用量で、最大 in vitro 応答の少なくとも50%に阻害する;(b)マイトジェン(ConA)の存在下において in vitro で培養された脾臓細胞の成長停止を、2mg/mlまたはそれ未満の用量で引き起こす;および(c)哺乳動物への約1mg/kg〜200mg/kgの用量での、免疫、抗炎症、抗腫瘍またはDNA修復を促進する全身投与、から成る群による少なくとも一つの性質を示す組成物に関する。
【0017】
本発明は、哺乳動物への投与用の単離された医薬組成物であって、αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸、塩またはキレートの有効量、例えば、ヒトに約0.2mg〜約10mg/kgの送達を行う剤形を含む医薬組成物の製造方法に関する。
【0018】
更に、本発明は、哺乳動物への投与用の植物材料の水性抽出物から単離された医薬組成物であって、αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸、塩またはキレートの有効量を含む医薬組成物の製造方法に関する。
【0019】
本発明は、更に、哺乳動物への投与用の実質的に純粋なキナ酸から単離された医薬組成物であって、約1:1.54のキナ酸対アンモニウムイオン比率のキナ酸キレート、好ましくは、アンモニウムキレートの有効量を含む医薬組成物の製造方法に関する。
【0020】
更に、本発明は、機能性食品の製造方法であって、食物中に存在するαヒドロキシル有機酸エステルの実質的に全ての形を加水分解して、食物中のαヒドロキシル有機酸の実質的に全ての天然に存在する形の遊離酸の塩および/またはキレートを生じることを含む方法に関する。
【0021】
本発明は、更に、本発明の方法によって製造される製品に関する。
本発明は、具体的には、本発明の方法によって製造される組成物であって、(a)ジャーカットT細胞におけるNF−κB活性化を、1.25mg/mlまたはそれ未満の用量で、最大 in vitro 応答の最低50%に阻害する;および/または(b)マイトジェン(ConA)の存在下において in vitro で培養された脾臓細胞の成長停止を、2mg/mlまたはそれ未満の用量で引き起こす;および/または(c)哺乳動物へ有効量で投与された場合、免疫過程、抗炎症過程、抗腫瘍過程、DNA修復過程またはトリプトファン取込み過程を促進する、遊離酸、塩またはキレートを含有する組成物に関する。
【0022】
更に、本発明は、DNA修復を促進する、トリプトファン取込みを促進する、免疫応答を促進する、炎症を制御する、または腫瘍の進行を阻害する方法であって、本発明の方法によって製造された組成物の有効量を投与することを含む方法に関する。
【0023】
発明の詳細な説明
特に断らない限り、本明細書中で用いられる専門用語および学術用語は全て、本発明が属する技術分野の業者によって一般的に理解されるのと同じ意味を有する。本明細書中に引用される公報および特許は全て、本明細書中に援用される。
【0024】
本明細書中で用いられる「αヒドロキシ有機酸」という用語は、カルボキシル(−COOH)基を含有する炭素へのαのヒドロキシル(−OH)基(または隣接する炭素)の位置を意味する。本明細書中で用いられる「αヒドロキシ有機酸の全ての形」という用語は、エステル化されたαヒドロキシ有機酸、遊離αヒドロキシ有機酸(H+)およびその塩およびキレートを意味する。
【0025】
ここでは、アンモニウムイオンが、例えば、植物抽出物中に存在するαヒドロキシ有機酸生物活性成分の栄養価も有効な作用様式も増強するということが開示される。
キナ酸(QA)は、ポリヒドロキシル化αヒドロキシモノカルボン酸であるので、キレート、更には、塩およびエステルを形成することができる。したがって、ここでは、実際に、キナ酸が、水酸化ナトリウムのような若干の塩基で中和された場合に塩を、そして水酸化カリウムまたは水酸化アンモニウムのような他の塩基で中和された場合にキレートを形成したということを開示する。例えば、下の表1を参照されたい。
【0026】
本明細書中で用いられる「キナ酸の全ての形」という用語は、遊離キナ酸(H+)、キナ酸塩、キナ酸キレート、または全ての天然に存在するキナ酸エステルのエステル、例えば、cats claw、タンニンまたはクロロゲン酸中の炭水化物エステルを意味する。キナ酸のエステルは、強塩基またはアルカリでの処理後にキナ酸を生じる化合物として定義される。
【0027】
カルボキシ有機酸塩は、1モルのカルボキシ基につき、それを中和するのに1相当モルの塩基を要するということによって定義される。したがって、モノカルボキシ有機酸の1:1モル塩は、真塩であり、ジカルボキシ酸が中和されている場合、2:1モル塩である。キナ酸およびαヒドロキシルクエン酸などのカルボキシ有機酸は、安定なキレート形が存在していることを示す飽和分子平衡において理論モル比に達しない。
【0028】
本明細書中で用いられる「キレート」という用語は、遊離酸対イオン(例えば、アンモニウムイオン)の比率であって、その比率で示されているイオンが整数でない比率、例えば、1:1.2、1:1.3、1:1.4、1:1.5および1:1.6、更には、中間の値、例えば、1:1.54(アンモニウムイオンで飽和したキナ酸)を意味する。しかしながら、それら条件、具体的には、溶液のpHに依存して、キレート比(chelate reatios)は異なる。本明細書中で論じられるように、1:1.54の比率に近いのが好適であるが、本発明のキナ酸キレート組成物は、1:1.54のキナ酸対アンモニウムイオン比率を有するものに制限されるわけではない。
【0029】
【表1】

【0030】
遊離酸(H+)としてのキナ酸自体、または過剰のアンモニアで(例えば、10%アンモニアで、例えば、2時間)処理された、キナ酸を放出する加水分解されたキナ酸エステルそれ自体は、各々、本明細書中に in vivo で有効と記載され且つ特性決定されるキナ酸アンモニアキレートを生じる。
【0031】
エステル以外のαヒドロキシ酸類似体構造を含有する粗製植物抽出物または生物活性物質も、本明細書中に記載のアンモニア処理により、一層有効な製剤へと変換することができる。
【0032】
更に、本発明は、例えば、アスコルビン酸、フマル酸、グルタル酸、乳酸、リンゴ酸、シュウ酸、酒石酸、クエン酸、αヒドロキシクエン酸、キナ酸、シキミ酸、ケイ皮酸(cinnamonic)、サリチル酸、カフェ酸、馬尿酸、安息香酸およびフェノール酸などであるが、これに制限されるわけではないヒドロキシル化またはカルボキシル化された有機酸を含有することも知られている、リンゴ、アンズ、ガルシニア(garcinia)、ツルコケモモ、マルメロ、カンキツ類、パイナップル、プルーン、ヒマワリ、ワルトルベリー(whortleberry)、クロイチゴ、アカフサスグリ(red currant)、クロスグリ(black currant)、キイチゴ、ババコ(babco)、フェイジョア(feijoa)、キワノ(kiwano)、パッションフルーツ、コダチトマト(tamarillo)、セイヨウカリン(medlar)、カキ(persimmon)または他の植物源のような、生物活性な低分子量有機酸をも包含する他の植物水抽出物も、一層有効なキレート形へと好都合に変換することができるということを開示している。
【0033】
本発明は、更に、植物材料中のキナ酸の実質的に全ての形を、キナ酸キレート、具体的には、キナ酸アンモニウムキレートへと変換する方法;および増加した生物学的効力を示すが、毒性を減少している改善された医薬組成物の関連した製造に関する。具体的には、本発明の好ましい組成物は、本明細書中に記載の少なくとも一つの生物活性を示す少なくとも一つのキナ酸キレートの実質的な量または少なくとも有効量を含む。
【0034】
本明細書中で用いられる実質的な量は、キナ酸キレートが、組成物中に存在するキナ酸の全ての形の5%を超えている、好ましくは、15%を超えている、最も好ましくは、25%を超えている組成物を意味する。
【0035】
好ましくは、少なくとも一つのキナ酸キレートは、組成物中に存在するキナ酸の大多数の形である。本明細書中で用いられる大多数の形は、キナ酸キレートが、組成物中に存在するキナ酸の全ての形の50%を超えている、好ましくは、60%を超えている、最も好ましくは、70%を超えている組成物を意味する。
【0036】
組成物は、少なくとも一つのキナ酸キレートが、組成物中に存在するキナ酸の実質的に大多数の形であるものが好適である。本明細書中で用いられる実質的に大多数の形は、キナ酸キレートが、組成物中に存在するキナ酸の全ての形の50%を超えている、好ましくは、60%を超えている、最も好ましくは、70%を超えている組成物を意味する。
【0037】
組成物は、例えば、キナ酸アンモニウムキレートが、組成物中に存在するキナ酸の実質的に大多数の形であるもの、またはキナ酸アンモニウムキレートが、組成物中に実質的に存在するキナ酸の唯一の形であるものが好適である。
【0038】
本明細書中で用いられる、実質的に存在する唯一の形としてのキナ酸アンモニウムキレートとは、キナ酸キレートが、組成物中に存在するキナ酸の全ての形の90%を超えている、好ましくは、95%を超えている、最も好ましくは、99%を超えている組成物を意味する。
【0039】
組成物は、例えば、キナ酸アンモニウムキレートが、組成物中にキナ酸の実質的に唯一の形として存在しているものを本明細書中に記載している。
本発明は、更に、水植物抽出物の生物活性成分の単離、精製および構造的識別に関する。Uncaria 抽出物中で以前に識別された生物活性成分のあるクラスは、キナ酸ラクトン、少なくとも271〜>10,000の分子量であるキナ酸の炭水化物エステル、および他の関連キナ酸エステル(例えば、タンニンおよびクロロゲン)を含めたCAE(カルボキシアルキルエステル)として識別された。本発明は、ここで更に、キナ酸アンモニアキレートを含めたキナ酸キレートおよびキナ酸を包含する Uncaria の生物活性成分を識別している。
【0040】
本発明は、多数の植物抽出物の生物活性成分として、キナ酸と、アスコルビン酸、フマル酸、グルタル酸、乳酸、リンゴ酸、シュウ酸、酒石酸、クエン酸、αヒドロキシクエン酸、キナ酸、シキミ酸、ケイ皮酸、サリチル酸、カフェ酸、馬尿酸、安息香酸およびフェノール酸などの他の天然に存在する有機酸に焦点を合わせている。本明細書中に開示されているのは、それが、植物抽出物に効力を与えるのに好ましい構造であるが、むしろ、キレートを形成するそれらの能力を与えるのに好ましい構造である有機酸エステルまたは塩ではないということである。
【0041】
例えば、キナ酸もヒドロキシクエン酸(garcinia)も、それらのアンモニア処理されたキレート形で一層生物学的に有効であるので、具体的には、キナ酸類似体、そして一般的には、植物抽出物中の他の天然に存在するヒドロキシル化およびカルボキシル化有機酸を、それらのキレート化形へと、具体的には、cat's claw の水抽出物、そして一般的には、他の植物抽出物の、分子飽和レベルのアンモニアでの直接処理によって製剤化することへの製造利点が存在しうるということが推論された。
【0042】
Cat's Claw の水溶性抽出物中で見出されるカルボキシアルキルエステル(CAE)は、キナ酸炭水化物エステルである
キナ酸部分およびエステル結合
C−Med−100中に存在するCAE(例えば、水溶性 Uncaria 抽出物)は、キナ酸エステルである。キナ酸へのエステル結合の存在は、HPLCクロマトグラムにおいて、多数のピークが、塩基加水分解後に激減するかまたは消失すると認められうるということによって支持される。これは、それら化合物を、塩基加水分解へのそれらの感受性ゆえに、エステルとして識別する。これらデータは、Cat's Claw 水抽出物中のCAEが、実際にQAエステルであるということを確証している。
【0043】
エステルのアルコール部分
例えば、C−Med−100からQAエステルを精製する試みは、以前に、主に、例えば、C−Med−100中で豊富と識別されうるエステルの不均一な性質ゆえに、きわめて困難であると示された。例えば、C−Med−100中には、少なくとも5個の主要な塩基ピークが見出された。塩基加水分解に感受性である、本明細書中に記載のQuin+には約10個存在する。したがって、本明細書中に更に記載のように、いずれか一つの精製QAエステルが、それ自体で、Cat's Claw 水抽出物の効力の大部分を説明しうるとは全く考えられない。QAエステル構造の不均一性は、分子のアルコール部分に由来し、Cat's Claw 製品の効力に大きく寄与してはいない。QAはそれ自体で、例えば、in vivo でのC−Med−100に匹敵しうる効力を有する。
【0044】
Cat's Claw の加水分解産物中のキナ酸の存在を確かめるNMR研究もまた、別の主要成分の出現を識別する場合に有用であった。この構造のNMR分析は、二糖であるそれと一致した。Cat's Claw 抽出物の塩基加水分解後のキナ酸および二糖の同時出現は、Cat's Claw 中のQAエステル、すなわち、QA炭水化物エステルの真の構造について最初に示したものであった。これは、二つの不可欠な方法で更に実証された。まず最初に、グルクロニダーゼは、炭水化物ポリマーのグリコシド結合を攻撃して、単糖、二糖およびオリゴ糖フラグメントのような一層小さいサブユニットへとそれらを分解することが周知の酵素である。Cat's Claw 中のQAエステルは、自然条件下で鎖長が変化する炭水化物エステルであったが、分岐は、グルクロニダーゼ処理によって示されるQAエステルの不均一な性質によって示される。これら結果は、キナ酸に富み、したがって、キナ酸の保持時間(1.96〜2.14分)に一層近づいている、部分消化されて生じた分子と一致している。
【0045】
本明細書中に記載されているのは、αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸、塩またはキレートの有効量を含む、哺乳動物への投与用の単離された医薬組成物の製造方法であって、αヒドロキシル有機酸の少なくとも一つの天然に存在する形と、一定量の強塩基(1〜10%アンモニア、1〜5M NaOH、1〜5M KOH、1〜5M水酸化カルシウムなど)とを、水溶液であって、αヒドロキシ有機酸の全含量が、その溶液の約0.5%〜約35%w/wになる水溶液中において、存在するαヒドロキシル有機酸エステルの実質的に全ての形を遊離酸へと加水分解し且つそれらをキレートへと変換するのに適当な時間中混合することを含む方法である。塩基処理された溶液を約7.5のpHへと酸性にすることにより、塩およびキレート形は全て、実質的に変換されて、遊離酸形だけになり、その後、得られた遊離酸形は、場合により凍結乾燥されて乾燥組成物になるかまたは、塩基での中和によって更にキレートに変換される。
【0046】
αヒドロキシル有機酸量の全含量は、例えば、その溶液の約5%〜約35%w/wであってよい。
実際には、当業者に知られているいずれかの実験室用酸、例えば、塩酸、硫酸、酢酸、酒石酸、乳酸、プロピオン酸、クエン酸および硝酸が含まれるがこれに制限されるわけではない酸を用いて、溶液を「中和する」ことができる。約7.5のpHが好適である。
【0047】
本発明の方法は、例えば、塩基が、NaOH、KOH、水酸化亜鉛、水酸化カルシウムおよびNH4OHから成る群より選択され、そしてそれを約15分間〜約4時間加えて、水溶液中の濃度を約0.5M〜約5Mの範囲内にする方法である。
【0048】
得られた組成物は、剤形の製造のために、例えば、薬学的に許容しうる担体(例えば、滅菌脱イオン水)との混合のために、凍結乾燥させることができる。本明細書中で論じられる凍結乾燥された医薬組成物が、本明細書中で論じられる生物学的作用を与えるのに好ましい投薬量は、約0.5〜約5mg/kg(ヒト体重)である。好ましくは、約1mg/kg〜約3mg/kg(体重)。本明細書中に記載の医薬組成物は、好ましくは、水基飲料中、例えば、水中に約0.5mg/ml〜約5mg/mlで製剤化することができる。好ましくは、約1mg/ml〜約3mg/ml。
【0049】
好適であるのは、単離された医薬組成物の製造方法であって、αヒドロキシル有機酸の少なくとも一つの天然に存在する形が、エステル、カルボキシアルキルエステル、塩、キレートおよび遊離酸から成る群より選択される方法である。例えば、ここにおいて、有機酸の少なくとも一つの天然に存在する形は、キナ酸、αヒドロキシルクエン酸、アスコルビン酸、フマル酸、グルタル酸、乳酸、リンゴ酸、シュウ酸、酒石酸、クエン酸、クエン酸、キナ酸、シキミ酸、ケイ皮酸、サリチル酸、カフェ酸、馬尿酸、安息香酸およびフェノール酸から成る群より選択される酸の天然に存在する形である。
【0050】
好適であるのは、本発明の方法であって、αヒドロキシル有機酸の天然に存在する形が、キナ酸およびαヒドロキシクエン酸から成る群より選択され、そして塩基が水酸化アンモニウムである方法である。
【0051】
投与用の単離された医薬組成物の製造について本明細書中に記載の方法は、特に好適であり、それは、キナ酸対アンモニウムイオンの比率が約1:1.54であるキナ酸キレートの有効量を生じる。本発明の方法は、好適であり、それは、凍結乾燥された組成物の有効量と、哺乳動物への経口投与に適する薬学的に許容しうる担体とを混合する工程を更に含む。
【0052】
Uncaria 抽出物中のキナ酸の全ての形の、例えば、現場での、一層生物活性な形への酸/塩基変換(栄養薬(Nutraceutical)組成物Quin+の製造)
例えば、Uncaria から単離された栄養薬製品を製造する場合に利用される化学理論は、pHの変更である。天然物の効力への有意の利点は、(1)抽出物中の生物活性成分が有効であるpHを最適化すること、(2)生物活性な形を有すると同時に、毒性を減少している、栄養薬中に存在する生物活性な酸または塩基を変換することによって達せられる。本明細書中で論じられるように、例えば、Uncaria 製品を用いて、本発明の態様「Quin+」、例えば、キレートを形成する水酸化アンモニウム処理を行う。アンモニアでのQAの処理時に、処理条件に依存して、アンモニウム塩かまたはアンモニウムキレートが形成される。QAがpH7〜7.5へと中和される場合、アンモニウムキレートの1:1.54モル比(キナ酸:アンモニウムイオン)が確かめられる。
【0053】
QAアンモニウムキレートの開発
Quin+製剤は、Uncaria 水抽出物中の主な活性成分としてCAEを定量したが、アルカロイドを定量していない、C−Med−100を含めた、以前の Cat's Claw 製品にまさる改善として作られた。活性成分のバイオアベイラビリティー並びに効力がC−Med−100にまさるQuin+の有意の改善は、本明細書中において、次のデータによって証明される。
【0054】
1.粗製樹皮からの抽出物の収率は、C−Med−100について認められる収率の約2倍であり、5.2%ではなく13.2%である。
2.Quin+中のCAEまたはQAEの定量的推定値は、C−Med−100の場合より5〜10倍多い。
【0055】
3.Quin+は、C−Med−100中にも存在しないQAエステル、例えば、>10,000MwのQAエステルを含有する。
4.Quin+は、QAエステルの不均一な群よりもむしろ、有意に増加した量の活性成分を含む。
【0056】
5.Quin+がいったん生じたら、その生物活性成分QA−H+を、水酸化アンモニウムでのQuin+の中和によってQA−H+をQA−NH4+へと変換する一段法により、容易に更に変換して、なお一層生物活性な状態にする
製造中に、サイズ排除の欠如ゆえに、Quin+製剤の製造に用いられる本明細書中に記載の抽出物は、C−Med−100よりも3倍多いQAエステルを示す。Quin+の製造における、例えば、エステルの一つは、QAエステルの約15%となる>10,000の分子量を示す。用いられた Seliwanoff's 試薬は、それらサイズにかかわらず炭水化物の定性的性質を決定する比色分析手順として設計された。試験されたいろいろな試料中の炭水化物の存在の分析は、存在するQAエステルの量およびサイズ双方にしたがった。要約すると、既知のQAエステル含量に関して、あらゆる Cat's Claw 水抽出物中には、いろいろなサイズの炭水化物が明らかに存在した。
【0057】
QUINPLUSTM(Quin+)(アンモニア処理された植物抽出物)
本明細書中に記載されているのは、Uncaria からの栄養薬組成物を製造する方法、例えば、組成物が、生体内利用可能なキナ酸それ自体の有意に増加した量を有する方法である。
【0058】
キナ酸の全ての形には、例えば、錯体形成したキナ酸、例えば、キナ酸エステル(例えば、炭水化物エステル、カルボキシアルキルエステル(CAE))、タンニンおよびクロロゲン酸が含まれる。
【0059】
しかしながら、本明細書中に記載の方法は、他の関連有機酸を含有する他の植物材料、例えば、garcinia にも同様に適用することができる。
本発明の好ましい態様において、水中に溶解したこれら抽出物を、約1〜10%アンモニアで更に処理して、それら抽出物中にエステル、塩またはキレート化形として存在しうるカルボキシ有機酸を変換して、抽出物を凍結乾燥することによる過剰のアンモニアの除去により、好ましい分子平衡した形のアンモニアキレートにする。ここでは、アンモニウムイオンが、植物抽出物中に存在するカルボキシ有機酸生物活性成分の栄養価も有効な作用様式も増強するということが開示される。
【0060】
基本的には、植物抽出物中、好ましくは、本明細書中に記載の水性 uncaria 抽出物中に存在する現場のキナ酸の全ての形を、活性成分として遊離(quinc)酸へと変換する(として放出する)。アンモニア処理された水性 uncaria 抽出物は、好適であり、それは、キナ酸の有効なアンモニアキレートを生じる。
【0061】
本発明の好ましい態様において、水中に溶解したこれら抽出物を、1〜10%アンモニアで更に処理して、それら抽出物中にエステル、塩またはキレート化形として存在しうるカルボキシ有機酸を変換して、抽出物を凍結乾燥することによる過剰のアンモニアの除去により、好ましい分子平衡した形のアンモニアキレートにする。
【0062】
例えば、C−MED−100の製造のための uncaria 材料の水抽出は、当該技術分野において周知である。米国特許第6,039,949号;第6,238,675号および第6,361,805号は、本明細書中に援用される。本発明は、抽出された植物材料、具体的には、当該技術分野において知られている且つ本明細書中に記載のような水抽出された uncaria 材料中のキナ酸の実質的に全ての形を、遊離キナ酸(quinice acid)またはキレート形に変換する方法に関し、特に好ましいのは、キナ酸アンモニウムキレートであり;そして増加した生物学的効力を示すが、毒性を減少させている改善された医薬組成物であって、キナ酸キレートが、実質的に存在するキナ酸の形である組成物の関連した製造に関する。水抽出後の、例えば、10kdまたは12kdを超えるサイズ排除は、本明細書中に記載の組成物の製造には不必要である。したがって、大分子量形の錯体形成したキナ酸は、従来の慣例のサイズ排除工程が行われるとしても利用可能でない遊離酸の加水分解および放出のための抽出物中で利用可能である。
【0063】
例として、水溶性植物医薬化合物の主要抽出物を製造する水抽出方法は、均一化された(粉砕または細断された)uncaria 植物材料と水とを、約1:5〜約1:50の範囲内の植物材料対水の比率で、約75℃〜約100℃の温度において、植物材料中に存在する熱水性抽出可能フィトコンパウンド(phytocompounds)の実質的な部分を可溶化する時間混合し、粒状物質を除去して、水溶性植物医薬化合物の組成物を製造する。好適であるのは、植物材料が、葉、樹皮、花、根、茎および果実から成る群より選択される方法である。好適であるのは、植物材料が、樹皮、根および茎から成る群より選択される方法である。好適であるのは、植物材料対水の比率が、約1:25〜約1:35の範囲内であり、そして温度が、約95℃〜約100℃であり、そして時間が、約1時間〜約6時間である方法である。
【0064】
αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸の塩またはキレートの有効量を含む、単離された医薬組成物の製造方法は、本明細書中に開示され且つ請求の範囲に記載されているが、それは、植物材料の水性抽出物であって、抽出物中のαヒドロキシル有機酸の全含量が、抽出物の約0.2%〜約35%w/wになる水性抽出物と、一定量の塩基とを、水溶液中において、存在するαヒドロキシル有機酸の実質的に全ての形を加水分解する一定時間混合し、その溶液を約6.9〜約7.6のpHへと中和して、αヒドロキシル有機酸の実質的に全ての天然に存在する形の遊離酸、遊離酸の塩またはキレートを生じ、そして場合により、その溶液を凍結乾燥させて、単離された医薬組成物を製造することを含む。
【0065】
好適であるのは、植物材料が、uncaria、garcinia、ツルコケモモおよびコーヒーから成る群より選択され、そして塩基が、NaOH、KOHおよびNH4OHから成る群より選択され、それを約15分間〜約4時間加えて、水溶液中の濃度を約0.5M〜約5Mの範囲内にする方法である。特に好適であるのは、植物材料が、uncaria(cat's claw)である方法、および単離された医薬組成物が、キナ酸対アンモニウムイオンの比率が約1:1.54であるキナ酸キレートの有効量を含む方法である。
【0066】
方法は、更に、凍結乾燥された組成物の有効量と、哺乳動物への経口または全身投与に適する製剤を製造するための薬学的に許容しうる担体とを混合する工程を含む。
ヒドロキシル化またはカルボキシル化有機酸を含有することが分かった、カラマツ、マツ樹皮、赤ワイン、garcinia、緑茶、ビルベリー(bilberry)、ブラックコホッシュ、トウガラシ、カミツレ、イタリア・ニンジンボク、ツルコケモモ、エキナシア(echinacea)、エリューセロ(eleuthero)、マオウ、メマツヨイグサ、ナツシロギク、アマ、ニンニク、ショウガ、イチョウ、ヤクヨウニンジン、ゴレンシール(golenseal)、サンザシ、ウマグリ、カワカワ、カンゾウ、オオアザミ、セイヨウハッカ、ノコギリパルメット、オトギリソウ(saint john's wort)、紅茶、カノコソウ、リンゴ、アンズ、マルメロ、カンキツ類、パイナップル、プルーン、ヒマワリ、ワルトルベリー、クロイチゴ、アカフサスグリ、クロスグリ、キイチゴ、ババコ、フェイジョア、キワノ、パッションフルーツ、コダチトマト、セイヨウカリンまたはカキなどの植物材料を、医学的使用に一般的な歴史的慣例であった熱水抽出をする場合、植物医薬製剤は、効力のある免疫、抗腫瘍、抗炎症およびDNA修復を促進する性質を有する前述の植物抽出物から製造される。本発明の好ましい態様において、水中に溶解したこれら抽出物を、1〜10%アンモニアで更に処理して、抽出物中にエステル、塩またはキレート化形として存在しうるカルボキシ有機酸を変換して、抽出物を凍結乾燥することによる過剰のアンモニアの除去により、好ましい分子平衡した形のアンモニアキレートにする。ここでは、アンモニウムイオン単独が、NF−κBを阻害することまたは成長停止を誘発することなどの、植物抽出物中に存在するカルボキシ有機酸生物活性成分の栄養価も有効な作用様式も増強するということが開示される。
【0067】
uncaria 水抽出物(例えば、C−MED−100)に、加水分解工程を施す。その抽出物に、例えば、約1N強塩基を、例えば、約2時間施して、遊離酸(キナ酸)を放出させる。少なくとも一つの塩基を用いる。水酸化アンモニウムが好適である。水酸化ナトリウムまたは水酸化カリウムなどの他の塩基を用いてもよい。これは、抽出物を約pH11〜12へと変換し、そしてキナ酸の全てのエステルをQA+炭水化物へと加水分解する。
【0068】
uncaria 水抽出物を、例えば、強塩基(例えば、1M NaOH)で約2時間現場処理した後、例えば、HClで約pH7〜7.5へと中和した。実質的に全てのQAエステルを、遊離キナ酸H+へと変換した後、所望の塩基(例えば、水酸化アンモニウム、NaOH、KOH等)での中和によって同様に変換して、いずれか所望の塩形またはキレートにする。QA−H+(キナ酸の遊離酸)へといったん変換されたら、抽出物中の全てのキナ酸起源(キナ酸の全ての形)「QA含量」を、好ましくは、QA−NH4+キレートへの変換により、高度の有効状態に置く。更に、NH4Clそれ自体は、強力な抗酸化剤であり、それが、順次、QA−NH4+を形成する利点を支持する。Cat's Claw(uncaria)の生物活性組成物を、本明細書中において、化学組成および薬理学的/効力双方の観点から標準化する。
【0069】
薬理学的価値例
化学文献での従来の報告は、Cat's Claw 抽出物も、キナ酸も、NF−κBを用量依存方式で阻害するということを確かめた。Aquilar, JL et al. J. Ethanopharmacology 81:: 271-276, 2002; Tak, PP et al. J Clin Invest 107: 7-11, 2001; Akesson et al. Int Immunopharmacol 3: 1889-1990, 2003; Akesson et al. Int Immunopharmacology 5: 219-22, 2005。これらデータは、キナ酸のような、ある種の天然に存在する有機酸、更には、他の天然に存在する単純なαヒドロキシ酸は、アンモニアで塩およびキレートへと変換することができ、それが順次、NF−κBを阻害することにおいてきわめて有効であるという概念を包含していない。アンモニウムイオンは、リソソームの酸化的ストレス発生の有効な阻害剤であることが分かったが、それ自体、NF−κBの阻害に相乗的である。Ogawa, Y et al. Int J Mol Med 14(6): 1007-1013, 2004。したがって、アンモニウムキレートおよび塩は、アンモニウムイオンが、キナ酸または他のαヒドロキシル酸とは無関係に、キナ酸などの有機酸の塩またはキレート化製剤によってNF−κB阻害を細胞に送達することが可能なことから、一層有効なNF−κB阻害剤である。本発明のこの理論を開示しているデータを、図4に示す。
【0070】
別の態様において、本発明は、医薬組成物であって、植物抽出物中で有機酸として最初に識別された生物活性なヒドロキシル化およびカルボキシル化有機酸キレートの薬学的有効量と、無毒性の不活性担体または希釈剤を含む医薬組成物を含む。本発明は、更に、その医薬組成物を用いることを含む態様であって、(i)哺乳動物の免疫能力を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発することによって増強するために、医薬組成物を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発する有効量で投与することを含む;(ii)哺乳動物の免疫系に関連した障害を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発することによって処置するために、医薬組成物を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発する有効量で投与することを含む;(iii)哺乳動物の炎症反応を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発することによって阻害するために、医薬組成物を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発する有効量で投与することを含む;(iv)哺乳動物の炎症反応に関連した障害を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発する、または化学療法で誘発された白血球減少症後に in vivo で白血球(WBC)を増加させることによって処置するために、医薬組成物を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発する有効量で投与することを含む;(v)哺乳動物の抗腫瘍反応を、腫瘍細胞のアポトーシスを誘発することによって促進するために、医薬組成物を、腫瘍細胞のアポトーシスを誘発する有効量で投与することを含む;(vi)哺乳動物の腫瘍形成および成長への応答に関連した障害を、腫瘍細胞のアポトーシスを誘発することによって処置するために、医薬組成物を、腫瘍細胞のアポトーシスを誘発する有効量で投与することを含む;および(vii)哺乳動物のDNA修復過程を促進するための、したがって、加齢性障害を処置するのに重要な抗変異原活性を与えるための態様を包含する。
【0071】
QAかまたはNH4+イオンによるNF−κBの独立阻害。ヒトジャーカットT細胞を、QAか、QA−NH4+かまたはNH4Clと一緒にインキュベートし、そしてNF−κB阻害の程度を、他のところに記載のように評価した。図4を参照されたい。Parra E, et al., 1997. Mol Cell Biol 17:1324-23; Akesson, C., et al., Int. Immunopharmacol., 5(1):219(2005)。
【0072】
本発明の方法によって製造された製品は、本明細書中に開示され且つ請求の範囲に記載された重要な発明の内容である。
QUINMAXTM
キナ酸のアンモニウムキレートは、実際に、キナ酸をpH=7.5へと変換する飽和量の1〜10%アンモニアでの処理によって形成された場合に1:1.54モルのアンモニアキレートとして実験的に決定される、好ましいキナ酸組成物である。
【0073】
その発見は、C−Med−100と称される、Uncaria tomentosa である Cat's Claw 樹皮の熱水抽出物の生物学的活性を説明する試みで始まった。この抽出物は、DNA修復を刺激するのに有効であることが示された。この初期の生物学的特性決定後、出願人は、DNA修復促進の裏にある天然物を、可能性のある抗加齢療法として認識することを示した。一連の化学研究は、科学者らに、カルボキシアルキルエステル(CAE)を生物活性物質として最初に識別させたが、その後、引き続き、キナ酸エステル(QAE)を、cat's claw 水抽出物中の唯一の生物活性CAEとして識別することが行われた。Cat's Claw QAEは、in vitro および in vivo 双方で生物活性であった。しかしながら、酸または塩基加水分解されてキナ酸になった場合、そして存在するQAEのアルコール部分を有することなく、キナ酸それ自体は、QAEの場合と同程度に、DNA修復促進活性を有した。したがって、結論として、キナ酸は、Cat's Claw の最終の生物活性な形であった。しかしながら、キナ酸は、Cat's Claw の水抽出物中にQAEとして存在している。QAEは、胃腸管内でキナ酸へと加水分解されると考えられることから、実際には、QAEは前代謝産物形である。
【0074】
年代順の発見を下に示す。
1.1967年− 認められた Cat's Claw の活性成分は、Dr Klaus Keplinger によって最初に提示されたオキシインドールアルカロイドであった。Keplinger, K, et al., 1999. Uncaria tomentosa (Wild) DC.-ethno medicinal use and new pharmacological, toxicological and botanical results. J Ethanopharmacology 64: 23-34。
【0075】
2.2000〜2000年− C−Med−100などの Cat's Claw 抽出物は、本質的には、アルカロイドを欠いていたが、それでもなお、きわめて有効であったので、主要活性成分としてのアルカロイドを無視していた。Sheng, Y, Pero, RW, Wagner, H. 2000. Treatment of chemotherapy induced leucopenia in the rat model with aqueous extract from Uncaria tomentosa. Phytomedicine 7:137-143; Sandoval, M, et al., 2002. Antiinflammatory and antioxidant activities of Cat's Claw (Uncaria tomentosa and Uncaria guianensis) are independent of their alkaloid content. Phytomedicine 9: 325-337。
【0076】
3.1998〜2003年− Cat's Claw の水抽出物は、潰瘍性大腸炎(炎症性反応)、変形性関節症/関節痛、腫瘍細胞成長、体重増加、オゾン傷害、DNA損傷/細胞死、化学療法に誘発される白血球減少症および痴呆/アルツハイマーを妨げたまたは制御した。Sandoval-Chacon, M, et al., 1998, Anti-inflammatory actions of cat's claw: the role of NF-kappa B. Alimentary Pharmacological Therapy 12: 1279-1289; Piscoya, J, et al., 2001. Efficacy and safety of freeze dried cat's claw in osteoarthritis of the knee: mechanisms of action of the species Uncaria guianensis. Inflammation Res 50: 442-448; Sheng, Y., Pero, R.W., et al., 1998. Induction of apoptosis and inhibition of proliferation and clonogenic growth of human leukemic cell lines treated with aqueous extracts of Uncaria Tomentosa, Anticancer Research 18:3363-3368; Pero, RW, et al., Formulation and clinical evaluation of combining DNA repair and immune enhancing nutritional supplements. Phytomedicine 12(4): 255, 2005; Sheng, Y., Pero, R.W., et al., 2000, Treatment of chemotherapy-induced leukopenia in the rat model with aqueous extract from Uncaria Tomentosa. Phytomedicine 7(2): 137-143; Cisneros, FJ, et al., 2005, An Uncaria tomentosa (Cat's Claw) extract protects mice against ozone-induced lung inflammation. Journal of Ethanopharmacology 96:355-364; Castillo and Snow, 2002年2月発行の米国特許第6,346,280号)同時に、DNA修復および免疫細胞機能は増強された(Lamm, S., Sheng, Y., Pero, R.W. 2001. Persistent response to pneumococcal vaccine in individuals supplemented with a novel water soluble extract of Uncaria tomentosa, C-Med-100. Phytomedicine 8(4): 267-274; Sheng, Y., Bryngelsson, C., Pero, R.W. 2000. Enhanced DNA repair, immune function and reduced toxicity of C-MED-100TM, a novel aqueous extract from uncaria tomentosa. Journal of Ethnopharmacology 69:115-126; Sheng, Y., Li, L., Holmgren, K., Pero, R.W. 2001. DNA repair enhancement of aqueous extracts of Uncaria Tomentosa in a human volunteer study. Phytomedicine 8(4): 275-282; Akesson, C, Lindgren, H, Pero, RW, Leanderson, T, Ivars, F. 2003. An extract of Uncaria tomentosa inhibiting cell division and NF-kappa B activity without inducing cell death. Int Immunopharmacol 3: 1889-1990)。
【0077】
4.2000〜2002年− 天然化合物の一般的化学クラスとしてのCAE(カルボキシアルキルエステル)は、Cat's Claw 効力に関与していることが分かった。Sheng, Y, Pero RW, et al., 2000. Treatment of chemotherapy-induced leukopenia in the rat model with aqueous extract from Uncaria Tomentosa. Phytomedicine 7(2): 137-143。
【0078】
5.2005年− キナ酸エステルは、Cat's Claw の効力に関与しているCAEの主要タイプであることが分かった。Sheng, Y, et al., RW. 2005. An active ingredient of Cat's Claw water extracts. Identification and efficacy of quinic acid. Journal of Ethanopharmacology 96(3): 577-584。
【0079】
6.2005年− キナ酸は、主に、植物における芳香族(すなわち、共役二重結合環系)化合物生産への不可欠な生合成中間体であるという理由で、食物および天然サプリメント中に、エステル、塩または遊離酸として遍在している(Herrmann, K.M., Weaver, L.M. 1999. The shikimate pathway. Annual Review of Plant Physiology and Plant Molecular Biology 50:476-503)。したがって、エステルを分解すると考えられる胃内の強いpH=1ゆえに、およびヒトにおいて、順次、エステルをキナ酸へと代謝するとも考えられる高レベルの非特異的エステラーゼの存在ゆえに、天然に存在するキナ酸エステルは、おそらくは、生体内代謝によってキナ酸の最終的な生物活性形へと変換されるプロドラッグであったということであった。
【0080】
キナ酸は、温血動物によって生産されることはあり得ない。それは、体内では合成されないが、飲食物中に少量で存在するので、重篤な疾患から個体のDNA健康状態を保護することができる。
【0081】
超精製有効天然物
特に好適であるのは、キナ酸キレートの有効量を含む、単離された医薬組成物の製造方法であって、実質的に純粋なキナ酸と、水酸化アンモニウムとを、約6.9〜約7.6のpHに達する十分な水溶液中で混合して、キナ酸対アンモニウムイオンの比率が約1:1.54であるキナ酸のアンモニウムキレートを生じることを含む方法である。好適であるのは、約1%〜約10%の濃度の水酸化アンモニウム溶液を、100mlにつき約5g〜約30gのキナ酸を含むキナ酸水溶液に、その溶液のpHが約7.4〜約7.6に達する十分な量で、約15分間〜約4時間の一定時間内に加える方法である。
【0082】
QUINMAXTMは、基本的には、生理的pHにおいて約1:1.6(実際は、1:1.54)のモル比の実質的に純粋なアンモニウムキレートを形成するようにアンモニア処理された実質的に純粋なキナ酸である。本明細書中に開示され且つ請求の範囲に記載されているのは、キナ酸の有効なアンモニウムキレートの単離され且つ精製された組成物の製造方法である。本明細書中に記載の組成物は、例えば、実質的に純粋なD−キナ酸を、約pH7〜約pH7.5の範囲内の水酸化アンモニウムを用いた水性基剤中において、約1:1.6のモル比のアンモニウムキレートへと変換することによって製造される。約7.5のpHが好適である。しかしながら、本明細書中に記載のキナ酸アンモニウムキレートは、例えば、pH6.9、7、7.1、7.2、7.3、7.4、7.5および7.6で、および中間の全てのpH値で生じることができる。本明細書中に開示されているのは、キナ酸のアンモニウムキレートの有意の且つ有効な量を含む、単離された医薬または栄養薬組成物である。QuinmaxTMは、キナ酸の1(QA):1.6(NH4+)のモル比のアンモニウムキレートである。
【0083】
DNA修復を促進すること、DNA損傷を阻害することおよび細胞死を妨げることにおいて、C−Med−100などの Cat's Claw 水抽出物と同程度に有効である、キナ酸の1:1.54のモル比のアンモニウムキレートである QuinmaxTM。
【0084】
QuinmaxTMは、水性アンモニアでpH=7.5へと中和された実質的に純粋なキナ酸である。結果として、水中では、アンモニウムイオンも生じるが、それら自体、効力のある生物学的機能を有する。アンモニウムイオンは、例えば、GI管内のタンパク質合成を刺激し、リソソーム小胞を中和し、それによって酸化的ストレスDNA損傷を妨げ、そしてNF−κBに媒介される炎症性反応を阻害する。これらは、追加の毒性が全くない QuinmaxTMの追加の生物学的性質の例である。キナ酸は、Ames Assay において突然変異誘発性によって評価した場合、例えば、2700μg/mlでは全く毒性を示さなかった。Jacobsen, LB, Richardson, CL, Floss, HG. 1978. Shikimic acid and quinic acid are not mutagenic in the Ames assay. Lloydia 41(5): 450-452。安全性は、表2に示されている。ここでは、最も重要な考察は、最高用量のキナ酸暴露を、いろいろな動物モデルで効力を有することが分かったものと比較することである。いろいろな動物モデルシステムにおいて、キナ酸の既知の有効用量をはるかに超えるキナ酸用量が用いられてきたということは、全く明らかである。したがって、キナ酸での in vivo 処置についての安全性の余地は、ヒトにおいて有効であると考えられる用量について首尾一貫して示された。
【0085】
過剰のアンモニアは、凍結乾燥することによって除去した。C−Med−100と、C−Med−100アンモニアキレートとの比較は、図5に、IC値として示されている。
キナ酸の既知の毒性または安全性を、表2に示す。ここでは、最も重要な考察は、最高用量のキナ酸暴露を、いろいろな動物モデルで効力を有することが分かったものと比較することである。いろいろな動物モデルシステムにおいて、キナ酸の既知の有効用量をはるかに超えるキナ酸用量が用いられてきたということは、全く明らかである。したがって、キナ酸での in vivo 処置についての安全性の余地は、ヒトにおいて有効であると考えられる用量について首尾一貫して示された。更に、QuinmaxTMは、水性アンモニアでpH=7.5へと中和されたキナ酸である。結果として、水中では、アンモニウムイオンも生じるが、それら自体、効力のある生物学的機能を有し、例えば、GI管内のタンパク質合成を刺激し、リソソーム小胞を中和して酸化的ストレスDNA損傷を妨げ、そしてそれ自体、NF−κBに媒介される抗炎症反応を阻害する。Fuller, MF, Reeds, PJ. 1998. Nitrogen cycling in the gut. Ann Rev Nutr 18:385-411; Seglen, PO. 1983 (59) Inhibitors of lysosomal function. Methods of Enzymology 96: 737-764。これらは、Quinmax に加えられた追加の生物学的性質であったが、追加の毒性は全くなかった。
【0086】
【表2】

【0087】
University of Lund においてヒト志願者に、高用量QAの追加経口投与を、6gmの QuinmaxTMの摂取後に行った。この研究の目的は、QAを、1:1.6のモル比のQA対アンモニアイオンである QuinmaxTMとしてのアンモニアキレート形で投与した場合に、QAの馬尿酸への有意の代謝が起こったかどうか確かめることであった。
【0088】
見たところ健康な65歳の志願者に、300mlの水中に溶解した6gmの QuinmaxTMを15分間にわたって飲ませた後、約40mlの末梢血(4本のレッドトップバキュテーナー(4-red topped vacutainers))を、室温で凝固させて、遠心分離によって血清試料を調製した。血清試料採取時点は、0.7時間、1.7時間、2.7時間、3.7時間、10.5時間、12.5時間、22時間、28時間および44時間であった。30mlの血清試料を、50%エタノールで沈殿させ、空気流下で乾固させ、そしてキナ酸および馬尿酸の同時HPLC分析のために、1mlのメタノール中に再溶解させた。
【0089】
データは、図6に示されている。
この実験の目的は、三つの部分からなった。第一は、QAのピーク血清濃度に達した時点と、どの程度長くそれらが検出可能な状態のままであると考えられるかを決定すること。第二は、有意の量のQAが、馬尿酸へと変換されたかどうかを明らかにすることであった。第三は、QuinmaxTM、QAのアンモニウムキレート、およびより有効なQA変形を、初期の実験において認められたQAの薬物動態を変化させることなく、in vivo で用いうるかどうか。
【0090】
図6に報告されているデータは、ピーク血清濃度が、初期のデータと適度に一致した約10.5時間に達し;馬尿酸は、QAピーク血清レベルと同時的である3.7〜12.5時間に測定されうる;そして QuinmaxTMの薬物動態は、QAと同様であったということを確かめている。
【0091】
QAが、馬尿酸の代謝源として役立ちうるということを示すもう一つの重要な理由を、図7に示す。
QuinmaxTMは、例えば、2mg/mlの濃度の飲料水中で500mlx2の経口用量として補給することができる。キナ酸は、ヒトの場合、6000mg/日まで投与されていたので、補給された水は、キナ酸アンモニウムキレートとして与えられる、安全で、無味・無色である。
【0092】
QuinmaxTMは、天然DNA保護体として設計される。キナ酸は、ビタミンDNAである。それは、経口補給後に、DNA構造自体の損傷を除去する天然酵素過程を促進することによって、その健康上の利点を媒介する。科学者らは、動物の長命が、DNA修復を行うその能力によって予測されるということを繰り返し示すことが可能であった。例えば、齧歯類動物は、容易に90歳まで生存しうるヒトと比較して、僅か数年しか生きられないが、ヒトは、齧歯類動物の場合の16倍のDNA修復能力を有する。更に、一般的な哺乳動物長命と、DNA修復能力との間には、線形関係がある。本発明者が、現在、DNAを損傷から保護することによって少なくとも部分的にそれを認めているように、明らかに、哺乳動物は生命を進化させてきた。
【0093】
キナ酸、QuinmaxTMおよびC−Med−100は全て、おそらくは、DNA損傷を除去することによってまたはそれ以外には妨げることによって、DNA損傷薬DXRへの暴露後の細胞死を妨げることが分かった(図1)。ラット白血球(WBC)またはマウス脾臓WBCは、in vivo において、強制飼養かまたは飲料水中でのキナ酸経口投与後に、それぞれ、7.2〜>8.2x106個/mlかまたは6.2〜8.3x109個/mlに増加した。これらデータは、それら細胞を損傷した状態にし且つ死滅させることからのDNAの保護において13〜25%の増加を算定している。論理的に妥当である寿命を推測するならば、90歳の平均年齢までの生存は、その生存期間中に最適量のキナ酸を摂取することにより、112歳へと増加すると考えられる。
【0094】
免疫機能促進。C−Med−100に誘発される免疫担当細胞成長応答は、キナ酸によって模擬されるので、キナ酸も、成長刺激物質への抗原応答を抑制することなく、多数の完全機能性白血球を増加させることによって免疫機能を誘発したということが認められた。
【0095】
C−Med−100などの Cat's Claw 水抽出物は、マウス肺のオゾン傷害を妨げ、アルツハイマーモデルにおけるアミロイド体の溶解を誘発した(Castillo and Snow,2002年2月発行の米国特許第6,346,280号)。キナ酸もC−Med−100も、効力のあるNF−κB阻害剤であるので、それらは、強力な抗酸化剤でもあるが、それは、それらが順次、前炎症性サイトカイン阻害によって酸素ラジカルの生産を止めるからである。Sandoval-Chacon, M, et al., 1988. Anti-inflammatory actions of cat's claw: the role of NF-kzppa B. Alimentary Pharmacological Therapy 12:1279-1289。したがって、いずれかその天然に存在する遊離酸、エステル、塩またはキレートの形のキナ酸は、効力のある抗炎症薬であると考えられる。
【0096】
抗腫瘍活性。既に指摘されたように、天然において遭遇するキナ酸の最も一般的な形はエステルとして存在するが、エステルは、胃およびGI管内でキナ酸へと加水分解されると考えられる。キナ酸も、キナ酸エステルも、腫瘍細胞成長の増殖および浸潤双方を阻害することによって、腫瘍成長を制御することに有効であることが分かった。Yagasaki, K, et al., 2000. Inhibitory effects of chlorogenic acid and its related compouinds on the invasion of hepatoma cells in culture. Cytotechnology 33(1-3): 229-235; Hata, G, et al., 1992. Synthesis, structure and antitumor activity of a water-soluble platinum complex, 1R,3R,4R,5R-quinato(1R,2R-cyclohexanediamine)platinum (II). Chem Pharm Bull (Tokyo) 40(6): 1604-1605。
【0097】
更に、そのデータは、栄養食品中に一般的に見出されるキナ酸の一般的な健康上の利点を強く支持する。例えば、食物の平均乾燥重量消費が、約500mg/日であった場合、および消費された全食物材料が、20%のキナ酸含量を有した場合、天然食物源から約100mgのキナ酸を摂取しうると考えられる。約1400mgの1日ヒト用量が、ほぼ最適であると考えられるということを考慮すると、ヒト集団は、QuinmaxTMを飲食物に補給することによって大いに利益を得ると考えられることになる。
【0098】
本明細書中で論じられる凍結乾燥された医薬組成物が、本明細書中で論じられる生物学的作用を与えるのに好ましい投薬量は、約0.5〜約5mg/kg(ヒト体重)である。好ましくは、約1mg/kg〜約3mg/kg(体重)。本明細書中に記載の医薬組成物は、好ましくは、水基飲料中、例えば、水中に約0.5mg/ml〜約5mg/mlで製剤化することができる。好ましくは、約1mg/ml〜約3mg/ml。
【0099】
機能性食品
本明細書中に開示されているのは、毒性を減少させ且つ健康上の作用を増加させるために、食物中の天然に存在するQAEを遊離キナ酸へと加水分解する方法である。
【0100】
加水分解性タンニン(タラガロタンニン(taragallotannins)およびカフェタンニン(caffetannins))およびクロロゲン類似体などのフェノール樹脂は、毒性とみなされるのみならず、それらは、カフェ酸またはグルコースとのエステル結合中に高濃度のキナ酸を含有する(例えば、クロロゲン酸の約50%は、キナ酸である)。ある種の食物の、例えば、1M NaOHまたは1M HClでの強塩基または酸加水分解は、その食物中の遊離キナ酸を生じる。
【0101】
本発明の方法は、αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸、塩またはキレートの有効量を含む機能性食品の製造方法であって、食物であって、その食物中に約0.2%〜約35%w/wの一定量のαヒドロキシル有機酸を含む食物と、塩基とを、水溶液中において、食物中のαヒドロキシル有機酸の実質的に全ての形を加水分解する一定時間混合し;その溶液を約6.9〜約7.6のpHへと中和して、食物中のαヒドロキシル有機酸の実質的に全ての天然に存在する形の遊離酸、遊離酸の塩またはキレートを生じ;そして場合により、その溶液を凍結乾燥させて、単離された医薬組成物を製造することを含む方法について開示する。
【0102】
好適であるのは、例えば、食物が、リンゴ、アンズ、ガルシニア、ツルコケモモ、マルメロ、カンキツ類、パイナップル、プルーン、ヒマワリ、ワルトルベリー、クロイチゴ、アカフサスグリ、クロスグリ、キイチゴ、ババコ、フェイジョア、キワノ、パッションフルーツ、コダチトマト、セイヨウカリン、カキおよびコーヒーから成る群より選択され、そして塩基が、NaOH、KOHおよびNH4OHから成る群より選択される方法である。
【0103】
食物中のQAの有効レベルを識別する利点、およびQAアンモニウムキレートを含有する新規な食品添加物およびサプリメント
機能性食品は、伝統的医薬慣例によって定義のような、栄養素を超える健康上の利点を与えることができるいずれかの改変食品または成分を含めた、可能性のある健康によい成分を包含するものである。食物の治癒効果は、機能性食品について一般的に知られている概念である。ここでおよび文献中で指摘されるように、キナ酸エステルは、主に、タンニン、またはフェノールを含有するまたは炭水化物に連結したクロロゲン酸類似体とのエステル結合において天然に存在している主なキナ酸源である。キナ酸の多数の異なった形は、多くの食物の天然成分である。「放出された」QAそれ自体が、植物に由来する食用物質中に十分な高濃度で存在していた場合、それは、機能性食品である性質を示唆していると考えられる。多くの食物は、それらの成分中に、例えば、QAEもキナ酸も有する。ここに示されているデータは、植物または食物のキナ酸含量が、0.5%w/wを超える場合、該当する食物は、基本的に、ヒト消費時に、DNA修復および免疫反応性を促進することによって抗加齢栄養薬として機能するということを示している。この最少濃度またはそれを超える濃度を有する植物源は、これら自然の生体防御過程を刺激することによる健康上の利点を増加させるのに有効な処置であると考えられる。1日に1杯につき0.5%を超えるキナ酸食品含量は、1杯200gmについて1日に1gmのキナ酸の1日ヒト用量に等しいと考えられる(すなわち、200mg/kg/日の有効齧歯類用量から計算される)。
【0104】
【表3】

【0105】
食物の健康上利点
食物中には、二つの主な天然キナ酸源が存在する。(i)正に論じられているエステル形で貯蔵されている有意の量のキナ酸を有する食物、および(ii)記載のように既に天然に存在している有効レベルの遊離キナ酸を有する食物。双方の食物源は、大部分の植物中に同時に存在し、互いに相加的である。例えば、1杯のコーヒーは、約13gmの固形分を含有するが、その内の約765mgは、クロロゲン酸類似体であり、そしてその約50%(388mg)、または0.338gm/13gm=コーヒーの2.6%は、キナ酸である。コーヒーは、更に、4.7〜5.9%の遊離(非エステル化)キナ酸を含有する。したがって、食物源を加水分解することにより、または遊離キナ酸を有していないが、高濃度のタンニンまたはクロロゲン酸または双方を有する食物源を加水分解することにより、それら食物は、キナ酸に媒介される応答に帰する有効な健康上の利点を有する機能性食品へと変換されうる。QAエステル加水分解によって食物中の遊離キナ酸を増加させて、胃腸管内で有効用量に達する、機能性食品としてかまたは食品添加物として直接的に適格となると考えられる食物源の例。食物のキナ酸含量が、胃腸管中に吸収される量の0.5%を超えて上昇すると、血中のキナ酸は十分に増加するので、DNA修復および免疫の促進が起こる。この方式で考えると、キナ酸含有機能性食品は、プルーン、キーウィ、シーバックソーン(sea buckthorn)、コーヒー、ツルコケモモ、コケモモ(lingonberry)、ブルーベリー、ワルトルベリー、赤/黄色コダチトマトおよびスルタナのような、>0.5%のキナ酸を有するものである。<0.5%のキナ酸含量を有するものは、キナ酸含量が>0.05%に上昇しうると考えられるので、食品添加物に変換された状態になる良好な候補である。このカテゴリーの食品添加物源の例は、マルメロ、ヒマワリ、ネクタリン、モモ、ナシ、スモモ、ハチミツ、クロスグリ、セイヨウカリン、アスパラガス、マッシュルームおよびグリーンオリーブであった。
【実施例】
【0106】
実施例I
本発明者は、以前に、キナ酸およびアンモニア処理されたキナ酸、そしてその天然の cat's claw 源(例えば、C−Med−100)に関して、細胞死を伴うことなく成長停止を誘発することができるし、そして炎症、免疫およびDNA修復阻害、癌成長および加齢の処置におけるそれらの使用に寄与する機構としてのNF−κBを阻害することができるということを開示した(Sheng, Y, Akesson, C, Holmgren, K, Brynegelsson, C., Giampapa, V, Pero, RW. An active ingredient of Car's Claw water extracts. Identification and efficacy of quinic acid. Journal of Ethanopharmacology 92: 577-584, 2005; Akesson, C, Lindgren, H, Pero, RW, Leanderson, T, Ivars, F. Quinic acid is a biologically active component of the Uncaria tomentosa extract C-Med-100(registered trademark). International Immunopharmacology 5:219-229, 2005)。C−Med−100のような、cat's claw の水抽出物の活性成分は、キナ酸の類似体である。C−Med−100中のキナ酸の天然の形は、キナ酸エステルである。しかしながら、1〜10%アンモニアで処理されて加水分解されたキナ酸エステル、または遊離酸(+)としてのキナ酸それ自体は、キナ酸アンモニア塩またはキレートを生じるが(以前には、考えられても記載されてもいない)、それらは双方とも、本明細書中において in vivo で有効と記載され且つ特性決定されている。本発明のキナ酸エステルおよび/またはキナ酸塩の態様は、更に、陽イオンとのキレート化錯体である。しかしながら、これまでのところ、最終のキナ酸生物活性構造は、依然として未決定であった。ここで、本発明者は、キナ酸が、塩およびキレート化構造錯体双方で存在しうるし、そしてアンモニア処理されたキナ酸は、キナ酸をpH=7.5に変換する飽和量の1%アンモニアでの処理によって形成された場合、実際に、1:1.54モルのアンモニアキレートとして実験的に決定されるキナ酸の好適な組成物であるというデータを与えている(表4)。更に、Garcinia 抽出物中に存在するαヒドロキシルクエン酸(すなわち、Citrimix)などの他の天然に存在する塩も、1%アンモニアで中和された場合、キレート化錯体で存在するということが示されている。結論として、これらデータは、(i)簡単なヒドロキシル化およびカルボキシル化有機酸のキレート化錯体は、しばしば、全てではないがいろいろな陽イオンとキレートを形成し、例えば、キナ酸のNaOH処理は、1:1モル塩を生じる、そして(ii)有機酸のアンモニウムキレートは、その増強された栄養価および有効な値ゆえに、好適な組成物であるということを開示している。
【0107】
【表4】

【0108】
下の図1〜2に示されるデータは、有機酸のアンモニアキレートの、他の陽イオンキレートまたは塩と比較した利点を示す。
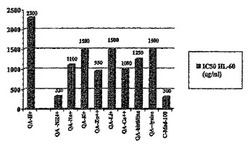
キナ酸塩およびキレートに関する研究について(図1)、キナ酸は、Sigma より購入した(>99%)。QA塩/キレートは、適当な塩基、すなわち、NH4OH、NaOH、Ca(OH)2、Zn(OH)2、LiOH、KOH、リシンまたはヒスチジンでのpH=7.5への中和によって合成した。試験化合物の連続希釈を、96ウェル平底微量滴定プレート中のヒトHL−60白血病細胞(0.05x106個/ml)に加えて、3000μg/mlまでの培養物中の最終濃度を与えた。それらプレートを、37Cで72時間インキュベートし、20μlのMTT(5mg/ml)で3時間パルス処理し、そして前記のように、分光測光によって540nmで発色を推定した。(Schweitzer, CM et al. Spectrophotometric determination of clonogenic capacity of leukemic cells in semisolid microtiter culture systems. Experimental Hematology 21: 573-578, 1993)。IC50値は、細胞の生/死比率に基づいて計算し且つ比較した。これらデータは、試験された全ての塩およびキレートが、HL−60腫瘍細胞成長を阻害することにおいて、遊離キナ酸(H+)より有効であったということを示している。QA−NH4+およびQA−Ca++などの既知のキレートは、QA−Na+などの既知の塩より有効であった。最後に、QA−NH4+キレートは、いずれか他の塩またはキレートよりもはるかに生物学的に有効であったし、そして実際に、生物活性成分としてキナ酸エステルを有する cat's claw 水抽出物(C−Med−100)と同程度に有効であった。これらデータは、それらの効力を増加させるために、アンモニアでキレート化される塩形であれ、エステルであれ、天然に存在する有機酸類似体のキレートを標的にしている。
【0109】
カルシウム/カリウムαヒドロキシクエン酸キレートとしての Citrimix の、ヒドロキシクエン酸のアンモニアキレート(Nu−Citrimix)と比較した研究について、マイトジェン(ConA,2ug/ml)の存在下における48時間の微量滴定細胞培養での in vitro 暴露後の一次脾臓細胞の阻害成長は、用いられたバイオアッセイ手順であった(Akesson C., Lindgren H., Pero R.W., Leanderson T., Ivars F., "An extract of Uncaria Tomentosa inhibiting cell division and NF-κB activity without inducing cell death," International Immunopharm 3:1889-1900, 2003)。Citrimix のIC25値およびIC50値は、アンモニアキレート(Nu−Citrimix)と全く同様であったが、Citrimix キレートとNu−Citrimix(アンモニウムキレート)との、それぞれ、3mg/mlおよび1mg/mlであるIC90値の間には、大きな減少があった。これらデータは、Nu−Citrimix(アンモニウムキレート)が、Citrimix、ヒドロキシルクエン酸のカルシウム/カリウムキレートと比較して、一次脾臓細胞の細胞死を伴わない成長停止として推定される改善された効力プロフィールを有したということを示していると解釈された。再度、これらデータは、天然に存在するヒドロキシル化およびカルボキシル化有機酸の有効な応答を媒介するのに好ましい組成物が、アンモニアキレートであるということを示している。
【0110】
実施例II
実施例2は、天然に存在するポリヒドロキシル化およびポリカルボキシル化有機酸のアンモニウムキレートが、温血動物の健康障害を処置するための栄養薬または医薬製品の開発に好適な構造類似体である理由を開示している。それら理由は、理論的には二つの部分からなる。(i)アンモニウムイオンは、その栄養的必要条件にしたがって生体による吸収を順次もたらす、腸内の窒素再循環〜アミノ酸およびタンパク質生合成を平衡させ且つ最大限にすることに、主に由来する主要な天然に存在する代謝産物である(Fuller and Reeds, Annu Rev Nutr 18: 385-411, 1998)。それ自体で、アンモニウムイオンは、引き続き、アミノ酸およびタンパク質の栄養代謝の一般的な支持に重要な前駆体であり、そして(ii)アンモニウムイオンは、リソソーム内部の酸性度を中和し、それによって酸化的ストレスラジカル生産を妨げることによってリソソーム機能を阻害することが周知であり、そしてそれによって、アンモニウムイオンは、免疫反応性を含めた細胞調節過程に影響を及ぼす重要な抗酸化剤である(Seglan, Methods in Enzymology 96: 737-764, 1983)。
【0111】
図3〜4に示されているデータは、天然起源のヒドロキシル化およびカルボキシル化有機酸の有効な健康上の利点を媒介するのに好適な構造としてのアンモニウムキレートの使用を直接的に支持する。
【0112】
図3に開示されているのは、キナ酸NH4+キレートが、キナ酸(H+)と比較して劇的に低下しているIC25値、IC50値およびIC90値を有することによって、in vitro で培養された脾臓細胞の成長を阻害するキナ酸(H+)の能力を大きく改善したことである。更に、そのデータは、等モルのNH4Clそれだけで、キナ酸アンモニウムキレートに匹敵するIC25値、IC50値およびIC90値を有したので、キナ酸NH4+キレート中のアンモニウムイオンの存在は、同様に生物学的に有効であったということを示している。
【0113】
更に、本発明者は、NF−κB阻害も、キナ酸NH4+キレート中に配合されたアンモニウムイオンによって促進されるかどうかも調べた(図4)。同様に、そのデータは、キナ酸NH4+キレートが、キナ酸(H+)を上回ってNF−κB阻害を促進したという事実と一致し、そして再度、NH4Cl中のアンモニウムイオン単独で、この有効な反応を誘発するキナ酸NH4+キレートと同程度有効であった。
【0114】
結論として、キナ酸NH4+キレートは、細胞死を伴わない成長停止およびNF−κB阻害として評価される優れた in vitro の有効な反応を有することが分かったが、それらは、順次、C−Med−100、キナ酸(H+)、およびアンモニア処理されたキナ酸(本明細書中において、キナ酸NH4+キレートとして構造的に解明されている)の in vivo 評価によって既に示されている、免疫、DNA修復、抗炎症性および抗腫瘍性を促進するのに役立つ分子機構である(Sheng, Y, Akesson, C, Holmgren, K, Brynegelsson, C., Giampapa, V, Pero, RW. An active ingredient of Car's Claw water extracts. Identification and efficacy of quinic acid. Journal of Ethanopharmacology 92: 577-584, 2005; Akesson, C, Lindgren, H, Pero, RW, Leanderson, T, Ivars, F. Quinic acid is a biologically active component of the Uncaria tomentosa extract C-Med-100(registered trademark). International Immunopharmacology 5:219-229, 2005)。
【0115】
実施例III
本明細書中に科学的に論じられているように、C−Med−100は、cat's claw の有効な水抽出物であり、そしてそれは、エステルなどのキナ酸類似体を含有することが知られている。キナ酸も、ヒドロキシクエン酸も、それらのアンモニア処理されたキレート形で一層生物学的に有効であったので(表3、図1〜4を参照されたい)、具体的には、キナ酸類似体、そして一般的には、植物抽出物中の他の天然に存在するヒドロキシル化およびカルボキシル化有機酸を、それらのキレート化形へと、具体的には、cat's claw の水抽出物、そして一般的には他の植物抽出物の、分子飽和レベルのアンモニアでの直接処理によって製剤化することへの製造利点が存在しうるということが推論された。この目的のために、および例として、C−Med−100を、最初に、90%メタノールでの沈殿によって、噴霧乾燥剤マルトデキストリンから水分涸渇させ(depleted)、そして次に、1%アンモニアで1時間処理後、凍結乾燥を施して、C−Med−100アンモニアキレートを直接的に形成した。過剰のアンモニアは、凍結乾燥することによって除去した。C−Med−100とC−Med−100アンモニアキレートとの比較は、図5に、IC値として示されている。そのデータは、Nu−CC100(すなわち、100%の水への溶解度、したがって、バイオアベイラビリティーを有する、アンモニア処理されたまたは栄養素化(nutrated)された cat's claw)についてのIC50値およびIC90値が、マウス脾臓細胞の成長を阻害することにおいて、普通のC−Med−100よりも有効であったという点で、C−Med−100をアンモニア処理することへの有効な利点を明らかに示している。これらデータは、未知の構造を有するキナ酸類似体のような、ヒドロキシル化およびカルボキシル化有機酸類似体を含有することが知られている粗製植物抽出物を、直接的にアンモニアキレート化形にし、それによって、それらの生物学的有効性を増強しうるという概念の証拠とされた。
【0116】
要約すると、カルボキシアルキル酸類似体構造を含有する粗製植物抽出物または生物活性物質のアンモニア処理は、アンモニア処理によって一層有効な製剤へと変換することができる。
【0117】
実施例IV
Quin+ Cat's Claw 水抽出物。
Quin+は、実験室において、75gmの Uncaria tomentosa 樹皮を、400mlの沸騰水抽出に1時間供することによって製造した。その樹皮熱水懸濁液を濾過し、遠心分離して、粒状物質を全て除去した。次に、抽出物を、フード内においてヘアドライヤーによって蒸発乾固させた。固体の収率は、9.9gm/75gmまたは13.2%であった。この抽出物を、Quin+と称し、全ての分析目的に用いた。
【0118】
実施例V
cats claw 中のキナ酸エステルは、キナ酸炭水化物エステルであるという確認。
グルクロニダーゼ実験。
【0119】
C−Med−100中のQAEが、炭水化物のQAエステルであったかどうか区別する努力において、グルクロニダーゼでの処理へのそれらの感受性を調べた。商業的に供給されたまま用いられたC−Med−100を、水中に710mg/mlで溶解させた後、1mlを未処理で放置し、そして更に1mlを、30mgのβグルクロニダーゼ(Type B1,ウシ肝1240000単位/gm)で37Cにおいて24時間処理した。次に、双方の標品を、QA含有エステルの分解について、HPLCによって分析した。
【0120】
Seliwanoff's 試験は、炭水化物が、単糖、二糖、オリゴ糖または多糖の形でありうるかどうかとは無関係に、それらが試料中に存在するかどうかを、またはそれらがエステル化されているか否かということについて、決定する場合に有用な比色法である。Seliwanoff's 試薬は、100mlの3M HCl中に0.05gmのレソルシノールである。0.1mlのほぼ1%炭水化物を、1mlの試薬と混合し、その試料を5〜10分間沸騰させる。深赤色沈殿は、フルクトースなどのケトース糖の存在を示すが、更に長時間加熱(例えば、30分)後に現れる赤色は、グルコースのようなヘキソース糖を示す。4種類の試料の炭水化物含量について、この手順によって分析した。それらは、D1 Rf=0.34、D1 Rf=0.56、C−Med−100およびQuin+であった。
【0121】
高速液体クロマトグラフィー(HPLC)分析。
Cat's Claw 樹皮の水抽出物のHPLCは、UV検出器785Aを装備した Perkin Elmer 200LCポンプを用いて行った。カラムは、C18 150X4.6mm Perkin Elmer-Brownlee(Pecosphere 製品番号0258−0169)であった。更に、縦一列であるが、150mm C18カラムの前に、Perkin Elmer C18 30X4.6mm Brownlee プレカラム(P/N N930−3395)を置いた。カラムを介して1ml/分において1500〜5000psiでポンプ輸送された移動相は、0.1%トリフルオロ酢酸(TFA):メタノール(77:23,v/v)かまたは0.2%TFA:メタノール(85:15,v/v)であった。UV検出器は、200nmの波長で設定した。20μlの注入ループを、全ての実験で用いた。データは、PE Nelson Turbochrom 4(S270−0052)を用いて蓄積し且つ再処理した。C18カラムは、1ml/分で30分洗浄後、次の溶媒順序で再生した。アセトニトリル:メタノール(30:70,v/v)、100%メタノール、メタノール:水(50:50)、メタノール:0.2%TFA、および100%の0.2%TFA。
【0122】
次に、1M NaOHを、1N HClでpH=4〜7へと中和した。加水分解された試料は、HPLC分析時点で25〜800mg/mlであった。±塩基加水分解を除いて、同一の処理済み Cats Claw 試料を、既に記載されたように、HPLCによって比較した。QA−H+を生じる塩基加水分解ピークは、C18カラムから、0.2%TFA:メタノール(85:15,v/v)中において1.97〜2.14分の保持時間で溶離した。対の未加水分解試料(すなわち、1.97〜2.14分)中に現れるいずれかのバックグラウンドピーク面積は、塩基加水分解に由来しないと考えられるので、QA計算から差し引いた。加水分解済み Cats Claw 試料中のQA濃度は、0〜25mg/mlのQA−H+の標準溶液のクロマトグラフィー後に生じたmVにしたがって、ピーク面積またはピーク高さから計算した。この方法により、QAが3mg/ml未満で検出されうることはない。mg/mlでのいろいろな濃度の分析用QA−H+(Sigma)標準へのmV応答で表されるピーク高さの線形回帰分析は、y=257.7(x)〜773,r=0.96として計算される3〜25mg/mlのきわめて有意の線形関係を生じた。
【0123】
±塩基加水分解済み試料の直接比較は、キナ酸ピークが、HPLCクロマトグラムにおいて、加水分解後試料で現れただけであったということを示したが、それは、加水分解前に存在するキナ酸エステルの炭水化物部分を示すいくつかの他の新しいピークを伴った。
【0124】
実施例VI
キナ酸は、ビタミンDNAである。
ビタミン類は、1929年に初めて発見され、その年の生理学・医学ノーベル賞を獲得した。ビタミン類は、生命に不可欠であり、そして代謝を調節することおよび消化された食物からエネルギーを放出する生化学的過程を補助することによって良好な健康に寄与しているので、そのようなものとして、現在、十分に定義された13種類のビタミン類が分類されている。したがって、「ビタミン」は、健康を保護するためにおよび生物の適切な成長を維持するために、少量(微量栄養素)で生体に必要とされる何らかの多様な有機化合物である。13種類のビタミンの内の(ビタミンDを除外する)12種類は、生体で製造され得ないので、最適な健康を維持するために、食事から得る必要がある。U.S. Food and Nutrition Board of the National Research Council は、微量栄養素に関して、消費者の健康が適切に維持されることを認識し且つ保証することを助けるために、栄養所要量を推奨している(RDA)。
【0125】
ここに既に示されているのは、ヒトDNAの健康状態が、最大限の生命機能を維持することにいかに重要であるかということである。事実、それは、DNA修復と称される全酵素系が、ヒトDNA(遺伝子)が化学的に損傷した状態になるおよび機能しなくなることへの第一線の防御を与えるように進化してきたというほどに重要である。この防御機構の酵素は、エンドヌクレアーゼ、エキソヌクレアーゼ、ポリメラーゼおよびリガーゼと称される。それらは全て、異なった仕事を有するが、一緒に働いて、1日24時間毎日のヒトの生活の誤った生活様式、食事および代謝によって引き起こされるDNA中の有害な損傷を除去する。加齢過程に対する生体の主要な防御機構として良好なDNA修復を維持することの重要性は、科学界においてこの20〜30年間に、正に認識され始めたばかりである。DNAは、DNA修復が、現在、ヒト寿命を予測することがきわめて周知であるように、ヒトの十分な生存に臨界的である。科学者らは、動物の長命が、DNA修復を行うその能力によって予測されるということを繰り返し示すことが可能であった。例えば、齧歯類動物は、容易に90歳まで生存しうるヒトと比較して、僅か数年しか生きられないが、ヒトは、齧歯類動物の場合の16倍のDNA修復能力を有する。更に、一般的な哺乳動物長命と、DNA修復能力との間には、線形関係がある(Pero, RW et al 1985; Pero et al 2000: Grube, K and Burkle, A 1992)。本発明者が、現在、DNAを損傷から保護することによって少なくとも部分的にそれを承知してるように、明らかに、哺乳動物は生命を進化させてきた。
【0126】
したがって、食事摂取量によって正常な代謝を触媒することにより、ヒト生体が良好な健康を維持するのに役立つことが知られている13種類のビタミンが既に存在しているので、加齢から保護する最も重要な代謝系であるDNA修復が、更に、ビタミンDNAに触媒される過程も有すると考えられるということは、単に妥当なだけである。ここで、食事中の微量栄養素として見出されるが、生体中では生産されない、キナ酸と称される天然物も、DNA修復を促進することが知られ、したがって、ビタミンとして分類される判定基準を全て満たしているということが示される。
【0127】
その発見は、C−Med−100と称される、Uncaria tomentosa である Cat's Claw 樹皮の熱水抽出物の生物学的活性を説明する試みで始まった。この抽出物は、DNA修復を刺激するのにきわめて有効であった。体内にある一つの最も重要なDNA保護過程の直接モジュレーション、すなわち、DNA修復についてのこの初期の生物学的特性決定後、DNA修復促進の裏にある天然物を、可能性のある抗加齢療法として認識する協定によるた努力がなされた。一連の化学研究は、科学者らに、カルボキシアルキルエステル(CAE)を生物活性物質として最初に識別させたが、その後、引き続き、キナ酸エステル(QAE)を、cat's claw 水抽出物中の唯一の生物活性CAEとして識別することが行われた。Cat's Claw QAEは、in vitro および in vivo 双方で生物活性であったが、しかしながら、酸または塩基加水分解されてキナ酸になった場合、そして存在するQAEのアルコール部分を有することなく、キナ酸それ自体は、QAEの場合と同程度に、in vivoDNA修復促進活性を有した。したがって、結論として、キナ酸は、Cat's Claw の最終の生物活性な形であったが、それは、Cat's Claw の水抽出物中にQAEとして存在した。QAEは、胃腸管内でキナ酸へと加水分解されると考えられることから、実際には、QAEは前代謝産物形である。
【0128】
もう一方において、キナ酸は、多くの植物中に、大部分の植物芳香族代謝産物の生合成に不可欠な中間体としてきわめて遍在して見出される。キナ酸は、温血動物によって生産されることはあり得ない。したがって、これら判定基準は、キナ酸を、ビタミンDNAのような、ビタミンの本質的な性質を全て有するとして分類する。それは、体内では合成されないが、食事中に少量で存在するので、重篤な疾患から個体のDNA健康状態を保護することができる。
【0129】
多くのビタミン類のように、ビタミンDNAは、いくつかの形で、すなわち、キナ酸エステル、キナ酸塩、キナ酸キレートとして、またはプロトン(H+)での遊離キナ酸として天然に存在しうる。これらいろいろなキナ酸天然形は、生存を促進しうるいずれの時点でも、生物の代謝によって媒介されている生物学的活性の変更に影響する。馬尿酸は、キナ酸の最終排泄形であり(Adamson, RH et al. Biochem J 113: 437-443, 1970)、それは、キナ酸が、周知の毒物である安息香酸を含めた(Nair, B. Int J Toxicol 20(suppl 3): 23-50, 2001)、植物ベンゾイル化アミノ酸生合成における不可欠な中間体(フェニルアラニン、トリプトファンおよびチロシン)であることから(Herrmann KM. The Plant Cell 7: 907-919, 1995; Herrmann KM and Weaver, LM. Annu Rev Plant Physiol Plant Mol Biol 50: 473-503, 1999)、存在すると考えられる。馬尿酸は、コーヒーおよび緑茶/紅茶などの健康食品を消費している個体の尿中に高濃度で見出されるが(Mulder, TP et al. Am J Clin Nutr 81(1 Suppl): 256S-260S, 2005)、ヒドロキシルラジカルトラップとして作用することも報告された(Malyusz, M et al. Kidney Blood Press Res 24(3) 149-158, 2001)。したがって、馬尿酸さえも、キヌレニン(kyrunenine)と直接的に拮抗して、トリプトファンIDO(インドールアミン2,3−ジオキゲナーゼ)分解経路を阻害することにより、キナ酸に関連した健康作用に寄与することがありうる(Bauer et al. Transplantation International 18: 95-100, 2004)。したがって、PHは、例えば、果実を有する(すなわち、大部分の果実は、酸性であり且つはるかに多量の遊離キナ酸を含有する)植物部分中の遊離キナ酸レベルを決定し、そしてそれは順次、植物生活史イベント中の成長因子および生殖因子に依存する。しかしながら、果実も、いったん種子が発芽し且つ成長し始めると、種子の初期成長期を支持するために高い栄養価貯蔵を必要とする。これは、時間を要するので、次に、キナ酸合成は、毒性タンニン(Dr Dan Brown, Cornell University, Department of Animal Science, www.ansci.cornell.edu/plants/toxicagents/tannin/)または芳香族エステル(例えば、クロロゲン酸)(Clifford, MN. J Sci Food Agri 80:1033-1043, 2000)または脂肪族エステル(例えば、Cat's Claw 中の炭水化物エステル)などの追加のキナ酸食物源の貯蔵または保護によって植物が生存するのに役立つ他の形へと迂回する。最後に、天然に見出されるキナ酸塩またはキレート形のタイプは、それらが成長している腸管微生物叢環境または土壌含有物によって調節される。それにもかかわらず、キナ酸は、遊離酸であれ、塩、キレートまたはエステル代謝形であれ、全て、ビタミンDNAの天然に存在する構造として考えられるはずである。
【0130】
いずれのビタミンも、いくつかの生物活性形を有するということは、例外ではないがむしろ、B−錯体ビタミンであるナイアシンの概説によって証明されうるように、原則であると考えられる。ナイアシンは、主に、穀物、堅果、フスマ、マメおよび種子の消費による食事から供される必要がある(Pitch, PT. Sante 15(3): 205-208, 2005)。ナイアシンは、体内でニコチンアミドへと代謝され、その場合、双方とも、ビタミンとして同様に有効であるが、ナイアシンは、潮紅を引き起こし、ニコチンアミドは引き起こさない。更に、外因供給されるL−トリプトファン(thrytophan)は、ナイアシンかまたはニコチンアミドのビタミン欠乏症を置き換えることができる(Oduho, GW and Baker, DH. J Nutr 123(12): 2201-2206, 1993)。ビタミンDNAとしてのキナ酸の考察と更に平行して、ナイアシンおよびニコチンアミドは、1−メチルニコチンアミドへと代謝されるが、その場合、それは尿中に排泄され、そしてこの排泄物も、生物学的活性を有することが分かった(Wozniacka, A et al. Clin Exp Dermatol 30(6): 632-635, 2005; Gebicki, J et al. Pol J Pharmacol 55(1): 109-112, 2003)。
【0131】
したがって、Cat's Claw QAEを、キナ酸へ、またはより生物活性なエステル、塩またはキレート形へと変換することは、ビタミンDNAの利用可能性を改善することでしかなく、現在、本発明者がその存在を承知していることである。これに関して、QuinmaxTMは、天然ビタミンDNAの利用可能性に最適な製剤である。
【0132】
本明細書中に挙げられている公報および特許は全て、本明細書中に援用される。記載された内容のいろいろな変更および変化は、発明の範囲および精神から逸脱することなく、当業者に明らかであろう。本発明を具体的な態様に関連して記載してきたが、請求の範囲に記載の発明が、これら態様に不適当に制限されるべきではないということは理解されるはずである。実際に、発明を実施するためのいろいろな変更は、当業者に明らかであり、請求の範囲の範囲内にあるものである。
【図面の簡単な説明】
【0133】
【図1】図1は、培養されたHL−60細胞において、いろいろなキナ酸塩、キレートまたは塩/キレート(未決定の飽和での分子構造)によって引き起こされる、IC50値(すなわち、50%の成長を阻害する用量)として表される in vitro 成長阻害を示す。QA−H+=遊離キナ酸(H+)、QA−NH4+=キナ酸アンモニウムキレート、QA−Na+=キナ酸ナトリウム塩、QA−K+=キナ酸カリウムキレート、QA−Zn++=キナ酸亜鉛塩/キレート、QA−Li+=キナ酸リチウム塩/キレート、Ca++=キナ酸カルシウムキレート、キナ酸ヒスチジン塩/キレート=QA−ヒスチジン、キナ酸リシン塩/キレート=QA−リシン、およびC−Med−100=非pH調整水抽出物。
【図2】図2は、C57BL/6マウス脾臓細胞の、Garcinia 抽出物によって引き起こされた成長停止を、Cat's Claw 水抽出物、C−Med−100と比較して示す。Garcinia 抽出物は、0.5M HClで遊離酸へと最初に変換し、凍結乾燥させた後、5MアンモニアでpH=7.5へと中和して、シトリミクス(citrimix)アンモニアキレート(表1)を生じることによって調製された Citrimix および栄養素化(nutrated)Citrimix(Nu−Citrimix)であった。脾臓細胞の成長は、48時間後のマイトジェンConA(2.5μg/ml)への応答において、放射性チミジン取込みによって評価した。比較は、脾臓細胞の成長の25%、50%および90%阻害について、mg/mlでの用量、すなわち、IC用量値で行う。
【図3】図3は、C57BL/6マウス脾臓細胞の、キナ酸(H+)、キナ酸NH4+キレートおよびNH4Clによって引き起こされる成長停止を示す。キナ酸NH4+キレートは、水酸化アンモニウムでpH=7.5キナ酸(H+)へと中和することによって合成した。キナ酸(H+)を中和するのに必要な水酸化アンモニウムの量も、HClで中和して、NH4Cl対照を生じた。脾臓細胞の成長は、48時間後のマイトジェンConA(2.5μg/ml)への応答において、放射性チミジン取込みによって評価した。比較は、脾臓細胞の成長の25%、50%および90%阻害について、mg/mlでの濃度、すなわち、IC値で行う。
【図4】図4は、前に詳細に記載のような、キナ酸(H+)、pH=7.5に中和されたキナ酸アンモニウムキレート、または同等量の水酸化アンモニウム(NH4Cl)で処理後のジャーカットT細胞におけるNF−κBの評価を示す。
【図5】図5は、C57BL/6マウス脾臓細胞の、Cat's Claw 水抽出物、C−Med−100またはNu−CC100によって引き起こされる成長停止を示す。Nu−CC100は、1%アンモニアでのC−Med−100の処理によって栄養素化した後、凍結乾燥させて、内在する有機酸類似体のキレートを形成させた。Cat's Claw 水抽出物、C−Med−100またはNu−CC100によって引き起こされるC57BL/6マウス脾臓細胞の成長停止は、48時間後のマイトジェンConA(2.5μg/ml)への応答において、トリチウム化チミジン取込みによって評価した。Nu−CC100は、1%アンモニアでのC−Med−100の処理によって栄養素化した後、凍結乾燥させた。比較は、脾臓細胞の成長の25%、50%および90%阻害について、mg/mlでの用量、すなわち、IC値で行う。
【図6】図6は、QAのアンモニアキレートである6gmの QuinmaxTMの経口投与後の馬尿酸の検出を示す。
【図7】図7は、馬尿酸とキヌレニンとの間の構造類似性を示すが、それは、トリプトファン分解経路に不可欠な中間体である。QAから代謝される馬尿酸は、キヌレニン酵素基質部位への化学結合によって、トリプトファン分解を競合阻害することがありうる。
【図8】図8は、ラットにおいて、DXR(2mg/ml)処置後にC−Med−100(80/kg)、キナ酸(200mg/kg)、またはアンモニア処理されたキナ酸(200mg/kg)によって引き起こされるDNA損傷回復を示す。15日後の白血球(WBC)成長を、血液中の1012WBC/リットルとして推定する。DXR=ドキソルビシンDNA損傷薬。
【背景技術】
【0001】
優先権は、本明細書中にそのまま援用される、2005年3月16日出願の米国仮出願第60/662,446号より示される。
【技術分野】
【0002】
本発明は、天然に存在するαヒドロキシル有機酸の実質的に全ての形を変換して、各々の該当する遊離酸、塩またはキレートにする、例えば、植物材料中のキナ酸をキレート形にする方法;および増加した生物学的効力を示すが、毒性を減少している改善された医薬組成物であって、各々の該当する遊離酸、塩またはキレートが、実質的に存在する形である医薬組成物の関連した製造に関する。
【0003】
ウンカリア・トメントサ(Uncaria tomentosa)および他の「キャッツクロー(Cat's Claw)」種は、アカネ科(Rubiaceae)、シンコノイデエ(cinchonoideae)亜科および Uncaria 属に属する。これらタイプの植物は、熱帯地域で成長し、フック様とげでよじ登る木性つるから成る。医学史的慣例による二つの主な種は、Uncaria tomentosa およびウンカリア・ギアネンシス(Uncaria guianensis)である。歴史的に、この科の植物に由来することが判明した化合物について二つの主な化学的クラスがある。それらは、1932年に初めて記載されたシンコナ(chinchona)樹皮中のキナ酸のような、遊離酸、塩またはエステルとしてとして天然に存在する有機酸、または1952年に抽出されたキニーネのような、シンコナ樹皮中のアルカロイドである。したがって、アルカロイドおよび有機酸類似体が、それら Uncaria 種中できわめて一般的に見出されるということは、驚くべきことではない。
【0004】
Cat's Claw 抽出物での主な医学史的慣例は、樹皮または他の植物部分を焚き火で沸点付近の温度に加熱することから発展してきたが、樹皮は、水中に一晩入れられる。翌朝、部分蒸発した抽出物を、普通にお茶として飲む。
【0005】
Cat's Claw は、歴史的伝統的薬剤として何千年も用いられていることが周知の植物であるが、その場合、それは南米原産である。Ashinka Indians は、水中の樹皮を焚き火で一晩沸騰させることで調合物を調製後、その混合物を植物部分から傾瀉し、そして得られた抽出物を毎日吸い飲みして、感染、炎症性障害、そして精神状態をも制御するのに役立てた。最近の公報は、Uncaria tomentosa(cat's claw)抽出物が、オゾンに誘発される肺炎症からマウスを防御するということを報告している(Cisneros, F.J., et al., J. Ethnopharmacol., 15;96(3):355(Jan. 2005)。
【0006】
エステル/CAE
Cat's Claw 製品の市販製剤は、アルカロイド含量かまたはカルボキシアルキルエステル(CAE)含量に基づく製剤を標準化することに集中してきた。2005年11月15日発行の米国特許第6,964,784号は、既知の uncaria 抽出物の生物活性成分の単離、精製および識別に及んでいる。uncaria 抽出物の生物活性成分として具体的に識別されているのは、キナ酸を含有するカルボキシアルキルエステル(CAE)として以前に包括的に識別されたキナ酸エステルを含めたキナ酸錯体である。単離された生物活性成分は、キナ酸エステル類似体、好ましくは、キナ酸ラクトンとして識別されている。
【0007】
Sheng, Y., et al., は、同様に、An Active Ingredient of Cat's Claw Water Extracts Identification and Efficacy Of Quinic Acid と称する報告を公表したが、ここにおいて、uncaria の活性成分は、キナ酸、すなわち、遊離酸それ自体として、更には、初期の包括的記載にカルボキシアルキルエステル(CAE)として包含されたキナ酸エステルとして化学的に定義された。J. Ethnopharmacol., 15;96(3):577(Jan. 2005)。
【0008】
遊離酸および塩
2004年10月21日出願の、2005年8月11日公開の米国出願公開第20050176825号は、uncaria の水抽出の生物活性成分の単離、精製および構造的識別に関する。その開示は、生物活性成分は、以前に、キナ酸ラクトンおよび他の関連キナ酸エステルとして識別されたが、その生物活性成分は、アンモニア処理されたキナ酸を含めた、キナ酸およびキナ酸塩それ自体として解明されるということを認めている。しかしながら、アンモニアキレートは、基本的に、アンモニア塩の生成に付随して最少量で存在しうる人工産物として識別されるにすぎない。
【0009】
Akesson, C., et al., は、Quinic Acid is a Biologically Active Component of the Uncaria Tomentosa Extract C-Med 100 と称する報告を公表したが、ここにおいて、キナ酸は、uncaria 抽出物の不可欠な生物活性成分として識別されているが、著者らは、それが、おそらくは、遊離酸形で天然に存在することはないということを認めている。新規な塩、キレートまたは加水分解性エステルは、単純なアンモニウム塩よりもむしろ好ましく示されるということが仮定される。更に、著者らは、エステル、キレートまたは塩の形のキナ酸同等物の含量が、in vivo 生物作用に有意に寄与しうるということを指摘している。Int. Immunopharmacol., 5(1):219(2005)。
【0010】
Cat's Claw 抽出物もキナ酸も、アルツハイマーなどの神経変性疾患に関連したβアミロイド斑を減少させることが以前に示された。米国特許第6,346,280号および米国出願公開第20010055630号および同第20010047032号。しかしながら、これら開示は、βアミロイド体および神経変性疾患に限定されているが、免疫過程、抗炎症過程、抗腫瘍過程およびDNA修復過程への一般的な論及を全く包含していなかった。
【0011】
しかしながら、米国食品医薬品局(FDA)の科学者によって最近公表されたように、「未知の物質の存在が、cat's claw[uncaria]抽出物の作用全体に重要な役割を有するということは、考察すべき重要な因子であると考えられる」。Valerio, LG, et al., Toxicological Aspects of the South American Herbs Cat's Claw (Uncaria tomentosa), Toxicol. Rev., 24(1):11(2005)。
【発明の開示】
【0012】
本発明は、キナ酸のような、遊離酸または塩またはキレートまたはエステルとして天然に存在するαヒドロキシ有機酸の生物活性成分の組成物であって、しかもヒトジャーカットT細胞におけるNF−κB活性化を、1.25mg/mlまたはそれ未満の用量で、最大 in vitro 応答の最低50%に阻害しうる、および/またはマイトジェン(ConA)の存在下において in vitro で培養された脾臓細胞の成長停止を、2mg/mlまたはそれ未満の用量で引き起こしうる、および/または処置のための十分な量での全身投与で、免疫、抗炎症、抗腫瘍またはDNA修復を促進する、αヒドロキシ有機酸の生物活性成分の組成物に関する。
【0013】
本発明は、更に、遊離酸、または塩またはキレートまたはエステルとして存在するαヒドロキシ有機酸を含有する植物抽出物の変換方法であって、しかもその抽出物の、強塩基、例えば、約1M NaOHまたは10%未満のアンモニア(例えば、約0.8%〜10%)または双方での約2時間(約15分間〜約4時間)の処理によって遊離酸かまたは塩かまたはキレート化した形へと変換されうるし且つその抽出物の強塩基処理後に、≧約0.5%(gm/100gm)の遊離有機酸または塩またはキレート形、例えば、キナ酸を含有する;そしてジャーカットT細胞におけるNF−κB活性化を、1.25mg/mlまたはそれ未満の用量で、最大 in vitro 応答の最低50%に阻害しうる;またはマイトジェン(ConA)の存在下において in vitro で培養された脾臓細胞の成長停止を、2mg/mlまたはそれ未満の用量で引き起こしうる;および全身処置が、免疫、抗炎症、抗腫瘍またはDNA修復を促進するのに十分な量である、αヒドロキシ有機酸を含有する植物抽出物の変換方法に関する。
【0014】
更に、本発明は、投与用に有効な医薬組成物中のキナ酸それ自体、または他の天然に存在する塩、キレートまたはエステルの形での化合物に関するが、それは、シキミ酸経路によって温血動物の体外で生産されることだけに制限される;およびDNA修復の体内過程を促進することによって、DNA損傷の排除およびその健康上の結果を増加させることができる;および食物源中に少量で広く存在するものであり;そしてそれは、DNA修復および老化を防止する良好な健康状態の維持に不可欠である、すなわち、老化を防止する良好な健康状態の維持に不可欠なビタミンDNAとして現在識別されているものである。
【0015】
本発明は、更に、飲食によるヒト消費後に、≧1mg/kgの有効量が24時間以内に与えられて、免疫過程、抗炎症過程、抗腫瘍過程またはDNA修復過程を促進するのに十分であるようになる≧0.5gm/100gmの量で、キナ酸、その塩またはキレートを含有する食物または植物組成物に関する。
【0016】
本発明は、更に、本発明の方法によって製造される組成物;または≧0.5%w/wのキナ酸またはその塩を含有する組成物;または凍結乾燥された全てのそれら組成物であって、(a)ヒトジャーカットT細胞におけるNF−κB活性化を、1.25mg/mlまたはそれ未満の用量で、最大 in vitro 応答の少なくとも50%に阻害する;(b)マイトジェン(ConA)の存在下において in vitro で培養された脾臓細胞の成長停止を、2mg/mlまたはそれ未満の用量で引き起こす;および(c)哺乳動物への約1mg/kg〜200mg/kgの用量での、免疫、抗炎症、抗腫瘍またはDNA修復を促進する全身投与、から成る群による少なくとも一つの性質を示す組成物に関する。
【0017】
本発明は、哺乳動物への投与用の単離された医薬組成物であって、αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸、塩またはキレートの有効量、例えば、ヒトに約0.2mg〜約10mg/kgの送達を行う剤形を含む医薬組成物の製造方法に関する。
【0018】
更に、本発明は、哺乳動物への投与用の植物材料の水性抽出物から単離された医薬組成物であって、αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸、塩またはキレートの有効量を含む医薬組成物の製造方法に関する。
【0019】
本発明は、更に、哺乳動物への投与用の実質的に純粋なキナ酸から単離された医薬組成物であって、約1:1.54のキナ酸対アンモニウムイオン比率のキナ酸キレート、好ましくは、アンモニウムキレートの有効量を含む医薬組成物の製造方法に関する。
【0020】
更に、本発明は、機能性食品の製造方法であって、食物中に存在するαヒドロキシル有機酸エステルの実質的に全ての形を加水分解して、食物中のαヒドロキシル有機酸の実質的に全ての天然に存在する形の遊離酸の塩および/またはキレートを生じることを含む方法に関する。
【0021】
本発明は、更に、本発明の方法によって製造される製品に関する。
本発明は、具体的には、本発明の方法によって製造される組成物であって、(a)ジャーカットT細胞におけるNF−κB活性化を、1.25mg/mlまたはそれ未満の用量で、最大 in vitro 応答の最低50%に阻害する;および/または(b)マイトジェン(ConA)の存在下において in vitro で培養された脾臓細胞の成長停止を、2mg/mlまたはそれ未満の用量で引き起こす;および/または(c)哺乳動物へ有効量で投与された場合、免疫過程、抗炎症過程、抗腫瘍過程、DNA修復過程またはトリプトファン取込み過程を促進する、遊離酸、塩またはキレートを含有する組成物に関する。
【0022】
更に、本発明は、DNA修復を促進する、トリプトファン取込みを促進する、免疫応答を促進する、炎症を制御する、または腫瘍の進行を阻害する方法であって、本発明の方法によって製造された組成物の有効量を投与することを含む方法に関する。
【0023】
発明の詳細な説明
特に断らない限り、本明細書中で用いられる専門用語および学術用語は全て、本発明が属する技術分野の業者によって一般的に理解されるのと同じ意味を有する。本明細書中に引用される公報および特許は全て、本明細書中に援用される。
【0024】
本明細書中で用いられる「αヒドロキシ有機酸」という用語は、カルボキシル(−COOH)基を含有する炭素へのαのヒドロキシル(−OH)基(または隣接する炭素)の位置を意味する。本明細書中で用いられる「αヒドロキシ有機酸の全ての形」という用語は、エステル化されたαヒドロキシ有機酸、遊離αヒドロキシ有機酸(H+)およびその塩およびキレートを意味する。
【0025】
ここでは、アンモニウムイオンが、例えば、植物抽出物中に存在するαヒドロキシ有機酸生物活性成分の栄養価も有効な作用様式も増強するということが開示される。
キナ酸(QA)は、ポリヒドロキシル化αヒドロキシモノカルボン酸であるので、キレート、更には、塩およびエステルを形成することができる。したがって、ここでは、実際に、キナ酸が、水酸化ナトリウムのような若干の塩基で中和された場合に塩を、そして水酸化カリウムまたは水酸化アンモニウムのような他の塩基で中和された場合にキレートを形成したということを開示する。例えば、下の表1を参照されたい。
【0026】
本明細書中で用いられる「キナ酸の全ての形」という用語は、遊離キナ酸(H+)、キナ酸塩、キナ酸キレート、または全ての天然に存在するキナ酸エステルのエステル、例えば、cats claw、タンニンまたはクロロゲン酸中の炭水化物エステルを意味する。キナ酸のエステルは、強塩基またはアルカリでの処理後にキナ酸を生じる化合物として定義される。
【0027】
カルボキシ有機酸塩は、1モルのカルボキシ基につき、それを中和するのに1相当モルの塩基を要するということによって定義される。したがって、モノカルボキシ有機酸の1:1モル塩は、真塩であり、ジカルボキシ酸が中和されている場合、2:1モル塩である。キナ酸およびαヒドロキシルクエン酸などのカルボキシ有機酸は、安定なキレート形が存在していることを示す飽和分子平衡において理論モル比に達しない。
【0028】
本明細書中で用いられる「キレート」という用語は、遊離酸対イオン(例えば、アンモニウムイオン)の比率であって、その比率で示されているイオンが整数でない比率、例えば、1:1.2、1:1.3、1:1.4、1:1.5および1:1.6、更には、中間の値、例えば、1:1.54(アンモニウムイオンで飽和したキナ酸)を意味する。しかしながら、それら条件、具体的には、溶液のpHに依存して、キレート比(chelate reatios)は異なる。本明細書中で論じられるように、1:1.54の比率に近いのが好適であるが、本発明のキナ酸キレート組成物は、1:1.54のキナ酸対アンモニウムイオン比率を有するものに制限されるわけではない。
【0029】
【表1】

【0030】
遊離酸(H+)としてのキナ酸自体、または過剰のアンモニアで(例えば、10%アンモニアで、例えば、2時間)処理された、キナ酸を放出する加水分解されたキナ酸エステルそれ自体は、各々、本明細書中に in vivo で有効と記載され且つ特性決定されるキナ酸アンモニアキレートを生じる。
【0031】
エステル以外のαヒドロキシ酸類似体構造を含有する粗製植物抽出物または生物活性物質も、本明細書中に記載のアンモニア処理により、一層有効な製剤へと変換することができる。
【0032】
更に、本発明は、例えば、アスコルビン酸、フマル酸、グルタル酸、乳酸、リンゴ酸、シュウ酸、酒石酸、クエン酸、αヒドロキシクエン酸、キナ酸、シキミ酸、ケイ皮酸(cinnamonic)、サリチル酸、カフェ酸、馬尿酸、安息香酸およびフェノール酸などであるが、これに制限されるわけではないヒドロキシル化またはカルボキシル化された有機酸を含有することも知られている、リンゴ、アンズ、ガルシニア(garcinia)、ツルコケモモ、マルメロ、カンキツ類、パイナップル、プルーン、ヒマワリ、ワルトルベリー(whortleberry)、クロイチゴ、アカフサスグリ(red currant)、クロスグリ(black currant)、キイチゴ、ババコ(babco)、フェイジョア(feijoa)、キワノ(kiwano)、パッションフルーツ、コダチトマト(tamarillo)、セイヨウカリン(medlar)、カキ(persimmon)または他の植物源のような、生物活性な低分子量有機酸をも包含する他の植物水抽出物も、一層有効なキレート形へと好都合に変換することができるということを開示している。
【0033】
本発明は、更に、植物材料中のキナ酸の実質的に全ての形を、キナ酸キレート、具体的には、キナ酸アンモニウムキレートへと変換する方法;および増加した生物学的効力を示すが、毒性を減少している改善された医薬組成物の関連した製造に関する。具体的には、本発明の好ましい組成物は、本明細書中に記載の少なくとも一つの生物活性を示す少なくとも一つのキナ酸キレートの実質的な量または少なくとも有効量を含む。
【0034】
本明細書中で用いられる実質的な量は、キナ酸キレートが、組成物中に存在するキナ酸の全ての形の5%を超えている、好ましくは、15%を超えている、最も好ましくは、25%を超えている組成物を意味する。
【0035】
好ましくは、少なくとも一つのキナ酸キレートは、組成物中に存在するキナ酸の大多数の形である。本明細書中で用いられる大多数の形は、キナ酸キレートが、組成物中に存在するキナ酸の全ての形の50%を超えている、好ましくは、60%を超えている、最も好ましくは、70%を超えている組成物を意味する。
【0036】
組成物は、少なくとも一つのキナ酸キレートが、組成物中に存在するキナ酸の実質的に大多数の形であるものが好適である。本明細書中で用いられる実質的に大多数の形は、キナ酸キレートが、組成物中に存在するキナ酸の全ての形の50%を超えている、好ましくは、60%を超えている、最も好ましくは、70%を超えている組成物を意味する。
【0037】
組成物は、例えば、キナ酸アンモニウムキレートが、組成物中に存在するキナ酸の実質的に大多数の形であるもの、またはキナ酸アンモニウムキレートが、組成物中に実質的に存在するキナ酸の唯一の形であるものが好適である。
【0038】
本明細書中で用いられる、実質的に存在する唯一の形としてのキナ酸アンモニウムキレートとは、キナ酸キレートが、組成物中に存在するキナ酸の全ての形の90%を超えている、好ましくは、95%を超えている、最も好ましくは、99%を超えている組成物を意味する。
【0039】
組成物は、例えば、キナ酸アンモニウムキレートが、組成物中にキナ酸の実質的に唯一の形として存在しているものを本明細書中に記載している。
本発明は、更に、水植物抽出物の生物活性成分の単離、精製および構造的識別に関する。Uncaria 抽出物中で以前に識別された生物活性成分のあるクラスは、キナ酸ラクトン、少なくとも271〜>10,000の分子量であるキナ酸の炭水化物エステル、および他の関連キナ酸エステル(例えば、タンニンおよびクロロゲン)を含めたCAE(カルボキシアルキルエステル)として識別された。本発明は、ここで更に、キナ酸アンモニアキレートを含めたキナ酸キレートおよびキナ酸を包含する Uncaria の生物活性成分を識別している。
【0040】
本発明は、多数の植物抽出物の生物活性成分として、キナ酸と、アスコルビン酸、フマル酸、グルタル酸、乳酸、リンゴ酸、シュウ酸、酒石酸、クエン酸、αヒドロキシクエン酸、キナ酸、シキミ酸、ケイ皮酸、サリチル酸、カフェ酸、馬尿酸、安息香酸およびフェノール酸などの他の天然に存在する有機酸に焦点を合わせている。本明細書中に開示されているのは、それが、植物抽出物に効力を与えるのに好ましい構造であるが、むしろ、キレートを形成するそれらの能力を与えるのに好ましい構造である有機酸エステルまたは塩ではないということである。
【0041】
例えば、キナ酸もヒドロキシクエン酸(garcinia)も、それらのアンモニア処理されたキレート形で一層生物学的に有効であるので、具体的には、キナ酸類似体、そして一般的には、植物抽出物中の他の天然に存在するヒドロキシル化およびカルボキシル化有機酸を、それらのキレート化形へと、具体的には、cat's claw の水抽出物、そして一般的には、他の植物抽出物の、分子飽和レベルのアンモニアでの直接処理によって製剤化することへの製造利点が存在しうるということが推論された。
【0042】
Cat's Claw の水溶性抽出物中で見出されるカルボキシアルキルエステル(CAE)は、キナ酸炭水化物エステルである
キナ酸部分およびエステル結合
C−Med−100中に存在するCAE(例えば、水溶性 Uncaria 抽出物)は、キナ酸エステルである。キナ酸へのエステル結合の存在は、HPLCクロマトグラムにおいて、多数のピークが、塩基加水分解後に激減するかまたは消失すると認められうるということによって支持される。これは、それら化合物を、塩基加水分解へのそれらの感受性ゆえに、エステルとして識別する。これらデータは、Cat's Claw 水抽出物中のCAEが、実際にQAエステルであるということを確証している。
【0043】
エステルのアルコール部分
例えば、C−Med−100からQAエステルを精製する試みは、以前に、主に、例えば、C−Med−100中で豊富と識別されうるエステルの不均一な性質ゆえに、きわめて困難であると示された。例えば、C−Med−100中には、少なくとも5個の主要な塩基ピークが見出された。塩基加水分解に感受性である、本明細書中に記載のQuin+には約10個存在する。したがって、本明細書中に更に記載のように、いずれか一つの精製QAエステルが、それ自体で、Cat's Claw 水抽出物の効力の大部分を説明しうるとは全く考えられない。QAエステル構造の不均一性は、分子のアルコール部分に由来し、Cat's Claw 製品の効力に大きく寄与してはいない。QAはそれ自体で、例えば、in vivo でのC−Med−100に匹敵しうる効力を有する。
【0044】
Cat's Claw の加水分解産物中のキナ酸の存在を確かめるNMR研究もまた、別の主要成分の出現を識別する場合に有用であった。この構造のNMR分析は、二糖であるそれと一致した。Cat's Claw 抽出物の塩基加水分解後のキナ酸および二糖の同時出現は、Cat's Claw 中のQAエステル、すなわち、QA炭水化物エステルの真の構造について最初に示したものであった。これは、二つの不可欠な方法で更に実証された。まず最初に、グルクロニダーゼは、炭水化物ポリマーのグリコシド結合を攻撃して、単糖、二糖およびオリゴ糖フラグメントのような一層小さいサブユニットへとそれらを分解することが周知の酵素である。Cat's Claw 中のQAエステルは、自然条件下で鎖長が変化する炭水化物エステルであったが、分岐は、グルクロニダーゼ処理によって示されるQAエステルの不均一な性質によって示される。これら結果は、キナ酸に富み、したがって、キナ酸の保持時間(1.96〜2.14分)に一層近づいている、部分消化されて生じた分子と一致している。
【0045】
本明細書中に記載されているのは、αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸、塩またはキレートの有効量を含む、哺乳動物への投与用の単離された医薬組成物の製造方法であって、αヒドロキシル有機酸の少なくとも一つの天然に存在する形と、一定量の強塩基(1〜10%アンモニア、1〜5M NaOH、1〜5M KOH、1〜5M水酸化カルシウムなど)とを、水溶液であって、αヒドロキシ有機酸の全含量が、その溶液の約0.5%〜約35%w/wになる水溶液中において、存在するαヒドロキシル有機酸エステルの実質的に全ての形を遊離酸へと加水分解し且つそれらをキレートへと変換するのに適当な時間中混合することを含む方法である。塩基処理された溶液を約7.5のpHへと酸性にすることにより、塩およびキレート形は全て、実質的に変換されて、遊離酸形だけになり、その後、得られた遊離酸形は、場合により凍結乾燥されて乾燥組成物になるかまたは、塩基での中和によって更にキレートに変換される。
【0046】
αヒドロキシル有機酸量の全含量は、例えば、その溶液の約5%〜約35%w/wであってよい。
実際には、当業者に知られているいずれかの実験室用酸、例えば、塩酸、硫酸、酢酸、酒石酸、乳酸、プロピオン酸、クエン酸および硝酸が含まれるがこれに制限されるわけではない酸を用いて、溶液を「中和する」ことができる。約7.5のpHが好適である。
【0047】
本発明の方法は、例えば、塩基が、NaOH、KOH、水酸化亜鉛、水酸化カルシウムおよびNH4OHから成る群より選択され、そしてそれを約15分間〜約4時間加えて、水溶液中の濃度を約0.5M〜約5Mの範囲内にする方法である。
【0048】
得られた組成物は、剤形の製造のために、例えば、薬学的に許容しうる担体(例えば、滅菌脱イオン水)との混合のために、凍結乾燥させることができる。本明細書中で論じられる凍結乾燥された医薬組成物が、本明細書中で論じられる生物学的作用を与えるのに好ましい投薬量は、約0.5〜約5mg/kg(ヒト体重)である。好ましくは、約1mg/kg〜約3mg/kg(体重)。本明細書中に記載の医薬組成物は、好ましくは、水基飲料中、例えば、水中に約0.5mg/ml〜約5mg/mlで製剤化することができる。好ましくは、約1mg/ml〜約3mg/ml。
【0049】
好適であるのは、単離された医薬組成物の製造方法であって、αヒドロキシル有機酸の少なくとも一つの天然に存在する形が、エステル、カルボキシアルキルエステル、塩、キレートおよび遊離酸から成る群より選択される方法である。例えば、ここにおいて、有機酸の少なくとも一つの天然に存在する形は、キナ酸、αヒドロキシルクエン酸、アスコルビン酸、フマル酸、グルタル酸、乳酸、リンゴ酸、シュウ酸、酒石酸、クエン酸、クエン酸、キナ酸、シキミ酸、ケイ皮酸、サリチル酸、カフェ酸、馬尿酸、安息香酸およびフェノール酸から成る群より選択される酸の天然に存在する形である。
【0050】
好適であるのは、本発明の方法であって、αヒドロキシル有機酸の天然に存在する形が、キナ酸およびαヒドロキシクエン酸から成る群より選択され、そして塩基が水酸化アンモニウムである方法である。
【0051】
投与用の単離された医薬組成物の製造について本明細書中に記載の方法は、特に好適であり、それは、キナ酸対アンモニウムイオンの比率が約1:1.54であるキナ酸キレートの有効量を生じる。本発明の方法は、好適であり、それは、凍結乾燥された組成物の有効量と、哺乳動物への経口投与に適する薬学的に許容しうる担体とを混合する工程を更に含む。
【0052】
Uncaria 抽出物中のキナ酸の全ての形の、例えば、現場での、一層生物活性な形への酸/塩基変換(栄養薬(Nutraceutical)組成物Quin+の製造)
例えば、Uncaria から単離された栄養薬製品を製造する場合に利用される化学理論は、pHの変更である。天然物の効力への有意の利点は、(1)抽出物中の生物活性成分が有効であるpHを最適化すること、(2)生物活性な形を有すると同時に、毒性を減少している、栄養薬中に存在する生物活性な酸または塩基を変換することによって達せられる。本明細書中で論じられるように、例えば、Uncaria 製品を用いて、本発明の態様「Quin+」、例えば、キレートを形成する水酸化アンモニウム処理を行う。アンモニアでのQAの処理時に、処理条件に依存して、アンモニウム塩かまたはアンモニウムキレートが形成される。QAがpH7〜7.5へと中和される場合、アンモニウムキレートの1:1.54モル比(キナ酸:アンモニウムイオン)が確かめられる。
【0053】
QAアンモニウムキレートの開発
Quin+製剤は、Uncaria 水抽出物中の主な活性成分としてCAEを定量したが、アルカロイドを定量していない、C−Med−100を含めた、以前の Cat's Claw 製品にまさる改善として作られた。活性成分のバイオアベイラビリティー並びに効力がC−Med−100にまさるQuin+の有意の改善は、本明細書中において、次のデータによって証明される。
【0054】
1.粗製樹皮からの抽出物の収率は、C−Med−100について認められる収率の約2倍であり、5.2%ではなく13.2%である。
2.Quin+中のCAEまたはQAEの定量的推定値は、C−Med−100の場合より5〜10倍多い。
【0055】
3.Quin+は、C−Med−100中にも存在しないQAエステル、例えば、>10,000MwのQAエステルを含有する。
4.Quin+は、QAエステルの不均一な群よりもむしろ、有意に増加した量の活性成分を含む。
【0056】
5.Quin+がいったん生じたら、その生物活性成分QA−H+を、水酸化アンモニウムでのQuin+の中和によってQA−H+をQA−NH4+へと変換する一段法により、容易に更に変換して、なお一層生物活性な状態にする
製造中に、サイズ排除の欠如ゆえに、Quin+製剤の製造に用いられる本明細書中に記載の抽出物は、C−Med−100よりも3倍多いQAエステルを示す。Quin+の製造における、例えば、エステルの一つは、QAエステルの約15%となる>10,000の分子量を示す。用いられた Seliwanoff's 試薬は、それらサイズにかかわらず炭水化物の定性的性質を決定する比色分析手順として設計された。試験されたいろいろな試料中の炭水化物の存在の分析は、存在するQAエステルの量およびサイズ双方にしたがった。要約すると、既知のQAエステル含量に関して、あらゆる Cat's Claw 水抽出物中には、いろいろなサイズの炭水化物が明らかに存在した。
【0057】
QUINPLUSTM(Quin+)(アンモニア処理された植物抽出物)
本明細書中に記載されているのは、Uncaria からの栄養薬組成物を製造する方法、例えば、組成物が、生体内利用可能なキナ酸それ自体の有意に増加した量を有する方法である。
【0058】
キナ酸の全ての形には、例えば、錯体形成したキナ酸、例えば、キナ酸エステル(例えば、炭水化物エステル、カルボキシアルキルエステル(CAE))、タンニンおよびクロロゲン酸が含まれる。
【0059】
しかしながら、本明細書中に記載の方法は、他の関連有機酸を含有する他の植物材料、例えば、garcinia にも同様に適用することができる。
本発明の好ましい態様において、水中に溶解したこれら抽出物を、約1〜10%アンモニアで更に処理して、それら抽出物中にエステル、塩またはキレート化形として存在しうるカルボキシ有機酸を変換して、抽出物を凍結乾燥することによる過剰のアンモニアの除去により、好ましい分子平衡した形のアンモニアキレートにする。ここでは、アンモニウムイオンが、植物抽出物中に存在するカルボキシ有機酸生物活性成分の栄養価も有効な作用様式も増強するということが開示される。
【0060】
基本的には、植物抽出物中、好ましくは、本明細書中に記載の水性 uncaria 抽出物中に存在する現場のキナ酸の全ての形を、活性成分として遊離(quinc)酸へと変換する(として放出する)。アンモニア処理された水性 uncaria 抽出物は、好適であり、それは、キナ酸の有効なアンモニアキレートを生じる。
【0061】
本発明の好ましい態様において、水中に溶解したこれら抽出物を、1〜10%アンモニアで更に処理して、それら抽出物中にエステル、塩またはキレート化形として存在しうるカルボキシ有機酸を変換して、抽出物を凍結乾燥することによる過剰のアンモニアの除去により、好ましい分子平衡した形のアンモニアキレートにする。
【0062】
例えば、C−MED−100の製造のための uncaria 材料の水抽出は、当該技術分野において周知である。米国特許第6,039,949号;第6,238,675号および第6,361,805号は、本明細書中に援用される。本発明は、抽出された植物材料、具体的には、当該技術分野において知られている且つ本明細書中に記載のような水抽出された uncaria 材料中のキナ酸の実質的に全ての形を、遊離キナ酸(quinice acid)またはキレート形に変換する方法に関し、特に好ましいのは、キナ酸アンモニウムキレートであり;そして増加した生物学的効力を示すが、毒性を減少させている改善された医薬組成物であって、キナ酸キレートが、実質的に存在するキナ酸の形である組成物の関連した製造に関する。水抽出後の、例えば、10kdまたは12kdを超えるサイズ排除は、本明細書中に記載の組成物の製造には不必要である。したがって、大分子量形の錯体形成したキナ酸は、従来の慣例のサイズ排除工程が行われるとしても利用可能でない遊離酸の加水分解および放出のための抽出物中で利用可能である。
【0063】
例として、水溶性植物医薬化合物の主要抽出物を製造する水抽出方法は、均一化された(粉砕または細断された)uncaria 植物材料と水とを、約1:5〜約1:50の範囲内の植物材料対水の比率で、約75℃〜約100℃の温度において、植物材料中に存在する熱水性抽出可能フィトコンパウンド(phytocompounds)の実質的な部分を可溶化する時間混合し、粒状物質を除去して、水溶性植物医薬化合物の組成物を製造する。好適であるのは、植物材料が、葉、樹皮、花、根、茎および果実から成る群より選択される方法である。好適であるのは、植物材料が、樹皮、根および茎から成る群より選択される方法である。好適であるのは、植物材料対水の比率が、約1:25〜約1:35の範囲内であり、そして温度が、約95℃〜約100℃であり、そして時間が、約1時間〜約6時間である方法である。
【0064】
αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸の塩またはキレートの有効量を含む、単離された医薬組成物の製造方法は、本明細書中に開示され且つ請求の範囲に記載されているが、それは、植物材料の水性抽出物であって、抽出物中のαヒドロキシル有機酸の全含量が、抽出物の約0.2%〜約35%w/wになる水性抽出物と、一定量の塩基とを、水溶液中において、存在するαヒドロキシル有機酸の実質的に全ての形を加水分解する一定時間混合し、その溶液を約6.9〜約7.6のpHへと中和して、αヒドロキシル有機酸の実質的に全ての天然に存在する形の遊離酸、遊離酸の塩またはキレートを生じ、そして場合により、その溶液を凍結乾燥させて、単離された医薬組成物を製造することを含む。
【0065】
好適であるのは、植物材料が、uncaria、garcinia、ツルコケモモおよびコーヒーから成る群より選択され、そして塩基が、NaOH、KOHおよびNH4OHから成る群より選択され、それを約15分間〜約4時間加えて、水溶液中の濃度を約0.5M〜約5Mの範囲内にする方法である。特に好適であるのは、植物材料が、uncaria(cat's claw)である方法、および単離された医薬組成物が、キナ酸対アンモニウムイオンの比率が約1:1.54であるキナ酸キレートの有効量を含む方法である。
【0066】
方法は、更に、凍結乾燥された組成物の有効量と、哺乳動物への経口または全身投与に適する製剤を製造するための薬学的に許容しうる担体とを混合する工程を含む。
ヒドロキシル化またはカルボキシル化有機酸を含有することが分かった、カラマツ、マツ樹皮、赤ワイン、garcinia、緑茶、ビルベリー(bilberry)、ブラックコホッシュ、トウガラシ、カミツレ、イタリア・ニンジンボク、ツルコケモモ、エキナシア(echinacea)、エリューセロ(eleuthero)、マオウ、メマツヨイグサ、ナツシロギク、アマ、ニンニク、ショウガ、イチョウ、ヤクヨウニンジン、ゴレンシール(golenseal)、サンザシ、ウマグリ、カワカワ、カンゾウ、オオアザミ、セイヨウハッカ、ノコギリパルメット、オトギリソウ(saint john's wort)、紅茶、カノコソウ、リンゴ、アンズ、マルメロ、カンキツ類、パイナップル、プルーン、ヒマワリ、ワルトルベリー、クロイチゴ、アカフサスグリ、クロスグリ、キイチゴ、ババコ、フェイジョア、キワノ、パッションフルーツ、コダチトマト、セイヨウカリンまたはカキなどの植物材料を、医学的使用に一般的な歴史的慣例であった熱水抽出をする場合、植物医薬製剤は、効力のある免疫、抗腫瘍、抗炎症およびDNA修復を促進する性質を有する前述の植物抽出物から製造される。本発明の好ましい態様において、水中に溶解したこれら抽出物を、1〜10%アンモニアで更に処理して、抽出物中にエステル、塩またはキレート化形として存在しうるカルボキシ有機酸を変換して、抽出物を凍結乾燥することによる過剰のアンモニアの除去により、好ましい分子平衡した形のアンモニアキレートにする。ここでは、アンモニウムイオン単独が、NF−κBを阻害することまたは成長停止を誘発することなどの、植物抽出物中に存在するカルボキシ有機酸生物活性成分の栄養価も有効な作用様式も増強するということが開示される。
【0067】
uncaria 水抽出物(例えば、C−MED−100)に、加水分解工程を施す。その抽出物に、例えば、約1N強塩基を、例えば、約2時間施して、遊離酸(キナ酸)を放出させる。少なくとも一つの塩基を用いる。水酸化アンモニウムが好適である。水酸化ナトリウムまたは水酸化カリウムなどの他の塩基を用いてもよい。これは、抽出物を約pH11〜12へと変換し、そしてキナ酸の全てのエステルをQA+炭水化物へと加水分解する。
【0068】
uncaria 水抽出物を、例えば、強塩基(例えば、1M NaOH)で約2時間現場処理した後、例えば、HClで約pH7〜7.5へと中和した。実質的に全てのQAエステルを、遊離キナ酸H+へと変換した後、所望の塩基(例えば、水酸化アンモニウム、NaOH、KOH等)での中和によって同様に変換して、いずれか所望の塩形またはキレートにする。QA−H+(キナ酸の遊離酸)へといったん変換されたら、抽出物中の全てのキナ酸起源(キナ酸の全ての形)「QA含量」を、好ましくは、QA−NH4+キレートへの変換により、高度の有効状態に置く。更に、NH4Clそれ自体は、強力な抗酸化剤であり、それが、順次、QA−NH4+を形成する利点を支持する。Cat's Claw(uncaria)の生物活性組成物を、本明細書中において、化学組成および薬理学的/効力双方の観点から標準化する。
【0069】
薬理学的価値例
化学文献での従来の報告は、Cat's Claw 抽出物も、キナ酸も、NF−κBを用量依存方式で阻害するということを確かめた。Aquilar, JL et al. J. Ethanopharmacology 81:: 271-276, 2002; Tak, PP et al. J Clin Invest 107: 7-11, 2001; Akesson et al. Int Immunopharmacol 3: 1889-1990, 2003; Akesson et al. Int Immunopharmacology 5: 219-22, 2005。これらデータは、キナ酸のような、ある種の天然に存在する有機酸、更には、他の天然に存在する単純なαヒドロキシ酸は、アンモニアで塩およびキレートへと変換することができ、それが順次、NF−κBを阻害することにおいてきわめて有効であるという概念を包含していない。アンモニウムイオンは、リソソームの酸化的ストレス発生の有効な阻害剤であることが分かったが、それ自体、NF−κBの阻害に相乗的である。Ogawa, Y et al. Int J Mol Med 14(6): 1007-1013, 2004。したがって、アンモニウムキレートおよび塩は、アンモニウムイオンが、キナ酸または他のαヒドロキシル酸とは無関係に、キナ酸などの有機酸の塩またはキレート化製剤によってNF−κB阻害を細胞に送達することが可能なことから、一層有効なNF−κB阻害剤である。本発明のこの理論を開示しているデータを、図4に示す。
【0070】
別の態様において、本発明は、医薬組成物であって、植物抽出物中で有機酸として最初に識別された生物活性なヒドロキシル化およびカルボキシル化有機酸キレートの薬学的有効量と、無毒性の不活性担体または希釈剤を含む医薬組成物を含む。本発明は、更に、その医薬組成物を用いることを含む態様であって、(i)哺乳動物の免疫能力を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発することによって増強するために、医薬組成物を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発する有効量で投与することを含む;(ii)哺乳動物の免疫系に関連した障害を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発することによって処置するために、医薬組成物を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発する有効量で投与することを含む;(iii)哺乳動物の炎症反応を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発することによって阻害するために、医薬組成物を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発する有効量で投与することを含む;(iv)哺乳動物の炎症反応に関連した障害を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発する、または化学療法で誘発された白血球減少症後に in vivo で白血球(WBC)を増加させることによって処置するために、医薬組成物を、TNF−α生産を阻害するまたは白血球のアポトーシスを誘発する有効量で投与することを含む;(v)哺乳動物の抗腫瘍反応を、腫瘍細胞のアポトーシスを誘発することによって促進するために、医薬組成物を、腫瘍細胞のアポトーシスを誘発する有効量で投与することを含む;(vi)哺乳動物の腫瘍形成および成長への応答に関連した障害を、腫瘍細胞のアポトーシスを誘発することによって処置するために、医薬組成物を、腫瘍細胞のアポトーシスを誘発する有効量で投与することを含む;および(vii)哺乳動物のDNA修復過程を促進するための、したがって、加齢性障害を処置するのに重要な抗変異原活性を与えるための態様を包含する。
【0071】
QAかまたはNH4+イオンによるNF−κBの独立阻害。ヒトジャーカットT細胞を、QAか、QA−NH4+かまたはNH4Clと一緒にインキュベートし、そしてNF−κB阻害の程度を、他のところに記載のように評価した。図4を参照されたい。Parra E, et al., 1997. Mol Cell Biol 17:1324-23; Akesson, C., et al., Int. Immunopharmacol., 5(1):219(2005)。
【0072】
本発明の方法によって製造された製品は、本明細書中に開示され且つ請求の範囲に記載された重要な発明の内容である。
QUINMAXTM
キナ酸のアンモニウムキレートは、実際に、キナ酸をpH=7.5へと変換する飽和量の1〜10%アンモニアでの処理によって形成された場合に1:1.54モルのアンモニアキレートとして実験的に決定される、好ましいキナ酸組成物である。
【0073】
その発見は、C−Med−100と称される、Uncaria tomentosa である Cat's Claw 樹皮の熱水抽出物の生物学的活性を説明する試みで始まった。この抽出物は、DNA修復を刺激するのに有効であることが示された。この初期の生物学的特性決定後、出願人は、DNA修復促進の裏にある天然物を、可能性のある抗加齢療法として認識することを示した。一連の化学研究は、科学者らに、カルボキシアルキルエステル(CAE)を生物活性物質として最初に識別させたが、その後、引き続き、キナ酸エステル(QAE)を、cat's claw 水抽出物中の唯一の生物活性CAEとして識別することが行われた。Cat's Claw QAEは、in vitro および in vivo 双方で生物活性であった。しかしながら、酸または塩基加水分解されてキナ酸になった場合、そして存在するQAEのアルコール部分を有することなく、キナ酸それ自体は、QAEの場合と同程度に、DNA修復促進活性を有した。したがって、結論として、キナ酸は、Cat's Claw の最終の生物活性な形であった。しかしながら、キナ酸は、Cat's Claw の水抽出物中にQAEとして存在している。QAEは、胃腸管内でキナ酸へと加水分解されると考えられることから、実際には、QAEは前代謝産物形である。
【0074】
年代順の発見を下に示す。
1.1967年− 認められた Cat's Claw の活性成分は、Dr Klaus Keplinger によって最初に提示されたオキシインドールアルカロイドであった。Keplinger, K, et al., 1999. Uncaria tomentosa (Wild) DC.-ethno medicinal use and new pharmacological, toxicological and botanical results. J Ethanopharmacology 64: 23-34。
【0075】
2.2000〜2000年− C−Med−100などの Cat's Claw 抽出物は、本質的には、アルカロイドを欠いていたが、それでもなお、きわめて有効であったので、主要活性成分としてのアルカロイドを無視していた。Sheng, Y, Pero, RW, Wagner, H. 2000. Treatment of chemotherapy induced leucopenia in the rat model with aqueous extract from Uncaria tomentosa. Phytomedicine 7:137-143; Sandoval, M, et al., 2002. Antiinflammatory and antioxidant activities of Cat's Claw (Uncaria tomentosa and Uncaria guianensis) are independent of their alkaloid content. Phytomedicine 9: 325-337。
【0076】
3.1998〜2003年− Cat's Claw の水抽出物は、潰瘍性大腸炎(炎症性反応)、変形性関節症/関節痛、腫瘍細胞成長、体重増加、オゾン傷害、DNA損傷/細胞死、化学療法に誘発される白血球減少症および痴呆/アルツハイマーを妨げたまたは制御した。Sandoval-Chacon, M, et al., 1998, Anti-inflammatory actions of cat's claw: the role of NF-kappa B. Alimentary Pharmacological Therapy 12: 1279-1289; Piscoya, J, et al., 2001. Efficacy and safety of freeze dried cat's claw in osteoarthritis of the knee: mechanisms of action of the species Uncaria guianensis. Inflammation Res 50: 442-448; Sheng, Y., Pero, R.W., et al., 1998. Induction of apoptosis and inhibition of proliferation and clonogenic growth of human leukemic cell lines treated with aqueous extracts of Uncaria Tomentosa, Anticancer Research 18:3363-3368; Pero, RW, et al., Formulation and clinical evaluation of combining DNA repair and immune enhancing nutritional supplements. Phytomedicine 12(4): 255, 2005; Sheng, Y., Pero, R.W., et al., 2000, Treatment of chemotherapy-induced leukopenia in the rat model with aqueous extract from Uncaria Tomentosa. Phytomedicine 7(2): 137-143; Cisneros, FJ, et al., 2005, An Uncaria tomentosa (Cat's Claw) extract protects mice against ozone-induced lung inflammation. Journal of Ethanopharmacology 96:355-364; Castillo and Snow, 2002年2月発行の米国特許第6,346,280号)同時に、DNA修復および免疫細胞機能は増強された(Lamm, S., Sheng, Y., Pero, R.W. 2001. Persistent response to pneumococcal vaccine in individuals supplemented with a novel water soluble extract of Uncaria tomentosa, C-Med-100. Phytomedicine 8(4): 267-274; Sheng, Y., Bryngelsson, C., Pero, R.W. 2000. Enhanced DNA repair, immune function and reduced toxicity of C-MED-100TM, a novel aqueous extract from uncaria tomentosa. Journal of Ethnopharmacology 69:115-126; Sheng, Y., Li, L., Holmgren, K., Pero, R.W. 2001. DNA repair enhancement of aqueous extracts of Uncaria Tomentosa in a human volunteer study. Phytomedicine 8(4): 275-282; Akesson, C, Lindgren, H, Pero, RW, Leanderson, T, Ivars, F. 2003. An extract of Uncaria tomentosa inhibiting cell division and NF-kappa B activity without inducing cell death. Int Immunopharmacol 3: 1889-1990)。
【0077】
4.2000〜2002年− 天然化合物の一般的化学クラスとしてのCAE(カルボキシアルキルエステル)は、Cat's Claw 効力に関与していることが分かった。Sheng, Y, Pero RW, et al., 2000. Treatment of chemotherapy-induced leukopenia in the rat model with aqueous extract from Uncaria Tomentosa. Phytomedicine 7(2): 137-143。
【0078】
5.2005年− キナ酸エステルは、Cat's Claw の効力に関与しているCAEの主要タイプであることが分かった。Sheng, Y, et al., RW. 2005. An active ingredient of Cat's Claw water extracts. Identification and efficacy of quinic acid. Journal of Ethanopharmacology 96(3): 577-584。
【0079】
6.2005年− キナ酸は、主に、植物における芳香族(すなわち、共役二重結合環系)化合物生産への不可欠な生合成中間体であるという理由で、食物および天然サプリメント中に、エステル、塩または遊離酸として遍在している(Herrmann, K.M., Weaver, L.M. 1999. The shikimate pathway. Annual Review of Plant Physiology and Plant Molecular Biology 50:476-503)。したがって、エステルを分解すると考えられる胃内の強いpH=1ゆえに、およびヒトにおいて、順次、エステルをキナ酸へと代謝するとも考えられる高レベルの非特異的エステラーゼの存在ゆえに、天然に存在するキナ酸エステルは、おそらくは、生体内代謝によってキナ酸の最終的な生物活性形へと変換されるプロドラッグであったということであった。
【0080】
キナ酸は、温血動物によって生産されることはあり得ない。それは、体内では合成されないが、飲食物中に少量で存在するので、重篤な疾患から個体のDNA健康状態を保護することができる。
【0081】
超精製有効天然物
特に好適であるのは、キナ酸キレートの有効量を含む、単離された医薬組成物の製造方法であって、実質的に純粋なキナ酸と、水酸化アンモニウムとを、約6.9〜約7.6のpHに達する十分な水溶液中で混合して、キナ酸対アンモニウムイオンの比率が約1:1.54であるキナ酸のアンモニウムキレートを生じることを含む方法である。好適であるのは、約1%〜約10%の濃度の水酸化アンモニウム溶液を、100mlにつき約5g〜約30gのキナ酸を含むキナ酸水溶液に、その溶液のpHが約7.4〜約7.6に達する十分な量で、約15分間〜約4時間の一定時間内に加える方法である。
【0082】
QUINMAXTMは、基本的には、生理的pHにおいて約1:1.6(実際は、1:1.54)のモル比の実質的に純粋なアンモニウムキレートを形成するようにアンモニア処理された実質的に純粋なキナ酸である。本明細書中に開示され且つ請求の範囲に記載されているのは、キナ酸の有効なアンモニウムキレートの単離され且つ精製された組成物の製造方法である。本明細書中に記載の組成物は、例えば、実質的に純粋なD−キナ酸を、約pH7〜約pH7.5の範囲内の水酸化アンモニウムを用いた水性基剤中において、約1:1.6のモル比のアンモニウムキレートへと変換することによって製造される。約7.5のpHが好適である。しかしながら、本明細書中に記載のキナ酸アンモニウムキレートは、例えば、pH6.9、7、7.1、7.2、7.3、7.4、7.5および7.6で、および中間の全てのpH値で生じることができる。本明細書中に開示されているのは、キナ酸のアンモニウムキレートの有意の且つ有効な量を含む、単離された医薬または栄養薬組成物である。QuinmaxTMは、キナ酸の1(QA):1.6(NH4+)のモル比のアンモニウムキレートである。
【0083】
DNA修復を促進すること、DNA損傷を阻害することおよび細胞死を妨げることにおいて、C−Med−100などの Cat's Claw 水抽出物と同程度に有効である、キナ酸の1:1.54のモル比のアンモニウムキレートである QuinmaxTM。
【0084】
QuinmaxTMは、水性アンモニアでpH=7.5へと中和された実質的に純粋なキナ酸である。結果として、水中では、アンモニウムイオンも生じるが、それら自体、効力のある生物学的機能を有する。アンモニウムイオンは、例えば、GI管内のタンパク質合成を刺激し、リソソーム小胞を中和し、それによって酸化的ストレスDNA損傷を妨げ、そしてNF−κBに媒介される炎症性反応を阻害する。これらは、追加の毒性が全くない QuinmaxTMの追加の生物学的性質の例である。キナ酸は、Ames Assay において突然変異誘発性によって評価した場合、例えば、2700μg/mlでは全く毒性を示さなかった。Jacobsen, LB, Richardson, CL, Floss, HG. 1978. Shikimic acid and quinic acid are not mutagenic in the Ames assay. Lloydia 41(5): 450-452。安全性は、表2に示されている。ここでは、最も重要な考察は、最高用量のキナ酸暴露を、いろいろな動物モデルで効力を有することが分かったものと比較することである。いろいろな動物モデルシステムにおいて、キナ酸の既知の有効用量をはるかに超えるキナ酸用量が用いられてきたということは、全く明らかである。したがって、キナ酸での in vivo 処置についての安全性の余地は、ヒトにおいて有効であると考えられる用量について首尾一貫して示された。
【0085】
過剰のアンモニアは、凍結乾燥することによって除去した。C−Med−100と、C−Med−100アンモニアキレートとの比較は、図5に、IC値として示されている。
キナ酸の既知の毒性または安全性を、表2に示す。ここでは、最も重要な考察は、最高用量のキナ酸暴露を、いろいろな動物モデルで効力を有することが分かったものと比較することである。いろいろな動物モデルシステムにおいて、キナ酸の既知の有効用量をはるかに超えるキナ酸用量が用いられてきたということは、全く明らかである。したがって、キナ酸での in vivo 処置についての安全性の余地は、ヒトにおいて有効であると考えられる用量について首尾一貫して示された。更に、QuinmaxTMは、水性アンモニアでpH=7.5へと中和されたキナ酸である。結果として、水中では、アンモニウムイオンも生じるが、それら自体、効力のある生物学的機能を有し、例えば、GI管内のタンパク質合成を刺激し、リソソーム小胞を中和して酸化的ストレスDNA損傷を妨げ、そしてそれ自体、NF−κBに媒介される抗炎症反応を阻害する。Fuller, MF, Reeds, PJ. 1998. Nitrogen cycling in the gut. Ann Rev Nutr 18:385-411; Seglen, PO. 1983 (59) Inhibitors of lysosomal function. Methods of Enzymology 96: 737-764。これらは、Quinmax に加えられた追加の生物学的性質であったが、追加の毒性は全くなかった。
【0086】
【表2】

【0087】
University of Lund においてヒト志願者に、高用量QAの追加経口投与を、6gmの QuinmaxTMの摂取後に行った。この研究の目的は、QAを、1:1.6のモル比のQA対アンモニアイオンである QuinmaxTMとしてのアンモニアキレート形で投与した場合に、QAの馬尿酸への有意の代謝が起こったかどうか確かめることであった。
【0088】
見たところ健康な65歳の志願者に、300mlの水中に溶解した6gmの QuinmaxTMを15分間にわたって飲ませた後、約40mlの末梢血(4本のレッドトップバキュテーナー(4-red topped vacutainers))を、室温で凝固させて、遠心分離によって血清試料を調製した。血清試料採取時点は、0.7時間、1.7時間、2.7時間、3.7時間、10.5時間、12.5時間、22時間、28時間および44時間であった。30mlの血清試料を、50%エタノールで沈殿させ、空気流下で乾固させ、そしてキナ酸および馬尿酸の同時HPLC分析のために、1mlのメタノール中に再溶解させた。
【0089】
データは、図6に示されている。
この実験の目的は、三つの部分からなった。第一は、QAのピーク血清濃度に達した時点と、どの程度長くそれらが検出可能な状態のままであると考えられるかを決定すること。第二は、有意の量のQAが、馬尿酸へと変換されたかどうかを明らかにすることであった。第三は、QuinmaxTM、QAのアンモニウムキレート、およびより有効なQA変形を、初期の実験において認められたQAの薬物動態を変化させることなく、in vivo で用いうるかどうか。
【0090】
図6に報告されているデータは、ピーク血清濃度が、初期のデータと適度に一致した約10.5時間に達し;馬尿酸は、QAピーク血清レベルと同時的である3.7〜12.5時間に測定されうる;そして QuinmaxTMの薬物動態は、QAと同様であったということを確かめている。
【0091】
QAが、馬尿酸の代謝源として役立ちうるということを示すもう一つの重要な理由を、図7に示す。
QuinmaxTMは、例えば、2mg/mlの濃度の飲料水中で500mlx2の経口用量として補給することができる。キナ酸は、ヒトの場合、6000mg/日まで投与されていたので、補給された水は、キナ酸アンモニウムキレートとして与えられる、安全で、無味・無色である。
【0092】
QuinmaxTMは、天然DNA保護体として設計される。キナ酸は、ビタミンDNAである。それは、経口補給後に、DNA構造自体の損傷を除去する天然酵素過程を促進することによって、その健康上の利点を媒介する。科学者らは、動物の長命が、DNA修復を行うその能力によって予測されるということを繰り返し示すことが可能であった。例えば、齧歯類動物は、容易に90歳まで生存しうるヒトと比較して、僅か数年しか生きられないが、ヒトは、齧歯類動物の場合の16倍のDNA修復能力を有する。更に、一般的な哺乳動物長命と、DNA修復能力との間には、線形関係がある。本発明者が、現在、DNAを損傷から保護することによって少なくとも部分的にそれを認めているように、明らかに、哺乳動物は生命を進化させてきた。
【0093】
キナ酸、QuinmaxTMおよびC−Med−100は全て、おそらくは、DNA損傷を除去することによってまたはそれ以外には妨げることによって、DNA損傷薬DXRへの暴露後の細胞死を妨げることが分かった(図1)。ラット白血球(WBC)またはマウス脾臓WBCは、in vivo において、強制飼養かまたは飲料水中でのキナ酸経口投与後に、それぞれ、7.2〜>8.2x106個/mlかまたは6.2〜8.3x109個/mlに増加した。これらデータは、それら細胞を損傷した状態にし且つ死滅させることからのDNAの保護において13〜25%の増加を算定している。論理的に妥当である寿命を推測するならば、90歳の平均年齢までの生存は、その生存期間中に最適量のキナ酸を摂取することにより、112歳へと増加すると考えられる。
【0094】
免疫機能促進。C−Med−100に誘発される免疫担当細胞成長応答は、キナ酸によって模擬されるので、キナ酸も、成長刺激物質への抗原応答を抑制することなく、多数の完全機能性白血球を増加させることによって免疫機能を誘発したということが認められた。
【0095】
C−Med−100などの Cat's Claw 水抽出物は、マウス肺のオゾン傷害を妨げ、アルツハイマーモデルにおけるアミロイド体の溶解を誘発した(Castillo and Snow,2002年2月発行の米国特許第6,346,280号)。キナ酸もC−Med−100も、効力のあるNF−κB阻害剤であるので、それらは、強力な抗酸化剤でもあるが、それは、それらが順次、前炎症性サイトカイン阻害によって酸素ラジカルの生産を止めるからである。Sandoval-Chacon, M, et al., 1988. Anti-inflammatory actions of cat's claw: the role of NF-kzppa B. Alimentary Pharmacological Therapy 12:1279-1289。したがって、いずれかその天然に存在する遊離酸、エステル、塩またはキレートの形のキナ酸は、効力のある抗炎症薬であると考えられる。
【0096】
抗腫瘍活性。既に指摘されたように、天然において遭遇するキナ酸の最も一般的な形はエステルとして存在するが、エステルは、胃およびGI管内でキナ酸へと加水分解されると考えられる。キナ酸も、キナ酸エステルも、腫瘍細胞成長の増殖および浸潤双方を阻害することによって、腫瘍成長を制御することに有効であることが分かった。Yagasaki, K, et al., 2000. Inhibitory effects of chlorogenic acid and its related compouinds on the invasion of hepatoma cells in culture. Cytotechnology 33(1-3): 229-235; Hata, G, et al., 1992. Synthesis, structure and antitumor activity of a water-soluble platinum complex, 1R,3R,4R,5R-quinato(1R,2R-cyclohexanediamine)platinum (II). Chem Pharm Bull (Tokyo) 40(6): 1604-1605。
【0097】
更に、そのデータは、栄養食品中に一般的に見出されるキナ酸の一般的な健康上の利点を強く支持する。例えば、食物の平均乾燥重量消費が、約500mg/日であった場合、および消費された全食物材料が、20%のキナ酸含量を有した場合、天然食物源から約100mgのキナ酸を摂取しうると考えられる。約1400mgの1日ヒト用量が、ほぼ最適であると考えられるということを考慮すると、ヒト集団は、QuinmaxTMを飲食物に補給することによって大いに利益を得ると考えられることになる。
【0098】
本明細書中で論じられる凍結乾燥された医薬組成物が、本明細書中で論じられる生物学的作用を与えるのに好ましい投薬量は、約0.5〜約5mg/kg(ヒト体重)である。好ましくは、約1mg/kg〜約3mg/kg(体重)。本明細書中に記載の医薬組成物は、好ましくは、水基飲料中、例えば、水中に約0.5mg/ml〜約5mg/mlで製剤化することができる。好ましくは、約1mg/ml〜約3mg/ml。
【0099】
機能性食品
本明細書中に開示されているのは、毒性を減少させ且つ健康上の作用を増加させるために、食物中の天然に存在するQAEを遊離キナ酸へと加水分解する方法である。
【0100】
加水分解性タンニン(タラガロタンニン(taragallotannins)およびカフェタンニン(caffetannins))およびクロロゲン類似体などのフェノール樹脂は、毒性とみなされるのみならず、それらは、カフェ酸またはグルコースとのエステル結合中に高濃度のキナ酸を含有する(例えば、クロロゲン酸の約50%は、キナ酸である)。ある種の食物の、例えば、1M NaOHまたは1M HClでの強塩基または酸加水分解は、その食物中の遊離キナ酸を生じる。
【0101】
本発明の方法は、αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸、塩またはキレートの有効量を含む機能性食品の製造方法であって、食物であって、その食物中に約0.2%〜約35%w/wの一定量のαヒドロキシル有機酸を含む食物と、塩基とを、水溶液中において、食物中のαヒドロキシル有機酸の実質的に全ての形を加水分解する一定時間混合し;その溶液を約6.9〜約7.6のpHへと中和して、食物中のαヒドロキシル有機酸の実質的に全ての天然に存在する形の遊離酸、遊離酸の塩またはキレートを生じ;そして場合により、その溶液を凍結乾燥させて、単離された医薬組成物を製造することを含む方法について開示する。
【0102】
好適であるのは、例えば、食物が、リンゴ、アンズ、ガルシニア、ツルコケモモ、マルメロ、カンキツ類、パイナップル、プルーン、ヒマワリ、ワルトルベリー、クロイチゴ、アカフサスグリ、クロスグリ、キイチゴ、ババコ、フェイジョア、キワノ、パッションフルーツ、コダチトマト、セイヨウカリン、カキおよびコーヒーから成る群より選択され、そして塩基が、NaOH、KOHおよびNH4OHから成る群より選択される方法である。
【0103】
食物中のQAの有効レベルを識別する利点、およびQAアンモニウムキレートを含有する新規な食品添加物およびサプリメント
機能性食品は、伝統的医薬慣例によって定義のような、栄養素を超える健康上の利点を与えることができるいずれかの改変食品または成分を含めた、可能性のある健康によい成分を包含するものである。食物の治癒効果は、機能性食品について一般的に知られている概念である。ここでおよび文献中で指摘されるように、キナ酸エステルは、主に、タンニン、またはフェノールを含有するまたは炭水化物に連結したクロロゲン酸類似体とのエステル結合において天然に存在している主なキナ酸源である。キナ酸の多数の異なった形は、多くの食物の天然成分である。「放出された」QAそれ自体が、植物に由来する食用物質中に十分な高濃度で存在していた場合、それは、機能性食品である性質を示唆していると考えられる。多くの食物は、それらの成分中に、例えば、QAEもキナ酸も有する。ここに示されているデータは、植物または食物のキナ酸含量が、0.5%w/wを超える場合、該当する食物は、基本的に、ヒト消費時に、DNA修復および免疫反応性を促進することによって抗加齢栄養薬として機能するということを示している。この最少濃度またはそれを超える濃度を有する植物源は、これら自然の生体防御過程を刺激することによる健康上の利点を増加させるのに有効な処置であると考えられる。1日に1杯につき0.5%を超えるキナ酸食品含量は、1杯200gmについて1日に1gmのキナ酸の1日ヒト用量に等しいと考えられる(すなわち、200mg/kg/日の有効齧歯類用量から計算される)。
【0104】
【表3】

【0105】
食物の健康上利点
食物中には、二つの主な天然キナ酸源が存在する。(i)正に論じられているエステル形で貯蔵されている有意の量のキナ酸を有する食物、および(ii)記載のように既に天然に存在している有効レベルの遊離キナ酸を有する食物。双方の食物源は、大部分の植物中に同時に存在し、互いに相加的である。例えば、1杯のコーヒーは、約13gmの固形分を含有するが、その内の約765mgは、クロロゲン酸類似体であり、そしてその約50%(388mg)、または0.338gm/13gm=コーヒーの2.6%は、キナ酸である。コーヒーは、更に、4.7〜5.9%の遊離(非エステル化)キナ酸を含有する。したがって、食物源を加水分解することにより、または遊離キナ酸を有していないが、高濃度のタンニンまたはクロロゲン酸または双方を有する食物源を加水分解することにより、それら食物は、キナ酸に媒介される応答に帰する有効な健康上の利点を有する機能性食品へと変換されうる。QAエステル加水分解によって食物中の遊離キナ酸を増加させて、胃腸管内で有効用量に達する、機能性食品としてかまたは食品添加物として直接的に適格となると考えられる食物源の例。食物のキナ酸含量が、胃腸管中に吸収される量の0.5%を超えて上昇すると、血中のキナ酸は十分に増加するので、DNA修復および免疫の促進が起こる。この方式で考えると、キナ酸含有機能性食品は、プルーン、キーウィ、シーバックソーン(sea buckthorn)、コーヒー、ツルコケモモ、コケモモ(lingonberry)、ブルーベリー、ワルトルベリー、赤/黄色コダチトマトおよびスルタナのような、>0.5%のキナ酸を有するものである。<0.5%のキナ酸含量を有するものは、キナ酸含量が>0.05%に上昇しうると考えられるので、食品添加物に変換された状態になる良好な候補である。このカテゴリーの食品添加物源の例は、マルメロ、ヒマワリ、ネクタリン、モモ、ナシ、スモモ、ハチミツ、クロスグリ、セイヨウカリン、アスパラガス、マッシュルームおよびグリーンオリーブであった。
【実施例】
【0106】
実施例I
本発明者は、以前に、キナ酸およびアンモニア処理されたキナ酸、そしてその天然の cat's claw 源(例えば、C−Med−100)に関して、細胞死を伴うことなく成長停止を誘発することができるし、そして炎症、免疫およびDNA修復阻害、癌成長および加齢の処置におけるそれらの使用に寄与する機構としてのNF−κBを阻害することができるということを開示した(Sheng, Y, Akesson, C, Holmgren, K, Brynegelsson, C., Giampapa, V, Pero, RW. An active ingredient of Car's Claw water extracts. Identification and efficacy of quinic acid. Journal of Ethanopharmacology 92: 577-584, 2005; Akesson, C, Lindgren, H, Pero, RW, Leanderson, T, Ivars, F. Quinic acid is a biologically active component of the Uncaria tomentosa extract C-Med-100(registered trademark). International Immunopharmacology 5:219-229, 2005)。C−Med−100のような、cat's claw の水抽出物の活性成分は、キナ酸の類似体である。C−Med−100中のキナ酸の天然の形は、キナ酸エステルである。しかしながら、1〜10%アンモニアで処理されて加水分解されたキナ酸エステル、または遊離酸(+)としてのキナ酸それ自体は、キナ酸アンモニア塩またはキレートを生じるが(以前には、考えられても記載されてもいない)、それらは双方とも、本明細書中において in vivo で有効と記載され且つ特性決定されている。本発明のキナ酸エステルおよび/またはキナ酸塩の態様は、更に、陽イオンとのキレート化錯体である。しかしながら、これまでのところ、最終のキナ酸生物活性構造は、依然として未決定であった。ここで、本発明者は、キナ酸が、塩およびキレート化構造錯体双方で存在しうるし、そしてアンモニア処理されたキナ酸は、キナ酸をpH=7.5に変換する飽和量の1%アンモニアでの処理によって形成された場合、実際に、1:1.54モルのアンモニアキレートとして実験的に決定されるキナ酸の好適な組成物であるというデータを与えている(表4)。更に、Garcinia 抽出物中に存在するαヒドロキシルクエン酸(すなわち、Citrimix)などの他の天然に存在する塩も、1%アンモニアで中和された場合、キレート化錯体で存在するということが示されている。結論として、これらデータは、(i)簡単なヒドロキシル化およびカルボキシル化有機酸のキレート化錯体は、しばしば、全てではないがいろいろな陽イオンとキレートを形成し、例えば、キナ酸のNaOH処理は、1:1モル塩を生じる、そして(ii)有機酸のアンモニウムキレートは、その増強された栄養価および有効な値ゆえに、好適な組成物であるということを開示している。
【0107】
【表4】

【0108】
下の図1〜2に示されるデータは、有機酸のアンモニアキレートの、他の陽イオンキレートまたは塩と比較した利点を示す。
キナ酸塩およびキレートに関する研究について(図1)、キナ酸は、Sigma より購入した(>99%)。QA塩/キレートは、適当な塩基、すなわち、NH4OH、NaOH、Ca(OH)2、Zn(OH)2、LiOH、KOH、リシンまたはヒスチジンでのpH=7.5への中和によって合成した。試験化合物の連続希釈を、96ウェル平底微量滴定プレート中のヒトHL−60白血病細胞(0.05x106個/ml)に加えて、3000μg/mlまでの培養物中の最終濃度を与えた。それらプレートを、37Cで72時間インキュベートし、20μlのMTT(5mg/ml)で3時間パルス処理し、そして前記のように、分光測光によって540nmで発色を推定した。(Schweitzer, CM et al. Spectrophotometric determination of clonogenic capacity of leukemic cells in semisolid microtiter culture systems. Experimental Hematology 21: 573-578, 1993)。IC50値は、細胞の生/死比率に基づいて計算し且つ比較した。これらデータは、試験された全ての塩およびキレートが、HL−60腫瘍細胞成長を阻害することにおいて、遊離キナ酸(H+)より有効であったということを示している。QA−NH4+およびQA−Ca++などの既知のキレートは、QA−Na+などの既知の塩より有効であった。最後に、QA−NH4+キレートは、いずれか他の塩またはキレートよりもはるかに生物学的に有効であったし、そして実際に、生物活性成分としてキナ酸エステルを有する cat's claw 水抽出物(C−Med−100)と同程度に有効であった。これらデータは、それらの効力を増加させるために、アンモニアでキレート化される塩形であれ、エステルであれ、天然に存在する有機酸類似体のキレートを標的にしている。
【0109】
カルシウム/カリウムαヒドロキシクエン酸キレートとしての Citrimix の、ヒドロキシクエン酸のアンモニアキレート(Nu−Citrimix)と比較した研究について、マイトジェン(ConA,2ug/ml)の存在下における48時間の微量滴定細胞培養での in vitro 暴露後の一次脾臓細胞の阻害成長は、用いられたバイオアッセイ手順であった(Akesson C., Lindgren H., Pero R.W., Leanderson T., Ivars F., "An extract of Uncaria Tomentosa inhibiting cell division and NF-κB activity without inducing cell death," International Immunopharm 3:1889-1900, 2003)。Citrimix のIC25値およびIC50値は、アンモニアキレート(Nu−Citrimix)と全く同様であったが、Citrimix キレートとNu−Citrimix(アンモニウムキレート)との、それぞれ、3mg/mlおよび1mg/mlであるIC90値の間には、大きな減少があった。これらデータは、Nu−Citrimix(アンモニウムキレート)が、Citrimix、ヒドロキシルクエン酸のカルシウム/カリウムキレートと比較して、一次脾臓細胞の細胞死を伴わない成長停止として推定される改善された効力プロフィールを有したということを示していると解釈された。再度、これらデータは、天然に存在するヒドロキシル化およびカルボキシル化有機酸の有効な応答を媒介するのに好ましい組成物が、アンモニアキレートであるということを示している。
【0110】
実施例II
実施例2は、天然に存在するポリヒドロキシル化およびポリカルボキシル化有機酸のアンモニウムキレートが、温血動物の健康障害を処置するための栄養薬または医薬製品の開発に好適な構造類似体である理由を開示している。それら理由は、理論的には二つの部分からなる。(i)アンモニウムイオンは、その栄養的必要条件にしたがって生体による吸収を順次もたらす、腸内の窒素再循環〜アミノ酸およびタンパク質生合成を平衡させ且つ最大限にすることに、主に由来する主要な天然に存在する代謝産物である(Fuller and Reeds, Annu Rev Nutr 18: 385-411, 1998)。それ自体で、アンモニウムイオンは、引き続き、アミノ酸およびタンパク質の栄養代謝の一般的な支持に重要な前駆体であり、そして(ii)アンモニウムイオンは、リソソーム内部の酸性度を中和し、それによって酸化的ストレスラジカル生産を妨げることによってリソソーム機能を阻害することが周知であり、そしてそれによって、アンモニウムイオンは、免疫反応性を含めた細胞調節過程に影響を及ぼす重要な抗酸化剤である(Seglan, Methods in Enzymology 96: 737-764, 1983)。
【0111】
図3〜4に示されているデータは、天然起源のヒドロキシル化およびカルボキシル化有機酸の有効な健康上の利点を媒介するのに好適な構造としてのアンモニウムキレートの使用を直接的に支持する。
【0112】
図3に開示されているのは、キナ酸NH4+キレートが、キナ酸(H+)と比較して劇的に低下しているIC25値、IC50値およびIC90値を有することによって、in vitro で培養された脾臓細胞の成長を阻害するキナ酸(H+)の能力を大きく改善したことである。更に、そのデータは、等モルのNH4Clそれだけで、キナ酸アンモニウムキレートに匹敵するIC25値、IC50値およびIC90値を有したので、キナ酸NH4+キレート中のアンモニウムイオンの存在は、同様に生物学的に有効であったということを示している。
【0113】
更に、本発明者は、NF−κB阻害も、キナ酸NH4+キレート中に配合されたアンモニウムイオンによって促進されるかどうかも調べた(図4)。同様に、そのデータは、キナ酸NH4+キレートが、キナ酸(H+)を上回ってNF−κB阻害を促進したという事実と一致し、そして再度、NH4Cl中のアンモニウムイオン単独で、この有効な反応を誘発するキナ酸NH4+キレートと同程度有効であった。
【0114】
結論として、キナ酸NH4+キレートは、細胞死を伴わない成長停止およびNF−κB阻害として評価される優れた in vitro の有効な反応を有することが分かったが、それらは、順次、C−Med−100、キナ酸(H+)、およびアンモニア処理されたキナ酸(本明細書中において、キナ酸NH4+キレートとして構造的に解明されている)の in vivo 評価によって既に示されている、免疫、DNA修復、抗炎症性および抗腫瘍性を促進するのに役立つ分子機構である(Sheng, Y, Akesson, C, Holmgren, K, Brynegelsson, C., Giampapa, V, Pero, RW. An active ingredient of Car's Claw water extracts. Identification and efficacy of quinic acid. Journal of Ethanopharmacology 92: 577-584, 2005; Akesson, C, Lindgren, H, Pero, RW, Leanderson, T, Ivars, F. Quinic acid is a biologically active component of the Uncaria tomentosa extract C-Med-100(registered trademark). International Immunopharmacology 5:219-229, 2005)。
【0115】
実施例III
本明細書中に科学的に論じられているように、C−Med−100は、cat's claw の有効な水抽出物であり、そしてそれは、エステルなどのキナ酸類似体を含有することが知られている。キナ酸も、ヒドロキシクエン酸も、それらのアンモニア処理されたキレート形で一層生物学的に有効であったので(表3、図1〜4を参照されたい)、具体的には、キナ酸類似体、そして一般的には、植物抽出物中の他の天然に存在するヒドロキシル化およびカルボキシル化有機酸を、それらのキレート化形へと、具体的には、cat's claw の水抽出物、そして一般的には他の植物抽出物の、分子飽和レベルのアンモニアでの直接処理によって製剤化することへの製造利点が存在しうるということが推論された。この目的のために、および例として、C−Med−100を、最初に、90%メタノールでの沈殿によって、噴霧乾燥剤マルトデキストリンから水分涸渇させ(depleted)、そして次に、1%アンモニアで1時間処理後、凍結乾燥を施して、C−Med−100アンモニアキレートを直接的に形成した。過剰のアンモニアは、凍結乾燥することによって除去した。C−Med−100とC−Med−100アンモニアキレートとの比較は、図5に、IC値として示されている。そのデータは、Nu−CC100(すなわち、100%の水への溶解度、したがって、バイオアベイラビリティーを有する、アンモニア処理されたまたは栄養素化(nutrated)された cat's claw)についてのIC50値およびIC90値が、マウス脾臓細胞の成長を阻害することにおいて、普通のC−Med−100よりも有効であったという点で、C−Med−100をアンモニア処理することへの有効な利点を明らかに示している。これらデータは、未知の構造を有するキナ酸類似体のような、ヒドロキシル化およびカルボキシル化有機酸類似体を含有することが知られている粗製植物抽出物を、直接的にアンモニアキレート化形にし、それによって、それらの生物学的有効性を増強しうるという概念の証拠とされた。
【0116】
要約すると、カルボキシアルキル酸類似体構造を含有する粗製植物抽出物または生物活性物質のアンモニア処理は、アンモニア処理によって一層有効な製剤へと変換することができる。
【0117】
実施例IV
Quin+ Cat's Claw 水抽出物。
Quin+は、実験室において、75gmの Uncaria tomentosa 樹皮を、400mlの沸騰水抽出に1時間供することによって製造した。その樹皮熱水懸濁液を濾過し、遠心分離して、粒状物質を全て除去した。次に、抽出物を、フード内においてヘアドライヤーによって蒸発乾固させた。固体の収率は、9.9gm/75gmまたは13.2%であった。この抽出物を、Quin+と称し、全ての分析目的に用いた。
【0118】
実施例V
cats claw 中のキナ酸エステルは、キナ酸炭水化物エステルであるという確認。
グルクロニダーゼ実験。
【0119】
C−Med−100中のQAEが、炭水化物のQAエステルであったかどうか区別する努力において、グルクロニダーゼでの処理へのそれらの感受性を調べた。商業的に供給されたまま用いられたC−Med−100を、水中に710mg/mlで溶解させた後、1mlを未処理で放置し、そして更に1mlを、30mgのβグルクロニダーゼ(Type B1,ウシ肝1240000単位/gm)で37Cにおいて24時間処理した。次に、双方の標品を、QA含有エステルの分解について、HPLCによって分析した。
【0120】
Seliwanoff's 試験は、炭水化物が、単糖、二糖、オリゴ糖または多糖の形でありうるかどうかとは無関係に、それらが試料中に存在するかどうかを、またはそれらがエステル化されているか否かということについて、決定する場合に有用な比色法である。Seliwanoff's 試薬は、100mlの3M HCl中に0.05gmのレソルシノールである。0.1mlのほぼ1%炭水化物を、1mlの試薬と混合し、その試料を5〜10分間沸騰させる。深赤色沈殿は、フルクトースなどのケトース糖の存在を示すが、更に長時間加熱(例えば、30分)後に現れる赤色は、グルコースのようなヘキソース糖を示す。4種類の試料の炭水化物含量について、この手順によって分析した。それらは、D1 Rf=0.34、D1 Rf=0.56、C−Med−100およびQuin+であった。
【0121】
高速液体クロマトグラフィー(HPLC)分析。
Cat's Claw 樹皮の水抽出物のHPLCは、UV検出器785Aを装備した Perkin Elmer 200LCポンプを用いて行った。カラムは、C18 150X4.6mm Perkin Elmer-Brownlee(Pecosphere 製品番号0258−0169)であった。更に、縦一列であるが、150mm C18カラムの前に、Perkin Elmer C18 30X4.6mm Brownlee プレカラム(P/N N930−3395)を置いた。カラムを介して1ml/分において1500〜5000psiでポンプ輸送された移動相は、0.1%トリフルオロ酢酸(TFA):メタノール(77:23,v/v)かまたは0.2%TFA:メタノール(85:15,v/v)であった。UV検出器は、200nmの波長で設定した。20μlの注入ループを、全ての実験で用いた。データは、PE Nelson Turbochrom 4(S270−0052)を用いて蓄積し且つ再処理した。C18カラムは、1ml/分で30分洗浄後、次の溶媒順序で再生した。アセトニトリル:メタノール(30:70,v/v)、100%メタノール、メタノール:水(50:50)、メタノール:0.2%TFA、および100%の0.2%TFA。
【0122】
次に、1M NaOHを、1N HClでpH=4〜7へと中和した。加水分解された試料は、HPLC分析時点で25〜800mg/mlであった。±塩基加水分解を除いて、同一の処理済み Cats Claw 試料を、既に記載されたように、HPLCによって比較した。QA−H+を生じる塩基加水分解ピークは、C18カラムから、0.2%TFA:メタノール(85:15,v/v)中において1.97〜2.14分の保持時間で溶離した。対の未加水分解試料(すなわち、1.97〜2.14分)中に現れるいずれかのバックグラウンドピーク面積は、塩基加水分解に由来しないと考えられるので、QA計算から差し引いた。加水分解済み Cats Claw 試料中のQA濃度は、0〜25mg/mlのQA−H+の標準溶液のクロマトグラフィー後に生じたmVにしたがって、ピーク面積またはピーク高さから計算した。この方法により、QAが3mg/ml未満で検出されうることはない。mg/mlでのいろいろな濃度の分析用QA−H+(Sigma)標準へのmV応答で表されるピーク高さの線形回帰分析は、y=257.7(x)〜773,r=0.96として計算される3〜25mg/mlのきわめて有意の線形関係を生じた。
【0123】
±塩基加水分解済み試料の直接比較は、キナ酸ピークが、HPLCクロマトグラムにおいて、加水分解後試料で現れただけであったということを示したが、それは、加水分解前に存在するキナ酸エステルの炭水化物部分を示すいくつかの他の新しいピークを伴った。
【0124】
実施例VI
キナ酸は、ビタミンDNAである。
ビタミン類は、1929年に初めて発見され、その年の生理学・医学ノーベル賞を獲得した。ビタミン類は、生命に不可欠であり、そして代謝を調節することおよび消化された食物からエネルギーを放出する生化学的過程を補助することによって良好な健康に寄与しているので、そのようなものとして、現在、十分に定義された13種類のビタミン類が分類されている。したがって、「ビタミン」は、健康を保護するためにおよび生物の適切な成長を維持するために、少量(微量栄養素)で生体に必要とされる何らかの多様な有機化合物である。13種類のビタミンの内の(ビタミンDを除外する)12種類は、生体で製造され得ないので、最適な健康を維持するために、食事から得る必要がある。U.S. Food and Nutrition Board of the National Research Council は、微量栄養素に関して、消費者の健康が適切に維持されることを認識し且つ保証することを助けるために、栄養所要量を推奨している(RDA)。
【0125】
ここに既に示されているのは、ヒトDNAの健康状態が、最大限の生命機能を維持することにいかに重要であるかということである。事実、それは、DNA修復と称される全酵素系が、ヒトDNA(遺伝子)が化学的に損傷した状態になるおよび機能しなくなることへの第一線の防御を与えるように進化してきたというほどに重要である。この防御機構の酵素は、エンドヌクレアーゼ、エキソヌクレアーゼ、ポリメラーゼおよびリガーゼと称される。それらは全て、異なった仕事を有するが、一緒に働いて、1日24時間毎日のヒトの生活の誤った生活様式、食事および代謝によって引き起こされるDNA中の有害な損傷を除去する。加齢過程に対する生体の主要な防御機構として良好なDNA修復を維持することの重要性は、科学界においてこの20〜30年間に、正に認識され始めたばかりである。DNAは、DNA修復が、現在、ヒト寿命を予測することがきわめて周知であるように、ヒトの十分な生存に臨界的である。科学者らは、動物の長命が、DNA修復を行うその能力によって予測されるということを繰り返し示すことが可能であった。例えば、齧歯類動物は、容易に90歳まで生存しうるヒトと比較して、僅か数年しか生きられないが、ヒトは、齧歯類動物の場合の16倍のDNA修復能力を有する。更に、一般的な哺乳動物長命と、DNA修復能力との間には、線形関係がある(Pero, RW et al 1985; Pero et al 2000: Grube, K and Burkle, A 1992)。本発明者が、現在、DNAを損傷から保護することによって少なくとも部分的にそれを承知してるように、明らかに、哺乳動物は生命を進化させてきた。
【0126】
したがって、食事摂取量によって正常な代謝を触媒することにより、ヒト生体が良好な健康を維持するのに役立つことが知られている13種類のビタミンが既に存在しているので、加齢から保護する最も重要な代謝系であるDNA修復が、更に、ビタミンDNAに触媒される過程も有すると考えられるということは、単に妥当なだけである。ここで、食事中の微量栄養素として見出されるが、生体中では生産されない、キナ酸と称される天然物も、DNA修復を促進することが知られ、したがって、ビタミンとして分類される判定基準を全て満たしているということが示される。
【0127】
その発見は、C−Med−100と称される、Uncaria tomentosa である Cat's Claw 樹皮の熱水抽出物の生物学的活性を説明する試みで始まった。この抽出物は、DNA修復を刺激するのにきわめて有効であった。体内にある一つの最も重要なDNA保護過程の直接モジュレーション、すなわち、DNA修復についてのこの初期の生物学的特性決定後、DNA修復促進の裏にある天然物を、可能性のある抗加齢療法として認識する協定によるた努力がなされた。一連の化学研究は、科学者らに、カルボキシアルキルエステル(CAE)を生物活性物質として最初に識別させたが、その後、引き続き、キナ酸エステル(QAE)を、cat's claw 水抽出物中の唯一の生物活性CAEとして識別することが行われた。Cat's Claw QAEは、in vitro および in vivo 双方で生物活性であったが、しかしながら、酸または塩基加水分解されてキナ酸になった場合、そして存在するQAEのアルコール部分を有することなく、キナ酸それ自体は、QAEの場合と同程度に、in vivoDNA修復促進活性を有した。したがって、結論として、キナ酸は、Cat's Claw の最終の生物活性な形であったが、それは、Cat's Claw の水抽出物中にQAEとして存在した。QAEは、胃腸管内でキナ酸へと加水分解されると考えられることから、実際には、QAEは前代謝産物形である。
【0128】
もう一方において、キナ酸は、多くの植物中に、大部分の植物芳香族代謝産物の生合成に不可欠な中間体としてきわめて遍在して見出される。キナ酸は、温血動物によって生産されることはあり得ない。したがって、これら判定基準は、キナ酸を、ビタミンDNAのような、ビタミンの本質的な性質を全て有するとして分類する。それは、体内では合成されないが、食事中に少量で存在するので、重篤な疾患から個体のDNA健康状態を保護することができる。
【0129】
多くのビタミン類のように、ビタミンDNAは、いくつかの形で、すなわち、キナ酸エステル、キナ酸塩、キナ酸キレートとして、またはプロトン(H+)での遊離キナ酸として天然に存在しうる。これらいろいろなキナ酸天然形は、生存を促進しうるいずれの時点でも、生物の代謝によって媒介されている生物学的活性の変更に影響する。馬尿酸は、キナ酸の最終排泄形であり(Adamson, RH et al. Biochem J 113: 437-443, 1970)、それは、キナ酸が、周知の毒物である安息香酸を含めた(Nair, B. Int J Toxicol 20(suppl 3): 23-50, 2001)、植物ベンゾイル化アミノ酸生合成における不可欠な中間体(フェニルアラニン、トリプトファンおよびチロシン)であることから(Herrmann KM. The Plant Cell 7: 907-919, 1995; Herrmann KM and Weaver, LM. Annu Rev Plant Physiol Plant Mol Biol 50: 473-503, 1999)、存在すると考えられる。馬尿酸は、コーヒーおよび緑茶/紅茶などの健康食品を消費している個体の尿中に高濃度で見出されるが(Mulder, TP et al. Am J Clin Nutr 81(1 Suppl): 256S-260S, 2005)、ヒドロキシルラジカルトラップとして作用することも報告された(Malyusz, M et al. Kidney Blood Press Res 24(3) 149-158, 2001)。したがって、馬尿酸さえも、キヌレニン(kyrunenine)と直接的に拮抗して、トリプトファンIDO(インドールアミン2,3−ジオキゲナーゼ)分解経路を阻害することにより、キナ酸に関連した健康作用に寄与することがありうる(Bauer et al. Transplantation International 18: 95-100, 2004)。したがって、PHは、例えば、果実を有する(すなわち、大部分の果実は、酸性であり且つはるかに多量の遊離キナ酸を含有する)植物部分中の遊離キナ酸レベルを決定し、そしてそれは順次、植物生活史イベント中の成長因子および生殖因子に依存する。しかしながら、果実も、いったん種子が発芽し且つ成長し始めると、種子の初期成長期を支持するために高い栄養価貯蔵を必要とする。これは、時間を要するので、次に、キナ酸合成は、毒性タンニン(Dr Dan Brown, Cornell University, Department of Animal Science, www.ansci.cornell.edu/plants/toxicagents/tannin/)または芳香族エステル(例えば、クロロゲン酸)(Clifford, MN. J Sci Food Agri 80:1033-1043, 2000)または脂肪族エステル(例えば、Cat's Claw 中の炭水化物エステル)などの追加のキナ酸食物源の貯蔵または保護によって植物が生存するのに役立つ他の形へと迂回する。最後に、天然に見出されるキナ酸塩またはキレート形のタイプは、それらが成長している腸管微生物叢環境または土壌含有物によって調節される。それにもかかわらず、キナ酸は、遊離酸であれ、塩、キレートまたはエステル代謝形であれ、全て、ビタミンDNAの天然に存在する構造として考えられるはずである。
【0130】
いずれのビタミンも、いくつかの生物活性形を有するということは、例外ではないがむしろ、B−錯体ビタミンであるナイアシンの概説によって証明されうるように、原則であると考えられる。ナイアシンは、主に、穀物、堅果、フスマ、マメおよび種子の消費による食事から供される必要がある(Pitch, PT. Sante 15(3): 205-208, 2005)。ナイアシンは、体内でニコチンアミドへと代謝され、その場合、双方とも、ビタミンとして同様に有効であるが、ナイアシンは、潮紅を引き起こし、ニコチンアミドは引き起こさない。更に、外因供給されるL−トリプトファン(thrytophan)は、ナイアシンかまたはニコチンアミドのビタミン欠乏症を置き換えることができる(Oduho, GW and Baker, DH. J Nutr 123(12): 2201-2206, 1993)。ビタミンDNAとしてのキナ酸の考察と更に平行して、ナイアシンおよびニコチンアミドは、1−メチルニコチンアミドへと代謝されるが、その場合、それは尿中に排泄され、そしてこの排泄物も、生物学的活性を有することが分かった(Wozniacka, A et al. Clin Exp Dermatol 30(6): 632-635, 2005; Gebicki, J et al. Pol J Pharmacol 55(1): 109-112, 2003)。
【0131】
したがって、Cat's Claw QAEを、キナ酸へ、またはより生物活性なエステル、塩またはキレート形へと変換することは、ビタミンDNAの利用可能性を改善することでしかなく、現在、本発明者がその存在を承知していることである。これに関して、QuinmaxTMは、天然ビタミンDNAの利用可能性に最適な製剤である。
【0132】
本明細書中に挙げられている公報および特許は全て、本明細書中に援用される。記載された内容のいろいろな変更および変化は、発明の範囲および精神から逸脱することなく、当業者に明らかであろう。本発明を具体的な態様に関連して記載してきたが、請求の範囲に記載の発明が、これら態様に不適当に制限されるべきではないということは理解されるはずである。実際に、発明を実施するためのいろいろな変更は、当業者に明らかであり、請求の範囲の範囲内にあるものである。
【図面の簡単な説明】
【0133】
【図1】図1は、培養されたHL−60細胞において、いろいろなキナ酸塩、キレートまたは塩/キレート(未決定の飽和での分子構造)によって引き起こされる、IC50値(すなわち、50%の成長を阻害する用量)として表される in vitro 成長阻害を示す。QA−H+=遊離キナ酸(H+)、QA−NH4+=キナ酸アンモニウムキレート、QA−Na+=キナ酸ナトリウム塩、QA−K+=キナ酸カリウムキレート、QA−Zn++=キナ酸亜鉛塩/キレート、QA−Li+=キナ酸リチウム塩/キレート、Ca++=キナ酸カルシウムキレート、キナ酸ヒスチジン塩/キレート=QA−ヒスチジン、キナ酸リシン塩/キレート=QA−リシン、およびC−Med−100=非pH調整水抽出物。
【図2】図2は、C57BL/6マウス脾臓細胞の、Garcinia 抽出物によって引き起こされた成長停止を、Cat's Claw 水抽出物、C−Med−100と比較して示す。Garcinia 抽出物は、0.5M HClで遊離酸へと最初に変換し、凍結乾燥させた後、5MアンモニアでpH=7.5へと中和して、シトリミクス(citrimix)アンモニアキレート(表1)を生じることによって調製された Citrimix および栄養素化(nutrated)Citrimix(Nu−Citrimix)であった。脾臓細胞の成長は、48時間後のマイトジェンConA(2.5μg/ml)への応答において、放射性チミジン取込みによって評価した。比較は、脾臓細胞の成長の25%、50%および90%阻害について、mg/mlでの用量、すなわち、IC用量値で行う。
【図3】図3は、C57BL/6マウス脾臓細胞の、キナ酸(H+)、キナ酸NH4+キレートおよびNH4Clによって引き起こされる成長停止を示す。キナ酸NH4+キレートは、水酸化アンモニウムでpH=7.5キナ酸(H+)へと中和することによって合成した。キナ酸(H+)を中和するのに必要な水酸化アンモニウムの量も、HClで中和して、NH4Cl対照を生じた。脾臓細胞の成長は、48時間後のマイトジェンConA(2.5μg/ml)への応答において、放射性チミジン取込みによって評価した。比較は、脾臓細胞の成長の25%、50%および90%阻害について、mg/mlでの濃度、すなわち、IC値で行う。
【図4】図4は、前に詳細に記載のような、キナ酸(H+)、pH=7.5に中和されたキナ酸アンモニウムキレート、または同等量の水酸化アンモニウム(NH4Cl)で処理後のジャーカットT細胞におけるNF−κBの評価を示す。
【図5】図5は、C57BL/6マウス脾臓細胞の、Cat's Claw 水抽出物、C−Med−100またはNu−CC100によって引き起こされる成長停止を示す。Nu−CC100は、1%アンモニアでのC−Med−100の処理によって栄養素化した後、凍結乾燥させて、内在する有機酸類似体のキレートを形成させた。Cat's Claw 水抽出物、C−Med−100またはNu−CC100によって引き起こされるC57BL/6マウス脾臓細胞の成長停止は、48時間後のマイトジェンConA(2.5μg/ml)への応答において、トリチウム化チミジン取込みによって評価した。Nu−CC100は、1%アンモニアでのC−Med−100の処理によって栄養素化した後、凍結乾燥させた。比較は、脾臓細胞の成長の25%、50%および90%阻害について、mg/mlでの用量、すなわち、IC値で行う。
【図6】図6は、QAのアンモニアキレートである6gmの QuinmaxTMの経口投与後の馬尿酸の検出を示す。
【図7】図7は、馬尿酸とキヌレニンとの間の構造類似性を示すが、それは、トリプトファン分解経路に不可欠な中間体である。QAから代謝される馬尿酸は、キヌレニン酵素基質部位への化学結合によって、トリプトファン分解を競合阻害することがありうる。
【図8】図8は、ラットにおいて、DXR(2mg/ml)処置後にC−Med−100(80/kg)、キナ酸(200mg/kg)、またはアンモニア処理されたキナ酸(200mg/kg)によって引き起こされるDNA損傷回復を示す。15日後の白血球(WBC)成長を、血液中の1012WBC/リットルとして推定する。DXR=ドキソルビシンDNA損傷薬。
【特許請求の範囲】
【請求項1】
αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸、塩またはキレートの有効量を含む、哺乳動物への投与用の単離された医薬組成物の製造方法であって、
αヒドロキシル有機酸の少なくとも一つの天然に存在する形と、一定量の塩基とを、水溶液であって、αヒドロキシル有機酸の全含量が、その溶液の約0.5%w/w〜約35%w/wになる水溶液中において、存在するαヒドロキシル有機酸の実質的に全ての形を加水分解する一定時間混合し、
その溶液を約6.9〜約7.6のpHへと中和して、αヒドロキシル有機酸の実質的に全ての天然に存在する形の遊離酸、遊離酸の塩またはキレートを生じ、そして場合により、
その溶液を凍結乾燥させて、単離された医薬組成物を製造することを含む方法。
【請求項2】
αヒドロキシル有機酸の少なくとも一つの天然に存在する形が、エステル、カルボキシアルキルエステル、塩、キレートおよび遊離酸から成る群より選択される、請求項1に記載の単離された医薬組成物の製造方法。
【請求項3】
αヒドロキシル有機酸の少なくとも一つの天然に存在する形が、キナ酸、αヒドロキシルクエン酸、アスコルビン酸、フマル酸、グルタル酸、乳酸、リンゴ酸、シュウ酸、酒石酸、クエン酸、αヒドロキシクエン酸、キナ酸、シキミ酸、ケイ皮酸(cinnamonic)、サリチル酸、カフェ酸、馬尿酸、安息香酸およびフェノール酸から成る群より選択される酸の天然に存在する形である、請求項2に記載の方法。
【請求項4】
塩基が、NaOH、KOHおよびNH4OHから成る群より選択され、それを約15分間〜約4時間加えて、水溶液中の濃度を約0.5M〜約5Mの範囲内にする、請求項3に記載の方法。
【請求項5】
αヒドロキシル有機酸の天然に存在する形が、キナ酸およびαヒドロキシルクエン酸から成る群より選択され、そして塩基が、水酸化アンモニウムである、請求項4に記載の方法。
【請求項6】
溶液を、塩酸、硫酸、酢酸、酒石酸、乳酸、プロピオン酸、クエン酸および硝酸から成る群より選択される酸で中和する、請求項5に記載の方法。
【請求項7】
キナ酸対アンモニウムイオンの比率が約1:1.54であるキナ酸キレートの有効量を含む投与用の単離された医薬組成物の製造のための、請求項6に記載の方法。
【請求項8】
凍結乾燥された組成物の有効量と、哺乳動物への経口投与に適する薬学的に許容しうる担体とを混合する工程を更に含む、請求項7に記載の方法。
【請求項9】
αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸の塩またはキレートの有効量を含む、単離された医薬組成物の製造方法であって、
植物材料の水性抽出物であって、抽出物中のαヒドロキシル有機酸の全含量が、抽出物の約0.2%w/v〜約35%w/vになる水性抽出物と、一定量の塩基とを、水溶液中において、存在するαヒドロキシル有機酸の実質的に全ての形を加水分解する一定時間混合し、
その溶液を約6.9〜約7.6のpHへと中和して、αヒドロキシル有機酸の実質的に全ての天然に存在する形の遊離酸、遊離酸の塩またはキレートを生じ、そして場合により、
その溶液を凍結乾燥させて、単離された医薬組成物を製造することを含む方法。
【請求項10】
植物材料が、ウンカリア(uncaria)、ガルシニア(garcinia)、ツルコケモモ(cranberry)およびコーヒーから成る群より選択され、そして塩基が、NaOH、KOHおよびNH4OHから成る群より選択され、それを約15分間〜約4時間加えて、水溶液中の濃度を約0.5M〜約5Mの範囲内にする、請求項9に記載の方法。
【請求項11】
植物材料が、uncaria(キャッツクロー(cat's claw))である、請求項10に記載の方法。
【請求項12】
単離された医薬組成物が、キナ酸対アンモニウムイオンの比率が約1:1.54であるキナ酸キレートの有効量を含む、請求項11に記載の方法。
【請求項13】
凍結乾燥された組成物の有効量と、哺乳動物への投与に適する製剤を製造するための薬学的に許容しうる担体とを混合する工程を更に含む、請求項12に記載の方法。
【請求項14】
キナ酸キレートの有効量を含む、単離された医薬組成物の製造方法であって、
実質的に純粋なキナ酸と、水酸化アンモニウムとを、水溶液中において、約6.9〜約7.6のpHに達する十分な時間混合して、キナ酸対アンモニウムイオンの比率が約1:1.54であるキナ酸のアンモニウムキレートを生じることを含む方法。
【請求項15】
約1%〜約10%の濃度の水酸化アンモニウム溶液を、100mlにつき約5g〜約30gのキナ酸を含むキナ酸水溶液に、その溶液が約7.4〜約7.6のpHに達する十分な量で、約15分間〜約4時間の一定時間以内に加える、請求項14に記載の方法。
【請求項17】
αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸、塩またはキレートの有効量を含む機能性食品の製造方法であって、
食物であって、その食物中に約0.2%w/w〜約35%w/wの一定量のαヒドロキシル有機酸を含む食物と、塩基とを、水溶液中において、食物中のαヒドロキシル有機酸の実質的に全ての形を加水分解する一定時間混合し、
その溶液を約6.9〜約7.6のpHへと中和して、食物中のαヒドロキシル有機酸の実質的に全ての天然に存在する形の遊離酸、遊離酸の塩またはキレートを生じ、そして場合により、
その溶液を凍結乾燥させて、単離された医薬組成物を製造することを含む方法。
【請求項18】
食物が、リンゴ、アンズ、ガルシニア、ツルコケモモ、マルメロ、カンキツ類、パイナップル、プルーン、ヒマワリ、ワルトルベリー(whortleberry)、クロイチゴ、アカフサスグリ(red currant)、クロスグリ(black currant)、キイチゴ、ババコ(babco)、フェイジョア(feijoa)、キワノ(kiwano)、パッションフルーツ、コダチトマト(tamarillo)、セイヨウカリン(medlar)、カキ(persimmon)およびコーヒーから成る群より選択され、そして塩基が、NaOH、KOHおよびNH4OHから成る群より選択される、請求項17に記載の方法。
【請求項19】
凍結乾燥されている、請求項1、請求項9、請求項14または請求項17に記載の方法によって製造された組成物であって、
(a)ジャーカットT細胞におけるNF−κB活性化を、1.25mg/mlまたはそれ未満の用量で、最大 in vitro 応答の最低50%に阻害する;
(b)マイトジェン(ConA)の存在下において in vitro で培養された脾臓細胞の成長停止を、2mg/mlまたはそれ未満の用量で引き起こす;および
(c)哺乳動物への約1mg/kg〜50mg/kgの用量での全身投与は、免疫過程、抗炎症過程、抗腫瘍過程、DNA修復過程またはトリプトファン取込み過程を促進する、から成る群より選択される少なくとも一つの性質を示す組成物。
【請求項20】
DNA修復を促進する、トリプトファン取込みを促進する、免疫応答を促進する、炎症を制御する、または腫瘍の進行を阻害する方法であって、請求項1、請求項9、請求項14または請求項17に記載の方法によって製造された組成物の有効量を投与することを含む方法。
【請求項1】
αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸、塩またはキレートの有効量を含む、哺乳動物への投与用の単離された医薬組成物の製造方法であって、
αヒドロキシル有機酸の少なくとも一つの天然に存在する形と、一定量の塩基とを、水溶液であって、αヒドロキシル有機酸の全含量が、その溶液の約0.5%w/w〜約35%w/wになる水溶液中において、存在するαヒドロキシル有機酸の実質的に全ての形を加水分解する一定時間混合し、
その溶液を約6.9〜約7.6のpHへと中和して、αヒドロキシル有機酸の実質的に全ての天然に存在する形の遊離酸、遊離酸の塩またはキレートを生じ、そして場合により、
その溶液を凍結乾燥させて、単離された医薬組成物を製造することを含む方法。
【請求項2】
αヒドロキシル有機酸の少なくとも一つの天然に存在する形が、エステル、カルボキシアルキルエステル、塩、キレートおよび遊離酸から成る群より選択される、請求項1に記載の単離された医薬組成物の製造方法。
【請求項3】
αヒドロキシル有機酸の少なくとも一つの天然に存在する形が、キナ酸、αヒドロキシルクエン酸、アスコルビン酸、フマル酸、グルタル酸、乳酸、リンゴ酸、シュウ酸、酒石酸、クエン酸、αヒドロキシクエン酸、キナ酸、シキミ酸、ケイ皮酸(cinnamonic)、サリチル酸、カフェ酸、馬尿酸、安息香酸およびフェノール酸から成る群より選択される酸の天然に存在する形である、請求項2に記載の方法。
【請求項4】
塩基が、NaOH、KOHおよびNH4OHから成る群より選択され、それを約15分間〜約4時間加えて、水溶液中の濃度を約0.5M〜約5Mの範囲内にする、請求項3に記載の方法。
【請求項5】
αヒドロキシル有機酸の天然に存在する形が、キナ酸およびαヒドロキシルクエン酸から成る群より選択され、そして塩基が、水酸化アンモニウムである、請求項4に記載の方法。
【請求項6】
溶液を、塩酸、硫酸、酢酸、酒石酸、乳酸、プロピオン酸、クエン酸および硝酸から成る群より選択される酸で中和する、請求項5に記載の方法。
【請求項7】
キナ酸対アンモニウムイオンの比率が約1:1.54であるキナ酸キレートの有効量を含む投与用の単離された医薬組成物の製造のための、請求項6に記載の方法。
【請求項8】
凍結乾燥された組成物の有効量と、哺乳動物への経口投与に適する薬学的に許容しうる担体とを混合する工程を更に含む、請求項7に記載の方法。
【請求項9】
αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸の塩またはキレートの有効量を含む、単離された医薬組成物の製造方法であって、
植物材料の水性抽出物であって、抽出物中のαヒドロキシル有機酸の全含量が、抽出物の約0.2%w/v〜約35%w/vになる水性抽出物と、一定量の塩基とを、水溶液中において、存在するαヒドロキシル有機酸の実質的に全ての形を加水分解する一定時間混合し、
その溶液を約6.9〜約7.6のpHへと中和して、αヒドロキシル有機酸の実質的に全ての天然に存在する形の遊離酸、遊離酸の塩またはキレートを生じ、そして場合により、
その溶液を凍結乾燥させて、単離された医薬組成物を製造することを含む方法。
【請求項10】
植物材料が、ウンカリア(uncaria)、ガルシニア(garcinia)、ツルコケモモ(cranberry)およびコーヒーから成る群より選択され、そして塩基が、NaOH、KOHおよびNH4OHから成る群より選択され、それを約15分間〜約4時間加えて、水溶液中の濃度を約0.5M〜約5Mの範囲内にする、請求項9に記載の方法。
【請求項11】
植物材料が、uncaria(キャッツクロー(cat's claw))である、請求項10に記載の方法。
【請求項12】
単離された医薬組成物が、キナ酸対アンモニウムイオンの比率が約1:1.54であるキナ酸キレートの有効量を含む、請求項11に記載の方法。
【請求項13】
凍結乾燥された組成物の有効量と、哺乳動物への投与に適する製剤を製造するための薬学的に許容しうる担体とを混合する工程を更に含む、請求項12に記載の方法。
【請求項14】
キナ酸キレートの有効量を含む、単離された医薬組成物の製造方法であって、
実質的に純粋なキナ酸と、水酸化アンモニウムとを、水溶液中において、約6.9〜約7.6のpHに達する十分な時間混合して、キナ酸対アンモニウムイオンの比率が約1:1.54であるキナ酸のアンモニウムキレートを生じることを含む方法。
【請求項15】
約1%〜約10%の濃度の水酸化アンモニウム溶液を、100mlにつき約5g〜約30gのキナ酸を含むキナ酸水溶液に、その溶液が約7.4〜約7.6のpHに達する十分な量で、約15分間〜約4時間の一定時間以内に加える、請求項14に記載の方法。
【請求項17】
αヒドロキシル有機酸の少なくとも一つの天然に存在する形の遊離酸、塩またはキレートの有効量を含む機能性食品の製造方法であって、
食物であって、その食物中に約0.2%w/w〜約35%w/wの一定量のαヒドロキシル有機酸を含む食物と、塩基とを、水溶液中において、食物中のαヒドロキシル有機酸の実質的に全ての形を加水分解する一定時間混合し、
その溶液を約6.9〜約7.6のpHへと中和して、食物中のαヒドロキシル有機酸の実質的に全ての天然に存在する形の遊離酸、遊離酸の塩またはキレートを生じ、そして場合により、
その溶液を凍結乾燥させて、単離された医薬組成物を製造することを含む方法。
【請求項18】
食物が、リンゴ、アンズ、ガルシニア、ツルコケモモ、マルメロ、カンキツ類、パイナップル、プルーン、ヒマワリ、ワルトルベリー(whortleberry)、クロイチゴ、アカフサスグリ(red currant)、クロスグリ(black currant)、キイチゴ、ババコ(babco)、フェイジョア(feijoa)、キワノ(kiwano)、パッションフルーツ、コダチトマト(tamarillo)、セイヨウカリン(medlar)、カキ(persimmon)およびコーヒーから成る群より選択され、そして塩基が、NaOH、KOHおよびNH4OHから成る群より選択される、請求項17に記載の方法。
【請求項19】
凍結乾燥されている、請求項1、請求項9、請求項14または請求項17に記載の方法によって製造された組成物であって、
(a)ジャーカットT細胞におけるNF−κB活性化を、1.25mg/mlまたはそれ未満の用量で、最大 in vitro 応答の最低50%に阻害する;
(b)マイトジェン(ConA)の存在下において in vitro で培養された脾臓細胞の成長停止を、2mg/mlまたはそれ未満の用量で引き起こす;および
(c)哺乳動物への約1mg/kg〜50mg/kgの用量での全身投与は、免疫過程、抗炎症過程、抗腫瘍過程、DNA修復過程またはトリプトファン取込み過程を促進する、から成る群より選択される少なくとも一つの性質を示す組成物。
【請求項20】
DNA修復を促進する、トリプトファン取込みを促進する、免疫応答を促進する、炎症を制御する、または腫瘍の進行を阻害する方法であって、請求項1、請求項9、請求項14または請求項17に記載の方法によって製造された組成物の有効量を投与することを含む方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2008−533163(P2008−533163A)
【公表日】平成20年8月21日(2008.8.21)
【国際特許分類】
【出願番号】特願2008−502014(P2008−502014)
【出願日】平成18年3月16日(2006.3.16)
【国際出願番号】PCT/US2006/009394
【国際公開番号】WO2006/101922
【国際公開日】平成18年9月28日(2006.9.28)
【出願人】(507311865)
【Fターム(参考)】
【公表日】平成20年8月21日(2008.8.21)
【国際特許分類】
【出願日】平成18年3月16日(2006.3.16)
【国際出願番号】PCT/US2006/009394
【国際公開番号】WO2006/101922
【国際公開日】平成18年9月28日(2006.9.28)
【出願人】(507311865)

【Fターム(参考)】
[ Back to top ]

