α2−アドレナリン受容体アゴニストとしてのアプラクロニジンおよびブリモドニジンのニトロオキシ含有誘導体
式(I):A-X1-Y-ONO2 (I)
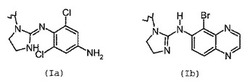
(式中、Aは(Ia)または(Ib)

から選択される)
のα2-アドレナリン受容体アゴニストのニトロオキシ誘導体は、改善された薬理活性および高められた忍容性を有する。それらは、眼科疾患、特に高眼圧および緑内障の治療に用いられ得る。
(式中、Aは(Ia)または(Ib)

から選択される)
のα2-アドレナリン受容体アゴニストのニトロオキシ誘導体は、改善された薬理活性および高められた忍容性を有する。それらは、眼科疾患、特に高眼圧および緑内障の治療に用いられ得る。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、α2-アドレナリン受容体アゴニストのニトロオキシ誘導体および眼疾患の治療、特に高眼圧および緑内障の治療のためのそれらの使用に関する。
【背景技術】
【0002】
緑内障は、40歳を超えた全人口の約2%に発生し、急速な視力損失に進行する前の何年もの間、無症候性である。
緑内障は、主として、開放隅角、閉塞隅角、または先天性として分類され、さらに、1次性および2次性として分類される。緑内障は種々の薬理学的および外科的アプローチで治療される。緑内障が眼高血圧に関連する場合、薬理学的治療は、アドレナリン作動性アゴニスト(エピネフリン、デペベフリン、アプラクロニジン)、コリン作動性アゴニスト(ピロカルピン)、β遮断薬(ベタキソロール、レボブノロール、チモロール)、炭酸脱水酵素阻害剤(アセタゾールアミド、クロルジラミド)または、最近では、プロスタグランジン類縁物質(ラタノプロスト、ビマトプロスト)およびα-アドレナリン作動性アゴニスト(ブリモニジン、アプラクロニジン)を含む。これらの薬理学的アプローチは、毛様体による房水の産生を阻害するか、小柱網を横切る房水流出を容易にするかのどちらかにより、IOPを正常血圧状態に戻すのに役立つ。特に、ブリモニジンおよびアプラクロニジンのようなα-アドレナリン作動性アゴニストは、房水の産生を減少することならびにブドウ膜強膜の流出を高めることによりIOPを制御する。
【0003】
α2-アドレナリン受容体アゴニストは、単独治療およびβ遮断薬に対する付加的治療の両方で、眼高血圧および視神経障害の治療にも用いられる。それらは、急性の圧力上昇(すなわち、アルゴンレーザー線維柱帯形成術、白内障外科手術、硝子体切除、周辺虹彩切除、嚢切開の前および後の圧力上昇)の予防的処置にも用いられる。これらの活性は、主に、眼のα2-アドレナリン受容体の活性化により、そのような活性化は、房水の産生の減少およびブドウ膜強膜の流出の増加をもたらす。(Curr Opin Ophtalmol 1997, 8(2); 42-49)
【0004】
α2-アドレナリン受容体アゴニストを含む点眼剤は、全身に吸収され、全身性低血圧、心拍数減少、口渇、眼瞼後退、結膜白化、充血、ほてり(burning)、ブドウ膜炎、タキフィラキシー、後部分(posterior segment)血管収縮、局所アレルギー様症候群、瞳孔直径増加、鬱、不安、倦怠感、悪心を含む副作用を生じ得ることが知られている。(Hoyng and van Beek, Drugs, 59: 411-434 (2000), Surv Ophtalmol 1996, 41 Suppl 1: S19-26)
【発明の開示】
【発明が解決しようとする課題】
【0005】
上記のように、緑内障を治療するために用いられる薬剤は、副作用を引き起こし得る。したがって、眼疾患および特に緑内障の治療において、安全でかつ効果的な選択的α2-アドレナリン受容体アゴニストに対する必要性がある。
【課題を解決するための手段】
【0006】
式(I)のα2-アドレナリン受容体アゴニストのニトロオキシ誘導体は、薬理活性および高められた忍容性に関して、元の化合物と比較して、著しく改善された全体的なプロファイルを有することが、驚くべきことに見出された。
【0007】
本発明の目的は、一般式(I):
A-X1-Y-ONO2 (I)
[式中、
Aは、
【化1】

から選択され、
【0008】
X1は次の意味:
-C(O)-、-C(O)O-、
【化2】

を有し、
【0009】
Yは次の意味:
a)
−ハロゲン原子、ヒドロキシ、-ONO2またはT0(ここで、T0は-OC(O)(C1-C10アルキル)-ONO2または-O(C1-C10アルキル)-ONO2である)からなる群から選択される1以上の置換基で任意に置換されていてもよい、直鎖状または分枝鎖状のC1-C20アルキレン、好ましくはC1-C10アルキレン;
−環が側鎖T(ここで、Tは1〜10の炭素原子を有する直鎖状または分枝鎖状のアルキルである)で任意に置換されていてもよい、シクロアルキレン環内に5〜7の炭素原子を有するシクロアルキレン;
【0010】
b)
【化3】

c)
【化4】

(ここで、nは0〜20の整数であり、好ましくはnは1〜10であり、n1は1〜20の整数であり、好ましくはn1は1〜10である);
【0011】
d)
【化5】

(ここで、n1は上記で定義されたとおりであり、n2は0〜2の整数であり;X2 = -OCO-または-COO-であり、R2は水素原子またはCH3である);
【0012】
e)
【化6】

(ここで、n1、n2、R2およびX2は上記で定義されたとおりであり;
Y1は-CH2-CH2-または-CH=CH-(CH2)n2-である);
【0013】
f)
【化7】

(ここで、n1およびR2は上記で定義されたとおりであり、R3はHまたは-COCH3である);
但し、Yがb)〜f)で挙げられた2価の基から選択されるとき、-ONO2基は-(CH2)n1基に結合している;
【0014】
g)
【化8】

(ここで、X3は酸素原子または硫黄原子であり、好ましくはX3は酸素原子であり、n3は1〜6、好ましくは1〜4の整数であり、R2は上記で定義されたとおりである);
【0015】
h)
【化9】

(ここで、n4は0〜10の整数であり、
n5は1〜10の整数であり、
R4、R5、R6、R7は同一または異なって、H、または直鎖状もしくは分枝鎖状のC1-C4アルキルであり、好ましくはR4、R5、R6、R7はHであり、
【0016】
-ONO2基は
【化10】

(ここで、n5は上記で定義されたとおりである)
に結合しており、
【0017】
Y2は、窒素、酸素、硫黄から選択される1以上のヘテロ原子を含む、飽和、不飽和もしくは芳香族の、5員または6員の複素環であり、次の:
【化11】

から選択される)
を有する2価の基である]
のα2-アドレナリン受容体アゴニストのニトロオキシ誘導体、および医薬的に許容されるその塩または立体異性体である。
【0018】
本明細書で用いられる「C1-C20アルキレン」の語は、分枝鎖状または直鎖状のC1-C20、好ましくはメチレン、エチレン、プロピレン、イソプロピレン、n-ブチレン、ペンチレン、n-ヘキシレンなどのような1〜10の炭素原子を有する炭化水素を意味する。
【0019】
本明細書で用いられる「C1-C10アルキル」の語は、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、イソブチル、t-ブチル、ペンチル、ヘキシル、オクチルなどを含む、1〜10の炭素原子を含む、分枝鎖状または直鎖状のアルキル基を意味する。
【0020】
本明細書で用いられる「シクロアルキレン」の語は、直鎖状または分枝鎖状の(C1-C10)アルキル、好ましくはCH3のような側鎖で任意に置換されていてもよい、非限定的にシクロペンチレン、シクロへキシレンを含む、5〜7の炭素原子を有する環を意味する。
【0021】
本明細書で用いられる「複素環式」の語は、例えばピリジン、ピラジン、ピリミジン、ピロリジン、モルホリン、イミダゾールなどのような、窒素、酸素、硫黄から選択される1以上のヘテロ原子を含む、飽和、不飽和もしくは芳香族の、5員または6員の環を意味する。
【0022】
式(I)の好ましいニトロオキシ誘導体は以下のとおりである:
【化12−1】

【0023】
【化12−2】

【0024】
【化12−3】

【0025】
【化12−4】

【0026】
【化12−5】

【0027】
【化12−6】

【0028】
【化12−7】

【0029】
【化12−8】

【0030】
【化12−9】

【0031】
【化12−10】

【0032】
本発明のもう1つの目的は、医薬の分野で通常用いられる無毒性の佐剤および/または担体と一緒に、本発明の式(I)の化合物を少なくとも1つ含む医薬組成物である。
好ましい投与経路は局所である。
【0033】
本発明の化合物は、眼科的に許容される媒体中の溶液、懸濁液またはエマルジョン(分散液)として投与され得る。本明細書で用いられる「眼科的に許容される媒体」の語は、本化合物と非反応性で患者への投与に適したあらゆる物質または物質の組み合わせを意味する。
患者の眼への局所適用に適した水性媒体が好ましい。
【0034】
本発明の眼科組成物中に用いるのに望ましいその他の成分は、抗菌剤、保存剤、助溶剤、界面活性剤および粘性構築剤(viscosity building agent)である。
【0035】
本発明は、緑内障または高眼圧症を治療する方法にも関し、該方法は、眼圧を減少し、減少されたレベルに眼圧を維持するために、効果的に眼内圧を減少させる組成物の量を眼と接触することにある。
【0036】
本発明の化合物の用量は、標準的な臨床方法によって決定され得る。そして、それは、Physician's Desk Reference, Medical Economics Company, Inc., Oradell, N.J., 58th Ed., 2004; The pharmacological basis of therapeutics, Goodman and Gilman, J. G. Hardman, L. e. Limbird, Tenth Ed.に報告されているように、対応する無誘導の市販化合物に対して記載されている量と同じ範囲かまたはそれより少ない。
治療は、約30μlに相当する組成物の1滴が、1日当り患者の眼に約数回、例えば1〜3回投与される状態で有利に行われ得る。
【0037】
本発明の化合物は、別々にまたは組み合わせてのいずれかで、緑内障または高眼圧症の治療に役立つその他の公知の医薬と一緒に用いられ得ることがさらに考えられる。例えば、本発明の化合物は、(i)チモロール、ベタキソロール、レボブノロールなどのようなβ遮断薬(U.S.特許番号4,952,581を参照);(ii)ブリンゾールアミドのような炭酸脱水酵素阻害剤と組み合わされ得る。
上で報告された化合物のニトロオキシ誘導体、例えば、U.S.特許番号6,242,432に記載されたようなβ遮断薬のニトロオキシ誘導体との組み合わせも考えられる。
【0038】
本発明の化合物は、次のように合成され得る。
A) 一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は-C(O)-であり、Yは上記で定義されたとおりである)の化合物は、
【0039】
1A) 式(IIIa)または(IIIb):
【化13】

(式中、
PはH、またはt-ブトキシカルボニルおよびT. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているようなアミノ保護基である)の化合物を
【0040】
式(1a):
Act-C(O)-Y-ONO2 (1a)
(式中、Yは上記で定義されたとおりであり、Actは、
【化14】

のようなペプチド化学で用いられるカルボン酸活性化基である)
の化合物と反応させること、
【0041】
1A.a) T. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているように、ジオキサン中のHClまたはトルフルオロ酢酸のような強酸の存在下、得られた化合物の保護基を除去すること、および得られた一般式(I)の化合物を医薬的に許容されるその塩に任意に変換すること
を含む方法により得ることができる。
【0042】
式(IIIa)または(IIIb)(ここで、Pは上記で定義されたとおりである)の化合物の、式(1a)(ここで、Yは上記で定義されたとおりであり、Actは上記で定義されたようにペプチド化学で用いられるカルボン酸活性化基である)の化合物との反応は、DMF、THF、アセトンもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基の存在下;あるいはDMF、CH2Cl2のような溶媒中、DMAPおよびSc(OTf)3もしくはBi(OTf)3のようなルイス酸の存在下に行なわれ得る。
【0043】
1A.b) アプラクロニジンとして知られている、式(IIIa)(ここで、Pは水素原子である)の化合物は商業的に入手可能であるか、またはUS 4,517,199に記載されているようにして合成され得る。ブリモニジンとして知られている、式IIIBの化合物は商業的に入手可能であるか、またはUS 3,890,319に記載されている方法に従って合成され得る。
【0044】
1A.c) 式(1a)(ここで、Actは、上記で定義されたとおり、ペプチド化学で用いられるカルボン酸活性化基である)の化合物は、文献中でよく知られているように、DCC、EDAC.HClのような縮合剤を用いる通常のエステル化反応により、酸(1b)
HOOC-Y-ONO2 (1b)
(ここで、Yは上記で定義されたとおりである)
を商業的に入手可能な化合物(1c)
Act-H (1c)
(ここで、Actは上記で定義されたとおりである)
と反応させることにより得られる。
【0045】
1A.d) 上記で定義された式(1b)の化合物は、式(1d)
Hal-Y-COOH (1d)
の商業的に入手可能な酸を、窒素下、暗所で、20℃〜80℃の温度範囲で、アセトニトリルまたはテトラヒドロフラン(THF)のような適当な有機溶媒中、AgNO3と反応させることにより得られる。あるいは、AgNO3との反応は、アセトニトリルまたはTHFのような溶媒中、70〜180℃の範囲の温度で、短時間(1〜60分間)、マイクロウエーブ照射下で行われ得る。
【0046】
2A) あるいは、一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は-C(O)-であり、Yは上記で定義されたとおりである)の化合物は、
2A.a) 式(IIIa)または(IIIb)
【化15】

(式中、
PはH、またはt-ブトキシカルボニルおよびT. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているようなアミノ保護基である)の化合物を
【0047】
式(1a'):
HO-C(O)-Y-ONO2 (1a')
(式中、Yは上記で定義されたとおりである)
の化合物と反応させ、次いで、1A.a)に記載されているように、得られた化合物の保護基を除去すること、および得られた一般式(I)の化合物を医薬的に許容される塩に任意に変換すること
を含む方法により得ることができる。
【0048】
式(IIIa)または(IIIb)(ここで、Pは上記で定義されたとおりである)の化合物の式(1a')(ここで、Yは上記で定義されたとおりである)の化合物との反応は、ジシクロヘキシルカルボジイミド(DCC)、N'-(3-ジメチルアミノプロピル)-N-エチルカルボジイミド塩酸塩(EDAC)のような縮合剤とN,N-ジメチルアミノピリジン(DMAP)のような触媒、またはベンゾトリアゾール-1-イルオキシ-トリス(ジメチルアミノ)ホスホニウム ヘキサフルオロホスフェート(BOP)とN-メチルモルホリン、N,N-ジイソプロピルアミンのような有機塩基の存在下で行なわれる。反応は、N,N'-ジメチルホルムアミド、テトラヒドロフラン、ベンゼン、トルエン、ジオキサン、ポリハロゲン化脂肪族炭化水素のような乾燥不活性有機溶媒中、-20℃〜40℃の温度で行われる。反応は、30分〜36時間の範囲の時間内で完了する。
【0049】
2A.b) 上記で定義された式(1a')の化合物は、式(1d)
Hal-Y-COOH (1d)
の商業的に入手可能な酸を、アセトニトリルまたはテトラヒドロフラン(THF)のような適当な有機溶媒中、窒素下、暗所で、20℃〜80℃の温度範囲で、AgNO3と反応させることによって得られる。あるいは、AgNO3との反応は、アセトニトリルまたはTHFのような溶媒中、70〜180℃の範囲の温度で、短時間(1〜60分間)、マイクロウエーブ照射下で行われ得る。
【0050】
2A.c) アプラクロニジンとして知られている、式(IIIa)(ここで、Pは水素原子である)の化合物は商業的に入手可能であるか、またはUS 4,517,199に記載されているようにして合成され得る。ブリモニジンとして知られている、式IIIBの化合物は商業的に入手可能であるか、またはUS 3,890,319に記載されている方法に従って合成され得る。
【0051】
3A) 一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は-C(O)-であり、Yは上記で定義されたとおりである)の化合物は、
3A.a) 式(IIIa)または(IIIb)
【化16】

(式中、
PはH、またはt-ブトキシカルボニルおよびT. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているようなアミノ保護基である)の化合物を
【0052】
式(1a''):
Hal-C(O)-Y-ONO2 (1a'')
(式中、Yは上記で定義されたとおりであり、Halは塩素原子または臭素原子である)
の化合物と反応させること:
【0053】
3A.b) 得られた化合物の保護基を、1A.a)に記載されているように除去し、得られた一般式(I)の化合物を医薬的に許容されるその塩に任意に変換すること
を含む方法により得ることができる。
【0054】
式(IIIa)または(IIIb)(ここで、Pは上記で定義されたとおりである)の化合物と式(1a'')(ここで、YおよびHalは上記で定義されたとおりである)の化合物との反応は、DMF、THF、アセトンもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中0℃〜65℃の温度範囲か、または2相系H2O/Et2O中20℃〜40℃の温度範囲で、無機もしくは有機塩基の存在下;あるいはDMF、CH2Cl2のような溶媒中、DMAPおよびSc(OTf)3もしくはBi(OTf)3のようなルイス酸の存在下に行なわれる。
【0055】
3A.c) アプラクロニジンとして知られている、式(IIIa)(ここで、Pは水素原子である)の化合物は商業的に入手可能であるか、またはUS 4,517,199に記載されているようにして合成され得る。ブリモニジンとして知られている、式IIIBの化合物は商業的に入手可能であるか、またはUS 3,890,319に記載されている方法に従って合成され得る。
【0056】
3A.d) 式(1a'')(ここで、Halは上記で定義されたとおりである)の化合物は、酸(1b)
HOOC-Y-ONO2 (1b)
(ここで、Yは上記で定義されたとおりである)
を、トルエン、クロロホルム、DMFのような不活性な溶媒中、20℃〜40℃の温度範囲で、チオニルまたはオキサリルクロライド、PIIIまたはPVのハライドと反応させることにより得られる。
【0057】
3A.e) 上記で定義された式(1b)の化合物は、式(1d)
Hal-Y-COOH (1d)
の商業的に入手可能な酸を、アセトニトリルまたはテトラヒドロフラン(THF)のような適当な有機溶媒中、窒素下、暗所で、20℃〜80℃の温度範囲で、AgNO3と反応させることによって得られる。あるいは、AgNO3との反応は、アセトニトリルまたはTHFのような溶媒中、70〜180℃の範囲の温度で、短時間(1〜60分間)、マイクロウエーブ照射下で行われ得る。
【0058】
B) 一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は-C(O)O-であり、Yは上記で定義されたとおりである)の化合物は、
【0059】
1B) 式(IIIa)または(IIIb):
【化17】

(式中、
PはH、またはt-ブトキシカルボニルおよびT. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているようなアミノ保護基である)の化合物を
【0060】
式(1a.i):
Act-C(O)-O-Y-ONO2 (1a.i)
(式中、ActおよびYは上記で定義されたとおりである)
の化合物と、DMF、THF、アセトンもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基/DMAPの存在下;あるいはDMF、CH2Cl2のような溶媒中、DMAPおよびSc(OTf)3もしくはBi(OTf)3のようなルイス酸の存在下に反応させること;
【0061】
次いで、1A.a)で記載されたようにして、得られた化合物の保護基を除去すること;ならびに式(I)の得られた化合物を医薬的に許容される塩に任意に変換すること
を含む方法により得ることができる。
【0062】
1B.a) 上記で定義された式(1a.i)の化合物は、式(1e)
Act-C(O)-Hal (1e)
の化合物を、式(1f)
HO-Y-ONO2 (1f)
(式中、Yは上記で定義されたとおりである)
と、DMF、THFもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基の存在下に反応させることにより得られる。
【0063】
1B.b) 式(1f)の化合物は、式HO-Y-Hal (1f')(式中、YおよびHalは上記で定義されたとおりである)の商業的に入手可能な化合物を、窒素下、暗所、20℃〜80℃の温度範囲で、アセトニトリルまたはテトラヒドロフラン(THF)のような適当な有機溶媒中、AgNO3と反応させることにより得られる。あるいは、AgNO3との反応は、アセトニトリルまたはTHFのような溶媒中、100〜180℃の範囲の温度で、約1〜60分の範囲の時間、マイクロウエーブ照射下で行われ得る。
式(1f')の化合物は、商業的に入手可能であるか、または文献でよく知られた方法により得ることができる。
【0064】
1B.c) 上記で定義された式(1e)の化合物は、式(1c)
Act-H (1c)
(式中、Actは上記で定義されたとおりである)
をホスゲンおよびトリホスゲンのような誘導体と、DMF、THFまたはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲で、無機または有機塩基の存在下に反応させることにより得られる。
【0065】
C) 一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は-C(O)O-であり、Yは上記で定義されたとおりである)の化合物は、
【0066】
1C) 式(IIIa)または(IIIb):
【化18】

(式中、
PはH、またはt-ブトキシカルボニルおよびT. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているようなアミノ保護基である)の化合物を
【0067】
式(1a.ii):
Hal-C(O)-O-Y-ONO2 (1a.ii)
(式中、Halはハロゲン原子であり、好ましくはClであり、Yは上記で定義されたとおりである)
の化合物と、DMF、THFもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基/DMAPの存在下;あるいはDMF、CH2Cl2のような溶媒中、DMAPおよびSc(OTf)3もしくはBi(OTf)3のようなルイス酸の存在下に反応させること;
【0068】
次いで、1A.a)で記載されたようにして、得られた化合物の保護基を除去すること;ならびに式(I)の得られた化合物を医薬的に許容される塩に任意に変換すること
を含む方法により得ることができる。
【0069】
1C.a) アプラクロニジンとして知られている、式(IIIa)(ここで、Pは水素原子である)の化合物は商業的に入手可能であるか、またはUS 4,517,199に記載されているようにして合成され得る。ブリモニジンとして知られている、式IIIBの化合物は商業的に入手可能であるか、またはUS 3,890,319に記載されている方法に従って合成され得る。
【0070】
1C.b) 上記で定義された式(1a.ii)の化合物は、式(1f)
HO-Y-ONO2 (1f)
の化合物をホスゲンおよびトリホスゲンのようなその誘導体と、DMF、THFまたはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲で、無機または有機塩基の存在下に反応させることにより得られる。
1C.c) 式(1f)の化合物は、1B.b)で記載されているようにして得られる。
【0071】
D) 一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は
【化19】

であり、Yは上記で定義されたとおりである)
の化合物は、
【0072】
1D) 式(IIIa)または(IIIb)
【化20】

(式中、
PはH、またはt-ブトキシカルボニルおよびT. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているようなアミノ保護基である)の化合物を
【0073】
式(1a.iii):
Hal-W4-OC(O)O-Y-ONO2 (1a.iii)
(式中、Halはハロゲン原子であり、W4は-CH2-または-CH(CH3)-である)の化合物と、DMF、THFもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基/DMAPの存在下に反応させること;
次いで、1A.a)で記載されたようにして、得られた化合物の保護基を除去すること
を含む方法により得ることができる。
【0074】
1D.a) 式(1a.iii)の化合物は、式(1g)
Hal-W4-OC(O)Hal (1g)
(式中、HalおよびW4は上記で定義されたとおりである)
の商業的に入手可能なハロアルキルハロカーボネートを、式(1f)
HO-Y-ONO2 (1f)
(式中、Yは上記で定義されたとおりである)
の化合物と、DMF、THFもしくはCH2Cl2のような非プロトン性極性または無極性溶媒中、0℃〜65℃の温度範囲で、無機または有機塩基の存在下に反応させることにより得られる。
1D.b) 式(1f)の化合物は、1B.b)で記載されたようにして得られる。
【0075】
E) 一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は-C(O)-または-C(O)O-であり、Yは上記で定義されたとおりである)の化合物は、
1E.a) 式(IIIa')または(IIIb')
【化21】

(式中、Qは塩素原子、臭素原子、ヨウ素原子、メシル、トシルから選択される)
の化合物を、硝酸銀、硝酸リチウム、硝酸ナトリウム、硝酸カリウム、硝酸マグネシウム、硝酸カルシウム、硝酸鉄、硝酸亜鉛またはテトラアルキルアンモニウム(ここで、アルキルはC1-C10アルキルである)のようなナイトレート(nitrate)源と、アセトニトリル、テトラヒドロフラン、メチルエチルケトン、酢酸エチル、DMFのような適当な有機溶媒中で反応させること(該反応は暗所、室温〜溶媒の沸点の温度範囲で行なわれる。好ましいナイトレート源は硝酸銀である。):次いで
【0076】
1E.b) 当分野で知られた方法で保護基を除去し、一般式(I)の得られた化合物を医薬的に許容される塩に任意に変換すること
を含む方法によって得ることができる。
【0077】
1E.c) 上記で定義された式(IIIa')または(IIIb')の化合物は、式(IIIa)および(IIIb)(ここで、Pは上記で定義されたとおりである)の化合物を、式(1h)
Act-C(O)-Y-Hal (1h)
の化合物または式(1l)
Act-C(O)-O-Y-Hal (1l)
(式中、Halはハロゲン原子であり、Act、Yは上記で定義されたとおりである)
の化合物と、DMF、THFもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基/DMAPの存在下、あるいはDMF、CH2Cl2のような溶媒中、DMAPおよびSc(OTf)3もしくはBi(OTf)3のようなルイス酸の存在下に反応させることにより得られる。
【0078】
1E.d) 上記で定義された式(1h)
Act-C(O)-Y-Hal (1h)
の化合物は、文献でよく知られたDCC、EDAC.HClのような縮合剤を用いる慣用のエステル化反応により、商業的に入手可能な(1c)
Act-H (1c)
を、式(1d)
HO(O)C-Y-Hal (1d)
の商業的に入手可能な化合物と反応させることにより得られる。
【0079】
上記で定義された式(1l)
Act-C(O)-O-Y-Hal (1l)
の化合物は、商業的に入手可能であるか、または1B.c)で記載されたようにして得られる式(1e)
Act-C(O)-Hal (1e)
を、式(1f')
HO-Y-Hal (1f')
の化合物と、DMF、THFもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基の存在下に反応させることにより得られる。
【0080】
1E.e) アプラクロニジンとして知られている、式(IIIa)(ここで、Pは水素原子である)の化合物は商業的に入手可能であるか、またはUS 4,517,199に記載されているようにして合成され得る。ブリモニジンとして知られている、式IIIBの化合物は商業的に入手可能であるか、またはUS 3,890,319に記載されている方法に従って合成され得る。
【0081】
F) あるいは、一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は-C(O)-または-C(O)O-であり、Yは上記で定義されたとおりである)の化合物は、
1F.a) 式(IIIa'')または(IIIb'')
【化22】

【0082】
(式中、
PはH、またはt-ブトキシカルボニルおよびT. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているようなアミノ保護基である)の化合物を、DMF、THFまたはCH2Cl2のような非プロトン性極性/無極性溶媒中、-60℃〜65℃の温度範囲で、トリフル酸無水物(triflic anhydride)/テトラアルキルアンモニウムナイトレート塩と反応させること;
【0083】
1F.b) 当分野で公知の方法を用いて保護基を除去すること;および式(I)の化合物を医薬的に許容される塩に任意に変換すること
を含む方法により得ることができる。
【0084】
1F.c) 式(IIIa'')または(IIIb'')の化合物は、式(IIIa)または(IIIb)(ここで、Pは上記で定義されたとおりである)の化合物を、式(1m)
Act-C(O)-Y-OH (1m)
の化合物、または式(1n)
Act-C(O)-O-Y-OH (1n)
の化合物(式中、ActおよびYは上記で定義されたとおりである)と、DMF、THFもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃で、無機もしくは有機塩基/DMAPの存在下;あるいはDMF、CH2Cl2のような溶媒中、DMAPおよびSc(OTf)3もしくはBi(OTf)3のようなルイス酸の存在下に反応させることにより得られる。
【0085】
1F.d) 式(1m)
Act-C(O)-Y-OH (1m)
の化合物は、文献でよく知られているDCC、EDAC.HClのような縮合剤を用いる慣用のエステル化反応により、商業的に入手可能な(1c)
Act-H (1c)
を、式(1o)
HOOC-Y-OH (1o)
の商業的に入手可能な化合物と反応させることにより得られる。
【0086】
式(1n)
Act-C(O)-O-Y-OH (1n)
の化合物は、商業的に入手可能であるか、または1B.c)で記載されたようにして得られる式(1e)
Act-C(O)-Hal (1e)
の化合物を、式(1j)
HO-Y-OH (1j)
の化合物と、DMF、THFもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基の存在下に反応させることにより得られる。
【実施例】
【0087】
【化23】

【0088】
試薬と条件:a) AgNO3, CH3CN, r.r., 24時間; b) トリホスゲン, Et3N, ベンゼン, 0〜20℃, 12時間; c) Et3N, DMF, 40時間.
略語:
DMF=N,N-ジメチルホルムアミド
DCM=メチレンクロライド
Et2O=ジエチルエーテル
Et3N=トリエチルアミン
TFA=トリフルオロ酢酸
【0089】
実施例1
2-[5-ブロモ-キノキサリン-6-イルイミノ]-イミダゾリジン-1-カルボン酸 2-ニトロオキシ-エチルエステル
2-ニトロオキシ-エタノール(B-13)
【化24】

【0090】
乾燥CH3CN(5.0 mL)中の2-ブロモ-エタノール(2.5 g, 20 mmol)の溶液に、乾燥CH3CN(20 mL)中のAgNO3(4.08 g, 24 mmol)の溶液を滴下した。溶液を暗所、室温で24時間撹拌した。反応混合物を濾過し、集められた固体をCH3CNで洗浄した。濾液を真空下に濃縮し、CH2Cl2で抽出した。有機層を真空下に蒸発し、Ziakas, G.N. et al, Bioorg. Med. Chem. 2005, 13, 6485-6492およびWO 2004/031372に報告されているものと同様のNMRを有する、淡黄色の油状物(1.07 g)として化合物B-13を得た。この粗生成物をさらに精製することなく、次の工程に用いた。
【0091】
2-ニトロオキシエチル クロロホルメート(B-14)
【化25】

【0092】
化合物B-13(1.07 g, 10 mmol)を、ベンゼン(10 mL)中のトリホスゲン(1.485 g, 5 mmol)の冷溶液に加えた。混合物を0℃で20分間以上撹拌した。反応混合物に、ベンゼン(5 mL)中のEt3N(1.01 g, 10 mmol)の溶液を滴下した。溶液を室温に温め、一晩撹拌した。乾燥窒素気流を通すバブリングにより過剰のホスゲンを除去した。反応混合物を蒸発し、残渣をEt2O中に溶解し、塩を除くために濾過した。集められた固体をEt2Oで洗浄した。合わせた濾液を真空下で蒸発し、淡黄色油状物(1.75 g)として化合物B-14を得た。粗生成物をさらに精製することなく、次の工程に用いた。
【0093】
2-[5-ブロモ-キノキサリン-6-イルイミノ]-イミダゾリジン-1-カルボン酸 2-ニトロオキシ-エチルエステル
DMF(8.0 mL)中のA-3(120 mg, 0.411 mmol)の溶液に、Et3N(166 mg, 1. 643 mmol)を加え、続いてEt2O(0.5 mL)中のB-14(140 mg, 0.822 mmol)の溶液を滴下した。溶液を65℃で4時間、次いで室温で40時間撹拌した。混合物を真空下に蒸発し、CH2Cl2に溶解した。粗生成物を分取(preparative)TLC(DCM/石油エーテル/EtOAc = 2:2:0.5で溶出)で精製し、白色固体(59 mg, 収率34%)として化合物Bを得た。アシル化が、環の間の環外窒素ではなく、環上で起こったかどうかを決定するため、Kosasayama, A.; et al Chem, Pharm. Bull. Jpn. 1979, 831-840に類縁化合物で報告されているように、2D ROSY 1HNMR実験は、以下に示したように、環とエトキシの水素の相互作用を示した。このことは、代わりの位置異性体の可能性を完全に除外しないが、実験的に見られる相互作用を観測するためには、分子力学計算は、より高いエネルギーの立体配座が選ばれなければならないことを示している。
【0094】
【化26】

【0095】
HPLC:純度98.3%.カラム:Luna 5μ C18 (2);保持時間:8.440分;移動相:メタノール:0.01%TFA水溶液=25:75, 波長:254 nm.
1H NMR (400 MHz, CDCl3):δ 3.97 (m, 4H, =N-CH2-CH2-NCO), 4.60 (t, J=4.0 Hz, 2H, COOCH2), 4.81 (t, J=4.0 Hz, 2H, CH2ONO2), 8.09 (d, J=9.6 Hz, 1H, Ar-H), 8.77 (d, J=1.6 Hz, 1H, =N-CH=CH-N=), 8.91 (d, J=1.6 Hz, 1H, =N-CH=CH-N=), 9.28 (d, J=9.6 Hz, 1H, Ar-H), 10.35 (s, 1H, -NH-).
MS (M+Na+):447.2
【0096】
【化27】

試薬および条件:a) ZnNO3, DCC, CH3CN, r.t.; b) トリホスゲン, Et3N, ベンゼン, 0〜20℃, 12時間; c) Et3N, DMF, 64時間.
【0097】
実施例2
2-[5-ブロモ-キノキサリン-6-イルイミノ]-イミダゾリジン-1-カルボン酸 4-ニトロオキシ-ブチルエステル
4-ニトロオキシ-ブタノール(A-11)
【化28】

【0098】
Environ. Sci. Technol. 2000, 34, 1197-1203からの製造法に従って、硝酸亜鉛6水和物(15 g)およびアセトニトリル(125 mL)の混合物に1,4-ブタンジオール(20 mmol)、続いてN,N'-ジシクロヘキシルカルボジイミド(10.3 g, 20 mmol)を加えた。反応混合物を氷-水浴で冷却し、次いで温め、室温で一晩撹拌した。白色の沈殿を濾別し、濾液を真空下に蒸発し、黄色の油状物(8.5 g)として化合物A-11を得た。粗生成物は、さらに精製することなく次の工程に用いられたが、引例に報告されたNMRデータと一致した。
1H NMR (400 MHz, CDCl3):δ 1.69 (m, 2H, -CH2-), 1.85 (m, 2H, -CH2-), 3.69 (t, 2H, J=6.0 Hz, CH2OH), 4.50 (t, 2H, J=6.0 Hz, CH2ONO2).
【0099】
4-ニトロオキシブチル クロロホルメート(A-12)
【化29】

【0100】
アルコールA-11(0.7 g)をベンゼン(5 mL)中のトリホスゲン(0.77 g)の冷溶液に加えた。混合物を20分間以上、0℃で撹拌した。ベンゼン(5 mL)中のEt3N(0.53 g)の溶液を反応混合物に滴下した。混合物を室温に温め、一晩撹拌した。過剰なホスゲンを乾燥窒素気流を通すバブリングにより除去した。次いで、反応混合物を蒸発し、残渣をEt2Oに溶解し、塩を除くために濾過した。集められた固体をEt2Oで洗浄した。合わせた濾液を真空下で蒸発し、淡黄色の油状物(0.5 g)として化合物A-12を得た。粗生成物をさらに精製することなく次の工程に用いた。
【0101】
2-[5-ブロモ-キノキサリン-6-イルイミノ]-イミダゾリジン-1-カルボン酸 4-ニトロオキシ-ブチルエステル
DMF(7.0 mL)中のA-3(96 mg)の溶液に、Et3N(133 mg)を加え、続いてEt2O(0.5 mL)中のA-12(260 mg)の溶液を滴下した。溶液を65℃で4時間、室温で64時間撹拌した。溶媒を真空下で蒸発し、残渣をCH2Cl2に溶解した。粗生成物を分取TLC(DCM/石油エーテル/EtOAc=2:2:0.5で溶出)で生成し、白色の固体(30 mg, 収率20%)として化合物Aを得た。この生成物の位置化学は、実施例1と類似と見なされた。
【0102】
HPLC:純度95.6%.カラム:Luna 5μ C18 (2);保持時間:2.576分;移動相:メタノール:0.01%TFA水溶液=48:52, 波長:254 nm.
1H NMR (400 MHz, CDCl3):δ 1.90-1.93 (m, 4H, -CH2-CH2-), 3.90-3.99 (m, 4H, =N-CH2-CH2-NCO), 4.37 (s, 2H, COOCH2), 4.56 (t, 2H, J=6.0 Hz, CH2ONO2), 8.09 (d, J=9.2 Hz, 1H, Ar-H), 8.78 (d, J=2.0 Hz, 1H, =N-CH=CH-N=), 8.92 (d, J=2.0 Hz, 1H, =N-CH=CH-N=), 9.31 (d, J=9.2 Hz, 1H, Ar-H), 10.49 (s, 1H, -NH-).
MS:453.
【技術分野】
【0001】
本発明は、α2-アドレナリン受容体アゴニストのニトロオキシ誘導体および眼疾患の治療、特に高眼圧および緑内障の治療のためのそれらの使用に関する。
【背景技術】
【0002】
緑内障は、40歳を超えた全人口の約2%に発生し、急速な視力損失に進行する前の何年もの間、無症候性である。
緑内障は、主として、開放隅角、閉塞隅角、または先天性として分類され、さらに、1次性および2次性として分類される。緑内障は種々の薬理学的および外科的アプローチで治療される。緑内障が眼高血圧に関連する場合、薬理学的治療は、アドレナリン作動性アゴニスト(エピネフリン、デペベフリン、アプラクロニジン)、コリン作動性アゴニスト(ピロカルピン)、β遮断薬(ベタキソロール、レボブノロール、チモロール)、炭酸脱水酵素阻害剤(アセタゾールアミド、クロルジラミド)または、最近では、プロスタグランジン類縁物質(ラタノプロスト、ビマトプロスト)およびα-アドレナリン作動性アゴニスト(ブリモニジン、アプラクロニジン)を含む。これらの薬理学的アプローチは、毛様体による房水の産生を阻害するか、小柱網を横切る房水流出を容易にするかのどちらかにより、IOPを正常血圧状態に戻すのに役立つ。特に、ブリモニジンおよびアプラクロニジンのようなα-アドレナリン作動性アゴニストは、房水の産生を減少することならびにブドウ膜強膜の流出を高めることによりIOPを制御する。
【0003】
α2-アドレナリン受容体アゴニストは、単独治療およびβ遮断薬に対する付加的治療の両方で、眼高血圧および視神経障害の治療にも用いられる。それらは、急性の圧力上昇(すなわち、アルゴンレーザー線維柱帯形成術、白内障外科手術、硝子体切除、周辺虹彩切除、嚢切開の前および後の圧力上昇)の予防的処置にも用いられる。これらの活性は、主に、眼のα2-アドレナリン受容体の活性化により、そのような活性化は、房水の産生の減少およびブドウ膜強膜の流出の増加をもたらす。(Curr Opin Ophtalmol 1997, 8(2); 42-49)
【0004】
α2-アドレナリン受容体アゴニストを含む点眼剤は、全身に吸収され、全身性低血圧、心拍数減少、口渇、眼瞼後退、結膜白化、充血、ほてり(burning)、ブドウ膜炎、タキフィラキシー、後部分(posterior segment)血管収縮、局所アレルギー様症候群、瞳孔直径増加、鬱、不安、倦怠感、悪心を含む副作用を生じ得ることが知られている。(Hoyng and van Beek, Drugs, 59: 411-434 (2000), Surv Ophtalmol 1996, 41 Suppl 1: S19-26)
【発明の開示】
【発明が解決しようとする課題】
【0005】
上記のように、緑内障を治療するために用いられる薬剤は、副作用を引き起こし得る。したがって、眼疾患および特に緑内障の治療において、安全でかつ効果的な選択的α2-アドレナリン受容体アゴニストに対する必要性がある。
【課題を解決するための手段】
【0006】
式(I)のα2-アドレナリン受容体アゴニストのニトロオキシ誘導体は、薬理活性および高められた忍容性に関して、元の化合物と比較して、著しく改善された全体的なプロファイルを有することが、驚くべきことに見出された。
【0007】
本発明の目的は、一般式(I):
A-X1-Y-ONO2 (I)
[式中、
Aは、
【化1】

から選択され、
【0008】
X1は次の意味:
-C(O)-、-C(O)O-、
【化2】

を有し、
【0009】
Yは次の意味:
a)
−ハロゲン原子、ヒドロキシ、-ONO2またはT0(ここで、T0は-OC(O)(C1-C10アルキル)-ONO2または-O(C1-C10アルキル)-ONO2である)からなる群から選択される1以上の置換基で任意に置換されていてもよい、直鎖状または分枝鎖状のC1-C20アルキレン、好ましくはC1-C10アルキレン;
−環が側鎖T(ここで、Tは1〜10の炭素原子を有する直鎖状または分枝鎖状のアルキルである)で任意に置換されていてもよい、シクロアルキレン環内に5〜7の炭素原子を有するシクロアルキレン;
【0010】
b)
【化3】

c)
【化4】

(ここで、nは0〜20の整数であり、好ましくはnは1〜10であり、n1は1〜20の整数であり、好ましくはn1は1〜10である);
【0011】
d)
【化5】

(ここで、n1は上記で定義されたとおりであり、n2は0〜2の整数であり;X2 = -OCO-または-COO-であり、R2は水素原子またはCH3である);
【0012】
e)
【化6】

(ここで、n1、n2、R2およびX2は上記で定義されたとおりであり;
Y1は-CH2-CH2-または-CH=CH-(CH2)n2-である);
【0013】
f)
【化7】

(ここで、n1およびR2は上記で定義されたとおりであり、R3はHまたは-COCH3である);
但し、Yがb)〜f)で挙げられた2価の基から選択されるとき、-ONO2基は-(CH2)n1基に結合している;
【0014】
g)
【化8】

(ここで、X3は酸素原子または硫黄原子であり、好ましくはX3は酸素原子であり、n3は1〜6、好ましくは1〜4の整数であり、R2は上記で定義されたとおりである);
【0015】
h)
【化9】

(ここで、n4は0〜10の整数であり、
n5は1〜10の整数であり、
R4、R5、R6、R7は同一または異なって、H、または直鎖状もしくは分枝鎖状のC1-C4アルキルであり、好ましくはR4、R5、R6、R7はHであり、
【0016】
-ONO2基は
【化10】

(ここで、n5は上記で定義されたとおりである)
に結合しており、
【0017】
Y2は、窒素、酸素、硫黄から選択される1以上のヘテロ原子を含む、飽和、不飽和もしくは芳香族の、5員または6員の複素環であり、次の:
【化11】

から選択される)
を有する2価の基である]
のα2-アドレナリン受容体アゴニストのニトロオキシ誘導体、および医薬的に許容されるその塩または立体異性体である。
【0018】
本明細書で用いられる「C1-C20アルキレン」の語は、分枝鎖状または直鎖状のC1-C20、好ましくはメチレン、エチレン、プロピレン、イソプロピレン、n-ブチレン、ペンチレン、n-ヘキシレンなどのような1〜10の炭素原子を有する炭化水素を意味する。
【0019】
本明細書で用いられる「C1-C10アルキル」の語は、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、イソブチル、t-ブチル、ペンチル、ヘキシル、オクチルなどを含む、1〜10の炭素原子を含む、分枝鎖状または直鎖状のアルキル基を意味する。
【0020】
本明細書で用いられる「シクロアルキレン」の語は、直鎖状または分枝鎖状の(C1-C10)アルキル、好ましくはCH3のような側鎖で任意に置換されていてもよい、非限定的にシクロペンチレン、シクロへキシレンを含む、5〜7の炭素原子を有する環を意味する。
【0021】
本明細書で用いられる「複素環式」の語は、例えばピリジン、ピラジン、ピリミジン、ピロリジン、モルホリン、イミダゾールなどのような、窒素、酸素、硫黄から選択される1以上のヘテロ原子を含む、飽和、不飽和もしくは芳香族の、5員または6員の環を意味する。
【0022】
式(I)の好ましいニトロオキシ誘導体は以下のとおりである:
【化12−1】

【0023】
【化12−2】

【0024】
【化12−3】

【0025】
【化12−4】

【0026】
【化12−5】

【0027】
【化12−6】

【0028】
【化12−7】

【0029】
【化12−8】

【0030】
【化12−9】

【0031】
【化12−10】

【0032】
本発明のもう1つの目的は、医薬の分野で通常用いられる無毒性の佐剤および/または担体と一緒に、本発明の式(I)の化合物を少なくとも1つ含む医薬組成物である。
好ましい投与経路は局所である。
【0033】
本発明の化合物は、眼科的に許容される媒体中の溶液、懸濁液またはエマルジョン(分散液)として投与され得る。本明細書で用いられる「眼科的に許容される媒体」の語は、本化合物と非反応性で患者への投与に適したあらゆる物質または物質の組み合わせを意味する。
患者の眼への局所適用に適した水性媒体が好ましい。
【0034】
本発明の眼科組成物中に用いるのに望ましいその他の成分は、抗菌剤、保存剤、助溶剤、界面活性剤および粘性構築剤(viscosity building agent)である。
【0035】
本発明は、緑内障または高眼圧症を治療する方法にも関し、該方法は、眼圧を減少し、減少されたレベルに眼圧を維持するために、効果的に眼内圧を減少させる組成物の量を眼と接触することにある。
【0036】
本発明の化合物の用量は、標準的な臨床方法によって決定され得る。そして、それは、Physician's Desk Reference, Medical Economics Company, Inc., Oradell, N.J., 58th Ed., 2004; The pharmacological basis of therapeutics, Goodman and Gilman, J. G. Hardman, L. e. Limbird, Tenth Ed.に報告されているように、対応する無誘導の市販化合物に対して記載されている量と同じ範囲かまたはそれより少ない。
治療は、約30μlに相当する組成物の1滴が、1日当り患者の眼に約数回、例えば1〜3回投与される状態で有利に行われ得る。
【0037】
本発明の化合物は、別々にまたは組み合わせてのいずれかで、緑内障または高眼圧症の治療に役立つその他の公知の医薬と一緒に用いられ得ることがさらに考えられる。例えば、本発明の化合物は、(i)チモロール、ベタキソロール、レボブノロールなどのようなβ遮断薬(U.S.特許番号4,952,581を参照);(ii)ブリンゾールアミドのような炭酸脱水酵素阻害剤と組み合わされ得る。
上で報告された化合物のニトロオキシ誘導体、例えば、U.S.特許番号6,242,432に記載されたようなβ遮断薬のニトロオキシ誘導体との組み合わせも考えられる。
【0038】
本発明の化合物は、次のように合成され得る。
A) 一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は-C(O)-であり、Yは上記で定義されたとおりである)の化合物は、
【0039】
1A) 式(IIIa)または(IIIb):
【化13】

(式中、
PはH、またはt-ブトキシカルボニルおよびT. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているようなアミノ保護基である)の化合物を
【0040】
式(1a):
Act-C(O)-Y-ONO2 (1a)
(式中、Yは上記で定義されたとおりであり、Actは、
【化14】

のようなペプチド化学で用いられるカルボン酸活性化基である)
の化合物と反応させること、
【0041】
1A.a) T. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているように、ジオキサン中のHClまたはトルフルオロ酢酸のような強酸の存在下、得られた化合物の保護基を除去すること、および得られた一般式(I)の化合物を医薬的に許容されるその塩に任意に変換すること
を含む方法により得ることができる。
【0042】
式(IIIa)または(IIIb)(ここで、Pは上記で定義されたとおりである)の化合物の、式(1a)(ここで、Yは上記で定義されたとおりであり、Actは上記で定義されたようにペプチド化学で用いられるカルボン酸活性化基である)の化合物との反応は、DMF、THF、アセトンもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基の存在下;あるいはDMF、CH2Cl2のような溶媒中、DMAPおよびSc(OTf)3もしくはBi(OTf)3のようなルイス酸の存在下に行なわれ得る。
【0043】
1A.b) アプラクロニジンとして知られている、式(IIIa)(ここで、Pは水素原子である)の化合物は商業的に入手可能であるか、またはUS 4,517,199に記載されているようにして合成され得る。ブリモニジンとして知られている、式IIIBの化合物は商業的に入手可能であるか、またはUS 3,890,319に記載されている方法に従って合成され得る。
【0044】
1A.c) 式(1a)(ここで、Actは、上記で定義されたとおり、ペプチド化学で用いられるカルボン酸活性化基である)の化合物は、文献中でよく知られているように、DCC、EDAC.HClのような縮合剤を用いる通常のエステル化反応により、酸(1b)
HOOC-Y-ONO2 (1b)
(ここで、Yは上記で定義されたとおりである)
を商業的に入手可能な化合物(1c)
Act-H (1c)
(ここで、Actは上記で定義されたとおりである)
と反応させることにより得られる。
【0045】
1A.d) 上記で定義された式(1b)の化合物は、式(1d)
Hal-Y-COOH (1d)
の商業的に入手可能な酸を、窒素下、暗所で、20℃〜80℃の温度範囲で、アセトニトリルまたはテトラヒドロフラン(THF)のような適当な有機溶媒中、AgNO3と反応させることにより得られる。あるいは、AgNO3との反応は、アセトニトリルまたはTHFのような溶媒中、70〜180℃の範囲の温度で、短時間(1〜60分間)、マイクロウエーブ照射下で行われ得る。
【0046】
2A) あるいは、一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は-C(O)-であり、Yは上記で定義されたとおりである)の化合物は、
2A.a) 式(IIIa)または(IIIb)
【化15】

(式中、
PはH、またはt-ブトキシカルボニルおよびT. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているようなアミノ保護基である)の化合物を
【0047】
式(1a'):
HO-C(O)-Y-ONO2 (1a')
(式中、Yは上記で定義されたとおりである)
の化合物と反応させ、次いで、1A.a)に記載されているように、得られた化合物の保護基を除去すること、および得られた一般式(I)の化合物を医薬的に許容される塩に任意に変換すること
を含む方法により得ることができる。
【0048】
式(IIIa)または(IIIb)(ここで、Pは上記で定義されたとおりである)の化合物の式(1a')(ここで、Yは上記で定義されたとおりである)の化合物との反応は、ジシクロヘキシルカルボジイミド(DCC)、N'-(3-ジメチルアミノプロピル)-N-エチルカルボジイミド塩酸塩(EDAC)のような縮合剤とN,N-ジメチルアミノピリジン(DMAP)のような触媒、またはベンゾトリアゾール-1-イルオキシ-トリス(ジメチルアミノ)ホスホニウム ヘキサフルオロホスフェート(BOP)とN-メチルモルホリン、N,N-ジイソプロピルアミンのような有機塩基の存在下で行なわれる。反応は、N,N'-ジメチルホルムアミド、テトラヒドロフラン、ベンゼン、トルエン、ジオキサン、ポリハロゲン化脂肪族炭化水素のような乾燥不活性有機溶媒中、-20℃〜40℃の温度で行われる。反応は、30分〜36時間の範囲の時間内で完了する。
【0049】
2A.b) 上記で定義された式(1a')の化合物は、式(1d)
Hal-Y-COOH (1d)
の商業的に入手可能な酸を、アセトニトリルまたはテトラヒドロフラン(THF)のような適当な有機溶媒中、窒素下、暗所で、20℃〜80℃の温度範囲で、AgNO3と反応させることによって得られる。あるいは、AgNO3との反応は、アセトニトリルまたはTHFのような溶媒中、70〜180℃の範囲の温度で、短時間(1〜60分間)、マイクロウエーブ照射下で行われ得る。
【0050】
2A.c) アプラクロニジンとして知られている、式(IIIa)(ここで、Pは水素原子である)の化合物は商業的に入手可能であるか、またはUS 4,517,199に記載されているようにして合成され得る。ブリモニジンとして知られている、式IIIBの化合物は商業的に入手可能であるか、またはUS 3,890,319に記載されている方法に従って合成され得る。
【0051】
3A) 一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は-C(O)-であり、Yは上記で定義されたとおりである)の化合物は、
3A.a) 式(IIIa)または(IIIb)
【化16】

(式中、
PはH、またはt-ブトキシカルボニルおよびT. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているようなアミノ保護基である)の化合物を
【0052】
式(1a''):
Hal-C(O)-Y-ONO2 (1a'')
(式中、Yは上記で定義されたとおりであり、Halは塩素原子または臭素原子である)
の化合物と反応させること:
【0053】
3A.b) 得られた化合物の保護基を、1A.a)に記載されているように除去し、得られた一般式(I)の化合物を医薬的に許容されるその塩に任意に変換すること
を含む方法により得ることができる。
【0054】
式(IIIa)または(IIIb)(ここで、Pは上記で定義されたとおりである)の化合物と式(1a'')(ここで、YおよびHalは上記で定義されたとおりである)の化合物との反応は、DMF、THF、アセトンもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中0℃〜65℃の温度範囲か、または2相系H2O/Et2O中20℃〜40℃の温度範囲で、無機もしくは有機塩基の存在下;あるいはDMF、CH2Cl2のような溶媒中、DMAPおよびSc(OTf)3もしくはBi(OTf)3のようなルイス酸の存在下に行なわれる。
【0055】
3A.c) アプラクロニジンとして知られている、式(IIIa)(ここで、Pは水素原子である)の化合物は商業的に入手可能であるか、またはUS 4,517,199に記載されているようにして合成され得る。ブリモニジンとして知られている、式IIIBの化合物は商業的に入手可能であるか、またはUS 3,890,319に記載されている方法に従って合成され得る。
【0056】
3A.d) 式(1a'')(ここで、Halは上記で定義されたとおりである)の化合物は、酸(1b)
HOOC-Y-ONO2 (1b)
(ここで、Yは上記で定義されたとおりである)
を、トルエン、クロロホルム、DMFのような不活性な溶媒中、20℃〜40℃の温度範囲で、チオニルまたはオキサリルクロライド、PIIIまたはPVのハライドと反応させることにより得られる。
【0057】
3A.e) 上記で定義された式(1b)の化合物は、式(1d)
Hal-Y-COOH (1d)
の商業的に入手可能な酸を、アセトニトリルまたはテトラヒドロフラン(THF)のような適当な有機溶媒中、窒素下、暗所で、20℃〜80℃の温度範囲で、AgNO3と反応させることによって得られる。あるいは、AgNO3との反応は、アセトニトリルまたはTHFのような溶媒中、70〜180℃の範囲の温度で、短時間(1〜60分間)、マイクロウエーブ照射下で行われ得る。
【0058】
B) 一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は-C(O)O-であり、Yは上記で定義されたとおりである)の化合物は、
【0059】
1B) 式(IIIa)または(IIIb):
【化17】

(式中、
PはH、またはt-ブトキシカルボニルおよびT. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているようなアミノ保護基である)の化合物を
【0060】
式(1a.i):
Act-C(O)-O-Y-ONO2 (1a.i)
(式中、ActおよびYは上記で定義されたとおりである)
の化合物と、DMF、THF、アセトンもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基/DMAPの存在下;あるいはDMF、CH2Cl2のような溶媒中、DMAPおよびSc(OTf)3もしくはBi(OTf)3のようなルイス酸の存在下に反応させること;
【0061】
次いで、1A.a)で記載されたようにして、得られた化合物の保護基を除去すること;ならびに式(I)の得られた化合物を医薬的に許容される塩に任意に変換すること
を含む方法により得ることができる。
【0062】
1B.a) 上記で定義された式(1a.i)の化合物は、式(1e)
Act-C(O)-Hal (1e)
の化合物を、式(1f)
HO-Y-ONO2 (1f)
(式中、Yは上記で定義されたとおりである)
と、DMF、THFもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基の存在下に反応させることにより得られる。
【0063】
1B.b) 式(1f)の化合物は、式HO-Y-Hal (1f')(式中、YおよびHalは上記で定義されたとおりである)の商業的に入手可能な化合物を、窒素下、暗所、20℃〜80℃の温度範囲で、アセトニトリルまたはテトラヒドロフラン(THF)のような適当な有機溶媒中、AgNO3と反応させることにより得られる。あるいは、AgNO3との反応は、アセトニトリルまたはTHFのような溶媒中、100〜180℃の範囲の温度で、約1〜60分の範囲の時間、マイクロウエーブ照射下で行われ得る。
式(1f')の化合物は、商業的に入手可能であるか、または文献でよく知られた方法により得ることができる。
【0064】
1B.c) 上記で定義された式(1e)の化合物は、式(1c)
Act-H (1c)
(式中、Actは上記で定義されたとおりである)
をホスゲンおよびトリホスゲンのような誘導体と、DMF、THFまたはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲で、無機または有機塩基の存在下に反応させることにより得られる。
【0065】
C) 一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は-C(O)O-であり、Yは上記で定義されたとおりである)の化合物は、
【0066】
1C) 式(IIIa)または(IIIb):
【化18】

(式中、
PはH、またはt-ブトキシカルボニルおよびT. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているようなアミノ保護基である)の化合物を
【0067】
式(1a.ii):
Hal-C(O)-O-Y-ONO2 (1a.ii)
(式中、Halはハロゲン原子であり、好ましくはClであり、Yは上記で定義されたとおりである)
の化合物と、DMF、THFもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基/DMAPの存在下;あるいはDMF、CH2Cl2のような溶媒中、DMAPおよびSc(OTf)3もしくはBi(OTf)3のようなルイス酸の存在下に反応させること;
【0068】
次いで、1A.a)で記載されたようにして、得られた化合物の保護基を除去すること;ならびに式(I)の得られた化合物を医薬的に許容される塩に任意に変換すること
を含む方法により得ることができる。
【0069】
1C.a) アプラクロニジンとして知られている、式(IIIa)(ここで、Pは水素原子である)の化合物は商業的に入手可能であるか、またはUS 4,517,199に記載されているようにして合成され得る。ブリモニジンとして知られている、式IIIBの化合物は商業的に入手可能であるか、またはUS 3,890,319に記載されている方法に従って合成され得る。
【0070】
1C.b) 上記で定義された式(1a.ii)の化合物は、式(1f)
HO-Y-ONO2 (1f)
の化合物をホスゲンおよびトリホスゲンのようなその誘導体と、DMF、THFまたはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲で、無機または有機塩基の存在下に反応させることにより得られる。
1C.c) 式(1f)の化合物は、1B.b)で記載されているようにして得られる。
【0071】
D) 一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は
【化19】

であり、Yは上記で定義されたとおりである)
の化合物は、
【0072】
1D) 式(IIIa)または(IIIb)
【化20】

(式中、
PはH、またはt-ブトキシカルボニルおよびT. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているようなアミノ保護基である)の化合物を
【0073】
式(1a.iii):
Hal-W4-OC(O)O-Y-ONO2 (1a.iii)
(式中、Halはハロゲン原子であり、W4は-CH2-または-CH(CH3)-である)の化合物と、DMF、THFもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基/DMAPの存在下に反応させること;
次いで、1A.a)で記載されたようにして、得られた化合物の保護基を除去すること
を含む方法により得ることができる。
【0074】
1D.a) 式(1a.iii)の化合物は、式(1g)
Hal-W4-OC(O)Hal (1g)
(式中、HalおよびW4は上記で定義されたとおりである)
の商業的に入手可能なハロアルキルハロカーボネートを、式(1f)
HO-Y-ONO2 (1f)
(式中、Yは上記で定義されたとおりである)
の化合物と、DMF、THFもしくはCH2Cl2のような非プロトン性極性または無極性溶媒中、0℃〜65℃の温度範囲で、無機または有機塩基の存在下に反応させることにより得られる。
1D.b) 式(1f)の化合物は、1B.b)で記載されたようにして得られる。
【0075】
E) 一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は-C(O)-または-C(O)O-であり、Yは上記で定義されたとおりである)の化合物は、
1E.a) 式(IIIa')または(IIIb')
【化21】

(式中、Qは塩素原子、臭素原子、ヨウ素原子、メシル、トシルから選択される)
の化合物を、硝酸銀、硝酸リチウム、硝酸ナトリウム、硝酸カリウム、硝酸マグネシウム、硝酸カルシウム、硝酸鉄、硝酸亜鉛またはテトラアルキルアンモニウム(ここで、アルキルはC1-C10アルキルである)のようなナイトレート(nitrate)源と、アセトニトリル、テトラヒドロフラン、メチルエチルケトン、酢酸エチル、DMFのような適当な有機溶媒中で反応させること(該反応は暗所、室温〜溶媒の沸点の温度範囲で行なわれる。好ましいナイトレート源は硝酸銀である。):次いで
【0076】
1E.b) 当分野で知られた方法で保護基を除去し、一般式(I)の得られた化合物を医薬的に許容される塩に任意に変換すること
を含む方法によって得ることができる。
【0077】
1E.c) 上記で定義された式(IIIa')または(IIIb')の化合物は、式(IIIa)および(IIIb)(ここで、Pは上記で定義されたとおりである)の化合物を、式(1h)
Act-C(O)-Y-Hal (1h)
の化合物または式(1l)
Act-C(O)-O-Y-Hal (1l)
(式中、Halはハロゲン原子であり、Act、Yは上記で定義されたとおりである)
の化合物と、DMF、THFもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基/DMAPの存在下、あるいはDMF、CH2Cl2のような溶媒中、DMAPおよびSc(OTf)3もしくはBi(OTf)3のようなルイス酸の存在下に反応させることにより得られる。
【0078】
1E.d) 上記で定義された式(1h)
Act-C(O)-Y-Hal (1h)
の化合物は、文献でよく知られたDCC、EDAC.HClのような縮合剤を用いる慣用のエステル化反応により、商業的に入手可能な(1c)
Act-H (1c)
を、式(1d)
HO(O)C-Y-Hal (1d)
の商業的に入手可能な化合物と反応させることにより得られる。
【0079】
上記で定義された式(1l)
Act-C(O)-O-Y-Hal (1l)
の化合物は、商業的に入手可能であるか、または1B.c)で記載されたようにして得られる式(1e)
Act-C(O)-Hal (1e)
を、式(1f')
HO-Y-Hal (1f')
の化合物と、DMF、THFもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基の存在下に反応させることにより得られる。
【0080】
1E.e) アプラクロニジンとして知られている、式(IIIa)(ここで、Pは水素原子である)の化合物は商業的に入手可能であるか、またはUS 4,517,199に記載されているようにして合成され得る。ブリモニジンとして知られている、式IIIBの化合物は商業的に入手可能であるか、またはUS 3,890,319に記載されている方法に従って合成され得る。
【0081】
F) あるいは、一般式(I)(ここで、Aは基(Ia)または(Ib)であり、X1は-C(O)-または-C(O)O-であり、Yは上記で定義されたとおりである)の化合物は、
1F.a) 式(IIIa'')または(IIIb'')
【化22】

【0082】
(式中、
PはH、またはt-ブトキシカルボニルおよびT. W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980に記載されているようなアミノ保護基である)の化合物を、DMF、THFまたはCH2Cl2のような非プロトン性極性/無極性溶媒中、-60℃〜65℃の温度範囲で、トリフル酸無水物(triflic anhydride)/テトラアルキルアンモニウムナイトレート塩と反応させること;
【0083】
1F.b) 当分野で公知の方法を用いて保護基を除去すること;および式(I)の化合物を医薬的に許容される塩に任意に変換すること
を含む方法により得ることができる。
【0084】
1F.c) 式(IIIa'')または(IIIb'')の化合物は、式(IIIa)または(IIIb)(ここで、Pは上記で定義されたとおりである)の化合物を、式(1m)
Act-C(O)-Y-OH (1m)
の化合物、または式(1n)
Act-C(O)-O-Y-OH (1n)
の化合物(式中、ActおよびYは上記で定義されたとおりである)と、DMF、THFもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃で、無機もしくは有機塩基/DMAPの存在下;あるいはDMF、CH2Cl2のような溶媒中、DMAPおよびSc(OTf)3もしくはBi(OTf)3のようなルイス酸の存在下に反応させることにより得られる。
【0085】
1F.d) 式(1m)
Act-C(O)-Y-OH (1m)
の化合物は、文献でよく知られているDCC、EDAC.HClのような縮合剤を用いる慣用のエステル化反応により、商業的に入手可能な(1c)
Act-H (1c)
を、式(1o)
HOOC-Y-OH (1o)
の商業的に入手可能な化合物と反応させることにより得られる。
【0086】
式(1n)
Act-C(O)-O-Y-OH (1n)
の化合物は、商業的に入手可能であるか、または1B.c)で記載されたようにして得られる式(1e)
Act-C(O)-Hal (1e)
の化合物を、式(1j)
HO-Y-OH (1j)
の化合物と、DMF、THFもしくはCH2Cl2のような非プロトン性極性/無極性溶媒中、0℃〜65℃の温度範囲か、または2相系H2O/Et2O中、20℃〜40℃の温度範囲で、無機もしくは有機塩基の存在下に反応させることにより得られる。
【実施例】
【0087】
【化23】

【0088】
試薬と条件:a) AgNO3, CH3CN, r.r., 24時間; b) トリホスゲン, Et3N, ベンゼン, 0〜20℃, 12時間; c) Et3N, DMF, 40時間.
略語:
DMF=N,N-ジメチルホルムアミド
DCM=メチレンクロライド
Et2O=ジエチルエーテル
Et3N=トリエチルアミン
TFA=トリフルオロ酢酸
【0089】
実施例1
2-[5-ブロモ-キノキサリン-6-イルイミノ]-イミダゾリジン-1-カルボン酸 2-ニトロオキシ-エチルエステル
2-ニトロオキシ-エタノール(B-13)
【化24】

【0090】
乾燥CH3CN(5.0 mL)中の2-ブロモ-エタノール(2.5 g, 20 mmol)の溶液に、乾燥CH3CN(20 mL)中のAgNO3(4.08 g, 24 mmol)の溶液を滴下した。溶液を暗所、室温で24時間撹拌した。反応混合物を濾過し、集められた固体をCH3CNで洗浄した。濾液を真空下に濃縮し、CH2Cl2で抽出した。有機層を真空下に蒸発し、Ziakas, G.N. et al, Bioorg. Med. Chem. 2005, 13, 6485-6492およびWO 2004/031372に報告されているものと同様のNMRを有する、淡黄色の油状物(1.07 g)として化合物B-13を得た。この粗生成物をさらに精製することなく、次の工程に用いた。
【0091】
2-ニトロオキシエチル クロロホルメート(B-14)
【化25】

【0092】
化合物B-13(1.07 g, 10 mmol)を、ベンゼン(10 mL)中のトリホスゲン(1.485 g, 5 mmol)の冷溶液に加えた。混合物を0℃で20分間以上撹拌した。反応混合物に、ベンゼン(5 mL)中のEt3N(1.01 g, 10 mmol)の溶液を滴下した。溶液を室温に温め、一晩撹拌した。乾燥窒素気流を通すバブリングにより過剰のホスゲンを除去した。反応混合物を蒸発し、残渣をEt2O中に溶解し、塩を除くために濾過した。集められた固体をEt2Oで洗浄した。合わせた濾液を真空下で蒸発し、淡黄色油状物(1.75 g)として化合物B-14を得た。粗生成物をさらに精製することなく、次の工程に用いた。
【0093】
2-[5-ブロモ-キノキサリン-6-イルイミノ]-イミダゾリジン-1-カルボン酸 2-ニトロオキシ-エチルエステル
DMF(8.0 mL)中のA-3(120 mg, 0.411 mmol)の溶液に、Et3N(166 mg, 1. 643 mmol)を加え、続いてEt2O(0.5 mL)中のB-14(140 mg, 0.822 mmol)の溶液を滴下した。溶液を65℃で4時間、次いで室温で40時間撹拌した。混合物を真空下に蒸発し、CH2Cl2に溶解した。粗生成物を分取(preparative)TLC(DCM/石油エーテル/EtOAc = 2:2:0.5で溶出)で精製し、白色固体(59 mg, 収率34%)として化合物Bを得た。アシル化が、環の間の環外窒素ではなく、環上で起こったかどうかを決定するため、Kosasayama, A.; et al Chem, Pharm. Bull. Jpn. 1979, 831-840に類縁化合物で報告されているように、2D ROSY 1HNMR実験は、以下に示したように、環とエトキシの水素の相互作用を示した。このことは、代わりの位置異性体の可能性を完全に除外しないが、実験的に見られる相互作用を観測するためには、分子力学計算は、より高いエネルギーの立体配座が選ばれなければならないことを示している。
【0094】
【化26】

【0095】
HPLC:純度98.3%.カラム:Luna 5μ C18 (2);保持時間:8.440分;移動相:メタノール:0.01%TFA水溶液=25:75, 波長:254 nm.
1H NMR (400 MHz, CDCl3):δ 3.97 (m, 4H, =N-CH2-CH2-NCO), 4.60 (t, J=4.0 Hz, 2H, COOCH2), 4.81 (t, J=4.0 Hz, 2H, CH2ONO2), 8.09 (d, J=9.6 Hz, 1H, Ar-H), 8.77 (d, J=1.6 Hz, 1H, =N-CH=CH-N=), 8.91 (d, J=1.6 Hz, 1H, =N-CH=CH-N=), 9.28 (d, J=9.6 Hz, 1H, Ar-H), 10.35 (s, 1H, -NH-).
MS (M+Na+):447.2
【0096】
【化27】

試薬および条件:a) ZnNO3, DCC, CH3CN, r.t.; b) トリホスゲン, Et3N, ベンゼン, 0〜20℃, 12時間; c) Et3N, DMF, 64時間.
【0097】
実施例2
2-[5-ブロモ-キノキサリン-6-イルイミノ]-イミダゾリジン-1-カルボン酸 4-ニトロオキシ-ブチルエステル
4-ニトロオキシ-ブタノール(A-11)
【化28】

【0098】
Environ. Sci. Technol. 2000, 34, 1197-1203からの製造法に従って、硝酸亜鉛6水和物(15 g)およびアセトニトリル(125 mL)の混合物に1,4-ブタンジオール(20 mmol)、続いてN,N'-ジシクロヘキシルカルボジイミド(10.3 g, 20 mmol)を加えた。反応混合物を氷-水浴で冷却し、次いで温め、室温で一晩撹拌した。白色の沈殿を濾別し、濾液を真空下に蒸発し、黄色の油状物(8.5 g)として化合物A-11を得た。粗生成物は、さらに精製することなく次の工程に用いられたが、引例に報告されたNMRデータと一致した。
1H NMR (400 MHz, CDCl3):δ 1.69 (m, 2H, -CH2-), 1.85 (m, 2H, -CH2-), 3.69 (t, 2H, J=6.0 Hz, CH2OH), 4.50 (t, 2H, J=6.0 Hz, CH2ONO2).
【0099】
4-ニトロオキシブチル クロロホルメート(A-12)
【化29】

【0100】
アルコールA-11(0.7 g)をベンゼン(5 mL)中のトリホスゲン(0.77 g)の冷溶液に加えた。混合物を20分間以上、0℃で撹拌した。ベンゼン(5 mL)中のEt3N(0.53 g)の溶液を反応混合物に滴下した。混合物を室温に温め、一晩撹拌した。過剰なホスゲンを乾燥窒素気流を通すバブリングにより除去した。次いで、反応混合物を蒸発し、残渣をEt2Oに溶解し、塩を除くために濾過した。集められた固体をEt2Oで洗浄した。合わせた濾液を真空下で蒸発し、淡黄色の油状物(0.5 g)として化合物A-12を得た。粗生成物をさらに精製することなく次の工程に用いた。
【0101】
2-[5-ブロモ-キノキサリン-6-イルイミノ]-イミダゾリジン-1-カルボン酸 4-ニトロオキシ-ブチルエステル
DMF(7.0 mL)中のA-3(96 mg)の溶液に、Et3N(133 mg)を加え、続いてEt2O(0.5 mL)中のA-12(260 mg)の溶液を滴下した。溶液を65℃で4時間、室温で64時間撹拌した。溶媒を真空下で蒸発し、残渣をCH2Cl2に溶解した。粗生成物を分取TLC(DCM/石油エーテル/EtOAc=2:2:0.5で溶出)で生成し、白色の固体(30 mg, 収率20%)として化合物Aを得た。この生成物の位置化学は、実施例1と類似と見なされた。
【0102】
HPLC:純度95.6%.カラム:Luna 5μ C18 (2);保持時間:2.576分;移動相:メタノール:0.01%TFA水溶液=48:52, 波長:254 nm.
1H NMR (400 MHz, CDCl3):δ 1.90-1.93 (m, 4H, -CH2-CH2-), 3.90-3.99 (m, 4H, =N-CH2-CH2-NCO), 4.37 (s, 2H, COOCH2), 4.56 (t, 2H, J=6.0 Hz, CH2ONO2), 8.09 (d, J=9.2 Hz, 1H, Ar-H), 8.78 (d, J=2.0 Hz, 1H, =N-CH=CH-N=), 8.92 (d, J=2.0 Hz, 1H, =N-CH=CH-N=), 9.31 (d, J=9.2 Hz, 1H, Ar-H), 10.49 (s, 1H, -NH-).
MS:453.
【特許請求の範囲】
【請求項1】
式(I):
A-X1-Y-ONO2 (I)
[式中、
Aは、
【化1】

から選択され、
X1は次の意味:
-C(O)-、-C(O)O-、
【化2】

を有し、
Yは次の意味:
a)
−ハロゲン原子、ヒドロキシ、-ONO2またはT0(ここで、T0は-OC(O)(C1-C10アルキル)-ONO2または-O(C1-C10アルキル)-ONO2である)からなる群から選択される1以上の置換基で任意に置換されていてもよい、直鎖状または分枝鎖状のC1-C20アルキレン、好ましくはC1-C10アルキレン;
−環が側鎖T(ここで、Tは1〜10の炭素原子を有する直鎖状または分枝鎖状のアルキルである)で任意に置換されていてもよい、シクロアルキレン環内に5〜7の炭素原子を有するシクロアルキレン;
b)
【化3】

c)
【化4】

(ここで、nは0〜20の整数であり、n1は1〜20の整数である);
d)
【化5】

(ここで、n1は上記で定義されたとおりであり、n2は0〜2の整数であり;X2 = -OCO-または-COO-であり、R2は水素原子またはCH3である);
e)
【化6】

(ここで、n1、n2、R2およびX2は上記で定義されたとおりであり;
Y1は-CH2-CH2-または-CH=CH-(CH2)n2-である);
f)
【化7】

(ここで、n1およびR2は上記で定義されたとおりであり、R3はHまたは-COCH3である);
但し、Yがb)〜f)で挙げられた2価の基から選択されるとき、-ONO2基は-(CH2)n1基に結合している;
g)
【化8】

(ここで、X3は酸素原子または硫黄原子であり、n3は1〜6の整数であり、R2は上記で定義されたとおりである);
h)
【化9】

(ここで、n4は0〜10の整数であり、
n5は1〜10の整数であり、
R4、R5、R6、R7は同一または異なって、H、または直鎖状もしくは分枝鎖状のC1-C4アルキルであり、-ONO2基は
【化10】

(ここで、n5は上記で定義されたとおりである)
に結合しており、
Y2は、窒素、酸素、硫黄から選択される1以上のヘテロ原子を含む、飽和、不飽和もしくは芳香族の、5員または6員の複素環であり、次の:
【化11】

から選択される)
を有する2価の基である]
の化合物、および医薬的に許容されるその塩または立体異性体。
【請求項2】
X1が-C(O)-または-C(O)O-であり、
Yが次の意味:
a)
−直鎖状または分枝鎖状のC1-C20アルキレン;
b)
【化12】

c)
【化13】

(ここで、nは0〜20の整数であり、
n1は1〜20の整数である);
g)
【化14】

(ここで、X3は酸素原子または硫黄原子であり、
n3は1〜6の整数であり、
R2は水素原子である)
を有する2価の基である、請求項1に記載の化合物。
【請求項3】
【化15−1】

【化15−2】

【化15−3】

【化15−4】

【化15−5】

【化15−6】

【化15−7】

【化15−8】

【化15−9】

【化15−10】

から選択される、請求項1または2に記載の化合物。
【請求項4】
医薬として使用するための、請求項1〜3のいずれかに記載の化合物。
【請求項5】
眼疾患の治療用医薬を製造するための、請求項1〜3のいずれかに記載の化合物の使用。
【請求項6】
高眼圧および緑内障の治療用医薬を製造するための、請求項1〜3のいずれかに記載の化合物の使用。
【請求項7】
医薬的に許容される担体、ならびに請求項1〜3のいずれかで定義された一般式(I)の化合物および/またはその塩もしくは立体異性体の医薬的有効量を含む医薬組成物。
【請求項8】
局所投与に適した形態にある、請求項7に記載の医薬組成物。
【請求項9】
眼疾患の治療のための、請求項7または8に記載の医薬組成物。
【請求項10】
一般式(I)の化合物が、眼科的に許容される媒体の溶液、懸濁液またはエマルジョンとして投与される、請求項7〜9のいずれかに記載の医薬組成物。
【請求項11】
請求項1で定義された式(I)の化合物と、(i)β遮断薬もしくは(ii)炭酸脱水酵素阻害薬またはそれらのニトロオキシ誘導体との混合物を含む医薬組成物。
【請求項1】
式(I):
A-X1-Y-ONO2 (I)
[式中、
Aは、
【化1】

から選択され、
X1は次の意味:
-C(O)-、-C(O)O-、
【化2】

を有し、
Yは次の意味:
a)
−ハロゲン原子、ヒドロキシ、-ONO2またはT0(ここで、T0は-OC(O)(C1-C10アルキル)-ONO2または-O(C1-C10アルキル)-ONO2である)からなる群から選択される1以上の置換基で任意に置換されていてもよい、直鎖状または分枝鎖状のC1-C20アルキレン、好ましくはC1-C10アルキレン;
−環が側鎖T(ここで、Tは1〜10の炭素原子を有する直鎖状または分枝鎖状のアルキルである)で任意に置換されていてもよい、シクロアルキレン環内に5〜7の炭素原子を有するシクロアルキレン;
b)
【化3】

c)
【化4】

(ここで、nは0〜20の整数であり、n1は1〜20の整数である);
d)
【化5】

(ここで、n1は上記で定義されたとおりであり、n2は0〜2の整数であり;X2 = -OCO-または-COO-であり、R2は水素原子またはCH3である);
e)
【化6】

(ここで、n1、n2、R2およびX2は上記で定義されたとおりであり;
Y1は-CH2-CH2-または-CH=CH-(CH2)n2-である);
f)
【化7】

(ここで、n1およびR2は上記で定義されたとおりであり、R3はHまたは-COCH3である);
但し、Yがb)〜f)で挙げられた2価の基から選択されるとき、-ONO2基は-(CH2)n1基に結合している;
g)
【化8】

(ここで、X3は酸素原子または硫黄原子であり、n3は1〜6の整数であり、R2は上記で定義されたとおりである);
h)
【化9】

(ここで、n4は0〜10の整数であり、
n5は1〜10の整数であり、
R4、R5、R6、R7は同一または異なって、H、または直鎖状もしくは分枝鎖状のC1-C4アルキルであり、-ONO2基は
【化10】

(ここで、n5は上記で定義されたとおりである)
に結合しており、
Y2は、窒素、酸素、硫黄から選択される1以上のヘテロ原子を含む、飽和、不飽和もしくは芳香族の、5員または6員の複素環であり、次の:
【化11】

から選択される)
を有する2価の基である]
の化合物、および医薬的に許容されるその塩または立体異性体。
【請求項2】
X1が-C(O)-または-C(O)O-であり、
Yが次の意味:
a)
−直鎖状または分枝鎖状のC1-C20アルキレン;
b)
【化12】

c)
【化13】

(ここで、nは0〜20の整数であり、
n1は1〜20の整数である);
g)
【化14】

(ここで、X3は酸素原子または硫黄原子であり、
n3は1〜6の整数であり、
R2は水素原子である)
を有する2価の基である、請求項1に記載の化合物。
【請求項3】
【化15−1】

【化15−2】

【化15−3】

【化15−4】

【化15−5】

【化15−6】

【化15−7】

【化15−8】

【化15−9】

【化15−10】

から選択される、請求項1または2に記載の化合物。
【請求項4】
医薬として使用するための、請求項1〜3のいずれかに記載の化合物。
【請求項5】
眼疾患の治療用医薬を製造するための、請求項1〜3のいずれかに記載の化合物の使用。
【請求項6】
高眼圧および緑内障の治療用医薬を製造するための、請求項1〜3のいずれかに記載の化合物の使用。
【請求項7】
医薬的に許容される担体、ならびに請求項1〜3のいずれかで定義された一般式(I)の化合物および/またはその塩もしくは立体異性体の医薬的有効量を含む医薬組成物。
【請求項8】
局所投与に適した形態にある、請求項7に記載の医薬組成物。
【請求項9】
眼疾患の治療のための、請求項7または8に記載の医薬組成物。
【請求項10】
一般式(I)の化合物が、眼科的に許容される媒体の溶液、懸濁液またはエマルジョンとして投与される、請求項7〜9のいずれかに記載の医薬組成物。
【請求項11】
請求項1で定義された式(I)の化合物と、(i)β遮断薬もしくは(ii)炭酸脱水酵素阻害薬またはそれらのニトロオキシ誘導体との混合物を含む医薬組成物。
【公表番号】特表2009−525970(P2009−525970A)
【公表日】平成21年7月16日(2009.7.16)
【国際特許分類】
【出願番号】特願2008−552815(P2008−552815)
【出願日】平成19年2月2日(2007.2.2)
【国際出願番号】PCT/EP2007/051017
【国際公開番号】WO2007/090793
【国際公開日】平成19年8月16日(2007.8.16)
【出願人】(398034032)ニコックス エス エイ (36)
【住所又は居所原語表記】Taissounieres HB4,1681 route des Dolines−BP313,06560 Sophia Antipolis−Valbonne,France
【出願人】(307020420)ファイザー,インコーポレーテッド (2)
【Fターム(参考)】
【公表日】平成21年7月16日(2009.7.16)
【国際特許分類】
【出願日】平成19年2月2日(2007.2.2)
【国際出願番号】PCT/EP2007/051017
【国際公開番号】WO2007/090793
【国際公開日】平成19年8月16日(2007.8.16)
【出願人】(398034032)ニコックス エス エイ (36)
【住所又は居所原語表記】Taissounieres HB4,1681 route des Dolines−BP313,06560 Sophia Antipolis−Valbonne,France
【出願人】(307020420)ファイザー,インコーポレーテッド (2)
【Fターム(参考)】
[ Back to top ]

