β−アミロイドフィブリル形成阻害剤として作用するスチリルベンゾフラン誘導体及びその製造方法
本発明は脳内でのβ−アミロイドフィブリル形成を効果的に阻害して退行性脳疾患の予防または治療に有用な新規化合物、その製造方法及びこれを有効成分として含む医薬組成物に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、β−アミロイドの蓄積によって生じる老人性プラークの形成を阻害する新規な化合物、その製造方法、及びこれを有効成分として含む退行性脳疾患の予防または治療用医薬組成物に関する。
【背景技術】
【0002】
老人性痴呆、脳卒中、及びパーキンソン病のような退行性脳疾患で苦しむ老人人口の増加は、このような疾患の予防及び治療に有効な薬剤または方法がまだ開発されていないため、深刻な社会的問題になっている。
【0003】
タクリン(Tackrin(登録商標),Warner−Lambert社製)、アリセプト(Aricept(登録商標),Eisai社製)、及びエクセロン(Excellon(登録商標),Novartis社製)のような商業的に入手可能なアルツハイマー病の治療剤は、β−アミロイドタンパク質自体の蓄積を遮断するのではなくアセチルコリンエステラーゼを抑制してコリン作動性神経伝達物質であるアセチルコリンの濃度を増加させて認知能を短期的に改善する作用をする。
【0004】
アルツハイマー病は特に深刻な老人性痴呆で、脳内でβ−アミロイドタンパク質の蓄積によって発生する神経毒性が主な病因であると知られている。即ち、β−アミロイドタンパク質前駆体(APP)がβ−及びγ−セクレターゼの作用によってβ−アミロイド42(Aβ42)単量体に変換され、このAβ42単量体が脳内に蓄積して漸次的にオリゴマー、プロトフィブリル、フィブリル及びプラークを形成する。従って、β−アミロイドを選択的に認識し、フィブリルの形成を遮断する治療剤の開発が要求されてきた。
【0005】
潜在的β−アミロイドとして、β−及びγ−セクレターゼ阻害剤、メタルキレート、β−アミロイドワクチン、スタチン系の薬物、及び非ステロイド抗炎症剤が研究された。β−アミロイドワクチンAN−1792(Elan)の研究によれば、β−アミロイドが過剰発現される遺伝子変形マウスにAN−1792を投与した際、β−アミロイドタンパク質の蓄積を阻害し、遺伝子変形マウスの脳内に形成されるアミロイドプラークを除去できる抗体が生成された:若いマウスでは老人性プラークの形成が阻害され、老いたマウスでは老人性プラーク形成の進行が遅延されると報告されている(Schenk,D.et al.,Nature 400,173(1999))。この研究によりオリゴマーまたは老人性プラークの形成を阻害する薬物がアルツハイマー性痴呆のような退行性脳疾患の予防または治療に有用であることが分かった。
【0006】
β−アミロイドに関連して考案された薬物は、作用点、作用機構、及び薬動力学に応じて治療剤と分子映像診断剤に分けられる。
【0007】
β−アミロイドフィブリルは90%のβ−アミロイド40(Aβ40)と10%のβ−アミロイド42(Aβ42)を含み(Bitan,G.et al.,Proc.Natl.Sci.U.S.A,100,330.,(2003)及びJan,A.etal.,J.Biol.Chem.,283,28176(2008))、β−アミロイド42は強い神経毒性で脳細胞の死滅に導く。その結果、β−アミロイド42は治療剤の主要作用点になり、β−アミロイド40は診断剤の主要作用点となる。作用機構の観点からみると、治療剤はアルファ−ヘリックスの構造を有する可溶性のモノマー及び低級のオリゴマーに作用し、フィブリルに比べて約5倍も高い神経毒性を有する不溶性のオリゴマーの生成を阻害する一方、診断剤はβ−シート構造(β−plated sheet)を有するため、不溶性のオリゴマーに対して高い結合親和度を示す。薬動力学的な観点での退行性脳疾患治療剤は、診断剤と異なる生体動力学的な特徴を有する。診断剤はラジオアイソトープの半減期中に患者の診断ができるような迅速な脳血管透過能が要求される。また、ターゲットと結合した診断剤の定量化のために診断後に残った診断剤に対する迅速な除去率(CL)が要求される(Mathis,C.A.et al.,Curr.Pharm.Design,10,1469(2004))。しかし、治療剤の場合は高い吸収力と共に、一定濃度以上の持続時間(area under the concentration versus time curve,AUC)が要求される。
【0008】
β−アミロイドフィブリル形成阻害に有用な数多くの化合物または抽出物が開示されており、その具体的な例としては、ヘキサデシル−N−メチルピペリジニウム(HMPBr)のような洗剤;ドキソルビシンのような坑癌・抗生剤;SKF−74652のようなベンゾフラン誘導体(Howlett,D.R.et al.,Biochem.J.,343,419(1999));プロピジウムのようなヒューマンアセチルコリンセクレターゼ(HuAchE)(Bartolini,M.et al.,Biochem.Pharmacol.,65,407(2003));イチョウ抽出物であるLB−152(Lin,S.et al.,Bioorg.Med.Chem.Lett.,14,1173(2004));カレーの抽出物であるクルクミン(Yang,F.et al.,J.Biol.Chem.,280,5892(2005));及びノルジヒドログアヤレチン酸(NDGA)(Ono,K.et al.,Biochem.Biophys.Res.Commun.,330,111(2005))が挙げられる。
【0009】
しかし、前記化合物及び抽出物のうち類似ペプチド化合物は分子量が高いため、生体内の有用性が低いとともに、安定性が劣化するという問題があり、坑癌抗生剤は長期服用時に副作用を誘発する。その上、このように報告された化合物及び抽出物は、脳血管障壁(BBB)を効果的に透過しなければならないという脳疾患治療剤の条件を満たさないと報告されている。
【0010】
そこで、本発明者は前記問題点を解消し、脳内でのβ−アミロイドフィブリルの蓄積に関する疾患の予防または治療に有効な新規化合物を開発するために努力し、特定スチリルベンゾフラン誘導体が副作用なくβ−アミロイド42に対して高い抑制効果を有し、増加した脳血管障壁浸透能を有することを見出した。
【発明の概要】
【0011】
したがって、本発明の目的はβ−アミロイドフィブリルの形成を効率よく阻害する新規な化合物またはその薬剤学的に許容可能な塩を提供することである。
【0012】
本発明の他の目的は前記化合物の製造方法を提供することである。
【0013】
本発明のさらに他の目的は前記化合物またはその薬剤学的に許容可能な塩を有効成分として含むβ−アミロイドフィブリルの形成阻害用医薬組成物を提供することである。
【0014】
本発明のさらに他の目的は前記化合物またはその薬剤学的に許容可能な塩を有効成分として含む退行性脳疾患の予防または治療用医薬組成物を提供することである。
【0015】
本発明の一様態によれば、下記化(I)の化合物またはその薬剤学的に許容可能な塩を提供する:
【化1】

【0016】
前記式中、
R1及びR2は、それぞれ独立的にH、OH、ハロゲン、C1−C3アルコキシ、C1−C3アルキル、一つ以上のハロゲンまたはヒドロキシ基を有する置換されたポリ(C1−C3アルコキシ)、または一つ以上のC1−C3アルキル基を有する置換されたピラニル(C1−C3アルコキシ)であり;
R3は、NH2、C1−C3アルキルアミノ、C1−C3ジアルキルアミノ、またはC1−C3アルコキシであり;
R4はHまたはC1−C3アルコキシである。
【0017】
本発明の他の一様態によれば、前記式(I)の化合物の製造方法を提供する。
【0018】
本発明のまた他の一様態によれば、前記式(I)の化合物またはその薬剤学的に許容可能な塩を有効成分とするβ−アミロイドフィブリル形成阻害用医薬組成物を提供する。
【0019】
本発明のさらに他の一様態によれば、前記式(I)の化合物またはその薬剤学的に許容可能な塩を有効成分とする退行性脳疾患の予防及び治療用医薬組成物を提供する。
【図面の簡単な説明】
【0020】
本発明の前記目的及びその他の目的並びにその特徴は、添付の図面と共に本発明に関する次の詳細な説明から明らかになる。
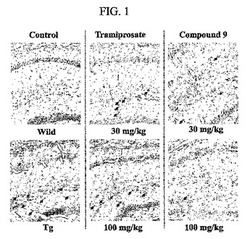
【図1】図1は実施例9の化合物及びトラミプロセート(比較化合物)によって染色された遺伝子変形マウスの海馬組職(hippocampus tissue)の写真図である。
【図2】図2は実施例9の化合物及びトラミプロセート(比較化合物)によって染色された遺伝子変形マウスの皮質の写真図である。
【発明の詳細な説明】
【0021】
本明細書において、用語「アルキル」は線型または分枝型飽和C1〜C3の炭化水素ラジカル鎖を意味する。「アルキル」の具体的な例としてはメチル、エチル、n−プロピル、及びイソプロピルが挙げられるが、これに限定されない。
【0022】
本明細書において、用語「アルコキシ」は−ORa基を意味し、ここでRaは前記定義したアルキルである。「アルコキシ」の具体的な例としてはメトキシ、エトキシ、n−プロポキシ及びイソプロポキシが挙げられるが、これに限定されない。
【0023】
本明細書において、用語「ハロゲン」はフルオロ(F)、クロロ(Cl)、ブロモ(Br)、またはヨード(I)を意味する。
【0024】
好ましくは、本発明による前記式(I)の化合物において、
R1及びR2は、それぞれ独立的にH、OH、ハロゲン、OCH3、CH3、(OCH2CH2)2F、(OCH2CH2)3F、またはジメチルピラニルメトキシであり;
R3は、NH2、NHCH3、N(CH3)2、またはOCH3であり;
R4はHまたはOCH3である。
【0025】
本発明による式(I)のスチリルベンゾフラン誘導体の更に好ましい例は次の通りである:
(1)2−(4−ジメチルアミノスチリル)ベンゾフラン;
(2)5−メトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(3)5−ヒドロキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(4)5−メチル−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(5)5−フルオロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(6)5−クロロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(7)5−ブロモ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(8)5−ヨード−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(9)6−メトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(10)6−ヒドロキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(11)6−メチル−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(12)6−フルオロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(13)6−クロロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(14)6−ブロモ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(15)6−ヨード−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(16)5−メトキシ−2−(4−アミノスチリル)ベンゾフラン;
(17)5−メトキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
(18)塩酸5−ヒドロキシ−2−(4−アミノスチリル)ベンゾフラン;
(19)塩酸5−ヒドロキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
(20)6−メトキシ−2−(4−アミノスチリル)ベンゾフラン;
(21)6−メトキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
(22)5−メトキシ−2−(3−メトキシ−4−ジメチルアミノスチリル)ベンゾフラン;
(23)6−メトキシ−2−(3−メトキシ−4−ジメチルアミノスチリル)ベンゾフラン;
(24)トリフルオロ酢酸2−(4−アミノスチリル)ベンゾフラン;
(25)トリフルオロ酢酸2−(4−メチルアミノスチリル)ベンゾフラン;
(26)2−(4−ジエチルアミノスチリル)ベンゾフラン;
(27)2−(4−メトキシスチリル)ベンゾフラン;
(28)2−(3,4−ジメトキシスチリル)ベンゾフラン;
(29)5−クロロ−2−(4−アミノスチリル)ベンゾフラン;
(30)5−クロロ−2−(4−メチルアミノスチリル)ベンゾフラン;
(31)5−クロロ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(32)5−クロロ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
(33)5−クロロ−2−(4−メトキシスチリル)ベンゾフラン;
(34)5−クロロ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
(35)5−メトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(36)5−メトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
(37)5−メトキシ−2−(4−メトキシスチリル)ベンゾフラン;
(38)5−メトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
(39)トリフルオロ酢酸5−メチル−2−(アミノスチリル)ベンゾフラン;
(40)トリフルオロ酢酸5−メチル−2−(4−メチルアミノスチリル)ベンゾフラン;
(41)5−メチル−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(42)5−メチル−2−(4−メトキシスチリル)ベンゾフラン;
(43)5−メチル−2−(3,4−ジメトキシスチリル)ベンゾフラン;
(44)5−(2−(2−フルオロエトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
(45)5−(2−(2−(2−フルオロエトキシ)エトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
(46)5−ヨード−2−(4−メチルアミノスチリル)ベンゾフラン;
(47)5−ヨード−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(48)5−ヨード−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
(49)5−ヨード−2−(4−メトキシスチリル)ベンゾフラン;
(50)5−ヨード−2−(3,4−ジメトキシスチリル)ベンゾフラン;
(51)5,6−ジメトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(52)5,6−ジメトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(53)5,6−ジメトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
(54)5,6−ジメトキシ−2−(4−メトキシスチリル)ベンゾフラン;
(55)5,6−ジメトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
(56)5−ヒドロキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(57)6−メトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(58)6−メトキシ−2−(4−メトキシスチリル)ベンゾフラン;
(59)6−メトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
(60)6−メトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
(61)トリフルオロ酢酸6−メチル−2−(4−アミノスチリル)ベンゾフラン;
(62)トリフルオロ酢酸6−メチル−2−(4−メチルアミノスチリル)ベンゾフラン;
(63)6−メチル−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(64)6−メチル−2−(4−メトキシスチリル)ベンゾフラン;
(65)6−メチル−2−(3,4−ジメトキシスチリル)ベンゾフラン;
(66)6−(2−(2−(2−フルオロエトキシ)エトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
(67)6−ヒドロキシ−2−(4−アミノスチリル)ベンゾフラン;
(68)6−ヒドロキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
(69)6−ヒドロキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(70)5,6−ジメトキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
(71)5−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−アミノスチリル)ベンゾフラン;
(72)5−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
(73)5−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(74)6−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−アミノスチリル)ベンゾフラン;
(75)6−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;及び
(76)6−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−ジメチルアミノスチリル)ベンゾフラン。
【0026】
本発明による式(I)の化合物は、塩酸、臭化水素酸、硫酸、リン酸、硝酸、酢酸、グリコール酸、乳酸、ピルビン酸、マロン酸、コハク酸、グルタル酸、フマル酸、リンゴ酸、マンデル酸、酒石酸、クエン酸、アスコルビン酸、パルミチン酸、マレイン酸、ヒドロキシマレイン酸、安息香酸、ヒドロキシ安息香酸、フェニル酢酸、桂皮酸、サリチル酸、メタンスルホン酸、ベンゼンスルホン酸、及びトルエンスルホン酸のような無機酸または有機酸からなる薬剤学的に許容可能な塩の形態で用いることができる。
【0027】
本発明のさらに他の態様によれば、ホーナーエモンズ反応(Honer−Emmons reaction)、すなわち、化(II)の2−(ジエトキシホスホリルメチル)ベンゾフランを塩基の存在下において有機溶媒中で下記化(III)のアルデヒドと反応させる段階を含む前記式(I)の化合物の製造方法を提供する:
【化2】

【0028】
前記式中、R1、R2、R3、及びR4は前記に定義した通りである。
【0029】
前記式(I)の化合物の製造方法を反応式1に図示する:
【化3】

【0030】
前記式中、R1、R2、R3、及びR4はそれぞれ前記に定義した通りである。
【0031】
具体的には、前記反応式1に示すように、前記式(I)の化合物は、前記式(II)の2−(ジエトキシホスホリルメチル)ベンゾフランを塩基の存在下において有機溶媒中で前記式(III)の置換されたアルデヒドと0℃〜室温で反応させることによって製造することができる。
【0032】
前記反応に用いられる塩基としては、アルカリ金属の水素化物(例えば、NaH、LiH、KH)、アルキルアルカリ金属化合物(例えば、n−BuLi)、アルカリ金属のアルコキシド化合物(例えば、ナトリウムメトキシド、ナトリウムエトキシド、ナトリウムイソプロポキシド、ナトリウムt−ブトキシド、カリウムt−ブトキシド、カリウムイソプロポキシド、リチウムイソプロポキシド)、アルカリ金属のアミド化合物(例えば、リチウムジイソプロピルアミド(LiN(i−Pr)2)、リチウムヘキサメチルジシリルアミド(LiHMDS)、カリウムヘキサメチルジシリルアミド(KHMDS)、ナトリウムヘキサメチルジシリルアミド(NaHMDS))、またはこれらの混合物が挙げられ、好ましくはカリウムt−ブトキシド及びナトリウムヘキサメチルジシリルアミドが用いられる。
【0033】
前記反応に有用な有機溶媒としては、テトラヒドロフラン、ジエチルエーテル、及びジイソプロピルエーテルのようなエーテルが挙げられる。
【0034】
前記反応に出発物質として用いられる式(II)の2−(ジエトキシホスホリルメチル)ベンゾフランは、反応式2に示される周知の方法(Asharm,M.J.Chem.Soc.Perkin Trans.,2,1662(2002);Michaelis,A.et. al.,Chem.Ber.,31,1048(1898);及びBhattacharya,A.K.et. al.,Chem.Rew.,81,415(1981))によって製造することができる。:
【化4】

【0035】
前記式中、R1及びR2は前記で定義した通りである。
【0036】
具体的には、前記反応式2の2−(ジエトキシホスホリルメチル)ベンゾフランは、塩基存在下での前記式(IV)の2−ヒドロキシベンズアルデヒドとエチルブロモアセテイトとの分子間アルドール/パーキン縮合反応(intramolecular Aldol/Perkin type condensation);水素化リチウムアルミニウムを用いた還元反応;リン酸トリブロマイドを用いた臭化反応;及びトリエチルホスファイトとの反応を順次用いて製造することができる。
【0037】
前記式(IV)のアルデヒド化合物の好ましい例として化(4a)〜(4o)の化合物を含む:
【化5】

【0038】
また、本発明の化合物(3)、(10)、(18)、及び(19)は、反応式3で表される通り、前記反応式1に従って製造された化合物をジクロロメタンなどの有機溶媒中で、ボロントリクロリド、ボロントリフルオリド、ボロントリブロマイド、またはヨードトリメチルシラン、好ましくはボロントリブロマイドを用いて−78℃〜室温で3〜5時間脱メチル化することによって製造することができる。
【化6】

【0039】
前記式中、R3は前記で定義した通りである。
【0040】
本発明の式(I)の化合物またはその薬剤学的に許容可能な塩は、β−アミロイドフィブリルの形成を効果的に阻害し、高水準の脳血管障壁透過能を示すことによって脳内でのβ−アミロイドフィブリルの蓄積を効果的に阻害する。その結果、本発明の化合物またはその薬剤学的に許容可能な塩は退行性脳疾患の予防または治療に有用である。
【0041】
したがって本発明は前記式(I)の化合物またはその薬剤学的に許容可能な塩を有効成分として含むβ−アミロイドフィブリルの形成阻害用医薬組成物を提供する。
【0042】
本発明は、また前記式(I)の化合物またはその薬剤学的に許容可能な塩を有効成分として含む退行性脳疾患の予防または治療用医薬組成物を提供する。
【0043】
本明細書において、用語「退行性脳疾患」とは β−アミロイドフィブリルの脳内蓄積によって惹起される疾患であって、例えば、老人性痴呆(例えば、アルツハイマー性痴呆)、脳卒中、パーキンソン病、及びハンチントン病が挙げられる。
【0044】
前記医薬組成物は、有効成分である式(I)の化合物またはその薬剤学的に許容可能な塩を医薬組成物の総重量に対して0.5〜10重量%、好ましくは0.5〜5重量%の量で含む。
【0045】
本発明の医薬組成物は、選択的に滅菌してもよく、また防腐剤、安定化剤、水和剤、乳化促進剤、浸透圧調節のための塩、緩衝剤、及びその他の治療学的活性化合物のような補助剤をさらに含んでいてもよい。本発明の医薬組成物は、混合、顆粒化またはコートのような通常の方法によって経口投与または非経口投与の形態として剤形化することができる。
【0046】
経口投与用剤形の例としては、錠剤、丸薬、硬・軟質−カプセル剤、液剤、懸濁液剤、乳化剤、シロップ剤、及び顆粒剤が挙げられる。これらの剤形は、前記活性成分とともに希釈剤(例えば、ラクトース、デキストロース、スクロース、マンニトール、ソルビトール、セルロース、グリシン)、潤滑剤(例えば、シリカ、タルク、ステアリン酸及びそのマグネシウムまたはカルシウム塩、及びポリエチレングリコール)を含んでいてもよい。
【0047】
前記錠剤は、結合剤(例えば、マグネシウムアルミニウム珪酸塩、でんぷん糊、ゼラチン、トラガカント、メチルセルロース、カルボキシメチルセルロースナトリウム、ポリビニルピロリジン)及び選択的には、崩壊剤または沸騰混合物(例えば、でんぷん、寒天、及びアルギン酸またはそのナトリウム塩)、吸収剤、着色剤、香味剤、及び甘味剤をさらに含むことができる。
【0048】
また、非経口投与用剤形の例としては注射投与用等張性水溶液または懸濁液を含んでいてもよい。
【0049】
本発明の化合物またはその薬剤学的に許容可能な塩は、活性成分として人間を含む哺乳動物に対して一日当り0.1〜30mg/kg、好ましくは0.5〜10mg/kg体重の有効量で1日1回または分割して経口または非経口的に投与することができる。
【0050】
以下に下記製造例及び実施例により本発明をさらに詳しく説明する。以下の製造例及び実施例は、本発明の例示の目的であって、本発明を限定するものではない。
【0051】
製造例1:5−メトキシ−2−(ジエトキシホスホリルメチル)ベンゾフラン(化2の化合物)
段階1:エチル5−メトキシ−2−ベンゾフランカルボキシレートの製造
ジメチルホルムアミドに溶解させた5−メトキシ−2−ヒドロキシベンズアルデヒド(化4bの化合物)7.61g(0.05mol)に、モレキュラーシーブ(molecular sieve)と炭酸カリウム15.2g(0.11mol)を加えて混合した。前記混合物にブロモ酢酸エチル16.7g(0.10mol)を滴下し、140℃で40分間還流させた。その後、炭酸カリウム15.2g(0.11mol)を添加し、得られた混合物を50分間還流させた後、モレキュラーシーブと、得られた沈殿物とを濾過して分離し、分離された固体を酢酸エチルで洗浄し、この洗浄液と濾液を混合して、減圧蒸留し、水と酢酸エチルの混合物で抽出した。有機層を分離して無水硫酸ナトリウムで乾燥し、濾過して減圧蒸留した。得られた残渣をカラムクロマトグラフィー(n−ヘキサン/酢酸エチル=9/1)で精製して標題化合物8.48g(収率77%)を得た。
【0052】
1H NMR(CDCl3,400MHz)δ7.42(m,2H),7.02(m,2H),4.39(q,2H,J=7.1Hz),3.79(s,3H),1.38(t,3H,J=7.1Hz)。
【0053】
段階2:5−メトキシ−2−ヒドロキシメチルベンゾフラン
水素化リチウムアルミニウム(0.85g、22.5mmol)を0℃でジメチルホルムアミドに溶解させた後、ここに、段階1で得られたエチル5−メトキシ−2−ベンゾフランカルボキシレート6.61g(0.03mol)をテトラヒドロフランに溶解して得られた溶液を添加して10分間0℃で攪拌した。反応終結後、得られた混合物に飽和硫酸ナトリウムを0℃で添加し、得られた沈殿物を濾過して除去した。余液を減圧蒸留して溶媒を除去し、残渣を水と酢酸エチルで抽出した。有機層を分離して無水硫酸ナトリウムで乾燥した後、減圧蒸留した。得られた残渣をカラムクロマトグラフィー(n−ヘキサン/酢酸エチル=3/1)により精製して標題化合物4.81g(収率90%)を得た。
【0054】
1H NMR(CDCl3,400MHz)δ7.31(d,1H,J=8.9Hz),6.96(s,1H),6.86(dd,1H,J=1.7,8.9Hz),6.53(s,1H),4.69(s,2H),3.81(s,3H),2.89(s,1H)。
【0055】
段階3:5−メトキシ−2−(ジエトキシホスホリルメチル)ベンゾフラン
ジメチルホルムアミドにリン酸トリブロマイド(8.12g,0.03mol)を0℃で添加した後、30分間0℃で攪拌した。ここに、段階2で得られた5−メトキシ−2−ヒドロキシメチルベンゾフラン3.56g(0.02mol)をジメチルホルムアミドに溶解して得られた溶液を添加して1時間0℃で攪拌した。反応終結後、反応混合物に炭酸ナトリウムと酢酸エチルを添加してpH7−8に中和した。得られた沈殿物を濾過して分離し、固体を酢酸エチルで洗滌した。洗浄液と余液を混合して得られた溶液を水と酢酸エチルの混合物で抽出した。有機層を分離し、無水硫酸ナトリウムで乾燥して濾過した後、減圧蒸留して5−メトキシ−2−ブロモメチルベンゾフラン化合物を得た。ここにトリエチルホスファイトを添加した後、3時間加熱還流した。反応終結後、トルエンを反応混合物に添加して減圧蒸留した。得られた残渣をカラムクロマトグラフィー(n−ヘキサン/酢酸エチル=1:1→酢酸エチル)により精製して標題化合物5.07g(収率85%)を得た。
【0056】
1H NMR(CDCl3,400MHz)δ7.31(d,1H,J=8.9Hz),6.97(d,1H,J=2.6Hz),6.84(dd,1H,J=2.6,8.9Hz),6.58(d,1H,J=3.9Hz)4.10(qn,4H,J=7.1Hz),3.82(s,3H),3.35(d,2H,J=21.3Hz),1.30(t,6H,J=7.1Hz)。
【0057】
実施例1:5−メトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物2)
製造例1で得られた5−メトキシ−2−(ジエトキシホスホリルメチル)ベンゾフラン0.30g(0.001mol)をテトラヒドロフランに溶解して得られた溶液に、0℃で1Mのヘキサメチルジシラザンナトリウム(NaHMDS)テトラヒドロフラン溶液を1.05当量で添加し、30分間攪拌した。ここに、4−ジメチルベンズアルデヒド0.16g(1.05mmol)をテトラヒドロフランに溶解して得られた溶液を添加した後、室温で2時間攪拌した。反応終結後、得られた混合物にメタノールを0℃で加えた。得られた混合物を減圧蒸留し、残渣を水と酢酸エチルの混合物で抽出した。有機層を分離して無水硫酸ナトリウムで乾燥して濾過し、溶媒を減圧蒸留して除去した後に残渣をメタノールで再結晶して標題化合物0.23g(収率80%)を得た。
【0058】
1H NMR(CDCl3,400MHz)δ7.43(d,2H,J=8.8Hz),7.33(d,1H,J=9.0Hz),7.23(d,1H,J=16.1Hz),6.97(d,1H,J=2.5Hz),6.84(dd,1H,J=2.6,8.8Hz),6.79(d,1H,J=16.1Hz),6.72(d,2H,J=8.8Hz),6.52(s,1H),3.85(s,3H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ157.0,155.9,150.4,149.7,130.5,130.0,127.9,124.8,112.3,112.1,111.0,103.4,103.1,55.9,40.4。
【0059】
実施例2:5−ヒドロキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物3)
実施例1で得られた5−メトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化2の化合物)146.7mg(0.5mmol)をジクロロメタンに溶解して得られた溶液に、−78℃で1Mボロントリブロマイドジクロロメタン溶液を10.0当量に添加し、室温で3時間攪拌した。反応終結後、ここに0℃で炭酸ナトリウムを添加してpH7−8で中和した。得られた溶液を水とジクロロメタンの混合物で抽出した。有機層を分離して無水硫酸ナトリウムで乾燥して濾過し、溶媒を減圧蒸留して除去した。得られた残渣に酢酸エチルを添加し、0℃で2NのHClを添加した。得られた沈殿物を濾過して分離した後、酢酸エチルで洗滌し、水で溶解させた。得られた溶液を0℃で炭酸水素カリウムで中和した後、酢酸エチルで抽出し、無水硫酸ナトリウムで乾燥した後、溶媒を減圧蒸留して除去した。得られた残渣をメタノールで再結晶して標題化合物69.8mg(収率50%)を得た。
【0060】
Mp:177.0−178.0℃
IR(KBr):3436,1602,1520,1358,1197,810cm−1
1H NMR(DMSO−d6,400MHz)δ9.10(s,1H),7.43(d,2H,J=7.8Hz),7.27(d,1H,J=8.5Hz),7.09(d,1H,J=16.1Hz),6.90(d,1H,J=16.1Hz),6.84(s,1H),6.67(m,4H),2.92(s,3H).
13C NMR(DMSO−d6,100MHz)δ156.6,153.8,150.8,148.7,130.5,130.3,128.4,127.4,113.1,112.6,112.3,111.1,105.5,103.9,40.0.
MSm/z279(M+)。
【0061】
実施例3〜70
それぞれ対応する出発物質を用いて実施例1及び/または2を繰り返して行うことによって、下記のような分析データをもつ実施例3〜70の化合物を製造した。
【0062】
実施例3:2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物1)
1H NMR(CDCl3,400MHz)δ7.49−7.43(m,4H),7.28−7.16(m,3H),6.82(d,1H,J=16.1Hz),6.73(d,2H,J=8.8Hz),6.57(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ156.1,154.7,150.7,130.7,129.5,127.9,124.8,123.9,122.7,120.4,112.3,112.1,110.7,103.2,40.4。
【0063】
実施例4:5−メチル−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物4)
Mp:188.0−189.0℃
IR(KBr):3437,1600,1518,1359,1184,814cm−1
1H NMR(CDCl3,400MHz)δ7.43(d,2H,J=8.8Hz),7.32(d,1H,J=8.3Hz),7.28(s,1H),7.23(d,1H,J=16.1Hz),7.04(d,1H,J=8.3Hz),6.79(d,1H,J=16.1Hz),6.72(d,2H,J=8.8Hz),6.50(s,1H),3.00(s,6H),2.42(s,3H).
13C NMR(CDCl3,100MHz)δ156.2,153.1,150.4,132.4,130.4,129.6,127.9,125.1,124.9,120.3,112.3,112.2,110.1,103.0,40.4,21.3.
MSm/z277(M+)。
【0064】
実施例5:5−フルオロ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物5)
1H NMR(CDCl3,400MHz)δ7.43(d,2H,J=8.8Hz),7.35(dd,1H,J=4.1,8.9Hz),7.26(d,1H,J=16.1Hz),7.14(dd,1H,J=2.6,8.6Hz),6.94(td,1H,J=2.6,9.0Hz),6.78(d,1H,J=6.78Hz),6.72(d,2H,J=8.8Hz),6.52(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ160.4,158.1,157.9,150.9,150.6,131.4,130.4,130.3,128.1,124.5,112.3,111.7,111.3,111.1,111.0,106.0,105.7,103.2,103.1,40.4.
実施例6:5−クロロ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物6)
1H NMR(CDCl3,400MHz)δ7.45(d,1H,J=2.1Hz),7.43(d,2H,J=8.8Hz),7.35(d,1H,J=8.7Hz),7.26(d,1H,J=16.2Hz),7.16(dd,1H,J=2.1,8.6Hz),6.77(d,1H,J=16.1Hz),6.72(d,2H,J=8.8Hz),6.50(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ157.6,153.1,150.6,131.7,130.9,128.2,128.1,124.5,123.9,117.9,112.3,111.9,111.5,102.4,40.3。
【0065】
実施例7:5−ブロモ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物7)
1H NMR(CDCl3,400MHz)δ7.60(s,1H),7.42(d,2H,J=8.4Hz),7.30−7.24(m,3H),6.77(d,1H,J=16.1Hz),6.71(d,2H,J=8.3Hz),6.49(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ157.5,153.4,150.8,131.8,131.6,128.1,126.6,124.4,122.9,115.7,112.3,112.0,111.4,102.3,40.3。
【0066】
実施例8:5−ヨード−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物8)
1H NMR(CDCl3,400MHz)δ7.81(d,1H,J=1.6Hz),7.49(dd,1H,J=1.7,8.5Hz),7.43(d,2H,J=8.8Hz),7.26(d,1H,J=16.1Hz),7.21(d,1H,J=8.6Hz),6.77(d,1H,J=16.2Hz),6.72(d,2H,J=8.8Hz),6.48(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ157.1,154.1,150.6,132.3,131.8,129.1,128.1,127.9,124.4,112.6,112.2,111.4,101.9,86.2,40.3。
【0067】
実施例9:6−メトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物9)
Mp:194.5−195.5℃
IR(KBr):3437,1602,1489,1356,1146,1107,820cm−1
1H NMR(CDCl3,400MHz)δ7.43(d,2H,J=8.8Hz),7.33(d,1H,J=9.0Hz),7.23(d,1H,J=16.1Hz),6.97(d,1H,J=2.5Hz),6.84(dd,1H,J=2.6,8.8Hz),6.79(d,1H,J=16.1Hz),6.72(d,2H,J=8.8Hz),6.52(s,1H),3.85(s,3H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ157.0,155.9,150.4,149.7,130.5,130.0,127.9,124.8,112.3,112.1,111.0,103.4,103.1,55.9,40.4.
MSm/z293(M+)。
【0068】
実施例10:6−ヒドロキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物10)
1H NMR(DMSO−d6,400MHz)δ9.53(s,1H),7.41(d,2H,J=8.3Hz),7.30(d,1H,J=8.3Hz),7.01(d,1H,J=16.1Hz),6.88(m,2H),6.67(m,4H),2.91(s,3H).
13C NMR(DMSO−d6,100MHz)δ156.1,155.8,154.7,150.6,128.9,128.1,124.7,121.5,121.1,112.7,112.5,112.1,104.0,97.8,40.0。
【0069】
実施例11:6−メチル−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物11)
1H NMR(CDCl3,400MHz)δ7.44(d,2H,J=8.5Hz),7.38(d,1H,J=7.8Hz),7.24(m,2H),7.03(d,1H,J=7.8Hz),6.81(d,1H,J=16.1Hz),6.75(d,2H,J=7.7Hz),6.53(s,1H),3.01(s,6H),2.48(s,3H).
13C NMR(CDCl3,100MHz)δ155.6,155.2,150.2,134.3,129.9,127.9,127.0,125.2,124.1,119.9,112.5,111.0,103.3,40.5,21.8。
【0070】
実施例12:6−フルオロ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物12)
1H NMR(CDCl3,400MHz)δ7.44−7.36(m,3H),7.22(d,1H,J=16.2Hz),7.17(dd,1H,J=1.6,9.0Hz),6.95(m,1H),6.77(d,1H,J=16.2Hz),6.72(d,2H,J=8.9Hz),6.53(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ161.9,159.5,157.0(d,2C),154.7,154.6,150.5,130.6,127.9,125.7,124.7,120.5,120.4,112.3,111.8,110.9,110.7,102.7,98.8,98.5,40.4.
実施例13:6−クロロ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物13)
1H NMR(CDCl3,400MHz)δ7.43(m,3H),7.39(d,1H,J=8.3Hz),7.24(d,1H,J=16.1Hz),7.16(dd,1H,J=1.8,8.3Hz),6.77(d,1H,J=16.1Hz),6.72(d,2H,J=8.9Hz),6.52(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ157.0,154.7,150.5,131.3,129.4,128.2,128.0,124.5,123.4,120.8,112.3,111.5,111.2,102.7,40.3。
【0071】
実施例14:6−ブロモ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物14)
1H NMR(CDCl3,400MHz)δ7.59(s,1H),7.42(d,2H,J=8.7Hz),7.34−7.22(m,3H),6.76(d,1H,J=16.1Hz),6.70(d,2H,J=8.6Hz),6.50(s,1H),3.00(s,6H).
13C NMR(CDCl3,100MHz)δ156.9,155.0,150.6,131.4,128.6,128.1,126.1,124.5,121.9,116.9,114.1,112.3,111.5,102.7,40.3。
【0072】
実施例15:6−ヨード−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物15)
1H NMR(CDCl3,400MHz)δ7.80(s,1H),7.48(dd,1H,J=1.3,8.1Hz),7.43(d,2H,J=8.8Hz),7.24(m,2H),6.77(d,1H,J=16.1Hz),6.72(d,2H,J=8.8Hz),6.51(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ156.6,155.2,150.6,131.7,131.5,129.2,128.1,124.5,121.7,119.9,112.3,111.4,102.7,86.9,40.3。
【0073】
実施例16:5−メトキシ−2−(4−アミノスチリル)ベンゾフラン(化合物16)
1H NMR(CDCl3,400MHz)δ7.38(d,1H,J=8.9Hz),7.29(d,2H,J=8.5Hz),7.07(m,2H),6.86(d,1H,J=16.2Hz),6.80(dd,1H,J=2.6,8.9Hz),6.68(s,1H),6.55(d,2H,J=8.5Hz),5.44(s,2H),3.75(s,3H).
13C NMR(CDCl3,100MHz)δ156.6,155.9,149.8,146.7,130.3,129.9,128.1,127.2,115.2,113.0,112.6,111.1,103.8,103.1,55.9。
【0074】
実施例17:5−メトキシ−2−(4−メチルアミノスチリル)ベンゾフラン(化合物17)
Mp:174.0−175.0℃
IR(KBr):3409,1602,1519,1201,1183,819cm−1
1H NMR(CDCl3,400MHz)δ7.38(d,2H,J=8.6Hz),7.33(d,1H,J=8.9Hz),7.2(d,1H,J=16.1Hz),6.97(d,1H,J=2.5Hz),6.83(dd,1H,J=2.6,8.8Hz),6.77(d,1H,J=16.1Hz),6.61(d,2H,J=8.5Hz),6.51(s,1H),3.85(s,3H),2.88(s,3H),1.55(s,3H).
13C NMR(CDCl3,100MHz)δ156.8,155.8,149.7,149.3,130.5,130.0,128.0,125.8,112.4,112.4,111.0,103.4,103.0,55.9,30.5.
MSm/z279(M+)。
【0075】
実施例18:塩酸5−ヒドロキシ−2−(4−アミノスチリル)ベンゾフラン(化合物18)
1H NMR(MeOD−d4,400MHz)δ7.74(d,2H,J=8.5Hz),7.39(d,2H,J=8.5Hz),7.28(m,2H),7.19(d,1H,J=16.2Hz),6.91(d,1H,J=2.4Hz),6.78(dd,1H,J=2.5,8.8Hz),6.73(s,1H).
13C NMR(MeOD−d4,100MHz)δ155.1,153.2,149.6,137.8,129.9,129.7,127.8,127.3,123.0,118.3,113.5,110.5,106.0,105.1。
【0076】
実施例19:塩酸5−ヒドロキシ−2−(4−メチルアミノスチリル)ベンゾフラン(化合物19)
1H NMR(MeOD−d4,400MHz)δ7.77(d,2H,J=8.6Hz),7.48(d,2H,J=8.6Hz),7.29(m,2H),7.21(d,1H,J=16.2Hz),6.91(d,1H,J=2.4Hz),6.79(dd,1H,J=2.5,8.8Hz),6.74(s,1H),3.09(s,1H).
13C NMR(MeOD−d4,100MHz)δ155.1,153.2,149.6,138.3,136.3,129.7,128.0,127.1,121.9,118.5,113.6,110.5,106.2,105.1,36.2。
【0077】
実施例20:6−メトキシ−2−(4−アミノスチリル)ベンゾフラン(化合物20)
1H NMR(CDCl3,400MHz)δ7.35(m,3H),7.15(d,1H,J=16.1Hz),7.02(d,1H,J=1.7Hz),6.83(dd,1H,J=2.2,8.5Hz),6.78(d,1H,J=16.1Hz),6.68(d,2H,J=8.4Hz),6.51(s,1H),3.86(s,3H),3.79(brs,2H).
13C NMR(CDCl3,100MHz)δ158.0,155.8,155.1,146.5,129.1,127.9,127.4,122.8,120.6,115.2,113.0,111.5,103.6,95.7,55.7。
【0078】
実施例21:6−メトキシ−2−(4−メチルアミノスチリル)ベンゾフラン(化合物21)
1H NMR(CDCl3,400MHz)δ7.37(m,3H),7.17(d,1H,J=16.1Hz),7.02(d,1H,J=2.0Hz),6.83(dd,1H,J=2.2,8.5Hz),6.77(d,1H,J=16.1Hz),6.61(d,2H,J=8.6Hz),6.46(s,1H),3.87(s,3H),2.88(s,3H).
13C NMR(CDCl3,100MHz)δ157.9,155.8,155.4,149.3,129.4,127.9,126.1,122.8,120.5,112.4,112.3,111.4,103.2,95.7,55.7,30.6。
【0079】
実施例22:5−メトキシ−2−(3−メトキシ−4−ジメチルアミノスチリル)ベンゾフラン(化合物22)
Mp:226.5−227.5℃
IR(KBr):3436,1595,1507,1470,1204,1167,834cm−1
1H NMR(CDCl3,400MHz)δ7.36−7.33(m,1H),7.10−7.07(m,1H),7.03(d,J=1.69Hz,1H),6.99(d,J=2.55Hz,1H)6.93−6.91(m,1H),6.58(s,1H),3.96(s,3H),3.85(s,3H),2.83(s,6H).
13C NMR(CDCl3,100MHz)δ156.29,155.98,152.29,149.83,142.84,130.76,130.23,129.83,129.65,120.21,118.01,117.44,114.47,113.81,104.46,103.27,103.17,55.90,55.39,43.20。
【0080】
MSm/z323(M+)。
【0081】
実施例23:6−メトキシ−2−(3−メトキシ−4−ジメチルアミノスチリル)ベンゾフラン(化合物23)
1H NMR(CDCl3,400MHz)δ7.38(d,J=8.46Hz,1H),7.19(d,J=16.09Hz),7.02(s,2H),6.87−6.83(m,2H),6.56(s,1H),6.56(s,1H),3.95(s,3H),3.87(s,3H),2.83(s,6H).
13C NMR(CDCl3,100MHz)158.18,155.88,154.80,152.31,142.62,131.03,128.98,122.65,120.74,120.01,118.03,114.55,111.62,108.54,104.25,95.74,55.74,55.38,43.23。
【0082】
実施例24:トリフルオロ酢酸2−(4−アミノスチリル)ベンゾフラン(化合物24)
1H NMR(400MHz,MeOD)δ7.70(d,2H,J=8.49Hz),7.57(d,1H,J=7.76Hz),7.48(d,1H,J=8.16Hz),7.35−7.29(m,4H),7.22(t,1H,J=7.49Hz),7.20(d,1H,J=16.23Hz),6.84(s,1H)。
【0083】
実施例25:トリフルオロ酢酸2−(4−メチルアミノスチリル)ベンゾフラン(化合物25)
1H NMR(400MHz,MeOD)δ7.60(d,2H,J=8.5Hz),7.52(d,1H,J=7.6Hz),7.44(d,1H,J=8.2Hz),7.26(d,1H,J=16.13Hz),7.26(t,1H,J=8.02Hz),7.18(t,1H,J=7.65Hz),7.09(d,2H,J=7.79Hz),7.07(d,1H,J=16.52Hz),6.75(s,1H),2.96(s,3H)。
【0084】
実施例26:2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物26)
1H NMR(400MHz,CDCl3)δ7.49(d,2H,J=7.18Hz),7.46−7.40(m,3H),7.27−7.16(m,2H),6.78(d,1H,J=16.06Hz),6.67(d,1H,J=7.86Hz),6.56(s,1H),3.40(d,4H,J=6.68Hz),1.20−1.18(m,6H)。
【0085】
実施例27:2−(4−メトキシスチリル)ベンゾフラン(化合物27)
1H NMR(400MHz,CDCl3)δ7,53−7.45(m,4H),7.37.24(m,2H),7.19(t,1H,J=8.44Hz),6.92(d,2H,J=8.78Hz),6.88(d,1H,J=16.15Hz),6.63(s,1H),3.83(s,3H)。
【0086】
実施例28:2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物28)
1H NMR(400MHz,CDCl3)δ7.52(d,1H,J=7.48Hz),7.46(d,1H,J=8.02Hz),7.29−7.24(m,3H),7.19(t,1H,J=8.73Hz),7.10−7.08(m,2H),6.88(d,2H,J=8.12Hz,J=4.6Hz),6.64(s,1H),3.94(d,6H,J=9.32Hz)。
【0087】
実施例29:5−クロロ−2−(4−アミノスチリル)ベンゾフラン(化合物29)
1H NMR(400MHz,DMSO)δ7.63(d,J=1.93Hz,1H),7.54(d,J=8.64Hz,1H),7.43(m,J=8.35Hz,2H),7.25(dd,J=8.69Hz,J=2.03Hz,1H),7.18(d,J=16.22Hz,1H),7.00(d,J=16.27Hz,1H),6.80(s,1H),6.75(d,J=8.15Hz,2H),3.93(s,2H)。
【0088】
実施例30:5−クロロ−2−(4−メチルアミノスチリル)ベンゾフラン(化合物30)
1H NMR(400MHz,DMSO)δ7.91(d,J=1.93Hz,1H),7.50(dd,J=6.72Hz,J=1.79Hz,1H),7.36(m,3H),7.15(d,J=16.19Hz,1H),7.91(d,J=16.20Hz,1H),6.72(s,1H),6.53(d,J=8.64Hz,2H),6.08(q,J=5.01Hz,1H),2.70(d,J=5.01Hz,3H)。
【0089】
実施例31:5−クロロ−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物31)
1H NMR(400MHz,CDCl3)δ7.65(d,J=2.12Hz,1H),7.40(d,J=8.82Hz,2H),7.34(d,J=8.6Hz1H),7.18(s,1H),6.77(s,1H),6.72(d,J=2.97Hz1H),6.67(d,J=8.87Hz2H),6.48(s,1H),3.40(q,J=7.08Hz,4H),1.19(t,J=7.02Hz,6H)。
【0090】
実施例32:5−クロロ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン(化合物32)
1H NMR(400MHz,DMSO)δ7.63(dd,J=13.45Hz,J=1.79Hz,1H),7.52(t,J=9Hz,1H),7.13(m,3H),6.82(m,1H),6.58(d,J=13.09Hz,1H),6.45(d,J=8.16Hz,1H),6.25(d,J=12.9Hz,1H),5.46(q,J=5.76Hz,1H),3.78(s,3H)2.73(d,J=5.01Hz,3H)。
【0091】
実施例33:5−クロロ−2−(4−メトキシスチリル)ベンゾフラン(化合物33)
1H NMR(400MHz,CDCl3)δ7.48(d,J=2.34Hz,1H),7.46(d,J=4.12Hz,1H),7.37(m,J=8.64Hz,1H),7.28(d,J=15.86Hz,1H),7.20(dd,J=8.65Hz,J=2.10Hz,1H),6.92(d,J=8.74Hz,2H),6.84(d,J=16.15Hz,1H),6.56(s,1H),3.85(s,3H)。
【0092】
実施例34:5−クロロ−2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物34)
1H NMR(400MHz,CDCl3)δ7.47(d,J=2.01Hz,1H),7.36(d,J=8.61Hz,1H),7.27(m,J=16.11Hz,1H),7.20(dd,J=8.64Hz,J=1.91Hz,1H),7.08(m,2H),6.85(m,2H),6.57(s,1H),3.95(s,3H),3.93(s,3H)。
【0093】
実施例35:5−メトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物35)
1H NMR(400MHz,CDCl3)δ7.40(d,J=8.8Hz,2H),7.32(d,J=8.8Hz,1H),7.16(d,J=16Hz,1H),6.96(d,J=2.8Hz,1H),6.83(dd,J=2.4,8.8Hz,1H),6.75(d,J=16Hz,1H),6.66(d,J=9.2Hz,2H),6.50(s,1H),3.84(s,3H),3.39(q,J=7.2Hz,4H),1.19(t,J=6.8Hz,6H)。
【0094】
実施例36:5−メトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン(化合物36)
1H NMR(400MHz,CDCl3)δ7.35(d,J=9.2Hz,1H),7.26(d,J=16Hz,1H),7.10(m,2H),7.04(s,1H),6.70(d,J=2.4Hz,1H),6.94(d,J=16Hz,1H),6.88(dd,J=2.8,8.8Hz,1H),6.63(s,1H),3.89(s,3H),3.85(s,3H),3.15(s,3H)。
【0095】
実施例37:5−メトキシ−2−(4−メトキシスチリル)ベンゾフラン(化合物37)
1H NMR(400MHz,CDCl3)δ7.46(d,J=8.8Hz,2H),7.34(d,J=8.8Hz,1H),7.24(d,J=16.4Hz,1H),6.98(d,J=2.8Hz,1H),6.91(d,J=8.8Hz,2H),6.85(d,J=16.4Hz,1H),6.84(d,J=2.8Hz,1H),6.57(s,1H),3.85(s,3H),3.84(s,3H)。
【0096】
実施例38:5−メトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物38)
1H NMR(400MHz,CDCl3)δ7.34(d,J=8.8Hz,1H),7.24(d,J=16Hz,1H),7.09(m,2H),6.99(d,J=2.8Hz,1H),6.88(d,J=2.8Hz,1H),6.87(m,1H),6.85(d,J=16Hz,1H),6.58(s,1H),3.95(s,3H),3.91(s,3H),3.85(s,3H)。
【0097】
実施例39:トリフルオロ酢酸5−メチル−2−(アミノスチリル)ベンゾフラン(化合物39)
1H NMR(400MHz,MeOD)δ7.64(d,2H,J=8.47Hz),7.32(d,2H,J=8.37Hz),7.26(d,1H,J=16.32Hz),7.23(d,1H,J=8.54Hz),7.14(s,1H),7.09(d,1H,J=7.94,Hz),6.72(s,1H),2.40(s,3H)。
【0098】
実施例40:トリフルオロ酢酸5−メチル−2−(4−メチルアミノスチリル)ベンゾフラン(化合物40)
1H NMR(400MHz,MeOD)δ7.60(d,2H,J=8.5Hz),7.31(d,2H,J=7.09Hz),7.24(d,1H,J=16.16Hz),7.13(d,2H,J=8.33Hz),7.09(s,1H),7.06(d,1H,J=10.49Hz),6.68(s,1H),3.00(s,3H),2.38(s,3H)。
【0099】
実施例41:5−メチル−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物41)
1H NMR(400MHz,CDCl3)δ7.41(d,2H,J=8.4Hz),7.33(d,1H,J=8.27Hz),7.29−7.26(m,1H),7.23(d,1H,J=16.11Hz),7.04(d,1H,J=8.08Hz),6.77(d,1H,J=16.08Hz),6.67(d,1H,J=8.38Hz),6.49(s,1H),3.40(d,4H,J=6.93Hz),2.43(s,3H),1.27−1.18(m,6H)。
【0100】
実施例42:5−メチル−2−(4−メトキシスチリル)ベンゾフラン(化合物42)
1H NMR(300MHz,CDCl3)δ7.48(d,2H,J=8.64Hz),7.34(d,1H,J=8.52Hz),7.37.23(m,2H),7.07(d,1H,J=8.1Hz),6.92(d,2H,J=8.7Hz),6.87(d,1H,J=16.17Hz),6.57(s,1H),3.86(s,3H),2.43(s,3H)。
【0101】
実施例43:5−メチル−2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物43)
1H NMR(300MHz,CDCl3)δ7.4(d,1H,J=7.85Hz),7.27−7.21(m,3H),7.17.08(m,2H),7.04(d,1H,J=7.98Hz),6.90(s,1H),6.86(d,1H,J=10.808Hz),6.60(s,1H),3.95(d,6H,J=7.97Hz),2.49(s,3H)。
【0102】
実施例44:5−(2−(2−フルオロエトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン(化合物44)
1H NMR(400MHz,CDCl3)δ7.42(d,J=8.4Hz,1H),7.37(d,J=8.4Hz,1H),7.31(d,J=8.4Hz,1H),7.20(d,J=16Hz,1H),6.98(d,J=1.6Hz,1H),6.84(dd,J=2.4,8.8Hz,1H),6.76(d,J=16Hz,1H),6.60(d,J=8.4Hz,2H),6.50(s,1H),4.61(dt,J=47.6,4.0Hz,2H),4.17(t,J=4.8,2H),3.90(m,3H),3.80(t,J=4.0Hz,1H),2.88(s,3H)。
【0103】
実施例45:5−(2−(2−(2−フルオロエトキシ)エトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン(化合物45)
1H NMR(400MHz,CDCl3)δ7.38(d,J=8.8Hz,1H),7.34(d,J=8.4Hz,1H),7.31(d,J=8.8Hz,1H),7.20(d,J=16Hz,1H),6.98(d,J=2.4Hz,1H),6.85(dd,J=2.8,8.8Hz,1H),6.76(d,J=16Hz,1H),6.60(d,J=8.8Hz,2H),6.50(s,1H),4.57(dt,J=47.6,4.0Hz,2H),4.16(t,J=4.8Hz,2H),3.88(t,J=4.8Hz,2H),3.76(m,4H),3.62(m,2H),2.10(s,3H).
13C NMR(100MHz,CDCl3)δ157.09,156.56,155.04,146.61,114.66,113.87,113.30,111.02,104.27,103.88,83.99,82.31,70.84,70.53,70.33,69.93,69.20,68.23,30.92。
【0104】
実施例46:5−ヨード−2−(4−メチルアミノスチリル)ベンゾフラン(化合物46)
1H NMR(400MHz,CDCl3)δ7.81(s,1H),7.46(dd,J=10.92Hz,J=1.39Hz,1H),7.37(d,J=8.53Hz,2H),7.21(d,J=10.61Hz,2H),7.07(s,1H),6.76(d,J=16.10Hz,1H),6.60(d,J=8.47Hz,2H),6.49(s,1H),3.95(s,1H),2.95(s,3H)。
【0105】
実施例47:5−ヨード−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物47)
1H NMR(400MHz,CDCl3)δ7.49(d,J=6.91Hz,1H),7.44(d,J=8.04Hz,1H),7.41(d,J=8.82Hz,2H),7.23(s,1H),7.19(m,1H),6.78(d,J=16.19Hz,1H),6.67(d,J=8.85Hz,2H),6.56(s,1H),3.40(q,J=7.07Hz,4H)1.20(t,J=7.04Hz,6H)。
【0106】
実施例48:5−ヨード−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン(化合物48)
1H NMR(400MHz,DMSO)δ7.52(m,2H),7.21(m,2H),7.01(q,J=13.80Hz,1H),6.90(s,1H),6.57(d,J=12.87Hz,1H),6.45(q,J=4.32Hz,1H),6.25(d,J=12.78Hz,1H),5.41(t,J=3.88Hz,1H),3.85(s,1H)3.73(s,2H),2.73(s,3H)。
【0107】
実施例49:5−ヨード−2−(4−メトキシスチリル)ベンゾフラン(化合物49)
1H NMR(400MHz,DMSO)δ7.59(d,J=7.55Hz1H),7.53(d,J=7.96Hz,1H),7.30(s,1H),7.25(t,J=8.24Hz,2H),7.20(d,J=4.93Hz,2H),7.15(d,J=8.2Hz,1H),6.95(d,J=8.29Hz,1H),6.87(s,1H),3.78(s,3H)。
【0108】
実施例50:5−ヨード−2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物50)
1H NMR(400MHz,DMSO)δ7.59(d,J=8.7Hz,2H),7.53(d,J=7.66Hz,1H),7.26(q,J=7.96Hz,1H),7.22(t,J=9.30Hz,1H),7.13(m,J=16.28Hz,1H),6.96(d,J=8.62Hz,1H),6.86(d,J=15.88Hz,1H),3.82(s,3H),3.77(s,3H)。
【0109】
実施例51:5,6−ジメトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物51)
1H NMR(400MHz,DMSO)δ7.36(d,J=18Hz,2H),7.21(d,J=9.8Hz,3H),7.12(s,1H),7.03(s,1H),6.93(s,1H),6.43(s,1H),3.85(s,3H),3.82(s,3H),3.80(s,3H)。
【0110】
実施例52:5,6−ジメトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物51)
1H NMR(400MHz,DMSO)δ7.36(d,J=18.12Hz,2H),7.21(d,J=9.8Hz,3H),7.12(s,1H),7.03(s,1H),6.93(s,1H),6.43(s,1H),3.85(s,5H),3.82(s,5H),3.80(s,3H),3.78(s,3H)。
【0111】
実施例53:5,6−ジメトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン(化合物53)
1H NMR(400MHz,DMSO)δ7.12(s,1H),6.98(d,J=6.24Hz,1H),7.00(m,2H),6.65(s,1H),6.42(d,J=8.2Hz,1H),5.35(q,J=4.96Hz,1H),3.79(s,3H),3.77(s,3H),3.74(s,3H),2.72(d,J=4.88Hz,3H)。
【0112】
実施例54:5,6−ジメトキシ−2−(4−メトキシスチリル)ベンゾフラン(化合物54)
1H NMR(400MHz,DMSO)δ7.52(d,J=8.62Hz,2H),7.20(s,1H),7.06(s,1H),7.05(s,2H),6.92(d,J=8.58Hz,2H),6.73(s,1H),3.96(s,3H),3.92(s,6H)。
【0113】
実施例55:5,6−ジメトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物55)
1H NMR(400MHz,CDCl3)δ7.54(s,1H),7.06(m,3H),7.00(s,1H),6.86(m,2H),6.58(s,1H),3.98(s,3H),3.95(s,3H),3.93(s,3H),3.92(s,3H)。
【0114】
実施例56:5−ヒドロキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物56)
1H NMR(400MHz,CDCl3)δ7.39(d,J=8.4Hz,2H),7.28(d,J=8.8Hz,1H),7.21(d,J=16Hz,1H),6.90(d,J=2.4Hz,1H),6.74(d,J=16Hz,1H),6.72(dd,J=2.4,8Hz,1H),6.66(d,J=8.8Hz,2H),6.46(s,1H),4.59(s,OH),3.39(q,J=7.2Hz,4H),1.19(t,J=6.8Hz,6H)。
【0115】
実施例57:6−メトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物57)
1H NMR(400MHz,CDCl3)δ7.38(d,J=8.8Hz,2H),7.35(d,J=8.4Hz,1H),7.15(d,J=16Hz,1H),7.01(d,J=2.4Hz,1H),6.82(dd,J=2.4,8.4Hz,1H),6.74(d,J=16Hz,1H),6.66(d,J=8.8Hz,2H),6.48(s,1H),3.86(s,3H),3.39(q,J=6.8Hz,4H),1.19(t,J=7.2Hz,6H)。
【0116】
実施例58:6−メトキシ−2−(4−メトキシスチリル)ベンゾフラン(化合物58)
1H NMR(400MHz,CDCl3)δ7.45(d,J=8.8Hz,2H),7.37(d,J=8.4Hz,1H),7.18(d,J=16Hz,1H),7.02(d,J=2.0Hz,1H),6.86(d,J=16Hz,1H),6.84(dd,J=2.4,8.4Hz,1H),6.83(d,J=8.8Hz,2H),6.55(s,1H),3.87(s,3H),3.84(s,3H)。
【0117】
実施例59:6−メトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物59)
1H NMR(400MHz,CDCl3)δ7.38(d,J=8.4Hz,1H),7.18(d,J=16Hz,1H),7.07(m,2H),7.01(m,1H),6.86(m,2H),6.84(d,J=16Hz,1H),6.56(s,1H),3.95(s,3H),3.91(s,3H),3.87(s,3H)。
【0118】
実施例60:6−メトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン(化合物60)
1H NMR(400MHz,CDCl3)δ7.39(d,J=8.8Hz,1H),7.19(d,J=16Hz,1H),7.05(m,4H),6.92(d,J=16Hz,1H),6.85(dd,J=2.8,8.8Hz,1H),6.61(s,1H),3.89(s,3H),3.87(s,3H),3.14(s,3H)。
【0119】
実施例61:トリフルオロ酢酸6−メチル−2−(4−アミノスチリル)ベンゾフラン(化合物61)
1H NMR(400MHz,MeOD)δ7.65(d,2H,J=8.51Hz),7.40(d,1H,J=7.92Hz),7.27(s,2H),7.23(d,2H,J=8.02Hz),7.13(d,1H,J=16.19Hz),7.04(d,1H,J=7.98Hz),6.74(s,1H),2.42(s,3H)。
【0120】
実施例62:トリフルオロ酢酸6−メチル−2−(4−メチルアミノスチリル)ベンゾフラン(化合物62)
1H NMR(400MHz,MeOD)δ7.63(d,2H,J=8.59Hz),7.39(d,1H,J=7.92Hz),6.62(d,1H,J=6.62Hz),7.22(d,3H,J=8.89Hz),7.09(d,1H,J=16.2Hz),7.09(d,1H,J=7.96Hz),6.72(s,1H),3.02(s,3H),2.97(s,3H)。
【0121】
実施例63:6−メチル−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物63)
1H NMR(400MHz,CDCl3)δ7.40(d,2H,J=8.30Hz),7.36(d,1H,J=8.10Hz),7.25(s,1H),7.20(d,1H,J=16.1Hz),7.01(d,1H,J=7.32Hz),6.76(d,1H,J=7.32Hz),6.76(d,1H,J=16.05Hz)6.67(d,1H,J=8.20Hz),6.50(s,1H),3.39(d,4H,J6.81Hz),2.47(s,3H),1.29−1.26(m,6H)。
【0122】
実施例64:6−メチル−2−(4−メトキシスチリル)ベンゾフラン(化合物64)
1H NMR(300MHz,CDCl3)δ7.48(d,2H,J=8.73Hz),7.40(d,1H,J=7.88Hz),7.27−7.21(m,2H),7.03(d,1H,J=7.96Hz),6.92(d,2H,J=8.6Hz),6.86(d,1H,J=16.15Hz),6.59(s,1H),3.88(s,3H),2.48(s,3H)。
【0123】
実施例65:6−メチル−2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物65)
1H NMR(400MHz,CDCl3)δ7.35(d,1H,J=7.84Hz),7.30−7.22(m,3H),7.09−7.07(m,3H),6.86−6.84(m,2H)6.57(s,1H),3.93(d,6H,J=14.2Hz),2.44(s,3H)。
【0124】
実施例66:6−(2−(2−(2−フルオロエトキシ)エトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン(化合物66)
1H NMR(400MHz,CDCl3)δ7.36(d,J=8.8Hz,1H),7.34(d,J=8.8Hz,1H),7.31(d,J=8.8Hz,1H),7.15(d,J=16Hz,1H),7.02(d,J=1.6Hz,1H),6.84(dd,J=2.4,8.4Hz,1H),6.75(d,J=16Hz,1H),6.60(d,J=8.8Hz,2H),6.48(s,1H),4.57(dt,J=47.6,4.0Hz,2H),4.19(t,J=4.8,2H),3.90(t,J=4.8Hz,2H),3.80(m,6H),2.87(s,3H)。
【0125】
実施例67:6−ヒドロキシ−2−(4−アミノスチリル)ベンゾフラン(化合物67)
1H NMR(400MHz,CDCl3)δ7.36(d,J=8.4Hz,1H),7.29(d,J=8.4Hz,1H),7.14(d,J=16Hz,1H),6.91(d,J=32Hz,1H),6.76(d,J=16Hz,1H),6.72(d,J=8.8Hz,1H),6.67(dd,J=5.2,8.4Hz,2H),6.54(d,J=36Hz,1H),6.38(dd,J=13,92Hz,1H),4.84(brs,OH),3.79(brs,NH2)。
【0126】
実施例68:6−ヒドロキシ−2−(4−メチルアミノスチリル)ベンゾフラン(化合物68)
1H NMR(400MHz,DMSO−d6)δ9.52(s,NHMe),7.35(d,J=8.8Hz,1H),7.31(d,J=8.4Hz,1H),7.00(d,J=16Hz,1H),6.87(s,1H),6.84(d,J=16Hz,1H),6.69(dd,J=2.0,8.0Hz,1H),6.62(s,1H),6.53(d,J=8.8Hz,2H),5.98(d,J=4.8Hz,1H),2.70(d,J=4.8Hz,3H)。
【0127】
実施例69:6−ヒドロキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物69)
1H NMR(400MHz,CDCl3)δ7.38(d,J=8.8Hz,2H),7.35(d,J=8.4Hz,1H),7.15(d,J=16Hz,1H),7.01(d,J=2.4Hz,1H),6.82(dd,J=2.4,8.4Hz,1H),6.74(d,J=16Hz,1H),6.66(d,J=8.8Hz,2H),6.47(s,1H),4.75(s,OH),3.39(q,J=6.8Hz,4H),1.19(t,J=7.2Hz,6H)。
【0128】
実施例70:5,6−ジメトキシ−2−(4−メチルアミノスチリル)ベンゾフラン(化合物70)
1H NMR(400MHz,CDCl3)δ7.71(d,J=7.71Hz,1H),7.19(m,4H),6.85(d,J=1.84Hz,2H),6.61(d,J=7.8Hz,2H),6.30(d,J=10.44Hz,1H),3.96(s,3H),3.94(s,3H),3.93(s,3H)。
【0129】
試験例1:試験管内でのβ−アミロイドフィブリル形成阻害効能(ThT蛍光分析)
本発明の化合物のβ−アミロイドフィブリル形成阻害効能を評価するために、下記の方法で実験を行った。
【0130】
本試験ではβ−アミロイドタンパク質、すなわちβ−アミロイド40及びβ−アミロイド42のうち、強い神経毒性を有して治療剤開発のための作用点となるβ−アミロイド42を用いた(Hammarstrom,P.et al.,Science 2003,299,713;及びCai,X.D.et al.,Science 1993,259,514)。
【0131】
β−アミロイド42(Aβ42)をジメチルスルホキシド(DMSO)に溶解して250mMのAβ42貯蔵液を作製した。また、ThT(thioflavin T)を1mMの濃度で蒸留水に溶解後、50mMのグリシン緩衝溶液(pH8.5)で希薄して5μMのThT貯蔵液を作製した。
【0132】
96ウェル蛍光マイクロプレート(白色、F−bottom)の各ウェルに45μlのPBS(phosphate buffer saline,pH7.4)を加え、更に250μMのAβ42貯蔵液5μlを加えた。実施例で得られたそれぞれの標題の化合物をDMSOに溶解して得られた溶液を2μlずつ各ウェルに添加し、各化合物の最終濃度が10〜0.001μMになるようにした。この時、各ウェルでのAβ42の最終濃度が25μMになった。その後、プレートを室温で1時間培養し、各ウェルに5μMのThT貯蔵液150μlを添加した。
【0133】
多重表示蛍光計数器(LS−55 Luminescence spectrometer、Perkin Elmer社製)を用いて励起波長450nm(励起スリット幅10nm)及び発光波長482nm(発光スリット幅10nm)で計数時間を1秒に調整しながら各ウェルの蛍光度を測定した。本発明の化合物を添加せずに、PBS溶液、Aβ42、及びDMSOを添加して対照群を製造した。β−アミロイドフィブリル形成に対する%阻害率を下記数式により計算し、グラフパッドプライズムバージョン4.03(GraphPad Prismversion 4.03)プログラムを用いてIC50を計算した。
【0134】
(数式1)
%阻害率=[1−(C−D)/(A−B)]×100
A(対照群):PBS溶液、Aβ42、及びDMSO処理群を用いた際の蛍光度
B(空試験値):PBS溶液及びDMSO処理群を用いた際の蛍光度
C(実験群):PBS溶液、Aβ42、DMSO、及び本発明の化合物処理群を用いた際の蛍光度
D(実験群補正値):PBS溶液、DMSO、及び本発明の化合物処理群を用いた際の蛍光度
Aβ42形成阻害に対する10μMでの%阻害率値及びIC50値を比較物質と比べた結果を表1〜7に示す。
【0135】
比較物質としては優れたAβ42形成阻害の効能を有する物質と知られたクルクミン(Sigma社製)、2−[2−(2−(ジメチルアミノチアゾール−5−イル)エテニル]ベンゾチアゾール(EP1655287、比較例1)、及び2−4−(ジメチルアミノフェニルエテニル)ベンゾチアゾール(WO02/16333 、比較例2)を用いた。
【0136】
表1〜7はそれぞれ別途実施した実験結果を示す。よって、表1〜7のクルクミンのIC50値は、各実験におけるβ−アミロイド42の蓄積程度やThTの状態に応じて変わる。本発明の化合物のβ−アミロイド42形成阻害の効能は、各表に示したIC50値を比較化合物と相対的に比較して評価することができる。
【表1】

【表2】

【表3】

【表4】

【表5】

【表6】

【表7】

【0137】
前記表1〜6から分かるように、本発明の化合物の殆どは、例えば、化合物3,4、6、7、8、9及びその塩酸塩、17及びその塩酸塩、22,23、30、34、37、44、46、47、48、54、56、59及び65は、β−アミロイド42形成阻害に対して比較物質であるクルクミンより優れた%阻害率を表した。
【0138】
また、表7から分かるように、本発明の化合物9及び17はβ−アミロイド42形成阻害に対して、従来技術の比較例1及び2の化合物より優れた%阻害率及びIC50値を表した。
【0139】
試験例2:マウス及びラットにおける薬動力学試験及び脳血管障壁透過率の試験
1.薬動力学試験
1)実験動物及び試験化合物の投与
7週齢のICR系のマウス(体重約30g)及び8週齢のSD系のラット(体重約250g)を各実験群当り3匹ずつ用いた。各実験動物に実施例9及び17の化合物を賦形剤(DMSO/Tween 20/食塩水:0.1/0.6/2.3,v/v/v)にそれぞれ溶解して得られた溶液を投与した。この時、経口投与の場合は10mL/kg体重の量で投与し、静脈投与の場合は5mL/kg体重の量で尾静脈を通じて投与した。
【0140】
2)血中濃度試験
経口投与後30分、1時間、2時間、4時間、10時間、及び24時間目にマウスは眼窩静脈から、ラットは頸静脈からヘパリン(1000IU/mL,3μl)を添加したチューブに血液を採血した。血液試料を12,000rpmで2分間遠心分離して血漿を得た。得られた血漿を分析前まで−80℃の冷凍庫で保管した。
【0141】
3)試料の分析
LC/MSMSシステムを用いて次のような条件下で試料を分析した。
【表8】

【0142】
試料の前処理方法は次の通りである。
【0143】
血漿50μlを取り、蓋付2.0mLのチューブ(Eppendorf Co.社製)に入れ、ここに0.1%ギ酸20μlを添加して酸性化した。内部標準溶液及び抽出溶媒として酢酸エチル1mLを得られた溶液に添加した。得られた溶液をサーモミキサー(Eppendorf Co.社製)を用いて1,400rpmで5分間混合した後、遠心分離した(Eppendorf Co.社製)。上澄み液を取って35℃でサイクロンを用いて濃縮した。残渣を移動相50μlで再溶解させた後、得られた溶液5μlをLC/MSに注入して分析した。
【0144】
2.脳血管障壁透過率の試験
1)実験動物及び試験化合物の投与
7週齢のICR系のマウス(体重約30g)及び8週齢のSD系のラット(体重約250g)を各実験群当り3匹ずつ用いた。実施例9及び17の化合物を賦形剤(DMSO/Tween 20/食塩水:0.1/0.6/2.3,v/v/v)に溶解して得られた溶液を各実験動物に投与した。この時、経口投与の場合10mL/kg体重の量で投与し、静脈投与の場合5mL/kg体重の量で尾静脈を通じて投与した。
【0145】
2)血中及び組職中の濃度測定(同時試験)
(1)血液試料の採取
試験化合物の経口投与後30分、1時間、2時間、4時間、10時間、及び24時間目にイソフルランを用いてマウス及びラットを呼吸痲酔した後、開腹した。腹部静脈から約1mLの血液をヘパリン(1000IU/mL,3μl)を添加したチューブに採血した。得られた血液試料を12,000rpmで2分間遠心分離して血漿を得た。得られた血漿は分析前まで−80℃の冷凍庫で保管した。
【0146】
(2)臓器組職試料の採取
血液採取したマウス及びラットを十分に放血した後、迅速に脳組織を採取した。採取した脳組織を生理食塩水で1回または2回洗浄して血液を除去した。脂肪組織及び周辺組職を除去した後、脳組職の重さを測定した。10倍に希薄された4%ウシ血清アルブミン(BSA)溶液を前記脳組職に添加した。得られた溶液を組職破鎖機で均質化した。得られた希薄均質液を2mLのチューブに移した後、分析前まで−80℃冷凍庫に保管した。すべての試料の処理は冷凍状態で行った。
【0147】
3)試料の分析
LC/MSMSシステムを用いて次のような条件下で試料を分析した。
【表9】

【0148】
試料の前処理方法は次の通りである。
【0149】
血漿50μlを取って蓋付2.0mLのチューブ(Eppendorf Co.社製)に入れ 、ここに0.1%ギ酸20μlを添加して酸性化した。内部標準溶媒及び抽出溶媒として酢酸エチル1mLを得られた溶液に添加した。得られた溶液をサーモミキサー(Eppendorf Co.社製)を用いて1、400rpmで5分間混合した後に遠心分離した(Eppendorf Co.社製)。上澄み液を取って35℃でサイクロンを用いて濃縮させた。残渣を移動相50μlで再溶解した後、得られた溶液5μlをLC/MSに注入して分析した。
【0150】
3.結果
実施例9及び17の化合物のマウスにおける薬動力学試験及び脳血管障壁透過率の試験結果を下記の表8に示し、レットにおける結果を下記の表9に示す。
【0151】
下記表8及び9に記載の「iv」は静脈注射を、「po」は口腔投与を、「AUC plasma」は血漿濃度曲線下面積を、「Cmax」は血漿最高濃度を、「Tmax」はCmaxに到逹する時間を、「BA」は下記数式2による生体利用率(%)を、「AUC Brain」は時間による脳組職濃度曲線下面積を、「AUC Brain/AUC Plasma」は試験化合物の脳への速度を意味する。
【0152】
(数式2)
生体利用率(%)=[(AUCpo/AUCiv)×(Doseiv/Dosepo)×100]
前記式中、AUCpoは経口投与後の血中濃度時間曲線下面積(AUC)を、AUCivは静脈注射の後のAUCを、Doseivは静脈注射量を、Dosepoは経口投与量を意味する。
【表10】

【表11】

【0153】
前記表8及び9から分かるように、実施例9及び17の化合物は脳疾患治療剤として適した高AUC及び優れた生体利用率を示した。
【0154】
また、脳血管障壁透過率の試験結果、実施例9及び17の化合物は血漿対比100%以上の透過能を示して脳疾患治療剤として適していることが明らかになった。
【0155】
試験例3:hERGカリウムイオンチャンネル阻害効能
1)モデル細胞株及び培養
hERGが安定的に発現されたHEK−hERG細胞株(IonGate Biosciences,Frankfurt,Germany Co.)をDMEM(Dulbecco’s Modified Eagle’s Medium,Sigma Co.,St.Louis,MO,USA)から10%ウシ胎児血清(FBS,Cambrex,Walkersville,MD,USA)、及び0.5mg/mLのゼオシン(Invitrogen,Carlsbad,CA,USA)を添加して培養した。前記細胞株は、培養5日後80%程度培養フラスコを覆ったときに継代培養した。
【0156】
2)試験溶液及び試験薬物の製造
(1)試験溶液
カリウムイオン電流の測定のために用いられた電極内溶液は、115mMのアスパラギン酸カリウム、20mMのKCl、10mMのEGTA、10mMのHEPES、2.5mMのトリス−ホスホクレアチン、0.1mMのNa2GTP及び5mMのMgCl2(pH7.2,290mOsm/Kg H2O)で構成された。また、細胞外潅流液は135mMのNaCl、5mMのKCl、1mMのMgCl2,2mMのCaCl2、10mMのグルコース、及び10mMのHEPES(pH7.2、300mOsm/KgH2O)で構成された。
【0157】
(2)試験薬物
本発明の化合物を細胞外潅流液を用いて所望の濃度にそれぞれ希薄して試験薬物溶液を製造した。製造された試験薬物溶液をガスクロマトグラフィ用の毛細管に連結された7−アレイポリエチレンチューブに置き、HEK−hERG細胞株の100μm以内高さのカラム先端から落ちるようにした。
【0158】
3)イオン電流測定
カリウムイオン電流の測定は、EPC10(Instrutech Co.,NY,USA)パッチクランプ増幅器を用いた典型的な全細胞パッチクランプ(whole−cell patch clamp)方法を用いた。測定に用いられた電極は、P−97Fleming Brown型のマイクロピベット・プラー微小電極作製器(Sutter Instrument Co.社製)で製造されたボロシリケイトガラス管(外径:1.65mm、内径:1.2mm、Corning 7052,Garner Glass Co.社製 ,Claremont,CA,USA)を使用した。前記電極をSylgard 184(Dow Corning Co.社製 ,Midland,MI,USA)でコートした後、マイクロフォージ(Narishige Co.社製,Tokyo,Japan)で仕上げた。前記電極は電極内部を溶液で満たしたときに2〜3MΩの抵抗をみせた。HEK−hERG細胞が入っている培養皿を倒立顕微鏡(Nikon Co.社製)に置き、本発明の化合物が含まれた細胞外潅流液を1−2mL/min速度で潅流した。細胞膜の電気容量と直列抵抗を80%以上補正し、サンプリング率は2kHzにし、ローパスフィルターは2kHz(−3dB;8−pole Bassel filter)にしてカリウムイオン電流を測定した。すべての実験は室温(21−24℃)で行った。
【0159】
4)データ分析及び統計処理
実験結果はPulse/Pulsefit(v9.0,HEKA Elcktronik,Lambrecht,Germany)とIgorマクロを用いて分析した。すべての結果は平均±標準誤差で表示した。Hill公式[Block=(1+IC50/[drug]n)−1]を用いて濃度反応曲線から試験化合物のIC50、つまりイオン電流を50%程度抑制した時の試験化合物の濃度を計算した。その結果を下記表10に示す。
【表12】

【0160】
前記表10から分かるように、本発明の実施例9及び17の化合物は、hERGカリウムイオンチャンネルに対する阻害効能は微々して心臓毒性がないように判断される。
【0161】
試験例4:生体内恐怖条件付け試験
1)遺伝子変形マウス
雄のB6C3−Tg(APPswe,PSEN1dE9,Jackson Laboratory Co.社製,Maine,A)と雌のB6C3F1(中央実験動物社、韓国)との間から生まれた3週齢のマウスの尻尾を約0.5cm(tail biopsy)長さに切った。尻尾サンプルからゲノムDNA(genomic DNA)を抽出し、遺伝子型検査を実施して二重遺伝子変形(Tg)マウスを選別した。
【0162】
前記のような遺伝子変形マウスは、痴呆治療効能試験において一般的に用いられるが、これは5ヶ月齢以上であれば脳にβ−アミロイドが蓄積して人間痴呆患者のような拡張表現型が現れるためである。
【0163】
2)薬物投与
5ヶ月齢から12ヶ月齢までのマウスに実施例9の化合物を30mg/kgまたは100mg/kgの量で毎日経口投与した。比較化合物としてはβ−アミロイドタンパク質と結合して沈着及び細胞毒性を阻害するトラミプロセートを用いた(Aisen,P.S.et.al.,Curr.Alzheimer Res.2007,4,473)。前記化合物を投与した。
【0164】
3)恐怖条件付け試験
訓練第一日目のマウスを条件付け箱に入れて2分間適応させた。恐怖条件付け実験として20秒間75dBの條件刺激(CS)を与え、条件刺激の最後の2秒間に0.5mAの電気刺激(unconditional stimulus(US))を一緒に与えた。1分後動物を飼育箱に移動した。24時間後に記憶力検査を行った。前記条件付け箱に動物を入れて5分間観察した。この時、CSとUSは提示せずに凍結反応を測定した。前記凍結反応とは動物が呼吸以外の動きがない状態を意味する。
【0165】
4)β−アミロイド量測定
恐怖条件付け試験後、脳を摘出して組織染色を行った。脳に沈着されたβ−アミロイドの量をELISA法を用いて測定した。その結果を下記の表11に示す。
【表13】

【0166】
前記表11から分かるように、本発明の実施例9の化合物は、トラミプロセートに比べて投与量依存的に高い記憶力を示した。
【0167】
試験例5:組職染色試験
試験例4の1)及び2)でのように、遺伝子変形マウスを選別して薬物投与をした。前記遺伝子変形マウスから脳を分離し、10%中性ホルマリン溶液で固定した。海馬と皮質を含む脳部位を切除して、水洗、脱水、及びパラフィン浸透の過程を経て脳組織を含むパラフィンブロックを作製した。パラフィンブロックを8μMに薄切りして海馬の全体領域に対する標本を作製し、その中から10個の標本を一定間隔に選び取って脱パラフィンした後に含水させた。その後、マイヤーヘマトキシリン液に1分間沈積し、水道水で水洗いした。水洗いした組職をアルカリ性塩化ナトリウム溶液中に20分間反応させた後、アルカリ性コンゴーレッド染色液に20分間反応させた。得られた組職を100%のエチルアルコールで洗浄し、キシレンで透明化させ、合成封入剤を用いて封入した。コンゴーレッドに染色されたすべての組織標本の海馬と皮質部位でそれぞれコンゴーレッド染色陽性のβ−アミロイドプラークを計数した。その結果を下記表12に示す。
【表14】

【0168】
前記表12から分かるように、本発明の実施例9の化合物はトラミプロセートに比べて優れたβ−アミロイドプラーク沈着量減少率を投与量依存的な様式で示した。
【0169】
図1及び2は、実施例9の化合物または比較化合物であるトラミプロセートで染色された遺伝子変形マウスの海馬及び皮質組職をそれぞれ示す図である。
【0170】
図1及び2に図示したとおり、実施例9の化合物の場合トラミプロセートに比べてβ−アミロイドの沈着が顕著に減少されたことが分かる。
【0171】
試験例6:生化学試験
試験例4の1)及び2)の方法で遺伝子変形マウスを選別して薬物投与した。前記遺伝子変形マウスの脳組職から海馬組織を摘出し、8倍に当たる量の5MグアニジンHCl/50mM Tris HClに入れて組職破鎖機で均質化した。その後、3時間室温に置いてこの均質液をタンパク質分解阻害剤(Pierce(登録商標),Cat No.78415)を含むBSAT−DPBS(5% BSA及び0.03% Tween−20を含むDulbecco’s phosphate buffered salin)で50倍希薄した。Human beta−amyliod HS 1−42 colorimetric kit(Invitrogen(登録商標),Cat No.#KHB3544)を用いてβ−アミロイド42の量を測定した。その結果を下記表13に示す。
【表15】

【0172】
前記表13から分かるように、本発明の実施例9の化合物はトラミプロセートに比べて優れたβ−アミロイドプラークの沈着量減少率を投与量依存的な様式で示した。
【0173】
以上、本発明は前記実施例を中心に説明したが、これは例示に過ぎず、本発明は本発明の技術分野における通常の知識を有する者に自明な多様な変形及び均等なその他の実施例を以下に添付する特許請求の範囲内で行なうことができるという事実を認めなければならない。
【技術分野】
【0001】
本発明は、β−アミロイドの蓄積によって生じる老人性プラークの形成を阻害する新規な化合物、その製造方法、及びこれを有効成分として含む退行性脳疾患の予防または治療用医薬組成物に関する。
【背景技術】
【0002】
老人性痴呆、脳卒中、及びパーキンソン病のような退行性脳疾患で苦しむ老人人口の増加は、このような疾患の予防及び治療に有効な薬剤または方法がまだ開発されていないため、深刻な社会的問題になっている。
【0003】
タクリン(Tackrin(登録商標),Warner−Lambert社製)、アリセプト(Aricept(登録商標),Eisai社製)、及びエクセロン(Excellon(登録商標),Novartis社製)のような商業的に入手可能なアルツハイマー病の治療剤は、β−アミロイドタンパク質自体の蓄積を遮断するのではなくアセチルコリンエステラーゼを抑制してコリン作動性神経伝達物質であるアセチルコリンの濃度を増加させて認知能を短期的に改善する作用をする。
【0004】
アルツハイマー病は特に深刻な老人性痴呆で、脳内でβ−アミロイドタンパク質の蓄積によって発生する神経毒性が主な病因であると知られている。即ち、β−アミロイドタンパク質前駆体(APP)がβ−及びγ−セクレターゼの作用によってβ−アミロイド42(Aβ42)単量体に変換され、このAβ42単量体が脳内に蓄積して漸次的にオリゴマー、プロトフィブリル、フィブリル及びプラークを形成する。従って、β−アミロイドを選択的に認識し、フィブリルの形成を遮断する治療剤の開発が要求されてきた。
【0005】
潜在的β−アミロイドとして、β−及びγ−セクレターゼ阻害剤、メタルキレート、β−アミロイドワクチン、スタチン系の薬物、及び非ステロイド抗炎症剤が研究された。β−アミロイドワクチンAN−1792(Elan)の研究によれば、β−アミロイドが過剰発現される遺伝子変形マウスにAN−1792を投与した際、β−アミロイドタンパク質の蓄積を阻害し、遺伝子変形マウスの脳内に形成されるアミロイドプラークを除去できる抗体が生成された:若いマウスでは老人性プラークの形成が阻害され、老いたマウスでは老人性プラーク形成の進行が遅延されると報告されている(Schenk,D.et al.,Nature 400,173(1999))。この研究によりオリゴマーまたは老人性プラークの形成を阻害する薬物がアルツハイマー性痴呆のような退行性脳疾患の予防または治療に有用であることが分かった。
【0006】
β−アミロイドに関連して考案された薬物は、作用点、作用機構、及び薬動力学に応じて治療剤と分子映像診断剤に分けられる。
【0007】
β−アミロイドフィブリルは90%のβ−アミロイド40(Aβ40)と10%のβ−アミロイド42(Aβ42)を含み(Bitan,G.et al.,Proc.Natl.Sci.U.S.A,100,330.,(2003)及びJan,A.etal.,J.Biol.Chem.,283,28176(2008))、β−アミロイド42は強い神経毒性で脳細胞の死滅に導く。その結果、β−アミロイド42は治療剤の主要作用点になり、β−アミロイド40は診断剤の主要作用点となる。作用機構の観点からみると、治療剤はアルファ−ヘリックスの構造を有する可溶性のモノマー及び低級のオリゴマーに作用し、フィブリルに比べて約5倍も高い神経毒性を有する不溶性のオリゴマーの生成を阻害する一方、診断剤はβ−シート構造(β−plated sheet)を有するため、不溶性のオリゴマーに対して高い結合親和度を示す。薬動力学的な観点での退行性脳疾患治療剤は、診断剤と異なる生体動力学的な特徴を有する。診断剤はラジオアイソトープの半減期中に患者の診断ができるような迅速な脳血管透過能が要求される。また、ターゲットと結合した診断剤の定量化のために診断後に残った診断剤に対する迅速な除去率(CL)が要求される(Mathis,C.A.et al.,Curr.Pharm.Design,10,1469(2004))。しかし、治療剤の場合は高い吸収力と共に、一定濃度以上の持続時間(area under the concentration versus time curve,AUC)が要求される。
【0008】
β−アミロイドフィブリル形成阻害に有用な数多くの化合物または抽出物が開示されており、その具体的な例としては、ヘキサデシル−N−メチルピペリジニウム(HMPBr)のような洗剤;ドキソルビシンのような坑癌・抗生剤;SKF−74652のようなベンゾフラン誘導体(Howlett,D.R.et al.,Biochem.J.,343,419(1999));プロピジウムのようなヒューマンアセチルコリンセクレターゼ(HuAchE)(Bartolini,M.et al.,Biochem.Pharmacol.,65,407(2003));イチョウ抽出物であるLB−152(Lin,S.et al.,Bioorg.Med.Chem.Lett.,14,1173(2004));カレーの抽出物であるクルクミン(Yang,F.et al.,J.Biol.Chem.,280,5892(2005));及びノルジヒドログアヤレチン酸(NDGA)(Ono,K.et al.,Biochem.Biophys.Res.Commun.,330,111(2005))が挙げられる。
【0009】
しかし、前記化合物及び抽出物のうち類似ペプチド化合物は分子量が高いため、生体内の有用性が低いとともに、安定性が劣化するという問題があり、坑癌抗生剤は長期服用時に副作用を誘発する。その上、このように報告された化合物及び抽出物は、脳血管障壁(BBB)を効果的に透過しなければならないという脳疾患治療剤の条件を満たさないと報告されている。
【0010】
そこで、本発明者は前記問題点を解消し、脳内でのβ−アミロイドフィブリルの蓄積に関する疾患の予防または治療に有効な新規化合物を開発するために努力し、特定スチリルベンゾフラン誘導体が副作用なくβ−アミロイド42に対して高い抑制効果を有し、増加した脳血管障壁浸透能を有することを見出した。
【発明の概要】
【0011】
したがって、本発明の目的はβ−アミロイドフィブリルの形成を効率よく阻害する新規な化合物またはその薬剤学的に許容可能な塩を提供することである。
【0012】
本発明の他の目的は前記化合物の製造方法を提供することである。
【0013】
本発明のさらに他の目的は前記化合物またはその薬剤学的に許容可能な塩を有効成分として含むβ−アミロイドフィブリルの形成阻害用医薬組成物を提供することである。
【0014】
本発明のさらに他の目的は前記化合物またはその薬剤学的に許容可能な塩を有効成分として含む退行性脳疾患の予防または治療用医薬組成物を提供することである。
【0015】
本発明の一様態によれば、下記化(I)の化合物またはその薬剤学的に許容可能な塩を提供する:
【化1】

【0016】
前記式中、
R1及びR2は、それぞれ独立的にH、OH、ハロゲン、C1−C3アルコキシ、C1−C3アルキル、一つ以上のハロゲンまたはヒドロキシ基を有する置換されたポリ(C1−C3アルコキシ)、または一つ以上のC1−C3アルキル基を有する置換されたピラニル(C1−C3アルコキシ)であり;
R3は、NH2、C1−C3アルキルアミノ、C1−C3ジアルキルアミノ、またはC1−C3アルコキシであり;
R4はHまたはC1−C3アルコキシである。
【0017】
本発明の他の一様態によれば、前記式(I)の化合物の製造方法を提供する。
【0018】
本発明のまた他の一様態によれば、前記式(I)の化合物またはその薬剤学的に許容可能な塩を有効成分とするβ−アミロイドフィブリル形成阻害用医薬組成物を提供する。
【0019】
本発明のさらに他の一様態によれば、前記式(I)の化合物またはその薬剤学的に許容可能な塩を有効成分とする退行性脳疾患の予防及び治療用医薬組成物を提供する。
【図面の簡単な説明】
【0020】
本発明の前記目的及びその他の目的並びにその特徴は、添付の図面と共に本発明に関する次の詳細な説明から明らかになる。
【図1】図1は実施例9の化合物及びトラミプロセート(比較化合物)によって染色された遺伝子変形マウスの海馬組職(hippocampus tissue)の写真図である。
【図2】図2は実施例9の化合物及びトラミプロセート(比較化合物)によって染色された遺伝子変形マウスの皮質の写真図である。
【発明の詳細な説明】
【0021】
本明細書において、用語「アルキル」は線型または分枝型飽和C1〜C3の炭化水素ラジカル鎖を意味する。「アルキル」の具体的な例としてはメチル、エチル、n−プロピル、及びイソプロピルが挙げられるが、これに限定されない。
【0022】
本明細書において、用語「アルコキシ」は−ORa基を意味し、ここでRaは前記定義したアルキルである。「アルコキシ」の具体的な例としてはメトキシ、エトキシ、n−プロポキシ及びイソプロポキシが挙げられるが、これに限定されない。
【0023】
本明細書において、用語「ハロゲン」はフルオロ(F)、クロロ(Cl)、ブロモ(Br)、またはヨード(I)を意味する。
【0024】
好ましくは、本発明による前記式(I)の化合物において、
R1及びR2は、それぞれ独立的にH、OH、ハロゲン、OCH3、CH3、(OCH2CH2)2F、(OCH2CH2)3F、またはジメチルピラニルメトキシであり;
R3は、NH2、NHCH3、N(CH3)2、またはOCH3であり;
R4はHまたはOCH3である。
【0025】
本発明による式(I)のスチリルベンゾフラン誘導体の更に好ましい例は次の通りである:
(1)2−(4−ジメチルアミノスチリル)ベンゾフラン;
(2)5−メトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(3)5−ヒドロキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(4)5−メチル−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(5)5−フルオロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(6)5−クロロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(7)5−ブロモ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(8)5−ヨード−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(9)6−メトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(10)6−ヒドロキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(11)6−メチル−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(12)6−フルオロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(13)6−クロロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(14)6−ブロモ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(15)6−ヨード−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(16)5−メトキシ−2−(4−アミノスチリル)ベンゾフラン;
(17)5−メトキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
(18)塩酸5−ヒドロキシ−2−(4−アミノスチリル)ベンゾフラン;
(19)塩酸5−ヒドロキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
(20)6−メトキシ−2−(4−アミノスチリル)ベンゾフラン;
(21)6−メトキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
(22)5−メトキシ−2−(3−メトキシ−4−ジメチルアミノスチリル)ベンゾフラン;
(23)6−メトキシ−2−(3−メトキシ−4−ジメチルアミノスチリル)ベンゾフラン;
(24)トリフルオロ酢酸2−(4−アミノスチリル)ベンゾフラン;
(25)トリフルオロ酢酸2−(4−メチルアミノスチリル)ベンゾフラン;
(26)2−(4−ジエチルアミノスチリル)ベンゾフラン;
(27)2−(4−メトキシスチリル)ベンゾフラン;
(28)2−(3,4−ジメトキシスチリル)ベンゾフラン;
(29)5−クロロ−2−(4−アミノスチリル)ベンゾフラン;
(30)5−クロロ−2−(4−メチルアミノスチリル)ベンゾフラン;
(31)5−クロロ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(32)5−クロロ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
(33)5−クロロ−2−(4−メトキシスチリル)ベンゾフラン;
(34)5−クロロ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
(35)5−メトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(36)5−メトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
(37)5−メトキシ−2−(4−メトキシスチリル)ベンゾフラン;
(38)5−メトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
(39)トリフルオロ酢酸5−メチル−2−(アミノスチリル)ベンゾフラン;
(40)トリフルオロ酢酸5−メチル−2−(4−メチルアミノスチリル)ベンゾフラン;
(41)5−メチル−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(42)5−メチル−2−(4−メトキシスチリル)ベンゾフラン;
(43)5−メチル−2−(3,4−ジメトキシスチリル)ベンゾフラン;
(44)5−(2−(2−フルオロエトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
(45)5−(2−(2−(2−フルオロエトキシ)エトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
(46)5−ヨード−2−(4−メチルアミノスチリル)ベンゾフラン;
(47)5−ヨード−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(48)5−ヨード−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
(49)5−ヨード−2−(4−メトキシスチリル)ベンゾフラン;
(50)5−ヨード−2−(3,4−ジメトキシスチリル)ベンゾフラン;
(51)5,6−ジメトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(52)5,6−ジメトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(53)5,6−ジメトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
(54)5,6−ジメトキシ−2−(4−メトキシスチリル)ベンゾフラン;
(55)5,6−ジメトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
(56)5−ヒドロキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(57)6−メトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(58)6−メトキシ−2−(4−メトキシスチリル)ベンゾフラン;
(59)6−メトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
(60)6−メトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
(61)トリフルオロ酢酸6−メチル−2−(4−アミノスチリル)ベンゾフラン;
(62)トリフルオロ酢酸6−メチル−2−(4−メチルアミノスチリル)ベンゾフラン;
(63)6−メチル−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(64)6−メチル−2−(4−メトキシスチリル)ベンゾフラン;
(65)6−メチル−2−(3,4−ジメトキシスチリル)ベンゾフラン;
(66)6−(2−(2−(2−フルオロエトキシ)エトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
(67)6−ヒドロキシ−2−(4−アミノスチリル)ベンゾフラン;
(68)6−ヒドロキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
(69)6−ヒドロキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
(70)5,6−ジメトキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
(71)5−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−アミノスチリル)ベンゾフラン;
(72)5−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
(73)5−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−ジメチルアミノスチリル)ベンゾフラン;
(74)6−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−アミノスチリル)ベンゾフラン;
(75)6−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;及び
(76)6−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−ジメチルアミノスチリル)ベンゾフラン。
【0026】
本発明による式(I)の化合物は、塩酸、臭化水素酸、硫酸、リン酸、硝酸、酢酸、グリコール酸、乳酸、ピルビン酸、マロン酸、コハク酸、グルタル酸、フマル酸、リンゴ酸、マンデル酸、酒石酸、クエン酸、アスコルビン酸、パルミチン酸、マレイン酸、ヒドロキシマレイン酸、安息香酸、ヒドロキシ安息香酸、フェニル酢酸、桂皮酸、サリチル酸、メタンスルホン酸、ベンゼンスルホン酸、及びトルエンスルホン酸のような無機酸または有機酸からなる薬剤学的に許容可能な塩の形態で用いることができる。
【0027】
本発明のさらに他の態様によれば、ホーナーエモンズ反応(Honer−Emmons reaction)、すなわち、化(II)の2−(ジエトキシホスホリルメチル)ベンゾフランを塩基の存在下において有機溶媒中で下記化(III)のアルデヒドと反応させる段階を含む前記式(I)の化合物の製造方法を提供する:
【化2】

【0028】
前記式中、R1、R2、R3、及びR4は前記に定義した通りである。
【0029】
前記式(I)の化合物の製造方法を反応式1に図示する:
【化3】

【0030】
前記式中、R1、R2、R3、及びR4はそれぞれ前記に定義した通りである。
【0031】
具体的には、前記反応式1に示すように、前記式(I)の化合物は、前記式(II)の2−(ジエトキシホスホリルメチル)ベンゾフランを塩基の存在下において有機溶媒中で前記式(III)の置換されたアルデヒドと0℃〜室温で反応させることによって製造することができる。
【0032】
前記反応に用いられる塩基としては、アルカリ金属の水素化物(例えば、NaH、LiH、KH)、アルキルアルカリ金属化合物(例えば、n−BuLi)、アルカリ金属のアルコキシド化合物(例えば、ナトリウムメトキシド、ナトリウムエトキシド、ナトリウムイソプロポキシド、ナトリウムt−ブトキシド、カリウムt−ブトキシド、カリウムイソプロポキシド、リチウムイソプロポキシド)、アルカリ金属のアミド化合物(例えば、リチウムジイソプロピルアミド(LiN(i−Pr)2)、リチウムヘキサメチルジシリルアミド(LiHMDS)、カリウムヘキサメチルジシリルアミド(KHMDS)、ナトリウムヘキサメチルジシリルアミド(NaHMDS))、またはこれらの混合物が挙げられ、好ましくはカリウムt−ブトキシド及びナトリウムヘキサメチルジシリルアミドが用いられる。
【0033】
前記反応に有用な有機溶媒としては、テトラヒドロフラン、ジエチルエーテル、及びジイソプロピルエーテルのようなエーテルが挙げられる。
【0034】
前記反応に出発物質として用いられる式(II)の2−(ジエトキシホスホリルメチル)ベンゾフランは、反応式2に示される周知の方法(Asharm,M.J.Chem.Soc.Perkin Trans.,2,1662(2002);Michaelis,A.et. al.,Chem.Ber.,31,1048(1898);及びBhattacharya,A.K.et. al.,Chem.Rew.,81,415(1981))によって製造することができる。:
【化4】

【0035】
前記式中、R1及びR2は前記で定義した通りである。
【0036】
具体的には、前記反応式2の2−(ジエトキシホスホリルメチル)ベンゾフランは、塩基存在下での前記式(IV)の2−ヒドロキシベンズアルデヒドとエチルブロモアセテイトとの分子間アルドール/パーキン縮合反応(intramolecular Aldol/Perkin type condensation);水素化リチウムアルミニウムを用いた還元反応;リン酸トリブロマイドを用いた臭化反応;及びトリエチルホスファイトとの反応を順次用いて製造することができる。
【0037】
前記式(IV)のアルデヒド化合物の好ましい例として化(4a)〜(4o)の化合物を含む:
【化5】

【0038】
また、本発明の化合物(3)、(10)、(18)、及び(19)は、反応式3で表される通り、前記反応式1に従って製造された化合物をジクロロメタンなどの有機溶媒中で、ボロントリクロリド、ボロントリフルオリド、ボロントリブロマイド、またはヨードトリメチルシラン、好ましくはボロントリブロマイドを用いて−78℃〜室温で3〜5時間脱メチル化することによって製造することができる。
【化6】

【0039】
前記式中、R3は前記で定義した通りである。
【0040】
本発明の式(I)の化合物またはその薬剤学的に許容可能な塩は、β−アミロイドフィブリルの形成を効果的に阻害し、高水準の脳血管障壁透過能を示すことによって脳内でのβ−アミロイドフィブリルの蓄積を効果的に阻害する。その結果、本発明の化合物またはその薬剤学的に許容可能な塩は退行性脳疾患の予防または治療に有用である。
【0041】
したがって本発明は前記式(I)の化合物またはその薬剤学的に許容可能な塩を有効成分として含むβ−アミロイドフィブリルの形成阻害用医薬組成物を提供する。
【0042】
本発明は、また前記式(I)の化合物またはその薬剤学的に許容可能な塩を有効成分として含む退行性脳疾患の予防または治療用医薬組成物を提供する。
【0043】
本明細書において、用語「退行性脳疾患」とは β−アミロイドフィブリルの脳内蓄積によって惹起される疾患であって、例えば、老人性痴呆(例えば、アルツハイマー性痴呆)、脳卒中、パーキンソン病、及びハンチントン病が挙げられる。
【0044】
前記医薬組成物は、有効成分である式(I)の化合物またはその薬剤学的に許容可能な塩を医薬組成物の総重量に対して0.5〜10重量%、好ましくは0.5〜5重量%の量で含む。
【0045】
本発明の医薬組成物は、選択的に滅菌してもよく、また防腐剤、安定化剤、水和剤、乳化促進剤、浸透圧調節のための塩、緩衝剤、及びその他の治療学的活性化合物のような補助剤をさらに含んでいてもよい。本発明の医薬組成物は、混合、顆粒化またはコートのような通常の方法によって経口投与または非経口投与の形態として剤形化することができる。
【0046】
経口投与用剤形の例としては、錠剤、丸薬、硬・軟質−カプセル剤、液剤、懸濁液剤、乳化剤、シロップ剤、及び顆粒剤が挙げられる。これらの剤形は、前記活性成分とともに希釈剤(例えば、ラクトース、デキストロース、スクロース、マンニトール、ソルビトール、セルロース、グリシン)、潤滑剤(例えば、シリカ、タルク、ステアリン酸及びそのマグネシウムまたはカルシウム塩、及びポリエチレングリコール)を含んでいてもよい。
【0047】
前記錠剤は、結合剤(例えば、マグネシウムアルミニウム珪酸塩、でんぷん糊、ゼラチン、トラガカント、メチルセルロース、カルボキシメチルセルロースナトリウム、ポリビニルピロリジン)及び選択的には、崩壊剤または沸騰混合物(例えば、でんぷん、寒天、及びアルギン酸またはそのナトリウム塩)、吸収剤、着色剤、香味剤、及び甘味剤をさらに含むことができる。
【0048】
また、非経口投与用剤形の例としては注射投与用等張性水溶液または懸濁液を含んでいてもよい。
【0049】
本発明の化合物またはその薬剤学的に許容可能な塩は、活性成分として人間を含む哺乳動物に対して一日当り0.1〜30mg/kg、好ましくは0.5〜10mg/kg体重の有効量で1日1回または分割して経口または非経口的に投与することができる。
【0050】
以下に下記製造例及び実施例により本発明をさらに詳しく説明する。以下の製造例及び実施例は、本発明の例示の目的であって、本発明を限定するものではない。
【0051】
製造例1:5−メトキシ−2−(ジエトキシホスホリルメチル)ベンゾフラン(化2の化合物)
段階1:エチル5−メトキシ−2−ベンゾフランカルボキシレートの製造
ジメチルホルムアミドに溶解させた5−メトキシ−2−ヒドロキシベンズアルデヒド(化4bの化合物)7.61g(0.05mol)に、モレキュラーシーブ(molecular sieve)と炭酸カリウム15.2g(0.11mol)を加えて混合した。前記混合物にブロモ酢酸エチル16.7g(0.10mol)を滴下し、140℃で40分間還流させた。その後、炭酸カリウム15.2g(0.11mol)を添加し、得られた混合物を50分間還流させた後、モレキュラーシーブと、得られた沈殿物とを濾過して分離し、分離された固体を酢酸エチルで洗浄し、この洗浄液と濾液を混合して、減圧蒸留し、水と酢酸エチルの混合物で抽出した。有機層を分離して無水硫酸ナトリウムで乾燥し、濾過して減圧蒸留した。得られた残渣をカラムクロマトグラフィー(n−ヘキサン/酢酸エチル=9/1)で精製して標題化合物8.48g(収率77%)を得た。
【0052】
1H NMR(CDCl3,400MHz)δ7.42(m,2H),7.02(m,2H),4.39(q,2H,J=7.1Hz),3.79(s,3H),1.38(t,3H,J=7.1Hz)。
【0053】
段階2:5−メトキシ−2−ヒドロキシメチルベンゾフラン
水素化リチウムアルミニウム(0.85g、22.5mmol)を0℃でジメチルホルムアミドに溶解させた後、ここに、段階1で得られたエチル5−メトキシ−2−ベンゾフランカルボキシレート6.61g(0.03mol)をテトラヒドロフランに溶解して得られた溶液を添加して10分間0℃で攪拌した。反応終結後、得られた混合物に飽和硫酸ナトリウムを0℃で添加し、得られた沈殿物を濾過して除去した。余液を減圧蒸留して溶媒を除去し、残渣を水と酢酸エチルで抽出した。有機層を分離して無水硫酸ナトリウムで乾燥した後、減圧蒸留した。得られた残渣をカラムクロマトグラフィー(n−ヘキサン/酢酸エチル=3/1)により精製して標題化合物4.81g(収率90%)を得た。
【0054】
1H NMR(CDCl3,400MHz)δ7.31(d,1H,J=8.9Hz),6.96(s,1H),6.86(dd,1H,J=1.7,8.9Hz),6.53(s,1H),4.69(s,2H),3.81(s,3H),2.89(s,1H)。
【0055】
段階3:5−メトキシ−2−(ジエトキシホスホリルメチル)ベンゾフラン
ジメチルホルムアミドにリン酸トリブロマイド(8.12g,0.03mol)を0℃で添加した後、30分間0℃で攪拌した。ここに、段階2で得られた5−メトキシ−2−ヒドロキシメチルベンゾフラン3.56g(0.02mol)をジメチルホルムアミドに溶解して得られた溶液を添加して1時間0℃で攪拌した。反応終結後、反応混合物に炭酸ナトリウムと酢酸エチルを添加してpH7−8に中和した。得られた沈殿物を濾過して分離し、固体を酢酸エチルで洗滌した。洗浄液と余液を混合して得られた溶液を水と酢酸エチルの混合物で抽出した。有機層を分離し、無水硫酸ナトリウムで乾燥して濾過した後、減圧蒸留して5−メトキシ−2−ブロモメチルベンゾフラン化合物を得た。ここにトリエチルホスファイトを添加した後、3時間加熱還流した。反応終結後、トルエンを反応混合物に添加して減圧蒸留した。得られた残渣をカラムクロマトグラフィー(n−ヘキサン/酢酸エチル=1:1→酢酸エチル)により精製して標題化合物5.07g(収率85%)を得た。
【0056】
1H NMR(CDCl3,400MHz)δ7.31(d,1H,J=8.9Hz),6.97(d,1H,J=2.6Hz),6.84(dd,1H,J=2.6,8.9Hz),6.58(d,1H,J=3.9Hz)4.10(qn,4H,J=7.1Hz),3.82(s,3H),3.35(d,2H,J=21.3Hz),1.30(t,6H,J=7.1Hz)。
【0057】
実施例1:5−メトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物2)
製造例1で得られた5−メトキシ−2−(ジエトキシホスホリルメチル)ベンゾフラン0.30g(0.001mol)をテトラヒドロフランに溶解して得られた溶液に、0℃で1Mのヘキサメチルジシラザンナトリウム(NaHMDS)テトラヒドロフラン溶液を1.05当量で添加し、30分間攪拌した。ここに、4−ジメチルベンズアルデヒド0.16g(1.05mmol)をテトラヒドロフランに溶解して得られた溶液を添加した後、室温で2時間攪拌した。反応終結後、得られた混合物にメタノールを0℃で加えた。得られた混合物を減圧蒸留し、残渣を水と酢酸エチルの混合物で抽出した。有機層を分離して無水硫酸ナトリウムで乾燥して濾過し、溶媒を減圧蒸留して除去した後に残渣をメタノールで再結晶して標題化合物0.23g(収率80%)を得た。
【0058】
1H NMR(CDCl3,400MHz)δ7.43(d,2H,J=8.8Hz),7.33(d,1H,J=9.0Hz),7.23(d,1H,J=16.1Hz),6.97(d,1H,J=2.5Hz),6.84(dd,1H,J=2.6,8.8Hz),6.79(d,1H,J=16.1Hz),6.72(d,2H,J=8.8Hz),6.52(s,1H),3.85(s,3H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ157.0,155.9,150.4,149.7,130.5,130.0,127.9,124.8,112.3,112.1,111.0,103.4,103.1,55.9,40.4。
【0059】
実施例2:5−ヒドロキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物3)
実施例1で得られた5−メトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化2の化合物)146.7mg(0.5mmol)をジクロロメタンに溶解して得られた溶液に、−78℃で1Mボロントリブロマイドジクロロメタン溶液を10.0当量に添加し、室温で3時間攪拌した。反応終結後、ここに0℃で炭酸ナトリウムを添加してpH7−8で中和した。得られた溶液を水とジクロロメタンの混合物で抽出した。有機層を分離して無水硫酸ナトリウムで乾燥して濾過し、溶媒を減圧蒸留して除去した。得られた残渣に酢酸エチルを添加し、0℃で2NのHClを添加した。得られた沈殿物を濾過して分離した後、酢酸エチルで洗滌し、水で溶解させた。得られた溶液を0℃で炭酸水素カリウムで中和した後、酢酸エチルで抽出し、無水硫酸ナトリウムで乾燥した後、溶媒を減圧蒸留して除去した。得られた残渣をメタノールで再結晶して標題化合物69.8mg(収率50%)を得た。
【0060】
Mp:177.0−178.0℃
IR(KBr):3436,1602,1520,1358,1197,810cm−1
1H NMR(DMSO−d6,400MHz)δ9.10(s,1H),7.43(d,2H,J=7.8Hz),7.27(d,1H,J=8.5Hz),7.09(d,1H,J=16.1Hz),6.90(d,1H,J=16.1Hz),6.84(s,1H),6.67(m,4H),2.92(s,3H).
13C NMR(DMSO−d6,100MHz)δ156.6,153.8,150.8,148.7,130.5,130.3,128.4,127.4,113.1,112.6,112.3,111.1,105.5,103.9,40.0.
MSm/z279(M+)。
【0061】
実施例3〜70
それぞれ対応する出発物質を用いて実施例1及び/または2を繰り返して行うことによって、下記のような分析データをもつ実施例3〜70の化合物を製造した。
【0062】
実施例3:2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物1)
1H NMR(CDCl3,400MHz)δ7.49−7.43(m,4H),7.28−7.16(m,3H),6.82(d,1H,J=16.1Hz),6.73(d,2H,J=8.8Hz),6.57(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ156.1,154.7,150.7,130.7,129.5,127.9,124.8,123.9,122.7,120.4,112.3,112.1,110.7,103.2,40.4。
【0063】
実施例4:5−メチル−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物4)
Mp:188.0−189.0℃
IR(KBr):3437,1600,1518,1359,1184,814cm−1
1H NMR(CDCl3,400MHz)δ7.43(d,2H,J=8.8Hz),7.32(d,1H,J=8.3Hz),7.28(s,1H),7.23(d,1H,J=16.1Hz),7.04(d,1H,J=8.3Hz),6.79(d,1H,J=16.1Hz),6.72(d,2H,J=8.8Hz),6.50(s,1H),3.00(s,6H),2.42(s,3H).
13C NMR(CDCl3,100MHz)δ156.2,153.1,150.4,132.4,130.4,129.6,127.9,125.1,124.9,120.3,112.3,112.2,110.1,103.0,40.4,21.3.
MSm/z277(M+)。
【0064】
実施例5:5−フルオロ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物5)
1H NMR(CDCl3,400MHz)δ7.43(d,2H,J=8.8Hz),7.35(dd,1H,J=4.1,8.9Hz),7.26(d,1H,J=16.1Hz),7.14(dd,1H,J=2.6,8.6Hz),6.94(td,1H,J=2.6,9.0Hz),6.78(d,1H,J=6.78Hz),6.72(d,2H,J=8.8Hz),6.52(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ160.4,158.1,157.9,150.9,150.6,131.4,130.4,130.3,128.1,124.5,112.3,111.7,111.3,111.1,111.0,106.0,105.7,103.2,103.1,40.4.
実施例6:5−クロロ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物6)
1H NMR(CDCl3,400MHz)δ7.45(d,1H,J=2.1Hz),7.43(d,2H,J=8.8Hz),7.35(d,1H,J=8.7Hz),7.26(d,1H,J=16.2Hz),7.16(dd,1H,J=2.1,8.6Hz),6.77(d,1H,J=16.1Hz),6.72(d,2H,J=8.8Hz),6.50(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ157.6,153.1,150.6,131.7,130.9,128.2,128.1,124.5,123.9,117.9,112.3,111.9,111.5,102.4,40.3。
【0065】
実施例7:5−ブロモ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物7)
1H NMR(CDCl3,400MHz)δ7.60(s,1H),7.42(d,2H,J=8.4Hz),7.30−7.24(m,3H),6.77(d,1H,J=16.1Hz),6.71(d,2H,J=8.3Hz),6.49(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ157.5,153.4,150.8,131.8,131.6,128.1,126.6,124.4,122.9,115.7,112.3,112.0,111.4,102.3,40.3。
【0066】
実施例8:5−ヨード−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物8)
1H NMR(CDCl3,400MHz)δ7.81(d,1H,J=1.6Hz),7.49(dd,1H,J=1.7,8.5Hz),7.43(d,2H,J=8.8Hz),7.26(d,1H,J=16.1Hz),7.21(d,1H,J=8.6Hz),6.77(d,1H,J=16.2Hz),6.72(d,2H,J=8.8Hz),6.48(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ157.1,154.1,150.6,132.3,131.8,129.1,128.1,127.9,124.4,112.6,112.2,111.4,101.9,86.2,40.3。
【0067】
実施例9:6−メトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物9)
Mp:194.5−195.5℃
IR(KBr):3437,1602,1489,1356,1146,1107,820cm−1
1H NMR(CDCl3,400MHz)δ7.43(d,2H,J=8.8Hz),7.33(d,1H,J=9.0Hz),7.23(d,1H,J=16.1Hz),6.97(d,1H,J=2.5Hz),6.84(dd,1H,J=2.6,8.8Hz),6.79(d,1H,J=16.1Hz),6.72(d,2H,J=8.8Hz),6.52(s,1H),3.85(s,3H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ157.0,155.9,150.4,149.7,130.5,130.0,127.9,124.8,112.3,112.1,111.0,103.4,103.1,55.9,40.4.
MSm/z293(M+)。
【0068】
実施例10:6−ヒドロキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物10)
1H NMR(DMSO−d6,400MHz)δ9.53(s,1H),7.41(d,2H,J=8.3Hz),7.30(d,1H,J=8.3Hz),7.01(d,1H,J=16.1Hz),6.88(m,2H),6.67(m,4H),2.91(s,3H).
13C NMR(DMSO−d6,100MHz)δ156.1,155.8,154.7,150.6,128.9,128.1,124.7,121.5,121.1,112.7,112.5,112.1,104.0,97.8,40.0。
【0069】
実施例11:6−メチル−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物11)
1H NMR(CDCl3,400MHz)δ7.44(d,2H,J=8.5Hz),7.38(d,1H,J=7.8Hz),7.24(m,2H),7.03(d,1H,J=7.8Hz),6.81(d,1H,J=16.1Hz),6.75(d,2H,J=7.7Hz),6.53(s,1H),3.01(s,6H),2.48(s,3H).
13C NMR(CDCl3,100MHz)δ155.6,155.2,150.2,134.3,129.9,127.9,127.0,125.2,124.1,119.9,112.5,111.0,103.3,40.5,21.8。
【0070】
実施例12:6−フルオロ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物12)
1H NMR(CDCl3,400MHz)δ7.44−7.36(m,3H),7.22(d,1H,J=16.2Hz),7.17(dd,1H,J=1.6,9.0Hz),6.95(m,1H),6.77(d,1H,J=16.2Hz),6.72(d,2H,J=8.9Hz),6.53(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ161.9,159.5,157.0(d,2C),154.7,154.6,150.5,130.6,127.9,125.7,124.7,120.5,120.4,112.3,111.8,110.9,110.7,102.7,98.8,98.5,40.4.
実施例13:6−クロロ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物13)
1H NMR(CDCl3,400MHz)δ7.43(m,3H),7.39(d,1H,J=8.3Hz),7.24(d,1H,J=16.1Hz),7.16(dd,1H,J=1.8,8.3Hz),6.77(d,1H,J=16.1Hz),6.72(d,2H,J=8.9Hz),6.52(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ157.0,154.7,150.5,131.3,129.4,128.2,128.0,124.5,123.4,120.8,112.3,111.5,111.2,102.7,40.3。
【0071】
実施例14:6−ブロモ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物14)
1H NMR(CDCl3,400MHz)δ7.59(s,1H),7.42(d,2H,J=8.7Hz),7.34−7.22(m,3H),6.76(d,1H,J=16.1Hz),6.70(d,2H,J=8.6Hz),6.50(s,1H),3.00(s,6H).
13C NMR(CDCl3,100MHz)δ156.9,155.0,150.6,131.4,128.6,128.1,126.1,124.5,121.9,116.9,114.1,112.3,111.5,102.7,40.3。
【0072】
実施例15:6−ヨード−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物15)
1H NMR(CDCl3,400MHz)δ7.80(s,1H),7.48(dd,1H,J=1.3,8.1Hz),7.43(d,2H,J=8.8Hz),7.24(m,2H),6.77(d,1H,J=16.1Hz),6.72(d,2H,J=8.8Hz),6.51(s,1H),3.01(s,6H).
13C NMR(CDCl3,100MHz)δ156.6,155.2,150.6,131.7,131.5,129.2,128.1,124.5,121.7,119.9,112.3,111.4,102.7,86.9,40.3。
【0073】
実施例16:5−メトキシ−2−(4−アミノスチリル)ベンゾフラン(化合物16)
1H NMR(CDCl3,400MHz)δ7.38(d,1H,J=8.9Hz),7.29(d,2H,J=8.5Hz),7.07(m,2H),6.86(d,1H,J=16.2Hz),6.80(dd,1H,J=2.6,8.9Hz),6.68(s,1H),6.55(d,2H,J=8.5Hz),5.44(s,2H),3.75(s,3H).
13C NMR(CDCl3,100MHz)δ156.6,155.9,149.8,146.7,130.3,129.9,128.1,127.2,115.2,113.0,112.6,111.1,103.8,103.1,55.9。
【0074】
実施例17:5−メトキシ−2−(4−メチルアミノスチリル)ベンゾフラン(化合物17)
Mp:174.0−175.0℃
IR(KBr):3409,1602,1519,1201,1183,819cm−1
1H NMR(CDCl3,400MHz)δ7.38(d,2H,J=8.6Hz),7.33(d,1H,J=8.9Hz),7.2(d,1H,J=16.1Hz),6.97(d,1H,J=2.5Hz),6.83(dd,1H,J=2.6,8.8Hz),6.77(d,1H,J=16.1Hz),6.61(d,2H,J=8.5Hz),6.51(s,1H),3.85(s,3H),2.88(s,3H),1.55(s,3H).
13C NMR(CDCl3,100MHz)δ156.8,155.8,149.7,149.3,130.5,130.0,128.0,125.8,112.4,112.4,111.0,103.4,103.0,55.9,30.5.
MSm/z279(M+)。
【0075】
実施例18:塩酸5−ヒドロキシ−2−(4−アミノスチリル)ベンゾフラン(化合物18)
1H NMR(MeOD−d4,400MHz)δ7.74(d,2H,J=8.5Hz),7.39(d,2H,J=8.5Hz),7.28(m,2H),7.19(d,1H,J=16.2Hz),6.91(d,1H,J=2.4Hz),6.78(dd,1H,J=2.5,8.8Hz),6.73(s,1H).
13C NMR(MeOD−d4,100MHz)δ155.1,153.2,149.6,137.8,129.9,129.7,127.8,127.3,123.0,118.3,113.5,110.5,106.0,105.1。
【0076】
実施例19:塩酸5−ヒドロキシ−2−(4−メチルアミノスチリル)ベンゾフラン(化合物19)
1H NMR(MeOD−d4,400MHz)δ7.77(d,2H,J=8.6Hz),7.48(d,2H,J=8.6Hz),7.29(m,2H),7.21(d,1H,J=16.2Hz),6.91(d,1H,J=2.4Hz),6.79(dd,1H,J=2.5,8.8Hz),6.74(s,1H),3.09(s,1H).
13C NMR(MeOD−d4,100MHz)δ155.1,153.2,149.6,138.3,136.3,129.7,128.0,127.1,121.9,118.5,113.6,110.5,106.2,105.1,36.2。
【0077】
実施例20:6−メトキシ−2−(4−アミノスチリル)ベンゾフラン(化合物20)
1H NMR(CDCl3,400MHz)δ7.35(m,3H),7.15(d,1H,J=16.1Hz),7.02(d,1H,J=1.7Hz),6.83(dd,1H,J=2.2,8.5Hz),6.78(d,1H,J=16.1Hz),6.68(d,2H,J=8.4Hz),6.51(s,1H),3.86(s,3H),3.79(brs,2H).
13C NMR(CDCl3,100MHz)δ158.0,155.8,155.1,146.5,129.1,127.9,127.4,122.8,120.6,115.2,113.0,111.5,103.6,95.7,55.7。
【0078】
実施例21:6−メトキシ−2−(4−メチルアミノスチリル)ベンゾフラン(化合物21)
1H NMR(CDCl3,400MHz)δ7.37(m,3H),7.17(d,1H,J=16.1Hz),7.02(d,1H,J=2.0Hz),6.83(dd,1H,J=2.2,8.5Hz),6.77(d,1H,J=16.1Hz),6.61(d,2H,J=8.6Hz),6.46(s,1H),3.87(s,3H),2.88(s,3H).
13C NMR(CDCl3,100MHz)δ157.9,155.8,155.4,149.3,129.4,127.9,126.1,122.8,120.5,112.4,112.3,111.4,103.2,95.7,55.7,30.6。
【0079】
実施例22:5−メトキシ−2−(3−メトキシ−4−ジメチルアミノスチリル)ベンゾフラン(化合物22)
Mp:226.5−227.5℃
IR(KBr):3436,1595,1507,1470,1204,1167,834cm−1
1H NMR(CDCl3,400MHz)δ7.36−7.33(m,1H),7.10−7.07(m,1H),7.03(d,J=1.69Hz,1H),6.99(d,J=2.55Hz,1H)6.93−6.91(m,1H),6.58(s,1H),3.96(s,3H),3.85(s,3H),2.83(s,6H).
13C NMR(CDCl3,100MHz)δ156.29,155.98,152.29,149.83,142.84,130.76,130.23,129.83,129.65,120.21,118.01,117.44,114.47,113.81,104.46,103.27,103.17,55.90,55.39,43.20。
【0080】
MSm/z323(M+)。
【0081】
実施例23:6−メトキシ−2−(3−メトキシ−4−ジメチルアミノスチリル)ベンゾフラン(化合物23)
1H NMR(CDCl3,400MHz)δ7.38(d,J=8.46Hz,1H),7.19(d,J=16.09Hz),7.02(s,2H),6.87−6.83(m,2H),6.56(s,1H),6.56(s,1H),3.95(s,3H),3.87(s,3H),2.83(s,6H).
13C NMR(CDCl3,100MHz)158.18,155.88,154.80,152.31,142.62,131.03,128.98,122.65,120.74,120.01,118.03,114.55,111.62,108.54,104.25,95.74,55.74,55.38,43.23。
【0082】
実施例24:トリフルオロ酢酸2−(4−アミノスチリル)ベンゾフラン(化合物24)
1H NMR(400MHz,MeOD)δ7.70(d,2H,J=8.49Hz),7.57(d,1H,J=7.76Hz),7.48(d,1H,J=8.16Hz),7.35−7.29(m,4H),7.22(t,1H,J=7.49Hz),7.20(d,1H,J=16.23Hz),6.84(s,1H)。
【0083】
実施例25:トリフルオロ酢酸2−(4−メチルアミノスチリル)ベンゾフラン(化合物25)
1H NMR(400MHz,MeOD)δ7.60(d,2H,J=8.5Hz),7.52(d,1H,J=7.6Hz),7.44(d,1H,J=8.2Hz),7.26(d,1H,J=16.13Hz),7.26(t,1H,J=8.02Hz),7.18(t,1H,J=7.65Hz),7.09(d,2H,J=7.79Hz),7.07(d,1H,J=16.52Hz),6.75(s,1H),2.96(s,3H)。
【0084】
実施例26:2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物26)
1H NMR(400MHz,CDCl3)δ7.49(d,2H,J=7.18Hz),7.46−7.40(m,3H),7.27−7.16(m,2H),6.78(d,1H,J=16.06Hz),6.67(d,1H,J=7.86Hz),6.56(s,1H),3.40(d,4H,J=6.68Hz),1.20−1.18(m,6H)。
【0085】
実施例27:2−(4−メトキシスチリル)ベンゾフラン(化合物27)
1H NMR(400MHz,CDCl3)δ7,53−7.45(m,4H),7.37.24(m,2H),7.19(t,1H,J=8.44Hz),6.92(d,2H,J=8.78Hz),6.88(d,1H,J=16.15Hz),6.63(s,1H),3.83(s,3H)。
【0086】
実施例28:2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物28)
1H NMR(400MHz,CDCl3)δ7.52(d,1H,J=7.48Hz),7.46(d,1H,J=8.02Hz),7.29−7.24(m,3H),7.19(t,1H,J=8.73Hz),7.10−7.08(m,2H),6.88(d,2H,J=8.12Hz,J=4.6Hz),6.64(s,1H),3.94(d,6H,J=9.32Hz)。
【0087】
実施例29:5−クロロ−2−(4−アミノスチリル)ベンゾフラン(化合物29)
1H NMR(400MHz,DMSO)δ7.63(d,J=1.93Hz,1H),7.54(d,J=8.64Hz,1H),7.43(m,J=8.35Hz,2H),7.25(dd,J=8.69Hz,J=2.03Hz,1H),7.18(d,J=16.22Hz,1H),7.00(d,J=16.27Hz,1H),6.80(s,1H),6.75(d,J=8.15Hz,2H),3.93(s,2H)。
【0088】
実施例30:5−クロロ−2−(4−メチルアミノスチリル)ベンゾフラン(化合物30)
1H NMR(400MHz,DMSO)δ7.91(d,J=1.93Hz,1H),7.50(dd,J=6.72Hz,J=1.79Hz,1H),7.36(m,3H),7.15(d,J=16.19Hz,1H),7.91(d,J=16.20Hz,1H),6.72(s,1H),6.53(d,J=8.64Hz,2H),6.08(q,J=5.01Hz,1H),2.70(d,J=5.01Hz,3H)。
【0089】
実施例31:5−クロロ−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物31)
1H NMR(400MHz,CDCl3)δ7.65(d,J=2.12Hz,1H),7.40(d,J=8.82Hz,2H),7.34(d,J=8.6Hz1H),7.18(s,1H),6.77(s,1H),6.72(d,J=2.97Hz1H),6.67(d,J=8.87Hz2H),6.48(s,1H),3.40(q,J=7.08Hz,4H),1.19(t,J=7.02Hz,6H)。
【0090】
実施例32:5−クロロ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン(化合物32)
1H NMR(400MHz,DMSO)δ7.63(dd,J=13.45Hz,J=1.79Hz,1H),7.52(t,J=9Hz,1H),7.13(m,3H),6.82(m,1H),6.58(d,J=13.09Hz,1H),6.45(d,J=8.16Hz,1H),6.25(d,J=12.9Hz,1H),5.46(q,J=5.76Hz,1H),3.78(s,3H)2.73(d,J=5.01Hz,3H)。
【0091】
実施例33:5−クロロ−2−(4−メトキシスチリル)ベンゾフラン(化合物33)
1H NMR(400MHz,CDCl3)δ7.48(d,J=2.34Hz,1H),7.46(d,J=4.12Hz,1H),7.37(m,J=8.64Hz,1H),7.28(d,J=15.86Hz,1H),7.20(dd,J=8.65Hz,J=2.10Hz,1H),6.92(d,J=8.74Hz,2H),6.84(d,J=16.15Hz,1H),6.56(s,1H),3.85(s,3H)。
【0092】
実施例34:5−クロロ−2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物34)
1H NMR(400MHz,CDCl3)δ7.47(d,J=2.01Hz,1H),7.36(d,J=8.61Hz,1H),7.27(m,J=16.11Hz,1H),7.20(dd,J=8.64Hz,J=1.91Hz,1H),7.08(m,2H),6.85(m,2H),6.57(s,1H),3.95(s,3H),3.93(s,3H)。
【0093】
実施例35:5−メトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物35)
1H NMR(400MHz,CDCl3)δ7.40(d,J=8.8Hz,2H),7.32(d,J=8.8Hz,1H),7.16(d,J=16Hz,1H),6.96(d,J=2.8Hz,1H),6.83(dd,J=2.4,8.8Hz,1H),6.75(d,J=16Hz,1H),6.66(d,J=9.2Hz,2H),6.50(s,1H),3.84(s,3H),3.39(q,J=7.2Hz,4H),1.19(t,J=6.8Hz,6H)。
【0094】
実施例36:5−メトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン(化合物36)
1H NMR(400MHz,CDCl3)δ7.35(d,J=9.2Hz,1H),7.26(d,J=16Hz,1H),7.10(m,2H),7.04(s,1H),6.70(d,J=2.4Hz,1H),6.94(d,J=16Hz,1H),6.88(dd,J=2.8,8.8Hz,1H),6.63(s,1H),3.89(s,3H),3.85(s,3H),3.15(s,3H)。
【0095】
実施例37:5−メトキシ−2−(4−メトキシスチリル)ベンゾフラン(化合物37)
1H NMR(400MHz,CDCl3)δ7.46(d,J=8.8Hz,2H),7.34(d,J=8.8Hz,1H),7.24(d,J=16.4Hz,1H),6.98(d,J=2.8Hz,1H),6.91(d,J=8.8Hz,2H),6.85(d,J=16.4Hz,1H),6.84(d,J=2.8Hz,1H),6.57(s,1H),3.85(s,3H),3.84(s,3H)。
【0096】
実施例38:5−メトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物38)
1H NMR(400MHz,CDCl3)δ7.34(d,J=8.8Hz,1H),7.24(d,J=16Hz,1H),7.09(m,2H),6.99(d,J=2.8Hz,1H),6.88(d,J=2.8Hz,1H),6.87(m,1H),6.85(d,J=16Hz,1H),6.58(s,1H),3.95(s,3H),3.91(s,3H),3.85(s,3H)。
【0097】
実施例39:トリフルオロ酢酸5−メチル−2−(アミノスチリル)ベンゾフラン(化合物39)
1H NMR(400MHz,MeOD)δ7.64(d,2H,J=8.47Hz),7.32(d,2H,J=8.37Hz),7.26(d,1H,J=16.32Hz),7.23(d,1H,J=8.54Hz),7.14(s,1H),7.09(d,1H,J=7.94,Hz),6.72(s,1H),2.40(s,3H)。
【0098】
実施例40:トリフルオロ酢酸5−メチル−2−(4−メチルアミノスチリル)ベンゾフラン(化合物40)
1H NMR(400MHz,MeOD)δ7.60(d,2H,J=8.5Hz),7.31(d,2H,J=7.09Hz),7.24(d,1H,J=16.16Hz),7.13(d,2H,J=8.33Hz),7.09(s,1H),7.06(d,1H,J=10.49Hz),6.68(s,1H),3.00(s,3H),2.38(s,3H)。
【0099】
実施例41:5−メチル−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物41)
1H NMR(400MHz,CDCl3)δ7.41(d,2H,J=8.4Hz),7.33(d,1H,J=8.27Hz),7.29−7.26(m,1H),7.23(d,1H,J=16.11Hz),7.04(d,1H,J=8.08Hz),6.77(d,1H,J=16.08Hz),6.67(d,1H,J=8.38Hz),6.49(s,1H),3.40(d,4H,J=6.93Hz),2.43(s,3H),1.27−1.18(m,6H)。
【0100】
実施例42:5−メチル−2−(4−メトキシスチリル)ベンゾフラン(化合物42)
1H NMR(300MHz,CDCl3)δ7.48(d,2H,J=8.64Hz),7.34(d,1H,J=8.52Hz),7.37.23(m,2H),7.07(d,1H,J=8.1Hz),6.92(d,2H,J=8.7Hz),6.87(d,1H,J=16.17Hz),6.57(s,1H),3.86(s,3H),2.43(s,3H)。
【0101】
実施例43:5−メチル−2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物43)
1H NMR(300MHz,CDCl3)δ7.4(d,1H,J=7.85Hz),7.27−7.21(m,3H),7.17.08(m,2H),7.04(d,1H,J=7.98Hz),6.90(s,1H),6.86(d,1H,J=10.808Hz),6.60(s,1H),3.95(d,6H,J=7.97Hz),2.49(s,3H)。
【0102】
実施例44:5−(2−(2−フルオロエトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン(化合物44)
1H NMR(400MHz,CDCl3)δ7.42(d,J=8.4Hz,1H),7.37(d,J=8.4Hz,1H),7.31(d,J=8.4Hz,1H),7.20(d,J=16Hz,1H),6.98(d,J=1.6Hz,1H),6.84(dd,J=2.4,8.8Hz,1H),6.76(d,J=16Hz,1H),6.60(d,J=8.4Hz,2H),6.50(s,1H),4.61(dt,J=47.6,4.0Hz,2H),4.17(t,J=4.8,2H),3.90(m,3H),3.80(t,J=4.0Hz,1H),2.88(s,3H)。
【0103】
実施例45:5−(2−(2−(2−フルオロエトキシ)エトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン(化合物45)
1H NMR(400MHz,CDCl3)δ7.38(d,J=8.8Hz,1H),7.34(d,J=8.4Hz,1H),7.31(d,J=8.8Hz,1H),7.20(d,J=16Hz,1H),6.98(d,J=2.4Hz,1H),6.85(dd,J=2.8,8.8Hz,1H),6.76(d,J=16Hz,1H),6.60(d,J=8.8Hz,2H),6.50(s,1H),4.57(dt,J=47.6,4.0Hz,2H),4.16(t,J=4.8Hz,2H),3.88(t,J=4.8Hz,2H),3.76(m,4H),3.62(m,2H),2.10(s,3H).
13C NMR(100MHz,CDCl3)δ157.09,156.56,155.04,146.61,114.66,113.87,113.30,111.02,104.27,103.88,83.99,82.31,70.84,70.53,70.33,69.93,69.20,68.23,30.92。
【0104】
実施例46:5−ヨード−2−(4−メチルアミノスチリル)ベンゾフラン(化合物46)
1H NMR(400MHz,CDCl3)δ7.81(s,1H),7.46(dd,J=10.92Hz,J=1.39Hz,1H),7.37(d,J=8.53Hz,2H),7.21(d,J=10.61Hz,2H),7.07(s,1H),6.76(d,J=16.10Hz,1H),6.60(d,J=8.47Hz,2H),6.49(s,1H),3.95(s,1H),2.95(s,3H)。
【0105】
実施例47:5−ヨード−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物47)
1H NMR(400MHz,CDCl3)δ7.49(d,J=6.91Hz,1H),7.44(d,J=8.04Hz,1H),7.41(d,J=8.82Hz,2H),7.23(s,1H),7.19(m,1H),6.78(d,J=16.19Hz,1H),6.67(d,J=8.85Hz,2H),6.56(s,1H),3.40(q,J=7.07Hz,4H)1.20(t,J=7.04Hz,6H)。
【0106】
実施例48:5−ヨード−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン(化合物48)
1H NMR(400MHz,DMSO)δ7.52(m,2H),7.21(m,2H),7.01(q,J=13.80Hz,1H),6.90(s,1H),6.57(d,J=12.87Hz,1H),6.45(q,J=4.32Hz,1H),6.25(d,J=12.78Hz,1H),5.41(t,J=3.88Hz,1H),3.85(s,1H)3.73(s,2H),2.73(s,3H)。
【0107】
実施例49:5−ヨード−2−(4−メトキシスチリル)ベンゾフラン(化合物49)
1H NMR(400MHz,DMSO)δ7.59(d,J=7.55Hz1H),7.53(d,J=7.96Hz,1H),7.30(s,1H),7.25(t,J=8.24Hz,2H),7.20(d,J=4.93Hz,2H),7.15(d,J=8.2Hz,1H),6.95(d,J=8.29Hz,1H),6.87(s,1H),3.78(s,3H)。
【0108】
実施例50:5−ヨード−2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物50)
1H NMR(400MHz,DMSO)δ7.59(d,J=8.7Hz,2H),7.53(d,J=7.66Hz,1H),7.26(q,J=7.96Hz,1H),7.22(t,J=9.30Hz,1H),7.13(m,J=16.28Hz,1H),6.96(d,J=8.62Hz,1H),6.86(d,J=15.88Hz,1H),3.82(s,3H),3.77(s,3H)。
【0109】
実施例51:5,6−ジメトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン(化合物51)
1H NMR(400MHz,DMSO)δ7.36(d,J=18Hz,2H),7.21(d,J=9.8Hz,3H),7.12(s,1H),7.03(s,1H),6.93(s,1H),6.43(s,1H),3.85(s,3H),3.82(s,3H),3.80(s,3H)。
【0110】
実施例52:5,6−ジメトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物51)
1H NMR(400MHz,DMSO)δ7.36(d,J=18.12Hz,2H),7.21(d,J=9.8Hz,3H),7.12(s,1H),7.03(s,1H),6.93(s,1H),6.43(s,1H),3.85(s,5H),3.82(s,5H),3.80(s,3H),3.78(s,3H)。
【0111】
実施例53:5,6−ジメトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン(化合物53)
1H NMR(400MHz,DMSO)δ7.12(s,1H),6.98(d,J=6.24Hz,1H),7.00(m,2H),6.65(s,1H),6.42(d,J=8.2Hz,1H),5.35(q,J=4.96Hz,1H),3.79(s,3H),3.77(s,3H),3.74(s,3H),2.72(d,J=4.88Hz,3H)。
【0112】
実施例54:5,6−ジメトキシ−2−(4−メトキシスチリル)ベンゾフラン(化合物54)
1H NMR(400MHz,DMSO)δ7.52(d,J=8.62Hz,2H),7.20(s,1H),7.06(s,1H),7.05(s,2H),6.92(d,J=8.58Hz,2H),6.73(s,1H),3.96(s,3H),3.92(s,6H)。
【0113】
実施例55:5,6−ジメトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物55)
1H NMR(400MHz,CDCl3)δ7.54(s,1H),7.06(m,3H),7.00(s,1H),6.86(m,2H),6.58(s,1H),3.98(s,3H),3.95(s,3H),3.93(s,3H),3.92(s,3H)。
【0114】
実施例56:5−ヒドロキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物56)
1H NMR(400MHz,CDCl3)δ7.39(d,J=8.4Hz,2H),7.28(d,J=8.8Hz,1H),7.21(d,J=16Hz,1H),6.90(d,J=2.4Hz,1H),6.74(d,J=16Hz,1H),6.72(dd,J=2.4,8Hz,1H),6.66(d,J=8.8Hz,2H),6.46(s,1H),4.59(s,OH),3.39(q,J=7.2Hz,4H),1.19(t,J=6.8Hz,6H)。
【0115】
実施例57:6−メトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物57)
1H NMR(400MHz,CDCl3)δ7.38(d,J=8.8Hz,2H),7.35(d,J=8.4Hz,1H),7.15(d,J=16Hz,1H),7.01(d,J=2.4Hz,1H),6.82(dd,J=2.4,8.4Hz,1H),6.74(d,J=16Hz,1H),6.66(d,J=8.8Hz,2H),6.48(s,1H),3.86(s,3H),3.39(q,J=6.8Hz,4H),1.19(t,J=7.2Hz,6H)。
【0116】
実施例58:6−メトキシ−2−(4−メトキシスチリル)ベンゾフラン(化合物58)
1H NMR(400MHz,CDCl3)δ7.45(d,J=8.8Hz,2H),7.37(d,J=8.4Hz,1H),7.18(d,J=16Hz,1H),7.02(d,J=2.0Hz,1H),6.86(d,J=16Hz,1H),6.84(dd,J=2.4,8.4Hz,1H),6.83(d,J=8.8Hz,2H),6.55(s,1H),3.87(s,3H),3.84(s,3H)。
【0117】
実施例59:6−メトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物59)
1H NMR(400MHz,CDCl3)δ7.38(d,J=8.4Hz,1H),7.18(d,J=16Hz,1H),7.07(m,2H),7.01(m,1H),6.86(m,2H),6.84(d,J=16Hz,1H),6.56(s,1H),3.95(s,3H),3.91(s,3H),3.87(s,3H)。
【0118】
実施例60:6−メトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン(化合物60)
1H NMR(400MHz,CDCl3)δ7.39(d,J=8.8Hz,1H),7.19(d,J=16Hz,1H),7.05(m,4H),6.92(d,J=16Hz,1H),6.85(dd,J=2.8,8.8Hz,1H),6.61(s,1H),3.89(s,3H),3.87(s,3H),3.14(s,3H)。
【0119】
実施例61:トリフルオロ酢酸6−メチル−2−(4−アミノスチリル)ベンゾフラン(化合物61)
1H NMR(400MHz,MeOD)δ7.65(d,2H,J=8.51Hz),7.40(d,1H,J=7.92Hz),7.27(s,2H),7.23(d,2H,J=8.02Hz),7.13(d,1H,J=16.19Hz),7.04(d,1H,J=7.98Hz),6.74(s,1H),2.42(s,3H)。
【0120】
実施例62:トリフルオロ酢酸6−メチル−2−(4−メチルアミノスチリル)ベンゾフラン(化合物62)
1H NMR(400MHz,MeOD)δ7.63(d,2H,J=8.59Hz),7.39(d,1H,J=7.92Hz),6.62(d,1H,J=6.62Hz),7.22(d,3H,J=8.89Hz),7.09(d,1H,J=16.2Hz),7.09(d,1H,J=7.96Hz),6.72(s,1H),3.02(s,3H),2.97(s,3H)。
【0121】
実施例63:6−メチル−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物63)
1H NMR(400MHz,CDCl3)δ7.40(d,2H,J=8.30Hz),7.36(d,1H,J=8.10Hz),7.25(s,1H),7.20(d,1H,J=16.1Hz),7.01(d,1H,J=7.32Hz),6.76(d,1H,J=7.32Hz),6.76(d,1H,J=16.05Hz)6.67(d,1H,J=8.20Hz),6.50(s,1H),3.39(d,4H,J6.81Hz),2.47(s,3H),1.29−1.26(m,6H)。
【0122】
実施例64:6−メチル−2−(4−メトキシスチリル)ベンゾフラン(化合物64)
1H NMR(300MHz,CDCl3)δ7.48(d,2H,J=8.73Hz),7.40(d,1H,J=7.88Hz),7.27−7.21(m,2H),7.03(d,1H,J=7.96Hz),6.92(d,2H,J=8.6Hz),6.86(d,1H,J=16.15Hz),6.59(s,1H),3.88(s,3H),2.48(s,3H)。
【0123】
実施例65:6−メチル−2−(3,4−ジメトキシスチリル)ベンゾフラン(化合物65)
1H NMR(400MHz,CDCl3)δ7.35(d,1H,J=7.84Hz),7.30−7.22(m,3H),7.09−7.07(m,3H),6.86−6.84(m,2H)6.57(s,1H),3.93(d,6H,J=14.2Hz),2.44(s,3H)。
【0124】
実施例66:6−(2−(2−(2−フルオロエトキシ)エトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン(化合物66)
1H NMR(400MHz,CDCl3)δ7.36(d,J=8.8Hz,1H),7.34(d,J=8.8Hz,1H),7.31(d,J=8.8Hz,1H),7.15(d,J=16Hz,1H),7.02(d,J=1.6Hz,1H),6.84(dd,J=2.4,8.4Hz,1H),6.75(d,J=16Hz,1H),6.60(d,J=8.8Hz,2H),6.48(s,1H),4.57(dt,J=47.6,4.0Hz,2H),4.19(t,J=4.8,2H),3.90(t,J=4.8Hz,2H),3.80(m,6H),2.87(s,3H)。
【0125】
実施例67:6−ヒドロキシ−2−(4−アミノスチリル)ベンゾフラン(化合物67)
1H NMR(400MHz,CDCl3)δ7.36(d,J=8.4Hz,1H),7.29(d,J=8.4Hz,1H),7.14(d,J=16Hz,1H),6.91(d,J=32Hz,1H),6.76(d,J=16Hz,1H),6.72(d,J=8.8Hz,1H),6.67(dd,J=5.2,8.4Hz,2H),6.54(d,J=36Hz,1H),6.38(dd,J=13,92Hz,1H),4.84(brs,OH),3.79(brs,NH2)。
【0126】
実施例68:6−ヒドロキシ−2−(4−メチルアミノスチリル)ベンゾフラン(化合物68)
1H NMR(400MHz,DMSO−d6)δ9.52(s,NHMe),7.35(d,J=8.8Hz,1H),7.31(d,J=8.4Hz,1H),7.00(d,J=16Hz,1H),6.87(s,1H),6.84(d,J=16Hz,1H),6.69(dd,J=2.0,8.0Hz,1H),6.62(s,1H),6.53(d,J=8.8Hz,2H),5.98(d,J=4.8Hz,1H),2.70(d,J=4.8Hz,3H)。
【0127】
実施例69:6−ヒドロキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン(化合物69)
1H NMR(400MHz,CDCl3)δ7.38(d,J=8.8Hz,2H),7.35(d,J=8.4Hz,1H),7.15(d,J=16Hz,1H),7.01(d,J=2.4Hz,1H),6.82(dd,J=2.4,8.4Hz,1H),6.74(d,J=16Hz,1H),6.66(d,J=8.8Hz,2H),6.47(s,1H),4.75(s,OH),3.39(q,J=6.8Hz,4H),1.19(t,J=7.2Hz,6H)。
【0128】
実施例70:5,6−ジメトキシ−2−(4−メチルアミノスチリル)ベンゾフラン(化合物70)
1H NMR(400MHz,CDCl3)δ7.71(d,J=7.71Hz,1H),7.19(m,4H),6.85(d,J=1.84Hz,2H),6.61(d,J=7.8Hz,2H),6.30(d,J=10.44Hz,1H),3.96(s,3H),3.94(s,3H),3.93(s,3H)。
【0129】
試験例1:試験管内でのβ−アミロイドフィブリル形成阻害効能(ThT蛍光分析)
本発明の化合物のβ−アミロイドフィブリル形成阻害効能を評価するために、下記の方法で実験を行った。
【0130】
本試験ではβ−アミロイドタンパク質、すなわちβ−アミロイド40及びβ−アミロイド42のうち、強い神経毒性を有して治療剤開発のための作用点となるβ−アミロイド42を用いた(Hammarstrom,P.et al.,Science 2003,299,713;及びCai,X.D.et al.,Science 1993,259,514)。
【0131】
β−アミロイド42(Aβ42)をジメチルスルホキシド(DMSO)に溶解して250mMのAβ42貯蔵液を作製した。また、ThT(thioflavin T)を1mMの濃度で蒸留水に溶解後、50mMのグリシン緩衝溶液(pH8.5)で希薄して5μMのThT貯蔵液を作製した。
【0132】
96ウェル蛍光マイクロプレート(白色、F−bottom)の各ウェルに45μlのPBS(phosphate buffer saline,pH7.4)を加え、更に250μMのAβ42貯蔵液5μlを加えた。実施例で得られたそれぞれの標題の化合物をDMSOに溶解して得られた溶液を2μlずつ各ウェルに添加し、各化合物の最終濃度が10〜0.001μMになるようにした。この時、各ウェルでのAβ42の最終濃度が25μMになった。その後、プレートを室温で1時間培養し、各ウェルに5μMのThT貯蔵液150μlを添加した。
【0133】
多重表示蛍光計数器(LS−55 Luminescence spectrometer、Perkin Elmer社製)を用いて励起波長450nm(励起スリット幅10nm)及び発光波長482nm(発光スリット幅10nm)で計数時間を1秒に調整しながら各ウェルの蛍光度を測定した。本発明の化合物を添加せずに、PBS溶液、Aβ42、及びDMSOを添加して対照群を製造した。β−アミロイドフィブリル形成に対する%阻害率を下記数式により計算し、グラフパッドプライズムバージョン4.03(GraphPad Prismversion 4.03)プログラムを用いてIC50を計算した。
【0134】
(数式1)
%阻害率=[1−(C−D)/(A−B)]×100
A(対照群):PBS溶液、Aβ42、及びDMSO処理群を用いた際の蛍光度
B(空試験値):PBS溶液及びDMSO処理群を用いた際の蛍光度
C(実験群):PBS溶液、Aβ42、DMSO、及び本発明の化合物処理群を用いた際の蛍光度
D(実験群補正値):PBS溶液、DMSO、及び本発明の化合物処理群を用いた際の蛍光度
Aβ42形成阻害に対する10μMでの%阻害率値及びIC50値を比較物質と比べた結果を表1〜7に示す。
【0135】
比較物質としては優れたAβ42形成阻害の効能を有する物質と知られたクルクミン(Sigma社製)、2−[2−(2−(ジメチルアミノチアゾール−5−イル)エテニル]ベンゾチアゾール(EP1655287、比較例1)、及び2−4−(ジメチルアミノフェニルエテニル)ベンゾチアゾール(WO02/16333 、比較例2)を用いた。
【0136】
表1〜7はそれぞれ別途実施した実験結果を示す。よって、表1〜7のクルクミンのIC50値は、各実験におけるβ−アミロイド42の蓄積程度やThTの状態に応じて変わる。本発明の化合物のβ−アミロイド42形成阻害の効能は、各表に示したIC50値を比較化合物と相対的に比較して評価することができる。
【表1】

【表2】

【表3】

【表4】

【表5】

【表6】

【表7】

【0137】
前記表1〜6から分かるように、本発明の化合物の殆どは、例えば、化合物3,4、6、7、8、9及びその塩酸塩、17及びその塩酸塩、22,23、30、34、37、44、46、47、48、54、56、59及び65は、β−アミロイド42形成阻害に対して比較物質であるクルクミンより優れた%阻害率を表した。
【0138】
また、表7から分かるように、本発明の化合物9及び17はβ−アミロイド42形成阻害に対して、従来技術の比較例1及び2の化合物より優れた%阻害率及びIC50値を表した。
【0139】
試験例2:マウス及びラットにおける薬動力学試験及び脳血管障壁透過率の試験
1.薬動力学試験
1)実験動物及び試験化合物の投与
7週齢のICR系のマウス(体重約30g)及び8週齢のSD系のラット(体重約250g)を各実験群当り3匹ずつ用いた。各実験動物に実施例9及び17の化合物を賦形剤(DMSO/Tween 20/食塩水:0.1/0.6/2.3,v/v/v)にそれぞれ溶解して得られた溶液を投与した。この時、経口投与の場合は10mL/kg体重の量で投与し、静脈投与の場合は5mL/kg体重の量で尾静脈を通じて投与した。
【0140】
2)血中濃度試験
経口投与後30分、1時間、2時間、4時間、10時間、及び24時間目にマウスは眼窩静脈から、ラットは頸静脈からヘパリン(1000IU/mL,3μl)を添加したチューブに血液を採血した。血液試料を12,000rpmで2分間遠心分離して血漿を得た。得られた血漿を分析前まで−80℃の冷凍庫で保管した。
【0141】
3)試料の分析
LC/MSMSシステムを用いて次のような条件下で試料を分析した。
【表8】

【0142】
試料の前処理方法は次の通りである。
【0143】
血漿50μlを取り、蓋付2.0mLのチューブ(Eppendorf Co.社製)に入れ、ここに0.1%ギ酸20μlを添加して酸性化した。内部標準溶液及び抽出溶媒として酢酸エチル1mLを得られた溶液に添加した。得られた溶液をサーモミキサー(Eppendorf Co.社製)を用いて1,400rpmで5分間混合した後、遠心分離した(Eppendorf Co.社製)。上澄み液を取って35℃でサイクロンを用いて濃縮した。残渣を移動相50μlで再溶解させた後、得られた溶液5μlをLC/MSに注入して分析した。
【0144】
2.脳血管障壁透過率の試験
1)実験動物及び試験化合物の投与
7週齢のICR系のマウス(体重約30g)及び8週齢のSD系のラット(体重約250g)を各実験群当り3匹ずつ用いた。実施例9及び17の化合物を賦形剤(DMSO/Tween 20/食塩水:0.1/0.6/2.3,v/v/v)に溶解して得られた溶液を各実験動物に投与した。この時、経口投与の場合10mL/kg体重の量で投与し、静脈投与の場合5mL/kg体重の量で尾静脈を通じて投与した。
【0145】
2)血中及び組職中の濃度測定(同時試験)
(1)血液試料の採取
試験化合物の経口投与後30分、1時間、2時間、4時間、10時間、及び24時間目にイソフルランを用いてマウス及びラットを呼吸痲酔した後、開腹した。腹部静脈から約1mLの血液をヘパリン(1000IU/mL,3μl)を添加したチューブに採血した。得られた血液試料を12,000rpmで2分間遠心分離して血漿を得た。得られた血漿は分析前まで−80℃の冷凍庫で保管した。
【0146】
(2)臓器組職試料の採取
血液採取したマウス及びラットを十分に放血した後、迅速に脳組織を採取した。採取した脳組織を生理食塩水で1回または2回洗浄して血液を除去した。脂肪組織及び周辺組職を除去した後、脳組職の重さを測定した。10倍に希薄された4%ウシ血清アルブミン(BSA)溶液を前記脳組職に添加した。得られた溶液を組職破鎖機で均質化した。得られた希薄均質液を2mLのチューブに移した後、分析前まで−80℃冷凍庫に保管した。すべての試料の処理は冷凍状態で行った。
【0147】
3)試料の分析
LC/MSMSシステムを用いて次のような条件下で試料を分析した。
【表9】

【0148】
試料の前処理方法は次の通りである。
【0149】
血漿50μlを取って蓋付2.0mLのチューブ(Eppendorf Co.社製)に入れ 、ここに0.1%ギ酸20μlを添加して酸性化した。内部標準溶媒及び抽出溶媒として酢酸エチル1mLを得られた溶液に添加した。得られた溶液をサーモミキサー(Eppendorf Co.社製)を用いて1、400rpmで5分間混合した後に遠心分離した(Eppendorf Co.社製)。上澄み液を取って35℃でサイクロンを用いて濃縮させた。残渣を移動相50μlで再溶解した後、得られた溶液5μlをLC/MSに注入して分析した。
【0150】
3.結果
実施例9及び17の化合物のマウスにおける薬動力学試験及び脳血管障壁透過率の試験結果を下記の表8に示し、レットにおける結果を下記の表9に示す。
【0151】
下記表8及び9に記載の「iv」は静脈注射を、「po」は口腔投与を、「AUC plasma」は血漿濃度曲線下面積を、「Cmax」は血漿最高濃度を、「Tmax」はCmaxに到逹する時間を、「BA」は下記数式2による生体利用率(%)を、「AUC Brain」は時間による脳組職濃度曲線下面積を、「AUC Brain/AUC Plasma」は試験化合物の脳への速度を意味する。
【0152】
(数式2)
生体利用率(%)=[(AUCpo/AUCiv)×(Doseiv/Dosepo)×100]
前記式中、AUCpoは経口投与後の血中濃度時間曲線下面積(AUC)を、AUCivは静脈注射の後のAUCを、Doseivは静脈注射量を、Dosepoは経口投与量を意味する。
【表10】

【表11】

【0153】
前記表8及び9から分かるように、実施例9及び17の化合物は脳疾患治療剤として適した高AUC及び優れた生体利用率を示した。
【0154】
また、脳血管障壁透過率の試験結果、実施例9及び17の化合物は血漿対比100%以上の透過能を示して脳疾患治療剤として適していることが明らかになった。
【0155】
試験例3:hERGカリウムイオンチャンネル阻害効能
1)モデル細胞株及び培養
hERGが安定的に発現されたHEK−hERG細胞株(IonGate Biosciences,Frankfurt,Germany Co.)をDMEM(Dulbecco’s Modified Eagle’s Medium,Sigma Co.,St.Louis,MO,USA)から10%ウシ胎児血清(FBS,Cambrex,Walkersville,MD,USA)、及び0.5mg/mLのゼオシン(Invitrogen,Carlsbad,CA,USA)を添加して培養した。前記細胞株は、培養5日後80%程度培養フラスコを覆ったときに継代培養した。
【0156】
2)試験溶液及び試験薬物の製造
(1)試験溶液
カリウムイオン電流の測定のために用いられた電極内溶液は、115mMのアスパラギン酸カリウム、20mMのKCl、10mMのEGTA、10mMのHEPES、2.5mMのトリス−ホスホクレアチン、0.1mMのNa2GTP及び5mMのMgCl2(pH7.2,290mOsm/Kg H2O)で構成された。また、細胞外潅流液は135mMのNaCl、5mMのKCl、1mMのMgCl2,2mMのCaCl2、10mMのグルコース、及び10mMのHEPES(pH7.2、300mOsm/KgH2O)で構成された。
【0157】
(2)試験薬物
本発明の化合物を細胞外潅流液を用いて所望の濃度にそれぞれ希薄して試験薬物溶液を製造した。製造された試験薬物溶液をガスクロマトグラフィ用の毛細管に連結された7−アレイポリエチレンチューブに置き、HEK−hERG細胞株の100μm以内高さのカラム先端から落ちるようにした。
【0158】
3)イオン電流測定
カリウムイオン電流の測定は、EPC10(Instrutech Co.,NY,USA)パッチクランプ増幅器を用いた典型的な全細胞パッチクランプ(whole−cell patch clamp)方法を用いた。測定に用いられた電極は、P−97Fleming Brown型のマイクロピベット・プラー微小電極作製器(Sutter Instrument Co.社製)で製造されたボロシリケイトガラス管(外径:1.65mm、内径:1.2mm、Corning 7052,Garner Glass Co.社製 ,Claremont,CA,USA)を使用した。前記電極をSylgard 184(Dow Corning Co.社製 ,Midland,MI,USA)でコートした後、マイクロフォージ(Narishige Co.社製,Tokyo,Japan)で仕上げた。前記電極は電極内部を溶液で満たしたときに2〜3MΩの抵抗をみせた。HEK−hERG細胞が入っている培養皿を倒立顕微鏡(Nikon Co.社製)に置き、本発明の化合物が含まれた細胞外潅流液を1−2mL/min速度で潅流した。細胞膜の電気容量と直列抵抗を80%以上補正し、サンプリング率は2kHzにし、ローパスフィルターは2kHz(−3dB;8−pole Bassel filter)にしてカリウムイオン電流を測定した。すべての実験は室温(21−24℃)で行った。
【0159】
4)データ分析及び統計処理
実験結果はPulse/Pulsefit(v9.0,HEKA Elcktronik,Lambrecht,Germany)とIgorマクロを用いて分析した。すべての結果は平均±標準誤差で表示した。Hill公式[Block=(1+IC50/[drug]n)−1]を用いて濃度反応曲線から試験化合物のIC50、つまりイオン電流を50%程度抑制した時の試験化合物の濃度を計算した。その結果を下記表10に示す。
【表12】

【0160】
前記表10から分かるように、本発明の実施例9及び17の化合物は、hERGカリウムイオンチャンネルに対する阻害効能は微々して心臓毒性がないように判断される。
【0161】
試験例4:生体内恐怖条件付け試験
1)遺伝子変形マウス
雄のB6C3−Tg(APPswe,PSEN1dE9,Jackson Laboratory Co.社製,Maine,A)と雌のB6C3F1(中央実験動物社、韓国)との間から生まれた3週齢のマウスの尻尾を約0.5cm(tail biopsy)長さに切った。尻尾サンプルからゲノムDNA(genomic DNA)を抽出し、遺伝子型検査を実施して二重遺伝子変形(Tg)マウスを選別した。
【0162】
前記のような遺伝子変形マウスは、痴呆治療効能試験において一般的に用いられるが、これは5ヶ月齢以上であれば脳にβ−アミロイドが蓄積して人間痴呆患者のような拡張表現型が現れるためである。
【0163】
2)薬物投与
5ヶ月齢から12ヶ月齢までのマウスに実施例9の化合物を30mg/kgまたは100mg/kgの量で毎日経口投与した。比較化合物としてはβ−アミロイドタンパク質と結合して沈着及び細胞毒性を阻害するトラミプロセートを用いた(Aisen,P.S.et.al.,Curr.Alzheimer Res.2007,4,473)。前記化合物を投与した。
【0164】
3)恐怖条件付け試験
訓練第一日目のマウスを条件付け箱に入れて2分間適応させた。恐怖条件付け実験として20秒間75dBの條件刺激(CS)を与え、条件刺激の最後の2秒間に0.5mAの電気刺激(unconditional stimulus(US))を一緒に与えた。1分後動物を飼育箱に移動した。24時間後に記憶力検査を行った。前記条件付け箱に動物を入れて5分間観察した。この時、CSとUSは提示せずに凍結反応を測定した。前記凍結反応とは動物が呼吸以外の動きがない状態を意味する。
【0165】
4)β−アミロイド量測定
恐怖条件付け試験後、脳を摘出して組織染色を行った。脳に沈着されたβ−アミロイドの量をELISA法を用いて測定した。その結果を下記の表11に示す。
【表13】

【0166】
前記表11から分かるように、本発明の実施例9の化合物は、トラミプロセートに比べて投与量依存的に高い記憶力を示した。
【0167】
試験例5:組職染色試験
試験例4の1)及び2)でのように、遺伝子変形マウスを選別して薬物投与をした。前記遺伝子変形マウスから脳を分離し、10%中性ホルマリン溶液で固定した。海馬と皮質を含む脳部位を切除して、水洗、脱水、及びパラフィン浸透の過程を経て脳組織を含むパラフィンブロックを作製した。パラフィンブロックを8μMに薄切りして海馬の全体領域に対する標本を作製し、その中から10個の標本を一定間隔に選び取って脱パラフィンした後に含水させた。その後、マイヤーヘマトキシリン液に1分間沈積し、水道水で水洗いした。水洗いした組職をアルカリ性塩化ナトリウム溶液中に20分間反応させた後、アルカリ性コンゴーレッド染色液に20分間反応させた。得られた組職を100%のエチルアルコールで洗浄し、キシレンで透明化させ、合成封入剤を用いて封入した。コンゴーレッドに染色されたすべての組織標本の海馬と皮質部位でそれぞれコンゴーレッド染色陽性のβ−アミロイドプラークを計数した。その結果を下記表12に示す。
【表14】

【0168】
前記表12から分かるように、本発明の実施例9の化合物はトラミプロセートに比べて優れたβ−アミロイドプラーク沈着量減少率を投与量依存的な様式で示した。
【0169】
図1及び2は、実施例9の化合物または比較化合物であるトラミプロセートで染色された遺伝子変形マウスの海馬及び皮質組職をそれぞれ示す図である。
【0170】
図1及び2に図示したとおり、実施例9の化合物の場合トラミプロセートに比べてβ−アミロイドの沈着が顕著に減少されたことが分かる。
【0171】
試験例6:生化学試験
試験例4の1)及び2)の方法で遺伝子変形マウスを選別して薬物投与した。前記遺伝子変形マウスの脳組職から海馬組織を摘出し、8倍に当たる量の5MグアニジンHCl/50mM Tris HClに入れて組職破鎖機で均質化した。その後、3時間室温に置いてこの均質液をタンパク質分解阻害剤(Pierce(登録商標),Cat No.78415)を含むBSAT−DPBS(5% BSA及び0.03% Tween−20を含むDulbecco’s phosphate buffered salin)で50倍希薄した。Human beta−amyliod HS 1−42 colorimetric kit(Invitrogen(登録商標),Cat No.#KHB3544)を用いてβ−アミロイド42の量を測定した。その結果を下記表13に示す。
【表15】

【0172】
前記表13から分かるように、本発明の実施例9の化合物はトラミプロセートに比べて優れたβ−アミロイドプラークの沈着量減少率を投与量依存的な様式で示した。
【0173】
以上、本発明は前記実施例を中心に説明したが、これは例示に過ぎず、本発明は本発明の技術分野における通常の知識を有する者に自明な多様な変形及び均等なその他の実施例を以下に添付する特許請求の範囲内で行なうことができるという事実を認めなければならない。
【特許請求の範囲】
【請求項1】
式(I)の化合物またはその薬剤学的に許容可能な塩:
【化1】

前記式中、
R1及びR2は、それぞれ独立的にH、OH、ハロゲン、C1−C3アルコキシ、C1−C3アルキル、一つ以上のハロゲンまたはヒドロキシ基を有する置換されたポリ(C1−C3アルコキシ)、または一つ以上のC1−C3アルキル基を有する置換されたピラニル(C1−C3アルコキシ)であり;
R3は、NH2、C1−C3アルキルアミノ、C1−C3ジアルキルアミノ、またはC1−C3アルコキシであり;
R4はHまたはC1−C3アルコキシである。
【請求項2】
前記R1及びR2がそれぞれ独立的にH、OH、ハロゲン、OCH3、CH3、(OCH2CH2)2F、(OCH2CH2)3F、またはジメチルピラニルメトキシであり;
R3が、NH2、NHCH3、N(CH3)2、またはOCH3であり;
R4がHまたはOCH3である、請求項1に記載の化合物またはその薬剤学的に許容可能な塩。
【請求項3】
下記化合物からなる群より選ばれることを特徴とする請求項1に記載の化合物またはその薬剤学的に許容可能な塩:
2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−メトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−ヒドロキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−メチル−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−フルオロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−クロロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−ブロモ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−ヨード−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−メトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−ヒドロキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−メチル−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−フルオロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−クロロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−ブロモ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−ヨード−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−メトキシ−2−(4−アミノスチリル)ベンゾフラン;
5−メトキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
塩酸5−ヒドロキシ−2−(4−アミノスチリル)ベンゾフラン;
塩酸5−ヒドロキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
6−メトキシ−2−(4−アミノスチリル)ベンゾフラン;
6−メトキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
5−メトキシ−2−(3−メトキシ−4−ジメチルアミノスチリル)ベンゾフラン;
6−メトキシ−2−(3−メトキシ−4−ジメチルアミノスチリル)ベンゾフラン;
トリフルオロ酢酸2−(4−アミノスチリル)ベンゾフラン;
トリフルオロ酢酸2−(4−メチルアミノスチリル)ベンゾフラン;
2−(4−ジエチルアミノスチリル)ベンゾフラン;
2−(4−メトキシスチリル)ベンゾフラン;
2−(3,4−ジメトキシスチリル)ベンゾフラン;
5−クロロ−2−(4−アミノスチリル)ベンゾフラン;
5−クロロ−2−(4−メチルアミノスチリル)ベンゾフラン;
5−クロロ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
5−クロロ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
5−クロロ−2−(4−メトキシスチリル)ベンゾフラン;
5−クロロ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
5−メトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
5−メトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
5−メトキシ−2−(4−メトキシスチリル)ベンゾフラン;
5−メトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
トリフルオロ酢酸5−メチル−2−(アミノスチリル)ベンゾフラン;
トリフルオロ酢酸5−メチル−2−(4−メチルアミノスチリル)ベンゾフラン;
5−メチル−2−(4−ジエチルアミノスチリル)ベンゾフラン;
5−メチル−2−(4−メトキシスチリル)ベンゾフラン;
5−メチル−2−(3,4−ジメトキシスチリル)ベンゾフラン;
5−(2−(2−フルオロエトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
5−(2−(2−(2−フルオロエトキシ)エトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
5−ヨード−2−(4−メチルアミノスチリル)ベンゾフラン;
5−ヨード−2−(4−ジエチルアミノスチリル)ベンゾフラン;
5−ヨード−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
5−ヨード−2−(4−メトキシスチリル)ベンゾフラン;
5−ヨード−2−(3,4−ジメトキシスチリル)ベンゾフラン;
5,6−ジメトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5,6−ジメトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
5,6−ジメトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
5,6−ジメトキシ−2−(4−メトキシスチリル)ベンゾフラン;
5,6−ジメトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
5−ヒドロキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
6−メトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
6−メトキシ−2−(4−メトキシスチリル)ベンゾフラン;
6−メトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
6−メトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
トリフルオロ酢酸6−メチル−2−(4−アミノスチリル)ベンゾフラン;
トリフルオロ酢酸6−メチル−2−(4−メチルアミノスチリル)ベンゾフラン;
6−メチル−2−(4−ジエチルアミノスチリル)ベンゾフラン;
6−メチル−2−(4−メトキシスチリル)ベンゾフラン;
6−メチル−2−(3,4−ジメトキシスチリル)ベンゾフラン;
6−(2−(2−(2−フルオロエトキシ)エトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
6−ヒドロキシ−2−(4−アミノスチリル)ベンゾフラン;
6−ヒドロキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
6−ヒドロキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
5,6−ジメトキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
5−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−アミノスチリル)ベンゾフラン;
5−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
5−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−アミノスチリル)ベンゾフラン;
6−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;及び
6−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−ジメチルアミノスチリル)ベンゾフラン。
【請求項4】
式(II)の化合物を塩基の存在下で有機溶媒中で式(III)の化合物とホーナーエモンズ(Honer−Emmons)反応させる段階とを含む請求項1に記載の式(I)の化合物の製造方法:
【化2】

前記式中、
X、R1、R2、R3、及びR4は請求項1で定義した通りである。
【請求項5】
前記塩基が、アルカリ金属の水素化物、アルキルアルカリ金属化合物、アルカリ金属のアルコキシド化合物、アルカリ金属アミド化合物、及びこれらの混合物からなる群より選ばれる請求項4に記載の製造方法。
【請求項6】
前記有機溶媒がエーテルである請求項4に記載の製造方法。
【請求項7】
ホーナーエモンズ反応によって生成された化合物をボロントリクロリド、ボロントリフルオリド、ボロントリブロマイド、またはヨードトリメチルシランの有機溶媒溶液を用いて脱メチル化させる段階をさらに含む請求項4から請求項6に記載の製造方法。
【請求項8】
請求項1に記載の式(I)の化合物またはその薬剤学的に許容可能な塩を有効成分として含むβ−アミロイドフィブリルの形成阻害用医薬組成物。
【請求項9】
請求項1に記載の式(I)の化合物またはその薬剤学的に許容可能な塩を有効成分として含む退行性脳疾患の予防または治療用医薬組成物。
【請求項10】
前記薬剤学的に許容可能な塩が、塩酸、臭化水素酸、硫酸、リン酸、硝酸、酢酸、グリコール酸、乳酸、ピルビン酸、マロン酸、コハク酸、グルタル酸、フマル酸、リンゴ酸、マンデル酸、酒石酸、クエン酸、アスコルビン酸、パルミチン酸、マレイン酸、ヒドロキシマレイン酸、安息香酸、ヒドロキシ安息香酸、フェニル酢酸、桂皮酸、サリチル酸、メタンスルホン酸、ベンゼンスルホン酸、トルエンスルホン酸、及びこれらの混合物からなる群より選ばれる酸の塩であることを特徴とする請求項9に記載の医薬組成物。
【請求項1】
式(I)の化合物またはその薬剤学的に許容可能な塩:
【化1】

前記式中、
R1及びR2は、それぞれ独立的にH、OH、ハロゲン、C1−C3アルコキシ、C1−C3アルキル、一つ以上のハロゲンまたはヒドロキシ基を有する置換されたポリ(C1−C3アルコキシ)、または一つ以上のC1−C3アルキル基を有する置換されたピラニル(C1−C3アルコキシ)であり;
R3は、NH2、C1−C3アルキルアミノ、C1−C3ジアルキルアミノ、またはC1−C3アルコキシであり;
R4はHまたはC1−C3アルコキシである。
【請求項2】
前記R1及びR2がそれぞれ独立的にH、OH、ハロゲン、OCH3、CH3、(OCH2CH2)2F、(OCH2CH2)3F、またはジメチルピラニルメトキシであり;
R3が、NH2、NHCH3、N(CH3)2、またはOCH3であり;
R4がHまたはOCH3である、請求項1に記載の化合物またはその薬剤学的に許容可能な塩。
【請求項3】
下記化合物からなる群より選ばれることを特徴とする請求項1に記載の化合物またはその薬剤学的に許容可能な塩:
2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−メトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−ヒドロキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−メチル−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−フルオロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−クロロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−ブロモ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−ヨード−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−メトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−ヒドロキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−メチル−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−フルオロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−クロロ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−ブロモ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−ヨード−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5−メトキシ−2−(4−アミノスチリル)ベンゾフラン;
5−メトキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
塩酸5−ヒドロキシ−2−(4−アミノスチリル)ベンゾフラン;
塩酸5−ヒドロキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
6−メトキシ−2−(4−アミノスチリル)ベンゾフラン;
6−メトキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
5−メトキシ−2−(3−メトキシ−4−ジメチルアミノスチリル)ベンゾフラン;
6−メトキシ−2−(3−メトキシ−4−ジメチルアミノスチリル)ベンゾフラン;
トリフルオロ酢酸2−(4−アミノスチリル)ベンゾフラン;
トリフルオロ酢酸2−(4−メチルアミノスチリル)ベンゾフラン;
2−(4−ジエチルアミノスチリル)ベンゾフラン;
2−(4−メトキシスチリル)ベンゾフラン;
2−(3,4−ジメトキシスチリル)ベンゾフラン;
5−クロロ−2−(4−アミノスチリル)ベンゾフラン;
5−クロロ−2−(4−メチルアミノスチリル)ベンゾフラン;
5−クロロ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
5−クロロ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
5−クロロ−2−(4−メトキシスチリル)ベンゾフラン;
5−クロロ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
5−メトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
5−メトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
5−メトキシ−2−(4−メトキシスチリル)ベンゾフラン;
5−メトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
トリフルオロ酢酸5−メチル−2−(アミノスチリル)ベンゾフラン;
トリフルオロ酢酸5−メチル−2−(4−メチルアミノスチリル)ベンゾフラン;
5−メチル−2−(4−ジエチルアミノスチリル)ベンゾフラン;
5−メチル−2−(4−メトキシスチリル)ベンゾフラン;
5−メチル−2−(3,4−ジメトキシスチリル)ベンゾフラン;
5−(2−(2−フルオロエトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
5−(2−(2−(2−フルオロエトキシ)エトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
5−ヨード−2−(4−メチルアミノスチリル)ベンゾフラン;
5−ヨード−2−(4−ジエチルアミノスチリル)ベンゾフラン;
5−ヨード−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
5−ヨード−2−(4−メトキシスチリル)ベンゾフラン;
5−ヨード−2−(3,4−ジメトキシスチリル)ベンゾフラン;
5,6−ジメトキシ−2−(4−ジメチルアミノスチリル)ベンゾフラン;
5,6−ジメトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
5,6−ジメトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
5,6−ジメトキシ−2−(4−メトキシスチリル)ベンゾフラン;
5,6−ジメトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
5−ヒドロキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
6−メトキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
6−メトキシ−2−(4−メトキシスチリル)ベンゾフラン;
6−メトキシ−2−(3,4−ジメトキシスチリル)ベンゾフラン;
6−メトキシ−2−(3−メトキシ−4−メチルアミノスチリル)ベンゾフラン;
トリフルオロ酢酸6−メチル−2−(4−アミノスチリル)ベンゾフラン;
トリフルオロ酢酸6−メチル−2−(4−メチルアミノスチリル)ベンゾフラン;
6−メチル−2−(4−ジエチルアミノスチリル)ベンゾフラン;
6−メチル−2−(4−メトキシスチリル)ベンゾフラン;
6−メチル−2−(3,4−ジメトキシスチリル)ベンゾフラン;
6−(2−(2−(2−フルオロエトキシ)エトキシ)エトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
6−ヒドロキシ−2−(4−アミノスチリル)ベンゾフラン;
6−ヒドロキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
6−ヒドロキシ−2−(4−ジエチルアミノスチリル)ベンゾフラン;
5,6−ジメトキシ−2−(4−メチルアミノスチリル)ベンゾフラン;
5−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−アミノスチリル)ベンゾフラン;
5−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;
5−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−ジメチルアミノスチリル)ベンゾフラン;
6−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−アミノスチリル)ベンゾフラン;
6−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−メチルアミノスチリル)ベンゾフラン;及び
6−(2,2−ジメチルテトラヒドロピラン−4−イルメトキシ)−2−(4−ジメチルアミノスチリル)ベンゾフラン。
【請求項4】
式(II)の化合物を塩基の存在下で有機溶媒中で式(III)の化合物とホーナーエモンズ(Honer−Emmons)反応させる段階とを含む請求項1に記載の式(I)の化合物の製造方法:
【化2】

前記式中、
X、R1、R2、R3、及びR4は請求項1で定義した通りである。
【請求項5】
前記塩基が、アルカリ金属の水素化物、アルキルアルカリ金属化合物、アルカリ金属のアルコキシド化合物、アルカリ金属アミド化合物、及びこれらの混合物からなる群より選ばれる請求項4に記載の製造方法。
【請求項6】
前記有機溶媒がエーテルである請求項4に記載の製造方法。
【請求項7】
ホーナーエモンズ反応によって生成された化合物をボロントリクロリド、ボロントリフルオリド、ボロントリブロマイド、またはヨードトリメチルシランの有機溶媒溶液を用いて脱メチル化させる段階をさらに含む請求項4から請求項6に記載の製造方法。
【請求項8】
請求項1に記載の式(I)の化合物またはその薬剤学的に許容可能な塩を有効成分として含むβ−アミロイドフィブリルの形成阻害用医薬組成物。
【請求項9】
請求項1に記載の式(I)の化合物またはその薬剤学的に許容可能な塩を有効成分として含む退行性脳疾患の予防または治療用医薬組成物。
【請求項10】
前記薬剤学的に許容可能な塩が、塩酸、臭化水素酸、硫酸、リン酸、硝酸、酢酸、グリコール酸、乳酸、ピルビン酸、マロン酸、コハク酸、グルタル酸、フマル酸、リンゴ酸、マンデル酸、酒石酸、クエン酸、アスコルビン酸、パルミチン酸、マレイン酸、ヒドロキシマレイン酸、安息香酸、ヒドロキシ安息香酸、フェニル酢酸、桂皮酸、サリチル酸、メタンスルホン酸、ベンゼンスルホン酸、トルエンスルホン酸、及びこれらの混合物からなる群より選ばれる酸の塩であることを特徴とする請求項9に記載の医薬組成物。
【図1】


【図2】




【図2】


【公表番号】特表2011−522882(P2011−522882A)
【公表日】平成23年8月4日(2011.8.4)
【国際特許分類】
【出願番号】特願2011−513431(P2011−513431)
【出願日】平成21年6月12日(2009.6.12)
【国際出願番号】PCT/KR2009/003165
【国際公開番号】WO2009/151299
【国際公開日】平成21年12月17日(2009.12.17)
【出願人】(595001181)コリア インスティテュート オブ サイエンス アンド テクノロジー (25)
【出願人】(510323554)ハンミ・ホールディングス・カンパニー・リミテッド (5)
【氏名又は名称原語表記】HANMI HOLDINGS CO., LTD.
【Fターム(参考)】
【公表日】平成23年8月4日(2011.8.4)
【国際特許分類】
【出願日】平成21年6月12日(2009.6.12)
【国際出願番号】PCT/KR2009/003165
【国際公開番号】WO2009/151299
【国際公開日】平成21年12月17日(2009.12.17)
【出願人】(595001181)コリア インスティテュート オブ サイエンス アンド テクノロジー (25)
【出願人】(510323554)ハンミ・ホールディングス・カンパニー・リミテッド (5)
【氏名又は名称原語表記】HANMI HOLDINGS CO., LTD.
【Fターム(参考)】
[ Back to top ]

