β−1,3−グルカンを含む過敏性腸症候群の下痢抑制剤、腹痛改善剤、及び大腸における痛覚過敏改善剤
【課題】本発明は、安全かつ効果的な過敏性腸症候群の下痢抑制剤、及び過敏性腸症候群の腹痛改善剤を提供することを課題とする。また、本発明は、安全かつ効果的な大腸における痛覚過敏改善剤を提供することを課題とする。
【解決手段】 β-1,3-グルカンを含む過敏性腸症候群の下痢抑制剤、過敏性腸症候群の腹痛改善剤、及び大腸における痛覚過敏改善剤。
【解決手段】 β-1,3-グルカンを含む過敏性腸症候群の下痢抑制剤、過敏性腸症候群の腹痛改善剤、及び大腸における痛覚過敏改善剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、過敏性腸症候群の下痢抑制、過敏性腸症候群の腹痛改善、及び大腸における痛覚過敏を抑制するための、β-1,3-グルカンの使用に関する。
【背景技術】
【0002】
過敏性腸症候群(irritable bowel syndrome; IBS)とは、大腸組織に器質的な病変が認められないにも関わらず、腹痛・腹部不快感をともなう慢性的な排便異常(便秘あるいは下痢)を生じる機能性消化管疾患である。IBSは、その症状より、下痢型、便秘型、混合型および分類不明型に分類されている。
先進国において、IBSの有病率は全人口の約10〜20%に達するいわれており、極めて高頻度な消化器疾患であると言われている。また、IBSの症状は、患者の生活の質や労働生産性を著しく低下させるなど大きな社会問題となっている。
【0003】
IBSの薬物療法として、ポリカルボフィルカルシウムなどの高分子重合体、若しくはマレイン酸トリメブチンなどの消化管運動調節薬を処方して、症状が改善されない場合には、その症状に応じて、乳酸菌製剤、下剤・抗コリン薬などが投与する方法が知られている。しかしながら、これらの方法では、症状の改善が不十分であり、有効性も低かった(非特許文献1)。一方、セロトニン受容体拮抗薬として、アロセトロン等の下痢型IBS治療薬が上市されており、比較的高い有効性が報告されているが、重篤な便秘や虚血性大腸炎などの副作用をなすことが報告されている(非特許文献2)。従って、安全かつ効果的な過敏性腸症候群の症状の予防又は改善剤が求められている
【0004】
一方、β-グルカンは、きのこやカビが産生する細胞壁の成分として古くから知られており、天然物由来の有用な健康食品として利用されてきた。β-グルカンは、免疫賦活活性から抗癌や抗癌転移効果(非特許文献3)や炎症性反応の低減にも効果があることが知られている(非特許文献4)。
また、特許文献1には、抗がん剤の経口投与と共に、β-1,3-1,6-D-グルカンを経口投与することにより、抗癌剤の副作用である小腸粘膜障害、及び下痢が抑制されたことが記載されている。このようにβ-グルカンは、免疫賦活作用を通した炎症反応の低減により、種々の疾病に対して効果を示すことが報告されている。しかしながら、過敏性腸症候群における下痢や腹痛・腹部不快感の症状を改善するとの報告はされていない。また、大腸における痛覚過敏を改善するとの報告もされていない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2010−90070号公報
【非特許文献】
【0006】
【非特許文献1】心療内科,8,21-27,2004
【非特許文献2】Am J Gastroentero,97(11suppl),S7-S26,2002
【非特許文献3】Immunity,19(3),311-315
【非特許文献4】Shock 27(4),397-401
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、安全かつ効果的な過敏性腸症候群の下痢抑制剤、及び腹痛改善剤を提供することを課題とする。また、本発明は、安全かつ効果的な大腸における痛覚過敏改善剤を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは、上記課題を解決するために研究を重ね、β-1,3-グルカンが過敏性腸症候群における排便異常を改善、及び腹痛を改善することを見出した。また、β-1,3-グルカンが、大腸における痛覚過敏を低減することを見出した。多糖がこれらの作用を有することは、これまで知られていない。本発明はこれらの知見に基づき完成されたものであり、以下の過敏性腸症候群の下痢抑制剤、腹痛改善剤、及び大腸における痛覚過敏改善剤を提供する。
【0009】
項1. β-1,3-グルカンを含む過敏性腸症候群の下痢抑制剤。
項2. β-1,3-グルカンがβ-1,3-1,6-D-グルカンである項1に記載の剤。
項3. β-1,3-1,6-グルカンが、β-1,3結合に対するβ-1,6結合の分岐度が50〜100%であるβ-1,3-1,6-グルカンである項1又は2に記載の剤。
項4. β-1,3-1,6-グルカンが、オーレオバシジウム属の微生物が産生するβ-1,3-1,6-グルカンである項1〜3に記載の剤。
項5. オーレオバシジウム属の微生物が、オーレオバシジウム・プルランスGM-NH-1A1株(FERM P-19285)、又はGM-NH-1A2株(FERM P-19286)である項4に記載の剤。
項6. β-1,3-グルカンを含む過敏性腸症候群の腹痛改善剤。
項7. β-1,3-グルカンがβ-1,3-1,6-D-グルカンである項6に記載の剤。
項8. β-1,3-1,6-グルカンが、β-1,3結合に対するβ-1,6結合の分岐度が50〜100%であるβ-1,3-1,6-グルカンである項6又は7に記載の剤。
項9. β-1,3-1,6-グルカンが、オーレオバシジウム属の微生物が産生するβ-1,3-1,6-グルカンである項6〜8に記載の剤。
項10. オーレオバシジウム属の微生物が、オーレオバシジウム・プルランスGM-NH-1A1株(FERM P-19285)、又はGM-NH-1A2株(FERM P-19286)である項9に記載の剤。
項11. β-1,3-グルカンを含む大腸における痛覚過敏改善剤。
項12. β-1,3-グルカンがβ-1,3-1,6-D-グルカンである項11に記載の剤。
項13. β-1,3-1,6-グルカンが、β-1,3結合に対するβ-1,6結合の分岐度が50〜100%であるβ-1,3-1,6-グルカンである項11又は12に記載の剤。
項14. β-1,3-1,6-グルカンが、オーレオバシジウム属の微生物が産生するβ-1,3-1,6-グルカンである項11〜13に記載の剤。
項15. オーレオバシジウム属の微生物が、オーレオバシジウム・プルランスGM-NH-1A1株(FERM P-19285)、又はGM-NH-1A2株(FERM P-19286)である項14に記載の剤。
【発明の効果】
【0010】
β-1,3-グルカンは、セロトニン及びアセチルコリン等に起因する排便異常の症状を改善する。即ち、過敏性腸症候群の排便異常、及び腹痛を予防又は改善剤として有用である。また、本発明の剤は、大腸のおける痛覚過敏に対して、効果的に症状を改善することから、腹痛・腹部不快感を伴う慢性的な便通異常を生じる機能性消化管疾患の予防又は改善剤などとして有用である。
【図面の簡単な説明】
【0011】
【図1】実験例で得たオーレオバシジウム・プルランス由来のグルカンの1H NMRスペクトルである。
【図2】実験例で得たオーレオバシジウム・プルランス由来のグルカンの超音波照射したときの培養液の粒度分布を示す図である。
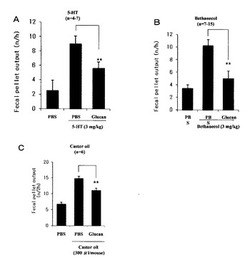
【図3】図Aは、低分子β-1,3-1,6-D-グルカンが、5-HT(セロトニン)による排便異常を抑制したことを示す図である。図Bは、低分子β-1,3-1,6-D-グルカンが、ベタネコールによる排便異常を抑制したことを示す図である。図Cは、低分子β-1,3-1,6-D-グルカンが、ひまし油による排便異常を抑制したことを示す図である。
【図4】オーレオバシジウム・プルランス由来のβ-グルカンが大腸における異常便排出による痛みを改善、及び低下させたことを示す図である。
【図5】オーレオバシジウム・プルランス由来のβ-グルカンが大腸における痛覚過敏を低下させたことを示す図である。
【発明を実施するための形態】
【0012】
以下、本発明を詳細に説明する。
本発明の過敏性腸症候群の下痢抑制剤、腹痛改善剤、及び大腸における痛覚過敏改善剤は、β-1,3-グルカンを有効成分として含む。
β-1,3-グルカン
β-1,3-グルカンとしては、β-1,3-D-グルカン、β-1,3-1,6-D-グルカン、β-1,3-1,4-D-グルカンなどが挙げられる。中でも、β-1,3-1,6-D-グルカンが好ましい。
これらのβ-1,3-グルカンは、酵母、担子菌(キノコ)類、かび類、乳酸菌、その他微生物等の細胞壁に大量に含まれている。また、β-1,3-グルカンを菌体外へ分泌する菌体も知られている。さらに、大麦、カラスムギ等のイネ科植物にも大量に含まれていることも知られている。中でも、オーレオバシジウム属微生物はβ-1,3-1,6-D-グルカンを主に生産するので、オーレオバシジウム属微生物由来のβ-1,3-グルカンが好ましい。
【0013】
β-1,3-1,6-D-グルカンにおいて、主鎖のβ-1,3結合数に対する側鎖のβ-1,6結合数の比率である分岐度は、通常約50〜100%、好ましくは約75〜100%、より好ましくは約85〜100%であればよい。
β-1,3-1,6-D-グルカンが上記分岐度を有することは、β-1,3-1,6-D-グルカンをエキソ型のβ-1,3-グルカナーゼ(キタラーゼ M、ケイアイ化成製)で加水分解処理した場合に分解生成物としてグルコースとゲンチオビオースが遊離すること、及びNMRの積算比から確認できる(今中忠行 監修、微生物利用の大展開、1012-1015、エヌ・ティー・エス(2002))。
【0014】
上記の分岐度を有するβ-1,3-1,6-D-グルカンは、水溶液の30℃、pH5.0、濃度0.5(w/v%)における粘度が、好ましくは200cP(mPa・s)以下、より好ましくは100cP(mPa・s)以下、さらに好ましくは50cP(mPa・s)以下のものである。上記粘度の下限値は通常10cP(mPa・s)程度であり得る。
本発明において、粘度は、BM型回転粘度計を用いて測定した値である。
【0015】
(a)オーレオバシジウム属微生物が生産するβ-1,3-1,6-D-グルカン
オーレオバシジウム属(Aureobasidium sp.)に属する微生物由来のβ-1,3-1,6-D-グルカンは、1N水酸化ナトリウム重水溶液を溶媒とする溶液の1H NMRスペクトルが約4.7ppm及び約4.5ppmの2つのシグナルを有する。NMRの測定値は条件の微妙な変化によって変化し、また誤差を伴うことは周知のことであることから、「約4.7ppm」「約4.5ppm」は、通常予測される範囲の測定値の変動幅(例えば±0.2)を含む数値を意味する。
オーレオバシジウム属の微生物が産生するβ-1,3-1,6-D-グルカンは、菌体外に分泌されるため、キノコ類やパン酵母の細胞壁に含まれるβ-グルカンと比べて、回収が容易であり、また水溶性である点で好ましいものである。オーレオバシジウム属の微生物は、分子量が100万以上の高分子量のグルカンから分子量が数万程度の低分子のグルカンまでを培養条件に応じて産生することができる。
【0016】
中でも、培養液が比較的低粘度であること、及びβ-1,3-1,6-D-グルカンを高生産する点で、オーレオバシジウム・プルランス(Aureobasidium pullulans)が生産するものが好ましく、オーレオバシジウム・プルランスGM-NH-1A1株、又はGM-NH-1A2株(独立行政法人産業技術研究所特許生物寄託センターにそれぞれFERM
P-19285及びFERM P-19286として寄託済み)が産生するものが好ましい。GM-NH-1A1株及びGM-NH-1A2株は、オーレオバシジウム属(Aureobasidium sp.)K-1株の変異株である。オーレオバシジウム属K-1株は、分子量200万以上と100万程度の2種類のβ-1,3-1,6-D-グルカンを産生することが知られている。
また、オーレオバシジウム属微生物が産生するβ-1,3-1,6-D-グルカンは、通常、硫黄含有基を有するところ、K-1株の産生するβ-グルカンはスルホ酢酸基を有することが知られている(Arg.Biol.Chem.,47,1167-1172(1983)),科学と工業,64,131-135(1990))。GM-NH-1A1株、及びGM-NH-1A2株が生産するβ-1,3-1,6-D-グルカンもスルホ酢酸基を有すると考えられる。オーレオバシジウム属微生物の中には、リン酸基のようなリン含有基、リンゴ酸基などを含むβ-1,3-1,6-D-グルカンを産生する菌種、菌株も存在する。
GM-NH-1A1株及びGM-NH-1A2株は、後に実施例において示すようにメインピークが見かけ上50〜250万の高分子量のβ-グルカン(微粒子グルカン)とメインピークが見かけ上2〜30万の低分子量のβ-グルカンの両方を産生する菌株である。この微粒子状グルカンは、一次粒子径が0.05〜2μm程度である。
【0017】
β-1,3-1,6-D-グルカンの溶解度は、pH及び温度に依存する。このβ-1,3-1,6-D-グルカンは、pH3.5、温度25℃の条件で2mg/ml水溶液を調製しようとすると、その50重量%以上が一次粒子径0.05〜2μmの微粒子を形成し、残部は水に溶解する。本発明において粒子径は、レーザー回折散乱法により測定した値である。
オーレオバシジウム属微生物が産生するβ-1,3-1,6-D-グルカンも、水溶液にしたときの粘度が、オーレオバシジウム属微生物が産生する天然型β-1,3-1,6-D-グルカンより低いものが好ましい。この低粘度β-1,3-1,6-D-グルカンは、水溶液の30℃、pH5.0、濃度0.5(w/v%)における粘度が、通常200cP(mPa・s)以下であり、より好ましくは100cP(mPa・s)以下であり、さらに好ましくは50cP(mPa・s)以下であり、さらにより好ましくは10cP以下である。
【0018】
この低粘度グルカンは、オーレオバシジウム属微生物が産生する天然型β-1,3-1,6-D-グルカンと同様の一次構造を有し得る。具体的には、1N水酸化ナトリウム重水溶液を溶媒とする溶液の1HNMRスペクトルが約4.7ppm及び約4.5ppmの2つのシグナルを有するものである。NMRの測定値は条件の微妙な変化によって変化し、また誤差を伴うことは周知のことであることから、「約4.7ppm」「約4.5ppm」は、通常予測される範囲の測定値の変動幅(例えば±0.2)を含む数値を意味する。
β-1,3-1,6-D-グルカンは、金属イオン濃度が、β-1,3-1,6-D-グルカンの固形分1g当たり0.4g以下であることが好ましく、0.2g以下であることがより好ましく、0.1g以下であることがさらにより好ましい。原料β-1,3-1,6-D-グルカンが水溶液状態のものである場合は、金属イオン濃度は、水溶液の100ml当たり120mg以下であることが好ましく、50mg以下であることがより好ましく、20mg以下であることがさらにより好ましい。
【0019】
ここでいう金属イオンには、アルカリ金属イオン、アルカリ土類金属イオン、第3〜第5族金属イオン、遷移金属イオンなどが含まれるが、混入する可能性のある金属イオンとしては、代表的には、低粘度β-1,3-1,6-D-グルカンの製造において使用されるアルカリ由来のカリウムイオン、ナトリウムイオンなどが挙げられる。金属イオン濃度は、限外ろ過や透析により調整できる。
金属イオン濃度が上記範囲であれば、水溶液状態で保存する場合や、水溶液状態で加熱滅菌する際に、β-1,3-1,6-D-グルカンのゲル化、凝集、沈殿が生じ難い。また、固形で使用する場合は、再溶解させる場合に凝集などが生じ難い。
【0020】
(b)オーレオバシジウム属微生物によるβ-1,3-1,6-D-グルカンの生産方法
分岐度50〜100%のβ-1,3-1,6-D-グルカンは、例えば、これを産生する微生物の培養上清に有機溶媒を添加することにより沈殿物として得ることができる。
また、オーレオバシジウム属の微生物を培養して、β-1,3-1,6-D-グルカンを産生させる方法は種々報告されている。培養培地に使用できる炭素源としては、シュークロース、グルコース、フラクトースなどの炭水化物、ペプトンや酵母エキスなどの有機栄養源等を挙げることができる。窒素源としては、硫酸アンモニウムや硝酸ナトリウム、硝酸カリウムなどの無機窒素源等を挙げることができる。場合によってはβ-グルカンの産生量を上昇させるために適宜、塩化ナトリウム、塩化カリウム、リン酸塩、マグネシウム塩、カルシウム塩などの無機塩、更には鉄、銅、マンガンなどの微量金属塩やビタミン類等を添加するのも有効な方法である。
オーレオバシジウム属微生物を、炭素源としてシュークロースを含むツアペック培地にアスコルビン酸を添加した培地で培養した場合、高濃度のβ-1,3-1,6-D-グルカンを産生することが報告されている(Arg.Biol.Chem.,47,1167-1172(1983));科学と工業,64,131-135(1990);特開平7−51082号公報)。しかし、培地は、微生物が生育し、β-1,3-1,6-D-グルカンを生産するものであればよく、特に限定されない。必要に応じて酵母エキスやペプトンなどの有機栄養源を添加してもよい。
【0021】
オーレオバシジウム属の微生物を上記培地で好気培養するための条件としては、10〜45℃程度、好ましくは20〜35℃程度の温度条件、3〜7程度、好ましくは3.5〜5程度のpH条件等が挙げられる。
効果的に培養pHを制御するためにアルカリ、あるいは酸で培養液のpHを制御することも可能である。更に培養液の消泡のために適宜、消泡剤を添加してもよい。培養時間は通常1〜10日間程度、好ましくは1〜4日間程度であり、これによりβ-グルカンを産生することが可能である。なお、β-グルカンの産生量を測定しながら培養時間を決めてもよい。
上記条件下オーレオバシジウム属の微生物を4〜6日間程度通気攪拌培養すると、培養液にはβ-1,3-1,6-D-グルカンを主成分とするβ−グルカン多糖が0.1%(w/v)〜数%(w/v)含有されており、その培養液の粘度はBM型回転粘度計(東機産業社製)により30℃では数百cP([mPa・s])から数千cP([mPa・s])という非常に高い粘度を有する。この培養を遠心分離して得られる上清に例えば有機溶媒を添加することにより、β-1,3-1,6-D-グルカンを沈殿物として得ることができる。
【0022】
<低粘度β-1,3-1,6-D-グルカンの製造方法>
上記の高粘度のβ-1,3-1,6-D-グルカンを含む培養液を、常温で攪拌しながら、これにアルカリを添加すると、急激に粘度が低下する。
アルカリは、水溶性で、かつ医薬品や食品添加物として用いることができるものであればよく、特に限定されない。例えば、炭酸カルシウム水溶液、炭酸ナトリウム水溶液、炭酸カリウム水溶液、炭酸アンモニウム水溶液などの炭酸アルカリ水溶液;水酸化ナトリウム水溶液、水酸化カリウム水溶液、水酸化カルシウム水溶液などの水酸化アルカリ水溶液;あるいはアンモニア水溶液などを使用できる。アルカリは、培養液のpHが12以上、好ましくは13以上になるように添加してもよい。例えば、水酸化ナトリウムを使用して培養液のpHを上げる場合は、水酸化ナトリウムの最終濃度が好ましくは0.5%(w/v)以上、より好ましくは1.25%(w/v)以上になるように添加すればよい。培養液にアルカリを添加し、良く攪拌すると、瞬時に培養液の粘度が低下する。
【0023】
次いで、アルカリ処理後の培養液から菌体などの不溶性物質を分離する。培養液の粘度が低いため、菌体を自然沈降させて上澄みを回収する方法(デカント法)、遠心分離、ろ紙あるいはろ布を利用した全量ろ過、フィルタープレス、更に膜ろ過(MF膜などの限外ろ過)などの方法で、容易に不溶性物質とグルカンとを分離できる。ろ紙あるいはろ布による全量ろ過の場合は、セライトなどろ過助剤を利用するのも一つの手段である。工業的にはフィルタープレスによる菌体除去が好ましい。また、不溶性物質除去前のβ-D-グルカン液は必要に応じて水で希釈しても良い。濃度が高すぎると不溶性物質除去が困難であり、低すぎても効率的でない。β-D-グルカン濃度は、例えば0.1mg/ml〜20mg/ml程度、好ましくは0.5mg/ml〜10mg/ml程度、さらに好ましくは1mg/ml〜5mg/ml程度が良い。
【0024】
次いで、グルカンを含む溶液に酸を添加して中和する。中和は、不溶物の除去前に行ってもよい。酸は、医薬や食品添加物として使用できるものであればよく、特に限定されない。例えば、塩酸、燐酸、硫酸、クエン酸、リンゴ酸などを使用できる。酸の使用量は、溶液又は培養液の液性が中性(pH5〜8程度)になるような量とすればよい。即ち、中和はpH7に合わせることを必ずしも要さない。
pH12以上のアルカリ処理後、中和して得られるβ-1,3-1,6-D-グルカンは、30℃、pH5.0、濃度0.5(w/v%)における粘度が通常200cP以下、場合によっては、100cP以下、50cP以下、又は10cP以下である。粘度は製造方法ないしは精製方法によって変動する。
アルカリ処理された低粘度のβ-1,3-1,6-D-グルカンは、中和しても粘度が高くなることがない。さらに、常温(15〜35℃)では、液性をpHが4を下回るような酸性にしても、粘度が高くなることがない。
また、培養上清をアルカリ処理、及び中和した後に、菌体などを除去するのに代えて、培養上清から菌体などを除去した後に、アルカリ処理、及び中和を行うこともできる。
【0025】
得られるグルカン水溶液からグルカンより低分子量の可溶性夾雑物(例えば塩類など)を除去する場合は、例えば限外ろ過を行えばよい。
また、アルカリ処理、除菌した後、中和せずに、アルカリ性条件下で限外ろ過することもでき、これにより透明性、熱安定性、長期保存性に一層優れる精製β-1,3-1,6-D-グルカンが得られる。アルカリ性条件は、pH10以上、好ましくは12以上であり、pHの上限は通常13.5程度である。
このようにして得られる水溶液に含まれるβ-1,3-1,6-D-グルカンは、乾燥させて固形製剤にする場合も、また水溶液のまま製剤として使用する場合も、一旦、水溶液から析出させることができる。β-1,3-1,6-D-グルカンの析出方法は、特に限定されないが、例えば、限外ろ過などにより濃縮してグルカン濃度を1w/w%以上にした水溶液に、エタノールのようなアルコールを、水溶液に対して容積比で等倍以上、好ましくは2倍以上添加することにより、β-1,3-1,6-D-グルカンを析出させることができる。この場合にpHをクエン酸などの有機酸によりpHを酸性、好ましくはpH4未満、さらに好ましくはpH3-3.7に調製して、エタノールを添加すると高純度のβ-1,3-1,6-グルカンの粉末を得ることができる。
【0026】
β-1,3-1,6-D-グルカンを低粘度化することにより、限外ろ過などによる濃縮を容易に行えることから、アルコール沈殿に使用するアルコール量を少なくすることができる。
固形物として得る場合は、低粘度β-1,3-1,6-D-グルカン水溶液を直接乾燥させてもよく、析出させたβ-1,3-1,6-D-グルカンを乾燥させてもよい。乾燥は、噴霧乾燥法、凍結乾燥法等公知の方法で行うことができる。
【0027】
医薬組成物
本発明の剤は、適当な担体及び添加剤と共に製剤化して医薬組成物とすることができる。医薬組成物の剤型としては、経口投与剤(咽頭用剤を含む)、坐剤などが挙げられる。
<経口投与剤>
経口投与剤は、大腸にβ-1,3-グルカンを効果的に送達できる剤型である。
固形経口投与製剤の剤型としては、例えば、散剤、顆粒剤、錠剤、タブレット剤、丸剤、カプセル剤、チュアブル剤などが挙げられ、液体経口投与製剤の剤型としては、乳剤、液剤、シロップ剤などが挙げられる。中でも、摂取が容易である点で、錠剤、顆粒剤、カプセル剤、チュアブル剤、液剤が好ましく、液剤がより好ましい。経口投与剤は咽頭用剤としても使用できる。
固形製剤は、β-1,3-グルカンに薬学的に許容される担体や添加剤を配合して調製される。例えば、白糖、乳糖、ブドウ糖、でんぷん、マンニットのような賦形剤;アラビアゴム、ゼラチン、結晶セルロース、ヒドロキシプロピルセルロース、メチルセルロースのような結合剤;カルメロース、デンプンのような崩壊剤;無水クエン酸、ラウリン酸ナトリウム、グリセロールのような安定剤などが配合される。さらに、ゼラチン、白糖、アラビアゴム、カルナバロウなどでコーティングしたり、カプセル化したりしてもよい。
また、液体製剤は、例えば、β-1,3-グルカンを、水、エタノール、グリセリン、単シロップ、又はこれらの混液などに、溶解又は分散させることにより調製される。これらの製剤には、甘味料、防腐剤、粘滑剤、滑沢剤、希釈剤、緩衝剤、着香剤、着色剤のような添加剤が添加されていてもよい。
【0028】
固形経口投与剤中のβ-1,3-グルカンの含有量は、乾燥重量に換算して、製剤全体に対して、約0.01〜99重量%が好ましく、約0.1〜50重量%がより好ましい。また、液体経口投与剤中のβ-1,3-グルカンの含有量は、乾燥重量に換算して、製剤全体に対して、約0.01〜2重量%が好ましく、約0.05〜0.5重量%がより好ましい。
上記含有量の範囲であれば、無理のない投薬量及び投薬スケジュールで、本発明を効果的に誘導できる。
<坐剤>
坐剤は、直腸粘膜にβ-1,3-グルカンを効果的に送達できる剤型である。
坐剤は、β-1,3-グルカンを、カルボポール及びポリカルボフィルのようなアクリル性高分子;ヒドロキシプロピルセルロース及びヒドロキシプロピルメチルセルロースのようなセルロース性高分子;アルギン酸ナトリウム及びキトサンのような天然高分子;脂肪酸ワックスなどの基剤に配合することにより調製できる。また、安息香酸ナトリウム、ソルビン酸カリウム、パラベンのような防腐剤;塩酸、クエン酸、水酸化ナトリウムのようなpH調節剤;メチオニンのような安定化剤を配合してもよい。
坐剤中のβ-1,3-グルカンの含有量は、乾燥重量に換算して、製剤全体に対して、約0.01〜99重量%が好ましく、約0.1〜50重量%がより好ましい。上記範囲であれば、通常の投薬量及び投薬スケジュールで、本発明を効果的に誘導できる。
【0029】
食品組成物
本発明の剤は食品組成物とすることもできる。この食品組成物は、健康食品、栄養補助食品(バランス栄養食、サプリメントなどを含む)、保健機能食品(特定保健用食品(疾病リスク低減表示、規格基準型を含む)、条件付き特定保健用食品、栄養機能食品を含む)に好適である。
食品組成物は、食品に通常用いられる賦形剤または添加剤を配合して、錠剤、タブレット剤、丸剤、顆粒剤、散剤、粉剤、カプセル剤、水和剤、乳剤、液剤等の剤型に調製することができる。中でも、摂取が容易である点で、錠剤、顆粒剤、カプセル剤、チュアブル剤、液剤が好ましく、液剤がより好ましい。
食品に通常用いられる賦形剤としては、シロップ、アラビアゴム、ショ糖、乳糖、粉末還元麦芽糖、セルロース糖、マンニトール、マルチトール、デキストラン、デンプン類、ゼラチン、ソルビット、トラガント、ポリビニルピロリドンのような結合剤;ショ糖脂肪酸エステル、グリセリン脂肪酸エステル、ステアリン酸マグネシウム、ステアリン酸カルシウム、タルク、ポリエチレングリコールのような潤沢剤;ジャガイモ澱粉のような崩壊剤;ラウリル硫酸ナトリウムのような湿潤剤等が挙げられる。添加剤としては、香料、緩衝剤、増粘剤、着色剤、安定剤、乳化剤、分散剤、懸濁化剤、防腐剤などが挙げられる。
【0030】
固形食品製剤中のβ-1,3-グルカンの含有量は、乾燥重量に換算して、製剤全体に対して、約0.01〜99重量%が好ましく、約0.1〜50重量%がより好ましい。また、液体食品製剤中のβ-1,3-グルカンの含有量は、乾燥重量に換算して、製剤全体に対して、約0.01〜2重量%が好ましく、約0.05〜0.5重量%がより好ましい。
上記範囲であれば、無理のない摂取量及び摂取スケジュールで、本発明を効果的に誘導できる。
【0031】
また、この食品組成物は、飲料(スポーツ飲料、ドリンク剤、乳飲料、乳酸菌飲料、果汁飲料、炭酸飲料、野菜飲料、茶飲料等)、菓子類(クッキー等の焼き菓子、ゼリー、ガム、グミ、飴等)のような一般の飲食品を含むものであってもよい。中でも、摂取が容易である点で、飲料が好ましい。
固形又は半固形の食品組成物中のβ-1,3-グルカンの含有量は、乾燥重量に換算して、製剤全体に対して、約0.01〜99重量%が好ましく、約0.1〜50重量%がより好ましい。また、液体状又は流動状の食品組成物中のβ-1,3-グルカンの含有量は、乾燥重量に換算して、組成物全体に対して、約0.01〜10重量%が好ましく、約0.1〜5重量%がより好ましい。
上記範囲であれば、無理なく摂取できる飲食品中に、本発明を効果的に誘導できるだけのβ-1,3-グルカンが含まれることになる。
食品添加剤
本発明の剤は、一つの実施態様として、β-1,3-グルカンを含む食品添加剤であり得る。当業者は、本発明が提供する食品添加剤を食品に配合させることにより、下記で説明する用途、機能または作用を食品に付加することができ、食品の質を改変することができる。
【0032】
使用方法
本発明の剤が経口投与医薬製剤、食品組成物、又は食品添加剤である場合のβ-1,3-グルカンの1日投与量は約0.1〜1000mgが好ましく、約1〜600mgがより好ましく、約5〜200mgがさらに好ましい。
また、本発明の剤が医薬組成物の坐剤である場合のβ-1,3-グルカンの1日投与量は、0.1〜1000mgが好ましく、約1〜600mgがより好ましい。
【0033】
用途
本発明の剤は、後述する実施例に示す通り、過敏性腸症候群の排便異常(例えば、下痢、排便亢進など)及び腹痛を改善する。従って、過敏性腸症候群の疾患の予防又は治療剤として有用である。
また、本発明の剤は、大腸痛覚伝達を抑制し、大腸痛覚閾値低下を抑制し得、大腸のおける痛覚過敏に対して、効果的に、症状を改善することから、腹痛・腹部不快感を伴う慢性的な便通異常を生じる機能性消化管疾患の予防又は治療剤などとして有用である。
過敏性腸症候群(irritable bowel syndrome; IBS)とは、例えば、診断基準Rome II基準またはRome III基準により定義された疾患である。Rome III基準によれば、過敏性腸症候群は、「最近3ヶ月の内の1ヶ月において、少なくとも3日以上腹痛あるいは腹部不快感が生じ、その腹部症状が1」排便によって改善する、2」排便頻度の変化で始まる、3」便性状の変化で始まる、の3項目中2項目以上にあてはまるもの」と定義されており、排便回数や便性状などの違いから、過敏性腸症候群は下痢型、便秘型、混合型および分類不能型に分類されている(日薬理誌133, 281-291 (2009))。
【0034】
対象
本発明の剤を投与または摂取する対象は、過敏性腸症候群に罹患しているヒト、その処置または予防が必要なヒト、その疑いがあるヒトであり得る。ここで、過敏性腸症候群は、下痢型、便秘型、混合型または分類不能型であってもよい。また、ヒトは男性であっても女性であってもよい。よって、本発明は、一つの実施態様として、β-1,3-グルカンを含む下痢型過敏性腸症候群の治療薬または予防薬を提供する。
また、過敏性腸症候群は、ストレスをはじめとする種々の病因によって引き起こされ、腸管神経の過緊張に伴う腸の運動機能亢進によって生ずる疾患であり得る。腸(例えば、大腸)などの消化管の運動に関与する神経伝達物質としては、セロトニン、およびアセチルコリンが挙げられる。本発明の剤は、後述する実施例に示すとおり、セロトニン、またはアセチルコリンが惹起する排便異常を改善する。よって、本発明は、一つの実施態様として、セロトニン、またはアセチルコリンが惹起する排便異常の改善剤、または、一つの実施態様として、腸におけるセロトニン、またはアセチルコリンの作用亢進抑制剤を提供する。腸におけるセロトニン、またはアセチルコリンの作用の亢進の例としては、腸の運動亢進(例えば、大腸における排便能、輸送能または水分輸送能が亢進していること)が挙げられる。また、腸におけるセロトニンの作用の亢進の他の例としては、大腸に投射している外来性求心性一次神経の終末に存在する5-HT3受容体を活性化することによる大腸で発生した痛覚シグナルの中枢への伝達および痛覚過敏の惹起が挙げられる。このような腸における異常が脳へ伝達されると、さらに、ストレスが発生し便通異常を悪化させるという脳腸相関の異常が惹起される。本発明の剤は、好ましい一つの実施態様として、脳腸相関の異常を改善する。
これまで、下痢型過敏性腸症候群の治療薬として用いられている、5-HT3受容体アンタゴニストおよび副交感神経を抑制する抗コリン薬には、便秘、尿が出にくい、口の渇き等の副作用が報告されている。β-1,3-グルカンには、そのような副作用は報告されていないことから、この点において、本発明の剤は安全である。
【実施例】
【0035】
以下、本発明の実施例を挙げてより詳細に説明するが、本発明はこれらに限定されるものではない。
(A)精製β-1,3-1,6-D-グルカンの製造
(1)低粘度β-1,3-1,6-D-グルカンの調製
(1-1)β-グルカンの培養産生
後掲の表1に示す組成を有する液体培地100mlを500ml容量の肩付きフラスコに入れ、121℃で、15分間、加圧蒸気滅菌を行った後、オーレオバシジウム プルランス(Aureobasidium pullulans)GM-NH-1A1株(FERM P-19285)を同培地組成のスラントより無菌的に1白金耳植菌し、130rpmの速度で通気攪拌しつつ、30℃で24時間培養することにより種培養液を調製した。
次いで、同じ組成の培地200Lを300L容量の培養装置(丸菱バイオエンジ製)に入れ、121℃で、15分間、加圧蒸気滅菌し、上記のようにして得られた種培養液2Lを無菌的に植菌し、200rpm、27℃、40L/minの通気攪拌培養を行った。なお、培地のpHは水酸化ナトリウム及び塩酸を用いてpH4.2〜4.5の範囲内に制御した。96時間後の菌体濁度はOD660nmで23ODで、多糖濃度は0.5%(w/v)で、硫黄含量から計算される置換スルホ酢酸含量は0.09%であった。
【0036】
<多糖濃度測定>
多糖濃度は、培養液を数mlサンプリングし、菌体を遠心分離除去した後、その上清に最終濃度が66%(v/v)となるようにエタノールを加えて多糖を沈殿させて回収した後、イオン交換水に溶解し、フェノール硫酸法で定量した。
【0037】
<置換スルホ含量測定>
同様にして菌体を除去した培養上清にエタノールを最終濃度が66%となるように添加し、β-グルカンを沈殿回収した。その後、再度イオン交換水に溶解し、再度遠心分離後、その上清に最終濃度が0.9%になるように食塩を加えた後、再度66%エタノールでβ-グルカンを回収した。このβ-グルカン回収精製操作を更に2回繰り返し、得られたβ-グルカン水溶液をイオン交換水で透析後、凍結乾燥によりβ-グルカン粉末を得た。
このβ-グルカン粉末を燃焼管式燃焼吸収後、イオンクロマト法で組成分析した結果、S含量は239mg/kgであり、この値から計算される置換スルホ酢酸含量は0.09%であった。
【0038】

【0039】
(1−2)アルカリ処理
上記のようにして得られた培養液の粘度をBM型回転粘度計(東京計器製)を用いて、30℃、12rpmで測定したところ、1500cP((mPa・s))であった。測定に用いるロータは粘度にあわせて適当なものを選択した。
この培養液に水酸化ナトリウム最終濃度が2.4%(w/v)となるように25%(w/w)水酸化ナトリウムを添加し攪拌したところ(pH13.6)、瞬時に粘度が低下した。引き続いて50%(w/v)クエン酸水溶液でpH5.0となるように中和してから、濃度0.5(w/v%)における粘度を測定したところ、そのときの粘度(30℃)は20cP([mPa・s])であった。
次いで、この培養液にろ過助剤としてKCフロック(日本製紙社製)を1wt%添加し、薮田式ろ過圧搾機(薮田機械製)を用いて菌体を除去し、最終的に培養ろ液(約230L)を得た。その多糖濃度は0.5%(w/v)で、ほぼ100%の回収率であった。
【0040】
(1−3)β-グルカン水溶液の脱塩
上記のβ-グルカン水溶液(培養ろ液)を0.3%に希釈後、限外ろ過(UF)膜(分子量カット5万、日東電工社製)を用いて脱塩を行い、最終的にナトリウムイオン濃度を20mg/100mlに落とした後、50%(w/v)クエン酸水溶液によりpHを3.5に調整した。
引き続いて、ホット充填用加熱ユニット(日阪製作所製)を用いて95℃で、3分間保持することにより殺菌処理を行い、最終製品のβ-グルカン水溶液を得た。この時のβ-グルカンの濃度をフェノール硫酸法により測定したところ0.22%(w/v)であった。また、培養液からのトータル収率は約73%であった。
【0041】
<硫黄含有量の測定>
また、得られたβ-グルカン水溶液をイオン交換水で透析後、凍結乾燥によりβ-グルカン粉末を得た。本β-グルカンの組成分析結果からS含量は330mg/kgであり、これから計算される置換スルホ酢酸含量は0.12%であった。
【0042】
<結合状態の確認>
また、脱塩を行った上記培養ろ液について、コンゴーレッド法によって、480nmから525nm付近への波長シフトを確認することができたのでβ-1,3結合を含むグルカンを含有していることが証明された(K. Ogawa, Carbohydrate Research, 67,
527-535 (1978)、今中忠行 監修, 微生物利用の大展開, 1012-1015, エヌ・ティー・エス(2002))。そのときの極大値へのシフト差分はΔ0.48/500μg多糖であった。
上記培養ろ液15mlを取り出し、30mlのエタノールを添加し、4℃、1000rpm、10minで遠心して、沈殿する多糖を回収した。66%エタノールで洗浄し、4℃、1000rpm、10分間遠心して、沈殿する多糖に2mlのイオン交換水と、1mlの1N水酸化ナトリウム水溶液を添加撹拌後、60℃、1時間保温して沈殿を溶解させた。次に-80℃にて凍結後、一晩、真空凍結乾燥を行い、乾燥後の粉末を1mlの1N水酸化ナトリウム重水溶液に溶解させ、2次元NMRに供した。
2次元NMR(13C−1H COSY NMR)106ppmと相関関係を有する1H NMRスペクトルを図1に示す。このスペクトルにおいて4.7ppmと4.5ppm付近との2つのシグナルが得られた。
この結果、本β-グルカンがβ-1,3-1,6-D-グルカンであることが証明された(今中忠行 監修、微生物利用の大展開、1012-1015、エヌ・ティー・エス(2002))。それぞれの1H NMRシグナルの積分比から、β-1,3結合/β-1,6結合の比は1.15であることが判明した。従って、主鎖のβ-1,3結合に対する側鎖のβ-1,6結合の分岐度は、約87%である。
【0043】
<粒度測定>
次に、レ−ザ回折/散乱式粒度分布測定装置(HORIBA製LA−920)を用いて培養液の粒度を測定したところ、粒子としては0.3μmと100μm程度の大きさのところにピ−クが見られた。続いて、超音波を照射しながら、粒度測定を行うと、100μmのピ−クはみるみるうちに消失し、0.3μmのピ−クが増え、最終的に0.3μmのみとなった。超音波照射したときの培養液の粒度分布を図2に示す。
0.3μmのピークはβ-1,3-1,6-D-グルカンの一次粒子によるピークであり、100〜200μmのピークはβ-1,3-1,6-D-グルカンの一次粒子が凝集した二次粒子によるピークであると考えられる。
また、二次粒子はマグネチックスターラ−による攪拌、軽い振とうでも同じように消失し、容易に砕けて一次粒子になることが確認された。よって、二次粒子は非常に緩い凝集(緩凝集状態)と考えられる。
【0044】
<分子量測定>
また、東ソー社製のトーヨーパールHW65(カラムサイズ75cm×φ1cm、排除分子量250万(デキストラン))を用いて、0.1Mの水酸化ナトリウム水溶液を溶離液としてゲルろ過クロマトグラフィーを行い、溶解β-1,3-1,6-D-グルカンとβ-1,3-1,6-D-グルカンの1次粒子とを含む溶液の分子量を測定したところ、溶解β-1,3-1,6-D-グルカンに由来する2〜30万のピークの低分子画分と、1次粒子に由来する見かけ上50〜250万の高分子画分との二種類が検出された。分子量のマーカーとしてShodex社製のプルランを用いた。
水溶性β-1,3-1,6-D-グルカンと微粒子とを分離するため、上記の微粒子画分と可溶性画分とを含むβ-1,3-1,6-D-グルカン溶液をアドバンテック社製のフィルター(0.2μm)でろ過を行ったところ、50〜250万の高分子画分が消失した。このことから、高分子画分はβ-1,3-1,6-D-グルカンの一次粒子や一次粒子が凝集した二次粒子に相当することが判明した。よって、水溶性β-1,3-1,6-D-グルカンの分子量は2〜30万と考えられる。
【0045】
(2)粉末化β-グルカンの調製
(1−2)において、アルカリ処理および菌体除去処理により調製された微粒子β-1,3-1,6-D-グルカンを含むβ-1,3-1,6-D-グルカン水溶液に、最終濃度が66%(v/v)となるようにエタノールを添加して、多糖グルカンを沈殿させ、遠心分離法により回収した。次いで凍結乾燥法によりエタノールと水分を除去し、乾燥β-1,3-1,6-D-グルカンを得た。そのときの収率はエタノール沈殿前の全糖濃度と比較して95%以上であった。
次いで、得られた乾燥β-1,3-1,6-D-グルカンを最終濃度が0.3%(w/v)となるように水に溶解分散後、前述したと同様にして東ソー社製のトーヨーパールHW65(カラムサイズ 75cm×φ1cm、排除分子量250万(デキストラン))により0.1Mの水酸化ナトリウム水溶液を溶離液としてゲルクロマトグラフィーを行い、分子量を測定したところ、得られた多糖の分子量は2〜30万のピークの低分子画分と見かけ上50〜250万の高分子画分の二種類からなることが判明した。ここで、分子量のマーカーとしてShodex社製のプルランを用いた。
一方、水溶性β-1,3-1,6-D-グルカンと微粒子を分離するため、本法で調製したβ-1,3-1,6-D-グルカン水溶液(微粒子と可溶化グルカンを含むもの)をアドバンテック社製のフィルター(0.2μm)でろ過を行ったところ、50〜250万の高分子画分が消失した。よって、本法により得られたβ-1,3-1,6-D-グルカンを乾燥させても、再溶解させれば乾燥前のβ-1,3-1,6-D-グルカンと同様の物理的挙動を再現することが実証された。
【0046】
(3)高純度β-1,3-1,6-D-グルカン粉末の製造
(1)においてアルカリ処理を行い低粘度化した培養液(多糖濃度0.5%(5mg/ml))90Lを50%クエン酸水溶液9kgで中和後、濾過助剤(日本製紙ケミカル製粉末セルロ−スKCフロック)を1.8kgプレコートした薮田式濾過圧搾機40D-4を通して、菌体を取り除いた。ろ液を限外濾過スパイラルエレメント(日東電工製NTU3150−S4)で9Lまで濃縮した。本濃縮液を攪拌しながら、pHを3.0-3.5にクエン酸により調整して、エタノール18Lを加え、グルカン/エタノール/水スラリーを得た。スラリーの粘度はBM型粘度計で22mPa・s(30℃)であった。室温で3時間静置し、上澄み液(エタノール/水)約17Lを取り除いた。残ったスラリーの粘度は45mPa・s(30℃)であった。本濃縮スラリー10Lを坂本技研型の噴霧乾燥装置R-3を用いて噴霧乾燥し、360gのβ-1,3-1,6-D-グルカン粉末を得た(回収率80%)。得られたβ-1,3-1,6-D-グルカンの純度はNMRスペクトルの解析の結果、90%以上であった。
なお、得られたβ-1,3-1,6-D-グルカン粉末を1N水酸化ナトリウム重水溶液に溶解させ、NMRスペクトルを測定したところ、1H NMRスペクトルが約4.7ppm及び約4.5ppmの2つのシグナルを得た。また、得られたβ-1,3-1,6-D-グルカン粉末の濃度0.5(w/v%)の水溶液の粘度は200cP以下であった(pH5.0、30℃)。
上記記載の方法によって得られた精製β-グルカンを下記の試験に供した。
【0047】
(B)ベタネコール(betanecol)、セロトニン(5-HT)、及びひまし油(castor
oil)のそれぞれの薬剤投与により誘導した便通異常による過剰排便(下痢症状)に対する低分子β-グルカン経口投与の効果
上記実験例において得た高純度β-1,3-1,6-D-グルカン粉末(以下「低分子β-グルカンという」)。
アセチルコリン作動薬であるベタネコール(bethanechol)、セロトニン(5-HT)、及び大腸刺激剤であるひまし油(castor oil)による便通異常(下痢)を誘発し、それぞれの刺激剤により誘発された下痢症状(排便異常)の低減に対する低分子β-グルカンの効果をマウスを用いて検討した。野生型(C57/BL6)マウス(6〜8週齢、体重20-25g)に低分子β-グルカン(600mg/kg)を経口投与し、その2時間後にベタネコールとセロトニンは皮下注射(3mg/kg)を行い、ひまし油(300μl/匹)は経口投与を行った。各刺激剤投与後ベタネコール、セロトニンは1時間後、ひまし油は2時間後の便排泄量を測定した。なお、比較対照にはPBS(リン酸緩衝生理食塩水)を用いた。
結果を図3A−Cに示す。図3Aより、低分子β-グルカンが、セロトニンによる大腸の排便異常を低減したことが分る。図3Bより、低分子β-グルカンが、ベタネコールによる大腸の排便異常を低減していることが分る。図3Cより、低分子β-グルカンが、ひまし油による粘膜刺激による排便異常を低減していることが分る。このことより、低分子β-グルカンの事前投与により便の異常排泄は有意に低減したことが分かる。即ち、低分子β-グルカンには、セロトニンやアセチルコリンのような排便異常を誘発する物質に起因した症状を改善することが分る。
【0048】
(C)大腸伸展運動により起こる痛覚刺激と低分子β-グルカン経口投与の効果
ウィスター系ラット(雌、3-4週齢)の肛門からポリエチレン製のバック(2cmの長さ)を大腸(直腸)に挿入した。バックが肛門から1cmの部位まで挿入した。そして、そのバックに空気を入れて一定の圧力になるまで膨らませて(大腸伸展運動 Colorectal distention (CRD))、その際に生じる痛みを筋肉の収縮が起こる電位を内臓知覚(visceromotor response (VMR))として測定した。CRD刺激は80mmHgの圧力で30秒間維持し、5分間隔で12回の繰り返しCRD刺激を行い、その際のVMRの数値推移を測定した。なお、CRD刺激は、低分子β-グルカンを1日あたり100mg/kg、および600mg/kgの量でラットに7日間継続経口投与し、7日目の投与終了後12時間後に、繰り返しCRDテストを行った。また、比較対照にはPBS(リン酸緩衝生理食塩水)を用いた。
結果を図4に示す。この結果より、低分子β-グルカン投与ラット群では、CRD刺激における痛覚レベルが明らかに低下した。また、12回後の繰り返しCRD刺激終了時点において、低分子β-グルカン600mg/kg投与ラットでは、痛覚レベルの改善傾向が認められた。このことから、低分子β-グルカン投与により、大腸における異常便排出による痛みは低減されたことが分かる。即ち、大腸における腹痛の症状を改善していることが分る。また、低分子β-グルカンは、大腸における痛覚過敏を改善することが分る。
【0049】
(D)酪酸浣腸により誘導した擬似大腸過敏症における大腸伸展運動により起こる痛覚刺激と低分子β-グルカン経口投与の効果
ウィスター系ラット(雌、3-4週齢)を酪酸(Butyrate)(110mg/ml、1ml)による浣腸(肛門から7cmの大腸部へ1日に2回、3日間)を行うことにより、擬似大腸過敏症を誘導した。擬似大腸過敏症の状態下でCRD刺激を行うことにより、大腸における痛覚刺激への低分子β-グルカン経口投与の効果を検討した。なお、比較対照として、生理食塩水(Saline)を用いた。
低分子β-グルカン経口投与群は、1日あたり1回600mg/kgで7日間与え、その後に酪酸浣腸を行った。酪酸浣腸により擬似大腸過敏症を誘導した上記ラットに、10-80mmHgで段階的にCRD刺激レベルを大きくし、それぞれ20秒間のCRD刺激を150秒間隔で与えて、その際の痛覚レベルをVMRで測定した。
結果を図5に示す。酪酸浣腸のみの場合と低分子β-グルカンを併用した場合では、低分子β-グルカンを与えたラットの方が、大腸伸展運動(CRD)刺激に対する痛覚レベルの低減がなされ、痛覚過敏が改善されたことが分かる。
【産業上の利用可能性】
【0050】
本発明の過敏性腸症候群の下痢抑制剤、腹痛改善剤、及び大腸のおける痛覚過敏改善剤は過敏性腸症候群の症状改善剤として有用であり、腹痛・腹部不快感を伴う慢性的な便通異常(便秘あるいは下痢)を生じる機能性消化管疾患などの疾患の予防又は治療剤として好適に使用できる。
【技術分野】
【0001】
本発明は、過敏性腸症候群の下痢抑制、過敏性腸症候群の腹痛改善、及び大腸における痛覚過敏を抑制するための、β-1,3-グルカンの使用に関する。
【背景技術】
【0002】
過敏性腸症候群(irritable bowel syndrome; IBS)とは、大腸組織に器質的な病変が認められないにも関わらず、腹痛・腹部不快感をともなう慢性的な排便異常(便秘あるいは下痢)を生じる機能性消化管疾患である。IBSは、その症状より、下痢型、便秘型、混合型および分類不明型に分類されている。
先進国において、IBSの有病率は全人口の約10〜20%に達するいわれており、極めて高頻度な消化器疾患であると言われている。また、IBSの症状は、患者の生活の質や労働生産性を著しく低下させるなど大きな社会問題となっている。
【0003】
IBSの薬物療法として、ポリカルボフィルカルシウムなどの高分子重合体、若しくはマレイン酸トリメブチンなどの消化管運動調節薬を処方して、症状が改善されない場合には、その症状に応じて、乳酸菌製剤、下剤・抗コリン薬などが投与する方法が知られている。しかしながら、これらの方法では、症状の改善が不十分であり、有効性も低かった(非特許文献1)。一方、セロトニン受容体拮抗薬として、アロセトロン等の下痢型IBS治療薬が上市されており、比較的高い有効性が報告されているが、重篤な便秘や虚血性大腸炎などの副作用をなすことが報告されている(非特許文献2)。従って、安全かつ効果的な過敏性腸症候群の症状の予防又は改善剤が求められている
【0004】
一方、β-グルカンは、きのこやカビが産生する細胞壁の成分として古くから知られており、天然物由来の有用な健康食品として利用されてきた。β-グルカンは、免疫賦活活性から抗癌や抗癌転移効果(非特許文献3)や炎症性反応の低減にも効果があることが知られている(非特許文献4)。
また、特許文献1には、抗がん剤の経口投与と共に、β-1,3-1,6-D-グルカンを経口投与することにより、抗癌剤の副作用である小腸粘膜障害、及び下痢が抑制されたことが記載されている。このようにβ-グルカンは、免疫賦活作用を通した炎症反応の低減により、種々の疾病に対して効果を示すことが報告されている。しかしながら、過敏性腸症候群における下痢や腹痛・腹部不快感の症状を改善するとの報告はされていない。また、大腸における痛覚過敏を改善するとの報告もされていない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2010−90070号公報
【非特許文献】
【0006】
【非特許文献1】心療内科,8,21-27,2004
【非特許文献2】Am J Gastroentero,97(11suppl),S7-S26,2002
【非特許文献3】Immunity,19(3),311-315
【非特許文献4】Shock 27(4),397-401
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、安全かつ効果的な過敏性腸症候群の下痢抑制剤、及び腹痛改善剤を提供することを課題とする。また、本発明は、安全かつ効果的な大腸における痛覚過敏改善剤を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは、上記課題を解決するために研究を重ね、β-1,3-グルカンが過敏性腸症候群における排便異常を改善、及び腹痛を改善することを見出した。また、β-1,3-グルカンが、大腸における痛覚過敏を低減することを見出した。多糖がこれらの作用を有することは、これまで知られていない。本発明はこれらの知見に基づき完成されたものであり、以下の過敏性腸症候群の下痢抑制剤、腹痛改善剤、及び大腸における痛覚過敏改善剤を提供する。
【0009】
項1. β-1,3-グルカンを含む過敏性腸症候群の下痢抑制剤。
項2. β-1,3-グルカンがβ-1,3-1,6-D-グルカンである項1に記載の剤。
項3. β-1,3-1,6-グルカンが、β-1,3結合に対するβ-1,6結合の分岐度が50〜100%であるβ-1,3-1,6-グルカンである項1又は2に記載の剤。
項4. β-1,3-1,6-グルカンが、オーレオバシジウム属の微生物が産生するβ-1,3-1,6-グルカンである項1〜3に記載の剤。
項5. オーレオバシジウム属の微生物が、オーレオバシジウム・プルランスGM-NH-1A1株(FERM P-19285)、又はGM-NH-1A2株(FERM P-19286)である項4に記載の剤。
項6. β-1,3-グルカンを含む過敏性腸症候群の腹痛改善剤。
項7. β-1,3-グルカンがβ-1,3-1,6-D-グルカンである項6に記載の剤。
項8. β-1,3-1,6-グルカンが、β-1,3結合に対するβ-1,6結合の分岐度が50〜100%であるβ-1,3-1,6-グルカンである項6又は7に記載の剤。
項9. β-1,3-1,6-グルカンが、オーレオバシジウム属の微生物が産生するβ-1,3-1,6-グルカンである項6〜8に記載の剤。
項10. オーレオバシジウム属の微生物が、オーレオバシジウム・プルランスGM-NH-1A1株(FERM P-19285)、又はGM-NH-1A2株(FERM P-19286)である項9に記載の剤。
項11. β-1,3-グルカンを含む大腸における痛覚過敏改善剤。
項12. β-1,3-グルカンがβ-1,3-1,6-D-グルカンである項11に記載の剤。
項13. β-1,3-1,6-グルカンが、β-1,3結合に対するβ-1,6結合の分岐度が50〜100%であるβ-1,3-1,6-グルカンである項11又は12に記載の剤。
項14. β-1,3-1,6-グルカンが、オーレオバシジウム属の微生物が産生するβ-1,3-1,6-グルカンである項11〜13に記載の剤。
項15. オーレオバシジウム属の微生物が、オーレオバシジウム・プルランスGM-NH-1A1株(FERM P-19285)、又はGM-NH-1A2株(FERM P-19286)である項14に記載の剤。
【発明の効果】
【0010】
β-1,3-グルカンは、セロトニン及びアセチルコリン等に起因する排便異常の症状を改善する。即ち、過敏性腸症候群の排便異常、及び腹痛を予防又は改善剤として有用である。また、本発明の剤は、大腸のおける痛覚過敏に対して、効果的に症状を改善することから、腹痛・腹部不快感を伴う慢性的な便通異常を生じる機能性消化管疾患の予防又は改善剤などとして有用である。
【図面の簡単な説明】
【0011】
【図1】実験例で得たオーレオバシジウム・プルランス由来のグルカンの1H NMRスペクトルである。
【図2】実験例で得たオーレオバシジウム・プルランス由来のグルカンの超音波照射したときの培養液の粒度分布を示す図である。
【図3】図Aは、低分子β-1,3-1,6-D-グルカンが、5-HT(セロトニン)による排便異常を抑制したことを示す図である。図Bは、低分子β-1,3-1,6-D-グルカンが、ベタネコールによる排便異常を抑制したことを示す図である。図Cは、低分子β-1,3-1,6-D-グルカンが、ひまし油による排便異常を抑制したことを示す図である。
【図4】オーレオバシジウム・プルランス由来のβ-グルカンが大腸における異常便排出による痛みを改善、及び低下させたことを示す図である。
【図5】オーレオバシジウム・プルランス由来のβ-グルカンが大腸における痛覚過敏を低下させたことを示す図である。
【発明を実施するための形態】
【0012】
以下、本発明を詳細に説明する。
本発明の過敏性腸症候群の下痢抑制剤、腹痛改善剤、及び大腸における痛覚過敏改善剤は、β-1,3-グルカンを有効成分として含む。
β-1,3-グルカン
β-1,3-グルカンとしては、β-1,3-D-グルカン、β-1,3-1,6-D-グルカン、β-1,3-1,4-D-グルカンなどが挙げられる。中でも、β-1,3-1,6-D-グルカンが好ましい。
これらのβ-1,3-グルカンは、酵母、担子菌(キノコ)類、かび類、乳酸菌、その他微生物等の細胞壁に大量に含まれている。また、β-1,3-グルカンを菌体外へ分泌する菌体も知られている。さらに、大麦、カラスムギ等のイネ科植物にも大量に含まれていることも知られている。中でも、オーレオバシジウム属微生物はβ-1,3-1,6-D-グルカンを主に生産するので、オーレオバシジウム属微生物由来のβ-1,3-グルカンが好ましい。
【0013】
β-1,3-1,6-D-グルカンにおいて、主鎖のβ-1,3結合数に対する側鎖のβ-1,6結合数の比率である分岐度は、通常約50〜100%、好ましくは約75〜100%、より好ましくは約85〜100%であればよい。
β-1,3-1,6-D-グルカンが上記分岐度を有することは、β-1,3-1,6-D-グルカンをエキソ型のβ-1,3-グルカナーゼ(キタラーゼ M、ケイアイ化成製)で加水分解処理した場合に分解生成物としてグルコースとゲンチオビオースが遊離すること、及びNMRの積算比から確認できる(今中忠行 監修、微生物利用の大展開、1012-1015、エヌ・ティー・エス(2002))。
【0014】
上記の分岐度を有するβ-1,3-1,6-D-グルカンは、水溶液の30℃、pH5.0、濃度0.5(w/v%)における粘度が、好ましくは200cP(mPa・s)以下、より好ましくは100cP(mPa・s)以下、さらに好ましくは50cP(mPa・s)以下のものである。上記粘度の下限値は通常10cP(mPa・s)程度であり得る。
本発明において、粘度は、BM型回転粘度計を用いて測定した値である。
【0015】
(a)オーレオバシジウム属微生物が生産するβ-1,3-1,6-D-グルカン
オーレオバシジウム属(Aureobasidium sp.)に属する微生物由来のβ-1,3-1,6-D-グルカンは、1N水酸化ナトリウム重水溶液を溶媒とする溶液の1H NMRスペクトルが約4.7ppm及び約4.5ppmの2つのシグナルを有する。NMRの測定値は条件の微妙な変化によって変化し、また誤差を伴うことは周知のことであることから、「約4.7ppm」「約4.5ppm」は、通常予測される範囲の測定値の変動幅(例えば±0.2)を含む数値を意味する。
オーレオバシジウム属の微生物が産生するβ-1,3-1,6-D-グルカンは、菌体外に分泌されるため、キノコ類やパン酵母の細胞壁に含まれるβ-グルカンと比べて、回収が容易であり、また水溶性である点で好ましいものである。オーレオバシジウム属の微生物は、分子量が100万以上の高分子量のグルカンから分子量が数万程度の低分子のグルカンまでを培養条件に応じて産生することができる。
【0016】
中でも、培養液が比較的低粘度であること、及びβ-1,3-1,6-D-グルカンを高生産する点で、オーレオバシジウム・プルランス(Aureobasidium pullulans)が生産するものが好ましく、オーレオバシジウム・プルランスGM-NH-1A1株、又はGM-NH-1A2株(独立行政法人産業技術研究所特許生物寄託センターにそれぞれFERM
P-19285及びFERM P-19286として寄託済み)が産生するものが好ましい。GM-NH-1A1株及びGM-NH-1A2株は、オーレオバシジウム属(Aureobasidium sp.)K-1株の変異株である。オーレオバシジウム属K-1株は、分子量200万以上と100万程度の2種類のβ-1,3-1,6-D-グルカンを産生することが知られている。
また、オーレオバシジウム属微生物が産生するβ-1,3-1,6-D-グルカンは、通常、硫黄含有基を有するところ、K-1株の産生するβ-グルカンはスルホ酢酸基を有することが知られている(Arg.Biol.Chem.,47,1167-1172(1983)),科学と工業,64,131-135(1990))。GM-NH-1A1株、及びGM-NH-1A2株が生産するβ-1,3-1,6-D-グルカンもスルホ酢酸基を有すると考えられる。オーレオバシジウム属微生物の中には、リン酸基のようなリン含有基、リンゴ酸基などを含むβ-1,3-1,6-D-グルカンを産生する菌種、菌株も存在する。
GM-NH-1A1株及びGM-NH-1A2株は、後に実施例において示すようにメインピークが見かけ上50〜250万の高分子量のβ-グルカン(微粒子グルカン)とメインピークが見かけ上2〜30万の低分子量のβ-グルカンの両方を産生する菌株である。この微粒子状グルカンは、一次粒子径が0.05〜2μm程度である。
【0017】
β-1,3-1,6-D-グルカンの溶解度は、pH及び温度に依存する。このβ-1,3-1,6-D-グルカンは、pH3.5、温度25℃の条件で2mg/ml水溶液を調製しようとすると、その50重量%以上が一次粒子径0.05〜2μmの微粒子を形成し、残部は水に溶解する。本発明において粒子径は、レーザー回折散乱法により測定した値である。
オーレオバシジウム属微生物が産生するβ-1,3-1,6-D-グルカンも、水溶液にしたときの粘度が、オーレオバシジウム属微生物が産生する天然型β-1,3-1,6-D-グルカンより低いものが好ましい。この低粘度β-1,3-1,6-D-グルカンは、水溶液の30℃、pH5.0、濃度0.5(w/v%)における粘度が、通常200cP(mPa・s)以下であり、より好ましくは100cP(mPa・s)以下であり、さらに好ましくは50cP(mPa・s)以下であり、さらにより好ましくは10cP以下である。
【0018】
この低粘度グルカンは、オーレオバシジウム属微生物が産生する天然型β-1,3-1,6-D-グルカンと同様の一次構造を有し得る。具体的には、1N水酸化ナトリウム重水溶液を溶媒とする溶液の1HNMRスペクトルが約4.7ppm及び約4.5ppmの2つのシグナルを有するものである。NMRの測定値は条件の微妙な変化によって変化し、また誤差を伴うことは周知のことであることから、「約4.7ppm」「約4.5ppm」は、通常予測される範囲の測定値の変動幅(例えば±0.2)を含む数値を意味する。
β-1,3-1,6-D-グルカンは、金属イオン濃度が、β-1,3-1,6-D-グルカンの固形分1g当たり0.4g以下であることが好ましく、0.2g以下であることがより好ましく、0.1g以下であることがさらにより好ましい。原料β-1,3-1,6-D-グルカンが水溶液状態のものである場合は、金属イオン濃度は、水溶液の100ml当たり120mg以下であることが好ましく、50mg以下であることがより好ましく、20mg以下であることがさらにより好ましい。
【0019】
ここでいう金属イオンには、アルカリ金属イオン、アルカリ土類金属イオン、第3〜第5族金属イオン、遷移金属イオンなどが含まれるが、混入する可能性のある金属イオンとしては、代表的には、低粘度β-1,3-1,6-D-グルカンの製造において使用されるアルカリ由来のカリウムイオン、ナトリウムイオンなどが挙げられる。金属イオン濃度は、限外ろ過や透析により調整できる。
金属イオン濃度が上記範囲であれば、水溶液状態で保存する場合や、水溶液状態で加熱滅菌する際に、β-1,3-1,6-D-グルカンのゲル化、凝集、沈殿が生じ難い。また、固形で使用する場合は、再溶解させる場合に凝集などが生じ難い。
【0020】
(b)オーレオバシジウム属微生物によるβ-1,3-1,6-D-グルカンの生産方法
分岐度50〜100%のβ-1,3-1,6-D-グルカンは、例えば、これを産生する微生物の培養上清に有機溶媒を添加することにより沈殿物として得ることができる。
また、オーレオバシジウム属の微生物を培養して、β-1,3-1,6-D-グルカンを産生させる方法は種々報告されている。培養培地に使用できる炭素源としては、シュークロース、グルコース、フラクトースなどの炭水化物、ペプトンや酵母エキスなどの有機栄養源等を挙げることができる。窒素源としては、硫酸アンモニウムや硝酸ナトリウム、硝酸カリウムなどの無機窒素源等を挙げることができる。場合によってはβ-グルカンの産生量を上昇させるために適宜、塩化ナトリウム、塩化カリウム、リン酸塩、マグネシウム塩、カルシウム塩などの無機塩、更には鉄、銅、マンガンなどの微量金属塩やビタミン類等を添加するのも有効な方法である。
オーレオバシジウム属微生物を、炭素源としてシュークロースを含むツアペック培地にアスコルビン酸を添加した培地で培養した場合、高濃度のβ-1,3-1,6-D-グルカンを産生することが報告されている(Arg.Biol.Chem.,47,1167-1172(1983));科学と工業,64,131-135(1990);特開平7−51082号公報)。しかし、培地は、微生物が生育し、β-1,3-1,6-D-グルカンを生産するものであればよく、特に限定されない。必要に応じて酵母エキスやペプトンなどの有機栄養源を添加してもよい。
【0021】
オーレオバシジウム属の微生物を上記培地で好気培養するための条件としては、10〜45℃程度、好ましくは20〜35℃程度の温度条件、3〜7程度、好ましくは3.5〜5程度のpH条件等が挙げられる。
効果的に培養pHを制御するためにアルカリ、あるいは酸で培養液のpHを制御することも可能である。更に培養液の消泡のために適宜、消泡剤を添加してもよい。培養時間は通常1〜10日間程度、好ましくは1〜4日間程度であり、これによりβ-グルカンを産生することが可能である。なお、β-グルカンの産生量を測定しながら培養時間を決めてもよい。
上記条件下オーレオバシジウム属の微生物を4〜6日間程度通気攪拌培養すると、培養液にはβ-1,3-1,6-D-グルカンを主成分とするβ−グルカン多糖が0.1%(w/v)〜数%(w/v)含有されており、その培養液の粘度はBM型回転粘度計(東機産業社製)により30℃では数百cP([mPa・s])から数千cP([mPa・s])という非常に高い粘度を有する。この培養を遠心分離して得られる上清に例えば有機溶媒を添加することにより、β-1,3-1,6-D-グルカンを沈殿物として得ることができる。
【0022】
<低粘度β-1,3-1,6-D-グルカンの製造方法>
上記の高粘度のβ-1,3-1,6-D-グルカンを含む培養液を、常温で攪拌しながら、これにアルカリを添加すると、急激に粘度が低下する。
アルカリは、水溶性で、かつ医薬品や食品添加物として用いることができるものであればよく、特に限定されない。例えば、炭酸カルシウム水溶液、炭酸ナトリウム水溶液、炭酸カリウム水溶液、炭酸アンモニウム水溶液などの炭酸アルカリ水溶液;水酸化ナトリウム水溶液、水酸化カリウム水溶液、水酸化カルシウム水溶液などの水酸化アルカリ水溶液;あるいはアンモニア水溶液などを使用できる。アルカリは、培養液のpHが12以上、好ましくは13以上になるように添加してもよい。例えば、水酸化ナトリウムを使用して培養液のpHを上げる場合は、水酸化ナトリウムの最終濃度が好ましくは0.5%(w/v)以上、より好ましくは1.25%(w/v)以上になるように添加すればよい。培養液にアルカリを添加し、良く攪拌すると、瞬時に培養液の粘度が低下する。
【0023】
次いで、アルカリ処理後の培養液から菌体などの不溶性物質を分離する。培養液の粘度が低いため、菌体を自然沈降させて上澄みを回収する方法(デカント法)、遠心分離、ろ紙あるいはろ布を利用した全量ろ過、フィルタープレス、更に膜ろ過(MF膜などの限外ろ過)などの方法で、容易に不溶性物質とグルカンとを分離できる。ろ紙あるいはろ布による全量ろ過の場合は、セライトなどろ過助剤を利用するのも一つの手段である。工業的にはフィルタープレスによる菌体除去が好ましい。また、不溶性物質除去前のβ-D-グルカン液は必要に応じて水で希釈しても良い。濃度が高すぎると不溶性物質除去が困難であり、低すぎても効率的でない。β-D-グルカン濃度は、例えば0.1mg/ml〜20mg/ml程度、好ましくは0.5mg/ml〜10mg/ml程度、さらに好ましくは1mg/ml〜5mg/ml程度が良い。
【0024】
次いで、グルカンを含む溶液に酸を添加して中和する。中和は、不溶物の除去前に行ってもよい。酸は、医薬や食品添加物として使用できるものであればよく、特に限定されない。例えば、塩酸、燐酸、硫酸、クエン酸、リンゴ酸などを使用できる。酸の使用量は、溶液又は培養液の液性が中性(pH5〜8程度)になるような量とすればよい。即ち、中和はpH7に合わせることを必ずしも要さない。
pH12以上のアルカリ処理後、中和して得られるβ-1,3-1,6-D-グルカンは、30℃、pH5.0、濃度0.5(w/v%)における粘度が通常200cP以下、場合によっては、100cP以下、50cP以下、又は10cP以下である。粘度は製造方法ないしは精製方法によって変動する。
アルカリ処理された低粘度のβ-1,3-1,6-D-グルカンは、中和しても粘度が高くなることがない。さらに、常温(15〜35℃)では、液性をpHが4を下回るような酸性にしても、粘度が高くなることがない。
また、培養上清をアルカリ処理、及び中和した後に、菌体などを除去するのに代えて、培養上清から菌体などを除去した後に、アルカリ処理、及び中和を行うこともできる。
【0025】
得られるグルカン水溶液からグルカンより低分子量の可溶性夾雑物(例えば塩類など)を除去する場合は、例えば限外ろ過を行えばよい。
また、アルカリ処理、除菌した後、中和せずに、アルカリ性条件下で限外ろ過することもでき、これにより透明性、熱安定性、長期保存性に一層優れる精製β-1,3-1,6-D-グルカンが得られる。アルカリ性条件は、pH10以上、好ましくは12以上であり、pHの上限は通常13.5程度である。
このようにして得られる水溶液に含まれるβ-1,3-1,6-D-グルカンは、乾燥させて固形製剤にする場合も、また水溶液のまま製剤として使用する場合も、一旦、水溶液から析出させることができる。β-1,3-1,6-D-グルカンの析出方法は、特に限定されないが、例えば、限外ろ過などにより濃縮してグルカン濃度を1w/w%以上にした水溶液に、エタノールのようなアルコールを、水溶液に対して容積比で等倍以上、好ましくは2倍以上添加することにより、β-1,3-1,6-D-グルカンを析出させることができる。この場合にpHをクエン酸などの有機酸によりpHを酸性、好ましくはpH4未満、さらに好ましくはpH3-3.7に調製して、エタノールを添加すると高純度のβ-1,3-1,6-グルカンの粉末を得ることができる。
【0026】
β-1,3-1,6-D-グルカンを低粘度化することにより、限外ろ過などによる濃縮を容易に行えることから、アルコール沈殿に使用するアルコール量を少なくすることができる。
固形物として得る場合は、低粘度β-1,3-1,6-D-グルカン水溶液を直接乾燥させてもよく、析出させたβ-1,3-1,6-D-グルカンを乾燥させてもよい。乾燥は、噴霧乾燥法、凍結乾燥法等公知の方法で行うことができる。
【0027】
医薬組成物
本発明の剤は、適当な担体及び添加剤と共に製剤化して医薬組成物とすることができる。医薬組成物の剤型としては、経口投与剤(咽頭用剤を含む)、坐剤などが挙げられる。
<経口投与剤>
経口投与剤は、大腸にβ-1,3-グルカンを効果的に送達できる剤型である。
固形経口投与製剤の剤型としては、例えば、散剤、顆粒剤、錠剤、タブレット剤、丸剤、カプセル剤、チュアブル剤などが挙げられ、液体経口投与製剤の剤型としては、乳剤、液剤、シロップ剤などが挙げられる。中でも、摂取が容易である点で、錠剤、顆粒剤、カプセル剤、チュアブル剤、液剤が好ましく、液剤がより好ましい。経口投与剤は咽頭用剤としても使用できる。
固形製剤は、β-1,3-グルカンに薬学的に許容される担体や添加剤を配合して調製される。例えば、白糖、乳糖、ブドウ糖、でんぷん、マンニットのような賦形剤;アラビアゴム、ゼラチン、結晶セルロース、ヒドロキシプロピルセルロース、メチルセルロースのような結合剤;カルメロース、デンプンのような崩壊剤;無水クエン酸、ラウリン酸ナトリウム、グリセロールのような安定剤などが配合される。さらに、ゼラチン、白糖、アラビアゴム、カルナバロウなどでコーティングしたり、カプセル化したりしてもよい。
また、液体製剤は、例えば、β-1,3-グルカンを、水、エタノール、グリセリン、単シロップ、又はこれらの混液などに、溶解又は分散させることにより調製される。これらの製剤には、甘味料、防腐剤、粘滑剤、滑沢剤、希釈剤、緩衝剤、着香剤、着色剤のような添加剤が添加されていてもよい。
【0028】
固形経口投与剤中のβ-1,3-グルカンの含有量は、乾燥重量に換算して、製剤全体に対して、約0.01〜99重量%が好ましく、約0.1〜50重量%がより好ましい。また、液体経口投与剤中のβ-1,3-グルカンの含有量は、乾燥重量に換算して、製剤全体に対して、約0.01〜2重量%が好ましく、約0.05〜0.5重量%がより好ましい。
上記含有量の範囲であれば、無理のない投薬量及び投薬スケジュールで、本発明を効果的に誘導できる。
<坐剤>
坐剤は、直腸粘膜にβ-1,3-グルカンを効果的に送達できる剤型である。
坐剤は、β-1,3-グルカンを、カルボポール及びポリカルボフィルのようなアクリル性高分子;ヒドロキシプロピルセルロース及びヒドロキシプロピルメチルセルロースのようなセルロース性高分子;アルギン酸ナトリウム及びキトサンのような天然高分子;脂肪酸ワックスなどの基剤に配合することにより調製できる。また、安息香酸ナトリウム、ソルビン酸カリウム、パラベンのような防腐剤;塩酸、クエン酸、水酸化ナトリウムのようなpH調節剤;メチオニンのような安定化剤を配合してもよい。
坐剤中のβ-1,3-グルカンの含有量は、乾燥重量に換算して、製剤全体に対して、約0.01〜99重量%が好ましく、約0.1〜50重量%がより好ましい。上記範囲であれば、通常の投薬量及び投薬スケジュールで、本発明を効果的に誘導できる。
【0029】
食品組成物
本発明の剤は食品組成物とすることもできる。この食品組成物は、健康食品、栄養補助食品(バランス栄養食、サプリメントなどを含む)、保健機能食品(特定保健用食品(疾病リスク低減表示、規格基準型を含む)、条件付き特定保健用食品、栄養機能食品を含む)に好適である。
食品組成物は、食品に通常用いられる賦形剤または添加剤を配合して、錠剤、タブレット剤、丸剤、顆粒剤、散剤、粉剤、カプセル剤、水和剤、乳剤、液剤等の剤型に調製することができる。中でも、摂取が容易である点で、錠剤、顆粒剤、カプセル剤、チュアブル剤、液剤が好ましく、液剤がより好ましい。
食品に通常用いられる賦形剤としては、シロップ、アラビアゴム、ショ糖、乳糖、粉末還元麦芽糖、セルロース糖、マンニトール、マルチトール、デキストラン、デンプン類、ゼラチン、ソルビット、トラガント、ポリビニルピロリドンのような結合剤;ショ糖脂肪酸エステル、グリセリン脂肪酸エステル、ステアリン酸マグネシウム、ステアリン酸カルシウム、タルク、ポリエチレングリコールのような潤沢剤;ジャガイモ澱粉のような崩壊剤;ラウリル硫酸ナトリウムのような湿潤剤等が挙げられる。添加剤としては、香料、緩衝剤、増粘剤、着色剤、安定剤、乳化剤、分散剤、懸濁化剤、防腐剤などが挙げられる。
【0030】
固形食品製剤中のβ-1,3-グルカンの含有量は、乾燥重量に換算して、製剤全体に対して、約0.01〜99重量%が好ましく、約0.1〜50重量%がより好ましい。また、液体食品製剤中のβ-1,3-グルカンの含有量は、乾燥重量に換算して、製剤全体に対して、約0.01〜2重量%が好ましく、約0.05〜0.5重量%がより好ましい。
上記範囲であれば、無理のない摂取量及び摂取スケジュールで、本発明を効果的に誘導できる。
【0031】
また、この食品組成物は、飲料(スポーツ飲料、ドリンク剤、乳飲料、乳酸菌飲料、果汁飲料、炭酸飲料、野菜飲料、茶飲料等)、菓子類(クッキー等の焼き菓子、ゼリー、ガム、グミ、飴等)のような一般の飲食品を含むものであってもよい。中でも、摂取が容易である点で、飲料が好ましい。
固形又は半固形の食品組成物中のβ-1,3-グルカンの含有量は、乾燥重量に換算して、製剤全体に対して、約0.01〜99重量%が好ましく、約0.1〜50重量%がより好ましい。また、液体状又は流動状の食品組成物中のβ-1,3-グルカンの含有量は、乾燥重量に換算して、組成物全体に対して、約0.01〜10重量%が好ましく、約0.1〜5重量%がより好ましい。
上記範囲であれば、無理なく摂取できる飲食品中に、本発明を効果的に誘導できるだけのβ-1,3-グルカンが含まれることになる。
食品添加剤
本発明の剤は、一つの実施態様として、β-1,3-グルカンを含む食品添加剤であり得る。当業者は、本発明が提供する食品添加剤を食品に配合させることにより、下記で説明する用途、機能または作用を食品に付加することができ、食品の質を改変することができる。
【0032】
使用方法
本発明の剤が経口投与医薬製剤、食品組成物、又は食品添加剤である場合のβ-1,3-グルカンの1日投与量は約0.1〜1000mgが好ましく、約1〜600mgがより好ましく、約5〜200mgがさらに好ましい。
また、本発明の剤が医薬組成物の坐剤である場合のβ-1,3-グルカンの1日投与量は、0.1〜1000mgが好ましく、約1〜600mgがより好ましい。
【0033】
用途
本発明の剤は、後述する実施例に示す通り、過敏性腸症候群の排便異常(例えば、下痢、排便亢進など)及び腹痛を改善する。従って、過敏性腸症候群の疾患の予防又は治療剤として有用である。
また、本発明の剤は、大腸痛覚伝達を抑制し、大腸痛覚閾値低下を抑制し得、大腸のおける痛覚過敏に対して、効果的に、症状を改善することから、腹痛・腹部不快感を伴う慢性的な便通異常を生じる機能性消化管疾患の予防又は治療剤などとして有用である。
過敏性腸症候群(irritable bowel syndrome; IBS)とは、例えば、診断基準Rome II基準またはRome III基準により定義された疾患である。Rome III基準によれば、過敏性腸症候群は、「最近3ヶ月の内の1ヶ月において、少なくとも3日以上腹痛あるいは腹部不快感が生じ、その腹部症状が1」排便によって改善する、2」排便頻度の変化で始まる、3」便性状の変化で始まる、の3項目中2項目以上にあてはまるもの」と定義されており、排便回数や便性状などの違いから、過敏性腸症候群は下痢型、便秘型、混合型および分類不能型に分類されている(日薬理誌133, 281-291 (2009))。
【0034】
対象
本発明の剤を投与または摂取する対象は、過敏性腸症候群に罹患しているヒト、その処置または予防が必要なヒト、その疑いがあるヒトであり得る。ここで、過敏性腸症候群は、下痢型、便秘型、混合型または分類不能型であってもよい。また、ヒトは男性であっても女性であってもよい。よって、本発明は、一つの実施態様として、β-1,3-グルカンを含む下痢型過敏性腸症候群の治療薬または予防薬を提供する。
また、過敏性腸症候群は、ストレスをはじめとする種々の病因によって引き起こされ、腸管神経の過緊張に伴う腸の運動機能亢進によって生ずる疾患であり得る。腸(例えば、大腸)などの消化管の運動に関与する神経伝達物質としては、セロトニン、およびアセチルコリンが挙げられる。本発明の剤は、後述する実施例に示すとおり、セロトニン、またはアセチルコリンが惹起する排便異常を改善する。よって、本発明は、一つの実施態様として、セロトニン、またはアセチルコリンが惹起する排便異常の改善剤、または、一つの実施態様として、腸におけるセロトニン、またはアセチルコリンの作用亢進抑制剤を提供する。腸におけるセロトニン、またはアセチルコリンの作用の亢進の例としては、腸の運動亢進(例えば、大腸における排便能、輸送能または水分輸送能が亢進していること)が挙げられる。また、腸におけるセロトニンの作用の亢進の他の例としては、大腸に投射している外来性求心性一次神経の終末に存在する5-HT3受容体を活性化することによる大腸で発生した痛覚シグナルの中枢への伝達および痛覚過敏の惹起が挙げられる。このような腸における異常が脳へ伝達されると、さらに、ストレスが発生し便通異常を悪化させるという脳腸相関の異常が惹起される。本発明の剤は、好ましい一つの実施態様として、脳腸相関の異常を改善する。
これまで、下痢型過敏性腸症候群の治療薬として用いられている、5-HT3受容体アンタゴニストおよび副交感神経を抑制する抗コリン薬には、便秘、尿が出にくい、口の渇き等の副作用が報告されている。β-1,3-グルカンには、そのような副作用は報告されていないことから、この点において、本発明の剤は安全である。
【実施例】
【0035】
以下、本発明の実施例を挙げてより詳細に説明するが、本発明はこれらに限定されるものではない。
(A)精製β-1,3-1,6-D-グルカンの製造
(1)低粘度β-1,3-1,6-D-グルカンの調製
(1-1)β-グルカンの培養産生
後掲の表1に示す組成を有する液体培地100mlを500ml容量の肩付きフラスコに入れ、121℃で、15分間、加圧蒸気滅菌を行った後、オーレオバシジウム プルランス(Aureobasidium pullulans)GM-NH-1A1株(FERM P-19285)を同培地組成のスラントより無菌的に1白金耳植菌し、130rpmの速度で通気攪拌しつつ、30℃で24時間培養することにより種培養液を調製した。
次いで、同じ組成の培地200Lを300L容量の培養装置(丸菱バイオエンジ製)に入れ、121℃で、15分間、加圧蒸気滅菌し、上記のようにして得られた種培養液2Lを無菌的に植菌し、200rpm、27℃、40L/minの通気攪拌培養を行った。なお、培地のpHは水酸化ナトリウム及び塩酸を用いてpH4.2〜4.5の範囲内に制御した。96時間後の菌体濁度はOD660nmで23ODで、多糖濃度は0.5%(w/v)で、硫黄含量から計算される置換スルホ酢酸含量は0.09%であった。
【0036】
<多糖濃度測定>
多糖濃度は、培養液を数mlサンプリングし、菌体を遠心分離除去した後、その上清に最終濃度が66%(v/v)となるようにエタノールを加えて多糖を沈殿させて回収した後、イオン交換水に溶解し、フェノール硫酸法で定量した。
【0037】
<置換スルホ含量測定>
同様にして菌体を除去した培養上清にエタノールを最終濃度が66%となるように添加し、β-グルカンを沈殿回収した。その後、再度イオン交換水に溶解し、再度遠心分離後、その上清に最終濃度が0.9%になるように食塩を加えた後、再度66%エタノールでβ-グルカンを回収した。このβ-グルカン回収精製操作を更に2回繰り返し、得られたβ-グルカン水溶液をイオン交換水で透析後、凍結乾燥によりβ-グルカン粉末を得た。
このβ-グルカン粉末を燃焼管式燃焼吸収後、イオンクロマト法で組成分析した結果、S含量は239mg/kgであり、この値から計算される置換スルホ酢酸含量は0.09%であった。
【0038】

【0039】
(1−2)アルカリ処理
上記のようにして得られた培養液の粘度をBM型回転粘度計(東京計器製)を用いて、30℃、12rpmで測定したところ、1500cP((mPa・s))であった。測定に用いるロータは粘度にあわせて適当なものを選択した。
この培養液に水酸化ナトリウム最終濃度が2.4%(w/v)となるように25%(w/w)水酸化ナトリウムを添加し攪拌したところ(pH13.6)、瞬時に粘度が低下した。引き続いて50%(w/v)クエン酸水溶液でpH5.0となるように中和してから、濃度0.5(w/v%)における粘度を測定したところ、そのときの粘度(30℃)は20cP([mPa・s])であった。
次いで、この培養液にろ過助剤としてKCフロック(日本製紙社製)を1wt%添加し、薮田式ろ過圧搾機(薮田機械製)を用いて菌体を除去し、最終的に培養ろ液(約230L)を得た。その多糖濃度は0.5%(w/v)で、ほぼ100%の回収率であった。
【0040】
(1−3)β-グルカン水溶液の脱塩
上記のβ-グルカン水溶液(培養ろ液)を0.3%に希釈後、限外ろ過(UF)膜(分子量カット5万、日東電工社製)を用いて脱塩を行い、最終的にナトリウムイオン濃度を20mg/100mlに落とした後、50%(w/v)クエン酸水溶液によりpHを3.5に調整した。
引き続いて、ホット充填用加熱ユニット(日阪製作所製)を用いて95℃で、3分間保持することにより殺菌処理を行い、最終製品のβ-グルカン水溶液を得た。この時のβ-グルカンの濃度をフェノール硫酸法により測定したところ0.22%(w/v)であった。また、培養液からのトータル収率は約73%であった。
【0041】
<硫黄含有量の測定>
また、得られたβ-グルカン水溶液をイオン交換水で透析後、凍結乾燥によりβ-グルカン粉末を得た。本β-グルカンの組成分析結果からS含量は330mg/kgであり、これから計算される置換スルホ酢酸含量は0.12%であった。
【0042】
<結合状態の確認>
また、脱塩を行った上記培養ろ液について、コンゴーレッド法によって、480nmから525nm付近への波長シフトを確認することができたのでβ-1,3結合を含むグルカンを含有していることが証明された(K. Ogawa, Carbohydrate Research, 67,
527-535 (1978)、今中忠行 監修, 微生物利用の大展開, 1012-1015, エヌ・ティー・エス(2002))。そのときの極大値へのシフト差分はΔ0.48/500μg多糖であった。
上記培養ろ液15mlを取り出し、30mlのエタノールを添加し、4℃、1000rpm、10minで遠心して、沈殿する多糖を回収した。66%エタノールで洗浄し、4℃、1000rpm、10分間遠心して、沈殿する多糖に2mlのイオン交換水と、1mlの1N水酸化ナトリウム水溶液を添加撹拌後、60℃、1時間保温して沈殿を溶解させた。次に-80℃にて凍結後、一晩、真空凍結乾燥を行い、乾燥後の粉末を1mlの1N水酸化ナトリウム重水溶液に溶解させ、2次元NMRに供した。
2次元NMR(13C−1H COSY NMR)106ppmと相関関係を有する1H NMRスペクトルを図1に示す。このスペクトルにおいて4.7ppmと4.5ppm付近との2つのシグナルが得られた。
この結果、本β-グルカンがβ-1,3-1,6-D-グルカンであることが証明された(今中忠行 監修、微生物利用の大展開、1012-1015、エヌ・ティー・エス(2002))。それぞれの1H NMRシグナルの積分比から、β-1,3結合/β-1,6結合の比は1.15であることが判明した。従って、主鎖のβ-1,3結合に対する側鎖のβ-1,6結合の分岐度は、約87%である。
【0043】
<粒度測定>
次に、レ−ザ回折/散乱式粒度分布測定装置(HORIBA製LA−920)を用いて培養液の粒度を測定したところ、粒子としては0.3μmと100μm程度の大きさのところにピ−クが見られた。続いて、超音波を照射しながら、粒度測定を行うと、100μmのピ−クはみるみるうちに消失し、0.3μmのピ−クが増え、最終的に0.3μmのみとなった。超音波照射したときの培養液の粒度分布を図2に示す。
0.3μmのピークはβ-1,3-1,6-D-グルカンの一次粒子によるピークであり、100〜200μmのピークはβ-1,3-1,6-D-グルカンの一次粒子が凝集した二次粒子によるピークであると考えられる。
また、二次粒子はマグネチックスターラ−による攪拌、軽い振とうでも同じように消失し、容易に砕けて一次粒子になることが確認された。よって、二次粒子は非常に緩い凝集(緩凝集状態)と考えられる。
【0044】
<分子量測定>
また、東ソー社製のトーヨーパールHW65(カラムサイズ75cm×φ1cm、排除分子量250万(デキストラン))を用いて、0.1Mの水酸化ナトリウム水溶液を溶離液としてゲルろ過クロマトグラフィーを行い、溶解β-1,3-1,6-D-グルカンとβ-1,3-1,6-D-グルカンの1次粒子とを含む溶液の分子量を測定したところ、溶解β-1,3-1,6-D-グルカンに由来する2〜30万のピークの低分子画分と、1次粒子に由来する見かけ上50〜250万の高分子画分との二種類が検出された。分子量のマーカーとしてShodex社製のプルランを用いた。
水溶性β-1,3-1,6-D-グルカンと微粒子とを分離するため、上記の微粒子画分と可溶性画分とを含むβ-1,3-1,6-D-グルカン溶液をアドバンテック社製のフィルター(0.2μm)でろ過を行ったところ、50〜250万の高分子画分が消失した。このことから、高分子画分はβ-1,3-1,6-D-グルカンの一次粒子や一次粒子が凝集した二次粒子に相当することが判明した。よって、水溶性β-1,3-1,6-D-グルカンの分子量は2〜30万と考えられる。
【0045】
(2)粉末化β-グルカンの調製
(1−2)において、アルカリ処理および菌体除去処理により調製された微粒子β-1,3-1,6-D-グルカンを含むβ-1,3-1,6-D-グルカン水溶液に、最終濃度が66%(v/v)となるようにエタノールを添加して、多糖グルカンを沈殿させ、遠心分離法により回収した。次いで凍結乾燥法によりエタノールと水分を除去し、乾燥β-1,3-1,6-D-グルカンを得た。そのときの収率はエタノール沈殿前の全糖濃度と比較して95%以上であった。
次いで、得られた乾燥β-1,3-1,6-D-グルカンを最終濃度が0.3%(w/v)となるように水に溶解分散後、前述したと同様にして東ソー社製のトーヨーパールHW65(カラムサイズ 75cm×φ1cm、排除分子量250万(デキストラン))により0.1Mの水酸化ナトリウム水溶液を溶離液としてゲルクロマトグラフィーを行い、分子量を測定したところ、得られた多糖の分子量は2〜30万のピークの低分子画分と見かけ上50〜250万の高分子画分の二種類からなることが判明した。ここで、分子量のマーカーとしてShodex社製のプルランを用いた。
一方、水溶性β-1,3-1,6-D-グルカンと微粒子を分離するため、本法で調製したβ-1,3-1,6-D-グルカン水溶液(微粒子と可溶化グルカンを含むもの)をアドバンテック社製のフィルター(0.2μm)でろ過を行ったところ、50〜250万の高分子画分が消失した。よって、本法により得られたβ-1,3-1,6-D-グルカンを乾燥させても、再溶解させれば乾燥前のβ-1,3-1,6-D-グルカンと同様の物理的挙動を再現することが実証された。
【0046】
(3)高純度β-1,3-1,6-D-グルカン粉末の製造
(1)においてアルカリ処理を行い低粘度化した培養液(多糖濃度0.5%(5mg/ml))90Lを50%クエン酸水溶液9kgで中和後、濾過助剤(日本製紙ケミカル製粉末セルロ−スKCフロック)を1.8kgプレコートした薮田式濾過圧搾機40D-4を通して、菌体を取り除いた。ろ液を限外濾過スパイラルエレメント(日東電工製NTU3150−S4)で9Lまで濃縮した。本濃縮液を攪拌しながら、pHを3.0-3.5にクエン酸により調整して、エタノール18Lを加え、グルカン/エタノール/水スラリーを得た。スラリーの粘度はBM型粘度計で22mPa・s(30℃)であった。室温で3時間静置し、上澄み液(エタノール/水)約17Lを取り除いた。残ったスラリーの粘度は45mPa・s(30℃)であった。本濃縮スラリー10Lを坂本技研型の噴霧乾燥装置R-3を用いて噴霧乾燥し、360gのβ-1,3-1,6-D-グルカン粉末を得た(回収率80%)。得られたβ-1,3-1,6-D-グルカンの純度はNMRスペクトルの解析の結果、90%以上であった。
なお、得られたβ-1,3-1,6-D-グルカン粉末を1N水酸化ナトリウム重水溶液に溶解させ、NMRスペクトルを測定したところ、1H NMRスペクトルが約4.7ppm及び約4.5ppmの2つのシグナルを得た。また、得られたβ-1,3-1,6-D-グルカン粉末の濃度0.5(w/v%)の水溶液の粘度は200cP以下であった(pH5.0、30℃)。
上記記載の方法によって得られた精製β-グルカンを下記の試験に供した。
【0047】
(B)ベタネコール(betanecol)、セロトニン(5-HT)、及びひまし油(castor
oil)のそれぞれの薬剤投与により誘導した便通異常による過剰排便(下痢症状)に対する低分子β-グルカン経口投与の効果
上記実験例において得た高純度β-1,3-1,6-D-グルカン粉末(以下「低分子β-グルカンという」)。
アセチルコリン作動薬であるベタネコール(bethanechol)、セロトニン(5-HT)、及び大腸刺激剤であるひまし油(castor oil)による便通異常(下痢)を誘発し、それぞれの刺激剤により誘発された下痢症状(排便異常)の低減に対する低分子β-グルカンの効果をマウスを用いて検討した。野生型(C57/BL6)マウス(6〜8週齢、体重20-25g)に低分子β-グルカン(600mg/kg)を経口投与し、その2時間後にベタネコールとセロトニンは皮下注射(3mg/kg)を行い、ひまし油(300μl/匹)は経口投与を行った。各刺激剤投与後ベタネコール、セロトニンは1時間後、ひまし油は2時間後の便排泄量を測定した。なお、比較対照にはPBS(リン酸緩衝生理食塩水)を用いた。
結果を図3A−Cに示す。図3Aより、低分子β-グルカンが、セロトニンによる大腸の排便異常を低減したことが分る。図3Bより、低分子β-グルカンが、ベタネコールによる大腸の排便異常を低減していることが分る。図3Cより、低分子β-グルカンが、ひまし油による粘膜刺激による排便異常を低減していることが分る。このことより、低分子β-グルカンの事前投与により便の異常排泄は有意に低減したことが分かる。即ち、低分子β-グルカンには、セロトニンやアセチルコリンのような排便異常を誘発する物質に起因した症状を改善することが分る。
【0048】
(C)大腸伸展運動により起こる痛覚刺激と低分子β-グルカン経口投与の効果
ウィスター系ラット(雌、3-4週齢)の肛門からポリエチレン製のバック(2cmの長さ)を大腸(直腸)に挿入した。バックが肛門から1cmの部位まで挿入した。そして、そのバックに空気を入れて一定の圧力になるまで膨らませて(大腸伸展運動 Colorectal distention (CRD))、その際に生じる痛みを筋肉の収縮が起こる電位を内臓知覚(visceromotor response (VMR))として測定した。CRD刺激は80mmHgの圧力で30秒間維持し、5分間隔で12回の繰り返しCRD刺激を行い、その際のVMRの数値推移を測定した。なお、CRD刺激は、低分子β-グルカンを1日あたり100mg/kg、および600mg/kgの量でラットに7日間継続経口投与し、7日目の投与終了後12時間後に、繰り返しCRDテストを行った。また、比較対照にはPBS(リン酸緩衝生理食塩水)を用いた。
結果を図4に示す。この結果より、低分子β-グルカン投与ラット群では、CRD刺激における痛覚レベルが明らかに低下した。また、12回後の繰り返しCRD刺激終了時点において、低分子β-グルカン600mg/kg投与ラットでは、痛覚レベルの改善傾向が認められた。このことから、低分子β-グルカン投与により、大腸における異常便排出による痛みは低減されたことが分かる。即ち、大腸における腹痛の症状を改善していることが分る。また、低分子β-グルカンは、大腸における痛覚過敏を改善することが分る。
【0049】
(D)酪酸浣腸により誘導した擬似大腸過敏症における大腸伸展運動により起こる痛覚刺激と低分子β-グルカン経口投与の効果
ウィスター系ラット(雌、3-4週齢)を酪酸(Butyrate)(110mg/ml、1ml)による浣腸(肛門から7cmの大腸部へ1日に2回、3日間)を行うことにより、擬似大腸過敏症を誘導した。擬似大腸過敏症の状態下でCRD刺激を行うことにより、大腸における痛覚刺激への低分子β-グルカン経口投与の効果を検討した。なお、比較対照として、生理食塩水(Saline)を用いた。
低分子β-グルカン経口投与群は、1日あたり1回600mg/kgで7日間与え、その後に酪酸浣腸を行った。酪酸浣腸により擬似大腸過敏症を誘導した上記ラットに、10-80mmHgで段階的にCRD刺激レベルを大きくし、それぞれ20秒間のCRD刺激を150秒間隔で与えて、その際の痛覚レベルをVMRで測定した。
結果を図5に示す。酪酸浣腸のみの場合と低分子β-グルカンを併用した場合では、低分子β-グルカンを与えたラットの方が、大腸伸展運動(CRD)刺激に対する痛覚レベルの低減がなされ、痛覚過敏が改善されたことが分かる。
【産業上の利用可能性】
【0050】
本発明の過敏性腸症候群の下痢抑制剤、腹痛改善剤、及び大腸のおける痛覚過敏改善剤は過敏性腸症候群の症状改善剤として有用であり、腹痛・腹部不快感を伴う慢性的な便通異常(便秘あるいは下痢)を生じる機能性消化管疾患などの疾患の予防又は治療剤として好適に使用できる。
【特許請求の範囲】
【請求項1】
β-1,3-グルカンを含む過敏性腸症候群の下痢抑制剤。
【請求項2】
β-1,3-グルカンがβ-1,3-1,6-D-グルカンである請求項1に記載の剤。
【請求項3】
β-1,3-1,6-グルカンが、β-1,3結合に対するβ-1,6結合の分岐度が50〜100%であるβ-1,3-1,6-グルカンである請求項1又は2に記載の剤。
【請求項4】
β-1,3-1,6-グルカンが、オーレオバシジウム属の微生物が産生するβ-1,3-1,6-グルカンである請求項1〜3に記載の剤。
【請求項5】
オーレオバシジウム属の微生物が、オーレオバシジウム・プルランスGM-NH-1A1株(FERM P-19285)、又はGM-NH-1A2株(FERM
P-19286)である請求項4に記載の剤。
【請求項6】
β-1,3-グルカンを含む過敏性腸症候群の腹痛改善剤。
【請求項7】
β-1,3-グルカンがβ-1,3-1,6-D-グルカンである請求項6に記載の剤。
【請求項8】
β-1,3-1,6-グルカンが、β-1,3結合に対するβ-1,6結合の分岐度が50〜100%であるβ-1,3-1,6-グルカンである請求項6又は7に記載の剤。
【請求項9】
β-1,3-1,6-グルカンが、オーレオバシジウム属の微生物が産生するβ-1,3-1,6-グルカンである請求項6〜8に記載の剤。
【請求項10】
オーレオバシジウム属の微生物が、オーレオバシジウム・プルランスGM-NH-1A1株(FERM P-19285)、又はGM-NH-1A2株(FERM
P-19286)である請求項9に記載の剤。
【請求項11】
β-1,3-グルカンを含む大腸における痛覚過敏改善剤。
【請求項12】
β-1,3-グルカンがβ-1,3-1,6-D-グルカンである請求項11に記載の剤。
【請求項13】
β-1,3-1,6-グルカンが、β-1,3結合に対するβ-1,6結合の分岐度が50〜100%であるβ-1,3-1,6-グルカンである請求項11又は12に記載の剤。
【請求項14】
β-1,3-1,6-グルカンが、オーレオバシジウム属の微生物が産生するβ-1,3-1,6-グルカンである請求項11〜13に記載の剤。
【請求項15】
オーレオバシジウム属の微生物が、オーレオバシジウム・プルランスGM-NH-1A1株(FERM P-19285)、又はGM-NH-1A2株(FERM
P-19286)である請求項14に記載の剤。
【請求項1】
β-1,3-グルカンを含む過敏性腸症候群の下痢抑制剤。
【請求項2】
β-1,3-グルカンがβ-1,3-1,6-D-グルカンである請求項1に記載の剤。
【請求項3】
β-1,3-1,6-グルカンが、β-1,3結合に対するβ-1,6結合の分岐度が50〜100%であるβ-1,3-1,6-グルカンである請求項1又は2に記載の剤。
【請求項4】
β-1,3-1,6-グルカンが、オーレオバシジウム属の微生物が産生するβ-1,3-1,6-グルカンである請求項1〜3に記載の剤。
【請求項5】
オーレオバシジウム属の微生物が、オーレオバシジウム・プルランスGM-NH-1A1株(FERM P-19285)、又はGM-NH-1A2株(FERM
P-19286)である請求項4に記載の剤。
【請求項6】
β-1,3-グルカンを含む過敏性腸症候群の腹痛改善剤。
【請求項7】
β-1,3-グルカンがβ-1,3-1,6-D-グルカンである請求項6に記載の剤。
【請求項8】
β-1,3-1,6-グルカンが、β-1,3結合に対するβ-1,6結合の分岐度が50〜100%であるβ-1,3-1,6-グルカンである請求項6又は7に記載の剤。
【請求項9】
β-1,3-1,6-グルカンが、オーレオバシジウム属の微生物が産生するβ-1,3-1,6-グルカンである請求項6〜8に記載の剤。
【請求項10】
オーレオバシジウム属の微生物が、オーレオバシジウム・プルランスGM-NH-1A1株(FERM P-19285)、又はGM-NH-1A2株(FERM
P-19286)である請求項9に記載の剤。
【請求項11】
β-1,3-グルカンを含む大腸における痛覚過敏改善剤。
【請求項12】
β-1,3-グルカンがβ-1,3-1,6-D-グルカンである請求項11に記載の剤。
【請求項13】
β-1,3-1,6-グルカンが、β-1,3結合に対するβ-1,6結合の分岐度が50〜100%であるβ-1,3-1,6-グルカンである請求項11又は12に記載の剤。
【請求項14】
β-1,3-1,6-グルカンが、オーレオバシジウム属の微生物が産生するβ-1,3-1,6-グルカンである請求項11〜13に記載の剤。
【請求項15】
オーレオバシジウム属の微生物が、オーレオバシジウム・プルランスGM-NH-1A1株(FERM P-19285)、又はGM-NH-1A2株(FERM
P-19286)である請求項14に記載の剤。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−95702(P2013−95702A)
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願番号】特願2011−240039(P2011−240039)
【出願日】平成23年11月1日(2011.11.1)
【出願人】(000108993)ダイソー株式会社 (229)
【Fターム(参考)】
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願日】平成23年11月1日(2011.11.1)
【出願人】(000108993)ダイソー株式会社 (229)
【Fターム(参考)】
[ Back to top ]

