γδT細胞の製造方法および医薬
【課題】HTLV−1感染細胞を含む末梢血単核球を細胞源として用いた場合であっても、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を得ることができる、γδT細胞の製造方法を提供すること。
【解決手段】細胞源として用いる末梢血単核球から、CD4、CCR4、TSLC1およびCD25からなる群から選択される1または2以上の表面マーカーを発現している細胞を除去する。次いで、残余の末梢血単核球を懸濁した細胞懸濁液に、ビスホスホネート系骨代謝改善薬およびインターロイキン−2を添加して、γδT細胞を増殖および活性化させる。以上の手順により、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を得ることができる。
【解決手段】細胞源として用いる末梢血単核球から、CD4、CCR4、TSLC1およびCD25からなる群から選択される1または2以上の表面マーカーを発現している細胞を除去する。次いで、残余の末梢血単核球を懸濁した細胞懸濁液に、ビスホスホネート系骨代謝改善薬およびインターロイキン−2を添加して、γδT細胞を増殖および活性化させる。以上の手順により、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を得ることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、γδT細胞の製造方法およびγδT細胞を含有する医薬に関する。
【背景技術】
【0002】
がん(悪性腫瘍)は、1981年から日本における死亡原因のトップとなっている。がんの治療法としては、外科療法、化学療法、放射線療法の三大療法がよく知られているが、近年、第4の治療法として免疫細胞療法が注目されている。免疫細胞療法とは、患者の体外で増殖および活性化させた免疫細胞を患者に投与し、その免疫細胞にがん細胞を攻撃させる治療法である。免疫細胞療法は、三大療法に比べて副作用がほとんどないという利点を有している。
【0003】
免疫細胞療法には様々な種類の治療法があるが、その一つとしてγδT細胞療法がある。γδT細胞は、自然免疫を担う細胞であり、がん細胞に対して細胞障害活性を有することが知られている。γδT細胞療法は、患者由来のγδT細胞を体外で増殖および活性化させた後、調製されたγδT細胞を患者の体内に戻す治療法である。
【0004】
γδT細胞療法では、患者の末梢血から得られた末梢血単核球(peripheral blood mononuclear cells;以下「PBMCs」と略記する)を細胞源として、γδT細胞を増殖および活性化させる。しかしながら、γδT細胞は、末梢血中に1〜5%程度しか存在しないため、患者から少量の末梢血を採取しても、治療に十分な数のγδT細胞を調製できないおそれがある。したがって、γδT細胞療法では、PBMCsを細胞源として、γδT細胞を効率的に増殖および活性化させることができる培養方法を確立することが重要である。そのような培養方法としては、ビスホスホネート系骨代謝改善薬およびインターロイキン−2(Interleukin-2;以下「IL−2」と略記する)を培養液に添加する方法が提案されている(例えば、特許文献1参照)。
【0005】
一方、現在、ヒトT細胞白血病ウイルス1型(human T-cell leukemia virus type-1;以下「HTLV−1」と略記する)の感染者は、日本に約100万人以上存在し、世界に2000万人以上存在する。感染者の一部は、HTLV−1関連脊髄症(HTLV-I associated myelopathy;以下「HAM」と略記する)を発病する(発病率:約0.3%)。また、感染者の別の一部は、成人T細胞白血病(adult T-cell leukemia;以下「ATL」と略記する)を発病する(発病率:約5%)。
【0006】
HAMおよびATLは、体内のHTLV−1感染細胞の数が増加すると発病しやすくなることが知られている。したがって、HTLV−1感染者(キャリア)の体内のHTLV−1感染細胞の数を減少させることができれば、HAMおよびATLの発病を予防できると期待される。同様に、HAM患者およびATL患者の体内のHTLV−1感染細胞の数を減少させることができれば、HAMおよびATLを治療できると期待される。しかしながら、現在のところ、HAMおよびATLに対する有効な予防法および治療法は確立されておらず、一刻も早い予防法および治療法の開発が切望されている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】国際公開第2006/006720号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0008】
HTLV−1感染者が、ATL以外のがんまたは感染症に罹患した場合、がんまたは感染症を治療するために免疫細胞療法を実施することが考えられる。しかしながら、従来の免疫細胞の培養方法では、試験管内においてHTLV−1の感染が拡大してしまうおそれがある。このようにして調製されたHTLV−1感染細胞を含む細胞集団を患者(HTLV−1感染者)に戻すと、患者の体内のHTLV−1感染細胞の数が増加してしまうおそれがある。以上のことから、HTLV−1感染者に対しては、γδT細胞療法などの免疫細胞療法を実施することができなかった。
【0009】
また、前述の通り、HTLV−1感染者の体内のHTLV−1感染細胞の数を減少させることができれば、HAMおよびATLを治療または予防することができると期待される。HTLV−1感染細胞の数を減少させる手法としては、上述の免疫細胞療法を実施することが考えられる。しかしながら、HTLV−1感染細胞の数を減少させる免疫細胞療法は、まだ確立されていない。
【0010】
本発明は、かかる点に鑑みてなされたものであり、HTLV−1感染者由来のPBMCsを細胞源として用いた場合であっても、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を得ることができる、γδT細胞の製造方法を提供することを目的とする。
【0011】
また、本発明は、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を含有する、がんまたは感染症を治療または予防するための医薬を提供することを目的とする。
【0012】
また、本発明は、HTLV−1の感染に起因するHAMおよびATLを治療または予防するための医薬を提供することを目的とする。
【課題を解決するための手段】
【0013】
本発明者は、γδT細胞を増殖させる前に、細胞源となるPBMCsからCD4+細胞を除去することで、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を得られることを見出した。また、本発明者は、γδT細胞がHTLV−1感染細胞(白血病細胞を含む)に対して細胞傷害活性を有することも見出した。本発明者は、これらの知見を基にしてさらに検討を加えて本発明を完成させた。
【0014】
すなわち、本発明の第1は、以下のγδT細胞の製造方法に関する。
[1]末梢血単核球を準備するステップと;前記末梢血単核球から、CD4、CCR4、TSLC1およびCD25からなる群から選択される1または2以上の表面マーカーを発現している細胞を除去するステップと;前記表面マーカーを発現している細胞を除去した末梢血単核球を含む細胞懸濁液にビスホスホネート系骨代謝改善薬およびインターロイキン−2を添加して、γδT細胞を培養するステップと;を含む、γδT細胞の製造方法。
[2]前記表面マーカーは、CD4である、[1]に記載のγδT細胞の製造方法。
[3]前記末梢血単核球は、HTLV−1の感染者の末梢血から得られたものである、[1]または[2]に記載のγδT細胞の製造方法。
[4]前記細胞懸濁液中における前記ビスホスホネート系骨代謝改善薬の濃度は、0.05〜100μMの範囲内であり;前記細胞懸濁液中における前記インターロイキン−2の濃度は、50〜2000U/mLの範囲内である、[1]〜[3]のいずれか一項に記載のγδT細胞の製造方法。
[5]前記ビスホスホネート系骨代謝改善薬は、パミドロン酸、アレンドロン酸、ゾレドロン酸、リセドロン酸、イバンドロン酸、インカドロン酸、エチドロン酸、もしくはこれらの塩、またはこれらの水和物である、[1]〜[4]のいずれか一項に記載のγδT細胞の製造方法。
【0015】
また、本発明の第2は、以下の医薬に関する。
[6]末梢血単核球を準備するステップと;前記末梢血単核球から、CD4、CCR4、TSLC1およびCD25からなる群から選択される1または2以上の表面マーカーを発現している細胞を除去するステップと;前記表面マーカーを発現している細胞を除去した末梢血単核球を含む細胞懸濁液にビスホスホネート系骨代謝改善薬およびインターロイキン−2を添加して、γδT細胞を培養するステップと;を含むγδT細胞の製造方法により製造されたγδT細胞を含有する、がんまたは感染症を治療または予防するための医薬。
[7]前記表面マーカーは、CD4である、[6]に記載の医薬。
[8]前記末梢血単核球は、HTLV−1の感染者の末梢血から得られたものである、[6]または[7]に記載の医薬。
[9]HTLV−1関連脊髄症または成人T細胞白血病を治療または予防するための医薬である、[8]に記載の医薬。
【発明の効果】
【0016】
本発明の製造方法によれば、HTLV−1感染者由来のPBMCsを用いた場合であっても、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を得ることができる。したがって、本発明の製造方法によれば、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を含有する、がんまたは感染症を治療または予防するための医薬を製造することができる。本発明の医薬は、特に、HTLV−1感染者に対してγδT細胞療法を行う際に有用である。
【図面の簡単な説明】
【0017】
【図1】図1Aは、培養前の細胞中のCD45+細胞におけるCD3およびTCR Vγ9の発現パターンを示す2パラメータドットプロットである。図1Bは、培養後の細胞中のCD45+細胞におけるCD3およびTCR Vγ9の発現パターンを示す2パラメータドットプロットである。
【図2】HTLV−1感染細胞を含むPBMCsを細胞源としてγδT細胞を培養したときの、100細胞あたりのHTLV−1のプロウイルス量の培養前後の変化を示すグラフである。
【図3】CD4+細胞を除去したPBMCsを細胞源としてγδT細胞を培養したときの、100細胞あたりのHTLV−1のプロウイルス量の培養前後の変化を示すグラフである。
【図4】図4Aは、HAM患者由来HTLV−1感染細胞株に対するγδT細胞およびαβT細胞の細胞傷害活性を示すグラフである。図4Bは、ATL患者由来HTLV−1感染細胞株に対するγδT細胞およびαβT細胞の細胞傷害活性を示すグラフである。
【発明を実施するための形態】
【0018】
1.γδT細胞の製造方法
本発明のγδT細胞の製造方法は、1)末梢血単核球(PBMCs)を準備する第1のステップと、2)前記PBMCsから所定の表面マーカーを発現している細胞を除去する第2のステップと、3)残余のPBMCsを懸濁した細胞懸濁液にビスホスホネート系骨代謝改善薬およびインターロイキン−2(IL−2)を添加して、γδT細胞を培養する第3のステップとを含む。
【0019】
本発明のγδT細胞の製造方法は、第2のステップにおいて、PBMCsから所定の表面マーカーを発現している細胞を除去することを一つの特徴とする。以下、各ステップについて説明する。
【0020】
第1のステップでは、γδT細胞の細胞源となる末梢血単核球(PBMCs)を準備する。ここで「末梢血単核球(PBMCs)」とは、末梢血から分離された、リンパ球(ナチュラルキラー細胞、ナチュラルキラーT細胞、γδT細胞など)、単球および樹状細胞を含む細胞集団を意味する。PBMCsを準備する方法は、特に限定されない。たとえば、採血により得られた末梢血を密度勾配遠心することで、PBMCsを得ることができる。採血量は、γδT細胞療法を行う患者に応じて適宜設定すればよいが、例えば45〜75mL程度である。
【0021】
第2のステップでは、第1のステップで準備したPBMCsから、CD4、CCR4(C-C chemokine receptor 4)、TSLC1(Tumor suppressor in lung cancer 1)およびCD25からなる群から選択される1または2以上の表面マーカーを発現している細胞を除去する。
【0022】
CD4、CCR4、TSLC1およびCD25は、HTLV−1感染細胞において発現することが知られている表面マーカーである。したがって、これらの表面マーカーを発現している細胞を除去することで、仮にPBMCs中にHTLV−1感染細胞が含まれていたとしても、PBMCs中のHTLV−1感染細胞をほとんどすべて除去することができる(実施例参照)。これらの表面マーカーは、単独で用いてもよいし、2種以上を組み合わせて使用してもよい。たとえば、PBMCsからCD4+細胞、CCR4+細胞またはTSLC1+細胞を除去してもよいし、PBMCsからCD4+CD25+細胞を除去してもよい。
【0023】
PBMCsから上記表面マーカーを発現している細胞を除去する方法は、特に限定されず、公知の方法から適宜選択すればよい。PBMCsから上記表面マーカーを発現している細胞を除去する方法の例には、磁気細胞分離法、フローサイトメトリーなどが含まれる。
【0024】
第3のステップでは、第2のステップにおいて所定の表面マーカーを発現している細胞を除去した後のPBMCsを培養液(培地)に懸濁し、得られた細胞懸濁液にビスホスホネート系骨代謝改善薬およびインターロイキン−2(IL−2)を添加して、γδT細胞を培養する。PBMCsをビスホスホネート系骨代謝改善薬およびIL−2の存在下で培養することにより、γδT細胞を選択的に増殖および活性化させて、活性化γδT細胞を高純度に含む細胞集団を調製することができる(特許文献1参照)。
【0025】
PBMCsを懸濁させる培養液(培地)の種類は、γδT細胞を増殖させることができれば特に限定されない。そのような培養液の例には、AIM−V培地、RPMI−1640培地、ダルベッコ改変イーグル培地(DMEM)、イスコフ培地が含まれる。これらの培養液には、必要に応じて血清を添加してもよい。添加される血清の例には、ウシ胎仔血清(FCS)、AB血清、自己血漿が含まれる。
【0026】
ビスホスホネート系骨代謝改善薬の種類は、骨吸収抑制作用を有し、一般的に骨粗鬆症治療薬として使用されているものであれば特に限定されない。ビスホスホネート系骨代謝改善薬の例には、パミドロン酸、アレンドロン酸、ゾレドロン酸、リセドロン酸、イバンドロン酸、インカドロン酸、エチドロン酸およびこれらの塩、ならびにこれらの水和物が含まれる。これらの中では、窒素原子を有するアミノビスホスホネートである、パミドロン酸、アレンドロン酸、ゾレドロン酸およびこれらの塩、ならびにこれらの水和物が特に好ましい。市販されているビスホスホネート系骨代謝改善薬としては、例えば、パミドロン酸二ナトリウム五水和物(アレディア;ノバルティスファーマ株式会社)、ゾレドロン酸水和物(ゾメタ;ノバルティスファーマ株式会社)などが挙げられる。
【0027】
細胞懸濁液中におけるビスホスホネート系骨代謝改善薬の濃度は、0.05〜100μMの範囲内が好ましく、0.1〜30μMの範囲内がより好ましい。より具体的には、ビスホスホネート系骨代謝改善薬としてアレンドロン酸もしくはその塩またはこれらの水和物を添加する場合は、ビスホスホネート系骨代謝改善薬の濃度は、1〜30μMの範囲内が好ましい。また、ビスホスホネート系骨代謝改善薬としてゾレドロン酸もしくはその塩またはこれらの水和物を添加する場合は、ビスホスホネート系骨代謝改善薬の濃度は、0.1〜10μMの範囲内が好ましい。
【0028】
細胞懸濁液中におけるIL−2の濃度は、50〜2000U/mLの範囲内が好ましく、400〜1000U/mLの範囲内がより好ましい。
【0029】
PBMCsの培養条件は、γδT細胞を増殖および活性化させることができれば特に限定されない。通常は、34〜38℃(好ましくは37℃)かつ2〜10%(好ましくは5%)CO2存在下で、7〜14日程度培養すればよい。
【0030】
以上の手順により、γδT細胞を大量に含む細胞集団を得ることができる。得られた細胞集団は、後述するようにγδT細胞療法において患者に移植する細胞として利用することができる。
【0031】
本発明のγδT細胞の製造方法では、第2のステップにおいてHTLV−1感染細胞を除去することから、第1のステップにおいて準備するPBMCs中にHTLV−1感染細胞が含まれていても特に問題とならない。したがって、本発明のγδT細胞の製造方法は、第1のステップにおいて準備するPBMCsがHTLV−1感染者の末梢血由来のものであってもよい。本発明のγδT細胞の製造方法を用いれば、HTLV−1感染者の末梢血由来のPBMCsを用いてもHTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を製造することができる。
【0032】
2.γδT細胞を含む医薬
本発明の医薬は、上述の本発明のγδT細胞の製造方法により製造された細胞集団を含有する、がんまたは感染症を治療または予防するための医薬である。
【0033】
本発明の医薬は、例えば、本発明のγδT細胞の製造方法により製造された細胞集団を医薬品として利用可能な液体(例えば、生理食塩水)に懸濁させた注射剤(細胞懸濁液)である。この注射剤は、静脈内や皮内、皮下などに注射されてもよいし、病変部に直接注入されてもよいし、点滴として全身投与されてもよい。
【0034】
本発明の医薬は、必須成分として本発明のγδT細胞の製造方法により製造された細胞集団を含むが、任意成分としてその他の成分を含んでいてもよい。たとえば、本発明の医薬をがんの治療または予防剤として使用する場合は、IL−2やIL−12などのサイトカインを添加してもよい。また、本発明の医薬をウイルス感染症の治療または予防剤として使用する場合は、インターフェロンなどを添加してもよい。
【0035】
本発明の医薬に含まれるγδT細胞の数は、投与方法や疾患の種類、患者の症状などに応じて適宜設定されうる。通常は、108〜1012個/人(好ましくは109個/人)となるように設定すればよい。
【0036】
本発明の医薬の製造方法は、特に限定されない。たとえば、本発明の医薬は、1)本発明のγδT細胞の製造方法により得られた細胞集団を遠心分離などにより回収し;2)回収した細胞集団を洗浄液(例えば、生理食塩水やPBSなど)で洗浄し;3)洗浄した細胞集団を遠心分離などにより回収し;4)回収した細胞集団を医薬品として利用可能な液体(例えば、生理食塩水)に懸濁させることで製造されうる。
【0037】
前述の通り、本発明のγδT細胞の製造方法により製造された細胞集団は、HTLV−1感染者由来のPBMCsを細胞源として用いた場合であっても、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む。よって、本発明の医薬は、HTLV−1感染者に投与しても、体内のHTLV−1感染細胞の数を増加させることはない。したがって、本発明の医薬は、HTLV−1感染者に対してγδT細胞療法を実施するための医薬として利用されうる。
【0038】
また、後述する実施例に示されるように、γδT細胞は、HTLV−1感染細胞(ATL患者の白血病細胞を含む)に対する細胞傷害活性を有する。このことは、本発明者らによって初めて見出されたことである。前述の通り、HTLV−1感染者の体内のHTLV−1感染細胞の数を減少させることができれば、HAMおよびATLを治療または予防することができると期待される。したがって、本発明の医薬は、HAMおよびATLを治療または予防するための医薬として利用されうる。
【0039】
以下、本発明を実施例を参照して詳細に説明するが、本発明はこれらの実施例により限定されない。
【実施例】
【0040】
1.従来の方法によるγδT細胞の培養
はじめに、比較例として、従来の方法(PBMCsからCD4+細胞を除去しない)によりγδT細胞を培養した例を示す。
【0041】
(1)γδT細胞の培養
抗凝固剤としてヘパリンを使用して、HTLV−1感染者から新鮮血を採取した。得られた血液を遠心分離して、血球成分と血漿成分に分離した。血漿成分は、56℃で60分間非働化した後、−80℃で一旦凍結させた。凍結した血漿を再度溶解させた後、遠心分離して上清を得た。得られた上清は、細胞培養時に自己血漿として用いた。一方、血球成分は、PBS(−)で希釈した後、リンパ球分離溶液(LSM;コスモ・バイオ株式会社)を用いてPBMCsを分離した。分離したPBMCsは、PBS(−)で洗浄した。
【0042】
洗浄したPBMCsをリンパ球培養用培地(ALyS203;株式会社細胞科学研究所)に懸濁して細胞懸濁液を調製した。得られた細胞懸濁液を2×106PBMCs/ウェルとなるように24ウェルマイクロプレートに分注した。次いで、各ウェルに、IL−2(イムノテック社)、ゾレドロン酸水和物(ゾメタ;ノバルティスファーマ株式会社)および自己血漿を添加した。各成分の終濃度は、IL−2:1000U/mL、ゾレドロン酸水和物:5μM、自己血漿:10%である。
【0043】
マイクロプレートをCO2インキュベータ(温度:37℃、CO2濃度:5%、湿度:過飽和)内に移し、PBMCsを14日間培養した。培養期間中、細胞がコンフルエントになるたびに、IL−2を添加した培地を加えた。また、培地中の血漿濃度が1%を下回らないように、適宜自己血漿を加えた。
【0044】
(2)フローサイトメトリー
培養前(day0)および培養後(day14)の細胞に含まれるγδT細胞の割合をフローサイトメトリーを用いて測定した。今回の実験では、CD45+CD3+TCR Vγ9+の細胞をγδT細胞と判定した。
【0045】
フローサイトメーターはFC500(ベックマン・コールター株式会社)を使用し、解析ソフトはCXP(ベックマン・コールター株式会社)を使用した。また、抗CD45抗体はECD標識抗ヒトCD45抗体(ベックマン・コールター株式会社)を使用し、抗CD3抗体はPC5標識抗ヒトCD3抗体(ベックマン・コールター株式会社)を使用し、抗TCR Vγ9抗体はFITC標識抗ヒトTCR Vγ9抗体(ベックマン・コールター株式会社)を使用した。
【0046】
図1Aは、day0の細胞中のCD45+細胞におけるCD3およびTCR Vγ9の発現パターンを示す2パラメータドットプロットである。図1Bは、day14の細胞中のCD45+細胞におけるCD3およびTCR Vγ9の発現パターンを示す2パラメータドットプロットである。これらの図に示されるように、day0の細胞中のγδT細胞の割合は3.5%であったのに対し(図1A参照)、day14の細胞中のγδT細胞の割合は68.5%であった(図1B参照)。
【0047】
これらの結果から、HTLV−1感染者由来のPBMCsを細胞源としても、ビスホスホネート系骨代謝改善薬およびIL−2を添加した培地中で培養することで、γδT細胞を増殖および活性化させうることが示唆される。
【0048】
(3)HTLV−1のプロウイルス量の測定
培養前の細胞(day0)および培養後の細胞(day14)について、100細胞あたりのHTLV−1のプロウイルス量をリアルタイムPCR法により測定した。
【0049】
測定対象の細胞集団(day0またはday14の細胞)を溶解バッファー(50mM Tris−HCl(pH8.0),20mM EDTA,0.1M NaCl,1%SDS)に懸濁した。得られた細胞懸濁液にプロテイナーゼK(和光純薬工業株式会社)を終濃度が150μg/mLとなるように添加し、55℃で一晩振盪した後、フェノールクロロホルムを用いてゲノムDNAを抽出した。HTLV−1のpX領域およびヒトβ−アクチンに対するTaqManプローブ−プライマーセットを用いて、リアルタイムPCRを行った。標準検体を用いて検量線を作成してHTLV−1のpX領域およびヒトβ−アクチンの量を算出し、これらの値から100細胞あたりのHTLV−1のプロウイルス量を算出した。
【0050】
図2は、day0およびday14の細胞についての、100細胞あたりのHTLV−1のプロウイルス量を示すグラフである(n=4)。このグラフに示されるように、day0の細胞中の平均ウイルス量は33.24(コピー/100細胞)であったのに対し、day14の細胞中の平均ウイルス量は3.37(コピー/100細胞)であった。
【0051】
この結果から、HTLV−1感染者由来のPBMCsを細胞源としてγδT細胞を培養すると、γδT細胞の増殖に伴いHTLV−1感染細胞の割合がある程度減少することがわかる。しかしながら、HTLV−1感染細胞を3%も含む細胞集団は、生体内のウイルス感染細胞数を増加させるおそれがあるため、γδT細胞療法に使用することはできない。
【0052】
2.本発明の方法によるγδT細胞の培養
次に、実施例として、本発明の方法(PBMCsからCD4+細胞を除去する)によりγδT細胞を培養した例を示す。
【0053】
(1)γδT細胞の培養
上記比較例と同様の手順で、HTLV−1感染者の新鮮血から自己血漿およびPBMCsを得た。次いで、磁気細胞分離法により、得られたPBMCsからCD4+細胞を除去して、CD4−の細胞集団を得た。具体的には、PBMCsを抗CD4マイクロビーズ(ミルテニーバイオテク社)と反応させた後、反応物をMACシステムの分離カラム(ミルテニーバイオテク社)に通して、PBMCsからCD4+細胞を除去した。
【0054】
得られたCD4−の細胞集団を上記比較例と同様の手順で14日間培養した。その結果、比較例と同様に、γδT細胞を選択的に増殖および活性化させることができた(図1参照)。
【0055】
(2)HTLV−1のプロウイルス量の測定
培養前の細胞(day0)および培養後の細胞(day14)について、上記比較例と同様の手順で、100細胞あたりのHTLV−1のプロウイルス量を測定した。
【0056】
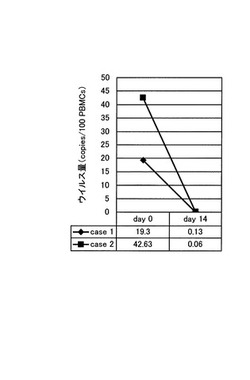
図3は、day0およびday14の細胞についての、100細胞あたりのHTLV−1のプロウイルス量を示すグラフである(n=2)。このグラフに示されるように、day0の細胞中の平均ウイルス量は30.965(コピー/100細胞)であったのに対し、day14の細胞中の平均ウイルス量は0.095(コピー/100細胞)であった。
【0057】
この結果から、HTLV−1感染者由来のPBMCsを細胞源とする場合であっても、CD4+細胞を除去した後に培養すると、HTLV−1感染細胞をほぼ完全に除去した状態でγδT細胞を増殖させうることがわかる。このようにHTLV−1感染細胞をほとんど含まない細胞集団は、生体内のウイルス感染細胞数を増加させるおそれが低いため、γδT細胞療法に使用することができる。
【0058】
3.HTLV−1感染細胞に対するγδT細胞の細胞傷害活性の測定
上記比較例で示したように、HTLV−1感染者由来のPBMCsを細胞源としてγδT細胞を増殖させたところ、HTLV−1感染細胞の割合がある程度減少した(図2参照)。このことは、γδT細胞がHTLV−1感染細胞に対して傷害活性を有することを示唆している。そこで、γδT細胞がHTLV−1感染細胞に対して傷害活性を有するかどうかを調べた。
【0059】
ターゲット細胞としては、HAM患者由来HTLV−1感染細胞株「HCT−4」およびATL患者由来HTLV−1感染細胞株「KK−1」を使用した。これらの培養細胞を回収し、細胞膜標識用蛍光色素(PKH26;シグマアルドリッチジャパン株式会社)を用いて染色した。細胞密度は、いずれも2×105細胞/mLに調整した。
【0060】
エフェクター細胞としては、前述のγδT細胞の選択的培養(比較例)により得られた、培養14日目の活性化γδT細胞(γδT−LAK)を含む細胞集団を使用した。また、対照実験として、抗CD3抗体およびIL−2を用いる培養方法(Takayama T. et al., Lancet, Vol.356, No.9232, pp.802-807.)により得られた、培養14日目の活性化αβT細胞(αβT−LAK)を含む細胞集団も使用した。細胞密度は、いずれも2×105細胞/mL、1×106細胞/mLおよび5×106細胞/mLに調整した。
【0061】
エフェクター細胞の細胞懸濁液とターゲット細胞の細胞懸濁液を混合して共培養を行い、4時間後に細胞を回収した。エフェクター細胞とターゲット細胞との比率は、1:1、5:1または25:1である。アポトーシス検出キット(ベックマン・コールター株式会社)に含まれるFITC−アネキシンVおよびヨウ化プロピジウムを用いて回収した細胞を染色した。そして、前述のフローサイトメーターを用いてアポトーシスを起こした細胞の割合を測定して、HTLV−1感染細胞に対するγδT細胞の細胞傷害活性を決定した。
【0062】
図4Aは、HCT−4(HAM患者由来HTLV−1感染細胞株)に対するγδT細胞およびαβT細胞の細胞傷害活性を示すグラフである。図4Bは、KK−1(ATL患者由来HTLV−1感染細胞株)に対するγδT細胞およびαβT細胞の細胞傷害活性を示すグラフである。「γδT−LAK」はγδT細胞を示し、「αβT−LAK」はαβT細胞を示す。また、「E/T」は、ターゲット細胞(T)に対するエフェクター細胞(E)の割合を意味する
【0063】
図4Aおよび図4Bのグラフから、γδT細胞は、HTLV−1感染細胞に対する細胞傷害活性がαβT細胞に比べて高いことがわかる。このことから、γδT細胞療法がHAMおよびALTの治療および予防に有効であることが示唆される。
【産業上の利用可能性】
【0064】
本発明の製造方法は、例えば、HTLV−1の感染者に対してγδT細胞療法を実施する際のγδT細胞の培養方法として有用である。また、本発明の医薬は、例えばHTLV−1感染者、HAM患者およびATL患者に対してγδT細胞療法を実施する際に用いられる医薬として有用である。
【技術分野】
【0001】
本発明は、γδT細胞の製造方法およびγδT細胞を含有する医薬に関する。
【背景技術】
【0002】
がん(悪性腫瘍)は、1981年から日本における死亡原因のトップとなっている。がんの治療法としては、外科療法、化学療法、放射線療法の三大療法がよく知られているが、近年、第4の治療法として免疫細胞療法が注目されている。免疫細胞療法とは、患者の体外で増殖および活性化させた免疫細胞を患者に投与し、その免疫細胞にがん細胞を攻撃させる治療法である。免疫細胞療法は、三大療法に比べて副作用がほとんどないという利点を有している。
【0003】
免疫細胞療法には様々な種類の治療法があるが、その一つとしてγδT細胞療法がある。γδT細胞は、自然免疫を担う細胞であり、がん細胞に対して細胞障害活性を有することが知られている。γδT細胞療法は、患者由来のγδT細胞を体外で増殖および活性化させた後、調製されたγδT細胞を患者の体内に戻す治療法である。
【0004】
γδT細胞療法では、患者の末梢血から得られた末梢血単核球(peripheral blood mononuclear cells;以下「PBMCs」と略記する)を細胞源として、γδT細胞を増殖および活性化させる。しかしながら、γδT細胞は、末梢血中に1〜5%程度しか存在しないため、患者から少量の末梢血を採取しても、治療に十分な数のγδT細胞を調製できないおそれがある。したがって、γδT細胞療法では、PBMCsを細胞源として、γδT細胞を効率的に増殖および活性化させることができる培養方法を確立することが重要である。そのような培養方法としては、ビスホスホネート系骨代謝改善薬およびインターロイキン−2(Interleukin-2;以下「IL−2」と略記する)を培養液に添加する方法が提案されている(例えば、特許文献1参照)。
【0005】
一方、現在、ヒトT細胞白血病ウイルス1型(human T-cell leukemia virus type-1;以下「HTLV−1」と略記する)の感染者は、日本に約100万人以上存在し、世界に2000万人以上存在する。感染者の一部は、HTLV−1関連脊髄症(HTLV-I associated myelopathy;以下「HAM」と略記する)を発病する(発病率:約0.3%)。また、感染者の別の一部は、成人T細胞白血病(adult T-cell leukemia;以下「ATL」と略記する)を発病する(発病率:約5%)。
【0006】
HAMおよびATLは、体内のHTLV−1感染細胞の数が増加すると発病しやすくなることが知られている。したがって、HTLV−1感染者(キャリア)の体内のHTLV−1感染細胞の数を減少させることができれば、HAMおよびATLの発病を予防できると期待される。同様に、HAM患者およびATL患者の体内のHTLV−1感染細胞の数を減少させることができれば、HAMおよびATLを治療できると期待される。しかしながら、現在のところ、HAMおよびATLに対する有効な予防法および治療法は確立されておらず、一刻も早い予防法および治療法の開発が切望されている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】国際公開第2006/006720号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0008】
HTLV−1感染者が、ATL以外のがんまたは感染症に罹患した場合、がんまたは感染症を治療するために免疫細胞療法を実施することが考えられる。しかしながら、従来の免疫細胞の培養方法では、試験管内においてHTLV−1の感染が拡大してしまうおそれがある。このようにして調製されたHTLV−1感染細胞を含む細胞集団を患者(HTLV−1感染者)に戻すと、患者の体内のHTLV−1感染細胞の数が増加してしまうおそれがある。以上のことから、HTLV−1感染者に対しては、γδT細胞療法などの免疫細胞療法を実施することができなかった。
【0009】
また、前述の通り、HTLV−1感染者の体内のHTLV−1感染細胞の数を減少させることができれば、HAMおよびATLを治療または予防することができると期待される。HTLV−1感染細胞の数を減少させる手法としては、上述の免疫細胞療法を実施することが考えられる。しかしながら、HTLV−1感染細胞の数を減少させる免疫細胞療法は、まだ確立されていない。
【0010】
本発明は、かかる点に鑑みてなされたものであり、HTLV−1感染者由来のPBMCsを細胞源として用いた場合であっても、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を得ることができる、γδT細胞の製造方法を提供することを目的とする。
【0011】
また、本発明は、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を含有する、がんまたは感染症を治療または予防するための医薬を提供することを目的とする。
【0012】
また、本発明は、HTLV−1の感染に起因するHAMおよびATLを治療または予防するための医薬を提供することを目的とする。
【課題を解決するための手段】
【0013】
本発明者は、γδT細胞を増殖させる前に、細胞源となるPBMCsからCD4+細胞を除去することで、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を得られることを見出した。また、本発明者は、γδT細胞がHTLV−1感染細胞(白血病細胞を含む)に対して細胞傷害活性を有することも見出した。本発明者は、これらの知見を基にしてさらに検討を加えて本発明を完成させた。
【0014】
すなわち、本発明の第1は、以下のγδT細胞の製造方法に関する。
[1]末梢血単核球を準備するステップと;前記末梢血単核球から、CD4、CCR4、TSLC1およびCD25からなる群から選択される1または2以上の表面マーカーを発現している細胞を除去するステップと;前記表面マーカーを発現している細胞を除去した末梢血単核球を含む細胞懸濁液にビスホスホネート系骨代謝改善薬およびインターロイキン−2を添加して、γδT細胞を培養するステップと;を含む、γδT細胞の製造方法。
[2]前記表面マーカーは、CD4である、[1]に記載のγδT細胞の製造方法。
[3]前記末梢血単核球は、HTLV−1の感染者の末梢血から得られたものである、[1]または[2]に記載のγδT細胞の製造方法。
[4]前記細胞懸濁液中における前記ビスホスホネート系骨代謝改善薬の濃度は、0.05〜100μMの範囲内であり;前記細胞懸濁液中における前記インターロイキン−2の濃度は、50〜2000U/mLの範囲内である、[1]〜[3]のいずれか一項に記載のγδT細胞の製造方法。
[5]前記ビスホスホネート系骨代謝改善薬は、パミドロン酸、アレンドロン酸、ゾレドロン酸、リセドロン酸、イバンドロン酸、インカドロン酸、エチドロン酸、もしくはこれらの塩、またはこれらの水和物である、[1]〜[4]のいずれか一項に記載のγδT細胞の製造方法。
【0015】
また、本発明の第2は、以下の医薬に関する。
[6]末梢血単核球を準備するステップと;前記末梢血単核球から、CD4、CCR4、TSLC1およびCD25からなる群から選択される1または2以上の表面マーカーを発現している細胞を除去するステップと;前記表面マーカーを発現している細胞を除去した末梢血単核球を含む細胞懸濁液にビスホスホネート系骨代謝改善薬およびインターロイキン−2を添加して、γδT細胞を培養するステップと;を含むγδT細胞の製造方法により製造されたγδT細胞を含有する、がんまたは感染症を治療または予防するための医薬。
[7]前記表面マーカーは、CD4である、[6]に記載の医薬。
[8]前記末梢血単核球は、HTLV−1の感染者の末梢血から得られたものである、[6]または[7]に記載の医薬。
[9]HTLV−1関連脊髄症または成人T細胞白血病を治療または予防するための医薬である、[8]に記載の医薬。
【発明の効果】
【0016】
本発明の製造方法によれば、HTLV−1感染者由来のPBMCsを用いた場合であっても、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を得ることができる。したがって、本発明の製造方法によれば、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を含有する、がんまたは感染症を治療または予防するための医薬を製造することができる。本発明の医薬は、特に、HTLV−1感染者に対してγδT細胞療法を行う際に有用である。
【図面の簡単な説明】
【0017】
【図1】図1Aは、培養前の細胞中のCD45+細胞におけるCD3およびTCR Vγ9の発現パターンを示す2パラメータドットプロットである。図1Bは、培養後の細胞中のCD45+細胞におけるCD3およびTCR Vγ9の発現パターンを示す2パラメータドットプロットである。
【図2】HTLV−1感染細胞を含むPBMCsを細胞源としてγδT細胞を培養したときの、100細胞あたりのHTLV−1のプロウイルス量の培養前後の変化を示すグラフである。
【図3】CD4+細胞を除去したPBMCsを細胞源としてγδT細胞を培養したときの、100細胞あたりのHTLV−1のプロウイルス量の培養前後の変化を示すグラフである。
【図4】図4Aは、HAM患者由来HTLV−1感染細胞株に対するγδT細胞およびαβT細胞の細胞傷害活性を示すグラフである。図4Bは、ATL患者由来HTLV−1感染細胞株に対するγδT細胞およびαβT細胞の細胞傷害活性を示すグラフである。
【発明を実施するための形態】
【0018】
1.γδT細胞の製造方法
本発明のγδT細胞の製造方法は、1)末梢血単核球(PBMCs)を準備する第1のステップと、2)前記PBMCsから所定の表面マーカーを発現している細胞を除去する第2のステップと、3)残余のPBMCsを懸濁した細胞懸濁液にビスホスホネート系骨代謝改善薬およびインターロイキン−2(IL−2)を添加して、γδT細胞を培養する第3のステップとを含む。
【0019】
本発明のγδT細胞の製造方法は、第2のステップにおいて、PBMCsから所定の表面マーカーを発現している細胞を除去することを一つの特徴とする。以下、各ステップについて説明する。
【0020】
第1のステップでは、γδT細胞の細胞源となる末梢血単核球(PBMCs)を準備する。ここで「末梢血単核球(PBMCs)」とは、末梢血から分離された、リンパ球(ナチュラルキラー細胞、ナチュラルキラーT細胞、γδT細胞など)、単球および樹状細胞を含む細胞集団を意味する。PBMCsを準備する方法は、特に限定されない。たとえば、採血により得られた末梢血を密度勾配遠心することで、PBMCsを得ることができる。採血量は、γδT細胞療法を行う患者に応じて適宜設定すればよいが、例えば45〜75mL程度である。
【0021】
第2のステップでは、第1のステップで準備したPBMCsから、CD4、CCR4(C-C chemokine receptor 4)、TSLC1(Tumor suppressor in lung cancer 1)およびCD25からなる群から選択される1または2以上の表面マーカーを発現している細胞を除去する。
【0022】
CD4、CCR4、TSLC1およびCD25は、HTLV−1感染細胞において発現することが知られている表面マーカーである。したがって、これらの表面マーカーを発現している細胞を除去することで、仮にPBMCs中にHTLV−1感染細胞が含まれていたとしても、PBMCs中のHTLV−1感染細胞をほとんどすべて除去することができる(実施例参照)。これらの表面マーカーは、単独で用いてもよいし、2種以上を組み合わせて使用してもよい。たとえば、PBMCsからCD4+細胞、CCR4+細胞またはTSLC1+細胞を除去してもよいし、PBMCsからCD4+CD25+細胞を除去してもよい。
【0023】
PBMCsから上記表面マーカーを発現している細胞を除去する方法は、特に限定されず、公知の方法から適宜選択すればよい。PBMCsから上記表面マーカーを発現している細胞を除去する方法の例には、磁気細胞分離法、フローサイトメトリーなどが含まれる。
【0024】
第3のステップでは、第2のステップにおいて所定の表面マーカーを発現している細胞を除去した後のPBMCsを培養液(培地)に懸濁し、得られた細胞懸濁液にビスホスホネート系骨代謝改善薬およびインターロイキン−2(IL−2)を添加して、γδT細胞を培養する。PBMCsをビスホスホネート系骨代謝改善薬およびIL−2の存在下で培養することにより、γδT細胞を選択的に増殖および活性化させて、活性化γδT細胞を高純度に含む細胞集団を調製することができる(特許文献1参照)。
【0025】
PBMCsを懸濁させる培養液(培地)の種類は、γδT細胞を増殖させることができれば特に限定されない。そのような培養液の例には、AIM−V培地、RPMI−1640培地、ダルベッコ改変イーグル培地(DMEM)、イスコフ培地が含まれる。これらの培養液には、必要に応じて血清を添加してもよい。添加される血清の例には、ウシ胎仔血清(FCS)、AB血清、自己血漿が含まれる。
【0026】
ビスホスホネート系骨代謝改善薬の種類は、骨吸収抑制作用を有し、一般的に骨粗鬆症治療薬として使用されているものであれば特に限定されない。ビスホスホネート系骨代謝改善薬の例には、パミドロン酸、アレンドロン酸、ゾレドロン酸、リセドロン酸、イバンドロン酸、インカドロン酸、エチドロン酸およびこれらの塩、ならびにこれらの水和物が含まれる。これらの中では、窒素原子を有するアミノビスホスホネートである、パミドロン酸、アレンドロン酸、ゾレドロン酸およびこれらの塩、ならびにこれらの水和物が特に好ましい。市販されているビスホスホネート系骨代謝改善薬としては、例えば、パミドロン酸二ナトリウム五水和物(アレディア;ノバルティスファーマ株式会社)、ゾレドロン酸水和物(ゾメタ;ノバルティスファーマ株式会社)などが挙げられる。
【0027】
細胞懸濁液中におけるビスホスホネート系骨代謝改善薬の濃度は、0.05〜100μMの範囲内が好ましく、0.1〜30μMの範囲内がより好ましい。より具体的には、ビスホスホネート系骨代謝改善薬としてアレンドロン酸もしくはその塩またはこれらの水和物を添加する場合は、ビスホスホネート系骨代謝改善薬の濃度は、1〜30μMの範囲内が好ましい。また、ビスホスホネート系骨代謝改善薬としてゾレドロン酸もしくはその塩またはこれらの水和物を添加する場合は、ビスホスホネート系骨代謝改善薬の濃度は、0.1〜10μMの範囲内が好ましい。
【0028】
細胞懸濁液中におけるIL−2の濃度は、50〜2000U/mLの範囲内が好ましく、400〜1000U/mLの範囲内がより好ましい。
【0029】
PBMCsの培養条件は、γδT細胞を増殖および活性化させることができれば特に限定されない。通常は、34〜38℃(好ましくは37℃)かつ2〜10%(好ましくは5%)CO2存在下で、7〜14日程度培養すればよい。
【0030】
以上の手順により、γδT細胞を大量に含む細胞集団を得ることができる。得られた細胞集団は、後述するようにγδT細胞療法において患者に移植する細胞として利用することができる。
【0031】
本発明のγδT細胞の製造方法では、第2のステップにおいてHTLV−1感染細胞を除去することから、第1のステップにおいて準備するPBMCs中にHTLV−1感染細胞が含まれていても特に問題とならない。したがって、本発明のγδT細胞の製造方法は、第1のステップにおいて準備するPBMCsがHTLV−1感染者の末梢血由来のものであってもよい。本発明のγδT細胞の製造方法を用いれば、HTLV−1感染者の末梢血由来のPBMCsを用いてもHTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む細胞集団を製造することができる。
【0032】
2.γδT細胞を含む医薬
本発明の医薬は、上述の本発明のγδT細胞の製造方法により製造された細胞集団を含有する、がんまたは感染症を治療または予防するための医薬である。
【0033】
本発明の医薬は、例えば、本発明のγδT細胞の製造方法により製造された細胞集団を医薬品として利用可能な液体(例えば、生理食塩水)に懸濁させた注射剤(細胞懸濁液)である。この注射剤は、静脈内や皮内、皮下などに注射されてもよいし、病変部に直接注入されてもよいし、点滴として全身投与されてもよい。
【0034】
本発明の医薬は、必須成分として本発明のγδT細胞の製造方法により製造された細胞集団を含むが、任意成分としてその他の成分を含んでいてもよい。たとえば、本発明の医薬をがんの治療または予防剤として使用する場合は、IL−2やIL−12などのサイトカインを添加してもよい。また、本発明の医薬をウイルス感染症の治療または予防剤として使用する場合は、インターフェロンなどを添加してもよい。
【0035】
本発明の医薬に含まれるγδT細胞の数は、投与方法や疾患の種類、患者の症状などに応じて適宜設定されうる。通常は、108〜1012個/人(好ましくは109個/人)となるように設定すればよい。
【0036】
本発明の医薬の製造方法は、特に限定されない。たとえば、本発明の医薬は、1)本発明のγδT細胞の製造方法により得られた細胞集団を遠心分離などにより回収し;2)回収した細胞集団を洗浄液(例えば、生理食塩水やPBSなど)で洗浄し;3)洗浄した細胞集団を遠心分離などにより回収し;4)回収した細胞集団を医薬品として利用可能な液体(例えば、生理食塩水)に懸濁させることで製造されうる。
【0037】
前述の通り、本発明のγδT細胞の製造方法により製造された細胞集団は、HTLV−1感染者由来のPBMCsを細胞源として用いた場合であっても、HTLV−1感染細胞をほとんど含まず、かつγδT細胞を大量に含む。よって、本発明の医薬は、HTLV−1感染者に投与しても、体内のHTLV−1感染細胞の数を増加させることはない。したがって、本発明の医薬は、HTLV−1感染者に対してγδT細胞療法を実施するための医薬として利用されうる。
【0038】
また、後述する実施例に示されるように、γδT細胞は、HTLV−1感染細胞(ATL患者の白血病細胞を含む)に対する細胞傷害活性を有する。このことは、本発明者らによって初めて見出されたことである。前述の通り、HTLV−1感染者の体内のHTLV−1感染細胞の数を減少させることができれば、HAMおよびATLを治療または予防することができると期待される。したがって、本発明の医薬は、HAMおよびATLを治療または予防するための医薬として利用されうる。
【0039】
以下、本発明を実施例を参照して詳細に説明するが、本発明はこれらの実施例により限定されない。
【実施例】
【0040】
1.従来の方法によるγδT細胞の培養
はじめに、比較例として、従来の方法(PBMCsからCD4+細胞を除去しない)によりγδT細胞を培養した例を示す。
【0041】
(1)γδT細胞の培養
抗凝固剤としてヘパリンを使用して、HTLV−1感染者から新鮮血を採取した。得られた血液を遠心分離して、血球成分と血漿成分に分離した。血漿成分は、56℃で60分間非働化した後、−80℃で一旦凍結させた。凍結した血漿を再度溶解させた後、遠心分離して上清を得た。得られた上清は、細胞培養時に自己血漿として用いた。一方、血球成分は、PBS(−)で希釈した後、リンパ球分離溶液(LSM;コスモ・バイオ株式会社)を用いてPBMCsを分離した。分離したPBMCsは、PBS(−)で洗浄した。
【0042】
洗浄したPBMCsをリンパ球培養用培地(ALyS203;株式会社細胞科学研究所)に懸濁して細胞懸濁液を調製した。得られた細胞懸濁液を2×106PBMCs/ウェルとなるように24ウェルマイクロプレートに分注した。次いで、各ウェルに、IL−2(イムノテック社)、ゾレドロン酸水和物(ゾメタ;ノバルティスファーマ株式会社)および自己血漿を添加した。各成分の終濃度は、IL−2:1000U/mL、ゾレドロン酸水和物:5μM、自己血漿:10%である。
【0043】
マイクロプレートをCO2インキュベータ(温度:37℃、CO2濃度:5%、湿度:過飽和)内に移し、PBMCsを14日間培養した。培養期間中、細胞がコンフルエントになるたびに、IL−2を添加した培地を加えた。また、培地中の血漿濃度が1%を下回らないように、適宜自己血漿を加えた。
【0044】
(2)フローサイトメトリー
培養前(day0)および培養後(day14)の細胞に含まれるγδT細胞の割合をフローサイトメトリーを用いて測定した。今回の実験では、CD45+CD3+TCR Vγ9+の細胞をγδT細胞と判定した。
【0045】
フローサイトメーターはFC500(ベックマン・コールター株式会社)を使用し、解析ソフトはCXP(ベックマン・コールター株式会社)を使用した。また、抗CD45抗体はECD標識抗ヒトCD45抗体(ベックマン・コールター株式会社)を使用し、抗CD3抗体はPC5標識抗ヒトCD3抗体(ベックマン・コールター株式会社)を使用し、抗TCR Vγ9抗体はFITC標識抗ヒトTCR Vγ9抗体(ベックマン・コールター株式会社)を使用した。
【0046】
図1Aは、day0の細胞中のCD45+細胞におけるCD3およびTCR Vγ9の発現パターンを示す2パラメータドットプロットである。図1Bは、day14の細胞中のCD45+細胞におけるCD3およびTCR Vγ9の発現パターンを示す2パラメータドットプロットである。これらの図に示されるように、day0の細胞中のγδT細胞の割合は3.5%であったのに対し(図1A参照)、day14の細胞中のγδT細胞の割合は68.5%であった(図1B参照)。
【0047】
これらの結果から、HTLV−1感染者由来のPBMCsを細胞源としても、ビスホスホネート系骨代謝改善薬およびIL−2を添加した培地中で培養することで、γδT細胞を増殖および活性化させうることが示唆される。
【0048】
(3)HTLV−1のプロウイルス量の測定
培養前の細胞(day0)および培養後の細胞(day14)について、100細胞あたりのHTLV−1のプロウイルス量をリアルタイムPCR法により測定した。
【0049】
測定対象の細胞集団(day0またはday14の細胞)を溶解バッファー(50mM Tris−HCl(pH8.0),20mM EDTA,0.1M NaCl,1%SDS)に懸濁した。得られた細胞懸濁液にプロテイナーゼK(和光純薬工業株式会社)を終濃度が150μg/mLとなるように添加し、55℃で一晩振盪した後、フェノールクロロホルムを用いてゲノムDNAを抽出した。HTLV−1のpX領域およびヒトβ−アクチンに対するTaqManプローブ−プライマーセットを用いて、リアルタイムPCRを行った。標準検体を用いて検量線を作成してHTLV−1のpX領域およびヒトβ−アクチンの量を算出し、これらの値から100細胞あたりのHTLV−1のプロウイルス量を算出した。
【0050】
図2は、day0およびday14の細胞についての、100細胞あたりのHTLV−1のプロウイルス量を示すグラフである(n=4)。このグラフに示されるように、day0の細胞中の平均ウイルス量は33.24(コピー/100細胞)であったのに対し、day14の細胞中の平均ウイルス量は3.37(コピー/100細胞)であった。
【0051】
この結果から、HTLV−1感染者由来のPBMCsを細胞源としてγδT細胞を培養すると、γδT細胞の増殖に伴いHTLV−1感染細胞の割合がある程度減少することがわかる。しかしながら、HTLV−1感染細胞を3%も含む細胞集団は、生体内のウイルス感染細胞数を増加させるおそれがあるため、γδT細胞療法に使用することはできない。
【0052】
2.本発明の方法によるγδT細胞の培養
次に、実施例として、本発明の方法(PBMCsからCD4+細胞を除去する)によりγδT細胞を培養した例を示す。
【0053】
(1)γδT細胞の培養
上記比較例と同様の手順で、HTLV−1感染者の新鮮血から自己血漿およびPBMCsを得た。次いで、磁気細胞分離法により、得られたPBMCsからCD4+細胞を除去して、CD4−の細胞集団を得た。具体的には、PBMCsを抗CD4マイクロビーズ(ミルテニーバイオテク社)と反応させた後、反応物をMACシステムの分離カラム(ミルテニーバイオテク社)に通して、PBMCsからCD4+細胞を除去した。
【0054】
得られたCD4−の細胞集団を上記比較例と同様の手順で14日間培養した。その結果、比較例と同様に、γδT細胞を選択的に増殖および活性化させることができた(図1参照)。
【0055】
(2)HTLV−1のプロウイルス量の測定
培養前の細胞(day0)および培養後の細胞(day14)について、上記比較例と同様の手順で、100細胞あたりのHTLV−1のプロウイルス量を測定した。
【0056】
図3は、day0およびday14の細胞についての、100細胞あたりのHTLV−1のプロウイルス量を示すグラフである(n=2)。このグラフに示されるように、day0の細胞中の平均ウイルス量は30.965(コピー/100細胞)であったのに対し、day14の細胞中の平均ウイルス量は0.095(コピー/100細胞)であった。
【0057】
この結果から、HTLV−1感染者由来のPBMCsを細胞源とする場合であっても、CD4+細胞を除去した後に培養すると、HTLV−1感染細胞をほぼ完全に除去した状態でγδT細胞を増殖させうることがわかる。このようにHTLV−1感染細胞をほとんど含まない細胞集団は、生体内のウイルス感染細胞数を増加させるおそれが低いため、γδT細胞療法に使用することができる。
【0058】
3.HTLV−1感染細胞に対するγδT細胞の細胞傷害活性の測定
上記比較例で示したように、HTLV−1感染者由来のPBMCsを細胞源としてγδT細胞を増殖させたところ、HTLV−1感染細胞の割合がある程度減少した(図2参照)。このことは、γδT細胞がHTLV−1感染細胞に対して傷害活性を有することを示唆している。そこで、γδT細胞がHTLV−1感染細胞に対して傷害活性を有するかどうかを調べた。
【0059】
ターゲット細胞としては、HAM患者由来HTLV−1感染細胞株「HCT−4」およびATL患者由来HTLV−1感染細胞株「KK−1」を使用した。これらの培養細胞を回収し、細胞膜標識用蛍光色素(PKH26;シグマアルドリッチジャパン株式会社)を用いて染色した。細胞密度は、いずれも2×105細胞/mLに調整した。
【0060】
エフェクター細胞としては、前述のγδT細胞の選択的培養(比較例)により得られた、培養14日目の活性化γδT細胞(γδT−LAK)を含む細胞集団を使用した。また、対照実験として、抗CD3抗体およびIL−2を用いる培養方法(Takayama T. et al., Lancet, Vol.356, No.9232, pp.802-807.)により得られた、培養14日目の活性化αβT細胞(αβT−LAK)を含む細胞集団も使用した。細胞密度は、いずれも2×105細胞/mL、1×106細胞/mLおよび5×106細胞/mLに調整した。
【0061】
エフェクター細胞の細胞懸濁液とターゲット細胞の細胞懸濁液を混合して共培養を行い、4時間後に細胞を回収した。エフェクター細胞とターゲット細胞との比率は、1:1、5:1または25:1である。アポトーシス検出キット(ベックマン・コールター株式会社)に含まれるFITC−アネキシンVおよびヨウ化プロピジウムを用いて回収した細胞を染色した。そして、前述のフローサイトメーターを用いてアポトーシスを起こした細胞の割合を測定して、HTLV−1感染細胞に対するγδT細胞の細胞傷害活性を決定した。
【0062】
図4Aは、HCT−4(HAM患者由来HTLV−1感染細胞株)に対するγδT細胞およびαβT細胞の細胞傷害活性を示すグラフである。図4Bは、KK−1(ATL患者由来HTLV−1感染細胞株)に対するγδT細胞およびαβT細胞の細胞傷害活性を示すグラフである。「γδT−LAK」はγδT細胞を示し、「αβT−LAK」はαβT細胞を示す。また、「E/T」は、ターゲット細胞(T)に対するエフェクター細胞(E)の割合を意味する
【0063】
図4Aおよび図4Bのグラフから、γδT細胞は、HTLV−1感染細胞に対する細胞傷害活性がαβT細胞に比べて高いことがわかる。このことから、γδT細胞療法がHAMおよびALTの治療および予防に有効であることが示唆される。
【産業上の利用可能性】
【0064】
本発明の製造方法は、例えば、HTLV−1の感染者に対してγδT細胞療法を実施する際のγδT細胞の培養方法として有用である。また、本発明の医薬は、例えばHTLV−1感染者、HAM患者およびATL患者に対してγδT細胞療法を実施する際に用いられる医薬として有用である。
【特許請求の範囲】
【請求項1】
末梢血単核球を準備するステップと、
前記末梢血単核球から、CD4、CCR4、TSLC1およびCD25からなる群から選択される1または2以上の表面マーカーを発現している細胞を除去するステップと、
前記表面マーカーを発現している細胞を除去した末梢血単核球を含む細胞懸濁液にビスホスホネート系骨代謝改善薬およびインターロイキン−2を添加して、γδT細胞を培養するステップと、
を含む、γδT細胞の製造方法。
【請求項2】
前記表面マーカーは、CD4である、請求項1に記載のγδT細胞の製造方法。
【請求項3】
前記末梢血単核球は、HTLV−1の感染者の末梢血から得られたものである、請求項1に記載のγδT細胞の製造方法。
【請求項4】
前記細胞懸濁液中における前記ビスホスホネート系骨代謝改善薬の濃度は、0.05〜100μMの範囲内であり、
前記細胞懸濁液中における前記インターロイキン−2の濃度は、50〜2000U/mLの範囲内である、
請求項1に記載のγδT細胞の製造方法。
【請求項5】
前記ビスホスホネート系骨代謝改善薬は、パミドロン酸、アレンドロン酸、ゾレドロン酸、リセドロン酸、イバンドロン酸、インカドロン酸、エチドロン酸、もしくはこれらの塩、またはこれらの水和物である、請求項1に記載のγδT細胞の製造方法。
【請求項6】
末梢血単核球を準備するステップと、
前記末梢血単核球から、CD4、CCR4、TSLC1およびCD25からなる群から選択される1または2以上の表面マーカーを発現している細胞を除去するステップと、
前記表面マーカーを発現している細胞を除去した末梢血単核球を含む細胞懸濁液にビスホスホネート系骨代謝改善薬およびインターロイキン−2を添加して、γδT細胞を培養するステップと、
を含むγδT細胞の製造方法により製造されたγδT細胞を含有する、
がんまたは感染症を治療または予防するための医薬。
【請求項7】
前記表面マーカーは、CD4である、請求項6に記載の医薬。
【請求項8】
前記末梢血単核球は、HTLV−1の感染者の末梢血から得られたものである、請求項6に記載の医薬。
【請求項9】
HTLV−1関連脊髄症または成人T細胞白血病を治療または予防するための医薬である、請求項8に記載の医薬。
【請求項1】
末梢血単核球を準備するステップと、
前記末梢血単核球から、CD4、CCR4、TSLC1およびCD25からなる群から選択される1または2以上の表面マーカーを発現している細胞を除去するステップと、
前記表面マーカーを発現している細胞を除去した末梢血単核球を含む細胞懸濁液にビスホスホネート系骨代謝改善薬およびインターロイキン−2を添加して、γδT細胞を培養するステップと、
を含む、γδT細胞の製造方法。
【請求項2】
前記表面マーカーは、CD4である、請求項1に記載のγδT細胞の製造方法。
【請求項3】
前記末梢血単核球は、HTLV−1の感染者の末梢血から得られたものである、請求項1に記載のγδT細胞の製造方法。
【請求項4】
前記細胞懸濁液中における前記ビスホスホネート系骨代謝改善薬の濃度は、0.05〜100μMの範囲内であり、
前記細胞懸濁液中における前記インターロイキン−2の濃度は、50〜2000U/mLの範囲内である、
請求項1に記載のγδT細胞の製造方法。
【請求項5】
前記ビスホスホネート系骨代謝改善薬は、パミドロン酸、アレンドロン酸、ゾレドロン酸、リセドロン酸、イバンドロン酸、インカドロン酸、エチドロン酸、もしくはこれらの塩、またはこれらの水和物である、請求項1に記載のγδT細胞の製造方法。
【請求項6】
末梢血単核球を準備するステップと、
前記末梢血単核球から、CD4、CCR4、TSLC1およびCD25からなる群から選択される1または2以上の表面マーカーを発現している細胞を除去するステップと、
前記表面マーカーを発現している細胞を除去した末梢血単核球を含む細胞懸濁液にビスホスホネート系骨代謝改善薬およびインターロイキン−2を添加して、γδT細胞を培養するステップと、
を含むγδT細胞の製造方法により製造されたγδT細胞を含有する、
がんまたは感染症を治療または予防するための医薬。
【請求項7】
前記表面マーカーは、CD4である、請求項6に記載の医薬。
【請求項8】
前記末梢血単核球は、HTLV−1の感染者の末梢血から得られたものである、請求項6に記載の医薬。
【請求項9】
HTLV−1関連脊髄症または成人T細胞白血病を治療または予防するための医薬である、請求項8に記載の医薬。
【図2】


【図3】


【図4】


【図1】




【図3】


【図4】


【図1】


【公開番号】特開2012−90574(P2012−90574A)
【公開日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願番号】特願2010−240868(P2010−240868)
【出願日】平成22年10月27日(2010.10.27)
【出願人】(596165589)学校法人 聖マリアンナ医科大学 (53)
【Fターム(参考)】
【公開日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願日】平成22年10月27日(2010.10.27)
【出願人】(596165589)学校法人 聖マリアンナ医科大学 (53)
【Fターム(参考)】
[ Back to top ]

