γ−アミノ酪酸アナログの結晶形
【課題】非晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸が有する欠点を克服することを課題とする。
【解決手段】図1で表される1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の提供することによる。
【解決手段】図1で表される1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の提供することによる。
【発明の詳細な説明】
【技術分野】
【0001】
1.分野
本明細書では、γ-アミノ酪酸アナログの結晶形及びその結晶形の製造方法が開示される。これらのアナログは、例えば、神経障害性疼痛及びヘルペス後の神経痛を含む特定の疾患及び障害の治療における治療剤として用いてもよい。
【背景技術】
【0002】
2.背景
一般的に、薬剤の結晶形は、それらの優れた安定性の点で薬剤の非晶形よりもある程度好ましい。例えば、多くの場合、非晶質の薬剤は貯蔵中に結晶質の剤形に変換される。薬剤の非晶形及び結晶形は、一般的に異なる物理的及び/又は化学的特性、効力及び/又はバイオアベイラビリティを有するため、このような相互変換は、医薬の投与における安全性の理由の点から望ましくない。あらゆる結晶質の薬剤物質の重要な特徴は、このような物質の多形性の挙動である。その結晶格子は異なる分子配置を含むため、多形性とは、異なる物理的特性を有する同一の分子の結晶である。多形性によって示されるこの異なる物理的特性は、貯蔵、安定性、圧縮性、(製剤化及び生産物の製造にとって重要な)密度及び(バイオアベイラビリティを決めることにとって重要な)溶解速度などの薬学上の重要なパラメータに影響を及ぼす。安定性の違いは、化学反応性の変化(例えば、加水分解又は酸化の違い。その結果、ある多形性からなる剤形が、別の多形性からなるものよりも急速に変色する)、機械的変化(好ましい動力学的に好ましい結晶形が熱力学的により安定な結晶形に変換する際の貯蔵時の錠剤の崩壊など)、又は両方(高湿度にて、ある多形性の錠剤がより崩壊しやすくなることなど)に起因しうる。多形性の間の溶解性の違いは、極限状態において結果的に、効力を欠くか又は有毒な結晶形への変化を生じさせることもある。さらに、結晶形の物理的特性は、医薬の加工に重要であるかもしれない。例えば、特定の結晶形は、その他の型よりもより容易に溶媒和化するかもしれず、又は不純物がなく、ろ過すること及び不純物のろ過及び洗浄することがより難しいこともある(すなわち、ある結晶形とそれに関連するその他の型との間で、粒子の形状及びサイズ分布が異なることもある)。
【0003】
米国食品医薬品局などの政府機関は、固形剤形の薬剤の有効成分の多形性成分を厳密に規制している。純粋で熱力学的に好ましい多形性以外のものを販売する場合、監督官庁は一般的に、多形性薬剤についてバッチ毎のモニタリングを要求する。従って、医学的及び営利的な理由から、熱力学的に安定な多形性であって、動力学的に好ましい多形性を実質的に含まないような固形の薬剤を合成し販売することが好ましい。
【0004】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸(1)、つまりGABAアナログであるガバペンチン(2)のプロドラッグは、経口的に又は哺乳動物の直腸に直接投与した場合のいずれかにおいて、ガバペンチンとして高いバイオアベイラビリティを有する(Gallop et al.国際公開番号WO 02/100347号)。この高いバイオアベイラビリティによって、化合物(1)が、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状を治療又は予防することにとって有用な、(徐放性の剤形を含む)経口用の剤形の価値ある成分となる。
【0005】
【化1】

【0006】
Gallop et al.国際公開番号WO 02/100347に記載されたとおりに製造した化合物(1)を、アセトニトリル水溶液から凍結乾燥した後にガラス状の固体として単離する。この方法によって得られる物質は、一部又は全部が非晶質であり、特定のアルカリ金属塩型は吸湿性である。しかしながら、非晶質の固体及び特に吸湿性の固体はかさ密度が低く、流動性が不十分なため、これを医薬の加工条件下で扱うことは難しい。さらに、吸湿性の固体を扱うためには、特別の技術、及び例えば有効化合物の再生産可能な量又は固形の製剤の安定性を取得するための装置が必要である。さらに、吸湿性を示す薬剤は、水蒸気を防ぐバリアを有する特別の容器に包装される必要があり、このようにして、このような生産物のコストが上昇する。
【発明の開示】
【発明が解決しようとする課題】
【0007】
従って、優れた物理化学的性質を伴う、医薬の加工及び医薬組成物に有利に用いられ得る1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形が求められている。
【課題を解決するための手段】
【0008】
3.要旨
これらの及びその他の要求を満足させる1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形が提供される。さらに、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の医薬組成物、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及びその医薬組成物の、種々の疾患を治療又は予防するための使用方法、ならびに1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を製造する方法が提供される。
【0009】
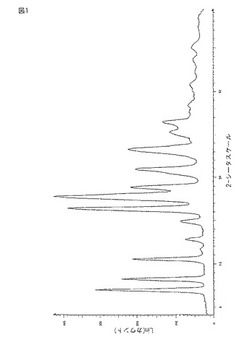
第一の態様においては、粉末X線回折図において、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、16.4°±0.3°、17.9°±0.3°、18.1°±0.3°、18.9°±0.3°、20.9°±0.3°、23.3°±0.3°、25.3°±0.3°及び26.6°±0.3°の位置に特徴的な吸収ピーク(2θ)を有する結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸が提供される。
【0010】
第二の態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の医薬組成物が提供される。この医薬組成物は、粉末X線回折図において、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、16.4°±0.3°、17.9°±0.3°、18.1°±0.3°、18.9°±0.3°、20.9°±0.3°、23.3°±0.3°、25.3°±0.3°及び26.6°±0.3°の位置に特徴的な吸収ピーク(2θ)を有する1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸と、医薬として許容され得る媒体とを含む。
【0011】
第三の態様においては、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状を治療又は予防するための方法が提供される。この方法は一般的に、粉末X線回折図において、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、16.4°±0.3°、17.9°±0.3°、18.1°±0.3°、18.9°±0.3°、20.9°±0.3°、23.3°±0.3°、25.3°±0.3°及び26.6°±0.3°の位置に特徴的な吸収ピーク(2θ)を有する1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の治療有効量を、このような治療又は予防を必要とする患者に投与するステップを含む。
【0012】
第四の態様においては、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状を、そのような治療又は予防が必要な患者において治療又は予防する医薬組成物が提供される。この方法は一般的に、粉末X線回折図において、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、16.4°±0.3°、17.9°±0.3°、18.1°±0.3°、18.9°±0.3°、20.9°±0.3°、23.3°±0.3°、25.3°±0.3°及び26.6°±0.3°の位置に特徴的な吸収ピーク(2θ)を有する1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の医薬組成物の治療有効量を、このような治療又は予防を必要とする患者に投与するステップを含む。
【0013】
第五の態様においては、粉末X線回折図において、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、16.4°±0.3°、17.9°±0.3°、18.1°±0.3°、18.9°±0.3°、20.9°±0.3°、23.3°±0.3°、25.3°±0.3°及び26.6°±0.3°の位置に特徴的な吸収ピーク(2θ)を有する結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を製造するための方法が提供される。
【発明を実施するための最良の形態】
【0014】
5.詳細な説明
5.1 定義
「医薬として許容され得る媒体」とは、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸がそれと共に投与される希釈剤、アジュバント、賦形剤又は担体を指す。
【0015】
「患者」はヒトを含む。「ヒト」及び「患者」という用語は、本明細書では交換して用いることができる。
【0016】
「予防すること」又は「予防」とは、疾患又は障害を被るリスクを軽減すること(すなわち、疾患に晒されたか又は感染しやすいだろう患者であって、今のところその疾患の症状を経験したか又は表していない患者において、その疾患の臨床症状の少なくとも一つの発現を引き起こさないこと)を意味する。
【0017】
「プロモエティ」とは、薬剤をプロドラッグに変換するその薬剤分子内の官能基をマスクするために用いられる時の保護基の型を指す。典型的には、プロモエティは、酵素的又は非酵素的な手段によってインビボで切断される単数(又は複数)の結合を介してその薬剤に結合することになる。
【0018】
任意の疾患又は障害を「治療すること」又は「治療」とは、一つの実施態様においては、その疾患又は障害を改善すること(すなわち、疾患又はその臨床症状の少なくとも一つの進行を停止させるか又は緩和すること)を指す。別の実施態様においては、「治療すること」又は「治療」とは、少なくとも一つの物理的パラメータを改善することを指し、このことは、患者によって認識されないかもしれない。さらに別の実施態様においては、「治療すること」又は「治療」とは、物理的に(例えば認識できる症状を安定化すること)、生理的に(例えば物理的パラメータを安定化すること)又はその両方のいずれかで疾患又は障害を阻害することを指す。さらに別の実施態様においては、「治療すること」又は「治療」とは、疾患又は障害の始まりを遅延させることを指す。
【0019】
「治療有効量」とは、疾患を治療するために患者に投与する時の化合物の量であって、その疾患のそのような治療に十分な効果を示すことができる量を意味する。「治療有効量」は、その化合物、疾患及びその重症度、ならびに治療を受ける患者の年齢、体重などに応じて変化する。
【0020】
ここで、好ましい実施態様についてより詳細に言及したい。好ましい実施態様が記載されているが、本発明がこれらの好ましい実施態様に制限されないことが理解される。これとは反対に、本発明は、本明細書から与えられるいずれかの請求項(単数又は複数)により規定される本発明の精神及び範囲内に包含されうるような代替物、改変物及び均等物を含むことを意図する。
【0021】
5.2 1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及びその調製
ここでは、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形、及び1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の製造方法を詳細に開示する。
【0022】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸に言及することは、実質的に全てのラセミ混合物、この化合物についての従来型の化学構造の可能性のある全ての互変異性型及びこの化合物の全ての同位体標識化誘導体(例えば、2H、3H、13C、14C、15N、17O、18Oなど)を含むことを理解すべきである。
【0023】
Gallop et al.の国際公開番号WO 02/100347号の実施例13又は2004年8月13日に「Methods for Synthesis Acyloxyalkyl Carbamate Prodrugs」という名称で出願されたGallop et al.の米国仮特許出願第60/606,637号の実施例12に開示された手順に従って、出発物質(すなわち、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸)を製造することができる。
【0024】
第一の態様では、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸が提供される。いくつかの実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、16.4°±0.3°、17.9°±0.3°、18.1°±0.3°、18.9°±0.3°、20.9°±0.3°、23.3°±0.3°、25.3°±0.3°及び26.6°±0.3°の位置に特徴的な吸収ピークを有する。その他の実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、粉末X線回折図において、7.0°±0.2°、8.2°±0.2°、10.5°±0.2°、12.8°±0.2°、14.9°±0.2°、16.4°±0.2°、17.9°±0.2°、18.1°±0.2°、18.9°±0.2°、20.9°±0.2°、23.3°±0.2°、25.3°±0.2°及び26.6°±0.2°の位置に特徴的な吸収ピークを有する。
【0025】
いくつかの実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、約54℃〜約78℃の間で融解する。その他の実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、約58℃〜約70℃の間で融解する。さらにその他の実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、約62℃〜約68℃の間で融解する。さらにその他の実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、約62℃〜約66℃の間で融解する。さらにその他の実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、約63℃〜約66℃の間で融解する。さらにその他の実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、約64℃〜約66℃の間で融解する。さらにその他の実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、約63℃〜約64℃の間で融解する。
【0026】
いくつかの実施態様においては、まず最初に、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を溶媒に添加して、溶液又は懸濁液を形成することによって、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を調製してもよい。本明細書で用いられるように、溶液及び懸濁液という用語は交換して用いることができ、そしてこれらは、溶解性に関係なく、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸が溶媒又は溶媒混合物内に置かれる状況を含むことを意味する。結晶化に用いられる溶媒は、均一の溶媒、溶媒の組み合わせ、又は1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸がその中で温度に依存する溶解性を示す溶媒若しくは溶媒の組み合わせのどれでもよい。一般的に、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸が第一の温度範囲内ではその中で溶解し、第二の温度範囲内ではほとんど溶解しない溶媒又は溶媒の組み合わせを、本明細書に記載された方法では有利に用いることができる。温度依存性の溶解性、すなわち高温で溶解し室温で結晶化する性質を伴う、「良好な」溶媒と「貧溶媒」との混合物も用いることができる。適切な「良好な」溶媒の例としては、メタノール、エタノール、1,2-プロパンジオール、t-ブタノール、n-ブタノール、イソプロパノール、酢酸、ニトロメタン、アセトニトリル、ジメチルスルホキシド、ジメチルホルムアミド、N-メチルピロリドン、アセトン、酢酸メチル、酢酸エチル、酢酸イソプロピル、酢酸イソブチル、メチルイソブチルケトン、1,2-ジメトキシエタン、テトラヒドロフラン、2-メチルテトラヒドロフラン、トルエン、メチルt-ブチルエーテル、クロロベンゼン、1,4-ジオキサン、ジエチルエーテル、クメン、o-キシレン、m-キシレン、p-キシレン、2-エトキシエタノール、1,2-エタンジオール、ギ酸エチル、2-メトキシエタノール、1-ペンタノール、アニソール、ジクロロメタン、シス-及びトランス-1,2-ジクロロエチレン、クロロホルム、ジメチルアセトアミド、プロピルアセテート及びその混合物が挙げられる。適切な「貧溶媒」の例としては、例えば、ペンタン、ヘキサン、ヘプタン、オクタン、ノナン、デカン、ウンデカン、ドデカン、シス-若しくはトランス-デカリン、シクロヘキサン、メチルシクロヘキサン及びその混合物などのアルカンが挙げられる。
【0027】
溶媒又は溶媒の組み合わせの沸点まで及び沸点を含む高温で、溶解工程を実施することが好ましい。従って、いくつかの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を、加熱した溶媒又は溶媒混合物に溶解させ、必要に応じて、振盪及び撹拌を行う。加熱された溶液を高温で維持して、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の溶解を確実に完了させる。加熱された溶液を高温でろ過して、任意の不溶解成分を除去してもよい。
【0028】
好ましくは、この溶液をゆっくりと冷却して、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を生じさせる。ろ過及び/又は減圧下での乾燥によって、これを残りの溶媒から分離してもよい。いくつかの実施態様においては、溶液を約0℃〜約25℃の間に冷却する。結晶化分野の当業者に知られているその他の方法(例えば、溶媒の蒸発、水での浸漬、化学反応、少量の所望の結晶形を種とすることなど)を採用して、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を生じさせてもよい。
【0029】
いくつかの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を、約70℃〜還流温度近傍の間の温度のヘプタン中に溶解させる。好ましくは、その温度は約70℃であり、ヘプタン中の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の濃度は約0.07g/mL〜約0.08g/mLの間である。次いで、この溶液を室温に冷却して、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を得る。
【0030】
その他の実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を、約50℃〜還流温度近傍の間の温度の、より好ましくは約70度の温度のヘプタン/酢酸エチル(容量で10:1)の混合物中に溶解させる。ヘプタン/酢酸エチルの混合物中の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の濃度は、約0.18g/mL〜約0.22g/mLの間である。次いで、この溶液を約0℃〜約25℃の間に冷却して、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を得る。
【0031】
さらにその他の実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を、メチルシクロヘキサン/メチルt-ブチルエーテルの混合物(メチルシクロヘキサン対メチルt-ブチルエーテルの体積比は約5:1〜約20:1の間であり、好ましくは10:1の近傍である)に、約20〜約40℃の間の温度で溶解させ、そしてメチルシクロヘキサン/メチルt-ブチルエーテルの混合物中の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の濃度は約0.1g/mL〜約0.25g/mLの間である。次いで、この溶液を約0℃〜約25℃の間に冷却して、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を得る。
【0032】
5.3 治療のための使用
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、ヘルペス後の神経痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状を被っている患者、好ましくはヒトに投与してもよい。さらに、特定の実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、種々の疾患又は障害に対する予防手段として患者、好ましくはヒトに投与する。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、ヘルペス後の神経痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状についての素因を有する患者に、予防手段として投与してもよい。従って、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、一つの疾患又は障害を予防することと同時に、別のことを治療することのために用いてもよい(例えば、精神疾患を予防すると同時に胃腸の障害を治療すること;神経障害性疼痛を予防すると同時にエタノールの禁断症状を治療すること)。
【0033】
てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、ヘルペス後の神経痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状の治療に、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物が適切かどうかについては、当該技術分野に知られている方法によって決定してもよい(例えば、Satzinger et al.,米国特許第4,024,175号;Satzinger et al.,米国特許第4,087,544号;Woodruff,米国特許第5,084,169号;Silverman et al.,米国特許第5,563,175号;Singh,米国特許第6,001,876号;Horwell et al.,米国特許第6,020,370号;Silverman et al.,米国特許第6,028,214号;Horwell et al.,米国特許第6,103,932号;Silverman et al.,米国特許第6,117,906号;Silverman,国際公開番号WO 92/09560号;Silverman et al.,国際公開番号WO 93/23383号;Horwell et al.,国際公開番号WO 97/29101号;Horwell et al.,国際公開番号WO 97/33858号;Horwell et al.,国際公開番号WO 97/33859号;Bryans et al.,国際公開番号WO 98/17627号;Guglietta et al.,国際公開番号WO 99/08671号;Bryans et al.,国際公開番号WO 99/21824号;Bryans et al.,国際公開番号WO 99/31057号;Magnus-Miller et al.,国際公開番号WO 99/37296号;Bryans et al.,国際公開番号WO 99/31075号;Bryans et al.,国際公開番号WO 99/61424号;Pande ,国際公開番号WO 00/23067号;Bellioti,国際公開番号WO 00/31020号;Bryans et al.,国際公開番号WO 00/50027号及びBryans et al.,国際公開番号WO 02/00209号)。当該技術分野において記載された既知の手順(上記の参考文献を参照すること)を利用して、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を用いて、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、ヘルペス後の神経痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状を治療又は予防してもよい。
【0034】
てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、ヘルペス後の神経痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状の治療又は予防における本明細書で開示される化合物の効果が、親の薬剤分子(ガバペンチン又はその他のGABAアナログなど)の効果よりも強いかもしれない。というのは、開示された化合物は、血中治療濃度に到達するのにほとんど時間を要さないかもしれないからである。すなわち、経口投与の場合、本明細書で開示されるこの化合物のtmaxがガバペンチンよりも短いからである。理論に拘束されるつもりは無いが、本明細書で開示される化合物は、ガバペンチン及びその他の公知のGABAアナログが吸収されるメカニズムとは異なるメカニズムによって胃腸の内腔から血液に吸収されると考えられる。例えば、ガバペンチンは、ヒトの小腸に局在化するキャリア輸送体によって消化管の壁を横切る活発な輸送体であると考えられる。ガバペンチン輸送体は容易に飽和する。このことは、血液内に吸収されるガバペンチンの量は、経口投与されたガバペンチンの量には比例しないことを意味する。というのは、輸送メカニズムが一旦飽和すれば、ガバペンチンのさらなる吸収が任意の有意な程度にまでは生じないからである。ガバペンチンと比較して、本明細書に開示された化合物は、結腸を含む消化管の大部分に渡って、消化間の壁を横切って吸収される。
【0035】
本明細書に開示された化合物を、数時間にわたり維持された胃腸管内での放出、特に大腸内での放出を与える徐放製剤に剤形することができるので、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、ヘルペス後の神経痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状の治療又は予防において、ガバペンチンよりも有効であってもよい。徐放性の経口用の剤形で用いられる、本明細書に開示される化合物の能力によって、血中の治療有効薬剤濃度を維持するために必要な投与頻度が減少する。
【0036】
5.4 投与方法
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、ヒトの医学において有利に用いることができる。前述のように、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物は、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、ヘルペス後の神経痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状の治療又は予防に有用である。
【0037】
上記の疾患又は障害を治療又は予防するために用いる場合、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を単独で投与、又はその他の薬剤と組み合わせて投与することができる。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を単独で投与、又はその他のGABAアナログを含む医薬として活性な成分と組み合わせて投与してもよい。
【0038】
治療方法及び予防方法は、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の治療有効量を患者に投与することによって提供される。この患者は動物であってよく、より好ましくは哺乳動物であり、最も好ましくはヒトである。
【0039】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を経口投与することが好ましい。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、その他の任意の都合のよい経路、例えば輸液又は静脈内ボーラスによって、上皮の内層又は皮膚と粘膜の内層(例えば口腔粘膜、直腸粘膜及び腸粘膜など)を経由する吸収によって投与してもよい。投与は全身的でも又は局所的でも可能である。種々の送達システム(例えばリポソーム、微粒子、マイクロカプセル、カプセル内へのカプセル封入など)が知られており、このことを用いて1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を投与することができる。投与方法としては、非限定的に皮内、筋肉内、腹膜内、静脈内、皮下、鼻腔内、硬膜外、経口、舌下、鼻腔内、大脳内、膣内、経皮、経直腸、吸入により、又は局所、特に耳、鼻、眼又は皮膚による投与が挙げられる。
【0040】
いくつかの実施態様においては、徐放性のシステムを経由して、好ましくは経口による徐放性のシステムを経由して、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物が送達され得る。一つの実施態様においては、ポンプを用いてもよい(Langer,上記;Sefton,1987,CRC Crit Ref.Biomed.Eng.14:201;Saudek et al.,1989,N.Engl.J.Med.321:574)。
【0041】
その他の実施態様においては、高分子材料を用いることができる(「Medical Applications of Controlled Release」,Langer and Wise(共著),CRC Pres.,Boca Raton,Florida(1974);「Controlled Drug Bioavailability」,Drug Product Design and Performance,Smolen and Ball(共著),Wiley,New York(1984);Langer et al.,1983,J.Macromol.Sci.Rev.Macromol.Chem.23:61;さらにLevy et al.,1985,Science 228:190;During et al.,1989,Ann.Neurol.25:351;Howard et al.,1989,J.Neurosurg.71:105を参照のこと)。さらにその他の実施態様においては、高分子材料を経口による徐放性の送達に用いられる。高分子としては、例えば、カルボキシメチルセルロースナトリウム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース及びヒドロキシエチルセルロース(好ましくはヒドロキシプロピルメチルセルロース)が挙げられる。その他のセルロースエーテルは記述されている(Alderman,Int.J.Pharm.Tech.and Prod.Mfr.1984,5(3)1-9)。薬剤の放出に影響を及ぼす因子は当業者にとって周知であり、当分野において記述されている(Bamba et al.,Int.J.Pharm.1979,2,307)。
【0042】
その他の実施態様においては、腸溶性製剤を経口による徐放性投与のために用いることができる。コーティング材料としては、例えば、pH依存性の溶解性を有する高分子(すなわちpHによりコントロールされる放出)、徐々に又はpHに依存して膨潤、溶解又は侵食する高分子(すなわち時間によりコントロールされる放出)、酵素によって分解される高分子(すなわち、酵素によりコントロールされる放出)及び圧力の上昇によって破壊される膜層を形成する高分子(すなわち圧力によりコントロールされる放出)が挙げられる。
【0043】
さらにその他の実施態様においては、浸透圧による送達システムが、経口による徐放性投与に用いられる(Verma et al.,Drug Dev.Ind.Pharm.2000,26 :695-708)。いくつかの実施態様においては、OROS(商標)浸透圧デバイスが、経口による徐放性の送達デバイスとして用いられる(Theeuwes et al.,米国特許第3,845,770号;Theeuwes et al.,米国特許第3,916,899号)。
【0044】
さらにその他の実施態様においては、徐放性システムを、標的の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の近傍に置くことが可能であり、その結果、全身的な投与の一部だけが必要となる(例えば、Goodson,in「Medical Applications of Controlled Release」,上記,vol.2,pp.115-138(1984))。Langer,1990,Science 249:1527-1533で検討されているその他の徐放性システムを用いてもよい。
【0045】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物は、患者にインビボで投与するときにガバペンチンを与えることが好ましい。理論に拘束されるつもりは無く、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形のプロモエティ及び/又はその医薬組成物は、化学的に及び/又は酵素的のいずれかで切断されうる。胃、腸の内腔、腸組織、血液、肝臓、脳又はその他の適切な任意の哺乳動物の組織に存在する一つ以上の酵素が、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形のプロモエティ及び/又はその医薬組成物を切断してもよい。切断のメカニズムは重要ではない。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形のプロモエティ及び/又はその医薬組成物から切断されることによって形成されるガバペンチンが、実質的な量のγ-ラクタムの汚染物を含まないことが好ましい(好ましくは、0.5重量%未満、より好ましくは0.2重量%未満、最も好ましくは0.1重量%未満)。ここでこの汚染物は、カルボキシの機能によるγアミノ基の分子内環化によって形成される。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物からのラクタム形成の程度を、標準的なインビトロ分析方法を用いて評価してもよい。
【0046】
理論に拘束されるつもりはないが、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形のプロモエティ及び/又はその医薬組成物を、消化管(例えば胃又は腸の内腔内)によって吸収される前に、及び/又は消化管によって吸収された後で(例えば腸の組織、血液、肝臓又は哺乳動物のその他の適切な組織において)切断してもよい。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形のプロモエティ及び/又はその医薬組成物を、消化管によって吸収される前に切断する場合、従来のようにガバペンチンは(例えば小腸に位置する大型中性アミノ酸輸送体を経由して)全身循環内に吸収されてもよい。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形のプロモエティ及び/又はその医薬組成物を、消化管による吸収の後に切断する場合、このGABAアナログのプロドラッグは、受動拡散、能動輸送又は受動的及び能動的プロセスの両者のいずれかによって全身循環に吸収されてもよい。
【0047】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形のプロモエティ及び/又はその医薬組成物を、消化管による吸収の後に切断する場合、このGABAアナログのプロドラッグが大腸から全身循環に吸収される機会が有ってもよい。この状態においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を徐放性のシステムとして投与することが好ましい。いくつかの実施態様においては、経口による徐放性の投与によって、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を送達する。好ましくは、これらの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、一日に二回(より好ましくは一日に一回)投与する。
【0048】
5.5 医薬組成物
本医薬組成物は、患者への適切な投与のための型を提供するために、医薬として許容され得る媒体の適切な量と共に、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の治療有効量を含む。患者に投与する場合、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び医薬として許容され得る媒体を滅菌することが好ましい。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を静脈内に投与する場合、水は好ましい媒体である。食塩水及びデキストロース水溶液及びグリセロール溶液を、特に注射可能な溶液用の液体の媒体として用いることもできる。適切な医薬媒体としては、デンプン、グルコース、ラクトース、スクロース、ゼラチン、麦芽、米、小麦粉、石灰粉、シリカゲル、ステアリン酸ナトリウム、モノステアリン酸グリセリン、タルク、塩化ナトリウム、脱脂粉乳、グリセロール、プロピレン、グリコール、水、エタノールなどの賦形剤も挙げられる。必要に応じて、本組成物は少量の湿潤剤若しくは乳化剤又はpH緩衝剤を含むこともできる。さらに、助剤、安定化剤、増粘剤、潤滑剤及び着色剤を用いてもよい。
【0049】
いくつかの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の医薬組成物は、分子内環化によって形成される副産物のラクタムを含んでいない。その他の実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の医薬組成物は安定しており、実質的にラクタムの形成を伴うことなく(好ましくはラクタムが0.5重量%未満、より好ましくはラクタムが0.2重量%未満、最も好ましくはラクタムが0.1重量%未満)、貯蔵期間が(好ましくは一年以上)延長される。
【0050】
従来の混合方法、溶解方法、造粒方法、糖衣錠作製方法、溶離方法、乳化方法、カプセル封入方法、封入方法又は凍結乾燥方法を利用して、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を含む医薬組成物を製造してもよい。一つ以上の生理的に許容される担体、希釈剤、賦形剤又は助剤を用いる従来の方法で、医薬組成物を製剤化してもよく、これらを用いることで、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を医薬として用いることができる製剤に円滑に加工することができる。適切な製剤化は、選択される投与経路に左右される。
【0051】
本医薬組成物は、溶液、懸濁液、乳濁液、錠剤、ピル、ペレット、カプセル、液体を含むカプセル、粉末、徐放性の製剤、坐薬、エマルジョン、エアロゾル、スプレー、懸濁液の形態又は使用に適するその他の任意の形態をとることができる。いくつかの実施態様においては、医薬として許容され得る媒体はカプセルである(例えば、Grosswald et al.,米国特許第5,698,155号)。薬学上の適切な媒体のその他の例は、当分野において既述されている(Remington’s Pharmaceutical Sciences,Philadelphia College of Pharmacy and Science,19th Edition,1995を参照のこと)。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の組成物を、経口による送達用に、特に経口による徐放性投与用に製剤化することが好ましい。
【0052】
経口による送達のための医薬組成物は、例えば、錠剤、ロゼンジ、水性若しくは油性の懸濁液、顆粒、粉末、乳濁剤、カプセル、シロップ又はエリキシル剤の形態であってよい。経口によって投与される組成物は、医薬として口当たりの良い製剤を供給するために、一以上の任意の薬剤、例えばフルクトース、アルパルテーム又はサッカリンなどの甘味料、ペパーミント、ウィンター・グリーン油などの香料又はサクラの着色剤及び保存剤を含んでもよい。さらに、錠剤又はピルの形態において、医薬組成物をコーティングして、消化管における崩壊及び吸収を遅延させてもよい。それによって、長時間に亘る作用の持続性を提供する。浸透圧活性をドライブする化合物の周囲の選択的な浸透性を示す膜は、本明細書に開示された化合物及び組成物を経口により投与することにも適している。これらの後者のプラットホームにおいては、カプセルの周囲の環境からの液体は、ドライブする化合物によって吸収される。このことによって膨潤し、隙間を経由して薬剤又は薬剤組成物と置き換わる。これらの送達用のプラットホームによって、即時放出性の製剤のスパイクされたプロファイルとは対照的に、本質的に0次の送達プロファイルを提供することができる。モノステアリン酸グリセリン又はステアリン酸グリセリンなどの時間遅延性物質を用いることもできる。経口用の組成物は、マンニトール、ラクトース、デンプン、ステアリン酸マグネシウム、サッカリンナトリウム、セルロース、炭酸マグネシウムなどの標準的な媒体を含むことができる。このような媒体は医薬用のグレードであることが好ましい。
【0053】
例えば懸濁液、エリキシル剤及び溶液などの経口用の液体製剤に適切な担体、賦形剤又は希釈剤としては、水、生理食塩水、アルキレングリコール(例えばプロピレングリコール)、ポリアルキレングリコール(例えばポリエチレングリコール)、油、アルコール、pH4〜pH6の間の弱酸性の緩衝液(例えば約5mM〜約50mMの間の酢酸塩、クエン酸塩、アスコルビン酸塩)などが挙げられる。さらに、香味料、保存剤、着色料、胆汁酸塩、アシルカルニチンなどを加えてもよい。
【0054】
その他の経路を経由する投与用医薬組成物を検討してもよい。舌下投与のためには、組成物の形態は、従来のやり方で製剤される錠剤、トローチ剤などでもよい。噴霧器及び液体噴霧装置及びEHDエアロゾル装置と共に使用することに適した液体の薬剤の製剤は、医薬として許容され得る媒体を伴う1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形が典型的に挙げられるだろう。好ましくは、医薬として許容され得る媒体が、アルコール、水、ポリエチレングリコール又はパーフルオロカーボンなどの液体である。必要に応じて、別の物質を添加して、本明細書に開示された化合物の溶液又は懸濁液を添加してエアロゾルの特質を改変してもよい。好ましくは、この物質は、アルコール、グリコール、ポリグリコール又は脂肪酸などの液体である。エアロゾル装置での使用に適した液体薬剤の溶液又は懸濁液を製剤化するその他の方法は、当業者にとっては公知である(例えば、Biesalski,米国特許第5,112,598号;Biesalski,米国特許第5,556,611号を参照のこと)。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を、カカオバター又はその他のグリセリドなどの従来の坐薬用の基剤などを含む坐薬又は滞留性の浣腸剤などの直腸用又は膣用組成物に製剤化してもよい。前述の製剤化に加えて、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形をデポー製剤に剤形してもよい。このような長期に亘って作用する製剤を、移植によって(例えば、皮下又は筋肉内に)投与してもよく、又は筋肉内注射によって投与してもよい。従って、例えば、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を、適切な高分子材料又は(例えば、油に許容されるエマルジョンとして)疎水性物質又はイオン交換樹脂と共に製剤化してもよく、又はやや溶解しにくい誘導体として、例えばやや溶解しにくい塩として製剤化してもよい。
【0055】
いくつかの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を、純粋な有効成分として製剤化する。その他の実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸のその他の結晶形を有する混合物として製剤化する。
【0056】
5.6 用量
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物は、一般的には意図する目的を達成するために有効な量を用いることになる。てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状などの疾患又は障害を治療又は予防に用いるために、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を治療有効量で投与又は適用する。
【0057】
本明細書で開示される特定の障害又は状態を治療することに有効となる、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の量は、障害又は状態の性質に依存することになる。そして前述のような当分野において公知の標準的な臨床技術によってそれを決定することができる。さらに、必要に応じてインビトロ又はインビボでの評価を適用して、最適な用量の範囲の特定を支援してもよい。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の用量は、当然のことながら、その他の因子、治療される対象、対象の体重、苦痛の重症度、投与方法及び処方する医師の判断に依存する。
【0058】
例えば、単回投与によって、複数回投与又は徐放性投与によって、医薬組成物における用量を送達してもよい。いくつかの実施態様においては、経口による徐放性投与によって、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を送達する。好ましくは、これらの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を一日に二回(より好ましくは一日に一回)投与する。投薬は断続的に繰り返してもよく、単独で又はその他の薬剤と共に与えてもよく、及び疾患の状態又は障害を効果的に治療する必要がある限り投薬を継続してもよい。
【0059】
いくつかの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の用量を、(約260mg/日〜約3600mg/日のガバペンチンに相当する)約500mg/日〜約7000mg/日のプロドラッグを与えるように調節してもよい。用量の範囲は、当業者が公知の方法によって容易に決定することができる。
【0060】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の所望の治療活性及び予防活性について、ヒトに用いる前に、インビトロ及びインビボで評価することが好ましい。好ましくは、本明細書に記載の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の治療有効量を投与することによって、毒性を実質的に生じさせることなく、治療上の利益が与えられる。標準的な薬学上の手順を用いて、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の毒性を求めることができ、そして当業者によって容易に確定される。毒性効果及び治療効果の間の用量の比率が、治療指数である。本明細書に記載の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の用量は、ほとんど又は全く毒性を示さない有効用量を含む循環する濃度の範囲内にあることが好ましい。
【0061】
5.7 併用療法
特定の実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、少なくとも一つの治療剤と共に、併用療法で用いることができる。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物ならびにその他の治療剤は、相加的に作用することができ、より好ましくは相乗的に作用できる。いくつかの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を含む医薬組成物を、別の治療剤と共に同時に投与する。ここで、この別の治療剤は1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形と同一の医薬組成物の一部でもよく、又は異なる医薬組成物でもよい。その他の実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を含む医薬組成物を、別の治療剤の投与の前に、又はその後に投与する。例えば、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の非晶形、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の別の結晶形、ガバペンチン又はプレガバリンと組み合わせて投与してもよい。
【0062】
6.実施例
次の実施例では、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸及びその結晶形の製法について詳細に記載する。本発明の範囲から逸脱することなく、材料及び方法の両者についての多数の改変物を用いてもよいことは、当業者にとって自明である。
【0063】
下記の実施例において、次の略語は次の意味を有する。略語が定義されていない場合、一般的に許容されている意味が適用される。
Atm=気圧
Boc=tert-ブチルオキシカルボニル
Cbz=カルボベンジルオキシ
DCC=ジシクロヘキシルカルボジイミド
DMAP=4-N,N-ジメチルアミノピリジン
DMF=N,N-ジメチルホルムアミド
DMSO=ジメチルスルホキシド
Fmoc=9-フルオレニルメチルオキシカルボニル
g=グラム
h=時間
HPLC=高圧液体クロマトグラフィー
L=リットル
LC/MS=液体クロマトグラフィー/質量分析
M=モル濃度
min=分間
mL=ミリリットル
mmol=ミリモル
NHS=N-ヒドロキシスクシンイミド
THF=テトラヒドロフラン
TFA=トリフルオロ酢酸
TLC=薄層クロマトグラフィー
TMS=トリメチルシリル
μL=マイクロリットル
μM=マイクロモル濃度
v/v=体積対体積
【実施例】
【0064】
6.1実施例1:トリメチルシリルエステル中間体を経由する1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸
ステップA:1-{[(α-クロロエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸
ジクロロメタン(1.6L)が入った5リットルの三つ首丸底フラスコに、ガバペンチン(120.4g、0.704mol)、次いでトリエチルアミン(294mL、2.11mol)を添加した。反応温度を15℃未満に維持している間に、クロロトリメチルシラン(178mL、1.40mol)をゆっくりと添加し、得られた懸濁液を30分間撹拌した。次いで、温度を15℃未満に維持している間に、1-クロロエチルクロロホルメート(100g、0.704mol)をゆっくりと添加した。添加を終えた後、追加のトリエチルアミン(88mL、0.63mol)を添加し、得られた懸濁液を室温で30分間撹拌した。反応混合物を水(2×1L)、次いで1NのHCl(2×2L)、次いで塩類溶液(2×500mL)で洗浄することによって、酸性を強めて、得られたシリルエステルを対応する酸に変換した。無水硫酸ナトリウムで乾燥させた後、減圧して溶媒を除去し、粗生産物(190g)をオレンジ色の油として得、そしてさらなる精製を行うことなくステップBで用いた。1HNMR(CDCl3,400MHz):δ1.41-1.57(m,10H),1.78(d,3H),2.33(s,2H),3.27(d,2H),5.42(br.s,1H),6.55(q,1H)。
【0065】
ステップB:1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸
3リットルの三つ首丸底フラスコに、イソ酪酸(254g、2.9mol)、次いでトリエチルアミン(395mL、2.84mol)を添加した。この反応混合物を室温に冷却し、温度を30℃未満に維持している間に、上記の反応ステップから得た粗製酸(190g、0.69mol)を含むジクロロメタン(80ml)を制御された様式で添加した。得られる黄白色の溶液を一晩撹拌した。次いで、この反応混合物を一体積のジクロロメタンで希釈し、水(6×500mL)、炭酸水素カリウム水溶液(3×500mL)及び塩類溶液(2×500mL)で洗浄した。無水硫酸ナトリウムで乾燥させた後、減圧して溶媒を除去し、粗製産物を暗赤色の油(87g)として得た。この生産物の一部(35g)を800gのBiotage(商標)順相シリカゲルフラッシュカラム上にロードし、ヘキサン中の40%のジエチルエーテル(6L)で溶出し、そして減圧して溶媒の除去後に生産物を無色の油(13.5g)として得た。このことを粗生産物の第二の35gの部分について繰り返し、さらに13.5gの1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を得た。70℃のヘプタン(325mL)に溶解させ、次いでゆっくりと室温に冷却することによって、生産物(25g)のサンプルを再結晶化させた。この白色の結晶質の生産物(23g)をろ過によって単離した。融点:63〜64℃。
【0066】
6.2実施例2:アリルエステル中間体を経由する1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸
ステップA:アリル1-アミノメチル-1-シクロヘキサン酢酸の塩酸塩
磁気撹拌子及び500mLの加圧供給式漏斗を備えた3Lの感想三つ首丸底フラッシュを窒素ガスで置換した。このフラスコにガバペンチン(171g、1.0mol)とアリルアルコール(1L、852g、14.6mol)とを入れ、混合物全体を氷水の槽で0℃に冷却した。1時間以上かけて、撹拌中の溶液に塩化チオニル(225mL、360g、3.0mol)を滴下した。この反応混合物を室温で16時間撹拌し、次いでエチルエーテル(2L)で希釈して撹拌しながら0℃に冷却した。数分後、白色の結晶が形成し、ろ過で集めた。エタノール及びエチルエーテルの1/3(v/v)の混合物(2L)から、この粗生産物を再結晶させて、白色の固体として生産物(220g、88%)を得た。融点:138〜142℃。1HNMR(CD3OD,400MHz):δ1.36-1.54(m,10H),2.57(s,2H),3.05(s,2H),4.61(d,J=6Hz,2H),5.22(dd,J1=10.4Hz,J2=1.2Hz,1H),5.33(dd,J1=17.2Hz,J2=1.4Hz,1H),5.90-6.00(m,1H)。MS(ESI)m/z212.0(M-Cl)+。
【0067】
ステップB:アリル1-{[(α-クロロエトキシ)カルボニル]アミノメチル}-1-シクロヘキサンアセテート
上記の塩酸塩(220g、0.89mol)を含むジクロロメタン溶液(1L)に、1-クロロエチルクロロホルマート(101.7mL、132.3g、0.92mol)をゆっくりと添加した。この反応混合物を0℃に冷却し、温度を10℃未満に維持している間に、4-メチルモルホリン(205mL、188.9g、1.87mol)を1時間かけてゆっくりと添加した。得られる濁った溶液を室温で1時間撹拌した。エタノール(150mL)を添加し、この反応混合物を室温で1時間撹拌した。次いで、この反応混合物をエーテル(2.5L)で希釈し、水(1L)及び塩類溶液(1L)で洗浄した。有機相を硫酸ナトリウムで乾燥させ、濃縮して標記の化合物を淡黄色の粘稠な液体(282g、100%)として得た。1HNMR(CDCl3,400MHz):δ1.35-1.58(m,10H),1.78(d,J=5.6Hz,3H),2.32(s,2H),3.22(d,J=6.8Hz,2H),4.57(d,J=5.6Hz,2H),5.25(dd,J1=10.4Hz,J2=1Hz,1H),5.32(dd,J1=17.2Hz,J2=1.6Hz,1H),5.52(br,1H,NH),5.90-5.94(m,1H),6.54(q,J=5.6Hz,1H)。
【0068】
ステップC:アリル1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサンアセテート
イソ酪酸(432mL,391.5g,4.4mol)及び4-メチルモルフォリン(488mL,449g,4.4mol)の混合物に、前ステップからのクロロカルバマート(282g,0.88mol)のイソ酪酸(432mL,391.5g,4.4mol)溶液を添加した。この添加は、0℃にて30分間かけて行った。得られる濁った溶液を室温で16時間撹拌した。この反応混合物をエーテル(2.5L)で希釈し、そして水(3×500mL)、次いで10%の炭酸水素カリウム水溶液(6×500mL)、次いで塩類溶液(500mL)で洗浄した。有機相を硫酸ナトリウムで乾燥させ、濃縮して標記の化合物を粘稠な液体として得た(328g、100%)。1HNMR(CDCl3,400MHz):δ1.15(d,J=7.2Hz,6H),1.35-1.58(m,10H),2.31(s,2H),2.51(m,1H),3.19(d,J=5.6Hz,2H),4.56(d,J=5.6Hz,2H),5.24(dd,J1=10Hz,J2=1Hz,1H),5.32(dd,J1=17Hz,J2=1.2Hz,1H),5.35(br,1H),5.84-5.94(m,1H),6.78(q,J=5.6Hz,1H)。MS(ESI)m/z392.24(M+H)+。
【0069】
ステップD:アリル1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサンアセテートの脱保護
撹拌中のギ酸アンモニウム(112g,1.7mol)のエタノール(500mL)懸濁液に、10%のPd/C(15g)と共に上記のアリルエステル(328g、0.88mol)を窒素雰囲気下で添加した。6時間後、触媒をろ別することによって、この反応混合物を得た。この触媒をエタノール(2×250mL)で洗浄し、ろ液を一つにまとめて蒸発させた。この粗生産物をエーテル(2L)に溶解させ、有機相を2NのHCl(2×2L)で洗浄してアンモニウム塩を酸型に変換し、次いで水(1L)及び塩類溶液(1L)で洗浄した。エーテル層を硫酸ナトリウムで乾燥させて濃縮し、粗生産物を粘稠な液体(240g,82%)として得た。
【0070】
ステップE:1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶化
3Lの丸底フラスコに、加熱用の油浴、窒素注入用アダプター、内部の温度計、上部の機械撹拌子及び還流冷却器を設置した。このフラスコを窒素で置換し、そして酢酸エチル/ヘプタンの1/10(v/v)の混合液(1.2L)と前の反応からの粗生産物(240g)とを入れた。この生産物が溶解するまでフラスコを加熱し、次いで次のスケジュールに従って冷却した。
【0071】
【表1】

【0072】
次いで、このフラスコを撹拌しながら一晩かけて4℃に冷却した(冷却によって収率が改善する)。この生産物をろ過し、ヘプタン(2×100mL)で洗浄し、次いで18時間かけて減圧下(25mmの水銀(0.033atm))で乾燥させて、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸(185g)を白色の結晶質の固体として得た。
【0073】
6.3実施例3:結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸のX線粉末回折分析
上記の実施例1及び2に従って生産された1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶質のサンプルの粉末X線回折図(XRPD’s)を、Cu Kα放射線を利用したBruker D8 Discover X線粉末回折装置で測定した。この装置は、平行ビーム・オプティクス及び二次元HI-STAR領域検出器を具備している。管の電圧及び電流をそれぞれ40kV及び40mAに設定した。平行X線ビームを直径約0.5mmのスポットサイズに縮小した。領域検出器をゴニオメータの中心から15cmの位置に設置し、角分解能をピクセル当たり約0.033°とする。この検出器は、一フレーム内において2-シータ(2θ)で35°の範囲を対象とした。X線ビームとサンプルプレートの横軸との間の角度を4°に設定し、エリア・デテクターの中心を18°の角度に設定した。この幾何学によって、一フレーム内の4.5°〜39.5°の2-シータの測定が可能になった。集められたそれぞれのXRPDのパターンについての典型的な平均時間は3分間であった。コランダムのサンプル(NIST 1976)を用いて、このXRPD装置を較正した。両方のサンプルは、図1に図解されるような同等の回折図のパターンを与えた。
【0074】
6.4実施例4:結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の融点及び示差走査熱量測定の分析
上記の実施例1及び2に従って生産された1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶質のサンプルの融点を、Electrothermal 9200融点装置を用いて測定し、63〜64℃と決定した。
【0075】
上記の実施例1及び2に従って生産された1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶質のサンプルの示差走査熱量測定(DSC)分析を、Perkin Elmer Series 7装置を用いて、5℃/分のスキャン速度で25℃から250℃までスキャンして測定した。サンプルのテスト部分をアルミニウムの皿と蓋との中に置き、蓋と皿との間の目に見えるあらゆる継ぎ目を無視するために圧着した。空の皿を同様に用意してブランクとした。この皿を示差走査熱量測定計内に置いた。この材料について、適切な温度プログラム(初期の温度での平衡化、等温、ランプレート、最終温度)を実行し、図2に示される温度記録図を得た。DSC分析から、58.3℃の開始温度及び72.39J/gのΔHを伴う吸熱転移が示された。63〜64℃の吸熱のピークにおいて、このサンプルの融解が目視できた。
【0076】
6.5実施例5:{[(1-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸
ガバペンチン(6.8g、0.04mol)の水溶液(40mL)に、[(1-イソブタノイルオキシエトキシ)カルボニルオキシ]スクシンイミド(10g、0.036mol)のアセトニトリル溶液(40mL)を、30分間かけて添加した。この反応を室温で3時間撹拌した。この反応混合物をメチルtert-ブチルエーテル(200mL)で希釈し、水(2×100mL)及び塩類溶液(50mL)で洗浄した。有機相を分離し、無水硫酸ナトリウムで乾燥させてろ過し、そして減圧下で濃縮して標記の化合物を白色の固体(12g、定量的)として得た。
【0077】
結晶化:固形の化合物(12g)を、メチルシクロヘキサン:メチルtert-ブチルエーテルの10:1(60mL)に懸濁させた。この懸濁液をゆっくりと30分間以上かけて、50℃まで加熱した。次いで、透明な溶液を室温に冷却した。濁った混合物に、5mgの標記の化合物の結晶形を種として入れた。さらに、混合物を2時間0〜4℃に冷却した。固形の生産物をろ過し、メチルシクロヘキサン(2×10mL)で洗浄して標記の化合物を白色の結晶質の固体(10g、83%の収率)として得た。結晶質の固体物質は、オープンキャピラリー融点測定法によって測定されるように、約64〜66℃の融点を有していた。
【0078】
最後に、本発明を実施するための別の方法が存在することを留意すべきである。従って、本実施態様は例証とみなされるべきであり、制限的なものではない。そして本発明は、本明細書に示された詳細な事項に制限されるわけではないが、本明細書に由来する任意の単数(又は複数)の請求項の範囲及び均等物の範囲内で改変してもよい。本明細書に列挙された全ての刊行物及び特許は、その全体が参照によって組み込まれる。
【図面の簡単な説明】
【0079】
【図1】結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の粉末X線回折図を示す。
【図2】結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の示差走査熱量測定の温度記録図を示す。
【技術分野】
【0001】
1.分野
本明細書では、γ-アミノ酪酸アナログの結晶形及びその結晶形の製造方法が開示される。これらのアナログは、例えば、神経障害性疼痛及びヘルペス後の神経痛を含む特定の疾患及び障害の治療における治療剤として用いてもよい。
【背景技術】
【0002】
2.背景
一般的に、薬剤の結晶形は、それらの優れた安定性の点で薬剤の非晶形よりもある程度好ましい。例えば、多くの場合、非晶質の薬剤は貯蔵中に結晶質の剤形に変換される。薬剤の非晶形及び結晶形は、一般的に異なる物理的及び/又は化学的特性、効力及び/又はバイオアベイラビリティを有するため、このような相互変換は、医薬の投与における安全性の理由の点から望ましくない。あらゆる結晶質の薬剤物質の重要な特徴は、このような物質の多形性の挙動である。その結晶格子は異なる分子配置を含むため、多形性とは、異なる物理的特性を有する同一の分子の結晶である。多形性によって示されるこの異なる物理的特性は、貯蔵、安定性、圧縮性、(製剤化及び生産物の製造にとって重要な)密度及び(バイオアベイラビリティを決めることにとって重要な)溶解速度などの薬学上の重要なパラメータに影響を及ぼす。安定性の違いは、化学反応性の変化(例えば、加水分解又は酸化の違い。その結果、ある多形性からなる剤形が、別の多形性からなるものよりも急速に変色する)、機械的変化(好ましい動力学的に好ましい結晶形が熱力学的により安定な結晶形に変換する際の貯蔵時の錠剤の崩壊など)、又は両方(高湿度にて、ある多形性の錠剤がより崩壊しやすくなることなど)に起因しうる。多形性の間の溶解性の違いは、極限状態において結果的に、効力を欠くか又は有毒な結晶形への変化を生じさせることもある。さらに、結晶形の物理的特性は、医薬の加工に重要であるかもしれない。例えば、特定の結晶形は、その他の型よりもより容易に溶媒和化するかもしれず、又は不純物がなく、ろ過すること及び不純物のろ過及び洗浄することがより難しいこともある(すなわち、ある結晶形とそれに関連するその他の型との間で、粒子の形状及びサイズ分布が異なることもある)。
【0003】
米国食品医薬品局などの政府機関は、固形剤形の薬剤の有効成分の多形性成分を厳密に規制している。純粋で熱力学的に好ましい多形性以外のものを販売する場合、監督官庁は一般的に、多形性薬剤についてバッチ毎のモニタリングを要求する。従って、医学的及び営利的な理由から、熱力学的に安定な多形性であって、動力学的に好ましい多形性を実質的に含まないような固形の薬剤を合成し販売することが好ましい。
【0004】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸(1)、つまりGABAアナログであるガバペンチン(2)のプロドラッグは、経口的に又は哺乳動物の直腸に直接投与した場合のいずれかにおいて、ガバペンチンとして高いバイオアベイラビリティを有する(Gallop et al.国際公開番号WO 02/100347号)。この高いバイオアベイラビリティによって、化合物(1)が、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状を治療又は予防することにとって有用な、(徐放性の剤形を含む)経口用の剤形の価値ある成分となる。
【0005】
【化1】

【0006】
Gallop et al.国際公開番号WO 02/100347に記載されたとおりに製造した化合物(1)を、アセトニトリル水溶液から凍結乾燥した後にガラス状の固体として単離する。この方法によって得られる物質は、一部又は全部が非晶質であり、特定のアルカリ金属塩型は吸湿性である。しかしながら、非晶質の固体及び特に吸湿性の固体はかさ密度が低く、流動性が不十分なため、これを医薬の加工条件下で扱うことは難しい。さらに、吸湿性の固体を扱うためには、特別の技術、及び例えば有効化合物の再生産可能な量又は固形の製剤の安定性を取得するための装置が必要である。さらに、吸湿性を示す薬剤は、水蒸気を防ぐバリアを有する特別の容器に包装される必要があり、このようにして、このような生産物のコストが上昇する。
【発明の開示】
【発明が解決しようとする課題】
【0007】
従って、優れた物理化学的性質を伴う、医薬の加工及び医薬組成物に有利に用いられ得る1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形が求められている。
【課題を解決するための手段】
【0008】
3.要旨
これらの及びその他の要求を満足させる1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形が提供される。さらに、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の医薬組成物、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及びその医薬組成物の、種々の疾患を治療又は予防するための使用方法、ならびに1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を製造する方法が提供される。
【0009】
第一の態様においては、粉末X線回折図において、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、16.4°±0.3°、17.9°±0.3°、18.1°±0.3°、18.9°±0.3°、20.9°±0.3°、23.3°±0.3°、25.3°±0.3°及び26.6°±0.3°の位置に特徴的な吸収ピーク(2θ)を有する結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸が提供される。
【0010】
第二の態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の医薬組成物が提供される。この医薬組成物は、粉末X線回折図において、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、16.4°±0.3°、17.9°±0.3°、18.1°±0.3°、18.9°±0.3°、20.9°±0.3°、23.3°±0.3°、25.3°±0.3°及び26.6°±0.3°の位置に特徴的な吸収ピーク(2θ)を有する1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸と、医薬として許容され得る媒体とを含む。
【0011】
第三の態様においては、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状を治療又は予防するための方法が提供される。この方法は一般的に、粉末X線回折図において、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、16.4°±0.3°、17.9°±0.3°、18.1°±0.3°、18.9°±0.3°、20.9°±0.3°、23.3°±0.3°、25.3°±0.3°及び26.6°±0.3°の位置に特徴的な吸収ピーク(2θ)を有する1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の治療有効量を、このような治療又は予防を必要とする患者に投与するステップを含む。
【0012】
第四の態様においては、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状を、そのような治療又は予防が必要な患者において治療又は予防する医薬組成物が提供される。この方法は一般的に、粉末X線回折図において、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、16.4°±0.3°、17.9°±0.3°、18.1°±0.3°、18.9°±0.3°、20.9°±0.3°、23.3°±0.3°、25.3°±0.3°及び26.6°±0.3°の位置に特徴的な吸収ピーク(2θ)を有する1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の医薬組成物の治療有効量を、このような治療又は予防を必要とする患者に投与するステップを含む。
【0013】
第五の態様においては、粉末X線回折図において、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、16.4°±0.3°、17.9°±0.3°、18.1°±0.3°、18.9°±0.3°、20.9°±0.3°、23.3°±0.3°、25.3°±0.3°及び26.6°±0.3°の位置に特徴的な吸収ピーク(2θ)を有する結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を製造するための方法が提供される。
【発明を実施するための最良の形態】
【0014】
5.詳細な説明
5.1 定義
「医薬として許容され得る媒体」とは、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸がそれと共に投与される希釈剤、アジュバント、賦形剤又は担体を指す。
【0015】
「患者」はヒトを含む。「ヒト」及び「患者」という用語は、本明細書では交換して用いることができる。
【0016】
「予防すること」又は「予防」とは、疾患又は障害を被るリスクを軽減すること(すなわち、疾患に晒されたか又は感染しやすいだろう患者であって、今のところその疾患の症状を経験したか又は表していない患者において、その疾患の臨床症状の少なくとも一つの発現を引き起こさないこと)を意味する。
【0017】
「プロモエティ」とは、薬剤をプロドラッグに変換するその薬剤分子内の官能基をマスクするために用いられる時の保護基の型を指す。典型的には、プロモエティは、酵素的又は非酵素的な手段によってインビボで切断される単数(又は複数)の結合を介してその薬剤に結合することになる。
【0018】
任意の疾患又は障害を「治療すること」又は「治療」とは、一つの実施態様においては、その疾患又は障害を改善すること(すなわち、疾患又はその臨床症状の少なくとも一つの進行を停止させるか又は緩和すること)を指す。別の実施態様においては、「治療すること」又は「治療」とは、少なくとも一つの物理的パラメータを改善することを指し、このことは、患者によって認識されないかもしれない。さらに別の実施態様においては、「治療すること」又は「治療」とは、物理的に(例えば認識できる症状を安定化すること)、生理的に(例えば物理的パラメータを安定化すること)又はその両方のいずれかで疾患又は障害を阻害することを指す。さらに別の実施態様においては、「治療すること」又は「治療」とは、疾患又は障害の始まりを遅延させることを指す。
【0019】
「治療有効量」とは、疾患を治療するために患者に投与する時の化合物の量であって、その疾患のそのような治療に十分な効果を示すことができる量を意味する。「治療有効量」は、その化合物、疾患及びその重症度、ならびに治療を受ける患者の年齢、体重などに応じて変化する。
【0020】
ここで、好ましい実施態様についてより詳細に言及したい。好ましい実施態様が記載されているが、本発明がこれらの好ましい実施態様に制限されないことが理解される。これとは反対に、本発明は、本明細書から与えられるいずれかの請求項(単数又は複数)により規定される本発明の精神及び範囲内に包含されうるような代替物、改変物及び均等物を含むことを意図する。
【0021】
5.2 1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及びその調製
ここでは、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形、及び1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の製造方法を詳細に開示する。
【0022】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸に言及することは、実質的に全てのラセミ混合物、この化合物についての従来型の化学構造の可能性のある全ての互変異性型及びこの化合物の全ての同位体標識化誘導体(例えば、2H、3H、13C、14C、15N、17O、18Oなど)を含むことを理解すべきである。
【0023】
Gallop et al.の国際公開番号WO 02/100347号の実施例13又は2004年8月13日に「Methods for Synthesis Acyloxyalkyl Carbamate Prodrugs」という名称で出願されたGallop et al.の米国仮特許出願第60/606,637号の実施例12に開示された手順に従って、出発物質(すなわち、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸)を製造することができる。
【0024】
第一の態様では、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸が提供される。いくつかの実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、16.4°±0.3°、17.9°±0.3°、18.1°±0.3°、18.9°±0.3°、20.9°±0.3°、23.3°±0.3°、25.3°±0.3°及び26.6°±0.3°の位置に特徴的な吸収ピークを有する。その他の実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、粉末X線回折図において、7.0°±0.2°、8.2°±0.2°、10.5°±0.2°、12.8°±0.2°、14.9°±0.2°、16.4°±0.2°、17.9°±0.2°、18.1°±0.2°、18.9°±0.2°、20.9°±0.2°、23.3°±0.2°、25.3°±0.2°及び26.6°±0.2°の位置に特徴的な吸収ピークを有する。
【0025】
いくつかの実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、約54℃〜約78℃の間で融解する。その他の実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、約58℃〜約70℃の間で融解する。さらにその他の実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、約62℃〜約68℃の間で融解する。さらにその他の実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、約62℃〜約66℃の間で融解する。さらにその他の実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、約63℃〜約66℃の間で融解する。さらにその他の実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、約64℃〜約66℃の間で融解する。さらにその他の実施態様においては、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、約63℃〜約64℃の間で融解する。
【0026】
いくつかの実施態様においては、まず最初に、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を溶媒に添加して、溶液又は懸濁液を形成することによって、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を調製してもよい。本明細書で用いられるように、溶液及び懸濁液という用語は交換して用いることができ、そしてこれらは、溶解性に関係なく、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸が溶媒又は溶媒混合物内に置かれる状況を含むことを意味する。結晶化に用いられる溶媒は、均一の溶媒、溶媒の組み合わせ、又は1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸がその中で温度に依存する溶解性を示す溶媒若しくは溶媒の組み合わせのどれでもよい。一般的に、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸が第一の温度範囲内ではその中で溶解し、第二の温度範囲内ではほとんど溶解しない溶媒又は溶媒の組み合わせを、本明細書に記載された方法では有利に用いることができる。温度依存性の溶解性、すなわち高温で溶解し室温で結晶化する性質を伴う、「良好な」溶媒と「貧溶媒」との混合物も用いることができる。適切な「良好な」溶媒の例としては、メタノール、エタノール、1,2-プロパンジオール、t-ブタノール、n-ブタノール、イソプロパノール、酢酸、ニトロメタン、アセトニトリル、ジメチルスルホキシド、ジメチルホルムアミド、N-メチルピロリドン、アセトン、酢酸メチル、酢酸エチル、酢酸イソプロピル、酢酸イソブチル、メチルイソブチルケトン、1,2-ジメトキシエタン、テトラヒドロフラン、2-メチルテトラヒドロフラン、トルエン、メチルt-ブチルエーテル、クロロベンゼン、1,4-ジオキサン、ジエチルエーテル、クメン、o-キシレン、m-キシレン、p-キシレン、2-エトキシエタノール、1,2-エタンジオール、ギ酸エチル、2-メトキシエタノール、1-ペンタノール、アニソール、ジクロロメタン、シス-及びトランス-1,2-ジクロロエチレン、クロロホルム、ジメチルアセトアミド、プロピルアセテート及びその混合物が挙げられる。適切な「貧溶媒」の例としては、例えば、ペンタン、ヘキサン、ヘプタン、オクタン、ノナン、デカン、ウンデカン、ドデカン、シス-若しくはトランス-デカリン、シクロヘキサン、メチルシクロヘキサン及びその混合物などのアルカンが挙げられる。
【0027】
溶媒又は溶媒の組み合わせの沸点まで及び沸点を含む高温で、溶解工程を実施することが好ましい。従って、いくつかの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を、加熱した溶媒又は溶媒混合物に溶解させ、必要に応じて、振盪及び撹拌を行う。加熱された溶液を高温で維持して、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の溶解を確実に完了させる。加熱された溶液を高温でろ過して、任意の不溶解成分を除去してもよい。
【0028】
好ましくは、この溶液をゆっくりと冷却して、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を生じさせる。ろ過及び/又は減圧下での乾燥によって、これを残りの溶媒から分離してもよい。いくつかの実施態様においては、溶液を約0℃〜約25℃の間に冷却する。結晶化分野の当業者に知られているその他の方法(例えば、溶媒の蒸発、水での浸漬、化学反応、少量の所望の結晶形を種とすることなど)を採用して、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を生じさせてもよい。
【0029】
いくつかの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を、約70℃〜還流温度近傍の間の温度のヘプタン中に溶解させる。好ましくは、その温度は約70℃であり、ヘプタン中の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の濃度は約0.07g/mL〜約0.08g/mLの間である。次いで、この溶液を室温に冷却して、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を得る。
【0030】
その他の実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を、約50℃〜還流温度近傍の間の温度の、より好ましくは約70度の温度のヘプタン/酢酸エチル(容量で10:1)の混合物中に溶解させる。ヘプタン/酢酸エチルの混合物中の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の濃度は、約0.18g/mL〜約0.22g/mLの間である。次いで、この溶液を約0℃〜約25℃の間に冷却して、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を得る。
【0031】
さらにその他の実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を、メチルシクロヘキサン/メチルt-ブチルエーテルの混合物(メチルシクロヘキサン対メチルt-ブチルエーテルの体積比は約5:1〜約20:1の間であり、好ましくは10:1の近傍である)に、約20〜約40℃の間の温度で溶解させ、そしてメチルシクロヘキサン/メチルt-ブチルエーテルの混合物中の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の濃度は約0.1g/mL〜約0.25g/mLの間である。次いで、この溶液を約0℃〜約25℃の間に冷却して、結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を得る。
【0032】
5.3 治療のための使用
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、ヘルペス後の神経痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状を被っている患者、好ましくはヒトに投与してもよい。さらに、特定の実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、種々の疾患又は障害に対する予防手段として患者、好ましくはヒトに投与する。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、ヘルペス後の神経痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状についての素因を有する患者に、予防手段として投与してもよい。従って、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、一つの疾患又は障害を予防することと同時に、別のことを治療することのために用いてもよい(例えば、精神疾患を予防すると同時に胃腸の障害を治療すること;神経障害性疼痛を予防すると同時にエタノールの禁断症状を治療すること)。
【0033】
てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、ヘルペス後の神経痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状の治療に、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物が適切かどうかについては、当該技術分野に知られている方法によって決定してもよい(例えば、Satzinger et al.,米国特許第4,024,175号;Satzinger et al.,米国特許第4,087,544号;Woodruff,米国特許第5,084,169号;Silverman et al.,米国特許第5,563,175号;Singh,米国特許第6,001,876号;Horwell et al.,米国特許第6,020,370号;Silverman et al.,米国特許第6,028,214号;Horwell et al.,米国特許第6,103,932号;Silverman et al.,米国特許第6,117,906号;Silverman,国際公開番号WO 92/09560号;Silverman et al.,国際公開番号WO 93/23383号;Horwell et al.,国際公開番号WO 97/29101号;Horwell et al.,国際公開番号WO 97/33858号;Horwell et al.,国際公開番号WO 97/33859号;Bryans et al.,国際公開番号WO 98/17627号;Guglietta et al.,国際公開番号WO 99/08671号;Bryans et al.,国際公開番号WO 99/21824号;Bryans et al.,国際公開番号WO 99/31057号;Magnus-Miller et al.,国際公開番号WO 99/37296号;Bryans et al.,国際公開番号WO 99/31075号;Bryans et al.,国際公開番号WO 99/61424号;Pande ,国際公開番号WO 00/23067号;Bellioti,国際公開番号WO 00/31020号;Bryans et al.,国際公開番号WO 00/50027号及びBryans et al.,国際公開番号WO 02/00209号)。当該技術分野において記載された既知の手順(上記の参考文献を参照すること)を利用して、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を用いて、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、ヘルペス後の神経痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状を治療又は予防してもよい。
【0034】
てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、ヘルペス後の神経痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状の治療又は予防における本明細書で開示される化合物の効果が、親の薬剤分子(ガバペンチン又はその他のGABAアナログなど)の効果よりも強いかもしれない。というのは、開示された化合物は、血中治療濃度に到達するのにほとんど時間を要さないかもしれないからである。すなわち、経口投与の場合、本明細書で開示されるこの化合物のtmaxがガバペンチンよりも短いからである。理論に拘束されるつもりは無いが、本明細書で開示される化合物は、ガバペンチン及びその他の公知のGABAアナログが吸収されるメカニズムとは異なるメカニズムによって胃腸の内腔から血液に吸収されると考えられる。例えば、ガバペンチンは、ヒトの小腸に局在化するキャリア輸送体によって消化管の壁を横切る活発な輸送体であると考えられる。ガバペンチン輸送体は容易に飽和する。このことは、血液内に吸収されるガバペンチンの量は、経口投与されたガバペンチンの量には比例しないことを意味する。というのは、輸送メカニズムが一旦飽和すれば、ガバペンチンのさらなる吸収が任意の有意な程度にまでは生じないからである。ガバペンチンと比較して、本明細書に開示された化合物は、結腸を含む消化管の大部分に渡って、消化間の壁を横切って吸収される。
【0035】
本明細書に開示された化合物を、数時間にわたり維持された胃腸管内での放出、特に大腸内での放出を与える徐放製剤に剤形することができるので、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸は、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、ヘルペス後の神経痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状の治療又は予防において、ガバペンチンよりも有効であってもよい。徐放性の経口用の剤形で用いられる、本明細書に開示される化合物の能力によって、血中の治療有効薬剤濃度を維持するために必要な投与頻度が減少する。
【0036】
5.4 投与方法
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、ヒトの医学において有利に用いることができる。前述のように、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物は、てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、ヘルペス後の神経痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状の治療又は予防に有用である。
【0037】
上記の疾患又は障害を治療又は予防するために用いる場合、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を単独で投与、又はその他の薬剤と組み合わせて投与することができる。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を単独で投与、又はその他のGABAアナログを含む医薬として活性な成分と組み合わせて投与してもよい。
【0038】
治療方法及び予防方法は、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の治療有効量を患者に投与することによって提供される。この患者は動物であってよく、より好ましくは哺乳動物であり、最も好ましくはヒトである。
【0039】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を経口投与することが好ましい。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、その他の任意の都合のよい経路、例えば輸液又は静脈内ボーラスによって、上皮の内層又は皮膚と粘膜の内層(例えば口腔粘膜、直腸粘膜及び腸粘膜など)を経由する吸収によって投与してもよい。投与は全身的でも又は局所的でも可能である。種々の送達システム(例えばリポソーム、微粒子、マイクロカプセル、カプセル内へのカプセル封入など)が知られており、このことを用いて1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を投与することができる。投与方法としては、非限定的に皮内、筋肉内、腹膜内、静脈内、皮下、鼻腔内、硬膜外、経口、舌下、鼻腔内、大脳内、膣内、経皮、経直腸、吸入により、又は局所、特に耳、鼻、眼又は皮膚による投与が挙げられる。
【0040】
いくつかの実施態様においては、徐放性のシステムを経由して、好ましくは経口による徐放性のシステムを経由して、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物が送達され得る。一つの実施態様においては、ポンプを用いてもよい(Langer,上記;Sefton,1987,CRC Crit Ref.Biomed.Eng.14:201;Saudek et al.,1989,N.Engl.J.Med.321:574)。
【0041】
その他の実施態様においては、高分子材料を用いることができる(「Medical Applications of Controlled Release」,Langer and Wise(共著),CRC Pres.,Boca Raton,Florida(1974);「Controlled Drug Bioavailability」,Drug Product Design and Performance,Smolen and Ball(共著),Wiley,New York(1984);Langer et al.,1983,J.Macromol.Sci.Rev.Macromol.Chem.23:61;さらにLevy et al.,1985,Science 228:190;During et al.,1989,Ann.Neurol.25:351;Howard et al.,1989,J.Neurosurg.71:105を参照のこと)。さらにその他の実施態様においては、高分子材料を経口による徐放性の送達に用いられる。高分子としては、例えば、カルボキシメチルセルロースナトリウム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース及びヒドロキシエチルセルロース(好ましくはヒドロキシプロピルメチルセルロース)が挙げられる。その他のセルロースエーテルは記述されている(Alderman,Int.J.Pharm.Tech.and Prod.Mfr.1984,5(3)1-9)。薬剤の放出に影響を及ぼす因子は当業者にとって周知であり、当分野において記述されている(Bamba et al.,Int.J.Pharm.1979,2,307)。
【0042】
その他の実施態様においては、腸溶性製剤を経口による徐放性投与のために用いることができる。コーティング材料としては、例えば、pH依存性の溶解性を有する高分子(すなわちpHによりコントロールされる放出)、徐々に又はpHに依存して膨潤、溶解又は侵食する高分子(すなわち時間によりコントロールされる放出)、酵素によって分解される高分子(すなわち、酵素によりコントロールされる放出)及び圧力の上昇によって破壊される膜層を形成する高分子(すなわち圧力によりコントロールされる放出)が挙げられる。
【0043】
さらにその他の実施態様においては、浸透圧による送達システムが、経口による徐放性投与に用いられる(Verma et al.,Drug Dev.Ind.Pharm.2000,26 :695-708)。いくつかの実施態様においては、OROS(商標)浸透圧デバイスが、経口による徐放性の送達デバイスとして用いられる(Theeuwes et al.,米国特許第3,845,770号;Theeuwes et al.,米国特許第3,916,899号)。
【0044】
さらにその他の実施態様においては、徐放性システムを、標的の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の近傍に置くことが可能であり、その結果、全身的な投与の一部だけが必要となる(例えば、Goodson,in「Medical Applications of Controlled Release」,上記,vol.2,pp.115-138(1984))。Langer,1990,Science 249:1527-1533で検討されているその他の徐放性システムを用いてもよい。
【0045】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物は、患者にインビボで投与するときにガバペンチンを与えることが好ましい。理論に拘束されるつもりは無く、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形のプロモエティ及び/又はその医薬組成物は、化学的に及び/又は酵素的のいずれかで切断されうる。胃、腸の内腔、腸組織、血液、肝臓、脳又はその他の適切な任意の哺乳動物の組織に存在する一つ以上の酵素が、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形のプロモエティ及び/又はその医薬組成物を切断してもよい。切断のメカニズムは重要ではない。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形のプロモエティ及び/又はその医薬組成物から切断されることによって形成されるガバペンチンが、実質的な量のγ-ラクタムの汚染物を含まないことが好ましい(好ましくは、0.5重量%未満、より好ましくは0.2重量%未満、最も好ましくは0.1重量%未満)。ここでこの汚染物は、カルボキシの機能によるγアミノ基の分子内環化によって形成される。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物からのラクタム形成の程度を、標準的なインビトロ分析方法を用いて評価してもよい。
【0046】
理論に拘束されるつもりはないが、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形のプロモエティ及び/又はその医薬組成物を、消化管(例えば胃又は腸の内腔内)によって吸収される前に、及び/又は消化管によって吸収された後で(例えば腸の組織、血液、肝臓又は哺乳動物のその他の適切な組織において)切断してもよい。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形のプロモエティ及び/又はその医薬組成物を、消化管によって吸収される前に切断する場合、従来のようにガバペンチンは(例えば小腸に位置する大型中性アミノ酸輸送体を経由して)全身循環内に吸収されてもよい。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形のプロモエティ及び/又はその医薬組成物を、消化管による吸収の後に切断する場合、このGABAアナログのプロドラッグは、受動拡散、能動輸送又は受動的及び能動的プロセスの両者のいずれかによって全身循環に吸収されてもよい。
【0047】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形のプロモエティ及び/又はその医薬組成物を、消化管による吸収の後に切断する場合、このGABAアナログのプロドラッグが大腸から全身循環に吸収される機会が有ってもよい。この状態においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を徐放性のシステムとして投与することが好ましい。いくつかの実施態様においては、経口による徐放性の投与によって、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を送達する。好ましくは、これらの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、一日に二回(より好ましくは一日に一回)投与する。
【0048】
5.5 医薬組成物
本医薬組成物は、患者への適切な投与のための型を提供するために、医薬として許容され得る媒体の適切な量と共に、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の治療有効量を含む。患者に投与する場合、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び医薬として許容され得る媒体を滅菌することが好ましい。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を静脈内に投与する場合、水は好ましい媒体である。食塩水及びデキストロース水溶液及びグリセロール溶液を、特に注射可能な溶液用の液体の媒体として用いることもできる。適切な医薬媒体としては、デンプン、グルコース、ラクトース、スクロース、ゼラチン、麦芽、米、小麦粉、石灰粉、シリカゲル、ステアリン酸ナトリウム、モノステアリン酸グリセリン、タルク、塩化ナトリウム、脱脂粉乳、グリセロール、プロピレン、グリコール、水、エタノールなどの賦形剤も挙げられる。必要に応じて、本組成物は少量の湿潤剤若しくは乳化剤又はpH緩衝剤を含むこともできる。さらに、助剤、安定化剤、増粘剤、潤滑剤及び着色剤を用いてもよい。
【0049】
いくつかの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の医薬組成物は、分子内環化によって形成される副産物のラクタムを含んでいない。その他の実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の医薬組成物は安定しており、実質的にラクタムの形成を伴うことなく(好ましくはラクタムが0.5重量%未満、より好ましくはラクタムが0.2重量%未満、最も好ましくはラクタムが0.1重量%未満)、貯蔵期間が(好ましくは一年以上)延長される。
【0050】
従来の混合方法、溶解方法、造粒方法、糖衣錠作製方法、溶離方法、乳化方法、カプセル封入方法、封入方法又は凍結乾燥方法を利用して、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を含む医薬組成物を製造してもよい。一つ以上の生理的に許容される担体、希釈剤、賦形剤又は助剤を用いる従来の方法で、医薬組成物を製剤化してもよく、これらを用いることで、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を医薬として用いることができる製剤に円滑に加工することができる。適切な製剤化は、選択される投与経路に左右される。
【0051】
本医薬組成物は、溶液、懸濁液、乳濁液、錠剤、ピル、ペレット、カプセル、液体を含むカプセル、粉末、徐放性の製剤、坐薬、エマルジョン、エアロゾル、スプレー、懸濁液の形態又は使用に適するその他の任意の形態をとることができる。いくつかの実施態様においては、医薬として許容され得る媒体はカプセルである(例えば、Grosswald et al.,米国特許第5,698,155号)。薬学上の適切な媒体のその他の例は、当分野において既述されている(Remington’s Pharmaceutical Sciences,Philadelphia College of Pharmacy and Science,19th Edition,1995を参照のこと)。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形の組成物を、経口による送達用に、特に経口による徐放性投与用に製剤化することが好ましい。
【0052】
経口による送達のための医薬組成物は、例えば、錠剤、ロゼンジ、水性若しくは油性の懸濁液、顆粒、粉末、乳濁剤、カプセル、シロップ又はエリキシル剤の形態であってよい。経口によって投与される組成物は、医薬として口当たりの良い製剤を供給するために、一以上の任意の薬剤、例えばフルクトース、アルパルテーム又はサッカリンなどの甘味料、ペパーミント、ウィンター・グリーン油などの香料又はサクラの着色剤及び保存剤を含んでもよい。さらに、錠剤又はピルの形態において、医薬組成物をコーティングして、消化管における崩壊及び吸収を遅延させてもよい。それによって、長時間に亘る作用の持続性を提供する。浸透圧活性をドライブする化合物の周囲の選択的な浸透性を示す膜は、本明細書に開示された化合物及び組成物を経口により投与することにも適している。これらの後者のプラットホームにおいては、カプセルの周囲の環境からの液体は、ドライブする化合物によって吸収される。このことによって膨潤し、隙間を経由して薬剤又は薬剤組成物と置き換わる。これらの送達用のプラットホームによって、即時放出性の製剤のスパイクされたプロファイルとは対照的に、本質的に0次の送達プロファイルを提供することができる。モノステアリン酸グリセリン又はステアリン酸グリセリンなどの時間遅延性物質を用いることもできる。経口用の組成物は、マンニトール、ラクトース、デンプン、ステアリン酸マグネシウム、サッカリンナトリウム、セルロース、炭酸マグネシウムなどの標準的な媒体を含むことができる。このような媒体は医薬用のグレードであることが好ましい。
【0053】
例えば懸濁液、エリキシル剤及び溶液などの経口用の液体製剤に適切な担体、賦形剤又は希釈剤としては、水、生理食塩水、アルキレングリコール(例えばプロピレングリコール)、ポリアルキレングリコール(例えばポリエチレングリコール)、油、アルコール、pH4〜pH6の間の弱酸性の緩衝液(例えば約5mM〜約50mMの間の酢酸塩、クエン酸塩、アスコルビン酸塩)などが挙げられる。さらに、香味料、保存剤、着色料、胆汁酸塩、アシルカルニチンなどを加えてもよい。
【0054】
その他の経路を経由する投与用医薬組成物を検討してもよい。舌下投与のためには、組成物の形態は、従来のやり方で製剤される錠剤、トローチ剤などでもよい。噴霧器及び液体噴霧装置及びEHDエアロゾル装置と共に使用することに適した液体の薬剤の製剤は、医薬として許容され得る媒体を伴う1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形が典型的に挙げられるだろう。好ましくは、医薬として許容され得る媒体が、アルコール、水、ポリエチレングリコール又はパーフルオロカーボンなどの液体である。必要に応じて、別の物質を添加して、本明細書に開示された化合物の溶液又は懸濁液を添加してエアロゾルの特質を改変してもよい。好ましくは、この物質は、アルコール、グリコール、ポリグリコール又は脂肪酸などの液体である。エアロゾル装置での使用に適した液体薬剤の溶液又は懸濁液を製剤化するその他の方法は、当業者にとっては公知である(例えば、Biesalski,米国特許第5,112,598号;Biesalski,米国特許第5,556,611号を参照のこと)。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を、カカオバター又はその他のグリセリドなどの従来の坐薬用の基剤などを含む坐薬又は滞留性の浣腸剤などの直腸用又は膣用組成物に製剤化してもよい。前述の製剤化に加えて、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形をデポー製剤に剤形してもよい。このような長期に亘って作用する製剤を、移植によって(例えば、皮下又は筋肉内に)投与してもよく、又は筋肉内注射によって投与してもよい。従って、例えば、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を、適切な高分子材料又は(例えば、油に許容されるエマルジョンとして)疎水性物質又はイオン交換樹脂と共に製剤化してもよく、又はやや溶解しにくい誘導体として、例えばやや溶解しにくい塩として製剤化してもよい。
【0055】
いくつかの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を、純粋な有効成分として製剤化する。その他の実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸のその他の結晶形を有する混合物として製剤化する。
【0056】
5.6 用量
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物は、一般的には意図する目的を達成するために有効な量を用いることになる。てんかん、疼痛(特に神経痛及び筋肉痛及び骨格痛)、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患(すなわち関節炎)、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状などの疾患又は障害を治療又は予防に用いるために、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を治療有効量で投与又は適用する。
【0057】
本明細書で開示される特定の障害又は状態を治療することに有効となる、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の量は、障害又は状態の性質に依存することになる。そして前述のような当分野において公知の標準的な臨床技術によってそれを決定することができる。さらに、必要に応じてインビトロ又はインビボでの評価を適用して、最適な用量の範囲の特定を支援してもよい。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の用量は、当然のことながら、その他の因子、治療される対象、対象の体重、苦痛の重症度、投与方法及び処方する医師の判断に依存する。
【0058】
例えば、単回投与によって、複数回投与又は徐放性投与によって、医薬組成物における用量を送達してもよい。いくつかの実施態様においては、経口による徐放性投与によって、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を送達する。好ましくは、これらの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を一日に二回(より好ましくは一日に一回)投与する。投薬は断続的に繰り返してもよく、単独で又はその他の薬剤と共に与えてもよく、及び疾患の状態又は障害を効果的に治療する必要がある限り投薬を継続してもよい。
【0059】
いくつかの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の用量を、(約260mg/日〜約3600mg/日のガバペンチンに相当する)約500mg/日〜約7000mg/日のプロドラッグを与えるように調節してもよい。用量の範囲は、当業者が公知の方法によって容易に決定することができる。
【0060】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の所望の治療活性及び予防活性について、ヒトに用いる前に、インビトロ及びインビボで評価することが好ましい。好ましくは、本明細書に記載の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の治療有効量を投与することによって、毒性を実質的に生じさせることなく、治療上の利益が与えられる。標準的な薬学上の手順を用いて、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の毒性を求めることができ、そして当業者によって容易に確定される。毒性効果及び治療効果の間の用量の比率が、治療指数である。本明細書に記載の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物の用量は、ほとんど又は全く毒性を示さない有効用量を含む循環する濃度の範囲内にあることが好ましい。
【0061】
5.7 併用療法
特定の実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物を、少なくとも一つの治療剤と共に、併用療法で用いることができる。1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形及び/又はその医薬組成物ならびにその他の治療剤は、相加的に作用することができ、より好ましくは相乗的に作用できる。いくつかの実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を含む医薬組成物を、別の治療剤と共に同時に投与する。ここで、この別の治療剤は1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形と同一の医薬組成物の一部でもよく、又は異なる医薬組成物でもよい。その他の実施態様においては、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を含む医薬組成物を、別の治療剤の投与の前に、又はその後に投与する。例えば、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶形を、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の非晶形、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の別の結晶形、ガバペンチン又はプレガバリンと組み合わせて投与してもよい。
【0062】
6.実施例
次の実施例では、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸及びその結晶形の製法について詳細に記載する。本発明の範囲から逸脱することなく、材料及び方法の両者についての多数の改変物を用いてもよいことは、当業者にとって自明である。
【0063】
下記の実施例において、次の略語は次の意味を有する。略語が定義されていない場合、一般的に許容されている意味が適用される。
Atm=気圧
Boc=tert-ブチルオキシカルボニル
Cbz=カルボベンジルオキシ
DCC=ジシクロヘキシルカルボジイミド
DMAP=4-N,N-ジメチルアミノピリジン
DMF=N,N-ジメチルホルムアミド
DMSO=ジメチルスルホキシド
Fmoc=9-フルオレニルメチルオキシカルボニル
g=グラム
h=時間
HPLC=高圧液体クロマトグラフィー
L=リットル
LC/MS=液体クロマトグラフィー/質量分析
M=モル濃度
min=分間
mL=ミリリットル
mmol=ミリモル
NHS=N-ヒドロキシスクシンイミド
THF=テトラヒドロフラン
TFA=トリフルオロ酢酸
TLC=薄層クロマトグラフィー
TMS=トリメチルシリル
μL=マイクロリットル
μM=マイクロモル濃度
v/v=体積対体積
【実施例】
【0064】
6.1実施例1:トリメチルシリルエステル中間体を経由する1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸
ステップA:1-{[(α-クロロエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸
ジクロロメタン(1.6L)が入った5リットルの三つ首丸底フラスコに、ガバペンチン(120.4g、0.704mol)、次いでトリエチルアミン(294mL、2.11mol)を添加した。反応温度を15℃未満に維持している間に、クロロトリメチルシラン(178mL、1.40mol)をゆっくりと添加し、得られた懸濁液を30分間撹拌した。次いで、温度を15℃未満に維持している間に、1-クロロエチルクロロホルメート(100g、0.704mol)をゆっくりと添加した。添加を終えた後、追加のトリエチルアミン(88mL、0.63mol)を添加し、得られた懸濁液を室温で30分間撹拌した。反応混合物を水(2×1L)、次いで1NのHCl(2×2L)、次いで塩類溶液(2×500mL)で洗浄することによって、酸性を強めて、得られたシリルエステルを対応する酸に変換した。無水硫酸ナトリウムで乾燥させた後、減圧して溶媒を除去し、粗生産物(190g)をオレンジ色の油として得、そしてさらなる精製を行うことなくステップBで用いた。1HNMR(CDCl3,400MHz):δ1.41-1.57(m,10H),1.78(d,3H),2.33(s,2H),3.27(d,2H),5.42(br.s,1H),6.55(q,1H)。
【0065】
ステップB:1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸
3リットルの三つ首丸底フラスコに、イソ酪酸(254g、2.9mol)、次いでトリエチルアミン(395mL、2.84mol)を添加した。この反応混合物を室温に冷却し、温度を30℃未満に維持している間に、上記の反応ステップから得た粗製酸(190g、0.69mol)を含むジクロロメタン(80ml)を制御された様式で添加した。得られる黄白色の溶液を一晩撹拌した。次いで、この反応混合物を一体積のジクロロメタンで希釈し、水(6×500mL)、炭酸水素カリウム水溶液(3×500mL)及び塩類溶液(2×500mL)で洗浄した。無水硫酸ナトリウムで乾燥させた後、減圧して溶媒を除去し、粗製産物を暗赤色の油(87g)として得た。この生産物の一部(35g)を800gのBiotage(商標)順相シリカゲルフラッシュカラム上にロードし、ヘキサン中の40%のジエチルエーテル(6L)で溶出し、そして減圧して溶媒の除去後に生産物を無色の油(13.5g)として得た。このことを粗生産物の第二の35gの部分について繰り返し、さらに13.5gの1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を得た。70℃のヘプタン(325mL)に溶解させ、次いでゆっくりと室温に冷却することによって、生産物(25g)のサンプルを再結晶化させた。この白色の結晶質の生産物(23g)をろ過によって単離した。融点:63〜64℃。
【0066】
6.2実施例2:アリルエステル中間体を経由する1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸
ステップA:アリル1-アミノメチル-1-シクロヘキサン酢酸の塩酸塩
磁気撹拌子及び500mLの加圧供給式漏斗を備えた3Lの感想三つ首丸底フラッシュを窒素ガスで置換した。このフラスコにガバペンチン(171g、1.0mol)とアリルアルコール(1L、852g、14.6mol)とを入れ、混合物全体を氷水の槽で0℃に冷却した。1時間以上かけて、撹拌中の溶液に塩化チオニル(225mL、360g、3.0mol)を滴下した。この反応混合物を室温で16時間撹拌し、次いでエチルエーテル(2L)で希釈して撹拌しながら0℃に冷却した。数分後、白色の結晶が形成し、ろ過で集めた。エタノール及びエチルエーテルの1/3(v/v)の混合物(2L)から、この粗生産物を再結晶させて、白色の固体として生産物(220g、88%)を得た。融点:138〜142℃。1HNMR(CD3OD,400MHz):δ1.36-1.54(m,10H),2.57(s,2H),3.05(s,2H),4.61(d,J=6Hz,2H),5.22(dd,J1=10.4Hz,J2=1.2Hz,1H),5.33(dd,J1=17.2Hz,J2=1.4Hz,1H),5.90-6.00(m,1H)。MS(ESI)m/z212.0(M-Cl)+。
【0067】
ステップB:アリル1-{[(α-クロロエトキシ)カルボニル]アミノメチル}-1-シクロヘキサンアセテート
上記の塩酸塩(220g、0.89mol)を含むジクロロメタン溶液(1L)に、1-クロロエチルクロロホルマート(101.7mL、132.3g、0.92mol)をゆっくりと添加した。この反応混合物を0℃に冷却し、温度を10℃未満に維持している間に、4-メチルモルホリン(205mL、188.9g、1.87mol)を1時間かけてゆっくりと添加した。得られる濁った溶液を室温で1時間撹拌した。エタノール(150mL)を添加し、この反応混合物を室温で1時間撹拌した。次いで、この反応混合物をエーテル(2.5L)で希釈し、水(1L)及び塩類溶液(1L)で洗浄した。有機相を硫酸ナトリウムで乾燥させ、濃縮して標記の化合物を淡黄色の粘稠な液体(282g、100%)として得た。1HNMR(CDCl3,400MHz):δ1.35-1.58(m,10H),1.78(d,J=5.6Hz,3H),2.32(s,2H),3.22(d,J=6.8Hz,2H),4.57(d,J=5.6Hz,2H),5.25(dd,J1=10.4Hz,J2=1Hz,1H),5.32(dd,J1=17.2Hz,J2=1.6Hz,1H),5.52(br,1H,NH),5.90-5.94(m,1H),6.54(q,J=5.6Hz,1H)。
【0068】
ステップC:アリル1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサンアセテート
イソ酪酸(432mL,391.5g,4.4mol)及び4-メチルモルフォリン(488mL,449g,4.4mol)の混合物に、前ステップからのクロロカルバマート(282g,0.88mol)のイソ酪酸(432mL,391.5g,4.4mol)溶液を添加した。この添加は、0℃にて30分間かけて行った。得られる濁った溶液を室温で16時間撹拌した。この反応混合物をエーテル(2.5L)で希釈し、そして水(3×500mL)、次いで10%の炭酸水素カリウム水溶液(6×500mL)、次いで塩類溶液(500mL)で洗浄した。有機相を硫酸ナトリウムで乾燥させ、濃縮して標記の化合物を粘稠な液体として得た(328g、100%)。1HNMR(CDCl3,400MHz):δ1.15(d,J=7.2Hz,6H),1.35-1.58(m,10H),2.31(s,2H),2.51(m,1H),3.19(d,J=5.6Hz,2H),4.56(d,J=5.6Hz,2H),5.24(dd,J1=10Hz,J2=1Hz,1H),5.32(dd,J1=17Hz,J2=1.2Hz,1H),5.35(br,1H),5.84-5.94(m,1H),6.78(q,J=5.6Hz,1H)。MS(ESI)m/z392.24(M+H)+。
【0069】
ステップD:アリル1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサンアセテートの脱保護
撹拌中のギ酸アンモニウム(112g,1.7mol)のエタノール(500mL)懸濁液に、10%のPd/C(15g)と共に上記のアリルエステル(328g、0.88mol)を窒素雰囲気下で添加した。6時間後、触媒をろ別することによって、この反応混合物を得た。この触媒をエタノール(2×250mL)で洗浄し、ろ液を一つにまとめて蒸発させた。この粗生産物をエーテル(2L)に溶解させ、有機相を2NのHCl(2×2L)で洗浄してアンモニウム塩を酸型に変換し、次いで水(1L)及び塩類溶液(1L)で洗浄した。エーテル層を硫酸ナトリウムで乾燥させて濃縮し、粗生産物を粘稠な液体(240g,82%)として得た。
【0070】
ステップE:1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶化
3Lの丸底フラスコに、加熱用の油浴、窒素注入用アダプター、内部の温度計、上部の機械撹拌子及び還流冷却器を設置した。このフラスコを窒素で置換し、そして酢酸エチル/ヘプタンの1/10(v/v)の混合液(1.2L)と前の反応からの粗生産物(240g)とを入れた。この生産物が溶解するまでフラスコを加熱し、次いで次のスケジュールに従って冷却した。
【0071】
【表1】

【0072】
次いで、このフラスコを撹拌しながら一晩かけて4℃に冷却した(冷却によって収率が改善する)。この生産物をろ過し、ヘプタン(2×100mL)で洗浄し、次いで18時間かけて減圧下(25mmの水銀(0.033atm))で乾燥させて、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸(185g)を白色の結晶質の固体として得た。
【0073】
6.3実施例3:結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸のX線粉末回折分析
上記の実施例1及び2に従って生産された1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶質のサンプルの粉末X線回折図(XRPD’s)を、Cu Kα放射線を利用したBruker D8 Discover X線粉末回折装置で測定した。この装置は、平行ビーム・オプティクス及び二次元HI-STAR領域検出器を具備している。管の電圧及び電流をそれぞれ40kV及び40mAに設定した。平行X線ビームを直径約0.5mmのスポットサイズに縮小した。領域検出器をゴニオメータの中心から15cmの位置に設置し、角分解能をピクセル当たり約0.033°とする。この検出器は、一フレーム内において2-シータ(2θ)で35°の範囲を対象とした。X線ビームとサンプルプレートの横軸との間の角度を4°に設定し、エリア・デテクターの中心を18°の角度に設定した。この幾何学によって、一フレーム内の4.5°〜39.5°の2-シータの測定が可能になった。集められたそれぞれのXRPDのパターンについての典型的な平均時間は3分間であった。コランダムのサンプル(NIST 1976)を用いて、このXRPD装置を較正した。両方のサンプルは、図1に図解されるような同等の回折図のパターンを与えた。
【0074】
6.4実施例4:結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の融点及び示差走査熱量測定の分析
上記の実施例1及び2に従って生産された1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶質のサンプルの融点を、Electrothermal 9200融点装置を用いて測定し、63〜64℃と決定した。
【0075】
上記の実施例1及び2に従って生産された1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶質のサンプルの示差走査熱量測定(DSC)分析を、Perkin Elmer Series 7装置を用いて、5℃/分のスキャン速度で25℃から250℃までスキャンして測定した。サンプルのテスト部分をアルミニウムの皿と蓋との中に置き、蓋と皿との間の目に見えるあらゆる継ぎ目を無視するために圧着した。空の皿を同様に用意してブランクとした。この皿を示差走査熱量測定計内に置いた。この材料について、適切な温度プログラム(初期の温度での平衡化、等温、ランプレート、最終温度)を実行し、図2に示される温度記録図を得た。DSC分析から、58.3℃の開始温度及び72.39J/gのΔHを伴う吸熱転移が示された。63〜64℃の吸熱のピークにおいて、このサンプルの融解が目視できた。
【0076】
6.5実施例5:{[(1-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸
ガバペンチン(6.8g、0.04mol)の水溶液(40mL)に、[(1-イソブタノイルオキシエトキシ)カルボニルオキシ]スクシンイミド(10g、0.036mol)のアセトニトリル溶液(40mL)を、30分間かけて添加した。この反応を室温で3時間撹拌した。この反応混合物をメチルtert-ブチルエーテル(200mL)で希釈し、水(2×100mL)及び塩類溶液(50mL)で洗浄した。有機相を分離し、無水硫酸ナトリウムで乾燥させてろ過し、そして減圧下で濃縮して標記の化合物を白色の固体(12g、定量的)として得た。
【0077】
結晶化:固形の化合物(12g)を、メチルシクロヘキサン:メチルtert-ブチルエーテルの10:1(60mL)に懸濁させた。この懸濁液をゆっくりと30分間以上かけて、50℃まで加熱した。次いで、透明な溶液を室温に冷却した。濁った混合物に、5mgの標記の化合物の結晶形を種として入れた。さらに、混合物を2時間0〜4℃に冷却した。固形の生産物をろ過し、メチルシクロヘキサン(2×10mL)で洗浄して標記の化合物を白色の結晶質の固体(10g、83%の収率)として得た。結晶質の固体物質は、オープンキャピラリー融点測定法によって測定されるように、約64〜66℃の融点を有していた。
【0078】
最後に、本発明を実施するための別の方法が存在することを留意すべきである。従って、本実施態様は例証とみなされるべきであり、制限的なものではない。そして本発明は、本明細書に示された詳細な事項に制限されるわけではないが、本明細書に由来する任意の単数(又は複数)の請求項の範囲及び均等物の範囲内で改変してもよい。本明細書に列挙された全ての刊行物及び特許は、その全体が参照によって組み込まれる。
【図面の簡単な説明】
【0079】
【図1】結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の粉末X線回折図を示す。
【図2】結晶質の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の示差走査熱量測定の温度記録図を示す。
【特許請求の範囲】
【請求項1】
Cu Kα放射線を用いた粉末X線回折図において、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、及び16.4°±0.3°の位置に特徴的な吸収ピークを有する1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶を含む、粉末、懸濁物、錠剤、ピル又はペレットの形態の医薬組成物。
【請求項2】
前記1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、5℃/分のスキャン速度での示差走査熱量測定により測定した場合に63℃〜64℃の融点範囲を有する、請求項1に記載の医薬組成物。
【請求項3】
前記1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、オープンキャピラリー融点測定により測定した場合に64℃〜66℃の融点範囲を有する、請求項2に記載の医薬組成物。
【請求項4】
治療を必要とする患者におけるてんかん、疼痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状の治療又は予防のための医薬組成物であって、有効量の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶を含む、請求項1に記載の医薬組成物。
【請求項5】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、5℃/分のスキャン速度での示差走査熱量測定により測定した場合に63℃〜64℃の融点範囲を有する、請求項4に記載の医薬組成物。
【請求項6】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、オープンキャピラリー融点測定により測定した場合に64℃〜66℃の融点範囲を有する、請求項4に記載の医薬組成物。
【請求項7】
治療を必要とする患者における神経痛、筋肉痛、骨格痛又は関節炎の治療又は予防のための医薬組成物であって、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶の治療有効量を含む、請求項1に記載の組成物。
【請求項8】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、5℃/分のスキャン速度での示差走査熱量測定により測定した場合に63℃〜64℃の融点範囲を有する、請求項7に記載の医薬組成物。
【請求項9】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、オープンキャピラリー融点測定により測定した場合に64℃〜66℃の融点範囲を有する、請求項7に記載の医薬組成物。
【請求項10】
治療を必要とする患者における神経痛の治療又は予防のための医薬組成物であって、治療有効量の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶を含む、請求項1に記載の医薬組成物。
【請求項11】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、5℃/分のスキャン速度での示差走査熱量測定により測定した場合に63℃〜64℃の融点範囲を有する、請求項10に記載の医薬組成物。
【請求項12】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、オープンキャピラリー融点測定により測定した場合に64℃〜66℃の融点範囲を有する、請求項10に記載の医薬組成物。
【請求項13】
治療を必要とする患者におけるてんかん、疼痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状の治療又は予防のための医薬組成物であって、請求項1に記載の医薬組成物の治療有効量を含む、前記組成物。
【請求項14】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、5℃/分のスキャン速度での示差走査熱量測定により測定した場合に63℃〜64℃の融点範囲を有する、請求項13に記載の医薬組成物。
【請求項15】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、オープンキャピラリー融点測定により測定した場合に64℃〜66℃の融点範囲を有する、請求項13に記載の医薬組成物。
【請求項16】
治療を必要とする患者における神経痛、筋肉痛、骨格痛又は関節炎の治療又は予防のための医薬組成物であって、治療有効量の請求項1に記載の医薬組成物を含む、前記組成物。
【請求項17】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、5℃/分のスキャン速度での示差走査熱量測定により測定した場合に63℃〜64℃の融点範囲を有する、請求項16に記載の医薬組成物。
【請求項18】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、オープンキャピラリー融点測定により測定した場合に64℃〜66℃の融点範囲を有する、請求項16に記載の医薬組成物。
【請求項19】
治療を必要とする患者における神経痛の治療又は予防のための医薬組成物であって、治療有効量の請求項1に記載の医薬組成物を含む、前記組成物。
【請求項20】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、5℃/分のスキャン速度での示差走査熱量測定により測定した場合に63℃〜64℃の融点範囲を有する、請求項19に記載の医薬組成物。
【請求項21】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、オープンキャピラリー融点測定により測定した場合に64℃〜66℃の融点範囲を有する、請求項19に記載の医薬組成物。
【請求項22】
Cu Kα放射線を用いた粉末X線回折図において、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、及び16.4°±0.3°の位置に特徴的な吸収ピークを有する1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶、及び医薬として許容される固体のビヒクルを含む、医薬組成物。
【請求項23】
カプセルをさらに含む、請求項1又は22に記載の医薬組成物。
【請求項24】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶の製造方法であって、以下の:
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の種結晶と、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の溶液を混合して混合物を形成し;そして
当該混合物から1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶を取得する
を含む、前記方法。
【請求項25】
高い温度で1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を1の溶媒又は溶媒の組み合わせ中に溶解することにより、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の溶液を形成することをさらに含む、請求項24に記載の方法。
【請求項26】
前記溶媒混合物が、メチルシクロヘキサンとメチルtert−ブチルエーテルを含む、請求項25に記載の方法。
【請求項27】
前記溶媒混合物が、10:1メチルシクロヘキサン:メチルtert−ブチルエーテルを含む、請求項26に記載の方法。
【請求項28】
前記溶液が0〜25℃の温度に冷却される、請求項24〜27のいずれか一項に記載の前記方法。
【請求項29】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶の製造方法であって、
メチルシクロヘキサンとメチルtert-ブチルエーテルの混合物である溶媒中で1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を加熱して溶液を与え;そして
その溶液の温度を変化させることを含み、ここで当該加熱温度が50℃である、前記方法。
【請求項30】
前記溶媒中の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の濃度が0.1g/mL〜0.25g/mLである、請求項29に記載の方法。
【請求項31】
前記溶液を0℃〜25℃に冷却することによって、当該溶液の温度を変化させるものである、請求項30に記載の方法。
【請求項1】
Cu Kα放射線を用いた粉末X線回折図において、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、及び16.4°±0.3°の位置に特徴的な吸収ピークを有する1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶を含む、粉末、懸濁物、錠剤、ピル又はペレットの形態の医薬組成物。
【請求項2】
前記1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、5℃/分のスキャン速度での示差走査熱量測定により測定した場合に63℃〜64℃の融点範囲を有する、請求項1に記載の医薬組成物。
【請求項3】
前記1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、オープンキャピラリー融点測定により測定した場合に64℃〜66℃の融点範囲を有する、請求項2に記載の医薬組成物。
【請求項4】
治療を必要とする患者におけるてんかん、疼痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状の治療又は予防のための医薬組成物であって、有効量の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶を含む、請求項1に記載の医薬組成物。
【請求項5】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、5℃/分のスキャン速度での示差走査熱量測定により測定した場合に63℃〜64℃の融点範囲を有する、請求項4に記載の医薬組成物。
【請求項6】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、オープンキャピラリー融点測定により測定した場合に64℃〜66℃の融点範囲を有する、請求項4に記載の医薬組成物。
【請求項7】
治療を必要とする患者における神経痛、筋肉痛、骨格痛又は関節炎の治療又は予防のための医薬組成物であって、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶の治療有効量を含む、請求項1に記載の組成物。
【請求項8】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、5℃/分のスキャン速度での示差走査熱量測定により測定した場合に63℃〜64℃の融点範囲を有する、請求項7に記載の医薬組成物。
【請求項9】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、オープンキャピラリー融点測定により測定した場合に64℃〜66℃の融点範囲を有する、請求項7に記載の医薬組成物。
【請求項10】
治療を必要とする患者における神経痛の治療又は予防のための医薬組成物であって、治療有効量の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶を含む、請求項1に記載の医薬組成物。
【請求項11】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、5℃/分のスキャン速度での示差走査熱量測定により測定した場合に63℃〜64℃の融点範囲を有する、請求項10に記載の医薬組成物。
【請求項12】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、オープンキャピラリー融点測定により測定した場合に64℃〜66℃の融点範囲を有する、請求項10に記載の医薬組成物。
【請求項13】
治療を必要とする患者におけるてんかん、疼痛、うつ病、不安症、精神疾患、脱力発作、運動機能低下症、頭蓋障害、神経変性疾患、パニック、炎症性疾患、不眠症、胃腸疾患、ほてり、下肢静止不能症候群、尿失禁又はエタノールの禁断症状の治療又は予防のための医薬組成物であって、請求項1に記載の医薬組成物の治療有効量を含む、前記組成物。
【請求項14】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、5℃/分のスキャン速度での示差走査熱量測定により測定した場合に63℃〜64℃の融点範囲を有する、請求項13に記載の医薬組成物。
【請求項15】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、オープンキャピラリー融点測定により測定した場合に64℃〜66℃の融点範囲を有する、請求項13に記載の医薬組成物。
【請求項16】
治療を必要とする患者における神経痛、筋肉痛、骨格痛又は関節炎の治療又は予防のための医薬組成物であって、治療有効量の請求項1に記載の医薬組成物を含む、前記組成物。
【請求項17】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、5℃/分のスキャン速度での示差走査熱量測定により測定した場合に63℃〜64℃の融点範囲を有する、請求項16に記載の医薬組成物。
【請求項18】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、オープンキャピラリー融点測定により測定した場合に64℃〜66℃の融点範囲を有する、請求項16に記載の医薬組成物。
【請求項19】
治療を必要とする患者における神経痛の治療又は予防のための医薬組成物であって、治療有効量の請求項1に記載の医薬組成物を含む、前記組成物。
【請求項20】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、5℃/分のスキャン速度での示差走査熱量測定により測定した場合に63℃〜64℃の融点範囲を有する、請求項19に記載の医薬組成物。
【請求項21】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶が、オープンキャピラリー融点測定により測定した場合に64℃〜66℃の融点範囲を有する、請求項19に記載の医薬組成物。
【請求項22】
Cu Kα放射線を用いた粉末X線回折図において、7.0°±0.3°、8.2°±0.3°、10.5°±0.3°、12.8°±0.3°、14.9°±0.3°、及び16.4°±0.3°の位置に特徴的な吸収ピークを有する1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶、及び医薬として許容される固体のビヒクルを含む、医薬組成物。
【請求項23】
カプセルをさらに含む、請求項1又は22に記載の医薬組成物。
【請求項24】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶の製造方法であって、以下の:
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の種結晶と、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の溶液を混合して混合物を形成し;そして
当該混合物から1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶を取得する
を含む、前記方法。
【請求項25】
高い温度で1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を1の溶媒又は溶媒の組み合わせ中に溶解することにより、1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の溶液を形成することをさらに含む、請求項24に記載の方法。
【請求項26】
前記溶媒混合物が、メチルシクロヘキサンとメチルtert−ブチルエーテルを含む、請求項25に記載の方法。
【請求項27】
前記溶媒混合物が、10:1メチルシクロヘキサン:メチルtert−ブチルエーテルを含む、請求項26に記載の方法。
【請求項28】
前記溶液が0〜25℃の温度に冷却される、請求項24〜27のいずれか一項に記載の前記方法。
【請求項29】
1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の結晶の製造方法であって、
メチルシクロヘキサンとメチルtert-ブチルエーテルの混合物である溶媒中で1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸を加熱して溶液を与え;そして
その溶液の温度を変化させることを含み、ここで当該加熱温度が50℃である、前記方法。
【請求項30】
前記溶媒中の1-{[(α-イソブタノイルオキシエトキシ)カルボニル]アミノメチル}-1-シクロヘキサン酢酸の濃度が0.1g/mL〜0.25g/mLである、請求項29に記載の方法。
【請求項31】
前記溶液を0℃〜25℃に冷却することによって、当該溶液の温度を変化させるものである、請求項30に記載の方法。
【図1】


【図2】




【図2】


【公開番号】特開2009−149648(P2009−149648A)
【公開日】平成21年7月9日(2009.7.9)
【国際特許分類】
【出願番号】特願2008−325914(P2008−325914)
【出願日】平成20年12月22日(2008.12.22)
【分割の表示】特願2006−535673(P2006−535673)の分割
【原出願日】平成16年10月14日(2004.10.14)
【出願人】(503455503)ゼノポート,インコーポレイティド (22)
【Fターム(参考)】
【公開日】平成21年7月9日(2009.7.9)
【国際特許分類】
【出願日】平成20年12月22日(2008.12.22)
【分割の表示】特願2006−535673(P2006−535673)の分割
【原出願日】平成16年10月14日(2004.10.14)
【出願人】(503455503)ゼノポート,インコーポレイティド (22)
【Fターム(参考)】
[ Back to top ]

