π共役型電気化学活性非天然ヌクレオシドを用いる相補鎖核酸分子配列検出方法及びSNP検出方法
【課題】完全相補鎖とSNPとの間で非常に大きな電気化学応答の差として現れ、ほぼデジタル的なon/off応答が得られるような新たなDNAプローブ、及び該プロ−ブを用いる相補鎖核酸分子配列検出方法並びにSNP検出方法を提供すること。
【解決手段】π電子が共役可能なスペーサーを介して結合した電気化学活性部位と核酸塩基から構成される非天然ヌクレオシド又はそのホスホロアミダイト誘導体、それを含むDNAプローブ。
【解決手段】π電子が共役可能なスペーサーを介して結合した電気化学活性部位と核酸塩基から構成される非天然ヌクレオシド又はそのホスホロアミダイト誘導体、それを含むDNAプローブ。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、相補鎖DNA配列検出用及びSNP検出用に使用することができる分子ビーコン(DNAプローブ)、並びに、該分子ビーコンを使用する相補鎖核酸分子配列(二重鎖核酸分子配列の相補性)検出方法及びSNP検出方法等に関する。
【背景技術】
【0002】
DNAチップ等での相補鎖DNA配列の検出は、相補鎖と非相補鎖とのプローブDNAに対するハイブリダイゼーションの熱力学的な安定性に基づいている。しかしながら一定以上の長さを有するDNAの場合、完全相補鎖と1塩基だけがミスマッチの相補鎖(SNP)をハイブリダイゼーションの安定性のみに基づいて厳密に区別することは難しい。蛍光ラベル化されたDNAと酵素を組み合わせてSNPを検出する方法としてはTaqManPCR法(非特許文献1)やlnvader法(非特許文献2)が確立されているが、マルチプレツクス反応(一度の操作で数種類のSNPをタイピング)には対応できない。
【0003】
又、より直接的にはMALDl-TOF/MS法で直接分子量からSNPを検出する方法(非特許文献3)もあるが、高価な装置と煩雑な前処理が必要である。「ゲノムに基づくオーダー一メイド医症」を実現するためには膨大な個々人のSNPタイピングが必須であり、感度、精度、簡便さ、迅速性、安価さ等の点で満足いく検出方法は未だ確立されていない。
【0004】
1塩基でもミスマッチがあると、DNA内部のミスマッチ周辺の局所構造は大きくくずれ、その部位での核酸塩基対の重なり(π−スタッキング)は小さくなる。この差を利用して電気化学的に完全相補鎖とSNPとを区別する研究がこれまでにもなされている。このような電気化学検出は蛍光検出に比べて感度が高く、検出装置も安価であり、アレイ化及びチッブ化も容易な利点がある。電気化学的なSNP検出の代表的な例としては、SNPでは完全相補鎖に比べて挿入するインターカレーターが少ない、導電性が減少する、という現象を利用した、一塩基対間に挿入するインターカレーター分子に電気化学活性部位を連結した電気化学活性インターカレーターを用いるSNP検出方法(非特許文献4)がある。
【非特許文献1】Morris, T. et al., J. Clin. Microbiol. 1996, 34, 2933
【非特許文献2】Lyamicher, V. etal., Nat. Biotechnol. 1999, 17, 292
【非特許文献3】Haff, LA, et al.,Genome Res. 1997, 7, 378
【非特許文献4】Takenaka, S., etal., Talanta, 2002, 56, 829
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかしながらインターカレーターを用いる方法は、完全相補鎖とSNPとの電気化学信号の差が明瞭でない場合が多く、電気化学触媒反応との組み合わせを用いない限りSNPの検出法としての信頼性は必ずしも高くない。
【課題を解決するための手段】
【0006】
本発明者は、上記の課題を解決することを目的として鋭意、研究を行った。その結果、完全相補鎖とSNPとの間で非常に大きな電気化学応答の差として現れ、場合によってはほぼデジタル的なon/off応答が得られるような新たなDNAプローブを見出し、本発明を完成した。
【0007】
即ち、本発明は、π電子が共役可能なスペーサーを介して結合した電気化学活性部位(酸化還元部位)と核酸塩基から構成される非天然ヌクレオシド又はそのホスホロアミダイト誘導体、及び、該非天然ヌクレオシドを含むDNAプローブに係る。
【0008】
本発明は更に、本発明のDNAプローブを用いて二重鎖核酸分子配列の相補性を検出する方法に係る。本発明方法によって得られる導電性の差に基づき、被検オリゴヌクレオチド配列に含まれているSNPを検出することが出来る。
【0009】
より具体的には、DNAプローブと被検オリゴヌクレオチドとをハイブリダイゼーションさせ、得られた二重鎖核酸分子を電極上に固定化し、固定化された二重鎖核酸分子の導電性を測定することから成る、二重鎖核酸分子配列の相補性を検出する方法、又は、該DNAプローブを電極上に固定化し、固定化されたDNAプローブと被検オリゴヌクレオチドとをハイブリダイゼーションさせ、固定化された二重鎖核酸分子の導電性を測定することから成る、二重鎖核酸分子配列の相補性を検出する方法、に係る。
【発明の効果】
【0010】
π電子共役型電気化学活性非天然ヌクレオシドを有する本発明のDNAプローブを用いた検出方法によって、完全相補鎖とSNPとをほぼデジタル的なon/off応答で電気化学的に識別することが可能となる。
【発明を実施するための最良の形態】
【0011】
本発明の「非天然ヌクレオシド」とは、天然のDNA又はRNA等を構成するヌクレオシド分子とは構造が異なるが、天然のヌクレオシド分子と同様にリン酸基を介して一本鎖オリゴヌクレオチドの一構成単位としてその末端に結合し、別の一本鎖オリゴヌクレオチドとハイブリダイゼーションすることが出来るような化合物を意味する。
【0012】
本発明の非天然ヌクレオシド又はそのホスホロアミダイト誘導体において、核酸塩基としては、検出鎖の核酸塩基と何らかの分子間相互作用が可能なπ電子もしくはπ軌道を有する分子である限り、当業者に公知の任意の構造を有するもので良く、天然型又は非天然型核酸塩基のいずれでもかまわない。
【0013】
非天然型核酸塩基の例としては、アミノピリジン、アミノピリミジン、アミノトリアジン、アミノピリミジノン、多核芳香族化合物、芳香族炭化水素化合物及びそれらの誘導体(アセチル基、ベンジル基等の任意の置換基を有する置換体)から成る群から選択される化合物(図1−2参照)を挙げることが出来る。
【0014】
電気化学活性部位も適当な電圧下で酸化還元反応を生起するような当業者に公知の任意の化合物を使用することが出来、その代表例として、フェロセンのようなメタロセン又はアントラキノンを挙げることが出来る。
【0015】
本発明の非天然ヌクレオシド又はそのホスホロアミダイト誘導体において、π電子が共役可能なスペーサーを介して、電気化学活性部位と核酸塩基が共役されている。このようなπ電子が共役可能なスペーサーの構造は当業者には公知にであり、例えば、π軌道を形成するspもしくはsp2混成軌道の炭素原子もしくは窒素原子2個を有する構造、具体的には、例えば、アセチレン、エチレン、イミン、アゾ、及び1,2−ジケトンから成る群から選択されるような構造を挙げることが出来る。
【0016】
本発明の非天然ヌクレオシド及びホスホロアミダイト誘導体は、当業者に公知の任意の方法で調製することが出来る。例えば、非天然ヌクレオシドはInouye, M. et al., J. Org. Chem. 2003, 68, 1134-1137 及びそれに引用されている文献等に記載の方法で調製することができる。又、ホスホロアミダイト誘導体は非天然ヌクレオシドの電気化学活性部位に導入した反応基を介してホスホロアミダイト部分を結合させることによって得ることができる。該反応基としては、ホスホロアミダイト誘導体を用いて一本鎖オリゴヌクレオチドの5’末端に非天然ヌクレオシドが結合された際の構造(例えば、非天然ヌクレオシドとその隣のヌクレオシドとの空間的位置(距離))を考慮して適宜選ぶことが出来る。その好適例としては、例えば、炭素数1〜12、好ましくは1〜6のヒドロキシアルキル基を挙げることが出来る。
【0017】
尚、非天然ヌクレオシドのホスホロアミダイト誘導体において、ホスホロアミダイト化させる反応基及びπ電子が共役可能なスペーサーが、それぞれ電気化学活性部位と結合する位置関係に特に制限はないが、オルト、メタ等の任意の位置関係をとることが出来る。DNAの高次構造に及ぼす影響を考慮すると、オルトの位置が好ましいと考えられる。或は、π電子が共役可能なスペーサーを介して結合した核酸塩基と、ホスホロアミダイト化させる反応基又は該反応基を介して結合したホスホロアミダイト部分は、フェロセン等の電気化学活性部位におけるそれぞれ別の芳香族環に結合していても良い。
【0018】
本発明のDNAプローブは上記の非天然ヌクレオシドを含むことを特徴とするが、その具体的な一例としては、一本鎖オリゴヌクレオチドの5’末端及び3’末端に、それぞれ、非天然ヌクレオシド及び電極金属への固定化部位が適当な長さのスペーサーを介して結合していることを特徴とするものである。ここで、「オリゴヌクレオチド」又は「核酸分子」は、天然分子由来の又は合成されたDNA及びRNAを含む。又、一本鎖オリゴヌクレオチドにおける塩基の数に特に制限はない。このようなDNAプローブは当業者に公知の方法で、一本鎖オリゴヌクレオチドに非天然ヌクレオシド及び電極金属への固定化部位を結合することによって調製することができる。
【0019】
非天然ヌクレオシドと一本鎖オリゴヌクレオチドの末端との間のスペーサーは、上記のホスホロアミダイト部分を結合させる際に利用した反応基に由来する構造である。一方、一本鎖オリゴヌクレオチドの末端と電極金属への固定化部位との間のスペーサーは、電気化学的に活性な距離及び配向性等を考慮して選択することが出来、例えば、炭素数1〜12、好ましくは1〜6のアルキレン基を挙げることが出来る。
【0020】
電極金属への固定化部位は、本発明のDNAプローブを金電極等の作用電極に結合させてそれを修飾されるために必要な部位であり、その為に当業者に公知の任意の化学構造とすることが出来る。例えば、チオール、ジスルフィド、イソシアニド、ジセレニド及びアミン類から成る群から選択される化学吸着部位を挙げることが出来る。
【0021】
本発明の二重鎖核酸分子配列の相補性を検出する方法又は被検オリゴヌクレオチド配列の様々な位置に含まれているSNPを検出する方法は、例えば、SWV(Square Wave Voltammetry)法及びDPV (Differential Pulse Voltammetry) 法等の当業者に公知の任意の測定系により、三電極系等の当業者に公知の任意の電気化学的測定装置を使用して実施することが出来る。尚、本発明方法におけるハイブリダーゼーション等の具体的な反応条件は、使用するDNAプローブ及び被検オリゴヌクレオチド、及び電気化学的測定系の種類等に応じて当業者が適宜選択することが出来る。従って、このような方法に使用する電気化学的測定システムも本発明の範囲である。
【0022】
例えば、本発明方法において、電極上に固定化された二重鎖核酸分子から被検オリゴヌクレオチドのみを、適当な手段、例えば、milli-Q 水等を用いて電極を洗浄することによって除去し、再度、電極上に固定化されたDNAプローブと被検オリゴヌクレオチドとをハイブリダイゼーションさせ、固定化された二重鎖核酸分子の導電性を測定することも可能である。このように、本発明の電気化学的測定システムを繰り返し使用して様々な被検オリゴヌクレオチドを検出することが可能であり、その際に、各検出サイクルにおいて、完全相補鎖とSNPとをほぼデジタル的なon/off応答で電気化学的に識別することが可能である。更に、本発明の方法又は電気化学的測定システムにおいては、DNAプローブと同じ鎖長(塩基数)を有する被検オリゴヌクレオチドのみならず、DNAプローブよりも長い鎖長を有する被可能性がある臨床的な応用面で使用することが可能である。
【0023】
以下、実施例に則して本発明を更に詳しく説明する。尚、本発明の技術的範囲はこれらの記載によって何等制限されるものではない。
【実施例1】
【0024】
π電子共役型電気化学活性である本発明の非天然ヌクレオシドの例と該DNAプローブを用いる完全相補鎖とSNPとのハイブリダイゼーション後の電気化学応答の例を詳述する。
【0025】
図1−1に本発明の非天然ヌクレオシド(1)の一例を示す。フェロセンのシクロペンタジエニル環(電気化学活性部位)から、アセチレン及びエチレン等のπ軌道を形成するspもしくはsp2混成軌道の炭素原子もしくは窒素原子2個(X:π電子が共役可能なスペーサー)を介して、非天然型核酸塩基(Y)と共役させている。この非天然ヌクレオシド(1)は、例えば、Inouye, M. et al., J. Org. Chem. 2003, 68, 1134-1137に記載の方法で調製することができる。シクロペンタジエニル環にはさらに反応基として、炭素数1〜6のヒドロキシアルキル基を導入しており、この水酸基を介してホスホロアミダイト体(2)へと誘導し、一本鎖オリゴヌクレオチド(DNA)の5‘末端にDNA自動合成装置を用いて連結した。3’末端はジスルフィドで保護した状態の固相を用い、DNA合成が終了した後、固相からの切り出しとジスルフィドからチオールヘの還元を行い、最後にHPLCで精製して該DNAプローブを得た。
【0026】
金電極には市販の蒸着薄膜電極(膜厚1,000A、DNA固定面積1mm2、Au(111)面率80%以上)を用い、使用に際して以下の前処理を行った。まず、milli-Q 水中にて超音波洗浄を5分間行った。次に該金電極を作用電極として(参照電極:銀一塩化銀電極、補助電極:白金線)、0.05M硫酸中でサイクリックポルタンメトリーを-0.1 Vから1.5 V、走査速度0.1 V/s にて10回繰り返し行い、電気化学的に活性な電極表面を得た。前処理を行った電極はmilli-Q水中で保存し、使用直前に窒素ガスで乾燥させた。
【0027】
16塩基からなる該DNAプローブ(3)を例にとって、それとの完全相補鎖及びSNPとのハイブリダイゼーション、それに続く上記金電極への固定化、及び電気化学測定を例示する。200μM該DNA水溶液(電解質:1M過塩素酸ナトリウム)0.5μLと、220μM完全相補鎖もしくはSNP水溶液(電解質:1M過塩索酸ナトリウム)0.5μLを混合した。混合溶液を65℃に昇温後、90分かけて25℃まで冷却し、ハイブリダイゼーションを行った。この混合溶液全量を金電極上で90分間室温で静置し、続いて1M過塩素酸ナトリウム水溶液で該電極を洗浄することによリ、完全相補鎖あるいはSNPをハイプリダイゼーションさせた該DNA修飾電極を得た(図2)。電気化学測定は1M過塩素酸ナトリウム水溶液中(25℃)にて一般的な三電極系(作用電極:該DNA修飾電極、参照電極:銀一塩化銀電極、補助電極:白金線)で行った。作用電極はグラスフィルター付きのセルを用いて対照電極と分離し、測定に用いる1M過塩素酸ナトリウム水溶液は使用前に窒素ガスを30分吹き込み脱気した。
【0028】
SWV(Square Wave Voltammetry)測定は、初期電位0V、終了電位0.6V、電位増加分0.004V、振幅0.025V、周波数10Hzで行った。図3に、完全相補鎖ならびにSNP1〜SNP3をハイブリダイゼーションさせた該DNA修飾電極を用いたSWV測定結果を示す。結果、完全相補鎖では明らかにフェロセン由来の電流が観測されたのに対し、SNPではほとんど電流は観測されなかった。
【実施例2】
【0029】
(繰り返し測定)
完全相補鎖あるいはSNPをハイブリダイゼーションさせた該DNA修飾電極の作成及び電気化学測定は、実施例1に記載の方法で行った。まず、完全相補鎖をハイブリダイゼーションさせた該DNA修飾電極のSWV測定を行い、+0.31Vの電位における電流値を相対電流値1とした(図4、ポイント[a])。測定後の該DNA修飾電極を室温においてMilli-Q水1mLで3回洗浄することにより被検オリゴヌクレオチドを除去した。この電極を用いて2回目のSWV測定を行うと+0.31Vの電位における相対電流値はほぼ0となった(図4、ポイント[c])。被検オリゴヌクレオチドが除去されたDNAプローブ修飾電極を、200μMの完全相補鎖水溶液(電解質:1M過塩素酸ナトリウム)50μLに浸し、室温で90分間振動撹拌し再ハイブリダイゼーションを行った。1M過塩素酸ナトリウム水溶液300μLで洗浄後SWV測定を行うと、+0.31Vの電位における相対電流値はほぼ1となった(図4、ポイント[d])。再ハイブリダイゼーションの際に、完全相補鎖の代わりにSNPを用いて同様の測定を行うと、ポイント[f]の相対電流値が得られた。また、SNPをハイブリダイゼーションさせた該DNA修飾電極から始まる繰り返し測定も行った(図4、ポイント[b])。前述同様のMilli-Q水洗浄にて被検オリゴヌクレオチドを除去し(図4、ポイント[c])、完全相補鎖あるいはSNPと再ハイブリダイゼーションした後、SWV測定を行った。完全相補鎖では有意な相対電流値を示した(図4、ポイント[e])のに対して、SNPの場合はほぼ0(図4、ポイント[g])となった。以上より、DNAプローブは電極上で繰り返し使用が可能であり、各検出サイクルにおいて、完全相補鎖とSNPとをほぼデジタル的なon/off応答で電気化学的に識別可能であることが示唆された。
【実施例3】
【0030】
(長鎖ターゲット)
一例として、16merのDNAプローブに対して43merの被検オリゴヌクレオチドを用いた例を図5に示す。16merのDNAプローブ3と43merの完全相補鎖(5’-ctgcatgggcggcatcatgtcagtagcgctcctcaccatcatc-3’:下線部分がDNAプローブと相補的な部位)およびSNP(5’-ctgcatgggcggcatcatgtcaCtagcgctcctcaccatcatc-3’:大文字で示した塩基がSNP)を用いた該DNA修飾電極の作成及び電気化学測定は、実施例1に記載の方法で行った。DNAプローブよりも長い鎖長(塩基数)を持つ被検オリゴヌクレオチドを用いても、完全相補鎖とSNPとをほぼデジタル的なon/off応答で電気化学的に識別可能であった。
【産業上の利用可能性】
【0031】
本発明によって、マルチプレツクス反応(一度の操作で数種類のSNPをタイピング)が可能になり、「ゲノムに基づくオーダー一メイド医療」を実現するためには膨大な個々人のSNPタイピングが必須であり、感度、精度、簡便さ、迅速性、安価さ等の点で優れた検出方法が提供される。
【図面の簡単な説明】
【0032】
【図1−1】本発明の非天然ヌクレオシド又はそのホスホロアミダイト誘導体の化学構造の例を示す。
【図1−2】本発明の非天然ヌクレオシド又はそのホスホロアミダイト誘導体の化学構造の例を示す。
【図2】本発明のDNAプローブと完全相補鎖又はSNPとのハイプリダイゼーションにより得られた二重鎖核酸分子の導電性の差に基づき、それらを識別する概念を示す。
【図3】実施例に記載した電気化学応答で得られたSWV測定結果を示す。
【図4】DNAプローブ3を用いた繰り返し測定結果を示す。
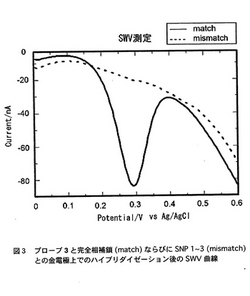
【図5】DNAプローブ3と43merの完全相補鎖(match)ならびにSNP(mismatch)との金電極上でのハイブリダイゼーション後のSWV曲線を示す。
【技術分野】
【0001】
本発明は、相補鎖DNA配列検出用及びSNP検出用に使用することができる分子ビーコン(DNAプローブ)、並びに、該分子ビーコンを使用する相補鎖核酸分子配列(二重鎖核酸分子配列の相補性)検出方法及びSNP検出方法等に関する。
【背景技術】
【0002】
DNAチップ等での相補鎖DNA配列の検出は、相補鎖と非相補鎖とのプローブDNAに対するハイブリダイゼーションの熱力学的な安定性に基づいている。しかしながら一定以上の長さを有するDNAの場合、完全相補鎖と1塩基だけがミスマッチの相補鎖(SNP)をハイブリダイゼーションの安定性のみに基づいて厳密に区別することは難しい。蛍光ラベル化されたDNAと酵素を組み合わせてSNPを検出する方法としてはTaqManPCR法(非特許文献1)やlnvader法(非特許文献2)が確立されているが、マルチプレツクス反応(一度の操作で数種類のSNPをタイピング)には対応できない。
【0003】
又、より直接的にはMALDl-TOF/MS法で直接分子量からSNPを検出する方法(非特許文献3)もあるが、高価な装置と煩雑な前処理が必要である。「ゲノムに基づくオーダー一メイド医症」を実現するためには膨大な個々人のSNPタイピングが必須であり、感度、精度、簡便さ、迅速性、安価さ等の点で満足いく検出方法は未だ確立されていない。
【0004】
1塩基でもミスマッチがあると、DNA内部のミスマッチ周辺の局所構造は大きくくずれ、その部位での核酸塩基対の重なり(π−スタッキング)は小さくなる。この差を利用して電気化学的に完全相補鎖とSNPとを区別する研究がこれまでにもなされている。このような電気化学検出は蛍光検出に比べて感度が高く、検出装置も安価であり、アレイ化及びチッブ化も容易な利点がある。電気化学的なSNP検出の代表的な例としては、SNPでは完全相補鎖に比べて挿入するインターカレーターが少ない、導電性が減少する、という現象を利用した、一塩基対間に挿入するインターカレーター分子に電気化学活性部位を連結した電気化学活性インターカレーターを用いるSNP検出方法(非特許文献4)がある。
【非特許文献1】Morris, T. et al., J. Clin. Microbiol. 1996, 34, 2933
【非特許文献2】Lyamicher, V. etal., Nat. Biotechnol. 1999, 17, 292
【非特許文献3】Haff, LA, et al.,Genome Res. 1997, 7, 378
【非特許文献4】Takenaka, S., etal., Talanta, 2002, 56, 829
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかしながらインターカレーターを用いる方法は、完全相補鎖とSNPとの電気化学信号の差が明瞭でない場合が多く、電気化学触媒反応との組み合わせを用いない限りSNPの検出法としての信頼性は必ずしも高くない。
【課題を解決するための手段】
【0006】
本発明者は、上記の課題を解決することを目的として鋭意、研究を行った。その結果、完全相補鎖とSNPとの間で非常に大きな電気化学応答の差として現れ、場合によってはほぼデジタル的なon/off応答が得られるような新たなDNAプローブを見出し、本発明を完成した。
【0007】
即ち、本発明は、π電子が共役可能なスペーサーを介して結合した電気化学活性部位(酸化還元部位)と核酸塩基から構成される非天然ヌクレオシド又はそのホスホロアミダイト誘導体、及び、該非天然ヌクレオシドを含むDNAプローブに係る。
【0008】
本発明は更に、本発明のDNAプローブを用いて二重鎖核酸分子配列の相補性を検出する方法に係る。本発明方法によって得られる導電性の差に基づき、被検オリゴヌクレオチド配列に含まれているSNPを検出することが出来る。
【0009】
より具体的には、DNAプローブと被検オリゴヌクレオチドとをハイブリダイゼーションさせ、得られた二重鎖核酸分子を電極上に固定化し、固定化された二重鎖核酸分子の導電性を測定することから成る、二重鎖核酸分子配列の相補性を検出する方法、又は、該DNAプローブを電極上に固定化し、固定化されたDNAプローブと被検オリゴヌクレオチドとをハイブリダイゼーションさせ、固定化された二重鎖核酸分子の導電性を測定することから成る、二重鎖核酸分子配列の相補性を検出する方法、に係る。
【発明の効果】
【0010】
π電子共役型電気化学活性非天然ヌクレオシドを有する本発明のDNAプローブを用いた検出方法によって、完全相補鎖とSNPとをほぼデジタル的なon/off応答で電気化学的に識別することが可能となる。
【発明を実施するための最良の形態】
【0011】
本発明の「非天然ヌクレオシド」とは、天然のDNA又はRNA等を構成するヌクレオシド分子とは構造が異なるが、天然のヌクレオシド分子と同様にリン酸基を介して一本鎖オリゴヌクレオチドの一構成単位としてその末端に結合し、別の一本鎖オリゴヌクレオチドとハイブリダイゼーションすることが出来るような化合物を意味する。
【0012】
本発明の非天然ヌクレオシド又はそのホスホロアミダイト誘導体において、核酸塩基としては、検出鎖の核酸塩基と何らかの分子間相互作用が可能なπ電子もしくはπ軌道を有する分子である限り、当業者に公知の任意の構造を有するもので良く、天然型又は非天然型核酸塩基のいずれでもかまわない。
【0013】
非天然型核酸塩基の例としては、アミノピリジン、アミノピリミジン、アミノトリアジン、アミノピリミジノン、多核芳香族化合物、芳香族炭化水素化合物及びそれらの誘導体(アセチル基、ベンジル基等の任意の置換基を有する置換体)から成る群から選択される化合物(図1−2参照)を挙げることが出来る。
【0014】
電気化学活性部位も適当な電圧下で酸化還元反応を生起するような当業者に公知の任意の化合物を使用することが出来、その代表例として、フェロセンのようなメタロセン又はアントラキノンを挙げることが出来る。
【0015】
本発明の非天然ヌクレオシド又はそのホスホロアミダイト誘導体において、π電子が共役可能なスペーサーを介して、電気化学活性部位と核酸塩基が共役されている。このようなπ電子が共役可能なスペーサーの構造は当業者には公知にであり、例えば、π軌道を形成するspもしくはsp2混成軌道の炭素原子もしくは窒素原子2個を有する構造、具体的には、例えば、アセチレン、エチレン、イミン、アゾ、及び1,2−ジケトンから成る群から選択されるような構造を挙げることが出来る。
【0016】
本発明の非天然ヌクレオシド及びホスホロアミダイト誘導体は、当業者に公知の任意の方法で調製することが出来る。例えば、非天然ヌクレオシドはInouye, M. et al., J. Org. Chem. 2003, 68, 1134-1137 及びそれに引用されている文献等に記載の方法で調製することができる。又、ホスホロアミダイト誘導体は非天然ヌクレオシドの電気化学活性部位に導入した反応基を介してホスホロアミダイト部分を結合させることによって得ることができる。該反応基としては、ホスホロアミダイト誘導体を用いて一本鎖オリゴヌクレオチドの5’末端に非天然ヌクレオシドが結合された際の構造(例えば、非天然ヌクレオシドとその隣のヌクレオシドとの空間的位置(距離))を考慮して適宜選ぶことが出来る。その好適例としては、例えば、炭素数1〜12、好ましくは1〜6のヒドロキシアルキル基を挙げることが出来る。
【0017】
尚、非天然ヌクレオシドのホスホロアミダイト誘導体において、ホスホロアミダイト化させる反応基及びπ電子が共役可能なスペーサーが、それぞれ電気化学活性部位と結合する位置関係に特に制限はないが、オルト、メタ等の任意の位置関係をとることが出来る。DNAの高次構造に及ぼす影響を考慮すると、オルトの位置が好ましいと考えられる。或は、π電子が共役可能なスペーサーを介して結合した核酸塩基と、ホスホロアミダイト化させる反応基又は該反応基を介して結合したホスホロアミダイト部分は、フェロセン等の電気化学活性部位におけるそれぞれ別の芳香族環に結合していても良い。
【0018】
本発明のDNAプローブは上記の非天然ヌクレオシドを含むことを特徴とするが、その具体的な一例としては、一本鎖オリゴヌクレオチドの5’末端及び3’末端に、それぞれ、非天然ヌクレオシド及び電極金属への固定化部位が適当な長さのスペーサーを介して結合していることを特徴とするものである。ここで、「オリゴヌクレオチド」又は「核酸分子」は、天然分子由来の又は合成されたDNA及びRNAを含む。又、一本鎖オリゴヌクレオチドにおける塩基の数に特に制限はない。このようなDNAプローブは当業者に公知の方法で、一本鎖オリゴヌクレオチドに非天然ヌクレオシド及び電極金属への固定化部位を結合することによって調製することができる。
【0019】
非天然ヌクレオシドと一本鎖オリゴヌクレオチドの末端との間のスペーサーは、上記のホスホロアミダイト部分を結合させる際に利用した反応基に由来する構造である。一方、一本鎖オリゴヌクレオチドの末端と電極金属への固定化部位との間のスペーサーは、電気化学的に活性な距離及び配向性等を考慮して選択することが出来、例えば、炭素数1〜12、好ましくは1〜6のアルキレン基を挙げることが出来る。
【0020】
電極金属への固定化部位は、本発明のDNAプローブを金電極等の作用電極に結合させてそれを修飾されるために必要な部位であり、その為に当業者に公知の任意の化学構造とすることが出来る。例えば、チオール、ジスルフィド、イソシアニド、ジセレニド及びアミン類から成る群から選択される化学吸着部位を挙げることが出来る。
【0021】
本発明の二重鎖核酸分子配列の相補性を検出する方法又は被検オリゴヌクレオチド配列の様々な位置に含まれているSNPを検出する方法は、例えば、SWV(Square Wave Voltammetry)法及びDPV (Differential Pulse Voltammetry) 法等の当業者に公知の任意の測定系により、三電極系等の当業者に公知の任意の電気化学的測定装置を使用して実施することが出来る。尚、本発明方法におけるハイブリダーゼーション等の具体的な反応条件は、使用するDNAプローブ及び被検オリゴヌクレオチド、及び電気化学的測定系の種類等に応じて当業者が適宜選択することが出来る。従って、このような方法に使用する電気化学的測定システムも本発明の範囲である。
【0022】
例えば、本発明方法において、電極上に固定化された二重鎖核酸分子から被検オリゴヌクレオチドのみを、適当な手段、例えば、milli-Q 水等を用いて電極を洗浄することによって除去し、再度、電極上に固定化されたDNAプローブと被検オリゴヌクレオチドとをハイブリダイゼーションさせ、固定化された二重鎖核酸分子の導電性を測定することも可能である。このように、本発明の電気化学的測定システムを繰り返し使用して様々な被検オリゴヌクレオチドを検出することが可能であり、その際に、各検出サイクルにおいて、完全相補鎖とSNPとをほぼデジタル的なon/off応答で電気化学的に識別することが可能である。更に、本発明の方法又は電気化学的測定システムにおいては、DNAプローブと同じ鎖長(塩基数)を有する被検オリゴヌクレオチドのみならず、DNAプローブよりも長い鎖長を有する被可能性がある臨床的な応用面で使用することが可能である。
【0023】
以下、実施例に則して本発明を更に詳しく説明する。尚、本発明の技術的範囲はこれらの記載によって何等制限されるものではない。
【実施例1】
【0024】
π電子共役型電気化学活性である本発明の非天然ヌクレオシドの例と該DNAプローブを用いる完全相補鎖とSNPとのハイブリダイゼーション後の電気化学応答の例を詳述する。
【0025】
図1−1に本発明の非天然ヌクレオシド(1)の一例を示す。フェロセンのシクロペンタジエニル環(電気化学活性部位)から、アセチレン及びエチレン等のπ軌道を形成するspもしくはsp2混成軌道の炭素原子もしくは窒素原子2個(X:π電子が共役可能なスペーサー)を介して、非天然型核酸塩基(Y)と共役させている。この非天然ヌクレオシド(1)は、例えば、Inouye, M. et al., J. Org. Chem. 2003, 68, 1134-1137に記載の方法で調製することができる。シクロペンタジエニル環にはさらに反応基として、炭素数1〜6のヒドロキシアルキル基を導入しており、この水酸基を介してホスホロアミダイト体(2)へと誘導し、一本鎖オリゴヌクレオチド(DNA)の5‘末端にDNA自動合成装置を用いて連結した。3’末端はジスルフィドで保護した状態の固相を用い、DNA合成が終了した後、固相からの切り出しとジスルフィドからチオールヘの還元を行い、最後にHPLCで精製して該DNAプローブを得た。
【0026】
金電極には市販の蒸着薄膜電極(膜厚1,000A、DNA固定面積1mm2、Au(111)面率80%以上)を用い、使用に際して以下の前処理を行った。まず、milli-Q 水中にて超音波洗浄を5分間行った。次に該金電極を作用電極として(参照電極:銀一塩化銀電極、補助電極:白金線)、0.05M硫酸中でサイクリックポルタンメトリーを-0.1 Vから1.5 V、走査速度0.1 V/s にて10回繰り返し行い、電気化学的に活性な電極表面を得た。前処理を行った電極はmilli-Q水中で保存し、使用直前に窒素ガスで乾燥させた。
【0027】
16塩基からなる該DNAプローブ(3)を例にとって、それとの完全相補鎖及びSNPとのハイブリダイゼーション、それに続く上記金電極への固定化、及び電気化学測定を例示する。200μM該DNA水溶液(電解質:1M過塩素酸ナトリウム)0.5μLと、220μM完全相補鎖もしくはSNP水溶液(電解質:1M過塩索酸ナトリウム)0.5μLを混合した。混合溶液を65℃に昇温後、90分かけて25℃まで冷却し、ハイブリダイゼーションを行った。この混合溶液全量を金電極上で90分間室温で静置し、続いて1M過塩素酸ナトリウム水溶液で該電極を洗浄することによリ、完全相補鎖あるいはSNPをハイプリダイゼーションさせた該DNA修飾電極を得た(図2)。電気化学測定は1M過塩素酸ナトリウム水溶液中(25℃)にて一般的な三電極系(作用電極:該DNA修飾電極、参照電極:銀一塩化銀電極、補助電極:白金線)で行った。作用電極はグラスフィルター付きのセルを用いて対照電極と分離し、測定に用いる1M過塩素酸ナトリウム水溶液は使用前に窒素ガスを30分吹き込み脱気した。
【0028】
SWV(Square Wave Voltammetry)測定は、初期電位0V、終了電位0.6V、電位増加分0.004V、振幅0.025V、周波数10Hzで行った。図3に、完全相補鎖ならびにSNP1〜SNP3をハイブリダイゼーションさせた該DNA修飾電極を用いたSWV測定結果を示す。結果、完全相補鎖では明らかにフェロセン由来の電流が観測されたのに対し、SNPではほとんど電流は観測されなかった。
【実施例2】
【0029】
(繰り返し測定)
完全相補鎖あるいはSNPをハイブリダイゼーションさせた該DNA修飾電極の作成及び電気化学測定は、実施例1に記載の方法で行った。まず、完全相補鎖をハイブリダイゼーションさせた該DNA修飾電極のSWV測定を行い、+0.31Vの電位における電流値を相対電流値1とした(図4、ポイント[a])。測定後の該DNA修飾電極を室温においてMilli-Q水1mLで3回洗浄することにより被検オリゴヌクレオチドを除去した。この電極を用いて2回目のSWV測定を行うと+0.31Vの電位における相対電流値はほぼ0となった(図4、ポイント[c])。被検オリゴヌクレオチドが除去されたDNAプローブ修飾電極を、200μMの完全相補鎖水溶液(電解質:1M過塩素酸ナトリウム)50μLに浸し、室温で90分間振動撹拌し再ハイブリダイゼーションを行った。1M過塩素酸ナトリウム水溶液300μLで洗浄後SWV測定を行うと、+0.31Vの電位における相対電流値はほぼ1となった(図4、ポイント[d])。再ハイブリダイゼーションの際に、完全相補鎖の代わりにSNPを用いて同様の測定を行うと、ポイント[f]の相対電流値が得られた。また、SNPをハイブリダイゼーションさせた該DNA修飾電極から始まる繰り返し測定も行った(図4、ポイント[b])。前述同様のMilli-Q水洗浄にて被検オリゴヌクレオチドを除去し(図4、ポイント[c])、完全相補鎖あるいはSNPと再ハイブリダイゼーションした後、SWV測定を行った。完全相補鎖では有意な相対電流値を示した(図4、ポイント[e])のに対して、SNPの場合はほぼ0(図4、ポイント[g])となった。以上より、DNAプローブは電極上で繰り返し使用が可能であり、各検出サイクルにおいて、完全相補鎖とSNPとをほぼデジタル的なon/off応答で電気化学的に識別可能であることが示唆された。
【実施例3】
【0030】
(長鎖ターゲット)
一例として、16merのDNAプローブに対して43merの被検オリゴヌクレオチドを用いた例を図5に示す。16merのDNAプローブ3と43merの完全相補鎖(5’-ctgcatgggcggcatcatgtcagtagcgctcctcaccatcatc-3’:下線部分がDNAプローブと相補的な部位)およびSNP(5’-ctgcatgggcggcatcatgtcaCtagcgctcctcaccatcatc-3’:大文字で示した塩基がSNP)を用いた該DNA修飾電極の作成及び電気化学測定は、実施例1に記載の方法で行った。DNAプローブよりも長い鎖長(塩基数)を持つ被検オリゴヌクレオチドを用いても、完全相補鎖とSNPとをほぼデジタル的なon/off応答で電気化学的に識別可能であった。
【産業上の利用可能性】
【0031】
本発明によって、マルチプレツクス反応(一度の操作で数種類のSNPをタイピング)が可能になり、「ゲノムに基づくオーダー一メイド医療」を実現するためには膨大な個々人のSNPタイピングが必須であり、感度、精度、簡便さ、迅速性、安価さ等の点で優れた検出方法が提供される。
【図面の簡単な説明】
【0032】
【図1−1】本発明の非天然ヌクレオシド又はそのホスホロアミダイト誘導体の化学構造の例を示す。
【図1−2】本発明の非天然ヌクレオシド又はそのホスホロアミダイト誘導体の化学構造の例を示す。
【図2】本発明のDNAプローブと完全相補鎖又はSNPとのハイプリダイゼーションにより得られた二重鎖核酸分子の導電性の差に基づき、それらを識別する概念を示す。
【図3】実施例に記載した電気化学応答で得られたSWV測定結果を示す。
【図4】DNAプローブ3を用いた繰り返し測定結果を示す。
【図5】DNAプローブ3と43merの完全相補鎖(match)ならびにSNP(mismatch)との金電極上でのハイブリダイゼーション後のSWV曲線を示す。
【特許請求の範囲】
【請求項1】
π電子が共役可能なスペーサーを介して結合した電気化学活性部位と核酸塩基から構成される非天然ヌクレオシド又はそのホスホロアミダイト誘導体。
【請求項2】
核酸塩基が非天然型であり、アミノピリジン、アミノピリミジン、アミノトリアジン、アミノピリミジノン、多核芳香族化合物、芳香族炭化水素化合物及びそれらの誘導体から成る群から選択される、請求項1記載の非天然ヌクレオシド又はそのホスホロアミダイト誘導体。
【請求項3】
電気化学活性部位が、メタロセンあるいはアントラキノンである、請求項1又は2記載の非天然ヌクレオシド又はそのホスホロアミダイト誘導体。
【請求項4】
メタロセンがフェロセンである、請求項3記載の非天然ヌクレオシド又はそのホスホロアミダイト誘導体。
【請求項5】
π電子が共役可能なスペーサーが、アセチレン、エチレン、イミン、アゾ、及び1,2−ジケトンから成る群から選択される、請求項1ないし4のいずれか一項に記載の非天然ヌクレオシド又はそのホスホロアミダイト誘導体。
【請求項6】
ホスホロアミダイト部分が電気化学活性部位に導入した反応基を介して結合している、請求項1ないし5のいずれか一項に記載の非天然ヌクレオシドのホスホロアミダイト誘導体。
【請求項7】
電気化学活性部位に導入した反応基が、炭素数1〜6のヒドロキシアルキル基である、請求項6に記載の非天然ヌクレオシドのホスホロアミダイト誘導体。
【請求項8】
請求項1ないし5のいずれか一項に記載の非天然ヌクレオシドを含むDNAプローブ。
【請求項9】
一本鎖オリゴヌクレオチドの5’末端及び3’末端に、それぞれ、非天然ヌクレオシド及び電極金属への固定化部位が適当な長さのスペーサーを介して結合していることを特徴とする請求項8のDNAプローブ。
【請求項10】
電極金属への固定化部位が、チオール、ジスルフィド、イソシアニド、ジセレニド及びアミン類から成る群から選択される化学吸着部位である、請求項9記載のDNAプローブ。
【請求項11】
適当な長さのスペーサーが炭素数1〜12のアルキレン基から成る、請求項9又は10記載のDNAプローブ。
【請求項12】
請求項8ないし11のいずれか一項に記載のDNAプローブを用いて二重鎖核酸分子配列の相補性を検出する方法。
【請求項13】
請求項8ないし11のいずれか一項に記載のDNAプローブと被検オリゴヌクレオチドとをハイブリダイゼーションさせ、得られた二重鎖核酸分子を電極上に固定化し、固定化された二重鎖核酸分子の導電性を測定することから成る、請求項12記載の方法。
【請求項14】
請求項8ないし11のいずれか一項に記載のDNAプローブを電極上に固定化し、固定化されたDNAプローブと被検オリゴヌクレオチドとをハイブリダイゼーションさせ、固定化された二重鎖核酸分子の導電性を測定することから成る、請求項12記載の方法。
【請求項15】
電極上に固定化された二重鎖核酸分子から被検オリゴヌクレオチドのみを除去し、再度、電極上に固定化されたDNAプローブと被検オリゴヌクレオチドとをハイブリダイゼーションさせ、固定化された二重鎖核酸分子の導電性を測定することから成る、請求項13又は14に記載の方法。
【請求項16】
被検オリゴヌクレオチドの鎖長がDNAプローブよりも長いことを特徴とする、請求項13〜15のいずれか一項に記載の方法。
【請求項17】
被検オリゴヌクレオチド配列の様々な位置に含まれているSNPを検出する、請求項12ないし16のいずれか一項に記載の方法。
【請求項18】
SWV(Square Wave Voltammetry)法を用いて実施する、請求項12ないし17のいずれか一項に記載の方法。
【請求項19】
三電極系を用いて行う、請求項12ないし18のいずれか一項に記載の方法。
【請求項20】
請求項8ないし11のいずれか一項に記載のDNAプローブが固定化された電極を含む、電気化学的測定システム。
【請求項21】
請求項8ないし11のいずれか一項に記載のDNAプローブが固定化された作用電極、参照電極、及び補助電極から構成される三電極系である、請求項20記載の電気化学的測定システム。
【請求項1】
π電子が共役可能なスペーサーを介して結合した電気化学活性部位と核酸塩基から構成される非天然ヌクレオシド又はそのホスホロアミダイト誘導体。
【請求項2】
核酸塩基が非天然型であり、アミノピリジン、アミノピリミジン、アミノトリアジン、アミノピリミジノン、多核芳香族化合物、芳香族炭化水素化合物及びそれらの誘導体から成る群から選択される、請求項1記載の非天然ヌクレオシド又はそのホスホロアミダイト誘導体。
【請求項3】
電気化学活性部位が、メタロセンあるいはアントラキノンである、請求項1又は2記載の非天然ヌクレオシド又はそのホスホロアミダイト誘導体。
【請求項4】
メタロセンがフェロセンである、請求項3記載の非天然ヌクレオシド又はそのホスホロアミダイト誘導体。
【請求項5】
π電子が共役可能なスペーサーが、アセチレン、エチレン、イミン、アゾ、及び1,2−ジケトンから成る群から選択される、請求項1ないし4のいずれか一項に記載の非天然ヌクレオシド又はそのホスホロアミダイト誘導体。
【請求項6】
ホスホロアミダイト部分が電気化学活性部位に導入した反応基を介して結合している、請求項1ないし5のいずれか一項に記載の非天然ヌクレオシドのホスホロアミダイト誘導体。
【請求項7】
電気化学活性部位に導入した反応基が、炭素数1〜6のヒドロキシアルキル基である、請求項6に記載の非天然ヌクレオシドのホスホロアミダイト誘導体。
【請求項8】
請求項1ないし5のいずれか一項に記載の非天然ヌクレオシドを含むDNAプローブ。
【請求項9】
一本鎖オリゴヌクレオチドの5’末端及び3’末端に、それぞれ、非天然ヌクレオシド及び電極金属への固定化部位が適当な長さのスペーサーを介して結合していることを特徴とする請求項8のDNAプローブ。
【請求項10】
電極金属への固定化部位が、チオール、ジスルフィド、イソシアニド、ジセレニド及びアミン類から成る群から選択される化学吸着部位である、請求項9記載のDNAプローブ。
【請求項11】
適当な長さのスペーサーが炭素数1〜12のアルキレン基から成る、請求項9又は10記載のDNAプローブ。
【請求項12】
請求項8ないし11のいずれか一項に記載のDNAプローブを用いて二重鎖核酸分子配列の相補性を検出する方法。
【請求項13】
請求項8ないし11のいずれか一項に記載のDNAプローブと被検オリゴヌクレオチドとをハイブリダイゼーションさせ、得られた二重鎖核酸分子を電極上に固定化し、固定化された二重鎖核酸分子の導電性を測定することから成る、請求項12記載の方法。
【請求項14】
請求項8ないし11のいずれか一項に記載のDNAプローブを電極上に固定化し、固定化されたDNAプローブと被検オリゴヌクレオチドとをハイブリダイゼーションさせ、固定化された二重鎖核酸分子の導電性を測定することから成る、請求項12記載の方法。
【請求項15】
電極上に固定化された二重鎖核酸分子から被検オリゴヌクレオチドのみを除去し、再度、電極上に固定化されたDNAプローブと被検オリゴヌクレオチドとをハイブリダイゼーションさせ、固定化された二重鎖核酸分子の導電性を測定することから成る、請求項13又は14に記載の方法。
【請求項16】
被検オリゴヌクレオチドの鎖長がDNAプローブよりも長いことを特徴とする、請求項13〜15のいずれか一項に記載の方法。
【請求項17】
被検オリゴヌクレオチド配列の様々な位置に含まれているSNPを検出する、請求項12ないし16のいずれか一項に記載の方法。
【請求項18】
SWV(Square Wave Voltammetry)法を用いて実施する、請求項12ないし17のいずれか一項に記載の方法。
【請求項19】
三電極系を用いて行う、請求項12ないし18のいずれか一項に記載の方法。
【請求項20】
請求項8ないし11のいずれか一項に記載のDNAプローブが固定化された電極を含む、電気化学的測定システム。
【請求項21】
請求項8ないし11のいずれか一項に記載のDNAプローブが固定化された作用電極、参照電極、及び補助電極から構成される三電極系である、請求項20記載の電気化学的測定システム。
【図1−1】


【図1−2】


【図2】


【図3】


【図4】


【図5】




【図1−2】


【図2】


【図3】


【図4】


【図5】


【公開番号】特開2006−182757(P2006−182757A)
【公開日】平成18年7月13日(2006.7.13)
【国際特許分類】
【出願番号】特願2005−218129(P2005−218129)
【出願日】平成17年7月28日(2005.7.28)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2004年8月11日、12日 機能性ホスト・ゲスト化学研究会主催の「第10回 機能性ホスト・ゲスト化学研究会サマーセミナー」において文書をもって発表
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【Fターム(参考)】
【公開日】平成18年7月13日(2006.7.13)
【国際特許分類】
【出願日】平成17年7月28日(2005.7.28)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2004年8月11日、12日 機能性ホスト・ゲスト化学研究会主催の「第10回 機能性ホスト・ゲスト化学研究会サマーセミナー」において文書をもって発表
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【Fターム(参考)】
[ Back to top ]

