あらかじめ選択された細胞内在化様式を有する粒子組成物
あらかじめ選択された細胞内在化様式を有する粒子組成物の製剤化方法は、表面受容体を有する標的細胞を選択し、i)表面部分であって、細胞の表面受容体に親和性を有するかまたは結合することができる前記表面部分およびii)あらかじめ選択された形状であって、粒子の表面部分の表面分布および粒子の形状が、あらかじめ選択された細胞内在化様式に有効である前記形状を有する粒子を得ることを含む。
【発明の詳細な説明】
【技術分野】
【0001】
連邦政府支援研究に関する陳述
本発明の基礎をなす研究の一部は、米国国防総省グラント番号W81XWH-04-2-0035およびNASAグラント番号SA23-06-017からのフェデラルファンドによる支援を受けた。米国政府は、これらの発明に一定の権利を有する。
技術分野
本発明は、一般に、ミクロおよびナノ粒子組成物およびその用途に関し、より具体的には、特定のあらかじめ選択された細胞内在化様式を有するミクロおよびナノ粒子組成物に関する。
【背景技術】
【0002】
エンドサイトーシスは、それによって、選択された細胞外種、例えば分子、ウイルス、粒子および微生物を細胞が取り込み、かつ/または放出し、それらを細胞質内の特定の細胞小器官に輸送することができるプロセスを定義する一般用語である。エンドサイトーシスは、クラスリン依存性およびカベオラ依存性エンドサイトーシス;食作用;クラスリン・カベオラ非依存性エンドサイトーシスを含む種々の経路によって行われることができる。特定のエンドサイトーシス経路は、細胞外のカーゴ(cargo)のサイズおよび性質に左右されうる。例えば、Conner S.D. and SX. Schmid. 2003. Nature 422: 37-44 を参照のこと。例えば、カベオラ依存性エンドサイトーシスは、50〜60nmの特徴的サイズを有する細胞膜陥入構造であるカベオラの活性化によって促進され;クラスリン依存性エンドサイトーシスは、数百ミクロン(100〜500nm)までの特徴的サイズを有する小胞ケージ(vesicular cage)の形成を引き起こす、細胞膜の膜貫通受容体およびその結合リガンドの集積を必要とし;食作用は、最終的に1マイクロメートルより大きい(>1μm)カーゴを包む細胞膜の突起の形成をもたらす特定の細胞表面受容体およびシグナル伝達カスケードを含む。クラスリンおよびカベオラ非依存性エンドサイトーシスは、100nmより小さい陥入小胞(invaginating vesicle)の形成と関連している可能性がある。
【0003】
粒子エンドサイトーシス(particle endocytosis)は、いくつかの分野、例えばウイルス学、薬物送達、遺伝子送達およびナノトキシコロジーにおいてきわめて重要な可能性がある。例えば、Marsh M. and A. Helenius. 2006. Cell 124:729-40; Vasir J.K., and V. Labhasetwar. 2006. Expert Opin. Drug Deliv. 3:325-344; Oberdorster G., E. Oberdorster, J. Oberdorster. 2005. 113:823-39 を参照のこと。
【0004】
ナノ粒子に関しては、エンベロープウイルスなどの天然のナノ粒子であってもバイオミメティック微粒子などの人工のナノ粒子であっても、最も有効な内在化機構は、粒子表面上に分布する分子(リガンド)が細胞膜上に発現された対分子(受容体)に結合し、最終的に細胞膜を曲げて外来カーゴを陥入させることができる受容体依存性エンドサイトーシスとすることができる。例えば、Marsh M. and A. Helenius. 2006. Cell 124:729-40; Smith A.E., A. Helenius. 2004. Science 304:237-42 を参照のこと。これらの受容体は表面拡散によって陥入部位に集積することができるが、もしそれがなければ、エンドサイトーシスは起こらないか、あるいはより長い時間スケールで起こると考えられる。
【発明の概要】
【0005】
一実施形態は、あらかじめ選択された細胞内在化様式を有する粒子組成物の製剤化方法であって、a)表面受容体を有する細胞を選択し;b)i)表面部分であって、前記受容体に親和性を有するかまたは結合することができる前記表面部分およびii)形状であって、前記表面部分の表面分布および前記形状が、選択された細胞のあらかじめ選択された細胞内在化様式に有効である前記形状を有する粒子を得ることを含む前記方法を提供する。
【0006】
他の実施形態は、それを必要とする被験者にあらかじめ選択された細胞内在化様式を有する粒子組成物の有効量を投与することを含む、生理的状態の治療方法またはモニタリング方法である。
【0007】
さらに他の実施形態は、あらかじめ選択された細胞内在化様式を有する粒子組成物である。
発明の詳細な説明
関連文献
以下の研究論文および特許文献(参照によりその全体が本願に組み込まれる)は、本発明を理解する上で有用である
1)国際公開番号WO2007/120248、公開日:2007年10月25日;
2)国際公開番号WO2008/041970、公開日:2008年4月10日;
3)国際公開番号WO2008/021908、公開日:2008年2月21日;
4)米国特許出願公開第2008/0102030号、公開日:2008年5月1日;
5)米国特許出願公開第2003/0114366号;
6)米国特許出願第12/034,259号、出願日:2008年2月20日;
7)米国特許出願第12/110,515号、出願日:2008年4月28日;
8) Tasciotti et al, Nature Nanotechnology, vol. 3, 151-158, 2008;
9) Decuzzi and Ferrari, Biomaterials 28, 2007, 2915-2922;
10) Decuzzi and Ferrari, Biophysical Journal, 94, 2008, 3790-3797。
定義
特記しない限り、ある("a"または"an")は、1以上のを意味する。
【0008】
特記しない限り用語"エンドサイトーシス"および"エンドサイトーシスの"は、それぞれ、受容体依存性エンドサイトーシスおよび受容体依存性エンドサイトーシスのを意味する。
【0009】
"ミクロ粒子"は、最大寸法が1マイクロメートルから1000マイクロメートルまでの粒子のことを言うが、いくつかの実施形態においては、規定されているように1ミクロンから100ミクロンまでの粒子のことを言う。
【0010】
"ナノ粒子"は、最大寸法が1ミクロン未満の粒子のことを言う。
"食作用"は、マクロファージ、単球および好中球を含む専門化した食細胞による大きな(2ミクロンを超える特徴的サイズの)粒子の取り込みのことを言う。食作用は、最終的に外部粒子を包むための細胞膜における突起の形成を含む。
【0011】
"受容体依存性エンドサイトーシス"すなわちRMEは、細胞膜上に発現された対部分(受容体)に結合できるリガンドなどの部分がその表面に分布する粒子の細胞による内在化のことを言う。RMEは、それによって、膜による粒子の完全なラッピング(wrapping)と、細胞による粒子の最終的な内在化が起こる細胞膜の曲げを含む。RMEによって内在化される粒子は、食作用によって内在化される粒子よりも小さい特徴的サイズを有しうる。RMEは、食細胞には限定されない。
【0012】
"生分解性"は、生理的媒体中で溶解または分解されうる材料、あるいは生理的条件下で生理的酵素および/または化学的条件によって分解されうる生体適合性ポリマー材料のことを言う。
開示
本発明者らは、受容体依存性エンドサイトーシスにとって粒子形状が重要であることを見出した。従って、本発明は、あらかじめ選択された細胞内在化様式を有する粒子組成物の製剤化方法であって、標的細胞を選択し、標的細胞の表面の表面受容体に親和性を有するかまたは結合することができる表面部分を表面に有する粒子を得ることを含むことができる前記方法を提供する。粒子上の表面部分の表面分布および粒子の形状は、選択された細胞のあらかじめ選択された細胞内在化様式に有効である。
【0013】
あらかじめ選択された細胞内在化様式は、"エンドサイトーシス"様式または"非エンドサイトーシス(no-endocytosis)"様式から選択することができる。"エンドサイトーシス"は、受容体依存性エンドサイトーシスによって細胞膜で粒子が完全に包まれ、最終的に内在化されることができる様式のことを言い、"非エンドサイトーシス"は、最大限でも細胞膜によって粒子が部分的にしか包まれない様式のことを言う。
【0014】
いくつかの実施形態において、あらかじめ選択された細胞内在化様式は、不完全エンドサイトーシスすなわち部分エンドサイトーシスとすることができる。"不完全エンドサイトーシス(frustrated endocytosis)"は、粒子が細胞膜によって部分的にしか包まれず、細胞が内在化されない様式のことを言う。
【0015】
生理的状態の治療および/またはモニタリングのために、あらかじめ選択された細胞内在化様式を有する粒子を用いることができる。この場合には、哺乳動物、好ましくはヒトなどの被験者の体内において、生理的状態に影響を受け表面に表面受容体を有する細胞を有する標的部位を選択し、標的部位の細胞のあらかじめ選択された内在化様式を有する粒子を含む組成物の有効量を被験者に投与することができる。生理的状態は例えば疾患とすることができ、例えば癌または炎症とすることができる。
【0016】
一般に、選択された細胞は、その表面に表面受容体を有する任意の種類の細胞とすることができる。多くの実施形態において、選択された細胞は、ヒト細胞などの哺乳動物細胞とすることができる。
【0017】
特定の選択された内在化様式は、粒子を対象とする用途に左右されうる。例えば、細胞内に送達されることが所望されるイメージング剤または治療剤などのカーゴを粒子が含む場合、エンドサイトーシス様式が好ましい場合がある。他方では、細胞内への送達を目的としないカーゴを粒子が含む場合、非エンドサイトーシスまたは不完全エンドサイトーシス様式が好ましい場合がある。このような状況の1例として、国際公開WO2008/021908に開示されている多段階送達ビヒクルを挙げることができる。多段階送達ビヒクルにおいては、ビヒクルの第1段階粒子(内部に第2段階粒子を含む)は、内皮における標的部位を認識し、それに接着することを目的とし、これは内皮細胞によって内在化されない。接着後、第1段階粒子は、第2段階粒子を放出することができる。
【0018】
多くの実施形態において、選択された細胞は非食細胞、すなわち食作用を行うことができない細胞とすることができる。食細胞、すなわち食作用を行うことができる細胞の例は、好中球、単球およびマクロファージを含む。
【0019】
いくつかの実施形態において、選択された細胞は、血管内皮細胞などの内皮細胞とすることができ、標的部位は、取り込まれた(coopted)血管、新生血管または再正常化された(renormalized)血管などの血管部位とすることができる。取り込まれた血管の細胞に関しては、表面受容体はアンギオポエチン2受容体とすることができ;新生血管の細胞に関しては、表面受容体は、血管形成誘導因子(VEGF)、塩基性線維芽細胞増殖因子または、αvβ3インテグリンなどの内皮マーカーとすることができ;再正常化された血管の細胞に関しては、表面受容体は癌胎児性抗原関連細胞接着分子1(CEACAM1)、エンドセリン-B受容体(ET-B)、血管内皮細胞増殖因子インヒビターグラビン/AKAP12、プロテインキナーゼAおよびプロテインキナーゼCの足場タンパク質とすることができる。
【0020】
粒子表面の表面部分は、選択された細胞表面の受容体に相補的であることができる。表面部分は、例えば、選択された細胞膜表面の受容体に親和性を有するかまたは結合することができる抗体、アプタマーまたはリガンドとすることができる。いくつかの実施形態において、表面部分は、選択された細胞膜表面の受容体に対する特異的部分を含むことができる。いくつかの実施形態において、表面部分は、選択された細胞膜表面の受容体に対する非特異的部分を含むことができる。さらに他の実施形態において、表面部分は特異的部分および非特異的部分の両方を含むことができる。
【0021】
あらかじめ選択された内在化様式を有する粒子は、あらかじめ選択された内在化様式を有さない粒子を含むこともできる組成物の一部とすることができる。あらかじめ選択された内在化様式を有する粒子は、組成物中の粒子の総数のうち、少なくとも10%または少なくとも25%または少なくとも50%または少なくとも75%または少なくとも90%の数を構成することができる。
【0022】
多くの実施形態において、粒子は非球形粒子とすることができる。いくつかの実施形態において、粒子は円形断面を有する粒子とすることができる。いくつかの実施形態において、粒子は楕円体粒子とすることができる。さらに他の実施形態において、粒子は、円柱の軸と直角の方向に楕円断面を有する円筒形粒子とすることができる。
【0023】
いくつかの実施形態において、楕円断面を有する粒子の主軸の長さなどの、粒子の最大の特徴的サイズは、2ミクロン未満とすることができ、あるいは1ミクロン未満または800nm未満または5nm〜500nmまたは5nm〜800nmまたは5nm〜1ミクロンまたは10nm〜1ミクロンまたは10nm〜800nmまたは10nm〜500nmまたは20nm〜1ミクロンまたは20nm〜800nmまたは20nm〜500nmまたは50nm〜1ミクロンまたは50nm〜800nmまたは50nm〜500nmとすることができる。
【0024】
好ましくは、粒子の最大の特徴的サイズは、選択された細胞の特徴的サイズよりも実質的に小さい。粒子の最大の特徴的サイズは、選択された細胞の特徴的サイズよりも少なくとも3倍小さいか、または少なくとも5倍小さいか、または少なくとも10倍小さいか、または少なくとも20倍小さいか、または少なくとも30倍小さいか、または少なくとも50倍小さいか、または少なくとも100倍小さいか、または少なくとも200倍小さいか、または少なくとも300倍小さいか、または少なくとも500倍小さいか、または少なくとも100倍小さいものとすることができる。選択された細胞の特徴的サイズは、約5ミクロンから約40ミクロンまでとすることもできるし、約10ミクロンから約30ミクロンまでとすることもできる。
【0025】
いくつかの実施形態において、得られた粒子が、受容体依存性エンドサイトーシスによる粒子の内在化に有効な局所曲率(local curvature)および、リガンドなどの部分の局所表面密度を有する凸亜表面(convex subsurface)を有する粒子とすることができ、このことは、前記局所曲率κが、部分の局所表面密度に関する最大エンドサイトーシス曲率κmaxよりも小さい事を意味する。最大エンドサイトーシス曲率は、粒子の表面における部分と選択された細胞膜の表面の受容体との間の結合エネルギー、選択された細胞膜の曲げエネルギー係数ならびに粒子の部分の表面密度および選択された細胞膜の受容体表面密度によって決めることができる。最大エンドサイトーシス曲率を求める方法を以下に開示する。
【0026】
いくつかの実施形態において、凸面における部分の局所表面密度を、粒子の表面の他の部分における部分の表面密度より大きくし、それによって粒子の表面における表面部分の表面分布を不均一にすることができる。
【0027】
楕円断面を有する粒子に関しては、あらかじめ選択された細胞内在化様式を有する粒子を得ることは、選択された様式に対応するアスペクト比(aspect ratio)を有する粒子を得ることを含むことができる。
【0028】
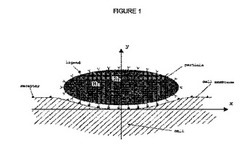
例えば、図1は、特異的なリガンド・受容体結合によって膜と相互作用する楕円円筒形粒子の楕円断面を示す。粒子の表面におけるリガンドの表面密度はmlであるのに対し、細胞膜の表面における受容体の表面密度はmrである。
【0029】
楕円断面はR1およびR2によって特徴づけることができる。これらは楕円の半軸長さである。楕円のアスペクト比はΓ=R1/R2で定義できる。粒子の断面積は、A=πR1R2=πΓR22=πRs2(式中、Rsは、楕円粒子と同じ断面積を有する円形断面を有する粒子の半径)である。
【0030】
粒子の外形寸法は、いくつかのパラメータ対、例えばR1およびR2;ΓおよびR1;ΓおよびR2;ΓおよびRsまたはΓおよびV(Vは粒子の体積である)によって十分に定義できる。
粒子の外形寸法がΓおよびR2によって定義される場合は、あらかじめ選択された内在化様式を決定するための形状パラメータは、特定のR2に対するアスペクト比Γとすることができる。
【0031】
楕円断面を有する粒子は、特定の半短軸長さに対するその粒子のアスペクト比が、第1臨界値Γ'=(R2κmax)-1/2(式中、κmaxは、下記で定義する最大エンドサイトーシス曲率である)未満である場合、"非エンドサイトーシス"様式に含まれることができる。
【0032】
粒子は、その特定の半短軸長さに対するその粒子のアスペクト比が第2臨界値Γ"=R2κmax未満である場合、不完全エンドサイトーシス様式に含まれることができる。
粒子は、その特定の半短軸長さに対するその粒子のアスペクト比が第1臨界値Γ'を超え、第2臨界値Γ"未満である場合、エンドサイトーシス様式に含まれることができる。
【0033】
最大エンドサイトーシス曲率κmaxは、その表面に非球形粒子と同じリガンドを有する球形粒子または円形断面を有する粒子の、選択された細胞に関して算出された最小エンドサイトーシス半径の逆数として定義できる。
【0034】
最小エンドサイトーシス半径、従って最大エンドサイトーシス曲率は、式(1)
【0035】
【数1】

【0036】
を用いて求めることができる。
上記の方程式において、CはκBTに対するリガンド-受容体結合エネルギーである。式中κBはボルツマン定数であり、Tはケルビンで表した細胞または標的部位の温度(絶対温度)である。Cは、特定のリガンド-受容体対に左右される。具体的には、C=log[Kd2D]であり、Kd2Dは細胞/粒子界面で相互作用しているリガンド-受容体の平衡解離定数である。Kd2Dは、関係式Kd2D=Kd/h(式中、Kdは、例えば溶液中実験的に測定された、同じリガンド-受容体対の平衡解離定数であり、hは、リガンド-受容体部位が限定される限定領域(confinement region)の厚さである)によって算出できる。多くの場合、hはおおよそ10nm程度とすることができる。
【0037】
Bは細胞膜の曲げエネルギー係数であり、これはHochmuth,R.M., J.Biomech., 33:15-22,2000に詳述されているようにして測定できる。
受容体の平均表面密度であるmrは、粒子が細胞と相互作用していない場合、当業者に公知の方法を用いて測定できる。例えば、Panes J., et al. Am. J. Physiol. 1995; 269(6Pt2):H1955-64 において細胞間接着分子1受容体に関して詳述されているような、受容体に相補的な放射性標識モノクローナル抗体を用いて、in vivoでmrを測定できる。代わりに、受容体に相補的な蛍光標識モノクローナル抗体を用いて、mrを測定できる。このような蛍光標識モノクローナル抗体は、米国特許第4,520,110号に開示されている、フィコエリスリンで標識された抗体とすることができる。
【0038】
mlは、リガンドの局所表面密度mlである。これは、粒子の表面機能化条件を調節することによって、かつ/またはリガンド分子のサイズを変えることによって変えることができる。粒子上のリガンドの実際の表面密度は、細胞蛍光測定法またはラジオアッセイにおける放射性標識対分子を用いて実験的に証明できる。
【0039】
リガンドの均一な表面分布を有する粒子に関しては、局所表面密度と平均表面密度は同じとすることができる。
特定の実施形態において、最小エンドサイトーシス半径すなわち最大エンドサイトーシス曲率は、米国特許出願第12/034,259号"Endocytotic particles"(出願日:2008年2月20日)に開示されているようにして求めることができる(参照によりその全体が本願に組み込まれる)。
【0040】
図2は、Decuzzi and Ferrari, Biophysical Journal, 94, 2008, 3790-3797 に開示されている理論モデル(参照によりその全体が本願に組み込まれる)を用いて評価した、R2=50nmに対する、0.9から4までの範囲のアスペクト比Γの関数としての半ラッピング時間0.5τwおよびラッピング長さ比xmax/R1を示す楕円円筒形粒子の漸進的変化を示す。xmaxは、図1におけるx軸への粒子のラッピング長さの投影である。xmax/R1=1の場合、時間τwにおいて完全ラッピングが起こる。図2において、Γ<Γcrの場合(この場合、Γはおよそ0.9である)、ラッピングは開始さえできないので、τwは無限に大きくなり、比xmax/R1は存在しない。Γが中間の値Γcr'<Γ<Γcr"である場合、比xmax/R1は常に1であり、このことは粒子の完全な内在化が起こり、0.5rwはΓと共にほぼ直線的に増大することを意味する。Γ>Γcr"の場合、xmax/R1は減少して最小に達し、次いでΓの増加と共に徐々に増加する。
【0041】
図3は、R2の関数としての、一定のR2に対する半ラッピング時間の最小値に対応するΓの値であるΓminのグラフを示す。図3はまた、R2の関数としての、Γminに対する半ラッピング時間のグラフも示す。同じデータを、Γcr'およびΓcr"と共に表1に示す。
【0042】
【表1】

【0043】
粒子サイズR2が増大するに従って、内在化時間が最小であるアスペクト比Γminは、1(R2=Rmin)から0.3(R2=500nm)まで減少する。
場合によっては、楕円円筒形粒子の外形寸法を記載する2つのパラメータはΓおよびRsとすることができる。
【0044】
このような場合、あらかじめ選択された細胞内在化様式を決定する形状パラメータは、特定の値のRsに対するアスペクト比Γとすることができる。
楕円断面を有する粒子は、特定の半短軸長さに対するその粒子のアスペクト比が、第1臨界値Γ1'=(Rsκmax)-2/3(式中、κmaxは、下記で定義する最大エンドサイトーシス曲率である)未満である場合、"非エンドサイトーシス"様式に含まれることができる。
【0045】
粒子は、その特定の半短軸長さに対するその粒子のアスペクト比が第2臨界値Γ1"=(Rsκmax)2/3未満である場合、不完全エンドサイトーシス様式に含まれることができる。
粒子は、その特定の半短軸長さに対するその粒子のアスペクト比が第1臨界値Γ1'を超え、第2臨界値Γ2"未満である場合、エンドサイトーシス様式に含まれることができる。
【0046】
図4は、Decuzzi and Ferrari, Biophysical Journal, 94, 2008, 3790-3797 に開示されている理論モデル(参照によりその全体が本願に組み込まれる)を用いて評価した、Rs=50nmに対する、0.9から4までの範囲のアスペクト比Γの関数としての半ラッピング時間0.5τwおよびラッピング長さ比xmax/R1を示す楕円円筒形粒子の漸進的変化を示す。
粒子の種類
あらかじめ選択された内在化様式を有する粒子の種類は特に限定されない。例えば、粒子は、リポソーム、ポリマーベース粒子、シリコンおよびシリカベース粒子、量子ドット、金ナノシェル、デンドリマーまたはウイルス粒子とすることができる。
【0047】
いくつかの実施形態において、粒子は、あらかじめ選択された内在化様式に有効な形状に加工することができる。さらにいくつかの実施形態において、あらかじめ選択された内在化様式に有効な形状を有する粒子は、形状および/またはサイズの幅広い分布を有することができる粒子のプールから選択されることができる。粒子のプールからの選択は、例えば、粒子の幾何学的寸法を測定することが可能な、Malvern Instruments社(英国ウスターシア州)製のZetasizer(登録商標)Nanoシリーズ機器を用いて行うことができる。
【0048】
粒子は、多くの方法を用いて加工するすることができる。一般に、粒子のサイズと形状の制御を提供する加工方法が好ましい。
いくつかの実施形態において、粒子は、トップダウンのミクロ加工またはナノ加工法、例えばフォトリソグラフィー、電子ビームリソグラフィー、X線リソグラフィー、遠紫外線リソグラフィーまたはナノプリントリソグラフィーによって加工することができる。トップダウンの加工方法を用いる利点は、このような方法が、寸法が均一な粒子の大規模製造を提供できるということであると言える。
【0049】
粒子は、その表面に、リガンド、アプタマーまたは抗体などの標的部分を有することができる。例えば、リガンドは、粒子の表面の適切な反応性基に化学的に結合されることができる。タンパク質リガンドは、チオエーテルまたはアミド結合をそれぞれ形成するのに有効な条件下でアミノ反応性基およびチオール反応性基に結合されることができる。抗体または他のポリマー結合剤を無機またはポリマー担体に結合させる方法は、例えば、Taylor, R., Ed., Protein Immobilization Fundamentals and Applications, pp. 109110 (1991) に詳述されている。
【0050】
表面部分の不均一な表面分布は、例えば、トップダウンのミクロ加工またはナノ加工法によって粒子を製造するとき達成できる。例えば、粒子が少なくとも2つの異なる表面領域(1つはリガンドの沈着に抵抗するもの、1つはそうでないもの)を有するように、リガンドの沈着に抵抗するコーティングを用いて基質(それから粒子が製造される)をパターニングできる。続いて、リガンドを含有する溶液に基質を暴露することによって、基質からの放出によってリガンドの不均一な分布を有する粒子をもたらすことができる。
【0051】
いくつかの実施形態において、粒子は、リザーバーと表面とを接続する1以上のチャネルを有することができる。いくつかの実施形態において、リザーバーとチャネルは、粒子の本体における孔とすることができる。この場合において、粒子は多孔質またはナノ多孔質材料を含むことができる。多孔質またはナノ多孔質材料の孔を制御して、活性剤の所望の負荷および/または所望の放出速度を得ることができる。制御可能な孔径を有するナノ多孔質材料には、SiO2、Al2O3またはTiO2などの酸化物材料を挙げることができる。ゾルゲル粒子とも呼ばれるナノ多孔質酸化物粒子の加工は、例えば、Paik J. A. et. al. J. Mater. Res., Vol. 17, Aug 2002 に詳述されている。制御可能な孔径を有するナノ多孔質材料には、ナノ多孔質シリコンを挙げることもできる。ナノ多孔質シリコン粒子の加工の詳細に関しては、例えば、Cohen M. H. et. ah Biomedical Microdevices 5:3, 253-259, 2003 を参照のこと。
【0052】
いくつかの他の実施形態において、粒子は、チャネルを全く有さないものとすることができる。このような粒子は、例えば、生分解性材料を含むことができる。例えば、粒子は、鉄、チタニウム、金、銀、白金、銅などの金属ならびにそれらの合金および酸化物で形成されることができる。生分解性材料はまた、ポリオルトエステル、ポリアンヒドリド、ポリアミド、ポリアルキルシアノアクリル酸、ポリホスファゼンおよびポリエステルなどの生分解性ポリマーとすることができる。典型的な生分解性ポリマーは、例えば米国特許第4,933,185号、第4,888,176号および第5,010,167号に記載されている。このような生分解性ポリマー材料の具体例は、ポリ乳酸、ポリグリコール酸、ポリカプロラクトン、ポリヒドロキシ酪酸、ポリ(N-パルミトイル-トランス-4-ヒドロキシ-L-プロリンエステル)およびポリ(DTHカルボナート)を含む。
【0053】
特定の実施形態において、粒子は、それ自体を活性剤とすることができる。
活性剤
活性剤は、治療化合物および/またはイメージング剤とすることができる。特定の活性剤の選択は、所望の用途に左右される。
【0054】
治療剤は、哺乳動物またはヒトなどの被験者の有窓性血管に所望の生物学的作用を生じさせることができる生理活性物質または薬理活性物質とすることができる。治療剤は、無機化合物とすることもできるし、ペプチド、タンパク質、核酸および小分子を含む有機化合物とすることもできる。治療剤は、例えば未変化分子、分子複合体、薬理学的に許容される塩、例えば硫酸塩、ラウリン酸塩、パルミチン酸塩、リン酸塩、亜硝酸塩、硝酸塩、ホウ酸塩、酢酸塩、マレイン酸塩、酒石酸塩、オレイン酸塩、サリチル酸塩などの種々の形態とすることができる。酸性治療剤に関しては、金属、アミンまたは有機カチオン、例えば第四級アンモニウムの塩を使用することができる。薬物の誘導体、例えば塩基、エステルおよびアミドもまた治療剤として使用できる。水に不溶性である治療剤は、その水可溶性誘導体形で、あるいはその塩基誘導体で使用できるが、いずれの場合においても、あるいはその送達によって、酵素によって、または体内のpHによって、または他の代謝過程によって元の治療活性体に変換される。
【0055】
治療剤は、化学療法剤、免疫抑制剤、サイトカイン、細胞毒、核酸分解化合物、放射性同位体、受容体およびプロドラッグ活性化酵素とすることができ、これらは天然に存在するもの、合成法もしくは組換え法によって製造されるもの、またはそれらの任意の組み合わせによるものであることもできる。
【0056】
古典的多剤耐性によって影響を受ける薬物、例えばビンカアルカロイド(例えば、ビンブラスチンおよびビンクリスチン)、アントラサイクリン(例えば、ドキソルビシンおよびダウノルビシン)、RNA転写阻害薬(例えば、アクチノマイシンD)ならびに微小管安定化薬(例えば、パクリタキセル)は、治療剤として特定の有用性を示すことができる。
【0057】
癌化学療法剤もまた好ましい治療剤とすることができる。有用な癌化学療法剤は、ナイトロジェンマスタード、ニトロソウレア、エチレンイミン、アルカンスルホナート、テトラジン、白金化合物、ピリミジンアナログ、プリンアナログ、代謝拮抗剤、葉酸アナログ、アントラサイクリン、タキサン系薬剤、ビンカアルカロイド、トポイソメラーゼ阻害薬およびホルモン剤を含む。典型的な化学療法剤は、アクチノマイシンD、アルケラン、Ara-C、アナストロゾール、アスパラギナーゼ、BiCNU、ビカルタミド、ブレオマイシン、ブスルファン、カペシタビン、カルボプラチン、カルボプラチナム、カルムスチン、CCNU、クロラムブシル、シスプラチン、クラドリビン、CPT-11、シクロホスファミド、シタラビン、シトシンアラビノシド、サイトキサン、ダカルバジン、ダクチノマイシン、ダウノルビシン、デクスラゾキサン、ドセタキセル、ドキソルビシン、DTIC、エピルビシン、エチレンイミン、エトポシド、フロックスウリジン、フルダラビン、フルオロウラシル、フルタミド、フォテムスチン、ゲムシタビン、ハーセプチン、ヘキサメチルアミン、ヒドロキシウレア、イダルビシン、イホスファミド、イリノテカン、ロムスチン、メクロレタミン、メルファラン、メルカプトプリン、メトトレキサート、マイトマイシン、ミトタン、ミトキサントロン、オキサリプラチン、パクリタキセル、パミドロネート、ペントスタチン、プリカマイシン、プロカルバジン、リツキシマブ、ステロイド、ストレプトゾシン、STI-571、ストレプトゾシン、タモキシフェン、テモゾロマイド、テニポシド、テトラジン、チオグアニン、チオテパ、トミュデックス、トポテカン、トレオスルファン、トリメトレキセート、ビンブラスチン、ビンクリスチン、ビンデシン、ビノレルビン、VP-16およびゼローダを含む。
【0058】
有用な癌化学療法剤はまた、チオテパおよびシクロホスファミドなどのアルキル化剤;ブスルファン、インプロスルファンおよびピポスルファンなどのアルキルスルホン酸塩;ベンゾドーパ、カルボコン、メツレドーパおよびウレドーパなどのアジリジン;アルトレタミン、トリエチレンメラミン、トリエチレンホスホルアミド、トリエチレンチオホスホラミドおよびトリメチロロメラミンを含むエチレンイミンおよびメチルアメラミン;クロラムブシル、クロルナファジン、クロロホスファミド、エストラムスチン、イホスファミド、メクロレタミン、メクロレタミンオキシド塩酸塩、メルファラン、ノベムビエヒン、フェネステリン、プレドニムスチン、トロフォスファミド、ウラシルマスタードなどのナイトロジェンマスタード;カヌスチン、クロロゾトシン、フォテムスチン、ロムスチン、ニムスチンおよびラニムスチンなどのニトロ尿素;アクラシノマイシン、アクチノマイシン、オースラマイシン、アザセリン、ブレオマイシン、カクチノマイシン、カリチェアミシン、カラビシン、カルミノマイシン、カルチノフィリン、クロモイニシン、ダクチノマイシン、ダウノルビシン、デトルビシン、6-ジアゾ-5-オキソ-L-ノルロイシン、ドキソルビシン、エピルビシン、エソルビシン、イダムビシン、マルセロマイシン、マイトマイシン、ミコフェノール酸、ノガラマイシン、オリボマイシン、ぺプロマイシン、ポトフィロマイシン、ピューロマイシン、クエラマイシン、ロドルビシン、ストレプトニグリン、ストレプトゾシン、ツベルシジン、ウベニメクス、ジノスタチンおよびゾルビシンなどの抗生物質;メトトレキサートおよび5-フルオロウラシル(5-FU)などの代謝拮抗剤;デノプテリン、メトトレキサート、プテロプテリン、およびトリメトレキセートなどの葉酸アナログ;フルダラビン、6-メルカプトプリン、チアミプリンおよびチオグアニンなどのプリンアナログ;アンシタビン、アザシチジン、6-アザウリジン、カルモフール、シタラビン、ジデオキシウリジン、ドキシフルリジン、エノシタビン、フロックスウリジンおよび5-FUなどのピリミジンアナログ;カルステロン、ドロモスタノロンプロピオナート、エピチオスタノール、ルネピチオスタンおよびテストラクトンなどのアンドロゲン;アミノグルテチミド、ミトタン、およびトリロスタンなどの抗副腎剤;フロリン酸などの葉酸補充剤;アセグラトン;アルドホスファミドグリコシド;アミノレブリン酸;アムサクリン;ベストラブシル;ビサントレン;エダトラキセート;デフォファミン;デメコルチン;ジアジコン;エルフォルニチン;酢酸エリプチニウム;エトグルシド;硝酸ガリウム;ヒドロキシウレア;レンチナン;ロニダミン;ミトグアゾン;ミトキサントロン;モピダモール;ニトラクリン;ペントスタチン;フェナメット;ピラルビシン;ポドフィリン酸;2-エチルヒドラジド;プロカルバジン;PSKR;ラゾキサン;シゾフラン;スピロゲルマニウム;テヌアゾン酸;トリアジクオン;2,2',2"-トリクロロトリエチルアミン;ウレタン;ビンデシン;ダカルバジン;マンノムスチン;ミトブロニトール;ミトラクトール;ピポブロマン;ガシトシン;アラビノシド("Ara-C");シクロホスファミド;チオテパ;タクソイド、例えば、パクリタキセル(TAXOL(登録商標)、Bristol Meyers Squibb Oncology社、ニュージャージー州プリンストン)およびドセタキセル(TAXOTERE(登録商標)、Rhone-Poulenc Rorer社、フランス・アントニー);クロラムブシル;ゲムシタビン;6-チオグアニン;メルカプトプリン;メトトレキサート;シスプラチンおよびカルボプラチンなどの白金アナログ;ビンブラスチン;白金;エトポシド(VP-16);イホスファミド;マイトマイシンC;ミトキサントロン;ビンクリスチン;ビノレルビン;ナベルビン;ノバントロン;テニポシド;ダウノマイシン;アミノプテリン;ゼローダ;イバンドロネート;CPT-11;トポイソメラーゼ阻害薬RFS2000;ジフルオロメチルオルニチン(DMFO);レチノイン酸;エスペラミシン;カペシタビン;ならびに上記のいずれかの薬学的に許容される塩、酸または誘導体を含む。腫瘍に対するホルモン作用を調節または抑制するように作用する抗ホルモン剤、例えば、タモキシフェン、ラロキシフェン、アロマターゼを阻害する4(5)-イミダゾール、4-ヒドロキシタモキシフェン、トリオキシフェン、ケオキシフェン、オナプロストンおよびトレミフェン(Fareston)を含む抗エストロゲン薬;フルタミド、ニルタミド、ビカルタミド、ロイプロリド、およびゴセレリンなどの抗アンドロゲン薬;ならびに上記のいずれかの薬学的に許容される塩、酸または誘導体もまた含まれる。
【0059】
サイトカインもまた治療剤として使用できる。このようなサイトカインの例には、リンホカイン、モノカインおよび旧来のポリペプチドホルモンがある。サイトカインに含まれるものには、ヒト成長ホルモン、N-メチオニルヒト成長ホルモンおよびウシ成長ホルモンなどの成長ホルモン;副甲状腺ホルモン;チロキシン;インスリン;プロインスリン;リラキシン;プロリラキシン;卵胞刺激ホルモン(FSH)、甲状腺刺激ホルモン(TSH)、および黄体形成ホルモン(LH)などの糖タンパク質ホルモン;肝細胞増殖因子;線維芽細胞増殖因子;プロラクチン;胎盤性ラクトゲン;腫瘍壊死因子-αおよび腫瘍壊死因子-β;ミュラー管抑制因子;マウスゴナドトロピン関連ペプチド;インヒビン;アクチビン;血管形成誘導因子;インテグリン;トロンボポエチン(TPO);NGF-βなどの神経成長因子;血小板由来成長因子;TGF-αおよびTGF-βなどのトランスフォーミング成長因子(TGF);インスリン様成長因子-Iおよびインスリン様成長因子-II;エリスロポエチン(EPO);骨誘導因子;インターフェロン-α、βおよびγなどのインターフェロン;マクロファージ-CSF(M-CSF)などのコロニー刺激因子(CSF);顆粒球・マクロファージ-CSF(GM-CSF);顆粒球-CSF(GCSF);IL-1、IL-1a、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、IL-9、IL-11、IL-12、IL-15などのインターロイキン(IL);TNF-αまたはTNF-βなどの腫瘍壊死因子;ならびにLIFおよびkitリガンド(KL)を含む他のポリペプチド因子がある。本明細書において、用語サイトカインは、自然源または組換え細胞培養物からのタンパク質および天然配列サイトカインの生物活性等価物を含む。
【0060】
イメージング剤は、哺乳動物またはヒトなどの動物の体内の標的部位に関する画像情報を提供できる物質とすることができる。イメージング剤は、磁気共鳴画像のためには、酸化鉄などの磁性材料を含むことができる。光学画像のためには、活性剤は、例えば半導体ナノ結晶または量子ドットとすることができる。光干渉断層撮影のためには、イメージング剤は、金属(例えば金または銀)ナノケージ粒子とすることができる。イメージング剤はまた、ミクロ・ナノバブルまたは酸化鉄ミクロ・ナノ粒子などの超音波造影剤とすることもできる。
組成物
特定の種類の細胞のためのあらかじめ選択された細胞内在化様式を有する粒子は、組成物、例えば医薬組成物の一部とすることができる。このような組成物は、治療剤またはイメージング剤の投与に使用する前述の粒子を含む懸濁液とすることができる。懸濁液を調製するために、選択された濃度で水性媒体に粒子を懸濁することができる。最適濃度は、粒子の特性(例えば、可溶化特性)、治療用途の種類および投与方法によって決めることができる。例えば、経口投与用組成物は、比較的粘性のあるものとすることができ、従ってより高濃度(例えば、>50%)の粒子を含ませることができる。ボーラス注射用溶液は、好ましくは、比較的高い濃度の粒子の懸濁液(例えば、10〜50%)を含むが、生理食塩水よりも明らかに高い粘度を有するほどには濃度は高くない(大口径の針の必要性を最小限にするために)。持続静注法に用いる溶液は、一般的には、比較的大容量の流体が投与されるため、比較的低濃度(例えば、2〜10%懸濁液)の粒子を含むことができる。
【0061】
粒子は、多くの適切な水性担体ビヒクルに懸濁することができる。適切な医薬担体は、用いられる投与量および濃度でレシピエントに無毒であり、製剤中の他の成分と適合する担体とすることができる。適切な担体ビヒクルの例は、限定するものではないが、水、生理食塩水、リンゲル液、デキストロース溶液および5%ヒト血清アルブミンを含む。注射剤に使用する懸濁液は、好ましくは、被験者の血液と等張である。一般に、担体は、等張性および化学的安定性を高める物質などの少量の添加剤、例えば緩衝液および防腐薬を含むことができ、同様に低分子量(約10未満の残基)ポリペプチド、タンパク質、アミノ酸、炭水化物(グルコースまたはデキストランを含む)、キレート剤例えばEDTAまたは他の賦形剤もまた含むことができる。
【0062】
被験者への投与の前に、粒子の懸濁液を適切な滅菌方法によって滅菌することができる。耐熱性材料から加工された粒子は、例えばオートクレーブを用いて熱滅菌することができる。耐熱性材料から加工された粒子は、市販の滅菌フィルターを通過させることによって滅菌することができる。もちろん、濾過は、滅菌フィルターの孔よりも粒子が小さい場合に限り利用することができる。
【0063】
多くの適切な投与方法によって、治療介入が必要な被験者に粒子を投与することができる。担当医は、特定の用途のために用いられる特定の方法を決定することができる。例えば、粒子は、以下の経路:局所、非経口、吸入、経口、経膣および経肛門の1つによって投与できる。静脈内(i.v.)、筋肉内(i.m.)および皮下(s.c.)注射を含む血管内投与が特に好ましい。血管内投与は、局所投与または全身投与のいずれかにすることができる。CATスキャンガイドカテーテルなどのガイドカテーテルシステムを用いて、既知の腫瘍または炎症を有する身体部位の近傍に粒子をもたらすために、局所血管内送達を用いることができる。一般的な注射、例えばボーラス静注または持続/点滴静注は、一般的には全身性である。
【0064】
粒子は、血流中に注入し、循環させ、その標的部位に局在化させることができる。好ましくは、粒子は、標的部位の血管系に注入される。
引用文献
1. Gao H, et al. 2005. Proc. Natl. Acad. Sci. USA 102:9469-74.
2. Sun S.X. and D. Wirtz. 2006. Biophysical Journal 90:L10-2.
3. Champion J.A., et al. 2007. Proc. Natl. Acad. Sci. USA 104:11901-4.
4. Champion J.A., S. Mitragotri. 2006. Proc. Natl. Acad. Sci. USA 103:4930-4.
5. Rolland J.P., et al. 2005. J. Am. Chem. Soc. 127:10096-100.
6. Cohen M.H, et al. 2001. Biomedical Microdevices 3:253-259.
7. Harris A, G. et al. 2006. Proc. Natl. Acad. Sci. USA 103:19123-7
8. Freund L. B. and Y. Lin. 2004. Journal of the Mechanics and Physics of Solids 52:2455-2472
9. Hill TL. 1960. An Introduction to Statistical Thermodynamics. Dover Publicatgions, Inc. New York.
10. Herant M., et al. 2006. J. Cell. Sci. 119: 1903-13.
11. Smythe E., K.R. Ayscough. 2006. J. Cell Sci. 119: 4589-98.
12. May R.C., L.M. Machesky. 2001.J. Cell Sci. 114: 1061-77.
13. Simson R, et al. 1998. Biophysical Journal. 74: 514-522.
14. Herant M, et al. 2005. J. Cell Sci. 118:1789-97.
前記のものは、特定の好ましい実施形態についてのものであるが、当然のことながら本発明はそれらに限定されない。開示された実施形態に種々の改変を行うことができることは当業者には明らかであり、そのような改変は、本発明の範囲内であるものとする。
【0065】
本明細書に引用したすべての公報、特許出願および特許は、参照により本願に組み込まれる。
【図面の簡単な説明】
【0066】
【図1】楕円断面を有する粒子の概略図である。前記粒子は、その表面に細胞膜の表面の受容体分子と相互作用できるリガンド分子を有する。
【図2】50nmに固定したR2に対する、0.9から4までの範囲のアスペクト比Γの関数としての半ラッピング時間0.5τwおよびラッピング長さ比xmax/R1を示す楕円円筒形粒子の漸進的変化を示す図である。
【図3】R2の関数としての、一定のR2に対する半ラッピング時間の最小値に対応するΓの値であるΓminのグラフを示す図である。この図はまた、R2の関数としての、Γminに対する半ラッピング時間のグラフも示す。
【図4】一定の体積(Rs=50nm)に対する、0.9から4までの範囲のアスペクト比Γの関数としての半ラッピング時間0.5τwおよびラッピング長さ比xmax/R1を示す楕円円筒形粒子の漸進的変化を示す図である。
【技術分野】
【0001】
連邦政府支援研究に関する陳述
本発明の基礎をなす研究の一部は、米国国防総省グラント番号W81XWH-04-2-0035およびNASAグラント番号SA23-06-017からのフェデラルファンドによる支援を受けた。米国政府は、これらの発明に一定の権利を有する。
技術分野
本発明は、一般に、ミクロおよびナノ粒子組成物およびその用途に関し、より具体的には、特定のあらかじめ選択された細胞内在化様式を有するミクロおよびナノ粒子組成物に関する。
【背景技術】
【0002】
エンドサイトーシスは、それによって、選択された細胞外種、例えば分子、ウイルス、粒子および微生物を細胞が取り込み、かつ/または放出し、それらを細胞質内の特定の細胞小器官に輸送することができるプロセスを定義する一般用語である。エンドサイトーシスは、クラスリン依存性およびカベオラ依存性エンドサイトーシス;食作用;クラスリン・カベオラ非依存性エンドサイトーシスを含む種々の経路によって行われることができる。特定のエンドサイトーシス経路は、細胞外のカーゴ(cargo)のサイズおよび性質に左右されうる。例えば、Conner S.D. and SX. Schmid. 2003. Nature 422: 37-44 を参照のこと。例えば、カベオラ依存性エンドサイトーシスは、50〜60nmの特徴的サイズを有する細胞膜陥入構造であるカベオラの活性化によって促進され;クラスリン依存性エンドサイトーシスは、数百ミクロン(100〜500nm)までの特徴的サイズを有する小胞ケージ(vesicular cage)の形成を引き起こす、細胞膜の膜貫通受容体およびその結合リガンドの集積を必要とし;食作用は、最終的に1マイクロメートルより大きい(>1μm)カーゴを包む細胞膜の突起の形成をもたらす特定の細胞表面受容体およびシグナル伝達カスケードを含む。クラスリンおよびカベオラ非依存性エンドサイトーシスは、100nmより小さい陥入小胞(invaginating vesicle)の形成と関連している可能性がある。
【0003】
粒子エンドサイトーシス(particle endocytosis)は、いくつかの分野、例えばウイルス学、薬物送達、遺伝子送達およびナノトキシコロジーにおいてきわめて重要な可能性がある。例えば、Marsh M. and A. Helenius. 2006. Cell 124:729-40; Vasir J.K., and V. Labhasetwar. 2006. Expert Opin. Drug Deliv. 3:325-344; Oberdorster G., E. Oberdorster, J. Oberdorster. 2005. 113:823-39 を参照のこと。
【0004】
ナノ粒子に関しては、エンベロープウイルスなどの天然のナノ粒子であってもバイオミメティック微粒子などの人工のナノ粒子であっても、最も有効な内在化機構は、粒子表面上に分布する分子(リガンド)が細胞膜上に発現された対分子(受容体)に結合し、最終的に細胞膜を曲げて外来カーゴを陥入させることができる受容体依存性エンドサイトーシスとすることができる。例えば、Marsh M. and A. Helenius. 2006. Cell 124:729-40; Smith A.E., A. Helenius. 2004. Science 304:237-42 を参照のこと。これらの受容体は表面拡散によって陥入部位に集積することができるが、もしそれがなければ、エンドサイトーシスは起こらないか、あるいはより長い時間スケールで起こると考えられる。
【発明の概要】
【0005】
一実施形態は、あらかじめ選択された細胞内在化様式を有する粒子組成物の製剤化方法であって、a)表面受容体を有する細胞を選択し;b)i)表面部分であって、前記受容体に親和性を有するかまたは結合することができる前記表面部分およびii)形状であって、前記表面部分の表面分布および前記形状が、選択された細胞のあらかじめ選択された細胞内在化様式に有効である前記形状を有する粒子を得ることを含む前記方法を提供する。
【0006】
他の実施形態は、それを必要とする被験者にあらかじめ選択された細胞内在化様式を有する粒子組成物の有効量を投与することを含む、生理的状態の治療方法またはモニタリング方法である。
【0007】
さらに他の実施形態は、あらかじめ選択された細胞内在化様式を有する粒子組成物である。
発明の詳細な説明
関連文献
以下の研究論文および特許文献(参照によりその全体が本願に組み込まれる)は、本発明を理解する上で有用である
1)国際公開番号WO2007/120248、公開日:2007年10月25日;
2)国際公開番号WO2008/041970、公開日:2008年4月10日;
3)国際公開番号WO2008/021908、公開日:2008年2月21日;
4)米国特許出願公開第2008/0102030号、公開日:2008年5月1日;
5)米国特許出願公開第2003/0114366号;
6)米国特許出願第12/034,259号、出願日:2008年2月20日;
7)米国特許出願第12/110,515号、出願日:2008年4月28日;
8) Tasciotti et al, Nature Nanotechnology, vol. 3, 151-158, 2008;
9) Decuzzi and Ferrari, Biomaterials 28, 2007, 2915-2922;
10) Decuzzi and Ferrari, Biophysical Journal, 94, 2008, 3790-3797。
定義
特記しない限り、ある("a"または"an")は、1以上のを意味する。
【0008】
特記しない限り用語"エンドサイトーシス"および"エンドサイトーシスの"は、それぞれ、受容体依存性エンドサイトーシスおよび受容体依存性エンドサイトーシスのを意味する。
【0009】
"ミクロ粒子"は、最大寸法が1マイクロメートルから1000マイクロメートルまでの粒子のことを言うが、いくつかの実施形態においては、規定されているように1ミクロンから100ミクロンまでの粒子のことを言う。
【0010】
"ナノ粒子"は、最大寸法が1ミクロン未満の粒子のことを言う。
"食作用"は、マクロファージ、単球および好中球を含む専門化した食細胞による大きな(2ミクロンを超える特徴的サイズの)粒子の取り込みのことを言う。食作用は、最終的に外部粒子を包むための細胞膜における突起の形成を含む。
【0011】
"受容体依存性エンドサイトーシス"すなわちRMEは、細胞膜上に発現された対部分(受容体)に結合できるリガンドなどの部分がその表面に分布する粒子の細胞による内在化のことを言う。RMEは、それによって、膜による粒子の完全なラッピング(wrapping)と、細胞による粒子の最終的な内在化が起こる細胞膜の曲げを含む。RMEによって内在化される粒子は、食作用によって内在化される粒子よりも小さい特徴的サイズを有しうる。RMEは、食細胞には限定されない。
【0012】
"生分解性"は、生理的媒体中で溶解または分解されうる材料、あるいは生理的条件下で生理的酵素および/または化学的条件によって分解されうる生体適合性ポリマー材料のことを言う。
開示
本発明者らは、受容体依存性エンドサイトーシスにとって粒子形状が重要であることを見出した。従って、本発明は、あらかじめ選択された細胞内在化様式を有する粒子組成物の製剤化方法であって、標的細胞を選択し、標的細胞の表面の表面受容体に親和性を有するかまたは結合することができる表面部分を表面に有する粒子を得ることを含むことができる前記方法を提供する。粒子上の表面部分の表面分布および粒子の形状は、選択された細胞のあらかじめ選択された細胞内在化様式に有効である。
【0013】
あらかじめ選択された細胞内在化様式は、"エンドサイトーシス"様式または"非エンドサイトーシス(no-endocytosis)"様式から選択することができる。"エンドサイトーシス"は、受容体依存性エンドサイトーシスによって細胞膜で粒子が完全に包まれ、最終的に内在化されることができる様式のことを言い、"非エンドサイトーシス"は、最大限でも細胞膜によって粒子が部分的にしか包まれない様式のことを言う。
【0014】
いくつかの実施形態において、あらかじめ選択された細胞内在化様式は、不完全エンドサイトーシスすなわち部分エンドサイトーシスとすることができる。"不完全エンドサイトーシス(frustrated endocytosis)"は、粒子が細胞膜によって部分的にしか包まれず、細胞が内在化されない様式のことを言う。
【0015】
生理的状態の治療および/またはモニタリングのために、あらかじめ選択された細胞内在化様式を有する粒子を用いることができる。この場合には、哺乳動物、好ましくはヒトなどの被験者の体内において、生理的状態に影響を受け表面に表面受容体を有する細胞を有する標的部位を選択し、標的部位の細胞のあらかじめ選択された内在化様式を有する粒子を含む組成物の有効量を被験者に投与することができる。生理的状態は例えば疾患とすることができ、例えば癌または炎症とすることができる。
【0016】
一般に、選択された細胞は、その表面に表面受容体を有する任意の種類の細胞とすることができる。多くの実施形態において、選択された細胞は、ヒト細胞などの哺乳動物細胞とすることができる。
【0017】
特定の選択された内在化様式は、粒子を対象とする用途に左右されうる。例えば、細胞内に送達されることが所望されるイメージング剤または治療剤などのカーゴを粒子が含む場合、エンドサイトーシス様式が好ましい場合がある。他方では、細胞内への送達を目的としないカーゴを粒子が含む場合、非エンドサイトーシスまたは不完全エンドサイトーシス様式が好ましい場合がある。このような状況の1例として、国際公開WO2008/021908に開示されている多段階送達ビヒクルを挙げることができる。多段階送達ビヒクルにおいては、ビヒクルの第1段階粒子(内部に第2段階粒子を含む)は、内皮における標的部位を認識し、それに接着することを目的とし、これは内皮細胞によって内在化されない。接着後、第1段階粒子は、第2段階粒子を放出することができる。
【0018】
多くの実施形態において、選択された細胞は非食細胞、すなわち食作用を行うことができない細胞とすることができる。食細胞、すなわち食作用を行うことができる細胞の例は、好中球、単球およびマクロファージを含む。
【0019】
いくつかの実施形態において、選択された細胞は、血管内皮細胞などの内皮細胞とすることができ、標的部位は、取り込まれた(coopted)血管、新生血管または再正常化された(renormalized)血管などの血管部位とすることができる。取り込まれた血管の細胞に関しては、表面受容体はアンギオポエチン2受容体とすることができ;新生血管の細胞に関しては、表面受容体は、血管形成誘導因子(VEGF)、塩基性線維芽細胞増殖因子または、αvβ3インテグリンなどの内皮マーカーとすることができ;再正常化された血管の細胞に関しては、表面受容体は癌胎児性抗原関連細胞接着分子1(CEACAM1)、エンドセリン-B受容体(ET-B)、血管内皮細胞増殖因子インヒビターグラビン/AKAP12、プロテインキナーゼAおよびプロテインキナーゼCの足場タンパク質とすることができる。
【0020】
粒子表面の表面部分は、選択された細胞表面の受容体に相補的であることができる。表面部分は、例えば、選択された細胞膜表面の受容体に親和性を有するかまたは結合することができる抗体、アプタマーまたはリガンドとすることができる。いくつかの実施形態において、表面部分は、選択された細胞膜表面の受容体に対する特異的部分を含むことができる。いくつかの実施形態において、表面部分は、選択された細胞膜表面の受容体に対する非特異的部分を含むことができる。さらに他の実施形態において、表面部分は特異的部分および非特異的部分の両方を含むことができる。
【0021】
あらかじめ選択された内在化様式を有する粒子は、あらかじめ選択された内在化様式を有さない粒子を含むこともできる組成物の一部とすることができる。あらかじめ選択された内在化様式を有する粒子は、組成物中の粒子の総数のうち、少なくとも10%または少なくとも25%または少なくとも50%または少なくとも75%または少なくとも90%の数を構成することができる。
【0022】
多くの実施形態において、粒子は非球形粒子とすることができる。いくつかの実施形態において、粒子は円形断面を有する粒子とすることができる。いくつかの実施形態において、粒子は楕円体粒子とすることができる。さらに他の実施形態において、粒子は、円柱の軸と直角の方向に楕円断面を有する円筒形粒子とすることができる。
【0023】
いくつかの実施形態において、楕円断面を有する粒子の主軸の長さなどの、粒子の最大の特徴的サイズは、2ミクロン未満とすることができ、あるいは1ミクロン未満または800nm未満または5nm〜500nmまたは5nm〜800nmまたは5nm〜1ミクロンまたは10nm〜1ミクロンまたは10nm〜800nmまたは10nm〜500nmまたは20nm〜1ミクロンまたは20nm〜800nmまたは20nm〜500nmまたは50nm〜1ミクロンまたは50nm〜800nmまたは50nm〜500nmとすることができる。
【0024】
好ましくは、粒子の最大の特徴的サイズは、選択された細胞の特徴的サイズよりも実質的に小さい。粒子の最大の特徴的サイズは、選択された細胞の特徴的サイズよりも少なくとも3倍小さいか、または少なくとも5倍小さいか、または少なくとも10倍小さいか、または少なくとも20倍小さいか、または少なくとも30倍小さいか、または少なくとも50倍小さいか、または少なくとも100倍小さいか、または少なくとも200倍小さいか、または少なくとも300倍小さいか、または少なくとも500倍小さいか、または少なくとも100倍小さいものとすることができる。選択された細胞の特徴的サイズは、約5ミクロンから約40ミクロンまでとすることもできるし、約10ミクロンから約30ミクロンまでとすることもできる。
【0025】
いくつかの実施形態において、得られた粒子が、受容体依存性エンドサイトーシスによる粒子の内在化に有効な局所曲率(local curvature)および、リガンドなどの部分の局所表面密度を有する凸亜表面(convex subsurface)を有する粒子とすることができ、このことは、前記局所曲率κが、部分の局所表面密度に関する最大エンドサイトーシス曲率κmaxよりも小さい事を意味する。最大エンドサイトーシス曲率は、粒子の表面における部分と選択された細胞膜の表面の受容体との間の結合エネルギー、選択された細胞膜の曲げエネルギー係数ならびに粒子の部分の表面密度および選択された細胞膜の受容体表面密度によって決めることができる。最大エンドサイトーシス曲率を求める方法を以下に開示する。
【0026】
いくつかの実施形態において、凸面における部分の局所表面密度を、粒子の表面の他の部分における部分の表面密度より大きくし、それによって粒子の表面における表面部分の表面分布を不均一にすることができる。
【0027】
楕円断面を有する粒子に関しては、あらかじめ選択された細胞内在化様式を有する粒子を得ることは、選択された様式に対応するアスペクト比(aspect ratio)を有する粒子を得ることを含むことができる。
【0028】
例えば、図1は、特異的なリガンド・受容体結合によって膜と相互作用する楕円円筒形粒子の楕円断面を示す。粒子の表面におけるリガンドの表面密度はmlであるのに対し、細胞膜の表面における受容体の表面密度はmrである。
【0029】
楕円断面はR1およびR2によって特徴づけることができる。これらは楕円の半軸長さである。楕円のアスペクト比はΓ=R1/R2で定義できる。粒子の断面積は、A=πR1R2=πΓR22=πRs2(式中、Rsは、楕円粒子と同じ断面積を有する円形断面を有する粒子の半径)である。
【0030】
粒子の外形寸法は、いくつかのパラメータ対、例えばR1およびR2;ΓおよびR1;ΓおよびR2;ΓおよびRsまたはΓおよびV(Vは粒子の体積である)によって十分に定義できる。
粒子の外形寸法がΓおよびR2によって定義される場合は、あらかじめ選択された内在化様式を決定するための形状パラメータは、特定のR2に対するアスペクト比Γとすることができる。
【0031】
楕円断面を有する粒子は、特定の半短軸長さに対するその粒子のアスペクト比が、第1臨界値Γ'=(R2κmax)-1/2(式中、κmaxは、下記で定義する最大エンドサイトーシス曲率である)未満である場合、"非エンドサイトーシス"様式に含まれることができる。
【0032】
粒子は、その特定の半短軸長さに対するその粒子のアスペクト比が第2臨界値Γ"=R2κmax未満である場合、不完全エンドサイトーシス様式に含まれることができる。
粒子は、その特定の半短軸長さに対するその粒子のアスペクト比が第1臨界値Γ'を超え、第2臨界値Γ"未満である場合、エンドサイトーシス様式に含まれることができる。
【0033】
最大エンドサイトーシス曲率κmaxは、その表面に非球形粒子と同じリガンドを有する球形粒子または円形断面を有する粒子の、選択された細胞に関して算出された最小エンドサイトーシス半径の逆数として定義できる。
【0034】
最小エンドサイトーシス半径、従って最大エンドサイトーシス曲率は、式(1)
【0035】
【数1】

【0036】
を用いて求めることができる。
上記の方程式において、CはκBTに対するリガンド-受容体結合エネルギーである。式中κBはボルツマン定数であり、Tはケルビンで表した細胞または標的部位の温度(絶対温度)である。Cは、特定のリガンド-受容体対に左右される。具体的には、C=log[Kd2D]であり、Kd2Dは細胞/粒子界面で相互作用しているリガンド-受容体の平衡解離定数である。Kd2Dは、関係式Kd2D=Kd/h(式中、Kdは、例えば溶液中実験的に測定された、同じリガンド-受容体対の平衡解離定数であり、hは、リガンド-受容体部位が限定される限定領域(confinement region)の厚さである)によって算出できる。多くの場合、hはおおよそ10nm程度とすることができる。
【0037】
Bは細胞膜の曲げエネルギー係数であり、これはHochmuth,R.M., J.Biomech., 33:15-22,2000に詳述されているようにして測定できる。
受容体の平均表面密度であるmrは、粒子が細胞と相互作用していない場合、当業者に公知の方法を用いて測定できる。例えば、Panes J., et al. Am. J. Physiol. 1995; 269(6Pt2):H1955-64 において細胞間接着分子1受容体に関して詳述されているような、受容体に相補的な放射性標識モノクローナル抗体を用いて、in vivoでmrを測定できる。代わりに、受容体に相補的な蛍光標識モノクローナル抗体を用いて、mrを測定できる。このような蛍光標識モノクローナル抗体は、米国特許第4,520,110号に開示されている、フィコエリスリンで標識された抗体とすることができる。
【0038】
mlは、リガンドの局所表面密度mlである。これは、粒子の表面機能化条件を調節することによって、かつ/またはリガンド分子のサイズを変えることによって変えることができる。粒子上のリガンドの実際の表面密度は、細胞蛍光測定法またはラジオアッセイにおける放射性標識対分子を用いて実験的に証明できる。
【0039】
リガンドの均一な表面分布を有する粒子に関しては、局所表面密度と平均表面密度は同じとすることができる。
特定の実施形態において、最小エンドサイトーシス半径すなわち最大エンドサイトーシス曲率は、米国特許出願第12/034,259号"Endocytotic particles"(出願日:2008年2月20日)に開示されているようにして求めることができる(参照によりその全体が本願に組み込まれる)。
【0040】
図2は、Decuzzi and Ferrari, Biophysical Journal, 94, 2008, 3790-3797 に開示されている理論モデル(参照によりその全体が本願に組み込まれる)を用いて評価した、R2=50nmに対する、0.9から4までの範囲のアスペクト比Γの関数としての半ラッピング時間0.5τwおよびラッピング長さ比xmax/R1を示す楕円円筒形粒子の漸進的変化を示す。xmaxは、図1におけるx軸への粒子のラッピング長さの投影である。xmax/R1=1の場合、時間τwにおいて完全ラッピングが起こる。図2において、Γ<Γcrの場合(この場合、Γはおよそ0.9である)、ラッピングは開始さえできないので、τwは無限に大きくなり、比xmax/R1は存在しない。Γが中間の値Γcr'<Γ<Γcr"である場合、比xmax/R1は常に1であり、このことは粒子の完全な内在化が起こり、0.5rwはΓと共にほぼ直線的に増大することを意味する。Γ>Γcr"の場合、xmax/R1は減少して最小に達し、次いでΓの増加と共に徐々に増加する。
【0041】
図3は、R2の関数としての、一定のR2に対する半ラッピング時間の最小値に対応するΓの値であるΓminのグラフを示す。図3はまた、R2の関数としての、Γminに対する半ラッピング時間のグラフも示す。同じデータを、Γcr'およびΓcr"と共に表1に示す。
【0042】
【表1】

【0043】
粒子サイズR2が増大するに従って、内在化時間が最小であるアスペクト比Γminは、1(R2=Rmin)から0.3(R2=500nm)まで減少する。
場合によっては、楕円円筒形粒子の外形寸法を記載する2つのパラメータはΓおよびRsとすることができる。
【0044】
このような場合、あらかじめ選択された細胞内在化様式を決定する形状パラメータは、特定の値のRsに対するアスペクト比Γとすることができる。
楕円断面を有する粒子は、特定の半短軸長さに対するその粒子のアスペクト比が、第1臨界値Γ1'=(Rsκmax)-2/3(式中、κmaxは、下記で定義する最大エンドサイトーシス曲率である)未満である場合、"非エンドサイトーシス"様式に含まれることができる。
【0045】
粒子は、その特定の半短軸長さに対するその粒子のアスペクト比が第2臨界値Γ1"=(Rsκmax)2/3未満である場合、不完全エンドサイトーシス様式に含まれることができる。
粒子は、その特定の半短軸長さに対するその粒子のアスペクト比が第1臨界値Γ1'を超え、第2臨界値Γ2"未満である場合、エンドサイトーシス様式に含まれることができる。
【0046】
図4は、Decuzzi and Ferrari, Biophysical Journal, 94, 2008, 3790-3797 に開示されている理論モデル(参照によりその全体が本願に組み込まれる)を用いて評価した、Rs=50nmに対する、0.9から4までの範囲のアスペクト比Γの関数としての半ラッピング時間0.5τwおよびラッピング長さ比xmax/R1を示す楕円円筒形粒子の漸進的変化を示す。
粒子の種類
あらかじめ選択された内在化様式を有する粒子の種類は特に限定されない。例えば、粒子は、リポソーム、ポリマーベース粒子、シリコンおよびシリカベース粒子、量子ドット、金ナノシェル、デンドリマーまたはウイルス粒子とすることができる。
【0047】
いくつかの実施形態において、粒子は、あらかじめ選択された内在化様式に有効な形状に加工することができる。さらにいくつかの実施形態において、あらかじめ選択された内在化様式に有効な形状を有する粒子は、形状および/またはサイズの幅広い分布を有することができる粒子のプールから選択されることができる。粒子のプールからの選択は、例えば、粒子の幾何学的寸法を測定することが可能な、Malvern Instruments社(英国ウスターシア州)製のZetasizer(登録商標)Nanoシリーズ機器を用いて行うことができる。
【0048】
粒子は、多くの方法を用いて加工するすることができる。一般に、粒子のサイズと形状の制御を提供する加工方法が好ましい。
いくつかの実施形態において、粒子は、トップダウンのミクロ加工またはナノ加工法、例えばフォトリソグラフィー、電子ビームリソグラフィー、X線リソグラフィー、遠紫外線リソグラフィーまたはナノプリントリソグラフィーによって加工することができる。トップダウンの加工方法を用いる利点は、このような方法が、寸法が均一な粒子の大規模製造を提供できるということであると言える。
【0049】
粒子は、その表面に、リガンド、アプタマーまたは抗体などの標的部分を有することができる。例えば、リガンドは、粒子の表面の適切な反応性基に化学的に結合されることができる。タンパク質リガンドは、チオエーテルまたはアミド結合をそれぞれ形成するのに有効な条件下でアミノ反応性基およびチオール反応性基に結合されることができる。抗体または他のポリマー結合剤を無機またはポリマー担体に結合させる方法は、例えば、Taylor, R., Ed., Protein Immobilization Fundamentals and Applications, pp. 109110 (1991) に詳述されている。
【0050】
表面部分の不均一な表面分布は、例えば、トップダウンのミクロ加工またはナノ加工法によって粒子を製造するとき達成できる。例えば、粒子が少なくとも2つの異なる表面領域(1つはリガンドの沈着に抵抗するもの、1つはそうでないもの)を有するように、リガンドの沈着に抵抗するコーティングを用いて基質(それから粒子が製造される)をパターニングできる。続いて、リガンドを含有する溶液に基質を暴露することによって、基質からの放出によってリガンドの不均一な分布を有する粒子をもたらすことができる。
【0051】
いくつかの実施形態において、粒子は、リザーバーと表面とを接続する1以上のチャネルを有することができる。いくつかの実施形態において、リザーバーとチャネルは、粒子の本体における孔とすることができる。この場合において、粒子は多孔質またはナノ多孔質材料を含むことができる。多孔質またはナノ多孔質材料の孔を制御して、活性剤の所望の負荷および/または所望の放出速度を得ることができる。制御可能な孔径を有するナノ多孔質材料には、SiO2、Al2O3またはTiO2などの酸化物材料を挙げることができる。ゾルゲル粒子とも呼ばれるナノ多孔質酸化物粒子の加工は、例えば、Paik J. A. et. al. J. Mater. Res., Vol. 17, Aug 2002 に詳述されている。制御可能な孔径を有するナノ多孔質材料には、ナノ多孔質シリコンを挙げることもできる。ナノ多孔質シリコン粒子の加工の詳細に関しては、例えば、Cohen M. H. et. ah Biomedical Microdevices 5:3, 253-259, 2003 を参照のこと。
【0052】
いくつかの他の実施形態において、粒子は、チャネルを全く有さないものとすることができる。このような粒子は、例えば、生分解性材料を含むことができる。例えば、粒子は、鉄、チタニウム、金、銀、白金、銅などの金属ならびにそれらの合金および酸化物で形成されることができる。生分解性材料はまた、ポリオルトエステル、ポリアンヒドリド、ポリアミド、ポリアルキルシアノアクリル酸、ポリホスファゼンおよびポリエステルなどの生分解性ポリマーとすることができる。典型的な生分解性ポリマーは、例えば米国特許第4,933,185号、第4,888,176号および第5,010,167号に記載されている。このような生分解性ポリマー材料の具体例は、ポリ乳酸、ポリグリコール酸、ポリカプロラクトン、ポリヒドロキシ酪酸、ポリ(N-パルミトイル-トランス-4-ヒドロキシ-L-プロリンエステル)およびポリ(DTHカルボナート)を含む。
【0053】
特定の実施形態において、粒子は、それ自体を活性剤とすることができる。
活性剤
活性剤は、治療化合物および/またはイメージング剤とすることができる。特定の活性剤の選択は、所望の用途に左右される。
【0054】
治療剤は、哺乳動物またはヒトなどの被験者の有窓性血管に所望の生物学的作用を生じさせることができる生理活性物質または薬理活性物質とすることができる。治療剤は、無機化合物とすることもできるし、ペプチド、タンパク質、核酸および小分子を含む有機化合物とすることもできる。治療剤は、例えば未変化分子、分子複合体、薬理学的に許容される塩、例えば硫酸塩、ラウリン酸塩、パルミチン酸塩、リン酸塩、亜硝酸塩、硝酸塩、ホウ酸塩、酢酸塩、マレイン酸塩、酒石酸塩、オレイン酸塩、サリチル酸塩などの種々の形態とすることができる。酸性治療剤に関しては、金属、アミンまたは有機カチオン、例えば第四級アンモニウムの塩を使用することができる。薬物の誘導体、例えば塩基、エステルおよびアミドもまた治療剤として使用できる。水に不溶性である治療剤は、その水可溶性誘導体形で、あるいはその塩基誘導体で使用できるが、いずれの場合においても、あるいはその送達によって、酵素によって、または体内のpHによって、または他の代謝過程によって元の治療活性体に変換される。
【0055】
治療剤は、化学療法剤、免疫抑制剤、サイトカイン、細胞毒、核酸分解化合物、放射性同位体、受容体およびプロドラッグ活性化酵素とすることができ、これらは天然に存在するもの、合成法もしくは組換え法によって製造されるもの、またはそれらの任意の組み合わせによるものであることもできる。
【0056】
古典的多剤耐性によって影響を受ける薬物、例えばビンカアルカロイド(例えば、ビンブラスチンおよびビンクリスチン)、アントラサイクリン(例えば、ドキソルビシンおよびダウノルビシン)、RNA転写阻害薬(例えば、アクチノマイシンD)ならびに微小管安定化薬(例えば、パクリタキセル)は、治療剤として特定の有用性を示すことができる。
【0057】
癌化学療法剤もまた好ましい治療剤とすることができる。有用な癌化学療法剤は、ナイトロジェンマスタード、ニトロソウレア、エチレンイミン、アルカンスルホナート、テトラジン、白金化合物、ピリミジンアナログ、プリンアナログ、代謝拮抗剤、葉酸アナログ、アントラサイクリン、タキサン系薬剤、ビンカアルカロイド、トポイソメラーゼ阻害薬およびホルモン剤を含む。典型的な化学療法剤は、アクチノマイシンD、アルケラン、Ara-C、アナストロゾール、アスパラギナーゼ、BiCNU、ビカルタミド、ブレオマイシン、ブスルファン、カペシタビン、カルボプラチン、カルボプラチナム、カルムスチン、CCNU、クロラムブシル、シスプラチン、クラドリビン、CPT-11、シクロホスファミド、シタラビン、シトシンアラビノシド、サイトキサン、ダカルバジン、ダクチノマイシン、ダウノルビシン、デクスラゾキサン、ドセタキセル、ドキソルビシン、DTIC、エピルビシン、エチレンイミン、エトポシド、フロックスウリジン、フルダラビン、フルオロウラシル、フルタミド、フォテムスチン、ゲムシタビン、ハーセプチン、ヘキサメチルアミン、ヒドロキシウレア、イダルビシン、イホスファミド、イリノテカン、ロムスチン、メクロレタミン、メルファラン、メルカプトプリン、メトトレキサート、マイトマイシン、ミトタン、ミトキサントロン、オキサリプラチン、パクリタキセル、パミドロネート、ペントスタチン、プリカマイシン、プロカルバジン、リツキシマブ、ステロイド、ストレプトゾシン、STI-571、ストレプトゾシン、タモキシフェン、テモゾロマイド、テニポシド、テトラジン、チオグアニン、チオテパ、トミュデックス、トポテカン、トレオスルファン、トリメトレキセート、ビンブラスチン、ビンクリスチン、ビンデシン、ビノレルビン、VP-16およびゼローダを含む。
【0058】
有用な癌化学療法剤はまた、チオテパおよびシクロホスファミドなどのアルキル化剤;ブスルファン、インプロスルファンおよびピポスルファンなどのアルキルスルホン酸塩;ベンゾドーパ、カルボコン、メツレドーパおよびウレドーパなどのアジリジン;アルトレタミン、トリエチレンメラミン、トリエチレンホスホルアミド、トリエチレンチオホスホラミドおよびトリメチロロメラミンを含むエチレンイミンおよびメチルアメラミン;クロラムブシル、クロルナファジン、クロロホスファミド、エストラムスチン、イホスファミド、メクロレタミン、メクロレタミンオキシド塩酸塩、メルファラン、ノベムビエヒン、フェネステリン、プレドニムスチン、トロフォスファミド、ウラシルマスタードなどのナイトロジェンマスタード;カヌスチン、クロロゾトシン、フォテムスチン、ロムスチン、ニムスチンおよびラニムスチンなどのニトロ尿素;アクラシノマイシン、アクチノマイシン、オースラマイシン、アザセリン、ブレオマイシン、カクチノマイシン、カリチェアミシン、カラビシン、カルミノマイシン、カルチノフィリン、クロモイニシン、ダクチノマイシン、ダウノルビシン、デトルビシン、6-ジアゾ-5-オキソ-L-ノルロイシン、ドキソルビシン、エピルビシン、エソルビシン、イダムビシン、マルセロマイシン、マイトマイシン、ミコフェノール酸、ノガラマイシン、オリボマイシン、ぺプロマイシン、ポトフィロマイシン、ピューロマイシン、クエラマイシン、ロドルビシン、ストレプトニグリン、ストレプトゾシン、ツベルシジン、ウベニメクス、ジノスタチンおよびゾルビシンなどの抗生物質;メトトレキサートおよび5-フルオロウラシル(5-FU)などの代謝拮抗剤;デノプテリン、メトトレキサート、プテロプテリン、およびトリメトレキセートなどの葉酸アナログ;フルダラビン、6-メルカプトプリン、チアミプリンおよびチオグアニンなどのプリンアナログ;アンシタビン、アザシチジン、6-アザウリジン、カルモフール、シタラビン、ジデオキシウリジン、ドキシフルリジン、エノシタビン、フロックスウリジンおよび5-FUなどのピリミジンアナログ;カルステロン、ドロモスタノロンプロピオナート、エピチオスタノール、ルネピチオスタンおよびテストラクトンなどのアンドロゲン;アミノグルテチミド、ミトタン、およびトリロスタンなどの抗副腎剤;フロリン酸などの葉酸補充剤;アセグラトン;アルドホスファミドグリコシド;アミノレブリン酸;アムサクリン;ベストラブシル;ビサントレン;エダトラキセート;デフォファミン;デメコルチン;ジアジコン;エルフォルニチン;酢酸エリプチニウム;エトグルシド;硝酸ガリウム;ヒドロキシウレア;レンチナン;ロニダミン;ミトグアゾン;ミトキサントロン;モピダモール;ニトラクリン;ペントスタチン;フェナメット;ピラルビシン;ポドフィリン酸;2-エチルヒドラジド;プロカルバジン;PSKR;ラゾキサン;シゾフラン;スピロゲルマニウム;テヌアゾン酸;トリアジクオン;2,2',2"-トリクロロトリエチルアミン;ウレタン;ビンデシン;ダカルバジン;マンノムスチン;ミトブロニトール;ミトラクトール;ピポブロマン;ガシトシン;アラビノシド("Ara-C");シクロホスファミド;チオテパ;タクソイド、例えば、パクリタキセル(TAXOL(登録商標)、Bristol Meyers Squibb Oncology社、ニュージャージー州プリンストン)およびドセタキセル(TAXOTERE(登録商標)、Rhone-Poulenc Rorer社、フランス・アントニー);クロラムブシル;ゲムシタビン;6-チオグアニン;メルカプトプリン;メトトレキサート;シスプラチンおよびカルボプラチンなどの白金アナログ;ビンブラスチン;白金;エトポシド(VP-16);イホスファミド;マイトマイシンC;ミトキサントロン;ビンクリスチン;ビノレルビン;ナベルビン;ノバントロン;テニポシド;ダウノマイシン;アミノプテリン;ゼローダ;イバンドロネート;CPT-11;トポイソメラーゼ阻害薬RFS2000;ジフルオロメチルオルニチン(DMFO);レチノイン酸;エスペラミシン;カペシタビン;ならびに上記のいずれかの薬学的に許容される塩、酸または誘導体を含む。腫瘍に対するホルモン作用を調節または抑制するように作用する抗ホルモン剤、例えば、タモキシフェン、ラロキシフェン、アロマターゼを阻害する4(5)-イミダゾール、4-ヒドロキシタモキシフェン、トリオキシフェン、ケオキシフェン、オナプロストンおよびトレミフェン(Fareston)を含む抗エストロゲン薬;フルタミド、ニルタミド、ビカルタミド、ロイプロリド、およびゴセレリンなどの抗アンドロゲン薬;ならびに上記のいずれかの薬学的に許容される塩、酸または誘導体もまた含まれる。
【0059】
サイトカインもまた治療剤として使用できる。このようなサイトカインの例には、リンホカイン、モノカインおよび旧来のポリペプチドホルモンがある。サイトカインに含まれるものには、ヒト成長ホルモン、N-メチオニルヒト成長ホルモンおよびウシ成長ホルモンなどの成長ホルモン;副甲状腺ホルモン;チロキシン;インスリン;プロインスリン;リラキシン;プロリラキシン;卵胞刺激ホルモン(FSH)、甲状腺刺激ホルモン(TSH)、および黄体形成ホルモン(LH)などの糖タンパク質ホルモン;肝細胞増殖因子;線維芽細胞増殖因子;プロラクチン;胎盤性ラクトゲン;腫瘍壊死因子-αおよび腫瘍壊死因子-β;ミュラー管抑制因子;マウスゴナドトロピン関連ペプチド;インヒビン;アクチビン;血管形成誘導因子;インテグリン;トロンボポエチン(TPO);NGF-βなどの神経成長因子;血小板由来成長因子;TGF-αおよびTGF-βなどのトランスフォーミング成長因子(TGF);インスリン様成長因子-Iおよびインスリン様成長因子-II;エリスロポエチン(EPO);骨誘導因子;インターフェロン-α、βおよびγなどのインターフェロン;マクロファージ-CSF(M-CSF)などのコロニー刺激因子(CSF);顆粒球・マクロファージ-CSF(GM-CSF);顆粒球-CSF(GCSF);IL-1、IL-1a、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、IL-9、IL-11、IL-12、IL-15などのインターロイキン(IL);TNF-αまたはTNF-βなどの腫瘍壊死因子;ならびにLIFおよびkitリガンド(KL)を含む他のポリペプチド因子がある。本明細書において、用語サイトカインは、自然源または組換え細胞培養物からのタンパク質および天然配列サイトカインの生物活性等価物を含む。
【0060】
イメージング剤は、哺乳動物またはヒトなどの動物の体内の標的部位に関する画像情報を提供できる物質とすることができる。イメージング剤は、磁気共鳴画像のためには、酸化鉄などの磁性材料を含むことができる。光学画像のためには、活性剤は、例えば半導体ナノ結晶または量子ドットとすることができる。光干渉断層撮影のためには、イメージング剤は、金属(例えば金または銀)ナノケージ粒子とすることができる。イメージング剤はまた、ミクロ・ナノバブルまたは酸化鉄ミクロ・ナノ粒子などの超音波造影剤とすることもできる。
組成物
特定の種類の細胞のためのあらかじめ選択された細胞内在化様式を有する粒子は、組成物、例えば医薬組成物の一部とすることができる。このような組成物は、治療剤またはイメージング剤の投与に使用する前述の粒子を含む懸濁液とすることができる。懸濁液を調製するために、選択された濃度で水性媒体に粒子を懸濁することができる。最適濃度は、粒子の特性(例えば、可溶化特性)、治療用途の種類および投与方法によって決めることができる。例えば、経口投与用組成物は、比較的粘性のあるものとすることができ、従ってより高濃度(例えば、>50%)の粒子を含ませることができる。ボーラス注射用溶液は、好ましくは、比較的高い濃度の粒子の懸濁液(例えば、10〜50%)を含むが、生理食塩水よりも明らかに高い粘度を有するほどには濃度は高くない(大口径の針の必要性を最小限にするために)。持続静注法に用いる溶液は、一般的には、比較的大容量の流体が投与されるため、比較的低濃度(例えば、2〜10%懸濁液)の粒子を含むことができる。
【0061】
粒子は、多くの適切な水性担体ビヒクルに懸濁することができる。適切な医薬担体は、用いられる投与量および濃度でレシピエントに無毒であり、製剤中の他の成分と適合する担体とすることができる。適切な担体ビヒクルの例は、限定するものではないが、水、生理食塩水、リンゲル液、デキストロース溶液および5%ヒト血清アルブミンを含む。注射剤に使用する懸濁液は、好ましくは、被験者の血液と等張である。一般に、担体は、等張性および化学的安定性を高める物質などの少量の添加剤、例えば緩衝液および防腐薬を含むことができ、同様に低分子量(約10未満の残基)ポリペプチド、タンパク質、アミノ酸、炭水化物(グルコースまたはデキストランを含む)、キレート剤例えばEDTAまたは他の賦形剤もまた含むことができる。
【0062】
被験者への投与の前に、粒子の懸濁液を適切な滅菌方法によって滅菌することができる。耐熱性材料から加工された粒子は、例えばオートクレーブを用いて熱滅菌することができる。耐熱性材料から加工された粒子は、市販の滅菌フィルターを通過させることによって滅菌することができる。もちろん、濾過は、滅菌フィルターの孔よりも粒子が小さい場合に限り利用することができる。
【0063】
多くの適切な投与方法によって、治療介入が必要な被験者に粒子を投与することができる。担当医は、特定の用途のために用いられる特定の方法を決定することができる。例えば、粒子は、以下の経路:局所、非経口、吸入、経口、経膣および経肛門の1つによって投与できる。静脈内(i.v.)、筋肉内(i.m.)および皮下(s.c.)注射を含む血管内投与が特に好ましい。血管内投与は、局所投与または全身投与のいずれかにすることができる。CATスキャンガイドカテーテルなどのガイドカテーテルシステムを用いて、既知の腫瘍または炎症を有する身体部位の近傍に粒子をもたらすために、局所血管内送達を用いることができる。一般的な注射、例えばボーラス静注または持続/点滴静注は、一般的には全身性である。
【0064】
粒子は、血流中に注入し、循環させ、その標的部位に局在化させることができる。好ましくは、粒子は、標的部位の血管系に注入される。
引用文献
1. Gao H, et al. 2005. Proc. Natl. Acad. Sci. USA 102:9469-74.
2. Sun S.X. and D. Wirtz. 2006. Biophysical Journal 90:L10-2.
3. Champion J.A., et al. 2007. Proc. Natl. Acad. Sci. USA 104:11901-4.
4. Champion J.A., S. Mitragotri. 2006. Proc. Natl. Acad. Sci. USA 103:4930-4.
5. Rolland J.P., et al. 2005. J. Am. Chem. Soc. 127:10096-100.
6. Cohen M.H, et al. 2001. Biomedical Microdevices 3:253-259.
7. Harris A, G. et al. 2006. Proc. Natl. Acad. Sci. USA 103:19123-7
8. Freund L. B. and Y. Lin. 2004. Journal of the Mechanics and Physics of Solids 52:2455-2472
9. Hill TL. 1960. An Introduction to Statistical Thermodynamics. Dover Publicatgions, Inc. New York.
10. Herant M., et al. 2006. J. Cell. Sci. 119: 1903-13.
11. Smythe E., K.R. Ayscough. 2006. J. Cell Sci. 119: 4589-98.
12. May R.C., L.M. Machesky. 2001.J. Cell Sci. 114: 1061-77.
13. Simson R, et al. 1998. Biophysical Journal. 74: 514-522.
14. Herant M, et al. 2005. J. Cell Sci. 118:1789-97.
前記のものは、特定の好ましい実施形態についてのものであるが、当然のことながら本発明はそれらに限定されない。開示された実施形態に種々の改変を行うことができることは当業者には明らかであり、そのような改変は、本発明の範囲内であるものとする。
【0065】
本明細書に引用したすべての公報、特許出願および特許は、参照により本願に組み込まれる。
【図面の簡単な説明】
【0066】
【図1】楕円断面を有する粒子の概略図である。前記粒子は、その表面に細胞膜の表面の受容体分子と相互作用できるリガンド分子を有する。
【図2】50nmに固定したR2に対する、0.9から4までの範囲のアスペクト比Γの関数としての半ラッピング時間0.5τwおよびラッピング長さ比xmax/R1を示す楕円円筒形粒子の漸進的変化を示す図である。
【図3】R2の関数としての、一定のR2に対する半ラッピング時間の最小値に対応するΓの値であるΓminのグラフを示す図である。この図はまた、R2の関数としての、Γminに対する半ラッピング時間のグラフも示す。
【図4】一定の体積(Rs=50nm)に対する、0.9から4までの範囲のアスペクト比Γの関数としての半ラッピング時間0.5τwおよびラッピング長さ比xmax/R1を示す楕円円筒形粒子の漸進的変化を示す図である。
【特許請求の範囲】
【請求項1】
あらかじめ選択された細胞内在化様式を有する粒子組成物の製剤化方法であって、
a)表面受容体を有する細胞を選択し;そして
b)i)表面部分であって、前記受容体に親和性を有するかまたは結合することができる前記表面部分およびii)形状であって、前記表面部分の表面分布および前記形状が、選択された細胞のあらかじめ選択された細胞内在化様式に有効である前記形状を有する粒子を得る、
ことを含む前記方法。
【請求項2】
あらかじめ選択された内在化様式が完全エンドサイトーシス、不完全エンドサイトーシスおよび非エンドサイトーシスから選択される、請求項1記載の方法。
【請求項3】
細胞が内皮細胞である、請求項1記載の方法。
【請求項4】
内皮細胞が血管内皮細胞である、請求項3記載の方法。
【請求項5】
受容体が血管新生血管受容体、取り込まれた血管受容体または再正常化された受容体である、請求項4記載の方法。
【請求項6】
細胞が非食細胞である、請求項1記載の方法。
【請求項7】
表面部分が、受容体に結合できるリガンドである、請求項1記載の方法。
【請求項8】
得ることが、粒子を加工することを含む、請求項1記載の方法。
【請求項9】
加工することが、トップダウンプロセスで加工することを含む、請求項8記載の方法。
【請求項10】
加工することが、粒子の表面上に部分を配置することを含む、請求項8記載の方法。
【請求項11】
得ることが、粒子集団から粒子を選択することを含む、請求項1記載の方法。
【請求項12】
粒子が活性剤を含む、請求項1記載の方法。
【請求項13】
活性剤がイメージング剤または治療剤を含む、請求項12記載の方法。
【請求項14】
前記粒子がナノ粒子である、請求項1記載の方法。
【請求項15】
粒子が非球形粒子である、請求項1記載の方法。
【請求項16】
粒子が、円形断面を有さない粒子である、請求項1記載の方法。
【請求項17】
粒子が楕円体粒子である、請求項1記載の方法。
【請求項18】
前記楕円体粒子が、選択された細胞のあらかじめ選択された細胞内在化様式に有効なアスペクト比を有する、請求項17記載の方法。
【請求項19】
表面部分の表面密度および表面受容体の表面密度に基づいてアスペクト比を決定することをさらに含む、請求項18記載の方法。
【請求項20】
あらかじめ選択されたエンドサイトーシス様式に有効な曲率および部分の局所表面密度を有する凸面を粒子表面が含む、請求項1記載の方法。
【請求項21】
それを必要とする被験者に請求項12記載の方法によって製剤化された粒子組成物の有効量を投与することを含む治療方法または生理的状態のモニタリング方法。
【請求項22】
請求項1記載の方法によって製剤化された組成物。
【請求項1】
あらかじめ選択された細胞内在化様式を有する粒子組成物の製剤化方法であって、
a)表面受容体を有する細胞を選択し;そして
b)i)表面部分であって、前記受容体に親和性を有するかまたは結合することができる前記表面部分およびii)形状であって、前記表面部分の表面分布および前記形状が、選択された細胞のあらかじめ選択された細胞内在化様式に有効である前記形状を有する粒子を得る、
ことを含む前記方法。
【請求項2】
あらかじめ選択された内在化様式が完全エンドサイトーシス、不完全エンドサイトーシスおよび非エンドサイトーシスから選択される、請求項1記載の方法。
【請求項3】
細胞が内皮細胞である、請求項1記載の方法。
【請求項4】
内皮細胞が血管内皮細胞である、請求項3記載の方法。
【請求項5】
受容体が血管新生血管受容体、取り込まれた血管受容体または再正常化された受容体である、請求項4記載の方法。
【請求項6】
細胞が非食細胞である、請求項1記載の方法。
【請求項7】
表面部分が、受容体に結合できるリガンドである、請求項1記載の方法。
【請求項8】
得ることが、粒子を加工することを含む、請求項1記載の方法。
【請求項9】
加工することが、トップダウンプロセスで加工することを含む、請求項8記載の方法。
【請求項10】
加工することが、粒子の表面上に部分を配置することを含む、請求項8記載の方法。
【請求項11】
得ることが、粒子集団から粒子を選択することを含む、請求項1記載の方法。
【請求項12】
粒子が活性剤を含む、請求項1記載の方法。
【請求項13】
活性剤がイメージング剤または治療剤を含む、請求項12記載の方法。
【請求項14】
前記粒子がナノ粒子である、請求項1記載の方法。
【請求項15】
粒子が非球形粒子である、請求項1記載の方法。
【請求項16】
粒子が、円形断面を有さない粒子である、請求項1記載の方法。
【請求項17】
粒子が楕円体粒子である、請求項1記載の方法。
【請求項18】
前記楕円体粒子が、選択された細胞のあらかじめ選択された細胞内在化様式に有効なアスペクト比を有する、請求項17記載の方法。
【請求項19】
表面部分の表面密度および表面受容体の表面密度に基づいてアスペクト比を決定することをさらに含む、請求項18記載の方法。
【請求項20】
あらかじめ選択されたエンドサイトーシス様式に有効な曲率および部分の局所表面密度を有する凸面を粒子表面が含む、請求項1記載の方法。
【請求項21】
それを必要とする被験者に請求項12記載の方法によって製剤化された粒子組成物の有効量を投与することを含む治療方法または生理的状態のモニタリング方法。
【請求項22】
請求項1記載の方法によって製剤化された組成物。
【図2】


【図3】


【図4】


【図1】




【図3】


【図4】


【図1】


【公表番号】特表2011−529491(P2011−529491A)
【公表日】平成23年12月8日(2011.12.8)
【国際特許分類】
【出願番号】特願2011−521073(P2011−521073)
【出願日】平成20年7月29日(2008.7.29)
【国際出願番号】PCT/US2008/071470
【国際公開番号】WO2010/014081
【国際公開日】平成22年2月4日(2010.2.4)
【出願人】(500039463)ボード・オブ・リージエンツ,ザ・ユニバーシテイ・オブ・テキサス・システム (115)
【Fターム(参考)】
【公表日】平成23年12月8日(2011.12.8)
【国際特許分類】
【出願日】平成20年7月29日(2008.7.29)
【国際出願番号】PCT/US2008/071470
【国際公開番号】WO2010/014081
【国際公開日】平成22年2月4日(2010.2.4)
【出願人】(500039463)ボード・オブ・リージエンツ,ザ・ユニバーシテイ・オブ・テキサス・システム (115)
【Fターム(参考)】
[ Back to top ]

