うつ病の治療または予防のための医薬品および機能性食品の製剤における5−メチル−1,3−ベンゼンジオールまたはその誘導体の使用
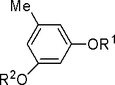
本発明は、式I(式中、可変部分は、本明細書に規定するとおりである)で表される5−メチル−1,3−ベンゼンジオールまたはその誘導体またはこれらを含むその医薬組成物の、医薬品または機能性食品製剤における使用に関する。本研究により、式I(式中、可変部分は、本明細書に規定するとおりである)で表される5−メチル−1,3−ベンゼンジオールまたはその誘導体またはこれらを含むその医薬組成物は、フルオキセチンまたはイミプラミンより大きな抗うつ効果を示すことが指摘されている。
式I
式I
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬品または機能性食品の製剤においてこれらを含有する医薬組成物の使用に関する。
【背景技術】
【0002】
うつ病は、総人口の最大20%の人々に発症している、一般に見られるの精神障害である。うつ病では、以下の症状、持続性または反復性抑うつ気分、不安、動揺、睡眠障害、異常なストレス応答、および認知機能障害が共通している。
【0003】
過去数十年間にわたり、神経薬理学の起動力の下、多くの公認された動物モデルが、抗うつ剤の活性を評価するために開発されてきた。最も広く使用されているモデルは、げっ歯類の強制水泳テストおよび尾懸垂テストである。近年、多くの研究により、恒常的な暗闇、睡眠遮断、および慢性の予測不能な軽度のストレスは、うつ病の発生の病因学的モデルであることが示されている。これらのモデルにより、抗うつ剤の研究の土台が築かれた。うつ病の発病機序はまだ完全に明らかではないが、海馬シナプス可塑性(たとえば、長期強化)における変化および認知機能における役割は、うつ病に内在する重要なメカニズムの一つであるかもしれない。
【発明の概要】
【発明が解決しようとする課題】
【0004】
5−メチル−1,3−ベンゼンジオール(一般的にオルシノールとして知られる)は、通常、有機合成用の熱分解中間体の加工における熱重合の阻害剤として使用される。また、RNAの特異的定量用の試薬でもある。5−メチル−1,3−ベンゼンジオールおよびその誘導体は、抗酸化剤としてしばしば使用されてきた。これらは、一定の抗菌活性を有する。今までのところ、それらを、うつ病、不安、動揺、睡眠障害、異常なストレス応答、または認知機能障害を軽減するために使用することについては報告がない。
【課題を解決するための手段】
【0005】
本発明は、5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬品または機能性食品の製剤中にこれらを含有する医薬組成物を、うつ病の治療または予防のために使用することに関する。さらに詳しくは、本発明は、うつ病またはそれに関連する疾病およびこれらの疾患の原因の治療に使用される5−メチル−1,3−ベンゼンジオールまたはその誘導体に関する。
【0006】
本発明の化合物は、式Iで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体である。
【化1】

式I
(式中、R1および/またはR2は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、マンノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【0007】
より好ましくは、本発明の化合物は、式IIで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体である。
【化2】

式II
(式中、R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、マンノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【0008】
より好ましくは、式中、R1は、水素、β−D−グルコピラノシル、オルシノールとして挙げられる、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、またはオルシノール−1−O−β−D−グルコピラノシド、またはオルシノール−1−O−[β−D−グルコピラノシル−(1→6)]−β−D−グルコピラノシドである。
【0009】
より好ましくは、本発明の化合物は、式IIIで表される5−メチル−1,3−ベンゼンジオールの誘導体である。
【化3】

式III
(式中、R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【0010】
とりわけ、R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、またはラムノピラノシルである。
【0011】
より好ましくは、本発明の化合物は、式IVで表される5−メチル−1,3−ベンゼンジオールの誘導体である。
【化4】

式IV
(式中、R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【0012】
好ましくは、R2は、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシルまたはアセチルである。
【0013】
アメリカ精神医学会により出版された精神障害の診断と統計マニュアル、第4版(DSM−IV)、および国際疾病分類、第10版(ICD−10)に記載されているように、うつ病は、異なるサブタイプの精神疾患および障害が挙げられ、(1)うつ病、躁病、混合性躁病、および軽躁病のようなうつ病および気分障害、(2)うつ病性障害およびおよび不機嫌のようなうつ病性障害、(3)たとえば健康不良に起因する他の感情障害であって、健康不良として、物質(たとえば、習慣性薬物)または療法(たとえば、外科手術、放射線療法、または化学療法)に起因するうつ病性障害および感情障害の特徴を持つ、異なる精神疾患またはサブタイプの障害が挙げられ、(4)うつ病および軽躁病の2種以上のエピソード、および躁病およびうつ病の交代性エピソードを含む双極性障害または双極性感情障害である。
【0014】
DSM−IVおよびICD−10に記載されたうつ病の症状の他に、本発明は、日内リズム障害、睡眠障害、慢性ストレス、不安、急性ストレス誘発障害、または認知機能低下または障害の治療および予防も含む。
【0015】
うつ病の他に、本発明は、日内リズム障害、睡眠障害、慢性ストレス、不安、急性 ストレス誘発障害、または認知機能低下または障害に関連する疾患の治療および予防も含む。さらに、本発明は、絶望感(たとえば、自殺念慮および行動)、気分障害、および異常な急性ストレス応答の予防および治療も含む。
【0016】
睡眠および日内リズム障害:うつ病を持つ患者に非常に一般的な疾患である睡眠障害は、うつ病の程度を評価するための評価尺度の中身の一つである。日内リズム障害は、最も重要な生理学的機能を言う。正常な日内リズムは、明暗が交互に変わることによって動かされる。時差、季節、生活習慣または遺伝は、日内リズム障害を引き起こす可能性があり、さらにうつ病および認知機能低下のような高次脳機能の欠損を引き起こす可能性がある。DSM−IVまたはICD−10によれば、睡眠障害は、三つの大きな範疇、(1)不眠症、過眠症、ナルコレプシー、呼吸関連睡眠障害および日内リズム関連睡眠障害のような睡眠異常、(2)悪夢、睡眠パニック、および夢遊症のような睡眠時随伴症、(3)物質(たとえば,習慣性薬物)または療法(たとえば、外科手術、放射線療法、または)に起因する健康関連睡眠障害および睡眠障害に分類される。
【0017】
不安は、うつ病を持つ患者に非常に一般的な症状である。それは、うつ病の程度を評価するためのガイドラインの一つである。不安障害は、二つの大きな範疇、(1)パニック障害、たとえば、広所恐怖症、特定のパニック障害(たとえば、特定の動物、環境、または輸血の恐怖、社会恐怖、または強迫性障害)、外傷後ストレス障害、急性ストレス障害、および大きな不安障害、および(2)健康関連不安障害および物質誘発障害(たとえば,習慣性薬物)または療法誘発障害(外科手術、放射線療法または化学療法)を含む。薬物の抗不安活性を評価するため、げっ歯類モデルの高架式十字迷路およびすくみ挙動が広く使用されている。
【0018】
ストレスは、生物系において、生物の生理的なまたは心理的な恒常性維持を重篤にかく乱する任意の状態と規定される。ストレスは、精神疾患および認知機能障害のような多くの疾病を悪化させるあるいは該疾病を発症させる主な要因の一つと考えられる。ストレス源として、数多くの日常の出来事を挙げることができ、これは人によって異なる。ある物質、たとえば習慣性薬物を摂取すること、あるいは外科手術のような療法を受けることは、普通、異常なストレス応答に導く。ストレスを評価するために一般的に用いられている生物学的指示薬として、コルチコステロイド濃度(たとえば、げっ歯類におけるコルチコステロンおよびヒトにおけるコルチゾール)が挙げられ、関連する急性ストレス誘発障害、たとえば、海馬シナプス可塑性の損傷ならびに学習および記憶の損傷を発症する可能性がある。動物実験で一般的に用いられているストレス方法として、フットショックおよび高架式台が挙げられる。
【0019】
認知は、最も重要な高次脳機能の一つである。これは、学習、記憶、言語、思考および気分を言う。うつ病は一種の認知障害とみなされ、これを患う患者は、ネガティブ思考および気分(気分障害)を無意識に持つ。1949年、へブは、シナプス修飾が学習および記憶の基礎であるという考えを提案した。1973年、この仮説は海馬の長期強化(LTP)を発見したブリスらによる実験で検証された。しかし、今のところ、臨床でLTPを直接調節する薬物を使用してうつ病を治療したことはない。より良好で速い治癒効果は、うつ病、その関連症状、およびその原因の治療において、シナプスの可塑性を改変する薬物の開発によって達成されるかもしれない。
【0020】
5−メチル−1,3−ベンゼンジオールまたはその誘導体は、遊離の形態または医薬組成物中で直接使用することができる。記載した医薬組成物は、医薬的に許容しうる賦形剤中、0.1〜99重量%の5−メチル−1,3−ベンゼンジオールまたはその誘導体を含む。
【0021】
本明細書で使用される用語「医薬担体および/または賦形剤」は、1種以上の固体、半固体または液状希釈剤、充填剤、または任意のタイプの形成補助剤を意味する。5−メチル−1,3−ベンゼンジオールまたはその誘導体の医薬組成物は、医薬品および食品分野で周知の技術によって、種々の医薬的に許容しうる賦形剤または食事療法的に許容しうる栄養補助食品として調製される。医薬的に許容しうる賦形剤または食事療法的に許容しうる栄養補助食品としては、噴霧剤、エアロゾル剤、注射剤、懸濁液剤、エマルジョン剤およびシロップ剤のような液体剤、および錠剤、カプセル剤および顆粒剤のような固体剤、または液体に溶解または懸濁した粉末が挙げられる。
【0022】
本発明では、投与方法として、注射または注入(静脈内、筋肉内、腹腔内または皮下)、経口、舌下および粘膜投与が挙げられる。
【0023】
前記疾患、それらの原因および症状を治療または予防するための活性成分(5−メチル−1,3−ベンゼンジオールまたは誘導体)の有効投与量は、0.1mg/成人/日と12g/成人/日との間、最適投与量は、50〜200mg/成人/日である。
【0024】
本発明は、5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいはそれらをうつ病の治療または予防用の医薬品および機能性食品の製剤中に含有する医薬組成物が、うつ病、および不安、ストレスおよび認知機能低下のようなうつ病を示唆する症状を治療および予防するための新しい選択を提供することを明らかにしている。
【発明を実施するための形態】
【0025】
以下の実施例に、本発明の理解および補足のために化合物および方法の詳細を記載するが、これらの実施例は、以下に続く請求項に記載された本発明を、いかなる方法によっても限定するものではないし、また本発明を限定的に解釈すべきではない。任意の他の方法によって調製された本発明に記載の化合物、およびうつ病、うつ病を示唆する症状、およびうつ病の病原学的原因を治療するための使用は、本発明に包含される。
【0026】
ここで、オルシノール(OR)、オルシノール−1−O−β−D−グルコピラノシド(ORG)およびオルシノール−1−O−[β−D−グルコピラノシル−(1→6)]−β−D−グルコピラノシド(ORGG)は、クルクリゴ・キンバイザサ(Curculigo orchioides)Garr.により抽出することができる。オルシノールの他の誘導体は、周知の技術により調製することができる。特定の方法を以下に示す。
【0027】
1.オルシノールは、対応する糖類のアセチル化生成物(ここで、R1および/またはR2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシルまたはアラビノシルである)と反応させることができ、該対応化合物は、オルシノールを前記糖類のアセチル化生成物と、光防護下、メタノ−ル中で反応させ、臭化水素酸および酢酸を添加し、室温で1〜5時間攪拌することによって得ることができる。オルシノールアセチル化グリコシド類が得られる。対応するオルシノールアセチル化グリコシド類を、ナトリウムメトキシドで、メタノ−ル中、室温で1〜5時間処理し、対応するオルシノールグリコシド類を得る。
【0028】
2.R1およびR2がアシルの場合、対応する酸無水物または塩化アシル物および10〜20%の4−ジメチルアミノピリジンの添加により、オルシノールまたはオルシノールグリコシド類をピリジン中に溶解し、60〜120℃で3〜5時間攪拌する。混合物を水に注ぎ込み、次いでクロロホルムで抽出し、粗生成物を得、これをさらに精製し、アシル化生成物を得る。
【0029】
3.R1およびR2がアルキルの場合、水素化ナトリウムの添加により、オルシノールまたはオルシノールグリコシド類をテトラヒドロフランまたはジメチルスルホキシドに溶解し、30〜60分攪拌する。対応するアルキロゲンの添加後、反応混合物をさらに3〜5時間攪拌し、次いで水に注ぎ込み、クロロホルムで抽出し、粗生成物を得、これをさらに精製し、アルキル化生成物を得る。
【実施例1】
【0030】
オルシノール−1−O−β−D−グルコピラノシド、オルシノール、およびオルシノール−1−O−[β−D−グルコピラノシル−(1→6)]−β−D−グルコピラノシドの
抽出および単離
【0031】
クルクリゴ・キンバイザサGarr.を集め、陰または日向で乾燥し、粉末化した。
【0032】
粉末材料(20kg)を、還流下、90%エタノ−ル(200kg)で各回それぞれ2時間で3回抽出した。抽出物を合わせ、濃縮し、約30kgを得、12時間沈降させたのち、ろ過した。次いで、粗抽出物をD−101マクロ多孔性樹脂カラムでクロマトグラフに供し(樹脂の重さは20kgであった)、100kgの蒸留水、60kgの70%エタノ−ルおよび60kgの90%エタノールで連続的に溶出した。70%エタノール溶出液および90%エタノール溶出液を別々に集め、蒸発乾固し、70%エタノール溶出液(340g)および90%エタノール溶出液(60g)を得た。
【0033】
得られた70%エタノール溶出液(340g)をメタノールに溶解し、400gのシリカゲルに吸収させた。室温で乾燥したのち、固形物を粉砕し、ふるいにかけ、シリカゲルカラムクロマトグラフィ(2.1kg,200〜300メッシュ)に供し、クロロホルム−メタノール−水(90:10:1〜70:30:3,v/v/v)で溶出し、26画分を得た。各画分は1500mlであった。画分2および画分3を合わせ、濃縮し、エタノールで結晶化し、オルシノール(5g)を得た。画分9〜画分15を合わせ、濃縮し、エタノールで結晶化し、オルシノール−1−O−β−D−グルコピラノシド(50g)を得た。画分22〜画分26を合わせ、濃縮し、エタノールで結晶化し、オルシノール−1−O−[β−D−グルコピラノシル−(1→6)]−β−D−グルコピラノシド(10g)を得た。
【0034】
構造決定:旋光度をSEPA−300偏光計で測定し、UV−VISスペクトルをUV−210A分光計で得、IRデータを、KBrペレットを備えるBio−Rad FTS−135分光計で集め、核磁気共鳴(1H NMRおよび13C NMR)スペクトルを、内部標準としてTMSを用い、CDCl3中でBruker DRX500分光計によって測定した。カラムクロマトグラフィおよび薄層クロマトグラフィシリカゲル用の材料は、Makall Group社(Qingdao,China)から入手した。
【0035】
【化5】

名称:オルシノール−1−O−β−D−グリコピラノシド
分子式:C13H18O7、
分子量:286、
特性:薄黄色粉末、
[a]D−63.03°(c5.95,メタノール)、
UV(メタノール):λmax(logε)279(3.19)、273(3.21)、219(3.99)、203(4.58)、
IR(KBr):νmax3495、3385、1620、1596、1175、1076、1032cm−1、
FAB−MS(−):m/z285[(M−1)−,100]、123[(M−1−glc)−,87]、
1H−NMR(CD3OD,400MHz)δH:6.41(1H,s,H−2)、6.36(1H,s,H−6)、6.29(1H,s,H−4)、4.84(1H,d,J=7.3Hz,H−1’)、2.22(3H,s,H−7)、
13C−NMR(CD3OD,100 MHz)δC:160.1(s,C−1)、111.4(d,C−2)、159.2(s,C−3)、102.4(s,C−4)、141.3(s,C−5)、110.0(d,C−6)、21.6(q,C−7)、102.5(d,C−1’)、75.0(d,C−2’)、78.1(d,C−3’)、71.6(d,C−4’)、78.2(d,C−5’)、62.7(t,C−6’)。
【0036】
【化6】

名称:オルシノール
分子式:C7H8O2、
分子量:124、
特性:薄黄色−白色粉末、
UV(メタノール):λmax(logε)281(3.20)、275(3.22)、204(4.59)、
IR(KBr):νmax3313、1629、1601、1512、1477、1332、1208、1148、1032、973cm−1、
EI−MS(70ev):m/z125[(M+1)+,8]、124[M+,100]、123[(M−1)+,55]、107[(M+1-18)+,7]、95(12)、77(8)、
1H−NMR(CD3OD、400MHz)δH:6.14(2H,brs,H−2,6)、6.10(1H,brs,H−4)、2.16(3H,s,H−7)、
13C−NMR(CD3OD,100MHz)δC:159.2(s×2、C−1、3),108.7(d×2,C−2、6)、108.7(s,C−4)、141.2(s,C−5)、21.5(q,C−7)。
【0037】
【化7】

名称:オルシノール−1−O−[β−D−グルコピラノシル−(1→6)]−β−D−グルコピラノシド
分子式:C19H28O12、
分子量:448、
特性:白色無定形粉末、
融点:117〜119℃、
FAB−MS(−)(m/z):447[M−1]−、123[M−1−2glc]、
1H NMR(400MHz,CD3OD)δH:6.43(1H,brs,H−2)、6.40(1H,brs,H−4)、6.28(1H,brs,H−6)、4.82(1H,d,J=7.30Hz,H−1’)、4.40(1H,d,J=7.73Hz,H−1’’)、2.21(3H,s,H−7)、
13C NMR(125MHz,CD3OD)δC:160.0(s,C−1)、102.0(d,C−2)、159.2(s,C−3)、111.2(d,C−4)、141.3(s,C−5)、109.8(d,C−6)、21.7(s,C−7)、102.1(d,C−1’)、74.8(d,C−2’)、77.7(d,C−3’)、71.3(s,C−4’)、77.5(d,C−5)、69.6(t,C−6’)、104.6(d,C−1’’)、75.2(d,C−2’’)、77.8(d,C−3’’)、71.5(d,C−4’’)、77.9(d,C−5’’)、62.6(t,C−6’’)。
【実施例2】
【0038】
1,3−O−ジアセチルオルシノールの調製
100mlの丸底フラスコにピリジン(40ml)およびオルシノール(1.24g,0.01mol)を充填した。反応混合物を室温で攪拌し、無水酢酸(3ml)を滴下した。室温で24時間攪拌した後、反応混合物を200mlの氷水に注ぎいれた。混合物を酢酸エチル(3×50ml)で抽出した。有機層を合わせ、5%塩酸で3回、飽和NaHCO3水溶液で3回、および飽和塩化ナトリウムで3回洗浄し、Na2SO4で乾燥し、ろ過し、真空下で蒸発乾固した。粗生成物を、シリカゲルカラムクロマトグラフィに供し、石油エーテル−アセトン(90:10,v/v)で溶出し、1,3−O−ジアセチルオルシノール(1.87g,収率90%)を得た。
【0039】
【化8】

名称:1,3−O−ジアセチルオルシノール
分子式:C11H12O4、
分子量:208、
特性:無色油状物
1,3−O−ジアセチルオルシノールの構造データ:
ESI−MS(+)m/z:231[M+Na]+、
IR(KBr)nmax:1769、1602、1592、1466、1434、1369、1292、1198、1124、1036cm−1、
1H NMR(CDCl3)δH:6.78(2H,s,J=1.9Hz,H−4,6)、6.71(1H,d,J=1.9Hz,H−2)、2.30(3H,s,H−7)、2.19(s,6H)、
13C NMR(CDCl3)δC:169.0(s,CH3CO)、169.0(s,CH3CO)、150.9(s,C−1)、150.9(s,C−3)、140.3(s,C−5)、119.7(d,C−4)、119.7(d,C−6)、112.5(d,C−2)、21.2(q,C−7)、20.9(q,CH3CO)、20.9(q,CH3CO)。
【実施例3】
【0040】
3−O−アセチル−オルシノール−1−O−(2,3,4,6−テトラアセチル)−β−D−グルコピラノシドの調製
オルシノール(286mg)をピリジン(20ml)に溶解した。反応混合物を室温で攪拌し、無水酢酸(2.5g,25mmol)を滴下した。室温で24時間攪拌した後、反応混合物を50mlの氷水に注ぎ入れた。混合物を酢酸エチル(3×20ml)で抽出した。有機層を合わせ、5%塩酸で3回、飽和NaHCO3水溶液で3回および飽和塩化ナトリウムで3回洗浄し、Na2SO4で乾燥し、ろ過し、真空下で蒸発乾固した。粗生成物をシリカゲルカラムクロマトグラフィに供し、3−O−アセチル−オルシノール−1−O−(2,3,4,6−テトラアセチル)−β−D−グルコピラノシド(421mg,収率85%)を得た。
【0041】
【化9】

名称:3−O−アセチル−オルシノール−1−O−(2,3,4,6−テトラアセチル)−β−D−グルコピラノシド
分子式:C23H28O12、
分子量:496、
特性:白色無定形粉末、
ESI−MS(+)m/z:519[M+Na]+、
IR(KBr)nmax:1759、1625、1590、1373、1241、1211cm−1、
1H NMR(CDCl3)δH:6.68(1H,s,J=1.9Hz)、6.63(1H,s,J=1.9Hz)、6.54(1H,s,J=1.9Hz)、5.30〜5.22(m,2H)、5.14(t,1H,J=9.7Hz)、5.06(1H,d,J=7.5Hz)、4.28〜4.14(m,2H)、3.89〜3.85(m,1H)、2.31(s,3H)、2.27(s,3H)、2.08(s,3H)、2.05(s,3H)、2.04(s,3H)、2.03(s,3H)、
13C NMR(CDCl3)δC:170.6(s,CH3CO)、170.2(s,CH3CO)、169.4(s,CH3CO)、169.3(s,CH3CO)、169.3(s,CH3CO)、157.2(s,C−3)、151.1(s,C−1)、140.6(s,C−5)、117.2(d,C−6)、115.1(d,C−4)、107.6(d,C−2)、98.8(s,C−1’)、72.6(d,C−3’)、72.0(d,C−5’)、71.0(d,C−2’)、68.2(d,C−4’)、62.0(t,C−6’)、21.5(q,C−7)、21.1(q,CH3CO)、20.6(q,CH3CO×4)。
【実施例4】
【0042】
オルシノール−1−テトラ−O−アセチル−ラムノピラノースの調製
テトラ−O−アセチル−ラムノピラノース(36g)を臭化水素酸および酢酸の混合物(100ml)に溶解した。反応混合物を、光防護下、5時間攪拌した。反応混合物を500mlの氷水に注ぎ入れ、酢酸エチル(3×500ml)で抽出した。有機層を合わせ、水で3回、5%NaHCO3水溶液で3回、および飽和塩化ナトリウムで3回洗浄し、Na2SO4で乾燥し、ろ過し、真空下で蒸発乾固し、テトラ−O−アセチル−ラムノピラノシルブロミドを得た。
【0043】
オルシノール(12.4g)をクロロホルム(20ml)に溶解した。反応混合物を攪拌し、5%水酸化ナトリウム溶液(20ml)を加えた。温度が50℃まで上昇した時、テトラ−O−アセチル−ラムノピラノシルブロミド(0.12mol)をクロロホルムに溶解した溶液を滴下した。反応が完了するまで、反応混合物を50℃で攪拌し、次いで150mlの氷水に注ぎ入れた。5%塩酸でpHを7に調節した。混合物を酢酸エチルで抽出した。有機層を合わせ、飽和塩化ナトリウムで洗浄し、Na2SO4で乾燥し、ろ過し、真空下で蒸発乾固した。粗生成物を、シリカゲルカラムクロマトグラフィに供し、酢酸エチル−石油エーテル(5:1,v/v)で溶出し、オルシノール−1−テトラ−O−アセチル−ラムノピラノース(1.87g,収率90%)を得た。
【実施例5】
【0044】
オルシノール−1−ラムノピラノースの調製
ナトリウムメトキシド(0.18g)を、オルシノール−1−テトラ−O−アセチル−ラムノピラノース(4.14g)のメタノール(20ml)溶液に加えた。室温で2時間攪拌した後、反応混合物を5%塩酸で中性にした。蒸留水(50ml)を添加した後、メタノールを真空下で除去した。混合物をn−ブタノール(3×50ml)で抽出した。有機層を合わせ、飽和塩化ナトリウムで洗浄し、Na2SO4で乾燥し、ろ過し、真空下で蒸発乾固した。粗生成物をエタノールで結晶化し、オルシノール−1−ラムノピラノースを得た。
【実施例6】
【0045】
実施例1に従って調製したオルシノール−1−O−β−D−グリコピラノシドを、注射用の水に溶解した。細菌ろ過(0.2〜0.45μmろ過)の後、溶液をバイアルにサブパッケージし、密封し、滅菌しオルシノール−1−O−β−D−グリコピラノシドの注射液を得た。
【実施例7】
【0046】
実施例1に従って調製したオルシノール−1−O−β−D−グリコピラノシドを、注射用の無菌水に溶解した。該溶液を、ブフナー漏斗を使用して真空ろ過によりろ過し、無菌条件下、精密フィルターでろ過(0.2〜0.45μmろ過)し、アンプルにサブパッケージし、凍結乾燥の後密封し、オルシノール−1−O−β−D−グリコピラノシドの注射用凍結乾燥粉末を得た。
【実施例8】
【0047】
実施例1に従って調製したオルシノール−1−O−β−D−グリコピラノシドを賦形剤と混合し、オルシノール−1−O−β−D−グリコピラノシドの注射用粉末を得た。前者の後者に対する重量比は、9:1であった。
【実施例9】
【0048】
オルシノール−1−O−β−D−グリコピラノシドを実施例1に従って調製した。オルシノール−1−O−β−D−グリコピラノシドと賦形剤とを、1:5と1:10との間の化合物と賦形剤との重量比で混合することによって錠剤、カプセル剤および顆粒剤を調製した。
【実施例10】
【0049】
オルシノール−1−O−β−D−グリコピラノシドを実施例1に従って調製した。オルシノール−1−O−β−D−グリコピラノシドの経口液剤を、従来の方法に従って調製した。
【実施例11】
【0050】
オルシノール−1−O−β−D−グリコピラノシドを実施例1に従って調製した。オルシノール−1−O−β−D−グリコピラノシドと賦形剤とを5:1の重量比で混合することによって、カプセル剤および顆粒剤を調製した。
【実施例12】
【0051】
実施例1に従って調製したオルシノール−1−O−β−D−グリコピラノシド(12.4g)、デンプン(600g)、ラクトース(200g)、メントール(5g)およびカルボキシメチルスターチナトリウム(183g)を混合し、機能性食品としてトローチとなるよう更に調製した。
【0052】
本発明の本質をより深く理解するために、オルシノールまたはその誘導体、および医薬担体または賦形剤を含有する医薬組成物の薬理学的効果を試験する。しかし、本発明は、特定の詳細な記載に限定されないことは理解されるものである。
【0053】
[実験例1]
ORGおよびORの薬理学的試験
1.ラットおよびマウスの尾懸垂テスト(TST)および強制水泳テスト(FST)における投与量−効果関係に関するORGおよびORの抗うつ効果
【0054】
1.1 実験方法
四川省の実験動物人民病院(the Institute Experimental Animals,People’s Hospital)から入手した昆明マウスおよびスプラーグ・ドーリー・ラット(認証番号:A4CXK(Chuan)2003−16)を使用した。マウスは、実験例開始時、3〜4週齢で、体重は25〜30gであった。ラットの体重は250〜300gであった。各群の動物の数を表1〜表5に示す。オルシノール(OR)、オルシノール−1−O−β−D−グルコピラノシド(ORG)、オルシノール−1−O−[β−D−グルコピラノシル−(1→6)]−β−D−グルコピラノシド(ORGG)、1,3−O−ジアセチルオルシノール(OR−2Ac)、および3−O−アセチル−オルシノール−1−O−(2,3,4,6−テトラアセチル)−β−D−グルコピラノシド(ORG−5Ac)を、実施例1、2および3に従って調製した。動物を、異なる投与量の実験例群、ビヒクル群、およびイミプラミン群(Sigma,バッチNo.106k1588)およびベンラファキシン群(Wuhan Yuancheng社,バッチNo.200701001)を含む2つのD群に分けた。
【0055】
薬剤:ORGを通常の生理食塩水に溶解した。正の対照では、イミプラミンまたはベンラファキシンを、音波処理により0.5%CMC−ナトリウムを含有する通常の生理食塩水に懸濁させた。イミプラミンまたはベンラファキシンの投与量は、15mg/kgであった。歯肉内または腹腔内注射の容量は、マウスで0.1ml/10g、およびラットで1ml/100gまたは0.1ml/100gであった。
【0056】
マウスにおけるFST:装置は水を深さ17cmまで満たしたシリンダ(高さ24cm×直径15cm)で構成され、温度は24±2℃であった。FSTを開始する24時間および5時間前に、全ての薬剤およびビヒクルを投与した。合計6分間の最後の4分間の間のマウスの不動時間を手動で記録した。
【0057】
ラットにおけるFST:各実験例で2回の水泳セッションを行った。先ず、15分間のプレテスト水泳セッションを行い、最初の5分間の不動時間を手動で記録した。不動時間が長すぎるあるいは短すぎる場合は、該ラットは排除した。全ての薬剤およびビヒクルを、プレテスト水泳セッション後0時間および19時間の2回投与した。プレテスト水泳セッションの24時間後、5分間の試験セッションの間の不動時間を手動で記録した。
【0058】
マウスにおけるTST:TSTを開始する24時間および5時間前に、全ての薬剤およびビヒクルを投与した。マウスを、試験チャンバの床から50cm上に位置する水平のバーに、尾の先から2cmの部分を接着テープで貼り付けることによって、ぶら下げた。6分間の不動時間を手動で記録した。
【0059】
データ分析:結果は平均±SEMとして表し、SPSS11ソフトウェアを使用して分析した。群間の比較は、一元配置分散分析(ANOVA)、次いで最小有意差(LSD)テストを使用して行った。有意レベルはP<0.05に設定した。ED50値は、GraphPad Prismソフトウェアを使用して計算した。
【0060】
1.2 結果
1.2.1 ラットのFSTにおけるORG(歯肉内注射)の抗うつ効果
【表1】

【0061】
ラットにおいて、経口投与したORGの投与量−効果関係を評価した。ORGにより不動時間が減らされ、その効果は投与量に有意に依存していた(表1)。最高効力の投与量は4mg/kgであり、ED50は約0.22mg/kgであった。
【0062】
1.2.2 マウスのFSTにおけるORG(歯肉内注射)の抗うつ効果
この試験では、FSTを開始する24時間および5時間前に、ORGを歯肉内投与した。不動時間は減少し、その効果は投与量に有意に依存していた(表2)。最高効力の投与量は3mg/kgであり、ED50は約0.22mg/kgであった。
【表2】

【0063】
1.2.3 マウスのTSTにおけるORG(歯肉内注射)の抗うつ効果
TSTを開始する24時間および5時間前に、ORGを歯肉内投与した。不動時間は減少し、その効果は投与量に有意に依存していた(表3)。最高効力の投与量は12mg/kgであり、ED50は約0.73mg/kgであった。
【表3】

【0064】
1.2.4 マウスのFSTにおけるOR(腹腔内注射)の抗うつ効果
この試験では、FSTを開始する24時間および5時間前に、ORを腹腔内投与した。不動時間は減少した(表4)。
【表4】

【0065】
1.2.5 マウスのFSTにおけるORGの誘導体(腹腔内注射)の抗うつ効果
この試験では、FSTを開始する24時間および5時間前に、ORGの誘導体(ORGG、OR−2Ac、およびORG−5Ac)を、腹腔内(i.p.)注射によって投与した。ORGの全ての誘導体により、FSTモデルのマウスの不動時間は減少した(表5)。
【表5】

【0066】
1.3 ORGの抗うつ活性の治療指数(TI)
急性毒性テストでは、コンメイマウスに1750mg/kgの投与量でORGを投与した場合、飽和濃度、動物行動学的および組織学的検査で、異常は発見されなかった。したがって、ORGの中毒量の中央値(TD50)は、1750mg/kgよりも高かった。
【0067】
FSTのマウスにおけるORGの治療指数(TI)=TD50÷ED50≧1750mg/kg÷0.22mg/kg≧7955。
【0068】
TSTのマウスにおけるORGの治療指数(TI)=TD50÷ED50≧1750mg/kg÷0.73mg/kg≧2397。
【0069】
[実験例2]
マウスの強制水泳テスト(FST)における時間経過依存性に関するORGの抗うつ効果
【0070】
2.1 実験方法
四川省の実験動物人民病院から入手したコンメイマウス(認証番号:A4CXK(Chuan)2003−16)を使用した。これらは、実験例開始時、3〜4週齢で、体重は25〜30gであった。各群の動物の数を表6〜表8に示す。ORGを実施例1に記載するように調製した。動物を、異なる投与量の実験例群、およびビヒクル対照群に分けた。
【0071】
2.1.1 投与および実験計画:
ORGを異なる濃度で通常の生理食塩水(NS)に溶解した。全ての薬物およびそれらのビヒクルを、0.1ml/10gの容量で経口投与した。
【0072】
2.1.2 投与回数:
動物を、ORG(3mg/kg)またはNSで、24時間以内に1〜5回処置した。最後のORG処置から5時間後、不動時間を記録した。
【0073】
2.1.3 異なる投与量および投与回数の比較:
マウスを、24時間以内で、6mg/kgのORGで1回、あるいは3mg/kgのORGで2回処置した。最後のORG処置から5時間後に不動時間を記録した。
【0074】
2.1.4 抗うつ活性に関するORGの効果(発現時間および保持時間):
マウスをORG(3mg/kg)で処置した。投与から19時間後、さらにORG(3mg/kg)の投与量を与えた。
【0075】
2回目の投与から2.5時間、5時間、24時間、72時間および2週間後に、不動時間を記録した。
【0076】
2.1.5 データ分析:
結果は平均±SEM(%)として表す。NS群の不動時間を100%と設定し、各群の抗うつ効果をNS群に基づいて計算した。パーセントの値が低いほど、より良好な抗うつ効果が示されている。このノーマライズの方法により、実験例群の間の比較が可能になった。統計分析は、一元配置ANOVA、次いでLSDテストで行った。P値<0.05で有意であるとした。
【0077】
2.2 結果
2.2.1 マウスのFSTにおける24時間以内の投与の異なる回数でのORGの抗うつ効果
ORG(3mg/kg)を24時間以内に1〜5回投与した。ORGで2回または3回処置した群において、不動時間が有意に減少した(表6)。結果は、最も良好な薬物効果は、10〜19時間の時間間隔で、24時間以内に2回または3回の投与後に得られたことを示している。
【表6】

【0078】
2.2.2 同じ最終投与量を用いた、24時間以内に異なる投与回数の中での抗うつ効果の比較
マウスを、24時間内に、6mg/kgのORGで1回、あるいは3mg/kgのORGで2回処置した場合、不動時間は全ての群で減少した(表7)。しかし、24時間内に、3mg/kgのORGで2回処置されたマウスがより良好な効果を示した。
【表7】

【0079】
2.2.3 FSTにおける迅速な発現および長期的な持続に関するORGの抗うつ効果
マウスにORGを経口的に与えた(3mg/kg)。19時間後、さらにORG(3mg/kg)の投与量を与えた。2回目の投与から2.5時間、5時間、24時間、72時間および2週間後に、不動時間を記録した。ORGの抗うつ効果は、2回目の投与から2.5時間後に迅速に現れた。最高の効果は2回目の投与から24時間後に現れ、該効果は、少なくとも72時間持続した(表8)。結果は、ORGが抗うつ効果を素早く発現し、この効果は少なくとも72時間持続することを示している。
【表8】

【0080】
[実験例3]
マウスの慢性の予測不能軽度ストレスモデルにおけるORGの抗うつ効果
慢性の予測不能軽度ストレス(CMS)は、ヒトにおいてうつ病を悪化させるまたは引き起こすのと同じ慢性ストレスの病因を持つうつ病モデルであると考えられる。飲料または食物制限、抑制および水泳のような種々の予測不能な軽度のストレスにより、動物は、報酬に対する反応(たとえば、糖飲料の好み)をなくすことがある。CMSに曝した後、FSTおよびTSTにおける不動時間は有意に増加し、これはうつ病がより重症化したことを示す。したがって、CMSは、ストレスに起因するうつ病に関して、抗うつ剤の効果を評価するために、広く使用される。
【0081】
3.1 実験方法
四川省の実験動物人民病院から入手したコンメイマウス(認証番号:A4CXK(Chuan)2003−16)を使用した。これらは、実験例開始時、3〜4週齢で、体重は25〜30gであった。各群の動物の数を表9および表10に示す。ORGを実施例1に記載するように調製した。動物を、異なる投与量の実験例群、ビヒクル対照群、および正の対照としてイミプラミン群(Sigma,バッチNo.106k1588)に分けた。
【0082】
CMSモデル:コンメイマウスに与えた慢性的な軽度ストレスは、日内リズムの逆転、連続照射、寒さ、湿った寝具、傾斜のあるケージ、食物および飲料制限、および拘束であった。これらのストレスのうち一つだけを、無作為に各マウスに24時間与え、同じストレスは、継続して2回与えなかった。ストレス期間を8週間続けた。最後の週で、ORG1日1回を7日間連続して経口投与した。行動テストを最後の投与から30分後に行った。テストしたパラメータは、CMSモデルマウスのFSTおよびTSTにおける不動時間であった。FSTおよびTSTの方法およびデータ分析は、先に記載の通りであった。
【0083】
3.2 結果
3.2.1 CMSモデルマウスのFSTにおけるORGの抗うつ効果
ORGは、FSTにおいて、不動時間を有意に減らし、その効果は投与量に有意に依存していた(表9)。抗うつ効果に関する最高投与量は20mg/kgであり、ED50は0.81mg/kgであった。
【表9】

【0084】
3.2.2 CMSモデルマウスのTSTにおけるORGの抗うつ効果
ORGは、TSTにおいて不動時間を有意に減らし、その効果は投与量に有意に依存していた(表10)。抗うつ効果に関する最高投与量は20mg/kgであり、ED50は約4.22mg/kgであった。
【表10】

【0085】
3.3 CMSモデルマウスのTSTおよびFSTにおけるORGのTI
急性毒性テストにおいて、マウスにORGを1750mg/kgの投与量で投与した場合、飽和濃度、動物行動学的および組織学的検査で、異常は発見されなかった。したがって、ORGの中毒量の中央値(TD50)は、1750mg/kgよりも高かった。
FSTのCMCマウスにおけるORGの治療指数(TI)≧1750mg/kg÷0.81mg/kg≧2160。
TSTのCMSマウスにおけるORGの治療指数(TI)=TD50÷ED50≧1750mg/kg÷4.22mg/kg≧415。
【0086】
[実験例4]
マウスの恒暗(DD)モデルにおけるORGの抗うつ効果
DDモデルは、日内リズム障害に関連するうつ病の試験のために使用されると近年報告された病原学的モデルである。このモデルでは、動物の日内リズムを、うつ病を誘発するまたは悪化させる連続した暗室飼育条件で変化させる。したがって、この試験では、DDモデルを、うつ病を起こすまたは悪化させるために使用し、次いでORGの抗うつ効果をFSTおよびTSTでテストした。
【0087】
4.1 実験方法
四川省の実験動物人民病院から入手したコンメイマウス(認証番号:A4CXK(Chuan)2003−16)を使用した。これらは、実験例開始時、3〜4週齢で、体重は25〜30gであった。各群の動物の数を表11および表12に示す。ORGを実施例1に記載するように調製した。動物を、異なる投与量の実験例群、ビヒクル対照群、および正の対照としてイミプラミン群(Sigma,バッチNo.106k1588)に分けた。
【0088】
マウスのDDモデル:マウスを24時間連続的に暗い条件下に置いた。パッドの交換、食物および水の追加、および他の操作は、輝度が1.0ルクス未満の赤色灯の条件下で行った。この条件の期間を、28日間継続した。最終の週で、ORGを1日1回1週間経口投与した。FSTおよびTSTを最後の投与から30分後に行った。方法およびデータ分析は先に記載した通りであった。
【0089】
4.2 結果
4.2.1 DDモデルマウスのFSTにおけるORGの抗うつ効果
ORGは、FSTにおいて不動時間を有意に減らし、その効果は投与量に有意に依存していた(表11)。最高効力の投与量は10mg/kgであり、ED50は約1.48mg/kgであった。
【表11】

【0090】
4.2.2 DDモデルマウスのTSTにおけるORGの抗うつ効果
ORGは、TSTにおいて不動時間を有意に減らし、その効果は投与量に有意に依存していた(表12)。最高効力の投与量は20mg/kgであり、ED50は約1.75mg/kgであった。
【表12】

【0091】
[実験例5]
マウスの睡眠遮断(SD)モデルにおけるORGの抗うつ効果
睡眠障害は、うつ病の症状の一つである。うつ病を発症するまたは悪化させる病理学的要因の一つであるかもしれない。不動状態のようなうつ病様行動は、睡眠遮断によって亢進される。そこで、SDモデルをうつ病を起こすまたは悪化させるために使用し、次いでORGの抗うつ効果を、SDモデルマウスのFSTおよびTSTにおいてテストした。
【0092】
5.1 実験方法
四川省の実験動物人民病院から入手したコンメイマウス(認証番号:A4CXK(Chuan)2003−16)を使用した。これらは、実験例開始時、3〜4週齢で、体重は25〜30gであった。各群の動物の数を表13に示す。ORGを実施例1に記載するように調製した。動物を、異なる投与量の実験例群、ビヒクル対照群、および正の対照としてイミプラミン群(Sigma,バッチNo.106k1588)に分けた。
【0093】
SDモデル:マウスのSDモデルを確立するために、水環境中の複数の台を用いる修正法を使用した。台上のマウスは、飲食は自由であった。しかし眠ってしまうと、筋緊張を失うため、水中に落ちた。落ちた動物は、台を支えている傾斜した柱を介して、台に再び這い上がった。72時間の睡眠遮断の後、ORGを、FSTを開始する24時間および5時間前に経口投与した。動物の不動時間を記録した。方法およびデータ分析は、先に記載した通りであった。
【0094】
5.2 結果
5.2.1 SDモデルマウスのFSTにおけるORGの抗うつ効果
3日間の睡眠遮断の第3日目、ORGを、FSTを開始する24時間および5時間前の2回投与した。ORGは、FSTにおいて不動時間を有意に減らし、その効果は投与量に有意に依存していた(表13)。最高効力の投与量は10mg/kgであり、ED50は約3.79mg/kgであった。
【表13】

【0095】
5.3 DDモデルおよびSDモデルマウスにおけるORGの治療指数
ORGの中毒量の中央値(TD50)は1750mg/kgよりも高かった(前を参照)。FSTのDDマウスにおけるORGの治療指数=TD50÷ED50≧1750mg/kg÷1.48mg/kg≧1182。TSTのDDマウスにおけるORGの治療指数=TD50÷ED50≧1750mg/kg÷1.75mg/kg≧1000。FSTのSDマウスにおけるORGの治療指数=TD50÷ED50≧1750mg/kg÷3.79mg/kg≧462。
【0096】
[実験例6]
ORGの抗不安効果の薬理試験
げっ歯類におけるフットショックおよび調整された恐怖ストレスにより誘発されたすくみ挙動は、不安のレベルを評価するためのモデルとして広く認められている。げっ歯類は、嫌悪刺激が与えられると、すくみ挙動を示す。避けられない恐怖刺激に対する動物の正常な応答であるすくみは、身体運動の完全な欠如またはしゃがんだ姿勢の維持と規定される。抗不安剤は動物のすくみ挙動を減らす。さらに、高架式十字迷路は、げっ歯類における不安の評価のための、広く認められているモデルである。該不安の査定は、げっ歯類は、恐ろしければ、自発的に高架式十字迷路のクローズドアームにより多くの時間を費やすように、新規探査への動向と高さの恐怖との間の葛藤に基づく。したがって、新規探査行動は、抗不安剤によって強化され、不安惹起剤によって抑制される。
【0097】
6.1 実験方法
四川省の実験動物人民病院から入手したコンメイマウス(認証番号:A4CXK(Chuan)2003−16)を使用した。これらは、実験例開始時、3〜4週齢で、体重は25〜30gであった。各群の動物の数を表13に示す。ORGを実施例1に記載するように調製した。動物を、異なる投与量のORGを与えた薬物投与群、ビヒクル対照群、および正の対照としてジアゼパム群(Jinyao社,バッチNo.106k1588)に分けた。
【0098】
フットショック誘発すくみ挙動:10分間のトレーニングセッションのために標準のコンディショニングチャンバ(Med Associates,USA)に置く24時間および5時間前に、動物にORGまたはビヒクルの腹腔内注射を与えた。セッション開始から2、4、6、8および10分後、フットショック(0.8mA、2秒)をチャンバのグリッド床を通して送った。最後の5分間のすくみ時間を記録した。最初のトレーニングから24時間後、ラットをフットショックのないチャンバに再び置き、すくみ時間を記録した。
【0099】
高架式十字迷路(EPM):EPMは、等しい寸法(長さ30cm×幅5cm)の2個のオープンアームおよび2個のクローズドアームを備えていた。2個のクローズドアームを、5cm×5cmの中央領域によって接続した。全迷路を35cmの高さに上げた。テストを始める24時間および5時間前に、ORGを腹腔内投与した。マウスを、クローズドアームに面する迷路の中央に個々に置いた。それぞれの動物を、5分間の単一セッションでテストした。オープンアームに入る数、クローズドアームに入る数、オープンアームに居る合計時間、およびクローズドアームに居る合計時間を記録し、全ての肢がアームに入ることを入場する基準として定義した。オープンアームへの入場の数およびオープンアームに居た時間は、動物の不安レベルを評価する主要な指標であり、より入場の回数が多いほど、あるいは時間が長いほど、不安レベルは小さい。
【0100】
データ分析:テストの結果は、平均±SEMとして表す。一方向ANOVA、次いでSPSS11ソフトウェアを使用するLSDテストを使用した。有意レベルは、P<0.05に設定した。
【0101】
6.2 結果
6.2.1 ラットのフットショック誘発すくみ挙動試験におけるORGの抗不安効果
【0102】
テストを開始する24時間および5時間前にORGを腹腔内投与した場合、ラットのすくみ時間は、有意に減少した(表14)。
【表14】

【0103】
6.2.2 ラットの調整された恐怖ストレス誘発すくみ挙動試験におけるORGの抗不安効果
フットショックを受ける24時間および5時間前に2回、ラットにORGを腹腔内投与し、24時間後、フットショックを与えずに、同じ環境に再び曝した。環境要因により誘発される恐れの記憶の回復により、ラットはすくみ挙動を誘発する調整された恐怖ストレスを起こす。ORGは、すくみ挙動を著しく減らした(表15)。
【表15】

【0104】
6.2.3 マウスの高架式十字迷路試験におけるORGの抗不安効果
高架式十字迷路テストの24時間および5時間前に2回投与されたORGにより、オープンアームへの入場の回数およびオープンアームに居た合計時間は有意に増加した(表16および表17)。この結果は、ORGの有意な抗不安効果を示していた。
【表16】

【表17】

【0105】
[実験例7]
ORGの抗ストレス効果の薬理試験
ストレスは、生物系において、生物の生理的または心理的な恒常性維持を深刻にかく乱する任意の状態として定義される。ストレスは、多くの病気を悪化させるあるいは至らせる主要な要因の一つであると考えられている。海馬は、学習および記憶、ならびにストレス応答の調節において重要な脳の構造である。ストレスにより、海馬シナプス可塑性、学習および記憶の機能低下に至るかもしれない。血清コルチコステロンの濃度は、ストレスレベルを評価するための、最も一般的な指標の一つである。
【0106】
7.1 実験方法
四川省の実験動物人民病院から入手した250〜300gの重さのラットを使用した。ORGを実施例1に記載するように調製した。フルオキセチンは、Wuhan Yuancheng Technology社(Wuhan,China、バッチNo:1004−0801002)からのものであった。
【0107】
血清コルチコステロンの測定:放射性免疫測定法(RIA、DSL80100、Texas)を使用して、血清コルチコステロンの濃度におけるORGの効果を測定した。非ストレス群で、ORG注射の1時間後に、エーテル麻酔下心穿刺によって血液を採取した。ストレス群では、ORG注射の1時間後、ラットに高架式台ストレスを30分与え、次いで同じ方法でサンプルを採取した。血液サンプルを、室温で4時間維持し、次いで15分間(3000rpm)遠心した。上澄み(血清)を採取し、−20℃で保存した。
【0108】
海馬における長期強化(LTP)記憶の方法:海馬の興奮性シナプス後電位(EPSP)を記録し、ORGの抗ストレス効果を測定した。ストレスは海馬のCA1領域のLTPを損ない、これは、抗ストレス薬によって減らすことができる。ラットは、フットショックによって以下のように、すなわち、2分間の間隔で、1mA、2秒のストレスを5回受けた。海馬切片を調製し、34〜36℃で1時間、インキュベートし、次いで室温に保った。ORGを浴溶液中で与えた。CA1領域におけるNMDAおよびAMPA受容体により媒介されたEPSPを、べースラインが20分間安定になるまで記録した。次いで、高周波刺激(HFS、100Hz、100パルス、20秒の間隔)を使用してLTPを誘発した。EPSPをHFS後1時間記録した。
【0109】
データ分析:データは平均±SEMとして表し、LTPはベースラインに対する最後の10分間の平均振幅のパーセントとして表した。一方向ANOVA、次いでSPSS11ソフトウェアを使用するLSDテストを使用した。有意レベルはP<0.05に設定した。
【0110】
7.2 結果
7.2.1 血清コルチコステロンレベルの急性ストレス誘発上昇におけるORG(腹腔内注射)の抗ストレス効果。
血液を、対照では、ORGの腹腔内注射から1時間後に、あるいはストレスを受けてから30分後に心穿刺により採取した。ORGにより、血清コルチコステロンの濃度は、投与量依存性方式で有意に増加した(表18)。
【表18】

【0111】
7.2.2 ストレスで損なわれた海馬LTPにおけるORGの回復効果
海馬切片をフットショックストレスに曝した後のラットから調製した。これは、海馬LTPを損なう一般的に認められたプロトコルである。ORGで1時間インキュベートした切片において、ベースラインEPSPを20分間記録した。ORGは、ストレスで損なわれたLTPを回復し、5μM/Lの投与量で、LTPを有意に増加さえし、投与量依存性効果を示した(表19)。
【0112】
前記結果は、ORGが有意な抗ストレス効果を有し、ストレスが原因のうつ病の治療において重要な臨床価値を有することを示す。
【表19】

【0113】
[実験例8]
ORGの薬理試験および学習および記憶の強化
モリス水迷路(MWM)は、海馬依存性学習および記憶、ならびにその細胞および分子メカニズムの試験に広く使用されている。MWMは、学習および記憶の薬理学的評価の効果的な方法であると一般的に認められている。動物の逃避潜伏期間、戦略および軌跡を、自動的に追跡および分析し、動物の空間的な学習および記憶を調べる。動物がどのようにして逃避するかを学んだ後、隠された台を取り除き、標的の四分の一の区での滞在をテストする。正しい四分の一の区に滞在する時間が長いほど、記憶が良いことを示す。
【0114】
8.1 実験方法
四川省の実験動物人民病院から入手したコンメイマウス(認証番号:A4CXK(Chuan)2003−16)を使用した。これらは、実験例開始時、3〜4週齢で、体重は25〜30gであった。各群の動物の数を表20および表21に示す。ORGを実施例1に記載するように調製した。動物を、フルオキセチンまたは異なる投与量のORGを与えた薬物投与群およびビヒクル対照群に分けた。薬物投与群には、1.75mg/kgまたは3.5mg/kgのORG、あるいは15mg/kgのフルオキセチンを与えた。動物には、薬物またはビヒクルの単独腹腔内注射を、毎日訓練の30分後に、あるいは第8日目の滞在テストの30分前に、のどちらかで与えた。
【0115】
モーリス水迷路:MWMは、水面から約1cm下にある隠れた台(10cm×10cm)の付いた円形プール(直径100cmおよび深さ36cm)で行った。プールを、各四分の一の区に吊るした、異なる形のマーカーをつけた黄色のカーテンで囲んだ。隠れた台を見つけるまでにかかった時間およびマウスの軌跡をコンピュータで記録した。1日〜7日まで、マウスはプールに置かれ、固定された隠れた台を見つけた。第8日目、台を取り除き、マウスが標的四分の一の区に滞在する時間を、自由遊泳の1分も含めてカウントした。
【0116】
データ分析:テストのテスト結果は、平均±SEMとして表す。一方向ANOVA、次いでSPSS11ソフトウェアを使用するLSDテストを使用した。有意なレベルをP<0.05に設定した。
【0117】
8.2 結果
8.2.1 MWMテストにおける訓練直後のORG(腹腔内注射)の効果
ORGを毎日訓練後に与えた場合、空間的な記憶の回復(動物が標的四分の一の区に滞在した時間)は、記憶固定に影響することによって、有意に強化された(表20)。
【表20】

【0118】
8.2.2 MWMテストにおける回復前のORG(腹腔内注射)の効果
訓練は7日後に終了した。第8日目に回復テストを行った。回復の30分前にORGを投与した場合、空間的記憶回復は有意に強化された(表21)。
【表21】

【0119】
[実験例9]
ORGの毒性テスト
9.1 マウスにおけるORGの急性毒性テスト
9.1.1 実験方法
四川省の実験動物人民病院から入手したコンメイマウス(認証番号:A4CXK(Chuan)2003−16)を使用した。これらは、実験例開始時、3〜4週齢で、体重は25〜30gであった。ORGを実施例1に記載するように調製した。ORG(1750mg)を10mlのNSに溶解し、濃度を175mg/mlとした。マウスを2つの群に分け、評価用としてORG群にはORGを与え、もう一つの群はビヒクル対照としてNSで処置した。ORGおよびNSをそれぞれの群に、0.1ml/10gの容積で経口投与した。
【0120】
9.1.2 結果
急性毒性テストにおいて、ORGを1750mg/kgでマウスに投与し、動物の外観、行動、精神的状態、食欲、毛、色、および呼吸を14日間観察したが、異常は発見されなかった。全てのマウスが該実験で生き残り、体重増加も正常であった。2つの群の間で有意な違いはなかった。全てのマウスを14日目に屠殺し、心臓、肝臓、脾臓、肺、腎臓、膵臓、卵巣、精巣、小腸および他の内臓を病理学切片により調べた。ここでも、異常な証拠はなかった。
【0121】
9.2 ラットにおけるORGの亜急性毒性
9.2.1 実験方法
四川省の実験動物人民病院から入手したラット(認証番号:A4CXK(Chuan)2003−16)を使用した。これらの体重は250〜300gであった。ORGを実施例1に記載するように調製した。
【0122】
9.2.2 結果
マウスFSTにおいて7955倍のED50、マウスTSTにおいて2397倍のED50であるORG(1750mg/kg)を、14日間連続して、1日1回経口投与した。動物の外観、行動、精神的状態、食欲、毛、色、および呼吸を14日間観察したが、異常は発見されなかった。全てのラットが該実験で生き残り、体重増加も正常であった。2つの群の間で有意な違いはなかった。全てのマウスを14日目に屠殺し、心臓、肝臓、脾臓、肺、腎臓、膵臓、卵巣、精巣、小腸および他の内臓を病理学切片により調べた。組織切片の画像は、異常な証拠を示さなかった。
5−メチル−1,3−ベンゼンジオールおよびその誘導体の薬理学的な概要
【0123】
ORGおよびその誘導体の抗うつ効果の投与量−効果および時間経過−応答を、FST、TST、DD、SDおよびCMSモデルを使用して試験した。結果は、OR、ORGおよびその誘導体は、うつ病およびうつ病を示唆する症状、すなわち、日内リズム障害、睡眠障害および慢性ストレスの治療および予防に有用な活性を示すことを表している。抗うつ剤メカニズムの実験により、OR、ORGおよびその誘導体は、海馬LTPの機能障害を改善し、海馬依存性学習および記憶を強化し、不安および急性ストレスのようなうつ病が関連する要因を治療し、予防することが示された。海馬LTPのメカニズムは、主に、NMDAおよびAMPA受容体、ならびにこれらの分子および細胞経路に関連する。要するに、OR、ORGおよびその誘導体は、調節剤として、これらの標的を調節し、海馬LTPの回復によってうつ病を治療および予防する効果を生み出す。
【0124】
主に化学シナプスおよび記憶を介する多くのニューロンによる伝達は、それらのシナプス内に記憶されると考えられるので、LTPは、学習および記憶の基本の主要細胞メカニズムの一つと考えられる。したがって、OR、ORGおよびその誘導体は、アルツハイマー病、小児期ADHD、喘息および統合失調症のような他の障害の治療および予防にも適用することができる。全ての疾患の90%超の疾患が、ストレスによって誘発されあるいは悪化されうるので、ストレス調節の海馬機能は、シナプス可塑性に関与し、OR、ORGおよびその誘導体は、服用中止期間の間、極度のストレスを感じる薬物中毒者、および過度のストレスまたは不安を受ける癌または心臓血管関連の病気の患者のような、臨床において多くの疾患の治療、予防およびリハビリテーションに有益である。
【0125】
毒性における先の実験例の結果と組合わせると、OR、ORGおよびその誘導体は、高い性能および低毒性の特徴によって、うつ病およびうつ病の病原学的原因の治療および予防において新しい応用がある。OR、ORGおよびその誘導体の他の用途は、急性ストレスおよび不安のようなうつ病を示唆する症状の治療および予防における適用である。OR、ORGおよびその誘導体の抗うつ効果に関与するメカニズムは、血清コルチコステロイド、NMDAおよびAMPA受容体、およびそれらの細胞内シグナル伝達を含む海馬シナプス可塑性、ならびに学習および記憶の調節である。
【0126】
したがって、OR、ORGおよびその誘導体に関する本発明の治療的用途および有益な効果は、以下の通りである。(1)うつ病に対する治療効果、(2)うつ病の原因に対する治療効果、(3)うつ病または類似の症状のある他の疾患に対する治療効果、(4)それらの潜在的用途は、いかなる方法でも、うつ病を治療および予防する方法に限定すると解釈するつもりはなく、またそのように解釈すべきではなく、ストレス、不安および認知機能低下に関与する他の疾患にも有用であろう。
【技術分野】
【0001】
本発明は、5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬品または機能性食品の製剤においてこれらを含有する医薬組成物の使用に関する。
【背景技術】
【0002】
うつ病は、総人口の最大20%の人々に発症している、一般に見られるの精神障害である。うつ病では、以下の症状、持続性または反復性抑うつ気分、不安、動揺、睡眠障害、異常なストレス応答、および認知機能障害が共通している。
【0003】
過去数十年間にわたり、神経薬理学の起動力の下、多くの公認された動物モデルが、抗うつ剤の活性を評価するために開発されてきた。最も広く使用されているモデルは、げっ歯類の強制水泳テストおよび尾懸垂テストである。近年、多くの研究により、恒常的な暗闇、睡眠遮断、および慢性の予測不能な軽度のストレスは、うつ病の発生の病因学的モデルであることが示されている。これらのモデルにより、抗うつ剤の研究の土台が築かれた。うつ病の発病機序はまだ完全に明らかではないが、海馬シナプス可塑性(たとえば、長期強化)における変化および認知機能における役割は、うつ病に内在する重要なメカニズムの一つであるかもしれない。
【発明の概要】
【発明が解決しようとする課題】
【0004】
5−メチル−1,3−ベンゼンジオール(一般的にオルシノールとして知られる)は、通常、有機合成用の熱分解中間体の加工における熱重合の阻害剤として使用される。また、RNAの特異的定量用の試薬でもある。5−メチル−1,3−ベンゼンジオールおよびその誘導体は、抗酸化剤としてしばしば使用されてきた。これらは、一定の抗菌活性を有する。今までのところ、それらを、うつ病、不安、動揺、睡眠障害、異常なストレス応答、または認知機能障害を軽減するために使用することについては報告がない。
【課題を解決するための手段】
【0005】
本発明は、5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬品または機能性食品の製剤中にこれらを含有する医薬組成物を、うつ病の治療または予防のために使用することに関する。さらに詳しくは、本発明は、うつ病またはそれに関連する疾病およびこれらの疾患の原因の治療に使用される5−メチル−1,3−ベンゼンジオールまたはその誘導体に関する。
【0006】
本発明の化合物は、式Iで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体である。
【化1】

式I
(式中、R1および/またはR2は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、マンノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【0007】
より好ましくは、本発明の化合物は、式IIで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体である。
【化2】

式II
(式中、R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、マンノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【0008】
より好ましくは、式中、R1は、水素、β−D−グルコピラノシル、オルシノールとして挙げられる、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、またはオルシノール−1−O−β−D−グルコピラノシド、またはオルシノール−1−O−[β−D−グルコピラノシル−(1→6)]−β−D−グルコピラノシドである。
【0009】
より好ましくは、本発明の化合物は、式IIIで表される5−メチル−1,3−ベンゼンジオールの誘導体である。
【化3】

式III
(式中、R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【0010】
とりわけ、R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、またはラムノピラノシルである。
【0011】
より好ましくは、本発明の化合物は、式IVで表される5−メチル−1,3−ベンゼンジオールの誘導体である。
【化4】

式IV
(式中、R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【0012】
好ましくは、R2は、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシルまたはアセチルである。
【0013】
アメリカ精神医学会により出版された精神障害の診断と統計マニュアル、第4版(DSM−IV)、および国際疾病分類、第10版(ICD−10)に記載されているように、うつ病は、異なるサブタイプの精神疾患および障害が挙げられ、(1)うつ病、躁病、混合性躁病、および軽躁病のようなうつ病および気分障害、(2)うつ病性障害およびおよび不機嫌のようなうつ病性障害、(3)たとえば健康不良に起因する他の感情障害であって、健康不良として、物質(たとえば、習慣性薬物)または療法(たとえば、外科手術、放射線療法、または化学療法)に起因するうつ病性障害および感情障害の特徴を持つ、異なる精神疾患またはサブタイプの障害が挙げられ、(4)うつ病および軽躁病の2種以上のエピソード、および躁病およびうつ病の交代性エピソードを含む双極性障害または双極性感情障害である。
【0014】
DSM−IVおよびICD−10に記載されたうつ病の症状の他に、本発明は、日内リズム障害、睡眠障害、慢性ストレス、不安、急性ストレス誘発障害、または認知機能低下または障害の治療および予防も含む。
【0015】
うつ病の他に、本発明は、日内リズム障害、睡眠障害、慢性ストレス、不安、急性 ストレス誘発障害、または認知機能低下または障害に関連する疾患の治療および予防も含む。さらに、本発明は、絶望感(たとえば、自殺念慮および行動)、気分障害、および異常な急性ストレス応答の予防および治療も含む。
【0016】
睡眠および日内リズム障害:うつ病を持つ患者に非常に一般的な疾患である睡眠障害は、うつ病の程度を評価するための評価尺度の中身の一つである。日内リズム障害は、最も重要な生理学的機能を言う。正常な日内リズムは、明暗が交互に変わることによって動かされる。時差、季節、生活習慣または遺伝は、日内リズム障害を引き起こす可能性があり、さらにうつ病および認知機能低下のような高次脳機能の欠損を引き起こす可能性がある。DSM−IVまたはICD−10によれば、睡眠障害は、三つの大きな範疇、(1)不眠症、過眠症、ナルコレプシー、呼吸関連睡眠障害および日内リズム関連睡眠障害のような睡眠異常、(2)悪夢、睡眠パニック、および夢遊症のような睡眠時随伴症、(3)物質(たとえば,習慣性薬物)または療法(たとえば、外科手術、放射線療法、または)に起因する健康関連睡眠障害および睡眠障害に分類される。
【0017】
不安は、うつ病を持つ患者に非常に一般的な症状である。それは、うつ病の程度を評価するためのガイドラインの一つである。不安障害は、二つの大きな範疇、(1)パニック障害、たとえば、広所恐怖症、特定のパニック障害(たとえば、特定の動物、環境、または輸血の恐怖、社会恐怖、または強迫性障害)、外傷後ストレス障害、急性ストレス障害、および大きな不安障害、および(2)健康関連不安障害および物質誘発障害(たとえば,習慣性薬物)または療法誘発障害(外科手術、放射線療法または化学療法)を含む。薬物の抗不安活性を評価するため、げっ歯類モデルの高架式十字迷路およびすくみ挙動が広く使用されている。
【0018】
ストレスは、生物系において、生物の生理的なまたは心理的な恒常性維持を重篤にかく乱する任意の状態と規定される。ストレスは、精神疾患および認知機能障害のような多くの疾病を悪化させるあるいは該疾病を発症させる主な要因の一つと考えられる。ストレス源として、数多くの日常の出来事を挙げることができ、これは人によって異なる。ある物質、たとえば習慣性薬物を摂取すること、あるいは外科手術のような療法を受けることは、普通、異常なストレス応答に導く。ストレスを評価するために一般的に用いられている生物学的指示薬として、コルチコステロイド濃度(たとえば、げっ歯類におけるコルチコステロンおよびヒトにおけるコルチゾール)が挙げられ、関連する急性ストレス誘発障害、たとえば、海馬シナプス可塑性の損傷ならびに学習および記憶の損傷を発症する可能性がある。動物実験で一般的に用いられているストレス方法として、フットショックおよび高架式台が挙げられる。
【0019】
認知は、最も重要な高次脳機能の一つである。これは、学習、記憶、言語、思考および気分を言う。うつ病は一種の認知障害とみなされ、これを患う患者は、ネガティブ思考および気分(気分障害)を無意識に持つ。1949年、へブは、シナプス修飾が学習および記憶の基礎であるという考えを提案した。1973年、この仮説は海馬の長期強化(LTP)を発見したブリスらによる実験で検証された。しかし、今のところ、臨床でLTPを直接調節する薬物を使用してうつ病を治療したことはない。より良好で速い治癒効果は、うつ病、その関連症状、およびその原因の治療において、シナプスの可塑性を改変する薬物の開発によって達成されるかもしれない。
【0020】
5−メチル−1,3−ベンゼンジオールまたはその誘導体は、遊離の形態または医薬組成物中で直接使用することができる。記載した医薬組成物は、医薬的に許容しうる賦形剤中、0.1〜99重量%の5−メチル−1,3−ベンゼンジオールまたはその誘導体を含む。
【0021】
本明細書で使用される用語「医薬担体および/または賦形剤」は、1種以上の固体、半固体または液状希釈剤、充填剤、または任意のタイプの形成補助剤を意味する。5−メチル−1,3−ベンゼンジオールまたはその誘導体の医薬組成物は、医薬品および食品分野で周知の技術によって、種々の医薬的に許容しうる賦形剤または食事療法的に許容しうる栄養補助食品として調製される。医薬的に許容しうる賦形剤または食事療法的に許容しうる栄養補助食品としては、噴霧剤、エアロゾル剤、注射剤、懸濁液剤、エマルジョン剤およびシロップ剤のような液体剤、および錠剤、カプセル剤および顆粒剤のような固体剤、または液体に溶解または懸濁した粉末が挙げられる。
【0022】
本発明では、投与方法として、注射または注入(静脈内、筋肉内、腹腔内または皮下)、経口、舌下および粘膜投与が挙げられる。
【0023】
前記疾患、それらの原因および症状を治療または予防するための活性成分(5−メチル−1,3−ベンゼンジオールまたは誘導体)の有効投与量は、0.1mg/成人/日と12g/成人/日との間、最適投与量は、50〜200mg/成人/日である。
【0024】
本発明は、5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいはそれらをうつ病の治療または予防用の医薬品および機能性食品の製剤中に含有する医薬組成物が、うつ病、および不安、ストレスおよび認知機能低下のようなうつ病を示唆する症状を治療および予防するための新しい選択を提供することを明らかにしている。
【発明を実施するための形態】
【0025】
以下の実施例に、本発明の理解および補足のために化合物および方法の詳細を記載するが、これらの実施例は、以下に続く請求項に記載された本発明を、いかなる方法によっても限定するものではないし、また本発明を限定的に解釈すべきではない。任意の他の方法によって調製された本発明に記載の化合物、およびうつ病、うつ病を示唆する症状、およびうつ病の病原学的原因を治療するための使用は、本発明に包含される。
【0026】
ここで、オルシノール(OR)、オルシノール−1−O−β−D−グルコピラノシド(ORG)およびオルシノール−1−O−[β−D−グルコピラノシル−(1→6)]−β−D−グルコピラノシド(ORGG)は、クルクリゴ・キンバイザサ(Curculigo orchioides)Garr.により抽出することができる。オルシノールの他の誘導体は、周知の技術により調製することができる。特定の方法を以下に示す。
【0027】
1.オルシノールは、対応する糖類のアセチル化生成物(ここで、R1および/またはR2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシルまたはアラビノシルである)と反応させることができ、該対応化合物は、オルシノールを前記糖類のアセチル化生成物と、光防護下、メタノ−ル中で反応させ、臭化水素酸および酢酸を添加し、室温で1〜5時間攪拌することによって得ることができる。オルシノールアセチル化グリコシド類が得られる。対応するオルシノールアセチル化グリコシド類を、ナトリウムメトキシドで、メタノ−ル中、室温で1〜5時間処理し、対応するオルシノールグリコシド類を得る。
【0028】
2.R1およびR2がアシルの場合、対応する酸無水物または塩化アシル物および10〜20%の4−ジメチルアミノピリジンの添加により、オルシノールまたはオルシノールグリコシド類をピリジン中に溶解し、60〜120℃で3〜5時間攪拌する。混合物を水に注ぎ込み、次いでクロロホルムで抽出し、粗生成物を得、これをさらに精製し、アシル化生成物を得る。
【0029】
3.R1およびR2がアルキルの場合、水素化ナトリウムの添加により、オルシノールまたはオルシノールグリコシド類をテトラヒドロフランまたはジメチルスルホキシドに溶解し、30〜60分攪拌する。対応するアルキロゲンの添加後、反応混合物をさらに3〜5時間攪拌し、次いで水に注ぎ込み、クロロホルムで抽出し、粗生成物を得、これをさらに精製し、アルキル化生成物を得る。
【実施例1】
【0030】
オルシノール−1−O−β−D−グルコピラノシド、オルシノール、およびオルシノール−1−O−[β−D−グルコピラノシル−(1→6)]−β−D−グルコピラノシドの
抽出および単離
【0031】
クルクリゴ・キンバイザサGarr.を集め、陰または日向で乾燥し、粉末化した。
【0032】
粉末材料(20kg)を、還流下、90%エタノ−ル(200kg)で各回それぞれ2時間で3回抽出した。抽出物を合わせ、濃縮し、約30kgを得、12時間沈降させたのち、ろ過した。次いで、粗抽出物をD−101マクロ多孔性樹脂カラムでクロマトグラフに供し(樹脂の重さは20kgであった)、100kgの蒸留水、60kgの70%エタノ−ルおよび60kgの90%エタノールで連続的に溶出した。70%エタノール溶出液および90%エタノール溶出液を別々に集め、蒸発乾固し、70%エタノール溶出液(340g)および90%エタノール溶出液(60g)を得た。
【0033】
得られた70%エタノール溶出液(340g)をメタノールに溶解し、400gのシリカゲルに吸収させた。室温で乾燥したのち、固形物を粉砕し、ふるいにかけ、シリカゲルカラムクロマトグラフィ(2.1kg,200〜300メッシュ)に供し、クロロホルム−メタノール−水(90:10:1〜70:30:3,v/v/v)で溶出し、26画分を得た。各画分は1500mlであった。画分2および画分3を合わせ、濃縮し、エタノールで結晶化し、オルシノール(5g)を得た。画分9〜画分15を合わせ、濃縮し、エタノールで結晶化し、オルシノール−1−O−β−D−グルコピラノシド(50g)を得た。画分22〜画分26を合わせ、濃縮し、エタノールで結晶化し、オルシノール−1−O−[β−D−グルコピラノシル−(1→6)]−β−D−グルコピラノシド(10g)を得た。
【0034】
構造決定:旋光度をSEPA−300偏光計で測定し、UV−VISスペクトルをUV−210A分光計で得、IRデータを、KBrペレットを備えるBio−Rad FTS−135分光計で集め、核磁気共鳴(1H NMRおよび13C NMR)スペクトルを、内部標準としてTMSを用い、CDCl3中でBruker DRX500分光計によって測定した。カラムクロマトグラフィおよび薄層クロマトグラフィシリカゲル用の材料は、Makall Group社(Qingdao,China)から入手した。
【0035】
【化5】

名称:オルシノール−1−O−β−D−グリコピラノシド
分子式:C13H18O7、
分子量:286、
特性:薄黄色粉末、
[a]D−63.03°(c5.95,メタノール)、
UV(メタノール):λmax(logε)279(3.19)、273(3.21)、219(3.99)、203(4.58)、
IR(KBr):νmax3495、3385、1620、1596、1175、1076、1032cm−1、
FAB−MS(−):m/z285[(M−1)−,100]、123[(M−1−glc)−,87]、
1H−NMR(CD3OD,400MHz)δH:6.41(1H,s,H−2)、6.36(1H,s,H−6)、6.29(1H,s,H−4)、4.84(1H,d,J=7.3Hz,H−1’)、2.22(3H,s,H−7)、
13C−NMR(CD3OD,100 MHz)δC:160.1(s,C−1)、111.4(d,C−2)、159.2(s,C−3)、102.4(s,C−4)、141.3(s,C−5)、110.0(d,C−6)、21.6(q,C−7)、102.5(d,C−1’)、75.0(d,C−2’)、78.1(d,C−3’)、71.6(d,C−4’)、78.2(d,C−5’)、62.7(t,C−6’)。
【0036】
【化6】

名称:オルシノール
分子式:C7H8O2、
分子量:124、
特性:薄黄色−白色粉末、
UV(メタノール):λmax(logε)281(3.20)、275(3.22)、204(4.59)、
IR(KBr):νmax3313、1629、1601、1512、1477、1332、1208、1148、1032、973cm−1、
EI−MS(70ev):m/z125[(M+1)+,8]、124[M+,100]、123[(M−1)+,55]、107[(M+1-18)+,7]、95(12)、77(8)、
1H−NMR(CD3OD、400MHz)δH:6.14(2H,brs,H−2,6)、6.10(1H,brs,H−4)、2.16(3H,s,H−7)、
13C−NMR(CD3OD,100MHz)δC:159.2(s×2、C−1、3),108.7(d×2,C−2、6)、108.7(s,C−4)、141.2(s,C−5)、21.5(q,C−7)。
【0037】
【化7】

名称:オルシノール−1−O−[β−D−グルコピラノシル−(1→6)]−β−D−グルコピラノシド
分子式:C19H28O12、
分子量:448、
特性:白色無定形粉末、
融点:117〜119℃、
FAB−MS(−)(m/z):447[M−1]−、123[M−1−2glc]、
1H NMR(400MHz,CD3OD)δH:6.43(1H,brs,H−2)、6.40(1H,brs,H−4)、6.28(1H,brs,H−6)、4.82(1H,d,J=7.30Hz,H−1’)、4.40(1H,d,J=7.73Hz,H−1’’)、2.21(3H,s,H−7)、
13C NMR(125MHz,CD3OD)δC:160.0(s,C−1)、102.0(d,C−2)、159.2(s,C−3)、111.2(d,C−4)、141.3(s,C−5)、109.8(d,C−6)、21.7(s,C−7)、102.1(d,C−1’)、74.8(d,C−2’)、77.7(d,C−3’)、71.3(s,C−4’)、77.5(d,C−5)、69.6(t,C−6’)、104.6(d,C−1’’)、75.2(d,C−2’’)、77.8(d,C−3’’)、71.5(d,C−4’’)、77.9(d,C−5’’)、62.6(t,C−6’’)。
【実施例2】
【0038】
1,3−O−ジアセチルオルシノールの調製
100mlの丸底フラスコにピリジン(40ml)およびオルシノール(1.24g,0.01mol)を充填した。反応混合物を室温で攪拌し、無水酢酸(3ml)を滴下した。室温で24時間攪拌した後、反応混合物を200mlの氷水に注ぎいれた。混合物を酢酸エチル(3×50ml)で抽出した。有機層を合わせ、5%塩酸で3回、飽和NaHCO3水溶液で3回、および飽和塩化ナトリウムで3回洗浄し、Na2SO4で乾燥し、ろ過し、真空下で蒸発乾固した。粗生成物を、シリカゲルカラムクロマトグラフィに供し、石油エーテル−アセトン(90:10,v/v)で溶出し、1,3−O−ジアセチルオルシノール(1.87g,収率90%)を得た。
【0039】
【化8】

名称:1,3−O−ジアセチルオルシノール
分子式:C11H12O4、
分子量:208、
特性:無色油状物
1,3−O−ジアセチルオルシノールの構造データ:
ESI−MS(+)m/z:231[M+Na]+、
IR(KBr)nmax:1769、1602、1592、1466、1434、1369、1292、1198、1124、1036cm−1、
1H NMR(CDCl3)δH:6.78(2H,s,J=1.9Hz,H−4,6)、6.71(1H,d,J=1.9Hz,H−2)、2.30(3H,s,H−7)、2.19(s,6H)、
13C NMR(CDCl3)δC:169.0(s,CH3CO)、169.0(s,CH3CO)、150.9(s,C−1)、150.9(s,C−3)、140.3(s,C−5)、119.7(d,C−4)、119.7(d,C−6)、112.5(d,C−2)、21.2(q,C−7)、20.9(q,CH3CO)、20.9(q,CH3CO)。
【実施例3】
【0040】
3−O−アセチル−オルシノール−1−O−(2,3,4,6−テトラアセチル)−β−D−グルコピラノシドの調製
オルシノール(286mg)をピリジン(20ml)に溶解した。反応混合物を室温で攪拌し、無水酢酸(2.5g,25mmol)を滴下した。室温で24時間攪拌した後、反応混合物を50mlの氷水に注ぎ入れた。混合物を酢酸エチル(3×20ml)で抽出した。有機層を合わせ、5%塩酸で3回、飽和NaHCO3水溶液で3回および飽和塩化ナトリウムで3回洗浄し、Na2SO4で乾燥し、ろ過し、真空下で蒸発乾固した。粗生成物をシリカゲルカラムクロマトグラフィに供し、3−O−アセチル−オルシノール−1−O−(2,3,4,6−テトラアセチル)−β−D−グルコピラノシド(421mg,収率85%)を得た。
【0041】
【化9】

名称:3−O−アセチル−オルシノール−1−O−(2,3,4,6−テトラアセチル)−β−D−グルコピラノシド
分子式:C23H28O12、
分子量:496、
特性:白色無定形粉末、
ESI−MS(+)m/z:519[M+Na]+、
IR(KBr)nmax:1759、1625、1590、1373、1241、1211cm−1、
1H NMR(CDCl3)δH:6.68(1H,s,J=1.9Hz)、6.63(1H,s,J=1.9Hz)、6.54(1H,s,J=1.9Hz)、5.30〜5.22(m,2H)、5.14(t,1H,J=9.7Hz)、5.06(1H,d,J=7.5Hz)、4.28〜4.14(m,2H)、3.89〜3.85(m,1H)、2.31(s,3H)、2.27(s,3H)、2.08(s,3H)、2.05(s,3H)、2.04(s,3H)、2.03(s,3H)、
13C NMR(CDCl3)δC:170.6(s,CH3CO)、170.2(s,CH3CO)、169.4(s,CH3CO)、169.3(s,CH3CO)、169.3(s,CH3CO)、157.2(s,C−3)、151.1(s,C−1)、140.6(s,C−5)、117.2(d,C−6)、115.1(d,C−4)、107.6(d,C−2)、98.8(s,C−1’)、72.6(d,C−3’)、72.0(d,C−5’)、71.0(d,C−2’)、68.2(d,C−4’)、62.0(t,C−6’)、21.5(q,C−7)、21.1(q,CH3CO)、20.6(q,CH3CO×4)。
【実施例4】
【0042】
オルシノール−1−テトラ−O−アセチル−ラムノピラノースの調製
テトラ−O−アセチル−ラムノピラノース(36g)を臭化水素酸および酢酸の混合物(100ml)に溶解した。反応混合物を、光防護下、5時間攪拌した。反応混合物を500mlの氷水に注ぎ入れ、酢酸エチル(3×500ml)で抽出した。有機層を合わせ、水で3回、5%NaHCO3水溶液で3回、および飽和塩化ナトリウムで3回洗浄し、Na2SO4で乾燥し、ろ過し、真空下で蒸発乾固し、テトラ−O−アセチル−ラムノピラノシルブロミドを得た。
【0043】
オルシノール(12.4g)をクロロホルム(20ml)に溶解した。反応混合物を攪拌し、5%水酸化ナトリウム溶液(20ml)を加えた。温度が50℃まで上昇した時、テトラ−O−アセチル−ラムノピラノシルブロミド(0.12mol)をクロロホルムに溶解した溶液を滴下した。反応が完了するまで、反応混合物を50℃で攪拌し、次いで150mlの氷水に注ぎ入れた。5%塩酸でpHを7に調節した。混合物を酢酸エチルで抽出した。有機層を合わせ、飽和塩化ナトリウムで洗浄し、Na2SO4で乾燥し、ろ過し、真空下で蒸発乾固した。粗生成物を、シリカゲルカラムクロマトグラフィに供し、酢酸エチル−石油エーテル(5:1,v/v)で溶出し、オルシノール−1−テトラ−O−アセチル−ラムノピラノース(1.87g,収率90%)を得た。
【実施例5】
【0044】
オルシノール−1−ラムノピラノースの調製
ナトリウムメトキシド(0.18g)を、オルシノール−1−テトラ−O−アセチル−ラムノピラノース(4.14g)のメタノール(20ml)溶液に加えた。室温で2時間攪拌した後、反応混合物を5%塩酸で中性にした。蒸留水(50ml)を添加した後、メタノールを真空下で除去した。混合物をn−ブタノール(3×50ml)で抽出した。有機層を合わせ、飽和塩化ナトリウムで洗浄し、Na2SO4で乾燥し、ろ過し、真空下で蒸発乾固した。粗生成物をエタノールで結晶化し、オルシノール−1−ラムノピラノースを得た。
【実施例6】
【0045】
実施例1に従って調製したオルシノール−1−O−β−D−グリコピラノシドを、注射用の水に溶解した。細菌ろ過(0.2〜0.45μmろ過)の後、溶液をバイアルにサブパッケージし、密封し、滅菌しオルシノール−1−O−β−D−グリコピラノシドの注射液を得た。
【実施例7】
【0046】
実施例1に従って調製したオルシノール−1−O−β−D−グリコピラノシドを、注射用の無菌水に溶解した。該溶液を、ブフナー漏斗を使用して真空ろ過によりろ過し、無菌条件下、精密フィルターでろ過(0.2〜0.45μmろ過)し、アンプルにサブパッケージし、凍結乾燥の後密封し、オルシノール−1−O−β−D−グリコピラノシドの注射用凍結乾燥粉末を得た。
【実施例8】
【0047】
実施例1に従って調製したオルシノール−1−O−β−D−グリコピラノシドを賦形剤と混合し、オルシノール−1−O−β−D−グリコピラノシドの注射用粉末を得た。前者の後者に対する重量比は、9:1であった。
【実施例9】
【0048】
オルシノール−1−O−β−D−グリコピラノシドを実施例1に従って調製した。オルシノール−1−O−β−D−グリコピラノシドと賦形剤とを、1:5と1:10との間の化合物と賦形剤との重量比で混合することによって錠剤、カプセル剤および顆粒剤を調製した。
【実施例10】
【0049】
オルシノール−1−O−β−D−グリコピラノシドを実施例1に従って調製した。オルシノール−1−O−β−D−グリコピラノシドの経口液剤を、従来の方法に従って調製した。
【実施例11】
【0050】
オルシノール−1−O−β−D−グリコピラノシドを実施例1に従って調製した。オルシノール−1−O−β−D−グリコピラノシドと賦形剤とを5:1の重量比で混合することによって、カプセル剤および顆粒剤を調製した。
【実施例12】
【0051】
実施例1に従って調製したオルシノール−1−O−β−D−グリコピラノシド(12.4g)、デンプン(600g)、ラクトース(200g)、メントール(5g)およびカルボキシメチルスターチナトリウム(183g)を混合し、機能性食品としてトローチとなるよう更に調製した。
【0052】
本発明の本質をより深く理解するために、オルシノールまたはその誘導体、および医薬担体または賦形剤を含有する医薬組成物の薬理学的効果を試験する。しかし、本発明は、特定の詳細な記載に限定されないことは理解されるものである。
【0053】
[実験例1]
ORGおよびORの薬理学的試験
1.ラットおよびマウスの尾懸垂テスト(TST)および強制水泳テスト(FST)における投与量−効果関係に関するORGおよびORの抗うつ効果
【0054】
1.1 実験方法
四川省の実験動物人民病院(the Institute Experimental Animals,People’s Hospital)から入手した昆明マウスおよびスプラーグ・ドーリー・ラット(認証番号:A4CXK(Chuan)2003−16)を使用した。マウスは、実験例開始時、3〜4週齢で、体重は25〜30gであった。ラットの体重は250〜300gであった。各群の動物の数を表1〜表5に示す。オルシノール(OR)、オルシノール−1−O−β−D−グルコピラノシド(ORG)、オルシノール−1−O−[β−D−グルコピラノシル−(1→6)]−β−D−グルコピラノシド(ORGG)、1,3−O−ジアセチルオルシノール(OR−2Ac)、および3−O−アセチル−オルシノール−1−O−(2,3,4,6−テトラアセチル)−β−D−グルコピラノシド(ORG−5Ac)を、実施例1、2および3に従って調製した。動物を、異なる投与量の実験例群、ビヒクル群、およびイミプラミン群(Sigma,バッチNo.106k1588)およびベンラファキシン群(Wuhan Yuancheng社,バッチNo.200701001)を含む2つのD群に分けた。
【0055】
薬剤:ORGを通常の生理食塩水に溶解した。正の対照では、イミプラミンまたはベンラファキシンを、音波処理により0.5%CMC−ナトリウムを含有する通常の生理食塩水に懸濁させた。イミプラミンまたはベンラファキシンの投与量は、15mg/kgであった。歯肉内または腹腔内注射の容量は、マウスで0.1ml/10g、およびラットで1ml/100gまたは0.1ml/100gであった。
【0056】
マウスにおけるFST:装置は水を深さ17cmまで満たしたシリンダ(高さ24cm×直径15cm)で構成され、温度は24±2℃であった。FSTを開始する24時間および5時間前に、全ての薬剤およびビヒクルを投与した。合計6分間の最後の4分間の間のマウスの不動時間を手動で記録した。
【0057】
ラットにおけるFST:各実験例で2回の水泳セッションを行った。先ず、15分間のプレテスト水泳セッションを行い、最初の5分間の不動時間を手動で記録した。不動時間が長すぎるあるいは短すぎる場合は、該ラットは排除した。全ての薬剤およびビヒクルを、プレテスト水泳セッション後0時間および19時間の2回投与した。プレテスト水泳セッションの24時間後、5分間の試験セッションの間の不動時間を手動で記録した。
【0058】
マウスにおけるTST:TSTを開始する24時間および5時間前に、全ての薬剤およびビヒクルを投与した。マウスを、試験チャンバの床から50cm上に位置する水平のバーに、尾の先から2cmの部分を接着テープで貼り付けることによって、ぶら下げた。6分間の不動時間を手動で記録した。
【0059】
データ分析:結果は平均±SEMとして表し、SPSS11ソフトウェアを使用して分析した。群間の比較は、一元配置分散分析(ANOVA)、次いで最小有意差(LSD)テストを使用して行った。有意レベルはP<0.05に設定した。ED50値は、GraphPad Prismソフトウェアを使用して計算した。
【0060】
1.2 結果
1.2.1 ラットのFSTにおけるORG(歯肉内注射)の抗うつ効果
【表1】

【0061】
ラットにおいて、経口投与したORGの投与量−効果関係を評価した。ORGにより不動時間が減らされ、その効果は投与量に有意に依存していた(表1)。最高効力の投与量は4mg/kgであり、ED50は約0.22mg/kgであった。
【0062】
1.2.2 マウスのFSTにおけるORG(歯肉内注射)の抗うつ効果
この試験では、FSTを開始する24時間および5時間前に、ORGを歯肉内投与した。不動時間は減少し、その効果は投与量に有意に依存していた(表2)。最高効力の投与量は3mg/kgであり、ED50は約0.22mg/kgであった。
【表2】

【0063】
1.2.3 マウスのTSTにおけるORG(歯肉内注射)の抗うつ効果
TSTを開始する24時間および5時間前に、ORGを歯肉内投与した。不動時間は減少し、その効果は投与量に有意に依存していた(表3)。最高効力の投与量は12mg/kgであり、ED50は約0.73mg/kgであった。
【表3】

【0064】
1.2.4 マウスのFSTにおけるOR(腹腔内注射)の抗うつ効果
この試験では、FSTを開始する24時間および5時間前に、ORを腹腔内投与した。不動時間は減少した(表4)。
【表4】

【0065】
1.2.5 マウスのFSTにおけるORGの誘導体(腹腔内注射)の抗うつ効果
この試験では、FSTを開始する24時間および5時間前に、ORGの誘導体(ORGG、OR−2Ac、およびORG−5Ac)を、腹腔内(i.p.)注射によって投与した。ORGの全ての誘導体により、FSTモデルのマウスの不動時間は減少した(表5)。
【表5】

【0066】
1.3 ORGの抗うつ活性の治療指数(TI)
急性毒性テストでは、コンメイマウスに1750mg/kgの投与量でORGを投与した場合、飽和濃度、動物行動学的および組織学的検査で、異常は発見されなかった。したがって、ORGの中毒量の中央値(TD50)は、1750mg/kgよりも高かった。
【0067】
FSTのマウスにおけるORGの治療指数(TI)=TD50÷ED50≧1750mg/kg÷0.22mg/kg≧7955。
【0068】
TSTのマウスにおけるORGの治療指数(TI)=TD50÷ED50≧1750mg/kg÷0.73mg/kg≧2397。
【0069】
[実験例2]
マウスの強制水泳テスト(FST)における時間経過依存性に関するORGの抗うつ効果
【0070】
2.1 実験方法
四川省の実験動物人民病院から入手したコンメイマウス(認証番号:A4CXK(Chuan)2003−16)を使用した。これらは、実験例開始時、3〜4週齢で、体重は25〜30gであった。各群の動物の数を表6〜表8に示す。ORGを実施例1に記載するように調製した。動物を、異なる投与量の実験例群、およびビヒクル対照群に分けた。
【0071】
2.1.1 投与および実験計画:
ORGを異なる濃度で通常の生理食塩水(NS)に溶解した。全ての薬物およびそれらのビヒクルを、0.1ml/10gの容量で経口投与した。
【0072】
2.1.2 投与回数:
動物を、ORG(3mg/kg)またはNSで、24時間以内に1〜5回処置した。最後のORG処置から5時間後、不動時間を記録した。
【0073】
2.1.3 異なる投与量および投与回数の比較:
マウスを、24時間以内で、6mg/kgのORGで1回、あるいは3mg/kgのORGで2回処置した。最後のORG処置から5時間後に不動時間を記録した。
【0074】
2.1.4 抗うつ活性に関するORGの効果(発現時間および保持時間):
マウスをORG(3mg/kg)で処置した。投与から19時間後、さらにORG(3mg/kg)の投与量を与えた。
【0075】
2回目の投与から2.5時間、5時間、24時間、72時間および2週間後に、不動時間を記録した。
【0076】
2.1.5 データ分析:
結果は平均±SEM(%)として表す。NS群の不動時間を100%と設定し、各群の抗うつ効果をNS群に基づいて計算した。パーセントの値が低いほど、より良好な抗うつ効果が示されている。このノーマライズの方法により、実験例群の間の比較が可能になった。統計分析は、一元配置ANOVA、次いでLSDテストで行った。P値<0.05で有意であるとした。
【0077】
2.2 結果
2.2.1 マウスのFSTにおける24時間以内の投与の異なる回数でのORGの抗うつ効果
ORG(3mg/kg)を24時間以内に1〜5回投与した。ORGで2回または3回処置した群において、不動時間が有意に減少した(表6)。結果は、最も良好な薬物効果は、10〜19時間の時間間隔で、24時間以内に2回または3回の投与後に得られたことを示している。
【表6】

【0078】
2.2.2 同じ最終投与量を用いた、24時間以内に異なる投与回数の中での抗うつ効果の比較
マウスを、24時間内に、6mg/kgのORGで1回、あるいは3mg/kgのORGで2回処置した場合、不動時間は全ての群で減少した(表7)。しかし、24時間内に、3mg/kgのORGで2回処置されたマウスがより良好な効果を示した。
【表7】

【0079】
2.2.3 FSTにおける迅速な発現および長期的な持続に関するORGの抗うつ効果
マウスにORGを経口的に与えた(3mg/kg)。19時間後、さらにORG(3mg/kg)の投与量を与えた。2回目の投与から2.5時間、5時間、24時間、72時間および2週間後に、不動時間を記録した。ORGの抗うつ効果は、2回目の投与から2.5時間後に迅速に現れた。最高の効果は2回目の投与から24時間後に現れ、該効果は、少なくとも72時間持続した(表8)。結果は、ORGが抗うつ効果を素早く発現し、この効果は少なくとも72時間持続することを示している。
【表8】

【0080】
[実験例3]
マウスの慢性の予測不能軽度ストレスモデルにおけるORGの抗うつ効果
慢性の予測不能軽度ストレス(CMS)は、ヒトにおいてうつ病を悪化させるまたは引き起こすのと同じ慢性ストレスの病因を持つうつ病モデルであると考えられる。飲料または食物制限、抑制および水泳のような種々の予測不能な軽度のストレスにより、動物は、報酬に対する反応(たとえば、糖飲料の好み)をなくすことがある。CMSに曝した後、FSTおよびTSTにおける不動時間は有意に増加し、これはうつ病がより重症化したことを示す。したがって、CMSは、ストレスに起因するうつ病に関して、抗うつ剤の効果を評価するために、広く使用される。
【0081】
3.1 実験方法
四川省の実験動物人民病院から入手したコンメイマウス(認証番号:A4CXK(Chuan)2003−16)を使用した。これらは、実験例開始時、3〜4週齢で、体重は25〜30gであった。各群の動物の数を表9および表10に示す。ORGを実施例1に記載するように調製した。動物を、異なる投与量の実験例群、ビヒクル対照群、および正の対照としてイミプラミン群(Sigma,バッチNo.106k1588)に分けた。
【0082】
CMSモデル:コンメイマウスに与えた慢性的な軽度ストレスは、日内リズムの逆転、連続照射、寒さ、湿った寝具、傾斜のあるケージ、食物および飲料制限、および拘束であった。これらのストレスのうち一つだけを、無作為に各マウスに24時間与え、同じストレスは、継続して2回与えなかった。ストレス期間を8週間続けた。最後の週で、ORG1日1回を7日間連続して経口投与した。行動テストを最後の投与から30分後に行った。テストしたパラメータは、CMSモデルマウスのFSTおよびTSTにおける不動時間であった。FSTおよびTSTの方法およびデータ分析は、先に記載の通りであった。
【0083】
3.2 結果
3.2.1 CMSモデルマウスのFSTにおけるORGの抗うつ効果
ORGは、FSTにおいて、不動時間を有意に減らし、その効果は投与量に有意に依存していた(表9)。抗うつ効果に関する最高投与量は20mg/kgであり、ED50は0.81mg/kgであった。
【表9】

【0084】
3.2.2 CMSモデルマウスのTSTにおけるORGの抗うつ効果
ORGは、TSTにおいて不動時間を有意に減らし、その効果は投与量に有意に依存していた(表10)。抗うつ効果に関する最高投与量は20mg/kgであり、ED50は約4.22mg/kgであった。
【表10】

【0085】
3.3 CMSモデルマウスのTSTおよびFSTにおけるORGのTI
急性毒性テストにおいて、マウスにORGを1750mg/kgの投与量で投与した場合、飽和濃度、動物行動学的および組織学的検査で、異常は発見されなかった。したがって、ORGの中毒量の中央値(TD50)は、1750mg/kgよりも高かった。
FSTのCMCマウスにおけるORGの治療指数(TI)≧1750mg/kg÷0.81mg/kg≧2160。
TSTのCMSマウスにおけるORGの治療指数(TI)=TD50÷ED50≧1750mg/kg÷4.22mg/kg≧415。
【0086】
[実験例4]
マウスの恒暗(DD)モデルにおけるORGの抗うつ効果
DDモデルは、日内リズム障害に関連するうつ病の試験のために使用されると近年報告された病原学的モデルである。このモデルでは、動物の日内リズムを、うつ病を誘発するまたは悪化させる連続した暗室飼育条件で変化させる。したがって、この試験では、DDモデルを、うつ病を起こすまたは悪化させるために使用し、次いでORGの抗うつ効果をFSTおよびTSTでテストした。
【0087】
4.1 実験方法
四川省の実験動物人民病院から入手したコンメイマウス(認証番号:A4CXK(Chuan)2003−16)を使用した。これらは、実験例開始時、3〜4週齢で、体重は25〜30gであった。各群の動物の数を表11および表12に示す。ORGを実施例1に記載するように調製した。動物を、異なる投与量の実験例群、ビヒクル対照群、および正の対照としてイミプラミン群(Sigma,バッチNo.106k1588)に分けた。
【0088】
マウスのDDモデル:マウスを24時間連続的に暗い条件下に置いた。パッドの交換、食物および水の追加、および他の操作は、輝度が1.0ルクス未満の赤色灯の条件下で行った。この条件の期間を、28日間継続した。最終の週で、ORGを1日1回1週間経口投与した。FSTおよびTSTを最後の投与から30分後に行った。方法およびデータ分析は先に記載した通りであった。
【0089】
4.2 結果
4.2.1 DDモデルマウスのFSTにおけるORGの抗うつ効果
ORGは、FSTにおいて不動時間を有意に減らし、その効果は投与量に有意に依存していた(表11)。最高効力の投与量は10mg/kgであり、ED50は約1.48mg/kgであった。
【表11】

【0090】
4.2.2 DDモデルマウスのTSTにおけるORGの抗うつ効果
ORGは、TSTにおいて不動時間を有意に減らし、その効果は投与量に有意に依存していた(表12)。最高効力の投与量は20mg/kgであり、ED50は約1.75mg/kgであった。
【表12】

【0091】
[実験例5]
マウスの睡眠遮断(SD)モデルにおけるORGの抗うつ効果
睡眠障害は、うつ病の症状の一つである。うつ病を発症するまたは悪化させる病理学的要因の一つであるかもしれない。不動状態のようなうつ病様行動は、睡眠遮断によって亢進される。そこで、SDモデルをうつ病を起こすまたは悪化させるために使用し、次いでORGの抗うつ効果を、SDモデルマウスのFSTおよびTSTにおいてテストした。
【0092】
5.1 実験方法
四川省の実験動物人民病院から入手したコンメイマウス(認証番号:A4CXK(Chuan)2003−16)を使用した。これらは、実験例開始時、3〜4週齢で、体重は25〜30gであった。各群の動物の数を表13に示す。ORGを実施例1に記載するように調製した。動物を、異なる投与量の実験例群、ビヒクル対照群、および正の対照としてイミプラミン群(Sigma,バッチNo.106k1588)に分けた。
【0093】
SDモデル:マウスのSDモデルを確立するために、水環境中の複数の台を用いる修正法を使用した。台上のマウスは、飲食は自由であった。しかし眠ってしまうと、筋緊張を失うため、水中に落ちた。落ちた動物は、台を支えている傾斜した柱を介して、台に再び這い上がった。72時間の睡眠遮断の後、ORGを、FSTを開始する24時間および5時間前に経口投与した。動物の不動時間を記録した。方法およびデータ分析は、先に記載した通りであった。
【0094】
5.2 結果
5.2.1 SDモデルマウスのFSTにおけるORGの抗うつ効果
3日間の睡眠遮断の第3日目、ORGを、FSTを開始する24時間および5時間前の2回投与した。ORGは、FSTにおいて不動時間を有意に減らし、その効果は投与量に有意に依存していた(表13)。最高効力の投与量は10mg/kgであり、ED50は約3.79mg/kgであった。
【表13】

【0095】
5.3 DDモデルおよびSDモデルマウスにおけるORGの治療指数
ORGの中毒量の中央値(TD50)は1750mg/kgよりも高かった(前を参照)。FSTのDDマウスにおけるORGの治療指数=TD50÷ED50≧1750mg/kg÷1.48mg/kg≧1182。TSTのDDマウスにおけるORGの治療指数=TD50÷ED50≧1750mg/kg÷1.75mg/kg≧1000。FSTのSDマウスにおけるORGの治療指数=TD50÷ED50≧1750mg/kg÷3.79mg/kg≧462。
【0096】
[実験例6]
ORGの抗不安効果の薬理試験
げっ歯類におけるフットショックおよび調整された恐怖ストレスにより誘発されたすくみ挙動は、不安のレベルを評価するためのモデルとして広く認められている。げっ歯類は、嫌悪刺激が与えられると、すくみ挙動を示す。避けられない恐怖刺激に対する動物の正常な応答であるすくみは、身体運動の完全な欠如またはしゃがんだ姿勢の維持と規定される。抗不安剤は動物のすくみ挙動を減らす。さらに、高架式十字迷路は、げっ歯類における不安の評価のための、広く認められているモデルである。該不安の査定は、げっ歯類は、恐ろしければ、自発的に高架式十字迷路のクローズドアームにより多くの時間を費やすように、新規探査への動向と高さの恐怖との間の葛藤に基づく。したがって、新規探査行動は、抗不安剤によって強化され、不安惹起剤によって抑制される。
【0097】
6.1 実験方法
四川省の実験動物人民病院から入手したコンメイマウス(認証番号:A4CXK(Chuan)2003−16)を使用した。これらは、実験例開始時、3〜4週齢で、体重は25〜30gであった。各群の動物の数を表13に示す。ORGを実施例1に記載するように調製した。動物を、異なる投与量のORGを与えた薬物投与群、ビヒクル対照群、および正の対照としてジアゼパム群(Jinyao社,バッチNo.106k1588)に分けた。
【0098】
フットショック誘発すくみ挙動:10分間のトレーニングセッションのために標準のコンディショニングチャンバ(Med Associates,USA)に置く24時間および5時間前に、動物にORGまたはビヒクルの腹腔内注射を与えた。セッション開始から2、4、6、8および10分後、フットショック(0.8mA、2秒)をチャンバのグリッド床を通して送った。最後の5分間のすくみ時間を記録した。最初のトレーニングから24時間後、ラットをフットショックのないチャンバに再び置き、すくみ時間を記録した。
【0099】
高架式十字迷路(EPM):EPMは、等しい寸法(長さ30cm×幅5cm)の2個のオープンアームおよび2個のクローズドアームを備えていた。2個のクローズドアームを、5cm×5cmの中央領域によって接続した。全迷路を35cmの高さに上げた。テストを始める24時間および5時間前に、ORGを腹腔内投与した。マウスを、クローズドアームに面する迷路の中央に個々に置いた。それぞれの動物を、5分間の単一セッションでテストした。オープンアームに入る数、クローズドアームに入る数、オープンアームに居る合計時間、およびクローズドアームに居る合計時間を記録し、全ての肢がアームに入ることを入場する基準として定義した。オープンアームへの入場の数およびオープンアームに居た時間は、動物の不安レベルを評価する主要な指標であり、より入場の回数が多いほど、あるいは時間が長いほど、不安レベルは小さい。
【0100】
データ分析:テストの結果は、平均±SEMとして表す。一方向ANOVA、次いでSPSS11ソフトウェアを使用するLSDテストを使用した。有意レベルは、P<0.05に設定した。
【0101】
6.2 結果
6.2.1 ラットのフットショック誘発すくみ挙動試験におけるORGの抗不安効果
【0102】
テストを開始する24時間および5時間前にORGを腹腔内投与した場合、ラットのすくみ時間は、有意に減少した(表14)。
【表14】

【0103】
6.2.2 ラットの調整された恐怖ストレス誘発すくみ挙動試験におけるORGの抗不安効果
フットショックを受ける24時間および5時間前に2回、ラットにORGを腹腔内投与し、24時間後、フットショックを与えずに、同じ環境に再び曝した。環境要因により誘発される恐れの記憶の回復により、ラットはすくみ挙動を誘発する調整された恐怖ストレスを起こす。ORGは、すくみ挙動を著しく減らした(表15)。
【表15】

【0104】
6.2.3 マウスの高架式十字迷路試験におけるORGの抗不安効果
高架式十字迷路テストの24時間および5時間前に2回投与されたORGにより、オープンアームへの入場の回数およびオープンアームに居た合計時間は有意に増加した(表16および表17)。この結果は、ORGの有意な抗不安効果を示していた。
【表16】

【表17】

【0105】
[実験例7]
ORGの抗ストレス効果の薬理試験
ストレスは、生物系において、生物の生理的または心理的な恒常性維持を深刻にかく乱する任意の状態として定義される。ストレスは、多くの病気を悪化させるあるいは至らせる主要な要因の一つであると考えられている。海馬は、学習および記憶、ならびにストレス応答の調節において重要な脳の構造である。ストレスにより、海馬シナプス可塑性、学習および記憶の機能低下に至るかもしれない。血清コルチコステロンの濃度は、ストレスレベルを評価するための、最も一般的な指標の一つである。
【0106】
7.1 実験方法
四川省の実験動物人民病院から入手した250〜300gの重さのラットを使用した。ORGを実施例1に記載するように調製した。フルオキセチンは、Wuhan Yuancheng Technology社(Wuhan,China、バッチNo:1004−0801002)からのものであった。
【0107】
血清コルチコステロンの測定:放射性免疫測定法(RIA、DSL80100、Texas)を使用して、血清コルチコステロンの濃度におけるORGの効果を測定した。非ストレス群で、ORG注射の1時間後に、エーテル麻酔下心穿刺によって血液を採取した。ストレス群では、ORG注射の1時間後、ラットに高架式台ストレスを30分与え、次いで同じ方法でサンプルを採取した。血液サンプルを、室温で4時間維持し、次いで15分間(3000rpm)遠心した。上澄み(血清)を採取し、−20℃で保存した。
【0108】
海馬における長期強化(LTP)記憶の方法:海馬の興奮性シナプス後電位(EPSP)を記録し、ORGの抗ストレス効果を測定した。ストレスは海馬のCA1領域のLTPを損ない、これは、抗ストレス薬によって減らすことができる。ラットは、フットショックによって以下のように、すなわち、2分間の間隔で、1mA、2秒のストレスを5回受けた。海馬切片を調製し、34〜36℃で1時間、インキュベートし、次いで室温に保った。ORGを浴溶液中で与えた。CA1領域におけるNMDAおよびAMPA受容体により媒介されたEPSPを、べースラインが20分間安定になるまで記録した。次いで、高周波刺激(HFS、100Hz、100パルス、20秒の間隔)を使用してLTPを誘発した。EPSPをHFS後1時間記録した。
【0109】
データ分析:データは平均±SEMとして表し、LTPはベースラインに対する最後の10分間の平均振幅のパーセントとして表した。一方向ANOVA、次いでSPSS11ソフトウェアを使用するLSDテストを使用した。有意レベルはP<0.05に設定した。
【0110】
7.2 結果
7.2.1 血清コルチコステロンレベルの急性ストレス誘発上昇におけるORG(腹腔内注射)の抗ストレス効果。
血液を、対照では、ORGの腹腔内注射から1時間後に、あるいはストレスを受けてから30分後に心穿刺により採取した。ORGにより、血清コルチコステロンの濃度は、投与量依存性方式で有意に増加した(表18)。
【表18】

【0111】
7.2.2 ストレスで損なわれた海馬LTPにおけるORGの回復効果
海馬切片をフットショックストレスに曝した後のラットから調製した。これは、海馬LTPを損なう一般的に認められたプロトコルである。ORGで1時間インキュベートした切片において、ベースラインEPSPを20分間記録した。ORGは、ストレスで損なわれたLTPを回復し、5μM/Lの投与量で、LTPを有意に増加さえし、投与量依存性効果を示した(表19)。
【0112】
前記結果は、ORGが有意な抗ストレス効果を有し、ストレスが原因のうつ病の治療において重要な臨床価値を有することを示す。
【表19】

【0113】
[実験例8]
ORGの薬理試験および学習および記憶の強化
モリス水迷路(MWM)は、海馬依存性学習および記憶、ならびにその細胞および分子メカニズムの試験に広く使用されている。MWMは、学習および記憶の薬理学的評価の効果的な方法であると一般的に認められている。動物の逃避潜伏期間、戦略および軌跡を、自動的に追跡および分析し、動物の空間的な学習および記憶を調べる。動物がどのようにして逃避するかを学んだ後、隠された台を取り除き、標的の四分の一の区での滞在をテストする。正しい四分の一の区に滞在する時間が長いほど、記憶が良いことを示す。
【0114】
8.1 実験方法
四川省の実験動物人民病院から入手したコンメイマウス(認証番号:A4CXK(Chuan)2003−16)を使用した。これらは、実験例開始時、3〜4週齢で、体重は25〜30gであった。各群の動物の数を表20および表21に示す。ORGを実施例1に記載するように調製した。動物を、フルオキセチンまたは異なる投与量のORGを与えた薬物投与群およびビヒクル対照群に分けた。薬物投与群には、1.75mg/kgまたは3.5mg/kgのORG、あるいは15mg/kgのフルオキセチンを与えた。動物には、薬物またはビヒクルの単独腹腔内注射を、毎日訓練の30分後に、あるいは第8日目の滞在テストの30分前に、のどちらかで与えた。
【0115】
モーリス水迷路:MWMは、水面から約1cm下にある隠れた台(10cm×10cm)の付いた円形プール(直径100cmおよび深さ36cm)で行った。プールを、各四分の一の区に吊るした、異なる形のマーカーをつけた黄色のカーテンで囲んだ。隠れた台を見つけるまでにかかった時間およびマウスの軌跡をコンピュータで記録した。1日〜7日まで、マウスはプールに置かれ、固定された隠れた台を見つけた。第8日目、台を取り除き、マウスが標的四分の一の区に滞在する時間を、自由遊泳の1分も含めてカウントした。
【0116】
データ分析:テストのテスト結果は、平均±SEMとして表す。一方向ANOVA、次いでSPSS11ソフトウェアを使用するLSDテストを使用した。有意なレベルをP<0.05に設定した。
【0117】
8.2 結果
8.2.1 MWMテストにおける訓練直後のORG(腹腔内注射)の効果
ORGを毎日訓練後に与えた場合、空間的な記憶の回復(動物が標的四分の一の区に滞在した時間)は、記憶固定に影響することによって、有意に強化された(表20)。
【表20】

【0118】
8.2.2 MWMテストにおける回復前のORG(腹腔内注射)の効果
訓練は7日後に終了した。第8日目に回復テストを行った。回復の30分前にORGを投与した場合、空間的記憶回復は有意に強化された(表21)。
【表21】

【0119】
[実験例9]
ORGの毒性テスト
9.1 マウスにおけるORGの急性毒性テスト
9.1.1 実験方法
四川省の実験動物人民病院から入手したコンメイマウス(認証番号:A4CXK(Chuan)2003−16)を使用した。これらは、実験例開始時、3〜4週齢で、体重は25〜30gであった。ORGを実施例1に記載するように調製した。ORG(1750mg)を10mlのNSに溶解し、濃度を175mg/mlとした。マウスを2つの群に分け、評価用としてORG群にはORGを与え、もう一つの群はビヒクル対照としてNSで処置した。ORGおよびNSをそれぞれの群に、0.1ml/10gの容積で経口投与した。
【0120】
9.1.2 結果
急性毒性テストにおいて、ORGを1750mg/kgでマウスに投与し、動物の外観、行動、精神的状態、食欲、毛、色、および呼吸を14日間観察したが、異常は発見されなかった。全てのマウスが該実験で生き残り、体重増加も正常であった。2つの群の間で有意な違いはなかった。全てのマウスを14日目に屠殺し、心臓、肝臓、脾臓、肺、腎臓、膵臓、卵巣、精巣、小腸および他の内臓を病理学切片により調べた。ここでも、異常な証拠はなかった。
【0121】
9.2 ラットにおけるORGの亜急性毒性
9.2.1 実験方法
四川省の実験動物人民病院から入手したラット(認証番号:A4CXK(Chuan)2003−16)を使用した。これらの体重は250〜300gであった。ORGを実施例1に記載するように調製した。
【0122】
9.2.2 結果
マウスFSTにおいて7955倍のED50、マウスTSTにおいて2397倍のED50であるORG(1750mg/kg)を、14日間連続して、1日1回経口投与した。動物の外観、行動、精神的状態、食欲、毛、色、および呼吸を14日間観察したが、異常は発見されなかった。全てのラットが該実験で生き残り、体重増加も正常であった。2つの群の間で有意な違いはなかった。全てのマウスを14日目に屠殺し、心臓、肝臓、脾臓、肺、腎臓、膵臓、卵巣、精巣、小腸および他の内臓を病理学切片により調べた。組織切片の画像は、異常な証拠を示さなかった。
5−メチル−1,3−ベンゼンジオールおよびその誘導体の薬理学的な概要
【0123】
ORGおよびその誘導体の抗うつ効果の投与量−効果および時間経過−応答を、FST、TST、DD、SDおよびCMSモデルを使用して試験した。結果は、OR、ORGおよびその誘導体は、うつ病およびうつ病を示唆する症状、すなわち、日内リズム障害、睡眠障害および慢性ストレスの治療および予防に有用な活性を示すことを表している。抗うつ剤メカニズムの実験により、OR、ORGおよびその誘導体は、海馬LTPの機能障害を改善し、海馬依存性学習および記憶を強化し、不安および急性ストレスのようなうつ病が関連する要因を治療し、予防することが示された。海馬LTPのメカニズムは、主に、NMDAおよびAMPA受容体、ならびにこれらの分子および細胞経路に関連する。要するに、OR、ORGおよびその誘導体は、調節剤として、これらの標的を調節し、海馬LTPの回復によってうつ病を治療および予防する効果を生み出す。
【0124】
主に化学シナプスおよび記憶を介する多くのニューロンによる伝達は、それらのシナプス内に記憶されると考えられるので、LTPは、学習および記憶の基本の主要細胞メカニズムの一つと考えられる。したがって、OR、ORGおよびその誘導体は、アルツハイマー病、小児期ADHD、喘息および統合失調症のような他の障害の治療および予防にも適用することができる。全ての疾患の90%超の疾患が、ストレスによって誘発されあるいは悪化されうるので、ストレス調節の海馬機能は、シナプス可塑性に関与し、OR、ORGおよびその誘導体は、服用中止期間の間、極度のストレスを感じる薬物中毒者、および過度のストレスまたは不安を受ける癌または心臓血管関連の病気の患者のような、臨床において多くの疾患の治療、予防およびリハビリテーションに有益である。
【0125】
毒性における先の実験例の結果と組合わせると、OR、ORGおよびその誘導体は、高い性能および低毒性の特徴によって、うつ病およびうつ病の病原学的原因の治療および予防において新しい応用がある。OR、ORGおよびその誘導体の他の用途は、急性ストレスおよび不安のようなうつ病を示唆する症状の治療および予防における適用である。OR、ORGおよびその誘導体の抗うつ効果に関与するメカニズムは、血清コルチコステロイド、NMDAおよびAMPA受容体、およびそれらの細胞内シグナル伝達を含む海馬シナプス可塑性、ならびに学習および記憶の調節である。
【0126】
したがって、OR、ORGおよびその誘導体に関する本発明の治療的用途および有益な効果は、以下の通りである。(1)うつ病に対する治療効果、(2)うつ病の原因に対する治療効果、(3)うつ病または類似の症状のある他の疾患に対する治療効果、(4)それらの潜在的用途は、いかなる方法でも、うつ病を治療および予防する方法に限定すると解釈するつもりはなく、またそのように解釈すべきではなく、ストレス、不安および認知機能低下に関与する他の疾患にも有用であろう。
【特許請求の範囲】
【請求項1】
式Iで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬品または機能性食品の製剤中に5−メチル−1,3−ベンゼンジオールまたはその誘導体を含有する医薬製剤を、医薬的に許容しうる賦形剤または許容しうる栄養補助食品中でうつ病を治療または予防するための使用。
【化1】

式I
(式中、
R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルであり、
R2は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項2】
式IIで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬品または機能性食品の製剤中に5−メチル−1,3−ベンゼンジオールまたはその誘導体を含有する医薬製剤を、医薬的に許容しうる賦形剤または許容しうる栄養補助食品中でうつ病を治療または予防するための使用。
【化2】

式II
(式中、R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項3】
R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、またはアラビノシルである請求項2に記載の式IIで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体。
【請求項4】
R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシルである請求項3に記載される式IIで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体。
【請求項5】
式IIIで表される5−メチル−1,3−ベンゼンジオール誘導体、あるいは医薬品または機能性食品の製剤中にそれらを含有する医薬製剤を、医薬的に許容しうる賦形剤または許容しうる栄養補助食品中でうつ病を治療または予防するための使用。
【化3】

式III
(式中、R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項6】
R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、またはアラビノシルである、請求項5に記載の式IIIで表される5−メチル−1,3−ベンゼンジオール誘導体。
【請求項7】
R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、またはラムノピラノシルである、請求項6に記載の誘導体。
【請求項8】
式IVで表される5−メチル−1,3−ベンゼンジオール誘導体、あるいは医薬品または機能性食品の製剤中にそれらを含有する医薬製剤を、医薬的に許容しうる賦形剤または許容しうる栄養補助食品中でうつ病を治療または予防するための使用。
【化4】

式IV
(式中、R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項9】
R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、またはスクシニルである、請求項8に記載の使用。
【請求項10】
R2は、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、またはアセチル:1,3−O−ジアセチルオルシノール、または3−O−アセチル−オルシノール−1−O−(2,3,4,6−テトラアセチル)−β−D−グルコピラノシドである、請求項8に記載の使用。
【請求項11】
日内リズム障害、睡眠障害、慢性ストレス、不安、急性ストレス誘発障害、または認知機能障害を始めとするうつ病を示唆する症状の治療のための医薬的に許容しうる賦形剤または食事療法的に許容しうる栄養補助食品中に、式Iで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体または5−メチル−1,3−ベンゼンジオールまたはその誘導体を含有する医薬製剤であって、12時間明所および12時間暗所に関連する脳機能の基礎的基盤の一つが、日内リズムであり、その障害は、脳機能の一連の悪化を起こすことが知られ、睡眠障害として、(1)睡眠異常、不眠症、過眠症、ナルコレプシー、呼吸関連睡眠障害、および日内リズム関連睡眠障害、(2)悪夢、睡眠パニック、および夢遊症のような睡眠時随伴症、(3)物質(たとえば、習慣性薬物)または療法(たとえば、外科手術、放射線療法、または化学療法)に起因する健康関連睡眠障害および睡眠障害が挙げられ、不安障害として、2つの大きな分野が挙げられ、(1)パニック障害、たとえば、広所恐怖症、特定のパニック障害(たとえば、特定の動物、環境および輸血に反応するパニック、社会恐怖、および強迫性障害)、外傷後ストレス障害、急性ストレス障害、および一般的な不安障害、(2)健康関連不安障害および物質誘発障害(たとえば、習慣性薬物)または療法(たとえば、外科手術、放射線療法、または化学療法)であり、ストレスは、環境因子、ある習慣性物質の摂取、あるいは、たとえば、外科手術のような療法を受けることに起因する現象に対する肉体的、心理的または情動的応答であり、ストレスは、海馬シナプス可塑性の減少および学習および記憶損傷のような、対応する「急性ストレス誘発障害」を引き起こす可能性があり、認知機能低下または障害は、記憶、思考、意志決定、注意力、および気分のような高次脳機能の低下を言う、請求項1から請求項10のいずれか一項に記載の使用。
【請求項12】
用語「うつ病」として、以下のサブタイプ、
(1)うつ病、躁うつ病、混合性うつ病、および躁病、あるいは軽躁病のようなうつ病および気分障害、または(2)うつ病性障害および気分変調症のようなうつ病性障害、または(3)物質(たとえば、習慣性薬物)または療法(たとえば、外科手術、放射線療法、または化学療法)に起因するうつ病性障害および感情障害の特徴を示す精神疾患または異なるサブタイプの障害に起因する感情障害のような他の感情障害、または(4)うつ病および軽躁病の2種以上のエピソード、および躁病およびうつ病の交代性エピソードを含む双極性障害または双極性感情障害を含む、請求項1から請求項10のいずれか一項に記載の使用。
【請求項13】
うつ病の症状またはうつ病を示唆する症状は、日内リズム障害、睡眠障害、慢性ストレス、不安、急性ストレス誘発障害、または認知機能障害を言う、請求項1から請求項10のいずれか一項に記載の使用。
【請求項14】
機能性食品として、5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは5−メチル−1,3−ベンゼンジオールまたはその誘導体を含有する医薬製剤が、前記うつ病の症状またはうつ病を示唆する症状を治療および予防するために使用される日常の食品、飲料または飲み物を含む、請求項1から請求項10のいずれか一項に記載の使用。
【請求項15】
抗うつ剤は、式Iで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬的に許容しうる担体または賦形剤中に活性成分(5−メチル−1,3−ベンゼンジオールまたはその誘導体)を含有する医薬組成物。
【化5】

式I
(式中、R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルであり、R2は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項16】
抗うつ剤は、式IIで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬的に許容しうる担体または賦形剤中に活性成分(5−メチル−1,3−ベンゼンジオールまたはその誘導体)を含有する医薬組成物。
【化6】

式II
(式中、R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項17】
R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、またはアラビノシルである、請求項16に記載の医薬組成物。
【請求項18】
R1は、水素、β−D−グルコピラノシルまたはβ−D−グルコピラノシル−(1→6)−β−D−グルコピラノシルである、請求項17に記載の医薬組成物。
【請求項19】
抗うつ剤は、式IIIで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬的に許容しうる担体または賦形剤中に活性成分(5−メチル−1,3−ベンゼンジオールまたはその誘導体)を含有する医薬組成物。
【化7】

式III
(式中、R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項20】
R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、またはアラビノシルである請求項19に記載の医薬組成物。
【請求項21】
R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、またはラムノピラノシルである、請求項20に記載の医薬組成物。
【請求項22】
抗うつ剤は、式IVで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬的に許容しうる担体または賦形剤中に活性成分(5−メチル−1,3−ベンゼンジオールまたはその誘導体)を含有する医薬組成物。
【化8】

式IV
(式中、R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項23】
R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、またはスクシニルである、請求項22に記載の医薬組成物。
【請求項24】
R2は、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、またはアセチル:1,3−O−ジアセチルオルシノール、または3−O−アセチル−オルシノール−1−O−(2,3,4,6−テトラアセチル)−β−D−グルコピラノシドである、請求項23に記載の医薬組成物。
【請求項25】
うつ病を治療または予防するための活性成分(5−メチル−1,3−ベンゼンジオールまたは誘導体)の有効投与量は、0.1mg/成人/日と12g/成人/日の間であり、最適投与量は、50〜200mg/成人/日である、請求項15〜24のいずれか一項に記載の医薬組成物。
【請求項26】
うつ病を治療または予防するための、活性成分(5−メチル−1,3−ベンゼンジオールまたは誘導体)の前記有効投与量は、50〜200mg/成人/日である、請求項25に記載の医薬組成物。
【請求項1】
式Iで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬品または機能性食品の製剤中に5−メチル−1,3−ベンゼンジオールまたはその誘導体を含有する医薬製剤を、医薬的に許容しうる賦形剤または許容しうる栄養補助食品中でうつ病を治療または予防するための使用。
【化1】

式I
(式中、
R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルであり、
R2は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項2】
式IIで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬品または機能性食品の製剤中に5−メチル−1,3−ベンゼンジオールまたはその誘導体を含有する医薬製剤を、医薬的に許容しうる賦形剤または許容しうる栄養補助食品中でうつ病を治療または予防するための使用。
【化2】

式II
(式中、R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項3】
R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、またはアラビノシルである請求項2に記載の式IIで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体。
【請求項4】
R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシルである請求項3に記載される式IIで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体。
【請求項5】
式IIIで表される5−メチル−1,3−ベンゼンジオール誘導体、あるいは医薬品または機能性食品の製剤中にそれらを含有する医薬製剤を、医薬的に許容しうる賦形剤または許容しうる栄養補助食品中でうつ病を治療または予防するための使用。
【化3】

式III
(式中、R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項6】
R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、またはアラビノシルである、請求項5に記載の式IIIで表される5−メチル−1,3−ベンゼンジオール誘導体。
【請求項7】
R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、またはラムノピラノシルである、請求項6に記載の誘導体。
【請求項8】
式IVで表される5−メチル−1,3−ベンゼンジオール誘導体、あるいは医薬品または機能性食品の製剤中にそれらを含有する医薬製剤を、医薬的に許容しうる賦形剤または許容しうる栄養補助食品中でうつ病を治療または予防するための使用。
【化4】

式IV
(式中、R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項9】
R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、またはスクシニルである、請求項8に記載の使用。
【請求項10】
R2は、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、またはアセチル:1,3−O−ジアセチルオルシノール、または3−O−アセチル−オルシノール−1−O−(2,3,4,6−テトラアセチル)−β−D−グルコピラノシドである、請求項8に記載の使用。
【請求項11】
日内リズム障害、睡眠障害、慢性ストレス、不安、急性ストレス誘発障害、または認知機能障害を始めとするうつ病を示唆する症状の治療のための医薬的に許容しうる賦形剤または食事療法的に許容しうる栄養補助食品中に、式Iで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体または5−メチル−1,3−ベンゼンジオールまたはその誘導体を含有する医薬製剤であって、12時間明所および12時間暗所に関連する脳機能の基礎的基盤の一つが、日内リズムであり、その障害は、脳機能の一連の悪化を起こすことが知られ、睡眠障害として、(1)睡眠異常、不眠症、過眠症、ナルコレプシー、呼吸関連睡眠障害、および日内リズム関連睡眠障害、(2)悪夢、睡眠パニック、および夢遊症のような睡眠時随伴症、(3)物質(たとえば、習慣性薬物)または療法(たとえば、外科手術、放射線療法、または化学療法)に起因する健康関連睡眠障害および睡眠障害が挙げられ、不安障害として、2つの大きな分野が挙げられ、(1)パニック障害、たとえば、広所恐怖症、特定のパニック障害(たとえば、特定の動物、環境および輸血に反応するパニック、社会恐怖、および強迫性障害)、外傷後ストレス障害、急性ストレス障害、および一般的な不安障害、(2)健康関連不安障害および物質誘発障害(たとえば、習慣性薬物)または療法(たとえば、外科手術、放射線療法、または化学療法)であり、ストレスは、環境因子、ある習慣性物質の摂取、あるいは、たとえば、外科手術のような療法を受けることに起因する現象に対する肉体的、心理的または情動的応答であり、ストレスは、海馬シナプス可塑性の減少および学習および記憶損傷のような、対応する「急性ストレス誘発障害」を引き起こす可能性があり、認知機能低下または障害は、記憶、思考、意志決定、注意力、および気分のような高次脳機能の低下を言う、請求項1から請求項10のいずれか一項に記載の使用。
【請求項12】
用語「うつ病」として、以下のサブタイプ、
(1)うつ病、躁うつ病、混合性うつ病、および躁病、あるいは軽躁病のようなうつ病および気分障害、または(2)うつ病性障害および気分変調症のようなうつ病性障害、または(3)物質(たとえば、習慣性薬物)または療法(たとえば、外科手術、放射線療法、または化学療法)に起因するうつ病性障害および感情障害の特徴を示す精神疾患または異なるサブタイプの障害に起因する感情障害のような他の感情障害、または(4)うつ病および軽躁病の2種以上のエピソード、および躁病およびうつ病の交代性エピソードを含む双極性障害または双極性感情障害を含む、請求項1から請求項10のいずれか一項に記載の使用。
【請求項13】
うつ病の症状またはうつ病を示唆する症状は、日内リズム障害、睡眠障害、慢性ストレス、不安、急性ストレス誘発障害、または認知機能障害を言う、請求項1から請求項10のいずれか一項に記載の使用。
【請求項14】
機能性食品として、5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは5−メチル−1,3−ベンゼンジオールまたはその誘導体を含有する医薬製剤が、前記うつ病の症状またはうつ病を示唆する症状を治療および予防するために使用される日常の食品、飲料または飲み物を含む、請求項1から請求項10のいずれか一項に記載の使用。
【請求項15】
抗うつ剤は、式Iで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬的に許容しうる担体または賦形剤中に活性成分(5−メチル−1,3−ベンゼンジオールまたはその誘導体)を含有する医薬組成物。
【化5】

式I
(式中、R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルであり、R2は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項16】
抗うつ剤は、式IIで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬的に許容しうる担体または賦形剤中に活性成分(5−メチル−1,3−ベンゼンジオールまたはその誘導体)を含有する医薬組成物。
【化6】

式II
(式中、R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項17】
R1は、水素、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、またはアラビノシルである、請求項16に記載の医薬組成物。
【請求項18】
R1は、水素、β−D−グルコピラノシルまたはβ−D−グルコピラノシル−(1→6)−β−D−グルコピラノシルである、請求項17に記載の医薬組成物。
【請求項19】
抗うつ剤は、式IIIで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬的に許容しうる担体または賦形剤中に活性成分(5−メチル−1,3−ベンゼンジオールまたはその誘導体)を含有する医薬組成物。
【化7】

式III
(式中、R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項20】
R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、またはアラビノシルである請求項19に記載の医薬組成物。
【請求項21】
R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、またはラムノピラノシルである、請求項20に記載の医薬組成物。
【請求項22】
抗うつ剤は、式IVで表される5−メチル−1,3−ベンゼンジオールまたはその誘導体、あるいは医薬的に許容しうる担体または賦形剤中に活性成分(5−メチル−1,3−ベンゼンジオールまたはその誘導体)を含有する医薬組成物。
【化8】

式IV
(式中、R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、スクシニル、メチル、エチル、プロピル、ブチル、またはベンジルである。)
【請求項23】
R2は、β−D−グルコピラノシル、β−D−グルコピラノシル−(1→6)−β−D−グルコピラノシル、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、マンノシル、アロシル、ガラクトシル、ラムノピラノシル、フコシル、キシロシル、アラビノシル、アセチル、プロピオニル、ベンゾイル、シンナモイル、またはスクシニルである、請求項22に記載の医薬組成物。
【請求項24】
R2は、2,3,4,6−テトラ−O−アセチル−β−D−グルコピラノシル、またはアセチル:1,3−O−ジアセチルオルシノール、または3−O−アセチル−オルシノール−1−O−(2,3,4,6−テトラアセチル)−β−D−グルコピラノシドである、請求項23に記載の医薬組成物。
【請求項25】
うつ病を治療または予防するための活性成分(5−メチル−1,3−ベンゼンジオールまたは誘導体)の有効投与量は、0.1mg/成人/日と12g/成人/日の間であり、最適投与量は、50〜200mg/成人/日である、請求項15〜24のいずれか一項に記載の医薬組成物。
【請求項26】
うつ病を治療または予防するための、活性成分(5−メチル−1,3−ベンゼンジオールまたは誘導体)の前記有効投与量は、50〜200mg/成人/日である、請求項25に記載の医薬組成物。
【公表番号】特表2010−535160(P2010−535160A)
【公表日】平成22年11月18日(2010.11.18)
【国際特許分類】
【出願番号】特願2010−518484(P2010−518484)
【出願日】平成20年7月25日(2008.7.25)
【国際出願番号】PCT/CN2008/071752
【国際公開番号】WO2009/018747
【国際公開日】平成21年2月12日(2009.2.12)
【出願人】(510029841)中国科学院昆明▲植▼物研究所 (1)
【出願人】(510030331)中国科学院昆明▲動▼物研究所 (1)
【出願人】(510030320)昆明晶▲ひょう▼生物科技有限公司 (1)
【Fターム(参考)】
【公表日】平成22年11月18日(2010.11.18)
【国際特許分類】
【出願日】平成20年7月25日(2008.7.25)
【国際出願番号】PCT/CN2008/071752
【国際公開番号】WO2009/018747
【国際公開日】平成21年2月12日(2009.2.12)
【出願人】(510029841)中国科学院昆明▲植▼物研究所 (1)
【出願人】(510030331)中国科学院昆明▲動▼物研究所 (1)
【出願人】(510030320)昆明晶▲ひょう▼生物科技有限公司 (1)
【Fターム(参考)】
[ Back to top ]

