がんの治療のためのアマトキシンと複合体形成した標的結合部分
本発明は、腫瘍療法に関する。一態様では、本発明は、がんの治療において有用な標的結合部分及び毒素の複合体に関する。特に、毒素はアマトキシンであり、標的結合部分(例えば抗体)は腫瘍関連抗原、例えば上皮細胞接着分子(EpCAM)に指向性を有する。さらなる一態様では、本発明は、かかる標的結合部分毒素複合体を含む医薬組成物に、及びかかる医薬組成物の調製のためのかかる標的結合部分毒素複合体の使用に関する。本発明の標的結合部分毒素複合体及び医薬組成物は、がん、特に腺癌、例えば膵臓がん、胆管癌、乳がん及び結腸直腸がんの治療に有用である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、腫瘍療法に関する。一態様では、本発明は、がんの治療において有用な標的結合部分及び毒素の複合体に関する。特に、毒素はアマトキシンであり、標的結合部分(例えば抗体)は腫瘍関連抗原、例えば上皮細胞接着分子(EpCAM)に指向性を有する。さらなる一態様では、本発明は、かかる標的結合部分毒素複合体を含む医薬組成物に、及びかかる医薬組成物の調製のためのかかる標的結合部分毒素複合体の使用に関する。本発明の標的結合部分毒素複合体及び医薬組成物は、がん、特に腺癌、例えば膵臓がん、胆管癌、乳がん及び結腸直腸がんの治療に有用である。
【背景技術】
【0002】
アマトキシン
アマトキシンは、8個のアミノ酸から構成される環状ペプチドである。アマトキシンは、タマゴテングダケ(Amanita phalloides)というキノコから単離することができ、又は合成により基本単位から調製することができる。アマトキシンは、哺乳動物細胞のDNA依存性RNAポリメラーゼIIを特異的に阻害し、それにより影響を受けた細胞の転写及びタンパク質生合成も特異的に阻害する。細胞における転写の阻害により、成長及び増殖の停止が引き起こされる。共有結合してはいないが、アマニチンとRNAポリメラーゼIIとの間の複合体は非常に堅固である(KD=3nM)。この酵素からのアマニチンの解離は、影響を受けた細胞の回復を起こりにくくする非常にゆっくりとしたプロセスである。転写の阻害があまりにも長く続くと、細胞はプログラム細胞死(アポトーシス)を被る。
【0003】
上皮細胞接着分子
上皮細胞接着分子(EpCAM、CD326)は、最も良く研究されているヒト腫瘍上の標的抗原の1つである(非特許文献1、非特許文献2)。上皮細胞接着分子は、見かけの分子量40kDa、アミノ酸数314のI型膜糖タンパク質である(非特許文献3)。上皮細胞接着分子は大部分の腺癌において過剰発現する(非特許文献4、非特許文献5)。特に、EpCAMの発現は、リンパ節陽性乳がん、上皮性卵巣がん、胆管癌、膵臓腺癌及び扁平上皮細胞頭頚部がんにおいて増強される。EpCAMの発現の増大は、乳癌及び胆嚢癌における予後不良の指標となる(非特許文献6、非特許文献7、非特許文献8、非特許文献9)。重要なことには、EpCAMは、乳癌、結腸直腸癌及び膵臓癌において腫瘍開始細胞又はがん幹細胞により発現される(非特許文献10、非特許文献11、非特許文献12)。
【0004】
EpCAM特異的モノクローナル抗体は、がん患者における希少な循環腫瘍細胞の検出のための診断ツールとして使用されている(非特許文献13、非特許文献14)。現在のところ、2種類〜3種類の改変抗EpCAM抗体が臨床研究において調査されている。
【0005】
アマトキシン及び抗体の複合体
本発明者らによる先の特許出願(特許文献1)(2007年11月28日に公開された)は、β−アマニチンをアルブミンと、又はモノクローナル抗体HEA125、OKT3及びPA−1と結合させた複合体を記載している。さらに、乳がん細胞(MCF−7)、バーキットリンパ腫細胞(ラージ細胞)及びT−リンパ腫細胞(ジャーカット細胞)の増殖に対するこれらの複合体の阻害効果が研究された。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】欧州特許第1859811号
【非特許文献】
【0007】
【非特許文献1】Trzpis M., McLaughlin P.M., de Leij L.M., Harmsen M.C. Epithelial cell adhesion molecule: more than a carcinoma marker and adhesion molecule. Am. J. Pathol. 171(2), 386-395 (2007)
【非特許文献2】Baeuerle P.A. and Gires O. EpCAM (CD326) finding its role in cancer. Br. J. Cancer 96(3), 417-423 (2007)
【非特許文献3】Balzar M., Winter M.J., de Boer C.J., Litvinov S.V. The biology of the 17-1A antigen (Ep-CAM). J. Mol. Med. 77(10), 699-712 (1999)
【非特許文献4】Winter M.J., Nagtegaal I.D., van Krieken J.H., Litvinov S.V. The epithelial cell adhesion molecule (Ep-CAM) as a morphoregulatory molecule is a tool in surgical pathology. Am. J. Pathol. 163(6), 2139-2148 (2003)
【非特許文献5】Went P.T., Lugli A., Meier S., Bundi M., Mirlacher M., Sauter G., Dirnhofer S. Frequent EpCam protein expression in human carcinomas. Hum. Pathol. 35(1), 122-128, 2004
【非特許文献6】Gastl G., Spizzo G., Obrist P., Duenser M., Mikuz G. Ep-CAM overexpression in breast cancer as a predictor of survival. Lancet 356(9246), 1981-1982 (2000)
【非特許文献7】Varga M., Obrist P., Schneeberger S., Muehlmann G., Felgel-Farnholz C., Fong D., Zitt M., Brunhuber T., Schaefer G., Gastl G., Spizzo G. Overexpression of epithelial cell adhesion molecule antigen in gallbladder carcinoma is an independent marker for poor survival. Clin. Cancer Res. 10(9), 3131-3136 (2004)
【非特許文献8】Spizzo G., Obrist P., Ensinger C., Theurl I., Duenser M., Ramoni A., Gunsilius E., Eibl G., Mikuz G., Gastl G. Prognostic significance of Ep-CAM AND Her-2/neu overexpression in invasive breast cancer. Int. J. Cancer 98(6), 883-888 (2002)
【非特許文献9】Spizzo G., Went P., Dirnhofer S., Obrist P., Simon R., Spichtin H., Maurer R., Metzger U., von Castelberg B., Bart R., Stopatschinskaya S., Koechli O.R., Haas P., Mross F., Zuber M., Dietrich H., Bischoff S., Mirlacher M., Sauter G., Gastl G. High Ep-CAM expression is associated with poor prognosis in node-positive breast cancer. Breast Cancer Res. Treat. 86(3), 207-213 (2004)
【非特許文献10】Al-Hajj M., Wicha M.S., Benito-Hernandez A., Morrison S.J., Clarke M.F. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. USA 100(7), 3983-3988 (2003)
【非特許文献11】Dalerba P., Dylla S.J., Park I.K., Liu R., Wang X., Cho R.W., Hoey T., Gurney A., Huang E.H., Simeone D.M., Shelton A.A., Parmiani G., Castelli C., Clarke M.F. Phenotypic characterization of human colorectal cancer stem cells. Proc. Natl. Acad. Sci. USA 104(24), 10158-10163 (2007)
【非特許文献12】Li C., Heidt D.G., Dalerba P., Burant C.F., Zhang L., Adsay V., Wicha M., Clarke M.F., Simeone D.M. Identification of pancreatic cancer stem cells. Cancer Res. 67(3), 1030-1037 (2007)
【非特許文献13】Allard W.J., Matera J., Miller M.C., Repollet M., Connelly M.C., Rao C., Tibbe A.G., Uhr J.W., Terstappen L.W. Tumor cells circulate in the peripheral blood of all major carcinomas but not in healthy subjects or patients with nonmalignant diseases. Clin. Cancer Res. 10(20), 6897-6904 (2004)
【非特許文献14】Nagrath S., Sequist L.V., Maheswaran S., Bell D.W., Irimia D., Ulkus L., Smith M.R., Kwak E.L., Digumarthy S., Muzikansky A., Ryan P., Balis U.J., Tompkins R.G., Haber D.A., Toner M. Isolation of rare circulating tumour cells in cancer patients by microchip technology. Nature 450(7173), 1235-1239 (2007)
【発明の概要】
【発明が解決しようとする課題】
【0008】
従来技術には、非常に低い濃度で標的細胞又は標的組織に対してその毒性効果を発揮する標的結合部分毒素複合体に対する必要性が存在していた。さらに、従来技術には、他の種類の疾患の治療に対する、特に他の種類のがん、特に治療法に抵抗性を有するもの、又は実際の腫瘍療法にあまり応答しないものの治療に対する必要性が依然として存在していた。
【0009】
本発明は、これらの及び他の必要性を満たす。例えば本発明者らは、本発明の基礎となる実験において、アマトキシン及び新たなキメラ抗体huHEA125を含む複合体が、従来技術に記載される複合体よりずっと低い濃度で腫瘍細胞の増殖を阻害することが可能であることを見出した。特に、アマトキシン及びキメラ抗体huHEA125を含む複合体は、従来技術の複合体を使用する場合に必要とされる濃度の約100分の1の濃度でその阻害効果を発揮する。さらに、本発明者らは、アマトキシン及びEpCAM特異的抗体を含む複合体が、乳がん細胞の増殖を阻害することができるだけでなく、驚くべきことに膵臓腺癌細胞、結腸直腸がん細胞及び胆管癌細胞の増殖を阻害することも可能であることを発見した。さらに、本発明者らは、複合体のアマトキシン部分において特定の連結点を選択することにより、非常に低い濃度(2×10−12M〜2×10−11M前後のIC50)で標的細胞に対してその毒性活性を発揮し、その標的細胞に対して高度に特異的である非常に効果的な標的結合部分毒素複合体(特に抗体毒素複合体)がもたらされることを見出した。特定の理論に拘束されることを望むものではないが、この後者の利点は、アマトキシンが標的細胞の外側ではなく標的細胞の内側で標的結合部分アマトキシン複合体から効率的に放出されるという点で説明することができよう。
【0010】
上の概説は必ずしも、本発明により解決される全ての課題を記載している訳ではない。
【課題を解決するための手段】
【0011】
第1の態様では、本発明は、患者における膵臓がん、胆管癌又は結腸直腸がんの治療のための抗体毒素複合体であって、(i)上皮細胞接着分子(EpCAM)のエピトープと特異的に結合する抗体又はその抗原結合断片、(ii)アマトキシン、及び(iii)任意にリンカーL1を含む、抗体毒素複合体に関する。
【0012】
第2の態様では、本発明は、抗体毒素複合体であって、(i)上皮細胞接着分子(EpCAM)と特異的に結合する抗体又はその抗原結合断片であって、(a)huHEA125の重鎖であって、(a1)配列番号1に記載の膜結合型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含み、配列番号26に示されるような重鎖の定常ドメインが、0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含む、膜結合型の重鎖、並びに(a2)配列番号2に記載の可溶型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含み、配列番号27に示されるような重鎖の定常ドメインが、0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含む、可溶型の重鎖からなる群から選択される、huHEA125の重鎖、並びに(b)配列番号11に記載のhuHEA125の軽鎖であって、配列番号12に示されるような軽鎖の可変ドメインVLが、VLのフレームワーク領域に位置する0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含み、配列番号28に示されるような軽鎖の定常ドメインCLが、0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含む、huHEA125の軽鎖を含む、抗体又はその抗原結合断片、(ii)アマトキシン、並びに(iii)任意にリンカーL2を含む、抗体毒素複合体に関する。
【0013】
第3の態様では、本発明は、医療における使用のための第2の態様による抗体毒素複合体に関する。
【0014】
第4の態様では、本発明は、患者におけるがんの治療のための第2の態様による抗体毒素複合体であって、該がんが、膵臓がん、胆管癌、乳がん及び結腸がんからなる群から選択される、抗体毒素複合体に関する。
【0015】
第5の態様では、本発明は、標的結合部分毒素複合体であって、(i)標的結合部分、(ii)アマトキシン、及び(iii)任意にリンカーL3を含み、アマトキシンが、アマトキシンのアミノ酸3のδC原子を介して、標的結合部分と、又は存在する場合リンカーL3と連結される、標的結合部分毒素複合体に関する。
【0016】
第6の態様では、本発明は、医療における使用のための第5の態様による標的結合部分毒素複合体に関する。
【0017】
第7の態様では、本発明は、患者におけるがんの治療のための第5の態様による標的結合部分毒素複合体であって、該がんが、膵臓がん、胆管癌、乳がん、結腸直腸がん、肺がん、前立腺がん、卵巣がん、胃がん、腎臓がん、悪性黒色腫、白血病及び悪性リンパ腫からなる群から選択される、標的結合部分毒素複合体に関する。
【0018】
第8の態様では、本発明は、第1の態様若しくは第2の態様による抗体毒素複合体、又は第5の態様による標的結合部分毒素複合体を含み、1つ又は複数の薬学的に許容可能な希釈剤、担体、賦形剤、充填剤、結合剤、滑剤、流動促進剤、崩壊剤、吸着剤、及び/又は保存料をさらに含む医薬組成物に関する。
【0019】
この本発明の概要は必ずしも、本発明の全ての特徴を記載している訳ではない。
【図面の簡単な説明】
【0020】
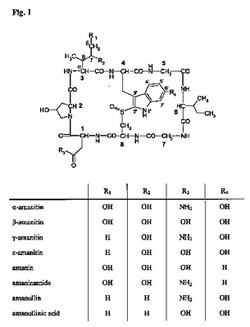
【図1】種々のアマトキシンの構造式を示す図である。太字の番号(1〜8)は、アマトキシンを形成する8個のアミノ酸の標準的な番号付けを示す。アミノ酸3における最も重要な炭素原子を、ギリシャ文字α、β、γ及びδを付して表示する。(置換された)トリプトファン(すなわちアミノ酸番号4)の側鎖の原子にも番号を示す(番号1’〜7’)。
【図2】結合競合分析による標的細胞に対するhuHEA125−Ama及びhuHEA125の結合親和性の比較を示す図である。EpCAMを発現するColo205細胞を、固定量の直接FITC標識したマウスHEA125抗体と共にインキュベートした。フローサイトメトリーにより標的細胞との結合を分析した。漸増量のhuHEA125−Ama又はhuHEA125による結合の競合により、標的抗原に対する非常に類似した親和性が明らかとなった。
【図3A】間接的な免疫蛍光により検出されるCapan−1(ヒト膵臓腺癌)株上におけるEpCAM抗原の表面発現を示す図である。図の左側における灰色の影付きのヒストグラムは、対照抗体Xolair(登録商標)により得られた結果を示す。図の右側における白色の領域を有するヒストグラムは、抗体huHEA125により得られた結果を示す。
【図3B】間接的な免疫蛍光により検出されるColo205(ヒト結腸腺癌)株上におけるEpCAM抗原の表面発現を示す図である。図の左側における灰色の影付きのヒストグラムは、対照抗体Xolair(登録商標)により得られた結果を示す。図の右側における白色の領域を有するヒストグラムは、抗体huHEA125により得られた結果を示す。
【図3C】間接的な免疫蛍光により検出されるOZ(ヒト胆管癌)株上におけるEpCAM抗原の表面発現を示す図である。図の左側における灰色の影付きのヒストグラムは、対照抗体Xolair(登録商標)により得られた結果を示す。図の右側における白色の領域を有するヒストグラムは、抗体huHEA125により得られた結果を示す。
【図3D】間接的な免疫蛍光により検出されるMCF−7(ヒト乳腺癌株)株上におけるEpCAM抗原の表面発現を示す図である。図の左側における灰色の影付きのヒストグラムは、対照抗体Xolair(登録商標)により得られた結果を示す。図の右側における白色の領域を有するヒストグラムは、抗体huHEA125により得られた結果を示す。
【図3E】間接的な免疫蛍光により検出されるBxPC−3(ヒト膵臓腺癌)株上におけるEpCAM抗原の表面発現を示す図である。図の左側における灰色の影付きのヒストグラムは、対照抗体Xolair(登録商標)により得られた結果を示す。図の右側における白色の領域を有するヒストグラムは、抗体huHEA125により得られた結果を示す。
【図3F】間接的な免疫蛍光により検出されるPC−3(ヒト前立腺腺癌)株上におけるEpCAM抗原の表面発現を示す図である。図の左側における灰色の影付きのヒストグラムは、対照抗体Xolair(登録商標)により得られた結果を示す。図の右側における白色の領域を有するヒストグラムは、抗体huHEA125により得られた結果を示す。
【図4】アマニチンと複合体形成した(Amanitin-armed)抗体huHEA125、アマニチンと複合体形成した対照抗体Xolair(登録商標)、及び遊離のアマニチンによりもたらされるCapan−1細胞の増殖の阻害の比較を示す図である。
【図5】アマニチンと複合体形成した抗体huHEA125、アマニチンと複合体形成した対照抗体Xolair(登録商標)、及び遊離のアマニチンによりもたらされるColo205細胞の増殖の阻害の比較を示す図である。
【図6】アマニチンと複合体形成した抗体huHEA125、アマニチンと複合体形成した対照抗体Xolair(登録商標)、及び遊離のアマニチンによりもたらされるMCF−7細胞の増殖の阻害の比較を示す図である。
【図7】アマニチンと複合体形成した抗体huHEA125、アマニチンと複合体形成した対照抗体Xolair(登録商標)、及び遊離のアマニチンによりもたらされるOZ細胞の増殖の阻害の比較を示す図である。
【図8】比較のためのアマニチンと複合体形成した抗体huHEA125、及びアマニチンと複合体形成した対照抗体Xolair(登録商標)、及び遊離のアマニチンによりもたらされるBxPC−3細胞の増殖の阻害を示す図である。
【図9】huHEA125−アマニチン処理後のNOD/SCIDマウスにおけるBxPC−3腫瘍異種移植片の成長阻害を示す図である。
【図10】huHEA125−アマニチン処理後のNOD/SCIDマウスにおけるPC−3腫瘍異種移植片の成長阻害を示す図である。
【発明を実施するための形態】
【0021】
定義
本発明を以下で詳細に記載する前に、本明細書中に記載する特定の方法論、プロトコル及び試薬は変動し得るので、本発明はこれらに限定されないことを理解すべきである。本明細書中で使用される専門用語が、特定の実施形態を記載するためのものにすぎず、添付した特許請求の範囲のみによって限定される本発明の範囲を限定することは意図されないことも理解すべきである。他に定義されない限り、本明細書中で使用される全ての技術用語及び科学用語は、当業者により一般的に理解されるのと同じ意味を有する。
【0022】
好ましくは、本明細書中で使用される用語は、"A multilingual glossary of biotechnological terms: (IUPACRecommendations)", Leuenberger, H.G.W, Nagel, B.and Koelbl, H. eds. (1995), Helvetica Chimica Acta, CH-4010 Basel, Switzerlandに記載されているように定義される。
【0023】
以下の本明細書及び添付の特許請求の範囲を通じて、文脈上他に必要な場合以外は、「を含む(comprise)」という単語、並びに「を含む(comprises)」及び「を含む(comprising)」等の変化形は、記載された整数若しくは工程、又は整数若しくは工程の群を包含することを示唆するが、任意の他の整数若しくは工程、又は整数若しくは工程の群を除外することを示唆しないと理解される。
【0024】
複数の文書が、本明細書の文章全体を通じて引用される。本明細書中で引用される文書(全ての特許、特許出願、科学的刊行物、製造業者の仕様書、取扱説明書、GenBankアクセッション番号配列提出書(submissions)等を含む)の各々が、上記のものであるか又は下記のものであるかに関わらず、その全体が参照により本明細書に援用される。本明細書のどの記載も、本発明が従来の発明に基づくかかる開示に先行する権利を有しないことを認めるものと解釈すべきではない。
【0025】
本明細書で使用する場合の「標的結合部分」という用語は、標的分子又は標的エピトープと特異的に結合することができる任意の分子又は分子の一部を表す。本願との関連では好ましい標的結合部分は、(i)抗体又はその抗原結合断片、(ii)抗体様タンパク質、及び(iii)核酸アプタマーである。本発明における使用に好適な「標的結合部分」は、典型的には40000Da(40kDa)以上の分子質量を有する。
【0026】
本願との関連ではそれぞれ「標的分子」及び「標的エピトープ」という用語は、標的結合部分が特異的に結合する抗原及び抗原のエピトープをそれぞれ表し、好ましくは標的分子は、腫瘍関連抗原、特に非腫瘍細胞の表面と比較して高い濃度で及び/又は異なる立体配置で1つ又は複数の腫瘍細胞型の表面上に存在する抗原又はエピトープである。好ましくは、上記抗原又は上記エピトープは、1つ又は複数の腫瘍細胞型の表面上に存在するが、非腫瘍細胞の表面上には存在しない。
【0027】
本明細書で使用する場合の「抗体又はその抗原結合断片」という用語は、免疫グロブリン分子及び免疫グロブリン分子の免疫学的に活性な部分、すなわち抗原を免疫特異的に結合する抗原結合部位を含有する分子を表す。例えば標的分子と、例えば標的タンパク質EpCAMと特異的に結合するファージディスプレイを含む技法により選択される免疫グロブリン様タンパク質も含まれる。本発明の免疫グロブリン分子は、任意のタイプ(例えばIgG、IgE、IgM、IgD、IgA及びIgY)、クラス(例えばIgG1、IgG2、IgG3、IgG4、IgA1及びIgA2)のもの、又は免疫グロブリン分子のサブクラスであり得る。本発明における使用に好適な「抗体及びその抗原結合断片」は、ポリクローナル抗体、モノクローナル抗体、一価抗体、二重特異性抗体、ヘテロ複合体抗体、多重特異性抗体、ヒト抗体、ヒト化(特にCDR移植)抗体、脱免疫化(deimmunized)抗体又はキメラ抗体、一本鎖抗体(例えばscFv)、Fab断片、F(ab’)2断片、Fab発現ライブラリにより産生される断片、ダイアボディ(diabodies)又はテトラボディ(tetrabodies)(Holliger P. et al., 1993)、ナノボディ(nanobodies)、抗イディオタイプ(抗Id)抗体(例えば、本発明の抗体に対する抗Id抗体を含む)、及び上記のもののいずれかのエピトープ結合断片を含むがこれらに限定されない。
【0028】
幾つかの実施形態では、抗原結合断片は本発明のヒト抗原結合抗体断片であり、Fab、Fab’及びF(ab’)2、Fd、一本鎖Fv(scFv)、一本鎖抗体、ジスルフィド結合したFv(dsFv)、並びにVLドメイン又はVHドメインを含む断片を含むがこれらに限定されない。一本鎖抗体を含む抗原結合抗体断片は、可変ドメイン(複数可)を単独で、又はヒンジ領域、CLドメイン、CH1ドメイン、CH2ドメイン及びCH3ドメインの全体若しくは一部と組み合わせて含み得る。ヒンジ領域、CLドメイン、CH1ドメイン、CH2ドメイン及びCH3ドメインと可変ドメイン(複数可)の任意の組合せも含む抗原結合断片も本発明に含まれる。
【0029】
本発明において使用可能な抗体は、鳥及び哺乳動物を含む任意の動物起源由来であり得る。好ましくは、抗体は、ヒト、げっ歯類(例えばマウス及びラット)、ロバ、ヒツジ、ウサギ、ヤギ、モルモット、ラクダ、ウマ又はニワトリの抗体である。抗体がヒト起源又はマウス起源のものであることが特に好ましい。本明細書で使用する場合の「ヒト抗体」は、ヒト免疫グロブリンのアミノ酸配列を有する抗体を含み、ヒト免疫グロブリンライブラリから単離された、又は1つ又は複数のヒト免疫グロブリンを遺伝子導入した内在性免疫グロブリンを発現しない動物(例えばKucherlapati &Jakobovitsによる米国特許第5939598号に記載されるような)由来の抗体を含む。
【0030】
「抗体様タンパク質」という用語は、標的分子と特異的に結合するように改変された(例えばループの突然変異誘発により)タンパク質を表す。典型的には、かかる抗体様タンパク質は、両端でタンパク質骨格と結合した少なくとも1つの可変ペプチドループを含む。この二重の構造的制約により、抗体様タンパク質の結合親和性が抗体の結合親和性に匹敵するレベルまで大幅に増大する。可変ペプチドループの長さは典型的には、10個〜20個のアミノ酸からなる。骨格タンパク質は、良好な溶解特性を有する任意のタンパク質であり得る。好ましくは、骨格タンパク質は小さい球状タンパク質である。抗体様タンパク質は、アフィボディ(affibodies)、アンチカリン(anticalins)、及び設計されたアンキリン反復タンパク質(概説に関してはBinz et al. 2005を参照されたい)を含むがこれらに限定されない。抗体様タンパク質は、突然変異体の大規模ライブラリ由来のものであってもよく、例えば大規模ファージディスプレイライブラリから選択して(panned)もよく、正規の抗体と同様に単離してもよい。また、抗体様結合タンパク質を、球状タンパク質の表面露出残基のコンビナトリアル突然変異誘発により得ることができる。
【0031】
「核酸アプタマー」という用語は、in vitro選択の繰り返し又はSELEX(試験管内進化法)により標的分子と結合するように改変された核酸分子を表す(概説に関してはBrody and Gold, 2000を参照されたい)。核酸アプタマーはDNA分子又はRNA分子であり得る。アプタマーは、例えば修飾ヌクレオチド、例えば2’−フッ素−置換ピリミジンのように修飾を含有していてもよい。
【0032】
「アマトキシン」という用語は、アマニタ(Amanita)属から単離され参考文献(Wieland, T. and Faulstich H., 1978)に記載されるような8個のアミノ酸から構成される全ての環状ペプチド、さらに全てのその化学的誘導体、さらに全てのその半合成類縁体、さらに天然化合物の主要構造(環状、8個のアミノ酸)に従って基本単位から構築される全てのその合成類縁体、さらにヒドロキシル化アミノ酸の代わりに非ヒドロキシル化アミノ酸を含有する全ての合成類縁体又は半合成類縁体、さらにスルフィド、スルホンにより、又は硫黄以外の原子、例えば炭素原子により(アマニチンのカルバアナログの場合のように)チオエーテルスルホキシド部分が置換された全ての合成類縁体又は半合成類縁体を含む。
【0033】
機能的には、アマトキシンは、哺乳動物のRNAポリメラーゼIIを阻害するペプチド又はデプシペプチドとして定義される。好ましいアマトキシンは、リンカー分子又はタンパク質、例えば抗体又は抗体断片と反応することができる官能基(例えばカルボキシル(carboxylic)基、アミノ基、ヒドロキシ基、チオール基又はチオール捕捉基)を有するものである。本発明の複合体に特に好適なアマトキシンは、図1に示されるようなα−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン(amanin)、アマニンアミド、アマヌリン及びアマヌリン酸(amanullinic acid)、並びにその塩、化学的誘導体、半合成類縁体及び合成類縁体である。本発明における使用のために特に好ましいアマトキシンは、α−アマニチン、β−アマニチン及びアマニンアミドである。
【0034】
本明細書で使用する場合の或る化合物の「誘導体」は、該化合物に類似する化学構造を有するが、該化合物中には存在しない少なくとも1つの化学基を含有し、及び/又は該化合物中に存在する少なくとも1つの化学基を欠く化学種を表す。誘導体の比較対象となる化合物は、「親」化合物として知られる。典型的には、「誘導体」は、1つ又は複数の化学反応工程で親化合物から作製することができる。
【0035】
本明細書で使用する場合の或る化合物の「類縁体」は、該化合物と構造的に関連するが同一ではなく、該化合物の少なくとも1つの活性を示す。類縁体の比較対象となる化合物は、「親」化合物として知られる。上で言及した活性は、別の化合物との結合活性、阻害活性、例えば酵素阻害活性、毒性効果、活性化活性、例えば酵素活性化活性を含むがこれらに限定されない。類縁体がかかる活性を親化合物と同程度示す必要はない。本願との関連内では、或る化合物が親化合物の活性の少なくとも1%(より好ましくは少なくとも5%、より好ましくは少なくとも10%、より好ましくは少なくとも20%、より好ましくは少なくとも30%、より好ましくは少なくとも40%、より好ましくは少なくとも50%)の程度まで関連する活性を示す場合、該化合物は類縁体とみなされる。したがって、「アマトキシンの類縁体」は、本明細書で使用する場合、図1に示されるようなα−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン及びアマヌリン酸のいずれか1つと構造的に関連し、α−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン及びアマヌリン酸の少なくとも1つと比較して哺乳動物のRNAポリメラーゼIIに対する少なくとも1%(より好ましくは少なくとも5%、より好ましくは少なくとも10%、より好ましくは少なくとも20%、より好ましくは少なくとも30%、より好ましくは少なくとも40%、より好ましくは少なくとも50%)の阻害活性を示す化合物を表す。本発明における使用に好適な「アマトキシンの類縁体」はさらに、哺乳動物のRNAポリメラーゼIIに対してα−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン又はアマヌリン酸のいずれか1つより大きな阻害活性を示し得る。阻害活性は、50%の阻害が生じる濃度(IC50値)を決定することにより測定することができる。
【0036】
本願との関連では「リンカー」は、例えば標的結合部分とアマトキシンとの間の立体的干渉を軽減させる(そうしなければRNAポリメラーゼIIと相互作用するアマトキシンの能力が減少する可能性がある)ために、2つの構成要素の間の距離を増大させる分子を表す。リンカーは、標的結合部分が標的とする細胞中で特異的にアマトキシンの放出を促進することがあるため、別の目的に適う可能性がある。リンカー、好ましくは一方側におけるリンカーとアマトキシンとの間の結合、及びもう一方側におけるリンカーと抗体との間の結合が細胞の外側(例えば血液中)では生理学的条件下で安定であるが、細胞の内側で、特に標的細胞、例えばがん細胞又は免疫細胞の内側で切断され得ることが好ましい。この選択的な安定性をもたらすために、リンカーは、好ましくは例えばS. Fletcher, M. R. Jorgensens and A. D.Miller; Org. Lett. 2004, 6(23), pp 4245-4248に記載されるようなpH感受性リンカーを生成するためにpH感受性の、又は例えばL. DA Ibsen, Blood 2003, 102, 1458-65若しくはFranciscoJA, Cerreny CG, Meyer DL, Nat. Biotechnol2003, 21, 778-84に記載されるようなプロテアーゼ感受性リンカーを生成するためにプロテアーゼ感受性の官能基(functionalities)を含み得る。代替的には、標的結合部分とリンカーを連結する結合は、選択的な安定性をもたらし得る。好ましくはリンカーは、少なくとも1原子長の、好ましくは1原子長〜20原子長(例えば1原子長、2原子長、3原子長、4原子長、5原子長、6原子長、7原子長、8原子長、9原子長、10原子長、11原子長、12原子長、13原子長、14原子長、15原子長、16原子長、17原子長、18原子長、19原子長又は20原子長)の長さを有し、リンカーの一方側がアマトキシンと反応しており、もう一方側が標的結合部分と反応している。本発明との関連では、リンカーは好ましくは、任意に置換されたC1〜20−アルキル基、C1〜20−ヘテロアルキル基、C2〜20−アルケニル基、C2〜20−ヘテロアルケニル基、C2〜20−アルキニル基、C2〜20−ヘテロアルキニル基、シクロアルキル基、ヘテロシクロアルキル基、アリール基、ヘテロアリール基、アラルキル基又はヘテロアラルキル基である。リンカーは、1つ又は複数の構造要素、例えばアミド部分、エステル部分、エーテル部分、チオエーテル部分、ジスルフィド部分、炭化水素部分等を含有し得る。リンカーは、これらの構造要素の2つ以上の組合せも含有し得る。これらの構造要素の各々が、リンカー中に2箇所以上、例えば2箇所、3箇所、4箇所、5箇所又は6箇所存在し得る。幾つかの実施形態では、リンカーは、ジスルフィド結合を含み得る。リンカーを、単一工程で又は2つ以上の後続の工程でアマトキシン及び標的結合部分と結合しなければならないことが理解される。そのために、その後リンカーとなるものは、好ましくは近位端及び遠位端に2つの基を保有し、該基は(i)或る基、好ましくはアマトキシン若しくは標的結合ペプチド上の活性化された基と共有結合を形成することができる、又は(ii)アマトキシン上の基と共有結合を形成するために活性化される若しくは活性化され得る。したがって、リンカーが存在する場合、化学基がリンカーの遠位端及び近位端に存在し、これがかかる結合反応の結果、例えばエステル結合、エーテル結合、ウレタン結合、ペプチド結合等であることが好ましい。「リンカー」の存在は任意であり、すなわち毒素は、本発明の標的結合部分毒素複合体の幾つかの実施形態では、標的結合部分の残基と直接連結され得る。リンカーが、標的とする部分との結合を介して、好ましくはその末端で、直接連結されることが好ましい。標的結合部分が、例えばAsp残基、Glu残基、Arg残基、Lys残基、Cys残基(ポリペプチド中に含まれ得る)の形態の遊離のアミノ基、遊離のカルボキシ基、又は遊離のスルフヒドリル基を含む場合、リンカーがかかる基と連結されることが好ましい。
【0037】
本明細書で使用する場合、第1の化合物(例えば抗体)が第2の化合物(例えば抗原、例えば標的タンパク質)に対して100μM以下、好ましくは50μM以下、好ましくは30μM以下、好ましくは20μM以下、好ましくは10μM以下、好ましくは5μM以下、より好ましくは1μM以下、より好ましくは900nM以下、より好ましくは800nM以下、より好ましくは700nM以下、より好ましくは600nM以下、より好ましくは500nM以下、より好ましくは400nM以下、より好ましくは300nM以下、より好ましくは200nM以下、さらにより好ましくは100nM以下、さらにより好ましくは90nM以下、さらにより好ましくは80nM以下、さらにより好ましくは70nM以下、さらにより好ましくは60nM以下、さらにより好ましくは50nM以下、さらにより好ましくは40nM以下、さらにより好ましくは30nM以下、さらにより好ましくは20nM以下、さらにより好ましくは10nM以下の解離定数KDを有する場合、第1の化合物は上記第2の化合物と「特異的に結合する」と考える。
【0038】
本明細書で使用する場合の「患者」は、本明細書に記載される標的結合部分毒素複合体による治療から利益を受け得る任意の哺乳動物又は鳥を意味する。好ましくは、「患者」は、実験動物(例えばマウス又はラット)、家畜動物(例えばモルモット、ウサギ、ロバ、ヒツジ、ヤギ、ニワトリ、ラクダ、ウマ、ネコ又はイヌを含む)、又は人間を含む霊長類からなる群から選択される。「患者」は人間であることが特に好ましい。
【0039】
本明細書で使用する場合、或る疾患又は障害に関する「を治療する(treat)」、「を治療すること(treating)」又は「治療(treatment)」は、(a)該障害の重症度を低減すること、(b)治療される該障害(複数可)に特徴的な症状の発症を制限又は予防すること、(c)治療される該障害(複数可)に特徴的な症状の悪化を阻止すること、(d)該障害(複数可)を過去に有していた患者における該障害(複数可)の再発を制限又は予防すること、及び(e)過去に該障害(複数可)の症状を示した患者における症状の再発を制限又は予防することのうち1つ又は複数を達成することを意味する。
【0040】
本明細書で使用する場合の「を投与すること(administering)」は、in vivoでの投与、及びex vivoでの組織(例えば静脈移植片)への直接の投与を含む。
【0041】
「有効量」は、意図した目的を達成するのに十分な治療剤の量である。所定の治療剤の有効量は、薬剤の性質、投与経路、治療剤の投与対象の動物の大きさ及び種、並びに投与目的等の因子により変動し得る。各々の個別のケースにおける有効量は、当該技術分野において確立された方法に従って当業者が経験的に決定することができる。
【0042】
「薬学的に許容可能な」は、連邦政府若しくは州政府の監督官庁により承認されていること、又は米国薬局方、若しくは動物における、より具体的にはヒトにおける使用のための他の一般的に認められた薬局方にリストされていることを意味する。
【0043】
本発明の実施形態
本発明をここでさらに記載する。以下の節では本発明の種々の態様をより詳細に規定する。そのようにして規定した各態様は、反対の内容が明示されない限り、任意の他の態様(単数又は複数)と組み合わせることができる。特に、好ましい又は有利であるとして示した任意の特徴を、好ましい又は有利であるとして示した任意の他の特徴(単数又は複数)と組み合わせることができる。
【0044】
第1の態様では、本発明は、患者における膵臓がん、胆管癌又は結腸直腸がんの治療のための抗体毒素複合体であって、(i)上皮細胞接着分子(EpCAM)のエピトープと特異的に結合する抗体又はその抗原結合断片、(ii)アマトキシン、及び(iii)任意にリンカーを含む、抗体毒素複合体に関する。
【0045】
第1の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、ダイアボディ、テトラボディ、ナノボディ、キメラ抗体、脱免疫化抗体、ヒト化抗体又はヒト抗体から選択される。第1の態様の好ましい一実施形態では、抗原結合断片は、Fab、F(ab’)2、Fd、Fv、一本鎖Fv、及びジスルフィド結合したFv(dsFv)からなる群から選択される。
【0046】
好ましい一実施形態では、EpCAMのエピトープは、ヒトEpCAMのエピトープである。
【0047】
第1の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、(a)huHEA125の重鎖のCDR3ドメイン(配列番号22)、及び/又は(b)huHEA125の軽鎖のCDR3ドメイン(配列番号25)を含む。特に好ましい一実施形態では、抗体又はその抗原結合断片は、配列番号22及び配列番号25に示されるようなこれらのCDR3ドメインの両方を含む。好ましくは、抗体又はその抗原結合断片は、(a)huHEA125の重鎖のCDR2ドメイン(配列番号21)、(b)huHEA125の重鎖のCDR1ドメイン(配列番号20)、(c)huHEA125の軽鎖のCDR2ドメイン(配列番号24)、及び(d)huHEA125の軽鎖のCDR1ドメイン(配列番号23)のうち1つ又は複数をさらに含む。好ましい一実施形態では、抗体又はその抗原結合断片は、huHEA125の重鎖のCDR3ドメイン(配列番号22)、CDR2ドメイン(配列番号21)及びCDR1ドメイン(配列番号20)を含む。好ましい一実施形態では、抗体又はその抗原結合断片は、huHEA125の軽鎖のCDR3ドメイン(配列番号25)、CDR2ドメイン(配列番号24)及びCDR1ドメイン(配列番号23)を含む。特に好ましい一実施形態では、抗体又はその抗原結合断片は、重鎖及び軽鎖のCDR3ドメイン、CDR2ドメイン及びCDR1ドメインを含み、すなわち抗体又はその抗原結合断片は、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24及び配列番号25に示されるようなアミノ酸配列を含む。
【0048】
第1の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、huHEA125の重鎖の可変ドメイン(=VH)(配列番号3)、及び/又はhuHEA125の軽鎖の可変ドメイン(=VL)(配列番号12)を含む。特に好ましい一実施形態では、抗体又はその抗原結合断片は、huHEA125のVHドメイン(配列番号3)及びVLドメイン(配列番号12)の両方を含む。
【0049】
第1の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、huHEA125の重鎖(可溶型、配列番号2)、及び/又はhuHEA125の軽鎖(配列番号11)を含む。一実施形態では、huHEA125の重鎖、及び/又はhuHEA125の軽鎖は各々、最大20個(例えば1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個又は20個)のアミノ酸置換、アミノ酸欠失又はアミノ酸付加を互いに独立して含み、これらのアミノ酸置換、アミノ酸欠失又はアミノ酸付加は、重鎖の定常ドメインに、及び/又は軽鎖の定常ドメインに、及び/又は重鎖の可変ドメインのフレームワーク領域に、及び/又は軽鎖の可変ドメインのフレームワーク領域に位置し得る。特に好ましい一実施形態では、抗体は2つのhuHEA125の重鎖(配列番号2)、及び2つのhuHEA125の軽鎖(配列番号11)を含む完全IgG抗体であり、1つの重鎖はジスルフィド結合を介して1つの軽鎖と連結されており、重鎖は1つ又は2つ(好ましくは2つ)のジスルフィド結合により互いに連結されている。
【0050】
第1の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、huHEA125の重鎖(膜結合型、配列番号1)、及び/又はhuHEA125の軽鎖(配列番号11)を含む。一実施形態では、huHEA125の重鎖、及び/又はhuHEA125の軽鎖は各々、最大20個(例えば1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個又は20個)のアミノ酸置換、アミノ酸欠失又はアミノ酸付加を互いに独立して含み、これらのアミノ酸置換、アミノ酸欠失又はアミノ酸付加は、重鎖の定常ドメインに、及び/又は軽鎖の定常ドメインに、及び/又は重鎖の可変ドメインのフレームワーク領域に、及び/又は軽鎖の可変ドメインのフレームワーク領域に位置し得る。特に好ましい一実施形態では、抗体は2つのhuHEA125の重鎖(配列番号1)、及び2つのhuHEA125の軽鎖(配列番号11)を含む完全IgG抗体であり、1つの重鎖はジスルフィド結合を介して1つの軽鎖と連結されており、重鎖は1つ又は2つ(好ましくは2つ)のジスルフィド結合により互いに連結されている。
【0051】
第1の態様の好ましい一実施形態では、アマトキシンは、α−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン及びアマヌリン酸(全て図1に示される)、並びにその塩、化学的誘導体、半合成類縁体及び合成類縁体から選択される。特に好ましいアマトキシンは、α−アマニチン、β−アマニチン及びアマニンアミド、並びにその塩、化学的誘導体、半合成類縁体及び合成類縁体である。
【0052】
第1の態様の好ましい一実施形態では、アマトキシンは、アマトキシンのアミノ酸3のδC原子を介して、抗体と、又は存在する場合リンカーL1と連結される(図1を参照されたい)。本発明において使用可能な好ましいアマトキシンでは、上記アミノ酸3は、イソロイシン、γ−ヒドロキシ−イソロイシン又はγ,δ−ジヒドロキシ−イソロイシンである。
【0053】
第1の態様の好ましい実施形態では、アマトキシンは、アマトキシンのアミノ酸3のδC原子と結合した酸素原子を介して、抗体と、又は存在する場合リンカーL1と連結される。アマトキシンが、エステル結合、エーテル結合又はウレタン結合を介して、抗体と、又は存在する場合リンカーL1と連結されることがさらに好ましい。これらの実施形態では、アミノ酸3がγ,δ−ジヒドロキシ−イソロイシンであることが好ましい。
【0054】
第1の態様の好ましい実施形態では、抗体は、該抗体に存在するアミノ基を介して、アマトキシンと、又は存在する場合リンカーL1と連結される。
【0055】
第1の態様の好ましい一実施形態では、リンカーL1は、任意に置換されたアルキル基、ヘテロアルキル基、アルケニル基、ヘテロアルケニル基、アルキニル基、ヘテロアルキニル基、シクロアルキル基、ヘテロシクロアルキル基、アリール基、ヘテロアリール基、アラルキル基又はヘテロアラルキル基である。第1の態様のさらに好ましい実施形態では、リンカーL1は、ジスルフィド結合を含む。
【0056】
第2の態様では、本発明は、抗体毒素複合体であって、(i)上皮細胞接着分子(EpCAM)と特異的に結合する抗体又はその抗原結合断片であって、(a)huHEA125の重鎖であって、(a1)配列番号1に記載の膜結合型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含み、配列番号26に示されるような重鎖の定常ドメインが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含む、膜結合型の重鎖、並びに(a2)配列番号2に記載の可溶型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含み、配列番号27に示されるような重鎖の定常ドメインが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含む、可溶型の重鎖からなる群から選択される、huHEA125の重鎖、並びに(b)配列番号11に記載のhuHEA125の軽鎖であって、配列番号12に示されるような軽鎖の可変ドメインVLが、VLのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含み、配列番号28に示されるような軽鎖の定常ドメインCLが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含む、huHEA125の軽鎖を含む、抗体又はその抗原結合断片、(ii)アマトキシン、並びに(iii)任意にリンカーを含む、抗体毒素複合体に関する。
【0057】
第2の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、(a)huHEA125の重鎖であって、(a1)配列番号1に記載の膜結合型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含む、膜結合型の重鎖、並びに(a2)配列番号2に記載の可溶型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含む、可溶型の重鎖からなる群から選択される、huHEA125の重鎖、並びに(b)配列番号11に記載のhuHEA125の軽鎖であって、配列番号12に示されるような軽鎖の可変ドメインVLが、VLのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含む、huHEA125の軽鎖を含む。
【0058】
第2の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、(a)huHEA125の重鎖であって、(a1)配列番号1に記載の膜結合型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、アミノ酸欠失及び/又はアミノ酸付加を含み、配列番号26に示されるような重鎖の定常ドメインが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、アミノ酸欠失及び/又はアミノ酸付加を含む、膜結合型の重鎖、並びに(a2)配列番号2に記載の可溶型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、アミノ酸欠失及び/又はアミノ酸付加を含み、配列番号27に示されるような重鎖の定常ドメインが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、アミノ酸欠失及び/又はアミノ酸付加を含む、可溶型の重鎖からなる群から選択される、huHEA125の重鎖、並びに(b)配列番号11に記載のhuHEA125の軽鎖であって、配列番号12に示されるような軽鎖の可変ドメインVLが、VLのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、アミノ酸欠失及び/又はアミノ酸付加を含み、配列番号28に示されるような軽鎖の定常ドメインCLが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、アミノ酸欠失及び/又はアミノ酸付加を含む、huHEA125の軽鎖を含む。
【0059】
第2の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、(a)huHEA125の重鎖であって、(a1)配列番号1に記載の膜結合型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換を含み、配列番号26に示されるような重鎖の定常ドメインが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換を含む、膜結合型の重鎖、及び(a2)配列番号2に記載の可溶型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換を含み、配列番号27に示されるような重鎖の定常ドメインが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換を含む、可溶型の重鎖からなる群から選択される、huHEA125の重鎖、並びに(b)配列番号11に記載のhuHEA125の軽鎖であって、配列番号12に示されるような軽鎖の可変ドメインVLが、VLのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換を含み、配列番号28に示されるような軽鎖の定常ドメインCLが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換を含む、huHEA125の軽鎖を含む。
【0060】
第2の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、(a)huHEA125の重鎖であって、(a1)配列番号1に記載の膜結合型の重鎖、及び(a2)配列番号2に記載の可溶型の重鎖からなる群から選択される、huHEA125の重鎖、並びに(b)配列番号11に記載のhuHEA125の軽鎖を含む。
【0061】
第2の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、キメラ抗体、脱免疫化抗体、ヒト化抗体又はヒト抗体から選択される。第2の態様の好ましい一実施形態では、抗原結合断片は、Fab、F(ab’)2及びFdからなる群から選択される。
【0062】
第2の態様の好ましい一実施形態では、抗体は、huHEA125又はその抗原結合断片である。
【0063】
第2の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、ヒトEpCAMと特異的に結合する。
【0064】
第2の態様の好ましい一実施形態では、アマトキシンは、α−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン及びアマヌリン酸(全て図1に示される)、並びにその塩、化学的誘導体、半合成類縁体及び合成類縁体から選択される。特に好ましいアマトキシンは、α−アマニチン、β−アマニチン及びアマニンアミド、並びにその塩、化学的誘導体、半合成類縁体及び合成類縁体である。
【0065】
第2の態様の好ましい一実施形態では、アマトキシンは、アマトキシンのアミノ酸3のδC原子を介して、抗体と、又は存在する場合リンカーL2と連結される(図1を参照されたい)。本発明において使用可能な好ましいアマトキシンでは、上記アミノ酸3は、イソロイシン、γ−ヒドロキシ−イソロイシン又はγ,δ−ジヒドロキシ−イソロイシンである。
【0066】
第2の態様の好ましい実施形態では、アマトキシンは、アマトキシンのアミノ酸3のδC原子と結合した酸素原子を介して、抗体と、又は存在する場合リンカーL2と連結される。アマトキシンが、エステル結合、エーテル結合又はウレタン結合を介して、抗体と、又は存在する場合リンカーL2と連結されることがさらに好ましい。これらの実施形態では、アミノ酸3がγ,δ−ジヒドロキシ−イソロイシンであることが好ましい。
【0067】
第2の態様の好ましい実施形態では、抗体は、該抗体に存在するアミノ基を介して、アマトキシンと、又は存在する場合リンカーL2と連結される。
【0068】
第2の態様の好ましい一実施形態では、リンカーL2は、任意に置換されたアルキル基、ヘテロアルキル基、アルケニル基、ヘテロアルケニル基、アルキニル基、ヘテロアルキニル基、シクロアルキル基、ヘテロシクロアルキル基、アリール基、ヘテロアリール基、アラルキル基又はヘテロアラルキル基である。第2の態様のさらに好ましい実施形態では、リンカーL2は、ジスルフィド結合を含む。
【0069】
第3の態様では、本発明は、医療における使用のための第2の態様の複合体に関する。
【0070】
第4の態様では、本発明は、患者におけるがんの治療のための第2の態様の複合体であって、該がんが、膵臓がん、胆管癌、乳がん及び結腸直腸がんからなる群から選択される、複合体に関する。
【0071】
第5の態様では、本発明は、患者におけるがんの治療用の医薬組成物の調製のための第2の態様の複合体であって、該がんが、膵臓がん、胆管癌、乳がん及び結腸直腸がんからなる群から選択される、複合体に関する。
【0072】
第5の態様では、本発明は、標的結合部分毒素複合体であって、(i)標的結合部分、(ii)アマトキシン、及び(iii)任意にリンカーL3を含み、アマトキシンが、アマトキシンのアミノ酸3、好ましくはアマトキシンのアミノ酸3のδC原子を介して、標的結合部分と、又は存在する場合リンカーL3と連結される、標的結合部分毒素複合体に関する(図1を参照されたい)。本発明において使用可能な好ましいアマトキシンでは、上記アミノ酸3は、イソロイシン、γ−ヒドロキシ−イソロイシン又はγ,δ−ジヒドロキシ−イソロイシンである。
【0073】
第5の態様の好ましい一実施形態では、アマトキシンは、アマトキシンのアミノ酸3のδC原子と結合した酸素原子を介して、標的結合部分と、又は存在する場合リンカーL3と連結される。アマトキシンが、エステル結合、好ましくはアマトキシン−O−C(O)−L3−標的結合部分若しくはアマトキシン−O−C(O)−標的結合部分、より好ましくはアマトキシン−δC−O−C(O)−L3−標的結合部分若しくはアマトキシン−δC−O−C(O)−標的結合部分、最も好ましくはアマトキシン−δCH2−O−C(O)−L3−標的結合部分若しくはアマトキシン−δCH2−O−C(O)−標的結合部分の形態のエステル結合、エーテル結合、好ましくはアマトキシン−O−L3−標的結合部分若しくはアマトキシン−O−標的結合部分、好ましくはアマトキシン−δC−O−L3−標的結合部分若しくはアマトキシン−δC−O−標的結合部分、より好ましくはアマトキシン−δCH2−O−L3−標的結合部分若しくはアマトキシン−δCH2−O−標的結合部分の形態のエーテル結合、又はウレタン結合、好ましくはアマトキシン−O−C(O)−NH−L3−標的結合部分若しくはアマトキシン−O−C(O)−NH−標的結合部分、好ましくはアマトキシン−δC−O−C(O)−NH−L3−標的結合部分若しくはアマトキシン−δC−O−C(O)−NH−標的結合部分、すなわちアマトキシン−δCH2−O−C(O)−NH−L3−標的結合部分若しくはアマトキシン−δCH2−O−C(O)−NH−標的結合部分の形態のウレタン結合を介して、標的結合部分と、又は存在する場合リンカーL3と連結されることがさらに好ましい。これらの実施形態では、アミノ酸3がγ,δ−ジヒドロキシ−イソロイシンであることが好ましい。
【0074】
第5の態様の好ましい実施形態では、リンカーL3が存在し、複合体が以下の構造:(i)アマトキシン−δC−O−C(O)−L3−C(O)−NH−標的結合部分、(ii)アマトキシン−δC−O−L3−C(O)−NH−標的結合部分、又は(iii)アマトキシン−δC−O−C(O)−NH−L3−C(O)−NH−標的結合部分、好ましくは(i)アマトキシン−δCH2−O−C(O)−L3−C(O)−NH−標的結合部分、(ii)アマトキシン−δCH2−O−L3−C(O)−NH−標的結合部分、又は(iii)アマトキシン−δCH2−O−C(O)−NH−L3−C(O)−NH−標的結合部分のうちの1つを有する。
【0075】
第5の態様の好ましい一実施形態では、標的結合部分は、該標的結合部分に存在するアミノ基を介して、アマトキシンと、又は存在する場合リンカーL3と連結される。
【0076】
第5の態様の好ましい一実施形態では、アマトキシンは、α−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン又はアマヌリン酸(全て図1に示される)、並びにその塩、化学的誘導体、半合成類縁体及び合成類縁体から選択される。特に好ましいアマトキシンは、α−アマニチン、β−アマニチン及びアマニンアミド、並びにその塩、化学的誘導体、半合成類縁体及び合成類縁体である。
【0077】
第5の態様の好ましい一実施形態では、リンカーL3は、任意に置換されたアルキル基、ヘテロアルキル基、アルケニル基、ヘテロアルケニル基、アルキニル基、ヘテロアルキニル基、シクロアルキル基、ヘテロシクロアルキル基、アリール基、ヘテロアリール基、アラルキル基又はヘテロアラルキル基である。第5の態様のさらに好ましい実施形態では、リンカーL3は、ジスルフィド結合を含む。
【0078】
第5の態様の好ましい一実施形態では、標的結合部分は、腫瘍細胞上に存在するエピトープと特異的に結合する。標的結合部分が上皮細胞接着分子(EpCAM)のエピトープと特異的に結合することが特に好ましい。
【0079】
第5の態様の好ましい一実施形態では、標的結合部分は、(i)抗体又はその抗原結合断片、(ii)抗体様タンパク質、及び(iii)核酸アプタマーからなる群から選択される。好ましい一実施形態では、抗体又はその抗原結合断片は、ダイアボディ、テトラボディ、ナノボディ、キメラ抗体、脱免疫化抗体、ヒト化抗体又はヒト抗体から選択される。好ましい一実施形態では、抗原結合断片は、Fab、F(ab’)2、Fd、Fv、一本鎖Fv、及びジスルフィド結合したFv(dsFv)からなる群から選択される。好ましい一実施形態では、抗体又はその抗原結合断片は、(a)huHEA125の膜結合型の重鎖(配列番号1)、若しくはhuHEA125の可溶型の重鎖(配列番号2)、及び/又は(b)huHEA125の軽鎖(配列番号11)を含む。
【0080】
第6の態様では、本発明は、医療における使用のための第5の態様による標的結合部分毒素複合体に関する。
【0081】
第7の態様では、本発明は、患者におけるがんの治療のための第5の態様による標的結合部分毒素複合体であって、該がんが、膵臓がん、胆管癌、乳がん、結腸直腸がん、肺がん、前立腺がん、卵巣がん、胃がん、腎臓がん、悪性黒色腫、白血病及び悪性リンパ腫からなる群から選択される、標的結合部分毒素複合体に関する。
【0082】
第8の態様では、本発明は、第1の態様の若しくは第2の態様の抗体毒素複合体、又は第5の態様による標的結合部分毒素複合体を含み、1つ又は複数の薬学的に許容可能な希釈剤、担体、賦形剤、充填剤、結合剤、滑剤、流動促進剤、崩壊剤、吸着剤、及び/又は保存料をさらに含む医薬組成物に関する。
【0083】
第5の実施形態〜第7の実施形態の標的結合部分は、好ましい実施形態では、タンパク質、特に抗体である。タンパク質、特に抗体は、アマトキシンの結合を可能にする幾つかのアミノ酸を含んでいるであろう。好ましいアミノ酸は、遊離のアミノ基、ヒドロキシ基又はカルボニル基を有するものであり、Lys、Gln、Glu、Asp、Asn、Thr及びSerを含む。したがって、2個以上のアマトキシン分子を1個のタンパク質分子と結合することが可能である。1分子当たりのアマトキシン数の増大により、毒性も増大する。したがって、好ましい一実施形態では、第1の実施形態〜第4の実施形態の抗体及び第5の実施形態〜第7の実施形態の標的結合部分対アマトキシンの比は、タンパク質1分子対アマトキシン1分子〜15分子、好ましくは1分子、2分子、3分子、4分子、5分子、6分子、7分子、8分子、9分子、10分子、11分子、12分子、13分子、14分子又は15分子である。二量体IgGのような二量体の場合において比を算出する目的では、二量体は1分子とみなす。標的結合部分がタンパク質ではない場合であっても、同様の比が好ましい。
【0084】
第8の態様の医薬組成物を、全身的に投与される医薬品の形態で使用することができることが特に好ましい。これらは、特に注射剤及び注入剤を含む非経口剤を含む。注射剤は、アンプルの形態で、又はいわゆる即用可能な(ready-for-use)注射剤、例えば即用可能な注射器若しくは使い捨ての注射器として、及びこれに加えて複数回の抜取りを行うための穿刺用フラスコ中に製剤化される。注射剤の投与は、皮下(s.c.)、筋肉内(i.m.)、静脈内(i.v.)又は皮内(i.c.)の適用の形態であり得る。特に、結晶の懸濁液、溶液、ナノ粒子又はコロイド分散系(例えばハイドロゾルのような)としてそれぞれ好適な注射製剤を製造することが可能である。
【0085】
注射用製剤はさらに、水性等張希釈剤を用いて溶解又は分散させることができる濃縮物として製造することができる。注入剤を、等張溶液、脂肪性エマルション、リポソーム製剤及びマイクロエマルションの形態で調製することもできる。注射剤と同様に、注入製剤を、希釈用濃縮物の形態で調製することもできる。注射用製剤を、例えばミニポンプにより、入院療法及び通院療法の両方において持続性注入剤の形態で適用することもできる。
【0086】
例えばアルブミン、血漿、増量剤、界面活性物質、有機希釈剤、pH調整物質(pH-influencing substances)、錯体形成物質若しくは高分子物質を、特にタンパク質若しくは高分子に対する本発明の標的結合部分毒素複合体の吸着に影響を与えるための物質として、非経口薬剤配合物に添加することが可能であり、又は本発明の標的結合部分毒素複合体の吸着を低減させる目的で、注射機器のような材料、若しくは包装用材料、例えばプラスチック若しくはガラスにこれらを添加することもできる。
【0087】
本発明の標的結合部分毒素複合体を、非経口剤におけるマイクロキャリア又はナノ粒子と、例えば、ポリ(メタ)アクリレート、ポリラクテート、ポリグリコレート、ポリアミノ酸又はポリエーテルウレタンに基づく微分散粒子等と結合させることができる。本発明の標的結合部分毒素複合体をそれぞれ微分散形態、分散形態及び懸濁形態で導入する場合、例えば「複数単位原理(multiple unit principle)」に基づき持続性製剤として、又は本発明の標的結合部分毒素複合体を製剤中に、例えば錠剤若しくは棒剤(rod)(その後埋め込まれる)中に封入する場合、医薬品中の結晶の懸濁液として若しくは「単一単位原理」に基づき、非経口製剤を変更することもできる。単一単位製剤及び複数単位製剤のこれらの埋め込み剤又は持続性医薬品は多くの場合、いわゆる生分解性高分子、例えば乳酸及びグリコール酸のポリエステル、ポリエーテルウレタン、ポリアミノ酸、ポリ(メタ)アクリレート、又は多糖等からなる。
【0088】
非経口剤として製剤化される本発明の医薬組成物の製造時に添加される補助剤及び担体は、好ましくは滅菌水(aqua sterilisata(sterilized water))、pH値調整物質、例えば有機酸若しくは無機酸若しくは有機塩基若しくは無機塩基及びそれらの塩等、pH値調整用の緩衝物質、等張化用の物質、例えば塩化ナトリウム、炭酸水素ナトリウム、グルコース及びフルクトース等、それぞれテンシド(tensides)及び界面活性剤、並びに乳化剤、例えばポリオキシエチレンソルビタンの脂肪酸の部分エステル(例えばTween(登録商標))、若しくは例えばポリオキシエチレンの脂肪酸エステル(例えばCremophor(登録商標))等、脂肪油、例えば落花生油、大豆油若しくはヒマシ油等、脂肪酸の合成エステル、例えばオレイン酸エチル、ミリスチン酸イソプロピル及び中性油(例えばMiglyol(登録商標))等、並びに高分子補助剤、例えばゼラチン、デキストラン、ポリビニルピロリドン等、有機溶媒の溶解度を増大させる添加剤、例えばプロピレングリコール、エタノール、N,N−ジメチルアセトアミド、プロピレングリコール等、又は錯体形成物質、例えばシトレート及び尿素等、保存料、例えば安息香酸ヒドロキシプロピルエステル及びメチルエステル、ベンジルアルコール等、抗酸化剤、例えば亜硫酸ナトリウム等、並びに安定化剤、例えばEDTA等である。
【0089】
好ましい一実施形態において懸濁液として本発明の医薬組成物を製剤化する場合、本発明の標的結合部分毒素複合体の硬化を防止するための増粘剤、又はテンシド、及び堆積物の再懸濁能を確保するための高分子電解質、及び/又は錯体形成剤、例えばEDTA等を添加する。様々な高分子との活性成分の複合体を得ることも可能である。かかる高分子の例は、ポリエチレングリコール、ポリスチロール、カルボキシメチルセルロース、Pluronics(登録商標)又はポリエチレングリコールソルビット脂肪酸エステルである。本発明の標的結合部分毒素複合体を、包接化合物(例えばシクロデキストリンによる)の形態で液体製剤中に組み込むこともできる。特定の実施形態では、分散剤を、さらなる補助剤として添加することができる。凍結乾燥物の製造のために、足場剤(scaffolding agents)、例えばマンニット、デキストラン、サッカロース、ヒトアルブミン、ラクトース、PVP、又は様々なゼラチンを使用することができる。
【0090】
さらなる一態様では、本発明は、それを必要とする患者において膵臓がん、胆管癌又は結腸直腸がんを治療する方法であって、第1の態様において規定されるような抗体毒素複合体を有効量該患者に投与することを含む、方法に関する。
【0091】
さらなる一態様では、本発明は、それを必要とする患者において膵臓がん、胆管癌、乳がん又は結腸直腸がんを治療する方法であって、第3の態様において規定されるような抗体毒素複合体を有効量該患者に投与することを含む、方法に関する。
【0092】
さらなる一態様では、本発明は、それを必要とする患者において膵臓がん、胆管癌、乳がん又は結腸直腸がんを治療する方法であって、第5の態様において規定されるような標的結合部分毒素複合体を有効量該患者に投与することを含む、方法に関する。
【実施例】
【0093】
以下で、非限定的な実施例を用いて本発明をより詳細に説明する。
【0094】
実施例1:抗体huHEA125と抗体毒素複合体アマニチン−huHEA125との間の標的細胞に対する結合親和性の比較
1.1 キメラ抗体huHEA125
数年前に、本発明者らは、抗EpCAMマウスモノクローナル抗体HEA125を分泌するハイブリドーマ細胞株を樹立した(Moldenhauer etal., 1987、Momburg et al., 1987)。分子生物学的技法を使用して、このハイブリドーマ株を再構築して、ヒトカッパ定常軽鎖及びヒトIgG1定常重鎖と連結した(hooked up)マウス可変ドメインからなるキメラ型の抗体を作製した。得られた抗体huHEA125は、高親和性(Kd=2.2×10−9M)及び高特異性でEpCAMを発現する細胞と結合する。huHEA125免疫グロブリンの遺伝子配列及びアミノ酸配列を以下に示す:
【0095】
huHEA125重鎖
ペプチド配列 重鎖、膜結合型(IGHV/IGHD/IGHJ/IGHG1;IGHG1に下線を付す)(配列番号1):
EVKLLESGGGLVQPGGSLKLSCAASGFDFSRFWMTWVRQAPGKGLEWIGEINLDSSTINYTPSLKDKFIISRDNAKNTLFLQMSKVRSEDTALYYCSRGISMDYWGQGTSVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGLQLDETCAEAQDGELDGLWTTITIFISLFLLSVCYSAAVTLFKVKWIFSSVVELKQTLVPEYKNMIGQAP
【0096】
ペプチド配列 重鎖、分泌型(配列番号2):
EVKLLESGGGLVQPGGSLKLSCAASGFDFSRFWMTWVRQAPGKGLEWIGEINLDSSTINYTPSLKDKFIISRDNAKNTLFLQMSKVRSEDTALYYCSRGISMDYWGQGTSVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
【0097】
ペプチド配列(IGHV/IGHD/IGHJ=VHドメイン;フレームワーク領域FR1、FR2、FR3及びFR4に下線を付す)(配列番号3):
EVKLLESGGGLVQPGGSLKLSCAASGFDFSRFWMTWVRQAPGKGLEWIGEINLDSSTINYTPSLKDKFIISRDNAKNTLFLQMSKVRSEDTALYYCSRGISMDYWGQGTSVTVSS
【0098】
核酸配列(IMGT命名法に従い注釈される、IGHV/IGHD/IGHJ;IGHDに下線を付す;IGHJに二重下線を付す):
【表1】

【0099】
huHEA125軽鎖
ペプチド配列 軽鎖(IGKV/IGKJ/IGKC;IGKCに下線を付す)(配列番号11):
DILLTQSPAILSVSPGERVSFSCRASQSIGISLHWYQQRPSDSPRLLIKYASESISGIPSRFSGSGSGTDFTLSINSVESEDIADYYCQQSNIWPTTFGAGTKLELKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
【0100】
ペプチド配列(IGKV/IGKJ=VLドメイン;フレームワーク領域FR1、FR2、FR3及びFR4に下線を付す)(配列番号12):
DILLTQSPAILSVSPGERVSFSCRASQSIGISLHWYQQRPSDSPRLLIKYASESISGIPSRFSGSGSGTDFTLSINSVESEDIADYYCQQSNIWPTTFGAGTKLELK
【0101】
核酸配列(IMGT命名法に従い注釈される、IGKV/IGKJ;IGKVに下線を付す;IGKJに二重下線を付す):
【表2】

【0102】
1.2 対照抗体Xolair(登録商標)
対照抗体Xolair(登録商標)(オマリズマブ、ヒトIgE免疫グロブリンに指向性を有するヒトIgG1抗体)は、Novartis(Germany)により製造されたものである。
【0103】
1.3 α−アマニチン抗体複合体の合成
1.3.1 α−アマニチン−グルタレートの合成
P4O10で真空乾燥した3.0mg(3.3μmol)のα−アマニチンを、0.25mlの乾燥ピリジンに溶解し、0.1mlのピリジン中の0.9mg(79μmol)のグルタル酸無水物と、暗所にて室温で24時間反応させた。ペプチドを、7mlの乾燥ジエチルエーテルの添加により沈殿させ、遠心分離し、固体を再度ジエチルエーテルで洗浄し、遠心分離した。
【0104】
この反応により、R1=−OH(図1における)がR1=−O−C(O)−(CH2)3−COOHにより置き換えられたα−アマニチン誘導体が得られる。
【0105】
1.3.2 α−アマニチン−グルタル酸N−ヒドロキシスクシンイミデートの合成
3.4mgのα−アマニチングルタレート(3.3μmol)を0.05mlの乾燥ジメチルホルムアミド(DMF)に溶解し、0.01mlのDMFに溶解した2.4mg(7等量)のN−ヒドロキシ−スクシンイミドを添加した。0.01mlのDMF中の1.2mgのジシクロヘキシルカルボジイミドの添加後、反応を室温で16時間進行させた。形成した結晶と溶液を分離し、4mlの乾燥ジエチルエーテルの添加によりペプチドを沈殿させた。遠心分離後、ペレットをさらに4mlのエーテルで洗浄し、遠心分離した。固体を0.1mlのジメチルホルムアミドに溶解し、直ちに抗体溶液との反応に使用した。
【0106】
1.3.3 α−アマニチン−グルタレート−huHEA125の合成
3.0mgのα−アマニチン−グルタル酸N−ヒドロキシスクシンイミデートの溶液0.1mlを、5mlのPBS中の10mgのhu−HEA125抗体に添加し、暗所にて5℃でゆっくりと回転させながら反応させた。16時間後、溶液をPBSで平衡化したSephadex G25カラム(120×1.5cm)にアプライし、タンパク質画分を収集した。アマニチン負荷量を、アマトキシンに関するモル吸光係数13,500cm−1M−1を使用して、同濃度の未反応(native)抗体を含有するブランクに対するタンパク質溶液の310nmでの吸光度の差異から分光光度的に決定した。この調製物のα−アマニチン:IgG比は、約8であった。
【0107】
1.4 結合競合分析
アマニチン−huHEA125複合体対複合体形成していないhuHEA125抗体の結合を、フローサイトメトリーにより競合実験において分析した。α−アマニチン−huHEA125複合体を、1.3.1節〜1.3.3節において上で記載されるように合成した。
【0108】
Colo205標的細胞(結腸がん転移)を、FACS緩衝液(1%の熱失活させたウシ胎児血清及び0.1%のアジ化ナトリウムを有するダルベッコPBS)で2回洗浄し、細胞の数を数え、1ml当たりの細胞数2×107個に調整した。50μlの細胞懸濁液を、50μl/ウェルのFITC標識したhuHEA125抗体をピペット添加した96ウェルU底マイクロタイタープレートの各ウェルに加えた。400μg/ml〜10ng/ml(最終希釈液)の範囲のアマニチン−huHEA125又はhuHEA125の段階希釈液を、50μl/ウェルの容量で三連で添加し、氷上で1時間インキュベートした。その後、プレートを遠心分離し(2000rpmで2分)、上清を細胞から除去した。細胞を150μlのFACS緩衝液に再懸濁し、再度遠心分離した。遠心分離による2回の洗浄工程の後、細胞を100μl/ウェルのヨウ化プロピジウム溶液(FACS緩衝液中1μg/ml)中に移し、死細胞を判別した。分析を、CellQuestソフトウェアを使用するFACScanサイトメーター(Becton and Dickinson(Heidelberg, Germany))で行った。
【0109】
図2に示されるように、漸増量のhuHEA125−アマニチン複合体又は非改変huHEA125抗体による標的細胞に対する結合の競合により、競合する抗体又は抗体複合体の10ng/ml〜400μg/mlの全濃度範囲にわたる同程度の結合強度が明らかとなった。したがって、複合体形成手順は、標的細胞に対するhuHEA125−アマニチンの親和性を顕著には変化させない。
【0110】
実施例2:間接的な免疫蛍光により検出される様々な癌細胞株上におけるEpCAM抗原の表面発現
初めに、細胞株Capan−1、Colo205、OZ、MCF−7、BxPC−3及びPC−3を、huHEA125又はXolair(登録商標)と共にインキュベートした。洗浄後、一次抗体の結合を、第2工程の試薬としてのFITC標識したヤギ抗ヒトIgG(H+L)のF(ab’)2により可視化した。結果を、図3A(Capan−1)、図3B(Colo205)、図3C(OZ)、図3D(MCF−7)、図3E(BxPC−3)及び図3F(PC−3)に示す。各図の左側における灰色の影付きのヒストグラムは、対照抗体Xolair(登録商標)により得られた結果を示す。各図の右側における白色の領域を有するヒストグラムは、抗体huHEA125により得られた結果を示す。
【0111】
実施例3:アマニチン及びアマニチン/抗体複合体による癌細胞増殖阻害の誘導
3.1 癌細胞株
以下の癌細胞株を成長阻害研究のために使用した:
Capan−1、BxPC−3 ヒト膵臓腺癌
MCF−7 ヒト乳腺癌
Colo205 ヒト結腸がん転移
OZ ヒト胆管癌
PC−3 ヒト前立腺腺癌
【0112】
3.2 増殖阻害アッセイ
アマニチン−IgG複合体による細胞成長の阻害を、[3H]−チミジンの取り込みにより決定した。完全培地(10%の熱失活させたFCS、2mMのL−グルタミン、及び1mMのピルビン酸ナトリウムを添加したRPMI1640)中における2×10−5M〜6×10−13Mの範囲のアマニチン−huHEA125、アマニチン−Xolair、及び遊離のアマニチンの段階希釈液を、96ウェル平底組織培養マイクロタイタープレートのウェルにおける100μlの容量で三連で調製した。細胞を、1ml当たり2×104個の密度、1ウェル当たり50μlの容量で添加した。プレートを、加湿雰囲気中、37℃及び5%CO2下で72時間又は96時間インキュベートした。アッセイ終了の20時間前に、1μCiの[3H]−チミジンを添加した。その後、プレートをTomtecセルハーベスターにより処理し、取り込まれた放射活性を液体シンチレーション計測(Wallac Betaplate Liquid Scintillation Counter(PerkinElmer Life and Analytical Sciences))により決定し、cpmで表した。
【0113】
膵臓癌細胞株Capan−1の場合には、huHEA125−アマニチン免疫毒素は、図4に示されるように1×10−11M〜3×10−10Mのアマニチン濃度で成長停止を誘導した。
【0114】
結腸がん細胞株Colo205の場合には、huHEA125−アマニチン免疫毒素は、図5に示されるように1×10−12M〜4×10−11Mのアマニチン濃度で成長停止を誘導した。
【0115】
乳がん細胞株MCF−7の場合には、huHEA125−アマニチン免疫毒素は、図6に示されるように1×10−12M〜1×10−11Mのアマニチン濃度で成長停止を誘導した。
【0116】
胆管癌細胞株OZの場合には、huHEA125−アマニチン免疫毒素は、図7に示されるように1×10−11M〜6×10−10Mのアマニチン濃度で成長停止を誘導した。
【0117】
膵臓細胞株BxPC−3の場合には、huHEA125−アマニチン免疫毒素は、図8に示されるように2×10−11M〜6×10−10Mのアマニチン濃度で成長停止を誘導した。
【0118】
実施例4:2つの異種移植マウス腫瘍モデルを使用するアマニチン/抗体複合体によるin vivoでの腫瘍の成長の阻害
5週齢〜6週齢の免疫不全NOD/SCIDマウスを全実験に使用した。BxPC−3膵臓腫瘍細胞又はPC−3前立腺腫瘍細胞(100μl PBS中5×106個)を、マウスの右側腹部の皮下に移植した。10日後、BxPC−3腫瘍が30mm3〜80mm3の体積に到達し、PC−3腫瘍が40mm3〜190mm3の体積に到達した時に、処理を開始した。動物に、対照huHEA125モノクローナル抗体を15mg/kgの用量で、又はhuHEA125−アマニチン複合体(huHEA125−Ama)を50μg/kgのアマニチンの用量で投与した。抗体及び複合体は、単回腹腔内注射剤として投与した。
【0119】
腫瘍の成長を、処理の開始後16日間モニタリングした。3日に1回、ノギスを使用して外側から腫瘍サイズを測定した。式:V=π/6×a×b×c(式中、a、b及びcは三次元における直径である)に従って腫瘍体積を算出した。データを、抗体投与時からの相対的な腫瘍サイズ/体積の増大として表す。
【0120】
50μg/kgのアマニチンの用量でのhuHEA125−Amaの投与は、BxPC−3腫瘍を保有するマウスで耐容性が良好であった(n=6)。マウスの体重の減少も、肝酵素の上昇も起こらなかった(実験の最終日に血清中のLDH、ALT、AST及びAPを測定した)。腫瘍の成長は、この用量の複合体により強く阻害された。全てのマウスが処理に応答し、腫瘍体積は複合体の投与後7日目から劇的に消失した。16日目の経過観察の終了時に、腫瘍は50%のマウスにおいて完全に根絶された。対照的に、複合体形成していないhuHEA125モノクローナル抗体を投与された対照マウスでは、腫瘍体積はおよそ880%増大した(図9)。
【0121】
PC−3腫瘍を保有するマウスの場合には、50μg/kgのアマニチンの用量のhuHEA125−Amaは耐容性が良好であった。マウスの体重の減少は観察されなかった。腫瘍の成長はこの用量の複合体により大幅に遅延化した。huHEA125−Ama投与の10日後、腫瘍体積は、処理の開始時の腫瘍体積と同様であった。対照的に、複合体形成していないhuHEA125モノクローナル抗体を投与された対照マウスでは、腫瘍体積はおよそ550%増大した。実験は、対照群の腫瘍サイズが大きいために処理後10日目で終了した(図10)。
【0122】
引用文献
Al-Hajj M., Wicha M.S., Benito-Hernandez A., Morrison S.J., ClarkeM.F. Prospective identification of tumorigenic breast cancer cells. Proc. Natl.Acad. Sci. USA100(7), 3983-3988 (2003)
Allard W.J., Matera J., Miller M.C., Repollet M., Connelly M.C.,Rao C., Tibbe A.G., Uhr J.W., Terstappen L.W. Tumor cells circulate in theperipheral blood of all major carcinomas but not in healthy subjects orpatients with nonmalignant diseases. Clin. Cancer Res. 10(20), 6897-6904 (2004)
Baeuerle P.A. and Gires O. EpCAM (CD326) finding its role incancer. Br. J. Cancer 96(3), 417-423 (2007)
Balzar M., Winter M.J., de Boer C.J., Litvinov S.V. The biology ofthe 17-1A antigen (Ep-CAM). J. Mol. Med. 77(10), 699-712 (1999)
Binz H.K., Amstutz P., Plueckthun A. Engineering novel bindingproteins from nonimmunoglobulin domains. Nat Biotechnol. 23(10):1257-1268(2005)
Brody E.N. and Gold L., Aptamers as therapeutic and diagnosticagents. J. Biotechnol. 74(1):5-13 (2000)
Dalerba P., Dylla S.J., Park I.K., Liu R., Wang X., Cho R.W., HoeyT., Gurney A., Huang E.H., Simeone D.M., Shelton A.A., Parmiani G., CastelliC., Clarke M.F. Phenotypic characterization of human colorectal cancer stemcells. Proc. Natl. Acad. Sci. USA 104(24), 10158-10163 (2007)
Gastl G., Spizzo G., Obrist P., Duenser M., Mikuz G. Ep-CAMoverexpression in breast cancer as a predictor of survival. Lancet 356(9246),1981-1982 (2000)
Holliger P., Prospero T., Winter G. "Diabodies": smallbivalent and bispecific antibody fragments. Proc. Natl. Acad. Sci. U.S.A.90(14), 6444-6448 (1993)
Leuenberger, H.G.W, Nagel, B. and Koelbl, H.eds. "Amultilingual glossary of biotechnological terms: (IUPAC Recommendations)",Helvetica Chimica Acta, CH-4010 Basel, Switzerland), 1995
Li C., Heidt D.G., Dalerba P., Burant C.F., Zhang L., Adsay V.,Wicha M., Clarke M.F., Simeone D.M. Identification of pancreatic cancer stemcells. Cancer Res. 67(3), 1030-1037 (2007)
Moldenhauer G., Momburg F., Moeller P., Schwartz R., HaemmerlingG.J. Epithelium-specific surface glycoprotein of Mr 34,000 is a widelydistributed human carcinoma marker. Br. J. Cancer 56(6), 714-721 (1987)
Momburg F., Moldenhauer G., Haemmerling G.J., Moeller P.Immunohistochemical study of the expression of a Mr 34,000 humanepithelium-specific surface glycoprotein in normal and malignant tissues.Cancer Res. 47(11), 2883-2891 (1987)
Nagrath S., Sequist L.V., Maheswaran S., Bell D.W., Irimia D.,Ulkus L., Smith M.R., Kwak E.L., Digumarthy S., Muzikansky A., Ryan P., BalisU.J., Tompkins R.G., Haber D.A., Toner M. Isolation of rare circulating tumourcells in cancer patients by microchip technology. Nature 450(7173), 1235-1239(2007)
Spizzo G., Obrist P., Ensinger C., Theurl I., Duenser M., RamoniA., Gunsilius E., Eibl G., Mikuz G., Gastl G. Prognostic significance of Ep-CAMAND Her-2/neu overexpression in invasive breast cancer. Int. J. Cancer 98(6),883-888 (2002)
Spizzo G., Went P., Dirnhofer S., Obrist P., Simon R., SpichtinH., Maurer R., Metzger U., von Castelberg B., Bart R., Stopatschinskaya S., KoechliO.R., Haas P., Mross F., Zuber M., Dietrich H., Bischoff S., Mirlacher M.,Sauter G., Gastl G. High Ep-CAM expression is associated with poor prognosis innode-positive breast cancer. Breast Cancer Res. Treat. 86(3), 207-213 (2004)
Trzpis M., McLaughlin P.M., de Leij L.M., Harmsen M.C. Epithelialcell adhesion molecule: more than a carcinoma marker and adhesion molecule. Am.J. Pathol. 171(2), 386-395 (2007)
Varga M., Obrist P., Schneeberger S., Muehlmann G.,Felgel-Farnholz C., Fong D., Zitt M., Brunhuber T., Schaefer G., Gastl G.,Spizzo G. Overexpression of epithelial cell adhesion molecule antigen ingallbladder carcinoma is an independent marker for poor survival. Clin. CancerRes. 10(9), 3131-3136 (2004)
Went P.T., Lugli A., Meier S., Bundi M., Mirlacher M., Sauter G.,Dirnhofer S. Frequent EpCam protein expression in human carcinomas. Hum.Pathol. 35(1), 122-128, 2004
Wieland, T. and Faulstich H. Amatoxins, phallotoxins, phallolysin,and antamanide: the biologically active components of poisonous Amanitamushrooms. CRC Crit. Rev. Biochem. 5(3), 185-260 (1978)
Winter M.J., Nagtegaal I.D., van Krieken J.H., Litvinov S.V. Theepithelial cell adhesion molecule (Ep-CAM) as a morphoregulatory molecule is atool in surgical pathology. Am. J. Pathol. 163(6), 2139-2148 (2003)
【0123】
配列リスト−フリーテキストの情報
配列番号1:キメラ抗体huHEA125、重鎖、膜結合型
配列番号2:キメラ抗体huHEA125、重鎖、分泌型
配列番号3:キメラ抗体huHEA125、重鎖、VHドメイン
配列番号4:キメラ抗体huHEA125、重鎖、FR1セグメント
配列番号5:キメラ抗体huHEA125、重鎖、CDR1セグメント
配列番号6:キメラ抗体huHEA125、重鎖、FR2セグメント
配列番号7:キメラ抗体huHEA125、重鎖、CDR2セグメント
配列番号8:キメラ抗体huHEA125、重鎖、FR3セグメント
配列番号9:キメラ抗体huHEA125、重鎖、CDR3セグメント
配列番号10:キメラ抗体huHEA125、重鎖、FR4セグメント
配列番号11:キメラ抗体huHEA125、軽鎖
配列番号12:キメラ抗体huHEA125、軽鎖、VLドメイン
配列番号13:キメラ抗体huHEA125、軽鎖、FR1セグメント
配列番号14:キメラ抗体huHEA125、軽鎖、CDR1セグメント
配列番号15:キメラ抗体huHEA125、軽鎖、FR2セグメント
配列番号16:キメラ抗体huHEA125、軽鎖、CDR2セグメント
配列番号17:キメラ抗体huHEA125、軽鎖、FR3セグメント
配列番号18:キメラ抗体huHEA125、軽鎖、CDR3セグメント
配列番号19:キメラ抗体huHEA125、軽鎖、FR4セグメント
配列番号20:キメラ抗体huHEA125、重鎖、CDR1ドメイン
配列番号21:キメラ抗体huHEA125、重鎖、CDR2ドメイン
配列番号22:キメラ抗体huHEA125、重鎖、CDR3ドメイン
配列番号23:キメラ抗体huHEA125、軽鎖、CDR1ドメイン
配列番号24:キメラ抗体huHEA125、軽鎖、CDR2ドメイン
配列番号25:キメラ抗体huHEA125、軽鎖、CDR3ドメイン
配列番号26:キメラ抗体huHEA125、重鎖、定常ドメイン、膜結合型
配列番号27:キメラ抗体huHEA125、重鎖、定常ドメイン、分泌型
配列番号28:キメラ抗体huHEA125、軽鎖、定常ドメイン
【技術分野】
【0001】
本発明は、腫瘍療法に関する。一態様では、本発明は、がんの治療において有用な標的結合部分及び毒素の複合体に関する。特に、毒素はアマトキシンであり、標的結合部分(例えば抗体)は腫瘍関連抗原、例えば上皮細胞接着分子(EpCAM)に指向性を有する。さらなる一態様では、本発明は、かかる標的結合部分毒素複合体を含む医薬組成物に、及びかかる医薬組成物の調製のためのかかる標的結合部分毒素複合体の使用に関する。本発明の標的結合部分毒素複合体及び医薬組成物は、がん、特に腺癌、例えば膵臓がん、胆管癌、乳がん及び結腸直腸がんの治療に有用である。
【背景技術】
【0002】
アマトキシン
アマトキシンは、8個のアミノ酸から構成される環状ペプチドである。アマトキシンは、タマゴテングダケ(Amanita phalloides)というキノコから単離することができ、又は合成により基本単位から調製することができる。アマトキシンは、哺乳動物細胞のDNA依存性RNAポリメラーゼIIを特異的に阻害し、それにより影響を受けた細胞の転写及びタンパク質生合成も特異的に阻害する。細胞における転写の阻害により、成長及び増殖の停止が引き起こされる。共有結合してはいないが、アマニチンとRNAポリメラーゼIIとの間の複合体は非常に堅固である(KD=3nM)。この酵素からのアマニチンの解離は、影響を受けた細胞の回復を起こりにくくする非常にゆっくりとしたプロセスである。転写の阻害があまりにも長く続くと、細胞はプログラム細胞死(アポトーシス)を被る。
【0003】
上皮細胞接着分子
上皮細胞接着分子(EpCAM、CD326)は、最も良く研究されているヒト腫瘍上の標的抗原の1つである(非特許文献1、非特許文献2)。上皮細胞接着分子は、見かけの分子量40kDa、アミノ酸数314のI型膜糖タンパク質である(非特許文献3)。上皮細胞接着分子は大部分の腺癌において過剰発現する(非特許文献4、非特許文献5)。特に、EpCAMの発現は、リンパ節陽性乳がん、上皮性卵巣がん、胆管癌、膵臓腺癌及び扁平上皮細胞頭頚部がんにおいて増強される。EpCAMの発現の増大は、乳癌及び胆嚢癌における予後不良の指標となる(非特許文献6、非特許文献7、非特許文献8、非特許文献9)。重要なことには、EpCAMは、乳癌、結腸直腸癌及び膵臓癌において腫瘍開始細胞又はがん幹細胞により発現される(非特許文献10、非特許文献11、非特許文献12)。
【0004】
EpCAM特異的モノクローナル抗体は、がん患者における希少な循環腫瘍細胞の検出のための診断ツールとして使用されている(非特許文献13、非特許文献14)。現在のところ、2種類〜3種類の改変抗EpCAM抗体が臨床研究において調査されている。
【0005】
アマトキシン及び抗体の複合体
本発明者らによる先の特許出願(特許文献1)(2007年11月28日に公開された)は、β−アマニチンをアルブミンと、又はモノクローナル抗体HEA125、OKT3及びPA−1と結合させた複合体を記載している。さらに、乳がん細胞(MCF−7)、バーキットリンパ腫細胞(ラージ細胞)及びT−リンパ腫細胞(ジャーカット細胞)の増殖に対するこれらの複合体の阻害効果が研究された。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】欧州特許第1859811号
【非特許文献】
【0007】
【非特許文献1】Trzpis M., McLaughlin P.M., de Leij L.M., Harmsen M.C. Epithelial cell adhesion molecule: more than a carcinoma marker and adhesion molecule. Am. J. Pathol. 171(2), 386-395 (2007)
【非特許文献2】Baeuerle P.A. and Gires O. EpCAM (CD326) finding its role in cancer. Br. J. Cancer 96(3), 417-423 (2007)
【非特許文献3】Balzar M., Winter M.J., de Boer C.J., Litvinov S.V. The biology of the 17-1A antigen (Ep-CAM). J. Mol. Med. 77(10), 699-712 (1999)
【非特許文献4】Winter M.J., Nagtegaal I.D., van Krieken J.H., Litvinov S.V. The epithelial cell adhesion molecule (Ep-CAM) as a morphoregulatory molecule is a tool in surgical pathology. Am. J. Pathol. 163(6), 2139-2148 (2003)
【非特許文献5】Went P.T., Lugli A., Meier S., Bundi M., Mirlacher M., Sauter G., Dirnhofer S. Frequent EpCam protein expression in human carcinomas. Hum. Pathol. 35(1), 122-128, 2004
【非特許文献6】Gastl G., Spizzo G., Obrist P., Duenser M., Mikuz G. Ep-CAM overexpression in breast cancer as a predictor of survival. Lancet 356(9246), 1981-1982 (2000)
【非特許文献7】Varga M., Obrist P., Schneeberger S., Muehlmann G., Felgel-Farnholz C., Fong D., Zitt M., Brunhuber T., Schaefer G., Gastl G., Spizzo G. Overexpression of epithelial cell adhesion molecule antigen in gallbladder carcinoma is an independent marker for poor survival. Clin. Cancer Res. 10(9), 3131-3136 (2004)
【非特許文献8】Spizzo G., Obrist P., Ensinger C., Theurl I., Duenser M., Ramoni A., Gunsilius E., Eibl G., Mikuz G., Gastl G. Prognostic significance of Ep-CAM AND Her-2/neu overexpression in invasive breast cancer. Int. J. Cancer 98(6), 883-888 (2002)
【非特許文献9】Spizzo G., Went P., Dirnhofer S., Obrist P., Simon R., Spichtin H., Maurer R., Metzger U., von Castelberg B., Bart R., Stopatschinskaya S., Koechli O.R., Haas P., Mross F., Zuber M., Dietrich H., Bischoff S., Mirlacher M., Sauter G., Gastl G. High Ep-CAM expression is associated with poor prognosis in node-positive breast cancer. Breast Cancer Res. Treat. 86(3), 207-213 (2004)
【非特許文献10】Al-Hajj M., Wicha M.S., Benito-Hernandez A., Morrison S.J., Clarke M.F. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. USA 100(7), 3983-3988 (2003)
【非特許文献11】Dalerba P., Dylla S.J., Park I.K., Liu R., Wang X., Cho R.W., Hoey T., Gurney A., Huang E.H., Simeone D.M., Shelton A.A., Parmiani G., Castelli C., Clarke M.F. Phenotypic characterization of human colorectal cancer stem cells. Proc. Natl. Acad. Sci. USA 104(24), 10158-10163 (2007)
【非特許文献12】Li C., Heidt D.G., Dalerba P., Burant C.F., Zhang L., Adsay V., Wicha M., Clarke M.F., Simeone D.M. Identification of pancreatic cancer stem cells. Cancer Res. 67(3), 1030-1037 (2007)
【非特許文献13】Allard W.J., Matera J., Miller M.C., Repollet M., Connelly M.C., Rao C., Tibbe A.G., Uhr J.W., Terstappen L.W. Tumor cells circulate in the peripheral blood of all major carcinomas but not in healthy subjects or patients with nonmalignant diseases. Clin. Cancer Res. 10(20), 6897-6904 (2004)
【非特許文献14】Nagrath S., Sequist L.V., Maheswaran S., Bell D.W., Irimia D., Ulkus L., Smith M.R., Kwak E.L., Digumarthy S., Muzikansky A., Ryan P., Balis U.J., Tompkins R.G., Haber D.A., Toner M. Isolation of rare circulating tumour cells in cancer patients by microchip technology. Nature 450(7173), 1235-1239 (2007)
【発明の概要】
【発明が解決しようとする課題】
【0008】
従来技術には、非常に低い濃度で標的細胞又は標的組織に対してその毒性効果を発揮する標的結合部分毒素複合体に対する必要性が存在していた。さらに、従来技術には、他の種類の疾患の治療に対する、特に他の種類のがん、特に治療法に抵抗性を有するもの、又は実際の腫瘍療法にあまり応答しないものの治療に対する必要性が依然として存在していた。
【0009】
本発明は、これらの及び他の必要性を満たす。例えば本発明者らは、本発明の基礎となる実験において、アマトキシン及び新たなキメラ抗体huHEA125を含む複合体が、従来技術に記載される複合体よりずっと低い濃度で腫瘍細胞の増殖を阻害することが可能であることを見出した。特に、アマトキシン及びキメラ抗体huHEA125を含む複合体は、従来技術の複合体を使用する場合に必要とされる濃度の約100分の1の濃度でその阻害効果を発揮する。さらに、本発明者らは、アマトキシン及びEpCAM特異的抗体を含む複合体が、乳がん細胞の増殖を阻害することができるだけでなく、驚くべきことに膵臓腺癌細胞、結腸直腸がん細胞及び胆管癌細胞の増殖を阻害することも可能であることを発見した。さらに、本発明者らは、複合体のアマトキシン部分において特定の連結点を選択することにより、非常に低い濃度(2×10−12M〜2×10−11M前後のIC50)で標的細胞に対してその毒性活性を発揮し、その標的細胞に対して高度に特異的である非常に効果的な標的結合部分毒素複合体(特に抗体毒素複合体)がもたらされることを見出した。特定の理論に拘束されることを望むものではないが、この後者の利点は、アマトキシンが標的細胞の外側ではなく標的細胞の内側で標的結合部分アマトキシン複合体から効率的に放出されるという点で説明することができよう。
【0010】
上の概説は必ずしも、本発明により解決される全ての課題を記載している訳ではない。
【課題を解決するための手段】
【0011】
第1の態様では、本発明は、患者における膵臓がん、胆管癌又は結腸直腸がんの治療のための抗体毒素複合体であって、(i)上皮細胞接着分子(EpCAM)のエピトープと特異的に結合する抗体又はその抗原結合断片、(ii)アマトキシン、及び(iii)任意にリンカーL1を含む、抗体毒素複合体に関する。
【0012】
第2の態様では、本発明は、抗体毒素複合体であって、(i)上皮細胞接着分子(EpCAM)と特異的に結合する抗体又はその抗原結合断片であって、(a)huHEA125の重鎖であって、(a1)配列番号1に記載の膜結合型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含み、配列番号26に示されるような重鎖の定常ドメインが、0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含む、膜結合型の重鎖、並びに(a2)配列番号2に記載の可溶型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含み、配列番号27に示されるような重鎖の定常ドメインが、0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含む、可溶型の重鎖からなる群から選択される、huHEA125の重鎖、並びに(b)配列番号11に記載のhuHEA125の軽鎖であって、配列番号12に示されるような軽鎖の可変ドメインVLが、VLのフレームワーク領域に位置する0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含み、配列番号28に示されるような軽鎖の定常ドメインCLが、0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含む、huHEA125の軽鎖を含む、抗体又はその抗原結合断片、(ii)アマトキシン、並びに(iii)任意にリンカーL2を含む、抗体毒素複合体に関する。
【0013】
第3の態様では、本発明は、医療における使用のための第2の態様による抗体毒素複合体に関する。
【0014】
第4の態様では、本発明は、患者におけるがんの治療のための第2の態様による抗体毒素複合体であって、該がんが、膵臓がん、胆管癌、乳がん及び結腸がんからなる群から選択される、抗体毒素複合体に関する。
【0015】
第5の態様では、本発明は、標的結合部分毒素複合体であって、(i)標的結合部分、(ii)アマトキシン、及び(iii)任意にリンカーL3を含み、アマトキシンが、アマトキシンのアミノ酸3のδC原子を介して、標的結合部分と、又は存在する場合リンカーL3と連結される、標的結合部分毒素複合体に関する。
【0016】
第6の態様では、本発明は、医療における使用のための第5の態様による標的結合部分毒素複合体に関する。
【0017】
第7の態様では、本発明は、患者におけるがんの治療のための第5の態様による標的結合部分毒素複合体であって、該がんが、膵臓がん、胆管癌、乳がん、結腸直腸がん、肺がん、前立腺がん、卵巣がん、胃がん、腎臓がん、悪性黒色腫、白血病及び悪性リンパ腫からなる群から選択される、標的結合部分毒素複合体に関する。
【0018】
第8の態様では、本発明は、第1の態様若しくは第2の態様による抗体毒素複合体、又は第5の態様による標的結合部分毒素複合体を含み、1つ又は複数の薬学的に許容可能な希釈剤、担体、賦形剤、充填剤、結合剤、滑剤、流動促進剤、崩壊剤、吸着剤、及び/又は保存料をさらに含む医薬組成物に関する。
【0019】
この本発明の概要は必ずしも、本発明の全ての特徴を記載している訳ではない。
【図面の簡単な説明】
【0020】
【図1】種々のアマトキシンの構造式を示す図である。太字の番号(1〜8)は、アマトキシンを形成する8個のアミノ酸の標準的な番号付けを示す。アミノ酸3における最も重要な炭素原子を、ギリシャ文字α、β、γ及びδを付して表示する。(置換された)トリプトファン(すなわちアミノ酸番号4)の側鎖の原子にも番号を示す(番号1’〜7’)。
【図2】結合競合分析による標的細胞に対するhuHEA125−Ama及びhuHEA125の結合親和性の比較を示す図である。EpCAMを発現するColo205細胞を、固定量の直接FITC標識したマウスHEA125抗体と共にインキュベートした。フローサイトメトリーにより標的細胞との結合を分析した。漸増量のhuHEA125−Ama又はhuHEA125による結合の競合により、標的抗原に対する非常に類似した親和性が明らかとなった。
【図3A】間接的な免疫蛍光により検出されるCapan−1(ヒト膵臓腺癌)株上におけるEpCAM抗原の表面発現を示す図である。図の左側における灰色の影付きのヒストグラムは、対照抗体Xolair(登録商標)により得られた結果を示す。図の右側における白色の領域を有するヒストグラムは、抗体huHEA125により得られた結果を示す。
【図3B】間接的な免疫蛍光により検出されるColo205(ヒト結腸腺癌)株上におけるEpCAM抗原の表面発現を示す図である。図の左側における灰色の影付きのヒストグラムは、対照抗体Xolair(登録商標)により得られた結果を示す。図の右側における白色の領域を有するヒストグラムは、抗体huHEA125により得られた結果を示す。
【図3C】間接的な免疫蛍光により検出されるOZ(ヒト胆管癌)株上におけるEpCAM抗原の表面発現を示す図である。図の左側における灰色の影付きのヒストグラムは、対照抗体Xolair(登録商標)により得られた結果を示す。図の右側における白色の領域を有するヒストグラムは、抗体huHEA125により得られた結果を示す。
【図3D】間接的な免疫蛍光により検出されるMCF−7(ヒト乳腺癌株)株上におけるEpCAM抗原の表面発現を示す図である。図の左側における灰色の影付きのヒストグラムは、対照抗体Xolair(登録商標)により得られた結果を示す。図の右側における白色の領域を有するヒストグラムは、抗体huHEA125により得られた結果を示す。
【図3E】間接的な免疫蛍光により検出されるBxPC−3(ヒト膵臓腺癌)株上におけるEpCAM抗原の表面発現を示す図である。図の左側における灰色の影付きのヒストグラムは、対照抗体Xolair(登録商標)により得られた結果を示す。図の右側における白色の領域を有するヒストグラムは、抗体huHEA125により得られた結果を示す。
【図3F】間接的な免疫蛍光により検出されるPC−3(ヒト前立腺腺癌)株上におけるEpCAM抗原の表面発現を示す図である。図の左側における灰色の影付きのヒストグラムは、対照抗体Xolair(登録商標)により得られた結果を示す。図の右側における白色の領域を有するヒストグラムは、抗体huHEA125により得られた結果を示す。
【図4】アマニチンと複合体形成した(Amanitin-armed)抗体huHEA125、アマニチンと複合体形成した対照抗体Xolair(登録商標)、及び遊離のアマニチンによりもたらされるCapan−1細胞の増殖の阻害の比較を示す図である。
【図5】アマニチンと複合体形成した抗体huHEA125、アマニチンと複合体形成した対照抗体Xolair(登録商標)、及び遊離のアマニチンによりもたらされるColo205細胞の増殖の阻害の比較を示す図である。
【図6】アマニチンと複合体形成した抗体huHEA125、アマニチンと複合体形成した対照抗体Xolair(登録商標)、及び遊離のアマニチンによりもたらされるMCF−7細胞の増殖の阻害の比較を示す図である。
【図7】アマニチンと複合体形成した抗体huHEA125、アマニチンと複合体形成した対照抗体Xolair(登録商標)、及び遊離のアマニチンによりもたらされるOZ細胞の増殖の阻害の比較を示す図である。
【図8】比較のためのアマニチンと複合体形成した抗体huHEA125、及びアマニチンと複合体形成した対照抗体Xolair(登録商標)、及び遊離のアマニチンによりもたらされるBxPC−3細胞の増殖の阻害を示す図である。
【図9】huHEA125−アマニチン処理後のNOD/SCIDマウスにおけるBxPC−3腫瘍異種移植片の成長阻害を示す図である。
【図10】huHEA125−アマニチン処理後のNOD/SCIDマウスにおけるPC−3腫瘍異種移植片の成長阻害を示す図である。
【発明を実施するための形態】
【0021】
定義
本発明を以下で詳細に記載する前に、本明細書中に記載する特定の方法論、プロトコル及び試薬は変動し得るので、本発明はこれらに限定されないことを理解すべきである。本明細書中で使用される専門用語が、特定の実施形態を記載するためのものにすぎず、添付した特許請求の範囲のみによって限定される本発明の範囲を限定することは意図されないことも理解すべきである。他に定義されない限り、本明細書中で使用される全ての技術用語及び科学用語は、当業者により一般的に理解されるのと同じ意味を有する。
【0022】
好ましくは、本明細書中で使用される用語は、"A multilingual glossary of biotechnological terms: (IUPACRecommendations)", Leuenberger, H.G.W, Nagel, B.and Koelbl, H. eds. (1995), Helvetica Chimica Acta, CH-4010 Basel, Switzerlandに記載されているように定義される。
【0023】
以下の本明細書及び添付の特許請求の範囲を通じて、文脈上他に必要な場合以外は、「を含む(comprise)」という単語、並びに「を含む(comprises)」及び「を含む(comprising)」等の変化形は、記載された整数若しくは工程、又は整数若しくは工程の群を包含することを示唆するが、任意の他の整数若しくは工程、又は整数若しくは工程の群を除外することを示唆しないと理解される。
【0024】
複数の文書が、本明細書の文章全体を通じて引用される。本明細書中で引用される文書(全ての特許、特許出願、科学的刊行物、製造業者の仕様書、取扱説明書、GenBankアクセッション番号配列提出書(submissions)等を含む)の各々が、上記のものであるか又は下記のものであるかに関わらず、その全体が参照により本明細書に援用される。本明細書のどの記載も、本発明が従来の発明に基づくかかる開示に先行する権利を有しないことを認めるものと解釈すべきではない。
【0025】
本明細書で使用する場合の「標的結合部分」という用語は、標的分子又は標的エピトープと特異的に結合することができる任意の分子又は分子の一部を表す。本願との関連では好ましい標的結合部分は、(i)抗体又はその抗原結合断片、(ii)抗体様タンパク質、及び(iii)核酸アプタマーである。本発明における使用に好適な「標的結合部分」は、典型的には40000Da(40kDa)以上の分子質量を有する。
【0026】
本願との関連ではそれぞれ「標的分子」及び「標的エピトープ」という用語は、標的結合部分が特異的に結合する抗原及び抗原のエピトープをそれぞれ表し、好ましくは標的分子は、腫瘍関連抗原、特に非腫瘍細胞の表面と比較して高い濃度で及び/又は異なる立体配置で1つ又は複数の腫瘍細胞型の表面上に存在する抗原又はエピトープである。好ましくは、上記抗原又は上記エピトープは、1つ又は複数の腫瘍細胞型の表面上に存在するが、非腫瘍細胞の表面上には存在しない。
【0027】
本明細書で使用する場合の「抗体又はその抗原結合断片」という用語は、免疫グロブリン分子及び免疫グロブリン分子の免疫学的に活性な部分、すなわち抗原を免疫特異的に結合する抗原結合部位を含有する分子を表す。例えば標的分子と、例えば標的タンパク質EpCAMと特異的に結合するファージディスプレイを含む技法により選択される免疫グロブリン様タンパク質も含まれる。本発明の免疫グロブリン分子は、任意のタイプ(例えばIgG、IgE、IgM、IgD、IgA及びIgY)、クラス(例えばIgG1、IgG2、IgG3、IgG4、IgA1及びIgA2)のもの、又は免疫グロブリン分子のサブクラスであり得る。本発明における使用に好適な「抗体及びその抗原結合断片」は、ポリクローナル抗体、モノクローナル抗体、一価抗体、二重特異性抗体、ヘテロ複合体抗体、多重特異性抗体、ヒト抗体、ヒト化(特にCDR移植)抗体、脱免疫化(deimmunized)抗体又はキメラ抗体、一本鎖抗体(例えばscFv)、Fab断片、F(ab’)2断片、Fab発現ライブラリにより産生される断片、ダイアボディ(diabodies)又はテトラボディ(tetrabodies)(Holliger P. et al., 1993)、ナノボディ(nanobodies)、抗イディオタイプ(抗Id)抗体(例えば、本発明の抗体に対する抗Id抗体を含む)、及び上記のもののいずれかのエピトープ結合断片を含むがこれらに限定されない。
【0028】
幾つかの実施形態では、抗原結合断片は本発明のヒト抗原結合抗体断片であり、Fab、Fab’及びF(ab’)2、Fd、一本鎖Fv(scFv)、一本鎖抗体、ジスルフィド結合したFv(dsFv)、並びにVLドメイン又はVHドメインを含む断片を含むがこれらに限定されない。一本鎖抗体を含む抗原結合抗体断片は、可変ドメイン(複数可)を単独で、又はヒンジ領域、CLドメイン、CH1ドメイン、CH2ドメイン及びCH3ドメインの全体若しくは一部と組み合わせて含み得る。ヒンジ領域、CLドメイン、CH1ドメイン、CH2ドメイン及びCH3ドメインと可変ドメイン(複数可)の任意の組合せも含む抗原結合断片も本発明に含まれる。
【0029】
本発明において使用可能な抗体は、鳥及び哺乳動物を含む任意の動物起源由来であり得る。好ましくは、抗体は、ヒト、げっ歯類(例えばマウス及びラット)、ロバ、ヒツジ、ウサギ、ヤギ、モルモット、ラクダ、ウマ又はニワトリの抗体である。抗体がヒト起源又はマウス起源のものであることが特に好ましい。本明細書で使用する場合の「ヒト抗体」は、ヒト免疫グロブリンのアミノ酸配列を有する抗体を含み、ヒト免疫グロブリンライブラリから単離された、又は1つ又は複数のヒト免疫グロブリンを遺伝子導入した内在性免疫グロブリンを発現しない動物(例えばKucherlapati &Jakobovitsによる米国特許第5939598号に記載されるような)由来の抗体を含む。
【0030】
「抗体様タンパク質」という用語は、標的分子と特異的に結合するように改変された(例えばループの突然変異誘発により)タンパク質を表す。典型的には、かかる抗体様タンパク質は、両端でタンパク質骨格と結合した少なくとも1つの可変ペプチドループを含む。この二重の構造的制約により、抗体様タンパク質の結合親和性が抗体の結合親和性に匹敵するレベルまで大幅に増大する。可変ペプチドループの長さは典型的には、10個〜20個のアミノ酸からなる。骨格タンパク質は、良好な溶解特性を有する任意のタンパク質であり得る。好ましくは、骨格タンパク質は小さい球状タンパク質である。抗体様タンパク質は、アフィボディ(affibodies)、アンチカリン(anticalins)、及び設計されたアンキリン反復タンパク質(概説に関してはBinz et al. 2005を参照されたい)を含むがこれらに限定されない。抗体様タンパク質は、突然変異体の大規模ライブラリ由来のものであってもよく、例えば大規模ファージディスプレイライブラリから選択して(panned)もよく、正規の抗体と同様に単離してもよい。また、抗体様結合タンパク質を、球状タンパク質の表面露出残基のコンビナトリアル突然変異誘発により得ることができる。
【0031】
「核酸アプタマー」という用語は、in vitro選択の繰り返し又はSELEX(試験管内進化法)により標的分子と結合するように改変された核酸分子を表す(概説に関してはBrody and Gold, 2000を参照されたい)。核酸アプタマーはDNA分子又はRNA分子であり得る。アプタマーは、例えば修飾ヌクレオチド、例えば2’−フッ素−置換ピリミジンのように修飾を含有していてもよい。
【0032】
「アマトキシン」という用語は、アマニタ(Amanita)属から単離され参考文献(Wieland, T. and Faulstich H., 1978)に記載されるような8個のアミノ酸から構成される全ての環状ペプチド、さらに全てのその化学的誘導体、さらに全てのその半合成類縁体、さらに天然化合物の主要構造(環状、8個のアミノ酸)に従って基本単位から構築される全てのその合成類縁体、さらにヒドロキシル化アミノ酸の代わりに非ヒドロキシル化アミノ酸を含有する全ての合成類縁体又は半合成類縁体、さらにスルフィド、スルホンにより、又は硫黄以外の原子、例えば炭素原子により(アマニチンのカルバアナログの場合のように)チオエーテルスルホキシド部分が置換された全ての合成類縁体又は半合成類縁体を含む。
【0033】
機能的には、アマトキシンは、哺乳動物のRNAポリメラーゼIIを阻害するペプチド又はデプシペプチドとして定義される。好ましいアマトキシンは、リンカー分子又はタンパク質、例えば抗体又は抗体断片と反応することができる官能基(例えばカルボキシル(carboxylic)基、アミノ基、ヒドロキシ基、チオール基又はチオール捕捉基)を有するものである。本発明の複合体に特に好適なアマトキシンは、図1に示されるようなα−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン(amanin)、アマニンアミド、アマヌリン及びアマヌリン酸(amanullinic acid)、並びにその塩、化学的誘導体、半合成類縁体及び合成類縁体である。本発明における使用のために特に好ましいアマトキシンは、α−アマニチン、β−アマニチン及びアマニンアミドである。
【0034】
本明細書で使用する場合の或る化合物の「誘導体」は、該化合物に類似する化学構造を有するが、該化合物中には存在しない少なくとも1つの化学基を含有し、及び/又は該化合物中に存在する少なくとも1つの化学基を欠く化学種を表す。誘導体の比較対象となる化合物は、「親」化合物として知られる。典型的には、「誘導体」は、1つ又は複数の化学反応工程で親化合物から作製することができる。
【0035】
本明細書で使用する場合の或る化合物の「類縁体」は、該化合物と構造的に関連するが同一ではなく、該化合物の少なくとも1つの活性を示す。類縁体の比較対象となる化合物は、「親」化合物として知られる。上で言及した活性は、別の化合物との結合活性、阻害活性、例えば酵素阻害活性、毒性効果、活性化活性、例えば酵素活性化活性を含むがこれらに限定されない。類縁体がかかる活性を親化合物と同程度示す必要はない。本願との関連内では、或る化合物が親化合物の活性の少なくとも1%(より好ましくは少なくとも5%、より好ましくは少なくとも10%、より好ましくは少なくとも20%、より好ましくは少なくとも30%、より好ましくは少なくとも40%、より好ましくは少なくとも50%)の程度まで関連する活性を示す場合、該化合物は類縁体とみなされる。したがって、「アマトキシンの類縁体」は、本明細書で使用する場合、図1に示されるようなα−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン及びアマヌリン酸のいずれか1つと構造的に関連し、α−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン及びアマヌリン酸の少なくとも1つと比較して哺乳動物のRNAポリメラーゼIIに対する少なくとも1%(より好ましくは少なくとも5%、より好ましくは少なくとも10%、より好ましくは少なくとも20%、より好ましくは少なくとも30%、より好ましくは少なくとも40%、より好ましくは少なくとも50%)の阻害活性を示す化合物を表す。本発明における使用に好適な「アマトキシンの類縁体」はさらに、哺乳動物のRNAポリメラーゼIIに対してα−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン又はアマヌリン酸のいずれか1つより大きな阻害活性を示し得る。阻害活性は、50%の阻害が生じる濃度(IC50値)を決定することにより測定することができる。
【0036】
本願との関連では「リンカー」は、例えば標的結合部分とアマトキシンとの間の立体的干渉を軽減させる(そうしなければRNAポリメラーゼIIと相互作用するアマトキシンの能力が減少する可能性がある)ために、2つの構成要素の間の距離を増大させる分子を表す。リンカーは、標的結合部分が標的とする細胞中で特異的にアマトキシンの放出を促進することがあるため、別の目的に適う可能性がある。リンカー、好ましくは一方側におけるリンカーとアマトキシンとの間の結合、及びもう一方側におけるリンカーと抗体との間の結合が細胞の外側(例えば血液中)では生理学的条件下で安定であるが、細胞の内側で、特に標的細胞、例えばがん細胞又は免疫細胞の内側で切断され得ることが好ましい。この選択的な安定性をもたらすために、リンカーは、好ましくは例えばS. Fletcher, M. R. Jorgensens and A. D.Miller; Org. Lett. 2004, 6(23), pp 4245-4248に記載されるようなpH感受性リンカーを生成するためにpH感受性の、又は例えばL. DA Ibsen, Blood 2003, 102, 1458-65若しくはFranciscoJA, Cerreny CG, Meyer DL, Nat. Biotechnol2003, 21, 778-84に記載されるようなプロテアーゼ感受性リンカーを生成するためにプロテアーゼ感受性の官能基(functionalities)を含み得る。代替的には、標的結合部分とリンカーを連結する結合は、選択的な安定性をもたらし得る。好ましくはリンカーは、少なくとも1原子長の、好ましくは1原子長〜20原子長(例えば1原子長、2原子長、3原子長、4原子長、5原子長、6原子長、7原子長、8原子長、9原子長、10原子長、11原子長、12原子長、13原子長、14原子長、15原子長、16原子長、17原子長、18原子長、19原子長又は20原子長)の長さを有し、リンカーの一方側がアマトキシンと反応しており、もう一方側が標的結合部分と反応している。本発明との関連では、リンカーは好ましくは、任意に置換されたC1〜20−アルキル基、C1〜20−ヘテロアルキル基、C2〜20−アルケニル基、C2〜20−ヘテロアルケニル基、C2〜20−アルキニル基、C2〜20−ヘテロアルキニル基、シクロアルキル基、ヘテロシクロアルキル基、アリール基、ヘテロアリール基、アラルキル基又はヘテロアラルキル基である。リンカーは、1つ又は複数の構造要素、例えばアミド部分、エステル部分、エーテル部分、チオエーテル部分、ジスルフィド部分、炭化水素部分等を含有し得る。リンカーは、これらの構造要素の2つ以上の組合せも含有し得る。これらの構造要素の各々が、リンカー中に2箇所以上、例えば2箇所、3箇所、4箇所、5箇所又は6箇所存在し得る。幾つかの実施形態では、リンカーは、ジスルフィド結合を含み得る。リンカーを、単一工程で又は2つ以上の後続の工程でアマトキシン及び標的結合部分と結合しなければならないことが理解される。そのために、その後リンカーとなるものは、好ましくは近位端及び遠位端に2つの基を保有し、該基は(i)或る基、好ましくはアマトキシン若しくは標的結合ペプチド上の活性化された基と共有結合を形成することができる、又は(ii)アマトキシン上の基と共有結合を形成するために活性化される若しくは活性化され得る。したがって、リンカーが存在する場合、化学基がリンカーの遠位端及び近位端に存在し、これがかかる結合反応の結果、例えばエステル結合、エーテル結合、ウレタン結合、ペプチド結合等であることが好ましい。「リンカー」の存在は任意であり、すなわち毒素は、本発明の標的結合部分毒素複合体の幾つかの実施形態では、標的結合部分の残基と直接連結され得る。リンカーが、標的とする部分との結合を介して、好ましくはその末端で、直接連結されることが好ましい。標的結合部分が、例えばAsp残基、Glu残基、Arg残基、Lys残基、Cys残基(ポリペプチド中に含まれ得る)の形態の遊離のアミノ基、遊離のカルボキシ基、又は遊離のスルフヒドリル基を含む場合、リンカーがかかる基と連結されることが好ましい。
【0037】
本明細書で使用する場合、第1の化合物(例えば抗体)が第2の化合物(例えば抗原、例えば標的タンパク質)に対して100μM以下、好ましくは50μM以下、好ましくは30μM以下、好ましくは20μM以下、好ましくは10μM以下、好ましくは5μM以下、より好ましくは1μM以下、より好ましくは900nM以下、より好ましくは800nM以下、より好ましくは700nM以下、より好ましくは600nM以下、より好ましくは500nM以下、より好ましくは400nM以下、より好ましくは300nM以下、より好ましくは200nM以下、さらにより好ましくは100nM以下、さらにより好ましくは90nM以下、さらにより好ましくは80nM以下、さらにより好ましくは70nM以下、さらにより好ましくは60nM以下、さらにより好ましくは50nM以下、さらにより好ましくは40nM以下、さらにより好ましくは30nM以下、さらにより好ましくは20nM以下、さらにより好ましくは10nM以下の解離定数KDを有する場合、第1の化合物は上記第2の化合物と「特異的に結合する」と考える。
【0038】
本明細書で使用する場合の「患者」は、本明細書に記載される標的結合部分毒素複合体による治療から利益を受け得る任意の哺乳動物又は鳥を意味する。好ましくは、「患者」は、実験動物(例えばマウス又はラット)、家畜動物(例えばモルモット、ウサギ、ロバ、ヒツジ、ヤギ、ニワトリ、ラクダ、ウマ、ネコ又はイヌを含む)、又は人間を含む霊長類からなる群から選択される。「患者」は人間であることが特に好ましい。
【0039】
本明細書で使用する場合、或る疾患又は障害に関する「を治療する(treat)」、「を治療すること(treating)」又は「治療(treatment)」は、(a)該障害の重症度を低減すること、(b)治療される該障害(複数可)に特徴的な症状の発症を制限又は予防すること、(c)治療される該障害(複数可)に特徴的な症状の悪化を阻止すること、(d)該障害(複数可)を過去に有していた患者における該障害(複数可)の再発を制限又は予防すること、及び(e)過去に該障害(複数可)の症状を示した患者における症状の再発を制限又は予防することのうち1つ又は複数を達成することを意味する。
【0040】
本明細書で使用する場合の「を投与すること(administering)」は、in vivoでの投与、及びex vivoでの組織(例えば静脈移植片)への直接の投与を含む。
【0041】
「有効量」は、意図した目的を達成するのに十分な治療剤の量である。所定の治療剤の有効量は、薬剤の性質、投与経路、治療剤の投与対象の動物の大きさ及び種、並びに投与目的等の因子により変動し得る。各々の個別のケースにおける有効量は、当該技術分野において確立された方法に従って当業者が経験的に決定することができる。
【0042】
「薬学的に許容可能な」は、連邦政府若しくは州政府の監督官庁により承認されていること、又は米国薬局方、若しくは動物における、より具体的にはヒトにおける使用のための他の一般的に認められた薬局方にリストされていることを意味する。
【0043】
本発明の実施形態
本発明をここでさらに記載する。以下の節では本発明の種々の態様をより詳細に規定する。そのようにして規定した各態様は、反対の内容が明示されない限り、任意の他の態様(単数又は複数)と組み合わせることができる。特に、好ましい又は有利であるとして示した任意の特徴を、好ましい又は有利であるとして示した任意の他の特徴(単数又は複数)と組み合わせることができる。
【0044】
第1の態様では、本発明は、患者における膵臓がん、胆管癌又は結腸直腸がんの治療のための抗体毒素複合体であって、(i)上皮細胞接着分子(EpCAM)のエピトープと特異的に結合する抗体又はその抗原結合断片、(ii)アマトキシン、及び(iii)任意にリンカーを含む、抗体毒素複合体に関する。
【0045】
第1の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、ダイアボディ、テトラボディ、ナノボディ、キメラ抗体、脱免疫化抗体、ヒト化抗体又はヒト抗体から選択される。第1の態様の好ましい一実施形態では、抗原結合断片は、Fab、F(ab’)2、Fd、Fv、一本鎖Fv、及びジスルフィド結合したFv(dsFv)からなる群から選択される。
【0046】
好ましい一実施形態では、EpCAMのエピトープは、ヒトEpCAMのエピトープである。
【0047】
第1の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、(a)huHEA125の重鎖のCDR3ドメイン(配列番号22)、及び/又は(b)huHEA125の軽鎖のCDR3ドメイン(配列番号25)を含む。特に好ましい一実施形態では、抗体又はその抗原結合断片は、配列番号22及び配列番号25に示されるようなこれらのCDR3ドメインの両方を含む。好ましくは、抗体又はその抗原結合断片は、(a)huHEA125の重鎖のCDR2ドメイン(配列番号21)、(b)huHEA125の重鎖のCDR1ドメイン(配列番号20)、(c)huHEA125の軽鎖のCDR2ドメイン(配列番号24)、及び(d)huHEA125の軽鎖のCDR1ドメイン(配列番号23)のうち1つ又は複数をさらに含む。好ましい一実施形態では、抗体又はその抗原結合断片は、huHEA125の重鎖のCDR3ドメイン(配列番号22)、CDR2ドメイン(配列番号21)及びCDR1ドメイン(配列番号20)を含む。好ましい一実施形態では、抗体又はその抗原結合断片は、huHEA125の軽鎖のCDR3ドメイン(配列番号25)、CDR2ドメイン(配列番号24)及びCDR1ドメイン(配列番号23)を含む。特に好ましい一実施形態では、抗体又はその抗原結合断片は、重鎖及び軽鎖のCDR3ドメイン、CDR2ドメイン及びCDR1ドメインを含み、すなわち抗体又はその抗原結合断片は、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24及び配列番号25に示されるようなアミノ酸配列を含む。
【0048】
第1の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、huHEA125の重鎖の可変ドメイン(=VH)(配列番号3)、及び/又はhuHEA125の軽鎖の可変ドメイン(=VL)(配列番号12)を含む。特に好ましい一実施形態では、抗体又はその抗原結合断片は、huHEA125のVHドメイン(配列番号3)及びVLドメイン(配列番号12)の両方を含む。
【0049】
第1の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、huHEA125の重鎖(可溶型、配列番号2)、及び/又はhuHEA125の軽鎖(配列番号11)を含む。一実施形態では、huHEA125の重鎖、及び/又はhuHEA125の軽鎖は各々、最大20個(例えば1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個又は20個)のアミノ酸置換、アミノ酸欠失又はアミノ酸付加を互いに独立して含み、これらのアミノ酸置換、アミノ酸欠失又はアミノ酸付加は、重鎖の定常ドメインに、及び/又は軽鎖の定常ドメインに、及び/又は重鎖の可変ドメインのフレームワーク領域に、及び/又は軽鎖の可変ドメインのフレームワーク領域に位置し得る。特に好ましい一実施形態では、抗体は2つのhuHEA125の重鎖(配列番号2)、及び2つのhuHEA125の軽鎖(配列番号11)を含む完全IgG抗体であり、1つの重鎖はジスルフィド結合を介して1つの軽鎖と連結されており、重鎖は1つ又は2つ(好ましくは2つ)のジスルフィド結合により互いに連結されている。
【0050】
第1の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、huHEA125の重鎖(膜結合型、配列番号1)、及び/又はhuHEA125の軽鎖(配列番号11)を含む。一実施形態では、huHEA125の重鎖、及び/又はhuHEA125の軽鎖は各々、最大20個(例えば1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個又は20個)のアミノ酸置換、アミノ酸欠失又はアミノ酸付加を互いに独立して含み、これらのアミノ酸置換、アミノ酸欠失又はアミノ酸付加は、重鎖の定常ドメインに、及び/又は軽鎖の定常ドメインに、及び/又は重鎖の可変ドメインのフレームワーク領域に、及び/又は軽鎖の可変ドメインのフレームワーク領域に位置し得る。特に好ましい一実施形態では、抗体は2つのhuHEA125の重鎖(配列番号1)、及び2つのhuHEA125の軽鎖(配列番号11)を含む完全IgG抗体であり、1つの重鎖はジスルフィド結合を介して1つの軽鎖と連結されており、重鎖は1つ又は2つ(好ましくは2つ)のジスルフィド結合により互いに連結されている。
【0051】
第1の態様の好ましい一実施形態では、アマトキシンは、α−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン及びアマヌリン酸(全て図1に示される)、並びにその塩、化学的誘導体、半合成類縁体及び合成類縁体から選択される。特に好ましいアマトキシンは、α−アマニチン、β−アマニチン及びアマニンアミド、並びにその塩、化学的誘導体、半合成類縁体及び合成類縁体である。
【0052】
第1の態様の好ましい一実施形態では、アマトキシンは、アマトキシンのアミノ酸3のδC原子を介して、抗体と、又は存在する場合リンカーL1と連結される(図1を参照されたい)。本発明において使用可能な好ましいアマトキシンでは、上記アミノ酸3は、イソロイシン、γ−ヒドロキシ−イソロイシン又はγ,δ−ジヒドロキシ−イソロイシンである。
【0053】
第1の態様の好ましい実施形態では、アマトキシンは、アマトキシンのアミノ酸3のδC原子と結合した酸素原子を介して、抗体と、又は存在する場合リンカーL1と連結される。アマトキシンが、エステル結合、エーテル結合又はウレタン結合を介して、抗体と、又は存在する場合リンカーL1と連結されることがさらに好ましい。これらの実施形態では、アミノ酸3がγ,δ−ジヒドロキシ−イソロイシンであることが好ましい。
【0054】
第1の態様の好ましい実施形態では、抗体は、該抗体に存在するアミノ基を介して、アマトキシンと、又は存在する場合リンカーL1と連結される。
【0055】
第1の態様の好ましい一実施形態では、リンカーL1は、任意に置換されたアルキル基、ヘテロアルキル基、アルケニル基、ヘテロアルケニル基、アルキニル基、ヘテロアルキニル基、シクロアルキル基、ヘテロシクロアルキル基、アリール基、ヘテロアリール基、アラルキル基又はヘテロアラルキル基である。第1の態様のさらに好ましい実施形態では、リンカーL1は、ジスルフィド結合を含む。
【0056】
第2の態様では、本発明は、抗体毒素複合体であって、(i)上皮細胞接着分子(EpCAM)と特異的に結合する抗体又はその抗原結合断片であって、(a)huHEA125の重鎖であって、(a1)配列番号1に記載の膜結合型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含み、配列番号26に示されるような重鎖の定常ドメインが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含む、膜結合型の重鎖、並びに(a2)配列番号2に記載の可溶型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含み、配列番号27に示されるような重鎖の定常ドメインが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含む、可溶型の重鎖からなる群から選択される、huHEA125の重鎖、並びに(b)配列番号11に記載のhuHEA125の軽鎖であって、配列番号12に示されるような軽鎖の可変ドメインVLが、VLのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含み、配列番号28に示されるような軽鎖の定常ドメインCLが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含む、huHEA125の軽鎖を含む、抗体又はその抗原結合断片、(ii)アマトキシン、並びに(iii)任意にリンカーを含む、抗体毒素複合体に関する。
【0057】
第2の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、(a)huHEA125の重鎖であって、(a1)配列番号1に記載の膜結合型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含む、膜結合型の重鎖、並びに(a2)配列番号2に記載の可溶型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含む、可溶型の重鎖からなる群から選択される、huHEA125の重鎖、並びに(b)配列番号11に記載のhuHEA125の軽鎖であって、配列番号12に示されるような軽鎖の可変ドメインVLが、VLのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸欠失、及び/又は0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸付加を含む、huHEA125の軽鎖を含む。
【0058】
第2の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、(a)huHEA125の重鎖であって、(a1)配列番号1に記載の膜結合型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、アミノ酸欠失及び/又はアミノ酸付加を含み、配列番号26に示されるような重鎖の定常ドメインが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、アミノ酸欠失及び/又はアミノ酸付加を含む、膜結合型の重鎖、並びに(a2)配列番号2に記載の可溶型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、アミノ酸欠失及び/又はアミノ酸付加を含み、配列番号27に示されるような重鎖の定常ドメインが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、アミノ酸欠失及び/又はアミノ酸付加を含む、可溶型の重鎖からなる群から選択される、huHEA125の重鎖、並びに(b)配列番号11に記載のhuHEA125の軽鎖であって、配列番号12に示されるような軽鎖の可変ドメインVLが、VLのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、アミノ酸欠失及び/又はアミノ酸付加を含み、配列番号28に示されるような軽鎖の定常ドメインCLが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換、アミノ酸欠失及び/又はアミノ酸付加を含む、huHEA125の軽鎖を含む。
【0059】
第2の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、(a)huHEA125の重鎖であって、(a1)配列番号1に記載の膜結合型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換を含み、配列番号26に示されるような重鎖の定常ドメインが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換を含む、膜結合型の重鎖、及び(a2)配列番号2に記載の可溶型の重鎖であって、配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換を含み、配列番号27に示されるような重鎖の定常ドメインが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換を含む、可溶型の重鎖からなる群から選択される、huHEA125の重鎖、並びに(b)配列番号11に記載のhuHEA125の軽鎖であって、配列番号12に示されるような軽鎖の可変ドメインVLが、VLのフレームワーク領域に位置する0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換を含み、配列番号28に示されるような軽鎖の定常ドメインCLが、0個〜10個(例えば0個、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸置換を含む、huHEA125の軽鎖を含む。
【0060】
第2の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、(a)huHEA125の重鎖であって、(a1)配列番号1に記載の膜結合型の重鎖、及び(a2)配列番号2に記載の可溶型の重鎖からなる群から選択される、huHEA125の重鎖、並びに(b)配列番号11に記載のhuHEA125の軽鎖を含む。
【0061】
第2の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、キメラ抗体、脱免疫化抗体、ヒト化抗体又はヒト抗体から選択される。第2の態様の好ましい一実施形態では、抗原結合断片は、Fab、F(ab’)2及びFdからなる群から選択される。
【0062】
第2の態様の好ましい一実施形態では、抗体は、huHEA125又はその抗原結合断片である。
【0063】
第2の態様の好ましい一実施形態では、抗体又はその抗原結合断片は、ヒトEpCAMと特異的に結合する。
【0064】
第2の態様の好ましい一実施形態では、アマトキシンは、α−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン及びアマヌリン酸(全て図1に示される)、並びにその塩、化学的誘導体、半合成類縁体及び合成類縁体から選択される。特に好ましいアマトキシンは、α−アマニチン、β−アマニチン及びアマニンアミド、並びにその塩、化学的誘導体、半合成類縁体及び合成類縁体である。
【0065】
第2の態様の好ましい一実施形態では、アマトキシンは、アマトキシンのアミノ酸3のδC原子を介して、抗体と、又は存在する場合リンカーL2と連結される(図1を参照されたい)。本発明において使用可能な好ましいアマトキシンでは、上記アミノ酸3は、イソロイシン、γ−ヒドロキシ−イソロイシン又はγ,δ−ジヒドロキシ−イソロイシンである。
【0066】
第2の態様の好ましい実施形態では、アマトキシンは、アマトキシンのアミノ酸3のδC原子と結合した酸素原子を介して、抗体と、又は存在する場合リンカーL2と連結される。アマトキシンが、エステル結合、エーテル結合又はウレタン結合を介して、抗体と、又は存在する場合リンカーL2と連結されることがさらに好ましい。これらの実施形態では、アミノ酸3がγ,δ−ジヒドロキシ−イソロイシンであることが好ましい。
【0067】
第2の態様の好ましい実施形態では、抗体は、該抗体に存在するアミノ基を介して、アマトキシンと、又は存在する場合リンカーL2と連結される。
【0068】
第2の態様の好ましい一実施形態では、リンカーL2は、任意に置換されたアルキル基、ヘテロアルキル基、アルケニル基、ヘテロアルケニル基、アルキニル基、ヘテロアルキニル基、シクロアルキル基、ヘテロシクロアルキル基、アリール基、ヘテロアリール基、アラルキル基又はヘテロアラルキル基である。第2の態様のさらに好ましい実施形態では、リンカーL2は、ジスルフィド結合を含む。
【0069】
第3の態様では、本発明は、医療における使用のための第2の態様の複合体に関する。
【0070】
第4の態様では、本発明は、患者におけるがんの治療のための第2の態様の複合体であって、該がんが、膵臓がん、胆管癌、乳がん及び結腸直腸がんからなる群から選択される、複合体に関する。
【0071】
第5の態様では、本発明は、患者におけるがんの治療用の医薬組成物の調製のための第2の態様の複合体であって、該がんが、膵臓がん、胆管癌、乳がん及び結腸直腸がんからなる群から選択される、複合体に関する。
【0072】
第5の態様では、本発明は、標的結合部分毒素複合体であって、(i)標的結合部分、(ii)アマトキシン、及び(iii)任意にリンカーL3を含み、アマトキシンが、アマトキシンのアミノ酸3、好ましくはアマトキシンのアミノ酸3のδC原子を介して、標的結合部分と、又は存在する場合リンカーL3と連結される、標的結合部分毒素複合体に関する(図1を参照されたい)。本発明において使用可能な好ましいアマトキシンでは、上記アミノ酸3は、イソロイシン、γ−ヒドロキシ−イソロイシン又はγ,δ−ジヒドロキシ−イソロイシンである。
【0073】
第5の態様の好ましい一実施形態では、アマトキシンは、アマトキシンのアミノ酸3のδC原子と結合した酸素原子を介して、標的結合部分と、又は存在する場合リンカーL3と連結される。アマトキシンが、エステル結合、好ましくはアマトキシン−O−C(O)−L3−標的結合部分若しくはアマトキシン−O−C(O)−標的結合部分、より好ましくはアマトキシン−δC−O−C(O)−L3−標的結合部分若しくはアマトキシン−δC−O−C(O)−標的結合部分、最も好ましくはアマトキシン−δCH2−O−C(O)−L3−標的結合部分若しくはアマトキシン−δCH2−O−C(O)−標的結合部分の形態のエステル結合、エーテル結合、好ましくはアマトキシン−O−L3−標的結合部分若しくはアマトキシン−O−標的結合部分、好ましくはアマトキシン−δC−O−L3−標的結合部分若しくはアマトキシン−δC−O−標的結合部分、より好ましくはアマトキシン−δCH2−O−L3−標的結合部分若しくはアマトキシン−δCH2−O−標的結合部分の形態のエーテル結合、又はウレタン結合、好ましくはアマトキシン−O−C(O)−NH−L3−標的結合部分若しくはアマトキシン−O−C(O)−NH−標的結合部分、好ましくはアマトキシン−δC−O−C(O)−NH−L3−標的結合部分若しくはアマトキシン−δC−O−C(O)−NH−標的結合部分、すなわちアマトキシン−δCH2−O−C(O)−NH−L3−標的結合部分若しくはアマトキシン−δCH2−O−C(O)−NH−標的結合部分の形態のウレタン結合を介して、標的結合部分と、又は存在する場合リンカーL3と連結されることがさらに好ましい。これらの実施形態では、アミノ酸3がγ,δ−ジヒドロキシ−イソロイシンであることが好ましい。
【0074】
第5の態様の好ましい実施形態では、リンカーL3が存在し、複合体が以下の構造:(i)アマトキシン−δC−O−C(O)−L3−C(O)−NH−標的結合部分、(ii)アマトキシン−δC−O−L3−C(O)−NH−標的結合部分、又は(iii)アマトキシン−δC−O−C(O)−NH−L3−C(O)−NH−標的結合部分、好ましくは(i)アマトキシン−δCH2−O−C(O)−L3−C(O)−NH−標的結合部分、(ii)アマトキシン−δCH2−O−L3−C(O)−NH−標的結合部分、又は(iii)アマトキシン−δCH2−O−C(O)−NH−L3−C(O)−NH−標的結合部分のうちの1つを有する。
【0075】
第5の態様の好ましい一実施形態では、標的結合部分は、該標的結合部分に存在するアミノ基を介して、アマトキシンと、又は存在する場合リンカーL3と連結される。
【0076】
第5の態様の好ましい一実施形態では、アマトキシンは、α−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン又はアマヌリン酸(全て図1に示される)、並びにその塩、化学的誘導体、半合成類縁体及び合成類縁体から選択される。特に好ましいアマトキシンは、α−アマニチン、β−アマニチン及びアマニンアミド、並びにその塩、化学的誘導体、半合成類縁体及び合成類縁体である。
【0077】
第5の態様の好ましい一実施形態では、リンカーL3は、任意に置換されたアルキル基、ヘテロアルキル基、アルケニル基、ヘテロアルケニル基、アルキニル基、ヘテロアルキニル基、シクロアルキル基、ヘテロシクロアルキル基、アリール基、ヘテロアリール基、アラルキル基又はヘテロアラルキル基である。第5の態様のさらに好ましい実施形態では、リンカーL3は、ジスルフィド結合を含む。
【0078】
第5の態様の好ましい一実施形態では、標的結合部分は、腫瘍細胞上に存在するエピトープと特異的に結合する。標的結合部分が上皮細胞接着分子(EpCAM)のエピトープと特異的に結合することが特に好ましい。
【0079】
第5の態様の好ましい一実施形態では、標的結合部分は、(i)抗体又はその抗原結合断片、(ii)抗体様タンパク質、及び(iii)核酸アプタマーからなる群から選択される。好ましい一実施形態では、抗体又はその抗原結合断片は、ダイアボディ、テトラボディ、ナノボディ、キメラ抗体、脱免疫化抗体、ヒト化抗体又はヒト抗体から選択される。好ましい一実施形態では、抗原結合断片は、Fab、F(ab’)2、Fd、Fv、一本鎖Fv、及びジスルフィド結合したFv(dsFv)からなる群から選択される。好ましい一実施形態では、抗体又はその抗原結合断片は、(a)huHEA125の膜結合型の重鎖(配列番号1)、若しくはhuHEA125の可溶型の重鎖(配列番号2)、及び/又は(b)huHEA125の軽鎖(配列番号11)を含む。
【0080】
第6の態様では、本発明は、医療における使用のための第5の態様による標的結合部分毒素複合体に関する。
【0081】
第7の態様では、本発明は、患者におけるがんの治療のための第5の態様による標的結合部分毒素複合体であって、該がんが、膵臓がん、胆管癌、乳がん、結腸直腸がん、肺がん、前立腺がん、卵巣がん、胃がん、腎臓がん、悪性黒色腫、白血病及び悪性リンパ腫からなる群から選択される、標的結合部分毒素複合体に関する。
【0082】
第8の態様では、本発明は、第1の態様の若しくは第2の態様の抗体毒素複合体、又は第5の態様による標的結合部分毒素複合体を含み、1つ又は複数の薬学的に許容可能な希釈剤、担体、賦形剤、充填剤、結合剤、滑剤、流動促進剤、崩壊剤、吸着剤、及び/又は保存料をさらに含む医薬組成物に関する。
【0083】
第5の実施形態〜第7の実施形態の標的結合部分は、好ましい実施形態では、タンパク質、特に抗体である。タンパク質、特に抗体は、アマトキシンの結合を可能にする幾つかのアミノ酸を含んでいるであろう。好ましいアミノ酸は、遊離のアミノ基、ヒドロキシ基又はカルボニル基を有するものであり、Lys、Gln、Glu、Asp、Asn、Thr及びSerを含む。したがって、2個以上のアマトキシン分子を1個のタンパク質分子と結合することが可能である。1分子当たりのアマトキシン数の増大により、毒性も増大する。したがって、好ましい一実施形態では、第1の実施形態〜第4の実施形態の抗体及び第5の実施形態〜第7の実施形態の標的結合部分対アマトキシンの比は、タンパク質1分子対アマトキシン1分子〜15分子、好ましくは1分子、2分子、3分子、4分子、5分子、6分子、7分子、8分子、9分子、10分子、11分子、12分子、13分子、14分子又は15分子である。二量体IgGのような二量体の場合において比を算出する目的では、二量体は1分子とみなす。標的結合部分がタンパク質ではない場合であっても、同様の比が好ましい。
【0084】
第8の態様の医薬組成物を、全身的に投与される医薬品の形態で使用することができることが特に好ましい。これらは、特に注射剤及び注入剤を含む非経口剤を含む。注射剤は、アンプルの形態で、又はいわゆる即用可能な(ready-for-use)注射剤、例えば即用可能な注射器若しくは使い捨ての注射器として、及びこれに加えて複数回の抜取りを行うための穿刺用フラスコ中に製剤化される。注射剤の投与は、皮下(s.c.)、筋肉内(i.m.)、静脈内(i.v.)又は皮内(i.c.)の適用の形態であり得る。特に、結晶の懸濁液、溶液、ナノ粒子又はコロイド分散系(例えばハイドロゾルのような)としてそれぞれ好適な注射製剤を製造することが可能である。
【0085】
注射用製剤はさらに、水性等張希釈剤を用いて溶解又は分散させることができる濃縮物として製造することができる。注入剤を、等張溶液、脂肪性エマルション、リポソーム製剤及びマイクロエマルションの形態で調製することもできる。注射剤と同様に、注入製剤を、希釈用濃縮物の形態で調製することもできる。注射用製剤を、例えばミニポンプにより、入院療法及び通院療法の両方において持続性注入剤の形態で適用することもできる。
【0086】
例えばアルブミン、血漿、増量剤、界面活性物質、有機希釈剤、pH調整物質(pH-influencing substances)、錯体形成物質若しくは高分子物質を、特にタンパク質若しくは高分子に対する本発明の標的結合部分毒素複合体の吸着に影響を与えるための物質として、非経口薬剤配合物に添加することが可能であり、又は本発明の標的結合部分毒素複合体の吸着を低減させる目的で、注射機器のような材料、若しくは包装用材料、例えばプラスチック若しくはガラスにこれらを添加することもできる。
【0087】
本発明の標的結合部分毒素複合体を、非経口剤におけるマイクロキャリア又はナノ粒子と、例えば、ポリ(メタ)アクリレート、ポリラクテート、ポリグリコレート、ポリアミノ酸又はポリエーテルウレタンに基づく微分散粒子等と結合させることができる。本発明の標的結合部分毒素複合体をそれぞれ微分散形態、分散形態及び懸濁形態で導入する場合、例えば「複数単位原理(multiple unit principle)」に基づき持続性製剤として、又は本発明の標的結合部分毒素複合体を製剤中に、例えば錠剤若しくは棒剤(rod)(その後埋め込まれる)中に封入する場合、医薬品中の結晶の懸濁液として若しくは「単一単位原理」に基づき、非経口製剤を変更することもできる。単一単位製剤及び複数単位製剤のこれらの埋め込み剤又は持続性医薬品は多くの場合、いわゆる生分解性高分子、例えば乳酸及びグリコール酸のポリエステル、ポリエーテルウレタン、ポリアミノ酸、ポリ(メタ)アクリレート、又は多糖等からなる。
【0088】
非経口剤として製剤化される本発明の医薬組成物の製造時に添加される補助剤及び担体は、好ましくは滅菌水(aqua sterilisata(sterilized water))、pH値調整物質、例えば有機酸若しくは無機酸若しくは有機塩基若しくは無機塩基及びそれらの塩等、pH値調整用の緩衝物質、等張化用の物質、例えば塩化ナトリウム、炭酸水素ナトリウム、グルコース及びフルクトース等、それぞれテンシド(tensides)及び界面活性剤、並びに乳化剤、例えばポリオキシエチレンソルビタンの脂肪酸の部分エステル(例えばTween(登録商標))、若しくは例えばポリオキシエチレンの脂肪酸エステル(例えばCremophor(登録商標))等、脂肪油、例えば落花生油、大豆油若しくはヒマシ油等、脂肪酸の合成エステル、例えばオレイン酸エチル、ミリスチン酸イソプロピル及び中性油(例えばMiglyol(登録商標))等、並びに高分子補助剤、例えばゼラチン、デキストラン、ポリビニルピロリドン等、有機溶媒の溶解度を増大させる添加剤、例えばプロピレングリコール、エタノール、N,N−ジメチルアセトアミド、プロピレングリコール等、又は錯体形成物質、例えばシトレート及び尿素等、保存料、例えば安息香酸ヒドロキシプロピルエステル及びメチルエステル、ベンジルアルコール等、抗酸化剤、例えば亜硫酸ナトリウム等、並びに安定化剤、例えばEDTA等である。
【0089】
好ましい一実施形態において懸濁液として本発明の医薬組成物を製剤化する場合、本発明の標的結合部分毒素複合体の硬化を防止するための増粘剤、又はテンシド、及び堆積物の再懸濁能を確保するための高分子電解質、及び/又は錯体形成剤、例えばEDTA等を添加する。様々な高分子との活性成分の複合体を得ることも可能である。かかる高分子の例は、ポリエチレングリコール、ポリスチロール、カルボキシメチルセルロース、Pluronics(登録商標)又はポリエチレングリコールソルビット脂肪酸エステルである。本発明の標的結合部分毒素複合体を、包接化合物(例えばシクロデキストリンによる)の形態で液体製剤中に組み込むこともできる。特定の実施形態では、分散剤を、さらなる補助剤として添加することができる。凍結乾燥物の製造のために、足場剤(scaffolding agents)、例えばマンニット、デキストラン、サッカロース、ヒトアルブミン、ラクトース、PVP、又は様々なゼラチンを使用することができる。
【0090】
さらなる一態様では、本発明は、それを必要とする患者において膵臓がん、胆管癌又は結腸直腸がんを治療する方法であって、第1の態様において規定されるような抗体毒素複合体を有効量該患者に投与することを含む、方法に関する。
【0091】
さらなる一態様では、本発明は、それを必要とする患者において膵臓がん、胆管癌、乳がん又は結腸直腸がんを治療する方法であって、第3の態様において規定されるような抗体毒素複合体を有効量該患者に投与することを含む、方法に関する。
【0092】
さらなる一態様では、本発明は、それを必要とする患者において膵臓がん、胆管癌、乳がん又は結腸直腸がんを治療する方法であって、第5の態様において規定されるような標的結合部分毒素複合体を有効量該患者に投与することを含む、方法に関する。
【実施例】
【0093】
以下で、非限定的な実施例を用いて本発明をより詳細に説明する。
【0094】
実施例1:抗体huHEA125と抗体毒素複合体アマニチン−huHEA125との間の標的細胞に対する結合親和性の比較
1.1 キメラ抗体huHEA125
数年前に、本発明者らは、抗EpCAMマウスモノクローナル抗体HEA125を分泌するハイブリドーマ細胞株を樹立した(Moldenhauer etal., 1987、Momburg et al., 1987)。分子生物学的技法を使用して、このハイブリドーマ株を再構築して、ヒトカッパ定常軽鎖及びヒトIgG1定常重鎖と連結した(hooked up)マウス可変ドメインからなるキメラ型の抗体を作製した。得られた抗体huHEA125は、高親和性(Kd=2.2×10−9M)及び高特異性でEpCAMを発現する細胞と結合する。huHEA125免疫グロブリンの遺伝子配列及びアミノ酸配列を以下に示す:
【0095】
huHEA125重鎖
ペプチド配列 重鎖、膜結合型(IGHV/IGHD/IGHJ/IGHG1;IGHG1に下線を付す)(配列番号1):
EVKLLESGGGLVQPGGSLKLSCAASGFDFSRFWMTWVRQAPGKGLEWIGEINLDSSTINYTPSLKDKFIISRDNAKNTLFLQMSKVRSEDTALYYCSRGISMDYWGQGTSVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGLQLDETCAEAQDGELDGLWTTITIFISLFLLSVCYSAAVTLFKVKWIFSSVVELKQTLVPEYKNMIGQAP
【0096】
ペプチド配列 重鎖、分泌型(配列番号2):
EVKLLESGGGLVQPGGSLKLSCAASGFDFSRFWMTWVRQAPGKGLEWIGEINLDSSTINYTPSLKDKFIISRDNAKNTLFLQMSKVRSEDTALYYCSRGISMDYWGQGTSVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
【0097】
ペプチド配列(IGHV/IGHD/IGHJ=VHドメイン;フレームワーク領域FR1、FR2、FR3及びFR4に下線を付す)(配列番号3):
EVKLLESGGGLVQPGGSLKLSCAASGFDFSRFWMTWVRQAPGKGLEWIGEINLDSSTINYTPSLKDKFIISRDNAKNTLFLQMSKVRSEDTALYYCSRGISMDYWGQGTSVTVSS
【0098】
核酸配列(IMGT命名法に従い注釈される、IGHV/IGHD/IGHJ;IGHDに下線を付す;IGHJに二重下線を付す):
【表1】

【0099】
huHEA125軽鎖
ペプチド配列 軽鎖(IGKV/IGKJ/IGKC;IGKCに下線を付す)(配列番号11):
DILLTQSPAILSVSPGERVSFSCRASQSIGISLHWYQQRPSDSPRLLIKYASESISGIPSRFSGSGSGTDFTLSINSVESEDIADYYCQQSNIWPTTFGAGTKLELKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
【0100】
ペプチド配列(IGKV/IGKJ=VLドメイン;フレームワーク領域FR1、FR2、FR3及びFR4に下線を付す)(配列番号12):
DILLTQSPAILSVSPGERVSFSCRASQSIGISLHWYQQRPSDSPRLLIKYASESISGIPSRFSGSGSGTDFTLSINSVESEDIADYYCQQSNIWPTTFGAGTKLELK
【0101】
核酸配列(IMGT命名法に従い注釈される、IGKV/IGKJ;IGKVに下線を付す;IGKJに二重下線を付す):
【表2】

【0102】
1.2 対照抗体Xolair(登録商標)
対照抗体Xolair(登録商標)(オマリズマブ、ヒトIgE免疫グロブリンに指向性を有するヒトIgG1抗体)は、Novartis(Germany)により製造されたものである。
【0103】
1.3 α−アマニチン抗体複合体の合成
1.3.1 α−アマニチン−グルタレートの合成
P4O10で真空乾燥した3.0mg(3.3μmol)のα−アマニチンを、0.25mlの乾燥ピリジンに溶解し、0.1mlのピリジン中の0.9mg(79μmol)のグルタル酸無水物と、暗所にて室温で24時間反応させた。ペプチドを、7mlの乾燥ジエチルエーテルの添加により沈殿させ、遠心分離し、固体を再度ジエチルエーテルで洗浄し、遠心分離した。
【0104】
この反応により、R1=−OH(図1における)がR1=−O−C(O)−(CH2)3−COOHにより置き換えられたα−アマニチン誘導体が得られる。
【0105】
1.3.2 α−アマニチン−グルタル酸N−ヒドロキシスクシンイミデートの合成
3.4mgのα−アマニチングルタレート(3.3μmol)を0.05mlの乾燥ジメチルホルムアミド(DMF)に溶解し、0.01mlのDMFに溶解した2.4mg(7等量)のN−ヒドロキシ−スクシンイミドを添加した。0.01mlのDMF中の1.2mgのジシクロヘキシルカルボジイミドの添加後、反応を室温で16時間進行させた。形成した結晶と溶液を分離し、4mlの乾燥ジエチルエーテルの添加によりペプチドを沈殿させた。遠心分離後、ペレットをさらに4mlのエーテルで洗浄し、遠心分離した。固体を0.1mlのジメチルホルムアミドに溶解し、直ちに抗体溶液との反応に使用した。
【0106】
1.3.3 α−アマニチン−グルタレート−huHEA125の合成
3.0mgのα−アマニチン−グルタル酸N−ヒドロキシスクシンイミデートの溶液0.1mlを、5mlのPBS中の10mgのhu−HEA125抗体に添加し、暗所にて5℃でゆっくりと回転させながら反応させた。16時間後、溶液をPBSで平衡化したSephadex G25カラム(120×1.5cm)にアプライし、タンパク質画分を収集した。アマニチン負荷量を、アマトキシンに関するモル吸光係数13,500cm−1M−1を使用して、同濃度の未反応(native)抗体を含有するブランクに対するタンパク質溶液の310nmでの吸光度の差異から分光光度的に決定した。この調製物のα−アマニチン:IgG比は、約8であった。
【0107】
1.4 結合競合分析
アマニチン−huHEA125複合体対複合体形成していないhuHEA125抗体の結合を、フローサイトメトリーにより競合実験において分析した。α−アマニチン−huHEA125複合体を、1.3.1節〜1.3.3節において上で記載されるように合成した。
【0108】
Colo205標的細胞(結腸がん転移)を、FACS緩衝液(1%の熱失活させたウシ胎児血清及び0.1%のアジ化ナトリウムを有するダルベッコPBS)で2回洗浄し、細胞の数を数え、1ml当たりの細胞数2×107個に調整した。50μlの細胞懸濁液を、50μl/ウェルのFITC標識したhuHEA125抗体をピペット添加した96ウェルU底マイクロタイタープレートの各ウェルに加えた。400μg/ml〜10ng/ml(最終希釈液)の範囲のアマニチン−huHEA125又はhuHEA125の段階希釈液を、50μl/ウェルの容量で三連で添加し、氷上で1時間インキュベートした。その後、プレートを遠心分離し(2000rpmで2分)、上清を細胞から除去した。細胞を150μlのFACS緩衝液に再懸濁し、再度遠心分離した。遠心分離による2回の洗浄工程の後、細胞を100μl/ウェルのヨウ化プロピジウム溶液(FACS緩衝液中1μg/ml)中に移し、死細胞を判別した。分析を、CellQuestソフトウェアを使用するFACScanサイトメーター(Becton and Dickinson(Heidelberg, Germany))で行った。
【0109】
図2に示されるように、漸増量のhuHEA125−アマニチン複合体又は非改変huHEA125抗体による標的細胞に対する結合の競合により、競合する抗体又は抗体複合体の10ng/ml〜400μg/mlの全濃度範囲にわたる同程度の結合強度が明らかとなった。したがって、複合体形成手順は、標的細胞に対するhuHEA125−アマニチンの親和性を顕著には変化させない。
【0110】
実施例2:間接的な免疫蛍光により検出される様々な癌細胞株上におけるEpCAM抗原の表面発現
初めに、細胞株Capan−1、Colo205、OZ、MCF−7、BxPC−3及びPC−3を、huHEA125又はXolair(登録商標)と共にインキュベートした。洗浄後、一次抗体の結合を、第2工程の試薬としてのFITC標識したヤギ抗ヒトIgG(H+L)のF(ab’)2により可視化した。結果を、図3A(Capan−1)、図3B(Colo205)、図3C(OZ)、図3D(MCF−7)、図3E(BxPC−3)及び図3F(PC−3)に示す。各図の左側における灰色の影付きのヒストグラムは、対照抗体Xolair(登録商標)により得られた結果を示す。各図の右側における白色の領域を有するヒストグラムは、抗体huHEA125により得られた結果を示す。
【0111】
実施例3:アマニチン及びアマニチン/抗体複合体による癌細胞増殖阻害の誘導
3.1 癌細胞株
以下の癌細胞株を成長阻害研究のために使用した:
Capan−1、BxPC−3 ヒト膵臓腺癌
MCF−7 ヒト乳腺癌
Colo205 ヒト結腸がん転移
OZ ヒト胆管癌
PC−3 ヒト前立腺腺癌
【0112】
3.2 増殖阻害アッセイ
アマニチン−IgG複合体による細胞成長の阻害を、[3H]−チミジンの取り込みにより決定した。完全培地(10%の熱失活させたFCS、2mMのL−グルタミン、及び1mMのピルビン酸ナトリウムを添加したRPMI1640)中における2×10−5M〜6×10−13Mの範囲のアマニチン−huHEA125、アマニチン−Xolair、及び遊離のアマニチンの段階希釈液を、96ウェル平底組織培養マイクロタイタープレートのウェルにおける100μlの容量で三連で調製した。細胞を、1ml当たり2×104個の密度、1ウェル当たり50μlの容量で添加した。プレートを、加湿雰囲気中、37℃及び5%CO2下で72時間又は96時間インキュベートした。アッセイ終了の20時間前に、1μCiの[3H]−チミジンを添加した。その後、プレートをTomtecセルハーベスターにより処理し、取り込まれた放射活性を液体シンチレーション計測(Wallac Betaplate Liquid Scintillation Counter(PerkinElmer Life and Analytical Sciences))により決定し、cpmで表した。
【0113】
膵臓癌細胞株Capan−1の場合には、huHEA125−アマニチン免疫毒素は、図4に示されるように1×10−11M〜3×10−10Mのアマニチン濃度で成長停止を誘導した。
【0114】
結腸がん細胞株Colo205の場合には、huHEA125−アマニチン免疫毒素は、図5に示されるように1×10−12M〜4×10−11Mのアマニチン濃度で成長停止を誘導した。
【0115】
乳がん細胞株MCF−7の場合には、huHEA125−アマニチン免疫毒素は、図6に示されるように1×10−12M〜1×10−11Mのアマニチン濃度で成長停止を誘導した。
【0116】
胆管癌細胞株OZの場合には、huHEA125−アマニチン免疫毒素は、図7に示されるように1×10−11M〜6×10−10Mのアマニチン濃度で成長停止を誘導した。
【0117】
膵臓細胞株BxPC−3の場合には、huHEA125−アマニチン免疫毒素は、図8に示されるように2×10−11M〜6×10−10Mのアマニチン濃度で成長停止を誘導した。
【0118】
実施例4:2つの異種移植マウス腫瘍モデルを使用するアマニチン/抗体複合体によるin vivoでの腫瘍の成長の阻害
5週齢〜6週齢の免疫不全NOD/SCIDマウスを全実験に使用した。BxPC−3膵臓腫瘍細胞又はPC−3前立腺腫瘍細胞(100μl PBS中5×106個)を、マウスの右側腹部の皮下に移植した。10日後、BxPC−3腫瘍が30mm3〜80mm3の体積に到達し、PC−3腫瘍が40mm3〜190mm3の体積に到達した時に、処理を開始した。動物に、対照huHEA125モノクローナル抗体を15mg/kgの用量で、又はhuHEA125−アマニチン複合体(huHEA125−Ama)を50μg/kgのアマニチンの用量で投与した。抗体及び複合体は、単回腹腔内注射剤として投与した。
【0119】
腫瘍の成長を、処理の開始後16日間モニタリングした。3日に1回、ノギスを使用して外側から腫瘍サイズを測定した。式:V=π/6×a×b×c(式中、a、b及びcは三次元における直径である)に従って腫瘍体積を算出した。データを、抗体投与時からの相対的な腫瘍サイズ/体積の増大として表す。
【0120】
50μg/kgのアマニチンの用量でのhuHEA125−Amaの投与は、BxPC−3腫瘍を保有するマウスで耐容性が良好であった(n=6)。マウスの体重の減少も、肝酵素の上昇も起こらなかった(実験の最終日に血清中のLDH、ALT、AST及びAPを測定した)。腫瘍の成長は、この用量の複合体により強く阻害された。全てのマウスが処理に応答し、腫瘍体積は複合体の投与後7日目から劇的に消失した。16日目の経過観察の終了時に、腫瘍は50%のマウスにおいて完全に根絶された。対照的に、複合体形成していないhuHEA125モノクローナル抗体を投与された対照マウスでは、腫瘍体積はおよそ880%増大した(図9)。
【0121】
PC−3腫瘍を保有するマウスの場合には、50μg/kgのアマニチンの用量のhuHEA125−Amaは耐容性が良好であった。マウスの体重の減少は観察されなかった。腫瘍の成長はこの用量の複合体により大幅に遅延化した。huHEA125−Ama投与の10日後、腫瘍体積は、処理の開始時の腫瘍体積と同様であった。対照的に、複合体形成していないhuHEA125モノクローナル抗体を投与された対照マウスでは、腫瘍体積はおよそ550%増大した。実験は、対照群の腫瘍サイズが大きいために処理後10日目で終了した(図10)。
【0122】
引用文献
Al-Hajj M., Wicha M.S., Benito-Hernandez A., Morrison S.J., ClarkeM.F. Prospective identification of tumorigenic breast cancer cells. Proc. Natl.Acad. Sci. USA100(7), 3983-3988 (2003)
Allard W.J., Matera J., Miller M.C., Repollet M., Connelly M.C.,Rao C., Tibbe A.G., Uhr J.W., Terstappen L.W. Tumor cells circulate in theperipheral blood of all major carcinomas but not in healthy subjects orpatients with nonmalignant diseases. Clin. Cancer Res. 10(20), 6897-6904 (2004)
Baeuerle P.A. and Gires O. EpCAM (CD326) finding its role incancer. Br. J. Cancer 96(3), 417-423 (2007)
Balzar M., Winter M.J., de Boer C.J., Litvinov S.V. The biology ofthe 17-1A antigen (Ep-CAM). J. Mol. Med. 77(10), 699-712 (1999)
Binz H.K., Amstutz P., Plueckthun A. Engineering novel bindingproteins from nonimmunoglobulin domains. Nat Biotechnol. 23(10):1257-1268(2005)
Brody E.N. and Gold L., Aptamers as therapeutic and diagnosticagents. J. Biotechnol. 74(1):5-13 (2000)
Dalerba P., Dylla S.J., Park I.K., Liu R., Wang X., Cho R.W., HoeyT., Gurney A., Huang E.H., Simeone D.M., Shelton A.A., Parmiani G., CastelliC., Clarke M.F. Phenotypic characterization of human colorectal cancer stemcells. Proc. Natl. Acad. Sci. USA 104(24), 10158-10163 (2007)
Gastl G., Spizzo G., Obrist P., Duenser M., Mikuz G. Ep-CAMoverexpression in breast cancer as a predictor of survival. Lancet 356(9246),1981-1982 (2000)
Holliger P., Prospero T., Winter G. "Diabodies": smallbivalent and bispecific antibody fragments. Proc. Natl. Acad. Sci. U.S.A.90(14), 6444-6448 (1993)
Leuenberger, H.G.W, Nagel, B. and Koelbl, H.eds. "Amultilingual glossary of biotechnological terms: (IUPAC Recommendations)",Helvetica Chimica Acta, CH-4010 Basel, Switzerland), 1995
Li C., Heidt D.G., Dalerba P., Burant C.F., Zhang L., Adsay V.,Wicha M., Clarke M.F., Simeone D.M. Identification of pancreatic cancer stemcells. Cancer Res. 67(3), 1030-1037 (2007)
Moldenhauer G., Momburg F., Moeller P., Schwartz R., HaemmerlingG.J. Epithelium-specific surface glycoprotein of Mr 34,000 is a widelydistributed human carcinoma marker. Br. J. Cancer 56(6), 714-721 (1987)
Momburg F., Moldenhauer G., Haemmerling G.J., Moeller P.Immunohistochemical study of the expression of a Mr 34,000 humanepithelium-specific surface glycoprotein in normal and malignant tissues.Cancer Res. 47(11), 2883-2891 (1987)
Nagrath S., Sequist L.V., Maheswaran S., Bell D.W., Irimia D.,Ulkus L., Smith M.R., Kwak E.L., Digumarthy S., Muzikansky A., Ryan P., BalisU.J., Tompkins R.G., Haber D.A., Toner M. Isolation of rare circulating tumourcells in cancer patients by microchip technology. Nature 450(7173), 1235-1239(2007)
Spizzo G., Obrist P., Ensinger C., Theurl I., Duenser M., RamoniA., Gunsilius E., Eibl G., Mikuz G., Gastl G. Prognostic significance of Ep-CAMAND Her-2/neu overexpression in invasive breast cancer. Int. J. Cancer 98(6),883-888 (2002)
Spizzo G., Went P., Dirnhofer S., Obrist P., Simon R., SpichtinH., Maurer R., Metzger U., von Castelberg B., Bart R., Stopatschinskaya S., KoechliO.R., Haas P., Mross F., Zuber M., Dietrich H., Bischoff S., Mirlacher M.,Sauter G., Gastl G. High Ep-CAM expression is associated with poor prognosis innode-positive breast cancer. Breast Cancer Res. Treat. 86(3), 207-213 (2004)
Trzpis M., McLaughlin P.M., de Leij L.M., Harmsen M.C. Epithelialcell adhesion molecule: more than a carcinoma marker and adhesion molecule. Am.J. Pathol. 171(2), 386-395 (2007)
Varga M., Obrist P., Schneeberger S., Muehlmann G.,Felgel-Farnholz C., Fong D., Zitt M., Brunhuber T., Schaefer G., Gastl G.,Spizzo G. Overexpression of epithelial cell adhesion molecule antigen ingallbladder carcinoma is an independent marker for poor survival. Clin. CancerRes. 10(9), 3131-3136 (2004)
Went P.T., Lugli A., Meier S., Bundi M., Mirlacher M., Sauter G.,Dirnhofer S. Frequent EpCam protein expression in human carcinomas. Hum.Pathol. 35(1), 122-128, 2004
Wieland, T. and Faulstich H. Amatoxins, phallotoxins, phallolysin,and antamanide: the biologically active components of poisonous Amanitamushrooms. CRC Crit. Rev. Biochem. 5(3), 185-260 (1978)
Winter M.J., Nagtegaal I.D., van Krieken J.H., Litvinov S.V. Theepithelial cell adhesion molecule (Ep-CAM) as a morphoregulatory molecule is atool in surgical pathology. Am. J. Pathol. 163(6), 2139-2148 (2003)
【0123】
配列リスト−フリーテキストの情報
配列番号1:キメラ抗体huHEA125、重鎖、膜結合型
配列番号2:キメラ抗体huHEA125、重鎖、分泌型
配列番号3:キメラ抗体huHEA125、重鎖、VHドメイン
配列番号4:キメラ抗体huHEA125、重鎖、FR1セグメント
配列番号5:キメラ抗体huHEA125、重鎖、CDR1セグメント
配列番号6:キメラ抗体huHEA125、重鎖、FR2セグメント
配列番号7:キメラ抗体huHEA125、重鎖、CDR2セグメント
配列番号8:キメラ抗体huHEA125、重鎖、FR3セグメント
配列番号9:キメラ抗体huHEA125、重鎖、CDR3セグメント
配列番号10:キメラ抗体huHEA125、重鎖、FR4セグメント
配列番号11:キメラ抗体huHEA125、軽鎖
配列番号12:キメラ抗体huHEA125、軽鎖、VLドメイン
配列番号13:キメラ抗体huHEA125、軽鎖、FR1セグメント
配列番号14:キメラ抗体huHEA125、軽鎖、CDR1セグメント
配列番号15:キメラ抗体huHEA125、軽鎖、FR2セグメント
配列番号16:キメラ抗体huHEA125、軽鎖、CDR2セグメント
配列番号17:キメラ抗体huHEA125、軽鎖、FR3セグメント
配列番号18:キメラ抗体huHEA125、軽鎖、CDR3セグメント
配列番号19:キメラ抗体huHEA125、軽鎖、FR4セグメント
配列番号20:キメラ抗体huHEA125、重鎖、CDR1ドメイン
配列番号21:キメラ抗体huHEA125、重鎖、CDR2ドメイン
配列番号22:キメラ抗体huHEA125、重鎖、CDR3ドメイン
配列番号23:キメラ抗体huHEA125、軽鎖、CDR1ドメイン
配列番号24:キメラ抗体huHEA125、軽鎖、CDR2ドメイン
配列番号25:キメラ抗体huHEA125、軽鎖、CDR3ドメイン
配列番号26:キメラ抗体huHEA125、重鎖、定常ドメイン、膜結合型
配列番号27:キメラ抗体huHEA125、重鎖、定常ドメイン、分泌型
配列番号28:キメラ抗体huHEA125、軽鎖、定常ドメイン
【特許請求の範囲】
【請求項1】
患者における膵臓がん、胆管癌又は結腸直腸がんの治療のための抗体毒素複合体であって、
(i)上皮細胞接着分子(EpCAM)のエピトープと特異的に結合する抗体又はその抗原結合断片、
(ii)アマトキシン、及び
(iii)任意にリンカーL1
を含む、抗体毒素複合体。
【請求項2】
抗体又はその抗原結合断片が、ダイアボディ、テトラボディ、ナノボディ、キメラ抗体、脱免疫化抗体、ヒト化抗体又はヒト抗体から選択される、請求項1に記載の複合体。
【請求項3】
抗原結合断片が、Fab、F(ab’)2、Fd、Fv、一本鎖Fv、及びジスルフィド結合したFv(dsFv)からなる群から選択される、請求項1又は2に記載の複合体。
【請求項4】
EpCAMのエピトープがヒトEpCAMのエピトープである、請求項1〜3のいずれか一項に記載の複合体。
【請求項5】
抗体又はその抗原結合断片が、
(a)huHEA125の重鎖のCDR3ドメイン(配列番号22)、及び/又は
(b)huHEA125の軽鎖のCDR3ドメイン(配列番号25)
を含む、請求項1〜4のいずれか一項に記載の複合体。
【請求項6】
抗体又はその抗原結合断片が、
(a)huHEA125の重鎖のCDR2ドメイン(配列番号21)、
(b)huHEA125の重鎖のCDR1ドメイン(配列番号20)、
(c)huHEA125の軽鎖のCDR2ドメイン(配列番号24)、及び
(d)huHEA125の軽鎖のCDR1ドメイン(配列番号23)
のうち1つ又は複数をさらに含む、請求項5に記載の複合体。
【請求項7】
抗体又はその抗原結合断片が、huHEA125のVHドメイン(配列番号3)、及び/又はhuHEA125のVLドメイン(配列番号12)を含む、請求項1〜6のいずれか一項に記載の複合体。
【請求項8】
抗体又はその抗原結合断片が、
(a)huHEA125の膜結合型の重鎖(配列番号1)、若しくはhuHEA125の可溶型の重鎖(配列番号2)、及び/又は
(b)huHEA125の軽鎖(配列番号11)
を含む、請求項1〜7のいずれか一項に記載の複合体。
【請求項9】
アマトキシンが、α−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン若しくはアマヌリン酸、又はその塩若しくは類縁体から選択される、請求項1〜8のいずれか一項に記載の複合体。
【請求項10】
抗体毒素複合体であって、
(i)上皮細胞接着分子(EpCAM)と特異的に結合する抗体又はその抗原結合断片であって、
(a)huHEA125の重鎖であって、
(a1)配列番号1に記載の膜結合型の重鎖であって、
配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含み、
配列番号26に示されるような重鎖の定常ドメインが、0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含む、
膜結合型の重鎖、並びに
(a2)配列番号2に記載の可溶型の重鎖であって、
配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含み、
配列番号27に示されるような重鎖の定常ドメインが、0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含む、
可溶型の重鎖
からなる群から選択される、huHEA125の重鎖、並びに
(b)配列番号11に記載のhuHEA125の軽鎖であって、
配列番号12に示されるような軽鎖の可変ドメインVLが、VLのフレームワーク領域に位置する0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含み、
配列番号28に示されるような軽鎖の定常ドメインCLが、0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含む、
huHEA125の軽鎖
を含む、抗体又はその抗原結合断片、
(ii)アマトキシン、並びに
(iii)任意にリンカーL2
を含む、抗体毒素複合体。
【請求項11】
抗体又はその抗原結合断片が、キメラ抗体、脱免疫化抗体、ヒト化抗体又はヒト抗体から選択される、請求項10に記載の複合体。
【請求項12】
抗原結合断片がFab、F(ab’)2及びFdからなる群から選択される、請求項10又は11に記載の複合体。
【請求項13】
抗体がhuHEA125又はその抗原結合断片である、請求項10〜12のいずれか一項に記載の複合体。
【請求項14】
アマトキシンが、α−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン若しくはアマヌリン酸、又はその塩若しくは類縁体から選択される、請求項10〜13のいずれか一項に記載の複合体。
【請求項15】
医療における使用のための請求項10〜14のいずれか一項に記載の複合体。
【請求項16】
患者におけるがんの治療のための請求項10〜14のいずれか一項に記載の複合体であって、該がんが、膵臓がん、胆管癌、乳がん及び結腸直腸がんからなる群から選択される、請求項10〜14のいずれか一項に記載の複合体。
【請求項17】
標的結合部分毒素複合体であって、
(i)上皮細胞接着分子(EpCAM)のエピトープと特異的に結合する標的結合部分、
(ii)アマトキシン、及び
(iii)任意にリンカーL3
を含み、
該アマトキシンが、アマトキシンのアミノ酸3のδC原子を介して、該標的結合部分と、又は存在する場合該リンカーL3と連結される、
標的結合部分毒素複合体。
【請求項18】
アマトキシンが、アマトキシンのアミノ酸3のδC原子と結合した酸素原子を介して、該標的結合部分と、又は存在する場合該リンカーL3と連結される、請求項17に記載の標的結合部分毒素複合体。
【請求項19】
アマトキシンが、エステル結合、エーテル結合又はウレタン結合を介して、該標的結合部分と、又は存在する場合該リンカーL3と連結される、請求項17又は18に記載の標的結合部分毒素複合体。
【請求項20】
リンカーL3が存在し、該複合体が以下の構造:
(i)アマトキシン−δC−O−C(O)−L3−C(O)−NH−標的結合部分、
(ii)アマトキシン−δC−O−L3−C(O)−NH−標的結合部分、又は
(iii)アマトキシン−δC−O−C(O)−NH−L3−C(O)−NH−標的結合部分
のうちの1つを有する、請求項17〜19のいずれか一項に記載の標的結合部分毒素複合体。
【請求項21】
標的結合部分が、該標的結合部分に存在するアミノ基を介して、該アマトキシンと、又は存在する場合該リンカーL3と連結される、請求項17〜20のいずれか一項に記載の標的結合部分毒素複合体。
【請求項22】
アマトキシンが、α−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン若しくはアマヌリン酸から、又はその塩若しくは類縁体から選択される、請求項17〜21のいずれか一項に記載の標的結合部分毒素複合体。
【請求項23】
リンカーL3が、任意に置換されたアルキル基、ヘテロアルキル基、アルケニル基、ヘテロアルケニル基、アルキニル基、ヘテロアルキニル基、シクロアルキル基、ヘテロシクロアルキル基、アリール基、ヘテロアリール基、アラルキル基又はヘテロアラルキル基である、請求項17〜22のいずれか一項に記載の標的結合部分毒素複合体。
【請求項24】
リンカーL3がジスルフィド結合を含む、請求項17〜23のいずれか一項に記載の標的結合部分毒素複合体。
【請求項25】
標的結合部分が、腫瘍細胞上に存在するエピトープと特異的に結合する、請求項17〜24のいずれか一項に記載の標的結合部分毒素複合体。
【請求項26】
標的結合部分が、
(i)抗体又はその抗原結合断片、
(ii)抗体様タンパク質、及び
(iii)核酸アプタマー
からなる群から選択される、請求項17〜25のいずれか一項に記載の標的結合部分毒素複合体。
【請求項27】
抗体又はその抗原結合断片が、ダイアボディ、テトラボディ、ナノボディ、キメラ抗体、脱免疫化抗体、ヒト化抗体又はヒト抗体から選択される、請求項26に記載の標的結合部分毒素複合体。
【請求項28】
抗原結合断片が、Fab、F(ab’)2、Fd、Fv、一本鎖Fv、及びジスルフィド結合したFv(dsFv)からなる群から選択される、請求項26又は27に記載の標的結合部分毒素複合体。
【請求項29】
抗体又はその抗原結合断片が、
(a)huHEA125の膜結合型の重鎖(配列番号1)、若しくはhuHEA125の可溶型の重鎖(配列番号2)、及び/又は
(b)huHEA125の軽鎖(配列番号11)
を含む、請求項26又は27に記載の標的結合部分毒素複合体。
【請求項30】
医療における使用のための請求項17〜29のいずれか一項に記載の標的結合部分毒素複合体。
【請求項31】
患者におけるがんの治療のための請求項17〜30のいずれか一項に記載の標的結合部分毒素複合体であって、該がんが、膵臓がん、胆管癌、乳がん、結腸直腸がん、肺がん、前立腺がん、卵巣がん、胃がん、腎臓がん、悪性黒色腫、白血病及び悪性リンパ腫からなる群から選択される、標的結合部分毒素複合体。
【請求項32】
請求項1〜14のいずれか一項に記載の抗体毒素複合体、又は請求項17〜29のいずれか一項に記載の標的結合部分毒素複合体を含み、1つ又は複数の薬学的に許容可能な希釈剤、担体、賦形剤、充填剤、結合剤、滑剤、流動促進剤、崩壊剤、吸着剤、及び/又は保存料をさらに含む医薬組成物。
【請求項1】
患者における膵臓がん、胆管癌又は結腸直腸がんの治療のための抗体毒素複合体であって、
(i)上皮細胞接着分子(EpCAM)のエピトープと特異的に結合する抗体又はその抗原結合断片、
(ii)アマトキシン、及び
(iii)任意にリンカーL1
を含む、抗体毒素複合体。
【請求項2】
抗体又はその抗原結合断片が、ダイアボディ、テトラボディ、ナノボディ、キメラ抗体、脱免疫化抗体、ヒト化抗体又はヒト抗体から選択される、請求項1に記載の複合体。
【請求項3】
抗原結合断片が、Fab、F(ab’)2、Fd、Fv、一本鎖Fv、及びジスルフィド結合したFv(dsFv)からなる群から選択される、請求項1又は2に記載の複合体。
【請求項4】
EpCAMのエピトープがヒトEpCAMのエピトープである、請求項1〜3のいずれか一項に記載の複合体。
【請求項5】
抗体又はその抗原結合断片が、
(a)huHEA125の重鎖のCDR3ドメイン(配列番号22)、及び/又は
(b)huHEA125の軽鎖のCDR3ドメイン(配列番号25)
を含む、請求項1〜4のいずれか一項に記載の複合体。
【請求項6】
抗体又はその抗原結合断片が、
(a)huHEA125の重鎖のCDR2ドメイン(配列番号21)、
(b)huHEA125の重鎖のCDR1ドメイン(配列番号20)、
(c)huHEA125の軽鎖のCDR2ドメイン(配列番号24)、及び
(d)huHEA125の軽鎖のCDR1ドメイン(配列番号23)
のうち1つ又は複数をさらに含む、請求項5に記載の複合体。
【請求項7】
抗体又はその抗原結合断片が、huHEA125のVHドメイン(配列番号3)、及び/又はhuHEA125のVLドメイン(配列番号12)を含む、請求項1〜6のいずれか一項に記載の複合体。
【請求項8】
抗体又はその抗原結合断片が、
(a)huHEA125の膜結合型の重鎖(配列番号1)、若しくはhuHEA125の可溶型の重鎖(配列番号2)、及び/又は
(b)huHEA125の軽鎖(配列番号11)
を含む、請求項1〜7のいずれか一項に記載の複合体。
【請求項9】
アマトキシンが、α−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン若しくはアマヌリン酸、又はその塩若しくは類縁体から選択される、請求項1〜8のいずれか一項に記載の複合体。
【請求項10】
抗体毒素複合体であって、
(i)上皮細胞接着分子(EpCAM)と特異的に結合する抗体又はその抗原結合断片であって、
(a)huHEA125の重鎖であって、
(a1)配列番号1に記載の膜結合型の重鎖であって、
配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含み、
配列番号26に示されるような重鎖の定常ドメインが、0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含む、
膜結合型の重鎖、並びに
(a2)配列番号2に記載の可溶型の重鎖であって、
配列番号3に示されるような重鎖の可変ドメインVHが、VHのフレームワーク領域に位置する0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含み、
配列番号27に示されるような重鎖の定常ドメインが、0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含む、
可溶型の重鎖
からなる群から選択される、huHEA125の重鎖、並びに
(b)配列番号11に記載のhuHEA125の軽鎖であって、
配列番号12に示されるような軽鎖の可変ドメインVLが、VLのフレームワーク領域に位置する0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含み、
配列番号28に示されるような軽鎖の定常ドメインCLが、0個〜10個のアミノ酸置換、0個〜10個のアミノ酸欠失、及び/又は0個〜10個のアミノ酸付加を含む、
huHEA125の軽鎖
を含む、抗体又はその抗原結合断片、
(ii)アマトキシン、並びに
(iii)任意にリンカーL2
を含む、抗体毒素複合体。
【請求項11】
抗体又はその抗原結合断片が、キメラ抗体、脱免疫化抗体、ヒト化抗体又はヒト抗体から選択される、請求項10に記載の複合体。
【請求項12】
抗原結合断片がFab、F(ab’)2及びFdからなる群から選択される、請求項10又は11に記載の複合体。
【請求項13】
抗体がhuHEA125又はその抗原結合断片である、請求項10〜12のいずれか一項に記載の複合体。
【請求項14】
アマトキシンが、α−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン若しくはアマヌリン酸、又はその塩若しくは類縁体から選択される、請求項10〜13のいずれか一項に記載の複合体。
【請求項15】
医療における使用のための請求項10〜14のいずれか一項に記載の複合体。
【請求項16】
患者におけるがんの治療のための請求項10〜14のいずれか一項に記載の複合体であって、該がんが、膵臓がん、胆管癌、乳がん及び結腸直腸がんからなる群から選択される、請求項10〜14のいずれか一項に記載の複合体。
【請求項17】
標的結合部分毒素複合体であって、
(i)上皮細胞接着分子(EpCAM)のエピトープと特異的に結合する標的結合部分、
(ii)アマトキシン、及び
(iii)任意にリンカーL3
を含み、
該アマトキシンが、アマトキシンのアミノ酸3のδC原子を介して、該標的結合部分と、又は存在する場合該リンカーL3と連結される、
標的結合部分毒素複合体。
【請求項18】
アマトキシンが、アマトキシンのアミノ酸3のδC原子と結合した酸素原子を介して、該標的結合部分と、又は存在する場合該リンカーL3と連結される、請求項17に記載の標的結合部分毒素複合体。
【請求項19】
アマトキシンが、エステル結合、エーテル結合又はウレタン結合を介して、該標的結合部分と、又は存在する場合該リンカーL3と連結される、請求項17又は18に記載の標的結合部分毒素複合体。
【請求項20】
リンカーL3が存在し、該複合体が以下の構造:
(i)アマトキシン−δC−O−C(O)−L3−C(O)−NH−標的結合部分、
(ii)アマトキシン−δC−O−L3−C(O)−NH−標的結合部分、又は
(iii)アマトキシン−δC−O−C(O)−NH−L3−C(O)−NH−標的結合部分
のうちの1つを有する、請求項17〜19のいずれか一項に記載の標的結合部分毒素複合体。
【請求項21】
標的結合部分が、該標的結合部分に存在するアミノ基を介して、該アマトキシンと、又は存在する場合該リンカーL3と連結される、請求項17〜20のいずれか一項に記載の標的結合部分毒素複合体。
【請求項22】
アマトキシンが、α−アマニチン、β−アマニチン、γ−アマニチン、ε−アマニチン、アマニン、アマニンアミド、アマヌリン若しくはアマヌリン酸から、又はその塩若しくは類縁体から選択される、請求項17〜21のいずれか一項に記載の標的結合部分毒素複合体。
【請求項23】
リンカーL3が、任意に置換されたアルキル基、ヘテロアルキル基、アルケニル基、ヘテロアルケニル基、アルキニル基、ヘテロアルキニル基、シクロアルキル基、ヘテロシクロアルキル基、アリール基、ヘテロアリール基、アラルキル基又はヘテロアラルキル基である、請求項17〜22のいずれか一項に記載の標的結合部分毒素複合体。
【請求項24】
リンカーL3がジスルフィド結合を含む、請求項17〜23のいずれか一項に記載の標的結合部分毒素複合体。
【請求項25】
標的結合部分が、腫瘍細胞上に存在するエピトープと特異的に結合する、請求項17〜24のいずれか一項に記載の標的結合部分毒素複合体。
【請求項26】
標的結合部分が、
(i)抗体又はその抗原結合断片、
(ii)抗体様タンパク質、及び
(iii)核酸アプタマー
からなる群から選択される、請求項17〜25のいずれか一項に記載の標的結合部分毒素複合体。
【請求項27】
抗体又はその抗原結合断片が、ダイアボディ、テトラボディ、ナノボディ、キメラ抗体、脱免疫化抗体、ヒト化抗体又はヒト抗体から選択される、請求項26に記載の標的結合部分毒素複合体。
【請求項28】
抗原結合断片が、Fab、F(ab’)2、Fd、Fv、一本鎖Fv、及びジスルフィド結合したFv(dsFv)からなる群から選択される、請求項26又は27に記載の標的結合部分毒素複合体。
【請求項29】
抗体又はその抗原結合断片が、
(a)huHEA125の膜結合型の重鎖(配列番号1)、若しくはhuHEA125の可溶型の重鎖(配列番号2)、及び/又は
(b)huHEA125の軽鎖(配列番号11)
を含む、請求項26又は27に記載の標的結合部分毒素複合体。
【請求項30】
医療における使用のための請求項17〜29のいずれか一項に記載の標的結合部分毒素複合体。
【請求項31】
患者におけるがんの治療のための請求項17〜30のいずれか一項に記載の標的結合部分毒素複合体であって、該がんが、膵臓がん、胆管癌、乳がん、結腸直腸がん、肺がん、前立腺がん、卵巣がん、胃がん、腎臓がん、悪性黒色腫、白血病及び悪性リンパ腫からなる群から選択される、標的結合部分毒素複合体。
【請求項32】
請求項1〜14のいずれか一項に記載の抗体毒素複合体、又は請求項17〜29のいずれか一項に記載の標的結合部分毒素複合体を含み、1つ又は複数の薬学的に許容可能な希釈剤、担体、賦形剤、充填剤、結合剤、滑剤、流動促進剤、崩壊剤、吸着剤、及び/又は保存料をさらに含む医薬組成物。
【図1】


【図2】


【図3A】


【図3B】


【図3C】


【図3D】


【図3E】


【図3F】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3A】


【図3B】


【図3C】


【図3D】


【図3E】


【図3F】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公表番号】特表2012−523383(P2012−523383A)
【公表日】平成24年10月4日(2012.10.4)
【国際特許分類】
【出願番号】特願2012−503923(P2012−503923)
【出願日】平成22年4月8日(2010.4.8)
【国際出願番号】PCT/EP2010/002206
【国際公開番号】WO2010/115630
【国際公開日】平成22年10月14日(2010.10.14)
【出願人】(511230646)
【出願人】(500349247)
【氏名又は名称原語表記】Deutsches Krebsforschungszentrum
【住所又は居所原語表記】Im Neuenheimer Feld 280,D−69120 Heidelberg,Germany
【Fターム(参考)】
【公表日】平成24年10月4日(2012.10.4)
【国際特許分類】
【出願日】平成22年4月8日(2010.4.8)
【国際出願番号】PCT/EP2010/002206
【国際公開番号】WO2010/115630
【国際公開日】平成22年10月14日(2010.10.14)
【出願人】(511230646)

【出願人】(500349247)

【氏名又は名称原語表記】Deutsches Krebsforschungszentrum
【住所又は居所原語表記】Im Neuenheimer Feld 280,D−69120 Heidelberg,Germany
【Fターム(参考)】
[ Back to top ]

