がん細胞自動分離装置およびがん細胞自動分離方法
【課題】マイクロ流体チップを用いて、極低濃度のがん細胞をその他の細胞から迅速にかつ正確に分離することができ、がん細胞およびその他の細胞を非侵襲的に回収することができるがん細胞自動分離装置およびがん細胞自動分離方法を提供する。
【解決手段】微小流路に導入されたがん細胞を含む細胞懸濁流体から、がん細胞を自動分離するがん細胞自動分離装置であって、前記微小流路は、(a)主流路、(b)前記主流路の上端において、前記主流路の延長方向に設けられた、前記細胞懸濁流体が導入される第1の入口分岐流路、及び(c)前記主流路の上端において、前記主流路に対し所定の角度をつけて設けられた、細胞や微粒子を含まない流体が導入される第2の入口分岐流路を有し、前記主流路は、その流路高さが標的がん細胞の代表径以下となる部分Aを、前記第2の入口分岐流路とは反対側に有することを特徴とするがん細胞自動分離装置。
【解決手段】微小流路に導入されたがん細胞を含む細胞懸濁流体から、がん細胞を自動分離するがん細胞自動分離装置であって、前記微小流路は、(a)主流路、(b)前記主流路の上端において、前記主流路の延長方向に設けられた、前記細胞懸濁流体が導入される第1の入口分岐流路、及び(c)前記主流路の上端において、前記主流路に対し所定の角度をつけて設けられた、細胞や微粒子を含まない流体が導入される第2の入口分岐流路を有し、前記主流路は、その流路高さが標的がん細胞の代表径以下となる部分Aを、前記第2の入口分岐流路とは反対側に有することを特徴とするがん細胞自動分離装置。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、がん細胞と他の細胞とを分離することができるがん細胞自動分離装置およびがん細胞自動分離方法に関する。
【背景技術】
【0002】
胃がんの腹膜転移は術後の最も多い再発形式であり、有効な治療法もなく予後は極めて不良である。腹膜転移の有効な診断方法の一つとして腹腔洗浄細胞診が広く行われているが、検出精度が悪く、発見されても予後が不良であることが多い。
腹腔洗浄細胞診の検出精度を上げるために腹腔洗浄液中のがん細胞を分離・濃縮する方法がある。その一例として、標的がん細胞を蛍光標識して画像認識により分離する方法(蛍光活性化セルソーター:FACS)、または特異的抗体反応や誘電泳動力(特許文献1)を利用した分離方法が挙げられる。
【0003】
一般的に腹腔洗浄液や血液、またはリンパ液中の転移がん細胞はがん細胞塊として存在し、その他の細胞よりサイズ径が大きい特性を示すことが見出されている。また近年、微小流路を持つマイクロ流体チップを用いて流体力のみで微粒子を分離・濃縮する方法が提案されている(特許文献2)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2010−227016号公報
【特許文献2】特開2004−154747号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
活性化セルソーター(FACS)を用いる場合、一般的に大型の装置導入と訓練されたオペレータの確保が必要である。さらに、多量の試料容量を必要とし10、000未満の細胞数の分離能力は著しく低い。また、特許文献1の技術のように、標的がん細胞へ蛍光抗体色素の標識や電磁気力の負荷で分離する場合、標的がん細胞に対する蛍光色素の侵襲や外部力の影響は回避できない。
【0006】
また、特許文献2の技術において、流体力は微小流路内の圧力変動に対して分離・濃縮の影響を受けやすい特徴があり、流量または流速の微小な調整をする必要があり、圧力変動に対してロバストかつ連続的に分離・濃縮することが困難である。
【0007】
本発明は、がん細胞を分離する際に、標的がん細胞自体を蛍光標識することや電磁気力で侵襲することなく、極低濃度のがん細胞をその他の細胞から迅速にかつ正確に分離することができ、圧力変動に対してロバストかつ連続的に分離・濃縮することができるがん細胞自動分離装置およびがん細胞自動分離方法を提供しようとするものである。
【課題を解決するための手段】
【0008】
上記目的を達成するために、本発明に係るがん細胞自動分離装置は、微小流路に導入されたがん細胞を含む細胞懸濁流体から、がん細胞と他の細胞とのサイズ径の差を利用してがん細胞とその他の細胞を自動分離することを特徴とする。
【0009】
上記がん細胞自動分離装置は、(a)主流路、(b)前記主流路の上端において、前記主流路の延長方向に設けられた、前記細胞懸濁流体が導入される第1の入口分岐流路、及び(c)前記主流路の上端において、前記主流路に対し所定の角度をつけて設けられた、細胞や微粒子を含まない流体が導入される第2の入口分岐流路を有し、前記主流路は、その流路高さが標的がん細胞の代表径以下となる部分Aを、前記第2の入口分岐流路とは反対側に有し、がん細胞を含む細胞群は前記第2の入口分岐流路から流体力を受け、さらに部分Aから機械的な拘束力を受けることにより、前記部分Aの高さ以下の径をもつ細胞群と前記部分Aの高さ以上の径をもつがん細胞群に自動分離することを特徴とする。
【0010】
上記がん細胞自動分離装置は、さらに、(d)前記主流路の下端において、前記主流路のうち、前記部分A以外の部分に接続した第1の出口分岐流路、及び(e)前記主流路の下端おいて、前記部分Aに接続した第2の出口分岐流路を有し、分離されたそれぞれの細胞群を回収することを特徴とする。
【0011】
上記がん細胞自動分離装置は、さらに、微小流路内にフィンを有することが好ましい。この場合、上記第2の入口分岐流路からの細胞や微粒子を含まない流体は部分A側面へ対して平行又は鋭角に流れ、かつ上記第1の入口分岐流路からの細胞懸濁流体に含まれるがん細胞群およびその他の細胞群は、ほぼすべて前記部分A側面へ接しながら流れるように誘導され、効率的に、がん細胞を分離することができる。
【0012】
上記がん細胞自動分離装置によれば、がん細胞は主流路に設けられた高さの異なる部分Aとその内壁に拘束されて分離するため、標的がん細胞自体に蛍光標識することや電磁気力で侵襲することなくダメージの少ない状態で、がん細胞を分離することができる。
【0013】
上記がん細胞自動分離装置によれば、上記第2の入口分岐流路からの流体力と前記内壁の機械的な拘束力によってがん細胞を分離するため、導入されたそれぞれの流体の流量または流速の微小な調整を必要とせず、圧力変動に対してロバストかつ連続的に、がん細胞を分離することができる。
【0014】
上記がん細胞自動分離装置によれば、上記第2の入口分岐流路からの流体力と前記内壁の機械的な拘束力によってがん細胞を分離するため、極低濃度のがん細胞であっても前記部分Aの高さ以上の径をもつがん細胞は前記内壁の機械的な拘束により自動的にかつ正確に、分離される。
【0015】
本発明のがん細胞自動分離装置は、微細加工技術を利用して作製した流路構造を有するマイクロ流体チップ上に搭載される。そのため、上記出口分岐流路を接続することにより、前記がん細胞自動分離装置が直列化、又は並列化した多段に配置されたマイクロ流体チップでもよい。マイクロ流体チップとは、複雑な流路構造を組み合わせることにより、液体や気体を流して種々の試薬の混合、化学合成、分離、精製を行わせるものである。
<発明の効果>
本発明よれば、微小流路に導入されたがん細胞を含む細胞懸濁流体から、がん細胞と他の細胞とのサイズ径の差を利用してがん細胞とその他の細胞を自動分離することにより、標的がん細胞自体ダメージの少ないうえに、極低濃度のがん細胞をその他の細胞から迅速にかつ正確に分離することができ、更に分離したがん細胞およびその他の細胞を非侵襲的に回収することができる。また、がん細胞分離に際して外部部品や高度な装置を必要とせずに、流路内の圧力変動に対してロバストかつ連続的に、がん細胞を分離することができるため、ベッドサイドなど幅広い環境で使用することが可能である。
【図面の簡単な説明】
【0016】
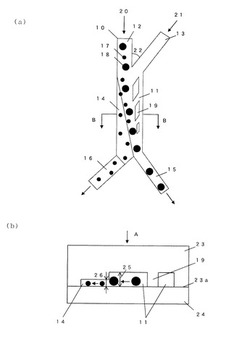
【図1】本発明によるがん細胞自動分離装置および自動分離方法の原理図を示す。図1(a)は図1(b)におけるA矢視図である。図1(b)は図1(a)におけるB−B線による断面図である。
【図2】本発明による実施形態を備えたマイクロ流体チップ27を示し、図2は図3(a)と図3(b)におけるA矢視図である。
【図3】図3(a)は図2におけるB−B 線による断面図、図3(b)は図2におけるC−C線による断面図である。
【図4】図1、2、3におけるマイクロ流体チップの1例として、実際に胃がん患者腹腔洗浄液を用いてがん細胞を分離・濃縮させた結果を示す。
【図5】本発明によるがん細胞自動分離装置を5つ備えたマイクロ流体チップ50を示す。
【図6】本発明によるがん細胞自動分離装置を3つ備えたマイクロ流体チップ65を示す。
【発明を実施するための形態】
【0017】
以下、添付の書類に基づいて、本発明によるがん細胞自動分離装置およびがん細胞自動分離方法の形態を詳細に説明する。
図1には、本発明によるがん細胞自動分離装置およびがん細胞自動分離方法の原理が示されている。
【0018】
がん細胞自動分離装置は基板28とガラス基板24とから構成され、微小流路10は、基板23の下面23aに形成された凹部である。
図1(a)において、主流路11は両端にそれぞれ分岐流路を有しており、矢印20、21はそれぞれ第1の入口分岐流路12、第2の入口分岐流路13に導入される流体の流れの方向を表している。なお、請求項における微小流路、主流路、第1の入口分岐流路、第2の入口分岐流路、部分A、第1の出口分岐流路、第2の出口分岐流路とはそれぞれ流路10、11、12、13、14、15、16のことである。
【0019】
図1(b)において、矢印25は主流路11の高さ方向を示し、矢印26は部分A14の高さ方向を示す。
微小流路10は、主流路11、第1の入口分岐流路12、第2の入口分岐流路13、第1の出口分岐流路15、及び第2の出口分岐流路16を含み、第2の入口分岐流路13は主流路11に対して所定の角度22をつけて設けられる。また、部分A14は主流路11の一部であり、第2の入口分岐流路13とは反対側に設置されている。第1の出口分岐流路15は、主流路11の下端において部分A14以外の部分に接続され、第2の出口分岐流路16は、主流路11の下端において部分A14に接続されている。ここで、主流路11に流れる上流および下流をそれぞれ上端および下端とする。
【0020】
図1(a)において、フィン19は部分A14とは反対側の主流路11内に複数個が設置されており、第2の入口分岐流路13からの細胞や微粒子を含まない流体が部分A14側面に対して平行又は鋭角に流れることを誘導する。フィン19は、必要に応じて任意の数に決める事ができ、フィン19の形状や大きさも必要に応じて任意に設定する事が可能である。
【0021】
第1の入口分岐流路12にがん細胞を含む細胞懸濁流体を連続的に導入し、第2の入口分岐流路13に細胞や微粒子を含まない流体を連続的に導入する。導入された細胞は、第2の入口分岐流路13から流体力を受け主流路11の内部において左側へ押しつけられる。しかしがん細胞は代表径が部分A14の流路高さ以上であるため機械的に拘束され、部分A14へは導入されず、第1の出口分岐流路15へ導入される。一方がん細胞以外の細胞は、代表径が部分A14の高さ以下であるため部分A14へ導入され、第2の出口分岐流路16へ導入される。
【実施例】
【0022】
以下、添付の書類に基づいて、本発明によるがん細胞自動分離装置およびがん細胞自動分離方法の実施例を詳細に説明するものとする。
図2には、本発明によるがん細胞自動分離装置およびがん細胞自動分離方法の実施形態を備えたマイクロ流体チップ27が示されており、図2は図3(a)と図3(b)におけるA矢視図であり、図3(a)は図2におけるB−B 線による断面図、図3(b)は図2におけるC−C線による断面図である。
【0023】
マイクロ流体チップ27は、微小流路30、主流路31、第1の入口分岐流路32、第2の入口分岐流路33、部分A34、第1の出口分岐流路35、第2の出口分岐流路36を有し、主流路31の高さ方向および部分A34の高さ方向はそれぞれ矢印43および矢印44で示す。
【0024】
マイクロ流体チップ27において、微小流路30は、主流路31、第1の入口分岐流路32、第2の入口分岐流路33、第1の出口分岐流路35、及び第2の出口分岐流路36を含み、第2の入口分岐流路33は主流路31に対して所定の角度38をつけて設けられる。また、部分A34は主流路31の一部であり、第2の入口分岐流路33とは反対側に設置されている。第1の出口分岐流路35は、主流路31の下端において部分A34以外の部分に接続され、第2の出口分岐流路36は、主流路31の下端において部分A34に接続されている。ここで、主流路31に流れる上流および下流をそれぞれ上端および下端とする。
【0025】
このマイクロ流体チップ27は、がん細胞を含む細胞懸濁流体を導入した際、がん細胞群と、がん細胞を含まない細胞群を別々に回収することができるマイクロ流体チップ27であり、高分子(ポリマー)材料、例えば、PDMS(ポリジメチルシロキサン)により形成された基板28とガラス基板29により形成された平板上の構造を有している。
【0026】
なお、マイクロ流体チップ27の材料としては、PDMSの他にも、アクリル等の各種ポリマー材料、ガラス、シリコン、セラミクス、ステンレスなどの各種金属、などを用いることができる。
【0027】
基板28の下面28aには主流路31、第1の入口分岐流路32、第2の入口分岐流路33、部分A34、第1の出口分岐流路35、第2の出口分岐流路36が形成されており、部分A34の高さ44は10μmであり、その他の流路の高さ43は100μmである。またこれらの値は例えば、1μm以上から1cmまで任意の値に設定することができる。
【0028】
入口ポート39はがん細胞を含む細胞懸濁流体の入口であり、入口ポート40は細胞や微粒子を含まない流体の入口である。また、出口ポート41はがん細胞が濃縮された流体の出口であり、出口ポート42はがん細胞以外の細胞を含む流体の出口である。
【0029】
入口ポート39は、基板28の上面から、第1の入口分岐流路32まで掘り下げられた孔であり、入口ポート40は、基板28の上面から、第2の入口分岐流路33まで掘り下げられた孔である。また、出口ポート41は、基板28の上面から、第1の出口分岐流路35まで掘り下げられた孔であり、出口ポート42は、基板28の上面から、第2の出口分岐流路36まで掘り下げられた孔である。
【0030】
主流路31の長さは、例えば20mmであり、分岐流路32、33、35、36の幅は、例えばそれぞれ300μm、300μm、300μm、600μmである。またこれらの値は全て、10μm以上の任意の値に設定することができる。
【0031】
フィン37a〜dは、部分A34とは反対側の主流路31内に複数個が設置されており、第2の入口分岐流路33からの細胞や微粒子を含まない流体が部分A34側面に対して平行または鋭角に流れることを補助し、必要に応じて任意の数に決める事ができ、フィンの形状や大きさも必要に応じて任意に設定する事が可能である。
【0032】
フィン37a〜dの形状は、この態様においては、主流路31の長手方向の先端に向かうほど主平面方向の幅が細くなる形状とし、かつ第2の入口分岐流路33とは反対側の側面は部分A34側面と平行になる形状とした。それにより第2の入口分岐流路33からの細胞や微粒子を含まない流体が部分A34側面に対して平行または鋭角に流れることとなり、その結果として第1の入口分岐流路32からの細胞懸濁流体に含まれるがん細胞群およびその他の細胞群は、ほぼすべて部分A34側面へ接しながら流れるように誘導され、効率的に、がん細胞を分離することができる。
【0033】
以上の構成において、上記したマイクロ流体チップ23を用いて胃がん患者腹腔洗浄液中のがん細胞を濃縮する方法について説明する。
胃がん患者腹腔洗浄液には、5mMのEDTAと0.5%のBSAを添加する。
【0034】
細胞や微粒子を含まない流体としては、培養液もしくはPBSに5mMのEDTAと0.5%のBSAを添加したものを用いる。
胃がん患者腹腔洗浄液に5mMのEDTAと0.5%のBSAを添加した流体を、入口ポート39から連続的に供給する。また、培養液もしくはPBSに5mMのEDTAと0.5%のBSAを添加した流体を入口ポート40から連続的に供給する。この時、流路構造内では、流体が層流を保ちつつ流れるほうが望ましい。なお、流体の導入に際して、シリンジポンプ等を用いた定流量導入、ボンベ、圧力装置等を用いた定圧導入の他に、電気浸透流や遠心力等を用いた方法などを用いることができる。
【0035】
この流路構造を用いた場合、入口ポート40から供給された細胞や微粒子を含まない流体により、胃がん患者腹腔洗浄液中のすべての細胞は主流路31の内部において左側へ押し付けられる。
【0036】
しかしながら主流路31は、流路高さが標的がん細胞の代表径以下となる部分A34と、それによる内壁を有するため、がん細胞は部分A34へ流れることができず、右側に設けた第1の出口分岐流路35へ向かうと期待される。
【0037】
一方、胃がん患者腹腔洗浄液に含まれる中皮細胞や赤血球等は、径が小さいため部分A34へと流れ、左側に設けた第2の出口分岐流路36へ向かうと期待される。
また、本発明は以上説明したように、細胞や微粒子を含まない流体の流れと、主流路内に設けた流路高さが標的がん細胞の代表径以下となる部分Aとそれによる内壁を用いて機械的にがん細胞塊を拘束する原理を用いるため、流路内の圧力変動に対してロバストかつ連続的に、がん細胞を分離することができる。
【0038】
また、その処理量は流路の数に比例するため、大量処理および短時間での処理を目的とする場合には同型の流路を並列化することが必要であるが、並列化は容易に行うことができる。
【0039】
実際に、胃がん患者腹腔洗浄液に5mMのEDTAと0.5%のBSAを添加した流体を入口ポート39からシリンジポンプを用いて1.5mL/hの流速で導入し、培養液に5mMのEDTAと0.5%のBSAを添加した流体を入口ポート40からシリンジポンプを用いて2.5mL/hの流速で導入したところ、がん細胞が濃縮された流体は出口ポート41から、がん細胞以外の中皮細胞や赤血球等を含む流体は出口ポート42から回収されることが確認された。
【0040】
図4は、図2のマイクロ流体チップを使用して、上記条件のもとで胃がん患者腹腔洗浄液のがん細胞分離を行った観察結果の一例である。写真45は入口ポート39から第1の入口分岐流路32に導入された流体の顕微鏡写真である。写真46、47は第1の出口分岐流路35を通って出口ポート41から、また第2の出口分岐流路36を通って出口ポート42から回収された流体のそれぞれの顕微鏡写真である。これら写真からわかるように、写真45でがん細胞(がん細胞塊)48とがん細胞以外の細胞(赤血球や中皮細胞等)49が混在していたものが、写真46では、ほぼがん細胞が観察され、写真46では、ほぼがん細胞以外の細胞49が観察される。その結果として、がん細胞の分離が確認された。
【0041】
図5に示すマイクロ流体チップ50のような構造を用いると、本発明によるがん細胞自動分離装置およびがん細胞自動分離方法を5回実施することができ、がん細胞のさらなる濃縮が期待される。
【0042】
マイクロ流体チップ50において、微小流路53は、主流路54a〜e、第1の入口分岐流路55a〜e、第2の入口分岐流路56a〜e、第1の出口分岐流路58、第2の出口分岐流路59a〜eを含む。また、部分A57a〜eはそれぞれ主流路54a〜eの一部であり、それぞれ第2の入口分岐流路56a〜eとは反対側に設置されている。第1の入口分岐流路55b〜eは、それぞれ主流路54a〜dの下端において部分A57a〜d以外の部分に接続され、第1の出口分岐流路58は、主流路54eの下端において部分A57e以外の部分に接続され、第2の出口分岐流路36a〜eは、それぞれ主流路54a〜eの下端において部分A57a〜eに接続されている。ここで、主流路54a〜eに流れる上流および下流をそれぞれ上端および下端とする。
【0043】
フィン60a〜oは、部分A57a〜eとは反対側の主流路54a〜e内に複数個が設置されており、第2の入口分岐流路56a〜eからの細胞や微粒子を含まない流体が部分A57a〜e側面に対して平行または鋭角に流れることを補助し、必要に応じて任意の数に決める事ができ、フィンの形状や大きさも必要に応じて任意に設定する事が可能である。
【0044】
マイクロ流体チップ50において、入口ポート61から導入されたがん細胞を含む細胞懸濁流体は主流路54aにてがん細胞分離の処理が実施され、さらにそのがん細胞が濃縮された流体は以降の主流路54b〜eにてがん細胞分離の処理が計5回実施される。
【0045】
マイクロ流体チップ50は、入口ポート61からがん細胞を含む細胞懸濁流体を導入し、入口ポート62から細胞や微粒子を含まない流体を導入した際、がん細胞が濃縮された流体を出口ポート63から回収することができるマイクロ流体チップである。
【0046】
マイクロ流体チップ50は、出口ポート63、64a〜eを有しており、出口ポート63はがん細胞が濃縮された流体を回収するための出口ポートであり、出口ポート64a〜eはそれぞれがん細胞以外の細胞を含む流体を回収するための出口ポートである。
【0047】
図6に示すマイクロ流体チップ65のような構造でも、本発明によるがん細胞自動分離装置およびがん細胞自動分離方法を複数回実施することができ、がん細胞のさらなる濃縮が期待される。
【0048】
マイクロ流体チップ65において、微小流路68は、主流路69a〜c、第1の入口分岐流路70a〜c、第2の入口分岐流路71a〜c、第1の出口分岐流路73、第2の出口分岐流路74a〜cを含む。また、部分A72a〜cはそれぞれ主流路69a〜cの一部であり、それぞれ第2の入口分岐流路71a〜cとは反対側に設置されている。第1の入口分岐流路70b〜cは、それぞれ主流路69a〜bの下端において部分A72a〜b以外の部分に接続され、第1の出口分岐流路73は、主流路69cの下端において部分A72c以外の部分に接続され、第2の出口分岐流路74a〜cは、それぞれ主流路69a〜cの下端において部分A72a〜cに接続されている。ここで、主流路69a〜cに流れる上流および下流をそれぞれ上端および下端とする。
【0049】
フィン75a〜lは、部分A72a〜cとは反対側の主流路69a〜c内に複数個が設置されており、第2の入口分岐流路71a〜cからの細胞や微粒子を含まない流体が部分A72a〜c側面に対して平行または鋭角に流れることを補助し、必要に応じて任意の数に決める事ができ、フィンの形状や大きさも必要に応じて任意に設定する事が可能である。
【0050】
マイクロ流体チップ65において、入口ポート76から導入されたがん細胞を含む細胞懸濁流体は主流路69aにてがん細胞分離の処理が実施され、さらにそのがん細胞が濃縮された流体は以降の主流路69b〜cにてがん細胞分離の処理が計3回実施される。
【0051】
マイクロ流体チップ65は、入口ポート76からがん細胞を含む細胞懸濁液を導入し、入口ポート77a〜cから細胞や微粒子を含まない流体を導入した際、がん細胞が濃縮された流体を出口ポート78から回収することができるマイクロ流体チップである。
【0052】
マイクロ流体チップ65は、出口ポート78、79a〜cを有しており、出口ポート78はがん細胞が濃縮された流体を回収するための出口ポートであり、出口ポート79a〜cはそれぞれがん細胞以外の細胞を含む流体を回収するための出口ポートである。
(産業上の利用可能性)
がんの予後向上においてはがん細胞の早期発見が非常に重要となるが、本発明に記載の装置および方法を用いることにより、極微量の胃がん患者腹腔洗浄液と極少量の培養液を導入するだけで直径25〜100μm程度のがん細胞の分離・濃縮が可能となる。
【0053】
また、本発明はマイクロ流体チップを用いてがん細胞の分離を行っているため、大型な装置が不要であり、例えば一般病院のベッドサイドのような狭い場所でも簡便に診断を行うことが可能となる。
【0054】
また、マイクロ流体チップは大量生産性があり、1個当たり数百円で生産することが可能なため、低コストでのがん診断が可能となる。
さらに、本発明は以上説明したように構成されているため、がん細胞への蛍光色素の標識や電磁気力の負荷による侵襲がなく、回収したがん細胞を例えば線維芽細胞と共に培養することでがん細胞塊の特性を評価し、がん幹細胞の発見や治療法の選択に役立てることも可能となる。
【符号の説明】
【0055】
10:微小流路
11:主流路
12:第1の入口分岐流路
13:第2の入口分岐流路
14:部分A
15:第1の出口分岐流路
16:第2の出口分岐流路
17:がん細胞以外の細胞
18:がん細胞(塊)
19:フィン
20:流れの方向
21:流れの方向
22:角度
23:基板
24:ガラス基板
25:流路高さ
26:流路高さ
27:マイクロ流体チップ
28:基板
29:ガラス基板
30:微小流路
31:主流路
32:第1の入口分岐流路
33:第2の入口分岐流路
34:部分A
35:第1の出口分岐流路
36:第2の出口分岐流路
37a〜d:フィン
38:角度
39:入口ポート
40:入口ポート
41:出口ポート
42:出口ポート
43:流路高さ
44:流路高さ
45:第1の入口分岐流路へ導入された胃がん患者腹腔洗浄液写真
46:第1の出口分岐流路から回収されたがん細胞が濃縮された流体の写真
47:第2の出口分岐流路から回収されたがん細胞以外の細胞を含む流体の写真
48:がん細胞(がん細胞塊)
49:がん細胞以外の細胞(中皮細胞や赤血球等)
50:マイクロ流体チップ
51:基板
52:ガラス基板
53:微小流路
54a〜e:主流路
55a〜e:第1の入口分岐流路
56a〜e:第2の入口分岐流路
57a〜e:部分A
58:第1の出口分岐流路
59a〜e:第2の出口分岐流路
60a〜o:フィン
61:入口ポート
62:入口ポート
63:出口ポート
64a〜e:出口ポート
65:マイクロ流体チップ
66:基板
67:ガラス基板
68:微小流路
69a〜c:主流路
70a〜c:第1の入口分岐流路
71a〜c:第2の入口分岐流路
72a〜c:部分A
73:第1の出口分岐流路
74a〜c:第2の出口分岐流路
75a〜l:フィン
76:入口ポート
77a〜c:入口ポート
78:出口ポート
79a〜c:出口ポート
【技術分野】
【0001】
本発明は、がん細胞と他の細胞とを分離することができるがん細胞自動分離装置およびがん細胞自動分離方法に関する。
【背景技術】
【0002】
胃がんの腹膜転移は術後の最も多い再発形式であり、有効な治療法もなく予後は極めて不良である。腹膜転移の有効な診断方法の一つとして腹腔洗浄細胞診が広く行われているが、検出精度が悪く、発見されても予後が不良であることが多い。
腹腔洗浄細胞診の検出精度を上げるために腹腔洗浄液中のがん細胞を分離・濃縮する方法がある。その一例として、標的がん細胞を蛍光標識して画像認識により分離する方法(蛍光活性化セルソーター:FACS)、または特異的抗体反応や誘電泳動力(特許文献1)を利用した分離方法が挙げられる。
【0003】
一般的に腹腔洗浄液や血液、またはリンパ液中の転移がん細胞はがん細胞塊として存在し、その他の細胞よりサイズ径が大きい特性を示すことが見出されている。また近年、微小流路を持つマイクロ流体チップを用いて流体力のみで微粒子を分離・濃縮する方法が提案されている(特許文献2)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2010−227016号公報
【特許文献2】特開2004−154747号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
活性化セルソーター(FACS)を用いる場合、一般的に大型の装置導入と訓練されたオペレータの確保が必要である。さらに、多量の試料容量を必要とし10、000未満の細胞数の分離能力は著しく低い。また、特許文献1の技術のように、標的がん細胞へ蛍光抗体色素の標識や電磁気力の負荷で分離する場合、標的がん細胞に対する蛍光色素の侵襲や外部力の影響は回避できない。
【0006】
また、特許文献2の技術において、流体力は微小流路内の圧力変動に対して分離・濃縮の影響を受けやすい特徴があり、流量または流速の微小な調整をする必要があり、圧力変動に対してロバストかつ連続的に分離・濃縮することが困難である。
【0007】
本発明は、がん細胞を分離する際に、標的がん細胞自体を蛍光標識することや電磁気力で侵襲することなく、極低濃度のがん細胞をその他の細胞から迅速にかつ正確に分離することができ、圧力変動に対してロバストかつ連続的に分離・濃縮することができるがん細胞自動分離装置およびがん細胞自動分離方法を提供しようとするものである。
【課題を解決するための手段】
【0008】
上記目的を達成するために、本発明に係るがん細胞自動分離装置は、微小流路に導入されたがん細胞を含む細胞懸濁流体から、がん細胞と他の細胞とのサイズ径の差を利用してがん細胞とその他の細胞を自動分離することを特徴とする。
【0009】
上記がん細胞自動分離装置は、(a)主流路、(b)前記主流路の上端において、前記主流路の延長方向に設けられた、前記細胞懸濁流体が導入される第1の入口分岐流路、及び(c)前記主流路の上端において、前記主流路に対し所定の角度をつけて設けられた、細胞や微粒子を含まない流体が導入される第2の入口分岐流路を有し、前記主流路は、その流路高さが標的がん細胞の代表径以下となる部分Aを、前記第2の入口分岐流路とは反対側に有し、がん細胞を含む細胞群は前記第2の入口分岐流路から流体力を受け、さらに部分Aから機械的な拘束力を受けることにより、前記部分Aの高さ以下の径をもつ細胞群と前記部分Aの高さ以上の径をもつがん細胞群に自動分離することを特徴とする。
【0010】
上記がん細胞自動分離装置は、さらに、(d)前記主流路の下端において、前記主流路のうち、前記部分A以外の部分に接続した第1の出口分岐流路、及び(e)前記主流路の下端おいて、前記部分Aに接続した第2の出口分岐流路を有し、分離されたそれぞれの細胞群を回収することを特徴とする。
【0011】
上記がん細胞自動分離装置は、さらに、微小流路内にフィンを有することが好ましい。この場合、上記第2の入口分岐流路からの細胞や微粒子を含まない流体は部分A側面へ対して平行又は鋭角に流れ、かつ上記第1の入口分岐流路からの細胞懸濁流体に含まれるがん細胞群およびその他の細胞群は、ほぼすべて前記部分A側面へ接しながら流れるように誘導され、効率的に、がん細胞を分離することができる。
【0012】
上記がん細胞自動分離装置によれば、がん細胞は主流路に設けられた高さの異なる部分Aとその内壁に拘束されて分離するため、標的がん細胞自体に蛍光標識することや電磁気力で侵襲することなくダメージの少ない状態で、がん細胞を分離することができる。
【0013】
上記がん細胞自動分離装置によれば、上記第2の入口分岐流路からの流体力と前記内壁の機械的な拘束力によってがん細胞を分離するため、導入されたそれぞれの流体の流量または流速の微小な調整を必要とせず、圧力変動に対してロバストかつ連続的に、がん細胞を分離することができる。
【0014】
上記がん細胞自動分離装置によれば、上記第2の入口分岐流路からの流体力と前記内壁の機械的な拘束力によってがん細胞を分離するため、極低濃度のがん細胞であっても前記部分Aの高さ以上の径をもつがん細胞は前記内壁の機械的な拘束により自動的にかつ正確に、分離される。
【0015】
本発明のがん細胞自動分離装置は、微細加工技術を利用して作製した流路構造を有するマイクロ流体チップ上に搭載される。そのため、上記出口分岐流路を接続することにより、前記がん細胞自動分離装置が直列化、又は並列化した多段に配置されたマイクロ流体チップでもよい。マイクロ流体チップとは、複雑な流路構造を組み合わせることにより、液体や気体を流して種々の試薬の混合、化学合成、分離、精製を行わせるものである。
<発明の効果>
本発明よれば、微小流路に導入されたがん細胞を含む細胞懸濁流体から、がん細胞と他の細胞とのサイズ径の差を利用してがん細胞とその他の細胞を自動分離することにより、標的がん細胞自体ダメージの少ないうえに、極低濃度のがん細胞をその他の細胞から迅速にかつ正確に分離することができ、更に分離したがん細胞およびその他の細胞を非侵襲的に回収することができる。また、がん細胞分離に際して外部部品や高度な装置を必要とせずに、流路内の圧力変動に対してロバストかつ連続的に、がん細胞を分離することができるため、ベッドサイドなど幅広い環境で使用することが可能である。
【図面の簡単な説明】
【0016】
【図1】本発明によるがん細胞自動分離装置および自動分離方法の原理図を示す。図1(a)は図1(b)におけるA矢視図である。図1(b)は図1(a)におけるB−B線による断面図である。
【図2】本発明による実施形態を備えたマイクロ流体チップ27を示し、図2は図3(a)と図3(b)におけるA矢視図である。
【図3】図3(a)は図2におけるB−B 線による断面図、図3(b)は図2におけるC−C線による断面図である。
【図4】図1、2、3におけるマイクロ流体チップの1例として、実際に胃がん患者腹腔洗浄液を用いてがん細胞を分離・濃縮させた結果を示す。
【図5】本発明によるがん細胞自動分離装置を5つ備えたマイクロ流体チップ50を示す。
【図6】本発明によるがん細胞自動分離装置を3つ備えたマイクロ流体チップ65を示す。
【発明を実施するための形態】
【0017】
以下、添付の書類に基づいて、本発明によるがん細胞自動分離装置およびがん細胞自動分離方法の形態を詳細に説明する。
図1には、本発明によるがん細胞自動分離装置およびがん細胞自動分離方法の原理が示されている。
【0018】
がん細胞自動分離装置は基板28とガラス基板24とから構成され、微小流路10は、基板23の下面23aに形成された凹部である。
図1(a)において、主流路11は両端にそれぞれ分岐流路を有しており、矢印20、21はそれぞれ第1の入口分岐流路12、第2の入口分岐流路13に導入される流体の流れの方向を表している。なお、請求項における微小流路、主流路、第1の入口分岐流路、第2の入口分岐流路、部分A、第1の出口分岐流路、第2の出口分岐流路とはそれぞれ流路10、11、12、13、14、15、16のことである。
【0019】
図1(b)において、矢印25は主流路11の高さ方向を示し、矢印26は部分A14の高さ方向を示す。
微小流路10は、主流路11、第1の入口分岐流路12、第2の入口分岐流路13、第1の出口分岐流路15、及び第2の出口分岐流路16を含み、第2の入口分岐流路13は主流路11に対して所定の角度22をつけて設けられる。また、部分A14は主流路11の一部であり、第2の入口分岐流路13とは反対側に設置されている。第1の出口分岐流路15は、主流路11の下端において部分A14以外の部分に接続され、第2の出口分岐流路16は、主流路11の下端において部分A14に接続されている。ここで、主流路11に流れる上流および下流をそれぞれ上端および下端とする。
【0020】
図1(a)において、フィン19は部分A14とは反対側の主流路11内に複数個が設置されており、第2の入口分岐流路13からの細胞や微粒子を含まない流体が部分A14側面に対して平行又は鋭角に流れることを誘導する。フィン19は、必要に応じて任意の数に決める事ができ、フィン19の形状や大きさも必要に応じて任意に設定する事が可能である。
【0021】
第1の入口分岐流路12にがん細胞を含む細胞懸濁流体を連続的に導入し、第2の入口分岐流路13に細胞や微粒子を含まない流体を連続的に導入する。導入された細胞は、第2の入口分岐流路13から流体力を受け主流路11の内部において左側へ押しつけられる。しかしがん細胞は代表径が部分A14の流路高さ以上であるため機械的に拘束され、部分A14へは導入されず、第1の出口分岐流路15へ導入される。一方がん細胞以外の細胞は、代表径が部分A14の高さ以下であるため部分A14へ導入され、第2の出口分岐流路16へ導入される。
【実施例】
【0022】
以下、添付の書類に基づいて、本発明によるがん細胞自動分離装置およびがん細胞自動分離方法の実施例を詳細に説明するものとする。
図2には、本発明によるがん細胞自動分離装置およびがん細胞自動分離方法の実施形態を備えたマイクロ流体チップ27が示されており、図2は図3(a)と図3(b)におけるA矢視図であり、図3(a)は図2におけるB−B 線による断面図、図3(b)は図2におけるC−C線による断面図である。
【0023】
マイクロ流体チップ27は、微小流路30、主流路31、第1の入口分岐流路32、第2の入口分岐流路33、部分A34、第1の出口分岐流路35、第2の出口分岐流路36を有し、主流路31の高さ方向および部分A34の高さ方向はそれぞれ矢印43および矢印44で示す。
【0024】
マイクロ流体チップ27において、微小流路30は、主流路31、第1の入口分岐流路32、第2の入口分岐流路33、第1の出口分岐流路35、及び第2の出口分岐流路36を含み、第2の入口分岐流路33は主流路31に対して所定の角度38をつけて設けられる。また、部分A34は主流路31の一部であり、第2の入口分岐流路33とは反対側に設置されている。第1の出口分岐流路35は、主流路31の下端において部分A34以外の部分に接続され、第2の出口分岐流路36は、主流路31の下端において部分A34に接続されている。ここで、主流路31に流れる上流および下流をそれぞれ上端および下端とする。
【0025】
このマイクロ流体チップ27は、がん細胞を含む細胞懸濁流体を導入した際、がん細胞群と、がん細胞を含まない細胞群を別々に回収することができるマイクロ流体チップ27であり、高分子(ポリマー)材料、例えば、PDMS(ポリジメチルシロキサン)により形成された基板28とガラス基板29により形成された平板上の構造を有している。
【0026】
なお、マイクロ流体チップ27の材料としては、PDMSの他にも、アクリル等の各種ポリマー材料、ガラス、シリコン、セラミクス、ステンレスなどの各種金属、などを用いることができる。
【0027】
基板28の下面28aには主流路31、第1の入口分岐流路32、第2の入口分岐流路33、部分A34、第1の出口分岐流路35、第2の出口分岐流路36が形成されており、部分A34の高さ44は10μmであり、その他の流路の高さ43は100μmである。またこれらの値は例えば、1μm以上から1cmまで任意の値に設定することができる。
【0028】
入口ポート39はがん細胞を含む細胞懸濁流体の入口であり、入口ポート40は細胞や微粒子を含まない流体の入口である。また、出口ポート41はがん細胞が濃縮された流体の出口であり、出口ポート42はがん細胞以外の細胞を含む流体の出口である。
【0029】
入口ポート39は、基板28の上面から、第1の入口分岐流路32まで掘り下げられた孔であり、入口ポート40は、基板28の上面から、第2の入口分岐流路33まで掘り下げられた孔である。また、出口ポート41は、基板28の上面から、第1の出口分岐流路35まで掘り下げられた孔であり、出口ポート42は、基板28の上面から、第2の出口分岐流路36まで掘り下げられた孔である。
【0030】
主流路31の長さは、例えば20mmであり、分岐流路32、33、35、36の幅は、例えばそれぞれ300μm、300μm、300μm、600μmである。またこれらの値は全て、10μm以上の任意の値に設定することができる。
【0031】
フィン37a〜dは、部分A34とは反対側の主流路31内に複数個が設置されており、第2の入口分岐流路33からの細胞や微粒子を含まない流体が部分A34側面に対して平行または鋭角に流れることを補助し、必要に応じて任意の数に決める事ができ、フィンの形状や大きさも必要に応じて任意に設定する事が可能である。
【0032】
フィン37a〜dの形状は、この態様においては、主流路31の長手方向の先端に向かうほど主平面方向の幅が細くなる形状とし、かつ第2の入口分岐流路33とは反対側の側面は部分A34側面と平行になる形状とした。それにより第2の入口分岐流路33からの細胞や微粒子を含まない流体が部分A34側面に対して平行または鋭角に流れることとなり、その結果として第1の入口分岐流路32からの細胞懸濁流体に含まれるがん細胞群およびその他の細胞群は、ほぼすべて部分A34側面へ接しながら流れるように誘導され、効率的に、がん細胞を分離することができる。
【0033】
以上の構成において、上記したマイクロ流体チップ23を用いて胃がん患者腹腔洗浄液中のがん細胞を濃縮する方法について説明する。
胃がん患者腹腔洗浄液には、5mMのEDTAと0.5%のBSAを添加する。
【0034】
細胞や微粒子を含まない流体としては、培養液もしくはPBSに5mMのEDTAと0.5%のBSAを添加したものを用いる。
胃がん患者腹腔洗浄液に5mMのEDTAと0.5%のBSAを添加した流体を、入口ポート39から連続的に供給する。また、培養液もしくはPBSに5mMのEDTAと0.5%のBSAを添加した流体を入口ポート40から連続的に供給する。この時、流路構造内では、流体が層流を保ちつつ流れるほうが望ましい。なお、流体の導入に際して、シリンジポンプ等を用いた定流量導入、ボンベ、圧力装置等を用いた定圧導入の他に、電気浸透流や遠心力等を用いた方法などを用いることができる。
【0035】
この流路構造を用いた場合、入口ポート40から供給された細胞や微粒子を含まない流体により、胃がん患者腹腔洗浄液中のすべての細胞は主流路31の内部において左側へ押し付けられる。
【0036】
しかしながら主流路31は、流路高さが標的がん細胞の代表径以下となる部分A34と、それによる内壁を有するため、がん細胞は部分A34へ流れることができず、右側に設けた第1の出口分岐流路35へ向かうと期待される。
【0037】
一方、胃がん患者腹腔洗浄液に含まれる中皮細胞や赤血球等は、径が小さいため部分A34へと流れ、左側に設けた第2の出口分岐流路36へ向かうと期待される。
また、本発明は以上説明したように、細胞や微粒子を含まない流体の流れと、主流路内に設けた流路高さが標的がん細胞の代表径以下となる部分Aとそれによる内壁を用いて機械的にがん細胞塊を拘束する原理を用いるため、流路内の圧力変動に対してロバストかつ連続的に、がん細胞を分離することができる。
【0038】
また、その処理量は流路の数に比例するため、大量処理および短時間での処理を目的とする場合には同型の流路を並列化することが必要であるが、並列化は容易に行うことができる。
【0039】
実際に、胃がん患者腹腔洗浄液に5mMのEDTAと0.5%のBSAを添加した流体を入口ポート39からシリンジポンプを用いて1.5mL/hの流速で導入し、培養液に5mMのEDTAと0.5%のBSAを添加した流体を入口ポート40からシリンジポンプを用いて2.5mL/hの流速で導入したところ、がん細胞が濃縮された流体は出口ポート41から、がん細胞以外の中皮細胞や赤血球等を含む流体は出口ポート42から回収されることが確認された。
【0040】
図4は、図2のマイクロ流体チップを使用して、上記条件のもとで胃がん患者腹腔洗浄液のがん細胞分離を行った観察結果の一例である。写真45は入口ポート39から第1の入口分岐流路32に導入された流体の顕微鏡写真である。写真46、47は第1の出口分岐流路35を通って出口ポート41から、また第2の出口分岐流路36を通って出口ポート42から回収された流体のそれぞれの顕微鏡写真である。これら写真からわかるように、写真45でがん細胞(がん細胞塊)48とがん細胞以外の細胞(赤血球や中皮細胞等)49が混在していたものが、写真46では、ほぼがん細胞が観察され、写真46では、ほぼがん細胞以外の細胞49が観察される。その結果として、がん細胞の分離が確認された。
【0041】
図5に示すマイクロ流体チップ50のような構造を用いると、本発明によるがん細胞自動分離装置およびがん細胞自動分離方法を5回実施することができ、がん細胞のさらなる濃縮が期待される。
【0042】
マイクロ流体チップ50において、微小流路53は、主流路54a〜e、第1の入口分岐流路55a〜e、第2の入口分岐流路56a〜e、第1の出口分岐流路58、第2の出口分岐流路59a〜eを含む。また、部分A57a〜eはそれぞれ主流路54a〜eの一部であり、それぞれ第2の入口分岐流路56a〜eとは反対側に設置されている。第1の入口分岐流路55b〜eは、それぞれ主流路54a〜dの下端において部分A57a〜d以外の部分に接続され、第1の出口分岐流路58は、主流路54eの下端において部分A57e以外の部分に接続され、第2の出口分岐流路36a〜eは、それぞれ主流路54a〜eの下端において部分A57a〜eに接続されている。ここで、主流路54a〜eに流れる上流および下流をそれぞれ上端および下端とする。
【0043】
フィン60a〜oは、部分A57a〜eとは反対側の主流路54a〜e内に複数個が設置されており、第2の入口分岐流路56a〜eからの細胞や微粒子を含まない流体が部分A57a〜e側面に対して平行または鋭角に流れることを補助し、必要に応じて任意の数に決める事ができ、フィンの形状や大きさも必要に応じて任意に設定する事が可能である。
【0044】
マイクロ流体チップ50において、入口ポート61から導入されたがん細胞を含む細胞懸濁流体は主流路54aにてがん細胞分離の処理が実施され、さらにそのがん細胞が濃縮された流体は以降の主流路54b〜eにてがん細胞分離の処理が計5回実施される。
【0045】
マイクロ流体チップ50は、入口ポート61からがん細胞を含む細胞懸濁流体を導入し、入口ポート62から細胞や微粒子を含まない流体を導入した際、がん細胞が濃縮された流体を出口ポート63から回収することができるマイクロ流体チップである。
【0046】
マイクロ流体チップ50は、出口ポート63、64a〜eを有しており、出口ポート63はがん細胞が濃縮された流体を回収するための出口ポートであり、出口ポート64a〜eはそれぞれがん細胞以外の細胞を含む流体を回収するための出口ポートである。
【0047】
図6に示すマイクロ流体チップ65のような構造でも、本発明によるがん細胞自動分離装置およびがん細胞自動分離方法を複数回実施することができ、がん細胞のさらなる濃縮が期待される。
【0048】
マイクロ流体チップ65において、微小流路68は、主流路69a〜c、第1の入口分岐流路70a〜c、第2の入口分岐流路71a〜c、第1の出口分岐流路73、第2の出口分岐流路74a〜cを含む。また、部分A72a〜cはそれぞれ主流路69a〜cの一部であり、それぞれ第2の入口分岐流路71a〜cとは反対側に設置されている。第1の入口分岐流路70b〜cは、それぞれ主流路69a〜bの下端において部分A72a〜b以外の部分に接続され、第1の出口分岐流路73は、主流路69cの下端において部分A72c以外の部分に接続され、第2の出口分岐流路74a〜cは、それぞれ主流路69a〜cの下端において部分A72a〜cに接続されている。ここで、主流路69a〜cに流れる上流および下流をそれぞれ上端および下端とする。
【0049】
フィン75a〜lは、部分A72a〜cとは反対側の主流路69a〜c内に複数個が設置されており、第2の入口分岐流路71a〜cからの細胞や微粒子を含まない流体が部分A72a〜c側面に対して平行または鋭角に流れることを補助し、必要に応じて任意の数に決める事ができ、フィンの形状や大きさも必要に応じて任意に設定する事が可能である。
【0050】
マイクロ流体チップ65において、入口ポート76から導入されたがん細胞を含む細胞懸濁流体は主流路69aにてがん細胞分離の処理が実施され、さらにそのがん細胞が濃縮された流体は以降の主流路69b〜cにてがん細胞分離の処理が計3回実施される。
【0051】
マイクロ流体チップ65は、入口ポート76からがん細胞を含む細胞懸濁液を導入し、入口ポート77a〜cから細胞や微粒子を含まない流体を導入した際、がん細胞が濃縮された流体を出口ポート78から回収することができるマイクロ流体チップである。
【0052】
マイクロ流体チップ65は、出口ポート78、79a〜cを有しており、出口ポート78はがん細胞が濃縮された流体を回収するための出口ポートであり、出口ポート79a〜cはそれぞれがん細胞以外の細胞を含む流体を回収するための出口ポートである。
(産業上の利用可能性)
がんの予後向上においてはがん細胞の早期発見が非常に重要となるが、本発明に記載の装置および方法を用いることにより、極微量の胃がん患者腹腔洗浄液と極少量の培養液を導入するだけで直径25〜100μm程度のがん細胞の分離・濃縮が可能となる。
【0053】
また、本発明はマイクロ流体チップを用いてがん細胞の分離を行っているため、大型な装置が不要であり、例えば一般病院のベッドサイドのような狭い場所でも簡便に診断を行うことが可能となる。
【0054】
また、マイクロ流体チップは大量生産性があり、1個当たり数百円で生産することが可能なため、低コストでのがん診断が可能となる。
さらに、本発明は以上説明したように構成されているため、がん細胞への蛍光色素の標識や電磁気力の負荷による侵襲がなく、回収したがん細胞を例えば線維芽細胞と共に培養することでがん細胞塊の特性を評価し、がん幹細胞の発見や治療法の選択に役立てることも可能となる。
【符号の説明】
【0055】
10:微小流路
11:主流路
12:第1の入口分岐流路
13:第2の入口分岐流路
14:部分A
15:第1の出口分岐流路
16:第2の出口分岐流路
17:がん細胞以外の細胞
18:がん細胞(塊)
19:フィン
20:流れの方向
21:流れの方向
22:角度
23:基板
24:ガラス基板
25:流路高さ
26:流路高さ
27:マイクロ流体チップ
28:基板
29:ガラス基板
30:微小流路
31:主流路
32:第1の入口分岐流路
33:第2の入口分岐流路
34:部分A
35:第1の出口分岐流路
36:第2の出口分岐流路
37a〜d:フィン
38:角度
39:入口ポート
40:入口ポート
41:出口ポート
42:出口ポート
43:流路高さ
44:流路高さ
45:第1の入口分岐流路へ導入された胃がん患者腹腔洗浄液写真
46:第1の出口分岐流路から回収されたがん細胞が濃縮された流体の写真
47:第2の出口分岐流路から回収されたがん細胞以外の細胞を含む流体の写真
48:がん細胞(がん細胞塊)
49:がん細胞以外の細胞(中皮細胞や赤血球等)
50:マイクロ流体チップ
51:基板
52:ガラス基板
53:微小流路
54a〜e:主流路
55a〜e:第1の入口分岐流路
56a〜e:第2の入口分岐流路
57a〜e:部分A
58:第1の出口分岐流路
59a〜e:第2の出口分岐流路
60a〜o:フィン
61:入口ポート
62:入口ポート
63:出口ポート
64a〜e:出口ポート
65:マイクロ流体チップ
66:基板
67:ガラス基板
68:微小流路
69a〜c:主流路
70a〜c:第1の入口分岐流路
71a〜c:第2の入口分岐流路
72a〜c:部分A
73:第1の出口分岐流路
74a〜c:第2の出口分岐流路
75a〜l:フィン
76:入口ポート
77a〜c:入口ポート
78:出口ポート
79a〜c:出口ポート
【特許請求の範囲】
【請求項1】
微小流路に導入されたがん細胞を含む細胞懸濁流体から、がん細胞を自動分離するがん細胞自動分離装置であって、
前記微小流路は、(a)主流路、(b)前記主流路の上端において、前記主流路の延長方向に設けられた、前記細胞懸濁流体が導入される第1の入口分岐流路、及び(c)前記主流路の上端において、前記主流路に対し所定の角度をつけて設けられた、細胞や微粒子を含まない流体が導入される第2の入口分岐流路を有し、
前記主流路は、その流路高さが標的がん細胞の代表径以下となる部分Aを、前記第2の入口分岐流路とは反対側に有することを特徴とするがん細胞自動分離装置。
【請求項2】
前記微小流路は、さらに、(d)前記主流路の下端において、前記主流路のうち、前記部分A以外の部分に接続した第1の出口分岐流路、及び(e)前記主流路の下端おいて、前記部分Aに接続した第2の出口分岐流路を有することを特徴とする請求項1記載のがん細胞自動分離装置。
【請求項3】
前記細胞や微粒子を含まない流体が、前記部分Aに対し、平行又は鋭角に流れるように誘導するフィンを、前記主流路内に備えることを特徴とする請求項1又は2記載のがん細胞自動分離装置。
【請求項4】
請求項1〜3のいずれか1項に記載のがん細胞自動分離装置を用いて、がん細胞を含む細胞懸濁流体から、がん細胞を自動分離するがん細胞自動分離方法。
【請求項1】
微小流路に導入されたがん細胞を含む細胞懸濁流体から、がん細胞を自動分離するがん細胞自動分離装置であって、
前記微小流路は、(a)主流路、(b)前記主流路の上端において、前記主流路の延長方向に設けられた、前記細胞懸濁流体が導入される第1の入口分岐流路、及び(c)前記主流路の上端において、前記主流路に対し所定の角度をつけて設けられた、細胞や微粒子を含まない流体が導入される第2の入口分岐流路を有し、
前記主流路は、その流路高さが標的がん細胞の代表径以下となる部分Aを、前記第2の入口分岐流路とは反対側に有することを特徴とするがん細胞自動分離装置。
【請求項2】
前記微小流路は、さらに、(d)前記主流路の下端において、前記主流路のうち、前記部分A以外の部分に接続した第1の出口分岐流路、及び(e)前記主流路の下端おいて、前記部分Aに接続した第2の出口分岐流路を有することを特徴とする請求項1記載のがん細胞自動分離装置。
【請求項3】
前記細胞や微粒子を含まない流体が、前記部分Aに対し、平行又は鋭角に流れるように誘導するフィンを、前記主流路内に備えることを特徴とする請求項1又は2記載のがん細胞自動分離装置。
【請求項4】
請求項1〜3のいずれか1項に記載のがん細胞自動分離装置を用いて、がん細胞を含む細胞懸濁流体から、がん細胞を自動分離するがん細胞自動分離方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2012−239449(P2012−239449A)
【公開日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願番号】特願2011−115083(P2011−115083)
【出願日】平成23年5月23日(2011.5.23)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【出願人】(304031427)愛知県 (36)
【Fターム(参考)】
【公開日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願日】平成23年5月23日(2011.5.23)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【出願人】(304031427)愛知県 (36)
【Fターム(参考)】
[ Back to top ]

