ふっ化水素酸とけい素化合物を含有する水溶液中のふっ化水素酸の分析方法
【課題】ガラスや金属けい素を溶解することによって生成したけい素化合物およびふっ化水素酸を含む水溶液中の遊離ふっ化水素酸の濃度を正確に測定できる分析方法を提供し、これによって、該水溶液の溶解能力を的確に判定できるようにする。
【解決手段】けい素化合物およびふっ化水素酸を含む水溶液中のけい素化合物をヘキサフルオロけい酸塩として析出させるなどの手段によって除去した後、ふっ化水素酸濃度を測定する。さらに、けい素化合物をヘキサフルオロけい酸塩として析出させることなくふっ化水素酸濃度を測定し、後者の測定値を用いて前者の測定値を補正する。
【解決手段】けい素化合物およびふっ化水素酸を含む水溶液中のけい素化合物をヘキサフルオロけい酸塩として析出させるなどの手段によって除去した後、ふっ化水素酸濃度を測定する。さらに、けい素化合物をヘキサフルオロけい酸塩として析出させることなくふっ化水素酸濃度を測定し、後者の測定値を用いて前者の測定値を補正する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ふっ化水素酸とけい素化合物を含有する水溶液中のふっ化水素酸の分析方法に関するものである。
【背景技術】
【0002】
ふっ化水素酸はガラスや金属けい素を化学的に溶解する目的で工業的に使用されている。例えば、ブラウン管用ガラスパネルを再利用するために、適当な濃度のふっ化水素酸溶液で処理して、表面を溶解する工程が行われている。また、金属けい素の製品であるシリコンウェーハを製造する過程においては、機械的研磨後の表面層をふっ化水素酸、硝酸および酢酸の混酸で溶解する工程が行われている。
【0003】
これらの溶解工程においては、ふっ化水素酸がガラスや金属けい素と化学反応して消費されるので、被処理物の処理量が増すにつれて酸溶液中の濃度が低下し、酸溶液の溶解能力が低下する。従って、酸溶液の溶解能力を必要な水準に保つために、通常は、酸溶液の一部を抜き出して廃棄し、代わりに未使用のふっ化水素酸を補充する操作が行われる。
【0004】
このような酸溶液の濃度管理を確実に実施するためには、酸溶液中に含まれる未反応のふっ化水素酸(以後、遊離ふっ化水素酸と呼ぶ)の濃度を知ることが最も重要であるが、現在のところ信頼できる測定方法が確立されていないので、実際には経験的に酸溶液の一部廃棄や新酸の補充を行うことが多い。
【0005】
また、遊離ふっ化水素酸濃度を測定する代わりに、酸溶液中に溶け込んだけい素の濃度を測定することによって、間接的に酸溶液の溶解能力を推測して濃度管理を行う方法が提案されている。例えば、特開2000−239001号公報には、ガラス洗浄用ふっ化水素酸溶液中に溶け込んだけい素の濃度を測定し、それに基づいて濃度管理を行う方法が開示されている。また、特開平11−279777号公報には、シリコンウェーハのエッチング液に含まれるけい素の濃度を所定の範囲内に維持する濃度管理方法が開示されている。
【0006】
しかし、これらの酸溶液やエッチング液によるガラスや金属けい素の溶解能力は液中のけい素濃度とは直接的にはほとんど関係が無く、遊離ふっ化水素酸濃度によって直接的に影響されることは理論的にも明らかなので、信頼できる遊離ふっ化水素酸分析方法の確立が望まれている。
【0007】
ただし、遊離ふっ化水素酸の分析方法が全く無いわけではなく、「Analytical Chemistry」誌の第40巻(1968年)の1276〜1279ページには、「アセチルアセトン鉄錯体退色吸光光度法」が開示されている。この方法は、アセチルアセトンと鉄の錯体がふっ化水素酸の作用によって分解し、その水溶液の色が退色することを利用した吸光光度法であり、ステンレス鋼の酸洗いに用いた硝ふっ酸(硝酸とふっ化水素酸の混酸)中の遊離ふっ化水素酸の分析方法として広く用いられているようである。
【特許文献1】特開2000−239001号公報
【特許文献2】特開平11−279777号公報
【非特許文献1】J.P.McKaveney著 「Spectrophotometric Method for Hydrofluoric Acid in Stainless Steel Pickling Baths」 Analytical Chemistry Vol.40 1968年
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明者はこの「アセチルアセトン鉄錯体退色吸光光度法」によって、ガラスを溶解したふっ化水素酸水溶液中の遊離ふっ化水素酸分析を試みたところ、測定された遊離ふっ化水素酸濃度とその水溶液の溶解能力の相関性が極めて悪いことを見出した。例えば、水溶液の溶解能力がほとんど無いにもかかわらず、かなり高濃度のふっ化水素酸が分析されるような結果が得られたので、このままではガラスを溶解したふっ化水素酸水溶液中の遊離ふっ化水素酸分析方法としては適用できないと判断された。
【0009】
そこで、本発明が解決しようとする課題は、ガラスや金属けい素を溶解することによって生成したけい素化合物およびふっ化水素酸を含む水溶液中の遊離ふっ化水素酸の濃度を正確に測定できる分析方法を提供することである。そして、これによって、該水溶液の溶解能力を的確に判定できるようにすることが、本発明の課題である。
【課題を解決するための手段】
【0010】
本発明者は、前述のように、ガラスや金属けい素を溶解したふっ化水素酸含有水溶液中の遊離ふっ化水素酸をアセチルアセトン鉄錯体退色吸光光度法によって測定した場合の測定値と、その水溶液の溶解能力の相関性が極めて悪い理由を調べた結果、溶解反応によって生成したヘキサフルオロけい酸あるいはそれが解離して生じたヘキサフルオロけい酸イオンが分析誤差を生じさせていることを見出した。
【0011】
すなわち、ガラスをふっ化水素酸水溶液で溶解する際には、主成分の二酸化けい素(SiO2)とふっ化水素酸(HF)が下記の(1)式のように反応して、ヘキサフルオロけい酸(H2SiF6)および水(H2O)を生じる。また、金属けい素(Si)をふっ化水素酸および硝酸(HNO3)を含む水溶液で溶解する際には、下記の(2)式のような反応が起きて、ヘキサフルオロけい酸、水および亜硝酸(HNO2)を生じる。なお、ヘキサフルオロけい酸は強酸なので、水溶液中ではその多くが(3)式のように解離して、水素イオン(H+)およびヘキサフルオロけい酸イオン(SiF62−)を生じることが知られている。
【0012】
SiO2+6HF→H2SiF6+2H2O (1)式
Si+6HF+2HNO3→H2SiF6+2H2O+2HNO2 (2)式
H2SiF6→2H++SiF62− (3)式
【0013】
そして、上記の(1)〜(3)式の反応によって生じたヘキサフルオロけい酸またはヘキサフルオロけい酸イオンがアセチルアセトン鉄錯体を分解する作用を及ぼし、ふっ化水素酸の分析において正誤差を生じさせているものと推測される。
【0014】
そこで、これらのけい素化合物を、遊離ふっ化水素酸分析に先だって除去する方法を種々検討した結果、これらのヘキサフルオロけい酸またはヘキサフルオロけい酸イオンを難溶性のヘキサフルオロけい酸塩として析出させ、さらに必要に応じて、ろ過等の手段によってこれを分離すればよいことを見出した。なお、これ以外の方法(例えば、イオン交換法)によってけい素化合物を除去できて、その結果、ふっ化水素酸の分析に支障が生じないならば、その方法を用いた分析方法も本発明法に含まれる。
【0015】
難溶性のヘキサフルオロけい酸塩としてはヘキサフルオロけい酸カリウムが好ましく、これを析出させるには、硝酸カリウムや塩化カリウムのような、水溶性のカリウム含有塩類を添加すればよい。なお、ヘキサフルオロけい酸カリウム以外の難溶性ヘキサフルオロけい酸塩として析出させる方法も本発明に含まれる。
【0016】
なお、けい素化合物を除去した後に遊離ふっ化水素酸濃度を測定する方法は、必ずしもアセチルアセトン鉄錯体退色吸光光度法である必要はなく、例えば、JISK0101−1998の31に規定されているランタン−アリザリンコンプレキソン吸光光度法やイオン電極法によってふっ素イオン濃度を測定し、ふっ化水素酸濃度に換算してもよい。また、滴定法によって遊離ふっ化水素酸濃度を測定してもよい。ただし、試料溶液中に硝酸などの強酸が含まれる場合には、ふっ化水素酸と強酸を分別定量できる滴定法(例えば、電位差滴定法)が必要である。
【0017】
このようにして測定された遊離ふっ化水素酸濃度は、けい素化合物およびふっ化水素酸を含む水溶液の溶解能力との相関性が十分に高いことが確認されたが、本発明者はさらに相関性を高めるための研究を行った。
【0018】
その結果、けい素化合物をヘキサフルオロけい酸塩として析出させた後に遊離ふっ化水素酸濃度を測定すると共に、けい素化合物をヘキサフルオロけい酸塩として析出させることなく、遊離ふっ化水素酸濃度を測定し、後者の測定値を用いて前者の測定値を補正することによって得られる遊離ふっ化水素酸濃度は、けい素化合物およびふっ化水素酸を含む水溶液の溶解能力との相関性が極めて高いことが判明した。
【0019】
本発明は、以上の研究に基づいて成し遂げられた発明であり、ふっ化水素酸とけい素化合物を含有する水溶液中のけい素化合物をヘキサフルオロけい酸塩として析出させるなどの手段によって除去した後、該水溶液中のふっ化水素酸濃度を測定することを第一の特徴とする。さらに、ふっ化水素酸とけい素化合物を含有する水溶液中のけい素化合物をヘキサフルオロけい酸塩として析出させた後、該水溶液中のふっ化水素酸濃度を測定すると共に、該水溶液中のけい素化合物をヘキサフルオロけい酸塩として析出させることなく、該水溶液中のふっ化水素酸濃度を測定し、後者の測定値を用いて前者の測定値を補正することを第二の特徴とする。
【発明の効果】
【0020】
本発明法によって測定した遊離ふっ化水素酸濃度は、けい素化合物およびふっ化水素酸を含む水溶液の溶解能力との相関性が高いので、この分析値を用いることにより、ガラス等を溶解するためのふっ化水素酸含有水溶液の濃度管理を的確に行うことが可能となる。
【発明を実施するための最良の形態】
【0021】
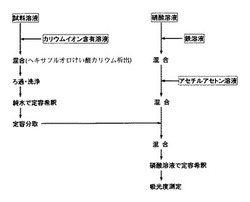
図1、図2および図3は、ヘキサフルオロけい酸またはヘキサフルオロけい酸イオンのようなけい素化合物を含む水溶液中の遊離ふっ化水素酸を本発明法によって分析する際の手順の例を示したものである。この内、図1は、アセチルアセトン鉄錯体退色吸光光度法によってふっ化水素酸濃度を測定する場合の手順、図2は、ランタン−アリザリンコンプレキソン吸光光度法によってふっ化水素酸濃度を測定する場合の手順、図3はふっ化物イオン電極を用いてふっ化水素酸濃度を測定する場合の手順である。
【0022】
これらの分析手順において、試料溶液に添加するカリウムイオン含有溶液としては、硝酸カリウムの水溶液が推奨されるが、塩化カリウムまたは硫酸カリウムの水溶液でもよい。その水溶液の濃度は、なるべく濃い方が、添加後の試料溶液の液量を少なくすることができ、その結果、カリウムイオン濃度が高まって、ヘキサフルオロけい酸カリウムの溶解量が少なくなり、分析誤差が小さくなる。従って、硝酸カリウム等の結晶をそのまま試料溶液に添加して溶解する方法でもよいが、利便性を考慮すると、1mol/l程度の水溶液で添加する方法が推奨される。
【0023】
試料溶液に添加するカリウムイオン含有溶液の量は、試料溶液中に含まれるけい素化合物をヘキサフルオロけい酸カリウムとして析出させるのに必要な理論値(すなわち、過不足無く反応する量)より多くする必要があり、望ましくは1.5倍以上、さらに望ましくは2倍以上とするのがよい。もし、カリウムイオン含有溶液の添加量を上記の理論値程度とすると、許容できない量のけい素化合物が溶液中に残留する。
【0024】
図4は上記のことを示す実験結果をグラフにまとめたものである。横軸の「当量比」とは、添加した硝酸カリウムのモル数を試料溶液中のけい素化合物のモル数の2倍で除したものである。理論的には、下記の(4)式の反応によってヘキサフルオロけい酸カリウム(K2SiF6)を析出させる際に、1分子のヘキサフルオロけい酸(H2SiF6)に対して2分子の硝酸カリウム(KNO3)が必要なので、当量比が1であれば過不足無く反応する硝酸カリウムが添加されていることを意味する。
H2SiF6+2KNO3→K2SiF6+2HNO3 (4)式
【0025】
図4からわかるように、当量比が1の場合には溶液中にかなりの量のけい素化合物が含まれており、ふっ化水素酸の分析値に無視できない正誤差を与えることが判明した。一方、当量比が約1.7になるように硝酸カリウムを添加した場合には、溶液中のけい素化合物は非常に少なくなり、ふっ化水素酸の分析値に全く影響を及ぼさないことを確認した。また、試料溶液に硝酸カリウム溶液を添加した後の液量が多いほど、溶液中のけい素化合物が多くなる傾向があることも確認された。
【0026】
遊離ふっ化水素酸の含有量が少ない場合(例えば、試料溶液100ml中0.5g未満)には、試料溶液中にヘキサフルオロけい酸カリウムとして析出しない形態のけい素化合物が多く含まれて、これが正誤差を生じさせることがある。この場合には、既知量のふっ化水素酸を試料溶液に添加した後にカリウムイオン含有溶液を添加して遊離ふっ化水素酸を定量し、先に添加した既知量のふっ化水素酸を差し引いて計算するのがよい。
【0027】
析出したヘキサフルオロけい酸塩を溶液から分離せずにふっ化水素酸濃度を測定すると、析出塩による分析誤差が生じる可能性があるので、これを溶液から分離するのが望ましい。分離方法としては、ろ過、遠心分離法、沈降法等が適用できるが、比較的、迅速かつ簡便に実施できる方法として、ろ過による方法が推奨される。
【0028】
ろ過後に析出塩を洗浄する場合には、カリウム塩の水溶液で洗浄するのがよい。もし、水で洗浄すると、析出塩の一部が溶解・解離し、ヘキサフルオロけい酸イオンを生じて、許容できない程度の分析誤差を生じることがある。
【0029】
アセチルアセトン鉄錯体退色吸光光度法やランタン−アリザリンコンプレキソン吸光光度法などによってふっ化水素酸濃度を定量する際に用いる検量線の作成においては、試料溶液中に含まれる共存物質(例えば、カリウム塩類)が同程度の量含まれるように、ふっ化水素酸標準液またはふっ素標準液に添加する必要がある。
【実施例1】
【0030】
一定量(2.1393g)の二酸化けい素の粉末に、前述の(1)式の反応で過不足無く溶解するのに必要な量(4.2739g)のふっ化水素酸を加えて溶解したのち、過剰のふっ化水素酸(約4g)を加え、純水で100mlに希釈した。この水溶液(記号:A)100ml中には遊離ふっ化水素酸約4gおよびけい素約1gが含まれる。
【0031】
同様に、一定量(2.1393g)の二酸化けい素の粉末に、前述の(1)式の反応で過不足無く溶解するのに必要な量(4.2739g)のふっ化水素酸を加えて溶解したのち、過剰のふっ化水素酸(約4g)および硝酸(約20g)と酢酸(約3g)を加え、純水で100mlに希釈した。この水溶液(記号:B)100ml中には遊離ふっ化水素酸約4g、けい素約1g、硝酸約20gおよび酢酸約3gが含まれる。
【0032】
これらの水溶液AおよびB中の遊離ふっ化水素酸を図1、図2および図3に示す分析手順で分析した。なお、これらの分析手順においては、カリウムイオン含有溶液として、濃度が1mol/lの硝酸カリウム水溶液を用い、試料溶液1.67mlに対して2.00mlを添加した。また、ヘキサフルオロけい酸カリウムの沈殿およびろ紙の洗浄にも、濃度が1mol/lの硝酸カリウム水溶液25mlを用いた。
【0033】
また、図1の分析手順におけるふっ化水素酸の定量条件は、前述の非特許文献に開示されている定量条件と同じ条件とし、図2および図3の分析手順におけるふっ素の定量条件はJISK0101−1998の31に規定されているランタン−アリザリンコンプレキソン吸光光度法およびイオン電極法と同じ条件とした。また、ふっ化水素酸の定量のための検量線は図1、図2または図3の分析手順の最初から操作して作成した。
【0034】
一方、比較のために、水溶液中のけい素化合物をヘキサフルオロけい酸カリウムとして析出・分離する操作、すなわち、図1、図2および図3における、カリウムイオン含有溶液の添加、混合およびろ過・洗浄の操作を行わない方法でも分析した。
【0035】
分析結果を表1に示す。本発明法による試料溶液AおよびB中の遊離ふっ化水素酸濃度分析値はそれぞれ4.0〜4.1g/100mlおよび3.9〜4.0g/100mlであり、試料溶液の調製条件から予想された濃度に近い値を示した。一方、比較法による分析値は7.3〜7.4g/100mlまたは8.1〜8.3g/100mlであり、本発明法による分析値に比べて大幅に高い値を示した。これは、試料溶液中にふっ化水素酸と共存するけい素化合物がふっ化水素酸分析値に正誤差を生じさせたためと推定される。
【0036】
【表1】

【実施例2】
【0037】
二酸化けい素粉末をふっ化水素酸で溶解して調製した水溶液およびふっ化水素酸のみを含む水溶液を種々の割合で混合して、7種類の試料溶液を調整し、これらの試料溶液中の遊離ふっ化水素酸濃度を、実施例1と同じ分析方法(ただし、イオン電極法は省略)で分析した。
【0038】
一方、これらの試料溶液50mlを50℃に加熱したのち、ガラス板(厚さ2mm、大きさ40×40mm)を浸漬し、超音波を照射しながら20分間保持して溶解した。ガラス板を試料溶液に浸漬する前の重量と浸漬後に水洗・乾燥した後の重量の差をガラス板の溶解減量とした。
【0039】
ガラス板の溶解減量と試料溶液中のふっ化水素酸濃度の分析結果を表2に示す。なお、表中の「Si析出あり(a)」とは、試料中のけい素化合物をヘキサフルオロけい酸塩として析出させた後に測定したふっ化水素酸濃度(記号aで示す)であり、「Si析出なし(b)」とは、試料中のけい素化合物をヘキサフルオロけい酸塩として析出させることなく測定したふっ化水素酸濃度(記号bで示す)である。
【0040】
【表2】

【0041】
また、「補正値(c)」とは、aの測定値を補正するために下記の数式1によって算出した数値であり、「補正後(a+c)」とは、aの測定値にcの数値を加えた数値である。
【0042】
【数1】

数式1において、kは定数であり、ふっ化水素酸をアセチルアセトン鉄退色吸光光度法で定量した場合には0.37、ランタン−アリザリンコンプレキソン吸光光度法で定量した場合には0.33とした。また、計算された(b−a)が負の数値になった場合には、これをゼロとした。
【0043】
測定されたガラスの溶解減量に対する試料溶液中のふっ化水素酸濃度分析値の関係を図5〜10に示す。このうち、図5および図6は試料溶液中のけい素化合物をヘキサフルオロけい酸カリウムとして析出させた後に測定したふっ化水素酸濃度(すなわち、表2のa)とガラスの溶解減量との関係を示したものであるが、両者には強い相関性が認められる(相関係数0.980)。また、図7および図8は補正後のふっ化水素酸濃度(すなわち、表2のa+c)とガラスの溶解減量との関係を示したものであるが、両者の相関性はさらに強まった(相関係数0.998)。
【0044】
一方、図9および図10は比較のために、試料溶液中のけい素化合物をヘキサフルオロけい酸カリウムとして析出させることなく測定したふっ化水素酸濃度(すなわち、表2のb)とガラスの溶解減量との関係を示したものであるが、両者の間にはごく弱い相関性しか認められなかった(相関係数0.614または0.447)。
【産業上の利用可能性】
【0045】
本発明法により、ガラスや金属けい素を溶解することによって生成したけい素化合物およびふっ化水素酸を含む水溶液中の遊離ふっ化水素酸の濃度を正確に測定できるので、該水溶液の溶解能力を的確に判定できる。
【図面の簡単な説明】
【0046】
【図1】アセチルアセトン鉄錯体退色吸光光度法によってふっ化水素酸濃度を測定する場合の手順を示した説明図である。
【図2】ランタン−アリザリンコンプレキソン吸光光度法によってふっ化水素酸濃度を測定する場合の手順を示した説明図である。
【図3】イオン電極法によってふっ化水素酸濃度を測定する場合の手順を示した説明図である。
【図4】けい素化合物をヘキサフルオロけい酸カリウムとして析出させるために添加する硝酸カリウム量とけい素溶出量の関係を示す図である。
【図5】けい素化合物をヘキサフルオロけい酸カリウムとして析出させた後にアセチルアセトン鉄錯体退色吸光光度法によって測定したふっ化水素酸濃度とガラスの溶解減量の関係を示す図である。
【図6】けい素化合物をヘキサフルオロけい酸カリウムとして析出させた後にランタン−アリザリンコンプレキソン吸光光度法によって測定したふっ化水素酸濃度とガラスの溶解減量の関係を示す図である。
【図7】けい素化合物をヘキサフルオロけい酸カリウムとして析出させた後にアセチルアセトン鉄錯体退色吸光光度法によって測定したふっ化水素酸濃度をヘキサフルオロけい酸カリウムとして析出させることなくアセチルアセトン鉄錯体退色吸光光度法によって測定したふっ化水素酸濃度を用いて補正したふっ化水素酸濃度とガラスの溶解減量の関係を示す図である。
【図8】けい素化合物をヘキサフルオロけい酸カリウムとして析出させた後にランタン−アリザリンコンプレキソン吸光光度法によって測定したふっ化水素酸濃度をヘキサフルオロけい酸カリウムとして析出させることなくランタン−アリザリンコンプレキソン吸光光度法によって測定したふっ化水素酸濃度を用いて補正したふっ化水素酸濃度とガラスの溶解減量の関係を示す図である。
【図9】けい素化合物をヘキサフルオロけい酸カリウムとして析出させることなくアセチルアセトン鉄錯体退色吸光光度法によって測定したふっ化水素酸濃度とガラスの溶解減量の関係を示す図である。
【図10】けい素化合物をヘキサフルオロけい酸カリウムとして析出させることなくランタン−アリザリンコンプレキソン吸光光度法によって測定したふっ化水素酸濃度とガラスの溶解減量の関係を示す図である。
【符号の説明】
【0047】
1 液量が8mlの場合のグラフ
2 液量が16mlの場合のグラフ
3 液量が24mlの場合のグラフ
4 測定値を示す点
5 回帰直線
【技術分野】
【0001】
本発明は、ふっ化水素酸とけい素化合物を含有する水溶液中のふっ化水素酸の分析方法に関するものである。
【背景技術】
【0002】
ふっ化水素酸はガラスや金属けい素を化学的に溶解する目的で工業的に使用されている。例えば、ブラウン管用ガラスパネルを再利用するために、適当な濃度のふっ化水素酸溶液で処理して、表面を溶解する工程が行われている。また、金属けい素の製品であるシリコンウェーハを製造する過程においては、機械的研磨後の表面層をふっ化水素酸、硝酸および酢酸の混酸で溶解する工程が行われている。
【0003】
これらの溶解工程においては、ふっ化水素酸がガラスや金属けい素と化学反応して消費されるので、被処理物の処理量が増すにつれて酸溶液中の濃度が低下し、酸溶液の溶解能力が低下する。従って、酸溶液の溶解能力を必要な水準に保つために、通常は、酸溶液の一部を抜き出して廃棄し、代わりに未使用のふっ化水素酸を補充する操作が行われる。
【0004】
このような酸溶液の濃度管理を確実に実施するためには、酸溶液中に含まれる未反応のふっ化水素酸(以後、遊離ふっ化水素酸と呼ぶ)の濃度を知ることが最も重要であるが、現在のところ信頼できる測定方法が確立されていないので、実際には経験的に酸溶液の一部廃棄や新酸の補充を行うことが多い。
【0005】
また、遊離ふっ化水素酸濃度を測定する代わりに、酸溶液中に溶け込んだけい素の濃度を測定することによって、間接的に酸溶液の溶解能力を推測して濃度管理を行う方法が提案されている。例えば、特開2000−239001号公報には、ガラス洗浄用ふっ化水素酸溶液中に溶け込んだけい素の濃度を測定し、それに基づいて濃度管理を行う方法が開示されている。また、特開平11−279777号公報には、シリコンウェーハのエッチング液に含まれるけい素の濃度を所定の範囲内に維持する濃度管理方法が開示されている。
【0006】
しかし、これらの酸溶液やエッチング液によるガラスや金属けい素の溶解能力は液中のけい素濃度とは直接的にはほとんど関係が無く、遊離ふっ化水素酸濃度によって直接的に影響されることは理論的にも明らかなので、信頼できる遊離ふっ化水素酸分析方法の確立が望まれている。
【0007】
ただし、遊離ふっ化水素酸の分析方法が全く無いわけではなく、「Analytical Chemistry」誌の第40巻(1968年)の1276〜1279ページには、「アセチルアセトン鉄錯体退色吸光光度法」が開示されている。この方法は、アセチルアセトンと鉄の錯体がふっ化水素酸の作用によって分解し、その水溶液の色が退色することを利用した吸光光度法であり、ステンレス鋼の酸洗いに用いた硝ふっ酸(硝酸とふっ化水素酸の混酸)中の遊離ふっ化水素酸の分析方法として広く用いられているようである。
【特許文献1】特開2000−239001号公報
【特許文献2】特開平11−279777号公報
【非特許文献1】J.P.McKaveney著 「Spectrophotometric Method for Hydrofluoric Acid in Stainless Steel Pickling Baths」 Analytical Chemistry Vol.40 1968年
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明者はこの「アセチルアセトン鉄錯体退色吸光光度法」によって、ガラスを溶解したふっ化水素酸水溶液中の遊離ふっ化水素酸分析を試みたところ、測定された遊離ふっ化水素酸濃度とその水溶液の溶解能力の相関性が極めて悪いことを見出した。例えば、水溶液の溶解能力がほとんど無いにもかかわらず、かなり高濃度のふっ化水素酸が分析されるような結果が得られたので、このままではガラスを溶解したふっ化水素酸水溶液中の遊離ふっ化水素酸分析方法としては適用できないと判断された。
【0009】
そこで、本発明が解決しようとする課題は、ガラスや金属けい素を溶解することによって生成したけい素化合物およびふっ化水素酸を含む水溶液中の遊離ふっ化水素酸の濃度を正確に測定できる分析方法を提供することである。そして、これによって、該水溶液の溶解能力を的確に判定できるようにすることが、本発明の課題である。
【課題を解決するための手段】
【0010】
本発明者は、前述のように、ガラスや金属けい素を溶解したふっ化水素酸含有水溶液中の遊離ふっ化水素酸をアセチルアセトン鉄錯体退色吸光光度法によって測定した場合の測定値と、その水溶液の溶解能力の相関性が極めて悪い理由を調べた結果、溶解反応によって生成したヘキサフルオロけい酸あるいはそれが解離して生じたヘキサフルオロけい酸イオンが分析誤差を生じさせていることを見出した。
【0011】
すなわち、ガラスをふっ化水素酸水溶液で溶解する際には、主成分の二酸化けい素(SiO2)とふっ化水素酸(HF)が下記の(1)式のように反応して、ヘキサフルオロけい酸(H2SiF6)および水(H2O)を生じる。また、金属けい素(Si)をふっ化水素酸および硝酸(HNO3)を含む水溶液で溶解する際には、下記の(2)式のような反応が起きて、ヘキサフルオロけい酸、水および亜硝酸(HNO2)を生じる。なお、ヘキサフルオロけい酸は強酸なので、水溶液中ではその多くが(3)式のように解離して、水素イオン(H+)およびヘキサフルオロけい酸イオン(SiF62−)を生じることが知られている。
【0012】
SiO2+6HF→H2SiF6+2H2O (1)式
Si+6HF+2HNO3→H2SiF6+2H2O+2HNO2 (2)式
H2SiF6→2H++SiF62− (3)式
【0013】
そして、上記の(1)〜(3)式の反応によって生じたヘキサフルオロけい酸またはヘキサフルオロけい酸イオンがアセチルアセトン鉄錯体を分解する作用を及ぼし、ふっ化水素酸の分析において正誤差を生じさせているものと推測される。
【0014】
そこで、これらのけい素化合物を、遊離ふっ化水素酸分析に先だって除去する方法を種々検討した結果、これらのヘキサフルオロけい酸またはヘキサフルオロけい酸イオンを難溶性のヘキサフルオロけい酸塩として析出させ、さらに必要に応じて、ろ過等の手段によってこれを分離すればよいことを見出した。なお、これ以外の方法(例えば、イオン交換法)によってけい素化合物を除去できて、その結果、ふっ化水素酸の分析に支障が生じないならば、その方法を用いた分析方法も本発明法に含まれる。
【0015】
難溶性のヘキサフルオロけい酸塩としてはヘキサフルオロけい酸カリウムが好ましく、これを析出させるには、硝酸カリウムや塩化カリウムのような、水溶性のカリウム含有塩類を添加すればよい。なお、ヘキサフルオロけい酸カリウム以外の難溶性ヘキサフルオロけい酸塩として析出させる方法も本発明に含まれる。
【0016】
なお、けい素化合物を除去した後に遊離ふっ化水素酸濃度を測定する方法は、必ずしもアセチルアセトン鉄錯体退色吸光光度法である必要はなく、例えば、JISK0101−1998の31に規定されているランタン−アリザリンコンプレキソン吸光光度法やイオン電極法によってふっ素イオン濃度を測定し、ふっ化水素酸濃度に換算してもよい。また、滴定法によって遊離ふっ化水素酸濃度を測定してもよい。ただし、試料溶液中に硝酸などの強酸が含まれる場合には、ふっ化水素酸と強酸を分別定量できる滴定法(例えば、電位差滴定法)が必要である。
【0017】
このようにして測定された遊離ふっ化水素酸濃度は、けい素化合物およびふっ化水素酸を含む水溶液の溶解能力との相関性が十分に高いことが確認されたが、本発明者はさらに相関性を高めるための研究を行った。
【0018】
その結果、けい素化合物をヘキサフルオロけい酸塩として析出させた後に遊離ふっ化水素酸濃度を測定すると共に、けい素化合物をヘキサフルオロけい酸塩として析出させることなく、遊離ふっ化水素酸濃度を測定し、後者の測定値を用いて前者の測定値を補正することによって得られる遊離ふっ化水素酸濃度は、けい素化合物およびふっ化水素酸を含む水溶液の溶解能力との相関性が極めて高いことが判明した。
【0019】
本発明は、以上の研究に基づいて成し遂げられた発明であり、ふっ化水素酸とけい素化合物を含有する水溶液中のけい素化合物をヘキサフルオロけい酸塩として析出させるなどの手段によって除去した後、該水溶液中のふっ化水素酸濃度を測定することを第一の特徴とする。さらに、ふっ化水素酸とけい素化合物を含有する水溶液中のけい素化合物をヘキサフルオロけい酸塩として析出させた後、該水溶液中のふっ化水素酸濃度を測定すると共に、該水溶液中のけい素化合物をヘキサフルオロけい酸塩として析出させることなく、該水溶液中のふっ化水素酸濃度を測定し、後者の測定値を用いて前者の測定値を補正することを第二の特徴とする。
【発明の効果】
【0020】
本発明法によって測定した遊離ふっ化水素酸濃度は、けい素化合物およびふっ化水素酸を含む水溶液の溶解能力との相関性が高いので、この分析値を用いることにより、ガラス等を溶解するためのふっ化水素酸含有水溶液の濃度管理を的確に行うことが可能となる。
【発明を実施するための最良の形態】
【0021】
図1、図2および図3は、ヘキサフルオロけい酸またはヘキサフルオロけい酸イオンのようなけい素化合物を含む水溶液中の遊離ふっ化水素酸を本発明法によって分析する際の手順の例を示したものである。この内、図1は、アセチルアセトン鉄錯体退色吸光光度法によってふっ化水素酸濃度を測定する場合の手順、図2は、ランタン−アリザリンコンプレキソン吸光光度法によってふっ化水素酸濃度を測定する場合の手順、図3はふっ化物イオン電極を用いてふっ化水素酸濃度を測定する場合の手順である。
【0022】
これらの分析手順において、試料溶液に添加するカリウムイオン含有溶液としては、硝酸カリウムの水溶液が推奨されるが、塩化カリウムまたは硫酸カリウムの水溶液でもよい。その水溶液の濃度は、なるべく濃い方が、添加後の試料溶液の液量を少なくすることができ、その結果、カリウムイオン濃度が高まって、ヘキサフルオロけい酸カリウムの溶解量が少なくなり、分析誤差が小さくなる。従って、硝酸カリウム等の結晶をそのまま試料溶液に添加して溶解する方法でもよいが、利便性を考慮すると、1mol/l程度の水溶液で添加する方法が推奨される。
【0023】
試料溶液に添加するカリウムイオン含有溶液の量は、試料溶液中に含まれるけい素化合物をヘキサフルオロけい酸カリウムとして析出させるのに必要な理論値(すなわち、過不足無く反応する量)より多くする必要があり、望ましくは1.5倍以上、さらに望ましくは2倍以上とするのがよい。もし、カリウムイオン含有溶液の添加量を上記の理論値程度とすると、許容できない量のけい素化合物が溶液中に残留する。
【0024】
図4は上記のことを示す実験結果をグラフにまとめたものである。横軸の「当量比」とは、添加した硝酸カリウムのモル数を試料溶液中のけい素化合物のモル数の2倍で除したものである。理論的には、下記の(4)式の反応によってヘキサフルオロけい酸カリウム(K2SiF6)を析出させる際に、1分子のヘキサフルオロけい酸(H2SiF6)に対して2分子の硝酸カリウム(KNO3)が必要なので、当量比が1であれば過不足無く反応する硝酸カリウムが添加されていることを意味する。
H2SiF6+2KNO3→K2SiF6+2HNO3 (4)式
【0025】
図4からわかるように、当量比が1の場合には溶液中にかなりの量のけい素化合物が含まれており、ふっ化水素酸の分析値に無視できない正誤差を与えることが判明した。一方、当量比が約1.7になるように硝酸カリウムを添加した場合には、溶液中のけい素化合物は非常に少なくなり、ふっ化水素酸の分析値に全く影響を及ぼさないことを確認した。また、試料溶液に硝酸カリウム溶液を添加した後の液量が多いほど、溶液中のけい素化合物が多くなる傾向があることも確認された。
【0026】
遊離ふっ化水素酸の含有量が少ない場合(例えば、試料溶液100ml中0.5g未満)には、試料溶液中にヘキサフルオロけい酸カリウムとして析出しない形態のけい素化合物が多く含まれて、これが正誤差を生じさせることがある。この場合には、既知量のふっ化水素酸を試料溶液に添加した後にカリウムイオン含有溶液を添加して遊離ふっ化水素酸を定量し、先に添加した既知量のふっ化水素酸を差し引いて計算するのがよい。
【0027】
析出したヘキサフルオロけい酸塩を溶液から分離せずにふっ化水素酸濃度を測定すると、析出塩による分析誤差が生じる可能性があるので、これを溶液から分離するのが望ましい。分離方法としては、ろ過、遠心分離法、沈降法等が適用できるが、比較的、迅速かつ簡便に実施できる方法として、ろ過による方法が推奨される。
【0028】
ろ過後に析出塩を洗浄する場合には、カリウム塩の水溶液で洗浄するのがよい。もし、水で洗浄すると、析出塩の一部が溶解・解離し、ヘキサフルオロけい酸イオンを生じて、許容できない程度の分析誤差を生じることがある。
【0029】
アセチルアセトン鉄錯体退色吸光光度法やランタン−アリザリンコンプレキソン吸光光度法などによってふっ化水素酸濃度を定量する際に用いる検量線の作成においては、試料溶液中に含まれる共存物質(例えば、カリウム塩類)が同程度の量含まれるように、ふっ化水素酸標準液またはふっ素標準液に添加する必要がある。
【実施例1】
【0030】
一定量(2.1393g)の二酸化けい素の粉末に、前述の(1)式の反応で過不足無く溶解するのに必要な量(4.2739g)のふっ化水素酸を加えて溶解したのち、過剰のふっ化水素酸(約4g)を加え、純水で100mlに希釈した。この水溶液(記号:A)100ml中には遊離ふっ化水素酸約4gおよびけい素約1gが含まれる。
【0031】
同様に、一定量(2.1393g)の二酸化けい素の粉末に、前述の(1)式の反応で過不足無く溶解するのに必要な量(4.2739g)のふっ化水素酸を加えて溶解したのち、過剰のふっ化水素酸(約4g)および硝酸(約20g)と酢酸(約3g)を加え、純水で100mlに希釈した。この水溶液(記号:B)100ml中には遊離ふっ化水素酸約4g、けい素約1g、硝酸約20gおよび酢酸約3gが含まれる。
【0032】
これらの水溶液AおよびB中の遊離ふっ化水素酸を図1、図2および図3に示す分析手順で分析した。なお、これらの分析手順においては、カリウムイオン含有溶液として、濃度が1mol/lの硝酸カリウム水溶液を用い、試料溶液1.67mlに対して2.00mlを添加した。また、ヘキサフルオロけい酸カリウムの沈殿およびろ紙の洗浄にも、濃度が1mol/lの硝酸カリウム水溶液25mlを用いた。
【0033】
また、図1の分析手順におけるふっ化水素酸の定量条件は、前述の非特許文献に開示されている定量条件と同じ条件とし、図2および図3の分析手順におけるふっ素の定量条件はJISK0101−1998の31に規定されているランタン−アリザリンコンプレキソン吸光光度法およびイオン電極法と同じ条件とした。また、ふっ化水素酸の定量のための検量線は図1、図2または図3の分析手順の最初から操作して作成した。
【0034】
一方、比較のために、水溶液中のけい素化合物をヘキサフルオロけい酸カリウムとして析出・分離する操作、すなわち、図1、図2および図3における、カリウムイオン含有溶液の添加、混合およびろ過・洗浄の操作を行わない方法でも分析した。
【0035】
分析結果を表1に示す。本発明法による試料溶液AおよびB中の遊離ふっ化水素酸濃度分析値はそれぞれ4.0〜4.1g/100mlおよび3.9〜4.0g/100mlであり、試料溶液の調製条件から予想された濃度に近い値を示した。一方、比較法による分析値は7.3〜7.4g/100mlまたは8.1〜8.3g/100mlであり、本発明法による分析値に比べて大幅に高い値を示した。これは、試料溶液中にふっ化水素酸と共存するけい素化合物がふっ化水素酸分析値に正誤差を生じさせたためと推定される。
【0036】
【表1】

【実施例2】
【0037】
二酸化けい素粉末をふっ化水素酸で溶解して調製した水溶液およびふっ化水素酸のみを含む水溶液を種々の割合で混合して、7種類の試料溶液を調整し、これらの試料溶液中の遊離ふっ化水素酸濃度を、実施例1と同じ分析方法(ただし、イオン電極法は省略)で分析した。
【0038】
一方、これらの試料溶液50mlを50℃に加熱したのち、ガラス板(厚さ2mm、大きさ40×40mm)を浸漬し、超音波を照射しながら20分間保持して溶解した。ガラス板を試料溶液に浸漬する前の重量と浸漬後に水洗・乾燥した後の重量の差をガラス板の溶解減量とした。
【0039】
ガラス板の溶解減量と試料溶液中のふっ化水素酸濃度の分析結果を表2に示す。なお、表中の「Si析出あり(a)」とは、試料中のけい素化合物をヘキサフルオロけい酸塩として析出させた後に測定したふっ化水素酸濃度(記号aで示す)であり、「Si析出なし(b)」とは、試料中のけい素化合物をヘキサフルオロけい酸塩として析出させることなく測定したふっ化水素酸濃度(記号bで示す)である。
【0040】
【表2】

【0041】
また、「補正値(c)」とは、aの測定値を補正するために下記の数式1によって算出した数値であり、「補正後(a+c)」とは、aの測定値にcの数値を加えた数値である。
【0042】
【数1】

数式1において、kは定数であり、ふっ化水素酸をアセチルアセトン鉄退色吸光光度法で定量した場合には0.37、ランタン−アリザリンコンプレキソン吸光光度法で定量した場合には0.33とした。また、計算された(b−a)が負の数値になった場合には、これをゼロとした。
【0043】
測定されたガラスの溶解減量に対する試料溶液中のふっ化水素酸濃度分析値の関係を図5〜10に示す。このうち、図5および図6は試料溶液中のけい素化合物をヘキサフルオロけい酸カリウムとして析出させた後に測定したふっ化水素酸濃度(すなわち、表2のa)とガラスの溶解減量との関係を示したものであるが、両者には強い相関性が認められる(相関係数0.980)。また、図7および図8は補正後のふっ化水素酸濃度(すなわち、表2のa+c)とガラスの溶解減量との関係を示したものであるが、両者の相関性はさらに強まった(相関係数0.998)。
【0044】
一方、図9および図10は比較のために、試料溶液中のけい素化合物をヘキサフルオロけい酸カリウムとして析出させることなく測定したふっ化水素酸濃度(すなわち、表2のb)とガラスの溶解減量との関係を示したものであるが、両者の間にはごく弱い相関性しか認められなかった(相関係数0.614または0.447)。
【産業上の利用可能性】
【0045】
本発明法により、ガラスや金属けい素を溶解することによって生成したけい素化合物およびふっ化水素酸を含む水溶液中の遊離ふっ化水素酸の濃度を正確に測定できるので、該水溶液の溶解能力を的確に判定できる。
【図面の簡単な説明】
【0046】
【図1】アセチルアセトン鉄錯体退色吸光光度法によってふっ化水素酸濃度を測定する場合の手順を示した説明図である。
【図2】ランタン−アリザリンコンプレキソン吸光光度法によってふっ化水素酸濃度を測定する場合の手順を示した説明図である。
【図3】イオン電極法によってふっ化水素酸濃度を測定する場合の手順を示した説明図である。
【図4】けい素化合物をヘキサフルオロけい酸カリウムとして析出させるために添加する硝酸カリウム量とけい素溶出量の関係を示す図である。
【図5】けい素化合物をヘキサフルオロけい酸カリウムとして析出させた後にアセチルアセトン鉄錯体退色吸光光度法によって測定したふっ化水素酸濃度とガラスの溶解減量の関係を示す図である。
【図6】けい素化合物をヘキサフルオロけい酸カリウムとして析出させた後にランタン−アリザリンコンプレキソン吸光光度法によって測定したふっ化水素酸濃度とガラスの溶解減量の関係を示す図である。
【図7】けい素化合物をヘキサフルオロけい酸カリウムとして析出させた後にアセチルアセトン鉄錯体退色吸光光度法によって測定したふっ化水素酸濃度をヘキサフルオロけい酸カリウムとして析出させることなくアセチルアセトン鉄錯体退色吸光光度法によって測定したふっ化水素酸濃度を用いて補正したふっ化水素酸濃度とガラスの溶解減量の関係を示す図である。
【図8】けい素化合物をヘキサフルオロけい酸カリウムとして析出させた後にランタン−アリザリンコンプレキソン吸光光度法によって測定したふっ化水素酸濃度をヘキサフルオロけい酸カリウムとして析出させることなくランタン−アリザリンコンプレキソン吸光光度法によって測定したふっ化水素酸濃度を用いて補正したふっ化水素酸濃度とガラスの溶解減量の関係を示す図である。
【図9】けい素化合物をヘキサフルオロけい酸カリウムとして析出させることなくアセチルアセトン鉄錯体退色吸光光度法によって測定したふっ化水素酸濃度とガラスの溶解減量の関係を示す図である。
【図10】けい素化合物をヘキサフルオロけい酸カリウムとして析出させることなくランタン−アリザリンコンプレキソン吸光光度法によって測定したふっ化水素酸濃度とガラスの溶解減量の関係を示す図である。
【符号の説明】
【0047】
1 液量が8mlの場合のグラフ
2 液量が16mlの場合のグラフ
3 液量が24mlの場合のグラフ
4 測定値を示す点
5 回帰直線
【特許請求の範囲】
【請求項1】
ふっ化水素酸とけい素化合物を含有する水溶液中のけい素化合物をあらかじめ除去した後、該水溶液中のふっ化水素酸濃度を測定することを特徴とする、ふっ化水素酸とけい素化合物を含有する水溶液中のふっ化水素酸の分析方法
【請求項2】
ふっ化水素酸とけい素化合物を含有する水溶液中のけい素化合物をヘキサフルオロけい酸塩として析出させた後、該水溶液中のふっ化水素酸濃度を測定することを特徴とする、ふっ化水素酸とけい素化合物を含有する水溶液中のふっ化水素酸の分析方法
【請求項3】
ふっ化水素酸とけい素化合物を含有する水溶液中のけい素化合物をヘキサフルオロけい酸塩として析出させた後、該水溶液中のふっ化水素酸濃度を測定すると共に、該水溶液中のけい素化合物をヘキサフルオロけい酸塩として析出させることなく、該水溶液中のふっ化水素酸濃度を測定し、後者の測定値を用いて前者の測定値を補正することを特徴とする、ふっ化水素酸とけい素化合物を含有する水溶液中のふっ化水素酸の分析方法
【請求項1】
ふっ化水素酸とけい素化合物を含有する水溶液中のけい素化合物をあらかじめ除去した後、該水溶液中のふっ化水素酸濃度を測定することを特徴とする、ふっ化水素酸とけい素化合物を含有する水溶液中のふっ化水素酸の分析方法
【請求項2】
ふっ化水素酸とけい素化合物を含有する水溶液中のけい素化合物をヘキサフルオロけい酸塩として析出させた後、該水溶液中のふっ化水素酸濃度を測定することを特徴とする、ふっ化水素酸とけい素化合物を含有する水溶液中のふっ化水素酸の分析方法
【請求項3】
ふっ化水素酸とけい素化合物を含有する水溶液中のけい素化合物をヘキサフルオロけい酸塩として析出させた後、該水溶液中のふっ化水素酸濃度を測定すると共に、該水溶液中のけい素化合物をヘキサフルオロけい酸塩として析出させることなく、該水溶液中のふっ化水素酸濃度を測定し、後者の測定値を用いて前者の測定値を補正することを特徴とする、ふっ化水素酸とけい素化合物を含有する水溶液中のふっ化水素酸の分析方法
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2008−216178(P2008−216178A)
【公開日】平成20年9月18日(2008.9.18)
【国際特許分類】
【出願番号】特願2007−57085(P2007−57085)
【出願日】平成19年3月7日(2007.3.7)
【出願人】(307006583)財団法人上越環境科学センター (1)
【Fターム(参考)】
【公開日】平成20年9月18日(2008.9.18)
【国際特許分類】
【出願日】平成19年3月7日(2007.3.7)
【出願人】(307006583)財団法人上越環境科学センター (1)
【Fターム(参考)】
[ Back to top ]

