アクチンの製造方法、それに用いるベクターおよび原核宿主細胞
【課題】 高収率でアクチンを容易に製造可能なアクチンの製造方法を提供する。
【解決手段】 本発明のアクチンの製造方法は、アクチン遺伝子を含むコールドショック発現ベクターにより形質転換された原核宿主細胞を準備する準備工程と、前記原核宿主細胞の正常生理的増殖温度よりも低い温度で前記原核宿主細胞を培養することにより前記コールドショック発現ベクター中のアクチン遺伝子を発現させてアクチンを産生させるアクチン産生工程とを含むことを特徴とする。
【解決手段】 本発明のアクチンの製造方法は、アクチン遺伝子を含むコールドショック発現ベクターにより形質転換された原核宿主細胞を準備する準備工程と、前記原核宿主細胞の正常生理的増殖温度よりも低い温度で前記原核宿主細胞を培養することにより前記コールドショック発現ベクター中のアクチン遺伝子を発現させてアクチンを産生させるアクチン産生工程とを含むことを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アクチンの製造方法、それに用いるベクターおよび原核宿主細胞に関する。
【背景技術】
【0002】
アクチンは、筋肉を構成するタンパク質として、1942年に発見された。筋肉において、アクチンは多量化して繊維状となり、ATPをADPに変換するエネルギーにより、繊維状アクチンの間をミオシンが滑ることで筋肉が収縮する。この他に、アクチンは、一般の細胞内にもマトリックスタンパク質として存在し、生体内のタンパク質総量の5ないし10%を占める最も量の多いタンパク質である。アクチンは、一分子あたり、ATPおよびカルシウムを各一個有している。アクチンの形状は、亜鈴状をしており、ATPが失われると、二量体となる。単量体をGアクチンといい、重合してポリマーとなったアクチンをFアクチンという。真核生物に広く存在するアクチンの一次構造は、保守的で種別による大きな変化はない。哺乳類では、六種類のアイソアクチンが知られており、等電点の差から、αアクチン(骨格筋)、βアクチン(一般細胞)、γアクチン(平滑筋)等がある。
【0003】
このように、アクチンは、広く生物に分布するタンパク質であるため、その研究が各分野で進められている。しかしながら、研究材料としてのアクチンの入手が困難である。すなわち、ヒト等の真核生物のアクチンを遺伝子工学で製造する場合、通常、アクチン遺伝子を導入した組換え酵母が用いられるが、この手法では、培養や細胞の粉砕等に手間がかかり不便である(非特許文献1)。また、生物から直接アクチンを採取する方法もあるが、生体材料の確保や抽出精製作業の点から大量のアクチンを採取することは実質的に困難である。このような点から、研究材料として市販されているアクチンは、大変高価であり、アクチンを大量に用いて研究することが困難であった。さらに、アクチンの機能や生物進化的な意義を解明するには、アクチンの変異体を作製する必要がある。このため、大量培養が容易で発現タンパク質の抽出精製が酵母よりも容易な大腸菌を用いてアクチン遺伝子を発現させることが試みられている(非特許文献2)。しかしながら、大腸菌を用いたアクチンの生産では、アクチン重合による不溶化、不純物タンパク質生成、アクチンの分解等の原因により、その収率等に問題があった。したがって、大腸菌を用いてアクチンを高収率で生産することは不可能であるというのが、従来の技術常識であり、他の原核生物を用いても同様であった。
【0004】
【非特許文献1】Genetics 132:337−350(October,1992)
【非特許文献2】THE JOURNAL OF BIOLOGICAL CHEMISTRY Vol.265,No.29,Issue of October 15,pp.17980−17987,1990
【発明の開示】
【発明が解決しようとする課題】
【0005】
そこで、本発明は、アクチンないしアクチンの変異体を高収率で容易に製造可能なアクチンの製造方法を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明のアクチンの製造方法は、アクチン遺伝子を含むコールドショック発現ベクターにより形質転換された原核宿主細胞を準備する準備工程と、前記原核宿主細胞の正常生理的増殖温度よりも低い温度で前記原核収縮細胞を培養することにより前記コールドショック発現ベクター中のアクチン遺伝子を発現させてアクチンを産生させるアクチン産生工程とを含むことを特徴とする。
【発明の効果】
【0007】
このように、本発明の製造方法では、低温化でアクチン遺伝子を発現させるため、アクチンの重合による不溶化を防止でき、不純物タンパク質の生成およびアクチンの分解を抑制することが可能である。また、本発明の製造方法では、大量培養が容易であり、また生成したアクチンの抽出精製操作が容易な原核宿主細胞を使用している。したがって、本発明の製造方法によれば、高収率で容易にアクチンを製造することができる。
【発明を実施するための最良の形態】
【0008】
つぎに、本発明について例をあげて詳しく説明する。ただし、本発明は、下記の事項によって限定されない。
【0009】
本発明において、対象になるアクチンは特に制限されず、アクチン変異体も含む。また、製造対象になるアクチンは、αアクチン、βアクチン、γアクチンおよびこれらのアクチンの各変異体が好ましく、より好ましくは、βアクチンおよびその変異体である。また、アクチンの変異体を製造する場合のアクチン遺伝子は、アクチンの変異遺伝子である。本発明のベクターは、本発明の製造方法に使用するベクターであって、前記ベクターはコールドショック発現ベクターであり、前記ベクターが、アクチン遺伝子またはアクチンの変異遺伝子を発現可能な状態で含むベクターである。本発明のベクターとしては、例えば、後述のベクターがある。
【0010】
本発明の原核宿主細胞は、本発明のアクチンの製造方法に使用する原核宿主細胞であって、本発明のベクターにより形質転換されている原核宿主細胞である。本発明において、前記原核宿主細胞は、特に限定されず、例えば、大腸菌および枯草菌等があげられ、このなかでも大腸菌が好ましい。
【0011】
本発明において、前記原核宿主細胞が大腸菌であり、前記コールドショック発現ベクターが、大腸菌コールドショック遺伝子のプロモータおよび5´非翻訳領域(5´UTR)を含むベクターであることが好ましい。また、前記プロモータが、cspAプロモータであることが好ましい。また、前記ベクターは、さらに12塩基配列のATリッチの翻訳増強エレメントを含むことが好ましい。前記ATリッチとは、12塩基配列中の70%以上の塩基がATであることを意味する。そして、前記ベクターは、AAGAGGTのSD配列を有することが好ましい。アクチン遺伝子の塩基配列中には、AAGGという偽SD配列が含まれており、このため従来のベクターを用いて大腸菌でアクチン遺伝子を発現しようとすると、アクチン遺伝子の途中から翻訳が始まってしまい、これが不純物タンパク質生成の原因の一つであった。これに対し、前記ベクターが、AAGAGGTのSD配列を有すると、大腸菌中のrRNAサブユニットとの配列と親和性が高いため、アクチン遺伝子の偽SD配列からの翻訳が防止できる。
【0012】
上述のコールドショック発現ベクターとしては、例えば、特表2005−518804号公報に記載のベクターがあり、前記ベクターの塩基配列は、NCBI Gene Bankに登録されており、そのAccession No.は、AB186388,AB186389、AB186390およびAB186391である。また、前記公報記載のベクターの市販品としては、タカラバイオ社製の商品名pCold I〜IV ベクターがある(以下、「pColdベクター」ともいう)。pColdベクターの外来遺伝子挿入部位には、cosAプロモータ、lacオペレータ、cspA5´UTR、MCS(multiple cloning site)およびcspA3´UTRが、この順序で作動的に連結しており、前記MCS部位に、アクチン遺伝子やアクチンの変異遺伝子を挿入できる。また、前記外来遺伝子挿入部位には、必要に応じて、TEE配列、His・Tag配列およびFactor Xa切断配列が挿入される。その他、pColdベクターには、大腸菌の複製起点(ColE1 ori)、lac I,Ampr,M13 IGの各遺伝子が挿入されている。
【0013】
本発明の前記アクチン産生工程において、本プラスミドは、正常生理的増殖温度よりも13℃低い温度で培養することが好ましく、より好ましくは、正常生理的増殖温度よりも20℃低い温度で培養することである。例えば、大腸菌の正常生理的増殖温度は37℃であるので、タンパク発現工程の培養温度は、24℃以下が好ましく、より好ましくは17℃以下である。
【0014】
本発明の製造方法において、さらに、前記原核宿主細胞を、その正常生理的増殖温度で培養する一般培養工程を有し、前記一般培養工程で前記原核宿主細胞を培養した後、前記アクチン産生工程を実施することが好ましい。すなわち、前記一般培養工程で大腸菌を十分量培養した後、アクチン産生工程を実施すれば、アクチンをより大量に製造することができる。
【0015】
本発明において、さらに、前記原核宿主細胞を溶菌して産生されたアクチンを回収する回収工程を有することが好ましい。そして、前記回収工程を、ADPおよびセリンプロテアーゼインヒビターの少なくとも一方の存在下で実施することが好ましい。ADPの存在下で前記回収工程を実施すれば、生成したアクチンの重合をより効果的に抑制でき、また前記セリンプロテアーゼインヒビターの存在下で前記回収工程を実施すれば、生成したアクチンのプロテアーゼによる分解をより効果的に抑制できるからである。前記セリンプロテアーゼインヒビターは、diisopropyl fluorophosphate(DIFP)が好ましい。なお、ADPおよび前記インヒビターの少なくとも一方の存在下という条件は、前記回収工程の全工程に適用してもよいし、一部の工程に適用してもよいが、好ましくは全工程に適用することである。
【0016】
本発明において、さらに、前記回収したアクチンを精製する精製工程を有することが好ましい。例えば、His・Tagを有する前記pColdベクターを用いれば、後述の実施例2に記載するように、Niカラムのクロマトグラフィーを実施して精製することができ、これにより、高純度のアクチンを得ることが可能になる。
【0017】
本発明の製造方法は、例えば、pColdベクターを用い、つぎのようにして実施できる。
【0018】
まず、アクチン遺伝子を準備する。アクチン遺伝子は既に塩基配列が公知であり、種々生物組織から特異的プライマーを用いてクローニングして自家調製できる。
【0019】
つぎに、pColdベクターのBamHIとEcoRIサイトの間に前記アクチン遺伝子をサブクローニングして発現用プラスミドを作製する。この発現用プラスミドで宿主大腸菌を形質転換し、アンピシリンを含む選択培地プレートを用いて形質転換体を選択する。つぎに、50〜100μg/mLアンピシリンを含むLB培地に形質転換体を植菌し、37℃で振とう培養する。培養液の濁度(OD600nm)が0.4〜0.5になるまで菌が増殖した時点で培養液を4℃に冷却する。そして、最終濃度0.1〜1.0mMとなるようにIPTGを添加して15℃で静置して培養する。培養終了後、菌を集めて溶菌し、可溶物の中からアクチンを回収する。前記溶菌からアクチンの回収に至るまでの工程は、ADPおよびDIFPの存在下で行う。なお、前記製造工程の各培養の時間は、種々の条件により適宜決定する。
【0020】
つぎに、本発明の実施例について比較例と併せて説明する。ただし、本発明は、下記の実施例および比較例によってなんら限定されない。
【実施例1】
【0021】
(形質転換大腸菌の作製)
プラスミド精製(アルカリSDS法)によって得たpGEX−6P−ActinプラスミドDNAをBamHI(東洋紡社製)およびEcoRI(東洋紡社製)により制限酵素処理を行ってActin cDNAを切り出した。ベクターとしては、商品名pCold I DNA(Code3360,タカラバイオ社製)を用いた。前記pCold I DNAベクターを、BamHI(東洋紡社製)およびEcoRI(東洋紡社製)により制限酵素処理を行い、ついで、アルカリフォスフォターゼ処理を行った。商品名Ligation kis ver.2.1(タカラバイオ社製)を用い、前記ActinインサートDNA(0.5pmol)および前記ベクター(0.05pmol)を混合して5μLの溶液を調製し、これに前記キットのSolution I 5μLを加え、15℃で4時間インキュベートしてLigationを行った後、前記キットのSolution III 1μLを加えて、下記のTSS法で、大腸菌XL−1株への形質移入を行った。大腸菌XL−1株を増殖させてプラスミドを調製した後、再びTSS法で、大腸菌BL−21株に形質導入した。前記大腸菌BL−21株においてミニスケール発現を行い、アクチンの発現を確認するとともに、ジデオキシ法でDNA配列の確認を行った。
【0022】
TSS法(大腸菌の形質転換法)
大腸菌BL−21株を2mL LB培地(アンピシリンなし)で、37℃で一晩震盪培養する。培養液20μLを2mL LB培地へ移し、さらに3時間震盪培養する。その培養液1.5mLをエッペンチューブへ移し、小型遠心機で15000rpm×1分遠心し、デカンテーションにより上澄みを除去する。沈澱した菌体を手でほぐし、氷冷する。菌体にTSS溶液200μL、DMSO10μL,およびDNA溶液10μLを順次加え、ピペッティングにより混合する。30分間氷冷した後、クリーンベンチの中でLB−Amp50寒天プレートに菌体をスプレッダーで捲く。プレートを気相インキュベータで37℃10時間インキュベートする。プラスミドがトランスフォームされた菌はコロニーを形成するので、形成したコロニーを楊子でつついて採取する。
【0023】
(アクチン遺伝子の発現)
前記形質転換大腸菌を、LB培地(アンピシリン50μg/mL入り)を用い、37℃で4時間、試験管(4mL×5)で振とう培養し、ついで、2リットル培地中で37℃で4時間、静置培養した。つぎに、4℃に冷却後、前記培地にIPTG(最終濃度50μM)を添加して15℃で20時間培養することによりIPTG誘導してアクチン遺伝子を発現させた。
【0024】
(溶菌処理)
アクチン遺伝子の発現後、遠心(6000rpm×10分、4℃)して前記大腸菌を集菌し、冷凍機で1時間以上凍結させた後、融解し、下記の組成の溶菌バッファーに前記大腸菌を分散した。なお、下記の組成表に示すように、インヒビター類は、分散させた後に添加した。そして、前記溶菌バッファーに分散した前記大腸菌を超音波処理(60W×1分、8回)により溶菌した。
【0025】
溶菌バッファー組成 (100mLに対して)
1M Tris−HCl(pH8.0) 1mL(10mM)
0.1M EDTA(pH8.0) 1mL(1mM)
0.4M PMSF 25μL(0.1mM)(分散後添加)
1M DTT 50μL(0.5mM)(分散後添加)
1M ADP 100μL(1mM)(分散後添加)
DIFP 6.0μL(分散後添加)
【0026】
(アクチンの回収と粗精製)
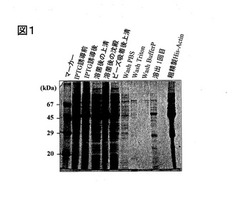
前記超音波処理した液を遠心(18000rpm×20分、4℃)し、その上清液を採取した。前記上清液に対し、Ni−NTAビーズ(商品名Ni−NTAアガロースビーズ、キアゲン社製)を用いて、粗精製を行った。前記Ni−NTAビーズは、下記組成のPBS(1mMのADP添加)を加えて濃度50%のスラリーにしたものである。前記上清液に、前記Ni−NTAビーズのスラリーを6ml添加し、4℃で一晩ディスクロータでゆっくり回転させた。その後、静置して沈澱させ、沈殿を回収した。洗浄は,下記のPBS,界面活性剤、バッファーP(各40mL)を順次用いて、次のように行った。すなわち、沈澱に洗浄液を加えて10分間4℃で回転させた後、遠心(2200rpm×10分、4℃)して沈澱を取る操作を繰り返した。次に沈澱からの溶出にはバッファーP´を10mL加えて4℃で30分間回転後、遠心(同上)して上清をとるという操作を3回繰り返した。得られた上清について、下記バッファーG(1リットル)に対する透析(2時間、4℃)を行った。2時間後、外液を交換し、さらに、2時間、前述と同様の透析を行った。その後、遠心ろ過フィルター(商品名Amicon Ultra、分画30000、ミリポア社製)を用いてタンパク質溶液を濃縮し、電気泳動(SDS−PAGE)およびタンパク質定量を行った。SDS−PAGEについては、IPTG誘導前、IPTG誘導後、溶菌後の上清、溶菌後の沈殿、ビーズ吸着後上清、1回目洗浄液(PBS)、2回目洗浄液(Triton溶液)、3回目洗浄液(バッファーP)、溶出1回目の溶出液についても実施した。なお、粗精製で得られたアクチンは、HisのTagがついたアクチン(His−Actin)である。SDS−PAGEの結果を図1の写真に示す。前記タンパク質の定量は、プロテインアッセイ染色液(Coomasie Brilliant Blueによる発色液、Bio−Rad社製)を用い、標準液として牛血清アルブミンを用いて実施した。
【0027】
PBS組成
50mM NaCl
50mM KCl
8mM Na2HPO4
1.5mM KH2PO4
1mM ADP
5mM イミダゾール
【0028】
界面活性剤溶液(Triton溶液)
商品名Triton 0.5%(w/v)
10mM イミダゾール
1mM ADP
【0029】
バッファーP
50mM Tris−HCl(pH8.0)
1mM EDTA(pH8.0)
10mM イミダゾール
1mM ADP
【0030】
バッファーP´
50mM Tris−HCl(pH8.0)
1mM EDTA(pH8.0)
250mM イミダゾール
1mM DTT
1mM ADP
【0031】
バッファーG
5mM Tris−HCl(pH8.0)
0.2mM CaCl2
0.2mM ATP
0.5mM DTT
【0032】
(比較例1)
アクチン遺伝子挿入ベクターとしてpGEX−6P−actinを準備し、これを用いて大腸菌を形質転換した。この形質転換大腸菌を、実施例1と同じ培地を用い、37℃で3時間、振とう培養し、ついで、前記培地にIPTG(最終濃度50μM)を添加した。そして20℃で20時間培養することによりIPTG誘導してアクチン遺伝子を発現させた。前記大腸菌について、以下に示す条件および操作で、アクチンの回収と粗精製を行った。
【0033】
前記超音波処理した液を遠心(18000rpm×20分、4℃)し、その上清液を採取した。前記上清液に対し、G−Sepharoseビーズ(商品名Glutathione Sepharose、GE Healthcare社製)を用いて粗製製を行った。前記ビーズは、前記組成のPBSを加えて濃度50%のスラリーにしたものである。前記上清液に、前記ビーズのスラリーを6ml添加し、4℃で一晩ディスクロータでゆっくり回転させた。その後、静置して沈澱させ、沈殿を回収した。洗浄は,前記のPBS,界面活性剤、バッファーP(各40mL)を順次用いて、次のように行った。すなわち、沈澱に洗浄液を加えて10分間4℃で回転させた後、遠心(2200rpm×10分、4℃)して沈澱を取る操作を繰り返した。次に沈澱からの溶出にはバッファーP´を10mL加えて4℃で30分間回転後、遠心(同上)して上清をとるという操作を3回繰り返した。得られた上清について、GST融合タンパク質切断用プロテアーゼ(PreScission Proteas)10μLおよび1mM DTT240μLを添加した前記バッファーPを加えて、4℃で1時間ディスクロータでゆっくり回転させる溶出(抽出)処理を6回行った。前記抽出液を、下記バッファー(1リットル)に対する透析(2時間、4℃)を行った。2時間後、外液を交換し、さらに、2時間、前述と同様の透析を行った。その後、遠心ろ過フィルター(商品名Amicon Ultra、分画30000、ミリポア社製)を用いてタンパク質溶液を濃縮し、電気泳動(SDS−PAGE)およびタンパク質定量を行った。SDS−PAGEについては、ビーズ吸着後1回目から6回目の抽出液と,それらのうち純度のよかった1回目と2回目を合わせて濃縮したもの(精製サンプル)について示した。なお、この粗精製で得られたアクチンは、Tagのないアクチンである。SDS−PAGEの結果を図2の写真に示す。前記タンパク質の定量は、前記実施例1と同様にして実施した。
【0034】
バッファー組成
10mM KPB(pH7.0)
0.2mM CaCl2
0.2mM ATP
【0035】
前記実施例1において、粗精製におけるアクチンの純度は、70%であり、回収率は、アクチン量2.7mg/L(培地)であり、高回収率でアクチンを得ることができた。これに対し、比較例1では、純度は70%であったが、回収率がアクチン量0.5mg/L(培地)であり、回収率が悪かった。なお、比較例1では、Tagを外す必要があったので、これ以上精製することができないため、純度をさらに上げることは困難であった。これに対し、本実施例では、以下の実施例2に示すように、さらに純度を上げることが可能であった。
【実施例2】
【0036】
実施例1と同様にして粗精製のアクチン(His−Actin)を得た。このアクチンを前記Ni−NTAビーズを充填したカラムにより精製を行った。前記カラムによる精製は、まず、10mMイミダゾールを含むNi用バッファー(下記参照)によりプレ平衡化を行ったNi−NTAアガロースビーズ5mLをカラムに詰めた後、同じバッファーを送液して平衡化を行った。その後、前記粗精製のアクチン溶液(濃縮液)をカラムの上に載せて4℃で60分間放置し、再度、前記バッファーをチャートが落ち着くまで流した(カラム洗浄)。つぎに、10〜250mMイミダゾール含有のNi用バッファーでグラジェントを行い、約1.5mLずつのフラクションで回収した。回収したフラクションをSDS−PAGEして、目的のタンパク質(アクチン)のみを含むフラクションについて、実施例1と同様にして、濃縮および透析を行い、精製アクチン(His−Actin)を得た。前記カラムの溶出チャートおよび各フラクションのSDS−PAGEの結果を、図3に示す。前記SDS−PAGEの結果、本実施例で得られた精製アクチンの純度は、90〜95%であった。
【0037】
Ni用バッファー
20mM Tris−HCl(pH8.0)
0.2mM CaCl2
0.2mM ADP
0.1mM DTT
【0038】
このようにして得られた精製アクチンについて、重合能を調べた。すなわち、まず、約10μMの精製アクチン溶液に、1/10量の10×バッファーF(下記参照)およびプロテアーゼインヒビター溶液(下記参照)を加え、37℃で30分インキュベートした。この反応液を、クッションバッファー(下記参照)の上に重層させ、超遠心(265000×g、1時間、24℃)を行い、上清(G−Actin)および沈殿物(F−Actin)をSDS−PAGEで解析した。また、対照として、市販の精製アクチン(Cytoskeleton社製)を用いて同様に重合能を調べた。これらの結果を、図4に示す。なお、図4の上に前記SDS−PAGEの写真を示し、図4の下に、前記SDS−PAGEのActinバンドを定量化したグラフを示す。
【0039】
バッファーF
5mM Tris−HCl(pH8.0)
50mM KCl
2mM MgCl2
1mM ATP
【0040】
プロテアーゼインヒビター溶液
0.2mM PMSF
10μM Leupeptin
1μM Pepstain
5mM DIFP
【0041】
クッションバッファー
5mM Tris−HCl(pH8.0)
0.2mM MgCl2
50mM KCl
10%(w/v) グリセリン
【0042】
図4に示すように、本実施例の精製アクチンは、市販の精製アクチンと同等の重合能を示した。
【産業上の利用可能性】
【0043】
本発明は、アクチンを高回収率で容易に製造できるアクチンの製造方法である。本発明によれば、高品質のアクチンないしアクチン変異体を低コストかつ大量に供給可能である。したがって、本発明は、アクチンに関する研究、技術開発、臨床応用、生物学、医学、薬学および農学等のアクチンに関わる全ての分野に好ましく利用可能である。
【図面の簡単な説明】
【0044】
【図1】図1は、本発明の一実施例におけるSDS−PAGEの写真である。
【図2】図2は、比較例のSDS−PAGEの写真である。
【図3】図3は、本発明のその他の実施例における溶出チャートおよびSDS−PAGEの写真である。
【図4】図4は、前記実施例におけるアクチンの重合能を示すSDS−PAGEおよびグラフである。
【技術分野】
【0001】
本発明は、アクチンの製造方法、それに用いるベクターおよび原核宿主細胞に関する。
【背景技術】
【0002】
アクチンは、筋肉を構成するタンパク質として、1942年に発見された。筋肉において、アクチンは多量化して繊維状となり、ATPをADPに変換するエネルギーにより、繊維状アクチンの間をミオシンが滑ることで筋肉が収縮する。この他に、アクチンは、一般の細胞内にもマトリックスタンパク質として存在し、生体内のタンパク質総量の5ないし10%を占める最も量の多いタンパク質である。アクチンは、一分子あたり、ATPおよびカルシウムを各一個有している。アクチンの形状は、亜鈴状をしており、ATPが失われると、二量体となる。単量体をGアクチンといい、重合してポリマーとなったアクチンをFアクチンという。真核生物に広く存在するアクチンの一次構造は、保守的で種別による大きな変化はない。哺乳類では、六種類のアイソアクチンが知られており、等電点の差から、αアクチン(骨格筋)、βアクチン(一般細胞)、γアクチン(平滑筋)等がある。
【0003】
このように、アクチンは、広く生物に分布するタンパク質であるため、その研究が各分野で進められている。しかしながら、研究材料としてのアクチンの入手が困難である。すなわち、ヒト等の真核生物のアクチンを遺伝子工学で製造する場合、通常、アクチン遺伝子を導入した組換え酵母が用いられるが、この手法では、培養や細胞の粉砕等に手間がかかり不便である(非特許文献1)。また、生物から直接アクチンを採取する方法もあるが、生体材料の確保や抽出精製作業の点から大量のアクチンを採取することは実質的に困難である。このような点から、研究材料として市販されているアクチンは、大変高価であり、アクチンを大量に用いて研究することが困難であった。さらに、アクチンの機能や生物進化的な意義を解明するには、アクチンの変異体を作製する必要がある。このため、大量培養が容易で発現タンパク質の抽出精製が酵母よりも容易な大腸菌を用いてアクチン遺伝子を発現させることが試みられている(非特許文献2)。しかしながら、大腸菌を用いたアクチンの生産では、アクチン重合による不溶化、不純物タンパク質生成、アクチンの分解等の原因により、その収率等に問題があった。したがって、大腸菌を用いてアクチンを高収率で生産することは不可能であるというのが、従来の技術常識であり、他の原核生物を用いても同様であった。
【0004】
【非特許文献1】Genetics 132:337−350(October,1992)
【非特許文献2】THE JOURNAL OF BIOLOGICAL CHEMISTRY Vol.265,No.29,Issue of October 15,pp.17980−17987,1990
【発明の開示】
【発明が解決しようとする課題】
【0005】
そこで、本発明は、アクチンないしアクチンの変異体を高収率で容易に製造可能なアクチンの製造方法を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明のアクチンの製造方法は、アクチン遺伝子を含むコールドショック発現ベクターにより形質転換された原核宿主細胞を準備する準備工程と、前記原核宿主細胞の正常生理的増殖温度よりも低い温度で前記原核収縮細胞を培養することにより前記コールドショック発現ベクター中のアクチン遺伝子を発現させてアクチンを産生させるアクチン産生工程とを含むことを特徴とする。
【発明の効果】
【0007】
このように、本発明の製造方法では、低温化でアクチン遺伝子を発現させるため、アクチンの重合による不溶化を防止でき、不純物タンパク質の生成およびアクチンの分解を抑制することが可能である。また、本発明の製造方法では、大量培養が容易であり、また生成したアクチンの抽出精製操作が容易な原核宿主細胞を使用している。したがって、本発明の製造方法によれば、高収率で容易にアクチンを製造することができる。
【発明を実施するための最良の形態】
【0008】
つぎに、本発明について例をあげて詳しく説明する。ただし、本発明は、下記の事項によって限定されない。
【0009】
本発明において、対象になるアクチンは特に制限されず、アクチン変異体も含む。また、製造対象になるアクチンは、αアクチン、βアクチン、γアクチンおよびこれらのアクチンの各変異体が好ましく、より好ましくは、βアクチンおよびその変異体である。また、アクチンの変異体を製造する場合のアクチン遺伝子は、アクチンの変異遺伝子である。本発明のベクターは、本発明の製造方法に使用するベクターであって、前記ベクターはコールドショック発現ベクターであり、前記ベクターが、アクチン遺伝子またはアクチンの変異遺伝子を発現可能な状態で含むベクターである。本発明のベクターとしては、例えば、後述のベクターがある。
【0010】
本発明の原核宿主細胞は、本発明のアクチンの製造方法に使用する原核宿主細胞であって、本発明のベクターにより形質転換されている原核宿主細胞である。本発明において、前記原核宿主細胞は、特に限定されず、例えば、大腸菌および枯草菌等があげられ、このなかでも大腸菌が好ましい。
【0011】
本発明において、前記原核宿主細胞が大腸菌であり、前記コールドショック発現ベクターが、大腸菌コールドショック遺伝子のプロモータおよび5´非翻訳領域(5´UTR)を含むベクターであることが好ましい。また、前記プロモータが、cspAプロモータであることが好ましい。また、前記ベクターは、さらに12塩基配列のATリッチの翻訳増強エレメントを含むことが好ましい。前記ATリッチとは、12塩基配列中の70%以上の塩基がATであることを意味する。そして、前記ベクターは、AAGAGGTのSD配列を有することが好ましい。アクチン遺伝子の塩基配列中には、AAGGという偽SD配列が含まれており、このため従来のベクターを用いて大腸菌でアクチン遺伝子を発現しようとすると、アクチン遺伝子の途中から翻訳が始まってしまい、これが不純物タンパク質生成の原因の一つであった。これに対し、前記ベクターが、AAGAGGTのSD配列を有すると、大腸菌中のrRNAサブユニットとの配列と親和性が高いため、アクチン遺伝子の偽SD配列からの翻訳が防止できる。
【0012】
上述のコールドショック発現ベクターとしては、例えば、特表2005−518804号公報に記載のベクターがあり、前記ベクターの塩基配列は、NCBI Gene Bankに登録されており、そのAccession No.は、AB186388,AB186389、AB186390およびAB186391である。また、前記公報記載のベクターの市販品としては、タカラバイオ社製の商品名pCold I〜IV ベクターがある(以下、「pColdベクター」ともいう)。pColdベクターの外来遺伝子挿入部位には、cosAプロモータ、lacオペレータ、cspA5´UTR、MCS(multiple cloning site)およびcspA3´UTRが、この順序で作動的に連結しており、前記MCS部位に、アクチン遺伝子やアクチンの変異遺伝子を挿入できる。また、前記外来遺伝子挿入部位には、必要に応じて、TEE配列、His・Tag配列およびFactor Xa切断配列が挿入される。その他、pColdベクターには、大腸菌の複製起点(ColE1 ori)、lac I,Ampr,M13 IGの各遺伝子が挿入されている。
【0013】
本発明の前記アクチン産生工程において、本プラスミドは、正常生理的増殖温度よりも13℃低い温度で培養することが好ましく、より好ましくは、正常生理的増殖温度よりも20℃低い温度で培養することである。例えば、大腸菌の正常生理的増殖温度は37℃であるので、タンパク発現工程の培養温度は、24℃以下が好ましく、より好ましくは17℃以下である。
【0014】
本発明の製造方法において、さらに、前記原核宿主細胞を、その正常生理的増殖温度で培養する一般培養工程を有し、前記一般培養工程で前記原核宿主細胞を培養した後、前記アクチン産生工程を実施することが好ましい。すなわち、前記一般培養工程で大腸菌を十分量培養した後、アクチン産生工程を実施すれば、アクチンをより大量に製造することができる。
【0015】
本発明において、さらに、前記原核宿主細胞を溶菌して産生されたアクチンを回収する回収工程を有することが好ましい。そして、前記回収工程を、ADPおよびセリンプロテアーゼインヒビターの少なくとも一方の存在下で実施することが好ましい。ADPの存在下で前記回収工程を実施すれば、生成したアクチンの重合をより効果的に抑制でき、また前記セリンプロテアーゼインヒビターの存在下で前記回収工程を実施すれば、生成したアクチンのプロテアーゼによる分解をより効果的に抑制できるからである。前記セリンプロテアーゼインヒビターは、diisopropyl fluorophosphate(DIFP)が好ましい。なお、ADPおよび前記インヒビターの少なくとも一方の存在下という条件は、前記回収工程の全工程に適用してもよいし、一部の工程に適用してもよいが、好ましくは全工程に適用することである。
【0016】
本発明において、さらに、前記回収したアクチンを精製する精製工程を有することが好ましい。例えば、His・Tagを有する前記pColdベクターを用いれば、後述の実施例2に記載するように、Niカラムのクロマトグラフィーを実施して精製することができ、これにより、高純度のアクチンを得ることが可能になる。
【0017】
本発明の製造方法は、例えば、pColdベクターを用い、つぎのようにして実施できる。
【0018】
まず、アクチン遺伝子を準備する。アクチン遺伝子は既に塩基配列が公知であり、種々生物組織から特異的プライマーを用いてクローニングして自家調製できる。
【0019】
つぎに、pColdベクターのBamHIとEcoRIサイトの間に前記アクチン遺伝子をサブクローニングして発現用プラスミドを作製する。この発現用プラスミドで宿主大腸菌を形質転換し、アンピシリンを含む選択培地プレートを用いて形質転換体を選択する。つぎに、50〜100μg/mLアンピシリンを含むLB培地に形質転換体を植菌し、37℃で振とう培養する。培養液の濁度(OD600nm)が0.4〜0.5になるまで菌が増殖した時点で培養液を4℃に冷却する。そして、最終濃度0.1〜1.0mMとなるようにIPTGを添加して15℃で静置して培養する。培養終了後、菌を集めて溶菌し、可溶物の中からアクチンを回収する。前記溶菌からアクチンの回収に至るまでの工程は、ADPおよびDIFPの存在下で行う。なお、前記製造工程の各培養の時間は、種々の条件により適宜決定する。
【0020】
つぎに、本発明の実施例について比較例と併せて説明する。ただし、本発明は、下記の実施例および比較例によってなんら限定されない。
【実施例1】
【0021】
(形質転換大腸菌の作製)
プラスミド精製(アルカリSDS法)によって得たpGEX−6P−ActinプラスミドDNAをBamHI(東洋紡社製)およびEcoRI(東洋紡社製)により制限酵素処理を行ってActin cDNAを切り出した。ベクターとしては、商品名pCold I DNA(Code3360,タカラバイオ社製)を用いた。前記pCold I DNAベクターを、BamHI(東洋紡社製)およびEcoRI(東洋紡社製)により制限酵素処理を行い、ついで、アルカリフォスフォターゼ処理を行った。商品名Ligation kis ver.2.1(タカラバイオ社製)を用い、前記ActinインサートDNA(0.5pmol)および前記ベクター(0.05pmol)を混合して5μLの溶液を調製し、これに前記キットのSolution I 5μLを加え、15℃で4時間インキュベートしてLigationを行った後、前記キットのSolution III 1μLを加えて、下記のTSS法で、大腸菌XL−1株への形質移入を行った。大腸菌XL−1株を増殖させてプラスミドを調製した後、再びTSS法で、大腸菌BL−21株に形質導入した。前記大腸菌BL−21株においてミニスケール発現を行い、アクチンの発現を確認するとともに、ジデオキシ法でDNA配列の確認を行った。
【0022】
TSS法(大腸菌の形質転換法)
大腸菌BL−21株を2mL LB培地(アンピシリンなし)で、37℃で一晩震盪培養する。培養液20μLを2mL LB培地へ移し、さらに3時間震盪培養する。その培養液1.5mLをエッペンチューブへ移し、小型遠心機で15000rpm×1分遠心し、デカンテーションにより上澄みを除去する。沈澱した菌体を手でほぐし、氷冷する。菌体にTSS溶液200μL、DMSO10μL,およびDNA溶液10μLを順次加え、ピペッティングにより混合する。30分間氷冷した後、クリーンベンチの中でLB−Amp50寒天プレートに菌体をスプレッダーで捲く。プレートを気相インキュベータで37℃10時間インキュベートする。プラスミドがトランスフォームされた菌はコロニーを形成するので、形成したコロニーを楊子でつついて採取する。
【0023】
(アクチン遺伝子の発現)
前記形質転換大腸菌を、LB培地(アンピシリン50μg/mL入り)を用い、37℃で4時間、試験管(4mL×5)で振とう培養し、ついで、2リットル培地中で37℃で4時間、静置培養した。つぎに、4℃に冷却後、前記培地にIPTG(最終濃度50μM)を添加して15℃で20時間培養することによりIPTG誘導してアクチン遺伝子を発現させた。
【0024】
(溶菌処理)
アクチン遺伝子の発現後、遠心(6000rpm×10分、4℃)して前記大腸菌を集菌し、冷凍機で1時間以上凍結させた後、融解し、下記の組成の溶菌バッファーに前記大腸菌を分散した。なお、下記の組成表に示すように、インヒビター類は、分散させた後に添加した。そして、前記溶菌バッファーに分散した前記大腸菌を超音波処理(60W×1分、8回)により溶菌した。
【0025】
溶菌バッファー組成 (100mLに対して)
1M Tris−HCl(pH8.0) 1mL(10mM)
0.1M EDTA(pH8.0) 1mL(1mM)
0.4M PMSF 25μL(0.1mM)(分散後添加)
1M DTT 50μL(0.5mM)(分散後添加)
1M ADP 100μL(1mM)(分散後添加)
DIFP 6.0μL(分散後添加)
【0026】
(アクチンの回収と粗精製)
前記超音波処理した液を遠心(18000rpm×20分、4℃)し、その上清液を採取した。前記上清液に対し、Ni−NTAビーズ(商品名Ni−NTAアガロースビーズ、キアゲン社製)を用いて、粗精製を行った。前記Ni−NTAビーズは、下記組成のPBS(1mMのADP添加)を加えて濃度50%のスラリーにしたものである。前記上清液に、前記Ni−NTAビーズのスラリーを6ml添加し、4℃で一晩ディスクロータでゆっくり回転させた。その後、静置して沈澱させ、沈殿を回収した。洗浄は,下記のPBS,界面活性剤、バッファーP(各40mL)を順次用いて、次のように行った。すなわち、沈澱に洗浄液を加えて10分間4℃で回転させた後、遠心(2200rpm×10分、4℃)して沈澱を取る操作を繰り返した。次に沈澱からの溶出にはバッファーP´を10mL加えて4℃で30分間回転後、遠心(同上)して上清をとるという操作を3回繰り返した。得られた上清について、下記バッファーG(1リットル)に対する透析(2時間、4℃)を行った。2時間後、外液を交換し、さらに、2時間、前述と同様の透析を行った。その後、遠心ろ過フィルター(商品名Amicon Ultra、分画30000、ミリポア社製)を用いてタンパク質溶液を濃縮し、電気泳動(SDS−PAGE)およびタンパク質定量を行った。SDS−PAGEについては、IPTG誘導前、IPTG誘導後、溶菌後の上清、溶菌後の沈殿、ビーズ吸着後上清、1回目洗浄液(PBS)、2回目洗浄液(Triton溶液)、3回目洗浄液(バッファーP)、溶出1回目の溶出液についても実施した。なお、粗精製で得られたアクチンは、HisのTagがついたアクチン(His−Actin)である。SDS−PAGEの結果を図1の写真に示す。前記タンパク質の定量は、プロテインアッセイ染色液(Coomasie Brilliant Blueによる発色液、Bio−Rad社製)を用い、標準液として牛血清アルブミンを用いて実施した。
【0027】
PBS組成
50mM NaCl
50mM KCl
8mM Na2HPO4
1.5mM KH2PO4
1mM ADP
5mM イミダゾール
【0028】
界面活性剤溶液(Triton溶液)
商品名Triton 0.5%(w/v)
10mM イミダゾール
1mM ADP
【0029】
バッファーP
50mM Tris−HCl(pH8.0)
1mM EDTA(pH8.0)
10mM イミダゾール
1mM ADP
【0030】
バッファーP´
50mM Tris−HCl(pH8.0)
1mM EDTA(pH8.0)
250mM イミダゾール
1mM DTT
1mM ADP
【0031】
バッファーG
5mM Tris−HCl(pH8.0)
0.2mM CaCl2
0.2mM ATP
0.5mM DTT
【0032】
(比較例1)
アクチン遺伝子挿入ベクターとしてpGEX−6P−actinを準備し、これを用いて大腸菌を形質転換した。この形質転換大腸菌を、実施例1と同じ培地を用い、37℃で3時間、振とう培養し、ついで、前記培地にIPTG(最終濃度50μM)を添加した。そして20℃で20時間培養することによりIPTG誘導してアクチン遺伝子を発現させた。前記大腸菌について、以下に示す条件および操作で、アクチンの回収と粗精製を行った。
【0033】
前記超音波処理した液を遠心(18000rpm×20分、4℃)し、その上清液を採取した。前記上清液に対し、G−Sepharoseビーズ(商品名Glutathione Sepharose、GE Healthcare社製)を用いて粗製製を行った。前記ビーズは、前記組成のPBSを加えて濃度50%のスラリーにしたものである。前記上清液に、前記ビーズのスラリーを6ml添加し、4℃で一晩ディスクロータでゆっくり回転させた。その後、静置して沈澱させ、沈殿を回収した。洗浄は,前記のPBS,界面活性剤、バッファーP(各40mL)を順次用いて、次のように行った。すなわち、沈澱に洗浄液を加えて10分間4℃で回転させた後、遠心(2200rpm×10分、4℃)して沈澱を取る操作を繰り返した。次に沈澱からの溶出にはバッファーP´を10mL加えて4℃で30分間回転後、遠心(同上)して上清をとるという操作を3回繰り返した。得られた上清について、GST融合タンパク質切断用プロテアーゼ(PreScission Proteas)10μLおよび1mM DTT240μLを添加した前記バッファーPを加えて、4℃で1時間ディスクロータでゆっくり回転させる溶出(抽出)処理を6回行った。前記抽出液を、下記バッファー(1リットル)に対する透析(2時間、4℃)を行った。2時間後、外液を交換し、さらに、2時間、前述と同様の透析を行った。その後、遠心ろ過フィルター(商品名Amicon Ultra、分画30000、ミリポア社製)を用いてタンパク質溶液を濃縮し、電気泳動(SDS−PAGE)およびタンパク質定量を行った。SDS−PAGEについては、ビーズ吸着後1回目から6回目の抽出液と,それらのうち純度のよかった1回目と2回目を合わせて濃縮したもの(精製サンプル)について示した。なお、この粗精製で得られたアクチンは、Tagのないアクチンである。SDS−PAGEの結果を図2の写真に示す。前記タンパク質の定量は、前記実施例1と同様にして実施した。
【0034】
バッファー組成
10mM KPB(pH7.0)
0.2mM CaCl2
0.2mM ATP
【0035】
前記実施例1において、粗精製におけるアクチンの純度は、70%であり、回収率は、アクチン量2.7mg/L(培地)であり、高回収率でアクチンを得ることができた。これに対し、比較例1では、純度は70%であったが、回収率がアクチン量0.5mg/L(培地)であり、回収率が悪かった。なお、比較例1では、Tagを外す必要があったので、これ以上精製することができないため、純度をさらに上げることは困難であった。これに対し、本実施例では、以下の実施例2に示すように、さらに純度を上げることが可能であった。
【実施例2】
【0036】
実施例1と同様にして粗精製のアクチン(His−Actin)を得た。このアクチンを前記Ni−NTAビーズを充填したカラムにより精製を行った。前記カラムによる精製は、まず、10mMイミダゾールを含むNi用バッファー(下記参照)によりプレ平衡化を行ったNi−NTAアガロースビーズ5mLをカラムに詰めた後、同じバッファーを送液して平衡化を行った。その後、前記粗精製のアクチン溶液(濃縮液)をカラムの上に載せて4℃で60分間放置し、再度、前記バッファーをチャートが落ち着くまで流した(カラム洗浄)。つぎに、10〜250mMイミダゾール含有のNi用バッファーでグラジェントを行い、約1.5mLずつのフラクションで回収した。回収したフラクションをSDS−PAGEして、目的のタンパク質(アクチン)のみを含むフラクションについて、実施例1と同様にして、濃縮および透析を行い、精製アクチン(His−Actin)を得た。前記カラムの溶出チャートおよび各フラクションのSDS−PAGEの結果を、図3に示す。前記SDS−PAGEの結果、本実施例で得られた精製アクチンの純度は、90〜95%であった。
【0037】
Ni用バッファー
20mM Tris−HCl(pH8.0)
0.2mM CaCl2
0.2mM ADP
0.1mM DTT
【0038】
このようにして得られた精製アクチンについて、重合能を調べた。すなわち、まず、約10μMの精製アクチン溶液に、1/10量の10×バッファーF(下記参照)およびプロテアーゼインヒビター溶液(下記参照)を加え、37℃で30分インキュベートした。この反応液を、クッションバッファー(下記参照)の上に重層させ、超遠心(265000×g、1時間、24℃)を行い、上清(G−Actin)および沈殿物(F−Actin)をSDS−PAGEで解析した。また、対照として、市販の精製アクチン(Cytoskeleton社製)を用いて同様に重合能を調べた。これらの結果を、図4に示す。なお、図4の上に前記SDS−PAGEの写真を示し、図4の下に、前記SDS−PAGEのActinバンドを定量化したグラフを示す。
【0039】
バッファーF
5mM Tris−HCl(pH8.0)
50mM KCl
2mM MgCl2
1mM ATP
【0040】
プロテアーゼインヒビター溶液
0.2mM PMSF
10μM Leupeptin
1μM Pepstain
5mM DIFP
【0041】
クッションバッファー
5mM Tris−HCl(pH8.0)
0.2mM MgCl2
50mM KCl
10%(w/v) グリセリン
【0042】
図4に示すように、本実施例の精製アクチンは、市販の精製アクチンと同等の重合能を示した。
【産業上の利用可能性】
【0043】
本発明は、アクチンを高回収率で容易に製造できるアクチンの製造方法である。本発明によれば、高品質のアクチンないしアクチン変異体を低コストかつ大量に供給可能である。したがって、本発明は、アクチンに関する研究、技術開発、臨床応用、生物学、医学、薬学および農学等のアクチンに関わる全ての分野に好ましく利用可能である。
【図面の簡単な説明】
【0044】
【図1】図1は、本発明の一実施例におけるSDS−PAGEの写真である。
【図2】図2は、比較例のSDS−PAGEの写真である。
【図3】図3は、本発明のその他の実施例における溶出チャートおよびSDS−PAGEの写真である。
【図4】図4は、前記実施例におけるアクチンの重合能を示すSDS−PAGEおよびグラフである。
【特許請求の範囲】
【請求項1】
アクチンの製造方法であって、アクチン遺伝子を含むコールドショック発現ベクターにより形質転換された原核宿主細胞を準備する準備工程と、前記原核宿主細胞の正常生理的増殖温度よりも低い温度で前記原核宿主細胞を培養することにより前記コールドショック発現ベクター中のアクチン遺伝子を発現させてアクチンを産生させるアクチン産生工程とを含むことを特徴とするアクチンの製造方法。
【請求項2】
前記原核宿主細胞が大腸菌であり、前記コールドショック発現ベクターが、大腸菌コールドショック遺伝子のプロモータおよび5´非翻訳領域(5´UTR)を含むベクターである請求項1記載のアクチンの製造方法。
【請求項3】
前記プロモータが、cspAプロモータである請求項2記載のアクチンの製造方法。
【請求項4】
前記ベクターが、さらに12塩基配列のATリッチの翻訳増強エレメントを含む請求項2または3に記載のアクチンの製造方法。
【請求項5】
前記ベクターが、AAGAGGTのSD配列を有する請求項2から4のいずれか一項に記載のアクチンの製造方法。
【請求項6】
前記産生工程において、前記正常生理的増殖温度よりも13℃低い温度で培養する請求項1から5のいずれか一項に記載のアクチンの製造方法。
【請求項7】
さらに、前記原核宿主細胞を、その正常生理的増殖温度で培養する一般培養工程を有し、前記一般培養工程で前記原核宿主細胞を培養した後、前記アクチン産生工程を実施する請求項1から6のいずれか一項に記載のアクチンの製造方法。
【請求項8】
さらに、前記原核宿主細胞を溶菌して産生されたアクチンを回収する回収工程を有する請求項1から7のいずれか一項に記載のアクチンの製造方法。
【請求項9】
前記回収工程を、ADPおよびセリンプロテアーゼインヒビターの少なくとも一方の存在下で実施する請求項8記載のアクチンの製造方法。
【請求項10】
前記セリンプロテアーゼインヒビターが、diisopropyl fluorophosphate(DIFP)である請求項9記載のアクチンの製造方法。
【請求項11】
さらに、回収したアクチンを精製する精製工程を有する請求項1から10のいずれか一項に記載のアクチンの製造方法。
【請求項12】
前記アクチンが、β−アクチンである請求項1から11のいずれか一項に記載のアクチンの製造方法。
【請求項13】
前記アクチンが、アクチン変異体であり、前記アクチン遺伝子が、前記アクチンの変異遺伝子である請求項1から11のいずれか一項に記載のアクチンの製造方法。
【請求項14】
請求項1記載のアクチンの製造方法に使用するベクターであって、前記ベクターがコールドショック発現ベクターであり、前記ベクターが、アクチン遺伝子またはアクチンの変異遺伝子を発現可能な状態で含むベクター。
【請求項15】
請求項1記載のアクチンの製造方法に使用する原核宿主細胞であって、請求項14記載のベクターにより形質転換されている原核宿主細胞。
【請求項1】
アクチンの製造方法であって、アクチン遺伝子を含むコールドショック発現ベクターにより形質転換された原核宿主細胞を準備する準備工程と、前記原核宿主細胞の正常生理的増殖温度よりも低い温度で前記原核宿主細胞を培養することにより前記コールドショック発現ベクター中のアクチン遺伝子を発現させてアクチンを産生させるアクチン産生工程とを含むことを特徴とするアクチンの製造方法。
【請求項2】
前記原核宿主細胞が大腸菌であり、前記コールドショック発現ベクターが、大腸菌コールドショック遺伝子のプロモータおよび5´非翻訳領域(5´UTR)を含むベクターである請求項1記載のアクチンの製造方法。
【請求項3】
前記プロモータが、cspAプロモータである請求項2記載のアクチンの製造方法。
【請求項4】
前記ベクターが、さらに12塩基配列のATリッチの翻訳増強エレメントを含む請求項2または3に記載のアクチンの製造方法。
【請求項5】
前記ベクターが、AAGAGGTのSD配列を有する請求項2から4のいずれか一項に記載のアクチンの製造方法。
【請求項6】
前記産生工程において、前記正常生理的増殖温度よりも13℃低い温度で培養する請求項1から5のいずれか一項に記載のアクチンの製造方法。
【請求項7】
さらに、前記原核宿主細胞を、その正常生理的増殖温度で培養する一般培養工程を有し、前記一般培養工程で前記原核宿主細胞を培養した後、前記アクチン産生工程を実施する請求項1から6のいずれか一項に記載のアクチンの製造方法。
【請求項8】
さらに、前記原核宿主細胞を溶菌して産生されたアクチンを回収する回収工程を有する請求項1から7のいずれか一項に記載のアクチンの製造方法。
【請求項9】
前記回収工程を、ADPおよびセリンプロテアーゼインヒビターの少なくとも一方の存在下で実施する請求項8記載のアクチンの製造方法。
【請求項10】
前記セリンプロテアーゼインヒビターが、diisopropyl fluorophosphate(DIFP)である請求項9記載のアクチンの製造方法。
【請求項11】
さらに、回収したアクチンを精製する精製工程を有する請求項1から10のいずれか一項に記載のアクチンの製造方法。
【請求項12】
前記アクチンが、β−アクチンである請求項1から11のいずれか一項に記載のアクチンの製造方法。
【請求項13】
前記アクチンが、アクチン変異体であり、前記アクチン遺伝子が、前記アクチンの変異遺伝子である請求項1から11のいずれか一項に記載のアクチンの製造方法。
【請求項14】
請求項1記載のアクチンの製造方法に使用するベクターであって、前記ベクターがコールドショック発現ベクターであり、前記ベクターが、アクチン遺伝子またはアクチンの変異遺伝子を発現可能な状態で含むベクター。
【請求項15】
請求項1記載のアクチンの製造方法に使用する原核宿主細胞であって、請求項14記載のベクターにより形質転換されている原核宿主細胞。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2007−275010(P2007−275010A)
【公開日】平成19年10月25日(2007.10.25)
【国際特許分類】
【出願番号】特願2006−108276(P2006−108276)
【出願日】平成18年4月11日(2006.4.11)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 発表した刊行物:「平成17年度 応用化学専攻 修士論文発表会 要旨」 発行者名:国立大学法人愛媛大学 頒布年月日:平成18年2月24日 発表した刊行物:「NADPH oxidase成分p47▲phox▼へのActinの結合とその役割」 発行者名:国立大学法人愛媛大学 頒布年月日:平成18年2月27日 発表した研究集会:平成17年度 応用化学専攻 修士論文発表会 主催者名:国立大学法人愛媛大学大学院理工学研究科 共催者名:国立大学法人愛媛大学 開催日:平成18年3月1日〜平成18年3月2日 発表日:平成18年3月1日
【出願人】(504147254)国立大学法人愛媛大学 (214)
【Fターム(参考)】
【公開日】平成19年10月25日(2007.10.25)
【国際特許分類】
【出願日】平成18年4月11日(2006.4.11)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 発表した刊行物:「平成17年度 応用化学専攻 修士論文発表会 要旨」 発行者名:国立大学法人愛媛大学 頒布年月日:平成18年2月24日 発表した刊行物:「NADPH oxidase成分p47▲phox▼へのActinの結合とその役割」 発行者名:国立大学法人愛媛大学 頒布年月日:平成18年2月27日 発表した研究集会:平成17年度 応用化学専攻 修士論文発表会 主催者名:国立大学法人愛媛大学大学院理工学研究科 共催者名:国立大学法人愛媛大学 開催日:平成18年3月1日〜平成18年3月2日 発表日:平成18年3月1日
【出願人】(504147254)国立大学法人愛媛大学 (214)
【Fターム(参考)】
[ Back to top ]

