アクリルポリマー接着剤を含有する熱成形組成物の製造方法、医薬製剤および該製剤の製造方法
有効医薬品成分、アクリル系腸溶ポリマーおよび可塑剤を含有する、熱成形または熱溶融押し出しされた医薬組成物を開示する。該医薬組成物ならびに種々の医薬製剤を作製する方法も開示する。好適な態様では、熱成形可能な混合物は粉末形態であり、有効成分、可塑剤、アクリルポリマー、および製剤に組み込んだ後の押し出し物の性能を高める任意の賦形剤を含む。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願の相互参照
本出願は、米国仮出願第60/468,625号(2003年5月6日出願)に基づく優先権の恩恵を主張するものであり、その開示内容は参照により本明細書中に含めるものとする。
【0002】
1. 発明の分野
本発明は、医薬品業界において有用な、押し出し可能な組成物に関する。また本発明は、押し出し賦形剤および医薬品として有効な成分を含有する種々の押し出し物を調製する方法にも関する。
【背景技術】
【0003】
2. 従来技術の説明
熱溶融押し出し(HME)は、プラスチック業界でチューブ、パイプ、ワイヤーおよびフィルムを製造する際に広く用いられている加工技術である。医薬系では、この方法を利用して粒剤、徐放性錠剤および経皮的薬物送達系を調製している。今日では、熱溶融押し出し技術への関心が急速に高まっており、該技術に関して100を超える論文が発表されている。医薬系に対して発行される熱溶融押し出し特許の数は、1980年代初頭から着実に増加し続けている。
【0004】
熱溶融押し出しは、従来の医薬品加工技術よりも優れた点を数多く提供する。溶剤および水を必要としないので、加工段階の数が減り、さらに時間のかかる乾燥段階が排除される。有効成分が圧縮可能である必要はないため、全ての手順は連続的かつ効率的である。回転スクリューによって激しく混合および攪拌することで、溶融ポリマー中の懸濁粒子が脱凝集して、より均一に分散する。また、熱溶融押し出しは、分子を分散させることにより薬物原料のバイオアベイラビリティーを改善する際にも利用されている。全ての構成要素は、短時間の加熱加工中はその加工温度において熱的に安定でなくてはならない。従って、熱溶融押し出しでは、多くの薬物の熱的感度との関係上、比較的低い温度で加工しうる医薬品等級のポリマーが必要とされる。
【0005】
多くの熱溶融押し出し加工では、通常、高い加工温度が必要とされる。しかし、医薬品製剤分野の技術者からは、これらの高温は治療薬および/または高分子担体もしくは担体マトリクスの分解を引き起こすものと認識されている。
【0006】
医薬品製剤の調製時に押し出し加工を利用しようとする初期の試みの1つが、米国特許第5,073,379号に記載されている。この特許には、活性化合物を含有するポリマー溶融物を押し出してから、ベルトとローラーの間または2つのベルトの間で依然として可塑性を有する押し出し物を形成するという連続工程について記載されている。
【0007】
米国特許第6,051,253号には、薬理学上許容しうるポリマー接着剤および医薬品有効成分を、従来の医薬品添加物と共に、または該添加物抜きで、溶剤の非存在下で混合しかつ溶融させて塑性混合物を得ることにより製造される固体剤形が開示されている。この場合の押し出し物は2段階に分けて成形される。該押し出し物を砕いて成形品とし、該成形品に第2段階で塑性状態にて丸みをつける。
【0008】
この点に関する取り組みの最近の1例は、PCT公報国際公開第02/35991号に記載されており、該公報には、熱溶融押し出し加工を利用して形成した球状ペレットを含有する活性物質が開示されている。具体的に言うと、有効成分、可塑剤、ポリマーおよび任意の賦形剤を押し出して紐状押し出し物とした後、これを切断してペレットとしてから球状化加工を施すことにより、熱成形可能な組成物を取得する。好適なポリマーとして、有効物質の分解温度を下回るガラス転移温度(Tg)を有することを基準に選択された、種々のEUDRAGIT(登録商標)タイプの製品などが挙げられている。
【0009】
McGinityらの米国特許第6,488,963号には、治療化合物とPEGなどの高分子量ポリ(エチレンオキシド)との熱成形可能な混合物を本質的に非フィルム性の調製物中に含有する医薬品製剤、および該医薬品製剤を調製する方法が開示されている。しかし、この‘963号特許には、その一部として腸溶性のポリマーを含有する熱成形可能な医薬品製剤を調製することは開示されていない。
【0010】
同一出願人による米国特許第6,420,473号(この特許文献の開示内容は参照により本明細書中に含めるものとする)には、医薬品をコーティングするための水系腸溶コーティング懸濁物を作製する際に使用されるアクリル樹脂をベースとした、完全処方済みで、無毒であり、食用に適し、腸溶性であり、フィルムコーティング用の、乾燥粉末組成物が記載されている。該コーティングは、胃の胃液には溶けずに腸で溶ける。Colorcon(West Point、PA)からACRYL EZE(登録商標)という商標の下で販売されているこの粉末組成物は、水系フィルムコーティング系に含めることを目的としているので、該組成物には前記アクリル樹脂と反応しうるアルカリ化剤および剥離剤(detackifier)も含まれている。これらのフィルムコーティング系を熱溶融押し出しまたは他の熱成形加工に使用しうることは、何ら開示も示唆もされていない。
【発明の開示】
【発明が解決しようとする課題】
【0011】
上記背景にもかかわらず、当分野では依然として、さらなる制御放出性医薬品製剤を開発することが必要とされている。本発明は、この必要性に取り組むものである。
【課題を解決するための手段】
【0012】
発明の概要
本発明のある態様では、医薬品製剤に使用するのに適した熱成形可能な組成物が提供される。この熱成形可能または押し出し可能な組成物は、好ましくは粉末ベースであり、(i)熱成形可能または押し出し可能なアクリルポリマー接着剤(binder)と(ii)有効量のアクリルポリマー可塑剤を含む。該アクリルポリマー接着剤は、
(a) 20〜85重量パーセントの、少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分、
(b) 80〜15重量パーセントの、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、ならびに
(c) 0〜30重量パーセントの、(a)および(b)と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分
を有するアクリル樹脂を含む。前記組成物には熱溶融押し出し加工または本明細書中に記載の他の熱成形加工をすぐに施すことができるが、これらの加工は該組成物を医薬品として有効な組成物および1つ以上の任意の医薬品賦形剤と混合した後とすることが好ましい。
【0013】
本発明のさらなる態様では、粉末ベースの熱成形または押し出し可能な組成物を作製する方法、熱成形組成物を作製する方法、押し出しまたは熱成形組成物を含有する医薬製剤(pharmaceutical dosage form)を作製する方法、ならびにその結果得られた医薬製剤、すなわち、錠剤、カプセル剤などが提供される。
【発明の効果】
【0014】
本発明の結果として、幾つかの利点が提供される。まず第1に、驚いたことに、錠剤などの腸溶コーティングにのみ有用であると考えられていたポリマーコーティング組成物を、本発明ではそれらの徐放特性を損なうことなく熱溶融押し出し加工に使用しうることが見出された。その上、予想外にも、腸溶ポリマーコーティングと可塑剤からなる本発明の混合物を含有する押し出し組成物が、当業者にゼロ次またはほぼゼロ次(near zero order)のin vitro放出プロフィールを提供しうることも見出された。
【0015】
さらに、熱成形可能な粉末が予め可塑化したアクリルポリマーおよび剥離剤(detackifier)を含むような本発明の幾つかの好適な実施形態では、驚いたことに、効率的なスループットを得るために追加量の可塑剤を加えてこれを急速に吸収させうることが見出された。その上、実施形態を問わず、本発明の組成物により、高度の含量均一性を示すだけでなく押し出し機に1回通すだけで作製しうる押し出し製品が提供されることが見出された。
【発明を実施するための最良の形態】
【0016】
発明の詳細な説明
A. 熱溶融押し出し加工
本明細書中で使用する場合、「熱成形可能な」という用語は、熱成形しうるかまたは熱加工時に溶融させるかもしくは流動化することによって加工しうる、すなわち、高温および/または高圧の組み合わせの下で押し出すことのできる化合物または製剤を指す。熱成形可能なポリマーとは、標準的な周囲温度および圧力では十分に硬いが、高熱または高圧下では、単独で、または好ましくは本明細書中に記載した実例のように後述のタイプの可塑剤と共に、変形しうるかあるいは半流動状態をとりうるポリマーである。
【0017】
前記の本発明の加工は熱成形または熱溶融押し出し加工と呼ばれるものであるが、射出成形、溶融メッキ、メルトキャスティング、溶融造粒および圧縮成形といった当業者に公知の他の等価な加工を利用することもできる。これらの方法のいずれかを利用することにより、所望の投与様式、例えば、錠剤、丸剤、トローチ剤、坐剤などに応じて随時製剤を成形することができる。
【0018】
本発明の幾つかの実施形態で利用する熱溶融押し出し加工は、高温で実施する。すなわち、押し出し機の加熱ゾーンの温度が室温(約20℃)を上回る。押し出し加工時には、加工中の治療化合物/医薬品有効成分の崩壊または分解を最小限に抑えるような動作温度範囲を選択することが重要である。無論、かかる温度は有効成分に応じて変更されるものであり、このことは当業者には自明であろう。具体的な温度範囲を示す必要はないが、本発明の殆どの態様では、前記動作温度範囲は、押し出し機の加熱ゾーンの設定によって測定した場合、通常、約60℃〜約160℃の範囲内であると考えられる。
【0019】
本発明の幾つかの実施形態では、前記熱溶融押し出しを、アクリルポリマー接着剤、可塑剤、医薬品として有効な成分がある場合には該成分、および全ての任意の存在する賦形剤を含むスラリー、固体、懸濁物、液体、粉末または他のそのような供給材料を用いて実施することができる。殆どの態様では、本発明の加工時に乾燥供給材料を用いることが好ましい。
【0020】
前記熱溶融押し出し加工は、通常は以下のように記述される:
所望の量の腸溶アクリルポリマーを、押し出し機に導入する前に、可塑剤、医薬品として有効な組成物または有効医薬品成分(以後、APIと記す)および他の任意に含まれる賦形剤と混合する。幾つかの実施形態では、治療化合物が予想外にも非従来型の可塑剤として機能するため、本発明の組成物中に別の(追加の)可塑剤を使用する必要がない。グアイフェネシンはそのようなAPIの1つであるが、アクリルポリマーの溶解パラメーターに近いパラメーターを有するかまたは該ポリマーのTgもしくは軟化点を下げる能力を有する他のAPIが意図される。しかし、多くの代替態様では、APIを他の成分と組み合わせることにより、通常は乾燥粉末である混合物を形成する。しかし、可塑剤がクエン酸トリエチル(TEC)などの液体である場合には、これを押し出し前に前記の乾燥成分構成要素に幾何級数的に加えることが好ましいということに注意すべきである。その後、この混合物を押し出し機のホッパーに入れ、アクリル系腸溶ポリマーおよび可塑剤が溶融または軟化する温度で該押し出し機の加熱部(ゾーン)を通すことにより、APIを分散させるマトリクスを形成する。その後、溶融または軟化した混合物はダイまたは他のそのようなエレメントを介して排出され、その時点でこの変形混合物(ここからは押し出し物と呼ぶ)は硬化し始める。該押し出し物はダイから排出された時点ではまだ温かいか熱いので、容易に造形し、成形し、細断し、粉砕し、成形し、球状化してビーズとし、切断してストランドとし、錠剤化するかまたは別の方法で加工することによって所望の物理形態、すなわち医薬品剤形(医薬製剤)とすることができる。
【0021】
当分野で認められている押し出し機であれば、いずれも本発明を実践するために利用することができる。かかる装置の適切かつ非限定的な例としては、市販されており、かつ乾燥供給材料を処理する設備が備わっており、固体搬送ゾーン、1つまたは複数の加熱ゾーン、および押し出しダイを有する装置が挙げられる。かかる装置の1つは、Randcastle(Cedar Grove、NJ)から入手できるMicrotruder(登録商標)RCP-0750 単軸押し出し機である。本発明を実施する際に有用な別の装置は、C.W. Brabender Instruments社(New Jersey)製の二段単軸押し出し機である。また、当業者の要求に応じて、二軸または多軸押し出し機を使用することもできる。複数の独立した温度可変型加熱ゾーンが備わっているということは、押し出し機としては特に都合が良い。
【0022】
多くの条件を押し出し加工時に変更することにより、特に都合の良い製剤を得ることができる。かかる条件としては、例として、製剤の組成、供給速度、動作温度、押し出し機スクリューのRPM、滞留時間、ダイの形状、加熱ゾーンの長さならびに押し出し機のトルクおよび/または圧力が挙げられる。かかる条件を最適化するための方法は、当業者に公知である。
【0023】
B. アクリルポリマー
本発明の好適な態様では、押し出し可能なアクリルポリマー接着剤部分は、
(a) 20〜85重量パーセントの、少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分、
(b) 80〜15重量パーセントの、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、ならびに
(c) 0〜30重量パーセントの、(a)および(b)と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分
を含有するアクリル樹脂を含有する。
【0024】
かかる製剤は、例えば、同一出願人による米国特許第6,420,473号(この特許文献の記載内容は参照により本明細書中に含めるものとする)に記載されている。かかるアクリル系腸溶ポリマーはACRYL-EZE(登録商標)としてColorconから入手することも可能であり、また該ポリマーはアルカリ化剤および剥離剤などの補助成分ならびに後述の多くの他の任意成分を含んでいてもよい。アルカリ化剤は、反応後、塩を形成しうるカルボン酸基を有するビニルまたはビニリデン部分内の酸性基の0.1〜10モルパーセントが塩形態で存在するように、アクリルポリマーのアクリル樹脂部分と反応することができる。本発明は決して現在市販されているAcryl-EZE製剤に限定されないこと、また、押し出しに先立って所望の腸溶アクリルポリマー接着剤、可塑剤および全ての所望の任意成分を個別に選択し予め混合した数多くの押し出し可能な製剤についても意図されることが理解されよう。しかし、市販のAcryl EZE製剤は、本発明を実施する際に使用するための、容易に入手しうる押し出し可能なアクリル系腸溶ポリマー製剤を当業者に提供する。
【0025】
本発明によれば、熱成形可能なアクリルポリマー接着剤は、アクリル樹脂を含む乾燥粉末組成物であることが好ましい。上記要件を満たすアクリル樹脂は、Rohm Pharma GmbH (ドイツ)からEUDRAGIT L100-55という商品名で入手可能であり、該樹脂はアクリル酸エチルとメタクリル酸とのコポリマーを主体としている。米国特許第4,520,172号(その開示内容は参照により本明細書中に含めるものとする)も参照されたい。
【0026】
押し出し可能なアクリルポリマー接着剤は、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分を含むアクリル樹脂である。該アクリル樹脂は、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、および少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分から構成されていてもよい。また、該アクリル樹脂は、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分、ならびに(a)アクリル酸アルキルまたはメタクリル酸アルキル部分および(b)塩を形成しうるカルボン酸基を有するビニルまたはビニリデン部分と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分から構成されていてもよい。さらに、該アクリル樹脂は、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、および塩を形成しうるカルボン酸基を有する該ビニルまたはビニリデン部分と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分から構成されていてもよい。
【0027】
好ましくは、前記アクリルポリマー接着剤は、(1)20〜85重量パーセントの、少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分、(2)80〜15重量パーセントの、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、ならびに(3)0〜30重量パーセントの、(1)および(2)と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分から構成されるアクリル樹脂である。本発明の特に好適な実施形態では、前記アクリル酸アルキル(1)はアクリル酸エチルであり、かつ前記ビニル部分(2)はメタクリル酸である。EUDRAGIT L100-55粉末は、この定義に見合うコポリマー系の1例である。
【0028】
好ましくは、前記アクリル樹脂は、本発明の押し出し可能な組成物の約10重量%〜約80重量%、好ましくは約15重量%〜約70重量%、最も好ましくは約20重量%〜約60重量%を占める。
【0029】
上記の任意のアルカリ化剤は、ナトリウムもしくはカリウムの重炭酸塩、炭酸塩、リン酸塩、または水酸化物、炭酸マグネシウム、水酸化マグネシウム、炭酸アンモニウム、重炭酸アンモニウム、酸化マグネシウム、水酸化カルシウム、あるいはそれらの混合物でありうる。使用するアルカリ化剤の量は、前記アクリル樹脂中に存在するカルボン酸担持型のビニルまたはビニリデン部分の量に直接左右される。具体的には、アルカリ化剤を、前記アクリル樹脂との反応後には前記酸性基の0.1〜10モルパーセントが塩形態で存在するような量で加える。
【0030】
上記剥離剤は、タルク、アルミニウム水和物、モノステアリン酸グリセリル、カオリン、またはそれらの混合物でありうる。好ましくは、該剥離剤は、本発明の押し出し可能な組成物の約5重量%〜約40重量%を占める。
【0031】
本発明のさらなる態様では、前記アクリルポリマー接着剤を、あらゆるAPIおよび他の任意成分と組み合わせうる即時使用可能な予備混合物(pre-blend)の一部として含めることができる。この場合、該予備混合物(単独)は、約20〜約80重量%のEudragit L100-55、約15〜約60重量%のクエン酸トリエチル、および約19〜約76重量%のタルクを含有する。
【0032】
C. 可塑剤
本明細書中で使用する場合、「可塑剤」という用語には、上記アクリルポリマー接着剤を可塑化しうる全ての化合物が含まれる。該可塑剤は、アクリルポリマーのガラス転移温度または軟化点を下げることにより、熱溶融押し出し加工時の加工温度、押し出し機のトルクおよび圧力を下げうるものとすべきである。
【0033】
適切な可塑剤の非限定的なリストには、クエン酸トリエチル、モノステアリン酸グリセリル、トリ酢酸グリセリル、クエン酸アセチルトリエチル、セバシン酸ジブチル、フタル酸ジエチル、ポリエチレングリコール、グリセロール、ヒマシ油、またはそれらの混合物が含まれる。好ましくは、可塑剤はクエン酸トリエチルである。可塑剤の組み合わせを本製剤に使用しうることも意図され、また本発明の範囲に含まれる。本発明において有用な他の可塑剤としては、単なる具体例であって限定するものではないが、低分子量ポリマー、オリゴマー、コポリマー、油、有機小分子、脂肪族ヒドロキシルを有する低分子量ポリオール、エステル型の可塑剤、グリコールエーテル、ポリ(プロピレングリコール)、マルチブロックポリマー、シングルブロックポリマー、低分子量ポリ(エチレンオキシド)(平均分子量が約500,000未満のもの)、エチレングリコール、プロピレングリコール、1,2-ブチレングリコール、2,3-ブチレングリコール、スチレングリコール、ジエチレングリコール、トリエチレングリコール、テトラエチレングリコールおよび他のポリ(エチレングリコール)化合物、モノプロピレングリコールモノイソプロピルエーテル、プロピレングリコールモノエチルエーテル、エチレングリコールモノエチルエーテル、ジエチレングリコールモノエチルエーテル、乳酸ソルビトール、乳酸エチル、乳酸ブチル、グリコール酸エチル、クエン酸トリエチル、クエン酸アセチルトリエチル、クエン酸トリブチルおよびグリコール酸アリルが挙げられる。かかる可塑剤は全て、AldrichまたはSigma Chemical Co.などの供給元から市販されている。
【0034】
本発明の熱成形可能な組成物中に含める可塑剤の量は、約4.0〜約40重量%としうる。好ましくは、該量は約7〜約35重量%であるが、最も好ましくは、該量は約10〜約30重量%である。製剤に使用する可塑剤の量は、その組成、物理的特性、アクリルポリマーに及ぼす影響、製剤の他の構成要素との相互作用、および医薬品製剤の調製時に考慮すべき他の因子にも左右される。
【0035】
D. 治療調製物
先に述べたように、本発明の組成物中に含めるAPIは、当業者の要求に応じて広い範囲で変更することができる。この点についての唯一の制限は、該APIが、有意に分解/崩壊することなく本明細書中に記載の押し出し加工を施しうるものでなくてはならないということである。本発明の押し出し可能な組成物および押し出し組成物に含めるAPIの量は、通常、治療化合物の所望の放出プロフィール、薬理活性および毒性ならびに他のかかる考慮事項に応じて、約0.001〜約85重量%の量とする。しかし好ましくは、該量は1.0〜約60重量%であり、最も好ましくは約3.0〜約10重量%である。
【0036】
本明細書中で使用する場合、「治療化合物」または「API」という用語は、哺乳動物において所望の有益かつ治療的な効果を示す有機化学物質を意味するものとする。かかる化合物は通常、医薬品または生物学的製剤に分類される。体液に曝露した際に該製剤から治療化合物が拡散される限り、その構造はさほど重要ではない。本発明の範囲内にあると考えられる治療化合物としては、疎水性、親水性および両親媒性の化合物が挙げられる。該化合物は、それらの遊離酸、遊離塩基、または製薬上許容しうる塩形態をとりうる。該化合物は所定の医薬品の誘導体またはプロドラッグでありうる。本発明に使用する特定の治療化合物が非対称置換炭素原子を含みうること、従って該化合物を光学活性形態またはラセミ形態として単離しうることは理解されよう。光学的に活性な出発物質からラセミ形態の分割または合成などにより光学活性形態を調製する方法は、当分野で周知である。同様に、治療化合物のシスおよびトランス幾何異性体についても記載されているので、これらを異性体混合物、または別々の異性体形態として単離しうることが分かる。具体的な立体化学または異性体形態が具体的に示されている場合を除き、ある構造の全てのキラル形態、ジアステレオマー形態、ラセミ形態および全ての幾何異性形態が対象となる。
【0037】
治療化合物が所定の製剤構成要素に可溶である必要はない。治療化合物は、製剤のポリマーマトリクス中に溶けるか、部分的に溶けるかまたは懸濁しうるものであればよい。治療化合物は使用する熱溶融押し出し加工条件において安定であることが必要である。安定であるとは、治療化合物の大部分が熱溶融押し出し加工中に著しく崩壊したり分解したりしないことを意味する。
【0038】
本発明の製剤中で熱成形しうる治療化合物は、単なる具体例であって限定するものではないが、炎症、痛風、高コレステロール血症、微生物感染症、AIDS、結核、真菌感染症、アメーバ感染症、寄生虫感染症、癌、腫瘍、臓器拒絶反応、糖尿病、心不全、関節炎、喘息、疼痛、鬱血、尿路感染症、膣感染症、発作関連障害、鬱病、精神病、痙攣、糖尿病、血液凝固、高血圧および受胎調節などの適応症を治療するために使用することができる。
【0039】
以下の治療化合物は、本発明の医薬品製剤により投与しうるAPIの具体例である。このリストは例示を目的としたものであって、他を除外するものではない。
【0040】
(1) アスピリン、アセトアミノフェン、ジフルニサルなどの鎮痛薬、
(2) リドカイン、プロカイン、ベンゾカイン、キシロカインなどの麻酔薬、
(3) フェニルブタゾン、インドメタシン、スリンダク、デキサメタゾン、イブプロフェン、アロプリノール、オキシフェンブタゾン、プロベネシド、コルチゾン、ヒドロコルチゾン、ベタメタゾン、デキサメタゾン、フルオコルトロン、プレドニゾロン、トリアムシノロン、インドメタシン、スリンダクならびにその塩および対応する硫化物などの抗関節炎薬および抗炎症薬、
(4) テオフィリン、エフェドリン、ジプロピオン酸ベルクロメタゾン、エピネフリンなどの抗喘息薬、
(5) スルファメトキサゾール、トリメトプリム、ニトロフラントイン、ノルフロキサシンなどの尿路消毒薬、
(6) へパリン、ビスヒドロキシクマリン、ワルファリンなどの抗凝固剤、
(7) ジフェニルヒダントイン、ジアゼパムなどの抗痙攣薬、
(8) アミトリプチリン、クロルジアゼポキシド、ペルフェナジン、プロトリプチリン、イミプラミン、ドキセピンなどの抗鬱薬、
(9) インスリン、トルブタミド、トラザミド、ソマトトロピン、アセトヘキサミド、クロルプロパミドなどの糖尿病の治療および血糖値の調節において有用な物質、
(10) アドリアマイシン、フルオロウラシル、メトトレキサート、アスパラギナーゼなどの抗新生物薬、
(11) プロクロルペラジン、炭酸リチウム、クエン酸リチウム、チオリダジン、モリンドン、フルフェナジン、トリフルオペラジン、ペルフェナジン、アミトリプチリン、トリフルプロマジンなどの抗精神病薬、
(12) スピロノラクトン、メチルドーパ、ヒドララジン、クロニジン、クロロチアジド、デセルピジン、チモロール、プロプラノロール、メタプロトール(metaprotol)、塩酸プラゾシン、レセルピンなどの降圧薬、
(13) メファラン、ダンブロレン(danbrolene)、シクロベンザプリン、メトカルバモール、ジアゼパム、塩化スクシノイルなどの筋弛緩薬、
(14) クロラムフェニコール、クロロキン、トリメトプリムおよびスルファメトキサゾールなどの抗原虫薬、
(15) ノノキシノールなどの殺精子剤、
(16) βラクタム系抗生物質、テトラサイクリン、クロラムフェニコール、ネオマイシン、セフォキシチン、チエナマイシン、グラミシジン、バシトラシン、スルホンアミド、アミノグリコシド系抗生物質、トブラマイシン、ニトロフラゾン、ナリジクス酸および類似物質などの抗菌物質、ならびにフルダラニン/ペンチジドン(pentizidone)からなる抗菌薬の組み合わせ、
(17) ペリラミン、クロルフェニラミン、テトラヒドロゾリンおよびアンタゾリンなどの抗ヒスタミン薬および充血除去剤、
(18) イベルメクチンなどの駆虫化合物、ならびに
(19) アシクロビルおよびインターフェロンなどの抗ウイルス性化合物。
【0041】
E 任意成分
本発明の押し出し可能な組成物ならびに押し出し製品および医薬製剤は、1つ以上の機能性賦形剤をさらに含みうる。これらの賦形剤は、放出調節剤、充填剤、加工剤および種々雑多な添加剤に大別される。種々の賦形剤を選択および使用することにより、従来の剤形の場合と同様にして本発明の組成物に特定の性質を付与することができる。かかる賦形剤の非限定的なリストには、放出速度調節剤(release rate modifier)、色素、流動助剤(flow aids)、界面活性剤、抗凝集剤(anti-agglomerating agents)、二次接着剤(secondary binders)、二次剥離剤(secondary detackifiers)などが含まれる。
【0042】
放出速度調節剤は、押し出しに先立って押し出し可能な成分に加えた場合に、押し出しマトリクスからのAPIの放出に影響を及ぼす物質である。本発明の殆どの態様では、該放出速度調節剤は、押し出しポリマーマトリクスからのAPIの放出速度を持続させる物質である。以下は、この目的に見合う物質の非限定的なリストである:ヒドロキシプロピルセルロース(HPC)、ポリ(エチレンオキシド)(PEO)、ヒドロキシプロピルメチルセルロース(HPMC)またはヒプロメロース(メトセル(Methocel)(登録商標))、エチルセルロース、セルロース系ポリマー、アクリルポリマー、脂肪(fat)、ワックス、脂質、ポリカルボフィル、カルボマー(carbomer)、多糖類およびそれらの混合物。好適な態様では、該放出速度調節剤はNoveon(Cleveland, OH)の製品であるカルボポール(Carbopol)934のようなカルボマーである。940、941、974、980、981などの他のカルボポールを使用してもよい。
【0043】
本発明の押し出し可能な組成物に含める前記放出速度調節剤の量は、約1〜約40重量%であり、好ましくは約2〜約30重量%である。
【0044】
前記色素は、FD&CもしくはD&Cレーキ、二酸化チタン、炭酸マグネシウム、タルク、焼成シリカ(pyrogenic silica)、酸化鉄、チャンネルブラック、リボフラビン、カルミン40、クルクミン、アンナット、不溶性染料、雲母および/もしくは二酸化チタンベースの真珠光沢色素またはそれらの混合物でありうる。適切な色素の他の具体例は、Jeffriesの米国特許第3,149,040号、Butlerらの米国特許第3,297,535号、およびColorconの米国特許第3,981,984号に記載されている(これらの特許文献は全て、参照により本明細書中に含めるものとする)。また該色素は、可塑剤とOPADRYで着色したコーティング組成物とを含有するレーキ混合物を含んでいてもよく、その一部は米国特許第4,543,370号(この特許文献は参照により本明細書中に含めるものとする)に開示されている。好ましくは、該色素は、押し出し可能な組成物の0重量%〜約50重量%を占める。
【0045】
前記流動助剤は、Cabot社からCab-O-Silという商品名で提供されているフュームドシリカなどのシリカでありうる。該流動助剤は、乾式混合とそれに続く混合機から保存容器への移送時の粉末組成物に流動性を付与する。好ましくは、該流動助剤は、押し出し可能な組成物の0重量%〜約3重量%を占める。
【0046】
前記界面活性剤は、ラウリル硫酸ナトリウム、ジオクチルスルホコハク酸ナトリウム、Tween 80などのポリソルベート、ソルビトールなどのポリオールまたはそれらの混合物でありうる。グリセリン、PEG、PPGなどの他の湿潤剤も意図される。好ましくは、該界面活性剤および/または湿潤剤は、押し出し可能な組成物の0重量%〜約5重量%を占める。
【0047】
前記抗凝集剤は、カオリンでありうる。本発明のドライコーティング組成物中の抗凝集剤の量は、押し出し可能な組成物の0重量%〜約40重量%とする。有益なことに、カオリンは抗凝集剤と剥離剤の両方の役目を果たす。
【0048】
前記二次接着剤は、キサンタンガム、アルギン酸ナトリウム、アルファ化澱粉、アルギン酸プロピレングリコール、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシエチルセルロース(HEC)、カルボキシメチルセルロースナトリウム(CMCナトリウム)、ポリビニルピロリドン(PVP)、コンニャク粉、カラギーナン、他のフィルム形成ポリマーまたはそれらの混合物でありうる。好ましくは、コーティング組成物中の二次フィルム形成物質の量は、本発明のドライコーティング組成物の0重量%〜約5重量%とする。
【0049】
前記二次剥離剤は、硫酸ナトリウム、硫酸カルシウム、塩化カルシウム、他の無機もしくは有機水分捕捉剤(water-sequestering agent)またはそれらの混合物でありうる。好ましくは、コーティング組成物中の二次剥離剤の量は、本発明のドライコーティング組成物の0重量%〜約5重量%とする。
【実施例】
【0050】
以下の実施例は本発明の理解を深めるためのものであって、決して本発明の有効範囲を限定するものではない。以下の材料を使用した。
【表1】

【0051】
熱溶融押し出し
Acryl-EZE(登録商標)のみを含有する乾燥粉末製剤ならびにAcryl-EZE、APIおよび機能性賦形剤を含有する粉末混合物を、熱溶融押し出しに先立って陶器のすり鉢とすりこぎで5分間混合した。液状の可塑剤であるTECをこの製剤中に含める場合には、5分間混合する前に、該可塑剤をすり鉢内のAcryl-EZE(登録商標)に幾何級数的に加えた。この乾燥粉末製剤を、Randcastle Microtruder(登録商標) RCP-0750 (Cedar Grove、NJ)単軸押し出し機を使用して押し出した。該押し出し機には、Nitralloy 135Mスクリュー(供給部、圧縮部および混練部を含むフライト形状の圧縮比は3:1)および丸ダイ(直径6 mm)が備わっていた。全製剤に対して用いたスクリュー速度は15〜20rpmであった。押し出し機のバレルゾーンとダイの温度は、外部の温度制御装置を使用して変更した。製剤は、押し出し機の各ゾーンおよびダイを設定温度に合わせてからホッパーに供給した。押し出し物は、25℃に冷却してから手作業で切断して錠剤とした。グアイフェニシン錠の重さはおよそ280 mgであったが、テオフィリン錠の重さはおよそ215 mgであった。
【0052】
薬物放出試験
溶出試験を行う際には、該試験を、オートサンプラー(VK8000型)を備えたVan Kel VK7000溶出試験装置上で、米国薬局方第24局記載の装置2(パドル法)に従って実施した。腸溶出試験は、2時間の酸性ステージ(pH 1.2、0.1 N HCl)とその後8時間の緩衝ステージ(pH 6.8、50 mmolのリン酸緩衝溶液)を含む米国薬局方第24局記載の方法Bに従って実施した。溶出試験用の容器容積900 mLを37℃で維持し、50 rpmで攪拌した。10時間にわたり、所定の時点で試料を取り出した。
【0053】
前記試料を、その薬物含量について、276 nmでグアイフェニシンを、また281 nmでテオフィリンを抽出するフォトダイオードアレイ検出器(996型)を備えたWatersの高性能液体クロマトグラフィー(HPLC)系を使用して分析した。試料は、予め0.2μmメンブレン(Gelman Laboratory、GHP Acrodisc)に通して濾過することにより不溶性の賦形剤を除去しておいた。オートサンプラー(717プラス型)を使用して20μLの試料を注入した。データは、Empower(登録商標)バージョン5.0ソフトウェアを使用して回収および積算した。グアイフェニシンの分析に使用したカラムはAlltech Alltima(商標) C18 10μm、250×4.1 mmであった。移動相には、水:メタノール:氷酢酸(体積比は600:400:15)からなる混合物が含まれていた。溶媒は、0.45μmのナイロン膜を通して真空濾過してから、WatersのIn-Line Degasser AFを使用して脱気した。流速は1.5 mL/分とした。グアイフェニシンの保持時間は3.5分であった。2〜200 mg/μLの範囲で線形性(R2>0.997)が示され、また10回の注入に対する注入再現性は0.35%相対標準偏差であった。テオフィリンの分析に使用したカラムは、Alltech Inertsil(商標) ODS-3 3μm、150×4.6 mmであった。移動相には、水:アセトニトリル:氷酢酸(体積比は845:150:5)からなる混合物および1.156 g/Lの酢酸ナトリウム三水和物が含まれていた。テオフィリンの保持時間は3.6分であった。1〜100 mg/μLの範囲で線形性(R2>0.998)が示され、また6回の注入に対する注入再現性は1%相対標準偏差であった。
【0054】
実施例1〜2
比較
これらの実施例では、製品Acryl-EZEを含有するアクリル系腸溶ポリマーを単独で押し出した。
【0055】
実施例1
【表2】

【0056】
実施例2
【表3】

【0057】
実施例3
本実施例では、押し出しに先立って、前記混合物に可塑剤であるクエン酸トリエチル(TEC)を加えた。
【表4】

【0058】
実施例4
比較
本実施例では、可塑剤は使用せず、押し出しに先立って前記混合物にAPIとしてテオフィリンを含めた。
【表5】

【0059】
実施例5〜6
これらの実施例では、可塑剤は使用せず、押し出しに先立って前記混合物にAPIとしてグアイフェニシンを含めた。
【表6】

【0060】

【0061】
ここで図1を参照し、動作温度が熱成形錠剤のグアイフェニシン放出プロフィールに及ぼす影響について検討する。いずれの場合も、錠剤は80%のAcryl-EZEと20%のグアイフェニシンを含有する押し出し物から調製した。溶出条件は、pH 1.2の媒質中で2時間、その後はpH 6.8の媒質中で8時間、900 mL、37℃、50 rpm、n = 6とした。押し出し機のゾーン温度における変化は、本実施例における錠剤のin vitro溶出にはわずかな効果しか及ぼさなかったことが分かる。
【0062】
実施例7〜8
これらの実施例では、ポリマー、可塑剤およびAPIを含めた。
【表7】

【0063】

【0064】
ここで図2を参照すると、実施例7および8の製品を含むように調製した錠剤の放出プロフィールが提供されている。具体的には、薬物:ポリマー比を実施例7から実施例8へと変更した場合に観察される差があるかどうかを確認する証拠を探した。溶出条件は、pH 1.2の媒質中で2時間、その後はpH 6.8の媒質中で8時間、900 mL、37℃、50 rpm、n = 6とした。約2〜4時間後に放出される薬物の量は、押し出し加工時に含める薬物の量が多いほど増加したことが分かる。
【0065】
実施例9〜10
これらの実施例では、ポリマー、可塑剤、APIおよびモノステアリン酸グリセロール(GMS)を含めた。
【表8】

【0066】

【0067】
ここで図3を参照すると、GMSを含めることの効果が示されている。0%のGMSを有する製品である実施例7の製品を基準として使用し、実施例8および9の製品の放出プロフィールを比較した。溶出条件は、pH 1.2の媒質中で2時間、その後はpH 6.8の媒質中で8時間、900 mL、37℃、50 rpm、n = 6とした。GMSが存在すると、特に約3時間後以降に放出されるテオフィリンの量が減少することが分かる。薬物が完全に放出されるのは約6時間後から約8時間後と若干遅くなる。含めるGMSの量は、この期間において放出速度を低下させるという点では幾らかの効果を有するが、使用する量を2倍(実施例8)にしても、実施例9で使用した量と比べて薬物が放出される時間が延長されることはなかった。
【0068】
実施例11〜13
これらの実施例では、ポリマー、可塑剤、APIおよび放出速度調節剤を含めた。
【表9】

【0069】

【0070】

【0071】
ここで図4を参照すると、カルボマー(Carbomer)934が上記の通りに調製した熱成形錠剤のテオフィリン放出プロフィールに及ぼす影響が示されている。基準製剤はここでも実施例7の製品(例えば、0%のカルボマー934、20%のテオフィリン、64%のAcryl-EZE、16%のTEC(Acryl-EZEを基準とすると25%))とした。
【0072】
押し出し物中にカルボマー934が存在すると、薬物が放出される時間が有意に延長されることが分かる。溶出条件は、pH 1.2の媒質中で2時間、その後はpH 6.8の媒質中で8時間、900 mL、37℃、50 rpm、n = 6とした。また、2.5%のカルボマー934を用いるとゼロ次またはほぼゼロ次の放出パターンが提供されるが、カルボマー934の量を5%から10%に増やしてもその延長された放出プロフィールに本質的な差はみられないということも分かる。実際は、意外なことに、カルボマー934の量を増やすと、2.5%カルボマー934押し出し物を用いて達成される場合よりも急速に薬物が放出された。
【0073】
実施例14〜17
これらの実施例では、ポリマー、可塑剤、APIおよび放出速度調節剤を含めた。
【表10】

【0074】

【0075】

【0076】

【0077】
ここで図5を参照すると、メトセルK4Mが上記の通りに調製した熱成形錠剤のテオフィリン放出プロフィールに及ぼす影響が示されている。基準製剤は、実施例7と同じ製剤であるが異なる加工パラメーターを持つ実施例17の製品である。溶出条件は、0.1 N HCl媒質中で2時間、その後はpH 6.8の媒質中で8時間、900 mL、37℃、50 rpm、n = 6とした。
【0078】
実施例17に用いるスクリュー速度、駆動アンペアおよび圧力が高くなると、実施例7の製品と比べて、溶出試験で0〜2時間後に放出されるテオフィリンの量が減少したことが分かる。実施例7の製品の溶出プロフィールは図2〜4に示してある。メトセルが基準製剤と比べて2〜10時間後の薬物の放出速度を低下させたことも分かる。さらに、5%メトセルを含有する錠剤は、2.5%メトセルを含有する製品と比べて、pH 6.8の媒質における薬物放出速度をより有意に低下させた。しかし、メトセルの濃度を高めると、0.1 N HCl媒質における薬物放出は増大した。
【0079】
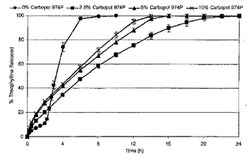
実施例18〜20
これらの実施例では、ポリマー、可塑剤、APIおよび放出速度調節剤を含めた。
【表11】

【0080】

【0081】

【0082】
ここで図6を参照すると、カルボポール974P が、実施例18〜20に記載されている通りに調製した溶融押し出し錠からのテオフィリン放出速度に及ぼす影響が示されている。溶出条件は、0.1 N HCl中で2時間、その後はpH 6.8の媒質中で22時間、900 mL、37°C、50 rpm、n = 6とした。基準製剤は、ここでも実施例17の製品(例えば、0%のカルボポール974P、20%のテオフィリン、64%のAcryl-EZE、16%のTEC(Acryl-EZEを基準とすると25%))とした。
【0083】
カルボマー934を含有する押し出し物について述べたように、カルボポール974Pが存在すると、テオフィリンが放出される時間が有意に延長される。2.5%のカルボポールを含有する錠剤は、溶出試験でおよそ20時間にわたって薬物を放出し続けた。5または10%のカルボポールを含有する製品の溶出プロフィール間には有意な差が見られず、またこれらのプロフィールはほぼゼロ次の放出パターンを示し、試験開始およそ14時間後に完全に薬物が放出された。全ての実施例において、カルボポールの存在により、0.1 N HCl媒質中で放出されるテオフィリンの量が増大した。
【0084】
ここで図7を参照すると、カルボポール974Pを含有する溶融押し出しAcryl-EZEマトリクス錠剤を、シリカ乾燥剤入りの誘導密閉HDPE容器中で40℃/75%RHにて3ヶ月間保存した場合の、該錠剤からのテオフィリン放出速度の安定性が示されている。試験した製剤は、実施例14、15および16の製品であった。溶出条件は、0.1 N HCl媒質中で2時間、その後はpH 6.8の媒質中で8時間、900 mL、37°C、50 rpm、n = 6とした。保存前および保存後の溶出プロフィールを重ね合わせることができたので、2.5、5および10%のカルボポールを含有する錠剤は加速条件で保存した場合にも安定であったことが分かる。
【0085】
実施例21
上記実施例で調製した組成物に対して「薬物放出試験」の項の第2段落に記載の含量均一性試験を行って作成したデータを、以下に示す。
【表12】

【0086】
上記データは、本発明の方法により、再現性がありかつその薬物含量均一性に高度に一貫性がみられる製品が提供されることを示している。該方法は、液状TECおよびカルボマーが含まれている場合でも非常に効率が良い。該製品は、押し出し機に1回通すだけで作製することができる。
【0087】
現段階で本発明の好適な実施形態と考えられるものについて記載してきたが、当業者であれば、本発明の精神から逸脱することなく本発明に変更および修正を加えうることが分かるだろう。本発明の真の範囲内にある全てのかかる変更および修正についても権利を主張するものとする。
【図面の簡単な説明】
【0088】
【図1】図1は、実施例5〜6の熱溶融押し出し組成物を含有する錠剤からの、グアイフェニシンのin vitro放出プロフィールを示すグラフである。
【図2】図2は、実施例7〜8の熱溶融押し出し組成物を含有する錠剤からの、テオフィリンのin vitro放出プロフィールを示すグラフである。
【図3】図3は、実施例9〜10の熱溶融押し出し組成物を含有する錠剤からの、テオフィリンのin vitro放出プロフィールを示すグラフである。
【図4】図4は、種々の量のカルボマーを含有し、かつ実施例11〜13に従って調製した錠剤の持続放出プロフィールを示すグラフである。
【図5】図5は、実施例15〜17の熱溶融押し出し組成物を含有する錠剤からの、テオフィリンのin vitro放出プロフィールを示すグラフである。
【図6】図6は、実施例18〜20の熱溶融押し出し組成物を含有する錠剤からの、テオフィリンのin vitro放出プロフィールを示すグラフである。
【図7】図7は、Acryl-EZEおよび種々の量のカルボポール974Pを含む熱溶融押し出し組成物を含有する錠剤からの、40℃/75%RHにおける3ヶ月間の保存前後の、テオフィリンのin vitro放出プロフィールを示すグラフである。
【技術分野】
【0001】
関連出願の相互参照
本出願は、米国仮出願第60/468,625号(2003年5月6日出願)に基づく優先権の恩恵を主張するものであり、その開示内容は参照により本明細書中に含めるものとする。
【0002】
1. 発明の分野
本発明は、医薬品業界において有用な、押し出し可能な組成物に関する。また本発明は、押し出し賦形剤および医薬品として有効な成分を含有する種々の押し出し物を調製する方法にも関する。
【背景技術】
【0003】
2. 従来技術の説明
熱溶融押し出し(HME)は、プラスチック業界でチューブ、パイプ、ワイヤーおよびフィルムを製造する際に広く用いられている加工技術である。医薬系では、この方法を利用して粒剤、徐放性錠剤および経皮的薬物送達系を調製している。今日では、熱溶融押し出し技術への関心が急速に高まっており、該技術に関して100を超える論文が発表されている。医薬系に対して発行される熱溶融押し出し特許の数は、1980年代初頭から着実に増加し続けている。
【0004】
熱溶融押し出しは、従来の医薬品加工技術よりも優れた点を数多く提供する。溶剤および水を必要としないので、加工段階の数が減り、さらに時間のかかる乾燥段階が排除される。有効成分が圧縮可能である必要はないため、全ての手順は連続的かつ効率的である。回転スクリューによって激しく混合および攪拌することで、溶融ポリマー中の懸濁粒子が脱凝集して、より均一に分散する。また、熱溶融押し出しは、分子を分散させることにより薬物原料のバイオアベイラビリティーを改善する際にも利用されている。全ての構成要素は、短時間の加熱加工中はその加工温度において熱的に安定でなくてはならない。従って、熱溶融押し出しでは、多くの薬物の熱的感度との関係上、比較的低い温度で加工しうる医薬品等級のポリマーが必要とされる。
【0005】
多くの熱溶融押し出し加工では、通常、高い加工温度が必要とされる。しかし、医薬品製剤分野の技術者からは、これらの高温は治療薬および/または高分子担体もしくは担体マトリクスの分解を引き起こすものと認識されている。
【0006】
医薬品製剤の調製時に押し出し加工を利用しようとする初期の試みの1つが、米国特許第5,073,379号に記載されている。この特許には、活性化合物を含有するポリマー溶融物を押し出してから、ベルトとローラーの間または2つのベルトの間で依然として可塑性を有する押し出し物を形成するという連続工程について記載されている。
【0007】
米国特許第6,051,253号には、薬理学上許容しうるポリマー接着剤および医薬品有効成分を、従来の医薬品添加物と共に、または該添加物抜きで、溶剤の非存在下で混合しかつ溶融させて塑性混合物を得ることにより製造される固体剤形が開示されている。この場合の押し出し物は2段階に分けて成形される。該押し出し物を砕いて成形品とし、該成形品に第2段階で塑性状態にて丸みをつける。
【0008】
この点に関する取り組みの最近の1例は、PCT公報国際公開第02/35991号に記載されており、該公報には、熱溶融押し出し加工を利用して形成した球状ペレットを含有する活性物質が開示されている。具体的に言うと、有効成分、可塑剤、ポリマーおよび任意の賦形剤を押し出して紐状押し出し物とした後、これを切断してペレットとしてから球状化加工を施すことにより、熱成形可能な組成物を取得する。好適なポリマーとして、有効物質の分解温度を下回るガラス転移温度(Tg)を有することを基準に選択された、種々のEUDRAGIT(登録商標)タイプの製品などが挙げられている。
【0009】
McGinityらの米国特許第6,488,963号には、治療化合物とPEGなどの高分子量ポリ(エチレンオキシド)との熱成形可能な混合物を本質的に非フィルム性の調製物中に含有する医薬品製剤、および該医薬品製剤を調製する方法が開示されている。しかし、この‘963号特許には、その一部として腸溶性のポリマーを含有する熱成形可能な医薬品製剤を調製することは開示されていない。
【0010】
同一出願人による米国特許第6,420,473号(この特許文献の開示内容は参照により本明細書中に含めるものとする)には、医薬品をコーティングするための水系腸溶コーティング懸濁物を作製する際に使用されるアクリル樹脂をベースとした、完全処方済みで、無毒であり、食用に適し、腸溶性であり、フィルムコーティング用の、乾燥粉末組成物が記載されている。該コーティングは、胃の胃液には溶けずに腸で溶ける。Colorcon(West Point、PA)からACRYL EZE(登録商標)という商標の下で販売されているこの粉末組成物は、水系フィルムコーティング系に含めることを目的としているので、該組成物には前記アクリル樹脂と反応しうるアルカリ化剤および剥離剤(detackifier)も含まれている。これらのフィルムコーティング系を熱溶融押し出しまたは他の熱成形加工に使用しうることは、何ら開示も示唆もされていない。
【発明の開示】
【発明が解決しようとする課題】
【0011】
上記背景にもかかわらず、当分野では依然として、さらなる制御放出性医薬品製剤を開発することが必要とされている。本発明は、この必要性に取り組むものである。
【課題を解決するための手段】
【0012】
発明の概要
本発明のある態様では、医薬品製剤に使用するのに適した熱成形可能な組成物が提供される。この熱成形可能または押し出し可能な組成物は、好ましくは粉末ベースであり、(i)熱成形可能または押し出し可能なアクリルポリマー接着剤(binder)と(ii)有効量のアクリルポリマー可塑剤を含む。該アクリルポリマー接着剤は、
(a) 20〜85重量パーセントの、少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分、
(b) 80〜15重量パーセントの、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、ならびに
(c) 0〜30重量パーセントの、(a)および(b)と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分
を有するアクリル樹脂を含む。前記組成物には熱溶融押し出し加工または本明細書中に記載の他の熱成形加工をすぐに施すことができるが、これらの加工は該組成物を医薬品として有効な組成物および1つ以上の任意の医薬品賦形剤と混合した後とすることが好ましい。
【0013】
本発明のさらなる態様では、粉末ベースの熱成形または押し出し可能な組成物を作製する方法、熱成形組成物を作製する方法、押し出しまたは熱成形組成物を含有する医薬製剤(pharmaceutical dosage form)を作製する方法、ならびにその結果得られた医薬製剤、すなわち、錠剤、カプセル剤などが提供される。
【発明の効果】
【0014】
本発明の結果として、幾つかの利点が提供される。まず第1に、驚いたことに、錠剤などの腸溶コーティングにのみ有用であると考えられていたポリマーコーティング組成物を、本発明ではそれらの徐放特性を損なうことなく熱溶融押し出し加工に使用しうることが見出された。その上、予想外にも、腸溶ポリマーコーティングと可塑剤からなる本発明の混合物を含有する押し出し組成物が、当業者にゼロ次またはほぼゼロ次(near zero order)のin vitro放出プロフィールを提供しうることも見出された。
【0015】
さらに、熱成形可能な粉末が予め可塑化したアクリルポリマーおよび剥離剤(detackifier)を含むような本発明の幾つかの好適な実施形態では、驚いたことに、効率的なスループットを得るために追加量の可塑剤を加えてこれを急速に吸収させうることが見出された。その上、実施形態を問わず、本発明の組成物により、高度の含量均一性を示すだけでなく押し出し機に1回通すだけで作製しうる押し出し製品が提供されることが見出された。
【発明を実施するための最良の形態】
【0016】
発明の詳細な説明
A. 熱溶融押し出し加工
本明細書中で使用する場合、「熱成形可能な」という用語は、熱成形しうるかまたは熱加工時に溶融させるかもしくは流動化することによって加工しうる、すなわち、高温および/または高圧の組み合わせの下で押し出すことのできる化合物または製剤を指す。熱成形可能なポリマーとは、標準的な周囲温度および圧力では十分に硬いが、高熱または高圧下では、単独で、または好ましくは本明細書中に記載した実例のように後述のタイプの可塑剤と共に、変形しうるかあるいは半流動状態をとりうるポリマーである。
【0017】
前記の本発明の加工は熱成形または熱溶融押し出し加工と呼ばれるものであるが、射出成形、溶融メッキ、メルトキャスティング、溶融造粒および圧縮成形といった当業者に公知の他の等価な加工を利用することもできる。これらの方法のいずれかを利用することにより、所望の投与様式、例えば、錠剤、丸剤、トローチ剤、坐剤などに応じて随時製剤を成形することができる。
【0018】
本発明の幾つかの実施形態で利用する熱溶融押し出し加工は、高温で実施する。すなわち、押し出し機の加熱ゾーンの温度が室温(約20℃)を上回る。押し出し加工時には、加工中の治療化合物/医薬品有効成分の崩壊または分解を最小限に抑えるような動作温度範囲を選択することが重要である。無論、かかる温度は有効成分に応じて変更されるものであり、このことは当業者には自明であろう。具体的な温度範囲を示す必要はないが、本発明の殆どの態様では、前記動作温度範囲は、押し出し機の加熱ゾーンの設定によって測定した場合、通常、約60℃〜約160℃の範囲内であると考えられる。
【0019】
本発明の幾つかの実施形態では、前記熱溶融押し出しを、アクリルポリマー接着剤、可塑剤、医薬品として有効な成分がある場合には該成分、および全ての任意の存在する賦形剤を含むスラリー、固体、懸濁物、液体、粉末または他のそのような供給材料を用いて実施することができる。殆どの態様では、本発明の加工時に乾燥供給材料を用いることが好ましい。
【0020】
前記熱溶融押し出し加工は、通常は以下のように記述される:
所望の量の腸溶アクリルポリマーを、押し出し機に導入する前に、可塑剤、医薬品として有効な組成物または有効医薬品成分(以後、APIと記す)および他の任意に含まれる賦形剤と混合する。幾つかの実施形態では、治療化合物が予想外にも非従来型の可塑剤として機能するため、本発明の組成物中に別の(追加の)可塑剤を使用する必要がない。グアイフェネシンはそのようなAPIの1つであるが、アクリルポリマーの溶解パラメーターに近いパラメーターを有するかまたは該ポリマーのTgもしくは軟化点を下げる能力を有する他のAPIが意図される。しかし、多くの代替態様では、APIを他の成分と組み合わせることにより、通常は乾燥粉末である混合物を形成する。しかし、可塑剤がクエン酸トリエチル(TEC)などの液体である場合には、これを押し出し前に前記の乾燥成分構成要素に幾何級数的に加えることが好ましいということに注意すべきである。その後、この混合物を押し出し機のホッパーに入れ、アクリル系腸溶ポリマーおよび可塑剤が溶融または軟化する温度で該押し出し機の加熱部(ゾーン)を通すことにより、APIを分散させるマトリクスを形成する。その後、溶融または軟化した混合物はダイまたは他のそのようなエレメントを介して排出され、その時点でこの変形混合物(ここからは押し出し物と呼ぶ)は硬化し始める。該押し出し物はダイから排出された時点ではまだ温かいか熱いので、容易に造形し、成形し、細断し、粉砕し、成形し、球状化してビーズとし、切断してストランドとし、錠剤化するかまたは別の方法で加工することによって所望の物理形態、すなわち医薬品剤形(医薬製剤)とすることができる。
【0021】
当分野で認められている押し出し機であれば、いずれも本発明を実践するために利用することができる。かかる装置の適切かつ非限定的な例としては、市販されており、かつ乾燥供給材料を処理する設備が備わっており、固体搬送ゾーン、1つまたは複数の加熱ゾーン、および押し出しダイを有する装置が挙げられる。かかる装置の1つは、Randcastle(Cedar Grove、NJ)から入手できるMicrotruder(登録商標)RCP-0750 単軸押し出し機である。本発明を実施する際に有用な別の装置は、C.W. Brabender Instruments社(New Jersey)製の二段単軸押し出し機である。また、当業者の要求に応じて、二軸または多軸押し出し機を使用することもできる。複数の独立した温度可変型加熱ゾーンが備わっているということは、押し出し機としては特に都合が良い。
【0022】
多くの条件を押し出し加工時に変更することにより、特に都合の良い製剤を得ることができる。かかる条件としては、例として、製剤の組成、供給速度、動作温度、押し出し機スクリューのRPM、滞留時間、ダイの形状、加熱ゾーンの長さならびに押し出し機のトルクおよび/または圧力が挙げられる。かかる条件を最適化するための方法は、当業者に公知である。
【0023】
B. アクリルポリマー
本発明の好適な態様では、押し出し可能なアクリルポリマー接着剤部分は、
(a) 20〜85重量パーセントの、少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分、
(b) 80〜15重量パーセントの、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、ならびに
(c) 0〜30重量パーセントの、(a)および(b)と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分
を含有するアクリル樹脂を含有する。
【0024】
かかる製剤は、例えば、同一出願人による米国特許第6,420,473号(この特許文献の記載内容は参照により本明細書中に含めるものとする)に記載されている。かかるアクリル系腸溶ポリマーはACRYL-EZE(登録商標)としてColorconから入手することも可能であり、また該ポリマーはアルカリ化剤および剥離剤などの補助成分ならびに後述の多くの他の任意成分を含んでいてもよい。アルカリ化剤は、反応後、塩を形成しうるカルボン酸基を有するビニルまたはビニリデン部分内の酸性基の0.1〜10モルパーセントが塩形態で存在するように、アクリルポリマーのアクリル樹脂部分と反応することができる。本発明は決して現在市販されているAcryl-EZE製剤に限定されないこと、また、押し出しに先立って所望の腸溶アクリルポリマー接着剤、可塑剤および全ての所望の任意成分を個別に選択し予め混合した数多くの押し出し可能な製剤についても意図されることが理解されよう。しかし、市販のAcryl EZE製剤は、本発明を実施する際に使用するための、容易に入手しうる押し出し可能なアクリル系腸溶ポリマー製剤を当業者に提供する。
【0025】
本発明によれば、熱成形可能なアクリルポリマー接着剤は、アクリル樹脂を含む乾燥粉末組成物であることが好ましい。上記要件を満たすアクリル樹脂は、Rohm Pharma GmbH (ドイツ)からEUDRAGIT L100-55という商品名で入手可能であり、該樹脂はアクリル酸エチルとメタクリル酸とのコポリマーを主体としている。米国特許第4,520,172号(その開示内容は参照により本明細書中に含めるものとする)も参照されたい。
【0026】
押し出し可能なアクリルポリマー接着剤は、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分を含むアクリル樹脂である。該アクリル樹脂は、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、および少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分から構成されていてもよい。また、該アクリル樹脂は、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分、ならびに(a)アクリル酸アルキルまたはメタクリル酸アルキル部分および(b)塩を形成しうるカルボン酸基を有するビニルまたはビニリデン部分と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分から構成されていてもよい。さらに、該アクリル樹脂は、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、および塩を形成しうるカルボン酸基を有する該ビニルまたはビニリデン部分と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分から構成されていてもよい。
【0027】
好ましくは、前記アクリルポリマー接着剤は、(1)20〜85重量パーセントの、少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分、(2)80〜15重量パーセントの、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、ならびに(3)0〜30重量パーセントの、(1)および(2)と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分から構成されるアクリル樹脂である。本発明の特に好適な実施形態では、前記アクリル酸アルキル(1)はアクリル酸エチルであり、かつ前記ビニル部分(2)はメタクリル酸である。EUDRAGIT L100-55粉末は、この定義に見合うコポリマー系の1例である。
【0028】
好ましくは、前記アクリル樹脂は、本発明の押し出し可能な組成物の約10重量%〜約80重量%、好ましくは約15重量%〜約70重量%、最も好ましくは約20重量%〜約60重量%を占める。
【0029】
上記の任意のアルカリ化剤は、ナトリウムもしくはカリウムの重炭酸塩、炭酸塩、リン酸塩、または水酸化物、炭酸マグネシウム、水酸化マグネシウム、炭酸アンモニウム、重炭酸アンモニウム、酸化マグネシウム、水酸化カルシウム、あるいはそれらの混合物でありうる。使用するアルカリ化剤の量は、前記アクリル樹脂中に存在するカルボン酸担持型のビニルまたはビニリデン部分の量に直接左右される。具体的には、アルカリ化剤を、前記アクリル樹脂との反応後には前記酸性基の0.1〜10モルパーセントが塩形態で存在するような量で加える。
【0030】
上記剥離剤は、タルク、アルミニウム水和物、モノステアリン酸グリセリル、カオリン、またはそれらの混合物でありうる。好ましくは、該剥離剤は、本発明の押し出し可能な組成物の約5重量%〜約40重量%を占める。
【0031】
本発明のさらなる態様では、前記アクリルポリマー接着剤を、あらゆるAPIおよび他の任意成分と組み合わせうる即時使用可能な予備混合物(pre-blend)の一部として含めることができる。この場合、該予備混合物(単独)は、約20〜約80重量%のEudragit L100-55、約15〜約60重量%のクエン酸トリエチル、および約19〜約76重量%のタルクを含有する。
【0032】
C. 可塑剤
本明細書中で使用する場合、「可塑剤」という用語には、上記アクリルポリマー接着剤を可塑化しうる全ての化合物が含まれる。該可塑剤は、アクリルポリマーのガラス転移温度または軟化点を下げることにより、熱溶融押し出し加工時の加工温度、押し出し機のトルクおよび圧力を下げうるものとすべきである。
【0033】
適切な可塑剤の非限定的なリストには、クエン酸トリエチル、モノステアリン酸グリセリル、トリ酢酸グリセリル、クエン酸アセチルトリエチル、セバシン酸ジブチル、フタル酸ジエチル、ポリエチレングリコール、グリセロール、ヒマシ油、またはそれらの混合物が含まれる。好ましくは、可塑剤はクエン酸トリエチルである。可塑剤の組み合わせを本製剤に使用しうることも意図され、また本発明の範囲に含まれる。本発明において有用な他の可塑剤としては、単なる具体例であって限定するものではないが、低分子量ポリマー、オリゴマー、コポリマー、油、有機小分子、脂肪族ヒドロキシルを有する低分子量ポリオール、エステル型の可塑剤、グリコールエーテル、ポリ(プロピレングリコール)、マルチブロックポリマー、シングルブロックポリマー、低分子量ポリ(エチレンオキシド)(平均分子量が約500,000未満のもの)、エチレングリコール、プロピレングリコール、1,2-ブチレングリコール、2,3-ブチレングリコール、スチレングリコール、ジエチレングリコール、トリエチレングリコール、テトラエチレングリコールおよび他のポリ(エチレングリコール)化合物、モノプロピレングリコールモノイソプロピルエーテル、プロピレングリコールモノエチルエーテル、エチレングリコールモノエチルエーテル、ジエチレングリコールモノエチルエーテル、乳酸ソルビトール、乳酸エチル、乳酸ブチル、グリコール酸エチル、クエン酸トリエチル、クエン酸アセチルトリエチル、クエン酸トリブチルおよびグリコール酸アリルが挙げられる。かかる可塑剤は全て、AldrichまたはSigma Chemical Co.などの供給元から市販されている。
【0034】
本発明の熱成形可能な組成物中に含める可塑剤の量は、約4.0〜約40重量%としうる。好ましくは、該量は約7〜約35重量%であるが、最も好ましくは、該量は約10〜約30重量%である。製剤に使用する可塑剤の量は、その組成、物理的特性、アクリルポリマーに及ぼす影響、製剤の他の構成要素との相互作用、および医薬品製剤の調製時に考慮すべき他の因子にも左右される。
【0035】
D. 治療調製物
先に述べたように、本発明の組成物中に含めるAPIは、当業者の要求に応じて広い範囲で変更することができる。この点についての唯一の制限は、該APIが、有意に分解/崩壊することなく本明細書中に記載の押し出し加工を施しうるものでなくてはならないということである。本発明の押し出し可能な組成物および押し出し組成物に含めるAPIの量は、通常、治療化合物の所望の放出プロフィール、薬理活性および毒性ならびに他のかかる考慮事項に応じて、約0.001〜約85重量%の量とする。しかし好ましくは、該量は1.0〜約60重量%であり、最も好ましくは約3.0〜約10重量%である。
【0036】
本明細書中で使用する場合、「治療化合物」または「API」という用語は、哺乳動物において所望の有益かつ治療的な効果を示す有機化学物質を意味するものとする。かかる化合物は通常、医薬品または生物学的製剤に分類される。体液に曝露した際に該製剤から治療化合物が拡散される限り、その構造はさほど重要ではない。本発明の範囲内にあると考えられる治療化合物としては、疎水性、親水性および両親媒性の化合物が挙げられる。該化合物は、それらの遊離酸、遊離塩基、または製薬上許容しうる塩形態をとりうる。該化合物は所定の医薬品の誘導体またはプロドラッグでありうる。本発明に使用する特定の治療化合物が非対称置換炭素原子を含みうること、従って該化合物を光学活性形態またはラセミ形態として単離しうることは理解されよう。光学的に活性な出発物質からラセミ形態の分割または合成などにより光学活性形態を調製する方法は、当分野で周知である。同様に、治療化合物のシスおよびトランス幾何異性体についても記載されているので、これらを異性体混合物、または別々の異性体形態として単離しうることが分かる。具体的な立体化学または異性体形態が具体的に示されている場合を除き、ある構造の全てのキラル形態、ジアステレオマー形態、ラセミ形態および全ての幾何異性形態が対象となる。
【0037】
治療化合物が所定の製剤構成要素に可溶である必要はない。治療化合物は、製剤のポリマーマトリクス中に溶けるか、部分的に溶けるかまたは懸濁しうるものであればよい。治療化合物は使用する熱溶融押し出し加工条件において安定であることが必要である。安定であるとは、治療化合物の大部分が熱溶融押し出し加工中に著しく崩壊したり分解したりしないことを意味する。
【0038】
本発明の製剤中で熱成形しうる治療化合物は、単なる具体例であって限定するものではないが、炎症、痛風、高コレステロール血症、微生物感染症、AIDS、結核、真菌感染症、アメーバ感染症、寄生虫感染症、癌、腫瘍、臓器拒絶反応、糖尿病、心不全、関節炎、喘息、疼痛、鬱血、尿路感染症、膣感染症、発作関連障害、鬱病、精神病、痙攣、糖尿病、血液凝固、高血圧および受胎調節などの適応症を治療するために使用することができる。
【0039】
以下の治療化合物は、本発明の医薬品製剤により投与しうるAPIの具体例である。このリストは例示を目的としたものであって、他を除外するものではない。
【0040】
(1) アスピリン、アセトアミノフェン、ジフルニサルなどの鎮痛薬、
(2) リドカイン、プロカイン、ベンゾカイン、キシロカインなどの麻酔薬、
(3) フェニルブタゾン、インドメタシン、スリンダク、デキサメタゾン、イブプロフェン、アロプリノール、オキシフェンブタゾン、プロベネシド、コルチゾン、ヒドロコルチゾン、ベタメタゾン、デキサメタゾン、フルオコルトロン、プレドニゾロン、トリアムシノロン、インドメタシン、スリンダクならびにその塩および対応する硫化物などの抗関節炎薬および抗炎症薬、
(4) テオフィリン、エフェドリン、ジプロピオン酸ベルクロメタゾン、エピネフリンなどの抗喘息薬、
(5) スルファメトキサゾール、トリメトプリム、ニトロフラントイン、ノルフロキサシンなどの尿路消毒薬、
(6) へパリン、ビスヒドロキシクマリン、ワルファリンなどの抗凝固剤、
(7) ジフェニルヒダントイン、ジアゼパムなどの抗痙攣薬、
(8) アミトリプチリン、クロルジアゼポキシド、ペルフェナジン、プロトリプチリン、イミプラミン、ドキセピンなどの抗鬱薬、
(9) インスリン、トルブタミド、トラザミド、ソマトトロピン、アセトヘキサミド、クロルプロパミドなどの糖尿病の治療および血糖値の調節において有用な物質、
(10) アドリアマイシン、フルオロウラシル、メトトレキサート、アスパラギナーゼなどの抗新生物薬、
(11) プロクロルペラジン、炭酸リチウム、クエン酸リチウム、チオリダジン、モリンドン、フルフェナジン、トリフルオペラジン、ペルフェナジン、アミトリプチリン、トリフルプロマジンなどの抗精神病薬、
(12) スピロノラクトン、メチルドーパ、ヒドララジン、クロニジン、クロロチアジド、デセルピジン、チモロール、プロプラノロール、メタプロトール(metaprotol)、塩酸プラゾシン、レセルピンなどの降圧薬、
(13) メファラン、ダンブロレン(danbrolene)、シクロベンザプリン、メトカルバモール、ジアゼパム、塩化スクシノイルなどの筋弛緩薬、
(14) クロラムフェニコール、クロロキン、トリメトプリムおよびスルファメトキサゾールなどの抗原虫薬、
(15) ノノキシノールなどの殺精子剤、
(16) βラクタム系抗生物質、テトラサイクリン、クロラムフェニコール、ネオマイシン、セフォキシチン、チエナマイシン、グラミシジン、バシトラシン、スルホンアミド、アミノグリコシド系抗生物質、トブラマイシン、ニトロフラゾン、ナリジクス酸および類似物質などの抗菌物質、ならびにフルダラニン/ペンチジドン(pentizidone)からなる抗菌薬の組み合わせ、
(17) ペリラミン、クロルフェニラミン、テトラヒドロゾリンおよびアンタゾリンなどの抗ヒスタミン薬および充血除去剤、
(18) イベルメクチンなどの駆虫化合物、ならびに
(19) アシクロビルおよびインターフェロンなどの抗ウイルス性化合物。
【0041】
E 任意成分
本発明の押し出し可能な組成物ならびに押し出し製品および医薬製剤は、1つ以上の機能性賦形剤をさらに含みうる。これらの賦形剤は、放出調節剤、充填剤、加工剤および種々雑多な添加剤に大別される。種々の賦形剤を選択および使用することにより、従来の剤形の場合と同様にして本発明の組成物に特定の性質を付与することができる。かかる賦形剤の非限定的なリストには、放出速度調節剤(release rate modifier)、色素、流動助剤(flow aids)、界面活性剤、抗凝集剤(anti-agglomerating agents)、二次接着剤(secondary binders)、二次剥離剤(secondary detackifiers)などが含まれる。
【0042】
放出速度調節剤は、押し出しに先立って押し出し可能な成分に加えた場合に、押し出しマトリクスからのAPIの放出に影響を及ぼす物質である。本発明の殆どの態様では、該放出速度調節剤は、押し出しポリマーマトリクスからのAPIの放出速度を持続させる物質である。以下は、この目的に見合う物質の非限定的なリストである:ヒドロキシプロピルセルロース(HPC)、ポリ(エチレンオキシド)(PEO)、ヒドロキシプロピルメチルセルロース(HPMC)またはヒプロメロース(メトセル(Methocel)(登録商標))、エチルセルロース、セルロース系ポリマー、アクリルポリマー、脂肪(fat)、ワックス、脂質、ポリカルボフィル、カルボマー(carbomer)、多糖類およびそれらの混合物。好適な態様では、該放出速度調節剤はNoveon(Cleveland, OH)の製品であるカルボポール(Carbopol)934のようなカルボマーである。940、941、974、980、981などの他のカルボポールを使用してもよい。
【0043】
本発明の押し出し可能な組成物に含める前記放出速度調節剤の量は、約1〜約40重量%であり、好ましくは約2〜約30重量%である。
【0044】
前記色素は、FD&CもしくはD&Cレーキ、二酸化チタン、炭酸マグネシウム、タルク、焼成シリカ(pyrogenic silica)、酸化鉄、チャンネルブラック、リボフラビン、カルミン40、クルクミン、アンナット、不溶性染料、雲母および/もしくは二酸化チタンベースの真珠光沢色素またはそれらの混合物でありうる。適切な色素の他の具体例は、Jeffriesの米国特許第3,149,040号、Butlerらの米国特許第3,297,535号、およびColorconの米国特許第3,981,984号に記載されている(これらの特許文献は全て、参照により本明細書中に含めるものとする)。また該色素は、可塑剤とOPADRYで着色したコーティング組成物とを含有するレーキ混合物を含んでいてもよく、その一部は米国特許第4,543,370号(この特許文献は参照により本明細書中に含めるものとする)に開示されている。好ましくは、該色素は、押し出し可能な組成物の0重量%〜約50重量%を占める。
【0045】
前記流動助剤は、Cabot社からCab-O-Silという商品名で提供されているフュームドシリカなどのシリカでありうる。該流動助剤は、乾式混合とそれに続く混合機から保存容器への移送時の粉末組成物に流動性を付与する。好ましくは、該流動助剤は、押し出し可能な組成物の0重量%〜約3重量%を占める。
【0046】
前記界面活性剤は、ラウリル硫酸ナトリウム、ジオクチルスルホコハク酸ナトリウム、Tween 80などのポリソルベート、ソルビトールなどのポリオールまたはそれらの混合物でありうる。グリセリン、PEG、PPGなどの他の湿潤剤も意図される。好ましくは、該界面活性剤および/または湿潤剤は、押し出し可能な組成物の0重量%〜約5重量%を占める。
【0047】
前記抗凝集剤は、カオリンでありうる。本発明のドライコーティング組成物中の抗凝集剤の量は、押し出し可能な組成物の0重量%〜約40重量%とする。有益なことに、カオリンは抗凝集剤と剥離剤の両方の役目を果たす。
【0048】
前記二次接着剤は、キサンタンガム、アルギン酸ナトリウム、アルファ化澱粉、アルギン酸プロピレングリコール、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシエチルセルロース(HEC)、カルボキシメチルセルロースナトリウム(CMCナトリウム)、ポリビニルピロリドン(PVP)、コンニャク粉、カラギーナン、他のフィルム形成ポリマーまたはそれらの混合物でありうる。好ましくは、コーティング組成物中の二次フィルム形成物質の量は、本発明のドライコーティング組成物の0重量%〜約5重量%とする。
【0049】
前記二次剥離剤は、硫酸ナトリウム、硫酸カルシウム、塩化カルシウム、他の無機もしくは有機水分捕捉剤(water-sequestering agent)またはそれらの混合物でありうる。好ましくは、コーティング組成物中の二次剥離剤の量は、本発明のドライコーティング組成物の0重量%〜約5重量%とする。
【実施例】
【0050】
以下の実施例は本発明の理解を深めるためのものであって、決して本発明の有効範囲を限定するものではない。以下の材料を使用した。
【表1】

【0051】
熱溶融押し出し
Acryl-EZE(登録商標)のみを含有する乾燥粉末製剤ならびにAcryl-EZE、APIおよび機能性賦形剤を含有する粉末混合物を、熱溶融押し出しに先立って陶器のすり鉢とすりこぎで5分間混合した。液状の可塑剤であるTECをこの製剤中に含める場合には、5分間混合する前に、該可塑剤をすり鉢内のAcryl-EZE(登録商標)に幾何級数的に加えた。この乾燥粉末製剤を、Randcastle Microtruder(登録商標) RCP-0750 (Cedar Grove、NJ)単軸押し出し機を使用して押し出した。該押し出し機には、Nitralloy 135Mスクリュー(供給部、圧縮部および混練部を含むフライト形状の圧縮比は3:1)および丸ダイ(直径6 mm)が備わっていた。全製剤に対して用いたスクリュー速度は15〜20rpmであった。押し出し機のバレルゾーンとダイの温度は、外部の温度制御装置を使用して変更した。製剤は、押し出し機の各ゾーンおよびダイを設定温度に合わせてからホッパーに供給した。押し出し物は、25℃に冷却してから手作業で切断して錠剤とした。グアイフェニシン錠の重さはおよそ280 mgであったが、テオフィリン錠の重さはおよそ215 mgであった。
【0052】
薬物放出試験
溶出試験を行う際には、該試験を、オートサンプラー(VK8000型)を備えたVan Kel VK7000溶出試験装置上で、米国薬局方第24局記載の装置2(パドル法)に従って実施した。腸溶出試験は、2時間の酸性ステージ(pH 1.2、0.1 N HCl)とその後8時間の緩衝ステージ(pH 6.8、50 mmolのリン酸緩衝溶液)を含む米国薬局方第24局記載の方法Bに従って実施した。溶出試験用の容器容積900 mLを37℃で維持し、50 rpmで攪拌した。10時間にわたり、所定の時点で試料を取り出した。
【0053】
前記試料を、その薬物含量について、276 nmでグアイフェニシンを、また281 nmでテオフィリンを抽出するフォトダイオードアレイ検出器(996型)を備えたWatersの高性能液体クロマトグラフィー(HPLC)系を使用して分析した。試料は、予め0.2μmメンブレン(Gelman Laboratory、GHP Acrodisc)に通して濾過することにより不溶性の賦形剤を除去しておいた。オートサンプラー(717プラス型)を使用して20μLの試料を注入した。データは、Empower(登録商標)バージョン5.0ソフトウェアを使用して回収および積算した。グアイフェニシンの分析に使用したカラムはAlltech Alltima(商標) C18 10μm、250×4.1 mmであった。移動相には、水:メタノール:氷酢酸(体積比は600:400:15)からなる混合物が含まれていた。溶媒は、0.45μmのナイロン膜を通して真空濾過してから、WatersのIn-Line Degasser AFを使用して脱気した。流速は1.5 mL/分とした。グアイフェニシンの保持時間は3.5分であった。2〜200 mg/μLの範囲で線形性(R2>0.997)が示され、また10回の注入に対する注入再現性は0.35%相対標準偏差であった。テオフィリンの分析に使用したカラムは、Alltech Inertsil(商標) ODS-3 3μm、150×4.6 mmであった。移動相には、水:アセトニトリル:氷酢酸(体積比は845:150:5)からなる混合物および1.156 g/Lの酢酸ナトリウム三水和物が含まれていた。テオフィリンの保持時間は3.6分であった。1〜100 mg/μLの範囲で線形性(R2>0.998)が示され、また6回の注入に対する注入再現性は1%相対標準偏差であった。
【0054】
実施例1〜2
比較
これらの実施例では、製品Acryl-EZEを含有するアクリル系腸溶ポリマーを単独で押し出した。
【0055】
実施例1
【表2】

【0056】
実施例2
【表3】

【0057】
実施例3
本実施例では、押し出しに先立って、前記混合物に可塑剤であるクエン酸トリエチル(TEC)を加えた。
【表4】

【0058】
実施例4
比較
本実施例では、可塑剤は使用せず、押し出しに先立って前記混合物にAPIとしてテオフィリンを含めた。
【表5】

【0059】
実施例5〜6
これらの実施例では、可塑剤は使用せず、押し出しに先立って前記混合物にAPIとしてグアイフェニシンを含めた。
【表6】

【0060】

【0061】
ここで図1を参照し、動作温度が熱成形錠剤のグアイフェニシン放出プロフィールに及ぼす影響について検討する。いずれの場合も、錠剤は80%のAcryl-EZEと20%のグアイフェニシンを含有する押し出し物から調製した。溶出条件は、pH 1.2の媒質中で2時間、その後はpH 6.8の媒質中で8時間、900 mL、37℃、50 rpm、n = 6とした。押し出し機のゾーン温度における変化は、本実施例における錠剤のin vitro溶出にはわずかな効果しか及ぼさなかったことが分かる。
【0062】
実施例7〜8
これらの実施例では、ポリマー、可塑剤およびAPIを含めた。
【表7】

【0063】

【0064】
ここで図2を参照すると、実施例7および8の製品を含むように調製した錠剤の放出プロフィールが提供されている。具体的には、薬物:ポリマー比を実施例7から実施例8へと変更した場合に観察される差があるかどうかを確認する証拠を探した。溶出条件は、pH 1.2の媒質中で2時間、その後はpH 6.8の媒質中で8時間、900 mL、37℃、50 rpm、n = 6とした。約2〜4時間後に放出される薬物の量は、押し出し加工時に含める薬物の量が多いほど増加したことが分かる。
【0065】
実施例9〜10
これらの実施例では、ポリマー、可塑剤、APIおよびモノステアリン酸グリセロール(GMS)を含めた。
【表8】

【0066】

【0067】
ここで図3を参照すると、GMSを含めることの効果が示されている。0%のGMSを有する製品である実施例7の製品を基準として使用し、実施例8および9の製品の放出プロフィールを比較した。溶出条件は、pH 1.2の媒質中で2時間、その後はpH 6.8の媒質中で8時間、900 mL、37℃、50 rpm、n = 6とした。GMSが存在すると、特に約3時間後以降に放出されるテオフィリンの量が減少することが分かる。薬物が完全に放出されるのは約6時間後から約8時間後と若干遅くなる。含めるGMSの量は、この期間において放出速度を低下させるという点では幾らかの効果を有するが、使用する量を2倍(実施例8)にしても、実施例9で使用した量と比べて薬物が放出される時間が延長されることはなかった。
【0068】
実施例11〜13
これらの実施例では、ポリマー、可塑剤、APIおよび放出速度調節剤を含めた。
【表9】

【0069】

【0070】

【0071】
ここで図4を参照すると、カルボマー(Carbomer)934が上記の通りに調製した熱成形錠剤のテオフィリン放出プロフィールに及ぼす影響が示されている。基準製剤はここでも実施例7の製品(例えば、0%のカルボマー934、20%のテオフィリン、64%のAcryl-EZE、16%のTEC(Acryl-EZEを基準とすると25%))とした。
【0072】
押し出し物中にカルボマー934が存在すると、薬物が放出される時間が有意に延長されることが分かる。溶出条件は、pH 1.2の媒質中で2時間、その後はpH 6.8の媒質中で8時間、900 mL、37℃、50 rpm、n = 6とした。また、2.5%のカルボマー934を用いるとゼロ次またはほぼゼロ次の放出パターンが提供されるが、カルボマー934の量を5%から10%に増やしてもその延長された放出プロフィールに本質的な差はみられないということも分かる。実際は、意外なことに、カルボマー934の量を増やすと、2.5%カルボマー934押し出し物を用いて達成される場合よりも急速に薬物が放出された。
【0073】
実施例14〜17
これらの実施例では、ポリマー、可塑剤、APIおよび放出速度調節剤を含めた。
【表10】

【0074】

【0075】

【0076】

【0077】
ここで図5を参照すると、メトセルK4Mが上記の通りに調製した熱成形錠剤のテオフィリン放出プロフィールに及ぼす影響が示されている。基準製剤は、実施例7と同じ製剤であるが異なる加工パラメーターを持つ実施例17の製品である。溶出条件は、0.1 N HCl媒質中で2時間、その後はpH 6.8の媒質中で8時間、900 mL、37℃、50 rpm、n = 6とした。
【0078】
実施例17に用いるスクリュー速度、駆動アンペアおよび圧力が高くなると、実施例7の製品と比べて、溶出試験で0〜2時間後に放出されるテオフィリンの量が減少したことが分かる。実施例7の製品の溶出プロフィールは図2〜4に示してある。メトセルが基準製剤と比べて2〜10時間後の薬物の放出速度を低下させたことも分かる。さらに、5%メトセルを含有する錠剤は、2.5%メトセルを含有する製品と比べて、pH 6.8の媒質における薬物放出速度をより有意に低下させた。しかし、メトセルの濃度を高めると、0.1 N HCl媒質における薬物放出は増大した。
【0079】
実施例18〜20
これらの実施例では、ポリマー、可塑剤、APIおよび放出速度調節剤を含めた。
【表11】

【0080】

【0081】

【0082】
ここで図6を参照すると、カルボポール974P が、実施例18〜20に記載されている通りに調製した溶融押し出し錠からのテオフィリン放出速度に及ぼす影響が示されている。溶出条件は、0.1 N HCl中で2時間、その後はpH 6.8の媒質中で22時間、900 mL、37°C、50 rpm、n = 6とした。基準製剤は、ここでも実施例17の製品(例えば、0%のカルボポール974P、20%のテオフィリン、64%のAcryl-EZE、16%のTEC(Acryl-EZEを基準とすると25%))とした。
【0083】
カルボマー934を含有する押し出し物について述べたように、カルボポール974Pが存在すると、テオフィリンが放出される時間が有意に延長される。2.5%のカルボポールを含有する錠剤は、溶出試験でおよそ20時間にわたって薬物を放出し続けた。5または10%のカルボポールを含有する製品の溶出プロフィール間には有意な差が見られず、またこれらのプロフィールはほぼゼロ次の放出パターンを示し、試験開始およそ14時間後に完全に薬物が放出された。全ての実施例において、カルボポールの存在により、0.1 N HCl媒質中で放出されるテオフィリンの量が増大した。
【0084】
ここで図7を参照すると、カルボポール974Pを含有する溶融押し出しAcryl-EZEマトリクス錠剤を、シリカ乾燥剤入りの誘導密閉HDPE容器中で40℃/75%RHにて3ヶ月間保存した場合の、該錠剤からのテオフィリン放出速度の安定性が示されている。試験した製剤は、実施例14、15および16の製品であった。溶出条件は、0.1 N HCl媒質中で2時間、その後はpH 6.8の媒質中で8時間、900 mL、37°C、50 rpm、n = 6とした。保存前および保存後の溶出プロフィールを重ね合わせることができたので、2.5、5および10%のカルボポールを含有する錠剤は加速条件で保存した場合にも安定であったことが分かる。
【0085】
実施例21
上記実施例で調製した組成物に対して「薬物放出試験」の項の第2段落に記載の含量均一性試験を行って作成したデータを、以下に示す。
【表12】

【0086】
上記データは、本発明の方法により、再現性がありかつその薬物含量均一性に高度に一貫性がみられる製品が提供されることを示している。該方法は、液状TECおよびカルボマーが含まれている場合でも非常に効率が良い。該製品は、押し出し機に1回通すだけで作製することができる。
【0087】
現段階で本発明の好適な実施形態と考えられるものについて記載してきたが、当業者であれば、本発明の精神から逸脱することなく本発明に変更および修正を加えうることが分かるだろう。本発明の真の範囲内にある全てのかかる変更および修正についても権利を主張するものとする。
【図面の簡単な説明】
【0088】
【図1】図1は、実施例5〜6の熱溶融押し出し組成物を含有する錠剤からの、グアイフェニシンのin vitro放出プロフィールを示すグラフである。
【図2】図2は、実施例7〜8の熱溶融押し出し組成物を含有する錠剤からの、テオフィリンのin vitro放出プロフィールを示すグラフである。
【図3】図3は、実施例9〜10の熱溶融押し出し組成物を含有する錠剤からの、テオフィリンのin vitro放出プロフィールを示すグラフである。
【図4】図4は、種々の量のカルボマーを含有し、かつ実施例11〜13に従って調製した錠剤の持続放出プロフィールを示すグラフである。
【図5】図5は、実施例15〜17の熱溶融押し出し組成物を含有する錠剤からの、テオフィリンのin vitro放出プロフィールを示すグラフである。
【図6】図6は、実施例18〜20の熱溶融押し出し組成物を含有する錠剤からの、テオフィリンのin vitro放出プロフィールを示すグラフである。
【図7】図7は、Acryl-EZEおよび種々の量のカルボポール974Pを含む熱溶融押し出し組成物を含有する錠剤からの、40℃/75%RHにおける3ヶ月間の保存前後の、テオフィリンのin vitro放出プロフィールを示すグラフである。
【特許請求の範囲】
【請求項1】
(i) (a) 20〜85重量パーセントの、少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分、
(b) 80〜15重量パーセントの、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、および
(c) 0〜30重量パーセントの、(a)および(b)と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分
を含むアクリル樹脂を含有する熱成形可能なアクリルポリマー接着剤、ならびに
(ii) 有効量のアクリルポリマー可塑剤
を含む熱成形可能な組成物。
【請求項2】
医薬品として有効な組成物をさらに含む、請求項1に記載の組成物。
【請求項3】
反応後に(i)(b)の酸性基の0.1〜10モルパーセントが塩形態で存在するように前記アクリル樹脂と反応しうるアルカリ化剤をさらに含む、請求項1に記載の組成物。
【請求項4】
剥離剤をさらに含む、請求項1に記載の組成物。
【請求項5】
前記可塑剤が約4.0〜約40重量%の量で存在する、請求項1に記載の組成物。
【請求項6】
前記可塑剤が約7〜約35重量%の量で存在する、請求項5に記載の組成物。
【請求項7】
前記可塑剤が約10〜約30重量%の量で存在する、請求項6に記載の組成物。
【請求項8】
前記可塑剤が、クエン酸トリエチル、トリ酢酸グリセリル、モノステアリン酸グリセリル、クエン酸アセチルトリエチル、セバシン酸ジブチル、フタル酸ジエチル、ポリエチレングリコール、グリセロール、ヒマシ油、およびそれらの混合物からなる群より選択される、請求項1に記載の組成物。
【請求項9】
前記可塑剤がクエン酸トリエチルである、請求項1に記載の組成物。
【請求項10】
前記の押し出し可能なアクリルポリマー接着剤が約10〜約80重量%の量で存在する、請求項1に記載の組成物。
【請求項11】
前記の押し出し可能なアクリルポリマー接着剤が約15〜約70重量%の量で存在する、請求項1に記載の組成物。
【請求項12】
前記の押し出し可能なアクリルポリマー接着剤が約20〜約60重量%の量で存在する、請求項1に記載の組成物。
【請求項13】
前記の医薬品として有効な組成物の量が約0.001〜約85重量%である、請求項1に記載の組成物。
【請求項14】
前記の医薬品として有効な組成物の量が約1.0〜約60重量%である、請求項1に記載の組成物。
【請求項15】
前記剥離剤が、タルク、アルミニウム水和物、モノステアリン酸グリセリル、カオリン、およびそれらの混合物からなる群より選択される、請求項4に記載の組成物。
【請求項16】
色素、流動助剤、界面活性剤、抗凝集剤、二次接着剤、二次剥離剤およびそれらの混合物からなる群より選択されるメンバーをさらに含む、請求項1に記載の組成物。
【請求項17】
放出速度調節剤をさらに含む、請求項1に記載の組成物。
【請求項18】
前記放出速度調節剤が、ヒドロキシプロピルセルロース(HPC)、ポリ(エチレンオキシド)(PEO)、ヒドロキシプロピルメチルセルロース(HPMC)、エチルセルロース、セルロース系ポリマー、アクリルポリマー、脂肪、ワックス、脂質、およびそれらの混合物からなる群より選択される、請求項17に記載の組成物。
【請求項19】
前記放出速度調節剤が、ポリカルボフィル、カルボマー、多糖類およびそれらの混合物からなる群より選択される、請求項17に記載の組成物。
【請求項20】
前記の制御放出速度調節剤が約1〜約40重量%の量で存在する、請求項17に記載の組成物。
【請求項21】
前記の制御放出速度調節剤が約2〜約30重量%の量で存在する、請求項20に記載の組成物。
【請求項22】
前記色素が、FD&CおよびD&Cレーキ、二酸化チタン、炭酸マグネシウム、タルク、焼成シリカ、酸化鉄、チャンネルブラック、リボフラビン、カルミン40、クルクミン、アンナット、不溶性染料、雲母および/または二酸化チタンベースの真珠光沢色素ならびにそれらの混合物からなる群より選択される、請求項16に記載の組成物。
【請求項23】
前記流動助剤が、シリカ、アルミナ、二酸化ケイ素、タルク、ステアリン酸、およびステアリン酸金属からなる群より選択され、かつ前記界面活性剤または湿潤剤が、ラウリル硫酸ナトリウム、ジオクチルスルホコハク酸ナトリウム、ポリソルベート、Tween 80、酸化プロピレンのコポリマー、エチレンオキシド、ステアリン酸スクロース、クレモフォール、エマルフォール(emulphor)、グリセリン、PEG、PPG、およびHLBが10より高い親水性界面活性剤、ならびにそれらの混合物からなる群より選択される、請求項16に記載の組成物。
【請求項24】
前記アクリル酸アルキルがアクリル酸エチルであり、前記の塩を形成しうるカルボン酸基を有するビニルまたはビニリデン部分がメタクリル酸であり、かつ前記アルカリ化剤が、ナトリウムもしくはカリウムの重炭酸塩、炭酸塩、リン酸塩、および水酸化物、炭酸マグネシウム、水酸化マグネシウム、炭酸アンモニウム、重炭酸アンモニウム、酸化マグネシウム、水酸化カルシウム、またはそれらの混合物からなる群より選択される、請求項1に記載の組成物。
【請求項25】
前記抗凝集剤がカオリンである、請求項16に記載の組成物。
【請求項26】
前記二次接着剤が、キサンタンガム、アルギン酸ナトリウム、アルギン酸プロピレングリコール、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシエチルセルロース(HEC)、カルボキシメチルセルロースナトリウム(CMCナトリウム)、ポリビニルピロリドン(PVP)、コンニャク粉、カラギーナン、アルファ化澱粉、他のフィルム形成ポリマーおよびそれらの混合物からなる群より選択される、請求項16に記載の組成物。
【請求項27】
前記二次剥離剤が、硫酸ナトリウム、硫酸カルシウム、塩化カルシウム、他の無機または有機水分捕捉剤およびそれらの混合物からなる群より選択される、請求項16に記載の組成物。
【請求項28】
(i) (a) 20〜85重量パーセントの、少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分、
(b) 80〜15重量パーセントの、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、および
(c) 0〜30重量パーセントの、(a)および(b)と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分
を含むアクリル樹脂を含有する熱成形可能なアクリルポリマー接着剤を、有効量のアクリルポリマー可塑剤と混合すること、そして
(ii) ステップ(i)の結果として取得した混合物を押し出し機で押し出すこと
を含む、熱成形組成物を調製する方法。
【請求項29】
医薬品として有効な組成物を、前記の押し出し可能なアクリルポリマーおよび前記可塑剤と、前記混合物の押し出しに先立って混合することをさらに含む、請求項28に記載の方法。
【請求項30】
反応後に(i)(b)の酸性基の0.1〜10モルパーセントが塩形態で存在するように、前記アクリル樹脂と反応しうるアルカリ化剤を、前記の押し出し可能なアクリルポリマーおよび前記可塑剤と、前記混合物の押し出しに先立って混合することをさらに含む、請求項28に記載の方法。
【請求項31】
剥離剤を、前記の押し出し可能なアクリルポリマーおよび前記可塑剤と、前記混合物の押し出しに先立って混合することをさらに含む、請求項28に記載の方法。
【請求項32】
放出速度調節剤、色素、流動助剤、界面活性剤、抗凝集剤、二次接着剤、二次剥離剤およびそれらの混合物からなる群のメンバーを、前記の押し出し可能なアクリルポリマーおよび前記可塑剤と、前記混合物の押し出しに先立って混合することをさらに含む、請求項28に記載の方法。
【請求項33】
前記の押し出しを、供給ゾーン、圧縮ゾーン、混合ゾーンおよび出口ダイを有する単軸押し出し機において実行する、請求項28に記載の方法。
【請求項34】
押し出し機から排出されて得られた押し出し混合物を球状化することをさらに含む、請求項28〜33のいずれか1項に記載の方法。
【請求項35】
押し出し機から排出された押し出し混合物をペレット化することをさらに含む、請求項28〜33のいずれか1項に記載の方法。
【請求項36】
押し出し機から排出されて得られた押し出し混合物を粉砕することをさらに含む、請求項28〜35のいずれか1項に記載の方法。
【請求項37】
押し出し機から排出された押し出し混合物を冷却することをさらに含む、請求項28〜35のいずれか1項に記載の方法。
【請求項38】
前記の得られた押し出し混合物を圧縮して医薬製剤とすることをさらに含む、請求項28〜37のいずれか1項に記載の方法。
【請求項39】
前記の得られた押し出し混合物をカプセル化することをさらに含む、請求項28〜37のいずれか1項に記載の方法。
【請求項40】
請求項28〜37のいずれか1項に記載の方法により取得した製品を含有する医薬製剤。
【請求項41】
請求項2に記載の組成物を含む医薬製剤。
【請求項42】
ゼロ次またはほぼゼロ次の放出特性を有する、請求項40または41に記載の医薬製剤。
【請求項43】
フィルムコーティングをさらに含む、請求項40または41に記載の医薬製剤。
【請求項44】
請求項40または41に記載の医薬製剤であって、前記の医薬品として有効な組成物を必要とする患者に投与した後8〜24時間にわたって該組成物を放出する医薬製剤。
【請求項45】
(i) (a) 20〜85重量パーセントの、少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分、
(b) 80〜15重量パーセントの、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、および
(c) 0〜30重量パーセントの、(a)および(b)と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分
を含むアクリル樹脂を含有する押し出し可能なアクリルポリマー接着剤、ならびに
(ii) 有効量の可塑剤
を含む熱成形可能な組成物。
【請求項46】
医薬品として有効な組成物をさらに含む、請求項45に記載の組成物。
【請求項47】
(a) 約20〜約80重量%のEudragit L100-55、
(b) 約15〜約60重量%のクエン酸トリエチル、および
(c) 約19〜約76重量%のタルク
を含む熱成形可能な組成物。
【請求項1】
(i) (a) 20〜85重量パーセントの、少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分、
(b) 80〜15重量パーセントの、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、および
(c) 0〜30重量パーセントの、(a)および(b)と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分
を含むアクリル樹脂を含有する熱成形可能なアクリルポリマー接着剤、ならびに
(ii) 有効量のアクリルポリマー可塑剤
を含む熱成形可能な組成物。
【請求項2】
医薬品として有効な組成物をさらに含む、請求項1に記載の組成物。
【請求項3】
反応後に(i)(b)の酸性基の0.1〜10モルパーセントが塩形態で存在するように前記アクリル樹脂と反応しうるアルカリ化剤をさらに含む、請求項1に記載の組成物。
【請求項4】
剥離剤をさらに含む、請求項1に記載の組成物。
【請求項5】
前記可塑剤が約4.0〜約40重量%の量で存在する、請求項1に記載の組成物。
【請求項6】
前記可塑剤が約7〜約35重量%の量で存在する、請求項5に記載の組成物。
【請求項7】
前記可塑剤が約10〜約30重量%の量で存在する、請求項6に記載の組成物。
【請求項8】
前記可塑剤が、クエン酸トリエチル、トリ酢酸グリセリル、モノステアリン酸グリセリル、クエン酸アセチルトリエチル、セバシン酸ジブチル、フタル酸ジエチル、ポリエチレングリコール、グリセロール、ヒマシ油、およびそれらの混合物からなる群より選択される、請求項1に記載の組成物。
【請求項9】
前記可塑剤がクエン酸トリエチルである、請求項1に記載の組成物。
【請求項10】
前記の押し出し可能なアクリルポリマー接着剤が約10〜約80重量%の量で存在する、請求項1に記載の組成物。
【請求項11】
前記の押し出し可能なアクリルポリマー接着剤が約15〜約70重量%の量で存在する、請求項1に記載の組成物。
【請求項12】
前記の押し出し可能なアクリルポリマー接着剤が約20〜約60重量%の量で存在する、請求項1に記載の組成物。
【請求項13】
前記の医薬品として有効な組成物の量が約0.001〜約85重量%である、請求項1に記載の組成物。
【請求項14】
前記の医薬品として有効な組成物の量が約1.0〜約60重量%である、請求項1に記載の組成物。
【請求項15】
前記剥離剤が、タルク、アルミニウム水和物、モノステアリン酸グリセリル、カオリン、およびそれらの混合物からなる群より選択される、請求項4に記載の組成物。
【請求項16】
色素、流動助剤、界面活性剤、抗凝集剤、二次接着剤、二次剥離剤およびそれらの混合物からなる群より選択されるメンバーをさらに含む、請求項1に記載の組成物。
【請求項17】
放出速度調節剤をさらに含む、請求項1に記載の組成物。
【請求項18】
前記放出速度調節剤が、ヒドロキシプロピルセルロース(HPC)、ポリ(エチレンオキシド)(PEO)、ヒドロキシプロピルメチルセルロース(HPMC)、エチルセルロース、セルロース系ポリマー、アクリルポリマー、脂肪、ワックス、脂質、およびそれらの混合物からなる群より選択される、請求項17に記載の組成物。
【請求項19】
前記放出速度調節剤が、ポリカルボフィル、カルボマー、多糖類およびそれらの混合物からなる群より選択される、請求項17に記載の組成物。
【請求項20】
前記の制御放出速度調節剤が約1〜約40重量%の量で存在する、請求項17に記載の組成物。
【請求項21】
前記の制御放出速度調節剤が約2〜約30重量%の量で存在する、請求項20に記載の組成物。
【請求項22】
前記色素が、FD&CおよびD&Cレーキ、二酸化チタン、炭酸マグネシウム、タルク、焼成シリカ、酸化鉄、チャンネルブラック、リボフラビン、カルミン40、クルクミン、アンナット、不溶性染料、雲母および/または二酸化チタンベースの真珠光沢色素ならびにそれらの混合物からなる群より選択される、請求項16に記載の組成物。
【請求項23】
前記流動助剤が、シリカ、アルミナ、二酸化ケイ素、タルク、ステアリン酸、およびステアリン酸金属からなる群より選択され、かつ前記界面活性剤または湿潤剤が、ラウリル硫酸ナトリウム、ジオクチルスルホコハク酸ナトリウム、ポリソルベート、Tween 80、酸化プロピレンのコポリマー、エチレンオキシド、ステアリン酸スクロース、クレモフォール、エマルフォール(emulphor)、グリセリン、PEG、PPG、およびHLBが10より高い親水性界面活性剤、ならびにそれらの混合物からなる群より選択される、請求項16に記載の組成物。
【請求項24】
前記アクリル酸アルキルがアクリル酸エチルであり、前記の塩を形成しうるカルボン酸基を有するビニルまたはビニリデン部分がメタクリル酸であり、かつ前記アルカリ化剤が、ナトリウムもしくはカリウムの重炭酸塩、炭酸塩、リン酸塩、および水酸化物、炭酸マグネシウム、水酸化マグネシウム、炭酸アンモニウム、重炭酸アンモニウム、酸化マグネシウム、水酸化カルシウム、またはそれらの混合物からなる群より選択される、請求項1に記載の組成物。
【請求項25】
前記抗凝集剤がカオリンである、請求項16に記載の組成物。
【請求項26】
前記二次接着剤が、キサンタンガム、アルギン酸ナトリウム、アルギン酸プロピレングリコール、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシエチルセルロース(HEC)、カルボキシメチルセルロースナトリウム(CMCナトリウム)、ポリビニルピロリドン(PVP)、コンニャク粉、カラギーナン、アルファ化澱粉、他のフィルム形成ポリマーおよびそれらの混合物からなる群より選択される、請求項16に記載の組成物。
【請求項27】
前記二次剥離剤が、硫酸ナトリウム、硫酸カルシウム、塩化カルシウム、他の無機または有機水分捕捉剤およびそれらの混合物からなる群より選択される、請求項16に記載の組成物。
【請求項28】
(i) (a) 20〜85重量パーセントの、少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分、
(b) 80〜15重量パーセントの、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、および
(c) 0〜30重量パーセントの、(a)および(b)と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分
を含むアクリル樹脂を含有する熱成形可能なアクリルポリマー接着剤を、有効量のアクリルポリマー可塑剤と混合すること、そして
(ii) ステップ(i)の結果として取得した混合物を押し出し機で押し出すこと
を含む、熱成形組成物を調製する方法。
【請求項29】
医薬品として有効な組成物を、前記の押し出し可能なアクリルポリマーおよび前記可塑剤と、前記混合物の押し出しに先立って混合することをさらに含む、請求項28に記載の方法。
【請求項30】
反応後に(i)(b)の酸性基の0.1〜10モルパーセントが塩形態で存在するように、前記アクリル樹脂と反応しうるアルカリ化剤を、前記の押し出し可能なアクリルポリマーおよび前記可塑剤と、前記混合物の押し出しに先立って混合することをさらに含む、請求項28に記載の方法。
【請求項31】
剥離剤を、前記の押し出し可能なアクリルポリマーおよび前記可塑剤と、前記混合物の押し出しに先立って混合することをさらに含む、請求項28に記載の方法。
【請求項32】
放出速度調節剤、色素、流動助剤、界面活性剤、抗凝集剤、二次接着剤、二次剥離剤およびそれらの混合物からなる群のメンバーを、前記の押し出し可能なアクリルポリマーおよび前記可塑剤と、前記混合物の押し出しに先立って混合することをさらに含む、請求項28に記載の方法。
【請求項33】
前記の押し出しを、供給ゾーン、圧縮ゾーン、混合ゾーンおよび出口ダイを有する単軸押し出し機において実行する、請求項28に記載の方法。
【請求項34】
押し出し機から排出されて得られた押し出し混合物を球状化することをさらに含む、請求項28〜33のいずれか1項に記載の方法。
【請求項35】
押し出し機から排出された押し出し混合物をペレット化することをさらに含む、請求項28〜33のいずれか1項に記載の方法。
【請求項36】
押し出し機から排出されて得られた押し出し混合物を粉砕することをさらに含む、請求項28〜35のいずれか1項に記載の方法。
【請求項37】
押し出し機から排出された押し出し混合物を冷却することをさらに含む、請求項28〜35のいずれか1項に記載の方法。
【請求項38】
前記の得られた押し出し混合物を圧縮して医薬製剤とすることをさらに含む、請求項28〜37のいずれか1項に記載の方法。
【請求項39】
前記の得られた押し出し混合物をカプセル化することをさらに含む、請求項28〜37のいずれか1項に記載の方法。
【請求項40】
請求項28〜37のいずれか1項に記載の方法により取得した製品を含有する医薬製剤。
【請求項41】
請求項2に記載の組成物を含む医薬製剤。
【請求項42】
ゼロ次またはほぼゼロ次の放出特性を有する、請求項40または41に記載の医薬製剤。
【請求項43】
フィルムコーティングをさらに含む、請求項40または41に記載の医薬製剤。
【請求項44】
請求項40または41に記載の医薬製剤であって、前記の医薬品として有効な組成物を必要とする患者に投与した後8〜24時間にわたって該組成物を放出する医薬製剤。
【請求項45】
(i) (a) 20〜85重量パーセントの、少なくとも1つのアクリル酸アルキルまたはメタクリル酸アルキル部分、
(b) 80〜15重量パーセントの、塩を形成しうるカルボン酸基を有する少なくとも1つのビニルまたはビニリデン部分、および
(c) 0〜30重量パーセントの、(a)および(b)と共重合しうる少なくとも1つの他のビニルまたはビニリデン部分
を含むアクリル樹脂を含有する押し出し可能なアクリルポリマー接着剤、ならびに
(ii) 有効量の可塑剤
を含む熱成形可能な組成物。
【請求項46】
医薬品として有効な組成物をさらに含む、請求項45に記載の組成物。
【請求項47】
(a) 約20〜約80重量%のEudragit L100-55、
(b) 約15〜約60重量%のクエン酸トリエチル、および
(c) 約19〜約76重量%のタルク
を含む熱成形可能な組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公表番号】特表2007−516220(P2007−516220A)
【公表日】平成19年6月21日(2007.6.21)
【国際特許分類】
【出願番号】特願2006−532816(P2006−532816)
【出願日】平成16年5月6日(2004.5.6)
【国際出願番号】PCT/US2004/014109
【国際公開番号】WO2004/100883
【国際公開日】平成16年11月25日(2004.11.25)
【出願人】(501306494)ビーピーエスアイ ホールディングス,インコーポレーテッド (5)
【出願人】(302014206)ザ ボード オブ レジェンツ−ザ ユニバーシティー オブ テキサス システム (10)
【Fターム(参考)】
【公表日】平成19年6月21日(2007.6.21)
【国際特許分類】
【出願日】平成16年5月6日(2004.5.6)
【国際出願番号】PCT/US2004/014109
【国際公開番号】WO2004/100883
【国際公開日】平成16年11月25日(2004.11.25)
【出願人】(501306494)ビーピーエスアイ ホールディングス,インコーポレーテッド (5)
【出願人】(302014206)ザ ボード オブ レジェンツ−ザ ユニバーシティー オブ テキサス システム (10)
【Fターム(参考)】
[ Back to top ]

