アザヘリセン系化合物の製造方法、有機エレクトロルミネッセント素子用発光材料、蛍光材料、非線形光学材料及び有機バッファ層構成材料
【課題】有機EL素子、蛍光材料、非線形光学材料などの各種の光学デバイスなどに応用が期待されるアザヘリセン系化合物の新規な製造方法、及び、アザヘリセン系化合物に限定されない螺旋状の構造を有する化合物の製造方法を提供する。
【解決の手段】窒素を含有するハロゲン化アルケニルビアリール化合物を出発原料として銀塩共存下、分子内C-Hアリール化反応によりアザヘリセン系化合物を合成するアザヘリセン系化合物の製造方法、及び、窒素を含有するハロゲン化アルケニルビアリール化合物を酸化した後に、分子内C-Hアリール化反応によりアザヘリセン系化合物を合成するアザヘリセン系化合物の製造方法を用いる。
【解決の手段】窒素を含有するハロゲン化アルケニルビアリール化合物を出発原料として銀塩共存下、分子内C-Hアリール化反応によりアザヘリセン系化合物を合成するアザヘリセン系化合物の製造方法、及び、窒素を含有するハロゲン化アルケニルビアリール化合物を酸化した後に、分子内C-Hアリール化反応によりアザヘリセン系化合物を合成するアザヘリセン系化合物の製造方法を用いる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、螺旋状の立体構造を有する化合物であるアザヘリセン化合物の製造方法並びに、この製造方法によって得られたアザヘリセン化合物を用いた有機エレクトロルミネッセント素子用発光材料、蛍光材料、非線形光学材料、有機バッファ層構成材料に関する。
【背景技術】
【0002】
ヘリセン系化合物はその構造に複数の芳香環が弧を描くように互いにオルト基で縮環した螺旋構造を有するため、非平面π共役系に基づく機能、物性を有すると考えられる。そのため、ヘリセン系化合物は新規機能性有機材料として大きな関心を集めている。
【0003】
ヘリセン系化合物は螺旋の向きによる光学異性体が存在するキラルな分子でもあり、光学活性体の比旋光度は極めて大きい。加えて、ヘリセン系化合物は、芳香族同士が近接してかさなりあう構造であり、それにより生じるπ電子間の相互作用に関しても大きな関心を持たれている。そのため、これらの性質を利用して種々の応用が期待されており、近年は特に有機EL(エレクトロルミネッセント)素子、蛍光材料、非線形材料等の光学材料などの用途で応用が期待されている(例えば、特許文献1参照)。
【0004】
ヘリセン系化合物の合成法としては、光環化反応が広く知られており、例えば、Wittig反応やSiegrist反応により合成した芳香族化合物を光環化するなど、多工程を経て合成される場合が多い(例えば、非特許文献1参照)。
【0005】
また、マイクロ波を照射して光環化する方法(例えば、特許文献2参照)や、遷移金属錯体触媒を用いた分子内[2+2+2]付加環化反応(例えば、特許文献3参照)、クロスカップリング反応による合成方法も報告されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2000−195673号公報
【特許文献2】特許第4474512号公報
【特許文献3】特開2008−069104号公報
【非特許文献】
【0007】
【非特許文献1】The Journal Of Organic Chemistry、第56号、第3769頁、1991年発行
【発明の概要】
【発明が解決しようとする課題】
【0008】
ヘリセン系化合物を合成する方法として広く知られている光環化反応は高希釈条件を必要とするため、大量合成への応用に難点がある。また、その他の合成法においても収率や触媒的不斉反応への展開が困難である等の課題がある。そのため、
ヘリセン系化合物の高効率かつ基質一般性の高い合成法の開発が強く求められていた。
【0009】
そこで、本発明の目的は、有機EL素子、蛍光材料、非線形光学材料などの各種の光学デバイスなどに応用が期待される、アザヘリセン系化合物の新規な製造方法を提供することにある。
本発明のアザヘリセン系化合物の合成方法は基質への置換基導入が容易であることから本発明を使用することにより様々なアザヘリセン系化合物の入手が容易になればこの分野の研究開発が活発化されることが期待できる。
【課題を解決するための手段】
【0010】
本発明者らは上記の目的を達成すべく鋭意検討を重ねた結果、ハロゲン化アルケニルビアリール化合物を出発原料として、銀塩共存下、分子内C−Hアリール化反応行うことによりアザヘリセン誘導体が生成することを見出した。
また、ハロゲン化アルケニルビアリール化合物のヘテロ原子部位を酸化した後、リン配位子と銀塩、そしてパラジウム触媒存在下分子内C-Hアリール化反応を行うことによりアザヘリセン誘導体が高収率で生成することを見出し、本発明を完成させるに至った。
すなわち本発明は、窒素を含有するハロゲン化アルケニルビアリール化合物を出発原料として銀塩共存下、分子内C-Hアリール化反応によりアザヘリセン系化合物を合成する、アザヘリセン系化合物の製造方法である。
また本発明は、窒素を含有するハロゲン化アルケニルビアリール化合物を酸化した後に、分子内C-Hアリール化反応によりアザヘリセン系化合物を合成する、アザヘリセン系化合物の製造方法である。
また本発明は、これらの製法により得られる、有機EL素子用発光材料、蛍光材料、非線形光学材料あるいは有機バッファ層構成材料である。以下、本発明を詳細に説明する。
【0011】
本発明を使用して合成するのに好ましいアザヘリセン系化合物は以下のような構造を有する。
【0012】
【化1】

【0013】
上記の化学式(I)及び(II)における炭素1〜21は、それらの合成で使用される出発物質に依存しており炭素原子に限定されず、窒素、硫黄原子等を含んでいてもよい。
また、最終的な材料において望まれる特性を得るために、1〜21の炭素原子に結合した水素原子は置換されていても置換されていなくともよい。
水素原子が置換されている場合、置換基は、制限なしに、ハロゲン元素、アルキル基、置換されたアルキル基、アルコキシル基、置換されたアルコキシル基、チオアルコキシル基、置換されたチオアルコキシル基、シアン基、アミノ基、1つまたは2つ置換されたアミノ基、アリールチオ基、置換されたアリールチオ基、ヒドロキシ基、メルカプト基、アリールチオ基、置換されたアリールチオ基、炭素環状芳香族基、置換された炭素環状芳香族、複素環状芳香族基、置換された複素環状芳香族基、複素環基、または置換された複素環基を含んでいてもよい。
【0014】
また、上記の化学式(I)及び(II)における縮環した芳香環の数は5個であるが、この縮環する芳香環の数は限定されない。また、6員環のみならず5員環等、その他の環員数の化合物にも適応さうる。
【0015】
上記の化学式(I)に示される本発明に係るアザヘリセンの前駆体である(Z)−ハロゲン化アルキニルビアリール(3a)は次の反応式(化2)によって示されるスキーム1により、容易に製造することができる。すなわち、公知の4−イソキノリンボロン酸と1−ハロゲン化ナフトアルデヒドをパラジウム触媒下、鈴木―宮浦反応によりホルミルビアリール(1a)を得る。次いで、Wittig反応によりジハロゲン化アルケニルビアリール(2a)を得る。最後に、パラジウム触媒と水素化トリブチルスズを用いてハロゲン部分を還元し(Z)−ハロゲン化アルキニルビアリール(3a)を得ることができる。なお、下記スキーム1において、Xはハロゲン原子を示す。
また、本発明に関する前駆体である(Z)−ハロゲン化アルキニルビアリール(3a)の合成方法は限定されておらず、公知のどのような方法を使用しても良い。
【0016】
【化2】

【0017】
当初、本発明者らは次の反応式(化3)のスキーム2に示すように(Z)−ハロゲン化アルキニルビアリール(3a)から直接C-Hアリール化反応を用い、[5]N−アザヘリセン(4a)の合成に関して検討を開始した。
【0018】
【化3】

【0019】
トルエン溶媒中でパラジウム触媒、リン配位子、塩基の存在下、C-Hアリール化反応を行ったが、同定できない複雑な混合物が得られるのみであった。
そこで、上記の反応系に銀塩を添加し検討を行った。するとC-Hアリール化反応は進行し、[5]N−アザヘリセン(4a)を得ることに成功した。
【0020】
しかしながら、その収率は20%程度であり、さらに収率の向上が望まれるものであった。
そこで、(Z)−ハロゲン化アルキニルビアリール(3a)を酸化した後、C-Hアリール化反応を行うことを検討した。
具体的には、(Z)−ハロゲン化アルキニルビアリール(3a)から(化4)のスキーム2に示すように、メチルトリオキソレニウム(VII)と過酸化水素水を用い酸化反応を行い、(Z)−ハロゲン化アルケニルビアリール(5a)を得る。続いて、トルエン溶媒中でパラジウム触媒、リン配位子、塩基、分子内C-Hアリール化反応を行うことにより、[5]N−オキシドアザヘリセン(6a)の高収率での合成を達成した。
【0021】
【化4】

【0022】
なお、本発明における出発原料である(Z)−ハロゲン化アルキニルビアリール(3a)のハロゲン原子は好ましくはヨウ素原子、臭素原子であるが、金属触媒に酸化的付加が進行する置換基であれば塩素原子やトリフルオロメタンスルホニル基等でも使用することができる。また、(Z)−ブロモアルキニルビアリール(3a)から(Z)−ブロモアルケニルビアリール(5a)を得る酸化反応は数多く知られており公知のすべての方法を利用することができる。
【0023】
また、本発明におけるC-Hアリール化反応において使用される溶媒、触媒、配位子、塩基及び銀塩は上記の条件に限定されない。公知のC-Hアリール化反応で使用されているすべての溶媒、触媒、配位子、塩基及び銀塩を使用することができる。
【0024】
また、[5]N−オキシドアザヘリセン(6a)は公知の還元方法を使用することにより容易に[5]N−アザヘリセン(4a)に還元することができる。
さらに、本発明のC-Hアリール化反応において光学活性な配位子を利用することで、エナンチオ選択的に光学活性なヘリセン系化合物の合成に展開することも予測される。
【発明の効果】
【0025】
本発明の利点は、基質一般性の高い合成法が数多く報告されているビアリール化合物から螺旋構造を有するアザヘリセン系化合物を簡便かつ高収率で合成することができる点である。
【図面の簡単な説明】
【0026】
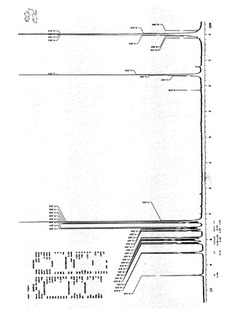
【図1】本発明に関するnaphtho[1,2-a]phenanthridineの1H−NMRを示す図であり、X軸(横軸)はδ(単位はppm)、Y軸(縦軸)の強度は任意の単位である。
【図2】本発明に関する(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline 2-oxideの1H−NMRを示す図であり、X軸(横軸)はδ(単位はppm)、Y軸(縦軸)の強度は任意の単位である。
【図3】本発明に関する(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline 2-oxideの13C−NMRを示す図であり、X軸(横軸)はδ(単位はppm)、Y軸(縦軸)の強度は任意の単位である。
【図4】本発明に関する(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline 2-oxideの質量分析測定結果を示す図であり、標準ピーク(BP)285(m/z)に対して375(m/z)を示した。図4中、上部左側が測定条件、上部右側が測定結果を示す。
【図5】本発明に関するnaphtho[1,2-a]phenanthridine 2-oxideの1H−NMRを示す図であり、X軸(横軸)はδ(単位はppm)、Y軸(縦軸)の強度は任意の単位である。
【図6】本発明に関するnaphtho[1,2-a]phenanthridine 2-oxideの13C−NMRを示す図であり、X軸(横軸)はδ(単位はppm)、Y軸(縦軸)の強度は任意の単位である。
【図7】本発明に関するnaphtho[1,2-a]phenanthridine 2-oxideの質量分析測定結果を示す図であり、標準ピーク(BP)69(m/z)に対して295(m/z)を示した。図4中、上部左側が測定条件、上部右側が測定結果を示す。
【実施例】
【0027】
以下に本発明の実施例によってさらに詳細に説明するが、この実施例は本発明を限定するものではない。
【0028】
なお化合物の分析については下記の機器を使用して実施した。
[測定機器]
1H−NMRは、JEOL製 AL−400を用いて行った。
13C−NMRは、JEOL製 AL−400を用いて行った。
質量分析は、JEOL製 MS700を使用しイオン化法はEIモードにて行った。
赤外吸光測定は、JASCO製 FT/IR−4100を用いて行った。
【0029】
実施例1 naphtho[1,2-a]phenanthridineの合成
(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline(10mg,0.028mg)、酢酸パラジウム (1.0mg, 0.0045mmol), 炭酸カリウム (8mg,0.058mmol), トリシクロヘキシルホスホニウムテトラフルオロホウ酸塩 (2mg,0.0054mmol), 炭酸銀 (4mg, 0.015mmol)をシュレンク管に入れ窒素置換した。反応溶媒としてトルエン(10ml)を加え100℃で12時間還流した。室温まで冷却後、酢酸エチルにて抽出を行い、飽和食塩で洗浄した。無水硫酸マグネシウムで乾燥しセライトにてろ過後、減圧下溶媒を留去した。残渣をシリカゲルクロマトグラフィー(ヘキサン/酢酸エチル=4/1)で精製することにより表記化合物1.5mg(20%)を得た。
【0030】
得られた化合物については既知化合物であるため、図1に示すように1H−NMR測定を実施し、NMRチャートと文献値が一致することを確認し、得られた化合物がnaphtho[1,2-a]phenanthridineであることを確認した。
【0031】
比較例1 naphtho[1,2-a]phenanthridineの合成(銀塩の添加なし)
(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline(10mg,0.028mg)、酢酸パラジウム (1.0mg, 0.0045mmol), 炭酸カリウム (8mg,0.058mmol), トリシクロヘキシルホスホニウムテトラフルオロホウ酸塩 (2mg,0.0054mmol)をシュレンク管に入れ窒素置換した。反応溶媒としてトルエン(10ml)を加え100℃で12時間還流した。室温まで冷却後、酢酸エチルにて抽出を行い、飽和食塩で洗浄した。無水硫酸マグネシウムで乾燥しセライトにてろ過後、減圧下溶媒を留去した。残渣をシリカゲルクロマトグラフィーで精製することを試みたが単離できない複雑な混合物が得られるのみであった。
【0032】
実施例2 naphtho[1,2-a]phenanthridine 2-oxideの合成
(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline (200 mg, 0.56 mmol), メチルトリオキソレニウム(VII) ( 2 mg, 7.8×10-3mmol)をシュレンク管に入れ窒素置換した。反応溶媒として塩化メチレン (5 mL) に溶解させ、0 ℃で15 分撹拌後、30 % 過酸化水素水(4 mL) を滴下し、室温で20 時間撹拌した。二酸化マンガンを加え、さらに2 時間撹拌した。クロロホルムで抽出を行い、飽和食塩水で洗浄した。無水硫酸マグネシウムで乾燥しセライトにてろ過後、減圧下溶媒を留去した。残渣をシリカゲルクロマトグラフィー (ヘキサン/酢酸エチル=1/1その後、メタノール) により精製し、(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline 2-oxide 152 mg(72%) を得た。
続き、上記の方法で得た(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline 2-oxide (50 mg, 0.13 mmol), 酢酸パラジウム (2.8 mg, 0.013 mmol), 炭酸カリウム (36 mg, 0.26 mmol), トリシクロヘキシルホスホニウムテトラフルオロホウ酸塩 (9.6 mg, 0.026 mmol), 炭酸銀 (19 mg, 0.07 mmol)をシュレンク管に入れ窒素置換した。溶媒としてトルエン (10 mL) に溶解させ、100 ℃で12 時間還流した。室温まで冷却後、酢酸エチルで抽出を行い、飽和食塩水で洗浄した。無水硫酸マグネシウムで乾燥しセライトにてろ過後、減圧下溶媒を留去した。残渣をシリカゲルクロマトグラフィー (ヘキサン/酢酸エチル=1/1, その後、メタノール) により精製することにより黄色の結晶の表記化合物36 mg(94%) を得た。
【0033】
得られた化合物について、図2〜図7に示すように1H−NMR、13C−NMR、質量分析(MS)測定を実施し、以下に示す結果を得た。この結果より、得られた化合物がnaphtho[1,2-a]phenanthridine 2-oxideであることを確認した。
【0034】
分析結果
(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline 2-oxide
(1H-NMR測定)
1H-NMR(400 MHz, CDCl3) δ 6.32(1H, d, J=8.0 Hz), 6.75(1H, d, J=8.0 Hz), 7.17(1H, d, 8.4 Hz), 7.25(1H, t, 8.4 Hz), 7.35(1H, t, J=8.0 Hz), 7.40(1H, t, J=8.4 Hz), 7.52(1H, t, J=8.0 Hz), 7.62(1H, t, J=8.4 Hz), 7.83(1H, d, J=8.4 Hz), 7.95(1H, d, 8.0 Hz), 8.02(2H, q, 8.8 Hz), 8.12(1H, s), 8.90(1H, s)
【0035】
(13C-NMR測定)
13C-NMR(100 MHz, CDCl3) δ 110.3, 125.4, 125.5, 125.6, 126.5, 126.8, 127.1, 128.3, 129.0, 129.5, 129.8, 129.9, 131.4, 132.3, 132.9, 133.2, 134.6, 136.0, 137.3
【0036】
(質量分析)
MS (relative intensity) m/z 375(M+, 21), 368(21), 359(22), 280(100), 279(100), 252(66), 236(27), 139(69), 125(34), 83(38), 69(49), 57(50)
HRMS calcd for C21H14ONBr, 375.0259 found 375.0263
【0037】
(赤外吸光測定)
IR(KBr)1596 cm-1, 1618 cm-1
【0038】
naphtho[1,2-a]phenanthridine 2-oxide
(1H-NMR測定)
1H-NMR (400 MHz, CDCl3) δ 7.31-7.39(2H, m), 7.58(2H, t, J=8.0 Hz), 7.82(1H, d, J=8.0 Hz), 7.88(1H, d, J=8.8 Hz), 7.99(2H, t, J=8.0 Hz), 7.81(1H, d, 8.8 Hz), 8.42(2H, t, J=8.8 Hz), 8.97(1H, d, J=8.8 Hz), 9.05(1H, s)
【0039】
(13C-NMR測定)
13C-NMR(100 MHz, CDCl3) δ 118.5, 12309, 125.0, 125.5, 126.0, 126.3, 126.8, 127.3, 127.4, 127.8, 128.2, 128.6, 128.9, 129.4, 130.3. 130.5, 133.0, 133.3, 134.8, 140.4
【0040】
(質量分析)
MS (relative intensity) m/z 295(M+, 29), 278(49), 277(38), 264(12), 219(17), 181(28), 169(33), 131(44), 119(47), 100(12), 81(16), 69(100), 57(32)
HRMS calcd for C21H13ON, 295.0997. found 295.0996
【0041】
(赤外吸光測定)
IR (KBr) 1596 cm-1, 1638 cm-1
【技術分野】
【0001】
本発明は、螺旋状の立体構造を有する化合物であるアザヘリセン化合物の製造方法並びに、この製造方法によって得られたアザヘリセン化合物を用いた有機エレクトロルミネッセント素子用発光材料、蛍光材料、非線形光学材料、有機バッファ層構成材料に関する。
【背景技術】
【0002】
ヘリセン系化合物はその構造に複数の芳香環が弧を描くように互いにオルト基で縮環した螺旋構造を有するため、非平面π共役系に基づく機能、物性を有すると考えられる。そのため、ヘリセン系化合物は新規機能性有機材料として大きな関心を集めている。
【0003】
ヘリセン系化合物は螺旋の向きによる光学異性体が存在するキラルな分子でもあり、光学活性体の比旋光度は極めて大きい。加えて、ヘリセン系化合物は、芳香族同士が近接してかさなりあう構造であり、それにより生じるπ電子間の相互作用に関しても大きな関心を持たれている。そのため、これらの性質を利用して種々の応用が期待されており、近年は特に有機EL(エレクトロルミネッセント)素子、蛍光材料、非線形材料等の光学材料などの用途で応用が期待されている(例えば、特許文献1参照)。
【0004】
ヘリセン系化合物の合成法としては、光環化反応が広く知られており、例えば、Wittig反応やSiegrist反応により合成した芳香族化合物を光環化するなど、多工程を経て合成される場合が多い(例えば、非特許文献1参照)。
【0005】
また、マイクロ波を照射して光環化する方法(例えば、特許文献2参照)や、遷移金属錯体触媒を用いた分子内[2+2+2]付加環化反応(例えば、特許文献3参照)、クロスカップリング反応による合成方法も報告されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2000−195673号公報
【特許文献2】特許第4474512号公報
【特許文献3】特開2008−069104号公報
【非特許文献】
【0007】
【非特許文献1】The Journal Of Organic Chemistry、第56号、第3769頁、1991年発行
【発明の概要】
【発明が解決しようとする課題】
【0008】
ヘリセン系化合物を合成する方法として広く知られている光環化反応は高希釈条件を必要とするため、大量合成への応用に難点がある。また、その他の合成法においても収率や触媒的不斉反応への展開が困難である等の課題がある。そのため、
ヘリセン系化合物の高効率かつ基質一般性の高い合成法の開発が強く求められていた。
【0009】
そこで、本発明の目的は、有機EL素子、蛍光材料、非線形光学材料などの各種の光学デバイスなどに応用が期待される、アザヘリセン系化合物の新規な製造方法を提供することにある。
本発明のアザヘリセン系化合物の合成方法は基質への置換基導入が容易であることから本発明を使用することにより様々なアザヘリセン系化合物の入手が容易になればこの分野の研究開発が活発化されることが期待できる。
【課題を解決するための手段】
【0010】
本発明者らは上記の目的を達成すべく鋭意検討を重ねた結果、ハロゲン化アルケニルビアリール化合物を出発原料として、銀塩共存下、分子内C−Hアリール化反応行うことによりアザヘリセン誘導体が生成することを見出した。
また、ハロゲン化アルケニルビアリール化合物のヘテロ原子部位を酸化した後、リン配位子と銀塩、そしてパラジウム触媒存在下分子内C-Hアリール化反応を行うことによりアザヘリセン誘導体が高収率で生成することを見出し、本発明を完成させるに至った。
すなわち本発明は、窒素を含有するハロゲン化アルケニルビアリール化合物を出発原料として銀塩共存下、分子内C-Hアリール化反応によりアザヘリセン系化合物を合成する、アザヘリセン系化合物の製造方法である。
また本発明は、窒素を含有するハロゲン化アルケニルビアリール化合物を酸化した後に、分子内C-Hアリール化反応によりアザヘリセン系化合物を合成する、アザヘリセン系化合物の製造方法である。
また本発明は、これらの製法により得られる、有機EL素子用発光材料、蛍光材料、非線形光学材料あるいは有機バッファ層構成材料である。以下、本発明を詳細に説明する。
【0011】
本発明を使用して合成するのに好ましいアザヘリセン系化合物は以下のような構造を有する。
【0012】
【化1】

【0013】
上記の化学式(I)及び(II)における炭素1〜21は、それらの合成で使用される出発物質に依存しており炭素原子に限定されず、窒素、硫黄原子等を含んでいてもよい。
また、最終的な材料において望まれる特性を得るために、1〜21の炭素原子に結合した水素原子は置換されていても置換されていなくともよい。
水素原子が置換されている場合、置換基は、制限なしに、ハロゲン元素、アルキル基、置換されたアルキル基、アルコキシル基、置換されたアルコキシル基、チオアルコキシル基、置換されたチオアルコキシル基、シアン基、アミノ基、1つまたは2つ置換されたアミノ基、アリールチオ基、置換されたアリールチオ基、ヒドロキシ基、メルカプト基、アリールチオ基、置換されたアリールチオ基、炭素環状芳香族基、置換された炭素環状芳香族、複素環状芳香族基、置換された複素環状芳香族基、複素環基、または置換された複素環基を含んでいてもよい。
【0014】
また、上記の化学式(I)及び(II)における縮環した芳香環の数は5個であるが、この縮環する芳香環の数は限定されない。また、6員環のみならず5員環等、その他の環員数の化合物にも適応さうる。
【0015】
上記の化学式(I)に示される本発明に係るアザヘリセンの前駆体である(Z)−ハロゲン化アルキニルビアリール(3a)は次の反応式(化2)によって示されるスキーム1により、容易に製造することができる。すなわち、公知の4−イソキノリンボロン酸と1−ハロゲン化ナフトアルデヒドをパラジウム触媒下、鈴木―宮浦反応によりホルミルビアリール(1a)を得る。次いで、Wittig反応によりジハロゲン化アルケニルビアリール(2a)を得る。最後に、パラジウム触媒と水素化トリブチルスズを用いてハロゲン部分を還元し(Z)−ハロゲン化アルキニルビアリール(3a)を得ることができる。なお、下記スキーム1において、Xはハロゲン原子を示す。
また、本発明に関する前駆体である(Z)−ハロゲン化アルキニルビアリール(3a)の合成方法は限定されておらず、公知のどのような方法を使用しても良い。
【0016】
【化2】

【0017】
当初、本発明者らは次の反応式(化3)のスキーム2に示すように(Z)−ハロゲン化アルキニルビアリール(3a)から直接C-Hアリール化反応を用い、[5]N−アザヘリセン(4a)の合成に関して検討を開始した。
【0018】
【化3】

【0019】
トルエン溶媒中でパラジウム触媒、リン配位子、塩基の存在下、C-Hアリール化反応を行ったが、同定できない複雑な混合物が得られるのみであった。
そこで、上記の反応系に銀塩を添加し検討を行った。するとC-Hアリール化反応は進行し、[5]N−アザヘリセン(4a)を得ることに成功した。
【0020】
しかしながら、その収率は20%程度であり、さらに収率の向上が望まれるものであった。
そこで、(Z)−ハロゲン化アルキニルビアリール(3a)を酸化した後、C-Hアリール化反応を行うことを検討した。
具体的には、(Z)−ハロゲン化アルキニルビアリール(3a)から(化4)のスキーム2に示すように、メチルトリオキソレニウム(VII)と過酸化水素水を用い酸化反応を行い、(Z)−ハロゲン化アルケニルビアリール(5a)を得る。続いて、トルエン溶媒中でパラジウム触媒、リン配位子、塩基、分子内C-Hアリール化反応を行うことにより、[5]N−オキシドアザヘリセン(6a)の高収率での合成を達成した。
【0021】
【化4】

【0022】
なお、本発明における出発原料である(Z)−ハロゲン化アルキニルビアリール(3a)のハロゲン原子は好ましくはヨウ素原子、臭素原子であるが、金属触媒に酸化的付加が進行する置換基であれば塩素原子やトリフルオロメタンスルホニル基等でも使用することができる。また、(Z)−ブロモアルキニルビアリール(3a)から(Z)−ブロモアルケニルビアリール(5a)を得る酸化反応は数多く知られており公知のすべての方法を利用することができる。
【0023】
また、本発明におけるC-Hアリール化反応において使用される溶媒、触媒、配位子、塩基及び銀塩は上記の条件に限定されない。公知のC-Hアリール化反応で使用されているすべての溶媒、触媒、配位子、塩基及び銀塩を使用することができる。
【0024】
また、[5]N−オキシドアザヘリセン(6a)は公知の還元方法を使用することにより容易に[5]N−アザヘリセン(4a)に還元することができる。
さらに、本発明のC-Hアリール化反応において光学活性な配位子を利用することで、エナンチオ選択的に光学活性なヘリセン系化合物の合成に展開することも予測される。
【発明の効果】
【0025】
本発明の利点は、基質一般性の高い合成法が数多く報告されているビアリール化合物から螺旋構造を有するアザヘリセン系化合物を簡便かつ高収率で合成することができる点である。
【図面の簡単な説明】
【0026】
【図1】本発明に関するnaphtho[1,2-a]phenanthridineの1H−NMRを示す図であり、X軸(横軸)はδ(単位はppm)、Y軸(縦軸)の強度は任意の単位である。
【図2】本発明に関する(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline 2-oxideの1H−NMRを示す図であり、X軸(横軸)はδ(単位はppm)、Y軸(縦軸)の強度は任意の単位である。
【図3】本発明に関する(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline 2-oxideの13C−NMRを示す図であり、X軸(横軸)はδ(単位はppm)、Y軸(縦軸)の強度は任意の単位である。
【図4】本発明に関する(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline 2-oxideの質量分析測定結果を示す図であり、標準ピーク(BP)285(m/z)に対して375(m/z)を示した。図4中、上部左側が測定条件、上部右側が測定結果を示す。
【図5】本発明に関するnaphtho[1,2-a]phenanthridine 2-oxideの1H−NMRを示す図であり、X軸(横軸)はδ(単位はppm)、Y軸(縦軸)の強度は任意の単位である。
【図6】本発明に関するnaphtho[1,2-a]phenanthridine 2-oxideの13C−NMRを示す図であり、X軸(横軸)はδ(単位はppm)、Y軸(縦軸)の強度は任意の単位である。
【図7】本発明に関するnaphtho[1,2-a]phenanthridine 2-oxideの質量分析測定結果を示す図であり、標準ピーク(BP)69(m/z)に対して295(m/z)を示した。図4中、上部左側が測定条件、上部右側が測定結果を示す。
【実施例】
【0027】
以下に本発明の実施例によってさらに詳細に説明するが、この実施例は本発明を限定するものではない。
【0028】
なお化合物の分析については下記の機器を使用して実施した。
[測定機器]
1H−NMRは、JEOL製 AL−400を用いて行った。
13C−NMRは、JEOL製 AL−400を用いて行った。
質量分析は、JEOL製 MS700を使用しイオン化法はEIモードにて行った。
赤外吸光測定は、JASCO製 FT/IR−4100を用いて行った。
【0029】
実施例1 naphtho[1,2-a]phenanthridineの合成
(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline(10mg,0.028mg)、酢酸パラジウム (1.0mg, 0.0045mmol), 炭酸カリウム (8mg,0.058mmol), トリシクロヘキシルホスホニウムテトラフルオロホウ酸塩 (2mg,0.0054mmol), 炭酸銀 (4mg, 0.015mmol)をシュレンク管に入れ窒素置換した。反応溶媒としてトルエン(10ml)を加え100℃で12時間還流した。室温まで冷却後、酢酸エチルにて抽出を行い、飽和食塩で洗浄した。無水硫酸マグネシウムで乾燥しセライトにてろ過後、減圧下溶媒を留去した。残渣をシリカゲルクロマトグラフィー(ヘキサン/酢酸エチル=4/1)で精製することにより表記化合物1.5mg(20%)を得た。
【0030】
得られた化合物については既知化合物であるため、図1に示すように1H−NMR測定を実施し、NMRチャートと文献値が一致することを確認し、得られた化合物がnaphtho[1,2-a]phenanthridineであることを確認した。
【0031】
比較例1 naphtho[1,2-a]phenanthridineの合成(銀塩の添加なし)
(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline(10mg,0.028mg)、酢酸パラジウム (1.0mg, 0.0045mmol), 炭酸カリウム (8mg,0.058mmol), トリシクロヘキシルホスホニウムテトラフルオロホウ酸塩 (2mg,0.0054mmol)をシュレンク管に入れ窒素置換した。反応溶媒としてトルエン(10ml)を加え100℃で12時間還流した。室温まで冷却後、酢酸エチルにて抽出を行い、飽和食塩で洗浄した。無水硫酸マグネシウムで乾燥しセライトにてろ過後、減圧下溶媒を留去した。残渣をシリカゲルクロマトグラフィーで精製することを試みたが単離できない複雑な混合物が得られるのみであった。
【0032】
実施例2 naphtho[1,2-a]phenanthridine 2-oxideの合成
(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline (200 mg, 0.56 mmol), メチルトリオキソレニウム(VII) ( 2 mg, 7.8×10-3mmol)をシュレンク管に入れ窒素置換した。反応溶媒として塩化メチレン (5 mL) に溶解させ、0 ℃で15 分撹拌後、30 % 過酸化水素水(4 mL) を滴下し、室温で20 時間撹拌した。二酸化マンガンを加え、さらに2 時間撹拌した。クロロホルムで抽出を行い、飽和食塩水で洗浄した。無水硫酸マグネシウムで乾燥しセライトにてろ過後、減圧下溶媒を留去した。残渣をシリカゲルクロマトグラフィー (ヘキサン/酢酸エチル=1/1その後、メタノール) により精製し、(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline 2-oxide 152 mg(72%) を得た。
続き、上記の方法で得た(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline 2-oxide (50 mg, 0.13 mmol), 酢酸パラジウム (2.8 mg, 0.013 mmol), 炭酸カリウム (36 mg, 0.26 mmol), トリシクロヘキシルホスホニウムテトラフルオロホウ酸塩 (9.6 mg, 0.026 mmol), 炭酸銀 (19 mg, 0.07 mmol)をシュレンク管に入れ窒素置換した。溶媒としてトルエン (10 mL) に溶解させ、100 ℃で12 時間還流した。室温まで冷却後、酢酸エチルで抽出を行い、飽和食塩水で洗浄した。無水硫酸マグネシウムで乾燥しセライトにてろ過後、減圧下溶媒を留去した。残渣をシリカゲルクロマトグラフィー (ヘキサン/酢酸エチル=1/1, その後、メタノール) により精製することにより黄色の結晶の表記化合物36 mg(94%) を得た。
【0033】
得られた化合物について、図2〜図7に示すように1H−NMR、13C−NMR、質量分析(MS)測定を実施し、以下に示す結果を得た。この結果より、得られた化合物がnaphtho[1,2-a]phenanthridine 2-oxideであることを確認した。
【0034】
分析結果
(Z)-4-(2-(2-bromovinyl)naphthalen-1-yl)isoquinoline 2-oxide
(1H-NMR測定)
1H-NMR(400 MHz, CDCl3) δ 6.32(1H, d, J=8.0 Hz), 6.75(1H, d, J=8.0 Hz), 7.17(1H, d, 8.4 Hz), 7.25(1H, t, 8.4 Hz), 7.35(1H, t, J=8.0 Hz), 7.40(1H, t, J=8.4 Hz), 7.52(1H, t, J=8.0 Hz), 7.62(1H, t, J=8.4 Hz), 7.83(1H, d, J=8.4 Hz), 7.95(1H, d, 8.0 Hz), 8.02(2H, q, 8.8 Hz), 8.12(1H, s), 8.90(1H, s)
【0035】
(13C-NMR測定)
13C-NMR(100 MHz, CDCl3) δ 110.3, 125.4, 125.5, 125.6, 126.5, 126.8, 127.1, 128.3, 129.0, 129.5, 129.8, 129.9, 131.4, 132.3, 132.9, 133.2, 134.6, 136.0, 137.3
【0036】
(質量分析)
MS (relative intensity) m/z 375(M+, 21), 368(21), 359(22), 280(100), 279(100), 252(66), 236(27), 139(69), 125(34), 83(38), 69(49), 57(50)
HRMS calcd for C21H14ONBr, 375.0259 found 375.0263
【0037】
(赤外吸光測定)
IR(KBr)1596 cm-1, 1618 cm-1
【0038】
naphtho[1,2-a]phenanthridine 2-oxide
(1H-NMR測定)
1H-NMR (400 MHz, CDCl3) δ 7.31-7.39(2H, m), 7.58(2H, t, J=8.0 Hz), 7.82(1H, d, J=8.0 Hz), 7.88(1H, d, J=8.8 Hz), 7.99(2H, t, J=8.0 Hz), 7.81(1H, d, 8.8 Hz), 8.42(2H, t, J=8.8 Hz), 8.97(1H, d, J=8.8 Hz), 9.05(1H, s)
【0039】
(13C-NMR測定)
13C-NMR(100 MHz, CDCl3) δ 118.5, 12309, 125.0, 125.5, 126.0, 126.3, 126.8, 127.3, 127.4, 127.8, 128.2, 128.6, 128.9, 129.4, 130.3. 130.5, 133.0, 133.3, 134.8, 140.4
【0040】
(質量分析)
MS (relative intensity) m/z 295(M+, 29), 278(49), 277(38), 264(12), 219(17), 181(28), 169(33), 131(44), 119(47), 100(12), 81(16), 69(100), 57(32)
HRMS calcd for C21H13ON, 295.0997. found 295.0996
【0041】
(赤外吸光測定)
IR (KBr) 1596 cm-1, 1638 cm-1
【特許請求の範囲】
【請求項1】
窒素を含有するハロゲン化アルケニルビアリール化合物を出発原料として銀塩共存下、分子内C-Hアリール化反応によりアザヘリセン系化合物を合成することを特徴とするアザヘリセン系化合物の製造方法。
【請求項2】
窒素を含有するハロゲン化アルケニルビアリール化合物を酸化した後に、分子内C-Hアリール化反応によりアザヘリセン系化合物を合成することを特徴とするアザヘリセン系化合物の製造方法。
【請求項3】
請求項2記載の分子内C-Hアリール化反応において銀塩を添加することを特徴とする、アザヘリセン系化合物の製造方法。
【請求項4】
請求項1〜3のいずれか1項に記載の製造方法により製造されたアザヘリセン系化合物を含んでなる有機エレクトロルミネッセント素子用発光材料。
【請求項5】
請求項1〜3のいずれか1項に記載の製造方法により製造されたアザヘリセン系化合物を含んでなる蛍光材料。
【請求項6】
請求項1〜3のいずれか1項に記載の製造方法により製造されたアザヘリセン系化合物を含んでなる非線形光学材料。
【請求項7】
請求項1〜3のいずれか1項に記載の製造方法により製造されたアザヘリセン系化合物を含んでなる有機バッファ層構成材料。
【請求項1】
窒素を含有するハロゲン化アルケニルビアリール化合物を出発原料として銀塩共存下、分子内C-Hアリール化反応によりアザヘリセン系化合物を合成することを特徴とするアザヘリセン系化合物の製造方法。
【請求項2】
窒素を含有するハロゲン化アルケニルビアリール化合物を酸化した後に、分子内C-Hアリール化反応によりアザヘリセン系化合物を合成することを特徴とするアザヘリセン系化合物の製造方法。
【請求項3】
請求項2記載の分子内C-Hアリール化反応において銀塩を添加することを特徴とする、アザヘリセン系化合物の製造方法。
【請求項4】
請求項1〜3のいずれか1項に記載の製造方法により製造されたアザヘリセン系化合物を含んでなる有機エレクトロルミネッセント素子用発光材料。
【請求項5】
請求項1〜3のいずれか1項に記載の製造方法により製造されたアザヘリセン系化合物を含んでなる蛍光材料。
【請求項6】
請求項1〜3のいずれか1項に記載の製造方法により製造されたアザヘリセン系化合物を含んでなる非線形光学材料。
【請求項7】
請求項1〜3のいずれか1項に記載の製造方法により製造されたアザヘリセン系化合物を含んでなる有機バッファ層構成材料。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2013−40145(P2013−40145A)
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願番号】特願2011−179300(P2011−179300)
【出願日】平成23年8月19日(2011.8.19)
【出願人】(505127721)公立大学法人大阪府立大学 (688)
【出願人】(301005614)東ソー・ファインケム株式会社 (38)
【Fターム(参考)】
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願日】平成23年8月19日(2011.8.19)
【出願人】(505127721)公立大学法人大阪府立大学 (688)
【出願人】(301005614)東ソー・ファインケム株式会社 (38)
【Fターム(参考)】
[ Back to top ]

