アジアティック酸(asiaticacid)及びその選択される塩に基づく治療用製剤
高純度アジアチコサイド(asiaticoside)及び医薬品グレードのアジアティック酸(asiatic acid)をアジアティック酸(asiatic acid)の塩と一緒に調製し、関節炎、乾癬、及び他の炎症疾病及び肺線維症、糖尿性ネフロパシー、及び他の線維症を治療するために有用な治療組成物を製剤化するのに用いる。
【発明の詳細な説明】
【技術分野】
【0001】
優先権の主張
本出願は2008年1月11日出願の米国仮出願第61/006,432の優先権を主張し、参照により本明細書に組み込まれる。
【背景技術】
【0002】
Bontems, Bull. ScL Pharmacol. 49: 186-91 (1941)にて最初に報告されたように、アジアティック酸(asiatic acid)及びそのトリサッカライドのアジアチコサイド(asiaticoside)はセンテラ アジアチカ(Centella asiatica)から抽出され、これは、小さい、一年生草本植物で、アジア太平洋周縁が原産であり、ニンジン及びディルを含むセリ科の仲間である。アジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)の化学構造式を下記に示す。
【式1】
【0003】

【式2】
【0004】

Polonsky, Compt. Rend. 232: 1878-80 (1951)、及びBull. Soc. Chim. 173-80 (1953)を参照願いたい。
【0005】
皮膚の傷及び慢性潰瘍の治療法ではアジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)を含むセンテラ アジアチカ(C. asiatica)抽出物の使用が知られている。関連する流れにおいて、文献は結核及びハンセン病に関連する皮膚変形の治療にセンテラ アジアチカ(C. asiatica)抽出物を使用することを開示している。例えば、Boiteau他、Bull. Soc. Chim. 31 : 46-51 (1949)を参照願いたい。
【0006】
このような創傷治癒のために、作用の薬理学作用機序は、角質化の誘導に関連している。May, Eur. J. Pharmacol. 4: 331-39(1968)を参照願いたい。このことは、特に、皮膚線維芽細胞の増殖及びコラーゲンIを含む細胞外マトリクス成分の合成を促進することにより行われる。例えば、Lu他、Int 'l J. Dermatol. 43: 801-07 (2004)、Skukla他、 J. Ethnopharmacol. 65: 1-11 (1999)を参照願いたい。Bonte他、Planta Med. 60:133-35 (1994)によれば、アジアチコサイド(asiaticoside)及び酸の比較は前者の糖部分がこの生物学的活性に必要ないらしいと示す。さらに、Grimaldi他、J. Ethnopharmacol. 28: 235-41 (1990)に記載のように、アジアチコサイド(asiaticoside)は、被験者への経口投与の後、血漿アジアティック酸(asiatic acid)に完全に転換する。
【0007】
これらの創傷治癒特性に関する知識に基づき、米国特許第5,834,437においてアジアティック酸(asiatic acid)又はその誘導体の一つを含む皮膚病薬の提案がなされた。また、米国特許第6,417,349を参照願いたい。それは、肝線維症の動物モデルにおいて、アジアチコサイド(asiaticoside)及びセンテラ アジアチカ(C. asiatica)により作られる関連化合物であるマデカッソシド(madecassoside)の水溶性抽出物の腹腔内投与により達成される苦痛緩和効果を開示する。創傷治癒及び抗線維化特性に加えて、内服投与されるアジアチコサイド(asiaticoside)が、脾臓細胞のレベル及びCOX‐2、PGE2、TNF‐アルファ、及びIL−6を含む炎症性の分子のレベルを低減し、その結果、関節炎の標準(コラーゲン誘発)げっ歯類モデルにおいて足浮腫、関節炎スコア、及び滑膜の過形成のような複数の関節炎パラメータの阻害又は低減の効果を有することが報告された。Li他、Yao Xue Xue Bao (Acta Pharma. Sinica) 42: 698-703 (2007)を参照願いたい。
【0008】
これら及び他の開示はアジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)の治療潜在能力に関連するけれども、いずれの化合物を抽出するにも比較的低い収量及び低い純度を伴うという困難性があるという事実により潜在能力が妨げられていたことがわかる。さらに、治療組成物に用いるためのアジアティック酸(asiatic acid)の塩を生成することについてあまり知られていない。米国特許第6,891,063は特定のアジアティック酸(asiatic acid)塩、特に、アンモニウムカチオンを有する塩を開示し、問題となる治療に有効であったと開示している。
【発明の概要】
【0009】
本発明は高純度のアジアティック酸(asiatic acid)を提供する。ある実施態様においては、医薬品グレード、好ましくは、約98%純度のアジアティック酸(asiatic acid)である。
【0010】
また、本発明は高純度アジアティック酸(asiatic acid)から作られる塩を提供する。その塩は、アルカリ金属塩、又はアルカリ土類金属塩、又は任意に置換されるアンモニウム塩である。あるいは、塩はカリウム塩である。別の実施態様においては、塩はナトリウム塩である。さらに別の実施態様においては、塩はトロメタモール塩である。本発明は、前述の塩の一以上のいずれかを含む固形の剤形を提供する。
【0011】
さらに、本発明は高純度のアジアティック酸(asiatic acid)誘導体を提供する。これらの誘導体の例は、アミド又はエステルである。好ましい実施態様においては、誘導体はアジアチコサイド(asiaticoside)である。
【0012】
本発明の別の態様によれば、治療組成物は、薬剤に許容できる担体を用いて高純度アジアティック酸(asiatic acid)又はアジアチコサイド(asiaticoside)を作成し、アジアティック酸又はアジアチコサイドの実質的に治療効果のある量からなる剤形を提供することを含む方法の生成物であることを特徴とする。
【0013】
さらなる態様によれば、本発明は線維症の治療のための手順又は線維症の予防を提供する。本発明の手順はそのような病気を患う又は患う危険性のある対象に上述の治療組成物を投与することを含む。この文脈において線維症の例は放射線‐誘発肺炎及び線維症、特発性肺線維症、糖尿病性ネフロパシー、及び慢性閉塞性肺疾患(COPD)である。
【0014】
さらに本発明の別の態様においては、方法は、炎症性の病気の治療又は予防であって、そのような病気を患う又は患う危険性のある対象に上述の治療組成物を投与することを含むことを特徴とする。これに関して、炎症性の病気のカテゴリーは例として関節炎、炎症性大腸炎、乾癬を含む。
【図面の簡単な説明】
【0015】
【図1】図1はアジアティック酸(asiatic acid)出発原料及び生成される塩のHPLC記録の重ね合わせを示す。
【図2】図2は300MHzにおける、アジアティック酸(asiatic acid)ロット番号071109及びナトリウム塩AJF09,99bのDMSO‐d6での1H‐NMR分光分析を示す。
【図3】図3は300MHzにおける、アジアティック酸(asiatic acid)ロット番号071109及びナトリウム塩AJF09,99bのDMSO‐d6での13C‐NMR分光分析を示す。
【図4】図4は300MHzでの11ppmから41ppmにおける、アジアティック酸(asiatic acid)ロット番号071109及びナトリウム塩AJF09,99bのDMSO‐d6での13C‐NMR分光分析を示す。
【図4a】図4aはDMSO‐d6でのアジアティック酸(asiatic acid)の完全1H‐NMRスペクトルを示す。
【図4b】図4bはアジアティック酸(asiatic acid)1H‐NMRスペクトルの拡大図を示す。
【図4c】図4cはアジアティック酸(asiatic acid)ナトリウム塩(AJF09,99b)の完全1H‐NMRスペクトルを示す。
【図4d】図4dはアジアティック酸(asiatic acid)1H‐NMRスペクトルの拡大図を示す。
【図4e】図4eはDMSO‐d6でのアジアティック酸(asiatic acid)の13C‐NMRスペクトルを示す。
【図4f】図4fはアジアティック酸(asiatic acid)の13C‐NMRスペクトルの拡大図を示す。
【図4g】図4gはDMSO‐d6でのアジアティック酸(asiatic acid)ナトリウム塩の完全13C‐NMRスペクトルを示す。
【図4h】図4hはアジアティック酸(asiatic acid)ナトリウム塩の13C‐NMRスペクトルの拡大図を示す。
【図5a】図5aはアジアティック酸(asiatic acid)のPXRDを示す。
【図5b】図5bはアジアティック酸(asiatic acid)のナトリウム塩のPXRDを示す。
【図6】図6はアジアティック酸(asiatic acid)のFTIRスペクトルを示す。
【図7】図7はアジアティック酸(asiatic acid)のナトリウム塩(AJF09,82)のFTIRスペクトルを示す。
【図8】図8はアジアティック酸(asiatic acid)のナトリウム塩(AJF09,99b)のFTIRスペクトルを示す。
【図9】図9はアジアティック酸(asiatic acid)のナトリウム塩(AJF09,99a)のFTIRスペクトルを示す。
【図10】図10はアジアティック酸(asiatic acid)のTGAサーモグラフを示す。
【図11】図11はアジアティック酸(asiatic acid)のナトリウム塩AJF09,82のTGAサーモグラフを示す。
【図12】図12はアジアティック酸(asiatic acid)のナトリウム塩AJF09,99bのTGAサーモグラフを示す。
【図13】図13は直線性の検量線を示す。
【図14】図14はアジアチコサイド(asiaticoside)生産のためのプロセスの図式的説明である。
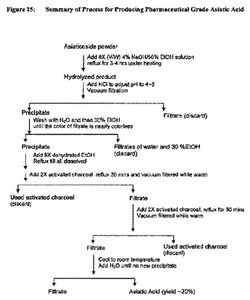
【図15】図15は医薬品グレードのアジアティック酸(asiatic acid)生産のためのプロセスの図式的説明である。
【図16a】図16aはアジアティック酸(asiatic acid)カリウム塩の1H‐NMRを示す。
【図16b】図16bはアジアティック酸(asiatic acid)トロメタモール塩の1H‐NMRを示す。
【図16c】図16cはアジアティック酸(asiatic acid)ナトリウム塩‐ホスホン酸ナトリウムの1H‐NMRを示す。
【図16d】図16dはアジアティック酸(asiatic acid)トリアセテート‐アミド誘導体の1H‐NMRを示す。
【図17a】図17aはアジアティック酸(asiatic acid)カリウム塩のマススペクトロスコピーを示す。
【図17b】図17bはアジアティック酸(asiatic acid)トロメタモール塩のマススペクトロスコピーを示す。
【図17c】図17cはアジアティック酸(asiatic acid)ナトリウム塩‐ホスホン酸ナトリウム塩のマススペクトロスコピーを示す。
【図17d】図17dはアジアティック酸(asiatic acid)トリアセテート‐アミド誘導体のマススペクトロスコピーを示す。
【発明を実施するための形態】
【0016】
発明の詳細な説明
上に詳しく述べた問題点にかんがみ、本願発明者は高い純度で、薬理学的開発に有用なアジアチコサイド(asiaticoside)及びアジアティック酸(asiatic acid)両方を得るための容易に実施できる方法を開発した。さらに、本願発明者は、治療製剤のための、特に炎症及び線維症にかかる疾患を治療するための必要な物理的特性を有するアジアティック酸(asiatic acid)塩を作り、その特徴づけを行った。
【実施例】
【0017】
I.医薬品グレードのアジアティック酸(asiatic acid)の生産
A.92%純度のアジアチコサイド(asiaticoside)の調製
粗アジアチコサイド(asiaticoside)粉を例えばGuangxi Changzhou Natural Product Co. Ltd. (www.changzhou−centella.com)から商業的に入手できる。
【0018】
粗アジアチコサイド(asiaticoside)粉に4X60%EtOH(V/W)を加えた。混合物を約70℃から約90℃(例えば、80℃)の範囲の温度にて加熱しながら還流し固形物を溶解した。溶液を冷却し、16時間結晶化のために5℃のコールドルームに放置した。非晶質の沈殿物が形成され、ろ過された。回収された沈殿物をその色が白色に変わるまで60%EtOHで洗浄した。それから、沈殿物を約55℃から約70℃(例えば、60℃)の範囲の温度及び約−0.09から−0.11MPaの範囲、例えば、−0.10MPaの減圧にてオーブン乾燥した。
【0019】
乾燥沈殿物に30X(V/W)80%アセトン水溶液を加えた。混合物を1時間加熱しながら還流し、固形物を溶解した。溶液をろ過し、そのろ液を24時間結晶化のために10℃のコールドルームに放置した。非晶質の沈殿物が形成され、ろ過された。回収沈殿物をその色が白色になるまで80%アセトンで洗浄した。沈殿物を乾燥し、乾燥固形物をアジアチコサイド(asiaticoside)粉を作るために粉にした。図14にプロセスの概要を示す。
【0020】
B.98%純度のアジアティック酸(asiatic acid)の調製
上述のように調製されるアジアチコサイド(asiaticoside)粉(純度約92%)の200mgを8X(V/W)4%NaOH/50%EtOH溶液(1600ml)に溶解した。得られた溶液を80℃の水浴中約3−4時間還流し、それから室温まで又は室温に近くなるまで冷却した。
【0021】
それからこの溶液のpHを連続的に攪拌しながら少量ずつ(例えば、各回約10ml)徐々に希釈HCl(1から2倍に前もって希釈された)を添加することにより4と5の間に調整した。その処理中継続的に沈殿物が析出し、最終的に粘性のある生地を形成した。
【0022】
この生地を減圧にて真空ろ過用200mmブフナー漏斗へ移した。そのろ液を除いた。沈殿物をろ液の色がほとんど無色になるまで真空下で水を用いて洗浄した。それから沈殿物をろ液の色がほとんど無色になるまで30%EtOHで洗浄した。これら二度の洗浄でのろ液を除去した。
【0023】
8X(V/W)無水EtOH(約1600ml)を沈殿物に加え、それから混合物を80℃の水浴中加熱しながら還流し、沈殿物を完全に溶解した。それから2X(約400g)活性炭を加え、溶液をさらに30分間連続的に還流した。溶液をまだ温めながら減圧にて真空ろ過で200mmのブフナー漏斗を用いて活性炭をろ過した。用いた活性炭を除去した。それから同量の別のバッチの活性炭をろ液に加えた。混合物を別に30分間還流させ、まだ温めながら減圧にて200mmのブフナー漏斗を用いて真空ろ過した。
【0024】
ろ液を室温まで冷却した。ろ液にさらなる白い沈殿物が析出しなくなるまで各約100−200mlに分けて水を加えた。水の全体積は約4000ml必要とされた。それから溶液を減圧にて200mmのブフナー漏斗を用いて真空ろ過した。ろ液を除去した。それから漏斗の中の白い固形物を乾燥した。乾燥固形物を98%(W/W)純度のアジアティック酸(asiatic acid)原料を生産するために粉にした。図15にプロセスの概要を示す。
【0025】
II.アジアティック酸(asiatic acid)の薬理学的活性
ラットのブレオマイシン処理は線維症の動物モデルを確立するために好ましい手段である。下記にさらに詳しく述べるように、本発明のアジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)組成物は、処理開始時期がブレオマイシン投与後1日であっても7日目であっても、ブレオマイシン処理ラットの生存を著しく増強させる。これは、従来肺線維症を治療するために用いるデキサメタゾンが同様な条件下でラットの生存をほとんど増強しない事実に照らして、予想外の結果である。
【0026】
デキサメタゾンの主な効果は炎症経路に対してであるので、本発明で得られる結果は、炎症プロセスに対する阻害効果に加えて、アジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)は線維症に関連する又は線維症に直接関与する他の経路にも効果を発揮することを示す。例えば、肺組織病理学により検出されるように、アジアティック酸(asiatic acid)はブレオマイシン‐誘発肺線維症の程度を低減する。アジアティック酸(asiatic acid)又はデキサメタゾン処理をブレオマイシン損傷後7日に開始する場合、アジアティック酸(asiatic acid)がデキサメタゾンより効果を有し、アジアティック酸(asiatic acid)が炎症プロセスを標的にするだけでなく、デキサメタゾンより直接的な線維症での効果を有することを示す。
【0027】
肺重量対体重の比により測定する場合、ブレオマイシン損傷後処理を1日又は7日に開始するかどうかにかかわらず、アジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)が、ブレオマイシン‐誘発肺線維症を顕著に低減し、デキサメタゾンより十分効果を発揮する。
【0028】
また、アジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)は、ヒドロキシプロリン(コラーゲン前駆体)及びタイプIIIコラーゲンの血清レベルにより測定する場合、ブレオマイシン‐誘発線維症を著しく低減する。同様な条件下におけるアジアティック酸(asiatic acid)の効果はブレオマイシン暴露後処理を1日又は7日に開始するかどうかにかかわらず、デキサメタゾンと同等又はデキサメタゾンよりわずかによい。
【0029】
デキサメタゾンと比較して、ブレオマイシン暴露後処理を1日又は7日に開始するかどうかにかかわらず、アジアティック酸(asiatic acid)は、線維症‐仲介サイトカイン形質転換成長因子ベータ(TGF‐β)及び腫瘍壊死因子アルファ(TNF‐α)のブレオマイシン誘発血清レベルを著しく低減する。
【0030】
III.治療指標及び製剤
従って、本明細書に詳しく説明する結果は、本発明に従って作られる医薬品グレードのアジアティック酸(asiatic acid)及び高純度のアジアチコサイド(asiaticoside)が炎症に関与する広範囲の疾病、及び線維芽細胞及びマトリックス蓄積(線維症)に関与する広範囲の疾病を治療するための実用性を明かにする。炎症に関する疾病のクラスの例は、乾癬、クローン病及び潰瘍性大腸炎を含む炎症性大腸炎疾患、及び関節リウマチ、変形性関節症及び乾癬性関節炎を含む関節炎である。これらの疾病の進行は、異常な免疫系活性により示され、COX‐2、及び特定のサイトカイン及びプロスタグランジンのような炎症性分子のレベルを上昇させる。線維症のクラスの例は放射線‐誘発肺炎及び線維症、特発性肺線維症、及び腎線維症により進行が発見される糖尿病性ネフロパシーである。
【0031】
従って、本発明の態様は、薬剤、特に内服用薬剤を製造するために従来使用する他の成分を有する高純度アジアティック酸(asiatic acid)又はアジアチコサイド(asiaticoside)を作ることにより調製される治療組成物を提供する。即ち、本発明の治療組成物は、高純度アジアティック酸(asiatic acid)又はアジアチコサイド(asiaticoside)の抗線維性効果が組成物の他の成分により悪影響を受けない限り、他の成分、すなわち薬剤に許容できる担体、賦形剤、又は安定剤の一以上を含んでよく、これらは例えばREMINGTON - THE SCIENCE AND PRACTICE OF PHARMACY 21st ed. (2005)に記載される。
【0032】
部分的に投与の所望の態様に応じて、本発明の治療組成物を非経口投与として注射剤用に製剤化してよい。この目的のために、治療組成物は水溶液として作られ、ハンクス液、リンゲル液、又は生理食塩緩衝液のような生理的に適合する緩衝液を含んでよい。
【0033】
本発明の別の態様においては、アジアティック酸(asiatic acid)の塩(次のセクションを参照願いたい)を薬剤に許容できる固形マトリックスと調合してよく、とりわけ、内服用、口腔用、舌下用、直腸用、又は膣内用投与に有用な固形剤形を提供する。本発明の本態様においては、治療組成物は、高純度アジアティック酸(asiatic acid)又はアジアチコサイド(asiaticoside)、又はアジアティック酸(asiatic acid)の塩を一以上の固形賦形剤と混ぜ合わせ、任意に混合物をすりつぶし、それからその混合物をできれば適切な補助剤の添加の後に加工し、それにより錠剤又はドラジェコア(Dragee core)を得ることのできる製品でよい。これに関する適切な賦形剤は糖(乳糖、サッカロース、マンニトール、ソルビトール等)のような充填剤及び例えば、トウモロコシデンプン、小麦デンプン、コメデンプン、ジャガイモデンプン、ゼラチン、トラガカントゴム、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロースナトリウム(CMC)、及び/又はポリビニルピロリドン(PVP、プロビドン)のようなセルロース調製物である。また、崩壊剤を加えてよく、例えば、架橋ポリビニルピロリドン、寒天、又はアルギン酸又はアルギン酸ナトリウムのようなアルギン酸塩である。
【0034】
ドラジェコア(Dragee core)には適切なコーティングが供される。この目的のため、糖溶液を用いてよく、これは、任意に、アラビアゴム、タルク、ポリビニルピロリドン、カーボポルゲル、ポリエチレングリコール(PEG)、及び/又は二酸化チタン、ラッカー溶液、及び適切な有機溶媒又は溶媒混合物を含んでよい。活性化合物投与量を同定するため又はその異なる組合せを特徴付けるために染料又は色素を錠剤又はドラジェコーティングに加えることができる。
【0035】
経口投与に有用な本発明の治療組成物は、ゼラチンから作られたプッシュ‐フィットカプセル、並びにゼラチン及び可塑剤、例えばグリセロール又はソルビトールから作られた軟質密封カプセルであり、高純度アジアティック酸(asiatic acid)又はアジアチコサイド(asiaticoside)で作られる固形製剤を含む。上述のように、これに関連して、プッシュ‐フィットカプセルは、例えばラクトースのような充填剤、例えばデンプンのようなバインダー、及び/又は、例えばタルク又はステアリン酸マグネシウムのような潤滑剤との混合物及び任意に一以上の安定剤との混合物において活性成分を含んでよい。軟質カプセルにおいて、活性化合物は、適切な液体、例えば脂肪油、液体パラフィン、又は液体ポリエチレングリコール(PEG)中に溶かし又は懸濁することができる。更に、任意に安定剤を加えることができる。
【0036】
本発明の治療組成物を投与する別の態様は吸入又は注入であり、治療剤が直接気道に運ばれる。例えば、米国特許第5,607,915及びPCT出願WO 97/39745及びWO 99/47196を参照願いたい。この目的のために、本発明はネブライザー、液体スプレー装置、又は電気流体力学(EHD)エアロゾル装置を通しての投与に有用である液体製剤を含む。
【0037】
ある実施態様においては、そのような組成物は薬剤に許容できる担体を含み、担体はアルコール、水、ポリエチレングルコール、又はペルフルオロカーボンのような液体である。任意に、別の材料を本明細書に記載のように活性成分の溶液又は懸濁液のエアロゾル特性を改変するために添加してよい。この他の材料は液体でよく、例えば、アルコール、グリコール、ポリグリコール、又は脂肪酸である。本発明に従って、他の手段をエアロゾル装置に用いるために有用な液体溶液又は懸濁液を作るために用いてよい。米国特許第5,112,598及び第5,556,611を参照願いたい。
【0038】
本発明の浮遊組成物を投与するために別の形式はドライパウダー吸入器に有用な乾燥粉末担体を用いる。そのような担体の例は、
フルクトース、マンニトール、アラビノース、キシリトール、及びデキストロース(グルコース)及びそれらの一水和物のようなモノサッカライド、
ラクトース、マルトース、又はスクロースのようなジサッカライド、及び
例えば、デンプン、デキストリン、及びデキストランのようなポリサッカライド
である。例えば、本発明のアジアティック酸(asiatic acid)塩を米国特許第5,376,386に一般的に記載されているようにミクロナイザー(micronizer)を用いて、これらの担体材料の一以上を有する乾燥粉末へ製剤化してよい。
【0039】
IV.薬理学的使用のためのアジアティック酸(asiatic acid)塩の生産及び特性評価
アジアティック酸(asiatic acid)がメタノール中で良好な溶解度を有することにかんがみ、本発明は、例えば、アジアティック酸(asiatic acid)をメタノール水酸化ナトリウム、メタノール炭酸ナトリウム、メタノール水酸化アンモニウム、それぞれに溶解することによる、アジアティック酸(asiatic acid)の塩を形成することを意図する。アジアティック酸(asiatic acid)塩の生産及び特性評価を下記に詳しく記載する。
【0040】
A.アジアティック酸(asiatic acid)の塩スクリーニング
アジアティック酸(asiatic acid)がメタノール中で良好な溶解度を有すること(下記参照)にかんがみて、アジアティック酸をメタノール水酸化ナトリウム溶液、メタノール炭酸ナトリウム溶液、メタノール水酸化アンモニウム溶液、それぞれに溶解することにより、アジアティック酸(asiatic acid)の塩を形成することを意図する。
【0041】
1.アジアティック酸(asiatic acid)―炭酸ナトリウム(AJF09,82)
アジアティック酸(asiatic acid)(0.992g)を27.5mLのメタノールに溶解した。無水炭酸ナトリウム(2.0043g)をそのメタノール溶液に添加し、激しく振った。メタノール‐アジアティック酸溶液を丸底フラスコに移し、乾燥するまで蒸発した。アジアティック酸ナトリウム塩の細かい白い粉体を生成し、2時間100℃にて真空オーブン中乾燥した。約1gのサンプルを得た。
【0042】
2.メタノール水酸化アンモニウム中のアジアティック酸(asiatic acid)(AJF09,99a)
約6mLのメタノール水酸化アンモニウムを0.4923gのアジアティック酸(asiatic acid)に滴下した。サンプルの多くが、溶液中に移り、新しいフレーク状の材料が現れ始めた。さらに1mlのメタノール水酸化アンモニウムを加え、溶液を終夜攪拌しながら放置した。沈殿物が生じ、ろ過により回収した。0.0741gのアジアティック酸アンモニウム塩を得た。
【0043】
3.メタノール水酸化ナトリウム中のアジアティック酸(asiatic acid)(AJF09,99b)
アジアティック酸(asiatic acid)(0.4961g)を0.2Mメタノール水酸化ナトリウムの7.0mL中に溶解した。一度完全に溶解した飽和塩化ナトリウム溶液を溶液が濁っていき、沈殿が生じるまで滴下した。脱イオン水(7.0mL)を添加し、存在するNaClを溶解した。沈殿物をろ過して回収し、2時間100℃にて真空オーブン中乾燥した。0.4938gのアジアティック酸ナトリウム塩を得た。
【0044】
4.アジアティック酸(asiatic acid)カリウム塩
【式3】
【0045】

上記スキーム4に関して、4g(8.196mmol)アジアティック酸(asiatic acid)をメタノール(30ml)に加えた。混合物を加熱し溶解した。その溶液にpHが8‐9になるまで0.56g(8.187mmol)のKOH及び20mlのメタノールで作られた溶液を加えた。それから、得られた溶液を活性炭で脱色し、濃縮した。濃縮溶液に十分な量のアセトンを加えホモジナイズし、その溶液を冷却した。沈殿物が生じ、ろ過した。オフホワイト結晶として3.5gのアジアティック酸カリウム塩を得た。図16aにその生成物の1H−NMRを示す。図17aはその生成物のマススペクトロスコピーを示す。
【0046】
5.アジアティック酸(asiatic acid)トロメタモール塩
【式4】
【0047】

上記スキーム5に関して、2g(4.09mmol)のアジアティック酸(asiatic acid)及び0.59g(4.623mmol)のトリヒドロキシメチルアミノメタン(トロメタミン)をメタノール(30ml)に加えた。混合物を24時間室温にて攪拌し、0.5時間還流した。その溶液を濃縮し、少量の水を加えた。沈殿物が生じ、それからろ過し不純物を除いた。ろ過ケーキをメタノール中に移し、加熱して溶解した。得られた溶液をろ過し、不溶性物質を除去し、それから濃縮した。濃縮溶液に十分な量のアセトンを添加し、ホモジナイズした。その溶液を冷却した。生じた沈殿物をろ過し、50℃にて乾燥した。淡褐色の固形物として1.5gのアジアティック酸トロメタモール塩を得た。図16bにその生成物の1H−NMRを示す。図17bはその生成物のマススペクトロスコピーを示す。
【0048】
6.アジアティック酸(asiatic acid)ナトリウム塩‐ホスホン酸ナトリウム
【式5】
【0049】

上記スキーム6のはじめの段階において、ピリジン(12ml)を氷の塩水を用いて−10℃まで冷却し、2.2g(0.01435mol)の水酸化ホスホニウムを滴下して加えた。2分後、2g(0.004098mol)のアジアティック酸(asiatic acid)溶液及びピリジン(6ml)を滴下して加えた。混合物を攪拌し、1.5時間反応した。反応溶液をゆっくり40mlの氷水に加えた。その混合物を室温にて終夜攪拌した。ほとんどの溶剤を蒸発し、減圧下乾燥させた固形物を得た。その固形物を4NHCl(20ml)に添加し、ゼリー状の原料が沈殿し、ろ過した。ろ過ケーキを水で洗浄し粗生成物を得た。粗生成物をメタノールに溶解した。その溶液を活性炭で脱色し、濃縮した。濃縮溶液に十分な量のアセトンを添加し、ホモジナイズした。生じた沈殿物ろ過した。ゼリー様のリン酸エステルを得た。
【0050】
上記スキーム6の終わりの段階において、上記粗生成物をメタノールに溶解した。その溶液にpHが8−9になるまで1Nの水酸化ナトリウムメタノール溶液を添加した。その溶液を活性炭で脱色し、濃縮した。濃縮溶液に十分な量のアセトンを添加し、ホモジナイズした。その溶液を冷却した。生じた沈殿物をろ過し、50℃にて乾燥した。淡褐色の固形物として2.2gのアジアティック酸ナトリウム塩―ホスホン酸塩を得た。図16cにその生成物の1H−NMRを示す。図17cはその生成物のマススペクトロスコピーを示す。
【0051】
7.アジアティック酸(asiatic acid)トリアセテート‐アミド誘導体
【式6】
【0052】

上記スキーム7の第一段階において、アジアティック酸(asiatic acid)(5g)を攪拌しながらピリジン(10ml)に溶解した。溶液を10℃に冷却し、15mlの無水酢酸を添加した。得られる溶液を20時間室温にて攪拌し、その後、200mlの氷水を添加した。生じた沈殿をろ過し、水で洗浄し、それから50℃にて乾燥した。白色粉体として6.28gのアジアティック酸トリアセテート塩を得た。
【0053】
上記スキーム7の第二段階において、6.5g(0.01058mol)のアジアティック酸トリアセテート塩を100mlのジクロロメタンに添加した。溶液を氷水で冷却し、それから1.2g(0.01186mol)のトリエチルアミン、1.55g(0.0111mol)エチルグリシネート(ethylglycinate)塩化水素、及び0.2g(0.00164mol)4‐ジメチルアミノピリジンを添加した。混合物を0.5時間0‐5℃にて攪拌した。その混合物に2.37g(0.0115mol)DCCの溶液及びジクロロメタン(50ml)を0.5時間以上滴下して加えた。反応物を2時間0−5℃にて攪拌し、それから24時間室温に放置した。固形物をろ過した。ろ過物を1NのHCl、及び飽和NaHCO3溶液で洗浄し、それから水で洗浄し、pHを中性にした。その溶剤を減圧下蒸発した。ゲル様材料として9gのアジアティック酸トリアセテート‐アミド誘導体を得た。
【0054】
その粗ゲル様生成物をシリカゲルカラムに移し、ジクロロメタン+アセトン(20:1)で溶出した。生成物の分画を集め、濃縮した。固形物をろ過して除去し、ろ過物を真空乾燥した。2.82gの白色結晶を得た。図16dにその生成物の1H−NMRを示す。図17dはその生成物のマススペクトロスコピーを示す。
【0055】
B.アジアティック酸(asiatic acid)塩のHPLC分析
上記に記載のように生成した特定のアジアティック酸(asiatic acid)塩をHPLC分析した。
【0056】
・標準調製物
約5mgのアジアティック酸(asiatic acid)を25mLのメスフラスコに移し、1mLのメタノールを加え、その酸がメタノールに溶解するまでよく混合した。それから、メスフラスコを移動相で体積に合わせ、よく混合した。
・クロマトグラフィーのパラメータ

【0057】
・システム適性
ワーキングスタンダード溶液(メタノール中200μg/mL)の6つの再現インジェクションで実施したクロマトグラフの操作ごとにシステム再現性を決定した。再現インジェクションでの相対標準偏差パーセント(%RSD)を計算した。アジアティック酸のテーリングファクター及び理論段数はRSDに用いられるワーキングスタンダード溶液の最初のインジェクションで計算された。
許容基準
・6つの再現インジェクション由来のピーク1に対するピークエリアレスポンスの%RSDが3.0%より大きくない。
・理論段数がNLT10000
・テーリングファクターがNMT1.5
・分離度NLT2.0
結果

【0058】
各塩の及び出発原料の回収を計算した(表1)。アジアティック酸(asiatic acid)塩の保持時間は出発原料のアジアティック酸と同じであり、塩がいかなる重要な構造変化をも起こしていないことを確認した(図1)。
【表1】

【0059】
水及びメタノールの溶解度
水及びメタノール中のアジアティック酸(asiatic acid)及びナトリウム塩(AJF09,99b)の一つについて溶解度の計算結果を得た。表2に結果を示す。アジアティック酸は水の中ではほとんど溶けない(0.03mg/ml)が、一方ナトリウム塩は228倍も溶ける。これは塩が形成されたことの有力な証拠であり、剤形調製に関して、薬剤的利用性に顕著な増加を明示する。
【0060】
サンプル調製物
メタノール及び水中での出発原料及び塩から得られる飽和溶液をろ過し、移動相で適宜希釈した。水中のアジアティック酸(asiatic acid)は希釈しなかった。メタノールで調製したナトリウム塩を除いて三回分のサンプルを調製した。そのナトリウム塩は2回分を調製した。
【表2】

【0061】
C.核磁気共鳴(NMR)分光法
予め、DMSO‐d6中1H−NMR及び13C‐NMR分光分析をアジアティック酸(asiatic acid)出発原料及びナトリウム塩(AJF09,99b)両方についてバリアン(Varian)300MHz装置にて実施した。一般的に、得られるプロトンNMRスペクトルはアジアティック酸の構造と整合性のある化学シフト及び分裂パターン(多重度)を証明する(図2)。両化合物のスペクトルを比較すると、幾つかのシグナルが化学シフトを変更し、この変更は特に4.0と4.6ppmの間であることが明らかとなる。これは塩形成と整合性のある電子的変化を示す。
【0062】
13C−NMRデータはアジアティック酸(asiatic acid)構造と整合性のある炭素の化学シフトを示す。図3及び4は出発材料及びそのナトリウム塩両方の代表的な13Cスペクトルを示す。アジアティック酸のスペクトル中およそ36、24、及び17ppmの化学シフトを有する炭素シグナルがナトリウム塩のスペクトル中で変化した。それは塩形成を示した。
【0063】
さらに、NMR分析を400MHzにて実施し、より分解されたプロファイルを得、予め行った分析結果を確認した。プロトン及びカーボンNMR両方の詳しい分析(図4a―hを参照願いたい)は、ナトリウム塩の分子構造が、新しいカルボン酸ナトリウムの効果により生じる観察される化学シフトの違いを除いて、実質的に同じもののままであることを明らかにする。塩形成の出現を立証する最も関連性のある違いは、
a.アジアティック酸は、通常カルボン酸官能基に関連する11.9ppmにてプロトンを有する。このシグナルはナトリウム塩では存在しない。
b.ひとつのカルボン酸炭素の化学シフトが、分析した材料両者間で相違いする。つまり、カルボン酸からカルボン酸塩への転換がこの挙動で説明される。
【0064】
D.粉体X線回析
X線回析をUSP<941>に従って、シマズLabX、XRD‐6000を用いて実施した。図5aはアジアティック酸(asiatic acid)回析図形を示す。得られる広いバンドは非晶質の特徴である。上記セクションIV.A.3にて設定した手順を2グラムスケールにてナトリウム塩を生成するためにスケールアップした場合、HPLC分析結果は上記セクションIV.B.にて述べたものと同様であり、粉体X線回析データからの結果は、得られた材料の結晶特性と整合性があった(図5bを参照願いたい)。
【0065】
E.フーリエ変換赤外分光法(FTIR)
FTIR分光分析をアジアティック酸(asiatic acid)、ナトリウム塩AJF09,82とAJF09,99b及びアンモニウム塩(AJF09,99a)について実施した。図6はアジアティック酸の得られる赤外スペクトルの例であり、1697cm−1付近の酸カルボニルバンドの存在により証明されるようにカルボン酸の典型的な特徴を示した。
【0066】
ナトリウム塩AJF09,82(図7)及びAJF09,99b(図8)から得られる赤外スペクトルは1697cm−1付近のカルボニルバンドの減少した強度及び1545及び1390cm−1付近の現れるバンドをはっきりと示した。後者のバンドの存在は、カルボン酸基ではなく、カルボキシレート基の存在に起因するものでる。これは塩形成の分光法的証拠である。アンモニウム塩AJF09,99a(図9)の赤外スペクトルは、塩が示すように、1390cm−1付近のバンドの存在を示す。1690cm−1付近のカルボン酸の特徴的バンドはまだ存在し、酸から塩への不十分な転換を反映しているかもしれない。
【0067】
F.熱重量分析(TGA)
TGAをTA Instruments Model Q5000を用いて実施した。装置のキャリブレーション検証をニッケルスタンダードを用いてUSP<891>に従って実施した。アジアティック酸(asiatic acid)及び二つのナトリウム塩、AJF09,82とAJF09,99bを分析した(図10−12)。サーモグラムに示すように、出発材料のアジアティック酸を400℃により分解した。両塩から得られるサーモグラムは温度に対する高い耐性を反映し、それは塩が化合物から形成されるときに見られる現象である。
【0068】
G.ナトリウム含有量決定
酸化空気アセチレンフレーム及び589nmでの検出を用いて、HGA 850 Graphite Furnaceを備えたPerkin Elmer AAnalyst 300 Atomic Absorption Spectrophotometerによりナトリウム含有量を決定した。ナトリウムの標準溶液を1000mg/Lの濃度にて塩化ナトリウムのストックから調製した。一般的にこの方法によるナトリウムの分析はセシウムのようなアルカリ塩存在下で実施し、イオン化を制御する。この場合、ナトリウムの感受性を最大化するために必要なセシウム(CsClの形での)の量を決定するために予備実験を行った。これらの実験に基づいて、0.3%CsClをすべてのサンプル及び標準調製物に用いた。
【0069】
標準ストック1(1000ppm Na)
これは正確に秤量した量の塩化ナトリウム(2.53g)を1.0Lのメスフラスコへ脱イオン水で溶解し、溶解後、脱イオン水で体積にあわせることにより調製した。
【0070】
3%塩化セシウム
これは正確に秤量した量の塩化セシウム(3g)を100mLのメスフラスコへ脱イオン水で溶解し、溶解後、脱イオン水で体積にあわせることにより調製した。
【0071】
0.3%塩化セシウム(希釈)
これは正確に秤量した量の塩化セシウム(6g)を2.0Lのメスフラスコへ脱イオン水で溶解し、溶解後、脱イオン水で体積にあわせることにより調製した。
【0072】
希釈ストック1(0.3% CsCl中100ppm Na)
これは10.0mLの標準ストック(1000ppm Na)及び10.0mLの3%の塩化セシウムを100mLのメスフラスコに移し、脱イオン水を用いて体積にあわせることにより調製した。
【0073】
希釈ストック2(0.3% CsCl中10ppm Na)
これは10.0mLの希釈ストック1(0.3% CsCl中100ppm Na)を100mLのメスフラスコに移し、0.3%塩化セシウム(希釈)を用いて体積にあわせることにより調製した。
【0074】
反応直線性
試験方法の直線性は試験結果に所望の範囲に渡って検体の濃度に正比例することを与える能力である。その吸収対相当するナトリウム濃度の試験を実施した。分析のセットそれぞれについて、2.0mL、3.0mL、4.0mL、5.0mL、及び6.0mLの希釈ストック2(0.3% CsCl中10ppm Na)を別々の50mLメスフラスコへ正確に移し、希釈液で各体積にあわせることによりNaClの標準溶液を調製し、それぞれ0.4ppm、0.6ppm、0.8ppm、1.0ppm、1.2ppmのスタンダードを作成した。各溶液を装置により3回測定し、三回の測定値の平均を用いて直線性のある検量線を作成した(図13)。
【0075】
アジアティック酸ナトリウム塩AJF09,82とAJF09,99bを分析した。結果を表3に示す。
【表3】

【0076】
アジアティック酸(asiatic acid)塩の各分子にナトリウムの1分子が存在すると仮定する場合、サンプル中約4.5%ナトリウムの含有が予想される。
【0077】
さらに、本発明を追加的下記実施例を参照することにより記載する。それらは実施例の本発明の説明であり、本発明を限定するものではない。
【0078】
ラットにおけるブレオマイシン‐誘発肺線維症への効果
1.目的
ラットにおけるブレオマイシン‐誘発肺線維症へのアジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)の効果を観察するために、疾患モデルが確立した後、2日目及び7日目それぞれでの投薬を実施した。
【0079】
2.材料及び方法
動物:SDラット(オス) 体重250−300g Shanghai SLACC Co. Ltdより入手
TFG‐βキット、ヒト96T ELISAキットShanghai Jingmeiより輸入
TNF‐αキット、ヒト96T ELISAキットShanghai Jingmeiより輸入
アジアチコサイド(≧92%純度)
アジアティック酸(≧98%純度)
注射用ブレオマイシン Tianjin Taihe Pharmaceuticalから使用 スペック:8 mg/Ap
デキサメタゾン Shanghai Sinepharm、スペック:5mg/Ap
3.用量及び投与経路
アジアティック酸 3、9、及び 27mg/kg 経口 (経口(p.o.))x 28日
アジアチコサイド 36mg/kg 経口(p.o.)x 28日
デキサメタゾン 0.6mg/kg 経口(p.o.)x 28日
ブレオマイシン 5mg/kg 経口(p.o.)x 28日
【0080】
4.方法
オスSDラット、体重250‐300g。ラットを3%セコナール(Seconal)で麻酔し、平たく広げて手術台に固定した。ラットの首をアルコールで消毒し、カットし、気管を露出させた。針を気管リング(tracheal ring)間の空間を通して求心的に挿入し5mg/kgのブレオマイシンを注射した。ラットを直立させ、反転させ、溶液を肺に均一に広げるようにした。それから切開箇所を縫合した。
【0081】
ラットが意識を回復した後、ラットを不規則的にグループ分けした。ラットを
(i)モデルが確立した後次の日に投与を受けるグループ、及び
(ii)モデルが確立した後7日目に投与を受けるグループ
に分けた。27、9、及び3mg/kg経口(p.o.)x 28日アジアティック酸(asiatic acid)、0.6mg/kg経口(p.o.)x 28日デキサメタゾングループ、36mg/kg経口(p.o.)x 28日アジアチコサイド(asiaticoside)グループ、モデルグループ及びブランクグループを含んだ。生理食塩水をモデル及びブランクグループに投与した。アジアティック酸及びアジアチコサイド投与後28日にて肺の生存及び重量比を測定した。病理学検査及び血清学的検査を実施した。
【表4】

アジアティック酸処理したラットにおけるブレオマイシン‐誘発肺線維症の肺重量指標での効果
ラットを殺処分した後、体重及び肺重量を測定した。
肺重量比=(肺重量/体重)x100%
【0082】
結果を表5及び6に示す。次の表の1アスタリスク(*)はモデルグループと比較しての有意差(P<0.05)を示し、2アスタリスク(**)は顕著な有意差(P<0.01)を示す。
【表5】

【表6】

【0083】
表5及び6に示すように、2日又は7日での開始であって、高、中、低‐用量のアジアティック酸(asiatic acid)グループにおけるラットの肺重量比はモデルグループと比較して顕著に低かった。アジアチコサイド(asiaticoside)グループから得られる結果は、アジアティック酸の結果と同様であった。デキサメタゾングループにおいて示される肺重量比は比較的高く、これはおそらく、デキサメタゾンにより生じる体重減少によるものである。
【0084】
ブレオマイシン‐誘発肺線維症のラットにおけるいくつかのサイトカインでのアジアティック酸(asiatic acid)処理の血清学的効果。
【0085】
血清サンプルを標準手順(回収後3000rpm、10分間遠心分離)に従って調製し、−20℃に保管した。試験をキットの説明書に従って実施した。表7に結果を示す。
【表7】

【0086】
ラットにおけるブレオマイシン誘発肺線維症でのアジアティック酸の効果の病理学的分析
肺組織を一週間10%ホルマリンで固定した。二つの肺の下葉の組織を乾燥させ、パラフィンに浸し、パラフィン包埋及びパラフィン切片を行った。切片の薄さは3−4μmであった。所定のヘマトキシリネオシン(HE)染色を行った。コラーゲン線維及び弾性線維の二つの特別な染色を実施し、線維症の程度を検出した。切片の二つのグループの染色を観察した。結果を下記に示す。
【0087】
ブレオマイシンを用いるモデルを確立後、次の日に投与を受けるグループ
通常グループ
動物の肺組織の形態学的構造は無傷であり、出血、増殖、又は浮腫はなかった。しかしながら、多くのラットの肺組織中、少量の炎症細胞の浸潤があった。幾つかのラットにおいて炎症細胞の顕著な浸潤及びいくつかの局部的範囲おけるに密集があった。
【0088】
コラーゲン線維及び弾性線維の二つの染色は肺胞中隔がわずかに厚みをおび、少量の線維芽細胞の増殖を示した。
【0089】
モデルグループ
炎症細胞(主にリンパ球)の浸潤があり、ラットの肺組織中、肺胞中隔の過形成があった。肺胞中隔において中等度から重篤に及ぶ局部の肥厚があり、厚くなった損傷中、線維芽細胞の中等度の過形成があった。末端細気管支の末梢領域に関与する重篤な肺胞炎及び線維増殖症があり、幾つかの領域にてほとんど肺胞がなかった。肺胸膜下、肺胞の軽度の委縮又は肺気腫があった。
【0090】
コラーゲン線維及び弾性線維の二つの染色が存在した。これは、肺組織中、コラーゲン線維及び弾性線維の多くが増殖することを示した。幾つかの領域でほとんど肺胞がなかった。幾つかの血管壁においてコラーゲン線維及び弾性線維の過形成があった。内腔は小さくなり、血管の周りにコラーゲン線維及び弾性線維の多くの過形成があった。
【0091】
デキサメタゾングループ
肺組織中炎症細胞(主にリンパ球)の軽度の浸潤があった。肺胞中少量の炎症細胞の浸潤があり、肺胞中隔の軽度の過形成があった。線維芽細胞の軽度の増殖、水疱形成があり、肺胸膜下、軽度の肺の萎縮及び肺気腫があった。
【0092】
コラーゲン線維及び弾性線維の染色は、肺組織中コラーゲン線維及び弾性線維の少しの増殖を示した。
【0093】
アジアチコサイド(asiaticoside)投与グループ
肺組織中、軽度の炎症及び肺胞炎(主にリンパ球)があった。肺胞中隔の軽度の過形成及び、軽度の肺の萎縮又は肺気腫が隔膜下に見られた。上記病理学の変化の程度及び範囲はデキサメタゾン投与グループのものと同様であったが、モデルグループのものよりそれほど重篤ではなかった。
【0094】
コラーゲン線維及び弾性線維の染色は、デキサメタゾングループのものと同様であった。
【0095】
アジアティック酸(asiatic acid)低用量グループ
肺組織中、軽度の炎症及び肺胞炎(主にリンパ球)があった。肺胞中隔の軽度の過形成があり、肺胞中隔は少し厚みをおび、少量の線維芽細胞の増殖があり、軽度の肺の萎縮又は肺気腫が、隔膜下に見られた。上記病理学の変化の程度及び範囲はアジアチコサイド投与グループのものと同様であった。
【0096】
コラーゲン線維及び弾性線維の染色は、デキサメタゾングループのものと同様であった。
【0097】
アジアティック酸(asiatic acid)中用量グループ
肺組織中、炎症細胞(主にリンパ球)の軽度の浸潤があった。炎症は肺胞に起こっており、肺胞中隔は軽度に厚みをおび、肺胞中隔の過形成があった。線維芽細胞の軽度の増殖があり、肺胸膜下に軽度の肺胞の萎縮及び肺気腫があった。
【0098】
コラーゲン線維及び弾性線維の染色は、線維芽細胞の増殖が明らかとなり、モデルグループのものよりかなり軽度であった。多くのラットでの範囲及び程度は低用量のものと同様であったが、本グループの2,3匹のラット中病理学的変化は低容量のものより軽度であった。
【0099】
アジアティック酸(asiatic acid)高用量グループ
肺組織中、炎症細胞(主にリンパ球)の軽度の浸潤があった。炎症は肺胞に起こっており、肺胞中隔は軽度な厚みをおびた。線維芽細胞の軽度の増殖があり、肺胸膜下に軽度の肺胞の萎縮及び肺気腫があった。
【0100】
コラーゲン線維及び弾性線維の染色は、わずかな線維芽細胞の増殖を示し、いくつかの範囲で通常のものと同様であった。このグループでの病理学的変化は中用量及び低用量グループ及びアジアチコサイド(asiaticoside)グループのものより軽度であった。
【0101】
ブレオマイシンを用いるモデルを確立後、7日目に投与を受けるグループ
通常グループ及びモデルグループの様子はモデルを確立後、次の日に投与を受けるグループのものと同様であった。
【0102】
デキサメタゾングループ
肺組織中、炎症細胞(主にリンパ球)の軽度な浸潤があった。肺胞中、少量の炎症細胞の浸潤があり、肺胞中隔が軽度に厚みをおびた。線維芽細胞の軽度の増殖及び多くの水疱の形成があり、肺胸膜下に軽度の肺の萎縮及び肺気腫があった。病理学的変化はモデルを確立後、次の日にデキサメタゾンを受けるグループのものより顕著に重篤であった。
【0103】
コラーゲン線維及び弾性線維の染色は、肺組織中、線維増殖があり、肺胞の壁の肥厚及び線維増殖の程度が、モデルを確立後、次の日にデキサメタゾンを受けるグループのものより顕著に重篤であった。
【0104】
アジアチコサイド(asiaticoside)及びアジアティック酸(asiatic acid)の用量グループそれぞれの様子はブレオマイシンをもちいてモデルを確立後、次の日に投与を受けるグループのものと同様であった。
【0105】
5.分析
ブレオマイシンにより誘発される肺線維症は肺線維症における作用機序の研究のための及び一般的な抗線維症及び抗炎症治療の発見のための「究極的な判断基準」モデルである。ブレオマイシン処理後多くの種類の肺において見られた生化学的及び形態学的変化はヒトに見られるものを想定する。
【0106】
ブレオマイシン処理により活性化される炎症経路及び線維症経路は、炎症及び糖尿性ネフロパシー(腎線維症)のような線維症に見られるものと同様である。さらに、Gauldie他、Proc. Am. Thorac. Soc. 3: 696-702 (2006)は、肺気腫を含む慢性閉塞性肺疾患(COPD)がいくつかの同じ異常調節経路に依存することを示す証拠を記載している。従って、上述のように、本発明の結論が関節炎、炎症性大腸炎、乾癬、肺線維症、糖尿性ネフロパシー、及びDOPDのような炎症及び線維症の疾病治療での治療組成物としての有用性に適合する。
【0107】
肺炎はブレオマイシンにより生じ、後の肺線維症は大変重篤になるので、モデルグループで50‐70%の動物が死んだ。動物の死は、呼吸不全に関連すると考えられ、慢性炎症及び線維症により生じる。デキサメタゾンはブレオマイシン誘発死からラットを保護することができない。驚くことに、アジアチコサイド(asiaticoside)及びアジアティック酸(asiatic acid)はブレオマイシン誘発死を顕著に防止した。
【0108】
また、結果はアジアティック酸(asiatic acid)がTNF−α及びTGF−βを低下できることを示す。最も高い用量を用いると有効性がわずかに高くなる。
【0109】
定期検査としてヘマトキシリン‐エオシン染色を導入し、コラーゲン線維及び弾性線維の染色を実施したところ、抗線維症効果がうまく観察された。病理学的結果は、用量反応に基づいて、アジアティック酸(asiatic acid)がブレオマイシン誘発肺線維症に対して有効であることを示す。アジアティック酸の高用量グループにおける有効性はアジアチコサイド(asiaticoside)グループよりよく、一方、中用量、低用量グループはアジアチコサイドグループと同様であった。興味深いことに、モデル確立後、2日目及び7日目に投与開始したデキサメタゾングループの間で顕著な病理学的相違があった。それは、投与が2日目に開始した場合、肺線維症がより顕著に軽減された。これは、デキサメタゾンが炎症を阻害することにより発揮するその抗線維症効果によるかもしれない。一度、炎症の初期段階が起こると、デキサメタゾンの効果は減少する。アジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)は初期の炎症段階及び後の線維症段階両者にて作用する。つまり、化合物が誘発後2日目及び7日目に投与された場合、有効性はグループ間でそれほど変化していない。
【0110】
従って、精製アジアティック酸及びアジアチコサイドはブレオマイシン誘発炎症及び線維症の効果に対抗することを示した。
【0111】
ブレオマイシン処理後7日目投与開始はデキサメタゾンの有効性に影響するが、それは、アジアティック酸又はアジアチコサイドの有効性にほとんど影響しない。これはアジアチコサイド及びアジアティック酸が、ブレオマイシン処理後にすぐに生じる炎症の阻害を通してのみ作用するのではないことを示唆する。代わりに、データは、炎症及び線維症過程両方にてアジアチコサイド及びアジアティック酸の直接的阻害作用を支持する。
【表8】

【表9】

【技術分野】
【0001】
優先権の主張
本出願は2008年1月11日出願の米国仮出願第61/006,432の優先権を主張し、参照により本明細書に組み込まれる。
【背景技術】
【0002】
Bontems, Bull. ScL Pharmacol. 49: 186-91 (1941)にて最初に報告されたように、アジアティック酸(asiatic acid)及びそのトリサッカライドのアジアチコサイド(asiaticoside)はセンテラ アジアチカ(Centella asiatica)から抽出され、これは、小さい、一年生草本植物で、アジア太平洋周縁が原産であり、ニンジン及びディルを含むセリ科の仲間である。アジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)の化学構造式を下記に示す。
【式1】
【0003】

【式2】
【0004】

Polonsky, Compt. Rend. 232: 1878-80 (1951)、及びBull. Soc. Chim. 173-80 (1953)を参照願いたい。
【0005】
皮膚の傷及び慢性潰瘍の治療法ではアジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)を含むセンテラ アジアチカ(C. asiatica)抽出物の使用が知られている。関連する流れにおいて、文献は結核及びハンセン病に関連する皮膚変形の治療にセンテラ アジアチカ(C. asiatica)抽出物を使用することを開示している。例えば、Boiteau他、Bull. Soc. Chim. 31 : 46-51 (1949)を参照願いたい。
【0006】
このような創傷治癒のために、作用の薬理学作用機序は、角質化の誘導に関連している。May, Eur. J. Pharmacol. 4: 331-39(1968)を参照願いたい。このことは、特に、皮膚線維芽細胞の増殖及びコラーゲンIを含む細胞外マトリクス成分の合成を促進することにより行われる。例えば、Lu他、Int 'l J. Dermatol. 43: 801-07 (2004)、Skukla他、 J. Ethnopharmacol. 65: 1-11 (1999)を参照願いたい。Bonte他、Planta Med. 60:133-35 (1994)によれば、アジアチコサイド(asiaticoside)及び酸の比較は前者の糖部分がこの生物学的活性に必要ないらしいと示す。さらに、Grimaldi他、J. Ethnopharmacol. 28: 235-41 (1990)に記載のように、アジアチコサイド(asiaticoside)は、被験者への経口投与の後、血漿アジアティック酸(asiatic acid)に完全に転換する。
【0007】
これらの創傷治癒特性に関する知識に基づき、米国特許第5,834,437においてアジアティック酸(asiatic acid)又はその誘導体の一つを含む皮膚病薬の提案がなされた。また、米国特許第6,417,349を参照願いたい。それは、肝線維症の動物モデルにおいて、アジアチコサイド(asiaticoside)及びセンテラ アジアチカ(C. asiatica)により作られる関連化合物であるマデカッソシド(madecassoside)の水溶性抽出物の腹腔内投与により達成される苦痛緩和効果を開示する。創傷治癒及び抗線維化特性に加えて、内服投与されるアジアチコサイド(asiaticoside)が、脾臓細胞のレベル及びCOX‐2、PGE2、TNF‐アルファ、及びIL−6を含む炎症性の分子のレベルを低減し、その結果、関節炎の標準(コラーゲン誘発)げっ歯類モデルにおいて足浮腫、関節炎スコア、及び滑膜の過形成のような複数の関節炎パラメータの阻害又は低減の効果を有することが報告された。Li他、Yao Xue Xue Bao (Acta Pharma. Sinica) 42: 698-703 (2007)を参照願いたい。
【0008】
これら及び他の開示はアジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)の治療潜在能力に関連するけれども、いずれの化合物を抽出するにも比較的低い収量及び低い純度を伴うという困難性があるという事実により潜在能力が妨げられていたことがわかる。さらに、治療組成物に用いるためのアジアティック酸(asiatic acid)の塩を生成することについてあまり知られていない。米国特許第6,891,063は特定のアジアティック酸(asiatic acid)塩、特に、アンモニウムカチオンを有する塩を開示し、問題となる治療に有効であったと開示している。
【発明の概要】
【0009】
本発明は高純度のアジアティック酸(asiatic acid)を提供する。ある実施態様においては、医薬品グレード、好ましくは、約98%純度のアジアティック酸(asiatic acid)である。
【0010】
また、本発明は高純度アジアティック酸(asiatic acid)から作られる塩を提供する。その塩は、アルカリ金属塩、又はアルカリ土類金属塩、又は任意に置換されるアンモニウム塩である。あるいは、塩はカリウム塩である。別の実施態様においては、塩はナトリウム塩である。さらに別の実施態様においては、塩はトロメタモール塩である。本発明は、前述の塩の一以上のいずれかを含む固形の剤形を提供する。
【0011】
さらに、本発明は高純度のアジアティック酸(asiatic acid)誘導体を提供する。これらの誘導体の例は、アミド又はエステルである。好ましい実施態様においては、誘導体はアジアチコサイド(asiaticoside)である。
【0012】
本発明の別の態様によれば、治療組成物は、薬剤に許容できる担体を用いて高純度アジアティック酸(asiatic acid)又はアジアチコサイド(asiaticoside)を作成し、アジアティック酸又はアジアチコサイドの実質的に治療効果のある量からなる剤形を提供することを含む方法の生成物であることを特徴とする。
【0013】
さらなる態様によれば、本発明は線維症の治療のための手順又は線維症の予防を提供する。本発明の手順はそのような病気を患う又は患う危険性のある対象に上述の治療組成物を投与することを含む。この文脈において線維症の例は放射線‐誘発肺炎及び線維症、特発性肺線維症、糖尿病性ネフロパシー、及び慢性閉塞性肺疾患(COPD)である。
【0014】
さらに本発明の別の態様においては、方法は、炎症性の病気の治療又は予防であって、そのような病気を患う又は患う危険性のある対象に上述の治療組成物を投与することを含むことを特徴とする。これに関して、炎症性の病気のカテゴリーは例として関節炎、炎症性大腸炎、乾癬を含む。
【図面の簡単な説明】
【0015】
【図1】図1はアジアティック酸(asiatic acid)出発原料及び生成される塩のHPLC記録の重ね合わせを示す。
【図2】図2は300MHzにおける、アジアティック酸(asiatic acid)ロット番号071109及びナトリウム塩AJF09,99bのDMSO‐d6での1H‐NMR分光分析を示す。
【図3】図3は300MHzにおける、アジアティック酸(asiatic acid)ロット番号071109及びナトリウム塩AJF09,99bのDMSO‐d6での13C‐NMR分光分析を示す。
【図4】図4は300MHzでの11ppmから41ppmにおける、アジアティック酸(asiatic acid)ロット番号071109及びナトリウム塩AJF09,99bのDMSO‐d6での13C‐NMR分光分析を示す。
【図4a】図4aはDMSO‐d6でのアジアティック酸(asiatic acid)の完全1H‐NMRスペクトルを示す。
【図4b】図4bはアジアティック酸(asiatic acid)1H‐NMRスペクトルの拡大図を示す。
【図4c】図4cはアジアティック酸(asiatic acid)ナトリウム塩(AJF09,99b)の完全1H‐NMRスペクトルを示す。
【図4d】図4dはアジアティック酸(asiatic acid)1H‐NMRスペクトルの拡大図を示す。
【図4e】図4eはDMSO‐d6でのアジアティック酸(asiatic acid)の13C‐NMRスペクトルを示す。
【図4f】図4fはアジアティック酸(asiatic acid)の13C‐NMRスペクトルの拡大図を示す。
【図4g】図4gはDMSO‐d6でのアジアティック酸(asiatic acid)ナトリウム塩の完全13C‐NMRスペクトルを示す。
【図4h】図4hはアジアティック酸(asiatic acid)ナトリウム塩の13C‐NMRスペクトルの拡大図を示す。
【図5a】図5aはアジアティック酸(asiatic acid)のPXRDを示す。
【図5b】図5bはアジアティック酸(asiatic acid)のナトリウム塩のPXRDを示す。
【図6】図6はアジアティック酸(asiatic acid)のFTIRスペクトルを示す。
【図7】図7はアジアティック酸(asiatic acid)のナトリウム塩(AJF09,82)のFTIRスペクトルを示す。
【図8】図8はアジアティック酸(asiatic acid)のナトリウム塩(AJF09,99b)のFTIRスペクトルを示す。
【図9】図9はアジアティック酸(asiatic acid)のナトリウム塩(AJF09,99a)のFTIRスペクトルを示す。
【図10】図10はアジアティック酸(asiatic acid)のTGAサーモグラフを示す。
【図11】図11はアジアティック酸(asiatic acid)のナトリウム塩AJF09,82のTGAサーモグラフを示す。
【図12】図12はアジアティック酸(asiatic acid)のナトリウム塩AJF09,99bのTGAサーモグラフを示す。
【図13】図13は直線性の検量線を示す。
【図14】図14はアジアチコサイド(asiaticoside)生産のためのプロセスの図式的説明である。
【図15】図15は医薬品グレードのアジアティック酸(asiatic acid)生産のためのプロセスの図式的説明である。
【図16a】図16aはアジアティック酸(asiatic acid)カリウム塩の1H‐NMRを示す。
【図16b】図16bはアジアティック酸(asiatic acid)トロメタモール塩の1H‐NMRを示す。
【図16c】図16cはアジアティック酸(asiatic acid)ナトリウム塩‐ホスホン酸ナトリウムの1H‐NMRを示す。
【図16d】図16dはアジアティック酸(asiatic acid)トリアセテート‐アミド誘導体の1H‐NMRを示す。
【図17a】図17aはアジアティック酸(asiatic acid)カリウム塩のマススペクトロスコピーを示す。
【図17b】図17bはアジアティック酸(asiatic acid)トロメタモール塩のマススペクトロスコピーを示す。
【図17c】図17cはアジアティック酸(asiatic acid)ナトリウム塩‐ホスホン酸ナトリウム塩のマススペクトロスコピーを示す。
【図17d】図17dはアジアティック酸(asiatic acid)トリアセテート‐アミド誘導体のマススペクトロスコピーを示す。
【発明を実施するための形態】
【0016】
発明の詳細な説明
上に詳しく述べた問題点にかんがみ、本願発明者は高い純度で、薬理学的開発に有用なアジアチコサイド(asiaticoside)及びアジアティック酸(asiatic acid)両方を得るための容易に実施できる方法を開発した。さらに、本願発明者は、治療製剤のための、特に炎症及び線維症にかかる疾患を治療するための必要な物理的特性を有するアジアティック酸(asiatic acid)塩を作り、その特徴づけを行った。
【実施例】
【0017】
I.医薬品グレードのアジアティック酸(asiatic acid)の生産
A.92%純度のアジアチコサイド(asiaticoside)の調製
粗アジアチコサイド(asiaticoside)粉を例えばGuangxi Changzhou Natural Product Co. Ltd. (www.changzhou−centella.com)から商業的に入手できる。
【0018】
粗アジアチコサイド(asiaticoside)粉に4X60%EtOH(V/W)を加えた。混合物を約70℃から約90℃(例えば、80℃)の範囲の温度にて加熱しながら還流し固形物を溶解した。溶液を冷却し、16時間結晶化のために5℃のコールドルームに放置した。非晶質の沈殿物が形成され、ろ過された。回収された沈殿物をその色が白色に変わるまで60%EtOHで洗浄した。それから、沈殿物を約55℃から約70℃(例えば、60℃)の範囲の温度及び約−0.09から−0.11MPaの範囲、例えば、−0.10MPaの減圧にてオーブン乾燥した。
【0019】
乾燥沈殿物に30X(V/W)80%アセトン水溶液を加えた。混合物を1時間加熱しながら還流し、固形物を溶解した。溶液をろ過し、そのろ液を24時間結晶化のために10℃のコールドルームに放置した。非晶質の沈殿物が形成され、ろ過された。回収沈殿物をその色が白色になるまで80%アセトンで洗浄した。沈殿物を乾燥し、乾燥固形物をアジアチコサイド(asiaticoside)粉を作るために粉にした。図14にプロセスの概要を示す。
【0020】
B.98%純度のアジアティック酸(asiatic acid)の調製
上述のように調製されるアジアチコサイド(asiaticoside)粉(純度約92%)の200mgを8X(V/W)4%NaOH/50%EtOH溶液(1600ml)に溶解した。得られた溶液を80℃の水浴中約3−4時間還流し、それから室温まで又は室温に近くなるまで冷却した。
【0021】
それからこの溶液のpHを連続的に攪拌しながら少量ずつ(例えば、各回約10ml)徐々に希釈HCl(1から2倍に前もって希釈された)を添加することにより4と5の間に調整した。その処理中継続的に沈殿物が析出し、最終的に粘性のある生地を形成した。
【0022】
この生地を減圧にて真空ろ過用200mmブフナー漏斗へ移した。そのろ液を除いた。沈殿物をろ液の色がほとんど無色になるまで真空下で水を用いて洗浄した。それから沈殿物をろ液の色がほとんど無色になるまで30%EtOHで洗浄した。これら二度の洗浄でのろ液を除去した。
【0023】
8X(V/W)無水EtOH(約1600ml)を沈殿物に加え、それから混合物を80℃の水浴中加熱しながら還流し、沈殿物を完全に溶解した。それから2X(約400g)活性炭を加え、溶液をさらに30分間連続的に還流した。溶液をまだ温めながら減圧にて真空ろ過で200mmのブフナー漏斗を用いて活性炭をろ過した。用いた活性炭を除去した。それから同量の別のバッチの活性炭をろ液に加えた。混合物を別に30分間還流させ、まだ温めながら減圧にて200mmのブフナー漏斗を用いて真空ろ過した。
【0024】
ろ液を室温まで冷却した。ろ液にさらなる白い沈殿物が析出しなくなるまで各約100−200mlに分けて水を加えた。水の全体積は約4000ml必要とされた。それから溶液を減圧にて200mmのブフナー漏斗を用いて真空ろ過した。ろ液を除去した。それから漏斗の中の白い固形物を乾燥した。乾燥固形物を98%(W/W)純度のアジアティック酸(asiatic acid)原料を生産するために粉にした。図15にプロセスの概要を示す。
【0025】
II.アジアティック酸(asiatic acid)の薬理学的活性
ラットのブレオマイシン処理は線維症の動物モデルを確立するために好ましい手段である。下記にさらに詳しく述べるように、本発明のアジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)組成物は、処理開始時期がブレオマイシン投与後1日であっても7日目であっても、ブレオマイシン処理ラットの生存を著しく増強させる。これは、従来肺線維症を治療するために用いるデキサメタゾンが同様な条件下でラットの生存をほとんど増強しない事実に照らして、予想外の結果である。
【0026】
デキサメタゾンの主な効果は炎症経路に対してであるので、本発明で得られる結果は、炎症プロセスに対する阻害効果に加えて、アジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)は線維症に関連する又は線維症に直接関与する他の経路にも効果を発揮することを示す。例えば、肺組織病理学により検出されるように、アジアティック酸(asiatic acid)はブレオマイシン‐誘発肺線維症の程度を低減する。アジアティック酸(asiatic acid)又はデキサメタゾン処理をブレオマイシン損傷後7日に開始する場合、アジアティック酸(asiatic acid)がデキサメタゾンより効果を有し、アジアティック酸(asiatic acid)が炎症プロセスを標的にするだけでなく、デキサメタゾンより直接的な線維症での効果を有することを示す。
【0027】
肺重量対体重の比により測定する場合、ブレオマイシン損傷後処理を1日又は7日に開始するかどうかにかかわらず、アジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)が、ブレオマイシン‐誘発肺線維症を顕著に低減し、デキサメタゾンより十分効果を発揮する。
【0028】
また、アジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)は、ヒドロキシプロリン(コラーゲン前駆体)及びタイプIIIコラーゲンの血清レベルにより測定する場合、ブレオマイシン‐誘発線維症を著しく低減する。同様な条件下におけるアジアティック酸(asiatic acid)の効果はブレオマイシン暴露後処理を1日又は7日に開始するかどうかにかかわらず、デキサメタゾンと同等又はデキサメタゾンよりわずかによい。
【0029】
デキサメタゾンと比較して、ブレオマイシン暴露後処理を1日又は7日に開始するかどうかにかかわらず、アジアティック酸(asiatic acid)は、線維症‐仲介サイトカイン形質転換成長因子ベータ(TGF‐β)及び腫瘍壊死因子アルファ(TNF‐α)のブレオマイシン誘発血清レベルを著しく低減する。
【0030】
III.治療指標及び製剤
従って、本明細書に詳しく説明する結果は、本発明に従って作られる医薬品グレードのアジアティック酸(asiatic acid)及び高純度のアジアチコサイド(asiaticoside)が炎症に関与する広範囲の疾病、及び線維芽細胞及びマトリックス蓄積(線維症)に関与する広範囲の疾病を治療するための実用性を明かにする。炎症に関する疾病のクラスの例は、乾癬、クローン病及び潰瘍性大腸炎を含む炎症性大腸炎疾患、及び関節リウマチ、変形性関節症及び乾癬性関節炎を含む関節炎である。これらの疾病の進行は、異常な免疫系活性により示され、COX‐2、及び特定のサイトカイン及びプロスタグランジンのような炎症性分子のレベルを上昇させる。線維症のクラスの例は放射線‐誘発肺炎及び線維症、特発性肺線維症、及び腎線維症により進行が発見される糖尿病性ネフロパシーである。
【0031】
従って、本発明の態様は、薬剤、特に内服用薬剤を製造するために従来使用する他の成分を有する高純度アジアティック酸(asiatic acid)又はアジアチコサイド(asiaticoside)を作ることにより調製される治療組成物を提供する。即ち、本発明の治療組成物は、高純度アジアティック酸(asiatic acid)又はアジアチコサイド(asiaticoside)の抗線維性効果が組成物の他の成分により悪影響を受けない限り、他の成分、すなわち薬剤に許容できる担体、賦形剤、又は安定剤の一以上を含んでよく、これらは例えばREMINGTON - THE SCIENCE AND PRACTICE OF PHARMACY 21st ed. (2005)に記載される。
【0032】
部分的に投与の所望の態様に応じて、本発明の治療組成物を非経口投与として注射剤用に製剤化してよい。この目的のために、治療組成物は水溶液として作られ、ハンクス液、リンゲル液、又は生理食塩緩衝液のような生理的に適合する緩衝液を含んでよい。
【0033】
本発明の別の態様においては、アジアティック酸(asiatic acid)の塩(次のセクションを参照願いたい)を薬剤に許容できる固形マトリックスと調合してよく、とりわけ、内服用、口腔用、舌下用、直腸用、又は膣内用投与に有用な固形剤形を提供する。本発明の本態様においては、治療組成物は、高純度アジアティック酸(asiatic acid)又はアジアチコサイド(asiaticoside)、又はアジアティック酸(asiatic acid)の塩を一以上の固形賦形剤と混ぜ合わせ、任意に混合物をすりつぶし、それからその混合物をできれば適切な補助剤の添加の後に加工し、それにより錠剤又はドラジェコア(Dragee core)を得ることのできる製品でよい。これに関する適切な賦形剤は糖(乳糖、サッカロース、マンニトール、ソルビトール等)のような充填剤及び例えば、トウモロコシデンプン、小麦デンプン、コメデンプン、ジャガイモデンプン、ゼラチン、トラガカントゴム、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロースナトリウム(CMC)、及び/又はポリビニルピロリドン(PVP、プロビドン)のようなセルロース調製物である。また、崩壊剤を加えてよく、例えば、架橋ポリビニルピロリドン、寒天、又はアルギン酸又はアルギン酸ナトリウムのようなアルギン酸塩である。
【0034】
ドラジェコア(Dragee core)には適切なコーティングが供される。この目的のため、糖溶液を用いてよく、これは、任意に、アラビアゴム、タルク、ポリビニルピロリドン、カーボポルゲル、ポリエチレングリコール(PEG)、及び/又は二酸化チタン、ラッカー溶液、及び適切な有機溶媒又は溶媒混合物を含んでよい。活性化合物投与量を同定するため又はその異なる組合せを特徴付けるために染料又は色素を錠剤又はドラジェコーティングに加えることができる。
【0035】
経口投与に有用な本発明の治療組成物は、ゼラチンから作られたプッシュ‐フィットカプセル、並びにゼラチン及び可塑剤、例えばグリセロール又はソルビトールから作られた軟質密封カプセルであり、高純度アジアティック酸(asiatic acid)又はアジアチコサイド(asiaticoside)で作られる固形製剤を含む。上述のように、これに関連して、プッシュ‐フィットカプセルは、例えばラクトースのような充填剤、例えばデンプンのようなバインダー、及び/又は、例えばタルク又はステアリン酸マグネシウムのような潤滑剤との混合物及び任意に一以上の安定剤との混合物において活性成分を含んでよい。軟質カプセルにおいて、活性化合物は、適切な液体、例えば脂肪油、液体パラフィン、又は液体ポリエチレングリコール(PEG)中に溶かし又は懸濁することができる。更に、任意に安定剤を加えることができる。
【0036】
本発明の治療組成物を投与する別の態様は吸入又は注入であり、治療剤が直接気道に運ばれる。例えば、米国特許第5,607,915及びPCT出願WO 97/39745及びWO 99/47196を参照願いたい。この目的のために、本発明はネブライザー、液体スプレー装置、又は電気流体力学(EHD)エアロゾル装置を通しての投与に有用である液体製剤を含む。
【0037】
ある実施態様においては、そのような組成物は薬剤に許容できる担体を含み、担体はアルコール、水、ポリエチレングルコール、又はペルフルオロカーボンのような液体である。任意に、別の材料を本明細書に記載のように活性成分の溶液又は懸濁液のエアロゾル特性を改変するために添加してよい。この他の材料は液体でよく、例えば、アルコール、グリコール、ポリグリコール、又は脂肪酸である。本発明に従って、他の手段をエアロゾル装置に用いるために有用な液体溶液又は懸濁液を作るために用いてよい。米国特許第5,112,598及び第5,556,611を参照願いたい。
【0038】
本発明の浮遊組成物を投与するために別の形式はドライパウダー吸入器に有用な乾燥粉末担体を用いる。そのような担体の例は、
フルクトース、マンニトール、アラビノース、キシリトール、及びデキストロース(グルコース)及びそれらの一水和物のようなモノサッカライド、
ラクトース、マルトース、又はスクロースのようなジサッカライド、及び
例えば、デンプン、デキストリン、及びデキストランのようなポリサッカライド
である。例えば、本発明のアジアティック酸(asiatic acid)塩を米国特許第5,376,386に一般的に記載されているようにミクロナイザー(micronizer)を用いて、これらの担体材料の一以上を有する乾燥粉末へ製剤化してよい。
【0039】
IV.薬理学的使用のためのアジアティック酸(asiatic acid)塩の生産及び特性評価
アジアティック酸(asiatic acid)がメタノール中で良好な溶解度を有することにかんがみ、本発明は、例えば、アジアティック酸(asiatic acid)をメタノール水酸化ナトリウム、メタノール炭酸ナトリウム、メタノール水酸化アンモニウム、それぞれに溶解することによる、アジアティック酸(asiatic acid)の塩を形成することを意図する。アジアティック酸(asiatic acid)塩の生産及び特性評価を下記に詳しく記載する。
【0040】
A.アジアティック酸(asiatic acid)の塩スクリーニング
アジアティック酸(asiatic acid)がメタノール中で良好な溶解度を有すること(下記参照)にかんがみて、アジアティック酸をメタノール水酸化ナトリウム溶液、メタノール炭酸ナトリウム溶液、メタノール水酸化アンモニウム溶液、それぞれに溶解することにより、アジアティック酸(asiatic acid)の塩を形成することを意図する。
【0041】
1.アジアティック酸(asiatic acid)―炭酸ナトリウム(AJF09,82)
アジアティック酸(asiatic acid)(0.992g)を27.5mLのメタノールに溶解した。無水炭酸ナトリウム(2.0043g)をそのメタノール溶液に添加し、激しく振った。メタノール‐アジアティック酸溶液を丸底フラスコに移し、乾燥するまで蒸発した。アジアティック酸ナトリウム塩の細かい白い粉体を生成し、2時間100℃にて真空オーブン中乾燥した。約1gのサンプルを得た。
【0042】
2.メタノール水酸化アンモニウム中のアジアティック酸(asiatic acid)(AJF09,99a)
約6mLのメタノール水酸化アンモニウムを0.4923gのアジアティック酸(asiatic acid)に滴下した。サンプルの多くが、溶液中に移り、新しいフレーク状の材料が現れ始めた。さらに1mlのメタノール水酸化アンモニウムを加え、溶液を終夜攪拌しながら放置した。沈殿物が生じ、ろ過により回収した。0.0741gのアジアティック酸アンモニウム塩を得た。
【0043】
3.メタノール水酸化ナトリウム中のアジアティック酸(asiatic acid)(AJF09,99b)
アジアティック酸(asiatic acid)(0.4961g)を0.2Mメタノール水酸化ナトリウムの7.0mL中に溶解した。一度完全に溶解した飽和塩化ナトリウム溶液を溶液が濁っていき、沈殿が生じるまで滴下した。脱イオン水(7.0mL)を添加し、存在するNaClを溶解した。沈殿物をろ過して回収し、2時間100℃にて真空オーブン中乾燥した。0.4938gのアジアティック酸ナトリウム塩を得た。
【0044】
4.アジアティック酸(asiatic acid)カリウム塩
【式3】
【0045】

上記スキーム4に関して、4g(8.196mmol)アジアティック酸(asiatic acid)をメタノール(30ml)に加えた。混合物を加熱し溶解した。その溶液にpHが8‐9になるまで0.56g(8.187mmol)のKOH及び20mlのメタノールで作られた溶液を加えた。それから、得られた溶液を活性炭で脱色し、濃縮した。濃縮溶液に十分な量のアセトンを加えホモジナイズし、その溶液を冷却した。沈殿物が生じ、ろ過した。オフホワイト結晶として3.5gのアジアティック酸カリウム塩を得た。図16aにその生成物の1H−NMRを示す。図17aはその生成物のマススペクトロスコピーを示す。
【0046】
5.アジアティック酸(asiatic acid)トロメタモール塩
【式4】
【0047】

上記スキーム5に関して、2g(4.09mmol)のアジアティック酸(asiatic acid)及び0.59g(4.623mmol)のトリヒドロキシメチルアミノメタン(トロメタミン)をメタノール(30ml)に加えた。混合物を24時間室温にて攪拌し、0.5時間還流した。その溶液を濃縮し、少量の水を加えた。沈殿物が生じ、それからろ過し不純物を除いた。ろ過ケーキをメタノール中に移し、加熱して溶解した。得られた溶液をろ過し、不溶性物質を除去し、それから濃縮した。濃縮溶液に十分な量のアセトンを添加し、ホモジナイズした。その溶液を冷却した。生じた沈殿物をろ過し、50℃にて乾燥した。淡褐色の固形物として1.5gのアジアティック酸トロメタモール塩を得た。図16bにその生成物の1H−NMRを示す。図17bはその生成物のマススペクトロスコピーを示す。
【0048】
6.アジアティック酸(asiatic acid)ナトリウム塩‐ホスホン酸ナトリウム
【式5】
【0049】

上記スキーム6のはじめの段階において、ピリジン(12ml)を氷の塩水を用いて−10℃まで冷却し、2.2g(0.01435mol)の水酸化ホスホニウムを滴下して加えた。2分後、2g(0.004098mol)のアジアティック酸(asiatic acid)溶液及びピリジン(6ml)を滴下して加えた。混合物を攪拌し、1.5時間反応した。反応溶液をゆっくり40mlの氷水に加えた。その混合物を室温にて終夜攪拌した。ほとんどの溶剤を蒸発し、減圧下乾燥させた固形物を得た。その固形物を4NHCl(20ml)に添加し、ゼリー状の原料が沈殿し、ろ過した。ろ過ケーキを水で洗浄し粗生成物を得た。粗生成物をメタノールに溶解した。その溶液を活性炭で脱色し、濃縮した。濃縮溶液に十分な量のアセトンを添加し、ホモジナイズした。生じた沈殿物ろ過した。ゼリー様のリン酸エステルを得た。
【0050】
上記スキーム6の終わりの段階において、上記粗生成物をメタノールに溶解した。その溶液にpHが8−9になるまで1Nの水酸化ナトリウムメタノール溶液を添加した。その溶液を活性炭で脱色し、濃縮した。濃縮溶液に十分な量のアセトンを添加し、ホモジナイズした。その溶液を冷却した。生じた沈殿物をろ過し、50℃にて乾燥した。淡褐色の固形物として2.2gのアジアティック酸ナトリウム塩―ホスホン酸塩を得た。図16cにその生成物の1H−NMRを示す。図17cはその生成物のマススペクトロスコピーを示す。
【0051】
7.アジアティック酸(asiatic acid)トリアセテート‐アミド誘導体
【式6】
【0052】

上記スキーム7の第一段階において、アジアティック酸(asiatic acid)(5g)を攪拌しながらピリジン(10ml)に溶解した。溶液を10℃に冷却し、15mlの無水酢酸を添加した。得られる溶液を20時間室温にて攪拌し、その後、200mlの氷水を添加した。生じた沈殿をろ過し、水で洗浄し、それから50℃にて乾燥した。白色粉体として6.28gのアジアティック酸トリアセテート塩を得た。
【0053】
上記スキーム7の第二段階において、6.5g(0.01058mol)のアジアティック酸トリアセテート塩を100mlのジクロロメタンに添加した。溶液を氷水で冷却し、それから1.2g(0.01186mol)のトリエチルアミン、1.55g(0.0111mol)エチルグリシネート(ethylglycinate)塩化水素、及び0.2g(0.00164mol)4‐ジメチルアミノピリジンを添加した。混合物を0.5時間0‐5℃にて攪拌した。その混合物に2.37g(0.0115mol)DCCの溶液及びジクロロメタン(50ml)を0.5時間以上滴下して加えた。反応物を2時間0−5℃にて攪拌し、それから24時間室温に放置した。固形物をろ過した。ろ過物を1NのHCl、及び飽和NaHCO3溶液で洗浄し、それから水で洗浄し、pHを中性にした。その溶剤を減圧下蒸発した。ゲル様材料として9gのアジアティック酸トリアセテート‐アミド誘導体を得た。
【0054】
その粗ゲル様生成物をシリカゲルカラムに移し、ジクロロメタン+アセトン(20:1)で溶出した。生成物の分画を集め、濃縮した。固形物をろ過して除去し、ろ過物を真空乾燥した。2.82gの白色結晶を得た。図16dにその生成物の1H−NMRを示す。図17dはその生成物のマススペクトロスコピーを示す。
【0055】
B.アジアティック酸(asiatic acid)塩のHPLC分析
上記に記載のように生成した特定のアジアティック酸(asiatic acid)塩をHPLC分析した。
【0056】
・標準調製物
約5mgのアジアティック酸(asiatic acid)を25mLのメスフラスコに移し、1mLのメタノールを加え、その酸がメタノールに溶解するまでよく混合した。それから、メスフラスコを移動相で体積に合わせ、よく混合した。
・クロマトグラフィーのパラメータ

【0057】
・システム適性
ワーキングスタンダード溶液(メタノール中200μg/mL)の6つの再現インジェクションで実施したクロマトグラフの操作ごとにシステム再現性を決定した。再現インジェクションでの相対標準偏差パーセント(%RSD)を計算した。アジアティック酸のテーリングファクター及び理論段数はRSDに用いられるワーキングスタンダード溶液の最初のインジェクションで計算された。
許容基準
・6つの再現インジェクション由来のピーク1に対するピークエリアレスポンスの%RSDが3.0%より大きくない。
・理論段数がNLT10000
・テーリングファクターがNMT1.5
・分離度NLT2.0
結果

【0058】
各塩の及び出発原料の回収を計算した(表1)。アジアティック酸(asiatic acid)塩の保持時間は出発原料のアジアティック酸と同じであり、塩がいかなる重要な構造変化をも起こしていないことを確認した(図1)。
【表1】

【0059】
水及びメタノールの溶解度
水及びメタノール中のアジアティック酸(asiatic acid)及びナトリウム塩(AJF09,99b)の一つについて溶解度の計算結果を得た。表2に結果を示す。アジアティック酸は水の中ではほとんど溶けない(0.03mg/ml)が、一方ナトリウム塩は228倍も溶ける。これは塩が形成されたことの有力な証拠であり、剤形調製に関して、薬剤的利用性に顕著な増加を明示する。
【0060】
サンプル調製物
メタノール及び水中での出発原料及び塩から得られる飽和溶液をろ過し、移動相で適宜希釈した。水中のアジアティック酸(asiatic acid)は希釈しなかった。メタノールで調製したナトリウム塩を除いて三回分のサンプルを調製した。そのナトリウム塩は2回分を調製した。
【表2】

【0061】
C.核磁気共鳴(NMR)分光法
予め、DMSO‐d6中1H−NMR及び13C‐NMR分光分析をアジアティック酸(asiatic acid)出発原料及びナトリウム塩(AJF09,99b)両方についてバリアン(Varian)300MHz装置にて実施した。一般的に、得られるプロトンNMRスペクトルはアジアティック酸の構造と整合性のある化学シフト及び分裂パターン(多重度)を証明する(図2)。両化合物のスペクトルを比較すると、幾つかのシグナルが化学シフトを変更し、この変更は特に4.0と4.6ppmの間であることが明らかとなる。これは塩形成と整合性のある電子的変化を示す。
【0062】
13C−NMRデータはアジアティック酸(asiatic acid)構造と整合性のある炭素の化学シフトを示す。図3及び4は出発材料及びそのナトリウム塩両方の代表的な13Cスペクトルを示す。アジアティック酸のスペクトル中およそ36、24、及び17ppmの化学シフトを有する炭素シグナルがナトリウム塩のスペクトル中で変化した。それは塩形成を示した。
【0063】
さらに、NMR分析を400MHzにて実施し、より分解されたプロファイルを得、予め行った分析結果を確認した。プロトン及びカーボンNMR両方の詳しい分析(図4a―hを参照願いたい)は、ナトリウム塩の分子構造が、新しいカルボン酸ナトリウムの効果により生じる観察される化学シフトの違いを除いて、実質的に同じもののままであることを明らかにする。塩形成の出現を立証する最も関連性のある違いは、
a.アジアティック酸は、通常カルボン酸官能基に関連する11.9ppmにてプロトンを有する。このシグナルはナトリウム塩では存在しない。
b.ひとつのカルボン酸炭素の化学シフトが、分析した材料両者間で相違いする。つまり、カルボン酸からカルボン酸塩への転換がこの挙動で説明される。
【0064】
D.粉体X線回析
X線回析をUSP<941>に従って、シマズLabX、XRD‐6000を用いて実施した。図5aはアジアティック酸(asiatic acid)回析図形を示す。得られる広いバンドは非晶質の特徴である。上記セクションIV.A.3にて設定した手順を2グラムスケールにてナトリウム塩を生成するためにスケールアップした場合、HPLC分析結果は上記セクションIV.B.にて述べたものと同様であり、粉体X線回析データからの結果は、得られた材料の結晶特性と整合性があった(図5bを参照願いたい)。
【0065】
E.フーリエ変換赤外分光法(FTIR)
FTIR分光分析をアジアティック酸(asiatic acid)、ナトリウム塩AJF09,82とAJF09,99b及びアンモニウム塩(AJF09,99a)について実施した。図6はアジアティック酸の得られる赤外スペクトルの例であり、1697cm−1付近の酸カルボニルバンドの存在により証明されるようにカルボン酸の典型的な特徴を示した。
【0066】
ナトリウム塩AJF09,82(図7)及びAJF09,99b(図8)から得られる赤外スペクトルは1697cm−1付近のカルボニルバンドの減少した強度及び1545及び1390cm−1付近の現れるバンドをはっきりと示した。後者のバンドの存在は、カルボン酸基ではなく、カルボキシレート基の存在に起因するものでる。これは塩形成の分光法的証拠である。アンモニウム塩AJF09,99a(図9)の赤外スペクトルは、塩が示すように、1390cm−1付近のバンドの存在を示す。1690cm−1付近のカルボン酸の特徴的バンドはまだ存在し、酸から塩への不十分な転換を反映しているかもしれない。
【0067】
F.熱重量分析(TGA)
TGAをTA Instruments Model Q5000を用いて実施した。装置のキャリブレーション検証をニッケルスタンダードを用いてUSP<891>に従って実施した。アジアティック酸(asiatic acid)及び二つのナトリウム塩、AJF09,82とAJF09,99bを分析した(図10−12)。サーモグラムに示すように、出発材料のアジアティック酸を400℃により分解した。両塩から得られるサーモグラムは温度に対する高い耐性を反映し、それは塩が化合物から形成されるときに見られる現象である。
【0068】
G.ナトリウム含有量決定
酸化空気アセチレンフレーム及び589nmでの検出を用いて、HGA 850 Graphite Furnaceを備えたPerkin Elmer AAnalyst 300 Atomic Absorption Spectrophotometerによりナトリウム含有量を決定した。ナトリウムの標準溶液を1000mg/Lの濃度にて塩化ナトリウムのストックから調製した。一般的にこの方法によるナトリウムの分析はセシウムのようなアルカリ塩存在下で実施し、イオン化を制御する。この場合、ナトリウムの感受性を最大化するために必要なセシウム(CsClの形での)の量を決定するために予備実験を行った。これらの実験に基づいて、0.3%CsClをすべてのサンプル及び標準調製物に用いた。
【0069】
標準ストック1(1000ppm Na)
これは正確に秤量した量の塩化ナトリウム(2.53g)を1.0Lのメスフラスコへ脱イオン水で溶解し、溶解後、脱イオン水で体積にあわせることにより調製した。
【0070】
3%塩化セシウム
これは正確に秤量した量の塩化セシウム(3g)を100mLのメスフラスコへ脱イオン水で溶解し、溶解後、脱イオン水で体積にあわせることにより調製した。
【0071】
0.3%塩化セシウム(希釈)
これは正確に秤量した量の塩化セシウム(6g)を2.0Lのメスフラスコへ脱イオン水で溶解し、溶解後、脱イオン水で体積にあわせることにより調製した。
【0072】
希釈ストック1(0.3% CsCl中100ppm Na)
これは10.0mLの標準ストック(1000ppm Na)及び10.0mLの3%の塩化セシウムを100mLのメスフラスコに移し、脱イオン水を用いて体積にあわせることにより調製した。
【0073】
希釈ストック2(0.3% CsCl中10ppm Na)
これは10.0mLの希釈ストック1(0.3% CsCl中100ppm Na)を100mLのメスフラスコに移し、0.3%塩化セシウム(希釈)を用いて体積にあわせることにより調製した。
【0074】
反応直線性
試験方法の直線性は試験結果に所望の範囲に渡って検体の濃度に正比例することを与える能力である。その吸収対相当するナトリウム濃度の試験を実施した。分析のセットそれぞれについて、2.0mL、3.0mL、4.0mL、5.0mL、及び6.0mLの希釈ストック2(0.3% CsCl中10ppm Na)を別々の50mLメスフラスコへ正確に移し、希釈液で各体積にあわせることによりNaClの標準溶液を調製し、それぞれ0.4ppm、0.6ppm、0.8ppm、1.0ppm、1.2ppmのスタンダードを作成した。各溶液を装置により3回測定し、三回の測定値の平均を用いて直線性のある検量線を作成した(図13)。
【0075】
アジアティック酸ナトリウム塩AJF09,82とAJF09,99bを分析した。結果を表3に示す。
【表3】

【0076】
アジアティック酸(asiatic acid)塩の各分子にナトリウムの1分子が存在すると仮定する場合、サンプル中約4.5%ナトリウムの含有が予想される。
【0077】
さらに、本発明を追加的下記実施例を参照することにより記載する。それらは実施例の本発明の説明であり、本発明を限定するものではない。
【0078】
ラットにおけるブレオマイシン‐誘発肺線維症への効果
1.目的
ラットにおけるブレオマイシン‐誘発肺線維症へのアジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)の効果を観察するために、疾患モデルが確立した後、2日目及び7日目それぞれでの投薬を実施した。
【0079】
2.材料及び方法
動物:SDラット(オス) 体重250−300g Shanghai SLACC Co. Ltdより入手
TFG‐βキット、ヒト96T ELISAキットShanghai Jingmeiより輸入
TNF‐αキット、ヒト96T ELISAキットShanghai Jingmeiより輸入
アジアチコサイド(≧92%純度)
アジアティック酸(≧98%純度)
注射用ブレオマイシン Tianjin Taihe Pharmaceuticalから使用 スペック:8 mg/Ap
デキサメタゾン Shanghai Sinepharm、スペック:5mg/Ap
3.用量及び投与経路
アジアティック酸 3、9、及び 27mg/kg 経口 (経口(p.o.))x 28日
アジアチコサイド 36mg/kg 経口(p.o.)x 28日
デキサメタゾン 0.6mg/kg 経口(p.o.)x 28日
ブレオマイシン 5mg/kg 経口(p.o.)x 28日
【0080】
4.方法
オスSDラット、体重250‐300g。ラットを3%セコナール(Seconal)で麻酔し、平たく広げて手術台に固定した。ラットの首をアルコールで消毒し、カットし、気管を露出させた。針を気管リング(tracheal ring)間の空間を通して求心的に挿入し5mg/kgのブレオマイシンを注射した。ラットを直立させ、反転させ、溶液を肺に均一に広げるようにした。それから切開箇所を縫合した。
【0081】
ラットが意識を回復した後、ラットを不規則的にグループ分けした。ラットを
(i)モデルが確立した後次の日に投与を受けるグループ、及び
(ii)モデルが確立した後7日目に投与を受けるグループ
に分けた。27、9、及び3mg/kg経口(p.o.)x 28日アジアティック酸(asiatic acid)、0.6mg/kg経口(p.o.)x 28日デキサメタゾングループ、36mg/kg経口(p.o.)x 28日アジアチコサイド(asiaticoside)グループ、モデルグループ及びブランクグループを含んだ。生理食塩水をモデル及びブランクグループに投与した。アジアティック酸及びアジアチコサイド投与後28日にて肺の生存及び重量比を測定した。病理学検査及び血清学的検査を実施した。
【表4】

アジアティック酸処理したラットにおけるブレオマイシン‐誘発肺線維症の肺重量指標での効果
ラットを殺処分した後、体重及び肺重量を測定した。
肺重量比=(肺重量/体重)x100%
【0082】
結果を表5及び6に示す。次の表の1アスタリスク(*)はモデルグループと比較しての有意差(P<0.05)を示し、2アスタリスク(**)は顕著な有意差(P<0.01)を示す。
【表5】

【表6】

【0083】
表5及び6に示すように、2日又は7日での開始であって、高、中、低‐用量のアジアティック酸(asiatic acid)グループにおけるラットの肺重量比はモデルグループと比較して顕著に低かった。アジアチコサイド(asiaticoside)グループから得られる結果は、アジアティック酸の結果と同様であった。デキサメタゾングループにおいて示される肺重量比は比較的高く、これはおそらく、デキサメタゾンにより生じる体重減少によるものである。
【0084】
ブレオマイシン‐誘発肺線維症のラットにおけるいくつかのサイトカインでのアジアティック酸(asiatic acid)処理の血清学的効果。
【0085】
血清サンプルを標準手順(回収後3000rpm、10分間遠心分離)に従って調製し、−20℃に保管した。試験をキットの説明書に従って実施した。表7に結果を示す。
【表7】

【0086】
ラットにおけるブレオマイシン誘発肺線維症でのアジアティック酸の効果の病理学的分析
肺組織を一週間10%ホルマリンで固定した。二つの肺の下葉の組織を乾燥させ、パラフィンに浸し、パラフィン包埋及びパラフィン切片を行った。切片の薄さは3−4μmであった。所定のヘマトキシリネオシン(HE)染色を行った。コラーゲン線維及び弾性線維の二つの特別な染色を実施し、線維症の程度を検出した。切片の二つのグループの染色を観察した。結果を下記に示す。
【0087】
ブレオマイシンを用いるモデルを確立後、次の日に投与を受けるグループ
通常グループ
動物の肺組織の形態学的構造は無傷であり、出血、増殖、又は浮腫はなかった。しかしながら、多くのラットの肺組織中、少量の炎症細胞の浸潤があった。幾つかのラットにおいて炎症細胞の顕著な浸潤及びいくつかの局部的範囲おけるに密集があった。
【0088】
コラーゲン線維及び弾性線維の二つの染色は肺胞中隔がわずかに厚みをおび、少量の線維芽細胞の増殖を示した。
【0089】
モデルグループ
炎症細胞(主にリンパ球)の浸潤があり、ラットの肺組織中、肺胞中隔の過形成があった。肺胞中隔において中等度から重篤に及ぶ局部の肥厚があり、厚くなった損傷中、線維芽細胞の中等度の過形成があった。末端細気管支の末梢領域に関与する重篤な肺胞炎及び線維増殖症があり、幾つかの領域にてほとんど肺胞がなかった。肺胸膜下、肺胞の軽度の委縮又は肺気腫があった。
【0090】
コラーゲン線維及び弾性線維の二つの染色が存在した。これは、肺組織中、コラーゲン線維及び弾性線維の多くが増殖することを示した。幾つかの領域でほとんど肺胞がなかった。幾つかの血管壁においてコラーゲン線維及び弾性線維の過形成があった。内腔は小さくなり、血管の周りにコラーゲン線維及び弾性線維の多くの過形成があった。
【0091】
デキサメタゾングループ
肺組織中炎症細胞(主にリンパ球)の軽度の浸潤があった。肺胞中少量の炎症細胞の浸潤があり、肺胞中隔の軽度の過形成があった。線維芽細胞の軽度の増殖、水疱形成があり、肺胸膜下、軽度の肺の萎縮及び肺気腫があった。
【0092】
コラーゲン線維及び弾性線維の染色は、肺組織中コラーゲン線維及び弾性線維の少しの増殖を示した。
【0093】
アジアチコサイド(asiaticoside)投与グループ
肺組織中、軽度の炎症及び肺胞炎(主にリンパ球)があった。肺胞中隔の軽度の過形成及び、軽度の肺の萎縮又は肺気腫が隔膜下に見られた。上記病理学の変化の程度及び範囲はデキサメタゾン投与グループのものと同様であったが、モデルグループのものよりそれほど重篤ではなかった。
【0094】
コラーゲン線維及び弾性線維の染色は、デキサメタゾングループのものと同様であった。
【0095】
アジアティック酸(asiatic acid)低用量グループ
肺組織中、軽度の炎症及び肺胞炎(主にリンパ球)があった。肺胞中隔の軽度の過形成があり、肺胞中隔は少し厚みをおび、少量の線維芽細胞の増殖があり、軽度の肺の萎縮又は肺気腫が、隔膜下に見られた。上記病理学の変化の程度及び範囲はアジアチコサイド投与グループのものと同様であった。
【0096】
コラーゲン線維及び弾性線維の染色は、デキサメタゾングループのものと同様であった。
【0097】
アジアティック酸(asiatic acid)中用量グループ
肺組織中、炎症細胞(主にリンパ球)の軽度の浸潤があった。炎症は肺胞に起こっており、肺胞中隔は軽度に厚みをおび、肺胞中隔の過形成があった。線維芽細胞の軽度の増殖があり、肺胸膜下に軽度の肺胞の萎縮及び肺気腫があった。
【0098】
コラーゲン線維及び弾性線維の染色は、線維芽細胞の増殖が明らかとなり、モデルグループのものよりかなり軽度であった。多くのラットでの範囲及び程度は低用量のものと同様であったが、本グループの2,3匹のラット中病理学的変化は低容量のものより軽度であった。
【0099】
アジアティック酸(asiatic acid)高用量グループ
肺組織中、炎症細胞(主にリンパ球)の軽度の浸潤があった。炎症は肺胞に起こっており、肺胞中隔は軽度な厚みをおびた。線維芽細胞の軽度の増殖があり、肺胸膜下に軽度の肺胞の萎縮及び肺気腫があった。
【0100】
コラーゲン線維及び弾性線維の染色は、わずかな線維芽細胞の増殖を示し、いくつかの範囲で通常のものと同様であった。このグループでの病理学的変化は中用量及び低用量グループ及びアジアチコサイド(asiaticoside)グループのものより軽度であった。
【0101】
ブレオマイシンを用いるモデルを確立後、7日目に投与を受けるグループ
通常グループ及びモデルグループの様子はモデルを確立後、次の日に投与を受けるグループのものと同様であった。
【0102】
デキサメタゾングループ
肺組織中、炎症細胞(主にリンパ球)の軽度な浸潤があった。肺胞中、少量の炎症細胞の浸潤があり、肺胞中隔が軽度に厚みをおびた。線維芽細胞の軽度の増殖及び多くの水疱の形成があり、肺胸膜下に軽度の肺の萎縮及び肺気腫があった。病理学的変化はモデルを確立後、次の日にデキサメタゾンを受けるグループのものより顕著に重篤であった。
【0103】
コラーゲン線維及び弾性線維の染色は、肺組織中、線維増殖があり、肺胞の壁の肥厚及び線維増殖の程度が、モデルを確立後、次の日にデキサメタゾンを受けるグループのものより顕著に重篤であった。
【0104】
アジアチコサイド(asiaticoside)及びアジアティック酸(asiatic acid)の用量グループそれぞれの様子はブレオマイシンをもちいてモデルを確立後、次の日に投与を受けるグループのものと同様であった。
【0105】
5.分析
ブレオマイシンにより誘発される肺線維症は肺線維症における作用機序の研究のための及び一般的な抗線維症及び抗炎症治療の発見のための「究極的な判断基準」モデルである。ブレオマイシン処理後多くの種類の肺において見られた生化学的及び形態学的変化はヒトに見られるものを想定する。
【0106】
ブレオマイシン処理により活性化される炎症経路及び線維症経路は、炎症及び糖尿性ネフロパシー(腎線維症)のような線維症に見られるものと同様である。さらに、Gauldie他、Proc. Am. Thorac. Soc. 3: 696-702 (2006)は、肺気腫を含む慢性閉塞性肺疾患(COPD)がいくつかの同じ異常調節経路に依存することを示す証拠を記載している。従って、上述のように、本発明の結論が関節炎、炎症性大腸炎、乾癬、肺線維症、糖尿性ネフロパシー、及びDOPDのような炎症及び線維症の疾病治療での治療組成物としての有用性に適合する。
【0107】
肺炎はブレオマイシンにより生じ、後の肺線維症は大変重篤になるので、モデルグループで50‐70%の動物が死んだ。動物の死は、呼吸不全に関連すると考えられ、慢性炎症及び線維症により生じる。デキサメタゾンはブレオマイシン誘発死からラットを保護することができない。驚くことに、アジアチコサイド(asiaticoside)及びアジアティック酸(asiatic acid)はブレオマイシン誘発死を顕著に防止した。
【0108】
また、結果はアジアティック酸(asiatic acid)がTNF−α及びTGF−βを低下できることを示す。最も高い用量を用いると有効性がわずかに高くなる。
【0109】
定期検査としてヘマトキシリン‐エオシン染色を導入し、コラーゲン線維及び弾性線維の染色を実施したところ、抗線維症効果がうまく観察された。病理学的結果は、用量反応に基づいて、アジアティック酸(asiatic acid)がブレオマイシン誘発肺線維症に対して有効であることを示す。アジアティック酸の高用量グループにおける有効性はアジアチコサイド(asiaticoside)グループよりよく、一方、中用量、低用量グループはアジアチコサイドグループと同様であった。興味深いことに、モデル確立後、2日目及び7日目に投与開始したデキサメタゾングループの間で顕著な病理学的相違があった。それは、投与が2日目に開始した場合、肺線維症がより顕著に軽減された。これは、デキサメタゾンが炎症を阻害することにより発揮するその抗線維症効果によるかもしれない。一度、炎症の初期段階が起こると、デキサメタゾンの効果は減少する。アジアティック酸(asiatic acid)及びアジアチコサイド(asiaticoside)は初期の炎症段階及び後の線維症段階両者にて作用する。つまり、化合物が誘発後2日目及び7日目に投与された場合、有効性はグループ間でそれほど変化していない。
【0110】
従って、精製アジアティック酸及びアジアチコサイドはブレオマイシン誘発炎症及び線維症の効果に対抗することを示した。
【0111】
ブレオマイシン処理後7日目投与開始はデキサメタゾンの有効性に影響するが、それは、アジアティック酸又はアジアチコサイドの有効性にほとんど影響しない。これはアジアチコサイド及びアジアティック酸が、ブレオマイシン処理後にすぐに生じる炎症の阻害を通してのみ作用するのではないことを示唆する。代わりに、データは、炎症及び線維症過程両方にてアジアチコサイド及びアジアティック酸の直接的阻害作用を支持する。
【表8】

【表9】

【特許請求の範囲】
【請求項1】
約98%の純度である形態のアジアティック酸(asiatic acid)。
【請求項2】
(A)請求項1に記載のアジアティック酸(asiatic acid)を提供し、及びそれから
(B)薬剤に許容できる担体を有する前記アジアティック酸(asiatic acid)を作成し、実質的にアジアティック酸(asiatic acid)の治療効果のある量からなる剤形を提供する
ことを含む方法の生成物であることを特徴とする治療組成物。
【請求項3】
線維症を患う又は、線維症を患う危険性のある対象を治療する方法であって、前記対象に(a)請求項1に記載のアジアティック酸(asiatic acid)又は(b)請求項2に記載の治療組成物を投与することを含む方法。
【請求項4】
前記線維症が放射線誘発肺炎及び線維症、特発性肺線維症、及び糖尿病性ネフロパシーからなる群から選択されることを特徴とする請求項3に記載の方法。
【請求項5】
炎症性の病気を患う又は、炎症性の病気を患う危険性のある対象を治療する方法であって、前記対象に(a)請求項1に記載のアジアティック酸(asiatic acid)又は(b)請求項2に記載の治療組成物を投与すること含むことを特徴とする方法。
【請求項6】
前記炎症性の病気が、関節炎、炎症性大腸炎、乾癬からなる群から選択されることを特徴とする請求項5に記載の方法。
【請求項7】
請求項1に記載のアジアティック酸(asiatic acid)から作られる塩。
【請求項8】
アルカリ金属塩、アルカリ土類塩、及び任意に置換されるアンモニウム塩からなる群から選択されることを特徴とする請求項7に記載の塩。
【請求項9】
ナトリウム塩、カリウム塩、アンモニウム塩、及びトロメタモール塩からなる群から選択されることを特徴とする請求項8に記載の塩。
【請求項10】
請求項7に記載の塩を含む固形の剤形。
【請求項11】
請求項1に記載のアジアティック酸(asiatic acid)の誘導体であって、前記誘導体がアミド又はエステルであることを特徴とする誘導体。
【請求項12】
請求項11に記載のアジアティック酸(asiatic acid)の誘導体であって、前記誘導体がアジアチコサイド(asiaticoside)であることを特徴とする誘導体。
【請求項1】
約98%の純度である形態のアジアティック酸(asiatic acid)。
【請求項2】
(A)請求項1に記載のアジアティック酸(asiatic acid)を提供し、及びそれから
(B)薬剤に許容できる担体を有する前記アジアティック酸(asiatic acid)を作成し、実質的にアジアティック酸(asiatic acid)の治療効果のある量からなる剤形を提供する
ことを含む方法の生成物であることを特徴とする治療組成物。
【請求項3】
線維症を患う又は、線維症を患う危険性のある対象を治療する方法であって、前記対象に(a)請求項1に記載のアジアティック酸(asiatic acid)又は(b)請求項2に記載の治療組成物を投与することを含む方法。
【請求項4】
前記線維症が放射線誘発肺炎及び線維症、特発性肺線維症、及び糖尿病性ネフロパシーからなる群から選択されることを特徴とする請求項3に記載の方法。
【請求項5】
炎症性の病気を患う又は、炎症性の病気を患う危険性のある対象を治療する方法であって、前記対象に(a)請求項1に記載のアジアティック酸(asiatic acid)又は(b)請求項2に記載の治療組成物を投与すること含むことを特徴とする方法。
【請求項6】
前記炎症性の病気が、関節炎、炎症性大腸炎、乾癬からなる群から選択されることを特徴とする請求項5に記載の方法。
【請求項7】
請求項1に記載のアジアティック酸(asiatic acid)から作られる塩。
【請求項8】
アルカリ金属塩、アルカリ土類塩、及び任意に置換されるアンモニウム塩からなる群から選択されることを特徴とする請求項7に記載の塩。
【請求項9】
ナトリウム塩、カリウム塩、アンモニウム塩、及びトロメタモール塩からなる群から選択されることを特徴とする請求項8に記載の塩。
【請求項10】
請求項7に記載の塩を含む固形の剤形。
【請求項11】
請求項1に記載のアジアティック酸(asiatic acid)の誘導体であって、前記誘導体がアミド又はエステルであることを特徴とする誘導体。
【請求項12】
請求項11に記載のアジアティック酸(asiatic acid)の誘導体であって、前記誘導体がアジアチコサイド(asiaticoside)であることを特徴とする誘導体。
【図1】


【図2】


【図3】


【図4】


【図4a】


【図4b】


【図4c】


【図4d】


【図4e】


【図4f】


【図4g】


【図4h】


【図5a】


【図5b】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16a】


【図16b】


【図16c】


【図16d】


【図17a】


【図17b】


【図17c】


【図17d】




【図2】


【図3】


【図4】


【図4a】


【図4b】


【図4c】


【図4d】


【図4e】


【図4f】


【図4g】


【図4h】


【図5a】


【図5b】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16a】


【図16b】


【図16c】


【図16d】


【図17a】


【図17b】


【図17c】


【図17d】


【公表番号】特表2011−509303(P2011−509303A)
【公表日】平成23年3月24日(2011.3.24)
【国際特許分類】
【出願番号】特願2010−542345(P2010−542345)
【出願日】平成21年1月8日(2009.1.8)
【国際出願番号】PCT/US2009/030458
【国際公開番号】WO2009/089365
【国際公開日】平成21年7月16日(2009.7.16)
【出願人】(510179113)シャンハイ・インスティチュート・オブ・ファーマシューティカル・インダストリー(エスアイピーアイ) (1)
【Fターム(参考)】
【公表日】平成23年3月24日(2011.3.24)
【国際特許分類】
【出願日】平成21年1月8日(2009.1.8)
【国際出願番号】PCT/US2009/030458
【国際公開番号】WO2009/089365
【国際公開日】平成21年7月16日(2009.7.16)
【出願人】(510179113)シャンハイ・インスティチュート・オブ・ファーマシューティカル・インダストリー(エスアイピーアイ) (1)
【Fターム(参考)】
[ Back to top ]

