アッセイ法
【課題】ダイナミックレンジの広い高感度の比色型のアッセイ法を提供する。
【解決手段】金属微細構造を有するように金属薄膜層13と誘電体多孔質膜層12とを交互に積層して形成され、特定の波長の光を吸収する光学的吸収性を有するプレート10を用意するステップと、そのプレート10を固相に用いて被検出物を検出するステップとを含む。
【解決手段】金属微細構造を有するように金属薄膜層13と誘電体多孔質膜層12とを交互に積層して形成され、特定の波長の光を吸収する光学的吸収性を有するプレート10を用意するステップと、そのプレート10を固相に用いて被検出物を検出するステップとを含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、物質の検出技術に係り、特に比色法を用いたアッセイ法に関する。
【背景技術】
【0002】
物質検出方法として、比色法を用いたアッセイ法が用いられている。比色法を用いたアッセイ法として、アルカリフォスファターゼ、パーオキシダーゼ等の酵素を用いる方法が挙げられる。これらのアッセイ法においては、サンドイッチアッセイ法がよく用いられる。サンドイッチアッセイ法では、酵素で修飾された二次抗体を用い、酵素に基質を加えて生成される生成物の色によって、被検出物の有無及び量を判定する。(例えば、特許文献1参照。)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2003−14692号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
しかしながら、従来の比色法では定量的測定が困難であり、ダイナミックレンジの欠如が問題となっていた。例えば臨床分野においては、イムノクロマトグラフィの形で比色法が用いられることが一般的であるが、ほとんどが定性的測定に限定されている。
【0005】
上記問題点に鑑み、本発明は、ダイナミックレンジの広い高感度の比色型のアッセイ法を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明の一態様によれば、金属微細構造を有するように金属薄膜層と誘電体多孔質膜層とを交互に積層して形成され、特定の波長の光を吸収する光学的吸収性を有するプレートを用意するステップと、そのプレートを固相に用いて被検出物を検出するステップとを含むアッセイ法が提供される。
【発明の効果】
【0007】
本発明によれば、ダイナミックレンジの広い高感度の比色型のアッセイ法を提供できる。
【図面の簡単な説明】
【0008】
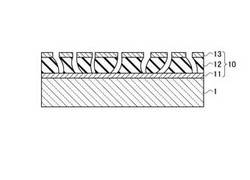
【図1】本発明の実施形態に係るアッセイ法に使用するプレートの構成例を示す模式的な断面図である。
【図2】本発明の実施形態に係るアッセイ法に使用するプレートの他の構成例を示す模式的な断面図である。
【図3】本発明の実施形態に係るアッセイ法に使用するプレートのSEM写真である。
【図4】本発明の実施形態に係るアッセイ法に使用するプレートの配置例である。
【図5】本発明の実施形態に係るアッセイ法を説明するための模式図である(その1)。
【図6】本発明の実施形態に係るアッセイ法を説明するための模式図である(その2)。
【図7】本発明の実施形態に係るアッセイ法を説明するための模式図である(その3)。
【図8】本発明の実施形態に係るアッセイ法を説明するための模式図である(その4)。
【図9】本発明の実施形態に係るアッセイ法を説明するための模式図である(その5)。
【図10】本発明の実施形態に係るアッセイ法による生成物の形成を示すSEM写真であり、図10(a)は生成物が形成される前のSEM写真であり、図10(b)は生成物が形成された後のSEM写真である。
【図11】本発明の実施形態に係るアッセイ法によって生成物が形成される前後のプレートの状態を示す例である。
【図12】本発明の実施形態に係るアッセイ法による吸収スペクトルの変化を示すグラフである。
【図13】比較例による吸収スペクトルの変化を示すグラフである。
【図14】本発明の実施形態に係るアッセイ法による吸収スペクトルの変化を示すグラフであり、図14(a)は可視光波長帯域及び近赤外波長帯域のグラフ、図14(b)は近赤外波長帯域のグラフである。
【図15】本発明の実施形態に係るアッセイ法による吸収スペクトルの変化の大きさを示すグラフである。
【発明を実施するための形態】
【0009】
次に、図面を参照して、本発明の実施形態を説明する。以下の図面の記載において、同一又は類似の部分には同一又は類似の符号を付している。ただし、図面は模式的なものであり、厚みと平面寸法との関係、各層の厚みの比率等は現実のものとは異なることに留意すべきである。したがって、具体的な厚みや寸法は以下の説明を参酌して判断すべきものである。又、図面相互間においても互いの寸法の関係や比率が異なる部分が含まれていることはもちろんである。
【0010】
又、以下に示す実施形態は、この発明の技術的思想を具体化するための装置や方法を例示するものであって、この発明の実施形態は、構成部品の材質、形状、構造、配置等を下記のものに特定するものでない。この発明の実施形態は、特許請求の範囲において、種々の変更を加えることができる。
【0011】
本発明の実施形態に係るアッセイ法は、図1に示すような、金属微細構造を有するように金属薄膜層13と誘電体多孔質膜層12とを交互に積層して形成され、特定の波長の光を吸収する光学的吸収性を有するプレート10を用意するステップと、そのプレート10を固相に用いて被検出物を検出するステップとを含む、比色型イノムアッセイ及び遺伝子解析方法である。誘電体多孔質膜層12は、誘電体多孔質膜層12を介して電子が金属薄膜層間を移動できない程度の絶縁性を有する。
【0012】
先ず、本発明の実施形態に係るアッセイ法の原理を説明する。金(Au)、銀(Ag)、プラチナ(Pt)等の金属微小体に光を照射すると、金属微小体内部の自由電子の振動が発生する。自由電子のこの振動の振動周波数及び振幅は、金属微小体近傍の誘電率に依存して変化することが知られている。このため、金属微小体表面上に酵素反応による生成物を形成することによって、生成物を形成する前と後とで金属微小体内部の自由電子の振動の振動周波数及び振幅が変化する。その結果、金属微小体の吸収スペクトルが変化する。
【0013】
したがって、金属微小体が形成されていることによって一定の波長の光を吸収する光学的吸収性を有するプレート10を用いて、被検出物を高感度で検出することが可能である。即ち、被検出物についての抗体を修飾する酵素と基質との酵素反応により形成された生成物を、プレート10上に堆積させる。これにより、プレート10の吸収スペクトルが変化するため、被検出物を高感度で検出できる。
【0014】
このために、自由電子を局在させるための金属微細構造を有するように、プレート10を形成する。つまり、光を照射されることによって内部の自由電子が振動する程度の大きさである金属微小体の集合により構成される金属微細構造が、プレート10に形成されている。
【0015】
例えば、膜厚5nm〜10μm程度の金属薄膜層11を基板1上に形成する。基板1には、例えばガラス基板やシリコン基板等の、表面が平坦な基板が採用可能である。金属薄膜層11には、Au、Ag、Pt、銅(Cu)等が採用可能である。
【0016】
次いで、金属薄膜層11上に、膜厚5nm〜10μm程度の誘電体多孔質膜層12を形成する。ただし、表面の平坦性を担保できるのであれば、誘電体多孔質膜層12の膜厚をもっと厚く、例えば数百μm程度にしてもよい。誘電体多孔質膜層12には、誘電体多孔質膜層12を電子が通過できない低導電率の材料、例えば絶縁膜、を採用可能である。
【0017】
更に、膜厚5nm〜10μm程度の金属薄膜層13を誘電体多孔質膜層12上に形成する。誘電体多孔質膜層12上に薄膜が形成されるため、図1に示すように、表面から膜厚方向に延伸する複数の溝がプレート10に形成される。つまり、金属薄膜層13は金属微小体の集合となる。溝に囲まれた金属微小体に金属薄膜層13の自由電子が局在する。
【0018】
なお、光の照射によって内部で自由電子の振動が発生する金属微小体が形成されるのであれば、金属薄膜層13の材料に制限は無い。例えば、Au、Ag、Pt等の貴金属であれば、上記金属微小体を形成可能である。また、Cuからなる金属微小体においても、内部の自由電子の振動が発生する。なお、金属微小体内部で自由電子の振動が発生するためには、金属微小体の大きさが1nm〜500nm程度であることが好ましい。金属微小体が小さいほど吸収スペクトルのピーク形状が急峻になるため、金属微小体の大きさは200nm以下であることが更に好ましい。吸収スペクトルのピーク形状が急峻なほど、吸収スペクトルの変化を観測しやすいためである。
【0019】
プレート10は、少なくとも2層の金属薄膜層11、13、及び金属薄膜層11、13に挟まれた誘電体多孔質膜層12から構成される。ただし、誘電体多孔質膜層12と金属薄膜層13の製造工程を繰り返して、3層以上の金属薄膜層を有するプレート10を形成してもよい。
【0020】
又、図2に示すプレート10を形成してもよい。即ち、金属薄膜層11の表面に誘電体多孔質膜層12として複数の微小体12aを吸着させ、更に、微小体12a上にそれぞれ金属薄膜を堆積させて金属薄膜層13を形成する。金属薄膜層13の上面を平坦にすると、吸収スペクトルの変化が観測されやすい。そのため、各微小体12aの上面を同一平面レベルにすることが好ましい。
【0021】
微小体12aの材質や形状は問わないが、例えば、直径10nm〜1μm程度のポリスチレン粒子やシリカ粒子を用いる。微小体12a上の金属薄膜は、各微粒子の金属薄膜の上面を同一平面レベルにするために、例えば抵抗加熱蒸着法やスパッタ法により形成することが好ましい。なお、微小体12aの吸着工程及び金属薄膜の形成工程を繰り返して、プレート10を形成してもよい。
【0022】
図3は、粒径が100nm程度のシリカ粒子を微小体12aに用いて形成された、図2に示した構造を有するプレート10の走査型電子顕微鏡(SEM)写真である。図4は、基板1上の複数のスポット領域にプレート10をアレイ状に配置した例を示す。スポット径は、例えば3mm程度である。
【0023】
以下に図5〜図9を参照して、図2に示したプレート10を用いた本発明の実施形態に係るアッセイ法の例を説明する。ここで、プレート10は、金属薄膜層11の表面に複数の微小体12aを吸着させ、微小体12a上にそれぞれ金属薄膜を堆積して形成された金属微粒子120を有する。以下では、プレート10を固相として用いるイノムアッセイ法を例示的に説明する。
【0024】
図5に示すように、プレート10で金属微細構造を構成する金属微粒子120表面に、抗体21が固定されている。抗体21の固定方法は、一般的な物理吸着、化学吸着等が採用可能である。
【0025】
抗体21に対する抗原である被検出物22を含む試料をプレート10に触れさせることにより、図6に示すように、抗原抗体反応によって試料中の被検出物22のみがプレート10に吸着する。一方、試料中の非抗原物質23はプレート10に吸着されない。
【0026】
その後、被検出物22に対する二次抗体24をプレート10に加える。二次抗体24は、アルカリフォスファターゼ(ALP)等の酵素25で修飾されている。抗原抗体反応により、図7に示すように二次抗体24がプレート10に吸着される。酵素標識として使用される酵素25には、ALPの他に、パーオキシダーゼ、アセチルコリンエステラーゼ、カタラーゼ、β-D-ガラクトシダーゼ、グルコースオキシダーゼ、グルコース-6-リン酸脱水素酵素、β-ラクタマーゼ、ピロホスファターゼ、ウレアーゼ等を使用できる。
【0027】
図8に、抗原抗体反応後の処理を示す。二次抗体24に結合されている酵素25に基質を加えることにより、生成物30が形成される。生成物30は、図9に示すように、プレート10の表面に生成物30として沈殿する。つまり、金属微粒子120表面に生成物30が形成される。
【0028】
金属微粒子120表面に生成物30が形成される前のSEM写真を図10(a)に、生成物30が形成された後のSEM写真を図10(b)に、それぞれ示す。ここで、粒径100nmのシリカ粒子を微小体12aに使用し、酵素25として用いたアルカリフォスファターゼに、ニトロブルーテトラゾリウム/ブロモクロロインドリルりん酸(NBT/BCIP)基質を添加して生成物30を形成した。図10(b)に示すように、金属微粒子120の輪郭のようにみえる生成物30を確認できる。
【0029】
上記のように、試料に被検出物22が含まれている場合には、プレート10上に生成物30が形成される。このため、生成物30を形成する前と後とで金属微粒子120内部の自由電子の振動の振動周波数及び振幅が変化する。つまり、生成物30が形成されることにより、プレート10の吸収スペクトルが変化する。この吸収スペクトルの変化は、色の変化として目視によっても識別が可能である。
【0030】
一方、試料に被検出物22が含まれていない場合には、生成物30が形成されず、プレート10の吸収スペクトルは変化しない。
【0031】
したがって、試料に被検出物22が含まれているか否かは、プレート10の色が変化するか否かにより判定可能である。図11に、酵素25に基質を加えることにより生じる酵素反応によって生成物30が形成される前後の、プレート10の状態の例を示す。図11で、符号Aで示したプレート10が生成物30を形成する前の状態、符号Bで示したプレート10が生成物30を形成した後の状態である。このように、目視により被検出物22を検出可能である。
【0032】
なお、上記ではプレート10に抗体21が最初に固定され、試料に被検出物22が含まれる場合を説明した。しかし、プレート10に被検出物22が最初に固定され、試料に抗体21が含まれていてもよいことはもちろんである。
【0033】
図12に、酵素反応による生成物30の形成が進むにつれて刻々と変化する吸収スペクトルの例を示す。図12中の矢印は、酵素反応が進むにつれての吸収スペクトルの変化を、10秒間隔で示している。吸収スペクトル50は酵素反応の開始時の吸収スペクトルであり、吸収スペクトル51は酵素反応の終了時の吸収スペクトルである。
【0034】
図12に示すように、酵素反応が進むに従って、吸収波長の極大値が長波長側にシフトすると共に、吸光度が増大する。このように、本発明の実施形態に係るアッセイ法によれば、吸収スペクトルの絶対値や吸収波長の極大値の変化を観測することにより、被検出物22を検出できる。
【0035】
比較例として、金属微細構造を有さない金属薄膜を固相に用いて、上記と同様の酵素反応を起こさせた場合の吸収スペクトルを図13に示す。図13中の矢印は、酵素反応が進むにつれての吸収スペクトルの変化を表す。吸収スペクトル60は酵素反応の開始時の吸収スペクトルであり、吸収スペクトル61は酵素反応の終了時の吸収スペクトルである。
【0036】
図13に示したように、金属微細構造を有さない金属薄膜を固相に用いた場合にも、吸収スペクトルの変化が生じている。しかし、プレート10を固相に用いた場合に比べて、図13に示した吸収スペクトルの変化は非常に小さい。したがって、金属微細構造を有するプレート10を固相に用いる本発明の実施形態に係るアッセイ法は、被検出物22の検出に顕著な効果があることが確認された。
【0037】
本発明の実施形態に係るアッセイ法による処理を実施した場合における、可視光波長帯域から近赤外波長帯域における光学特性の変化を、図14(a)及び図14(b)に示す。図14(a)及び図14(b)に示した特性は、水中ではなく、乾燥された状態、即ち空気中で測定されたプレート10の吸収スペクトルである。図14(a)及び図14(b)において、吸収スペクトル70は未処理のプレート10の吸収スペクトル、吸収スペクトル71は酵素25が物理吸着された直後のプレート10の吸収スペクトル、吸収スペクトル72は酵素反応後のプレート10の吸収スペクトルである。
【0038】
図14(a)に示すように、酵素反応後に波長630nm近傍に顕著な吸収波長のピークが現れている。また、図14(a)に示した可視光波長帯域及び近赤外波長帯域の吸収スペクトルにおいては、測定に使用した分光光度計の特性上、波長950nmより長波長側は正確に測定されていない。しかし、図14(b)に示すように、波長1650nm近傍まで測定可能な分光光度計を用いると、酵素反応後に波長1075nm近傍に顕著な吸収波長のピークが現れている。つまり、吸収スペクトルの変化は、可視光波長帯域のみならず、近赤外波長帯域にも起こることがわかる。
【0039】
即ち、本発明の実施形態に係るアッセイ法によれば、目視によって被検出物22を検出できるのみならず、近赤外波長帯域における吸収スペクトルの変化を生じさせて、この変化を検出することができる。例えば、波長400nm〜700nmの可視光波長帯域に吸収波長の極大値を有するプレート10を固相として用いることにより、目視若しくは吸収スペクトルの変化によって被検出物22を検出できる。更に、波長800nm〜1600nmの近赤外波長帯域に吸収波長の極大値を有するプレート10を固相として用いることにより、吸収スペクトルの変化によって被検出物22を検出できる。プレート10の吸収スペクトルは、金属微細構造を構成する金属微小体のサイズや材料等に依存する。
【0040】
図15に、可視光波長帯域及び近赤外波長帯域における、酵素反応の進行による吸収スペクトルの変化の例を示す。図15は、酵素25としてALPを使用した場合における、酵素反応の開始時刻を起点とする酵素反応時間と、酵素反応の開始時刻からの、吸収スペクトルの吸収波長の極大値(吸収極大波長)を示す波長の変化量(以下において、「吸収極大波長のシフト量」という。)との関係を表す。
【0041】
図15中に符号aで示した値は、近赤外波長帯域における吸収極大波長のシフト量であり、符号bで示した値は、可視光波長帯域における吸収極大波長のシフト量である。図15に示すように、可視光波長帯域での吸収極大波長のシフト量が20nm程度であるのに対して、近赤外波長帯域での吸収極大波長のシフト量は200nm程度である。即ち、可視光波長帯域での吸収極大波長のシフト量よりも、近赤外波長帯域での吸収極大波長のシフト量の方が大きい。したがって、可視光波長帯域における吸収スペクトルの変化のみを利用する方法に比べて、近赤外波長帯域における吸収スペクトルの変化も利用できる本発明の実施形態に係るアッセイ法が有利であることは明らかである。
【0042】
上記では、金属微細構造を有するプレート10を固相として使用する例として、微小体12aを使用して形成された金属微粒子120表面上に、抗体21や被検出物22を固定する場合を示した。しかし、金属薄膜層13中の自由電子を局在して分布させることによって光学的吸収性を得るための微細構造であれば、プレート10には他の種々の構造が採用可能である。即ち、図1、図2に示したように、金属薄膜層13が表面方向に不連続な構造を有することによって複数の金属微小体が構成され、この金属微小体が、光の照射によって自由電子が振動する程度の大きさ、材料であればよい。
【0043】
また、図1や図2に示したように、プレート10表面に達する空洞やひび等の空間がプレート10内部に形成されていることにより、被検出物22及び酵素25の基質がプレート10の内部に容易に浸透する。このため、被検出物22や酵素25の基質等がプレート10に接触する面積が増大し、検出感度を向上することができる。
【0044】
以上に説明したように、本発明の実施形態に係るアッセイ法では、金属薄膜層と誘電体多孔質膜層とを交互に積層して形成することよって光学的吸収性を有するプレート10を固相として使用する。そして、プレート10上に酵素反応による生成物30を形成することによって、プレート10の吸収スペクトルを変化させる。これにより、被検出物22を高感度で検出できる。更に、例えば簡便な光学装置と本発明の実施形態に係るアッセイ法とを組み合わせることにより、広いダイナミックレンジで被検出物22の定量的測定が可能である。
【0045】
したがって、本発明の実施形態に係るアッセイ法によれば、ダイナミックレンジの広い高感度の比色型アッセイ法を実現できる。また、検出感度が同じ場合には、従来よりも短時間で酵素反応の結果を判定できるため、検出時間の短縮が可能である。更に、検出に必要なサンプル量を低減することもできる。
【0046】
また、デオキシリボ核酸(DNA)やリボ核酸(RNA)等の核酸を解析するために、本発明の実施形態の係る光学的吸収性を有するプレート10を固相として、酵素標識を使用した比色型アッセイ法を実施することができる。つまり、本発明は、遺伝子解析に利用可能である。
【0047】
(その他の実施形態)
上記のように、本発明は実施形態によって記載したが、この開示の一部をなす論述及び図面はこの発明を限定するものであると理解すべきではない。この開示から当業者には様々な代替実施形態、実施例及び運用技術が明らかとなろう。
【0048】
既に述べた実施形態の説明においては、基板1上に金属薄膜層11、誘電体多孔質膜層12及び金属薄膜層13を積層してプレート10が形成されていたが、金属からなる基板1上に、誘電体多孔質膜層12及び金属薄膜層13を積層してプレート10を形成してもよい。
【0049】
このように、本発明はここでは記載していない様々な実施形態等を含むことは勿論である。したがって、本発明の技術的範囲は上記の説明から妥当な特許請求の範囲に係る発明特定事項によってのみ定められるものである。
【産業上の利用可能性】
【0050】
本発明のアッセイ法は、イノムアッセイ、遺伝子解析、臨床検査、環境モニタリング、食品検査等の、酵素標識を用いた検出方法を採用する用途に利用可能である。
【符号の説明】
【0051】
1…基板
10…プレート
11…金属薄膜層
12…誘電体多孔質膜層
12a…微小体
13…金属薄膜層
21…抗体
22…被検出物
23…非抗原物質
24…二次抗体
25…酵素
30…生成物
120…金属微粒子
【技術分野】
【0001】
本発明は、物質の検出技術に係り、特に比色法を用いたアッセイ法に関する。
【背景技術】
【0002】
物質検出方法として、比色法を用いたアッセイ法が用いられている。比色法を用いたアッセイ法として、アルカリフォスファターゼ、パーオキシダーゼ等の酵素を用いる方法が挙げられる。これらのアッセイ法においては、サンドイッチアッセイ法がよく用いられる。サンドイッチアッセイ法では、酵素で修飾された二次抗体を用い、酵素に基質を加えて生成される生成物の色によって、被検出物の有無及び量を判定する。(例えば、特許文献1参照。)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2003−14692号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
しかしながら、従来の比色法では定量的測定が困難であり、ダイナミックレンジの欠如が問題となっていた。例えば臨床分野においては、イムノクロマトグラフィの形で比色法が用いられることが一般的であるが、ほとんどが定性的測定に限定されている。
【0005】
上記問題点に鑑み、本発明は、ダイナミックレンジの広い高感度の比色型のアッセイ法を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明の一態様によれば、金属微細構造を有するように金属薄膜層と誘電体多孔質膜層とを交互に積層して形成され、特定の波長の光を吸収する光学的吸収性を有するプレートを用意するステップと、そのプレートを固相に用いて被検出物を検出するステップとを含むアッセイ法が提供される。
【発明の効果】
【0007】
本発明によれば、ダイナミックレンジの広い高感度の比色型のアッセイ法を提供できる。
【図面の簡単な説明】
【0008】
【図1】本発明の実施形態に係るアッセイ法に使用するプレートの構成例を示す模式的な断面図である。
【図2】本発明の実施形態に係るアッセイ法に使用するプレートの他の構成例を示す模式的な断面図である。
【図3】本発明の実施形態に係るアッセイ法に使用するプレートのSEM写真である。
【図4】本発明の実施形態に係るアッセイ法に使用するプレートの配置例である。
【図5】本発明の実施形態に係るアッセイ法を説明するための模式図である(その1)。
【図6】本発明の実施形態に係るアッセイ法を説明するための模式図である(その2)。
【図7】本発明の実施形態に係るアッセイ法を説明するための模式図である(その3)。
【図8】本発明の実施形態に係るアッセイ法を説明するための模式図である(その4)。
【図9】本発明の実施形態に係るアッセイ法を説明するための模式図である(その5)。
【図10】本発明の実施形態に係るアッセイ法による生成物の形成を示すSEM写真であり、図10(a)は生成物が形成される前のSEM写真であり、図10(b)は生成物が形成された後のSEM写真である。
【図11】本発明の実施形態に係るアッセイ法によって生成物が形成される前後のプレートの状態を示す例である。
【図12】本発明の実施形態に係るアッセイ法による吸収スペクトルの変化を示すグラフである。
【図13】比較例による吸収スペクトルの変化を示すグラフである。
【図14】本発明の実施形態に係るアッセイ法による吸収スペクトルの変化を示すグラフであり、図14(a)は可視光波長帯域及び近赤外波長帯域のグラフ、図14(b)は近赤外波長帯域のグラフである。
【図15】本発明の実施形態に係るアッセイ法による吸収スペクトルの変化の大きさを示すグラフである。
【発明を実施するための形態】
【0009】
次に、図面を参照して、本発明の実施形態を説明する。以下の図面の記載において、同一又は類似の部分には同一又は類似の符号を付している。ただし、図面は模式的なものであり、厚みと平面寸法との関係、各層の厚みの比率等は現実のものとは異なることに留意すべきである。したがって、具体的な厚みや寸法は以下の説明を参酌して判断すべきものである。又、図面相互間においても互いの寸法の関係や比率が異なる部分が含まれていることはもちろんである。
【0010】
又、以下に示す実施形態は、この発明の技術的思想を具体化するための装置や方法を例示するものであって、この発明の実施形態は、構成部品の材質、形状、構造、配置等を下記のものに特定するものでない。この発明の実施形態は、特許請求の範囲において、種々の変更を加えることができる。
【0011】
本発明の実施形態に係るアッセイ法は、図1に示すような、金属微細構造を有するように金属薄膜層13と誘電体多孔質膜層12とを交互に積層して形成され、特定の波長の光を吸収する光学的吸収性を有するプレート10を用意するステップと、そのプレート10を固相に用いて被検出物を検出するステップとを含む、比色型イノムアッセイ及び遺伝子解析方法である。誘電体多孔質膜層12は、誘電体多孔質膜層12を介して電子が金属薄膜層間を移動できない程度の絶縁性を有する。
【0012】
先ず、本発明の実施形態に係るアッセイ法の原理を説明する。金(Au)、銀(Ag)、プラチナ(Pt)等の金属微小体に光を照射すると、金属微小体内部の自由電子の振動が発生する。自由電子のこの振動の振動周波数及び振幅は、金属微小体近傍の誘電率に依存して変化することが知られている。このため、金属微小体表面上に酵素反応による生成物を形成することによって、生成物を形成する前と後とで金属微小体内部の自由電子の振動の振動周波数及び振幅が変化する。その結果、金属微小体の吸収スペクトルが変化する。
【0013】
したがって、金属微小体が形成されていることによって一定の波長の光を吸収する光学的吸収性を有するプレート10を用いて、被検出物を高感度で検出することが可能である。即ち、被検出物についての抗体を修飾する酵素と基質との酵素反応により形成された生成物を、プレート10上に堆積させる。これにより、プレート10の吸収スペクトルが変化するため、被検出物を高感度で検出できる。
【0014】
このために、自由電子を局在させるための金属微細構造を有するように、プレート10を形成する。つまり、光を照射されることによって内部の自由電子が振動する程度の大きさである金属微小体の集合により構成される金属微細構造が、プレート10に形成されている。
【0015】
例えば、膜厚5nm〜10μm程度の金属薄膜層11を基板1上に形成する。基板1には、例えばガラス基板やシリコン基板等の、表面が平坦な基板が採用可能である。金属薄膜層11には、Au、Ag、Pt、銅(Cu)等が採用可能である。
【0016】
次いで、金属薄膜層11上に、膜厚5nm〜10μm程度の誘電体多孔質膜層12を形成する。ただし、表面の平坦性を担保できるのであれば、誘電体多孔質膜層12の膜厚をもっと厚く、例えば数百μm程度にしてもよい。誘電体多孔質膜層12には、誘電体多孔質膜層12を電子が通過できない低導電率の材料、例えば絶縁膜、を採用可能である。
【0017】
更に、膜厚5nm〜10μm程度の金属薄膜層13を誘電体多孔質膜層12上に形成する。誘電体多孔質膜層12上に薄膜が形成されるため、図1に示すように、表面から膜厚方向に延伸する複数の溝がプレート10に形成される。つまり、金属薄膜層13は金属微小体の集合となる。溝に囲まれた金属微小体に金属薄膜層13の自由電子が局在する。
【0018】
なお、光の照射によって内部で自由電子の振動が発生する金属微小体が形成されるのであれば、金属薄膜層13の材料に制限は無い。例えば、Au、Ag、Pt等の貴金属であれば、上記金属微小体を形成可能である。また、Cuからなる金属微小体においても、内部の自由電子の振動が発生する。なお、金属微小体内部で自由電子の振動が発生するためには、金属微小体の大きさが1nm〜500nm程度であることが好ましい。金属微小体が小さいほど吸収スペクトルのピーク形状が急峻になるため、金属微小体の大きさは200nm以下であることが更に好ましい。吸収スペクトルのピーク形状が急峻なほど、吸収スペクトルの変化を観測しやすいためである。
【0019】
プレート10は、少なくとも2層の金属薄膜層11、13、及び金属薄膜層11、13に挟まれた誘電体多孔質膜層12から構成される。ただし、誘電体多孔質膜層12と金属薄膜層13の製造工程を繰り返して、3層以上の金属薄膜層を有するプレート10を形成してもよい。
【0020】
又、図2に示すプレート10を形成してもよい。即ち、金属薄膜層11の表面に誘電体多孔質膜層12として複数の微小体12aを吸着させ、更に、微小体12a上にそれぞれ金属薄膜を堆積させて金属薄膜層13を形成する。金属薄膜層13の上面を平坦にすると、吸収スペクトルの変化が観測されやすい。そのため、各微小体12aの上面を同一平面レベルにすることが好ましい。
【0021】
微小体12aの材質や形状は問わないが、例えば、直径10nm〜1μm程度のポリスチレン粒子やシリカ粒子を用いる。微小体12a上の金属薄膜は、各微粒子の金属薄膜の上面を同一平面レベルにするために、例えば抵抗加熱蒸着法やスパッタ法により形成することが好ましい。なお、微小体12aの吸着工程及び金属薄膜の形成工程を繰り返して、プレート10を形成してもよい。
【0022】
図3は、粒径が100nm程度のシリカ粒子を微小体12aに用いて形成された、図2に示した構造を有するプレート10の走査型電子顕微鏡(SEM)写真である。図4は、基板1上の複数のスポット領域にプレート10をアレイ状に配置した例を示す。スポット径は、例えば3mm程度である。
【0023】
以下に図5〜図9を参照して、図2に示したプレート10を用いた本発明の実施形態に係るアッセイ法の例を説明する。ここで、プレート10は、金属薄膜層11の表面に複数の微小体12aを吸着させ、微小体12a上にそれぞれ金属薄膜を堆積して形成された金属微粒子120を有する。以下では、プレート10を固相として用いるイノムアッセイ法を例示的に説明する。
【0024】
図5に示すように、プレート10で金属微細構造を構成する金属微粒子120表面に、抗体21が固定されている。抗体21の固定方法は、一般的な物理吸着、化学吸着等が採用可能である。
【0025】
抗体21に対する抗原である被検出物22を含む試料をプレート10に触れさせることにより、図6に示すように、抗原抗体反応によって試料中の被検出物22のみがプレート10に吸着する。一方、試料中の非抗原物質23はプレート10に吸着されない。
【0026】
その後、被検出物22に対する二次抗体24をプレート10に加える。二次抗体24は、アルカリフォスファターゼ(ALP)等の酵素25で修飾されている。抗原抗体反応により、図7に示すように二次抗体24がプレート10に吸着される。酵素標識として使用される酵素25には、ALPの他に、パーオキシダーゼ、アセチルコリンエステラーゼ、カタラーゼ、β-D-ガラクトシダーゼ、グルコースオキシダーゼ、グルコース-6-リン酸脱水素酵素、β-ラクタマーゼ、ピロホスファターゼ、ウレアーゼ等を使用できる。
【0027】
図8に、抗原抗体反応後の処理を示す。二次抗体24に結合されている酵素25に基質を加えることにより、生成物30が形成される。生成物30は、図9に示すように、プレート10の表面に生成物30として沈殿する。つまり、金属微粒子120表面に生成物30が形成される。
【0028】
金属微粒子120表面に生成物30が形成される前のSEM写真を図10(a)に、生成物30が形成された後のSEM写真を図10(b)に、それぞれ示す。ここで、粒径100nmのシリカ粒子を微小体12aに使用し、酵素25として用いたアルカリフォスファターゼに、ニトロブルーテトラゾリウム/ブロモクロロインドリルりん酸(NBT/BCIP)基質を添加して生成物30を形成した。図10(b)に示すように、金属微粒子120の輪郭のようにみえる生成物30を確認できる。
【0029】
上記のように、試料に被検出物22が含まれている場合には、プレート10上に生成物30が形成される。このため、生成物30を形成する前と後とで金属微粒子120内部の自由電子の振動の振動周波数及び振幅が変化する。つまり、生成物30が形成されることにより、プレート10の吸収スペクトルが変化する。この吸収スペクトルの変化は、色の変化として目視によっても識別が可能である。
【0030】
一方、試料に被検出物22が含まれていない場合には、生成物30が形成されず、プレート10の吸収スペクトルは変化しない。
【0031】
したがって、試料に被検出物22が含まれているか否かは、プレート10の色が変化するか否かにより判定可能である。図11に、酵素25に基質を加えることにより生じる酵素反応によって生成物30が形成される前後の、プレート10の状態の例を示す。図11で、符号Aで示したプレート10が生成物30を形成する前の状態、符号Bで示したプレート10が生成物30を形成した後の状態である。このように、目視により被検出物22を検出可能である。
【0032】
なお、上記ではプレート10に抗体21が最初に固定され、試料に被検出物22が含まれる場合を説明した。しかし、プレート10に被検出物22が最初に固定され、試料に抗体21が含まれていてもよいことはもちろんである。
【0033】
図12に、酵素反応による生成物30の形成が進むにつれて刻々と変化する吸収スペクトルの例を示す。図12中の矢印は、酵素反応が進むにつれての吸収スペクトルの変化を、10秒間隔で示している。吸収スペクトル50は酵素反応の開始時の吸収スペクトルであり、吸収スペクトル51は酵素反応の終了時の吸収スペクトルである。
【0034】
図12に示すように、酵素反応が進むに従って、吸収波長の極大値が長波長側にシフトすると共に、吸光度が増大する。このように、本発明の実施形態に係るアッセイ法によれば、吸収スペクトルの絶対値や吸収波長の極大値の変化を観測することにより、被検出物22を検出できる。
【0035】
比較例として、金属微細構造を有さない金属薄膜を固相に用いて、上記と同様の酵素反応を起こさせた場合の吸収スペクトルを図13に示す。図13中の矢印は、酵素反応が進むにつれての吸収スペクトルの変化を表す。吸収スペクトル60は酵素反応の開始時の吸収スペクトルであり、吸収スペクトル61は酵素反応の終了時の吸収スペクトルである。
【0036】
図13に示したように、金属微細構造を有さない金属薄膜を固相に用いた場合にも、吸収スペクトルの変化が生じている。しかし、プレート10を固相に用いた場合に比べて、図13に示した吸収スペクトルの変化は非常に小さい。したがって、金属微細構造を有するプレート10を固相に用いる本発明の実施形態に係るアッセイ法は、被検出物22の検出に顕著な効果があることが確認された。
【0037】
本発明の実施形態に係るアッセイ法による処理を実施した場合における、可視光波長帯域から近赤外波長帯域における光学特性の変化を、図14(a)及び図14(b)に示す。図14(a)及び図14(b)に示した特性は、水中ではなく、乾燥された状態、即ち空気中で測定されたプレート10の吸収スペクトルである。図14(a)及び図14(b)において、吸収スペクトル70は未処理のプレート10の吸収スペクトル、吸収スペクトル71は酵素25が物理吸着された直後のプレート10の吸収スペクトル、吸収スペクトル72は酵素反応後のプレート10の吸収スペクトルである。
【0038】
図14(a)に示すように、酵素反応後に波長630nm近傍に顕著な吸収波長のピークが現れている。また、図14(a)に示した可視光波長帯域及び近赤外波長帯域の吸収スペクトルにおいては、測定に使用した分光光度計の特性上、波長950nmより長波長側は正確に測定されていない。しかし、図14(b)に示すように、波長1650nm近傍まで測定可能な分光光度計を用いると、酵素反応後に波長1075nm近傍に顕著な吸収波長のピークが現れている。つまり、吸収スペクトルの変化は、可視光波長帯域のみならず、近赤外波長帯域にも起こることがわかる。
【0039】
即ち、本発明の実施形態に係るアッセイ法によれば、目視によって被検出物22を検出できるのみならず、近赤外波長帯域における吸収スペクトルの変化を生じさせて、この変化を検出することができる。例えば、波長400nm〜700nmの可視光波長帯域に吸収波長の極大値を有するプレート10を固相として用いることにより、目視若しくは吸収スペクトルの変化によって被検出物22を検出できる。更に、波長800nm〜1600nmの近赤外波長帯域に吸収波長の極大値を有するプレート10を固相として用いることにより、吸収スペクトルの変化によって被検出物22を検出できる。プレート10の吸収スペクトルは、金属微細構造を構成する金属微小体のサイズや材料等に依存する。
【0040】
図15に、可視光波長帯域及び近赤外波長帯域における、酵素反応の進行による吸収スペクトルの変化の例を示す。図15は、酵素25としてALPを使用した場合における、酵素反応の開始時刻を起点とする酵素反応時間と、酵素反応の開始時刻からの、吸収スペクトルの吸収波長の極大値(吸収極大波長)を示す波長の変化量(以下において、「吸収極大波長のシフト量」という。)との関係を表す。
【0041】
図15中に符号aで示した値は、近赤外波長帯域における吸収極大波長のシフト量であり、符号bで示した値は、可視光波長帯域における吸収極大波長のシフト量である。図15に示すように、可視光波長帯域での吸収極大波長のシフト量が20nm程度であるのに対して、近赤外波長帯域での吸収極大波長のシフト量は200nm程度である。即ち、可視光波長帯域での吸収極大波長のシフト量よりも、近赤外波長帯域での吸収極大波長のシフト量の方が大きい。したがって、可視光波長帯域における吸収スペクトルの変化のみを利用する方法に比べて、近赤外波長帯域における吸収スペクトルの変化も利用できる本発明の実施形態に係るアッセイ法が有利であることは明らかである。
【0042】
上記では、金属微細構造を有するプレート10を固相として使用する例として、微小体12aを使用して形成された金属微粒子120表面上に、抗体21や被検出物22を固定する場合を示した。しかし、金属薄膜層13中の自由電子を局在して分布させることによって光学的吸収性を得るための微細構造であれば、プレート10には他の種々の構造が採用可能である。即ち、図1、図2に示したように、金属薄膜層13が表面方向に不連続な構造を有することによって複数の金属微小体が構成され、この金属微小体が、光の照射によって自由電子が振動する程度の大きさ、材料であればよい。
【0043】
また、図1や図2に示したように、プレート10表面に達する空洞やひび等の空間がプレート10内部に形成されていることにより、被検出物22及び酵素25の基質がプレート10の内部に容易に浸透する。このため、被検出物22や酵素25の基質等がプレート10に接触する面積が増大し、検出感度を向上することができる。
【0044】
以上に説明したように、本発明の実施形態に係るアッセイ法では、金属薄膜層と誘電体多孔質膜層とを交互に積層して形成することよって光学的吸収性を有するプレート10を固相として使用する。そして、プレート10上に酵素反応による生成物30を形成することによって、プレート10の吸収スペクトルを変化させる。これにより、被検出物22を高感度で検出できる。更に、例えば簡便な光学装置と本発明の実施形態に係るアッセイ法とを組み合わせることにより、広いダイナミックレンジで被検出物22の定量的測定が可能である。
【0045】
したがって、本発明の実施形態に係るアッセイ法によれば、ダイナミックレンジの広い高感度の比色型アッセイ法を実現できる。また、検出感度が同じ場合には、従来よりも短時間で酵素反応の結果を判定できるため、検出時間の短縮が可能である。更に、検出に必要なサンプル量を低減することもできる。
【0046】
また、デオキシリボ核酸(DNA)やリボ核酸(RNA)等の核酸を解析するために、本発明の実施形態の係る光学的吸収性を有するプレート10を固相として、酵素標識を使用した比色型アッセイ法を実施することができる。つまり、本発明は、遺伝子解析に利用可能である。
【0047】
(その他の実施形態)
上記のように、本発明は実施形態によって記載したが、この開示の一部をなす論述及び図面はこの発明を限定するものであると理解すべきではない。この開示から当業者には様々な代替実施形態、実施例及び運用技術が明らかとなろう。
【0048】
既に述べた実施形態の説明においては、基板1上に金属薄膜層11、誘電体多孔質膜層12及び金属薄膜層13を積層してプレート10が形成されていたが、金属からなる基板1上に、誘電体多孔質膜層12及び金属薄膜層13を積層してプレート10を形成してもよい。
【0049】
このように、本発明はここでは記載していない様々な実施形態等を含むことは勿論である。したがって、本発明の技術的範囲は上記の説明から妥当な特許請求の範囲に係る発明特定事項によってのみ定められるものである。
【産業上の利用可能性】
【0050】
本発明のアッセイ法は、イノムアッセイ、遺伝子解析、臨床検査、環境モニタリング、食品検査等の、酵素標識を用いた検出方法を採用する用途に利用可能である。
【符号の説明】
【0051】
1…基板
10…プレート
11…金属薄膜層
12…誘電体多孔質膜層
12a…微小体
13…金属薄膜層
21…抗体
22…被検出物
23…非抗原物質
24…二次抗体
25…酵素
30…生成物
120…金属微粒子
【特許請求の範囲】
【請求項1】
金属微細構造を有するように金属薄膜層と誘電体多孔質膜層とを交互に積層して形成され、特定の波長の光を吸収する光学的吸収性を有するプレートを用意するステップと、
前記プレートを固相に用いて被検出物を検出するステップと
を含むことを特徴とするアッセイ法。
【請求項2】
前記被検出物及び前記被検出物の抗体を前記プレート上に固定するステップと、
酵素で修飾された二次抗体を前記プレートに吸着させるステップと、
前記プレート上の前記酵素に基質を加えて生成した生成物を前記プレートの表面に形成し、前記プレートの吸収スペクトルを変化させるステップと
を含むことを特徴とする請求項1に記載のアッセイ法。
【請求項3】
前記吸収スペクトルの変化が、前記吸収スペクトルの絶対値又は吸収波長の極大値の変化であることを特徴とする請求項2に記載のアッセイ法。
【請求項4】
前記プレートが、波長400nm〜700nmの可視光波長帯域に前記吸収波長の極大値を有することを特徴とする請求項3に記載のアッセイ法。
【請求項5】
前記プレートが、波長800nm〜1600nmの近赤外波長帯域に前記吸収波長の極大値を有することを特徴とする請求項3又は4に記載のアッセイ法。
【請求項6】
前記金属薄膜層が、前記金属薄膜層中の自由電子を局在させるための微細構造を有することを特徴とする請求項1乃至5のいずれか1項に記載のアッセイ法。
【請求項7】
前記金属薄膜層が、表面が不連続な構造を有することを特徴とする請求項6に記載のアッセイ法。
【請求項8】
前記プレートの表面に達する空間が前記プレート内部に形成されていることにより、前記被検出物及び前記基質が前記プレート内部に浸透することを特徴とする請求項2乃至7のいずれか1項に記載のアッセイ法。
【請求項1】
金属微細構造を有するように金属薄膜層と誘電体多孔質膜層とを交互に積層して形成され、特定の波長の光を吸収する光学的吸収性を有するプレートを用意するステップと、
前記プレートを固相に用いて被検出物を検出するステップと
を含むことを特徴とするアッセイ法。
【請求項2】
前記被検出物及び前記被検出物の抗体を前記プレート上に固定するステップと、
酵素で修飾された二次抗体を前記プレートに吸着させるステップと、
前記プレート上の前記酵素に基質を加えて生成した生成物を前記プレートの表面に形成し、前記プレートの吸収スペクトルを変化させるステップと
を含むことを特徴とする請求項1に記載のアッセイ法。
【請求項3】
前記吸収スペクトルの変化が、前記吸収スペクトルの絶対値又は吸収波長の極大値の変化であることを特徴とする請求項2に記載のアッセイ法。
【請求項4】
前記プレートが、波長400nm〜700nmの可視光波長帯域に前記吸収波長の極大値を有することを特徴とする請求項3に記載のアッセイ法。
【請求項5】
前記プレートが、波長800nm〜1600nmの近赤外波長帯域に前記吸収波長の極大値を有することを特徴とする請求項3又は4に記載のアッセイ法。
【請求項6】
前記金属薄膜層が、前記金属薄膜層中の自由電子を局在させるための微細構造を有することを特徴とする請求項1乃至5のいずれか1項に記載のアッセイ法。
【請求項7】
前記金属薄膜層が、表面が不連続な構造を有することを特徴とする請求項6に記載のアッセイ法。
【請求項8】
前記プレートの表面に達する空間が前記プレート内部に形成されていることにより、前記被検出物及び前記基質が前記プレート内部に浸透することを特徴とする請求項2乃至7のいずれか1項に記載のアッセイ法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公開番号】特開2011−169726(P2011−169726A)
【公開日】平成23年9月1日(2011.9.1)
【国際特許分類】
【出願番号】特願2010−33354(P2010−33354)
【出願日】平成22年2月18日(2010.2.18)
【出願人】(501061319)学校法人 東洋大学 (68)
【Fターム(参考)】
【公開日】平成23年9月1日(2011.9.1)
【国際特許分類】
【出願日】平成22年2月18日(2010.2.18)
【出願人】(501061319)学校法人 東洋大学 (68)
【Fターム(参考)】
[ Back to top ]

