アデノウイルスベクターによるSOD2酵素ノックダウンの系を用いた用量依存性の薬物誘導性肝障害ラットモデル
【課題】ヒトにおける用量依存性の薬物誘導性肝障害を再現するモデル動物として使用可能である遺伝子ノックダウン非ヒト哺乳動物を提供する。
【解決手段】SOD2酵素の発現がRNA干渉法によりノックダウンされている、遺伝子ノックダウン非ヒト哺乳動物。このRNA干渉法では、特定の第1の塩基配列と、他の第2の塩基配列と、第1の塩基配列および第2の塩基配列を連結するループ配列と、を含む塩基配列からなるshRNAを発現可能なアデノウイルスベクターを非ヒト哺乳動物に感染させることにより、SOD2酵素の発現を抑制する。
【解決手段】SOD2酵素の発現がRNA干渉法によりノックダウンされている、遺伝子ノックダウン非ヒト哺乳動物。このRNA干渉法では、特定の第1の塩基配列と、他の第2の塩基配列と、第1の塩基配列および第2の塩基配列を連結するループ配列と、を含む塩基配列からなるshRNAを発現可能なアデノウイルスベクターを非ヒト哺乳動物に感染させることにより、SOD2酵素の発現を抑制する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、遺伝子ノックダウン非ヒト哺乳動物、それを用いる薬物動態の試験方法、並びにそれを作成するためのshRNA、siRNAおよびアデノウイルスベクターに関する。
【背景技術】
【0002】
臨床で問題となる薬物による副作用の3分の1以上は、代謝反応に起因するものであると言われている。そのうちの90%以上がチトクロムP450による代謝反応が関与する。最近、代謝反応に起因する薬物相互作用に関心が高まり、医療用医薬品の添付文書も相互作用をチトクロムP450の分子種レベルで説明するように改訂されてきている。
【0003】
さらに、1997年米国FDAの「Guideline for Drug Metabolism and Drug Interactions」でも示されたように、薬の開発から臨床での適切な使用に至るまで、代謝反応が関わる薬物相互作用に充分注意をする必要があると言われるようになってきた。特に、すでに臨床で使用されている薬に見いだされている様々な薬物相互作用について代謝レベルで主にin vitroで検討することにより、相互作用についてさらに理解を深めることが重要となってきた。
【0004】
実験動物やin vitroでの試験結果からヒトでの結果を予測することを「外挿」と言う。すなわち、実験動物で得られた代謝物が本当にヒトにも生成し得るものであるか等が問題となる。ラットやマウスの齧歯類よりも、ヒトに近いイヌやサルを用いた研究も盛んに行われているが、膨大な数の実験動物の使用を少しでも減らすためにも、適切にヒトへの外挿ができる実験手段の開発が望まれている。こうした観点から、ヒトの薬物代謝酵素の遺伝子を導入したあらたな試験系の開発が望まれている。
【0005】
ヒトの薬物代謝酵素の遺伝子を導入した公知の薬理学的および毒性学的研究のための非ヒトトランスジェニック動物としては、例えば、ヒトCYP450イソ型を発現するトランスジェニックマウス(特許文献1の実施例6)などが挙げられる。
【0006】
一方、薬物誘導性肝障害を惹起する原因の一つとして、酸化ストレスが知られており、酸化ストレスの引き金となるスーパーオキシドの90%以上がミトコンドリア中で産生される。Superoxide dismutase 2(SOD2)はミトコンドリア中に局在しており、スーパーオキシドの除去に重要な役割を果たしている。
【0007】
ここで、非特許文献1および非特許文献2には、SOD2へテロノックアウトマウスにおけるSOD2遺伝子の発現抑制が薬物誘導性肝障害を引き起こす原因となる旨が記載されている。すなわち、非特許文献1および非特許文献2には、マウスのSOD2ヘテロノックアウトによって薬物誘導性肝障害がおきる旨が記載されている。特に、非特許文献1には、SOD2へテロノックアウトマウスにトログリタゾンを投与すると、ミトコンドリアの酸化ストレスのバイオマーカー(ACO2)の減少や、タンパク質の酸化物(protein carbonyls)の増加が観察される旨が記載されている。
【0008】
なお、トログリタゾンによる薬物性肝障害については、例えば非特許文献3において代謝性特異体質性肝障害に分類されている。
【0009】
【特許文献1】特表2004−533826号公報
【非特許文献1】Lee YH, Chung MC, Lin Q, Boelsterli UA., “Troglitazone-induced hepatic mitochondrial proteome expression dynamics in heterozygous Sod2(+/-) mice: two-stage oxidative injury.”, Toxicol Appl Pharmacol. 2008 Aug 15; 231(1):43-51. Epub 2008 Apr 12.
【非特許文献2】Ong MM, Latchoumycandane C, Boelsterli UA., “Troglitazone-induced hepatic necrosis in an animal model of silent genetic mitochondrial abnormalities.”, Toxicol Sci. 2007 May; 97(1):205-13. Epub 2006 Dec 5.
【非特許文献3】池田敏彦著、「肝機能障害」日本薬理学雑誌 Vol.127 (2006), No.6 454-459
【発明の開示】
【発明が解決しようとする課題】
【0010】
しかしながら、特許文献1に記載されているヒトCYP450イソ型を発現するトランスジェニックマウスは、ヒトにおける薬物誘導性肝障害を予測するモデル動物としてはさらなる改善の余地がある。なぜなら、ラットおよびマウスの肝臓組織におけるグルタチオン合成能は、ヒトの肝臓組織におけるグルタチオン合成能よりも著しく高いため、活性代謝物をグルタチオン抱合して解毒する能力に優れるためである。
【0011】
特に、グルタチオン抱合の速度はラットよりマウスが4倍速いことが知られている(Liu J et al., “Characterization of the acetaminophen-glutathione conjugation reaction by liver microsomes: species difference in the effects of acetone.”, Toxicol Lett., 1991, May;56(3):269-274)ことから、ヒトCYP450イソ型を発現するトランスジェニックマウスでは、薬物誘導性肝障害が起こりにくく、ヒトにおける薬物誘導性肝障害を予測するモデル動物としては使用困難である。
【0012】
また、非特許文献1および非特許文献2に記載されているSOD2へテロノックアウトマウスでは、トログリタゾンを投与することによって薬物誘導性肝障害が引き起こされている。ここで、トログリタゾンによって引き起こされる薬物誘導性肝障害は、非特許文献3にもあるように、代謝性特異体質性の薬物誘導性肝障害(非用量依存性の薬物誘導性肝障害)に分類されており、アセトアミノフェンによって引き起こされる非特異体質性の薬物誘導性肝障害(用量依存性の薬物誘導性肝障害)とは作用機序が全く異なっている。そのため、非特許文献1および非特許文献2に記載されているSOD2へテロノックアウトマウスを、アセトアミノフェンによって引き起こされる非特異体質性の薬物誘導性肝障害のモデルマウスとして使用することは困難である。
【0013】
本発明は上記事情に鑑みてなされたものであり、アセトアミノフェンなどによって引き起こされるヒトにおける非特異体質性の薬物誘導性肝障害(用量依存性の薬物誘導性肝障害)を予測するモデル動物として活用できる、遺伝子ノックダウン非ヒト哺乳動物を提供することを目的とする。
【課題を解決するための手段】
【0014】
本発明によれば、SOD2遺伝子がノックダウンされている、遺伝子ノックダウン非ヒト哺乳動物が提供される。
【0015】
この遺伝子ノックダウン非ヒト哺乳動物によれば、SOD2遺伝子がノックダウンされているため、薬物の活性代謝物のSOD2酵素による解毒作用を抑制することができる。その結果、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となるので、ヒトにおける毒性発現予測に役立てることのできる遺伝子ノックダウン非ヒト哺乳動物が得られる。
【0016】
上記の遺伝子ノックダウン非ヒト哺乳動物は、別の視点から見れば、同一種の野生型の非ヒト哺乳動物に対して、肝臓組織におけるSOD2mRNAの発現量、SOD2タンパク質の発現量、またはSOD2酵素活性のいずれかが有意に低い、遺伝子ノックダウン非ヒト哺乳動物である。
【0017】
この遺伝子ノックダウン非ヒト哺乳動物によれば、同一種の野生型の非ヒト哺乳動物に対して、肝臓組織におけるSOD2mRNAの発現量、SOD2タンパク質の発現量、またはSOD2酵素活性のいずれかが有意に低いため、薬物の活性代謝物のSOD2酵素による解毒作用を抑制することができる。その結果、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となるので、ヒトにおける毒性発現予測に役立てることのできる遺伝子ノックダウン非ヒト哺乳動物が得られる。
【0018】
また、本発明によれば、上記のいずれかの遺伝子ノックダウン非ヒト哺乳動物、その肝臓組織またはその肝臓細胞を用いる、ヒトにおける用量依存性の薬物誘導性肝障害の原因候補化合物についての薬物動態の試験方法が提供される。
【0019】
この薬物動態の試験方法によれば、上記のいずれかの遺伝子ノックダウン非ヒト哺乳動物、その肝臓組織またはその肝臓細胞を用いるため、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となり、その薬物の活性代謝物によるヒトにおける毒性発現予測が可能となる。
【0020】
また、本発明によれば、後述する特定の塩基配列からなるshRNAまたはsiRNAが提供される。
【0021】
これらの特定の塩基配列からなるshRNAまたはsiRNAをラットの細胞内で発現させることにより、ラットの細胞内におけるSOD2酵素の発現をRNA干渉法によりノックダウンさせることができる。
【0022】
そして、このラットでは、SOD2酵素がノックダウンされているため、薬物の活性代謝物のSOD2酵素による解毒作用を抑制することができる。その結果、このラットでは、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となるので、ヒトにおける毒性発現予測に役立てることのできるモデルラットが得られる。
【0023】
また、本発明によれば、上記のshRNAまたはsiRNAのいずれかを発現可能なアデノウイルスベクターが提供される。
【0024】
このアデノウイルスベクターをラットに感染させ、上記のshRNAまたはsiRNAのいずれかを発現させることにより、SOD2酵素の発現をRNA干渉法によりノックダウンさせることができる。
【0025】
そして、このラットでは、SOD2酵素がノックダウンされているため、薬物の活性代謝物のSOD2酵素による解毒作用を抑制することができる。その結果、このラットでは、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となるので、ヒトにおける毒性発現予測に役立てることのできるモデルラットが得られる。
【発明の効果】
【0026】
本発明によれば、薬物の活性代謝物のSOD2酵素による解毒作用が抑制されるため、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となるので、ヒトにおける毒性発現予測に役立てることのできる遺伝子ノックダウン非ヒト哺乳動物が得られる。
【0027】
また、本発明によれば、上記の遺伝子ノックダウン非ヒト哺乳動物を用いることにより、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となるので、ヒトにおける毒性発現予測が可能となる。
【発明を実施するための最良の形態】
【0028】
以下、本発明の実施の形態について説明する。
【0029】
<本研究の経緯>
図1で説明するように、薬物誘導性肝障害を惹起する原因の一つとして、酸化ストレスが知られており、酸化ストレスの引き金となるスーパーオキシドの90%以上がミトコンドリア中で産生される。Superoxide dismutase 2(SOD2)は、ミトコンドリア中に局在しており、スーパーオキシドの除去に重要な役割を果たしている。本研究ではラットSOD2−short hairpin RNA(SOD2−shRNA)を発現するアデノウイルス(AdSOD2−shRNA)を構築することで、SOD2を減少させた細胞実験系およびラットにおけるモデル動物実験系を作製し、薬物誘導性のスーパーオキシドが関与する肝障害を高感度に予測する系を確立することを目的とした。in vitroではアデノウイルスを用いたshRNA発現法を用いてラット肝由来BRL3A細胞においてSOD2を減少させる検討を行い、被検薬物による細胞生存率への影響を検討した。in vivoでは、SOD2減少ラットを作製し、肝障害性を引き起こす典型的な化合物であるアセトアミノフェン(APAP)の肝障害性への影響を検討した。
【0030】
ここで、酵素活性を抑制する主な方法にノックアウトとノックダウンがあるが、ノックアウトでは、遺伝子を欠損させることにより、他の遺伝子の発現に及ぼす影響が無視できない場合がある。また、図2で説明するように、SOD2遺伝子を完全にノックアウトするとマウス胎児は致死性となるため、SOD2遺伝子のノックアウトマウスを得ることは不可能であり、非特許文献1および非特許文献2のようにSOD2へテロノックアウトマウスしか得ることができない。そこで、本発明者は、ラットのSOD2遺伝子をノックダウンする方法を採用した。なかでもスモールヘアピンRNAの発現ベクターをアデノウイルスの系で用いることを考えた。
【0031】
すなわち、図2で説明するように、本研究では、スーパーオキシドを除去する能力を持つSuperoxide dismutase 2(SOD2)酵素に注目し、この酵素の産生をアデノウイルスの系を用いてRNA干渉法によりノックダウンすることを検討した。これにより、in vitroおよびin vivoでSOD2酵素の発現を阻害し、SOD2酵素によるスーパーオキシド除去能を減少させた細胞実験系またはモデル動物実験系を作成し、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明および、ヒトにおける毒性発現予測に役立てることを目的として検討した。
【0032】
その結果、本発明者は、後述するように、SOD2酵素の産生をアデノウイルスの系を用いてRNA干渉法によりノックダウンすることにより、ラットの肝臓組織におけるSOD2酵素の含有量を実際に低減できることを見出した。そして、本発明者は、その結果、ラットの肝臓組織において実際にin vivoでアセトアミノフェン(APAP)の投与による用量依存性の肝障害が発症することを見出した。すなわち、本発明者は、この遺伝子ノックダウンラットが、ヒトにおける用量依存性の薬物誘導性肝障害の原因候補化合物についての薬物動態の研究に役立てることのできる遺伝子ノックダウン非ヒト哺乳動物であることを確認した。
【0033】
<SOD2>
本願において、Superoxide dismutase(SOD)とは、スーパーオキシドの除去に重要な役割を果たす酵素である。SODは、図1に示すように、スーパーオキシド陰イオン(・O2−)を過酸化水素と酸素分子とにする不均化反応を触媒する重要な抗酸化酵素の1つである。SODは、様々な疾患や老化を引き起こすといわれている活性酸素種に対し防御的に働く酵素の1つであり、構成する遷移金属や局在する場所によって様々な種類(例えば、SOD1(Cu/Zn SOD)、SOD2(Mn SOD)など)に分類される。これらの中でも、SOD2はミトコンドリア中に局在しており、スーパーオキシドの除去に重要な役割を果たしている。
【0034】
<活性酸素>
本願において、活性酸素とは、酸素が化学的に活性になった化学種を指す用語であり、一般に非常に不安定で強い酸化力を示す。活性酸素のうちスーパーオキシドアニオンラジカルおよび一重項酸素は、酸素原子のみでできており、その分子構造は普通の酸素分子とそれほど大きく違わないが電子配置が異なっている。一般に活性酸素とフリーラジカルとは混同されることが多いが、活性酸素にはフリーラジカルとそうでないものがある。スーパーオキシドアニオンラジカルやヒドロキシルラジカルはフリーラジカルである。過酸化水素や一重項酸素はフリーラジカルではない。広義の活性酸素には一酸化窒素、二酸化窒素、オゾン、過酸化脂質などを含む。
【0035】
活性酸素・フリーラジカルは生命を維持するために無くてはならないものであり、肺から取り込んだ酸素は赤血球中のヘモグロビンにより全身の細胞に運び込まれ、細胞中のミトコンドリアで酸素は糖質から電子を奪いスーパーオキシド→過酸化水素→ヒドロキシラジカルを経て水になる。つまりこの反応中に酸素は何度か活性酸素・フリーラジカルに変わることになる。この過程をミトコンドリア電子伝達系といい、食事で摂取した糖質がこれによってアデノシン三リン酸(ATP)というエネルギー物質に変わる。しかし全ての活性酸素・フリーラジカルが水になる訳ではなく、余った活性酸素・フリーラジカルは細胞に損傷を与える。それを防ぐために各組織には抗酸化酵素と呼ばれる、活性酸素・フリーラジカルを消去あるいは除去する酵素が存在する。その抗酸化酵素としてカタラーゼやスーパーオキシドディスムターゼ、ペルオキシダーゼなど、活性酸素を無害化する酵素がある。
【0036】
<トログリタゾン>
トログリタゾン(商品名 ノスカール(登録商標))は、三共株式会社が開発した糖尿病治療薬であり、日本では1997年3月から販売されている。また、海外ではこれまでに米国、英国などで承認されている。トログリタゾンの肝障害については治験段階では認められていなかったが、2000年に、米食品医薬品局(FDA)が、肝障害への副作用を理由に販売の中止を要請し、米国での販売元のワーナー・ランバート社(Warner−Lambert)がそれに応じたため、三共株式会社も日本での販売を中止している。トログリタゾンによって引き起こされる薬物誘導性肝障害のメカニズムは完全に解明されたわけではないが、非特許文献3に示すように、トログリタゾンによって引き起こされる薬物誘導性肝障害は、一般的には代謝性特異体質性の薬物誘導性肝障害(非用量依存性の薬物誘導性肝障害)に分類されている。
【0037】
<アセトアミノフェン>
化合物アセトアミノフェン(別名パラセタモール)は、解熱鎮痛薬の一つである。軽い発熱や、寒け、頭痛などの症状を抑える解熱剤、鎮痛剤として用いられる薬物の主要な成分の一つとなっている。一般に解熱剤は禁忌とされるインフルエンザの際にも解熱剤としてしばしば用いられるなど標準的な服用法では非常に安全な薬物であるが、その広い薬効のため、服用量が過剰となる事が少なくない。
【0038】
人体内に存在するシトクロムP450はアセトアミノフェンを酸化し、アセトアミドキノンを生成する。アセトアミドキノンは強い求電子試薬であり、グルタチオン(GSH)のチオール基や細胞内タンパク質と反応する。従ってアセトアミノフェンを多量に摂取すると肝臓毒性が現れる。ただし、治療レベルならこれは問題にならない。アセトアミノフェンによって引き起こされる薬物誘導性肝障害のメカニズムは、非特許文献3に示すように、一般的には非特異体質性の薬物誘導性肝障害(用量依存性の薬物誘導性肝障害)に分類されており、上記のトログリタゾンによって引き起こされる薬物誘導性肝障害のメカニズムとは大きく異なると考えられている。
【0039】
<非特異体質性の薬物誘導性肝障害>
薬物性肝障害には、非特許文献3に示されているように、(1)用量依存的で動物実験でも再現される非特異体質性肝障害と、(2)動物実験では再現できない特異体質性肝障害が知られている。ここで、本願で非特異体質性の薬物誘導性肝障害(用量依存性の薬物誘導性肝障害)とは、非特許文献3に示されている(1)用量依存的で動物実験でも再現される非特異体質性肝障害のことを意味するものとする。
【0040】
すなわち、アセトアミノフェンに代表される非特異体質性肝障害においては、反応性代謝物による細胞傷害と細胞ストレスが進行すると、クッパー細胞が細胞傷害性リンパ球を肝臓に動員し、これらの細胞からインターフェロンγが分泌されることによって種々なサイトカインの産生が刺激されることが、肝障害発現に重要な鍵となると考えられている。よって、アセトアミノフェン以外の薬物であっても、ヒトをはじめとする哺乳動物に投与すると、反応性代謝物による細胞傷害と細胞ストレスが進行し、クッパー細胞が細胞傷害性リンパ球を肝臓に動員し、これらの細胞からインターフェロンγが分泌されることによって種々サイトカインの産生が刺激される結果、用量依存的に肝障害発現するものは、非特異体質性の薬物誘導性肝障害(用量依存性の薬物誘導性肝障害)の原因候補化合物に含まれるものとする。
【0041】
このような非特異体質性の薬物誘導性肝障害(用量依存性の薬物誘導性肝障害)の原因候補化合物としては、アセトアミノフェン以外にも、メトトレキサート、テトラサイクリンなどが挙げられる。
【0042】
<RNA干渉>
RNA干渉(RNAi)は、細胞に導入された2本鎖RNAが、それと同じ配列を持つ遺伝子の発現を抑制する現象のことである。この方法は、標的遺伝子(mRNA)の発現を抑制(ノックダウン)するため、遺伝子の機能解析に有効な方法として近年急速に注目されている。哺乳動物細胞では、30bp以上の長い2本鎖RNAが導入されると抗ウイルス応答により非特異的抑制を引き起こし、アポトーシスを誘発しやすいが、短いRNAでは単一のmRNAまたはタンパク質の発現のみが特異的に抑制される。
【0043】
特異的発現抑制を制御する最も有効なRNA長は21merで、3’末端に2塩基がオーバーハングしたdsRNAであるとされている。このような20mer前後の短い2本鎖のRNAはsmall interfering RNA(siRNA)と呼ばれている。また、ヘアピン構造に折り畳んだ小さなRNA(short hairpin RNA(shRNA))もsiRNAと同様に遺伝子の発現を抑制することが知られている。
【0044】
siRNAを発現ベクターで発現する場合は、例えば、ベクター内に、siRNA配列をinverted repeat配列としてもつDNA断片を組み込む。ベクターから発現したinverted repeatをもつ一本鎖RNAは、細胞内で相補配列が水素結合を行い、ヘアピン構造を作り、shRNAと呼ばれる。shRNAは、細胞内でループ構造部分が切断され、2本鎖のsiRNAとなり、RNAi効果をもたらす。
【0045】
なお、一般に、siRNAと比較し、shRNAは安定した発現が可能であり、アデノウイルスへの組み込みも容易である。また、ラット個体および肝臓細胞といった遺伝子導入効率の低い標的に対しても、アデノウイルスを使うことである程度の高効率での遺伝子発現が可能である。これらの特徴から、一過性のRNA干渉を行う際には、shRNA アデノウイルスによる遺伝子のノックダウンを用いることが好ましい。もっとも、このことは、特に本願発明の範囲から他のRNA干渉法を除去する趣旨ではなく、shRNA アデノウイルスを用いることが好ましいことを述べるに過ぎないものである。
【0046】
ラットおよびマウスの肝臓組織におけるSOD2酵素活性をノックダウンするには、当然のことながら、肝臓組織におけるSOD2タンパク質の発現量をノックダウンすればよく、そのためには肝臓組織におけるSOD2mRNAの発現量をノックダウンすればよい。
【0047】
この場合、ラットのSOD2酵素活性をノックダウンするためのshRNA配列としては、下記の配列番号1および配列番号2を含む配列を用いることが好ましい。下記の配列番号1および配列番号2を含む塩基配列からなるこれらの配列を含むshRNAを用いることにより、ラットのSOD2酵素の発現を好適に抑制することができ、ヒトにおけるアセトアミノフェンなどの薬物による用量依存性の薬物誘導性肝障害を再現するために活用できるモデルラットが得られることが後述する実施例の実験データで確認されているからである。
【0048】
配列番号1:CCACATATGTGTAAGCATA
配列番号2:TATGCTTACACATATGTGG
なお、配列番号1および配列番号2は互いに相補的な配列である。また、配列の左側が5’末端であり、右側が3’末端である。
【0049】
より具体的には、SOD2酵素をノックダウンするためのshRNA配列としては、下記の配列番号3を含む配列を用いることが好ましい。この配列を含むshRNAを用いることにより、ラットのSOD2酵素の発現を好適に抑制することができ、ヒトにおけるアセトアミノフェンなどの薬物による用量依存性の薬物誘導性肝障害の予測に役立てることのできるモデルラットが得られることが後述する実施例の実験データで確認されているからである。
【0050】
配列番号3:CCACATATGTGTAAGCATAgaagcttgTATGCTTACACATATGTGG
なお、配列番号3は、配列番号1および配列番号2がループ配列によって連結された配列である。また、配列の左側が5’末端であり、右側が3’末端である。また、小文字で示した塩基配列がループ配列部分である。
【0051】
なお、この配列からなるshRNAは、shRNAアデノウイルスとして静脈内注射により投与することが好ましい。この場合、shRNAアデノウイルスの投与ウイルス量は、後述の実験データに示すように、2.5×1010PFU以上であることが好ましく、より好ましくは5.0×1010PFU以上であり、さらに好ましくは10×1010PFU以上であり、特に20×1010(2×1011)PFUであればSOD2酵素のノックダウン効率も高く肝臓機能にも悪影響がでない量であるので好適である。これらの投与ウイルス量以上であれば、ラットの細胞内におけるSOD2酵素の発現をRNA干渉法により好適にノックダウンさせることができることが図8に示すように実験的に確認されているからである。
【0052】
<作用効果>
以下、本実施形態の作用効果について説明する。
本実施形態のshRNAまたはsiRNAは、上記の特定の塩基配列からなるshRNAまたはsiRNAであるため、これらのshRNAまたはsiRNAのいずれかをラットの細胞内で発現させることにより、後述する実施例の実験データで示すように、ラットの細胞内におけるSOD2酵素の発現をRNA干渉法によりノックダウンさせることができる。
【0053】
そして、本実施形態の遺伝子ノックダウン非ヒト哺乳動物では、肝臓組織におけるSOD2mRNAの発現量がノックダウンされているため、同一種の野生型の非ヒト哺乳動物に対して、肝臓組織におけるSOD2タンパク質の発現量が有意に低くなる。したがって、同一種の野生型の非ヒト哺乳動物に対して、肝臓組織におけるSOD2酵素活性が有意に低くなり、薬物の活性代謝物のSOD2酵素による解毒作用を抑制することができる。
【0054】
ここで、本実施形態の遺伝子ノックダウン非ヒト哺乳動物では、アデノウイルスベクターを用いてshRNAまたはsiRNAのいずれかをラットの細胞内で発現させることにより、後述する実施例の実験データで示すように、ラットの細胞内におけるSOD2酵素の発現をRNA干渉法によりノックダウンさせている。そして、医学・薬学・生化学などの技術分野においては、アデノウイルスベクターは肝臓特異的に感染・発現することは技術常識である。そのため、SOD2ヘテロノックアウトマウスの場合にはないメリットとして、本実施形態のSOD2酵素の発現をノックダウンさせたラットの場合には、肝臓のみでSOD2酵素の発現が減少しているため、全身でSOD2酵素の発現が減少しているSOD2ヘテロノックアウトマウスよりも、薬物誘導性肝障害を予測するモデル動物として優れている。
【0055】
その結果、本実施形態の遺伝子ノックダウン非ヒト哺乳動物によれば、後述する実施例の実験データで示すように、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物によるヒトにおける毒性発現のメカニズムの解明が可能となるので、ヒトにおける毒性発現予測に役立てることができる。特に、この遺伝子ノックダウン非ヒト哺乳動物によれば、アセトアミノフェンなどのヒトにおける用量依存性の薬物誘導性肝障害の原因候補化合物についての薬物動態の試験のモデル動物として好適に用いることができる。
【0056】
そして、本実施形態の薬物動態の試験方法によれば、上記のいずれかの遺伝子ノックダウン非ヒト哺乳動物、その肝臓組織またはその肝臓細胞(例えば、後述の実施例で示すSOD2酵素の発現をノックダウンしたBRL3A細胞)を用いるため、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となり、その薬物の活性代謝物によるヒトにおける毒性発現予測が可能となる。特に、この試験方法によれば、アセトアミノフェンなどのヒトにおける用量依存性の薬物誘導性肝障害の原因候補化合物についての薬物動態の試験を好適に行うことができる。
【0057】
以上、本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【0058】
例えば、上記実施の形態では配列番号1および配列番号2を含む配列(すなわち配列番号3)からなるshRNAを用いたが、特に限定する趣旨ではなく、他の配列からなるshRNAまたはsiRNAを用いてもよい。
【0059】
例えば、配列番号:1に記載される塩基配列に対して1以上の塩基を欠失、置換、付加してなる第1の塩基配列と、配列番号:2に記載される塩基配列に対して1以上の塩基を欠失、置換、付加してなる第2の塩基配列と、を含む配列(すなわち、配列番号3に記載される塩基配列に対して1以上の塩基を欠失、置換、付加してなる第3の塩基配列)からなるshRNAまたはsiRNAを用いてもよい。なぜなら、一般的には、RNA干渉作用を示す塩基配列のうち1以上の塩基を欠失、置換、付加しても、同様のRNA干渉作用を示すためである。
【0060】
また、配列番号:1に記載される塩基配列に対して80%以上の相同性を有する第1の塩基配列と、配列番号:2に記載される塩基配列に対して80%以上の相同性を有する第2の塩基配列と、を含む配列(すなわち、配列番号3に記載される塩基配列に対してループ配列を除くステム配列部分で80%以上の相同性を有する第3の塩基配列)からなるshRNAまたはsiRNAを用いてもよい。なぜなら、一般的には、RNA干渉作用を示す塩基配列に対して80%以上の相同性を有する塩基配列を用いても、同様のRNA干渉作用を示すためである。
【0061】
また、配列番号:1に記載される塩基配列に対して相補的な塩基配列と特異的に結合する第1の塩基配列と、配列番号:2に記載される塩基配列に対して相補的な塩基配列と特異的に結合する第2の塩基配列と、を含む配列(すなわち、配列番号3に記載される塩基配列に対して相補的な塩基配列と特異的に結合する第3の塩基配列)からなるshRNAまたはsiRNAを用いてもよい。なぜなら、一般的には、RNA干渉作用を示す塩基配列に対して相補的な塩基配列と特異的に結合する塩基配列を用いても、同様のRNA干渉作用を示すためである。
【0062】
さらに、上記の塩基配列からなるshRNAまたはsiRNAにおいて、配列番号1の代わりに、下記の配列番号4〜7に置き換えた場合のshRNAまたはsiRNAを用いてもよい。
配列番号4:5’−CCCTAAGGGTGGTGGAGAA−3’
配列番号5:5’−GGAGAATGTTAGCCAAAGA−3’
配列番号6:5’−GGCCACAGTTTCATAGAAA−3’
配列番号7:5’−GGACTAGGCCACAGGGCAT−3’
これらの配列番号4〜7についても、ラットSOD2遺伝子をノックダウンするためのshRNAまたはsiRNAに含まれる塩基配列として、B−Bridge社製の信頼性の高い配列予測ソフトウェア(非公開)によって、配列番号1と同様に好適な配列としてリストアップされた配列であるため、当然ながら同様のRNA干渉作用を示すと推測されるためである。
【0063】
また、上記実施の形態では、薬物誘導性肝障害の原因候補化合物として、アセトアミノフェンをはじめとする非特異体質性の薬物誘導性肝障害(用量依存性の薬物誘導性肝障害)の原因候補化合物を中心に説明したが、上記のモデルラットが特異体質性の薬物誘導性肝障害(非用量依存性の薬物誘導性肝障害)の原因候補化合物の薬物動態の試験に用いることができないわけではない。当然のことではあるが、上記のモデルラットは、トログリタゾンをはじめとする特異体質性の薬物誘導性肝障害(非用量依存性の薬物誘導性肝障害)の原因候補化合物の薬物動態の試験にも好適に用いることができる。
【0064】
このような特異体質性の薬物誘導性肝障害(非用量依存性の薬物誘導性肝障害)の原因候補化合物としては、トログリタゾン以外にも、例えば、特に限定する趣旨ではないが、現時点で知られている限りでも、アカルボース、アミオダロン、イソニアジド、イトラコナゾール、経口避妊薬、ザフィルルカスト、ジクロフェナクナトリウム、ジスルフィラム、タモキシフェン、蛋白同化ステロイド、ダントロレンナトリウム、テガフール・ウラシル、塩酸テルビナフィン、バルプロ酸ナトリウム、塩酸ヒドララジン、フルコナゾール、フルタミド、ペモリン、塩酸ラベタロールなどが挙げられる。
【0065】
また、上記実施の形態で、薬物誘導性肝障害のモデル動物としてラットを用いたが、特に限定する趣旨ではなく、他の非ヒト哺乳動物であっても好適に使用可能である。例えば、非ヒト哺乳動物の種類がマウスであれば、マウスのSOD2酵素の塩基配列に対応した配列からなるshRNAまたはsiRNAを用いてもよい。このようにすれば、マウスのSOD2酵素の発現を好適に抑制でき、ヒトにおける毒性発現予測に役立てることのできるモデルマウスが得られるからである。
【実施例】
【0066】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0067】
<実験材料>
F−344系ラット(雄性、7週齢)は日本SLC(Shizuoka,Japan)より購入した。Adenovirus Expression Vector Kit(Dual Version)はタカラバイオ株式会社(Otsu,Japan)より購入した。GeneSilencer shRNA Vector KitsはGene Therapy Systems(San Diego,U.S.)より購入した。Cell Counting Kit−8(CCK−8)は和光純薬工業(Osaka,Japan)より購入した。トログリタゾンおよびロシグリタゾンは第一三共株式会社(Tokyo,Japan)より御供与頂いた。その他の試薬は和光純薬工業等の特級またはHPLC用のものを用いた。
【0068】
<実験方法1>
SOD2 shRNA発現アデノウイルスの作成
B−Bridge International Inc.(California,U.S.)に依頼し、ラットSOD2 mRNAの配列からsiRNA配列(下記参照)を選択し、in vitroにおいてノックダウン効果を確認した後、その配列を用いて二本鎖オリゴDNAを作成し、pU6プロモーターを持つpGSU6−GFPベクターに組み込んだ。制限酵素Hinc IIで目的配列およびpU6プロモーターを切り出し、pAxcwitコスミドベクターに組み込んだ。以後のアデノウイルス作成はAdenovirus Expression Vector Kit(Dual Version)を用い、マニュアルに従って図3に示すように行った。
【0069】
Rat SOD2 mRNAに対するsiRNAの認識配列(実際に実験で使用したもの)
配列番号1:5’−CCACATATGTGTAAGCATA−3’
配列番号2:5’−TATGCTTACACATATGTGG−3’
なお、配列番号1および配列番号2は互いに相補的な配列である。
【0070】
Rat SOD2 mRNAに対するsiRNAの認識配列(B−Bridgeより得た上記以外の配列)
配列番号4:5’−CCCTAAGGGTGGTGGAGAA−3’
配列番号5:5’−GGAGAATGTTAGCCAAAGA−3’
配列番号6:5’−GGCCACAGTTTCATAGAAA−3’
配列番号7:5’−GGACTAGGCCACAGGGCAT−3’
【0071】
アデノウイルスベクターに組み込んだshRNAの配列
Top strand(配列番号8):5’−gatccCCACATATGTGTAAGCATAgaagcttgTATGCTTACACATATGTGGttttttggaagc−3’
Bottom strand(配列番号9):5’−ggccgcttccaaaaaaCCACATATGTGTAAGCATAcaagcttcTATGCTTACACATATGTGGg−3’
【0072】
なお、上記のTop strandと Bottom strandをアニールさせることで2本鎖のshRNAを作製してアデノウイルスベクターに組み込める。すなわち、合成した個々の1本鎖からアニールして、2本鎖を作成してアデノウイルスベクターに組み込める。
【0073】
<実験方法2>
SOD2 shRNA発現アデノウイルスの細胞への感染
細胞はラット肝由来細胞のBRL3A細胞、ラット肝癌由来のH4IIE細胞、マウス肝癌由来細胞のHepa1−6細胞、ヒト肝癌由来細胞HLE細胞を用いた。細胞を6wellまたは12wellプレートにまき、70〜100%コンフルエントまで培養した。培地を除き、SOD2 shRNA発現アデノウイルスをMOI 100で1時間感染させた。対照としてLuc(ルシフェラーゼ)shRNA発現アデノウイルスを同様に感染させた。1時間感染操作を行った後に培地を添加し、その3日後におけるmRNAの発現をreal−time RT PCRにて測定した(primerの配列に関しては下記表1を参照)。
【0074】
【表1】

【0075】
<実験方法3>
テストステロン6β水酸化酵素活性の測定
YamazakiとShimadaの方法に従い測定した(Arch Biochem Biophys 346:161−169:1997)。実験操作は以下に従って行った。BRL3A細胞にAdSOD2−shRNAウイルス液をMOI 100で、AdCYP3A4ウイルス液をMOI 0、5、10、20、50および100で感染させた。感染72時間後に培養液をアスピレーターで吸引し、100μMテストステロンを含む培地1mLを加えた。1時間後に培地を採取して生成した代謝物である6β水酸化テストステロンを以下の方法により測定した。採取した培地500μLにジクロロメタン4mL、精製水500μL、内部標準物質として100μMのコルチコステロン20μLを加えて激しく撹拌した。3,000rpm(700g)で10分間遠心分離後、ジクロロメタン層を別の試験管に移し、窒素気流下乾固させた。すべての溶液を乾固させた後、試験管に200μLの45%メタノールを加え、1分間ボルテックスミキサーで激しく撹拌し、2,000rpm(500g)で5分間遠心分離し、40μLをHPLCに注入して分析した。HPLCによる分析には、ポンプ(日立L−2130)、オートサンプラー(日立L−2200)、カラムオーブン(日立分光CO−965)、UV検出器(日立L−2400)を用いて、溶離液を240nmでモニターした。カラムはMightsil RP−18 GP−150−4−6 5μM(関東化学)を用いた。移動相は50%MeOH/10mMリン酸カリウム緩衝液(pH7.4)を使用し、流速は1.0mL/min、カラム温度は35°Cとした。
【0076】
<実験方法4>
SOD2 shRNA発現アデノウイルス感染細胞への薬物処置後CCK(MTT assay)による細胞生存率の検討
BRL3A細胞を96 wellプレートにまき、コンフルエントとした後、SOD2 shRNA発現アデノウイルスを1時間感染させた。72時間後に肝障害性化合物であるトログリタゾンおよびダプソンを、ネガティブコントロールとしてロシグリタゾンを処置し、24時間後に各wellに試薬10μLを加え、1hr培養した。その後、GE Healthcare Amersham Bioscience (Tokyo,Japan)のプレートリーダーで吸光度を測定した。
【0077】
<実験方法5>
スーパーオキシドの測定
Carterらの方法に準じて測定を行った(J Leukoc Biol 55:253−258:1994)。すなわち、BRL3A細胞にAdSOD2−shRNAまたはAdLuc shRNAウイルス液をMOI 100で、またAdCYP3A4ウイルス液をMOI 50で感染させた。48時間後に培養液をアスピレーターで吸引し、薬物含む培地100μLを加えた。処置後24時間後にジヒドロエチジウムが10μMになるよう加え、30分間インキュベートし、1×PBSでwashし、トリプシンで細胞をはがし懸濁させた液をexcitation 352nm、 emission 590 nmで測定した。
【0078】
<実験方法6>
活性酸素種の測定
Posselらの方法に準じて測定を行った(FEBS Lett 416:175−178:1997)。すなわち、BRL3A細胞にAdSOD2−shRNAまたはAdLuc shRNAウイルス液をMOI 100で、またAdCYP3A4ウイルス液をMOI 50で感染させた。48時間後に培養液をアスピレーターで吸引し、薬物を含む培地100μLを加えた。処置後24時間後にジクロロフルオレセインジアセテートが30μMになるよう加え、2時間インキュベートし、1×PBSで2回washし、1×PBSを200μL加え、1時間インキュベートしたあとexcitation 485 nm、emission 538nmで測定した。
【0079】
<実験方法7>
ASTおよびALT値の測定
ラットの末梢血を尾静脈または下行大静脈より採取した。1時間室温で放置し、7,000rpm(3,000g)、4°Cで15分間遠心分離した後、血清約50μLをサンプルチューブに採取した。ASTおよびALT値をトランスアミナーゼCII−テストワコーキットを用い、マニュアルに従って以下の方法で定量した。血清10μLにASTまたはALT用基質酵素液を250μL加えた後よく混合し、37°Cで5分間インキュベートした後、発色試液を加えよく混合し、37°Cで正確に20分間加温した。20分後に反応停止液を加えて反応を停止させ、よく混合後、555nmでの吸光度を測定し、ASTおよびALT活性を測定した。
【0080】
<実施例1>
SOD2 shRNA発現アデノウイルスによるノックダウン効率の確認
ラット、マウスおよびヒト肝由来細胞を用い、real−time RT PCRで各々の動物種におけるSOD2 mRNAを定量した。その結果、ラット肝由来細胞であるBRL3Aにおいては対照群と比べて60%以上の有意な減少を示した。なおラット肝癌由来細胞H4IIE細胞、マウス肝癌由来細胞Hepa1−6細胞、およびヒト肝癌由来細胞HLE細胞においては、対照群と比べ有意な差ではなかった(図4)。
【0081】
<実施例2>
テストステロン6β水酸化酵素活性の測定
薬物誘導性肝障害は主としてCYPなどにより代謝的活性化を受けることで起こることが知られている。また、臨床で使用されている薬物の半数以上がCYP3A4で代謝されることが知られている。しかしながらBRL3A細胞にはCYPがほとんど発現していなく、そのため、CYP3A4を発現させることとし、本研究室に既存のCYP3A4発現アデノウイルス(AdCYP3A4)との同時感染の至適条件を検討した。図5ではAdCYP3A4単独感染、およびAdCYP3A4・AdSOD2−shRNA同時感染におけるテストステロン6β水酸化酵素活性を示した。AdCYP3A4のMOI依存的に活性値は上昇した。MOI 50でほぼプラトーに達した。これより、今後の薬物処置における細胞障害性の実験はAdSOD2−shRNA MOI 100、AdCYP3A4 MOI 50で行うことにした。
【0082】
<実施例3>
SOD2 shRNA発現アデノウイルスの細胞への薬物障害性の影響
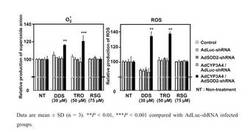
AdSOD2−shRNAをBRL3A細胞に感染させ、3日後に肝障害化合物であるダプソン10、20、30 μMおよびトログリタゾン25、50、75μMを24時間処置したところ、対照群と比べて細胞障害性への影響に有意な差が認められた(図6)。また、ダプソン30μM、トログリタゾン50μMを24時間処置したところ、対照群と比べてスーパーオキシドおよび活性酸素種の有意な上昇が認められた(図7)。なお、図7のROSは、Reactive Oxygen Speciesの略称である。
【0083】
<実施例4>
ウイルス投与量および時間依存的なラット肝SOD2 mRNA、SOD2タンパク量およびSOD2酵素活性の変動
アデノウイルスは主に肝組織に感染することが知られている。そこで、AdSOD2−shRNAをラット尾静脈より投与し、ラット肝臓中のSOD2 mRNA、SOD2タンパク質およびSOD2酵素活性の変化を検討した。SOD2 mRNAにおいては5×1010(pfu/body)投与群ではPBS投与群と比べて最大約35%の減少が認められ、2×1011(pfu/body)投与群では最大約70%の減少が認められた。SOD2タンパク質においては5×1010(pfu/body)投与群では最大約33%の減少が認められ、2×1011(pfu/body)投与群では最大約65%の減少が認められた。SOD2酵素活性においては5×1010(pfu/body)投与群では最大約35%の減少が認められ、2×1011(pfu/body)投与群では最大約60%の減少が認められた。また、5×1010(pfu/body)投与群および2×1011(pfu/body)投与群ともに投与後7日目にSOD2酵素活性値が最も減少した(図8)。
【0084】
<実施例5>
SOD2ノックダウンラットにおけるAPAPによる肝障害の検討
SOD2酵素活性値が最も低下した条件は2×1011(pfu/body)投与後7日目であったことから(図8)、APAPの投与はAdSOD2−shRNAの2×1011(pfu/body)感染後7日目に行うことにした。AdLuc−shRNA投与群において、1,000mg/kgのAPAP投与によるAST値およびALT値の上昇は認められなかった。しかし、AdSOD2−shRNA投与群においては1,000mg/kgのAPAP投与によりAST値およびALT値の有意な増加が認められた(図9)。
【0085】
一方、300mg/kgのAPAP投与ではいずれの群においても有意なAST値・ALT値の増加は認められなかった。AdSOD2−shRNA投与ラットにおけるAPAP投与による肝障害性への影響を検討するため、HE染色による肝組織像の検討を行った(図10)。その結果、AdSOD2−shRNA投与を行ったラットにおいてのみ、APAP1,000mg/kg投与によって中心静脈周辺に肝細胞の壊死が認められた。これは薬物誘導性肝障害の一般的な所見である。AdLuc−shRNA投与を行ったラットにおいて、肝細胞壊死は全く認められなかった。
【0086】
<考察>
本研究では、in vitroおよびin vivoにおいて、SOD2 shRNA発現アデノウイルスを感染することで、解毒的な代謝能を低下させ、肝障害性化合物による障害を増強できる系の構築について検討した。
【0087】
様々な動物種由来肝細胞を用いた検討では、ラット肝由来のBRL3A細胞において約60%のSOD2 mRNAの減少が認められた(図4)が、ラット肝癌由来細胞であるH4IIE細胞ではSOD2 mRNAの有意な減少は認められなかった。H4IIE細胞にMOI 100でAdSOD2−shRNAを感染させると細胞変性が認められたため、ノックダウンの影響が明確に見られなかった。また、マウスおよびヒト肝癌由来細胞ではSOD2 mRNAの有意な減少は認められなかった。これはshRNAが認識するSOD2 mRNAに対する塩基配列の相同性が関与していると考えられる。本研究において、標的としたラットSOD2遺伝子に対しては100%の相同性を持つようにshRNAを設計した。この配列における相同性は、マウスSOD2遺伝子に対しては63%、ヒトSOD2遺伝子に対しては58%であった。本実験によりラット肝由来細胞であるBRL3AでSOD2 mRNAの有意な減少が認められた。
【0088】
AdCYP3A4とAdSOD2−shRNA同時感染させたBRL3A細胞で細胞生存率の検討(図6)および、活性酸素種とスーパーオキシドアニオンの生成量への影響について検討を行った(図7)。ダプソン、トログリタゾンにおいて細胞生存率が対照群のAdLuc−shRNA感染群に比べて有意に減少し、活性酸素種およびスーパーオキシドアニオンの生成量の有意な増加が認められた。ネガティブコントロールとして用いたロシグリタゾンにおいては対照群のAdLuc−shRNA感染群との細胞生存率、活性酸素種およびスーパーオキシドアニオン生成量への有意な差は認められなかった。トログリタゾンはCYP3A4によりキノン体を、ダプソンはN−水酸化体を生じることが報告されている。一般にキノン体・N−水酸化体は活性酸素を産生することが知られている。以上、本研究において、SOD2とCYP3A4が関与する薬物の細胞障害性のスクリーニングに使用できる高感度なin vitroの検出系を構築することができた。
【0089】
ラットin vivoにおいてアデノウイルスを用い、SOD2遺伝子のノックダウンについて検討した。本研究においては主に肝組織に感染するアデノウイルスベクターを用いて行い、SOD2ノックダウンの影響が最も見やすい条件を検討した。5×1010pfu/body投与群ではSOD2 mRNAが投与後5日目で最も減少し、SOD2タンパク質およびSOD2酵素活性値においては投与後7日目で最大の減少(活性値の約35%減少)が認められた。2×1011pfu/body投与群においてはSOD2 mRNA、SOD2タンパク質およびSOD2酵素活性値いずれにおいても投与後7日目において最大の減少(活性値の約60%減少)が認められた(図8)。また、2×1011pfu/body投与のいずれのラットにおいてもAST値およびALT値の上昇は認められなかったため(data not shown)、投与量は2×1011pfu/bodyが適当であると考えられる。こうした予備検討の結果、単回肝障害性試験の検討はAdSOD2−shRNA投与後7日目に行うこととした。
【0090】
薬物誘導性肝障害を引き起こす薬物としてAPAPの単回投与肝障害性試験を行うこととし、AdSOD2−shRNAのネガティブコントロールとしてはAdLuc−shRNAの投与を行った。AdLuc−shRNAを感染させたラットにおいてはAPAP投与によるAST値およびALT値の有意な上昇は認められなかったが、AdSOD2−shRNAを投与したラットにおいてAPAP投与によるAST値およびALT値の有意な上昇が認められた(図9)。また、ラット肝の組織像においてもAdLuc−shRNA投与ラットにおいてはAPAP投与による肝細胞の変性・脱落は認められなかったが、AdSOD2−shRNA投与ラットにおいてはAPAP投与による肝細胞壊死が認められた(図10)。以上、これまでの検討において、本検出系はラットin vivoにおいても適用可能であることを示すことができた。
【0091】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることは当業者に理解されるところである。
【0092】
たとえば、上記実施例では、遺伝子ノックダウン非ヒト哺乳動物としてF−344系ラットを用いたが、特に限定する趣旨ではなく、Wister系をはじめとする他の系統のラットを用いてもよい。さらに、薬物動態および毒性の前臨床試験において、ラットが第一選択肢として多用されるため、実施例はラットで示したが、上記の遺伝子ノックダウン非ヒト哺乳動物は、ラットに限られず、ラットと同様の齧歯類であるマウスであってもよい。そして、上記の遺伝子ノックダウン非ヒト哺乳動物は、齧歯類に限られず、例えば、イヌ、ネコ、ブタ、ウシ、ヤギなどのヒト以外のほ乳類であればよい。もっとも、これらの場合には、適宜SOD2 shRNAの設計を変更することが好ましいことは言うまでもない。
【図面の簡単な説明】
【0093】
【図1】Superoxide dismutase(SOD)について説明するための概念図である。
【図2】本研究の目的について説明するための概念図である。
【図3】本研究で作成したSOD2 shRNA発現アデノウイルスの作成方法について説明するための概念図である。
【図4】SOD2 shRNA発現アデノウイルスによるSOD2 mRNAのノックダウン効率の肝細胞株による違いを確認した結果を示すグラフである。
【図5】AdCYP3A4単独感染、およびAdCYP3A4・AdSOD2−shRNA同時感染におけるテストステロン6β水酸化酵素活性を示したグラフである。
【図6】AdSOD2−shRNAをBRL3A細胞に感染させ、3日後に肝障害化合物であるダプソン10、20、30 μMおよびトログリタゾン25、50、75μMを24時間処置した場合のMTTアッセイの結果を示したグラフである。
【図7】ダプソン30μM、トログリタゾン50μMを24時間処置した場合の対照群と比べたスーパーオキシドおよび活性酸素種の変化を示したグラフである。
【図8】F344系統のラットにおけるウイルス投与量および時間依存的なラット肝SOD2 mRNA、SOD2タンパク量およびSOD2酵素活性の変動を示したグラフである。
【図9】F344系統のラットにおけるSOD2ノックダウンした場合のAPAPによる肝障害の検討結果を示したグラフである。
【図10】F344系統のラットにおけるAdSOD2−shRNA投与による肝障害を示す顕微鏡写真である。
【技術分野】
【0001】
本発明は、遺伝子ノックダウン非ヒト哺乳動物、それを用いる薬物動態の試験方法、並びにそれを作成するためのshRNA、siRNAおよびアデノウイルスベクターに関する。
【背景技術】
【0002】
臨床で問題となる薬物による副作用の3分の1以上は、代謝反応に起因するものであると言われている。そのうちの90%以上がチトクロムP450による代謝反応が関与する。最近、代謝反応に起因する薬物相互作用に関心が高まり、医療用医薬品の添付文書も相互作用をチトクロムP450の分子種レベルで説明するように改訂されてきている。
【0003】
さらに、1997年米国FDAの「Guideline for Drug Metabolism and Drug Interactions」でも示されたように、薬の開発から臨床での適切な使用に至るまで、代謝反応が関わる薬物相互作用に充分注意をする必要があると言われるようになってきた。特に、すでに臨床で使用されている薬に見いだされている様々な薬物相互作用について代謝レベルで主にin vitroで検討することにより、相互作用についてさらに理解を深めることが重要となってきた。
【0004】
実験動物やin vitroでの試験結果からヒトでの結果を予測することを「外挿」と言う。すなわち、実験動物で得られた代謝物が本当にヒトにも生成し得るものであるか等が問題となる。ラットやマウスの齧歯類よりも、ヒトに近いイヌやサルを用いた研究も盛んに行われているが、膨大な数の実験動物の使用を少しでも減らすためにも、適切にヒトへの外挿ができる実験手段の開発が望まれている。こうした観点から、ヒトの薬物代謝酵素の遺伝子を導入したあらたな試験系の開発が望まれている。
【0005】
ヒトの薬物代謝酵素の遺伝子を導入した公知の薬理学的および毒性学的研究のための非ヒトトランスジェニック動物としては、例えば、ヒトCYP450イソ型を発現するトランスジェニックマウス(特許文献1の実施例6)などが挙げられる。
【0006】
一方、薬物誘導性肝障害を惹起する原因の一つとして、酸化ストレスが知られており、酸化ストレスの引き金となるスーパーオキシドの90%以上がミトコンドリア中で産生される。Superoxide dismutase 2(SOD2)はミトコンドリア中に局在しており、スーパーオキシドの除去に重要な役割を果たしている。
【0007】
ここで、非特許文献1および非特許文献2には、SOD2へテロノックアウトマウスにおけるSOD2遺伝子の発現抑制が薬物誘導性肝障害を引き起こす原因となる旨が記載されている。すなわち、非特許文献1および非特許文献2には、マウスのSOD2ヘテロノックアウトによって薬物誘導性肝障害がおきる旨が記載されている。特に、非特許文献1には、SOD2へテロノックアウトマウスにトログリタゾンを投与すると、ミトコンドリアの酸化ストレスのバイオマーカー(ACO2)の減少や、タンパク質の酸化物(protein carbonyls)の増加が観察される旨が記載されている。
【0008】
なお、トログリタゾンによる薬物性肝障害については、例えば非特許文献3において代謝性特異体質性肝障害に分類されている。
【0009】
【特許文献1】特表2004−533826号公報
【非特許文献1】Lee YH, Chung MC, Lin Q, Boelsterli UA., “Troglitazone-induced hepatic mitochondrial proteome expression dynamics in heterozygous Sod2(+/-) mice: two-stage oxidative injury.”, Toxicol Appl Pharmacol. 2008 Aug 15; 231(1):43-51. Epub 2008 Apr 12.
【非特許文献2】Ong MM, Latchoumycandane C, Boelsterli UA., “Troglitazone-induced hepatic necrosis in an animal model of silent genetic mitochondrial abnormalities.”, Toxicol Sci. 2007 May; 97(1):205-13. Epub 2006 Dec 5.
【非特許文献3】池田敏彦著、「肝機能障害」日本薬理学雑誌 Vol.127 (2006), No.6 454-459
【発明の開示】
【発明が解決しようとする課題】
【0010】
しかしながら、特許文献1に記載されているヒトCYP450イソ型を発現するトランスジェニックマウスは、ヒトにおける薬物誘導性肝障害を予測するモデル動物としてはさらなる改善の余地がある。なぜなら、ラットおよびマウスの肝臓組織におけるグルタチオン合成能は、ヒトの肝臓組織におけるグルタチオン合成能よりも著しく高いため、活性代謝物をグルタチオン抱合して解毒する能力に優れるためである。
【0011】
特に、グルタチオン抱合の速度はラットよりマウスが4倍速いことが知られている(Liu J et al., “Characterization of the acetaminophen-glutathione conjugation reaction by liver microsomes: species difference in the effects of acetone.”, Toxicol Lett., 1991, May;56(3):269-274)ことから、ヒトCYP450イソ型を発現するトランスジェニックマウスでは、薬物誘導性肝障害が起こりにくく、ヒトにおける薬物誘導性肝障害を予測するモデル動物としては使用困難である。
【0012】
また、非特許文献1および非特許文献2に記載されているSOD2へテロノックアウトマウスでは、トログリタゾンを投与することによって薬物誘導性肝障害が引き起こされている。ここで、トログリタゾンによって引き起こされる薬物誘導性肝障害は、非特許文献3にもあるように、代謝性特異体質性の薬物誘導性肝障害(非用量依存性の薬物誘導性肝障害)に分類されており、アセトアミノフェンによって引き起こされる非特異体質性の薬物誘導性肝障害(用量依存性の薬物誘導性肝障害)とは作用機序が全く異なっている。そのため、非特許文献1および非特許文献2に記載されているSOD2へテロノックアウトマウスを、アセトアミノフェンによって引き起こされる非特異体質性の薬物誘導性肝障害のモデルマウスとして使用することは困難である。
【0013】
本発明は上記事情に鑑みてなされたものであり、アセトアミノフェンなどによって引き起こされるヒトにおける非特異体質性の薬物誘導性肝障害(用量依存性の薬物誘導性肝障害)を予測するモデル動物として活用できる、遺伝子ノックダウン非ヒト哺乳動物を提供することを目的とする。
【課題を解決するための手段】
【0014】
本発明によれば、SOD2遺伝子がノックダウンされている、遺伝子ノックダウン非ヒト哺乳動物が提供される。
【0015】
この遺伝子ノックダウン非ヒト哺乳動物によれば、SOD2遺伝子がノックダウンされているため、薬物の活性代謝物のSOD2酵素による解毒作用を抑制することができる。その結果、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となるので、ヒトにおける毒性発現予測に役立てることのできる遺伝子ノックダウン非ヒト哺乳動物が得られる。
【0016】
上記の遺伝子ノックダウン非ヒト哺乳動物は、別の視点から見れば、同一種の野生型の非ヒト哺乳動物に対して、肝臓組織におけるSOD2mRNAの発現量、SOD2タンパク質の発現量、またはSOD2酵素活性のいずれかが有意に低い、遺伝子ノックダウン非ヒト哺乳動物である。
【0017】
この遺伝子ノックダウン非ヒト哺乳動物によれば、同一種の野生型の非ヒト哺乳動物に対して、肝臓組織におけるSOD2mRNAの発現量、SOD2タンパク質の発現量、またはSOD2酵素活性のいずれかが有意に低いため、薬物の活性代謝物のSOD2酵素による解毒作用を抑制することができる。その結果、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となるので、ヒトにおける毒性発現予測に役立てることのできる遺伝子ノックダウン非ヒト哺乳動物が得られる。
【0018】
また、本発明によれば、上記のいずれかの遺伝子ノックダウン非ヒト哺乳動物、その肝臓組織またはその肝臓細胞を用いる、ヒトにおける用量依存性の薬物誘導性肝障害の原因候補化合物についての薬物動態の試験方法が提供される。
【0019】
この薬物動態の試験方法によれば、上記のいずれかの遺伝子ノックダウン非ヒト哺乳動物、その肝臓組織またはその肝臓細胞を用いるため、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となり、その薬物の活性代謝物によるヒトにおける毒性発現予測が可能となる。
【0020】
また、本発明によれば、後述する特定の塩基配列からなるshRNAまたはsiRNAが提供される。
【0021】
これらの特定の塩基配列からなるshRNAまたはsiRNAをラットの細胞内で発現させることにより、ラットの細胞内におけるSOD2酵素の発現をRNA干渉法によりノックダウンさせることができる。
【0022】
そして、このラットでは、SOD2酵素がノックダウンされているため、薬物の活性代謝物のSOD2酵素による解毒作用を抑制することができる。その結果、このラットでは、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となるので、ヒトにおける毒性発現予測に役立てることのできるモデルラットが得られる。
【0023】
また、本発明によれば、上記のshRNAまたはsiRNAのいずれかを発現可能なアデノウイルスベクターが提供される。
【0024】
このアデノウイルスベクターをラットに感染させ、上記のshRNAまたはsiRNAのいずれかを発現させることにより、SOD2酵素の発現をRNA干渉法によりノックダウンさせることができる。
【0025】
そして、このラットでは、SOD2酵素がノックダウンされているため、薬物の活性代謝物のSOD2酵素による解毒作用を抑制することができる。その結果、このラットでは、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となるので、ヒトにおける毒性発現予測に役立てることのできるモデルラットが得られる。
【発明の効果】
【0026】
本発明によれば、薬物の活性代謝物のSOD2酵素による解毒作用が抑制されるため、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となるので、ヒトにおける毒性発現予測に役立てることのできる遺伝子ノックダウン非ヒト哺乳動物が得られる。
【0027】
また、本発明によれば、上記の遺伝子ノックダウン非ヒト哺乳動物を用いることにより、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となるので、ヒトにおける毒性発現予測が可能となる。
【発明を実施するための最良の形態】
【0028】
以下、本発明の実施の形態について説明する。
【0029】
<本研究の経緯>
図1で説明するように、薬物誘導性肝障害を惹起する原因の一つとして、酸化ストレスが知られており、酸化ストレスの引き金となるスーパーオキシドの90%以上がミトコンドリア中で産生される。Superoxide dismutase 2(SOD2)は、ミトコンドリア中に局在しており、スーパーオキシドの除去に重要な役割を果たしている。本研究ではラットSOD2−short hairpin RNA(SOD2−shRNA)を発現するアデノウイルス(AdSOD2−shRNA)を構築することで、SOD2を減少させた細胞実験系およびラットにおけるモデル動物実験系を作製し、薬物誘導性のスーパーオキシドが関与する肝障害を高感度に予測する系を確立することを目的とした。in vitroではアデノウイルスを用いたshRNA発現法を用いてラット肝由来BRL3A細胞においてSOD2を減少させる検討を行い、被検薬物による細胞生存率への影響を検討した。in vivoでは、SOD2減少ラットを作製し、肝障害性を引き起こす典型的な化合物であるアセトアミノフェン(APAP)の肝障害性への影響を検討した。
【0030】
ここで、酵素活性を抑制する主な方法にノックアウトとノックダウンがあるが、ノックアウトでは、遺伝子を欠損させることにより、他の遺伝子の発現に及ぼす影響が無視できない場合がある。また、図2で説明するように、SOD2遺伝子を完全にノックアウトするとマウス胎児は致死性となるため、SOD2遺伝子のノックアウトマウスを得ることは不可能であり、非特許文献1および非特許文献2のようにSOD2へテロノックアウトマウスしか得ることができない。そこで、本発明者は、ラットのSOD2遺伝子をノックダウンする方法を採用した。なかでもスモールヘアピンRNAの発現ベクターをアデノウイルスの系で用いることを考えた。
【0031】
すなわち、図2で説明するように、本研究では、スーパーオキシドを除去する能力を持つSuperoxide dismutase 2(SOD2)酵素に注目し、この酵素の産生をアデノウイルスの系を用いてRNA干渉法によりノックダウンすることを検討した。これにより、in vitroおよびin vivoでSOD2酵素の発現を阻害し、SOD2酵素によるスーパーオキシド除去能を減少させた細胞実験系またはモデル動物実験系を作成し、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明および、ヒトにおける毒性発現予測に役立てることを目的として検討した。
【0032】
その結果、本発明者は、後述するように、SOD2酵素の産生をアデノウイルスの系を用いてRNA干渉法によりノックダウンすることにより、ラットの肝臓組織におけるSOD2酵素の含有量を実際に低減できることを見出した。そして、本発明者は、その結果、ラットの肝臓組織において実際にin vivoでアセトアミノフェン(APAP)の投与による用量依存性の肝障害が発症することを見出した。すなわち、本発明者は、この遺伝子ノックダウンラットが、ヒトにおける用量依存性の薬物誘導性肝障害の原因候補化合物についての薬物動態の研究に役立てることのできる遺伝子ノックダウン非ヒト哺乳動物であることを確認した。
【0033】
<SOD2>
本願において、Superoxide dismutase(SOD)とは、スーパーオキシドの除去に重要な役割を果たす酵素である。SODは、図1に示すように、スーパーオキシド陰イオン(・O2−)を過酸化水素と酸素分子とにする不均化反応を触媒する重要な抗酸化酵素の1つである。SODは、様々な疾患や老化を引き起こすといわれている活性酸素種に対し防御的に働く酵素の1つであり、構成する遷移金属や局在する場所によって様々な種類(例えば、SOD1(Cu/Zn SOD)、SOD2(Mn SOD)など)に分類される。これらの中でも、SOD2はミトコンドリア中に局在しており、スーパーオキシドの除去に重要な役割を果たしている。
【0034】
<活性酸素>
本願において、活性酸素とは、酸素が化学的に活性になった化学種を指す用語であり、一般に非常に不安定で強い酸化力を示す。活性酸素のうちスーパーオキシドアニオンラジカルおよび一重項酸素は、酸素原子のみでできており、その分子構造は普通の酸素分子とそれほど大きく違わないが電子配置が異なっている。一般に活性酸素とフリーラジカルとは混同されることが多いが、活性酸素にはフリーラジカルとそうでないものがある。スーパーオキシドアニオンラジカルやヒドロキシルラジカルはフリーラジカルである。過酸化水素や一重項酸素はフリーラジカルではない。広義の活性酸素には一酸化窒素、二酸化窒素、オゾン、過酸化脂質などを含む。
【0035】
活性酸素・フリーラジカルは生命を維持するために無くてはならないものであり、肺から取り込んだ酸素は赤血球中のヘモグロビンにより全身の細胞に運び込まれ、細胞中のミトコンドリアで酸素は糖質から電子を奪いスーパーオキシド→過酸化水素→ヒドロキシラジカルを経て水になる。つまりこの反応中に酸素は何度か活性酸素・フリーラジカルに変わることになる。この過程をミトコンドリア電子伝達系といい、食事で摂取した糖質がこれによってアデノシン三リン酸(ATP)というエネルギー物質に変わる。しかし全ての活性酸素・フリーラジカルが水になる訳ではなく、余った活性酸素・フリーラジカルは細胞に損傷を与える。それを防ぐために各組織には抗酸化酵素と呼ばれる、活性酸素・フリーラジカルを消去あるいは除去する酵素が存在する。その抗酸化酵素としてカタラーゼやスーパーオキシドディスムターゼ、ペルオキシダーゼなど、活性酸素を無害化する酵素がある。
【0036】
<トログリタゾン>
トログリタゾン(商品名 ノスカール(登録商標))は、三共株式会社が開発した糖尿病治療薬であり、日本では1997年3月から販売されている。また、海外ではこれまでに米国、英国などで承認されている。トログリタゾンの肝障害については治験段階では認められていなかったが、2000年に、米食品医薬品局(FDA)が、肝障害への副作用を理由に販売の中止を要請し、米国での販売元のワーナー・ランバート社(Warner−Lambert)がそれに応じたため、三共株式会社も日本での販売を中止している。トログリタゾンによって引き起こされる薬物誘導性肝障害のメカニズムは完全に解明されたわけではないが、非特許文献3に示すように、トログリタゾンによって引き起こされる薬物誘導性肝障害は、一般的には代謝性特異体質性の薬物誘導性肝障害(非用量依存性の薬物誘導性肝障害)に分類されている。
【0037】
<アセトアミノフェン>
化合物アセトアミノフェン(別名パラセタモール)は、解熱鎮痛薬の一つである。軽い発熱や、寒け、頭痛などの症状を抑える解熱剤、鎮痛剤として用いられる薬物の主要な成分の一つとなっている。一般に解熱剤は禁忌とされるインフルエンザの際にも解熱剤としてしばしば用いられるなど標準的な服用法では非常に安全な薬物であるが、その広い薬効のため、服用量が過剰となる事が少なくない。
【0038】
人体内に存在するシトクロムP450はアセトアミノフェンを酸化し、アセトアミドキノンを生成する。アセトアミドキノンは強い求電子試薬であり、グルタチオン(GSH)のチオール基や細胞内タンパク質と反応する。従ってアセトアミノフェンを多量に摂取すると肝臓毒性が現れる。ただし、治療レベルならこれは問題にならない。アセトアミノフェンによって引き起こされる薬物誘導性肝障害のメカニズムは、非特許文献3に示すように、一般的には非特異体質性の薬物誘導性肝障害(用量依存性の薬物誘導性肝障害)に分類されており、上記のトログリタゾンによって引き起こされる薬物誘導性肝障害のメカニズムとは大きく異なると考えられている。
【0039】
<非特異体質性の薬物誘導性肝障害>
薬物性肝障害には、非特許文献3に示されているように、(1)用量依存的で動物実験でも再現される非特異体質性肝障害と、(2)動物実験では再現できない特異体質性肝障害が知られている。ここで、本願で非特異体質性の薬物誘導性肝障害(用量依存性の薬物誘導性肝障害)とは、非特許文献3に示されている(1)用量依存的で動物実験でも再現される非特異体質性肝障害のことを意味するものとする。
【0040】
すなわち、アセトアミノフェンに代表される非特異体質性肝障害においては、反応性代謝物による細胞傷害と細胞ストレスが進行すると、クッパー細胞が細胞傷害性リンパ球を肝臓に動員し、これらの細胞からインターフェロンγが分泌されることによって種々なサイトカインの産生が刺激されることが、肝障害発現に重要な鍵となると考えられている。よって、アセトアミノフェン以外の薬物であっても、ヒトをはじめとする哺乳動物に投与すると、反応性代謝物による細胞傷害と細胞ストレスが進行し、クッパー細胞が細胞傷害性リンパ球を肝臓に動員し、これらの細胞からインターフェロンγが分泌されることによって種々サイトカインの産生が刺激される結果、用量依存的に肝障害発現するものは、非特異体質性の薬物誘導性肝障害(用量依存性の薬物誘導性肝障害)の原因候補化合物に含まれるものとする。
【0041】
このような非特異体質性の薬物誘導性肝障害(用量依存性の薬物誘導性肝障害)の原因候補化合物としては、アセトアミノフェン以外にも、メトトレキサート、テトラサイクリンなどが挙げられる。
【0042】
<RNA干渉>
RNA干渉(RNAi)は、細胞に導入された2本鎖RNAが、それと同じ配列を持つ遺伝子の発現を抑制する現象のことである。この方法は、標的遺伝子(mRNA)の発現を抑制(ノックダウン)するため、遺伝子の機能解析に有効な方法として近年急速に注目されている。哺乳動物細胞では、30bp以上の長い2本鎖RNAが導入されると抗ウイルス応答により非特異的抑制を引き起こし、アポトーシスを誘発しやすいが、短いRNAでは単一のmRNAまたはタンパク質の発現のみが特異的に抑制される。
【0043】
特異的発現抑制を制御する最も有効なRNA長は21merで、3’末端に2塩基がオーバーハングしたdsRNAであるとされている。このような20mer前後の短い2本鎖のRNAはsmall interfering RNA(siRNA)と呼ばれている。また、ヘアピン構造に折り畳んだ小さなRNA(short hairpin RNA(shRNA))もsiRNAと同様に遺伝子の発現を抑制することが知られている。
【0044】
siRNAを発現ベクターで発現する場合は、例えば、ベクター内に、siRNA配列をinverted repeat配列としてもつDNA断片を組み込む。ベクターから発現したinverted repeatをもつ一本鎖RNAは、細胞内で相補配列が水素結合を行い、ヘアピン構造を作り、shRNAと呼ばれる。shRNAは、細胞内でループ構造部分が切断され、2本鎖のsiRNAとなり、RNAi効果をもたらす。
【0045】
なお、一般に、siRNAと比較し、shRNAは安定した発現が可能であり、アデノウイルスへの組み込みも容易である。また、ラット個体および肝臓細胞といった遺伝子導入効率の低い標的に対しても、アデノウイルスを使うことである程度の高効率での遺伝子発現が可能である。これらの特徴から、一過性のRNA干渉を行う際には、shRNA アデノウイルスによる遺伝子のノックダウンを用いることが好ましい。もっとも、このことは、特に本願発明の範囲から他のRNA干渉法を除去する趣旨ではなく、shRNA アデノウイルスを用いることが好ましいことを述べるに過ぎないものである。
【0046】
ラットおよびマウスの肝臓組織におけるSOD2酵素活性をノックダウンするには、当然のことながら、肝臓組織におけるSOD2タンパク質の発現量をノックダウンすればよく、そのためには肝臓組織におけるSOD2mRNAの発現量をノックダウンすればよい。
【0047】
この場合、ラットのSOD2酵素活性をノックダウンするためのshRNA配列としては、下記の配列番号1および配列番号2を含む配列を用いることが好ましい。下記の配列番号1および配列番号2を含む塩基配列からなるこれらの配列を含むshRNAを用いることにより、ラットのSOD2酵素の発現を好適に抑制することができ、ヒトにおけるアセトアミノフェンなどの薬物による用量依存性の薬物誘導性肝障害を再現するために活用できるモデルラットが得られることが後述する実施例の実験データで確認されているからである。
【0048】
配列番号1:CCACATATGTGTAAGCATA
配列番号2:TATGCTTACACATATGTGG
なお、配列番号1および配列番号2は互いに相補的な配列である。また、配列の左側が5’末端であり、右側が3’末端である。
【0049】
より具体的には、SOD2酵素をノックダウンするためのshRNA配列としては、下記の配列番号3を含む配列を用いることが好ましい。この配列を含むshRNAを用いることにより、ラットのSOD2酵素の発現を好適に抑制することができ、ヒトにおけるアセトアミノフェンなどの薬物による用量依存性の薬物誘導性肝障害の予測に役立てることのできるモデルラットが得られることが後述する実施例の実験データで確認されているからである。
【0050】
配列番号3:CCACATATGTGTAAGCATAgaagcttgTATGCTTACACATATGTGG
なお、配列番号3は、配列番号1および配列番号2がループ配列によって連結された配列である。また、配列の左側が5’末端であり、右側が3’末端である。また、小文字で示した塩基配列がループ配列部分である。
【0051】
なお、この配列からなるshRNAは、shRNAアデノウイルスとして静脈内注射により投与することが好ましい。この場合、shRNAアデノウイルスの投与ウイルス量は、後述の実験データに示すように、2.5×1010PFU以上であることが好ましく、より好ましくは5.0×1010PFU以上であり、さらに好ましくは10×1010PFU以上であり、特に20×1010(2×1011)PFUであればSOD2酵素のノックダウン効率も高く肝臓機能にも悪影響がでない量であるので好適である。これらの投与ウイルス量以上であれば、ラットの細胞内におけるSOD2酵素の発現をRNA干渉法により好適にノックダウンさせることができることが図8に示すように実験的に確認されているからである。
【0052】
<作用効果>
以下、本実施形態の作用効果について説明する。
本実施形態のshRNAまたはsiRNAは、上記の特定の塩基配列からなるshRNAまたはsiRNAであるため、これらのshRNAまたはsiRNAのいずれかをラットの細胞内で発現させることにより、後述する実施例の実験データで示すように、ラットの細胞内におけるSOD2酵素の発現をRNA干渉法によりノックダウンさせることができる。
【0053】
そして、本実施形態の遺伝子ノックダウン非ヒト哺乳動物では、肝臓組織におけるSOD2mRNAの発現量がノックダウンされているため、同一種の野生型の非ヒト哺乳動物に対して、肝臓組織におけるSOD2タンパク質の発現量が有意に低くなる。したがって、同一種の野生型の非ヒト哺乳動物に対して、肝臓組織におけるSOD2酵素活性が有意に低くなり、薬物の活性代謝物のSOD2酵素による解毒作用を抑制することができる。
【0054】
ここで、本実施形態の遺伝子ノックダウン非ヒト哺乳動物では、アデノウイルスベクターを用いてshRNAまたはsiRNAのいずれかをラットの細胞内で発現させることにより、後述する実施例の実験データで示すように、ラットの細胞内におけるSOD2酵素の発現をRNA干渉法によりノックダウンさせている。そして、医学・薬学・生化学などの技術分野においては、アデノウイルスベクターは肝臓特異的に感染・発現することは技術常識である。そのため、SOD2ヘテロノックアウトマウスの場合にはないメリットとして、本実施形態のSOD2酵素の発現をノックダウンさせたラットの場合には、肝臓のみでSOD2酵素の発現が減少しているため、全身でSOD2酵素の発現が減少しているSOD2ヘテロノックアウトマウスよりも、薬物誘導性肝障害を予測するモデル動物として優れている。
【0055】
その結果、本実施形態の遺伝子ノックダウン非ヒト哺乳動物によれば、後述する実施例の実験データで示すように、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物によるヒトにおける毒性発現のメカニズムの解明が可能となるので、ヒトにおける毒性発現予測に役立てることができる。特に、この遺伝子ノックダウン非ヒト哺乳動物によれば、アセトアミノフェンなどのヒトにおける用量依存性の薬物誘導性肝障害の原因候補化合物についての薬物動態の試験のモデル動物として好適に用いることができる。
【0056】
そして、本実施形態の薬物動態の試験方法によれば、上記のいずれかの遺伝子ノックダウン非ヒト哺乳動物、その肝臓組織またはその肝臓細胞(例えば、後述の実施例で示すSOD2酵素の発現をノックダウンしたBRL3A細胞)を用いるため、通常であれば活性代謝物がSOD2酵素により解毒されてしまう薬物による毒性発現のメカニズムの解明が可能となり、その薬物の活性代謝物によるヒトにおける毒性発現予測が可能となる。特に、この試験方法によれば、アセトアミノフェンなどのヒトにおける用量依存性の薬物誘導性肝障害の原因候補化合物についての薬物動態の試験を好適に行うことができる。
【0057】
以上、本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【0058】
例えば、上記実施の形態では配列番号1および配列番号2を含む配列(すなわち配列番号3)からなるshRNAを用いたが、特に限定する趣旨ではなく、他の配列からなるshRNAまたはsiRNAを用いてもよい。
【0059】
例えば、配列番号:1に記載される塩基配列に対して1以上の塩基を欠失、置換、付加してなる第1の塩基配列と、配列番号:2に記載される塩基配列に対して1以上の塩基を欠失、置換、付加してなる第2の塩基配列と、を含む配列(すなわち、配列番号3に記載される塩基配列に対して1以上の塩基を欠失、置換、付加してなる第3の塩基配列)からなるshRNAまたはsiRNAを用いてもよい。なぜなら、一般的には、RNA干渉作用を示す塩基配列のうち1以上の塩基を欠失、置換、付加しても、同様のRNA干渉作用を示すためである。
【0060】
また、配列番号:1に記載される塩基配列に対して80%以上の相同性を有する第1の塩基配列と、配列番号:2に記載される塩基配列に対して80%以上の相同性を有する第2の塩基配列と、を含む配列(すなわち、配列番号3に記載される塩基配列に対してループ配列を除くステム配列部分で80%以上の相同性を有する第3の塩基配列)からなるshRNAまたはsiRNAを用いてもよい。なぜなら、一般的には、RNA干渉作用を示す塩基配列に対して80%以上の相同性を有する塩基配列を用いても、同様のRNA干渉作用を示すためである。
【0061】
また、配列番号:1に記載される塩基配列に対して相補的な塩基配列と特異的に結合する第1の塩基配列と、配列番号:2に記載される塩基配列に対して相補的な塩基配列と特異的に結合する第2の塩基配列と、を含む配列(すなわち、配列番号3に記載される塩基配列に対して相補的な塩基配列と特異的に結合する第3の塩基配列)からなるshRNAまたはsiRNAを用いてもよい。なぜなら、一般的には、RNA干渉作用を示す塩基配列に対して相補的な塩基配列と特異的に結合する塩基配列を用いても、同様のRNA干渉作用を示すためである。
【0062】
さらに、上記の塩基配列からなるshRNAまたはsiRNAにおいて、配列番号1の代わりに、下記の配列番号4〜7に置き換えた場合のshRNAまたはsiRNAを用いてもよい。
配列番号4:5’−CCCTAAGGGTGGTGGAGAA−3’
配列番号5:5’−GGAGAATGTTAGCCAAAGA−3’
配列番号6:5’−GGCCACAGTTTCATAGAAA−3’
配列番号7:5’−GGACTAGGCCACAGGGCAT−3’
これらの配列番号4〜7についても、ラットSOD2遺伝子をノックダウンするためのshRNAまたはsiRNAに含まれる塩基配列として、B−Bridge社製の信頼性の高い配列予測ソフトウェア(非公開)によって、配列番号1と同様に好適な配列としてリストアップされた配列であるため、当然ながら同様のRNA干渉作用を示すと推測されるためである。
【0063】
また、上記実施の形態では、薬物誘導性肝障害の原因候補化合物として、アセトアミノフェンをはじめとする非特異体質性の薬物誘導性肝障害(用量依存性の薬物誘導性肝障害)の原因候補化合物を中心に説明したが、上記のモデルラットが特異体質性の薬物誘導性肝障害(非用量依存性の薬物誘導性肝障害)の原因候補化合物の薬物動態の試験に用いることができないわけではない。当然のことではあるが、上記のモデルラットは、トログリタゾンをはじめとする特異体質性の薬物誘導性肝障害(非用量依存性の薬物誘導性肝障害)の原因候補化合物の薬物動態の試験にも好適に用いることができる。
【0064】
このような特異体質性の薬物誘導性肝障害(非用量依存性の薬物誘導性肝障害)の原因候補化合物としては、トログリタゾン以外にも、例えば、特に限定する趣旨ではないが、現時点で知られている限りでも、アカルボース、アミオダロン、イソニアジド、イトラコナゾール、経口避妊薬、ザフィルルカスト、ジクロフェナクナトリウム、ジスルフィラム、タモキシフェン、蛋白同化ステロイド、ダントロレンナトリウム、テガフール・ウラシル、塩酸テルビナフィン、バルプロ酸ナトリウム、塩酸ヒドララジン、フルコナゾール、フルタミド、ペモリン、塩酸ラベタロールなどが挙げられる。
【0065】
また、上記実施の形態で、薬物誘導性肝障害のモデル動物としてラットを用いたが、特に限定する趣旨ではなく、他の非ヒト哺乳動物であっても好適に使用可能である。例えば、非ヒト哺乳動物の種類がマウスであれば、マウスのSOD2酵素の塩基配列に対応した配列からなるshRNAまたはsiRNAを用いてもよい。このようにすれば、マウスのSOD2酵素の発現を好適に抑制でき、ヒトにおける毒性発現予測に役立てることのできるモデルマウスが得られるからである。
【実施例】
【0066】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0067】
<実験材料>
F−344系ラット(雄性、7週齢)は日本SLC(Shizuoka,Japan)より購入した。Adenovirus Expression Vector Kit(Dual Version)はタカラバイオ株式会社(Otsu,Japan)より購入した。GeneSilencer shRNA Vector KitsはGene Therapy Systems(San Diego,U.S.)より購入した。Cell Counting Kit−8(CCK−8)は和光純薬工業(Osaka,Japan)より購入した。トログリタゾンおよびロシグリタゾンは第一三共株式会社(Tokyo,Japan)より御供与頂いた。その他の試薬は和光純薬工業等の特級またはHPLC用のものを用いた。
【0068】
<実験方法1>
SOD2 shRNA発現アデノウイルスの作成
B−Bridge International Inc.(California,U.S.)に依頼し、ラットSOD2 mRNAの配列からsiRNA配列(下記参照)を選択し、in vitroにおいてノックダウン効果を確認した後、その配列を用いて二本鎖オリゴDNAを作成し、pU6プロモーターを持つpGSU6−GFPベクターに組み込んだ。制限酵素Hinc IIで目的配列およびpU6プロモーターを切り出し、pAxcwitコスミドベクターに組み込んだ。以後のアデノウイルス作成はAdenovirus Expression Vector Kit(Dual Version)を用い、マニュアルに従って図3に示すように行った。
【0069】
Rat SOD2 mRNAに対するsiRNAの認識配列(実際に実験で使用したもの)
配列番号1:5’−CCACATATGTGTAAGCATA−3’
配列番号2:5’−TATGCTTACACATATGTGG−3’
なお、配列番号1および配列番号2は互いに相補的な配列である。
【0070】
Rat SOD2 mRNAに対するsiRNAの認識配列(B−Bridgeより得た上記以外の配列)
配列番号4:5’−CCCTAAGGGTGGTGGAGAA−3’
配列番号5:5’−GGAGAATGTTAGCCAAAGA−3’
配列番号6:5’−GGCCACAGTTTCATAGAAA−3’
配列番号7:5’−GGACTAGGCCACAGGGCAT−3’
【0071】
アデノウイルスベクターに組み込んだshRNAの配列
Top strand(配列番号8):5’−gatccCCACATATGTGTAAGCATAgaagcttgTATGCTTACACATATGTGGttttttggaagc−3’
Bottom strand(配列番号9):5’−ggccgcttccaaaaaaCCACATATGTGTAAGCATAcaagcttcTATGCTTACACATATGTGGg−3’
【0072】
なお、上記のTop strandと Bottom strandをアニールさせることで2本鎖のshRNAを作製してアデノウイルスベクターに組み込める。すなわち、合成した個々の1本鎖からアニールして、2本鎖を作成してアデノウイルスベクターに組み込める。
【0073】
<実験方法2>
SOD2 shRNA発現アデノウイルスの細胞への感染
細胞はラット肝由来細胞のBRL3A細胞、ラット肝癌由来のH4IIE細胞、マウス肝癌由来細胞のHepa1−6細胞、ヒト肝癌由来細胞HLE細胞を用いた。細胞を6wellまたは12wellプレートにまき、70〜100%コンフルエントまで培養した。培地を除き、SOD2 shRNA発現アデノウイルスをMOI 100で1時間感染させた。対照としてLuc(ルシフェラーゼ)shRNA発現アデノウイルスを同様に感染させた。1時間感染操作を行った後に培地を添加し、その3日後におけるmRNAの発現をreal−time RT PCRにて測定した(primerの配列に関しては下記表1を参照)。
【0074】
【表1】

【0075】
<実験方法3>
テストステロン6β水酸化酵素活性の測定
YamazakiとShimadaの方法に従い測定した(Arch Biochem Biophys 346:161−169:1997)。実験操作は以下に従って行った。BRL3A細胞にAdSOD2−shRNAウイルス液をMOI 100で、AdCYP3A4ウイルス液をMOI 0、5、10、20、50および100で感染させた。感染72時間後に培養液をアスピレーターで吸引し、100μMテストステロンを含む培地1mLを加えた。1時間後に培地を採取して生成した代謝物である6β水酸化テストステロンを以下の方法により測定した。採取した培地500μLにジクロロメタン4mL、精製水500μL、内部標準物質として100μMのコルチコステロン20μLを加えて激しく撹拌した。3,000rpm(700g)で10分間遠心分離後、ジクロロメタン層を別の試験管に移し、窒素気流下乾固させた。すべての溶液を乾固させた後、試験管に200μLの45%メタノールを加え、1分間ボルテックスミキサーで激しく撹拌し、2,000rpm(500g)で5分間遠心分離し、40μLをHPLCに注入して分析した。HPLCによる分析には、ポンプ(日立L−2130)、オートサンプラー(日立L−2200)、カラムオーブン(日立分光CO−965)、UV検出器(日立L−2400)を用いて、溶離液を240nmでモニターした。カラムはMightsil RP−18 GP−150−4−6 5μM(関東化学)を用いた。移動相は50%MeOH/10mMリン酸カリウム緩衝液(pH7.4)を使用し、流速は1.0mL/min、カラム温度は35°Cとした。
【0076】
<実験方法4>
SOD2 shRNA発現アデノウイルス感染細胞への薬物処置後CCK(MTT assay)による細胞生存率の検討
BRL3A細胞を96 wellプレートにまき、コンフルエントとした後、SOD2 shRNA発現アデノウイルスを1時間感染させた。72時間後に肝障害性化合物であるトログリタゾンおよびダプソンを、ネガティブコントロールとしてロシグリタゾンを処置し、24時間後に各wellに試薬10μLを加え、1hr培養した。その後、GE Healthcare Amersham Bioscience (Tokyo,Japan)のプレートリーダーで吸光度を測定した。
【0077】
<実験方法5>
スーパーオキシドの測定
Carterらの方法に準じて測定を行った(J Leukoc Biol 55:253−258:1994)。すなわち、BRL3A細胞にAdSOD2−shRNAまたはAdLuc shRNAウイルス液をMOI 100で、またAdCYP3A4ウイルス液をMOI 50で感染させた。48時間後に培養液をアスピレーターで吸引し、薬物含む培地100μLを加えた。処置後24時間後にジヒドロエチジウムが10μMになるよう加え、30分間インキュベートし、1×PBSでwashし、トリプシンで細胞をはがし懸濁させた液をexcitation 352nm、 emission 590 nmで測定した。
【0078】
<実験方法6>
活性酸素種の測定
Posselらの方法に準じて測定を行った(FEBS Lett 416:175−178:1997)。すなわち、BRL3A細胞にAdSOD2−shRNAまたはAdLuc shRNAウイルス液をMOI 100で、またAdCYP3A4ウイルス液をMOI 50で感染させた。48時間後に培養液をアスピレーターで吸引し、薬物を含む培地100μLを加えた。処置後24時間後にジクロロフルオレセインジアセテートが30μMになるよう加え、2時間インキュベートし、1×PBSで2回washし、1×PBSを200μL加え、1時間インキュベートしたあとexcitation 485 nm、emission 538nmで測定した。
【0079】
<実験方法7>
ASTおよびALT値の測定
ラットの末梢血を尾静脈または下行大静脈より採取した。1時間室温で放置し、7,000rpm(3,000g)、4°Cで15分間遠心分離した後、血清約50μLをサンプルチューブに採取した。ASTおよびALT値をトランスアミナーゼCII−テストワコーキットを用い、マニュアルに従って以下の方法で定量した。血清10μLにASTまたはALT用基質酵素液を250μL加えた後よく混合し、37°Cで5分間インキュベートした後、発色試液を加えよく混合し、37°Cで正確に20分間加温した。20分後に反応停止液を加えて反応を停止させ、よく混合後、555nmでの吸光度を測定し、ASTおよびALT活性を測定した。
【0080】
<実施例1>
SOD2 shRNA発現アデノウイルスによるノックダウン効率の確認
ラット、マウスおよびヒト肝由来細胞を用い、real−time RT PCRで各々の動物種におけるSOD2 mRNAを定量した。その結果、ラット肝由来細胞であるBRL3Aにおいては対照群と比べて60%以上の有意な減少を示した。なおラット肝癌由来細胞H4IIE細胞、マウス肝癌由来細胞Hepa1−6細胞、およびヒト肝癌由来細胞HLE細胞においては、対照群と比べ有意な差ではなかった(図4)。
【0081】
<実施例2>
テストステロン6β水酸化酵素活性の測定
薬物誘導性肝障害は主としてCYPなどにより代謝的活性化を受けることで起こることが知られている。また、臨床で使用されている薬物の半数以上がCYP3A4で代謝されることが知られている。しかしながらBRL3A細胞にはCYPがほとんど発現していなく、そのため、CYP3A4を発現させることとし、本研究室に既存のCYP3A4発現アデノウイルス(AdCYP3A4)との同時感染の至適条件を検討した。図5ではAdCYP3A4単独感染、およびAdCYP3A4・AdSOD2−shRNA同時感染におけるテストステロン6β水酸化酵素活性を示した。AdCYP3A4のMOI依存的に活性値は上昇した。MOI 50でほぼプラトーに達した。これより、今後の薬物処置における細胞障害性の実験はAdSOD2−shRNA MOI 100、AdCYP3A4 MOI 50で行うことにした。
【0082】
<実施例3>
SOD2 shRNA発現アデノウイルスの細胞への薬物障害性の影響
AdSOD2−shRNAをBRL3A細胞に感染させ、3日後に肝障害化合物であるダプソン10、20、30 μMおよびトログリタゾン25、50、75μMを24時間処置したところ、対照群と比べて細胞障害性への影響に有意な差が認められた(図6)。また、ダプソン30μM、トログリタゾン50μMを24時間処置したところ、対照群と比べてスーパーオキシドおよび活性酸素種の有意な上昇が認められた(図7)。なお、図7のROSは、Reactive Oxygen Speciesの略称である。
【0083】
<実施例4>
ウイルス投与量および時間依存的なラット肝SOD2 mRNA、SOD2タンパク量およびSOD2酵素活性の変動
アデノウイルスは主に肝組織に感染することが知られている。そこで、AdSOD2−shRNAをラット尾静脈より投与し、ラット肝臓中のSOD2 mRNA、SOD2タンパク質およびSOD2酵素活性の変化を検討した。SOD2 mRNAにおいては5×1010(pfu/body)投与群ではPBS投与群と比べて最大約35%の減少が認められ、2×1011(pfu/body)投与群では最大約70%の減少が認められた。SOD2タンパク質においては5×1010(pfu/body)投与群では最大約33%の減少が認められ、2×1011(pfu/body)投与群では最大約65%の減少が認められた。SOD2酵素活性においては5×1010(pfu/body)投与群では最大約35%の減少が認められ、2×1011(pfu/body)投与群では最大約60%の減少が認められた。また、5×1010(pfu/body)投与群および2×1011(pfu/body)投与群ともに投与後7日目にSOD2酵素活性値が最も減少した(図8)。
【0084】
<実施例5>
SOD2ノックダウンラットにおけるAPAPによる肝障害の検討
SOD2酵素活性値が最も低下した条件は2×1011(pfu/body)投与後7日目であったことから(図8)、APAPの投与はAdSOD2−shRNAの2×1011(pfu/body)感染後7日目に行うことにした。AdLuc−shRNA投与群において、1,000mg/kgのAPAP投与によるAST値およびALT値の上昇は認められなかった。しかし、AdSOD2−shRNA投与群においては1,000mg/kgのAPAP投与によりAST値およびALT値の有意な増加が認められた(図9)。
【0085】
一方、300mg/kgのAPAP投与ではいずれの群においても有意なAST値・ALT値の増加は認められなかった。AdSOD2−shRNA投与ラットにおけるAPAP投与による肝障害性への影響を検討するため、HE染色による肝組織像の検討を行った(図10)。その結果、AdSOD2−shRNA投与を行ったラットにおいてのみ、APAP1,000mg/kg投与によって中心静脈周辺に肝細胞の壊死が認められた。これは薬物誘導性肝障害の一般的な所見である。AdLuc−shRNA投与を行ったラットにおいて、肝細胞壊死は全く認められなかった。
【0086】
<考察>
本研究では、in vitroおよびin vivoにおいて、SOD2 shRNA発現アデノウイルスを感染することで、解毒的な代謝能を低下させ、肝障害性化合物による障害を増強できる系の構築について検討した。
【0087】
様々な動物種由来肝細胞を用いた検討では、ラット肝由来のBRL3A細胞において約60%のSOD2 mRNAの減少が認められた(図4)が、ラット肝癌由来細胞であるH4IIE細胞ではSOD2 mRNAの有意な減少は認められなかった。H4IIE細胞にMOI 100でAdSOD2−shRNAを感染させると細胞変性が認められたため、ノックダウンの影響が明確に見られなかった。また、マウスおよびヒト肝癌由来細胞ではSOD2 mRNAの有意な減少は認められなかった。これはshRNAが認識するSOD2 mRNAに対する塩基配列の相同性が関与していると考えられる。本研究において、標的としたラットSOD2遺伝子に対しては100%の相同性を持つようにshRNAを設計した。この配列における相同性は、マウスSOD2遺伝子に対しては63%、ヒトSOD2遺伝子に対しては58%であった。本実験によりラット肝由来細胞であるBRL3AでSOD2 mRNAの有意な減少が認められた。
【0088】
AdCYP3A4とAdSOD2−shRNA同時感染させたBRL3A細胞で細胞生存率の検討(図6)および、活性酸素種とスーパーオキシドアニオンの生成量への影響について検討を行った(図7)。ダプソン、トログリタゾンにおいて細胞生存率が対照群のAdLuc−shRNA感染群に比べて有意に減少し、活性酸素種およびスーパーオキシドアニオンの生成量の有意な増加が認められた。ネガティブコントロールとして用いたロシグリタゾンにおいては対照群のAdLuc−shRNA感染群との細胞生存率、活性酸素種およびスーパーオキシドアニオン生成量への有意な差は認められなかった。トログリタゾンはCYP3A4によりキノン体を、ダプソンはN−水酸化体を生じることが報告されている。一般にキノン体・N−水酸化体は活性酸素を産生することが知られている。以上、本研究において、SOD2とCYP3A4が関与する薬物の細胞障害性のスクリーニングに使用できる高感度なin vitroの検出系を構築することができた。
【0089】
ラットin vivoにおいてアデノウイルスを用い、SOD2遺伝子のノックダウンについて検討した。本研究においては主に肝組織に感染するアデノウイルスベクターを用いて行い、SOD2ノックダウンの影響が最も見やすい条件を検討した。5×1010pfu/body投与群ではSOD2 mRNAが投与後5日目で最も減少し、SOD2タンパク質およびSOD2酵素活性値においては投与後7日目で最大の減少(活性値の約35%減少)が認められた。2×1011pfu/body投与群においてはSOD2 mRNA、SOD2タンパク質およびSOD2酵素活性値いずれにおいても投与後7日目において最大の減少(活性値の約60%減少)が認められた(図8)。また、2×1011pfu/body投与のいずれのラットにおいてもAST値およびALT値の上昇は認められなかったため(data not shown)、投与量は2×1011pfu/bodyが適当であると考えられる。こうした予備検討の結果、単回肝障害性試験の検討はAdSOD2−shRNA投与後7日目に行うこととした。
【0090】
薬物誘導性肝障害を引き起こす薬物としてAPAPの単回投与肝障害性試験を行うこととし、AdSOD2−shRNAのネガティブコントロールとしてはAdLuc−shRNAの投与を行った。AdLuc−shRNAを感染させたラットにおいてはAPAP投与によるAST値およびALT値の有意な上昇は認められなかったが、AdSOD2−shRNAを投与したラットにおいてAPAP投与によるAST値およびALT値の有意な上昇が認められた(図9)。また、ラット肝の組織像においてもAdLuc−shRNA投与ラットにおいてはAPAP投与による肝細胞の変性・脱落は認められなかったが、AdSOD2−shRNA投与ラットにおいてはAPAP投与による肝細胞壊死が認められた(図10)。以上、これまでの検討において、本検出系はラットin vivoにおいても適用可能であることを示すことができた。
【0091】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることは当業者に理解されるところである。
【0092】
たとえば、上記実施例では、遺伝子ノックダウン非ヒト哺乳動物としてF−344系ラットを用いたが、特に限定する趣旨ではなく、Wister系をはじめとする他の系統のラットを用いてもよい。さらに、薬物動態および毒性の前臨床試験において、ラットが第一選択肢として多用されるため、実施例はラットで示したが、上記の遺伝子ノックダウン非ヒト哺乳動物は、ラットに限られず、ラットと同様の齧歯類であるマウスであってもよい。そして、上記の遺伝子ノックダウン非ヒト哺乳動物は、齧歯類に限られず、例えば、イヌ、ネコ、ブタ、ウシ、ヤギなどのヒト以外のほ乳類であればよい。もっとも、これらの場合には、適宜SOD2 shRNAの設計を変更することが好ましいことは言うまでもない。
【図面の簡単な説明】
【0093】
【図1】Superoxide dismutase(SOD)について説明するための概念図である。
【図2】本研究の目的について説明するための概念図である。
【図3】本研究で作成したSOD2 shRNA発現アデノウイルスの作成方法について説明するための概念図である。
【図4】SOD2 shRNA発現アデノウイルスによるSOD2 mRNAのノックダウン効率の肝細胞株による違いを確認した結果を示すグラフである。
【図5】AdCYP3A4単独感染、およびAdCYP3A4・AdSOD2−shRNA同時感染におけるテストステロン6β水酸化酵素活性を示したグラフである。
【図6】AdSOD2−shRNAをBRL3A細胞に感染させ、3日後に肝障害化合物であるダプソン10、20、30 μMおよびトログリタゾン25、50、75μMを24時間処置した場合のMTTアッセイの結果を示したグラフである。
【図7】ダプソン30μM、トログリタゾン50μMを24時間処置した場合の対照群と比べたスーパーオキシドおよび活性酸素種の変化を示したグラフである。
【図8】F344系統のラットにおけるウイルス投与量および時間依存的なラット肝SOD2 mRNA、SOD2タンパク量およびSOD2酵素活性の変動を示したグラフである。
【図9】F344系統のラットにおけるSOD2ノックダウンした場合のAPAPによる肝障害の検討結果を示したグラフである。
【図10】F344系統のラットにおけるAdSOD2−shRNA投与による肝障害を示す顕微鏡写真である。
【特許請求の範囲】
【請求項1】
SOD2遺伝子がノックダウンされている、遺伝子ノックダウン非ヒト哺乳動物。
【請求項2】
SOD2酵素の発現がノックダウンされている、請求項1記載の遺伝子ノックダウン非ヒト哺乳動物。
【請求項3】
前記SOD2酵素の発現がRNA干渉法によりノックダウンされている、請求項2記載の遺伝子ノックダウン非ヒト哺乳動物。
【請求項4】
前記RNA干渉法が、shRNAまたはsiRNAを発現させる干渉法である、請求項3記載の遺伝子ノックダウン非ヒト哺乳動物。
【請求項5】
前記RNA干渉法が、前記shRNAまたは前記siRNAを発現可能なアデノウイルスベクターを前記非ヒト哺乳動物に感染させる干渉法である、請求項4記載の遺伝子ノックダウン非ヒト哺乳動物。
【請求項6】
前記遺伝子ノックダウン非ヒト哺乳動物がラットである、請求項1乃至5いずれかに記載の遺伝子ノックダウン非ヒト哺乳動物。
【請求項7】
同一種の野生型の非ヒト哺乳動物に対して、肝臓組織におけるSOD2mRNAの発現量、SOD2タンパク質の発現量、またはSOD2酵素活性のいずれかが有意に低い、請求項1乃至6いずれかに記載の遺伝子ノックダウン非ヒト哺乳動物。
【請求項8】
ヒトにおける用量依存性の薬物誘導性肝障害を再現するモデル動物として使用可能である、請求項1乃至7いずれかに記載の遺伝子ノックダウン非ヒト哺乳動物。
【請求項9】
請求項1乃至8いずれかに記載の遺伝子ノックダウン非ヒト哺乳動物、その肝臓組織またはその肝臓細胞を用いる、ヒトにおける用量依存性の薬物誘導性肝障害の原因候補化合物についての薬物動態の試験方法。
【請求項10】
(a)配列番号:1に記載される第1の塩基配列と、配列番号:2に記載される第2の塩基配列と、前記第1の塩基配列および前記第2の塩基配列を連結するループ配列と、を含む塩基配列、
(b)配列番号:1に記載される塩基配列に対して1以上の塩基を欠失、置換、付加してなる第1の塩基配列と、配列番号:2に記載される塩基配列に対して1以上の塩基を欠失、置換、付加してなる第2の塩基配列と、前記第1の塩基配列および前記第2の塩基配列を連結するループ配列と、を含む塩基配列、
(c)配列番号:1に記載される塩基配列に対して80%以上の相同性を有する第1の塩基配列と、配列番号:2に記載される塩基配列に対して80%以上の相同性を有する第2の塩基配列と、前記第1の塩基配列および前記第2の塩基配列を連結するループ配列と、を含む塩基配列、
(d)配列番号:1に記載される塩基配列に対して相補的な塩基配列と特異的に結合する第1の塩基配列と、配列番号:2に記載される塩基配列相補的な塩基配列と特異的に結合する第2の塩基配列と、前記第1の塩基配列および前記第2の塩基配列を連結するループ配列と、を含む塩基配列、
のいずれかの塩基配列からなるshRNA。
【請求項11】
前記shRNAをラットの細胞内で発現させることにより、前記ラットの細胞内におけるSOD2酵素の発現をRNA干渉法によりノックダウンさせることができる、請求項10記載のshRNA。
【請求項12】
(a)配列番号:1に記載される第1の塩基配列と、配列番号:2に記載される第2の塩基配列と、を含む塩基配列、
(b)配列番号:1に記載される塩基配列に対して1以上の塩基を欠失、置換、付加してなる第1の塩基配列と、配列番号:2に記載される塩基配列に対して1以上の塩基を欠失、置換、付加してなる第2の塩基配列と、を含む塩基配列、
(c)配列番号:1に記載される塩基配列に対して80%以上の相同性を有する第1の塩基配列と、配列番号:2に記載される塩基配列に対して80%以上の相同性を有する第2の塩基配列と、を含む塩基配列、
(d)配列番号:1に記載される塩基配列に対して相補的な塩基配列と特異的に結合する第1の塩基配列と、配列番号:2に記載される塩基配列相補的な塩基配列と特異的に結合する第2の塩基配列と、を含む塩基配列、
のいずれかの塩基配列からなるsiRNA。
【請求項13】
前記siRNAをラットの細胞内で発現させることにより、前記ラットの細胞内におけるSOD2酵素の発現をRNA干渉法によりノックダウンさせることができる、請求項12記載のsiRNA。
【請求項14】
請求項10または11記載のshRNAまたは請求項12または13記載のsiRNAを発現可能なアデノウイルスベクター。
【請求項15】
前記アデノウイルスベクターをラットに感染させ、前記shRNAまたは前記siRNAを発現させることにより、SOD2酵素の発現をRNA干渉法によりノックダウンさせることができる、請求項14記載のアデノウイルスベクター。
【請求項1】
SOD2遺伝子がノックダウンされている、遺伝子ノックダウン非ヒト哺乳動物。
【請求項2】
SOD2酵素の発現がノックダウンされている、請求項1記載の遺伝子ノックダウン非ヒト哺乳動物。
【請求項3】
前記SOD2酵素の発現がRNA干渉法によりノックダウンされている、請求項2記載の遺伝子ノックダウン非ヒト哺乳動物。
【請求項4】
前記RNA干渉法が、shRNAまたはsiRNAを発現させる干渉法である、請求項3記載の遺伝子ノックダウン非ヒト哺乳動物。
【請求項5】
前記RNA干渉法が、前記shRNAまたは前記siRNAを発現可能なアデノウイルスベクターを前記非ヒト哺乳動物に感染させる干渉法である、請求項4記載の遺伝子ノックダウン非ヒト哺乳動物。
【請求項6】
前記遺伝子ノックダウン非ヒト哺乳動物がラットである、請求項1乃至5いずれかに記載の遺伝子ノックダウン非ヒト哺乳動物。
【請求項7】
同一種の野生型の非ヒト哺乳動物に対して、肝臓組織におけるSOD2mRNAの発現量、SOD2タンパク質の発現量、またはSOD2酵素活性のいずれかが有意に低い、請求項1乃至6いずれかに記載の遺伝子ノックダウン非ヒト哺乳動物。
【請求項8】
ヒトにおける用量依存性の薬物誘導性肝障害を再現するモデル動物として使用可能である、請求項1乃至7いずれかに記載の遺伝子ノックダウン非ヒト哺乳動物。
【請求項9】
請求項1乃至8いずれかに記載の遺伝子ノックダウン非ヒト哺乳動物、その肝臓組織またはその肝臓細胞を用いる、ヒトにおける用量依存性の薬物誘導性肝障害の原因候補化合物についての薬物動態の試験方法。
【請求項10】
(a)配列番号:1に記載される第1の塩基配列と、配列番号:2に記載される第2の塩基配列と、前記第1の塩基配列および前記第2の塩基配列を連結するループ配列と、を含む塩基配列、
(b)配列番号:1に記載される塩基配列に対して1以上の塩基を欠失、置換、付加してなる第1の塩基配列と、配列番号:2に記載される塩基配列に対して1以上の塩基を欠失、置換、付加してなる第2の塩基配列と、前記第1の塩基配列および前記第2の塩基配列を連結するループ配列と、を含む塩基配列、
(c)配列番号:1に記載される塩基配列に対して80%以上の相同性を有する第1の塩基配列と、配列番号:2に記載される塩基配列に対して80%以上の相同性を有する第2の塩基配列と、前記第1の塩基配列および前記第2の塩基配列を連結するループ配列と、を含む塩基配列、
(d)配列番号:1に記載される塩基配列に対して相補的な塩基配列と特異的に結合する第1の塩基配列と、配列番号:2に記載される塩基配列相補的な塩基配列と特異的に結合する第2の塩基配列と、前記第1の塩基配列および前記第2の塩基配列を連結するループ配列と、を含む塩基配列、
のいずれかの塩基配列からなるshRNA。
【請求項11】
前記shRNAをラットの細胞内で発現させることにより、前記ラットの細胞内におけるSOD2酵素の発現をRNA干渉法によりノックダウンさせることができる、請求項10記載のshRNA。
【請求項12】
(a)配列番号:1に記載される第1の塩基配列と、配列番号:2に記載される第2の塩基配列と、を含む塩基配列、
(b)配列番号:1に記載される塩基配列に対して1以上の塩基を欠失、置換、付加してなる第1の塩基配列と、配列番号:2に記載される塩基配列に対して1以上の塩基を欠失、置換、付加してなる第2の塩基配列と、を含む塩基配列、
(c)配列番号:1に記載される塩基配列に対して80%以上の相同性を有する第1の塩基配列と、配列番号:2に記載される塩基配列に対して80%以上の相同性を有する第2の塩基配列と、を含む塩基配列、
(d)配列番号:1に記載される塩基配列に対して相補的な塩基配列と特異的に結合する第1の塩基配列と、配列番号:2に記載される塩基配列相補的な塩基配列と特異的に結合する第2の塩基配列と、を含む塩基配列、
のいずれかの塩基配列からなるsiRNA。
【請求項13】
前記siRNAをラットの細胞内で発現させることにより、前記ラットの細胞内におけるSOD2酵素の発現をRNA干渉法によりノックダウンさせることができる、請求項12記載のsiRNA。
【請求項14】
請求項10または11記載のshRNAまたは請求項12または13記載のsiRNAを発現可能なアデノウイルスベクター。
【請求項15】
前記アデノウイルスベクターをラットに感染させ、前記shRNAまたは前記siRNAを発現させることにより、SOD2酵素の発現をRNA干渉法によりノックダウンさせることができる、請求項14記載のアデノウイルスベクター。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2010−68785(P2010−68785A)
【公開日】平成22年4月2日(2010.4.2)
【国際特許分類】
【出願番号】特願2008−243131(P2008−243131)
【出願日】平成20年9月22日(2008.9.22)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年4月10日 インターネットアドレス「http://mhlw−grants.niph.go.jp/niph/search/NIST00.do」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年4月14日 インターネットアドレス「http://mhlw−grants.niph.go.jp/niph/search/NIST00.do」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年6月 第35回日本トキシコロジー学会学術年会事務局発行の「第35回日本トキシコロジー学会学術年会 要旨集」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年6月25日 日本薬学会北陸支部第118回例会事務局発行の「日本薬学会北陸支部平成20年度第1回総会及び第118回例会 プログラム・講演要旨集」に発表
【出願人】(504160781)国立大学法人金沢大学 (282)
【Fターム(参考)】
【公開日】平成22年4月2日(2010.4.2)
【国際特許分類】
【出願日】平成20年9月22日(2008.9.22)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年4月10日 インターネットアドレス「http://mhlw−grants.niph.go.jp/niph/search/NIST00.do」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年4月14日 インターネットアドレス「http://mhlw−grants.niph.go.jp/niph/search/NIST00.do」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年6月 第35回日本トキシコロジー学会学術年会事務局発行の「第35回日本トキシコロジー学会学術年会 要旨集」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年6月25日 日本薬学会北陸支部第118回例会事務局発行の「日本薬学会北陸支部平成20年度第1回総会及び第118回例会 プログラム・講演要旨集」に発表
【出願人】(504160781)国立大学法人金沢大学 (282)
【Fターム(参考)】
[ Back to top ]

