アフィニティークロマトグラフィーマトリックスおよびその作成および使用法
【課題】固体支持体上にタンパク質リガンドを連結する方法、また、標的分子を精製するためにアフィニティークロマトグラフィーマトリックスを使用する方法を提供する。
【解決手段】a)固体支持体;b)固体支持体に結合したタンパク質リガンド;c)タンパク質リガンドと共有結合的に相互作用する、固体支持体に結合した活性化基;d)固体支持体に結合した会合性基;を含むアフィニティークロマトグラフィーマトリックス。
【解決手段】a)固体支持体;b)固体支持体に結合したタンパク質リガンド;c)タンパク質リガンドと共有結合的に相互作用する、固体支持体に結合した活性化基;d)固体支持体に結合した会合性基;を含むアフィニティークロマトグラフィーマトリックス。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、参照によりその全体を本明細書に組み入れる、2006年1月6日出願の米国仮出願第60/756873号に基づく優先権を主張する。
【0002】
本発明は、一般的にクロマトグラフィーの分野に関する。ある特別な実施形態において、本発明は、アフィニティークロマトグラフィーに関するマトリックスと方法を提供する。
【背景技術】
【0003】
クロマトグラフィー法は一般的に、タンパク質、核酸および多糖類などの関心のある分子を混合物から分離および/または精製するために用いられる。アフィニティークロマトグラフィーは具体的には、その混合物を、マトリックスに結合した、関心のある分子に特異性なリガンド(即ち、特異的結合相手)を有するマトリックス上を通すことを含む。関心のある分子は、リガンドに接触すると、マトリックスに結合され、従ってその混合物から拘束される。アフィニティークロマトグラフィーは、他の種類のクロマトグラフィーに対してある利点を提供する。それは、高い特異性のある、迅速な、経済的で高収量である精製方法を提供する。
【0004】
1つの適用において、アフィニティークロマトグラフィーはモノクロナール抗体などのタンパク質を精製する為に用いられ得る。一例として、IgGサブタイプの抗体を、マトリックスに結合したプロテインAまたはプロテインGを有するマトリックス上を通して、IgGサブタイプの抗体が親和精製され得る(Boyle and Reis, 1987, Biotechnology5:697;Hermanson et al., 1992, Immobilized Affinity Ligand Techniques, Academic Press; U.S.Patent Publication No. 2006/0134805)。
【0005】
プロテインAおよびプロテインGなどのタンパク質リガンドを、固体支持体(例えばクロマトグラフィー媒体)に取り付ける方法は、以前に記述されている(例えば、Hermanson et al.1992, Immobilized Affinity Ligand Techniques, Academic Press; U.S.Patent Nos.5,874,165;3,932,557;4,772,653;4,210,723;5,250,6123;欧州特許出願EP1352957A1,WO2004/074471.参照)。通常、該媒体は、例えばエポキシド(エピクロルヒドリン)、シアン(臭化シアン(CNBr))、N,N−ジスクシンイミジル炭酸塩(DSC)、アルデヒドまたは活性化カルボン酸(例えば、N−ヒドロキシスクシンイミド(NHS)エステル、カルボニルジイミダゾール(CDI)活性化エステル)などの反応性官能基(「活性化基」)で活性化される。これらの活性化基は、CNBrの場合のように、基材マトリックスに直接取り付けられ得るか、または通常リンカーのブタンジオールジグリシジルエーテル(通常のエポキシドカップリング剤)中に見られる炭素と酸素の10員環などの炭素、酸素および窒素原子の直鎖である「リンカー」またはスペーサー分子の一部であり得る。活性化された媒体は、ついでカップリング条件下で、該タンパク質リガンドと平衡化される。該カップリング反応が終了すると、該媒体は完全に洗浄される。プロテインAに対して、通常タンパク質4−6mg(リガンド密度)がロードされ40g/LのIgG最大静的容量(Qs)が得られる。タンパク質リガンド密度が静的容量を決める。この静的容量は、クロマトグラフィー分離中に使用され得るタンパク質の容量の上限を提供する。一般に、動的容量またはロード容量(Qd)は与えられた媒体で静的容量と相関する。
【0006】
アガロース支持体への取り付けに適したプロテインAの組み換え形もまた記述されている。該タンパク質の組み換え形は末端システインを有するように設計されている(例えば、米国特許第6,399,750;GE Healthcare Product Literature for r−Protein A Sepharose Fast Flow, Mabselect(登録商標)and Mabselect Xtra(登録商標)参照)。この組み換えプロテインAを用いて、55から70の範囲のIgGの静的容量が達成されている。しかし、この組み換えプロテインAの使用に関連する1つの制約は、それが選択的なカップリング官能基を含むように遺伝子的に設計されなければならず、これは時間を消費し、高価なことである。
【0007】
タンパク質リガンドを固体支持体にカップリングするためのもう1つの戦略は、「リンカーを利用するカップリング」である。リンカーを利用するカップリングは、以下に詳述するリガンドを利用するカップリングと対照的に、該リガンド(即ち、精製すべき標的分子の特異結合相手)および該リガンドの固体支持体へのカップリングに利用し得る、適した会合官能基の両方を含む単一の分子に依存することで特徴付けられる。この技術は、関心のあるタンパク質リガンドを連結するために設計されたリンカーまたはスペーサーの中に官能基(例えば、帯電アミン)を設計することを含む。これらのシステムにおける該リンカーはまた、該タンパク質を該リンカーにカップリングする為の活性化基も有する。該リンカーは、先ず該固体支持体と会合され、ついでタンパク質と接触される。従って、単一分子のリンカーは、該タンパク質をマトリックスに共有結合的に取り付ける役割と該タンパク質と非共有結合的に相互作用する2つの役割を果たす。これは、カップリング反応の前/中に成分のいくつかの前会合を提供する。この技術は、電気泳動の膜ブロティングのための膜表面にグリカンを連結するために開発された(米国特許第5,543,054号;Charkoudian et al., 1995, Analytical Letters, 28:1055)。
【0008】
リンカーを利用するカップリングのもう一つの例は、市販の商品Affi−Gel15(登録商標)(BioRad, Hercules, CA)に見られる。Affi−Gel15(登録商標)は、正に帯電した官能基を含むリンカーアームの1部としてNHS活性化されたカルボン酸で誘導体化されたアガロース支持体である。正に帯電した官能基は二級アミンである。このアミンは、pH7.4でプロトン化され、6未満の等電点のタンパク質のカップリングを可能にする。Affigelマトリックスの性質およびリンカーを利用するカップリングによって作られた他のこのようなリガンドは、会合性基(正の電荷)が、2つの官能基の固定した1:1の比を提供するタンパク質カップリングリンカーの一部であるために制約を有する。プロテインAをアガロースにカップリングするためのもう一つの帯電したリンカーアームが米国特許第5,260,373に記述されている。ここでは、アルギニンを含む短いリンカーアームが、アガロース支持体へのタンパク質カップリングを容易にするために用いられる。このアルギニンリンカーは、NHSで活性化され、正の電荷を有する。しかし、結果は、リンカーを利用しないカップリングと比べて、IgGの小幅な改善が達成されるにすぎない。更に、上述の1:1比がここでも同様に維持されている。リンカーを介して固体支持体に結合されたプロテインAが最近米国特許出願第10/928,731に記述されている。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】米国特許出願公開第2006/0134805号明細書
【特許文献2】米国特許第5,874,165号明細書
【特許文献3】米国特許第3,932,557号明細書
【特許文献4】米国特許第4,772,653号明細書
【特許文献5】米国特許第4,210,723号明細書
【特許文献6】米国特許第5,250,6123号明細書
【特許文献7】欧州特許出願公開第1352957号明細書
【特許文献8】国際公開第2004/074471号
【特許文献9】米国特許第6,399,750号明細書
【特許文献10】米国特許第5,543,054号明細書
【特許文献11】米国特許第5,260,373号明細書
【特許文献12】米国特許出願第10/928,731号明細書
【非特許文献】
【0010】
【非特許文献1】Boyle and Reis, 1987, Biotechnology5:697
【非特許文献2】Hermanson et al., 1992, Immobilized Affinity Ligand Techniques, Academic Press
【非特許文献3】GE Healthcare Product Literature for r−Protein A Sepharose Fast Flow, Mabselect(登録商標)and Mabselect Xtra(登録商標)
【非特許文献4】Charkoudian et al., 1995, Analytical Letters, 28:1055
【発明の概要】
【発明が解決しようとする課題】
【0011】
発酵および組織培養法(例えば、モノクロナール抗体の製造のため)のスケールアップは、これらの方法で製造される標的分子の容量の増加および濃度の増加をもたらした。リッターあたり1グラムを超す製品濃度は珍しいことではない。これらの製品は販売され得る前に精製が必要である。従って、良好な製品収量を与える増強された結合容量を有し、経済的で、製造が容易なクロマトグラフィーマトリックスの必要性がある。以下に記述する本発明の多様な実施形態はこれらのおよび他の必要性を満たす。
【課題を解決するための手段】
【0012】
(本発明の概要)
ある実施形態において、本発明は、該マトリックスが固体支持体および少なくとも1つのタンパク質リガンドを含み、その方法が、a)会合性基が該固体支持体と反応するように、該固体支持体を該会合性基に接触させること;b)該固体支持体を活性化すること(即ち、活性化基の添加);c)該タンパク質リガンドが該固体支持体に結合し、a)の該会合性基と相互作用するように、該固体支持体を該タンパク質リガンドに接触させること;
を含む、アフィニティークロマトグラフィーマトリックスを作る方法を提供する。
【0013】
ある他の実施形態において、本発明は、a)固体支持体;b)該固体支持体に結合したタンパク質リガンド;c)会合性基が、タンパク質リガンドと相互作用している該固体支持体に別個に結合した会合性基を含む、アフィニティークロマトグラフィーマトリックスを提供する。
【0014】
更に他の実施形態において、本発明は、
標的分子がマトリックスのタンパク質リガンドに結合するように、条件の第一の組の下で、混合物を
a)固体支持体;b)該固体支持体に結合したタンパク質リガンド;およびc)会合性基が、該タンパク質リガンドと相互作用している該固体支持体に別個に結合した該会合性基;を含むアフィニティークロマトグラフィーマトリックスと接触させること;および2)標的分子が該マトリックスの該タンパク質リガンドにもはや結合しないように、1)の条件を変更し、それによって関心のある物質を精製することを含む、該混合物から標的分子を精製する方法を提供する。場合により、例えば、リン酸塩緩衝食塩水、水または以下に記述した補充された緩衝液などの適した洗浄剤を用いる1つ以上の洗浄段階が段階1および2の間に行われ得る。該マトリックスは、段階1に先立って適切な緩衝液で平衡化され得る。
【0015】
更に他の実施形態において、本発明は、a)会合性基が固体支持体と相互作用するように、該固体支持体を該会合性基に接触させこと;b)該固体支持体を活性化すること;
c)タンパク質リガンドが該固体支持体に結合し、a)の該会合性基と相互作用するように、該固体支持体を該タンパク質リガンドに接触させること;を含む、該タンパク質リガンドを該固体支持体に連結する方法を提供する。
【0016】
ある更なる実施形態において、本発明は、a)帯電分子種がアガロース支持体と共有結合で反応するように、該アガロース支持体を該帯電分子種に接触させること;b)該アガロース支持体を活性化基で活性化すること;
c)プロテインAが該固体支持体に共有結合し、a)の該帯電分子種と非共有結合的に相互作用するように、該アガロース支持体を該プロテインAに接触させること;を含む、該プロテインAをアガロース支持体に連結する方法を提供する。
【0017】
更に他の実施形態において、本発明は、a)アガロース支持体;b)該アガロース支持体に共有結合的に結合したプロテインA;c)固体支持体と共有結合的に結合し、該プロテインAと非共有結合的に相互作用する帯電分子種を含む、アフィニティークロマトグラフィーマトリックスを提供する。
【0018】
更に他の実施形態において、本発明は、アガロース・ビーズの表面に結合したタンパク質リガンドの少なくとも10g/Lを含む、アガロース・ビーズを提供する。該タンパク質リガンド(例えば、プロテインA,プロテインG)は親和性リガンドとして働き得、従って、標的分子(例えば、関心のあるタンパク質)の特異的結合相手であり得る。
【0019】
いくつかの実施形態において、タンパク質リガンドは、介在性リンカーなしに、活性化された官能基を介して固体支持体に、例えば共有結合的に結合する。該タンパク質リガンドは、いずれかの介在性リンカー分子によりにまたは介在性リンカー分子なしに、該固体支持体に明確な共有結合を介して共有結合的に結合する1つ以上の会合性基と非共有結合的に相互作用し得る。従って、ある実施形態において、本発明は固体支持体に結合したリンカーを利用しない会合性基を提供する。ある実施形態において、本発明は固体支持体に結合したリンカーを利用しないタンパク質リガンドを提供する。ある実施形態において、会合性基およびタンパク質リガンドはそれぞれ固体支持体に共有結合を介して別個に結合される。
【0020】
他の実施形態において、タンパク質リガンドは、介在性リンカー分子を有する活性化された官能基を介して、固体支持体に、例えば共有結合的に、結合する。該タンパク質リガンドは、いずれかの介在性リンカー分子なしに、該固体支持体に共有結合的に結合している1つ以上の会合性基と非共有結合的に相互作用し得る。従って、ある実施形態において、本発明は、固体支持体に連結したリンカーを利用しない会合性基および該固体支持体に連結したリンカーを利用するタンパク質リガンドを提供する。
【0021】
他の実施形態において、本発明は、固体支持体に連結した会合性基および該固体支持体(そこでは、該会合性基および該タンパク質リガンドのいくつかの部分集団がリンカーを介して該固体支持体に連結している。)に連結したタンパク質リガンドを提供する。該タンパク質リガンドのいくつかの集団は、リンカーを介して該固体支持体に連結され得、または該会合性基のいくつかの集団は、該リンカーを介して該固体支持体に連結され得る。いくつかの実施形態において、会合性基およびタンパク質リガンドは両方とも、異なるリンカーを介して固体支持体に連結される集団を有し得る。
【0022】
更に他の実施形態において、本発明は、例えば共有結合によって、固体支持体に連結したリンカーを利用した会合性基を提供する。該会合性基は、いずれかの介在性リンカー分子なしで、該固体支持体に共有結合したタンパク質リガンドと例えば非共有結合的に相互作用し得る。
【0023】
本発明の更なる目的及び利点は、一部は以下の記述において説明され、一部は記述から明らかであり、または本発明の実施によって確認され得る。本発明の目的及び利点は、添付の請求項において具体的に指摘した要素および組み合わせによって理解され達成され得る。
【0024】
先述の一般的な説明及び以下の詳細な説明は単に典型的で、説明のためのものであり、請求した本発明を制限するものでない。
【0025】
(発明の説明)
固体支持体ヘのリガンドのカップリング方法
ある実施形態において、本発明はタンパク質リガンドをクロマトグラフィー媒体などの予め形成された固体支持体へカップリング(例えば、リガンドを利用するカップリング)する方法を提供する。この方法では、該タンパク質リガンドを共有結合的に結合する活性化剤および該タンパク質リガンドと非共有結合的に相互作用し、該タンパク質リガンドと該活性化剤の間の共有結合の形成を容易にする会合性基が両方とも、別個で明確な反応によって該固体支持体に連結され、該活性化剤および該会合性基は、それらを該固体支持体に共有結合的に結合する該反応に先立って連結されない。この方法は、a)該会合性基を該固体支持体と反応させることb)該固体支持体を活性化することおよびc)タンパク質リガンドを該固体支持体に連結することを含み得る。ある実施形態において、該会合性基および該タンパク質リガンドは両方とも該固体支持体に共有結合的に結合され得るが、該固体支持体を介する以外、お互いに共有結合的に結合されない。該会合性基および該活性化剤は、該固体支持体の外表面に共有結合的に結合され得る。該タンパク質リガンドは、該固体支持体に結合される該活性化剤に共有結合され得る。該会合性基は、該タンパク質リガンドと、例えば非共有結合的に相互作用し得、従って該タンパク質リガンドと該固体支持体の外表面に共有結合的に結合されている該活性化剤の間の共有結合の形成を容易にする。該タンパク質リガンドおよび該会合性基は両方とも、該固体支持体の内表面および微細孔に接近して結合し得ることが意図されている。
【0026】
段階a)およびb)が任意の順序で実施され得ることが認識されよう。従っていくつかの実施形態において、本発明は、会合性基およびタンパク質リガンドを固体支持体に連結するために使用され得る2段階反応を提供する。段階a)からc)を独立して実施することは、該会合性基、該タンパク質リガンドおよび該固体支持体の選択における柔軟性および所望のアフィニティークロマトグラフィーを実施するための条件の最適化を可能にする該タンパク質リガンドに対する該会合性基の比の制御を含む多数の利点を提供する。これは、必然的に該タンパク質リガンドおよび該会合性基の1:1の比をもたらす、例えばリンカーを利用するカップリングなどの該タンパク質リガンドを該固体支持体にカップリングする先述の方法と対照的である。
【0027】
先述の方法において、該活性化剤および該会合性基は、該固体支持体に結合される前にお互いに共有結合的に連結されるかまたは、該固体支持体を形成する重合反応の一部として該固体支持体の中に直接組み込まれる。これらの方法は、柔軟性に乏しく、およびリガンド密度の制御は至適以下である。ランダムカップリングまたは多点取り付けなどの他の先述の方法は、タンパク質リガンド中の利用できる任意のアミン基に依存する。多点取り付けは、柔軟性または固体支持体へのタンパク質リガンドのカップリングの制御に乏しい。
【0028】
本発明による更なる利点は、2つ以上の異なる会合性基の使用および/または2つ以上のタンパク質リガンドの使用を含む。更に他の利点は、リガンド密度を厳重に制御し、動的容量、静的容量または両方を最適化する能力を含む。更に他の利点は、マトリックス上の望まない不純物の非特異的結合の量を制限することを提供する。非特異的結合は、所望のタンパク質リガンドを連結する能力のあるアミンを含む化学種などの化学種で固体支持体を被覆することに依存する先述の方法に対して特別な問題である。本発明によって提供されるリガンド密度の制御は、これらの先述の方法に見られる非特異的結合の高いレベルを避ける。
【0029】
従って、固体支持体への会合性基および活性化剤を結合するための反応のアンカップリングによって、本発明は、該活性化剤および該会合性基の両方の濃度比のより良好な制御を提供し、それによって、標的タンパク質の単離のための、例えばpH,緩衝液中の塩濃度などのクロマトグラフィーの条件の良好な制御および調整を提供する。従って、ある実施形態において、本発明は、タンパク質リガンドおよび会合性基の比の多様性を意図し、該タンパク質リガンド濃度が該会合性基を上回る比および該会合性基の濃度が該タンパク質リガンド濃度を上回る比を含む。本発明の多様な実施形態において複数の異なる会合性基が用いられ得ることが意図される。本複数の発明の多様な実施形態において、固体支持体を活性化するために複数の異なる活性化剤が使用され得ることも意図されている。同様に、本複数の発明の多様な実施形態において、複数の異なるタンパク質リガンドが使用され得ることも意図されている。
【0030】
本明細書で使用されるタンパク質リガンドは、固体支持体に結合され、関心のある標的分子を特異的に結合することに適しているタンパク質を意味する。タンパク質は、完全長のタンパク質、完全長のタンパク質の断片またはサブユニット、ポリペプチドまたはタンパク質のペプチド断片を含み得る。
【0031】
いくつかの実施形態において、本発明の方法は、固体支持体への高密度タンパク質リガンドのカップリングを提供する。これは同様に、例えば先述の方法と比べて、該標的分子の結合容量(例えば、静的容量(Qs)および動的容量(Qd))を増強する。1例として、先述の方法を用いて、通常、該固体支持体のmlあたりn−プロテインA(ブドウ球菌(スタフィロコッカス/Staphylococcus))4−6mgがロードされ得る。本発明の方法を用いて、固体支持体のmlあたりプロテインA7−100mgがロードされ得る。ある実施形態において、10mg/mlを超すプロテインAが固体支持体上にロードされ得る。他の実施形態において、少なくとも8mg/mlが固体支持体上にロードされ得る。本発明のいくつかの実施形態において、プロテインAを組み換えによる改変(例えば、システイン残基の添加により)またはリンカーを利用するカップリングへの依存のいずれもなしに、増強された静的容量および動的容量が達成される。
【0032】
ある実施形態において、本発明の方法は、固体支持体を、該固体支持体と反応する能力がある少なくとも1つの会合性基と接触させることを含む。該固体支持体はすでに形成されていてよい(例えば、少なくとも1つの会合性基と反応され得る重合された支持体)。他の実施形態において、固体支持体は前もって形成されていなくてよく(例えば、重合されていない)、会合性基は、化学構成要素に添加され、該化学構成要素は、ついで反応されて組み込まれた該会合性基を有する固体支持体を形成するようにしてよい。該固体支持体と該会合性基の間の反応は、該固体支持体と該会合性基の間の共有結合の形成をもたらし得る。該会合性基は、従って該固体支持体の外表面に共有結合的に結合され得、内表面、例えば微細孔に接近して結合され得る。
【0033】
会合性基を含む非共有結合的相互作用、例えばイオン相互作用、疎水性相互作用、ファンデアワールス力および水素結合もまた意図される。1例として該会合性基は、帯電分子、例えば、固体支持体に共有結合的に取り付けられているポリマー、と非共有結合的に相互作用し得る。この会合性基はまた、タンパク質リガンドと相互作用し得る。従って該固体支持体は、該タンパク質リガンドが該固体支持体と共有結合的に結合し、該会合性基と非共有結合的に相互作用するように活性化され得る。従って。該非共有結合相互作用は、該タンパク質リガンドの該固体支持体への共有結合を容易にし得る。
【0034】
いくつかの実施形態において、会合性基は、いずれかの介入分子または連結分子を必要とせずに、固体支持体と直接反応し得る。他の実施形態において、会合性基は、該会合性基の第一の集団が固体支持体と直接反応し、該会合性基の第二の集団が1つ以上のリンカー分子を介して該固体支持体と間接的に反応する混合物として提供され得る。更に、該会合性基は、リンカー分子を用いた活性化によって修飾され得、それによって、少なくともいくつかの会合性基はリンカー分子の中に組み込まれ、他方、いくつかの会合性基は該固体支持体に、例えば共有結合で直接反応することが可能となる。ある化学反応の性質のために、タンパク質リガンドと非共有結合的に相互作用するように設計された該会合性基は該活性化基と反応し得、従って、該会合性基および該活性化基の両方を含むリンカーアームを通して、該タンパク質リガンドを該固体支持体に最終的にカップリングする。しかし、これらの活性化反応は、該固体支持体および該会合性基の両方を修飾し、タンパク質のカップリング位置の分布を生じる。これらの位置の1つの集団は、該会合性基を通して(CNBrで活性化された第二級アミンの場合のように)該固体支持体に連結された活性化された基を含む。カップリング位置が、ベースマトリックスに直接取り付けられた活性化された基および修飾されていない会合性基(残りの修飾されていない第二級アミンを有するCNBrで活性化されたベースマトリックスの場合のように)からなる第二の集団が存在し得る。これは、「リンカーを利用するカップリング」(ここでは、ただ1つのカップリング位置の集団が存在し得る。)および「リガンドを利用するカップリング」(ここでは、カップリング位置の少なくとも2つの可変の集団が存在し得る。)の間の相違の1例である。会合性基および活性化基は、その種類、量および関与する基の反応性において独立に変化され得るために、広範囲のカップリング条件および形態が利用され得る。
【0035】
会合性基およびタンパク質リガンドの間のすべての非共有結合相互作用が意図される。該タンパク質リガンドとの非共有結合相互作用は、例えばイオン相互作用、疎水性相互作用、水素結合を介する相互作用またはファンデアワールス力を含み得る。
【0036】
1つの実施形態において、会合性基およびタンパク質リガンドの間の相互作用はイオン性であり得る。例えば、正に帯電した会合性基は、固体支持体に結合され得る。該固体支持体は、ついで、該タンパク質リガンドの該固体支持体への化学結合(例えば、共有結合)を容易にし得る化学官能性によって活性化され得る。該タンパク質リガンドを含む溶液のpHは、該タンパク質が、該固体支持体に会合した該会合性基の電荷と相補的な電荷、例えば少なくとも1つの負電荷または正味の負電荷を有するように調整され得る。該固体支持体に結合した正に帯電した該会合性基および負に帯電した該タンパク質間の相互作用は、該タンパク質リガンドの該活性化された固体支持体への結合を容易にし、従って、先述の方法に比べて、増強された結合容量を提供する。帯電分子種は、イオンであるか、または正味の電荷を有する分子であり得る。
【0037】
タンパク質リガンドを固体支持体にカップリングするための適切な緩衝液の条件を選ぶことは、十分当業者の能力の範囲内である。適した緩衝液は、炭酸塩、重炭酸塩、リン酸塩および酢酸緩衝液などのアミンを含まない任意の緩衝液を含む。該緩衝液の塩濃度は、使用する会合性基に依存し得る。1例として、該塩濃度は、5nM−100nMの範囲であり得る。帯電した分子種が用いられる場合、該塩濃度は、少なくとも5nM、ただし0.1M未満、少なくとも5nM、ただし0.01M未満、少なくとも5nM、ただし0.001M未満であり得る。ある実施形態において、該塩濃度は、0.01Mであり得る。疎水性分子種が用いられる場合は、高塩濃度が望ましい。従って、該塩濃度は、0.001Mより多く、0.01Mより多く、0.1Mより多くてよい。
【0038】
本発明の方法は、0℃から99℃の範囲の温度で実施し得る。ある実施形態において、該方法は、60℃未満、40℃未満、20℃未満、10℃未満の温度で実施され得る。いくつかの実施形態において、本発明の方法は、4℃の温度で実施され得る。他の実施形態において、本発明の方法は、20℃の温度で実施され得る。
【0039】
会合性基
本発明における使用に適した会合性基は、イオン化学種などの帯電分子種および疎水性分子種などの非帯電分子種を含む。該会合性基は、例えば、固体支持体に直接共有結合的に結合することによって、該固体支持体を修飾し得る。イオン化学種の適した例は、第4級アミン、第3級アミン、第2級アミン、第1級アミン、スルホン酸、カルボン酸またはそれらの任意の組み合わせを含み得る。疎水性分子種の適した例は、フェニル基、ブチル基、プロピル基またはそれらの任意の組み合わせを含み得る。また、混合状態の分子種、例えば、帯電分子種および疎水性分子種の混合物、が用いられ得る。該会合性基はまた、タンパク質リガンドと相互作用し得る。従って、該会合性基および該タンパク質リガンドの間の相互作用は、相互作用の混合で構成され得る(例えばイオン性および疎水性分子種)。
【0040】
該会合性基は、該固体支持体上の官能基を該会合性基上の官能基と反応させて該固体支持体に共有結合的に連結され得る。適した官能基は、アミン、ヒドロキシ、スルフヒドリル、カルボキシル、イミン、アルデヒド、ケトン、アルケン、アルキン、アゾ、ニトリル、エポキシド、シアンおよび活性化されたカルボン酸基を含むが、これらに限定されない。1例として、アガロース・ビーズは、グリシジルトリメチルアンモニウムクロリドなどの正に帯電した会合性基のエポキシド官能基と反応され得るヒドロキシ基を含む。当業者は、少なくとも1つの2官能性会合性基が用いられるならば、複数の会合性基が該固体支持体に連結され得ることを認識するであろう。従って、該会合性基は、該固体支持体に直列に結合され得、またはそれらは個別に該固体支持体に直接結合されてよい。
【0041】
タンパク質リガンドおよび標的分子
それが、関心のある標的分子の特異的結合相手であれば、本発明の実施において、任意のタンパク質リガンドが用いられ得る。タンパク質リガンドの例は、プロテインA,プロテインG,抗体のFc受容体、ホルモンまたは成長因子の受容体を含み得る。該タンパク質リガンドは、例えばIgG、IgM、IgA、IgD、IgEなどの免疫グロブリンまたはその断片であり得る。断片は、標的抗原の抗原決定基および/またはFc受容体および/またはプロテインAおよび/またはプロテインGを結合する能力を保持している免疫グロブリン断片を含み得る。該タンパク質リガンドは、Fc分子またはその断片であり得る;Fabなど;酵素、例えばグルタチオントランスフェラーゼ、チロシンキナーゼ、例えば、MAP,Src、Lck;基剤、例えばグルタチオン。該タンパク質リガンドは、例えば1つ以上のヒスチジンを含むポリペプチドなどのタンパク質タグであり得る。該タンパク質リガンドは、Embrel(登録商標)などの融合タンパク質であり得る。該タンパク質リガンドは、転写因子、逆転写酵素、トポイソメラーゼ、ヘリカーゼなどの核酸結合タンパク質であり得る。標的分子が、受容体である場合は、そのリガンド、例えば成長因子、は本発明の方法において該タンパク質リガンドとして働き得る。該標的分子が、免疫グロブリン、例えばIgG、またはFc領域の少なくとの1部を含むその断片である場合、該タンパク質リガンドは、プロテインA、プロテインGまたはその機能性断片であり得る。その機能性断片は、IgGのFc領域またはFc断片に結合する能力を保持しているプロテインA断片またはプロテインG断片を含み得る。
【0042】
タンパク質リガンドは、天然起源の分子または設計された分子であり得る。ある実施形態において、固体支持体への結合または該固体支持体上での該タンパク質リガンドの配向のいずれかまたは両方を容易にするために、天然起源の該タンパク質リガンドを遺伝学的に改変することが望ましい場合がある。従って、用いられる会合性基に応じて、当業者は帯電基または疎水基または両方を該タンパク質リガンドの中に設計し得る。これらの改変は、該タンパク質リガンド内のどこででもなされ得る。
【0043】
タンパク質リガンドが、プロテインAである場合、本発明は、n−プロテインA(天然起源)が用いられる場合、50mg/mlより大きい静的結合容量Qsを与え、r−プロテインA(組み換えプロテインA)が用いられる場合、65mg/mlより大きい静的結合容量Qsを与える。該組み換えプロテインAは、末端システイン以外の修飾を含み得る。
【0044】
固体支持体、例えばビーズが溶液中に提供されている場合、タンパク質リガンドの適した濃度は、該固体支持体の0.05−700μmols/ml、該固体支持体の0.1−100μmols/mlの範囲であり得る。
【0045】
標的分子は、選択されるタンパク質リガンドに特異的に結合する任意の分子を含み得る。該タンパク質リガンドが、プロテインAまたはプロテインGである場合、該標的分子は、IgGサブクラスの免疫グロブリンを含み得る。該標的分子の具体的な例は、モノクロナール抗体を含み得る。免疫グロブリンの断片もまた、それらが選択される該タンパク質リガンドに結合する能力を保持するならば意図される。該標的分子はまた、Embrel(登録商標)などのFc融合タンパク質を含む融合タンパク質であり得る。
【0046】
固体支持体および活性化剤
任意の多孔性物質が、固体支持体として用いられ得る。一例として、該多孔性物質は、膜、ゲル、カセット、カラム、チップ、スライド、プレートまたはモノリスの形をとり得るが、これらに限定されない。
【0047】
該多孔性物質は、有機または無機の分子または有機または無機の分子の混合物から構成され得、および、会合性基、活性化基のいずれかまたは両方と例えば共有結合を形成する、例えばヒドロキシ基などの、反応に適した1つ以上の官能基から構成され得る。該多孔性物質は、親水性化合物、疎水性化合物、疎油性化合物、親油性化合物またはそれらの任意の組み合わせであり得る。該多孔性物質は、ポリマーまたはコポリマーから構成され得る。
【0048】
適した多孔性物質は、ポリエーテルスルホン、ポリアミド(例えば、アガロース)、セルロース、ポリサッカライド、ポリテトラフルオロエチレン、ポリスルホン、ポリエステル、ポリビニリデンフルオライド、ポリプロピレン、フルオロカーボン(例えば、ポリ(テトラフルオロエチレンーコーパーフルオロ(アルキルビニルエーテル))、ポリカーボネート、ポリエチレン、ガラス、ポリカーボネート、ポリアクリレート、ポリアクリルアミド、ポリ(アゾラクトン)、ポリスチレン、セラミック、ナイロンおよび金属を含むが、これらに限定されない。
【0049】
固体支持体は適切な化学官能基で活性化され得る。適した化学官能基は、シアン(例えば臭化シアン)、アルデヒド、エポキシドおよび活性化されたカルボン酸(例えば、N−ヒドロキシスクシンイミドエステル)またはそれらの任意の組み合わせを含み得る。替わりに、会合性基が、第一級、第二級、第三級アミンである場合、該会合性基は、エピクロルヒドリンまたは2官能性エポキシドで活性化され得る。
【0050】
リンカー
いくつかの実施形態において、本発明は、介入リンカーを介して固体支持体に連結され得る会合性基および/またはタンパク質リガンドを提供する。該リンカーは、リンキング部分に連結した少なくとも1つの官能基を含み得る。該連結部分は、官能基に連結され得る任意の分子を含み得る。従って、該連結部分は任意のアルキル、アルケニルまたはアルキニル基を含み得る。該連結部分は、1から30の範囲の炭素原子を含み得る。いくつかの実施形態において、リンカーは30を超す炭素原子で構成され得る。連結部分は、窒素、酸素および硫黄などの少なくとも1つのヘテロ原子を含み得る。該連結部分は、分枝鎖、非分枝鎖または環状鎖で構成され得る。該連結部分は、2つ以上の官能基で置換され得る。1つの特別な実施形態において、該リンカーはヒドロキシ基を介してアガロースに取り付けられた次の式の化合物を含み得る。
CH2CH2N(CH2CH3)CH2CH(OH)CH2O(CH2)4OCH2CH(O)CH2
【0051】
標的分子の精製法
ある実施形態において、本発明は、混合物からの標的分子の精製法を提供する。該標的分子は、特異的結合相手が、固体支持体に連結され得るならば、該特異的結合相手を有する任意の分子であり得る。該標的分子の例は、免疫グロブリンなどのタンパク質を含み得る。該免疫グロブリンは、ポリクロナール抗体またはモノクロナール抗体またはその機能的断片であり得る。該機能的断片は、その抗原になお特異的に結合し、一方で、同時に固体支持体に連結したタンパク質リガンドに特異的に結合する能力を保持している可変領域を含む免疫グロブリンの任意の断片を含み得る。
【0052】
ある実施形態において、その方法は、a)条件の第一の組の下で、本発明の固体支持体(本明細書に記述した)を標的分子を含む混合物に、標的分子が、固体支持体にカップルしたタンパク質リガンドに結合するように、接触させること、およびb)該標的分子が親和性リガンドにもはや結合しないように、条件を変更することを含む。ある実施形態において、その方法は、段階a)およびb)の間のpHを変えることを含む。ある実施形態において、段階b)は段階a)のpHよりも酸性であるpHで行い得る。ある実施形態において、段階b)はpHを変えることを含む。従って段階a)は、中性のpH、即ち6−8の範囲のpHで実施され得、段階b)は、酸性のpH、例えば1−6の範囲のpHで実施され得る。他の実施形態において、その方法は、該緩衝液の塩濃度を変えることを含む。従って、1つの実施形態において、段階a)において、例えば、>0.1Mの高い塩濃度が使用され得、および/または段階b)において、例えば、<0.1Mの低い塩濃度が使用され得る。他の実施形態において、段階a)において、例えば、<0.1Mの低い塩濃度が使用され得、および/または段階b)において、高い塩濃度が使用され得る。さらに他の実施形態において、該緩衝液の該pHおよび/または塩濃度は、段階a)およびb)の間で変えられ得る。
【0053】
1.クロマトグラフィーマトリックスの中間洗浄
ある実施形態において、本発明はまた、非特異的に結合した不純物を除去し、従ってより純粋な最終製品を得るためのクロマトグラフィーマトリックスの洗浄方法を提供する。マトリックスは、当分野で知られている任意のクロマトグラフィーマトリックスを含み得る。1例として、該クロマトグラフィーマトリックスは親和性マトリックスであり得る。該親和性マトリックスは、リガンドを利用するカップリングで作られる親和性マトリックスを含む本明細書に記述する親和性マトリックスのいずれかであり得る。該方法は、該標的分子が該クロマトグラフィーマトリックスに結合後に実施される中間洗浄を含み得る。通常、非特異的に吸着された不純物は、標的化合物または製品を除く任意の成分を含み得る。非特異的に結合した不純物の例は、タンパク質、DNA,脂質、エンドトキシン、ウイルス粒子およびフェノール赤、ペプトン、フルロニックF68,アミノ酸を含む他の小分子を含み得る。
【0054】
中間洗浄剤は、平衡化緩衝液またはフィード(即ち、未精製試料を含む溶液)と類似したpHおよび塩濃度を有する緩衝液、および更に、a)高い塩濃度(例えば、塩化ナトリウム、塩化アンモニウム、硫酸ナトリウム、塩化カリウム、硫酸アンモニウムなど)、またはb)異なるpH(低いまたは高い)、またはc)a)およびb)の組み合わせ、またはd)例えば、界面活性剤(例えば、Tween)、アミノ酸およびその誘導体または有機溶質(例えば、エチレングリコール)を含む緩衝液を含み得る。中間洗浄は、PBSなどの洗浄溶液と比べてある化学種の非特異的結合を2−5倍低下し得る。ある実施形態において、PBSなどの知られている洗浄溶液と比べて、ある化学種の非特異的結合の5倍を超す低下が達成される。
【0055】
ある実施形態において、本発明は、相溶性マトリックスを、僅かに塩基性pH(例えば、7.3−7.5)および0−1Mの範囲の補充塩濃度を有する緩衝液と接触させることを含む、非特異的結合分子種を除去するための相溶性マトリックスを洗浄する方法を提供する。従って、該緩衝液はPBSまたは追加の塩でさらに補充された、他の任意の緩衝液であり得る。いくつかの実施形態において、該塩濃度は、0.15M−1Mの範囲である。更に他の実施形態において、該塩濃度は0.25M−1Mの範囲である。更に他の実施形態において、該塩濃度は、0.25M−0.5Mの範囲である。
いくつかの実施形態において、該塩濃度は、0.0001Mより多いが、0.8M未満である。
【0056】
他の実施形態において、例えばPBSまたは任意の他の適した緩衝液は、酸性のpH(例えば、6.5)および1M未満であるが、0.0001M(例えば、0.4M)より多い、補充された塩濃度を有し得る。更に他の実施形態において、洗浄緩衝液は、僅かに塩基性のpH(例えば、7.3−7.5)を有し得る。いくつかの実施形態において、洗浄緩衝液は、1つ以上の帯電したアミノ酸を含み得る。洗浄緩衝液は、ベタイン、L−アラニン、グリシン、バリン、グルタミン酸およびリジンを含むアミノ酸またはアルキル化アミノ酸を含み得る。該アミノ酸またはアルキル化アミノ酸は、0.25−0.5Mの濃度の範囲で存在し得る。ある実施形態において、アミノ酸またはアルキル化アミノ酸の濃度は、0.5M未満、ただし0.0001Mより多い。更に他の実施形態において、アミノ酸またはアルキル化アミノ酸の濃度は、0.0001Mから1Mの範囲であり得る。中間洗浄緩衝液に用いられ得る、適したアミノ酸は、グリシン、バリン、リジン、アルギニン、アスパラギン酸、グルタミン酸ならびにn−メチルグリシンおよびトリメチルβ−アラニンなどのアミノ酸誘導体を含むが、これらに限定されない。中間洗浄緩衝液が、アミノ酸またはアミノ酸誘導体で補充されている緩衝液を含むある実施形態において、該緩衝液は、僅かに酸性のpH(例えば、6.0−6.99の範囲内)を有し得る。
【図面の簡単な説明】
【0057】
【図1】プロテインAを含む各種のアフィニティークロマトグラフィー媒体の動的および静的容量を示すグラフである。
【図2】会合性基と連結したおよび会合性基と連結していない各種クロマトグラフィー媒体の結合容量を比較したグラフおよび本発明によるリンカーを利用するプロテインAのカップリング方法である。
【図3】溶出プールにおいて測定されたCHO細胞タンパク質(CHOP)レベルを示すグラフおよび中間の塩緩衝液の洗浄ありまたはなしでの、会合性基の異なる量での、宿主細胞タンパク質の媒体への結合も示す。IgGの回収はすべて類似し、〜90−95%であった。
【図4a】中間の塩洗浄を実施することによる、リガンドを利用するカップリング化学を介して作られたプロテインA媒体からの溶出プールにおける宿主細胞タンパク質レベルの減少を示すグラフである。
【図4b】図4b中間の塩洗浄を実施することによる、リガンドを利用するカップリング化学を介して作られたプロテインA媒体からの溶出プールにおけるDNAレベルの減少を示すグラフである。
【図5】異なるpHおよび塩濃度の緩衝液を用いる中間洗浄を実施することによる、リガンドを利用するカップリング化学を介して作られたプロテインA媒体からの溶出プールにおける宿主細胞タンパク質レベルの減少を示すグラフである。
【図6a】アラニンまたはベタインを含む緩衝液を用いる中間洗浄を実施することによる、リガンドを利用するカップリング化学を介して作られたプロテインA媒体からの溶出プールにおける宿主細胞タンパク質レベルの減少を示すグラフである。
【図6b】各種アミノ酸を含む緩衝液を用いる中間洗浄を実施することによる、リガンドを利用するカップリング化学を介して作られたプロテインA媒体からの溶出プールにおける宿主細胞タンパク質レベルの減少を示すグラフである。
【0058】
(実施例)
【実施例1】
【0059】
第4級アミンリガンド、臭化シアンおよびn−プロテインA(14mg/ml)を用いるリガンドを利用するカップリング
アガロース・ビーズ(Sepharose 4B)(GE Healthcare,Piscataway NJ)を先述した方法(Porath and Fornstedt, 1970,J.Chromatography,51:479)に従って、エピクロルヒドリンを用いて架橋した。該アガロース・ビーズを次の方法に従って、正に帯電した会合性基(例えば、カチオン類)と反応させた:ビーズ100mLを75重量%のグリシジルトリメチルアンモニウムクロリド(GTMAC)100mLおよび50重量%の水酸化ナトリウム3.3gに加えた。反応溶液を室温で一晩回転振蕩器で激しく振蕩(>100rpm)した。ついで、該ビーズをろ過し、Milli−Q水(Millipore Corp,Billerica,MA)200mL容量で3回洗浄した。
【0060】
該ビーズ(10mL)をろ過し、ついで20mLの1MNa2CO3中で平衡化させた。試料を0.5gCNBr/mLのアセトニトリル溶液を含む第二の瓶と共に氷上で冷却した。該溶液が一旦冷却されると、該ビーズにCNBrのアセトニトリル溶液1.5mLを加え、該ビーズを氷上の振蕩器上に置いた(>100rpm)。2分後に、もう1つのCNBrのアセトニトリル溶液1.5mLを該ビーズに加え、該ビーズを再度氷上の振蕩器(>100rpm)上に置いた。該ビーズを4分間反応させ、ついで200mLの氷冷水および200mLの氷冷0.012MNaHCO3で洗浄し,濾過した。濾過ビーズケーキ(10mL)をn−プロテインA140mg(14mg/mL)を含む0.012MNaHCO310mLに加えた。該ビーズを一晩室温で振蕩した。該ビーズをついで、0.2MNaHCO3で洗浄し,濾過した。該ビーズケーキを、0.2MNaHCO3中の0.5Mのエタノールアミン20mLに加えた。30分後、該ビーズを0.2MNaHCO3,0.5MNaCl(pH4.5)を含む0.1M酢酸ナトリウムで洗浄し、ついで最後にリン酸塩緩衝食塩水で洗浄した。静的及び動的容量を下の実施例12に記述したように測定した。
【実施例2】
【0061】
第4級アミンリガンド、臭化シアンおよびn−プロテインA(17.8mg/ml)を用いるリガンドを利用するカップリング
アガロース・ビーズ(Sepharose 4B)(GE Healthcare, Piscataway NJ)を先述した方法(Porath and Fornstedt, 1970, J. Chromatography, 51 :479)に従って、エピクロルヒドリンを用いて架橋した。該アガロース・ビーズを次の方法に従って、正に帯電した会合性基(例えば、カチオン類)と反応させた:ビーズ100mLを75重量%のグリシジルトリメチルアンモニウムクロリド(GTMAC)100mLおよび50重量%の水酸化ナトリウム3.3gに加えた。反応溶液を室温で一晩回転振蕩器で激しく振蕩(>100rpm)した。ついで該ビーズをろ過し、Milli−Q水(Millipore Corp,Billerica,MA)200mL容量で3回洗浄した。
【0062】
該ビーズ(10mL)をろ過し、ついで20mLの1MNa2CO3中で平衡化させた。試料を0.5gCNBr/mLのアセトニトリル溶液を含む第二の瓶と共に氷上で冷却した。該溶液を冷却後、該ビーズにCNBrのアセトニトリル溶液1.5mLを加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。2分後に、もう1つのCNBrのアセトニトリル溶液1.5mLを該ビーズに加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。該ビーズを4分間反応させ、ついで200mLの氷冷水および200mLの氷冷0.012MNaHCO3で洗浄し,濾過した。濾過ビーズケーキ(10mL)をn−プロテインA285mg(17.8mg/mL)を含む0.012MNaHCO316mLに加えた。該ビーズを一晩室温で振蕩した。該ビーズをついで、0.2MNaHCO3で洗浄し,濾過した。該ビーズケーキを、0.2MNaHCO3中の0.5Mのエタノールアミン20mLに加えた。30分後、該ビーズを0.2MNaHCO3,0.5MNaCl(pH4.5)を含む0.1M酢酸ナトリウムで洗浄し、最後にリン酸塩緩衝食塩水で洗浄した。静的及び動的容量を下の実施例12に記述したように測定した。
【実施例3】
【0063】
第4級アミンリガンド、臭化シアンおよびr−プロテインAを用いるリガンドを利用するカップリング
アガロース・ビーズ(Sepharose 4B)(GE Healthcare,Piscataway,NJ)を先述した方法(Porath and Fornstedt, 1970,J.Chromatography,51:479)に従って、エピクロルヒドリンを用いて架橋した。該アガロース・ビーズを次の方法に従って、正に帯電した会合性基(例えば、カチオン類)と反応させた:ビーズ100mLを75重量%のグリシジルトリメチルアンモニウムクロリド(GTMAC)100mLおよび50重量%の水酸化ナトリウム3.3gに加えた。反応溶液を室温で一晩回転振蕩器で激しく振蕩(>100rpm)した。ついで該ビーズをろ過し、Milli−Q水200mL容量で3回洗浄した。
【0064】
該ビーズ(10mL)をろ過し、ついで20mLの1MNa2CO3中で平衡化させた。該試料を0.5gCNBr/mLのアセトニトリル溶液を含む第二の瓶と共に氷上で冷却した。該溶液を冷却後、該ビーズにCNBrのアセトニトリル溶液1.5mLを加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。2分後に、もう1つのCNBrのアセトニトリル溶液1.5mLを該ビーズに加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。該ビーズを4分間反応させ、ついで200mLの氷冷水および200mLの氷冷0.012MNaHCO3で洗浄し,濾過した。濾過ビーズケーキ(10mL)を市販のr−プロテインA250mg(25mg/mL)を含む0.012MNaHCO310mLに加えた。該ビーズを一晩室温で振蕩した。該ビーズを、ついで、0.2MNaHCO3で洗浄し,濾過した。該ビーズケーキを、0.2MNaHCO3中の0.5Mエタノールアミン20mLに加えた。30分後、該ビーズを0.2MNaHCO3,0.5MNaCl(pH4.5)を含む0.1M酢酸ナトリウムで洗浄し、最後にリン酸塩緩衝食塩水で洗浄した。静的及び動的容量を下の実施例12に記述したように測定した。
【実施例4】
【0065】
臭化シアンおよびn−プロテインA(17.8mg/ml)を用いる、第4級アミンリガンドを用いないリガンドを利用しないカップリング
アガロース・ビーズ(Sepharose 4B)(GE Healthcare,Piscataway,NJ)を先述した方法(Porath and Fornstedt,1970,J.Chromatography,51:479)に従って、エピクロルヒドリンを用いて架橋した。ついで、該ビーズをろ過し、Milli−Q水(Millipore Corp,Billerica,MA)200mL容量で3回洗浄した。
【0066】
該ビーズ(10mL)をろ過し、ついで20mLの1MNa2CO3中で平衡化させた。試料を0.5gCNBr/mLのアセトニトリル溶液を含む第二の瓶と共に氷上で冷却した。該溶液を冷却後、該ビーズにCNBrのアセトニトリル溶液1.5mLを加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。2分後に、もう1つのCNBrのアセトニトリル溶液1.5mLを該ビーズに加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。該ビーズを4分間反応させ、ついで200mLの氷冷水および200mLの氷冷0.012MNaHCO3で洗浄し,濾過した。濾過ビーズケーキ(10mL)をn−プロテインA285mg(17.8mg/mL)を含む0.012MNaHCO316mLに加えた。該ビーズを一晩室温で振蕩した。ついで、該ビーズを0.2MNaHCO3で洗浄し,濾過した。該ビーズケーキを、0.2MNaHCO3中の0.5Mのエタノールアミン20mLに加えた。30分後、該ビーズを0.2MNaHCO3,0.5MNaCl(pH4.5)を含む0.1M酢酸ナトリウムで洗浄し、最後にリン酸塩緩衝食塩水で洗浄した。静的及び動的容量を下の実施例12に記述したように測定した。
【実施例5】
【0067】
臭化シアンおよびn−プロテインAを用いる、第4級アミンリガンドを用いないリガンドを利用しないカップリング
アガロース・ビーズ(Sepharose 4B)(GE Healthcare,Piscataway,NJ)を先述した方法(Porath and Fornstedt,1970,J.Chromatography,51:479)に従って、エピクロルヒドリンを用いて架橋した。ついで該ビーズをろ過し、Milli−Q(登録商標)水(Millipore Corp,Billerica,MA)200mL容量で3回洗浄した。該ビーズ(10mL)をろ過し、ついで20mLの1MNa2CO3中で平衡化させた。試料を0.5gCNBr/mLのアセトニトリル溶液を含む第二の瓶と共に氷上で冷却した。該溶液を冷却後、該ビーズにCNBrのアセトニトリル溶液1.5mLを加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。2分後に、もう1つのCNBrのアセトニトリル溶液1.5mLを該ビーズに加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。該ビーズを4分間反応させ、ついで200mLの氷冷水および200mLの氷冷0.012MNaHCO3で洗浄し、濾過した。濾過ビーズケーキ(10mL)を市販のr−プロテインA250mg(25mg/mL)を含む0.012MNaHCO310mLに加えた。該ビーズを一晩室温で振蕩した。該ビーズをついで、0.2MNaHCO3で洗浄し,濾過した。該ビーズケーキを、0.2MNaHCO3中の0.5Mのエタノールアミン20mLに加えた。30分後、該ビーズを0.2MNaHCO3,0.5MNaCl(pH4.5)を含む0.1M酢酸ナトリウムで洗浄し、最後にリン酸塩緩衝食塩水で洗浄した。静的及び動的容量を下の実施例12に記述したように測定した。
【実施例6】
【0068】
第4級アミンリガンド、ブタンジオールジグリシジルエーテルおよびn−プロテインAを用いるリガンドを利用するカップリング
アガロース・ビーズ(Sepharose 4B) (GE Healthcare,Piscataway,NJ)を先述した方法(Porath and Fornstedt,1970,J.Chromatography,51:479)に従って、エピクロルヒドリンを用いて架橋した。該アガロース・ビーズを次の方法に従って、正に帯電した会合性基(例えば、カチオン類)と反応させた:ビーズ50mLを75重量%のグリシジルトリメチルアンモニウムクロリド(GTMAC)40g、10mLのMilli−Q水および50重量%の水酸化ナトリウム1.67gに加えた。反応液を室温で一晩回転振蕩器で激しく振蕩(>100rpm)した。ついで該ビーズをろ過し、Milli−Q(登録商標)水(Millipore Corp,Billerica,MA)100mL容量で3回洗浄した。ビーズの試料を下記のプロトコールを用いて滴定し、第4級アンモニウムリガンド密度を測定した。
【0069】
該ビーズ(50mL、濾過ケーキ)を4.6MのNaOH15mLを含む瓶に加えた。該混合物をスラリー化し、ついでブタンジオールジグリシジルエーテル(BUDGE)19.5mLを加えた。この混合物を35℃で2時間振蕩した。ついで、該ビーズをMilli−Q(登録商標)水(Millipore Corp,Billerica,MA)750mLで洗浄し、10mMNaHCO3250mLで平衡化させた。
【0070】
BUDGE活性化段階の直後、濾過ビーズケーキ10mLをn−プロテインA30g/L濃度を含む10mMNaHCO3の10mL溶液に加えた。該ビーズをハイブリダイザー中で37°℃で2時間回転した。2時間後、該ビーズを30mLのMilli−Q水(Millipore Corp,Billerica,MA)で洗浄した。該濾過ビーズケーキ(10mL)を、チオグリセロール1mLおよび0.2MのNaHCO3および0.5MのNaClを含む緩衝溶液9mLから構成された10mL溶液を含む瓶に加えた。該混合物をスラリー化し、室温で一晩回転した。ついで該ビーズを次の緩衝液30mLで洗浄した:0.1Mのトリス緩衝液(pH8)、0.15MのNaCl(pH8)を含む0.1Mのトリス緩衝液、50mMの酢酸(pH4.5)、0.002%のアジドナトリウムを含むPBS(pH7.4)。ついで該ビーズを標準曲線にn−プロテインAを用いる標準BCAアッセイ(Pierce,Rockford,IL)を用いて、記載した静的容量およびプロテインAリガンド密度について特性化した(下表1参照)。
【実施例7】
【0071】
第4級アミンリガンド、ブタンジオールジグリシジルエーテルおよびn−プロテインAを用いるリガンドを利用するカップリング
実施例7のビーズは、会合性基の添加を除いて実施例6に記述したビーズと同じである。アガロース・ビーズを次の方法に従って、正に帯電した会合性基(例えば、カチオン類)と反応させた:ビーズ50mLを75重量%のGTMAC25g、25mLのMilli−Q水および50重量%の水酸化ナトリウム1.67gに加えた。反応液を室温で一晩回転振蕩器上で激しく振蕩(>100rpm)した。ついで該ビーズをろ過し、Milli−Q(登録商標)水(Millipore Corp,Billerica,MA)100mL容量で3回洗浄した。次の段階(BUDGE活性化およびプロテインAカップリング)はすべて実施例6に記載したのと同じであった。ついで該ビーズを標準曲線にn−プロテインAを用いる標準BCAアッセイ(Pierce,Rockford,IL)を用いて、記載した静的容量およびプロテインAリガンド密度について特性化した(下表1参照)。
【実施例8】
【0072】
第4級アミンリガンド、ブタンジオールジグリシジルエーテルおよびn−プロテインAを用いるリガンドを利用するカップリング
実施例8のビーズは、会合性基の添加を除いて実施例6に記述したビーズと同じである。アガロース・ビーズ次の方法に従って、正に帯電した会合性基(例えば、カチオン類)と反応させた:ビーズ50mLを75重量%のGTMAC10g、40mLのMilli−Q水(Millipore Corp,Billerica,MA)および50重量%の水酸化ナトリウム1.67gに加えた。反応液を室温で一晩回転振蕩器上で激しく振蕩(>100rpm)した。ついで該ビーズをろ過し、Milli−Q(登録商標)水(Millipore Corp,Billerica,MA)100mL容量で3回洗浄した。次の段階(BUDGE活性化およびプロテインAカップリング)はすべて実施例6に記載したのと同じであった。ついで該ビーズを標準曲線にn−プロテインAを用いる標準BCAアッセイ(Pierce,Rockford,IL)を用いて、記載した静的容量およびプロテインAリガンド密度について特性化した(下表1参照)
【0073】
【表1】

【実施例9】
【0074】
CPG上で第4級アミンリガンド、エピクロルヒドリンおよびn−プロテインAを用いるリガンドを利用するカップリング
プロテインAを会合性基を用いてCPGにカップルするために、Controlled pore glass(CPG)(Millipore Corp,Billerica,MA)LCA−CPG1000Aを用いた。LCA−CPG(10mL)を、50%重量のグリシジルトリメチルアンモニウムクロリドを含む10mLの水溶液に加えた。反応液を30℃で一晩軽く(<100rpm)振蕩した。ついで、該CPGを50mLのMilli−Q(登録商標)水(Millipore Corp,Billerica,MA)で洗浄し、濾過して乾燥ケーキを得た。該CPGを30℃で2時間軽く振蕩したエピクロルヒドリンの水溶液35mLに加えた。該ビーズを100mLのMilli−Q(登録商標)水(Millipore Corp,Billerica,MA)で洗浄し、ついで濾過し、乾燥ケーキを得た。該ビーズ(5mL)をn−プロテインA15mg/mL濃度を含む0.01MNaHCO35mLに加えた。カップリング反応液を35℃で一晩軽く振蕩した。ついで、該ビーズを100mLのMilli−Q(登録商標)水(Millipore Corp,Billerica,MA)で洗浄し、ついで濾過して、乾燥ケーキを得た。ついで、該ビーズをpH8の0.1Mのトリス緩衝液中の1Mのエタノールアミン10mLに加えた。該反応を1時間行い、ついで該ビーズを0.2MNaHCO3,0.5MNaCl(pH4.5)を含む0.1M酢酸ナトリウムそれぞれ50mLで洗浄し、ついで、最終的にリン酸塩緩衝食塩水で洗浄した。先述したように該静的容量を測定し、結果を表2に示す。該会合性基の濃度は、元素分析により測定した。
【実施例10】
【0075】
CPG上で第4級アミンリガンド、エピクロルヒドリンを用いないプロテインAのリガンドカップリング
プロテインAを会合性基を用いないでCPGに連結するために、Controlled pore glass(CPG)(Millipore Corp,Billerica,MA)ProsSep5−CHO1000Aを用いた。該5−CHOビーズ(5mL)をn−プロテインA15mg/mL濃度含む0.01MのNaHCO35mLに加えた。カップリング反応液を35℃で一晩軽く(<100rpm)振蕩した。ついで、該ビーズをMilli−Q(登録商標)水(Millipore Corp,Billerica,MA)100mLで洗浄し、ついで濾過し、乾燥ケーキを得た。ついで、該ビーズをpH8の0.1Mのトリス緩衝液中の1Mのエタノールアミン10mLに加えた。反応を1時間行い、ついで該ビーズを0.2MNaHCO3,0.5MNaCl(pH4.5)を含む0.1M酢酸ナトリウムそれぞれ50mlで洗浄し、ついで最終的にリン酸塩緩衝食塩水で洗浄した。先述した該静的容量を測定し、結果を表2に示す。該会合性基の濃度は元素分析により測定した。
【0076】
【表2】

【実施例11】
【0077】
会合性基濃度の測定:第四級アミンリガンドの滴定
第四級アミンリガンド密度を酸塩基滴定を用いて測定した。ビーズの試料1mLを使い捨てプラスチックカラムに置き、ついで、Milli−Q(登録商標)水(10mL)(Millipore Corp,Billerica,MA)および1MNaCl(10mL)で平衡化させた。ついで該ビーズをMilli−Q(登録商標)水(10mL)(Millipore Corp,Billerica,MA)4mLで洗浄し、濾過して湿ったビーズケーキを得た。該ビーズを攪拌棒を備えた小さなビーカー中の1MNaCl80mLに加えた。ビーカにpH計を置いた。該試料を0.01MHClで滴定した。対照として強アニオン交換ビーズ(Q−Sepharose FF)を用いた。実施例6−8のデータを下表1に示す。結果は驚くべきことに、低会合性基密度および対応する低リガンド密度は、市販の代替物および替わりの実験条件の両方と比較して、より優れた静的容量を与えることを示す。
【実施例12】
【0078】
IgGの静的および動的容量の測定
上記の実施例に記述した製品それぞれの静的または飽和容量および商業的標準を次の方法を用いて測定した:
1.PBS緩衝液中の各試料からビーズ懸濁液(20%ビーズ)を作成した。
2.該ビーズ懸濁液を攪拌し、500μL試料を15mLの3つの円錐プラスチック管にピペットで採った。
3.PBS中のタンパク質溶液(IgG)(1mg/mL)を各管(14mL)に加えた。
4.該管に栓をし、オービタルシェーカーでゆっくり(<100rpm)と振蕩した。
5.24時間後、該ビーズを安定させ、結合後該溶液のUV測定をした。
6.該UV吸収をIgG濃度に変換し(ε−1.38)、物質収支を用いて飽和容量を測定した。
【0079】
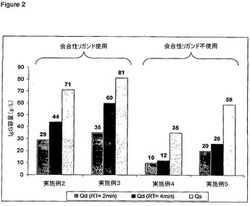
プロテインA媒体をOmnifitカラム(0.66cm直径、7cm床高さ)にロードし、ポリクロナールにヒト免疫グロブリン(IgG)の動的結合容量を試験した。該カラムをPBS緩衝液(pH7.4)で平衡化させ、該タンパク質(1g/L)を同じ緩衝液を用いてカラムに装填した。10%破過点における容量を用いて、異なる媒体を比較した。図1は、IgGの静的および動的容量が如何に2つの市販の標準, Mabselect(登録商標) and Mabselect Xtra(登録商標)(GE Healthcare,Piscataway,NJ)及び実施例1−3の製品を比較するかを示す。実施例2−5の結果を図2に示す。表は実施例6−8の静的容量を示す。表2は実施例9−10の静的容量を示す。
【実施例13】
【0080】
中間洗浄を用いて、および用いずに、異なる結合リガンド密度に対するIgG溶出プールにおける宿主細胞タンパク質(HCP)レベル
モデルHCPフィードストックとして、精製したモノクロナール抗体(mAb)、血清を含まぬCHO培地(Angel Biotechnology,Northumberland,UK)を用いた。リン酸塩緩衝食塩水(PBS1 pH 7.4−7.5,伝導率15−17mS/cm)溶液の10カラム容量(CV)で平衡化させた後、該フィードの20CVを実施例6−8に記述した該プロテインA媒体を充填したカラム(内径0.66cm、長さ7cm)にロードした。ついで該カラムをPBSの10CVまたは1MNaCIを補充したPBSの8CV(pH 7.4−7.5)で洗浄し、ついで補充されていない PBS(pH 7.4−7.5)の2CVで洗浄した。ついで、0.1Mクエン酸ナトリウム(pH3)溶出緩衝液の10CVで洗浄した。0.5から5.5CVのピーク画分を集めた。ついで、該カラムを6Mのグアニジン塩酸塩の5CVで洗浄し、ついでPBS緩衝液で平衡化させた。結合−溶出実験をBioCad(登録商標)分取液体クロマトグラフィー(Applied Biosystems Inc.,Foster City,CA)上で行った。溶出プールの280nmにおけるUV吸収を測定してIgG濃度および収量を決定した。CHOP濃度についても市販の酵素免疫測定(ELISA)キット(Cygnus Technologies Inc.,Southport,NC)を用いて分析した。結果を図3に示す。結果は高タンパク質リガンド密度に関連した非特異的結合が、適切な中間洗浄緩衝液を用いて容易に相殺されることを示している。表1の結果と組み合わせて、このデータは、本明細書中に記述した方法およびマトリックスの柔軟性は、当業者が非特異的結合のような望ましくない副作用を最小化しながら望ましい容量を最大化することを可能にし、従って、特別な用途に合わせ得る親和性マトリックスを提供することを示唆している。
【実施例14】
【0081】
塩緩衝液による中間洗浄を用いた、IgG溶出プールにおける宿主細胞タンパク質(HCP)およびDNAレベルの減少
モデルHCPフィードストックとして、精製した、IgGを発現していない、血清を含まないCHO培地(Lampire,Biological Laboratories,Piperville,PA)を用い、ポリクロナールヒトγグロブリン(hlgG)(SeraCare Life Sciences,Inc.,Oceanside,CA)1mg/mlでスパイクした。リン酸塩緩衝食塩水(PBS1 pH7.4−7.5,伝導率15−17mS/cm)溶液の10カラム容量(CV)で平衡化させた後、該フィードの20CVを実施例2に記述した該プロテインA媒体を充填したカラム(内径0.66cm、 長さx7cm)に装填した。ついで該カラムを0−1MNaCIを補充したPBS(pH7.4−7.5)の8CVついで補充されていないPBS(pH7.4−7.5)の2CVで洗浄した。ついで、0.1Mクエン酸ナトリウム(pH3)溶出緩衝液の10CVで洗浄した。0.5から5.5CVのピーク画分を集めた。ついで該カラムを6Mのグアニジン塩酸塩の5CVで洗浄し、ついでPBS緩衝液で再平衡化させた。結合−溶出実験をBioCad(登録商標)分取液体クロマトグラフィーシステム(Applied Biosystems Inc.,Foster City,CA)上で行った。該溶出プールの280nmにおけるUV吸収を測定してIgG濃度および収量を決定した。CHOP濃度についても市販の酵素免疫測定(ELISA)キット(Cygnus Technologies Inc.,Southport,NC)を用いて分析した。
【0082】
図4aは、異なる塩の洗浄緩衝液を用いて測定された溶出プール中のCHOPレベルを示す。NaCIの濃度を0から1Mに増加すると、CHOP濃度は450ng/mlから80ng/mlまで5倍より多く減少した。IgGの回収はすべて類似しており、90−95%であった。
【0083】
図4bは、1MNaCI補充PBS緩衝液洗浄を用いて測定された溶出プール中のDNAレベルを示す。リガンドを利用するカップリングから作られたプロテインA試料の通常のPBS洗浄に比べて、塩洗浄は、非特異的に吸着されたDNAのレベルを20−60%だけ減少させた。
【実施例15】
【0084】
低pHおよび高塩濃度での中間洗浄を用いた、IgG溶出プールにおけるHCPレベルの減少
本実験は、PBS(pH6.5および0.4MNaCI補充)の8CVを含む中間洗浄緩衝液を用いたことを除き、上記実施例14に記述したのと同様の条件下で行った。
【0085】
図5は、異なるpHおよび塩濃度の中間洗浄緩衝液を用いて測定された溶出プール中のCHOPレベルを示す。0.4MNaCI補充pH6.5のPBS緩衝液を用いて得られた結果は、補充されていないPBS(pH7.4−7.5)を用いて得られた結果と比べて、〜8の因子だけCHOPレベルが低下した。
【実施例16】
【0086】
アミノ酸またはアルキル化アミノ酸を含む中間洗浄緩衝液を用いた、IgG溶出プールにおけるHCPレベルの減少
本実験は、8CVのPBS緩衝液(pH7.4−7.5、伝導率15−17mS/cm)および0.25−0.5Mベタイン、L−アラニン、グリシン、またはリジン、または0.125−0.25Mバリンまたは0.15Mグルタミン酸含む中間洗浄緩衝液を用いたことを除き、上記実施例14に記述したのと同様の条件下で行った。
【0087】
図6aは、ベタインおよびL−アラニンを含む中間洗浄緩衝液を用いて測定された溶出プール中のCHOPレベルを示す。0.25MのベタインはCHOP濃度を減少した。比較すると、アラニンはベタインに比べより有効であった。アラニンの両濃度で、結合CHOPは2倍より多く減少した。
【0088】
図6bは、バリン、グリシン、グルタミン酸またはリジンの各種濃度を含中間洗浄緩衝液を用いて測定された溶出プール中のCHOPレベルを示す。PBS洗浄と比較すると、溶出プール中のCHOPレベルは、アミノ酸洗浄で約3−10倍低く、その中でリジンおよびグルタミン酸が最も有効であるようである。
【0089】
本明細書および請求項で用いられる成分、反応条件などの量を表わすすべての数字は、すべての場合において用語「約」で修飾されていると理解されるべきである。従って、反対に指示されていなければ、この明細書および添付の請求項に規定されている数字のパラメーターは、近似値であり、それは本発明によって得られるべく探求されている所望の性質によって変化し得る。少なくとも、および本請求項の範囲に均等論の適用を制限する試みとしてではなく、それぞれの数字のパラメーターは、有効数字および通常の四捨五入方法に照らして解釈されるべきである。
【0090】
当業者に明白であるように、本発明の精神および範囲から逸脱することなく、本発明の多数の修飾および変更がなされ得る。本明細書に記述された具体的な実施形態は実施例のためにだけに提供したもので、制限的していることを決して意味しない。明細書及び実施例は、単に典型的な例と考えられるべきで、本発明の真の範囲および精神は以下の請求項によって示されていることが意図されている。
【技術分野】
【0001】
本出願は、参照によりその全体を本明細書に組み入れる、2006年1月6日出願の米国仮出願第60/756873号に基づく優先権を主張する。
【0002】
本発明は、一般的にクロマトグラフィーの分野に関する。ある特別な実施形態において、本発明は、アフィニティークロマトグラフィーに関するマトリックスと方法を提供する。
【背景技術】
【0003】
クロマトグラフィー法は一般的に、タンパク質、核酸および多糖類などの関心のある分子を混合物から分離および/または精製するために用いられる。アフィニティークロマトグラフィーは具体的には、その混合物を、マトリックスに結合した、関心のある分子に特異性なリガンド(即ち、特異的結合相手)を有するマトリックス上を通すことを含む。関心のある分子は、リガンドに接触すると、マトリックスに結合され、従ってその混合物から拘束される。アフィニティークロマトグラフィーは、他の種類のクロマトグラフィーに対してある利点を提供する。それは、高い特異性のある、迅速な、経済的で高収量である精製方法を提供する。
【0004】
1つの適用において、アフィニティークロマトグラフィーはモノクロナール抗体などのタンパク質を精製する為に用いられ得る。一例として、IgGサブタイプの抗体を、マトリックスに結合したプロテインAまたはプロテインGを有するマトリックス上を通して、IgGサブタイプの抗体が親和精製され得る(Boyle and Reis, 1987, Biotechnology5:697;Hermanson et al., 1992, Immobilized Affinity Ligand Techniques, Academic Press; U.S.Patent Publication No. 2006/0134805)。
【0005】
プロテインAおよびプロテインGなどのタンパク質リガンドを、固体支持体(例えばクロマトグラフィー媒体)に取り付ける方法は、以前に記述されている(例えば、Hermanson et al.1992, Immobilized Affinity Ligand Techniques, Academic Press; U.S.Patent Nos.5,874,165;3,932,557;4,772,653;4,210,723;5,250,6123;欧州特許出願EP1352957A1,WO2004/074471.参照)。通常、該媒体は、例えばエポキシド(エピクロルヒドリン)、シアン(臭化シアン(CNBr))、N,N−ジスクシンイミジル炭酸塩(DSC)、アルデヒドまたは活性化カルボン酸(例えば、N−ヒドロキシスクシンイミド(NHS)エステル、カルボニルジイミダゾール(CDI)活性化エステル)などの反応性官能基(「活性化基」)で活性化される。これらの活性化基は、CNBrの場合のように、基材マトリックスに直接取り付けられ得るか、または通常リンカーのブタンジオールジグリシジルエーテル(通常のエポキシドカップリング剤)中に見られる炭素と酸素の10員環などの炭素、酸素および窒素原子の直鎖である「リンカー」またはスペーサー分子の一部であり得る。活性化された媒体は、ついでカップリング条件下で、該タンパク質リガンドと平衡化される。該カップリング反応が終了すると、該媒体は完全に洗浄される。プロテインAに対して、通常タンパク質4−6mg(リガンド密度)がロードされ40g/LのIgG最大静的容量(Qs)が得られる。タンパク質リガンド密度が静的容量を決める。この静的容量は、クロマトグラフィー分離中に使用され得るタンパク質の容量の上限を提供する。一般に、動的容量またはロード容量(Qd)は与えられた媒体で静的容量と相関する。
【0006】
アガロース支持体への取り付けに適したプロテインAの組み換え形もまた記述されている。該タンパク質の組み換え形は末端システインを有するように設計されている(例えば、米国特許第6,399,750;GE Healthcare Product Literature for r−Protein A Sepharose Fast Flow, Mabselect(登録商標)and Mabselect Xtra(登録商標)参照)。この組み換えプロテインAを用いて、55から70の範囲のIgGの静的容量が達成されている。しかし、この組み換えプロテインAの使用に関連する1つの制約は、それが選択的なカップリング官能基を含むように遺伝子的に設計されなければならず、これは時間を消費し、高価なことである。
【0007】
タンパク質リガンドを固体支持体にカップリングするためのもう1つの戦略は、「リンカーを利用するカップリング」である。リンカーを利用するカップリングは、以下に詳述するリガンドを利用するカップリングと対照的に、該リガンド(即ち、精製すべき標的分子の特異結合相手)および該リガンドの固体支持体へのカップリングに利用し得る、適した会合官能基の両方を含む単一の分子に依存することで特徴付けられる。この技術は、関心のあるタンパク質リガンドを連結するために設計されたリンカーまたはスペーサーの中に官能基(例えば、帯電アミン)を設計することを含む。これらのシステムにおける該リンカーはまた、該タンパク質を該リンカーにカップリングする為の活性化基も有する。該リンカーは、先ず該固体支持体と会合され、ついでタンパク質と接触される。従って、単一分子のリンカーは、該タンパク質をマトリックスに共有結合的に取り付ける役割と該タンパク質と非共有結合的に相互作用する2つの役割を果たす。これは、カップリング反応の前/中に成分のいくつかの前会合を提供する。この技術は、電気泳動の膜ブロティングのための膜表面にグリカンを連結するために開発された(米国特許第5,543,054号;Charkoudian et al., 1995, Analytical Letters, 28:1055)。
【0008】
リンカーを利用するカップリングのもう一つの例は、市販の商品Affi−Gel15(登録商標)(BioRad, Hercules, CA)に見られる。Affi−Gel15(登録商標)は、正に帯電した官能基を含むリンカーアームの1部としてNHS活性化されたカルボン酸で誘導体化されたアガロース支持体である。正に帯電した官能基は二級アミンである。このアミンは、pH7.4でプロトン化され、6未満の等電点のタンパク質のカップリングを可能にする。Affigelマトリックスの性質およびリンカーを利用するカップリングによって作られた他のこのようなリガンドは、会合性基(正の電荷)が、2つの官能基の固定した1:1の比を提供するタンパク質カップリングリンカーの一部であるために制約を有する。プロテインAをアガロースにカップリングするためのもう一つの帯電したリンカーアームが米国特許第5,260,373に記述されている。ここでは、アルギニンを含む短いリンカーアームが、アガロース支持体へのタンパク質カップリングを容易にするために用いられる。このアルギニンリンカーは、NHSで活性化され、正の電荷を有する。しかし、結果は、リンカーを利用しないカップリングと比べて、IgGの小幅な改善が達成されるにすぎない。更に、上述の1:1比がここでも同様に維持されている。リンカーを介して固体支持体に結合されたプロテインAが最近米国特許出願第10/928,731に記述されている。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】米国特許出願公開第2006/0134805号明細書
【特許文献2】米国特許第5,874,165号明細書
【特許文献3】米国特許第3,932,557号明細書
【特許文献4】米国特許第4,772,653号明細書
【特許文献5】米国特許第4,210,723号明細書
【特許文献6】米国特許第5,250,6123号明細書
【特許文献7】欧州特許出願公開第1352957号明細書
【特許文献8】国際公開第2004/074471号
【特許文献9】米国特許第6,399,750号明細書
【特許文献10】米国特許第5,543,054号明細書
【特許文献11】米国特許第5,260,373号明細書
【特許文献12】米国特許出願第10/928,731号明細書
【非特許文献】
【0010】
【非特許文献1】Boyle and Reis, 1987, Biotechnology5:697
【非特許文献2】Hermanson et al., 1992, Immobilized Affinity Ligand Techniques, Academic Press
【非特許文献3】GE Healthcare Product Literature for r−Protein A Sepharose Fast Flow, Mabselect(登録商標)and Mabselect Xtra(登録商標)
【非特許文献4】Charkoudian et al., 1995, Analytical Letters, 28:1055
【発明の概要】
【発明が解決しようとする課題】
【0011】
発酵および組織培養法(例えば、モノクロナール抗体の製造のため)のスケールアップは、これらの方法で製造される標的分子の容量の増加および濃度の増加をもたらした。リッターあたり1グラムを超す製品濃度は珍しいことではない。これらの製品は販売され得る前に精製が必要である。従って、良好な製品収量を与える増強された結合容量を有し、経済的で、製造が容易なクロマトグラフィーマトリックスの必要性がある。以下に記述する本発明の多様な実施形態はこれらのおよび他の必要性を満たす。
【課題を解決するための手段】
【0012】
(本発明の概要)
ある実施形態において、本発明は、該マトリックスが固体支持体および少なくとも1つのタンパク質リガンドを含み、その方法が、a)会合性基が該固体支持体と反応するように、該固体支持体を該会合性基に接触させること;b)該固体支持体を活性化すること(即ち、活性化基の添加);c)該タンパク質リガンドが該固体支持体に結合し、a)の該会合性基と相互作用するように、該固体支持体を該タンパク質リガンドに接触させること;
を含む、アフィニティークロマトグラフィーマトリックスを作る方法を提供する。
【0013】
ある他の実施形態において、本発明は、a)固体支持体;b)該固体支持体に結合したタンパク質リガンド;c)会合性基が、タンパク質リガンドと相互作用している該固体支持体に別個に結合した会合性基を含む、アフィニティークロマトグラフィーマトリックスを提供する。
【0014】
更に他の実施形態において、本発明は、
標的分子がマトリックスのタンパク質リガンドに結合するように、条件の第一の組の下で、混合物を
a)固体支持体;b)該固体支持体に結合したタンパク質リガンド;およびc)会合性基が、該タンパク質リガンドと相互作用している該固体支持体に別個に結合した該会合性基;を含むアフィニティークロマトグラフィーマトリックスと接触させること;および2)標的分子が該マトリックスの該タンパク質リガンドにもはや結合しないように、1)の条件を変更し、それによって関心のある物質を精製することを含む、該混合物から標的分子を精製する方法を提供する。場合により、例えば、リン酸塩緩衝食塩水、水または以下に記述した補充された緩衝液などの適した洗浄剤を用いる1つ以上の洗浄段階が段階1および2の間に行われ得る。該マトリックスは、段階1に先立って適切な緩衝液で平衡化され得る。
【0015】
更に他の実施形態において、本発明は、a)会合性基が固体支持体と相互作用するように、該固体支持体を該会合性基に接触させこと;b)該固体支持体を活性化すること;
c)タンパク質リガンドが該固体支持体に結合し、a)の該会合性基と相互作用するように、該固体支持体を該タンパク質リガンドに接触させること;を含む、該タンパク質リガンドを該固体支持体に連結する方法を提供する。
【0016】
ある更なる実施形態において、本発明は、a)帯電分子種がアガロース支持体と共有結合で反応するように、該アガロース支持体を該帯電分子種に接触させること;b)該アガロース支持体を活性化基で活性化すること;
c)プロテインAが該固体支持体に共有結合し、a)の該帯電分子種と非共有結合的に相互作用するように、該アガロース支持体を該プロテインAに接触させること;を含む、該プロテインAをアガロース支持体に連結する方法を提供する。
【0017】
更に他の実施形態において、本発明は、a)アガロース支持体;b)該アガロース支持体に共有結合的に結合したプロテインA;c)固体支持体と共有結合的に結合し、該プロテインAと非共有結合的に相互作用する帯電分子種を含む、アフィニティークロマトグラフィーマトリックスを提供する。
【0018】
更に他の実施形態において、本発明は、アガロース・ビーズの表面に結合したタンパク質リガンドの少なくとも10g/Lを含む、アガロース・ビーズを提供する。該タンパク質リガンド(例えば、プロテインA,プロテインG)は親和性リガンドとして働き得、従って、標的分子(例えば、関心のあるタンパク質)の特異的結合相手であり得る。
【0019】
いくつかの実施形態において、タンパク質リガンドは、介在性リンカーなしに、活性化された官能基を介して固体支持体に、例えば共有結合的に結合する。該タンパク質リガンドは、いずれかの介在性リンカー分子によりにまたは介在性リンカー分子なしに、該固体支持体に明確な共有結合を介して共有結合的に結合する1つ以上の会合性基と非共有結合的に相互作用し得る。従って、ある実施形態において、本発明は固体支持体に結合したリンカーを利用しない会合性基を提供する。ある実施形態において、本発明は固体支持体に結合したリンカーを利用しないタンパク質リガンドを提供する。ある実施形態において、会合性基およびタンパク質リガンドはそれぞれ固体支持体に共有結合を介して別個に結合される。
【0020】
他の実施形態において、タンパク質リガンドは、介在性リンカー分子を有する活性化された官能基を介して、固体支持体に、例えば共有結合的に、結合する。該タンパク質リガンドは、いずれかの介在性リンカー分子なしに、該固体支持体に共有結合的に結合している1つ以上の会合性基と非共有結合的に相互作用し得る。従って、ある実施形態において、本発明は、固体支持体に連結したリンカーを利用しない会合性基および該固体支持体に連結したリンカーを利用するタンパク質リガンドを提供する。
【0021】
他の実施形態において、本発明は、固体支持体に連結した会合性基および該固体支持体(そこでは、該会合性基および該タンパク質リガンドのいくつかの部分集団がリンカーを介して該固体支持体に連結している。)に連結したタンパク質リガンドを提供する。該タンパク質リガンドのいくつかの集団は、リンカーを介して該固体支持体に連結され得、または該会合性基のいくつかの集団は、該リンカーを介して該固体支持体に連結され得る。いくつかの実施形態において、会合性基およびタンパク質リガンドは両方とも、異なるリンカーを介して固体支持体に連結される集団を有し得る。
【0022】
更に他の実施形態において、本発明は、例えば共有結合によって、固体支持体に連結したリンカーを利用した会合性基を提供する。該会合性基は、いずれかの介在性リンカー分子なしで、該固体支持体に共有結合したタンパク質リガンドと例えば非共有結合的に相互作用し得る。
【0023】
本発明の更なる目的及び利点は、一部は以下の記述において説明され、一部は記述から明らかであり、または本発明の実施によって確認され得る。本発明の目的及び利点は、添付の請求項において具体的に指摘した要素および組み合わせによって理解され達成され得る。
【0024】
先述の一般的な説明及び以下の詳細な説明は単に典型的で、説明のためのものであり、請求した本発明を制限するものでない。
【0025】
(発明の説明)
固体支持体ヘのリガンドのカップリング方法
ある実施形態において、本発明はタンパク質リガンドをクロマトグラフィー媒体などの予め形成された固体支持体へカップリング(例えば、リガンドを利用するカップリング)する方法を提供する。この方法では、該タンパク質リガンドを共有結合的に結合する活性化剤および該タンパク質リガンドと非共有結合的に相互作用し、該タンパク質リガンドと該活性化剤の間の共有結合の形成を容易にする会合性基が両方とも、別個で明確な反応によって該固体支持体に連結され、該活性化剤および該会合性基は、それらを該固体支持体に共有結合的に結合する該反応に先立って連結されない。この方法は、a)該会合性基を該固体支持体と反応させることb)該固体支持体を活性化することおよびc)タンパク質リガンドを該固体支持体に連結することを含み得る。ある実施形態において、該会合性基および該タンパク質リガンドは両方とも該固体支持体に共有結合的に結合され得るが、該固体支持体を介する以外、お互いに共有結合的に結合されない。該会合性基および該活性化剤は、該固体支持体の外表面に共有結合的に結合され得る。該タンパク質リガンドは、該固体支持体に結合される該活性化剤に共有結合され得る。該会合性基は、該タンパク質リガンドと、例えば非共有結合的に相互作用し得、従って該タンパク質リガンドと該固体支持体の外表面に共有結合的に結合されている該活性化剤の間の共有結合の形成を容易にする。該タンパク質リガンドおよび該会合性基は両方とも、該固体支持体の内表面および微細孔に接近して結合し得ることが意図されている。
【0026】
段階a)およびb)が任意の順序で実施され得ることが認識されよう。従っていくつかの実施形態において、本発明は、会合性基およびタンパク質リガンドを固体支持体に連結するために使用され得る2段階反応を提供する。段階a)からc)を独立して実施することは、該会合性基、該タンパク質リガンドおよび該固体支持体の選択における柔軟性および所望のアフィニティークロマトグラフィーを実施するための条件の最適化を可能にする該タンパク質リガンドに対する該会合性基の比の制御を含む多数の利点を提供する。これは、必然的に該タンパク質リガンドおよび該会合性基の1:1の比をもたらす、例えばリンカーを利用するカップリングなどの該タンパク質リガンドを該固体支持体にカップリングする先述の方法と対照的である。
【0027】
先述の方法において、該活性化剤および該会合性基は、該固体支持体に結合される前にお互いに共有結合的に連結されるかまたは、該固体支持体を形成する重合反応の一部として該固体支持体の中に直接組み込まれる。これらの方法は、柔軟性に乏しく、およびリガンド密度の制御は至適以下である。ランダムカップリングまたは多点取り付けなどの他の先述の方法は、タンパク質リガンド中の利用できる任意のアミン基に依存する。多点取り付けは、柔軟性または固体支持体へのタンパク質リガンドのカップリングの制御に乏しい。
【0028】
本発明による更なる利点は、2つ以上の異なる会合性基の使用および/または2つ以上のタンパク質リガンドの使用を含む。更に他の利点は、リガンド密度を厳重に制御し、動的容量、静的容量または両方を最適化する能力を含む。更に他の利点は、マトリックス上の望まない不純物の非特異的結合の量を制限することを提供する。非特異的結合は、所望のタンパク質リガンドを連結する能力のあるアミンを含む化学種などの化学種で固体支持体を被覆することに依存する先述の方法に対して特別な問題である。本発明によって提供されるリガンド密度の制御は、これらの先述の方法に見られる非特異的結合の高いレベルを避ける。
【0029】
従って、固体支持体への会合性基および活性化剤を結合するための反応のアンカップリングによって、本発明は、該活性化剤および該会合性基の両方の濃度比のより良好な制御を提供し、それによって、標的タンパク質の単離のための、例えばpH,緩衝液中の塩濃度などのクロマトグラフィーの条件の良好な制御および調整を提供する。従って、ある実施形態において、本発明は、タンパク質リガンドおよび会合性基の比の多様性を意図し、該タンパク質リガンド濃度が該会合性基を上回る比および該会合性基の濃度が該タンパク質リガンド濃度を上回る比を含む。本発明の多様な実施形態において複数の異なる会合性基が用いられ得ることが意図される。本複数の発明の多様な実施形態において、固体支持体を活性化するために複数の異なる活性化剤が使用され得ることも意図されている。同様に、本複数の発明の多様な実施形態において、複数の異なるタンパク質リガンドが使用され得ることも意図されている。
【0030】
本明細書で使用されるタンパク質リガンドは、固体支持体に結合され、関心のある標的分子を特異的に結合することに適しているタンパク質を意味する。タンパク質は、完全長のタンパク質、完全長のタンパク質の断片またはサブユニット、ポリペプチドまたはタンパク質のペプチド断片を含み得る。
【0031】
いくつかの実施形態において、本発明の方法は、固体支持体への高密度タンパク質リガンドのカップリングを提供する。これは同様に、例えば先述の方法と比べて、該標的分子の結合容量(例えば、静的容量(Qs)および動的容量(Qd))を増強する。1例として、先述の方法を用いて、通常、該固体支持体のmlあたりn−プロテインA(ブドウ球菌(スタフィロコッカス/Staphylococcus))4−6mgがロードされ得る。本発明の方法を用いて、固体支持体のmlあたりプロテインA7−100mgがロードされ得る。ある実施形態において、10mg/mlを超すプロテインAが固体支持体上にロードされ得る。他の実施形態において、少なくとも8mg/mlが固体支持体上にロードされ得る。本発明のいくつかの実施形態において、プロテインAを組み換えによる改変(例えば、システイン残基の添加により)またはリンカーを利用するカップリングへの依存のいずれもなしに、増強された静的容量および動的容量が達成される。
【0032】
ある実施形態において、本発明の方法は、固体支持体を、該固体支持体と反応する能力がある少なくとも1つの会合性基と接触させることを含む。該固体支持体はすでに形成されていてよい(例えば、少なくとも1つの会合性基と反応され得る重合された支持体)。他の実施形態において、固体支持体は前もって形成されていなくてよく(例えば、重合されていない)、会合性基は、化学構成要素に添加され、該化学構成要素は、ついで反応されて組み込まれた該会合性基を有する固体支持体を形成するようにしてよい。該固体支持体と該会合性基の間の反応は、該固体支持体と該会合性基の間の共有結合の形成をもたらし得る。該会合性基は、従って該固体支持体の外表面に共有結合的に結合され得、内表面、例えば微細孔に接近して結合され得る。
【0033】
会合性基を含む非共有結合的相互作用、例えばイオン相互作用、疎水性相互作用、ファンデアワールス力および水素結合もまた意図される。1例として該会合性基は、帯電分子、例えば、固体支持体に共有結合的に取り付けられているポリマー、と非共有結合的に相互作用し得る。この会合性基はまた、タンパク質リガンドと相互作用し得る。従って該固体支持体は、該タンパク質リガンドが該固体支持体と共有結合的に結合し、該会合性基と非共有結合的に相互作用するように活性化され得る。従って。該非共有結合相互作用は、該タンパク質リガンドの該固体支持体への共有結合を容易にし得る。
【0034】
いくつかの実施形態において、会合性基は、いずれかの介入分子または連結分子を必要とせずに、固体支持体と直接反応し得る。他の実施形態において、会合性基は、該会合性基の第一の集団が固体支持体と直接反応し、該会合性基の第二の集団が1つ以上のリンカー分子を介して該固体支持体と間接的に反応する混合物として提供され得る。更に、該会合性基は、リンカー分子を用いた活性化によって修飾され得、それによって、少なくともいくつかの会合性基はリンカー分子の中に組み込まれ、他方、いくつかの会合性基は該固体支持体に、例えば共有結合で直接反応することが可能となる。ある化学反応の性質のために、タンパク質リガンドと非共有結合的に相互作用するように設計された該会合性基は該活性化基と反応し得、従って、該会合性基および該活性化基の両方を含むリンカーアームを通して、該タンパク質リガンドを該固体支持体に最終的にカップリングする。しかし、これらの活性化反応は、該固体支持体および該会合性基の両方を修飾し、タンパク質のカップリング位置の分布を生じる。これらの位置の1つの集団は、該会合性基を通して(CNBrで活性化された第二級アミンの場合のように)該固体支持体に連結された活性化された基を含む。カップリング位置が、ベースマトリックスに直接取り付けられた活性化された基および修飾されていない会合性基(残りの修飾されていない第二級アミンを有するCNBrで活性化されたベースマトリックスの場合のように)からなる第二の集団が存在し得る。これは、「リンカーを利用するカップリング」(ここでは、ただ1つのカップリング位置の集団が存在し得る。)および「リガンドを利用するカップリング」(ここでは、カップリング位置の少なくとも2つの可変の集団が存在し得る。)の間の相違の1例である。会合性基および活性化基は、その種類、量および関与する基の反応性において独立に変化され得るために、広範囲のカップリング条件および形態が利用され得る。
【0035】
会合性基およびタンパク質リガンドの間のすべての非共有結合相互作用が意図される。該タンパク質リガンドとの非共有結合相互作用は、例えばイオン相互作用、疎水性相互作用、水素結合を介する相互作用またはファンデアワールス力を含み得る。
【0036】
1つの実施形態において、会合性基およびタンパク質リガンドの間の相互作用はイオン性であり得る。例えば、正に帯電した会合性基は、固体支持体に結合され得る。該固体支持体は、ついで、該タンパク質リガンドの該固体支持体への化学結合(例えば、共有結合)を容易にし得る化学官能性によって活性化され得る。該タンパク質リガンドを含む溶液のpHは、該タンパク質が、該固体支持体に会合した該会合性基の電荷と相補的な電荷、例えば少なくとも1つの負電荷または正味の負電荷を有するように調整され得る。該固体支持体に結合した正に帯電した該会合性基および負に帯電した該タンパク質間の相互作用は、該タンパク質リガンドの該活性化された固体支持体への結合を容易にし、従って、先述の方法に比べて、増強された結合容量を提供する。帯電分子種は、イオンであるか、または正味の電荷を有する分子であり得る。
【0037】
タンパク質リガンドを固体支持体にカップリングするための適切な緩衝液の条件を選ぶことは、十分当業者の能力の範囲内である。適した緩衝液は、炭酸塩、重炭酸塩、リン酸塩および酢酸緩衝液などのアミンを含まない任意の緩衝液を含む。該緩衝液の塩濃度は、使用する会合性基に依存し得る。1例として、該塩濃度は、5nM−100nMの範囲であり得る。帯電した分子種が用いられる場合、該塩濃度は、少なくとも5nM、ただし0.1M未満、少なくとも5nM、ただし0.01M未満、少なくとも5nM、ただし0.001M未満であり得る。ある実施形態において、該塩濃度は、0.01Mであり得る。疎水性分子種が用いられる場合は、高塩濃度が望ましい。従って、該塩濃度は、0.001Mより多く、0.01Mより多く、0.1Mより多くてよい。
【0038】
本発明の方法は、0℃から99℃の範囲の温度で実施し得る。ある実施形態において、該方法は、60℃未満、40℃未満、20℃未満、10℃未満の温度で実施され得る。いくつかの実施形態において、本発明の方法は、4℃の温度で実施され得る。他の実施形態において、本発明の方法は、20℃の温度で実施され得る。
【0039】
会合性基
本発明における使用に適した会合性基は、イオン化学種などの帯電分子種および疎水性分子種などの非帯電分子種を含む。該会合性基は、例えば、固体支持体に直接共有結合的に結合することによって、該固体支持体を修飾し得る。イオン化学種の適した例は、第4級アミン、第3級アミン、第2級アミン、第1級アミン、スルホン酸、カルボン酸またはそれらの任意の組み合わせを含み得る。疎水性分子種の適した例は、フェニル基、ブチル基、プロピル基またはそれらの任意の組み合わせを含み得る。また、混合状態の分子種、例えば、帯電分子種および疎水性分子種の混合物、が用いられ得る。該会合性基はまた、タンパク質リガンドと相互作用し得る。従って、該会合性基および該タンパク質リガンドの間の相互作用は、相互作用の混合で構成され得る(例えばイオン性および疎水性分子種)。
【0040】
該会合性基は、該固体支持体上の官能基を該会合性基上の官能基と反応させて該固体支持体に共有結合的に連結され得る。適した官能基は、アミン、ヒドロキシ、スルフヒドリル、カルボキシル、イミン、アルデヒド、ケトン、アルケン、アルキン、アゾ、ニトリル、エポキシド、シアンおよび活性化されたカルボン酸基を含むが、これらに限定されない。1例として、アガロース・ビーズは、グリシジルトリメチルアンモニウムクロリドなどの正に帯電した会合性基のエポキシド官能基と反応され得るヒドロキシ基を含む。当業者は、少なくとも1つの2官能性会合性基が用いられるならば、複数の会合性基が該固体支持体に連結され得ることを認識するであろう。従って、該会合性基は、該固体支持体に直列に結合され得、またはそれらは個別に該固体支持体に直接結合されてよい。
【0041】
タンパク質リガンドおよび標的分子
それが、関心のある標的分子の特異的結合相手であれば、本発明の実施において、任意のタンパク質リガンドが用いられ得る。タンパク質リガンドの例は、プロテインA,プロテインG,抗体のFc受容体、ホルモンまたは成長因子の受容体を含み得る。該タンパク質リガンドは、例えばIgG、IgM、IgA、IgD、IgEなどの免疫グロブリンまたはその断片であり得る。断片は、標的抗原の抗原決定基および/またはFc受容体および/またはプロテインAおよび/またはプロテインGを結合する能力を保持している免疫グロブリン断片を含み得る。該タンパク質リガンドは、Fc分子またはその断片であり得る;Fabなど;酵素、例えばグルタチオントランスフェラーゼ、チロシンキナーゼ、例えば、MAP,Src、Lck;基剤、例えばグルタチオン。該タンパク質リガンドは、例えば1つ以上のヒスチジンを含むポリペプチドなどのタンパク質タグであり得る。該タンパク質リガンドは、Embrel(登録商標)などの融合タンパク質であり得る。該タンパク質リガンドは、転写因子、逆転写酵素、トポイソメラーゼ、ヘリカーゼなどの核酸結合タンパク質であり得る。標的分子が、受容体である場合は、そのリガンド、例えば成長因子、は本発明の方法において該タンパク質リガンドとして働き得る。該標的分子が、免疫グロブリン、例えばIgG、またはFc領域の少なくとの1部を含むその断片である場合、該タンパク質リガンドは、プロテインA、プロテインGまたはその機能性断片であり得る。その機能性断片は、IgGのFc領域またはFc断片に結合する能力を保持しているプロテインA断片またはプロテインG断片を含み得る。
【0042】
タンパク質リガンドは、天然起源の分子または設計された分子であり得る。ある実施形態において、固体支持体への結合または該固体支持体上での該タンパク質リガンドの配向のいずれかまたは両方を容易にするために、天然起源の該タンパク質リガンドを遺伝学的に改変することが望ましい場合がある。従って、用いられる会合性基に応じて、当業者は帯電基または疎水基または両方を該タンパク質リガンドの中に設計し得る。これらの改変は、該タンパク質リガンド内のどこででもなされ得る。
【0043】
タンパク質リガンドが、プロテインAである場合、本発明は、n−プロテインA(天然起源)が用いられる場合、50mg/mlより大きい静的結合容量Qsを与え、r−プロテインA(組み換えプロテインA)が用いられる場合、65mg/mlより大きい静的結合容量Qsを与える。該組み換えプロテインAは、末端システイン以外の修飾を含み得る。
【0044】
固体支持体、例えばビーズが溶液中に提供されている場合、タンパク質リガンドの適した濃度は、該固体支持体の0.05−700μmols/ml、該固体支持体の0.1−100μmols/mlの範囲であり得る。
【0045】
標的分子は、選択されるタンパク質リガンドに特異的に結合する任意の分子を含み得る。該タンパク質リガンドが、プロテインAまたはプロテインGである場合、該標的分子は、IgGサブクラスの免疫グロブリンを含み得る。該標的分子の具体的な例は、モノクロナール抗体を含み得る。免疫グロブリンの断片もまた、それらが選択される該タンパク質リガンドに結合する能力を保持するならば意図される。該標的分子はまた、Embrel(登録商標)などのFc融合タンパク質を含む融合タンパク質であり得る。
【0046】
固体支持体および活性化剤
任意の多孔性物質が、固体支持体として用いられ得る。一例として、該多孔性物質は、膜、ゲル、カセット、カラム、チップ、スライド、プレートまたはモノリスの形をとり得るが、これらに限定されない。
【0047】
該多孔性物質は、有機または無機の分子または有機または無機の分子の混合物から構成され得、および、会合性基、活性化基のいずれかまたは両方と例えば共有結合を形成する、例えばヒドロキシ基などの、反応に適した1つ以上の官能基から構成され得る。該多孔性物質は、親水性化合物、疎水性化合物、疎油性化合物、親油性化合物またはそれらの任意の組み合わせであり得る。該多孔性物質は、ポリマーまたはコポリマーから構成され得る。
【0048】
適した多孔性物質は、ポリエーテルスルホン、ポリアミド(例えば、アガロース)、セルロース、ポリサッカライド、ポリテトラフルオロエチレン、ポリスルホン、ポリエステル、ポリビニリデンフルオライド、ポリプロピレン、フルオロカーボン(例えば、ポリ(テトラフルオロエチレンーコーパーフルオロ(アルキルビニルエーテル))、ポリカーボネート、ポリエチレン、ガラス、ポリカーボネート、ポリアクリレート、ポリアクリルアミド、ポリ(アゾラクトン)、ポリスチレン、セラミック、ナイロンおよび金属を含むが、これらに限定されない。
【0049】
固体支持体は適切な化学官能基で活性化され得る。適した化学官能基は、シアン(例えば臭化シアン)、アルデヒド、エポキシドおよび活性化されたカルボン酸(例えば、N−ヒドロキシスクシンイミドエステル)またはそれらの任意の組み合わせを含み得る。替わりに、会合性基が、第一級、第二級、第三級アミンである場合、該会合性基は、エピクロルヒドリンまたは2官能性エポキシドで活性化され得る。
【0050】
リンカー
いくつかの実施形態において、本発明は、介入リンカーを介して固体支持体に連結され得る会合性基および/またはタンパク質リガンドを提供する。該リンカーは、リンキング部分に連結した少なくとも1つの官能基を含み得る。該連結部分は、官能基に連結され得る任意の分子を含み得る。従って、該連結部分は任意のアルキル、アルケニルまたはアルキニル基を含み得る。該連結部分は、1から30の範囲の炭素原子を含み得る。いくつかの実施形態において、リンカーは30を超す炭素原子で構成され得る。連結部分は、窒素、酸素および硫黄などの少なくとも1つのヘテロ原子を含み得る。該連結部分は、分枝鎖、非分枝鎖または環状鎖で構成され得る。該連結部分は、2つ以上の官能基で置換され得る。1つの特別な実施形態において、該リンカーはヒドロキシ基を介してアガロースに取り付けられた次の式の化合物を含み得る。
CH2CH2N(CH2CH3)CH2CH(OH)CH2O(CH2)4OCH2CH(O)CH2
【0051】
標的分子の精製法
ある実施形態において、本発明は、混合物からの標的分子の精製法を提供する。該標的分子は、特異的結合相手が、固体支持体に連結され得るならば、該特異的結合相手を有する任意の分子であり得る。該標的分子の例は、免疫グロブリンなどのタンパク質を含み得る。該免疫グロブリンは、ポリクロナール抗体またはモノクロナール抗体またはその機能的断片であり得る。該機能的断片は、その抗原になお特異的に結合し、一方で、同時に固体支持体に連結したタンパク質リガンドに特異的に結合する能力を保持している可変領域を含む免疫グロブリンの任意の断片を含み得る。
【0052】
ある実施形態において、その方法は、a)条件の第一の組の下で、本発明の固体支持体(本明細書に記述した)を標的分子を含む混合物に、標的分子が、固体支持体にカップルしたタンパク質リガンドに結合するように、接触させること、およびb)該標的分子が親和性リガンドにもはや結合しないように、条件を変更することを含む。ある実施形態において、その方法は、段階a)およびb)の間のpHを変えることを含む。ある実施形態において、段階b)は段階a)のpHよりも酸性であるpHで行い得る。ある実施形態において、段階b)はpHを変えることを含む。従って段階a)は、中性のpH、即ち6−8の範囲のpHで実施され得、段階b)は、酸性のpH、例えば1−6の範囲のpHで実施され得る。他の実施形態において、その方法は、該緩衝液の塩濃度を変えることを含む。従って、1つの実施形態において、段階a)において、例えば、>0.1Mの高い塩濃度が使用され得、および/または段階b)において、例えば、<0.1Mの低い塩濃度が使用され得る。他の実施形態において、段階a)において、例えば、<0.1Mの低い塩濃度が使用され得、および/または段階b)において、高い塩濃度が使用され得る。さらに他の実施形態において、該緩衝液の該pHおよび/または塩濃度は、段階a)およびb)の間で変えられ得る。
【0053】
1.クロマトグラフィーマトリックスの中間洗浄
ある実施形態において、本発明はまた、非特異的に結合した不純物を除去し、従ってより純粋な最終製品を得るためのクロマトグラフィーマトリックスの洗浄方法を提供する。マトリックスは、当分野で知られている任意のクロマトグラフィーマトリックスを含み得る。1例として、該クロマトグラフィーマトリックスは親和性マトリックスであり得る。該親和性マトリックスは、リガンドを利用するカップリングで作られる親和性マトリックスを含む本明細書に記述する親和性マトリックスのいずれかであり得る。該方法は、該標的分子が該クロマトグラフィーマトリックスに結合後に実施される中間洗浄を含み得る。通常、非特異的に吸着された不純物は、標的化合物または製品を除く任意の成分を含み得る。非特異的に結合した不純物の例は、タンパク質、DNA,脂質、エンドトキシン、ウイルス粒子およびフェノール赤、ペプトン、フルロニックF68,アミノ酸を含む他の小分子を含み得る。
【0054】
中間洗浄剤は、平衡化緩衝液またはフィード(即ち、未精製試料を含む溶液)と類似したpHおよび塩濃度を有する緩衝液、および更に、a)高い塩濃度(例えば、塩化ナトリウム、塩化アンモニウム、硫酸ナトリウム、塩化カリウム、硫酸アンモニウムなど)、またはb)異なるpH(低いまたは高い)、またはc)a)およびb)の組み合わせ、またはd)例えば、界面活性剤(例えば、Tween)、アミノ酸およびその誘導体または有機溶質(例えば、エチレングリコール)を含む緩衝液を含み得る。中間洗浄は、PBSなどの洗浄溶液と比べてある化学種の非特異的結合を2−5倍低下し得る。ある実施形態において、PBSなどの知られている洗浄溶液と比べて、ある化学種の非特異的結合の5倍を超す低下が達成される。
【0055】
ある実施形態において、本発明は、相溶性マトリックスを、僅かに塩基性pH(例えば、7.3−7.5)および0−1Mの範囲の補充塩濃度を有する緩衝液と接触させることを含む、非特異的結合分子種を除去するための相溶性マトリックスを洗浄する方法を提供する。従って、該緩衝液はPBSまたは追加の塩でさらに補充された、他の任意の緩衝液であり得る。いくつかの実施形態において、該塩濃度は、0.15M−1Mの範囲である。更に他の実施形態において、該塩濃度は0.25M−1Mの範囲である。更に他の実施形態において、該塩濃度は、0.25M−0.5Mの範囲である。
いくつかの実施形態において、該塩濃度は、0.0001Mより多いが、0.8M未満である。
【0056】
他の実施形態において、例えばPBSまたは任意の他の適した緩衝液は、酸性のpH(例えば、6.5)および1M未満であるが、0.0001M(例えば、0.4M)より多い、補充された塩濃度を有し得る。更に他の実施形態において、洗浄緩衝液は、僅かに塩基性のpH(例えば、7.3−7.5)を有し得る。いくつかの実施形態において、洗浄緩衝液は、1つ以上の帯電したアミノ酸を含み得る。洗浄緩衝液は、ベタイン、L−アラニン、グリシン、バリン、グルタミン酸およびリジンを含むアミノ酸またはアルキル化アミノ酸を含み得る。該アミノ酸またはアルキル化アミノ酸は、0.25−0.5Mの濃度の範囲で存在し得る。ある実施形態において、アミノ酸またはアルキル化アミノ酸の濃度は、0.5M未満、ただし0.0001Mより多い。更に他の実施形態において、アミノ酸またはアルキル化アミノ酸の濃度は、0.0001Mから1Mの範囲であり得る。中間洗浄緩衝液に用いられ得る、適したアミノ酸は、グリシン、バリン、リジン、アルギニン、アスパラギン酸、グルタミン酸ならびにn−メチルグリシンおよびトリメチルβ−アラニンなどのアミノ酸誘導体を含むが、これらに限定されない。中間洗浄緩衝液が、アミノ酸またはアミノ酸誘導体で補充されている緩衝液を含むある実施形態において、該緩衝液は、僅かに酸性のpH(例えば、6.0−6.99の範囲内)を有し得る。
【図面の簡単な説明】
【0057】
【図1】プロテインAを含む各種のアフィニティークロマトグラフィー媒体の動的および静的容量を示すグラフである。
【図2】会合性基と連結したおよび会合性基と連結していない各種クロマトグラフィー媒体の結合容量を比較したグラフおよび本発明によるリンカーを利用するプロテインAのカップリング方法である。
【図3】溶出プールにおいて測定されたCHO細胞タンパク質(CHOP)レベルを示すグラフおよび中間の塩緩衝液の洗浄ありまたはなしでの、会合性基の異なる量での、宿主細胞タンパク質の媒体への結合も示す。IgGの回収はすべて類似し、〜90−95%であった。
【図4a】中間の塩洗浄を実施することによる、リガンドを利用するカップリング化学を介して作られたプロテインA媒体からの溶出プールにおける宿主細胞タンパク質レベルの減少を示すグラフである。
【図4b】図4b中間の塩洗浄を実施することによる、リガンドを利用するカップリング化学を介して作られたプロテインA媒体からの溶出プールにおけるDNAレベルの減少を示すグラフである。
【図5】異なるpHおよび塩濃度の緩衝液を用いる中間洗浄を実施することによる、リガンドを利用するカップリング化学を介して作られたプロテインA媒体からの溶出プールにおける宿主細胞タンパク質レベルの減少を示すグラフである。
【図6a】アラニンまたはベタインを含む緩衝液を用いる中間洗浄を実施することによる、リガンドを利用するカップリング化学を介して作られたプロテインA媒体からの溶出プールにおける宿主細胞タンパク質レベルの減少を示すグラフである。
【図6b】各種アミノ酸を含む緩衝液を用いる中間洗浄を実施することによる、リガンドを利用するカップリング化学を介して作られたプロテインA媒体からの溶出プールにおける宿主細胞タンパク質レベルの減少を示すグラフである。
【0058】
(実施例)
【実施例1】
【0059】
第4級アミンリガンド、臭化シアンおよびn−プロテインA(14mg/ml)を用いるリガンドを利用するカップリング
アガロース・ビーズ(Sepharose 4B)(GE Healthcare,Piscataway NJ)を先述した方法(Porath and Fornstedt, 1970,J.Chromatography,51:479)に従って、エピクロルヒドリンを用いて架橋した。該アガロース・ビーズを次の方法に従って、正に帯電した会合性基(例えば、カチオン類)と反応させた:ビーズ100mLを75重量%のグリシジルトリメチルアンモニウムクロリド(GTMAC)100mLおよび50重量%の水酸化ナトリウム3.3gに加えた。反応溶液を室温で一晩回転振蕩器で激しく振蕩(>100rpm)した。ついで、該ビーズをろ過し、Milli−Q水(Millipore Corp,Billerica,MA)200mL容量で3回洗浄した。
【0060】
該ビーズ(10mL)をろ過し、ついで20mLの1MNa2CO3中で平衡化させた。試料を0.5gCNBr/mLのアセトニトリル溶液を含む第二の瓶と共に氷上で冷却した。該溶液が一旦冷却されると、該ビーズにCNBrのアセトニトリル溶液1.5mLを加え、該ビーズを氷上の振蕩器上に置いた(>100rpm)。2分後に、もう1つのCNBrのアセトニトリル溶液1.5mLを該ビーズに加え、該ビーズを再度氷上の振蕩器(>100rpm)上に置いた。該ビーズを4分間反応させ、ついで200mLの氷冷水および200mLの氷冷0.012MNaHCO3で洗浄し,濾過した。濾過ビーズケーキ(10mL)をn−プロテインA140mg(14mg/mL)を含む0.012MNaHCO310mLに加えた。該ビーズを一晩室温で振蕩した。該ビーズをついで、0.2MNaHCO3で洗浄し,濾過した。該ビーズケーキを、0.2MNaHCO3中の0.5Mのエタノールアミン20mLに加えた。30分後、該ビーズを0.2MNaHCO3,0.5MNaCl(pH4.5)を含む0.1M酢酸ナトリウムで洗浄し、ついで最後にリン酸塩緩衝食塩水で洗浄した。静的及び動的容量を下の実施例12に記述したように測定した。
【実施例2】
【0061】
第4級アミンリガンド、臭化シアンおよびn−プロテインA(17.8mg/ml)を用いるリガンドを利用するカップリング
アガロース・ビーズ(Sepharose 4B)(GE Healthcare, Piscataway NJ)を先述した方法(Porath and Fornstedt, 1970, J. Chromatography, 51 :479)に従って、エピクロルヒドリンを用いて架橋した。該アガロース・ビーズを次の方法に従って、正に帯電した会合性基(例えば、カチオン類)と反応させた:ビーズ100mLを75重量%のグリシジルトリメチルアンモニウムクロリド(GTMAC)100mLおよび50重量%の水酸化ナトリウム3.3gに加えた。反応溶液を室温で一晩回転振蕩器で激しく振蕩(>100rpm)した。ついで該ビーズをろ過し、Milli−Q水(Millipore Corp,Billerica,MA)200mL容量で3回洗浄した。
【0062】
該ビーズ(10mL)をろ過し、ついで20mLの1MNa2CO3中で平衡化させた。試料を0.5gCNBr/mLのアセトニトリル溶液を含む第二の瓶と共に氷上で冷却した。該溶液を冷却後、該ビーズにCNBrのアセトニトリル溶液1.5mLを加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。2分後に、もう1つのCNBrのアセトニトリル溶液1.5mLを該ビーズに加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。該ビーズを4分間反応させ、ついで200mLの氷冷水および200mLの氷冷0.012MNaHCO3で洗浄し,濾過した。濾過ビーズケーキ(10mL)をn−プロテインA285mg(17.8mg/mL)を含む0.012MNaHCO316mLに加えた。該ビーズを一晩室温で振蕩した。該ビーズをついで、0.2MNaHCO3で洗浄し,濾過した。該ビーズケーキを、0.2MNaHCO3中の0.5Mのエタノールアミン20mLに加えた。30分後、該ビーズを0.2MNaHCO3,0.5MNaCl(pH4.5)を含む0.1M酢酸ナトリウムで洗浄し、最後にリン酸塩緩衝食塩水で洗浄した。静的及び動的容量を下の実施例12に記述したように測定した。
【実施例3】
【0063】
第4級アミンリガンド、臭化シアンおよびr−プロテインAを用いるリガンドを利用するカップリング
アガロース・ビーズ(Sepharose 4B)(GE Healthcare,Piscataway,NJ)を先述した方法(Porath and Fornstedt, 1970,J.Chromatography,51:479)に従って、エピクロルヒドリンを用いて架橋した。該アガロース・ビーズを次の方法に従って、正に帯電した会合性基(例えば、カチオン類)と反応させた:ビーズ100mLを75重量%のグリシジルトリメチルアンモニウムクロリド(GTMAC)100mLおよび50重量%の水酸化ナトリウム3.3gに加えた。反応溶液を室温で一晩回転振蕩器で激しく振蕩(>100rpm)した。ついで該ビーズをろ過し、Milli−Q水200mL容量で3回洗浄した。
【0064】
該ビーズ(10mL)をろ過し、ついで20mLの1MNa2CO3中で平衡化させた。該試料を0.5gCNBr/mLのアセトニトリル溶液を含む第二の瓶と共に氷上で冷却した。該溶液を冷却後、該ビーズにCNBrのアセトニトリル溶液1.5mLを加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。2分後に、もう1つのCNBrのアセトニトリル溶液1.5mLを該ビーズに加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。該ビーズを4分間反応させ、ついで200mLの氷冷水および200mLの氷冷0.012MNaHCO3で洗浄し,濾過した。濾過ビーズケーキ(10mL)を市販のr−プロテインA250mg(25mg/mL)を含む0.012MNaHCO310mLに加えた。該ビーズを一晩室温で振蕩した。該ビーズを、ついで、0.2MNaHCO3で洗浄し,濾過した。該ビーズケーキを、0.2MNaHCO3中の0.5Mエタノールアミン20mLに加えた。30分後、該ビーズを0.2MNaHCO3,0.5MNaCl(pH4.5)を含む0.1M酢酸ナトリウムで洗浄し、最後にリン酸塩緩衝食塩水で洗浄した。静的及び動的容量を下の実施例12に記述したように測定した。
【実施例4】
【0065】
臭化シアンおよびn−プロテインA(17.8mg/ml)を用いる、第4級アミンリガンドを用いないリガンドを利用しないカップリング
アガロース・ビーズ(Sepharose 4B)(GE Healthcare,Piscataway,NJ)を先述した方法(Porath and Fornstedt,1970,J.Chromatography,51:479)に従って、エピクロルヒドリンを用いて架橋した。ついで、該ビーズをろ過し、Milli−Q水(Millipore Corp,Billerica,MA)200mL容量で3回洗浄した。
【0066】
該ビーズ(10mL)をろ過し、ついで20mLの1MNa2CO3中で平衡化させた。試料を0.5gCNBr/mLのアセトニトリル溶液を含む第二の瓶と共に氷上で冷却した。該溶液を冷却後、該ビーズにCNBrのアセトニトリル溶液1.5mLを加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。2分後に、もう1つのCNBrのアセトニトリル溶液1.5mLを該ビーズに加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。該ビーズを4分間反応させ、ついで200mLの氷冷水および200mLの氷冷0.012MNaHCO3で洗浄し,濾過した。濾過ビーズケーキ(10mL)をn−プロテインA285mg(17.8mg/mL)を含む0.012MNaHCO316mLに加えた。該ビーズを一晩室温で振蕩した。ついで、該ビーズを0.2MNaHCO3で洗浄し,濾過した。該ビーズケーキを、0.2MNaHCO3中の0.5Mのエタノールアミン20mLに加えた。30分後、該ビーズを0.2MNaHCO3,0.5MNaCl(pH4.5)を含む0.1M酢酸ナトリウムで洗浄し、最後にリン酸塩緩衝食塩水で洗浄した。静的及び動的容量を下の実施例12に記述したように測定した。
【実施例5】
【0067】
臭化シアンおよびn−プロテインAを用いる、第4級アミンリガンドを用いないリガンドを利用しないカップリング
アガロース・ビーズ(Sepharose 4B)(GE Healthcare,Piscataway,NJ)を先述した方法(Porath and Fornstedt,1970,J.Chromatography,51:479)に従って、エピクロルヒドリンを用いて架橋した。ついで該ビーズをろ過し、Milli−Q(登録商標)水(Millipore Corp,Billerica,MA)200mL容量で3回洗浄した。該ビーズ(10mL)をろ過し、ついで20mLの1MNa2CO3中で平衡化させた。試料を0.5gCNBr/mLのアセトニトリル溶液を含む第二の瓶と共に氷上で冷却した。該溶液を冷却後、該ビーズにCNBrのアセトニトリル溶液1.5mLを加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。2分後に、もう1つのCNBrのアセトニトリル溶液1.5mLを該ビーズに加え、該ビーズを氷上の振蕩器(>100rpm)上に置いた。該ビーズを4分間反応させ、ついで200mLの氷冷水および200mLの氷冷0.012MNaHCO3で洗浄し、濾過した。濾過ビーズケーキ(10mL)を市販のr−プロテインA250mg(25mg/mL)を含む0.012MNaHCO310mLに加えた。該ビーズを一晩室温で振蕩した。該ビーズをついで、0.2MNaHCO3で洗浄し,濾過した。該ビーズケーキを、0.2MNaHCO3中の0.5Mのエタノールアミン20mLに加えた。30分後、該ビーズを0.2MNaHCO3,0.5MNaCl(pH4.5)を含む0.1M酢酸ナトリウムで洗浄し、最後にリン酸塩緩衝食塩水で洗浄した。静的及び動的容量を下の実施例12に記述したように測定した。
【実施例6】
【0068】
第4級アミンリガンド、ブタンジオールジグリシジルエーテルおよびn−プロテインAを用いるリガンドを利用するカップリング
アガロース・ビーズ(Sepharose 4B) (GE Healthcare,Piscataway,NJ)を先述した方法(Porath and Fornstedt,1970,J.Chromatography,51:479)に従って、エピクロルヒドリンを用いて架橋した。該アガロース・ビーズを次の方法に従って、正に帯電した会合性基(例えば、カチオン類)と反応させた:ビーズ50mLを75重量%のグリシジルトリメチルアンモニウムクロリド(GTMAC)40g、10mLのMilli−Q水および50重量%の水酸化ナトリウム1.67gに加えた。反応液を室温で一晩回転振蕩器で激しく振蕩(>100rpm)した。ついで該ビーズをろ過し、Milli−Q(登録商標)水(Millipore Corp,Billerica,MA)100mL容量で3回洗浄した。ビーズの試料を下記のプロトコールを用いて滴定し、第4級アンモニウムリガンド密度を測定した。
【0069】
該ビーズ(50mL、濾過ケーキ)を4.6MのNaOH15mLを含む瓶に加えた。該混合物をスラリー化し、ついでブタンジオールジグリシジルエーテル(BUDGE)19.5mLを加えた。この混合物を35℃で2時間振蕩した。ついで、該ビーズをMilli−Q(登録商標)水(Millipore Corp,Billerica,MA)750mLで洗浄し、10mMNaHCO3250mLで平衡化させた。
【0070】
BUDGE活性化段階の直後、濾過ビーズケーキ10mLをn−プロテインA30g/L濃度を含む10mMNaHCO3の10mL溶液に加えた。該ビーズをハイブリダイザー中で37°℃で2時間回転した。2時間後、該ビーズを30mLのMilli−Q水(Millipore Corp,Billerica,MA)で洗浄した。該濾過ビーズケーキ(10mL)を、チオグリセロール1mLおよび0.2MのNaHCO3および0.5MのNaClを含む緩衝溶液9mLから構成された10mL溶液を含む瓶に加えた。該混合物をスラリー化し、室温で一晩回転した。ついで該ビーズを次の緩衝液30mLで洗浄した:0.1Mのトリス緩衝液(pH8)、0.15MのNaCl(pH8)を含む0.1Mのトリス緩衝液、50mMの酢酸(pH4.5)、0.002%のアジドナトリウムを含むPBS(pH7.4)。ついで該ビーズを標準曲線にn−プロテインAを用いる標準BCAアッセイ(Pierce,Rockford,IL)を用いて、記載した静的容量およびプロテインAリガンド密度について特性化した(下表1参照)。
【実施例7】
【0071】
第4級アミンリガンド、ブタンジオールジグリシジルエーテルおよびn−プロテインAを用いるリガンドを利用するカップリング
実施例7のビーズは、会合性基の添加を除いて実施例6に記述したビーズと同じである。アガロース・ビーズを次の方法に従って、正に帯電した会合性基(例えば、カチオン類)と反応させた:ビーズ50mLを75重量%のGTMAC25g、25mLのMilli−Q水および50重量%の水酸化ナトリウム1.67gに加えた。反応液を室温で一晩回転振蕩器上で激しく振蕩(>100rpm)した。ついで該ビーズをろ過し、Milli−Q(登録商標)水(Millipore Corp,Billerica,MA)100mL容量で3回洗浄した。次の段階(BUDGE活性化およびプロテインAカップリング)はすべて実施例6に記載したのと同じであった。ついで該ビーズを標準曲線にn−プロテインAを用いる標準BCAアッセイ(Pierce,Rockford,IL)を用いて、記載した静的容量およびプロテインAリガンド密度について特性化した(下表1参照)。
【実施例8】
【0072】
第4級アミンリガンド、ブタンジオールジグリシジルエーテルおよびn−プロテインAを用いるリガンドを利用するカップリング
実施例8のビーズは、会合性基の添加を除いて実施例6に記述したビーズと同じである。アガロース・ビーズ次の方法に従って、正に帯電した会合性基(例えば、カチオン類)と反応させた:ビーズ50mLを75重量%のGTMAC10g、40mLのMilli−Q水(Millipore Corp,Billerica,MA)および50重量%の水酸化ナトリウム1.67gに加えた。反応液を室温で一晩回転振蕩器上で激しく振蕩(>100rpm)した。ついで該ビーズをろ過し、Milli−Q(登録商標)水(Millipore Corp,Billerica,MA)100mL容量で3回洗浄した。次の段階(BUDGE活性化およびプロテインAカップリング)はすべて実施例6に記載したのと同じであった。ついで該ビーズを標準曲線にn−プロテインAを用いる標準BCAアッセイ(Pierce,Rockford,IL)を用いて、記載した静的容量およびプロテインAリガンド密度について特性化した(下表1参照)
【0073】
【表1】

【実施例9】
【0074】
CPG上で第4級アミンリガンド、エピクロルヒドリンおよびn−プロテインAを用いるリガンドを利用するカップリング
プロテインAを会合性基を用いてCPGにカップルするために、Controlled pore glass(CPG)(Millipore Corp,Billerica,MA)LCA−CPG1000Aを用いた。LCA−CPG(10mL)を、50%重量のグリシジルトリメチルアンモニウムクロリドを含む10mLの水溶液に加えた。反応液を30℃で一晩軽く(<100rpm)振蕩した。ついで、該CPGを50mLのMilli−Q(登録商標)水(Millipore Corp,Billerica,MA)で洗浄し、濾過して乾燥ケーキを得た。該CPGを30℃で2時間軽く振蕩したエピクロルヒドリンの水溶液35mLに加えた。該ビーズを100mLのMilli−Q(登録商標)水(Millipore Corp,Billerica,MA)で洗浄し、ついで濾過し、乾燥ケーキを得た。該ビーズ(5mL)をn−プロテインA15mg/mL濃度を含む0.01MNaHCO35mLに加えた。カップリング反応液を35℃で一晩軽く振蕩した。ついで、該ビーズを100mLのMilli−Q(登録商標)水(Millipore Corp,Billerica,MA)で洗浄し、ついで濾過して、乾燥ケーキを得た。ついで、該ビーズをpH8の0.1Mのトリス緩衝液中の1Mのエタノールアミン10mLに加えた。該反応を1時間行い、ついで該ビーズを0.2MNaHCO3,0.5MNaCl(pH4.5)を含む0.1M酢酸ナトリウムそれぞれ50mLで洗浄し、ついで、最終的にリン酸塩緩衝食塩水で洗浄した。先述したように該静的容量を測定し、結果を表2に示す。該会合性基の濃度は、元素分析により測定した。
【実施例10】
【0075】
CPG上で第4級アミンリガンド、エピクロルヒドリンを用いないプロテインAのリガンドカップリング
プロテインAを会合性基を用いないでCPGに連結するために、Controlled pore glass(CPG)(Millipore Corp,Billerica,MA)ProsSep5−CHO1000Aを用いた。該5−CHOビーズ(5mL)をn−プロテインA15mg/mL濃度含む0.01MのNaHCO35mLに加えた。カップリング反応液を35℃で一晩軽く(<100rpm)振蕩した。ついで、該ビーズをMilli−Q(登録商標)水(Millipore Corp,Billerica,MA)100mLで洗浄し、ついで濾過し、乾燥ケーキを得た。ついで、該ビーズをpH8の0.1Mのトリス緩衝液中の1Mのエタノールアミン10mLに加えた。反応を1時間行い、ついで該ビーズを0.2MNaHCO3,0.5MNaCl(pH4.5)を含む0.1M酢酸ナトリウムそれぞれ50mlで洗浄し、ついで最終的にリン酸塩緩衝食塩水で洗浄した。先述した該静的容量を測定し、結果を表2に示す。該会合性基の濃度は元素分析により測定した。
【0076】
【表2】

【実施例11】
【0077】
会合性基濃度の測定:第四級アミンリガンドの滴定
第四級アミンリガンド密度を酸塩基滴定を用いて測定した。ビーズの試料1mLを使い捨てプラスチックカラムに置き、ついで、Milli−Q(登録商標)水(10mL)(Millipore Corp,Billerica,MA)および1MNaCl(10mL)で平衡化させた。ついで該ビーズをMilli−Q(登録商標)水(10mL)(Millipore Corp,Billerica,MA)4mLで洗浄し、濾過して湿ったビーズケーキを得た。該ビーズを攪拌棒を備えた小さなビーカー中の1MNaCl80mLに加えた。ビーカにpH計を置いた。該試料を0.01MHClで滴定した。対照として強アニオン交換ビーズ(Q−Sepharose FF)を用いた。実施例6−8のデータを下表1に示す。結果は驚くべきことに、低会合性基密度および対応する低リガンド密度は、市販の代替物および替わりの実験条件の両方と比較して、より優れた静的容量を与えることを示す。
【実施例12】
【0078】
IgGの静的および動的容量の測定
上記の実施例に記述した製品それぞれの静的または飽和容量および商業的標準を次の方法を用いて測定した:
1.PBS緩衝液中の各試料からビーズ懸濁液(20%ビーズ)を作成した。
2.該ビーズ懸濁液を攪拌し、500μL試料を15mLの3つの円錐プラスチック管にピペットで採った。
3.PBS中のタンパク質溶液(IgG)(1mg/mL)を各管(14mL)に加えた。
4.該管に栓をし、オービタルシェーカーでゆっくり(<100rpm)と振蕩した。
5.24時間後、該ビーズを安定させ、結合後該溶液のUV測定をした。
6.該UV吸収をIgG濃度に変換し(ε−1.38)、物質収支を用いて飽和容量を測定した。
【0079】
プロテインA媒体をOmnifitカラム(0.66cm直径、7cm床高さ)にロードし、ポリクロナールにヒト免疫グロブリン(IgG)の動的結合容量を試験した。該カラムをPBS緩衝液(pH7.4)で平衡化させ、該タンパク質(1g/L)を同じ緩衝液を用いてカラムに装填した。10%破過点における容量を用いて、異なる媒体を比較した。図1は、IgGの静的および動的容量が如何に2つの市販の標準, Mabselect(登録商標) and Mabselect Xtra(登録商標)(GE Healthcare,Piscataway,NJ)及び実施例1−3の製品を比較するかを示す。実施例2−5の結果を図2に示す。表は実施例6−8の静的容量を示す。表2は実施例9−10の静的容量を示す。
【実施例13】
【0080】
中間洗浄を用いて、および用いずに、異なる結合リガンド密度に対するIgG溶出プールにおける宿主細胞タンパク質(HCP)レベル
モデルHCPフィードストックとして、精製したモノクロナール抗体(mAb)、血清を含まぬCHO培地(Angel Biotechnology,Northumberland,UK)を用いた。リン酸塩緩衝食塩水(PBS1 pH 7.4−7.5,伝導率15−17mS/cm)溶液の10カラム容量(CV)で平衡化させた後、該フィードの20CVを実施例6−8に記述した該プロテインA媒体を充填したカラム(内径0.66cm、長さ7cm)にロードした。ついで該カラムをPBSの10CVまたは1MNaCIを補充したPBSの8CV(pH 7.4−7.5)で洗浄し、ついで補充されていない PBS(pH 7.4−7.5)の2CVで洗浄した。ついで、0.1Mクエン酸ナトリウム(pH3)溶出緩衝液の10CVで洗浄した。0.5から5.5CVのピーク画分を集めた。ついで、該カラムを6Mのグアニジン塩酸塩の5CVで洗浄し、ついでPBS緩衝液で平衡化させた。結合−溶出実験をBioCad(登録商標)分取液体クロマトグラフィー(Applied Biosystems Inc.,Foster City,CA)上で行った。溶出プールの280nmにおけるUV吸収を測定してIgG濃度および収量を決定した。CHOP濃度についても市販の酵素免疫測定(ELISA)キット(Cygnus Technologies Inc.,Southport,NC)を用いて分析した。結果を図3に示す。結果は高タンパク質リガンド密度に関連した非特異的結合が、適切な中間洗浄緩衝液を用いて容易に相殺されることを示している。表1の結果と組み合わせて、このデータは、本明細書中に記述した方法およびマトリックスの柔軟性は、当業者が非特異的結合のような望ましくない副作用を最小化しながら望ましい容量を最大化することを可能にし、従って、特別な用途に合わせ得る親和性マトリックスを提供することを示唆している。
【実施例14】
【0081】
塩緩衝液による中間洗浄を用いた、IgG溶出プールにおける宿主細胞タンパク質(HCP)およびDNAレベルの減少
モデルHCPフィードストックとして、精製した、IgGを発現していない、血清を含まないCHO培地(Lampire,Biological Laboratories,Piperville,PA)を用い、ポリクロナールヒトγグロブリン(hlgG)(SeraCare Life Sciences,Inc.,Oceanside,CA)1mg/mlでスパイクした。リン酸塩緩衝食塩水(PBS1 pH7.4−7.5,伝導率15−17mS/cm)溶液の10カラム容量(CV)で平衡化させた後、該フィードの20CVを実施例2に記述した該プロテインA媒体を充填したカラム(内径0.66cm、 長さx7cm)に装填した。ついで該カラムを0−1MNaCIを補充したPBS(pH7.4−7.5)の8CVついで補充されていないPBS(pH7.4−7.5)の2CVで洗浄した。ついで、0.1Mクエン酸ナトリウム(pH3)溶出緩衝液の10CVで洗浄した。0.5から5.5CVのピーク画分を集めた。ついで該カラムを6Mのグアニジン塩酸塩の5CVで洗浄し、ついでPBS緩衝液で再平衡化させた。結合−溶出実験をBioCad(登録商標)分取液体クロマトグラフィーシステム(Applied Biosystems Inc.,Foster City,CA)上で行った。該溶出プールの280nmにおけるUV吸収を測定してIgG濃度および収量を決定した。CHOP濃度についても市販の酵素免疫測定(ELISA)キット(Cygnus Technologies Inc.,Southport,NC)を用いて分析した。
【0082】
図4aは、異なる塩の洗浄緩衝液を用いて測定された溶出プール中のCHOPレベルを示す。NaCIの濃度を0から1Mに増加すると、CHOP濃度は450ng/mlから80ng/mlまで5倍より多く減少した。IgGの回収はすべて類似しており、90−95%であった。
【0083】
図4bは、1MNaCI補充PBS緩衝液洗浄を用いて測定された溶出プール中のDNAレベルを示す。リガンドを利用するカップリングから作られたプロテインA試料の通常のPBS洗浄に比べて、塩洗浄は、非特異的に吸着されたDNAのレベルを20−60%だけ減少させた。
【実施例15】
【0084】
低pHおよび高塩濃度での中間洗浄を用いた、IgG溶出プールにおけるHCPレベルの減少
本実験は、PBS(pH6.5および0.4MNaCI補充)の8CVを含む中間洗浄緩衝液を用いたことを除き、上記実施例14に記述したのと同様の条件下で行った。
【0085】
図5は、異なるpHおよび塩濃度の中間洗浄緩衝液を用いて測定された溶出プール中のCHOPレベルを示す。0.4MNaCI補充pH6.5のPBS緩衝液を用いて得られた結果は、補充されていないPBS(pH7.4−7.5)を用いて得られた結果と比べて、〜8の因子だけCHOPレベルが低下した。
【実施例16】
【0086】
アミノ酸またはアルキル化アミノ酸を含む中間洗浄緩衝液を用いた、IgG溶出プールにおけるHCPレベルの減少
本実験は、8CVのPBS緩衝液(pH7.4−7.5、伝導率15−17mS/cm)および0.25−0.5Mベタイン、L−アラニン、グリシン、またはリジン、または0.125−0.25Mバリンまたは0.15Mグルタミン酸含む中間洗浄緩衝液を用いたことを除き、上記実施例14に記述したのと同様の条件下で行った。
【0087】
図6aは、ベタインおよびL−アラニンを含む中間洗浄緩衝液を用いて測定された溶出プール中のCHOPレベルを示す。0.25MのベタインはCHOP濃度を減少した。比較すると、アラニンはベタインに比べより有効であった。アラニンの両濃度で、結合CHOPは2倍より多く減少した。
【0088】
図6bは、バリン、グリシン、グルタミン酸またはリジンの各種濃度を含中間洗浄緩衝液を用いて測定された溶出プール中のCHOPレベルを示す。PBS洗浄と比較すると、溶出プール中のCHOPレベルは、アミノ酸洗浄で約3−10倍低く、その中でリジンおよびグルタミン酸が最も有効であるようである。
【0089】
本明細書および請求項で用いられる成分、反応条件などの量を表わすすべての数字は、すべての場合において用語「約」で修飾されていると理解されるべきである。従って、反対に指示されていなければ、この明細書および添付の請求項に規定されている数字のパラメーターは、近似値であり、それは本発明によって得られるべく探求されている所望の性質によって変化し得る。少なくとも、および本請求項の範囲に均等論の適用を制限する試みとしてではなく、それぞれの数字のパラメーターは、有効数字および通常の四捨五入方法に照らして解釈されるべきである。
【0090】
当業者に明白であるように、本発明の精神および範囲から逸脱することなく、本発明の多数の修飾および変更がなされ得る。本明細書に記述された具体的な実施形態は実施例のためにだけに提供したもので、制限的していることを決して意味しない。明細書及び実施例は、単に典型的な例と考えられるべきで、本発明の真の範囲および精神は以下の請求項によって示されていることが意図されている。
【特許請求の範囲】
【請求項1】
a)会合性基が固体支持体と相互作用するように、前記固体支持体を前記会合性基に接触させこと;
b)前記固体支持体を活性化すること;
c)タンパク質リガンドが前記固体支持体に結合し、a)の前記会合性基と非共有結合的に相互作用するように、前記固体支持体を別個に前記タンパク質リガンドに接触させること;
を含む、前記タンパク質リガンドを前記固体支持体に連結する方法。
【請求項2】
固体支持体がビーズである、請求項1に記載の方法。
【請求項3】
ビーズが、アガロース・ビーズである、請求項2に記載の方法。
【請求項4】
会合性基が、帯電分子種である、請求項1に記載の方法。
【請求項5】
帯電分子種が、陽電荷を帯びている、請求項4に記載の方法。
【請求項6】
帯電分子種が、陰電荷を帯びている、請求項4に記載の方法。
【請求項7】
会合性基が、疎水性である、請求項1に記載の方法。
【請求項8】
固体支持体を、a)臭化シアン;b)アルデヒド;c)エポキシド;d)活性化カルボン酸の少なくとも1つと接触させることにより、前記固体支持体が活性化される、請求項1に記載の方法。
【請求項9】
タンパク質リガンドがまた、免疫グロブリンを結合し得る、請求項1に記載の方法。
【請求項10】
タンパク質リガンドが、プロテインAおよびプロテインGから選ばれる、請求項9に記載の方法。
【請求項11】
タンパク質リガンドが、固体支持体に共有結合的に結合している、請求項1に記載の方法。
【請求項12】
会合性基および固体支持体の間の相互作用が、共有結合である、請求項1に記載の方法。
【請求項13】
会合性基が、タンパク質リガンドと非共有結合的に相互作用する、
a)固体支持体;
b)前記固体支持体に結合した前記タンパク質リガンド;
c)前記固体支持体に別個に結合した前記会合性基;
を含むアフィニティークロマトグラフィーマトリックス。
【請求項14】
固体支持体が、ビーズである、請求項13に記載のアフィニティークロマトグラフィーマトリックス。
【請求項15】
ビーズが、アガロース・ビーズである、請求項14に記載のアフィニティークロマトグラフィーマトリックス。
【請求項16】
会合性基が、帯電分子種である、請求項13に記載のアフィニティークロマトグラフィーマトリックス。
【請求項17】
帯電分子種が、陽電荷を帯びている、請求項16に記載のアフィニティークロマトグラフィーマトリックス。
【請求項18】
帯電分子種が、陰電荷を帯びている、請求項16に記載のアフィニティークロマトグラフィーマトリックス。
【請求項19】
会合性基が、疎水性である、請求項13に記載のアフィニティークロマトグラフィーマトリックス。
【請求項20】
タンパク質リガンドが、プロテインAおよびプロテインGから選ばれる、請求項13に記載のアフィニティークロマトグラフィーマトリックス。
【請求項21】
標的分子がマトリックスのタンパク質リガンドに結合するように、
1)条件の第一の組の下で、混合物を
a)固体支持体;
b)前記固体支持体に結合した前記タンパク質リガンド;
c)会合性基が、前記タンパク質リガンドと相互作用している前記固体支持体に別個に結合した前記会合性基;
を含むアフィニティークロマトグラフィーマトリックスと接触させること;および
2)標的分子が前記マトリックスのタンパク質リガンドともはや結合しないように、1)の前記条件を変更し、それによって関心のある物質を精製すること;
を含む、前記混合物から標的分子を精製する方法。
【請求項22】
標的分子が、免疫グロブリンである、請求項21に記載の方法。
【請求項23】
標的分子が、融合タンパク質である、請求項21に記載の方法。
【請求項24】
融合タンパク質が、Fc融合タンパク質である、請求項23に記載の方法。
【請求項25】
免疫グロブリンが、モノクロナール抗体である、請求項22に記載の方法。
【請求項26】
段階1)の後および段階2)の前に、アガロース支持体を洗浄緩衝液と接触させることを含む不純物を除去するための中間洗浄段階を更に含む、請求項21に記載の方法。
【請求項27】
不純物が、小分子、タンパク質、核酸またはそれらの任意の組み合わせを含む、請求項26に記載の方法。
【請求項28】
洗浄緩衝液が、酸性pHおよび塩または両方を含む、請求項26に記載の方法。
【請求項29】
pHが、5から6.99の範囲である、請求項28に記載の方法。
【請求項30】
洗浄緩衝液が、5.0から8.0の範囲のpHを有する、請求項26に記載の方法。
【請求項31】
洗浄緩衝液が、塩基性pHを有し、0.0001Mより多く、0.8Mより少ないNaClを含む、請求項26に記載の方法。
【請求項32】
pHが、7.4である、請求項31に記載の方法。
【請求項33】
洗浄緩衝液が、アミノ酸またはアルキル化アミノ酸を含む、請求項26に記載の方法。
【請求項34】
アミノ酸またはアルキル化アミノ酸が、L−アラニン、ベタイン、グリシンバリン、グルタミン酸およびリジンから選ばれる、請求項33に記載の方法。
【請求項35】
アミノ酸が、帯電アミノ酸である、請求項33に記載の方法。
【請求項36】
a)アガロース支持体;
b)前記アガロース支持体に共有結合的に結合しているプロテインA;および
c)前記固体支持体に別個におよび共有結合的に結合し、前記プロテインAと非共有結合的に相互作用する帯電分子種;
を含むアフィニティークロマトグラフィーマトリックス。
【請求項37】
アガロース・ビーズの表面に結合したプロテインAの少なくとも10g/Lを含む、アガロース・ビーズ。
【請求項1】
a)会合性基が固体支持体と相互作用するように、前記固体支持体を前記会合性基に接触させこと;
b)前記固体支持体を活性化すること;
c)タンパク質リガンドが前記固体支持体に結合し、a)の前記会合性基と非共有結合的に相互作用するように、前記固体支持体を別個に前記タンパク質リガンドに接触させること;
を含む、前記タンパク質リガンドを前記固体支持体に連結する方法。
【請求項2】
固体支持体がビーズである、請求項1に記載の方法。
【請求項3】
ビーズが、アガロース・ビーズである、請求項2に記載の方法。
【請求項4】
会合性基が、帯電分子種である、請求項1に記載の方法。
【請求項5】
帯電分子種が、陽電荷を帯びている、請求項4に記載の方法。
【請求項6】
帯電分子種が、陰電荷を帯びている、請求項4に記載の方法。
【請求項7】
会合性基が、疎水性である、請求項1に記載の方法。
【請求項8】
固体支持体を、a)臭化シアン;b)アルデヒド;c)エポキシド;d)活性化カルボン酸の少なくとも1つと接触させることにより、前記固体支持体が活性化される、請求項1に記載の方法。
【請求項9】
タンパク質リガンドがまた、免疫グロブリンを結合し得る、請求項1に記載の方法。
【請求項10】
タンパク質リガンドが、プロテインAおよびプロテインGから選ばれる、請求項9に記載の方法。
【請求項11】
タンパク質リガンドが、固体支持体に共有結合的に結合している、請求項1に記載の方法。
【請求項12】
会合性基および固体支持体の間の相互作用が、共有結合である、請求項1に記載の方法。
【請求項13】
会合性基が、タンパク質リガンドと非共有結合的に相互作用する、
a)固体支持体;
b)前記固体支持体に結合した前記タンパク質リガンド;
c)前記固体支持体に別個に結合した前記会合性基;
を含むアフィニティークロマトグラフィーマトリックス。
【請求項14】
固体支持体が、ビーズである、請求項13に記載のアフィニティークロマトグラフィーマトリックス。
【請求項15】
ビーズが、アガロース・ビーズである、請求項14に記載のアフィニティークロマトグラフィーマトリックス。
【請求項16】
会合性基が、帯電分子種である、請求項13に記載のアフィニティークロマトグラフィーマトリックス。
【請求項17】
帯電分子種が、陽電荷を帯びている、請求項16に記載のアフィニティークロマトグラフィーマトリックス。
【請求項18】
帯電分子種が、陰電荷を帯びている、請求項16に記載のアフィニティークロマトグラフィーマトリックス。
【請求項19】
会合性基が、疎水性である、請求項13に記載のアフィニティークロマトグラフィーマトリックス。
【請求項20】
タンパク質リガンドが、プロテインAおよびプロテインGから選ばれる、請求項13に記載のアフィニティークロマトグラフィーマトリックス。
【請求項21】
標的分子がマトリックスのタンパク質リガンドに結合するように、
1)条件の第一の組の下で、混合物を
a)固体支持体;
b)前記固体支持体に結合した前記タンパク質リガンド;
c)会合性基が、前記タンパク質リガンドと相互作用している前記固体支持体に別個に結合した前記会合性基;
を含むアフィニティークロマトグラフィーマトリックスと接触させること;および
2)標的分子が前記マトリックスのタンパク質リガンドともはや結合しないように、1)の前記条件を変更し、それによって関心のある物質を精製すること;
を含む、前記混合物から標的分子を精製する方法。
【請求項22】
標的分子が、免疫グロブリンである、請求項21に記載の方法。
【請求項23】
標的分子が、融合タンパク質である、請求項21に記載の方法。
【請求項24】
融合タンパク質が、Fc融合タンパク質である、請求項23に記載の方法。
【請求項25】
免疫グロブリンが、モノクロナール抗体である、請求項22に記載の方法。
【請求項26】
段階1)の後および段階2)の前に、アガロース支持体を洗浄緩衝液と接触させることを含む不純物を除去するための中間洗浄段階を更に含む、請求項21に記載の方法。
【請求項27】
不純物が、小分子、タンパク質、核酸またはそれらの任意の組み合わせを含む、請求項26に記載の方法。
【請求項28】
洗浄緩衝液が、酸性pHおよび塩または両方を含む、請求項26に記載の方法。
【請求項29】
pHが、5から6.99の範囲である、請求項28に記載の方法。
【請求項30】
洗浄緩衝液が、5.0から8.0の範囲のpHを有する、請求項26に記載の方法。
【請求項31】
洗浄緩衝液が、塩基性pHを有し、0.0001Mより多く、0.8Mより少ないNaClを含む、請求項26に記載の方法。
【請求項32】
pHが、7.4である、請求項31に記載の方法。
【請求項33】
洗浄緩衝液が、アミノ酸またはアルキル化アミノ酸を含む、請求項26に記載の方法。
【請求項34】
アミノ酸またはアルキル化アミノ酸が、L−アラニン、ベタイン、グリシンバリン、グルタミン酸およびリジンから選ばれる、請求項33に記載の方法。
【請求項35】
アミノ酸が、帯電アミノ酸である、請求項33に記載の方法。
【請求項36】
a)アガロース支持体;
b)前記アガロース支持体に共有結合的に結合しているプロテインA;および
c)前記固体支持体に別個におよび共有結合的に結合し、前記プロテインAと非共有結合的に相互作用する帯電分子種;
を含むアフィニティークロマトグラフィーマトリックス。
【請求項37】
アガロース・ビーズの表面に結合したプロテインAの少なくとも10g/Lを含む、アガロース・ビーズ。
【図1】


【図2】


【図3】


【図4a】


【図4b】


【図5】


【図6a】


【図6b】




【図2】


【図3】


【図4a】


【図4b】


【図5】


【図6a】


【図6b】


【公開番号】特開2011−256176(P2011−256176A)
【公開日】平成23年12月22日(2011.12.22)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−149726(P2011−149726)
【出願日】平成23年7月6日(2011.7.6)
【分割の表示】特願2008−549585(P2008−549585)の分割
【原出願日】平成19年1月5日(2007.1.5)
【出願人】(390019585)ミリポア・コーポレイション (212)
【氏名又は名称原語表記】MILLIPORE CORPORATION
【Fターム(参考)】
【公開日】平成23年12月22日(2011.12.22)
【国際特許分類】
【出願番号】特願2011−149726(P2011−149726)
【出願日】平成23年7月6日(2011.7.6)
【分割の表示】特願2008−549585(P2008−549585)の分割
【原出願日】平成19年1月5日(2007.1.5)
【出願人】(390019585)ミリポア・コーポレイション (212)
【氏名又は名称原語表記】MILLIPORE CORPORATION
【Fターム(参考)】
[ Back to top ]

