アフィニティー機能を有する多孔膜を製造する方法およびタンパク質を分離精製する方法
【課題】タンパク質の精製に好適なアフィニティー機能を有する多孔膜を、簡易な工程で製造可能な製造方法、及び、この製造方法で製造された多孔膜を用いたタンパク質の精製方法を提供すること。
【解決手段】ポリマー1と、ポリマーを溶解する有機液体と、グルタチオン及びグルタチオンに結合した疎水性基を有する有機化合物3と、を含むポリマー溶液を相分離させて形成された多孔膜前駆体を得る工程と、多孔膜前駆体から有機液体を除去して、ポリマー1及び有機化合物3を含む多孔膜7を形成する工程とを備える、多孔膜を製造する方法。
【解決手段】ポリマー1と、ポリマーを溶解する有機液体と、グルタチオン及びグルタチオンに結合した疎水性基を有する有機化合物3と、を含むポリマー溶液を相分離させて形成された多孔膜前駆体を得る工程と、多孔膜前駆体から有機液体を除去して、ポリマー1及び有機化合物3を含む多孔膜7を形成する工程とを備える、多孔膜を製造する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、多孔膜を製造する方法及びタンパク質を分離精製する方法に関する。
【背景技術】
【0002】
近年、様々な研究開発、分析現場において、作業の省力化や試料の減量、また、データの精密化を目的として、多種多様な試料や情報を同時に処理することを可能にするハイスループット化が進められている。例えば、生体内の抗原抗体反応に基づく抗体医薬の分野において、膨大な種類のタンパク質を選別するスクリーニングが行われており、その際、一度に多種のタンパク質を精製することが必要とされる。抗体医薬は、患部に選択的に作用するため副作用が少ないことから、近年、特に注目されている。通常、遺伝子組換えタンパク質は、大腸菌又は動物細胞を宿主として生産され、このとき、多数の不純物タンパク質も同時に生産される。そのため、宿主である細胞を破砕し、目的タンパク質を溶出させた後、細胞の破砕物を目的タンパク質から遠心分離又はフィルターにより分離する必要がある。その後、目的タンパク質及び不純物タンパク質を含む液体を各種のクロマトグラフィーにより処理して、目的タンパク質を分離精製する。クロマトグラフィーの種類としては、篩分効果による分離を利用したゲルろ過クロマトグラフィー、タンパク質の担体への吸着力の差を利用する吸着クロマトグラフィー(イオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、アフィニティークロマトグラフィー、逆相クロマトグラフィー)がある。
【0003】
近年、特定のタンパク質と特異的にかつ可逆的に吸着するリガンドを有する担体を用いて、タンパク質を分離精製するアフィニティークロマトグラフィーが注目されている。これは、アフィニティークロマトグラフィーは他のクロマトグラフィーと比べて精製効率及び回収率が高く、また、一度に多量の試料を処理できるメリットがあるためである。
【0004】
例えば、非特許文献1では、担体としてのアガロースビーズにグルタチオンがアフィニティーリガンドとして導入されたアフィニティークロマトグラフィー用のビーズと、このアフィニティービーズを用いてグルタチオン−S−トランスフェラーゼ(GST)融合タンパク質を分離精製する方法とが開示されている。
【0005】
多孔膜を担体として用いたアフィニティークロマトグラフィーも知られている。例えば、特許文献1では、多孔質架橋セルロース膜を予め担体として用意し、これに化学反応により、四級アンモニウム基およびジエチルアミノアチル基からなるアフィニティーリガンドを導入する方法が開示されている。非特許文献2には、再生セルロース多孔膜を予め用意し、これに化学反応により、グルタチオンを固定化して得られる膜型のアフィニティークロマトグラフィーが開示されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特表2009−503160号公報
【非特許文献】
【0007】
【非特許文献1】GEヘルスケア株式会社 製品カタログ、28−9622−84AA、2009年12月、[online]、[平成23年8月15日検索]、インターネット<URL:http://www.gelifesciences.co.jp/catalog/pdf/28962284.pdf>
【非特許文献2】Biochimica et Biophysica Acta、1994年、第1205巻、p.29−38
【発明の概要】
【発明が解決しようとする課題】
【0008】
非特許文献1に開示されるような、ビーズを担体として用いたアフィニティークロマトグラフィーの場合、目的タンパク質を含む被処理液をクロマトグラフィーにより処理する前に、被処理液から遠心分離又はフィルターろ過により細胞の破砕物等の懸濁物質を除去する必要がある。そのため、工程が多く、目的タンパク質を含む被処理液が多量に必要とされる。また、高速処理を行うと被処理液がビーズ間を素抜けするチャネリングが発生し、目的タンパク質がリガンドに吸着されずにろ過液側に透過してしまうという問題もある。
【0009】
一方、多孔膜を担体として用いたアフィニティークロマトグラフィーの場合、目的タンパク質、不純物タンパク質及び細胞破砕物を含む被処理液を処理したときに、多孔膜の細孔による篩い分けにより細胞の破砕物と目的タンパク質及び不純物タンパク質とを分離しながら、アフィニティーリガンドにより目的タンパク質と不純物タンパク質とを分離することが可能である。すなわち、多孔膜を担体として用いたアフィニティークロマトグラフィーによれば、一段プロセスでの分離精製が可能である。さらに、目的タンパク質を含む液体が細孔内に担持されたリガンドまで強制流により送液されるため、リガンドと目的タンパク質との接触効率が高く、高速処理が可能である。スケールアップが容易であるという利点もある。
【0010】
しかしながら、多孔膜を担体として用いたアフィニティークロマトグラフィーは、従来、多孔膜を作製した後でそこに化学反応によりアフィニティーリガンドを導入する方法により製造されているため、製造に要する工程が複雑である。低コスト化のため、より簡易な工程により多孔膜を担体として用いたアフィニティークロマトグラフィーを製造する方法の開発が求められている。
【0011】
本発明の目的は、タンパク質の分離精製に好適なアフィニティー機能を有する多孔膜を、簡易な工程で製造することを可能にする方法を提供することにある。また、本発明は、係る方法により得ることのできる多孔膜を用いたタンパク質の分離精製方法を提供することも目的とする。
【課題を解決するための手段】
【0012】
本発明者らは、鋭意検討を重ねた結果、アフィニティーリガンドであるグルタチオンと結合した疎水性基を有する有機化合物を含有するポリマー溶液(製膜原液)から、相分離法を利用して多孔膜を形成させることにより、分離精度が高いアフィニティー機能を有する多孔膜を簡易な工程で製造できることを見出し、本発明を完成した。
【0013】
すなわち、本発明は、以下の方法に関する。
(1)ポリマーと、ポリマーを溶解する有機液体と、グルタチオン及びグルタチオンに結合した疎水性基を有する有機化合物と、を含むポリマー溶液を相分離させて形成された多孔膜前駆体を得る工程と、多孔膜前駆体から有機液体を除去して、ポリマー及び上記有機化合物を含む多孔膜を形成する工程とを備える、多孔膜を製造する方法。
(2)疎水性基が、アルキル基、アルキレン基、アリール基、及び、R(C=O)−で表され、Rが飽和脂肪族基若しくは不飽和脂肪族基である基からなる群より選択される基である、(1)の方法。
(3)疎水性基が、ヘキサデシル基である、(1)又は(2)の方法。
(4)ポリマーがセルロース誘導体である(1)〜(3)のいずれかに記載の方法。
(5)グルタチオン−S−トランスフェラーゼ融合タンパク質を含む原液を、(1)〜(4)のいずれかに記載の方法によって得ることができる多孔膜でろ過し、多孔膜にグルタチオン−S−トランスフェラーゼ融合タンパク質を吸着させる工程を含む、グルタチオン−S−トランスフェラーゼ融合タンパク質の分離精製方法。
【発明の効果】
【0014】
本発明によれば、タンパク質の分離精製に好適なアフィニティー機能を有する多孔膜を、簡易な工程で製造することが可能である。工程が簡易であることから、多孔膜を低コストで提供することができる。また、本発明により、上記の方法により製造された多孔膜を用いたタンパク質の分離精製方法が提供される。本発明の分離精製方法によれば、一段プロセスでの分離精製が可能である。また、目的タンパク質を含む液体が細孔内に担持されたリガンドまで強制流により送液されるため、リガンドと目的タンパク質との接触効率が高く、高速処理が可能であり、スケールアップが容易である。
【0015】
アフィニティーリガンドを化学反応により多孔膜の表面に固定化する従来の方法によれば、多孔膜内部の細孔内へのリガンドの導入が難しいことから、多孔膜表面におけるリガンド密度の粗密が生じ、目的タンパク質の分離性能が低下してしまう問題がある。これに対して、本発明の方法によれば、多孔膜表面におけるリガンド密度の粗密が生じにくい。また、従来のように化学反応によってアフィニティーリガンドを導入する際、使用するアルカリ、酸、酸化剤等の薬剤により、有機材料から形成された多孔膜自体が劣化してしまうという問題があるのに対して、本発明の方法はそのような問題を回避できる。有機材料を用いた多孔膜は、一般に無機材料を用いた多孔膜と比較して製造コストが抑制される。
【図面の簡単な説明】
【0016】
【図1】多孔膜の一実施形態を示す概略模式図である。
【図2】多孔膜を用いて、目的タンパク質を含む被処理液から目的タンパク質を分離精製した結果を示すグラフである。
【図3】多孔膜を用いて、不純物タンパク質を含む被処理液から不純物タンパク質を分離精製した結果を示すグラフである。
【図4】多孔膜を用いて、目的タンパク質と不純物タンパク質を含む被処理液から目的タンパク質を分離精製した結果を示すグラフである。
【発明を実施するための形態】
【0017】
以下、本発明を実施するための形態について詳細に説明する。ただし、本発明は、以下の実施形態に限定されるものではなく、その要旨の範囲内で種々変形することができる。
【0018】
[アフィニティー機能を有する多孔膜を製造する方法]
本実施形態に係る方法は、ポリマーと、ポリマーを溶解する有機液体と、アフィニティーリガンドであるグルタチオン及びグルタチオンに結合した疎水性基を有する有機化合物(以下、場合により「リガンド化合物」という。)とを含むポリマー溶液を相分離させて形成された多孔膜前駆体を得る工程と、相分離により得られた多孔膜前駆体から有機液体を除去して、ポリマー及びリガンド化合物を含む多孔膜を形成する工程とを備える。
【0019】
上記ポリマーは、多孔膜において細孔を形成する基材として機能する。このポリマーは、特に限定されないが、例えば、ポリスルホン、ポリエーテルスルホン、ポリアクリロニトリル、酢酸セルロース、プロピオン酸セルロース、酪酸セルロース、ポリフッ化ビニリデン、ポリエチレン、ポリプロピレン、ポリテトラフルオロエチレン、ポリカーボネート、ポリエステル、ポリスチレン及びポリメチルメタクリレートからなる群より選ばれる少なくとも1種である。これらの中でも、酢酸セルロース、プロピオン酸セルロース及び酪酸セルロースのようなセルロース誘導体が好ましい。これらセルロース誘導体は、高い親水性を有し、不純物タンパク質の多孔膜への非特異的吸着を抑制することができる。ポリマーの分子量は、製膜性や強度等を考慮して適宜選定することができる。異なる分子量のポリマーがブレンドされていてもよい。
【0020】
ポリマーを溶解する有機液体は、常温(例えば20℃)又は高温(例えば50〜300℃)においてポリマーを溶解する。ポリマーをこの有機液体に溶解することにより、均一なポリマー溶液が形成される。
【0021】
ポリマーがポリスルホン又はポリエーテルスルホンである場合、有機液体は、N−メチル−2−ピロリドン、N,N−ジメチルホルムアミド及びN,N−ジメチルアセトアミド等から選ばれる。ポリマーがポリアクリロニトリルである場合、有機液体は、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、ジメチルスルホキシド及びN−メチル−2−ピロリドン等から選ばれる。ポリマーが酢酸セルロース、プロピオン酸セルロース及び酪酸セルロース等のセルロース誘導体である場合、非溶媒誘起相分離法が利用されるときの有機液体は、アセトン、ジオキサン、ジメチルスルホキシド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン及びN,N−ジメチルホルムアミド等から選ばれ、熱誘起相分離法が利用されるときの有機液体(潜在溶媒)は、トリエチレングリコール、2−メチル−2,4−ペンタンジオール及び2−エチル−1,3−ヘキサンジオール等から選ばれる。ポリマーがポリフッ化ビニリデンである場合、非溶媒誘起相分離法が利用されるときの有機液体は、N−メチル−2−ピロリドン、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド及びジメチルスルホキシド等から選ばれ、熱誘起相分離法が利用されるときの有機液体(潜在溶媒)は、フタル酸ジメチル、フタル酸ジエチル、フタル酸ジブチル、フタル酸ジシクロヘキシル、フタル酸ジヘプチル、フタル酸ジオクチル及びフタル酸ジ(2−エチルヘキシル)のようなフタル酸エステル類;γ―ブチロラクトン、エチレンカーボネイト、プロピレンカーボネイト、シクロヘキサノン、アセトフェノン及びイソホロンのようなケトン類;安息香酸エステル類;並びにリン酸エステル類から選ばれる。ポリマーがポリエチレンである場合、有機液体は、フタル酸ジブチル、フタル酸ジヘプチル、フタル酸ジオクチル、フタル酸ジ(2−エチルヘキシル)、フタル酸ジイソデシル及びフタル酸ジトリデシルのようなフタル酸エステル類;流動パラフィンのようなパラフィン類;プロピレングリコールジカプレート及びプロピレングリコールジオレエートのようなグリセリンエステル類;アジピン酸エステル類;並びにリン酸エステル類から選ばれる。これら有機液体は、単独で使用してもよいし2種以上を組み合わせて使用してもよい。
【0022】
リガンド化合物は、目的タンパク質と特異的にかつ可逆的に吸着するアフィニティーリガンドと、このアフィニティーリガンドを担体としての多孔膜に固定化するための疎水性基とを有する。後述する、多孔膜前駆体を得る工程において、ポリマー溶液を相分離させることにより、ポリマーの濃度が高い濃厚相と、濃厚相よりもポリマーの濃度が低い希薄相とに相分離している多孔膜前駆体が形成される。多孔膜前駆体において、リガンド化合物は、ポリマーと親和性を有する疎水性基が濃厚相側、リガンドが希薄相側に向いた状態になる。その結果、多孔膜においてリガンドが細孔表面に配され、タンパク質の吸着が可能となる。
【0023】
疎水性基は、ポリマーに対して親和性を有する。リガンド導入の容易さ及びポリマーとの親和性を調整し易いことから、疎水性基は、直鎖若しくは分岐状アルキル基、アルキレン基、アリール基、及び、R(C=O)−で表され、Rが飽和脂肪族基若しくは不飽和脂肪族基である基からなる群より選択される基であることが好ましい。R(C=O)−で表され、Rが飽和脂肪族基若しくは不飽和脂肪族基である基は、飽和脂肪酸若しくは不飽和脂肪酸に由来するものであってもよい。これら疎水性基が短過ぎると、ポリマーの多孔体に固定化されにくくなることから、疎水性基は、炭素数が10個以上30個以下であることがより好ましい。
【0024】
アフィニティーリガンドは、目的タンパク質を特異的かつ可逆的に吸着できるものであり、目的タンパク質とグルタチオン−S−トランスフェラーゼ(GST)との融合タンパク質(GST融合タンパク質)を特異的に捕捉できるグルタチオンである。
【0025】
多孔膜前駆体は、例えば、非溶媒誘起相分離法又は熱誘起相分離法によりポリマー溶液を相分離させることにより得ることができる。非溶媒誘起相分離法では、ポリマーが有機液体に溶解している溶液に対して、該ポリマーの非溶媒である液体を添加して相分離を誘起する。熱誘起相分離法では、ポリマーが常温では溶解しないが高温で溶解する有機液体(潜在溶媒)にポリマーを溶解して、均一なポリマー溶液とし、その後、ポリマー溶液の温度を下げることにより、相分離を誘起する。化学的安定性及び機械的強度に優れた結晶性ポリマーを利用することができ、また、得られた細孔の多孔度が高く、かつ孔径分布がシャープであることから、熱誘起相分離法を利用して多孔膜前駆体を形成することが好ましい。多孔膜の多孔度が高いと実質的な膜面積を大きくすることができるため捕捉できるタンパク質の吸着量が多くなる。また、孔径分布がシャープな多孔膜では、被処理液が各細孔に均一に流れるため、破過するまでに利用できるリガンド量が多くなる。孔径分布が大きいと、まず初めに流れやすい大孔径の細孔上のリガンドがタンパク吸着し、ここが破過する時点により膜の寿命が決定される。
【0026】
ポリマー、有機液体、及びリガンド化合物を含有する製膜原液から、多孔膜前駆体が形成される。製膜原液は、必要に応じてポリエチレングリコール及びポリビニルピロリドン等の高分子量の有機物、テトラエチレングリコール等の低分子量の有機物、又は、塩化リチウム、シリカ、炭酸カルシウム及びアルミナ等の無機物を含有してもよい。
【0027】
製膜原液を準備する際、全ての成分を同時に混合してもよいし、各成分を順次混合してもよい。あるいは、一部の成分を予備混合した後、そこに残りの成分を混合してもよい。混合条件(混合の温度や混合のエネルギー)、混合時の雰囲気(真空下又は不活性気体雰囲気)は、適宜選定することができる。混合を行う装置としては、攪拌および温度調整が可能な設備を備えた溶解槽を用いてもよく、単軸や二軸の押出機等を用いてもよい。製膜原液の気泡を除去するために、脱泡操作を行ってもよい。
【0028】
製膜原液中のポリマーの含有量は、製膜原液全体量を基準として10〜60質量%が好ましい。この含有量が10質量%以上であると、製膜性及び機械的強度の点でより優れた多孔膜を得ることができ、60質量%以下であると、高い空隙率の多孔膜を得ることができるため、タンパク質の高い吸着量を達成することができる。リガンド化合物のポリマーに対する質量比は、0.01〜0.1が好ましい。この質量比が0.01以上であると、多孔膜が特に高いタンパク質の捕捉性能を示し、また、0.1以下であると、タンパク質の分離精製の際に薬剤を用いても、多孔膜の機械的及び化学的な耐性がより高く保たれる。
【0029】
平膜状の多孔膜を製造する場合、製膜原液をTダイから押出すか、又は、ガラス板等の基板に塗布することにより、平膜状に成形することができる。このとき、製膜原液を不織布に塗布して、不織布及び多孔膜から構成された複合膜を得ることもできる。中空糸状の多孔膜を製造する場合、二重環式の紡糸口金から押出し、中空状に成形することができる。この際、中空部に非溶媒、溶媒と非溶媒の混合液あるいは、空気等の流体を流すことができる。また、中空糸状の膜においても、組紐等に製膜原液を塗布した複合膜としても良い。
【0030】
上記のような方法により、平膜状あるいは中空糸状に成形されたゲル状の製膜原液は、必要に応じて空走部を経て、非溶媒、非溶媒と溶媒の混合液、又は、製膜原液を冷却するための液体(例えば、水)が満たされた槽に導入され、平膜状、中空糸状の状態で固化される。固化にともなって相分離し、多孔膜前駆体が形成される。
【0031】
多孔膜前駆体から、主として希薄相に含まれる有機液体及び場合によりその他の添加剤を抽出して、これらを除去することにより、細孔を形成する多孔体であるポリマー相を有する多孔膜を得ることができる。抽出に用いる溶媒は、ポリマーを実質的に溶解せず、有機液体を溶解するものであれば特に限定されず、例えば、水、アルコール、ハロゲン化系溶媒等を、使用するポリマーにより適宜選定すれば良い。ここで、ポリマーを実質的に溶解しない溶媒とは、抽出する温度にてポリマーを1質量%以下溶解する溶媒のことである。抽出方法は、有機液体が多孔膜前駆体から抽出できる方法であれば特に限定されず、例えば、抽出溶媒に浸漬しても良いし、あるいは、抽出溶媒をろ過しても良い。さらに、抽出中に、加温をしても良いし、あるいは、超音波等を照射して、抽出を促進しても良い。上記抽出の前後で、透水性能の向上及び強度特性の向上のため、延伸及び/又は熱処理を行ってもよい。
【0032】
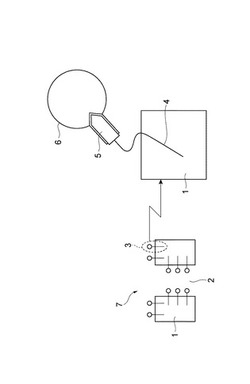
図1は、多孔膜の一実施形態を示す概略模式図である。図1に示す多孔膜7は、細孔2を形成しているポリマー(ポリマー相)1と、ポリマー相1の表面に配されたリガンド化合物(グルタチオン及びグルタチオンに結合した疎水性基を有する有機化合物)3とから構成される。リガンド化合物3は、アフィニティーリガンド(グルタチオン)5と、これに結合した疎水性基4とを有する。疎水性基4がポリマー相1に固定化されている。アフィニティーリガンド5はGST融合タンパク質6を特異的に捕捉できる。
【0033】
本実施形態に係る多孔膜の細孔径は、好ましくは10nm〜10μm、より好ましくは50nm〜5μmである。細孔径が10nm以上であれば、膜のろ過抵抗が低く、より高いろ過性能が得られ、さらに、不純物タンパク質の透過性も高い。また、細孔径が10μm以下であれば、ミクロンオーダーの細胞破砕物とタンパク質との分離性能が特に優れる。
【0034】
上記細孔径は、粒子径が既知の指標物質を多孔膜によってろ過したときの、阻止率が90%以上である指標物質の大きさを細孔径とする方法により測定することができる。具体的には、指標物質として単分散ポリスチレン粒子を用いることにより、20〜30nm以上の細孔径を有する多孔膜の測定を行うことができる。また、指標物質としてタンパク質を用いることにより、20〜30nm以下の細孔径を有する多孔膜の測定を行うことができる。
【0035】
本実施形態に係る多孔膜の形態は、平膜状でも、中空糸状でもよい。平膜状の場合は、膜を形成するポリマーの単体でもよいし、不織布等の支持体上に多孔膜を担持させて複合膜を形成してもよい。膜厚は、5μm〜1000μmであることが好ましい。膜厚が5μm以上であれば、タンパク質を含有する液体と膜表面のアフィニティーリガンドとの接触が大きくなり、より高い分離精度が達成できる。また、膜厚が1000μm以下であれば、被分離液体が膜を透過する際の抵抗が小さく、より高い透水性能が得られる。
【0036】
中空糸状の多孔膜の場合、その内径(中空部分に相当する。)は100μm〜5mmであることが好ましい。内径が100μm以上であれば、液体が中空部を流れるときに発生する圧力損失を低く抑えることが可能であり、また、5mm以下であれば、単位体積当たりの膜充填密度を高くすることができ、コンパクト化が可能である。
【0037】
中空糸状の多孔膜の膜厚は5μm〜1000μmであることが好ましい。膜厚が5μm以上であれば、タンパク質を含有する液体と膜表面のアフィニティーリガンドとの接触が大きくなり、より高い分離精度が達成でき、さらに、内圧ろ過式中空糸多孔膜に求められる十分な内圧破裂強度を得ることがでる。また、膜厚が1000μm以下であれば、単位体積当たりの膜充填密度を高くすることができ、コンパクト化が可能である。
【0038】
本実施形態に係る多孔膜の空隙率は、20%〜90%であることが好ましい。空隙率が20%以上であれば、特に優れた透水性能と高い吸着容量が得られ、また、90%以下であれば、実用的な強度特性が得られる。
【0039】
上記空隙率は、細孔内に水を含浸した多孔膜の湿潤状態の質量と絶乾状態の質量との差分を、膜体積で除する方法により測定することができる。中空糸状の多孔膜の場合は、中空部の体積を除いた膜厚部分の空隙率が、20%〜90%であることが好ましい。
【0040】
[タンパク質の分離精製方法]
本実施形態に係るアフィニティー機能を有する多孔膜を用いて、目的タンパク質を分離精製することができる。以下、分離精製方法に関して詳細に説明する。
【0041】
目的とする遺伝子組換えタンパク質は、大腸菌、酵母、動物細胞等を宿主として生産することができる。あるいは、無細胞合成系にて生産することもできる。この際、目的タンパク質の他に不純物タンパク質も生産されるため、これらを分離精製する必要がある。目的タンパク質を、そのままの状態で分離精製するためには習熟した技術が必要であり、従って、分離精製を容易にするため、目的タンパク質は、低分子のタグを付けたり、あるいは、酵素であるGSTを結合した融合タンパク質として生産されることが好ましい。中でも、発現されるタンパク質量が多く、また、可溶性画分へ回収されやすく、かつ、少ない処理プロセスで精製操作が可能であるGST融合タンパク質が好ましい。GST融合タンパク質は、目的タンパク質と、目的タンパク質に結合したGSTとを有する。
【0042】
タグを付加し生産された組換えタンパク質は、その後、菌体や細胞を破砕して溶解させる。この溶解された目的タンパク質及び破砕細胞を含む被処理液(GST融合タンパク質を含む原液)は、本実施形態に係る多孔膜によってろ過され、目的タンパク質を多孔膜中のアフィニティーリガンドに結合させることができる。
【0043】
このように、本実施形態に係る多孔膜を用いれば、細胞破砕物を予め遠心分離又はフィルターによって分離する必要がないため、ビーズを担体としたアフィニティークロマトグラフィーに比べて、分離精製プロセスを簡素化でき、少量のサンプルから目的タンパク質を短時間で得ることができる。
【0044】
ろ過の後、多孔膜のアフィニティーリガンドに弱く非特異的に結合した不純物タンパク質をリン酸緩衝液等のバッファー溶液を用いた洗浄により除去する。
【0045】
次いで、溶出バッファーを用いて、目的タンパク質を多孔膜から溶出し、分離精製された目的タンパク質を得ることができる。溶出バッファーは、例えば、TRISバッファーやリン酸バッファー等の緩衝液に還元型グルタチオンを添加した溶液を用いることができる。
【0046】
タンパク質の分離精製の際、平膜状の多孔膜はホルダーに固定した状態で使用することができる。中空糸状の多孔膜の場合、複数本の多孔膜を束ね、これをエポキシ樹脂又はウレンタン樹脂等を用いてプラスチック製のハウジング等に固定した膜モジュールの形態で多孔膜を使用することができる。
【0047】
ろ過の駆動力は、ポンプ又はエアーを用いた加圧であってもよい。ホルダーにセットされた平膜状の多孔膜をシリンジ等に設置し、手動で加圧ろ過することもできる。タンパク質を含む被処理液を多孔膜でろ過する際の圧力、ろ過流速等の操作条件は、ろ過圧力が高すぎると膜が破損しやすくなり、ろ過流束が高すぎると目的タンパク質がアフィニティーリガンドに捕捉できず素抜けしやすくなるので、これらの因子を考慮して適宜選択することができる。
【実施例】
【0048】
以下、実施例を挙げて本発明についてさらに具体的に説明する。ただし、本発明はこれら実施例に限定されるものではない。
【0049】
[実施例1]
(グルタチオン及びグルタチオンに結合した疎水性基を有する有機化合物の合成:GSSG化合物及びGSH化合物)
N,N−ジメチルホルムアミド(DMF)10mLに、グルタチオン(酸化型)306.3mg(0.5mmol)、1−ブロモヘキサデカン137.9mg(0.55mmol)、炭酸カリウム103.67mg(0.75mmol)を混合し、窒素雰囲気下、50℃で24時間還流した。反応後、エバポレーターを用いてDMFを減圧留去した。残留物をジエチルエーテルで2回洗浄し、その後、過剰量の1M塩酸を加え、さらに、クロロホルムを加えた。分液ロートを用いて、水相を捨て、クロロホルム相を1M塩酸で1回、超純水で1回洗浄した。クロロホルム相を回収し、エバポレーターを用いてクロロホルムを減圧留去した後、残留物を凍結乾燥し、酸化型グルタチオン及び酸化型グルタチオンに結合した疎水性基を有する化合物(GSSG化合物)を得た。得られたGSSG化合物を、トリブチルホスフィンにより還元した。得られた反応生成物についてナノ−エレクトロスプレイ質量分析(ESI−MS)を実施した。その結果、反応生成物は、リガンドであるグルタチオン(還元型)及びグルタチオンに結合した疎水性基であるヘキサデシル基を有する、化学式(1)で表される有機化合物(GSH化合物)であることが確認された。
【0050】
【化1】

【0051】
(アフィニティー機能を有する多孔膜の製造)
セルロースジアセテート2.3g、GSSG化合物115mg及びメルトカプトエタノール82mg(GSSG化合物の10倍モル当量)を、有機液体であるトリエチレングリコール7.7gに150℃にて溶解し、均一なポリマー溶液(製膜原液)を得た。このポリマー溶液を加熱したホットステージ上に置いたガラス板に塗布し、塗布されたポリマー溶液の上からガラス板を被せた。その後、室温雰囲気下で徐冷することによりポリマー溶液を固化させるとともに相分離させて、多孔膜前駆体であるポリマー薄膜を形成させた。得られたポリマー薄膜を水で洗浄することにより、膜中に残留するトリエチレングリコールを除去し、薄膜状の多孔膜を得た。得られた多孔膜の表面、裏面及び断面をFE−SEMを用いて観察したところ、500nm程度の孔径を有する細孔がセルロースアセテートによって形成されていることが確認された。この結果から、多孔膜は、数μmオーダーの大きさを有する細胞破砕物は除去しながら、不純物タンパク質は透過し得るサイズの孔径を有することが確認された。
【0052】
(目的タンパク質の捕捉性能の確認)
目的タンパク質であるグルタチオン−S−トランスフェラーゼ(GST)をTRITC(Tetramethylrhodamine−5−(and 6)−isothiocyanate)で蛍光標識化した、TRITC−GSTを含む水溶液から、上記のリガンドを有するGSH化合物が固定化された多孔膜を用いた目的タンパク質の分離精製を、下記(1)〜(5)の操作に従って行った。直径25mmの円形に切り出された多孔膜をホルダーにセットし、このホルダーをシリンダーに取り付け、ろ過を行った。
(1)多孔膜の洗浄:多孔膜に脱イオン水10mLを通水することにより、多孔膜を洗浄した。
(2)多孔膜の平衡化:pH7.3のリン酸緩衝液10mLを通水し、多孔膜のコンディショニングを行った。
(3)目的タンパク質の添加:43μg/mLのTRITC−GSTを含む溶液(原液)4mLを、多孔膜に通液した。原液中のタンパク質の質量(以下「原液画分」という。)と、ろ液中のタンパク質の質量(以下「非吸着画分」という。)は、溶液中のTRITC−GSTの濃度を蛍光測定(励起波長:544nm、蛍光波長:572nm)することにより求めた。結果を図2に示した。図2中、「GST」はTRITC−GSTを示す。TRITC−GSTの原液画分中の質量は172μgであった。一方、非吸着画分中の質量は23μgであった。目的タンパク質であるTRITC−GSTの87質量%を多孔膜中に捕捉することができた。
(4)多孔膜の洗浄:多孔膜にpH7.3のリン酸緩衝液10mLを通水することにより、多孔膜を洗浄した。このときのろ過液中のタンパク質の質量(以下「素通り画分」という。)は、43μgであった。ここで、洗浄の際に溶出したTRITC−GSTは、主に、ホルダー又はシリンダー中に残留した成分である。
(5)目的タンパク質の溶出:多孔膜にpH7.3の溶出緩衝液(50mMのTris−HCl緩衝液、10mMのグルタチオンを含む混合液)5mLを通液し、目的タンパク質を溶出した。得られたろ過液中のタンパク質の質量(以下「溶出画分」という。)は、65μgであり、目的タンパク質であるTRITC−GSTを効率的に捕捉できることが確認できた。なお、この結果から、GST融合タンパク質も、TRITC−GSTと同様に効率的に捕捉できることが明らかである。
【0053】
(不純物タンパクの非特異的吸着性の確認)
上記、手順(3)において、不純物タンパクとして、ヒスチジン残基(His−tag)をN末端に有するenhanced green fluorescence protein(His−tag EGFP)を濃度45μg/mLで2mL通液した以外は、上記(1)〜(5)の手順に従ってHis−tag EGFPの多孔膜への吸着性能を評価した。EGFPの濃度は、蛍光測定(励起波長:488nm、蛍光波長:510nm)することにより求めた。結果を図3に示した。His−tag EGFPの原液画分、非吸着画分、素通り画分、溶出画分中の質量は、それぞれ、90μg、50μg、22μg、3μgであった。供給された不純物タンパクであるHis−tag EGFPの約80%は、膜に全く吸着しない非吸着画分か、あるいは、膜に弱く吸着した素通り画分であり、膜に吸着した溶出画分は約3%と非常に少ないことが確認された。以上より、GSH化合物が固定化された多孔膜は、GST融合タンパクは選択的に捕捉するが、それ以外の不純物タンパクによる非特異的吸着が極めて少ないことが確認できた。
【0054】
[実施例2]
実施例1で作成した多孔膜を用い、手順(3)において、目的タンパク質としてTRITC−GSTを、不純物タンパク質としてフルオレセインイソチオシアネート(FITC)にて標識化されたBSA(FITC−BSA)を含み、それぞれのタンパク質濃度が45μg/mLである混合液を、2mLろ過したこと以外は、実施例1の(タンパク質の分離精製)の手順に従ってTRITC−GSTの分離精製を行った。なお、溶液中のFITC−BSAの濃度を蛍光測定(励起波長:495nm、蛍光波長:525nm)することにより求めた。結果を図4に示した。図4中、「BSA」はFITC−BSAを示し、「GST」はTRITC−GSTを示す。目的タンパクであるTRITC−GSTの原液画分、非吸着画分、素通り画分、溶出画分中の質量は、それぞれ、90μg、14μg、22μg、54μgであり、不純物タンパクとしてBSAが共存していても、GSTタンパクを選択的に回収できることが確認された。一方、不純物タンパクであるFITC−BSAの原液画分、非吸着画分、素通り画分、溶出画分中の質量は、それぞれ、90μg、9μg、15μg、5μgであった。
【産業上の利用可能性】
【0055】
本発明は、タンパク質の分離精製の分野において産業上の利用可能性を有する。
【符号の説明】
【0056】
1…ポリマー相、2…細孔、3…グルタチオン及びグルタチオンに結合した疎水性基を有する有機化合物(リガンド化合物)、4…疎水性基、5…リガンド(グルタチオン)、6…GST融合タンパク質、7…多孔膜。
【技術分野】
【0001】
本発明は、多孔膜を製造する方法及びタンパク質を分離精製する方法に関する。
【背景技術】
【0002】
近年、様々な研究開発、分析現場において、作業の省力化や試料の減量、また、データの精密化を目的として、多種多様な試料や情報を同時に処理することを可能にするハイスループット化が進められている。例えば、生体内の抗原抗体反応に基づく抗体医薬の分野において、膨大な種類のタンパク質を選別するスクリーニングが行われており、その際、一度に多種のタンパク質を精製することが必要とされる。抗体医薬は、患部に選択的に作用するため副作用が少ないことから、近年、特に注目されている。通常、遺伝子組換えタンパク質は、大腸菌又は動物細胞を宿主として生産され、このとき、多数の不純物タンパク質も同時に生産される。そのため、宿主である細胞を破砕し、目的タンパク質を溶出させた後、細胞の破砕物を目的タンパク質から遠心分離又はフィルターにより分離する必要がある。その後、目的タンパク質及び不純物タンパク質を含む液体を各種のクロマトグラフィーにより処理して、目的タンパク質を分離精製する。クロマトグラフィーの種類としては、篩分効果による分離を利用したゲルろ過クロマトグラフィー、タンパク質の担体への吸着力の差を利用する吸着クロマトグラフィー(イオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、アフィニティークロマトグラフィー、逆相クロマトグラフィー)がある。
【0003】
近年、特定のタンパク質と特異的にかつ可逆的に吸着するリガンドを有する担体を用いて、タンパク質を分離精製するアフィニティークロマトグラフィーが注目されている。これは、アフィニティークロマトグラフィーは他のクロマトグラフィーと比べて精製効率及び回収率が高く、また、一度に多量の試料を処理できるメリットがあるためである。
【0004】
例えば、非特許文献1では、担体としてのアガロースビーズにグルタチオンがアフィニティーリガンドとして導入されたアフィニティークロマトグラフィー用のビーズと、このアフィニティービーズを用いてグルタチオン−S−トランスフェラーゼ(GST)融合タンパク質を分離精製する方法とが開示されている。
【0005】
多孔膜を担体として用いたアフィニティークロマトグラフィーも知られている。例えば、特許文献1では、多孔質架橋セルロース膜を予め担体として用意し、これに化学反応により、四級アンモニウム基およびジエチルアミノアチル基からなるアフィニティーリガンドを導入する方法が開示されている。非特許文献2には、再生セルロース多孔膜を予め用意し、これに化学反応により、グルタチオンを固定化して得られる膜型のアフィニティークロマトグラフィーが開示されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特表2009−503160号公報
【非特許文献】
【0007】
【非特許文献1】GEヘルスケア株式会社 製品カタログ、28−9622−84AA、2009年12月、[online]、[平成23年8月15日検索]、インターネット<URL:http://www.gelifesciences.co.jp/catalog/pdf/28962284.pdf>
【非特許文献2】Biochimica et Biophysica Acta、1994年、第1205巻、p.29−38
【発明の概要】
【発明が解決しようとする課題】
【0008】
非特許文献1に開示されるような、ビーズを担体として用いたアフィニティークロマトグラフィーの場合、目的タンパク質を含む被処理液をクロマトグラフィーにより処理する前に、被処理液から遠心分離又はフィルターろ過により細胞の破砕物等の懸濁物質を除去する必要がある。そのため、工程が多く、目的タンパク質を含む被処理液が多量に必要とされる。また、高速処理を行うと被処理液がビーズ間を素抜けするチャネリングが発生し、目的タンパク質がリガンドに吸着されずにろ過液側に透過してしまうという問題もある。
【0009】
一方、多孔膜を担体として用いたアフィニティークロマトグラフィーの場合、目的タンパク質、不純物タンパク質及び細胞破砕物を含む被処理液を処理したときに、多孔膜の細孔による篩い分けにより細胞の破砕物と目的タンパク質及び不純物タンパク質とを分離しながら、アフィニティーリガンドにより目的タンパク質と不純物タンパク質とを分離することが可能である。すなわち、多孔膜を担体として用いたアフィニティークロマトグラフィーによれば、一段プロセスでの分離精製が可能である。さらに、目的タンパク質を含む液体が細孔内に担持されたリガンドまで強制流により送液されるため、リガンドと目的タンパク質との接触効率が高く、高速処理が可能である。スケールアップが容易であるという利点もある。
【0010】
しかしながら、多孔膜を担体として用いたアフィニティークロマトグラフィーは、従来、多孔膜を作製した後でそこに化学反応によりアフィニティーリガンドを導入する方法により製造されているため、製造に要する工程が複雑である。低コスト化のため、より簡易な工程により多孔膜を担体として用いたアフィニティークロマトグラフィーを製造する方法の開発が求められている。
【0011】
本発明の目的は、タンパク質の分離精製に好適なアフィニティー機能を有する多孔膜を、簡易な工程で製造することを可能にする方法を提供することにある。また、本発明は、係る方法により得ることのできる多孔膜を用いたタンパク質の分離精製方法を提供することも目的とする。
【課題を解決するための手段】
【0012】
本発明者らは、鋭意検討を重ねた結果、アフィニティーリガンドであるグルタチオンと結合した疎水性基を有する有機化合物を含有するポリマー溶液(製膜原液)から、相分離法を利用して多孔膜を形成させることにより、分離精度が高いアフィニティー機能を有する多孔膜を簡易な工程で製造できることを見出し、本発明を完成した。
【0013】
すなわち、本発明は、以下の方法に関する。
(1)ポリマーと、ポリマーを溶解する有機液体と、グルタチオン及びグルタチオンに結合した疎水性基を有する有機化合物と、を含むポリマー溶液を相分離させて形成された多孔膜前駆体を得る工程と、多孔膜前駆体から有機液体を除去して、ポリマー及び上記有機化合物を含む多孔膜を形成する工程とを備える、多孔膜を製造する方法。
(2)疎水性基が、アルキル基、アルキレン基、アリール基、及び、R(C=O)−で表され、Rが飽和脂肪族基若しくは不飽和脂肪族基である基からなる群より選択される基である、(1)の方法。
(3)疎水性基が、ヘキサデシル基である、(1)又は(2)の方法。
(4)ポリマーがセルロース誘導体である(1)〜(3)のいずれかに記載の方法。
(5)グルタチオン−S−トランスフェラーゼ融合タンパク質を含む原液を、(1)〜(4)のいずれかに記載の方法によって得ることができる多孔膜でろ過し、多孔膜にグルタチオン−S−トランスフェラーゼ融合タンパク質を吸着させる工程を含む、グルタチオン−S−トランスフェラーゼ融合タンパク質の分離精製方法。
【発明の効果】
【0014】
本発明によれば、タンパク質の分離精製に好適なアフィニティー機能を有する多孔膜を、簡易な工程で製造することが可能である。工程が簡易であることから、多孔膜を低コストで提供することができる。また、本発明により、上記の方法により製造された多孔膜を用いたタンパク質の分離精製方法が提供される。本発明の分離精製方法によれば、一段プロセスでの分離精製が可能である。また、目的タンパク質を含む液体が細孔内に担持されたリガンドまで強制流により送液されるため、リガンドと目的タンパク質との接触効率が高く、高速処理が可能であり、スケールアップが容易である。
【0015】
アフィニティーリガンドを化学反応により多孔膜の表面に固定化する従来の方法によれば、多孔膜内部の細孔内へのリガンドの導入が難しいことから、多孔膜表面におけるリガンド密度の粗密が生じ、目的タンパク質の分離性能が低下してしまう問題がある。これに対して、本発明の方法によれば、多孔膜表面におけるリガンド密度の粗密が生じにくい。また、従来のように化学反応によってアフィニティーリガンドを導入する際、使用するアルカリ、酸、酸化剤等の薬剤により、有機材料から形成された多孔膜自体が劣化してしまうという問題があるのに対して、本発明の方法はそのような問題を回避できる。有機材料を用いた多孔膜は、一般に無機材料を用いた多孔膜と比較して製造コストが抑制される。
【図面の簡単な説明】
【0016】
【図1】多孔膜の一実施形態を示す概略模式図である。
【図2】多孔膜を用いて、目的タンパク質を含む被処理液から目的タンパク質を分離精製した結果を示すグラフである。
【図3】多孔膜を用いて、不純物タンパク質を含む被処理液から不純物タンパク質を分離精製した結果を示すグラフである。
【図4】多孔膜を用いて、目的タンパク質と不純物タンパク質を含む被処理液から目的タンパク質を分離精製した結果を示すグラフである。
【発明を実施するための形態】
【0017】
以下、本発明を実施するための形態について詳細に説明する。ただし、本発明は、以下の実施形態に限定されるものではなく、その要旨の範囲内で種々変形することができる。
【0018】
[アフィニティー機能を有する多孔膜を製造する方法]
本実施形態に係る方法は、ポリマーと、ポリマーを溶解する有機液体と、アフィニティーリガンドであるグルタチオン及びグルタチオンに結合した疎水性基を有する有機化合物(以下、場合により「リガンド化合物」という。)とを含むポリマー溶液を相分離させて形成された多孔膜前駆体を得る工程と、相分離により得られた多孔膜前駆体から有機液体を除去して、ポリマー及びリガンド化合物を含む多孔膜を形成する工程とを備える。
【0019】
上記ポリマーは、多孔膜において細孔を形成する基材として機能する。このポリマーは、特に限定されないが、例えば、ポリスルホン、ポリエーテルスルホン、ポリアクリロニトリル、酢酸セルロース、プロピオン酸セルロース、酪酸セルロース、ポリフッ化ビニリデン、ポリエチレン、ポリプロピレン、ポリテトラフルオロエチレン、ポリカーボネート、ポリエステル、ポリスチレン及びポリメチルメタクリレートからなる群より選ばれる少なくとも1種である。これらの中でも、酢酸セルロース、プロピオン酸セルロース及び酪酸セルロースのようなセルロース誘導体が好ましい。これらセルロース誘導体は、高い親水性を有し、不純物タンパク質の多孔膜への非特異的吸着を抑制することができる。ポリマーの分子量は、製膜性や強度等を考慮して適宜選定することができる。異なる分子量のポリマーがブレンドされていてもよい。
【0020】
ポリマーを溶解する有機液体は、常温(例えば20℃)又は高温(例えば50〜300℃)においてポリマーを溶解する。ポリマーをこの有機液体に溶解することにより、均一なポリマー溶液が形成される。
【0021】
ポリマーがポリスルホン又はポリエーテルスルホンである場合、有機液体は、N−メチル−2−ピロリドン、N,N−ジメチルホルムアミド及びN,N−ジメチルアセトアミド等から選ばれる。ポリマーがポリアクリロニトリルである場合、有機液体は、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、ジメチルスルホキシド及びN−メチル−2−ピロリドン等から選ばれる。ポリマーが酢酸セルロース、プロピオン酸セルロース及び酪酸セルロース等のセルロース誘導体である場合、非溶媒誘起相分離法が利用されるときの有機液体は、アセトン、ジオキサン、ジメチルスルホキシド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン及びN,N−ジメチルホルムアミド等から選ばれ、熱誘起相分離法が利用されるときの有機液体(潜在溶媒)は、トリエチレングリコール、2−メチル−2,4−ペンタンジオール及び2−エチル−1,3−ヘキサンジオール等から選ばれる。ポリマーがポリフッ化ビニリデンである場合、非溶媒誘起相分離法が利用されるときの有機液体は、N−メチル−2−ピロリドン、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド及びジメチルスルホキシド等から選ばれ、熱誘起相分離法が利用されるときの有機液体(潜在溶媒)は、フタル酸ジメチル、フタル酸ジエチル、フタル酸ジブチル、フタル酸ジシクロヘキシル、フタル酸ジヘプチル、フタル酸ジオクチル及びフタル酸ジ(2−エチルヘキシル)のようなフタル酸エステル類;γ―ブチロラクトン、エチレンカーボネイト、プロピレンカーボネイト、シクロヘキサノン、アセトフェノン及びイソホロンのようなケトン類;安息香酸エステル類;並びにリン酸エステル類から選ばれる。ポリマーがポリエチレンである場合、有機液体は、フタル酸ジブチル、フタル酸ジヘプチル、フタル酸ジオクチル、フタル酸ジ(2−エチルヘキシル)、フタル酸ジイソデシル及びフタル酸ジトリデシルのようなフタル酸エステル類;流動パラフィンのようなパラフィン類;プロピレングリコールジカプレート及びプロピレングリコールジオレエートのようなグリセリンエステル類;アジピン酸エステル類;並びにリン酸エステル類から選ばれる。これら有機液体は、単独で使用してもよいし2種以上を組み合わせて使用してもよい。
【0022】
リガンド化合物は、目的タンパク質と特異的にかつ可逆的に吸着するアフィニティーリガンドと、このアフィニティーリガンドを担体としての多孔膜に固定化するための疎水性基とを有する。後述する、多孔膜前駆体を得る工程において、ポリマー溶液を相分離させることにより、ポリマーの濃度が高い濃厚相と、濃厚相よりもポリマーの濃度が低い希薄相とに相分離している多孔膜前駆体が形成される。多孔膜前駆体において、リガンド化合物は、ポリマーと親和性を有する疎水性基が濃厚相側、リガンドが希薄相側に向いた状態になる。その結果、多孔膜においてリガンドが細孔表面に配され、タンパク質の吸着が可能となる。
【0023】
疎水性基は、ポリマーに対して親和性を有する。リガンド導入の容易さ及びポリマーとの親和性を調整し易いことから、疎水性基は、直鎖若しくは分岐状アルキル基、アルキレン基、アリール基、及び、R(C=O)−で表され、Rが飽和脂肪族基若しくは不飽和脂肪族基である基からなる群より選択される基であることが好ましい。R(C=O)−で表され、Rが飽和脂肪族基若しくは不飽和脂肪族基である基は、飽和脂肪酸若しくは不飽和脂肪酸に由来するものであってもよい。これら疎水性基が短過ぎると、ポリマーの多孔体に固定化されにくくなることから、疎水性基は、炭素数が10個以上30個以下であることがより好ましい。
【0024】
アフィニティーリガンドは、目的タンパク質を特異的かつ可逆的に吸着できるものであり、目的タンパク質とグルタチオン−S−トランスフェラーゼ(GST)との融合タンパク質(GST融合タンパク質)を特異的に捕捉できるグルタチオンである。
【0025】
多孔膜前駆体は、例えば、非溶媒誘起相分離法又は熱誘起相分離法によりポリマー溶液を相分離させることにより得ることができる。非溶媒誘起相分離法では、ポリマーが有機液体に溶解している溶液に対して、該ポリマーの非溶媒である液体を添加して相分離を誘起する。熱誘起相分離法では、ポリマーが常温では溶解しないが高温で溶解する有機液体(潜在溶媒)にポリマーを溶解して、均一なポリマー溶液とし、その後、ポリマー溶液の温度を下げることにより、相分離を誘起する。化学的安定性及び機械的強度に優れた結晶性ポリマーを利用することができ、また、得られた細孔の多孔度が高く、かつ孔径分布がシャープであることから、熱誘起相分離法を利用して多孔膜前駆体を形成することが好ましい。多孔膜の多孔度が高いと実質的な膜面積を大きくすることができるため捕捉できるタンパク質の吸着量が多くなる。また、孔径分布がシャープな多孔膜では、被処理液が各細孔に均一に流れるため、破過するまでに利用できるリガンド量が多くなる。孔径分布が大きいと、まず初めに流れやすい大孔径の細孔上のリガンドがタンパク吸着し、ここが破過する時点により膜の寿命が決定される。
【0026】
ポリマー、有機液体、及びリガンド化合物を含有する製膜原液から、多孔膜前駆体が形成される。製膜原液は、必要に応じてポリエチレングリコール及びポリビニルピロリドン等の高分子量の有機物、テトラエチレングリコール等の低分子量の有機物、又は、塩化リチウム、シリカ、炭酸カルシウム及びアルミナ等の無機物を含有してもよい。
【0027】
製膜原液を準備する際、全ての成分を同時に混合してもよいし、各成分を順次混合してもよい。あるいは、一部の成分を予備混合した後、そこに残りの成分を混合してもよい。混合条件(混合の温度や混合のエネルギー)、混合時の雰囲気(真空下又は不活性気体雰囲気)は、適宜選定することができる。混合を行う装置としては、攪拌および温度調整が可能な設備を備えた溶解槽を用いてもよく、単軸や二軸の押出機等を用いてもよい。製膜原液の気泡を除去するために、脱泡操作を行ってもよい。
【0028】
製膜原液中のポリマーの含有量は、製膜原液全体量を基準として10〜60質量%が好ましい。この含有量が10質量%以上であると、製膜性及び機械的強度の点でより優れた多孔膜を得ることができ、60質量%以下であると、高い空隙率の多孔膜を得ることができるため、タンパク質の高い吸着量を達成することができる。リガンド化合物のポリマーに対する質量比は、0.01〜0.1が好ましい。この質量比が0.01以上であると、多孔膜が特に高いタンパク質の捕捉性能を示し、また、0.1以下であると、タンパク質の分離精製の際に薬剤を用いても、多孔膜の機械的及び化学的な耐性がより高く保たれる。
【0029】
平膜状の多孔膜を製造する場合、製膜原液をTダイから押出すか、又は、ガラス板等の基板に塗布することにより、平膜状に成形することができる。このとき、製膜原液を不織布に塗布して、不織布及び多孔膜から構成された複合膜を得ることもできる。中空糸状の多孔膜を製造する場合、二重環式の紡糸口金から押出し、中空状に成形することができる。この際、中空部に非溶媒、溶媒と非溶媒の混合液あるいは、空気等の流体を流すことができる。また、中空糸状の膜においても、組紐等に製膜原液を塗布した複合膜としても良い。
【0030】
上記のような方法により、平膜状あるいは中空糸状に成形されたゲル状の製膜原液は、必要に応じて空走部を経て、非溶媒、非溶媒と溶媒の混合液、又は、製膜原液を冷却するための液体(例えば、水)が満たされた槽に導入され、平膜状、中空糸状の状態で固化される。固化にともなって相分離し、多孔膜前駆体が形成される。
【0031】
多孔膜前駆体から、主として希薄相に含まれる有機液体及び場合によりその他の添加剤を抽出して、これらを除去することにより、細孔を形成する多孔体であるポリマー相を有する多孔膜を得ることができる。抽出に用いる溶媒は、ポリマーを実質的に溶解せず、有機液体を溶解するものであれば特に限定されず、例えば、水、アルコール、ハロゲン化系溶媒等を、使用するポリマーにより適宜選定すれば良い。ここで、ポリマーを実質的に溶解しない溶媒とは、抽出する温度にてポリマーを1質量%以下溶解する溶媒のことである。抽出方法は、有機液体が多孔膜前駆体から抽出できる方法であれば特に限定されず、例えば、抽出溶媒に浸漬しても良いし、あるいは、抽出溶媒をろ過しても良い。さらに、抽出中に、加温をしても良いし、あるいは、超音波等を照射して、抽出を促進しても良い。上記抽出の前後で、透水性能の向上及び強度特性の向上のため、延伸及び/又は熱処理を行ってもよい。
【0032】
図1は、多孔膜の一実施形態を示す概略模式図である。図1に示す多孔膜7は、細孔2を形成しているポリマー(ポリマー相)1と、ポリマー相1の表面に配されたリガンド化合物(グルタチオン及びグルタチオンに結合した疎水性基を有する有機化合物)3とから構成される。リガンド化合物3は、アフィニティーリガンド(グルタチオン)5と、これに結合した疎水性基4とを有する。疎水性基4がポリマー相1に固定化されている。アフィニティーリガンド5はGST融合タンパク質6を特異的に捕捉できる。
【0033】
本実施形態に係る多孔膜の細孔径は、好ましくは10nm〜10μm、より好ましくは50nm〜5μmである。細孔径が10nm以上であれば、膜のろ過抵抗が低く、より高いろ過性能が得られ、さらに、不純物タンパク質の透過性も高い。また、細孔径が10μm以下であれば、ミクロンオーダーの細胞破砕物とタンパク質との分離性能が特に優れる。
【0034】
上記細孔径は、粒子径が既知の指標物質を多孔膜によってろ過したときの、阻止率が90%以上である指標物質の大きさを細孔径とする方法により測定することができる。具体的には、指標物質として単分散ポリスチレン粒子を用いることにより、20〜30nm以上の細孔径を有する多孔膜の測定を行うことができる。また、指標物質としてタンパク質を用いることにより、20〜30nm以下の細孔径を有する多孔膜の測定を行うことができる。
【0035】
本実施形態に係る多孔膜の形態は、平膜状でも、中空糸状でもよい。平膜状の場合は、膜を形成するポリマーの単体でもよいし、不織布等の支持体上に多孔膜を担持させて複合膜を形成してもよい。膜厚は、5μm〜1000μmであることが好ましい。膜厚が5μm以上であれば、タンパク質を含有する液体と膜表面のアフィニティーリガンドとの接触が大きくなり、より高い分離精度が達成できる。また、膜厚が1000μm以下であれば、被分離液体が膜を透過する際の抵抗が小さく、より高い透水性能が得られる。
【0036】
中空糸状の多孔膜の場合、その内径(中空部分に相当する。)は100μm〜5mmであることが好ましい。内径が100μm以上であれば、液体が中空部を流れるときに発生する圧力損失を低く抑えることが可能であり、また、5mm以下であれば、単位体積当たりの膜充填密度を高くすることができ、コンパクト化が可能である。
【0037】
中空糸状の多孔膜の膜厚は5μm〜1000μmであることが好ましい。膜厚が5μm以上であれば、タンパク質を含有する液体と膜表面のアフィニティーリガンドとの接触が大きくなり、より高い分離精度が達成でき、さらに、内圧ろ過式中空糸多孔膜に求められる十分な内圧破裂強度を得ることがでる。また、膜厚が1000μm以下であれば、単位体積当たりの膜充填密度を高くすることができ、コンパクト化が可能である。
【0038】
本実施形態に係る多孔膜の空隙率は、20%〜90%であることが好ましい。空隙率が20%以上であれば、特に優れた透水性能と高い吸着容量が得られ、また、90%以下であれば、実用的な強度特性が得られる。
【0039】
上記空隙率は、細孔内に水を含浸した多孔膜の湿潤状態の質量と絶乾状態の質量との差分を、膜体積で除する方法により測定することができる。中空糸状の多孔膜の場合は、中空部の体積を除いた膜厚部分の空隙率が、20%〜90%であることが好ましい。
【0040】
[タンパク質の分離精製方法]
本実施形態に係るアフィニティー機能を有する多孔膜を用いて、目的タンパク質を分離精製することができる。以下、分離精製方法に関して詳細に説明する。
【0041】
目的とする遺伝子組換えタンパク質は、大腸菌、酵母、動物細胞等を宿主として生産することができる。あるいは、無細胞合成系にて生産することもできる。この際、目的タンパク質の他に不純物タンパク質も生産されるため、これらを分離精製する必要がある。目的タンパク質を、そのままの状態で分離精製するためには習熟した技術が必要であり、従って、分離精製を容易にするため、目的タンパク質は、低分子のタグを付けたり、あるいは、酵素であるGSTを結合した融合タンパク質として生産されることが好ましい。中でも、発現されるタンパク質量が多く、また、可溶性画分へ回収されやすく、かつ、少ない処理プロセスで精製操作が可能であるGST融合タンパク質が好ましい。GST融合タンパク質は、目的タンパク質と、目的タンパク質に結合したGSTとを有する。
【0042】
タグを付加し生産された組換えタンパク質は、その後、菌体や細胞を破砕して溶解させる。この溶解された目的タンパク質及び破砕細胞を含む被処理液(GST融合タンパク質を含む原液)は、本実施形態に係る多孔膜によってろ過され、目的タンパク質を多孔膜中のアフィニティーリガンドに結合させることができる。
【0043】
このように、本実施形態に係る多孔膜を用いれば、細胞破砕物を予め遠心分離又はフィルターによって分離する必要がないため、ビーズを担体としたアフィニティークロマトグラフィーに比べて、分離精製プロセスを簡素化でき、少量のサンプルから目的タンパク質を短時間で得ることができる。
【0044】
ろ過の後、多孔膜のアフィニティーリガンドに弱く非特異的に結合した不純物タンパク質をリン酸緩衝液等のバッファー溶液を用いた洗浄により除去する。
【0045】
次いで、溶出バッファーを用いて、目的タンパク質を多孔膜から溶出し、分離精製された目的タンパク質を得ることができる。溶出バッファーは、例えば、TRISバッファーやリン酸バッファー等の緩衝液に還元型グルタチオンを添加した溶液を用いることができる。
【0046】
タンパク質の分離精製の際、平膜状の多孔膜はホルダーに固定した状態で使用することができる。中空糸状の多孔膜の場合、複数本の多孔膜を束ね、これをエポキシ樹脂又はウレンタン樹脂等を用いてプラスチック製のハウジング等に固定した膜モジュールの形態で多孔膜を使用することができる。
【0047】
ろ過の駆動力は、ポンプ又はエアーを用いた加圧であってもよい。ホルダーにセットされた平膜状の多孔膜をシリンジ等に設置し、手動で加圧ろ過することもできる。タンパク質を含む被処理液を多孔膜でろ過する際の圧力、ろ過流速等の操作条件は、ろ過圧力が高すぎると膜が破損しやすくなり、ろ過流束が高すぎると目的タンパク質がアフィニティーリガンドに捕捉できず素抜けしやすくなるので、これらの因子を考慮して適宜選択することができる。
【実施例】
【0048】
以下、実施例を挙げて本発明についてさらに具体的に説明する。ただし、本発明はこれら実施例に限定されるものではない。
【0049】
[実施例1]
(グルタチオン及びグルタチオンに結合した疎水性基を有する有機化合物の合成:GSSG化合物及びGSH化合物)
N,N−ジメチルホルムアミド(DMF)10mLに、グルタチオン(酸化型)306.3mg(0.5mmol)、1−ブロモヘキサデカン137.9mg(0.55mmol)、炭酸カリウム103.67mg(0.75mmol)を混合し、窒素雰囲気下、50℃で24時間還流した。反応後、エバポレーターを用いてDMFを減圧留去した。残留物をジエチルエーテルで2回洗浄し、その後、過剰量の1M塩酸を加え、さらに、クロロホルムを加えた。分液ロートを用いて、水相を捨て、クロロホルム相を1M塩酸で1回、超純水で1回洗浄した。クロロホルム相を回収し、エバポレーターを用いてクロロホルムを減圧留去した後、残留物を凍結乾燥し、酸化型グルタチオン及び酸化型グルタチオンに結合した疎水性基を有する化合物(GSSG化合物)を得た。得られたGSSG化合物を、トリブチルホスフィンにより還元した。得られた反応生成物についてナノ−エレクトロスプレイ質量分析(ESI−MS)を実施した。その結果、反応生成物は、リガンドであるグルタチオン(還元型)及びグルタチオンに結合した疎水性基であるヘキサデシル基を有する、化学式(1)で表される有機化合物(GSH化合物)であることが確認された。
【0050】
【化1】

【0051】
(アフィニティー機能を有する多孔膜の製造)
セルロースジアセテート2.3g、GSSG化合物115mg及びメルトカプトエタノール82mg(GSSG化合物の10倍モル当量)を、有機液体であるトリエチレングリコール7.7gに150℃にて溶解し、均一なポリマー溶液(製膜原液)を得た。このポリマー溶液を加熱したホットステージ上に置いたガラス板に塗布し、塗布されたポリマー溶液の上からガラス板を被せた。その後、室温雰囲気下で徐冷することによりポリマー溶液を固化させるとともに相分離させて、多孔膜前駆体であるポリマー薄膜を形成させた。得られたポリマー薄膜を水で洗浄することにより、膜中に残留するトリエチレングリコールを除去し、薄膜状の多孔膜を得た。得られた多孔膜の表面、裏面及び断面をFE−SEMを用いて観察したところ、500nm程度の孔径を有する細孔がセルロースアセテートによって形成されていることが確認された。この結果から、多孔膜は、数μmオーダーの大きさを有する細胞破砕物は除去しながら、不純物タンパク質は透過し得るサイズの孔径を有することが確認された。
【0052】
(目的タンパク質の捕捉性能の確認)
目的タンパク質であるグルタチオン−S−トランスフェラーゼ(GST)をTRITC(Tetramethylrhodamine−5−(and 6)−isothiocyanate)で蛍光標識化した、TRITC−GSTを含む水溶液から、上記のリガンドを有するGSH化合物が固定化された多孔膜を用いた目的タンパク質の分離精製を、下記(1)〜(5)の操作に従って行った。直径25mmの円形に切り出された多孔膜をホルダーにセットし、このホルダーをシリンダーに取り付け、ろ過を行った。
(1)多孔膜の洗浄:多孔膜に脱イオン水10mLを通水することにより、多孔膜を洗浄した。
(2)多孔膜の平衡化:pH7.3のリン酸緩衝液10mLを通水し、多孔膜のコンディショニングを行った。
(3)目的タンパク質の添加:43μg/mLのTRITC−GSTを含む溶液(原液)4mLを、多孔膜に通液した。原液中のタンパク質の質量(以下「原液画分」という。)と、ろ液中のタンパク質の質量(以下「非吸着画分」という。)は、溶液中のTRITC−GSTの濃度を蛍光測定(励起波長:544nm、蛍光波長:572nm)することにより求めた。結果を図2に示した。図2中、「GST」はTRITC−GSTを示す。TRITC−GSTの原液画分中の質量は172μgであった。一方、非吸着画分中の質量は23μgであった。目的タンパク質であるTRITC−GSTの87質量%を多孔膜中に捕捉することができた。
(4)多孔膜の洗浄:多孔膜にpH7.3のリン酸緩衝液10mLを通水することにより、多孔膜を洗浄した。このときのろ過液中のタンパク質の質量(以下「素通り画分」という。)は、43μgであった。ここで、洗浄の際に溶出したTRITC−GSTは、主に、ホルダー又はシリンダー中に残留した成分である。
(5)目的タンパク質の溶出:多孔膜にpH7.3の溶出緩衝液(50mMのTris−HCl緩衝液、10mMのグルタチオンを含む混合液)5mLを通液し、目的タンパク質を溶出した。得られたろ過液中のタンパク質の質量(以下「溶出画分」という。)は、65μgであり、目的タンパク質であるTRITC−GSTを効率的に捕捉できることが確認できた。なお、この結果から、GST融合タンパク質も、TRITC−GSTと同様に効率的に捕捉できることが明らかである。
【0053】
(不純物タンパクの非特異的吸着性の確認)
上記、手順(3)において、不純物タンパクとして、ヒスチジン残基(His−tag)をN末端に有するenhanced green fluorescence protein(His−tag EGFP)を濃度45μg/mLで2mL通液した以外は、上記(1)〜(5)の手順に従ってHis−tag EGFPの多孔膜への吸着性能を評価した。EGFPの濃度は、蛍光測定(励起波長:488nm、蛍光波長:510nm)することにより求めた。結果を図3に示した。His−tag EGFPの原液画分、非吸着画分、素通り画分、溶出画分中の質量は、それぞれ、90μg、50μg、22μg、3μgであった。供給された不純物タンパクであるHis−tag EGFPの約80%は、膜に全く吸着しない非吸着画分か、あるいは、膜に弱く吸着した素通り画分であり、膜に吸着した溶出画分は約3%と非常に少ないことが確認された。以上より、GSH化合物が固定化された多孔膜は、GST融合タンパクは選択的に捕捉するが、それ以外の不純物タンパクによる非特異的吸着が極めて少ないことが確認できた。
【0054】
[実施例2]
実施例1で作成した多孔膜を用い、手順(3)において、目的タンパク質としてTRITC−GSTを、不純物タンパク質としてフルオレセインイソチオシアネート(FITC)にて標識化されたBSA(FITC−BSA)を含み、それぞれのタンパク質濃度が45μg/mLである混合液を、2mLろ過したこと以外は、実施例1の(タンパク質の分離精製)の手順に従ってTRITC−GSTの分離精製を行った。なお、溶液中のFITC−BSAの濃度を蛍光測定(励起波長:495nm、蛍光波長:525nm)することにより求めた。結果を図4に示した。図4中、「BSA」はFITC−BSAを示し、「GST」はTRITC−GSTを示す。目的タンパクであるTRITC−GSTの原液画分、非吸着画分、素通り画分、溶出画分中の質量は、それぞれ、90μg、14μg、22μg、54μgであり、不純物タンパクとしてBSAが共存していても、GSTタンパクを選択的に回収できることが確認された。一方、不純物タンパクであるFITC−BSAの原液画分、非吸着画分、素通り画分、溶出画分中の質量は、それぞれ、90μg、9μg、15μg、5μgであった。
【産業上の利用可能性】
【0055】
本発明は、タンパク質の分離精製の分野において産業上の利用可能性を有する。
【符号の説明】
【0056】
1…ポリマー相、2…細孔、3…グルタチオン及びグルタチオンに結合した疎水性基を有する有機化合物(リガンド化合物)、4…疎水性基、5…リガンド(グルタチオン)、6…GST融合タンパク質、7…多孔膜。
【特許請求の範囲】
【請求項1】
ポリマーと、前記ポリマーを溶解する有機液体と、グルタチオン及びグルタチオンに結合した疎水性基を有する有機化合物と、を含むポリマー溶液を相分離させて形成された多孔膜前駆体を得る工程と、
前記多孔膜前駆体から前記有機液体を除去して、前記ポリマー及び前記有機化合物を含む多孔膜を形成する工程と
を備える、多孔膜を製造する方法。
【請求項2】
前記疎水性基が、アルキル基、アルキレン基、アリール基、及び、R(C=O)−で表され、Rが飽和脂肪族基若しくは不飽和脂肪族基である基からなる群より選択される基である、請求項1記載の方法。
【請求項3】
前記疎水性基が、ヘキサデシル基である、請求項1又は2に記載の方法。
【請求項4】
前記ポリマーが、セルロース誘導体である、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
グルタチオン−S−トランスフェラーゼ融合タンパク質を含む原液を、請求項1〜4のいずれか一項に記載の方法によって得ることのできる多孔膜でろ過し、前記多孔膜にグルタチオン−S−トランスフェラーゼ融合タンパク質を吸着させる工程を含む、グルタチオン−S−トランスフェラーゼ融合タンパク質を分離精製する方法。
【請求項1】
ポリマーと、前記ポリマーを溶解する有機液体と、グルタチオン及びグルタチオンに結合した疎水性基を有する有機化合物と、を含むポリマー溶液を相分離させて形成された多孔膜前駆体を得る工程と、
前記多孔膜前駆体から前記有機液体を除去して、前記ポリマー及び前記有機化合物を含む多孔膜を形成する工程と
を備える、多孔膜を製造する方法。
【請求項2】
前記疎水性基が、アルキル基、アルキレン基、アリール基、及び、R(C=O)−で表され、Rが飽和脂肪族基若しくは不飽和脂肪族基である基からなる群より選択される基である、請求項1記載の方法。
【請求項3】
前記疎水性基が、ヘキサデシル基である、請求項1又は2に記載の方法。
【請求項4】
前記ポリマーが、セルロース誘導体である、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
グルタチオン−S−トランスフェラーゼ融合タンパク質を含む原液を、請求項1〜4のいずれか一項に記載の方法によって得ることのできる多孔膜でろ過し、前記多孔膜にグルタチオン−S−トランスフェラーゼ融合タンパク質を吸着させる工程を含む、グルタチオン−S−トランスフェラーゼ融合タンパク質を分離精製する方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−53192(P2013−53192A)
【公開日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願番号】特願2011−191026(P2011−191026)
【出願日】平成23年9月1日(2011.9.1)
【出願人】(303046314)旭化成ケミカルズ株式会社 (2,513)
【出願人】(504150450)国立大学法人神戸大学 (421)
【Fターム(参考)】
【公開日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願日】平成23年9月1日(2011.9.1)
【出願人】(303046314)旭化成ケミカルズ株式会社 (2,513)
【出願人】(504150450)国立大学法人神戸大学 (421)
【Fターム(参考)】
[ Back to top ]

