アポトーシス誘導剤
【課題】ヒメマツタケ子実体から得ることができるヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤の提供。
【解決手段】下記式(1)で表されるステロイド誘導体を有効成分とするヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤。

....(1)
【解決手段】下記式(1)で表されるステロイド誘導体を有効成分とするヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤。

....(1)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヒメマツタケ子実体又はその破砕物から得ることができるステロイド誘導体を有効成分とするヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤に関する。
【背景技術】
【0002】
現在、日本において癌は死亡原因のトップの病気であり、その予防や治療に対する人々の関心は非常に高い。また、日常的に取り人れることができる癌予防及び治療のための方法が数多く提案されている。
【0003】
従来の多くの抗癌剤は、正常細胞と癌細胞の区別なく直接的に殺細胞的に作用し、癌細胞の増殖を阻害する(伊藤均,抗腫瘍剤 日高弘義編 阻害剤研究法 共立出版 東京 1985年 453-468頁)。このような殺細胞性抗癌剤は、使用量や使用期間等を最適に設定することが困難であり、さらにその副作用は癌患者にとって大きな負担となるものである。
【0004】
近年、癌研究の分野ではアポトーシス、すなわち細胞自滅に関する研究が盛んに行なわれている。アポトーシスは生物個体発生における組織、臓器の形成、生体の恒常性の維持と防衛に重要な働きをするだけではなく、多くの病気の発生に深い関係があることが解明されつつある。
【0005】
アポトーシスによる細胞の制御作用の異常は、癌形成の一つの原因であると考えられている。本来死滅すべき細胞がアポトーシス、つまり細胞自滅を起こすことなく生き残ると、その細胞が様々な刺激を受けて染色体に変異を重ね、最終的に癌細胞になるとされている。癌細胞は、アポトーシス機構への耐性を得て初めて増殖が可能となる。すなわち、癌はアポトーシス機構が衰退したために生じる病気である。このことから、種々の遺伝子変異を伴う細胞の癌化の過程はアポトーシスに対する耐性能獲得の過程に関係がある。
【0006】
アポトーシスが正常に機能するためには、アポトーシス誘導を刺激する要因が必要である。この要因により、最終的に細胞死滅の実行過程を活性化し.アポトーシスが起きるとされている。従って、アポトーシス誘導刺激となる要因とその誘導物質の究明は癌の予防と治療に対して非常に重要である。
【0007】
特開2005−73502号公報(特許文献1)には、コウタケを抽出して得られるコウタケ抽出物からなるアポトーシス誘導能を有する食品又は食品素材が記載されている。また同公報には、このコウタケ抽出物ががんの抑制乃至予防効果を示すこと、及び、アポトーシス誘導能を有する食品又は食品素材がコウタケ由来のエルゴステロールパーオキサイドからなるものであることが記載されている。
【0008】
また特開2005−35987号公報(特許文献2)には、細胞増殖阻害剤および免疫賦活剤の少なくとも一方を主成分とする悪性腫瘍の治療剤が記載されている。同公報には、前記細胞増殖阻害剤がアポトーシス誘導活性を有するものであり得ること、前記細胞増殖阻害剤がビスフォスフォネート若しくはビタミンK2あるいはそれらの誘導体のうち少なくとも1種とすることができること、並びに、前記免疫賦活剤が、AHCC、溶連菌などの死菌体あるいはその抽出物、丸山ワクチン、アガリクス茸などのキノコやその抽出物等のうち、1種又は2種以上とすることができることが記載されている。
【0009】
更に、特開2008−115158号公報(特許文献3)には、ヒメマツタケ子実体又はその破砕物から得ることができるステロイド誘導体が、アポトーシス誘導作用を有すること、特に、ヒト胃癌細胞及びヒト肺癌細胞のアポトーシスを誘導する作用を有することが記載されている。
【0010】
しかしながら、ヒト大腸癌細胞又はヒト肝癌細胞については、特開2008−115158号公報記載のステロイド誘導体のアポトーシス誘導作用は確認されていない。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2005−73502号公報
【特許文献2】特開2005−35987号公報
【特許文献3】特開2008−115158号公報
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、従来技術に存した上記のような課題に鑑み行われたものであって、その目的とするところは、ヒメマツタケ子実体又はその破砕物から得ることができるステロイド誘導体を有効成分とするヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤を提供することにある。
【課題を解決するための手段】
【0013】
上記目的を達成する本発明のヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤は、式(1)で表されるステロイド誘導体を有効成分とする。
【0014】
【化1】

....(1)
【0015】
また本発明のヒト大腸癌細胞アポトーシス誘導剤は、式(1)で表されるステロイド誘導体を有効成分とするものである。
【0016】
また本発明のヒト肝癌細胞アポトーシス誘導剤は、式(1)で表されるステロイド誘導体を有効成分とするものである。
【発明の効果】
【0017】
本発明のヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤、ヒト大腸癌細胞アポトーシス誘導剤、及びヒト肝癌細胞アポトーシス誘導剤は、それぞれヒト大腸癌細胞又はヒト肝癌細胞、ヒト大腸癌細胞、及びヒト肝癌細胞について、アポトーシス誘導効果を有し、アポトーシスの機能を正常化、活発化させることができる。
【図面の簡単な説明】
【0018】
【図1】式(1)で表されるステロイド誘導体の製造についての概略工程図である。
【図2】式(1)で表されるステロイド誘導体によるCOLO 201の形態変化を示す写真である。
【図3】式(1)で表されるステロイド誘導体によって引き起こされたCOLO201細胞(A)およびHLE細胞(B)のDNA断片化の用量依存性を示す写真である。
【図4】式(1)で表されるステロイド誘導体によって引き起こされたCOLO201細胞(A)およびHLE細胞(B)のDNA断片化の経時的変化を示す写真である。
【図5】本ステロイド誘導体が正常リンパ球細胞に及ぼす影響を示す写真である。
【発明を実施するための形態】
【0019】
本発明のヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤、ヒト大腸癌細胞アポトーシス誘導剤、及びヒト肝癌細胞アポトーシス誘導剤における有効成分である上記式(1)で表されるステロイド誘導体は、ヒメマツタケ(Agaricus blazei Murrill)の子実体又はその破砕物から有機溶媒により抽出される抽出物に含まれる。ヒメマツタケ子実体は、新鮮子実体、乾燥子実体等、何れでもよいが、好ましくは新鮮子実体である。その有機溶媒としては、アセトン、酢酸エチル、クロロホルム、アルコール等の脂溶性のものが好ましく、特にアセトン、クロロホルム、メタノール、エタノールの何れかを単独で又は2以上の混合溶媒として用いることが好ましい。
【0020】
上記式(1)で表されるステロイド誘導体は、低分子の脂質・ステロイド画分であると考えられ、例えば図1の工程図に示されるように製造することができる。
【0021】
すなわち、ヒメマツタケ子実体又はその破砕物に有機溶媒を加えて一定時間撹拌することにより(又はその他の手段により)抽出を行い、この有機溶媒抽出物のろ過又は遠心分離等により得られた上清を濃縮し、濃縮物を得る。この濃縮物に有機溶媒を加えて水層と有機溶媒層に分別する。この有機溶媒層を、飽和炭酸水素ナトリウム水溶液により洗浄し、次いで1規定塩酸水溶液により洗浄し、更に無水硫酸ナトリウムで脱水する。その後、減圧濃縮により濃縮物を得る。この濃縮物をシリカゲルカラムを通過させてカラム吸着物を得る。次いで、このカラム吸着物を有機溶媒で溶出させて、[1]乃至[4]の画分に分画する。このうち[3]の画分について再度クロマトグラフィによる精製を行うことにより、上記式(1)で表されるステロイド誘導体を得ることができる。
【0022】
本発明のヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤、ヒト大腸癌細胞アポトーシス誘導剤、及びヒト肝癌細胞アポトーシス誘導剤は、上記式(1)で表されるステロイド誘導体を有効成分とするものである。
【0023】
本発明のヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤、ヒト大腸癌細胞アポトーシス誘導剤、及びヒト肝癌細胞アポトーシス誘導剤は、何れも、他の成分(例えば賦形剤、結合剤、崩壊剤、滑沢剤、安定剤、矯味矯臭剤等)と混合した状態、各種食品に配合した状態、カプセルに内包した状態、錠剤若しくは顆粒剤等とした状態で、食し又は服用し得る。また、他の液体及び必要に応じ添加剤等(例えば安定剤、矯味矯臭剤等)と混合した状態、各種飲料に溶解させた状態で飲用又は服用することもできる。更に、アポトーシス誘導剤として通常採用し得る他の各種剤形において適用可能であることは言うまでもない。
【0024】
なお、本発明のヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤、ヒト大腸癌細胞アポトーシス誘導剤、及びヒト肝癌細胞アポトーシス誘導剤のヒトの服用量は、本発明のステロイド誘導体含有量において例えば5mg乃至50mg/日程度が好ましい。
【実施例】
【0025】
以下、実施例を挙げて本発明を更に詳細に説明する。尤も、実施例についての記述は、特許請求の範囲に記載された発明を限定し、或は特許請求の範囲を減縮するように解すべきではない。また、本発明の構成は、下記実施例に記載された内容に限らす、特許請求の範囲に記載の技術的範囲内で種々の変形が可能である。
【0026】
製造例[式(1)で表されるステロイド誘導体の製造]
【0027】
ヒメマツタケ新鮮子実体5kgにアセトン10L(リットル)を加え、ミキサーで破砕した後、5時間撹拌した。得られた混合液について、4℃で10分間の遠心分離(遠心加速度:9000×g)を行い、得られた上清(ろ液)を回収した。
【0028】
その上清を50℃で3時間エバポレーターで減圧濃縮し、得られた濃縮物に酢酸エチル2L(リットル)を加えて5時間撹拌した後、水層を除き、酢酸エチル層を得た。その酢酸エチル層を、飽和炭酸水素ナトリウム水溶液で洗浄し、次いで1規定塩酸水溶液で洗浄した後、無水硫酸ナトリウムで脱水し、更に減圧濃縮することにより、酢酸エチル層画分より、15.2gの濃縮物が得られた。
【0029】
本濃縮物をシリカゲルカラム(ワコーゲルC−200,450g 和光純薬社製)を通過させてこのカラムに吸着させ、更にこのカラム吸着物をクロロホルム/メタノール混合溶媒(混合容量比:94:6)で溶出させ、[1]乃至[4]の画分を得た。このうち[3]の画分について再度クロマトグラフィによる精製を行うことにより、450mgの物質を得た。得られた物質をミリポアフィルター(0.22μm)でろ過滅菌して、後記の試験に使用した。
【0030】
このようにして得られた物質は、エルゴステロールの酸化物と考えられ、下記物性を示した。
比旋光度:
【0031】
【数1】

【0032】
電解離脱質量分析法[FDMS (Field Desorption Mass Spectrometry)]:
m/z 444 [M]+
電子衝撃イオン化質量分析法[EIMS (Electron ionization Mass Spectrometry)]:
m/z 426 [M−H2O]+,411 [M−H2O−CH3]+,393 [M−2H2O−CH3]+
赤外吸収分光法[IR (Infrared Spectrometry)]:
【0033】
【数2】

【0034】
以上のデータより、前記物質は、前記式(1)で表されるステロイド誘導体(β,5α−Dihydroxy−6β−methoxyergosta−7,22−diene)[以下、「本ステロイド誘導体」とも言う。]であることが確認された。
【0035】
なお、本製造例では、ヒメマツタケ子実体又はその破砕物中の新規活性ステロイド成分の抽出において、有機溶媒としてクロロホルム/メタノール混合溶媒(混合容量比:94:6)を用いてカラム吸着物の溶出を行った。
【0036】
細胞培養
【0037】
ヒトの大腸癌COLO201細胞を10%ウシ胎児血清、ペニシリンG(50IU/ml)およびストレプトマイシン(50μg/ml)を含むRPMI 1640培地中で増殖させた。ヒト肝細胞癌HLE細胞を10%ウシ胎児血清、ペニシリンG(50IU/ml)およびストレプトマイシン(50μg/ml)を含むダルベッコ変法イーグル培地中で増殖させた。これらの細胞を加湿95%空気−5%二酸化炭素雰囲気下で37℃で培養し、4日ごとに継代した。マイコプラズマ試験は常に陰性であった。
【0038】
ヒトリンパ球細胞の増殖
【0039】
3mlのリンパ球分離培地を遠心管に無菌的に移し、希釈済み血液(ヘパリン化血液:生理食塩水=1:1)をその遠心管中のリンパ球分離培地に上層した。遠心管を室温下、400×gで20分間遠心分離した。透明血漿の上澄層を除去し、リンパ球層を新しい遠心管に移した。等量のPBS(-)を試験管中のリンパ球層に加え、室温で260×gで10分間遠心分離した。この遠心分離の後、沈澱したリンパ球を再度PBS(-)で洗い、10%のFRSと2%のフィトヘマグルチニンM[ギブコ社(Gibco Laboratories, Grand Island, NY, USA)]を含むRPMI 1640培地に懸濁した。得られた正常リンパ球細胞をベヒクルまたは本ステロイド誘導体の存在下で培養した。
【0040】
COLO201細胞の形態変化の顕微鏡観察
【0041】
指数関数的に増殖中のCOLO 201細胞を、初回濃度3〜4×105個/mlで平板培養した。ベヒクルまたは本ステロイド誘導体の存在下で3日間培養した後、細胞を1%のグルタルアルデヒドで固定し、ヘキスト33258で染色した。染色細胞の形態をOkumuraら(Okumura K, Nobami M, Taguchi H, Hisamatsu H and Tanaka K : The genes for the s-type HC3 and s-type HC5 subunits of human proteasome map to chromosomes 6q27 and 7q12-p13 by fluorescence in situ hybridization. Genomics 27 : 377-379, 1995.)の報告に従い、冷却CCDカメラデジタル画像処理装置と富士フィルム社製ピクトログラフィー3000を取り付けた落射蛍光顕微鏡で調べた。
【0042】
DNA断片化の測定
【0043】
指数関数的に増殖中のCOLO201およびHLE癌細胞株を3〜4×105個/mlで平板培養した。ベヒクルまたは本ステロイド誘導体の存在下で1〜3日間培養した後、細胞を緩徐遠心分離によってペレット化した。既報(Hibasami H, Shohji T, Shibuya I, Higo K and Kanda T : Induction of apoptosis by three types of procyanidin isolated from apple in human stomach cancer KATO III cells. Int J Mol Med 13 : 795-799, 2004)に従い、DNAを細胞ペレットから単離した。等量のDNA 2μgを2%アガロースゲルのウエルに加え、2mM EDTAを含む40mMトリス−酢酸(pH7.5)緩衝液中で電気泳動にかけた。
【0044】
本ステロイド誘導体によるCOLO 201の形態変化
【0045】
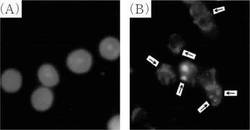
図2は、本ステロイド誘導体によるCOLO201細胞の形態変化を示す写真である。
【0046】
(A)は無処理COLO201細胞についての写真であり、(B)は200μMの本ステロイド誘導体で処理したCOLO201細胞についての写真である。これらの細胞を本ステロイド誘導体とともに3日間培養し、1%グルタルアルデヒドで固定し、ヘキスト33258で染色した後、冷却CCDカメラデジタル画像装置と富士フィルム社製ピクトログラフィー3000を取り付けた落射蛍光顕微鏡(Phometrics社製PxL1400)下で調べた。矢印はアポトーシスを起こした細胞を示す。
【0047】
図2に示すように、200μMの本ステロイド誘導体を培養物に添加した後で、COLO 201細胞においてアポトーシス体を示す形態的変化が認められた。
【0048】
細胞株における本ステロイド誘導体によるアポトーシスの誘導
【0049】
本ステロイド誘導体が有意な増殖阻害活性を示したことから、その効果の一部がアポトーシス誘導によるものかどうか検討した。
【0050】
ゲノムDNAがオリゴヌクレオソーム大の断片に分解される現象(DNAラダー)はアポトーシス発現に特徴的に見られる。
【0051】
図3は、式(1)で表されるステロイド誘導体によって引き起こされたCOLO201細胞(A)およびHLE細胞(B)のDNA断片化の用量依存性を示す写真である。
【0052】
細胞をベヒクル(レーン1)または本ステロイド誘導体50μM(レーン2)、100μM(レーン3)、200μM(レーン4)の存在下、3日間培養した。
【0053】
本ステロイド誘導体処理細胞からDNAを単離した後、等量のDNA(2μg)を2%アガロースゲルのウエルに添加し、2mMのEDTAを含むpH7.5の40mMトリス−酢酸中で電気泳動にかけた。
【0054】
M:HindIIIで消化したλDNA
【0055】
図3に示すように、COLO 201細胞(A)では、100および200μMの本ステロイド誘導体濃度でDNAラダーが認められ、HLE細胞(B)では、より低濃度で認められた。
【0056】
図4は、式(1)で表されるステロイド誘導体によって引き起こされたCOLO201細胞(A)およびHLE細胞(B)のDNA断片化の経時的変化を示す写真である。
【0057】
細胞をベヒクル(レーン1)または200μMの本ステロイド誘導体の存在下、1日間(レーン2)、2日間(レーン3)および3日間(レーン4)培養した。
【0058】
本ステロイド誘導体処理細胞からDNAを単離した後、等量のDNA(2μg)を2%アガロースゲルのウエルに添加し、2mMのEDTAを含むpH7.5の40mMトリス−酢酸中で電気泳動にかけた。
【0059】
M:HindIIIで消化したDNA
【0060】
図4に示すように、DNAラダーは、200μMの本ステロイド誘導体で処理したCOLO 201(B)細胞では、200μMの本ステロイド誘導体を培養物に添加してから2日目以後に認められ、HLE細胞(B)では、3日目以後に認められた。
【0061】
図5は、本ステロイド誘導体が正常リンパ球細胞に及ぼす影響を示す写真である。
【0062】
細胞をベヒクル(レーン1)または本ステロイド誘導体50μM(レーン2)、100μM(レーン3)、200μM(レーン4)の存在下、3日間培養した。カルコン処理細胞からDNAを単離した後、等量のDNA(2μg)を2%アガロースゲルのウエルに添加し、2mMのEDTAを含むpH7.5の40mMトリス−酢酸中で電気泳動にかけた。
M:HindIIIで消化したλDNA
【0063】
健康志願者から調製された正常白血球では、本ステロイド誘導体によるアポトーシス誘導を認めていない(図5)。健康志願者から調製された非癌性リンパ球は本ステロイド誘導体の影響を受けなかったことから、これらの化合物の活性は癌細胞に対して特異的なものであって、健康組織には破壊作用を示さないことが示唆された。
【技術分野】
【0001】
本発明は、ヒメマツタケ子実体又はその破砕物から得ることができるステロイド誘導体を有効成分とするヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤に関する。
【背景技術】
【0002】
現在、日本において癌は死亡原因のトップの病気であり、その予防や治療に対する人々の関心は非常に高い。また、日常的に取り人れることができる癌予防及び治療のための方法が数多く提案されている。
【0003】
従来の多くの抗癌剤は、正常細胞と癌細胞の区別なく直接的に殺細胞的に作用し、癌細胞の増殖を阻害する(伊藤均,抗腫瘍剤 日高弘義編 阻害剤研究法 共立出版 東京 1985年 453-468頁)。このような殺細胞性抗癌剤は、使用量や使用期間等を最適に設定することが困難であり、さらにその副作用は癌患者にとって大きな負担となるものである。
【0004】
近年、癌研究の分野ではアポトーシス、すなわち細胞自滅に関する研究が盛んに行なわれている。アポトーシスは生物個体発生における組織、臓器の形成、生体の恒常性の維持と防衛に重要な働きをするだけではなく、多くの病気の発生に深い関係があることが解明されつつある。
【0005】
アポトーシスによる細胞の制御作用の異常は、癌形成の一つの原因であると考えられている。本来死滅すべき細胞がアポトーシス、つまり細胞自滅を起こすことなく生き残ると、その細胞が様々な刺激を受けて染色体に変異を重ね、最終的に癌細胞になるとされている。癌細胞は、アポトーシス機構への耐性を得て初めて増殖が可能となる。すなわち、癌はアポトーシス機構が衰退したために生じる病気である。このことから、種々の遺伝子変異を伴う細胞の癌化の過程はアポトーシスに対する耐性能獲得の過程に関係がある。
【0006】
アポトーシスが正常に機能するためには、アポトーシス誘導を刺激する要因が必要である。この要因により、最終的に細胞死滅の実行過程を活性化し.アポトーシスが起きるとされている。従って、アポトーシス誘導刺激となる要因とその誘導物質の究明は癌の予防と治療に対して非常に重要である。
【0007】
特開2005−73502号公報(特許文献1)には、コウタケを抽出して得られるコウタケ抽出物からなるアポトーシス誘導能を有する食品又は食品素材が記載されている。また同公報には、このコウタケ抽出物ががんの抑制乃至予防効果を示すこと、及び、アポトーシス誘導能を有する食品又は食品素材がコウタケ由来のエルゴステロールパーオキサイドからなるものであることが記載されている。
【0008】
また特開2005−35987号公報(特許文献2)には、細胞増殖阻害剤および免疫賦活剤の少なくとも一方を主成分とする悪性腫瘍の治療剤が記載されている。同公報には、前記細胞増殖阻害剤がアポトーシス誘導活性を有するものであり得ること、前記細胞増殖阻害剤がビスフォスフォネート若しくはビタミンK2あるいはそれらの誘導体のうち少なくとも1種とすることができること、並びに、前記免疫賦活剤が、AHCC、溶連菌などの死菌体あるいはその抽出物、丸山ワクチン、アガリクス茸などのキノコやその抽出物等のうち、1種又は2種以上とすることができることが記載されている。
【0009】
更に、特開2008−115158号公報(特許文献3)には、ヒメマツタケ子実体又はその破砕物から得ることができるステロイド誘導体が、アポトーシス誘導作用を有すること、特に、ヒト胃癌細胞及びヒト肺癌細胞のアポトーシスを誘導する作用を有することが記載されている。
【0010】
しかしながら、ヒト大腸癌細胞又はヒト肝癌細胞については、特開2008−115158号公報記載のステロイド誘導体のアポトーシス誘導作用は確認されていない。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2005−73502号公報
【特許文献2】特開2005−35987号公報
【特許文献3】特開2008−115158号公報
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、従来技術に存した上記のような課題に鑑み行われたものであって、その目的とするところは、ヒメマツタケ子実体又はその破砕物から得ることができるステロイド誘導体を有効成分とするヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤を提供することにある。
【課題を解決するための手段】
【0013】
上記目的を達成する本発明のヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤は、式(1)で表されるステロイド誘導体を有効成分とする。
【0014】
【化1】

....(1)
【0015】
また本発明のヒト大腸癌細胞アポトーシス誘導剤は、式(1)で表されるステロイド誘導体を有効成分とするものである。
【0016】
また本発明のヒト肝癌細胞アポトーシス誘導剤は、式(1)で表されるステロイド誘導体を有効成分とするものである。
【発明の効果】
【0017】
本発明のヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤、ヒト大腸癌細胞アポトーシス誘導剤、及びヒト肝癌細胞アポトーシス誘導剤は、それぞれヒト大腸癌細胞又はヒト肝癌細胞、ヒト大腸癌細胞、及びヒト肝癌細胞について、アポトーシス誘導効果を有し、アポトーシスの機能を正常化、活発化させることができる。
【図面の簡単な説明】
【0018】
【図1】式(1)で表されるステロイド誘導体の製造についての概略工程図である。
【図2】式(1)で表されるステロイド誘導体によるCOLO 201の形態変化を示す写真である。
【図3】式(1)で表されるステロイド誘導体によって引き起こされたCOLO201細胞(A)およびHLE細胞(B)のDNA断片化の用量依存性を示す写真である。
【図4】式(1)で表されるステロイド誘導体によって引き起こされたCOLO201細胞(A)およびHLE細胞(B)のDNA断片化の経時的変化を示す写真である。
【図5】本ステロイド誘導体が正常リンパ球細胞に及ぼす影響を示す写真である。
【発明を実施するための形態】
【0019】
本発明のヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤、ヒト大腸癌細胞アポトーシス誘導剤、及びヒト肝癌細胞アポトーシス誘導剤における有効成分である上記式(1)で表されるステロイド誘導体は、ヒメマツタケ(Agaricus blazei Murrill)の子実体又はその破砕物から有機溶媒により抽出される抽出物に含まれる。ヒメマツタケ子実体は、新鮮子実体、乾燥子実体等、何れでもよいが、好ましくは新鮮子実体である。その有機溶媒としては、アセトン、酢酸エチル、クロロホルム、アルコール等の脂溶性のものが好ましく、特にアセトン、クロロホルム、メタノール、エタノールの何れかを単独で又は2以上の混合溶媒として用いることが好ましい。
【0020】
上記式(1)で表されるステロイド誘導体は、低分子の脂質・ステロイド画分であると考えられ、例えば図1の工程図に示されるように製造することができる。
【0021】
すなわち、ヒメマツタケ子実体又はその破砕物に有機溶媒を加えて一定時間撹拌することにより(又はその他の手段により)抽出を行い、この有機溶媒抽出物のろ過又は遠心分離等により得られた上清を濃縮し、濃縮物を得る。この濃縮物に有機溶媒を加えて水層と有機溶媒層に分別する。この有機溶媒層を、飽和炭酸水素ナトリウム水溶液により洗浄し、次いで1規定塩酸水溶液により洗浄し、更に無水硫酸ナトリウムで脱水する。その後、減圧濃縮により濃縮物を得る。この濃縮物をシリカゲルカラムを通過させてカラム吸着物を得る。次いで、このカラム吸着物を有機溶媒で溶出させて、[1]乃至[4]の画分に分画する。このうち[3]の画分について再度クロマトグラフィによる精製を行うことにより、上記式(1)で表されるステロイド誘導体を得ることができる。
【0022】
本発明のヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤、ヒト大腸癌細胞アポトーシス誘導剤、及びヒト肝癌細胞アポトーシス誘導剤は、上記式(1)で表されるステロイド誘導体を有効成分とするものである。
【0023】
本発明のヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤、ヒト大腸癌細胞アポトーシス誘導剤、及びヒト肝癌細胞アポトーシス誘導剤は、何れも、他の成分(例えば賦形剤、結合剤、崩壊剤、滑沢剤、安定剤、矯味矯臭剤等)と混合した状態、各種食品に配合した状態、カプセルに内包した状態、錠剤若しくは顆粒剤等とした状態で、食し又は服用し得る。また、他の液体及び必要に応じ添加剤等(例えば安定剤、矯味矯臭剤等)と混合した状態、各種飲料に溶解させた状態で飲用又は服用することもできる。更に、アポトーシス誘導剤として通常採用し得る他の各種剤形において適用可能であることは言うまでもない。
【0024】
なお、本発明のヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤、ヒト大腸癌細胞アポトーシス誘導剤、及びヒト肝癌細胞アポトーシス誘導剤のヒトの服用量は、本発明のステロイド誘導体含有量において例えば5mg乃至50mg/日程度が好ましい。
【実施例】
【0025】
以下、実施例を挙げて本発明を更に詳細に説明する。尤も、実施例についての記述は、特許請求の範囲に記載された発明を限定し、或は特許請求の範囲を減縮するように解すべきではない。また、本発明の構成は、下記実施例に記載された内容に限らす、特許請求の範囲に記載の技術的範囲内で種々の変形が可能である。
【0026】
製造例[式(1)で表されるステロイド誘導体の製造]
【0027】
ヒメマツタケ新鮮子実体5kgにアセトン10L(リットル)を加え、ミキサーで破砕した後、5時間撹拌した。得られた混合液について、4℃で10分間の遠心分離(遠心加速度:9000×g)を行い、得られた上清(ろ液)を回収した。
【0028】
その上清を50℃で3時間エバポレーターで減圧濃縮し、得られた濃縮物に酢酸エチル2L(リットル)を加えて5時間撹拌した後、水層を除き、酢酸エチル層を得た。その酢酸エチル層を、飽和炭酸水素ナトリウム水溶液で洗浄し、次いで1規定塩酸水溶液で洗浄した後、無水硫酸ナトリウムで脱水し、更に減圧濃縮することにより、酢酸エチル層画分より、15.2gの濃縮物が得られた。
【0029】
本濃縮物をシリカゲルカラム(ワコーゲルC−200,450g 和光純薬社製)を通過させてこのカラムに吸着させ、更にこのカラム吸着物をクロロホルム/メタノール混合溶媒(混合容量比:94:6)で溶出させ、[1]乃至[4]の画分を得た。このうち[3]の画分について再度クロマトグラフィによる精製を行うことにより、450mgの物質を得た。得られた物質をミリポアフィルター(0.22μm)でろ過滅菌して、後記の試験に使用した。
【0030】
このようにして得られた物質は、エルゴステロールの酸化物と考えられ、下記物性を示した。
比旋光度:
【0031】
【数1】

【0032】
電解離脱質量分析法[FDMS (Field Desorption Mass Spectrometry)]:
m/z 444 [M]+
電子衝撃イオン化質量分析法[EIMS (Electron ionization Mass Spectrometry)]:
m/z 426 [M−H2O]+,411 [M−H2O−CH3]+,393 [M−2H2O−CH3]+
赤外吸収分光法[IR (Infrared Spectrometry)]:
【0033】
【数2】

【0034】
以上のデータより、前記物質は、前記式(1)で表されるステロイド誘導体(β,5α−Dihydroxy−6β−methoxyergosta−7,22−diene)[以下、「本ステロイド誘導体」とも言う。]であることが確認された。
【0035】
なお、本製造例では、ヒメマツタケ子実体又はその破砕物中の新規活性ステロイド成分の抽出において、有機溶媒としてクロロホルム/メタノール混合溶媒(混合容量比:94:6)を用いてカラム吸着物の溶出を行った。
【0036】
細胞培養
【0037】
ヒトの大腸癌COLO201細胞を10%ウシ胎児血清、ペニシリンG(50IU/ml)およびストレプトマイシン(50μg/ml)を含むRPMI 1640培地中で増殖させた。ヒト肝細胞癌HLE細胞を10%ウシ胎児血清、ペニシリンG(50IU/ml)およびストレプトマイシン(50μg/ml)を含むダルベッコ変法イーグル培地中で増殖させた。これらの細胞を加湿95%空気−5%二酸化炭素雰囲気下で37℃で培養し、4日ごとに継代した。マイコプラズマ試験は常に陰性であった。
【0038】
ヒトリンパ球細胞の増殖
【0039】
3mlのリンパ球分離培地を遠心管に無菌的に移し、希釈済み血液(ヘパリン化血液:生理食塩水=1:1)をその遠心管中のリンパ球分離培地に上層した。遠心管を室温下、400×gで20分間遠心分離した。透明血漿の上澄層を除去し、リンパ球層を新しい遠心管に移した。等量のPBS(-)を試験管中のリンパ球層に加え、室温で260×gで10分間遠心分離した。この遠心分離の後、沈澱したリンパ球を再度PBS(-)で洗い、10%のFRSと2%のフィトヘマグルチニンM[ギブコ社(Gibco Laboratories, Grand Island, NY, USA)]を含むRPMI 1640培地に懸濁した。得られた正常リンパ球細胞をベヒクルまたは本ステロイド誘導体の存在下で培養した。
【0040】
COLO201細胞の形態変化の顕微鏡観察
【0041】
指数関数的に増殖中のCOLO 201細胞を、初回濃度3〜4×105個/mlで平板培養した。ベヒクルまたは本ステロイド誘導体の存在下で3日間培養した後、細胞を1%のグルタルアルデヒドで固定し、ヘキスト33258で染色した。染色細胞の形態をOkumuraら(Okumura K, Nobami M, Taguchi H, Hisamatsu H and Tanaka K : The genes for the s-type HC3 and s-type HC5 subunits of human proteasome map to chromosomes 6q27 and 7q12-p13 by fluorescence in situ hybridization. Genomics 27 : 377-379, 1995.)の報告に従い、冷却CCDカメラデジタル画像処理装置と富士フィルム社製ピクトログラフィー3000を取り付けた落射蛍光顕微鏡で調べた。
【0042】
DNA断片化の測定
【0043】
指数関数的に増殖中のCOLO201およびHLE癌細胞株を3〜4×105個/mlで平板培養した。ベヒクルまたは本ステロイド誘導体の存在下で1〜3日間培養した後、細胞を緩徐遠心分離によってペレット化した。既報(Hibasami H, Shohji T, Shibuya I, Higo K and Kanda T : Induction of apoptosis by three types of procyanidin isolated from apple in human stomach cancer KATO III cells. Int J Mol Med 13 : 795-799, 2004)に従い、DNAを細胞ペレットから単離した。等量のDNA 2μgを2%アガロースゲルのウエルに加え、2mM EDTAを含む40mMトリス−酢酸(pH7.5)緩衝液中で電気泳動にかけた。
【0044】
本ステロイド誘導体によるCOLO 201の形態変化
【0045】
図2は、本ステロイド誘導体によるCOLO201細胞の形態変化を示す写真である。
【0046】
(A)は無処理COLO201細胞についての写真であり、(B)は200μMの本ステロイド誘導体で処理したCOLO201細胞についての写真である。これらの細胞を本ステロイド誘導体とともに3日間培養し、1%グルタルアルデヒドで固定し、ヘキスト33258で染色した後、冷却CCDカメラデジタル画像装置と富士フィルム社製ピクトログラフィー3000を取り付けた落射蛍光顕微鏡(Phometrics社製PxL1400)下で調べた。矢印はアポトーシスを起こした細胞を示す。
【0047】
図2に示すように、200μMの本ステロイド誘導体を培養物に添加した後で、COLO 201細胞においてアポトーシス体を示す形態的変化が認められた。
【0048】
細胞株における本ステロイド誘導体によるアポトーシスの誘導
【0049】
本ステロイド誘導体が有意な増殖阻害活性を示したことから、その効果の一部がアポトーシス誘導によるものかどうか検討した。
【0050】
ゲノムDNAがオリゴヌクレオソーム大の断片に分解される現象(DNAラダー)はアポトーシス発現に特徴的に見られる。
【0051】
図3は、式(1)で表されるステロイド誘導体によって引き起こされたCOLO201細胞(A)およびHLE細胞(B)のDNA断片化の用量依存性を示す写真である。
【0052】
細胞をベヒクル(レーン1)または本ステロイド誘導体50μM(レーン2)、100μM(レーン3)、200μM(レーン4)の存在下、3日間培養した。
【0053】
本ステロイド誘導体処理細胞からDNAを単離した後、等量のDNA(2μg)を2%アガロースゲルのウエルに添加し、2mMのEDTAを含むpH7.5の40mMトリス−酢酸中で電気泳動にかけた。
【0054】
M:HindIIIで消化したλDNA
【0055】
図3に示すように、COLO 201細胞(A)では、100および200μMの本ステロイド誘導体濃度でDNAラダーが認められ、HLE細胞(B)では、より低濃度で認められた。
【0056】
図4は、式(1)で表されるステロイド誘導体によって引き起こされたCOLO201細胞(A)およびHLE細胞(B)のDNA断片化の経時的変化を示す写真である。
【0057】
細胞をベヒクル(レーン1)または200μMの本ステロイド誘導体の存在下、1日間(レーン2)、2日間(レーン3)および3日間(レーン4)培養した。
【0058】
本ステロイド誘導体処理細胞からDNAを単離した後、等量のDNA(2μg)を2%アガロースゲルのウエルに添加し、2mMのEDTAを含むpH7.5の40mMトリス−酢酸中で電気泳動にかけた。
【0059】
M:HindIIIで消化したDNA
【0060】
図4に示すように、DNAラダーは、200μMの本ステロイド誘導体で処理したCOLO 201(B)細胞では、200μMの本ステロイド誘導体を培養物に添加してから2日目以後に認められ、HLE細胞(B)では、3日目以後に認められた。
【0061】
図5は、本ステロイド誘導体が正常リンパ球細胞に及ぼす影響を示す写真である。
【0062】
細胞をベヒクル(レーン1)または本ステロイド誘導体50μM(レーン2)、100μM(レーン3)、200μM(レーン4)の存在下、3日間培養した。カルコン処理細胞からDNAを単離した後、等量のDNA(2μg)を2%アガロースゲルのウエルに添加し、2mMのEDTAを含むpH7.5の40mMトリス−酢酸中で電気泳動にかけた。
M:HindIIIで消化したλDNA
【0063】
健康志願者から調製された正常白血球では、本ステロイド誘導体によるアポトーシス誘導を認めていない(図5)。健康志願者から調製された非癌性リンパ球は本ステロイド誘導体の影響を受けなかったことから、これらの化合物の活性は癌細胞に対して特異的なものであって、健康組織には破壊作用を示さないことが示唆された。
【特許請求の範囲】
【請求項1】
式(1)で表されるステロイド誘導体を有効成分とするヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤。
【化1】

....(1)
【請求項2】
式(1)で表されるステロイド誘導体を有効成分とする請求項1記載のヒト大腸癌細胞アポトーシス誘導剤。
【請求項3】
式(1)で表されるステロイド誘導体を有効成分とする請求項1記載のヒト肝癌細胞アポトーシス誘導剤。
【請求項1】
式(1)で表されるステロイド誘導体を有効成分とするヒト大腸癌細胞又はヒト肝癌細胞アポトーシス誘導剤。
【化1】

....(1)
【請求項2】
式(1)で表されるステロイド誘導体を有効成分とする請求項1記載のヒト大腸癌細胞アポトーシス誘導剤。
【請求項3】
式(1)で表されるステロイド誘導体を有効成分とする請求項1記載のヒト肝癌細胞アポトーシス誘導剤。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2010−229077(P2010−229077A)
【公開日】平成22年10月14日(2010.10.14)
【国際特許分類】
【出願番号】特願2009−78216(P2009−78216)
【出願日】平成21年3月27日(2009.3.27)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年9月30日 日本癌学会発行の「第67回 日本癌学会学術総会」に発表
【出願人】(504136144)
【出願人】(591253249)パワフル健康食品株式会社 (4)
【出願人】(596120326)株式会社サン・クロレラ (8)
【Fターム(参考)】
【公開日】平成22年10月14日(2010.10.14)
【国際特許分類】
【出願日】平成21年3月27日(2009.3.27)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年9月30日 日本癌学会発行の「第67回 日本癌学会学術総会」に発表
【出願人】(504136144)

【出願人】(591253249)パワフル健康食品株式会社 (4)
【出願人】(596120326)株式会社サン・クロレラ (8)
【Fターム(参考)】
[ Back to top ]

