アミノ化合物の製造方法
【課題】多価アルコールやアミノアルコールとアンモニア若しくは第1級アミン又は第2級アミンとを反応させて、対応する第3級アミンやアミノアルコール等を製造するアミノ化合物の製造方法に関し、触媒にパラジウムやルテニウム等の貴金属を用いていないのでランニングコストを抑制することができるとともに、高い反応速度で高収率かつ選択性よく工業的に有用な第3級アミン等のアミノ化合物を製造できるアミノ化合物の製造方法を提供することを目的とする。
【解決手段】本発明は、多価アルコールとアンモニア若しくは第1級アミン又は第2級アミンとを、銅、ニッケル、カルシウム、アルカリ金属又はアルカリ土類金属(カルシウムを除く)を必須成分とする触媒の存在下、反応させる構成を備える。
【解決手段】本発明は、多価アルコールとアンモニア若しくは第1級アミン又は第2級アミンとを、銅、ニッケル、カルシウム、アルカリ金属又はアルカリ土類金属(カルシウムを除く)を必須成分とする触媒の存在下、反応させる構成を備える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、多価アルコールやアミノアルコールとアンモニア若しくは第1級アミン又は第2級アミンとを反応させて、対応する第3級アミンやアミノアルコール等を製造するアミノ化合物の製造方法に関するものである。
【背景技術】
【0002】
アミノ化合物の1種であるN,N,N’,N’-テトラメチル-α,ω-アルキレンジアミンは、一般式(A)で示される工業的に重要な第3級アミンであり、ウレタンフォーム製造時の触媒として使用され、主にn=2,3又は6のものが製造販売されている。
Me2N-(CH2)n-NMe2 …(A)
また、一般式(B)で示される中間体のアミノアルコールは、反応性ウレタン触媒とよばれ、一般式(A)で示される第3級アミンと比較して、劣悪な刺激臭と眼粘膜刺激性が少ないため作業環境の向上をもたらすとともに、さらに活性水素(水酸基)を有するためウレタン原料であるイソシアネートと反応してポリウレタン樹脂骨格に組み込まれることからウレタン触媒の蒸散が抑制され、それ故、ポリウレタン樹脂やウレタンフォームの耐フォギング性、耐ビニルシステイン性、耐熱性を向上させることができるため高い評価を得ている重要なアミノ化合物である。
Me2N-(CH2)n-OH …(B)
【0003】
ここで、一般式(A)で示される第3級アミンの一般的な製造方法としては、一般式(C)で示される対応する第1級アミンの還元メチル化反応法と、化学反応式(D)で示される多価アルコールのアミノ化反応法がある。なお、ここでは多価アルコールとして2価アルコール(ジオール)を例示する。
H2N-(CH2)n-NH2 …(C)
HO-(CH2)n-OH → Me2N-(CH2)n-NMe2+2H2O …(D)
なお、化学反応式(D)のアミノ化反応は、化学反応式(E),(F)の逐次反応で進行し、化学反応式(F)で示す2段目の反応の速度が従来触媒では一般に遅いことが知られている。
HO-(CH2)n-OH+Me2NH → Me2N-(CH2)n-OH+H2O…(E)
Me2N-(CH2)n-OH+Me2NH → Me2N-(CH2)n-NMe2+H2O …(F)
【0004】
前者の還元メチル化反応法は、例えば(特許文献1)に記載されているように、反応の際にホルムアルデヒドを過剰に必要とするため、未反応のホルムアルデヒドの後処理が負荷となり工業的に不利である。一方、後者の化学反応式(D)で示されるアミノ化反応法は、第3級アミン以外には反応水が生成するだけなので、グリーンケミストリーの観点からも工業的に有利な製造方法である。
そこで、多価アルコールを出発原料として、アミノ化反応によって第3級アミン等のアミノ化合物を製造するための方法が開発されている。
【0005】
従来の技術としては、例えば(特許文献2)に「多価アルコールと環状第1級又は第2級アミンとを、(a)銅のカルボン酸塩又は銅の分子内錯体として銅アセチルアセトン錯体と、(b)周期律表第8族元素、マンガン及び亜鉛から選ばれる金属のカルボン酸塩又は分子内錯体としてアセチルアセトン錯体の1種又は2種以上と、(c)カルボン酸又はカルボン酸のアルカリ金属塩若しくはアルカリ土類金属塩の1種又は2種以上と、の混合物を水素とアミンの混合物又は他の還元剤で還元処理した触媒の存在下、150〜300℃の温度で反応させる第3級アミンの製造方法」が開示されている。
(特許文献3)には「多価アルコールと第1級アミン若しくは第2級アミンとを、銅−ニッケル−第8族白金元素触媒の存在下に、反応で生成した水を除去しつつ、大気圧乃至は5気圧以下の加圧下、150℃乃至250℃の温度で反応させる第3級アミンの製造方法」が開示されている。
(特許文献4)や(特許文献5)には「ジオールと第1級アミンとを、銅−ニッケル−第8族白金元素触媒の存在下に、反応で生成した水を除去しつつ、150℃乃至250℃の温度で反応させてアミノアルコールを製造する技術」が開示されている。
【特許文献1】特開2000−159731号公報
【特許文献2】特公昭60−11020号公報
【特許文献3】特公平3−4534号公報
【特許文献4】特開平5−39338号公報
【特許文献5】特開平5−93031号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら上記従来の技術においては、以下のような課題を有していた。
(1)(特許文献2)には多価アルコールから第3級アミンを製造した実施例の記載がないため、本発明者らが明細書の記載に従ってステアリン酸銅、ステアリン酸ニッケル、ステアリン酸バリウムを触媒原料に用いて、1,6−へキサンジオール(多価アルコール)を、モルホリンに代えてジメチルアミン(第2級アミン)と反応させる追試を行ったところ、触媒が凝集してしまい高速で効率的なアミノ化反応を実現できなかった。これらの触媒原料は、極性の高い多価アルコール中では有効に活性化されず、また活性化されたとしても触媒の安定性が不十分なため、触媒を十分活性化させることができず、多価アルコールを効率よくアミノ化することができなかった。
(2)(特許文献3)の実施例13には、銅−ニッケル−ルテニウム系触媒を用いて、1,6−へキサンジオールをアミノ化した実施例が記載されているが、(特許文献3)に開示された触媒の第8族白金元素は、高価で触媒の製造コストが嵩み工業的に不利であるという課題を有していた。さらに、該特許の触媒の活性を追試した結果、触媒製造コストの基礎になる銅単位重量当たりの触媒活性(反応速度)が低く、生産性が乏しいことが確認された。
(3)(特許文献4)や(特許文献5)に開示の技術も、助触媒としてパラジウム等の第8族白金元素を用いているため、触媒の製造コストが嵩み工業的に不利であるという課題を有していた。また、触媒の活性が低いため、多価アルコールに対する触媒の使用量が2〜4wt%と非常に多く多大なランニングコストを要するという課題を有していた。
(4)逐次反応で進行する多価アルコールのアミノ化反応は、化学反応式(F)で示される2段目の反応性が非常に低いため、(特許文献2)乃至(特許文献5)に開示された触媒では活性が低く反応の完結に長時間を要し、また多量の副生物(アルドール縮合物)が生成するため、目的とするアミンやアミノアルコールを高収率で選択性良く製造できなかった。
【0007】
本発明は上記従来の課題を解決するもので、触媒にパラジウムやルテニウム等の貴金属を用いていないので、ランニングコストを抑制することができるとともに、高い反応速度で高収率かつ選択性よく工業的に有用な第3級アミン等のアミノ化合物を製造できるアミノ化合物の製造方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
上記従来の課題を解決するために本発明のアミノ化合物の製造方法は、以下の構成を有している。
本発明の請求項1に記載のアミノ化合物の製造方法は、多価アルコールとアンモニア若しくは第1級アミン又は第2級アミンとを、銅、ニッケル、カルシウム、アルカリ金属又はアルカリ土類金属(カルシウムを除く)を必須成分とする触媒の存在下、反応させる構成を有している。
この構成により、以下のような作用が得られる。
(1)銅、ニッケル、カルシウム、アルカリ金属又はアルカリ土類金属(カルシウムを除く)を必須成分とする触媒の存在下で反応させることによって、高い反応速度で高収率かつ選択性よく工業的に有用な第3級アミン等のアミノ化合物を製造することができる。特に、アミノ化反応は、化学反応式(F)で示される2段目の反応速度が極めて低いのであるが、従来と比較して、2段目の反応速度が著しく高く高活性化できることがわかった。
(2)触媒が高活性であるため、反応条件が温和であるとともに、少量の触媒で短時間で反応を完結させることができ低原価で生産性に著しく優れる。
(3)触媒にパラジウムやルテニウム等の貴金属を用いていないので、触媒のランニングコストを抑制することができる。
(4)貴金属含有に由来する原料アミンおよび生成アミンの不均化反応が大幅に抑制され、生成アミンの選択性を向上させることができる。
【0009】
ここで、出発原料の多価アルコールとしては、1,3−プロパンジオール,1,4−ブタンジオール、1,5−ペンタンジオール、1,6−へキサンジオール、1,8−オクタンジオール、1,9−ノナンジオール、1,10−デカンジオール、1,12−ドデカンジオール、12−ヒドロキシステアリルアルコール、エチレングリコール、トリエチレングリコール、プロピレングリコール等の2価アルコール、グリセリン等の3価アルコール等が用いられる。1,10−デカンジオールは、ひまし油のアルカリ酸化によって製造されるセバシン酸又はそのジメチルエステルの水素還元によって製造することができ、12−ヒドロキシステアリルアルコールは、リシノレイン酸の水素化によって製造することができる。
【0010】
出発原料のアミノアルコールとしては、化学反応式(E),(F)の逐次反応の中間体であって、前記多価アルコールをアミノ化することで得られるアミノ基と水酸基を有する化合物が用いられ、例えば、モノエタノールアミン、ジエタノールアミン、メチルジエタノールアミン、メチルエタノールアミン、ジメチルエタノールアミン、ジエチルエタノールアミン、ジイソプロピルエタノールアミン、ジブチルエタノールアミンが挙げられる。
【0011】
出発原料としての原料アミンは、アンモニア、一般式R1NH2で示される第1級アミン、一般式R2N2Hで示される第2級アミンが用いられる。
ここで、R1は炭素数1〜6の直鎖又は分岐鎖、脂環式のアルキル基、モルホリル基等の脂環式ヘテロ環であり、第1級アミンとしては、メチルアミン、エチルアミン、プロピルアミン、シクロヘキシルアミン等を挙げることができる。R2は炭素数1〜4の直鎖のアルキル基であり、第2級アミンとしては、ジメチルアミン、ジエチルアミン、ジプロピルアミン、ジブチルアミン等を挙げることができる。また、その他の原料アミンとしてはベンジルアミン等の芳香族アミン、シクロヘキシアミン等の脂環式アミン、フルフリルアミン等のヘテロ芳香族アミン、ピロリジン,ピペリジン,ピペラジン,ピロリドン等の環状アミンが挙げられる。
【0012】
銅、ニッケル、カルシウム及びアルカリ土類金属(カルシウムを除く)を必須成分とする触媒の触媒原料としては、(a)銅のカルボン酸塩又は銅の分子内錯体の1種又は2種以上、(b)ニッケルのカルボン酸塩又はニッケルの分子内錯体の1種又は2種以上、(c)カルシウムのカルボン酸塩又はカルシウム錯体の1種又は2種以上、(d)アルカリ金属又はアルカリ土類金属(カルシウムを除く)のカルボン酸塩の1種又は2種以上の混合物が用いられる。
アミノ化反応を実施するには、まず触媒原料を還元活性化させる必要がある。例えば、出発原料の多価アルコール若しくはアミノアルコールに触媒原料を加熱溶解させ、水素又は他の還元剤を導入して還元活性化させた後(以下、還元活性化処理という。)、原料アミンを導入することでアミノ化反応を進行させることができる。また、触媒原料を高級アルコール等の溶媒に加熱溶解させ、還元活性化処理の後、出発原料の多価アルコールやアミノアルコールと原料アミンとを導入することでアミノ化反応を進行させることができる。還元活性化処理によって得られた触媒は、見掛け上均一なコロイド状触媒(銅/ニッケル粒子径は約1nm)となる。
【0013】
触媒原料中、(a)銅のカルボン酸塩及び銅の分子内錯体は、還元活性化処理の過程で、金属銅にまで還元される。銅のカルボン酸塩を形成するカルボン酸としては、分子中にカルボキシル基を有するものであれば芳香族系であっても、分岐を有するものでも、直鎖アルキル基に複数のカルボキシル基や、他の置換基を有するものであってもよく、例えば、カプロン酸、エナント酸、カプリル酸、ペラルゴン酸、カプリン酸、ウンデカン酸、ラウリン酸、トリデカン酸、ミリスチン酸、ペンタデカン酸、パルミチン酸、ステアリン酸、オレイン酸等を挙げることができる。好ましいのは炭素数6以上のカルボン酸であり、特に好ましくは炭素数12以上のカルボン酸である。
炭素数5以下のカルボン酸塩は還元中、遊離したカルボン酸の影響によって金属コロイドが凝集し易く活性が低下し易いため好ましくない。銅の分子内錯体としては、例えば、アセチルアセトン錯体やジメチルグリオキシム錯体等、イオウを含有しない一般のキレート化合物を挙げることができる。
【0014】
また、触媒原料中、(b)ニッケルのカルボン酸塩及びニッケルの分子内錯体も、還元活性化処理の過程で還元される。カルボン酸塩、分子内錯体としては、前記カルボン酸、前記分子内錯体と同様の有機配位子を例示できる。なお、カルボン酸としては炭素数6以上のものが好ましい。炭素数5以下のカルボン酸塩は還元中、遊離したカルボン酸の影響によって金属コロイドが凝集し易く活性が低下し易いためである。
【0015】
また、触媒原料中、(c)カルシウムのカルボン酸塩及びカルシウム錯体は、アミノ化反応中に次第に還元され、銅及びニッケルと共に強力な触媒作用を発現する。カルボン酸としては前記カルボン酸と同様のものを例示できる。カルシウム錯体としては、例えば、アセチルアセトン錯体、ジメチルグリオキシム錯体等、無機陰イオンを持たない一般のキレート化合物が挙げられる。
なお、カルボン酸としては炭素数6以上のものが好ましい。銅、ニッケルの場合と同様にカルボン酸を遊離させ、銅/ニッケル金属コロイドを凝集させ易く活性を低下させ易いためである。
【0016】
触媒原料中、(d)アルカリ金属又はアルカリ土類金属(カルシウムを除く)のカルボン酸塩は、還元活性化処理及びアミノ化反応中も還元されることなく、銅−ニッケル−カルシウム系コロイド触媒の安定化剤として機能する。なかでもアルカリ土類金属のカルボン酸塩、特にバリウムのカルボン酸塩が有効である。バリウムは、銅やニッケルと比較して特に還元され難く、触媒の活性を維持する安定化剤として特に有効に機能するからである。
カルボン酸塩としては、前記したものと同様のものを例示でき、例えばステアリン酸バリウム、ラウリン酸バリウム、ステアリン酸ナトリウム等を挙げることができる。なかでも炭素数8〜30好ましくは10〜24特に18〜24のステアリン酸、ベヘニン酸、リグノセリン酸等が好適に用いられる。容易に入手できるとともに、本発明者らの実験の結果、炭素数8〜30のカルボン酸塩は、カルボキシル基の鎖長効果により銅/ニッケル金属コロイドの凝集抑制効果が高く、高い触媒活性を与えることがわかったからである。
なお、銅、ニッケル、アルカリ金属、アルカリ土類金属のカルボン酸塩は、特公昭59−27617号公報等に記載された周知の方法を用いて製造できる。
【0017】
触媒原料の還元活性化処理で用いる水素以外の他の還元剤としては、Al(C2H5)3、(C2H5)2Al(OC2H5)等を用いることができる。
また、触媒原料を溶解させる溶媒としては、高沸点の高級アルコールや流動パラフィン等を用いることができる。溶媒中で触媒原料を還元活性化することによって、高濃度の触媒溶液を製造することができる。この触媒溶液中で、多価アルコールやアミノアルコールのアミノ化反応を行うこともできる。
触媒原料の還元活性化処理では、多価アルコールやアミノアルコール、溶媒中に触媒原料を投入し、昇温と同時に水素等の還元剤を連続的に供給する。160℃付近から2価の銅の還元が始まり、200℃未満で触媒の活性化が完了する。還元活性化処理後、アミノ化反応の進行とともにコロイド状触媒を含有する反応混合物の色調が淡黄色(透明)から黒色へと変化し、次第に赤褐色の均一なコロイド状触媒へと変化し、高活性を発現するようになる。初期の淡黄色から黒色の状態の期間は、高活性のコロイド状触媒への移行期間にあり、一種の誘導期である。多価アルコールや高級アルコール等の鎖長が短くなるにつれ(例えば1,9−ノナンジオール、1,8−オクタンジオール等)、極性が高くなり誘導期間が長くなる傾向がみられるため、多価アルコールは鎖長が長い方が反応し易く好ましくない。また、溶媒としての高級アルコールの鎖長も沸点の点で長いほうが有利である。沸点の違いを利用して、反応生成物(アミノ化合物)を気化させ蒸留分離できるからである。
【0018】
還元活性化処理後は、反応器を100〜250℃好ましくは150〜220℃より好ましくは180〜220℃に設定し、多価アルコールや溶媒等に第1級アミンや第2級アミン等のガス状の原料アミンを導入し、アミノ化反応を開始させる。反応温度が180℃より低くなるにつれ反応速度が低下する傾向がみられ、150℃より低くなるにつれこの傾向が顕著になり、100℃より低いと生産性に著しく欠けるため好ましくない。反応温度が220℃より高くなるにつれ副反応が加速される傾向がみられ、250℃より高くなると顕著になるため好ましくない。
アミノ化反応は、−0.5〜10MPa好ましくは−0.05〜1MPaより好ましくは0.1〜0.5MPaの範囲で行うのが好適である。アミノ化反応は脱水反応であるため、加圧条件下では反応速度の低下を招くためである。
【0019】
アミノ化反応では、第1級アミンや第2級アミン等の原料アミンを導入すると数分間の誘導期の後、水が留出し始め反応の進行を確認できる。反応は水素を導入しない条件下でも進行する。多価アルコールやアミノアルコール等の脱水素によって発生した活性化水素が反応に使われるからである。しかし、水素を導入して水素の存在下で反応を行うのが好ましい。反応時間を若干短縮できるとともに、導入された水素が反応水の系外への搬出を助けるからである。水を系外へ効率よく搬出させるため、反応器内に導入された反応水搬出用の水素,窒素や不活性ガス等は消費されないので、水素に代えて、又は水素に混合して、窒素や希ガス等の不活性ガスを反応器内に導入することもできる。
水の生成とともに生成物である油分も留出するので、常法によって油水分離し、必要に応じて油分を反応器に戻しアミノ化反応を進行させる。反応の進行は、アミン価、水酸基価、或いはガスクロマトグラフィ分析によって追跡することができる。
アミノ化反応が終了すると水の留出も停止する。反応温度、触媒の濃度、アミンの供給速度にもよるが、アミノ化反応は2〜10時間で完了させることができる。
【0020】
触媒の濃度としては、金属銅を基準にして0.001〜10wt%(出発原料のアルコールに対して)好ましくは0.01〜5wt%より好ましくは0.05〜2wt%が好適である。濃度が0.05wt%より低くなるにつれ反応速度が低下する傾向がみられ、0.001wt%より低くなると生産性に著しく欠けるため好ましくない。濃度が2wt%より高くなるにつれ副反応が促進される傾向がみられ、10wt%を超えると顕著になるため好ましくない。
【0021】
触媒の組成としては、原子比で、銅:ニッケル:カルシウム:アルカリ金属又はアルカリ土類金属(カルシウムを除く)=5:1:1:1が最適である。なお、触媒の組成において、カルシウムに対するアルカリ金属又はアルカリ土類金属(カルシウムを除く)の比率は、原子比で0.1〜10が好適である。前記比率が0.1未満では、金属コロイド系の安定性が激減して金属コロイドの凝集が促進され触媒が失活し、10を超えると反応速度が大きく低下するからである。
また、触媒の組成において、銅に対するカルシウムの比率は、原子比で0.1〜0.5が好適である。前記比率が0.1未満や0.5を超えると反応速度が大きく低下するからである。
【0022】
アミノ化反応において、反応器内に供給される原料アミン(アンモニア,第1級アミン,第2級アミン)の単位時間当たりの供給速度(L/時間)としては、標準状態(25℃、0.1MPa)で、出発原料のアルコールの水酸基1モル当たり0.01〜100モル/時間、好ましくは0.1〜10モル/時間、特に好ましくは0.2〜5モル/時間がよい。0.01モル/時間未満では反応速度が遅く生産性に著しく欠けるため好ましくない。100モル/時間を越える場合は、原料アミンによる触媒被毒が顕著になって反応速度と収率の低下をきたし、さらに不均化も大きく促進されるため好ましくない。
【0023】
アミノ化反応は、回分式、連続式いずれの方法も可能である。回分式の場合は、例えば、通常の攪拌層型反応器、インジェクター方式の撹拌型反応器やループ式反応器等を用いることができる。連続式の場合も、特別の撹拌装置は必要なく、ガス撹拌式等の反応器を用いることができる。
【0024】
本発明によって得られるアミノ化合物としては、N,N,N’,N’-テトラメチル-1,6-ヘキサメチレンジアン、N,N,N’,N’-テトラメチル-1,8-オクタメチレンジアン、N,N,N’,N’-テトラメチル-1,9-ノナメチレンジアン、N,N,N’,N’-テトラメチル-1,10-デカメチレンジアン、N,N,N’,N’-テトラメチル-1,12-ドデカメチレンジアン、12-ヒドロキシ-N,N-ジメチルステアリルアミン、及び12−N,N−ジメチル−N’,N’−ジメチルステアリルアミン等の第3級アミン、これらの第3級アミンの中間体であるアミノアルコールを挙げることができる。これらのアミノ化合物は、ポリウレタン及びウレタンフォーム製造用触媒として好適に用いられる。
【0025】
アミノ化反応終了後は、反応混合物を冷却し活性炭等の吸着剤に吸着させることによって触媒を濾過分離することができる。但し、吸着時には触媒を還元状態に保つ必要がある。
しかし、コロイド状の触媒(銅/ニッケル粒子径は約1nm)は通常の濾過操作では分離不可能なので、通常の蒸留操作によって留分と残渣に分けるのが好ましい。残渣には触媒が存在しており、これを次回の反応にそのまま再使用することができるため、固体触媒の場合に必要な触媒の濾過工程を要さず作業性に優れる。
本発明の触媒は、還元活性処理後は極性溶液に対して極めて安定であり、アセトン溶液として1週間放置しても触媒が凝集しないことを確認した。さらに耐極性を向上させるため、触媒成分の内の安定化剤(アルカリ金属又はアルカリ土類金属(カルシウムを除く)成分)を増量することも有効である。また、繰り返し反応を行っても触媒の性能はほとんど低下しなかった。
【0026】
本発明の請求項2に記載の発明は、請求項1に記載のアミノ化合物の製造方法であって、前記触媒が、(a)銅のカルボン酸塩又は銅の分子内錯体の1種又は2種以上と、(b)ニッケルのカルボン酸塩又はニッケルの分子内錯体の1種又は2種以上と、(c)カルシウムのカルボン酸塩又はカルシウム錯体の1種又は2種以上と、(d)アルカリ金属又はアルカリ土類金属(カルシウムを除く)のカルボン酸塩の1種又は2種以上と、の混合物が、前記多価アルコール若しくは前記アミノアルコール又は溶媒中で、水素又は他の還元剤で還元処理された構成を有している。
この構成により、請求項1で得られる作用に加え、以下のような作用が得られる。
(1)触媒の原料が金属石鹸であるため、固体触媒を製造する場合に必要となる金属水酸化物の製造、水洗、乾燥、粉砕、分級等の煩雑なプロセスが不要なため、生産性に著しく優れる。
(2)多価アルコール等で還元処理された触媒はコロイド状のため、回分式及び連続式のいずれの方法にも適用できるとともに小規模生産にも容易に対応でき、自在性に優れる。
【0027】
本発明の請求項3に記載の発明は、請求項2に記載のアミノ化合物の製造方法であって、前記多価アルコールや前記アミノアルコールより低極性の前記溶媒中で、前記触媒が還元処理され、前記触媒を含有する前記溶媒に、前記多価アルコール及び/又は前記アミノアルコールと、前記アンモニア若しくは前記第1級アミン又は前記第2級アミン(原料アミン)と、を連続的に供給し反応させる構成を有している。
この構成により、請求項2で得られる作用に加え、以下のような作用が得られる。
(1)溶媒中で触媒を還元活性化させた後、触媒を含有する溶媒に原料の多価アルコールやアミノアルコールと第2級アミン等の原料アミンとを少量ずつ連続的に供給し反応させると、高極性の多価アルコール(例えば、炭素数2〜8の多価アルコールである1,6−ヘキサンジオールや1,8−オクタンジオール等)やアミノアルコールの場合でも、コロイド状の触媒が多価アルコール等の極性の影響を受け難いため、凝集し難く高活性を維持できる。このため、原料が高極性の炭素数2〜8の多価アルコールやアミノアルコールであっても、誘導期を完全に消滅させ、溶媒への原料の供給と同時に即座にアミノ化反応を開始させることができ、生産性を著しく高めることができるとともに、従来では不可能と考えられていた多彩なアミンの製造を可能にすることができ応用性に著しく優れる。これに対し、極性が高い炭素数2〜8の多価アルコールに触媒原料を溶解し還元活性化処理を行った後、これに第2級アミン等の原料アミンを供給する方法では、多価アルコール中で触媒が凝集する傾向がみられ、本来の活性が発現せず数時間に亘る誘導期がみられる場合があることがわかった。
【0028】
ここで、溶媒としては、原料の多価アルコールやアミノアルコールよりも低極性の高級アルコールや流動パラフィン等が用いられる。特に、低極性で、かつ、目的とする反応生成物(アミノ化合物)よりも高沸点の長鎖(炭素数12〜40好ましくは18〜24)の1価アルコール(ステアリルアルコール、ベヘニルアルコール、リグノアルコール等)や流動パラフィンが好適である。蒸留によって反応生成物(アミノ化合物)を溶媒と分離できるため、生産性に著しく優れるからである。
溶媒中で触媒原料を還元活性化することによって、溶媒に触媒が均一溶解した高濃度の触媒溶液を製造することができる。溶媒として高級アルコールを用いる場合、還元活性化された触媒の存在下で高級アルコールをアミノ化する。溶媒の高級アルコールの水酸基を消滅させ、水酸基を有する多価アルコールやアミノアルコールのアミノ化だけを観測できるようにするためである。
この触媒溶液に固定床プロセスと同様の考え方で、多価アルコールやアミノアルコール及びアミンを連続的に供給することで、アミノ化反応を行うことができる。得られたアミノ化合物は、触媒溶液より沸点が低いことを利用して連続的に留出させることができる。
【0029】
本発明の請求項4に記載の発明は、請求項2又は3に記載のアミノ化合物の製造方法であって、前記溶媒の沸点が、反応生成物の沸点より高いという構成を有している。
この構成により、請求項3で得られる作用に加え、以下のような作用が得られる。
(1)溶媒と反応生成物(アミノ化合物)との沸点の違いを利用して、蒸留によって反応生成物を溶媒と分離できるため、生産性に優れる。
【発明の効果】
【0030】
以上のように、本発明のアミノ化合物の製造方法によれば、以下のような有利な効果が得られる。
請求項1に記載の発明によれば、
(1)銅、ニッケル、カルシウム、アルカリ金属又はアルカリ土類金属(カルシウムを除く)を必須成分とする触媒の存在下で反応させることによって、高い反応速度で高収率かつ選択性よく工業的に有用な第3級アミン等のアミノ化合物を製造することができるアミノ化合物の製造方法を提供できる。
(2)触媒が高活性であるため、反応条件が温和であるとともに、少量の触媒で短時間で反応を完結させることができ生産性に著しく優れたアミノ化合物の製造方法を提供できる。
(3)触媒にパラジウムやルテニウム等の貴金属を用いていないので、触媒のランニングコストを抑制することができるアミノ化合物の製造方法を提供できる。
(4)貴金属含有に由来する原料アミンおよび生成アミンの不均化反応が大幅に抑制され、生成アミンの選択性を向上できアミノ化合物の優れた製造方法を提供できる。
【0031】
請求項2に記載の発明によれば、請求項1の効果に加え、
(1)触媒の原料が金属石鹸であるため、固体触媒を製造する場合に必要となる金属水酸化物の製造、水洗、乾燥、粉砕、分級等の煩雑なプロセスが不要なため、生産性に著しく優れたアミノ化合物の製造方法を提供できる。
(2)多価アルコール等で還元処理された触媒はコロイド状のため、回分式及び連続式のいずれの方法にも適用できるとともに小規模生産にも容易に対応でき、自在性に優れたアミノ化合物の製造方法を提供できる。
【0032】
請求項3に記載の発明によれば、請求項2の効果に加え、
(1)溶媒に高活性のコロイド状の触媒を安定に存在させることができるので、溶媒に出発原料である多価アルコールやアミンを連続的に供給すると、多価アルコール等の極性の影響を受けて触媒が凝集することなく活性低下を引き起こさないので、溶媒への原料の供給と同時に即座にアミノ化反応を開始させることができ、生産性を著しく高めることができるとともに、従来では不可能と考えられていた多彩なアミンの製造を可能にすることができ応用性に著しく優れたアミノ化合物の製造方法を提供できる。
【0033】
請求項4に記載の発明によれば、請求項2又は3の効果に加え、
(1)溶媒と反応生成物(アミノ化合物)との沸点の違いを利用して、蒸留によって反応生成物を溶媒と分離でき生産性に優れたアミノ化合物の製造方法を提供できる。
【発明を実施するための最良の形態】
【0034】
以下、本発明を実施するための最良の形態を、図面を参照しながら説明する。
(実施の形態1)
図1は実施の形態1におけるアミノ化合物の製造装置を示す模式図である。
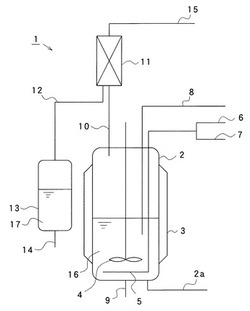
図中、1は出発原料を連続式に反応させてアミノ化合物を連続式に製造する製造装置、2は反応器、2aは反応器2に接続され後述する溶媒や触媒原料を反応器2内に供給する供給管、3は反応器2の外周壁に配設されたヒータ等の加熱装置、4は反応器2内に配設された撹拌器、5は原料ガスや還元剤を反応器2内に導入するスパージャー(多孔ノズル)等のガス供給部、6はガス供給部5に水素等の還元剤を導く還元剤供給管、7はガス供給部5にガス状のアンモニア,第1級アミン,第2級アミンの原料アミンを導く原料ガス供給管、8は反応器2内に多価アルコールやアミノアルコールの原料アルコールを導入する原料アルコール供給管、9は使用済みの触媒を含有する溶媒等を反応器2から排出する排出管、10は反応器2の頂部に接続され発生蒸気を反応器2の外部に抜き出す蒸気管、11は蒸気管10に配設され反応器2で発生した蒸気を冷却凝縮させる冷却器、12は凝縮した反応生成物(アミノ化合物)が流れる流出管、13は流出管12に接続され流出する反応生成物(アミノ化合物)を受ける受器、14は受器13に接続され反応生成物(アミノ化合物)を取り出す採取管、15は排ガス管、16は反応器2内に貯留された高級アルコールや流動パラフィン等の溶媒と触媒とを含有する触媒含有溶液、17は受器13に貯留された反応生成物(アミノ化合物)と反応水である。受器13内で反応水は下層に、反応生成物は上層に分離している。
なお、本実施の形態においては、触媒含有溶液16の溶媒は原料アルコールよりも低極性で、かつ、目的とする反応生成物(アミノ化合物)よりも高沸点のステアリルアルコール、ベヘニルアルコール、リグノアルコール等の長鎖の1価アルコールや流動パラフィンが用いられている。
【0035】
以上のように構成された実施の形態1におけるアミノ化合物の製造方法について、以下、図面を参照しながら説明する。
始めに、供給管2aから反応器2に溶媒を供給した後、ステアリン酸銅,ステアリン酸ニッケル,ステアリン酸カルシウム,ステアリン酸バリウム等の触媒原料を反応器2内に投入する。撹拌器4を回転させながら、加熱装置3によって反応器2を昇温させると同時に、ガス供給部5から還元剤を連続的に供給し、触媒を溶媒中で還元活性化させ、触媒含有溶液16を生成する。
還元活性化処理後、反応器2を好ましくは180〜220℃に設定し、原料アルコールを原料アルコール供給管8から触媒含有溶液16に少量ずつ連続的に供給するとともに、ガス供給部5から触媒含有溶液16にガス状の原料アミンを連続的に供給し、触媒含有溶液16中で原料アルコールのアミノ化反応を開始させる。
触媒含有溶液16の溶媒より低沸点の反応生成物(アミノ化合物)と反応水は、気化して蒸気管10から反応器2の外部に排出され、冷却器11によって凝縮され連続的に反応生成物(アミノ化合物)を製造することができる。
【0036】
以上説明したような実施の形態1におけるアミノ化合物の製造方法によれば、以下のような作用が得られる。
(1)溶媒中で触媒を還元活性化させた後、触媒含有溶液16に原料アルコールと原料アミンとを少量ずつ連続的に供給し反応させると、原料アルコールが高極性の多価アルコール(例えば、炭素数2〜8の多価アルコールである1,6−ヘキサンジオールや1,8−オクタンジオール等)の場合でも、コロイド状の触媒が原料アルコールの極性の影響を受け難いため、凝集し難く高活性を維持できる。このため、誘導期を完全に消滅させ、触媒含有溶液16への原料の供給と同時に即座にアミノ化反応を開始させることができ、生産性を著しく高めることができる。一方、極性が高い原料アルコール(炭素数2〜8の多価アルコール)に触媒原料を溶解し還元活性化処理を行った後、これに原料アミンを供給する方法では、原料アルコール中で触媒が凝集する傾向がみられ、本来の活性が発現せず数時間に亘る誘導期がみられ生産性に欠け、さらに反応混合物中には高沸点物が多く生成され収率も低下する。
(2)触媒含有溶液16の溶媒の沸点が反応生成物(アミノ化合物)の沸点より高いため、溶媒と反応生成物との沸点の違いを利用して、蒸留によって反応生成物を溶媒と分離できるため生産性に優れる。
【実施例】
【0037】
以下、本発明を実施例により具体的に説明する。なお、本発明はこれらの実施例に限定されるものではない。なお、生成したアミノ化合物の同定は、ガスクロマトグラフィとGC/MS(ガスクロマトグラフィ/質量分析法)で行った。
(実施例1)
生成した水を分離するための凝縮器及び分離器、反応混合物サンプリング器、排ガス出口管、原料ガス導入管(多孔質ガラス製のスパージャー)、撹拌器、温度計を設けた500mLのフラスコに、多価アルコールとして1,12−ドデカンジオールを200g仕込み、触媒原料としてステアリン酸銅2.0g(多価アルコールに対する金属銅0.1wt%)、ステアリン酸ニッケル0.4g(多価アルコールに対する金属ニッケル0.02wt%)、ステアリン酸カルシウム0.4g(多価アルコールに対する金属カルシウム0.02wt%)、ステアリン酸バリウム0.4g(多価アルコールに対する金属バリウム0.02wt%)を加えた後、撹拌器を回転させ、フラスコ内を窒素で置換し昇温した。触媒原料の4種類の金属石鹸は、100℃に達するまでに均一に溶解した。100℃に達したら窒素を水素に切換え、水素ガスを、流量計を通じて22L/時間の流速でフラスコ内にバブリングさせて還元活性化処理を行った。170〜190℃で2価の銅とニッケルの特徴的な緑色が次第に淡色化し、触媒原料が還元され見掛け上均一なコロイド状触媒となった。反応温度を210℃に保ち、第2級アミンのジメチルアミンを常圧で28L/時間の流速で水素(流速22L/時間)との混合ガスとして連続供給した。
まもなく、水の留出を伴ってアミノ化反応が進行しだした。反応開始時、フラスコ内の反応混合物の色相は黒色であったが、反応の進行とともにフラスコ内の触媒は褐色の完全なコロイド状になり、急激に反応速度が向上した。1時間間隔で反応混合物(反応水を除く)をサンプリングしてガスクロマトグラフィで分析し、転化率、生成物比率、収率、反応速度を算出した。反応速度は、化学反応式(E)で示す1段目の反応、化学反応式(F)で示す2段目の反応について、銅の単位モル当たり、ジメチルアミン単位モル供給速度当たりの反応速度(mole・h−1・mole(Cu)−1・[mole(DMA)・h−1]−1)を各々算出した。
なお、ガスクロマトグラフィの分析条件は以下のとおりである。
機種:島津製作所製GC−14B、キャピラリーカラム:0.32mm×30m、キャリアガス:窒素 30mL/分、充填剤:DB−17、カラム温度:100〜270℃、270℃で13分間保持、昇温速度:10℃/分、検知器:FID、試料濃度:10%、スプリット比:20。
【0038】
(実施例2)
多価アルコールとして1,10−デカンジオールを用い、ジメチルアミンを28L/時間の流速で供給した以外は、実施例1と同様にしてアミノ化反応を行った。
【0039】
(実施例3)
多価アルコールとして1,9−ノナンジオールを用い、ジメチルアミンを28L/時間の流速で供給した以外は、実施例1と同様にしてアミノ化反応を行った。
【0040】
(実施例4)
多価アルコールとして1,8−オクタンジオールを用い、ジメチルアミンを28L/時間の流速で供給した以外は、実施例1と同様にしてアミノ化反応を行った。
【0041】
(実施例5)
生成した水を分離するための凝縮器及び分離器、反応混合物サンプリング器、排ガス出口管、原料ガス導入管、撹拌器、温度計を設けた500mLのフラスコに、溶媒としてベヘニルアルコール(炭素数22)を200g仕込み、触媒原料としてステアリン酸銅4.0g(溶媒の高級アルコールに対する金属銅0.2wt%)、ステアリン酸ニッケル0.8g(高級アルコールに対する金属ニッケル0.04wt%)、ステアリン酸カルシウム0.8g(高級アルコールに対する金属カルシウム0.04wt%)、ステアリン酸バリウム0.8g(高級アルコールに対する金属バリウム0.04wt%)を加えた後、撹拌器を回転させ、フラスコ内を窒素で置換し昇温した。触媒原料の4種類の金属石鹸は、100℃に達するまでに均一に溶解した。100℃に達したら窒素を水素に切換え、水素ガスを、流量計を通じて22L/時間の流速でフラスコ内にバブリングさせて還元活性化処理を行った。170〜190℃で2価の銅とニッケルの特徴的な緑色が次第に淡色化し、触媒原料が還元され見掛け上均一なコロイド状触媒となった。反応温度を210℃に保ち、第2級アミンのジメチルアミンを常圧で28L/時間の流速で水素(流速22L/時間)との混合ガスとして3時間連続供給し、ベヘニルアルコールがアミノ化されてN,N−ジメチルベヘニルアミンが生成した触媒溶液を得た。なお、ベヘニルアルコールの転化率は100%であった。
210℃に保った触媒溶液中に、多価アルコールとして1,6−ヘキサンジオールを0.48モル/時間の供給速度で連続して添加するとともに、第2級アミンとしてジメチルアミンを常圧で1.0モル/時間の供給速度で水素ガスとの混合ガスとしてバブリングして連続供給した。なお、水素ガスの供給速度は22L/時間であった。
1、6−ヘキサンジオールの供給開始とともに、直ちに水の留出を伴ってアミノ化反応が進行した。誘導期は全く観察されなかった。反応混合物は反応水とともに定常的に反応系外に留出させた。定常に達してから(平均滞留時間2.1時間)、留出した反応混合物(反応水を除く)をサンプリングしてガスクロマトグラフィ分析を行い、転化率、生成物比率、収率、反応速度を算出した。
【0042】
(実施例6)
多価アルコールとして12−ヒドロキシステアリルアルコールを用い、ジメチルアミンを17L/時間の流速で供給した以外は、実施例1と同様にしてアミノ化反応を行った。
【0043】
(実施例7)
触媒原料としてステアリン酸銅2.0g(多価アルコールに対する金属銅0.1wt%)、ステアリン酸ニッケル0.4g(多価アルコールに対する金属ニッケル0.02wt%)、ステアリン酸カルシウム0.1g(多価アルコールに対する金属カルシウム0.005wt%、金属銅に対する金属カルシウムの比率0.05)、ステアリン酸バリウム0.4g(多価アルコールに対する金属バリウム0.02wt%)を加えた以外は、実施例1と同様にしてアミノ化反応を行った。
【0044】
(実施例8)
触媒原料としてステアリン酸銅2.0g(多価アルコールに対する金属銅0.1wt%)、ステアリン酸ニッケル0.4g(多価アルコールに対する金属ニッケル0.02wt%)、ステアリン酸カルシウム0.2g(多価アルコールに対する金属カルシウム0.01wt%、金属銅に対する金属カルシウムの比率0.1)、ステアリン酸バリウム0.4g(多価アルコールに対する金属バリウム0.02wt%)を加えた以外は、実施例1と同様にしてアミノ化反応を行った。
【0045】
(実施例9)
触媒原料としてステアリン酸銅2.0g(多価アルコールに対する金属銅0.1wt%)、ステアリン酸ニッケル0.4g(多価アルコールに対する金属ニッケル0.02wt%)、ステアリン酸カルシウム1.0g(多価アルコールに対する金属カルシウム0.04wt%、金属銅に対する金属カルシウムの比率0.5)、ステアリン酸バリウム0.4g(多価アルコールに対する金属バリウム0.02wt%)を加えた以外は、実施例1と同様にしてアミノ化反応を行った。
【0046】
(実施例10)
触媒原料としてステアリン酸銅2.0g(多価アルコールに対する金属銅0.1wt%)、ステアリン酸ニッケル0.4g(多価アルコールに対する金属ニッケル0.02wt%)、ステアリン酸カルシウム1.2g(多価アルコールに対する金属カルシウム0.06wt%、金属銅に対する金属カルシウムの比率0.6)、ステアリン酸バリウム0.4g(多価アルコールに対する金属バリウム0.02wt%)を加えた以外は、実施例1と同様にしてアミノ化反応を行った。
【0047】
(比較例1)
触媒原料としてステアリン酸銅2.0g(多価アルコールに対する金属銅0.1wt%)、ステアリン酸ニッケル0.4g(多価アルコールに対する金属ニッケル0.02wt%)、ステアリン酸バリウム0.4g(多価アルコールに対する金属バリウム0.02wt%)を加えた以外は、実施例1と同様にしてアミノ化反応を行った。比較例1は、触媒原料にステアリン酸カルシウムを加えていない点で、実施例1と相違する。
【0048】
(比較例2)
(特許文献3)に記載された実施例1に従って、合成ゼオライトに担持させた銅−ニッケル−白金族元素の3元触媒(Cu:Ni:Ru=4:1:0.01、担体はY型ゼオライト、担持量は金属酸化物を基準として50wt%)を調製した。
生成した水を分離するための凝縮器及び分離器、反応混合物サンプリング器、排ガス出口管、原料ガス導入管、撹拌器、温度計を設けた500mLのフラスコに、多価アルコールとして1,10−デカンジオール200gと、調製した触媒0.62g(多価アルコールに対する金属銅0.1wt%)を仕込み撹拌しながら、フラスコ内を窒素で置換し昇温した。100℃に達したら窒素を水素に切換え、水素ガスを、流量計を通じて22L/時間の流速でフラスコ内に吹き込み210℃まで昇温した。反応温度を210℃に保ち、第2級アミンのジメチルアミンを常圧で27L/時間の流速で水素(流速22L/時間)との混合ガスとして連続供給し、反応を、ガスクロマトグラフィを用いて追跡した。
【0049】
(比較例3)
触媒の担体が合成ゼオライトMS−13Xであること以外は比較例2と全く同じ条件で、1,10−デカンジオールのアミノ化反応を行った。
【0050】
(表1)に、実施例1〜10における触媒原料の各金属の多価アルコールに対する質量分率を示し、(表2)に、実施例1〜6及び比較例1〜3の反応時間(時間)、多価アルコールからアミノ化合物への転化率(%)、サンプリングした反応時間経過後の反応混合物(反応水を除く)の多価アルコール比率(%)、ジ3級アミン比率(%)、モノ3級アミン比率(%)、高沸点物比率(%)、低沸点物比率(%)、アミノ化反応1段目と2段目の反応速度(mole・h−1・mole(Cu)−1・[mole(DMA)・h−1]−1)(銅の単位モル当たり、ジメチルアミンの単位モル供給速度当たりの反応速度)をまとめて示した。なお、(表1)において、ジ3級アミンと表記しているのは、実施例1及び比較例1においてはN,N,N’,N’−テトラメチル−1,12−ドデカンジアミンであり、実施例2、比較例2及び比較例3においてはN,N,N’,N’−テトラメチル−1,10−デカンジアミンであり、実施例3においてはN,N,N’,N’−テトラメチル−1,9−ノナンジアミンであり、実施例4においてはN,N,N’,N’−テトラメチル−1,8−オクタンジアミンであり、実施例5においてはN,N,N’,N’−テトラメチル−1,6−ヘキサンジアミンであり、実施例6においては12−N,N−ジメチルアミノ−1−N’,N’−ジメチルステアリルアミンであり、モノ3級アミンと表記しているのは、実施例1及び比較例1においては12−N,N−ジメチルアミノ−1−ドデカノールであり、実施例2、比較例2及び比較例3においては10−N,N−ジメチルアミノ−デカノール−1であり、実施例3においては9−N,N−ジメチルアミノ−ノナノール−1であり、実施例4においては8−N,N−ジメチルアミノ−オクタノール−1であり、実施例5においては6−N,N−ジメチルアミノ−ヘキサノール−1であり、実施例6においては12−N,N−ジメチルアミノステアリルアルコールである。
【0051】
【表1】

【0052】
【表2】

【0053】
(表2)において実施例1と比較例1とを比較すると、実施例1では反応7時間目で転化率99.9%、ジ3級アミンとモノ3級アミンが各々84.2%、10.8%(合計95.0%)、高沸点物と低沸点物が各々4.2%、0.6%であったのに対し、比較例1では反応35時間目でも転化率94.0%、ジ3級アミンとモノ3級アミンが各々70.4%、12.3%(合計82.7%)、高沸点物と低沸点物が各々9.8%、0.8%であり、実施例1は転化率が高く、目的とする第3級アミンが高い選択性で得られていることが明らかになった。また、1段目と2段目の反応速度においても、比較例1に対して実施例1は、3〜4倍の極めて高い反応速度で反応が進行したことが明らかになった。
比較例1は、触媒原料のステアリン酸カルシウムを加えておらず、触媒が銅−ニッケル−バリウムの3元触媒であることから、触媒活性は実施例1の触媒の1/3以下と大きく下回っており、カルシウム含有コロイダル触媒の優位性を明確に確認することができた。
【0054】
次に、実施例2と比較例2とを比較すると、実施例2では反応7時間目で転化率100%、ジ3級アミンとモノ3級アミンが各々88.3%、5.7%(合計94.0%)であったのに対し、比較例2では反応6時間目で転化率34.0%、ジ3級アミンとモノ3級アミンが各々2.9%、29.1%(合計32.0%)であり、実施例2は転化率が高く、目的とする第3級アミンが高い選択性で得られていることが明らかになった。また、2段目の反応速度を比較すると、比較例2に対して実施例2は、40倍以上の極めて高い反応速度で反応が進行したことが明らかになった。
なお、比較例3は、比較例2と比較すると2段目のアミノ化反応速度が大きく向上しているものの、実施例2との比較から明らかなように、本発明で使用するカルシウム含有コロイダル触媒の方が、圧倒的に触媒活性が高いことが明らかになった。
本実施例によれば、アミノ化反応1段目の反応生成物であるアミノアルコールと、反応2段目の反応生成物である第3級アミンが、いずれも高い反応速度で得られることから、アミノアルコールや第3級アミンを低原価で量産でき、生産性に著しく優れることが明らかになった。
【0055】
また、実施例3及び4では、反応19時間目で転化率はほぼ100%、ジ3級アミンとモノ3級アミンの合計が約90%であることから、転化率が高く、目的とする第3級アミンが高い選択性で得られていることが明らかになった。
また、実施例6によれば、反応16時間での転化率、12−ヒドロキシ−1−N,N−ジメチルステアリルアミン(モノ3級アミン)及び12−N,N−ジメチルアミノ−1−N’,N’−ジメチルステアリルアミン(ジ3級アミン)の生成比率は、それぞれ94.7%、61.6%、33.1%であり、1段目のアミノ化反応速度(mole・h−1・mole(Cu)−1・[mole(DMA)・h−1]−1)は13であり、2段目のアミノ化反応速度(単位は既述)は4であった。以上のことから、カルシウム含有コロイダル触媒を使用することにより、12−ヒドロキシステアリルアルコールから12−ヒドロキシ−1−N,N−ジメチルステアリルアミンを製造するだけでなく、安定な12−ヒドロキシル基をアミノ化して、12−N,N−ジメチルアミノ−1−N’,N’−ジメチルステアリルアミンも製造できることが明らかになり、本発明で使用するカルシウム含有コロイダル触媒の触媒活性の高さを示すことができた。
なお、(表2)において、多価アルコール比率、ジ3級アミン比率、モノ3級アミン比率、高沸点物比率、低沸点物比率の合計が100%に満たない実施例や比較例があるのは、ガスクロマトグラフィ分析に伴う誤差、触媒原料由来のエステル等による影響が考えられるが、詳細は検討中である。
【0056】
さらに、触媒溶液に多価アルコールとジメチルアミンを連続的に供給した実施例5では、誘導期が全く観察されなかっただけでなく、平均滞留時間(反応時間)2.1時間で転化率99.5%、ジ3級アミンとモノ3級アミンが各々85.9%、11.8%(合計97.7%)、高沸点物と低沸点物が各々1.2%、0.2%であり、高い転化率と選択性を実現できるとともに、高沸点物が極めて少なくできることが明らかになった。また、アミノ化反応速度は1段目305、2段目262であり、本実施例及び比較例の中で最高の値を示した。
なお、実施例5と同じ1,6−ヘキサンジオールのアミノ化反応を、連続式プロセスによらず(触媒溶液を使用することなく)実施例1〜4と同様の回分式反応で行った場合、反応時間5.5時間で転化率20%であり、ジ3級アミンとモノ3級アミンの合計収率は20%であった。
また、実施例5で行った連続式プロセスを、実施例3及び4の1,9−ノナンジオール及び1,8−オクタンジオールのアミノ化反応に適用したところ、実施例5の場合と同様に、誘導期間を完全に消滅させることができた。
これにより、実施例5で行った連続式プロセスの圧倒的優位性が示された。
【0057】
なお、反応1時間における実施例7,10のジ3級アミン及びモノ3級アミンの生成比率と、実施例8,9のジ3級アミン及びモノ3級アミンの生成比率とを比較したところ、実施例7,10は、実施例8,9に比べて大きく低下していた。本実施例により、触媒の組成において、銅に対するカルシウムの比率が原子比で0.1〜0.5の範囲を外れると、触媒の活性が低下することが確認された。
【0058】
なお、実施例1〜5において、触媒原料として、ステアリン酸銅、ステアリン酸ニッケル及びステアリン酸カルシウムに代えて、ミリスチン酸銅、銅アセチルアセトン、銅ジメチルグリオキシム、ニッケルジメチルグリオキシム、ペラルゴン酸ニッケル、ニッケルアセチルアセトン、ラウリン酸カルシウムを用いた場合も、ほぼ100%の転化率が得られ、同様の傾向が確認された。また、実施例1〜5において、ステアリン酸バリウムに代えて、ラウリン酸バリウム、ステアリン酸ナトリウムを用いた場合も、ほぼ100%の転化率が得られ同様の傾向が確認された。しかし、ラウリン酸バリウム、ステアリン酸ナトリウムを用いた場合は、ステアリン酸バリウムを用いた場合より若干反応速度が低いことが確認された。これは、ラウリン酸に比べて鎖長の長いステアリン酸の金属塩は、銅/ニッケル金属コロイドの凝集抑制効果がラウリン酸塩より優れていることを示している。また、バリウムのステアリン酸塩は、銅/ニッケル金属コロイドの凝集抑制効果がナトリウムのステアリン酸塩の凝集抑制効果より優れていることを示している。
また、原料アミンとして、アンモニア、メチルアミン、シクロヘキシアミン等を用いた場合も、実施例1〜5と同様に、対応する第3級アミンが得られることを確認した。
【0059】
以上のように本実施例によれば、銅、ニッケル、カルシウム、アルカリ金属又はアルカリ土類金属(カルシウムを除く)を必須成分とする触媒を用いて反応させることにより、高収率かつ選択性よく第3級アミンが得られることが明らかになった。また、律速段階である2段目のアミノ化反応においても、極めて高い反応速度で反応を完結できることが明らかになった。さらに、触媒溶液に多価アルコールとジエチルアミンを連続的に供給することによって、触媒の本来の活性を発現させることができ、誘導期が全くなく、極めて高い反応速度が得られるとともに、極めて高い選択性が実現できることが明らかになった。これにより、従来では不可能と考えられていた多彩なアミンの製造を可能にすることができ、応用性に著しく優れたアミノ化合物の製造方法を提供できる。
【産業上の利用可能性】
【0060】
本発明は、多価アルコールやアミノアルコールとアンモニア若しくは第1級アミン又は第2級アミンとを反応させて、対応する第3級アミンやアミノアルコール等を製造するアミノ化合物の製造方法に関し、触媒にパラジウムやルテニウム等の貴金属を用いていないので、ランニングコストを大幅に低減することができるとともに、本発明のアミノ化反応は基本的に水素を必要としない(触媒原料の還元活性化処理は除く)反応であり、触媒成分としてカルシウムの併用がその効果を強化しているため、高い反応速度で高収率かつ選択性よく工業的に有用な第3級アミン等のアミノ化合物を製造できるアミノ化合物の製造方法を提供することができる。
【図面の簡単な説明】
【0061】
【図1】実施の形態1におけるアミノ化合物の製造装置を示す模式図
【符号の説明】
【0062】
1 アミノ化合物の製造装置
2 反応器
2a 供給管
3 加熱装置
4 撹拌器
5 ガス供給部
6 還元剤(水素)供給管
7 原料ガス(原料アミン)供給管
8 原料アルコール供給管
9 排出管
10 蒸気管
11 冷却器
12 流出管
13 受器
14 採取管
15 排ガス管
16 触媒含有溶液
17 反応生成物と反応水
【技術分野】
【0001】
本発明は、多価アルコールやアミノアルコールとアンモニア若しくは第1級アミン又は第2級アミンとを反応させて、対応する第3級アミンやアミノアルコール等を製造するアミノ化合物の製造方法に関するものである。
【背景技術】
【0002】
アミノ化合物の1種であるN,N,N’,N’-テトラメチル-α,ω-アルキレンジアミンは、一般式(A)で示される工業的に重要な第3級アミンであり、ウレタンフォーム製造時の触媒として使用され、主にn=2,3又は6のものが製造販売されている。
Me2N-(CH2)n-NMe2 …(A)
また、一般式(B)で示される中間体のアミノアルコールは、反応性ウレタン触媒とよばれ、一般式(A)で示される第3級アミンと比較して、劣悪な刺激臭と眼粘膜刺激性が少ないため作業環境の向上をもたらすとともに、さらに活性水素(水酸基)を有するためウレタン原料であるイソシアネートと反応してポリウレタン樹脂骨格に組み込まれることからウレタン触媒の蒸散が抑制され、それ故、ポリウレタン樹脂やウレタンフォームの耐フォギング性、耐ビニルシステイン性、耐熱性を向上させることができるため高い評価を得ている重要なアミノ化合物である。
Me2N-(CH2)n-OH …(B)
【0003】
ここで、一般式(A)で示される第3級アミンの一般的な製造方法としては、一般式(C)で示される対応する第1級アミンの還元メチル化反応法と、化学反応式(D)で示される多価アルコールのアミノ化反応法がある。なお、ここでは多価アルコールとして2価アルコール(ジオール)を例示する。
H2N-(CH2)n-NH2 …(C)
HO-(CH2)n-OH → Me2N-(CH2)n-NMe2+2H2O …(D)
なお、化学反応式(D)のアミノ化反応は、化学反応式(E),(F)の逐次反応で進行し、化学反応式(F)で示す2段目の反応の速度が従来触媒では一般に遅いことが知られている。
HO-(CH2)n-OH+Me2NH → Me2N-(CH2)n-OH+H2O…(E)
Me2N-(CH2)n-OH+Me2NH → Me2N-(CH2)n-NMe2+H2O …(F)
【0004】
前者の還元メチル化反応法は、例えば(特許文献1)に記載されているように、反応の際にホルムアルデヒドを過剰に必要とするため、未反応のホルムアルデヒドの後処理が負荷となり工業的に不利である。一方、後者の化学反応式(D)で示されるアミノ化反応法は、第3級アミン以外には反応水が生成するだけなので、グリーンケミストリーの観点からも工業的に有利な製造方法である。
そこで、多価アルコールを出発原料として、アミノ化反応によって第3級アミン等のアミノ化合物を製造するための方法が開発されている。
【0005】
従来の技術としては、例えば(特許文献2)に「多価アルコールと環状第1級又は第2級アミンとを、(a)銅のカルボン酸塩又は銅の分子内錯体として銅アセチルアセトン錯体と、(b)周期律表第8族元素、マンガン及び亜鉛から選ばれる金属のカルボン酸塩又は分子内錯体としてアセチルアセトン錯体の1種又は2種以上と、(c)カルボン酸又はカルボン酸のアルカリ金属塩若しくはアルカリ土類金属塩の1種又は2種以上と、の混合物を水素とアミンの混合物又は他の還元剤で還元処理した触媒の存在下、150〜300℃の温度で反応させる第3級アミンの製造方法」が開示されている。
(特許文献3)には「多価アルコールと第1級アミン若しくは第2級アミンとを、銅−ニッケル−第8族白金元素触媒の存在下に、反応で生成した水を除去しつつ、大気圧乃至は5気圧以下の加圧下、150℃乃至250℃の温度で反応させる第3級アミンの製造方法」が開示されている。
(特許文献4)や(特許文献5)には「ジオールと第1級アミンとを、銅−ニッケル−第8族白金元素触媒の存在下に、反応で生成した水を除去しつつ、150℃乃至250℃の温度で反応させてアミノアルコールを製造する技術」が開示されている。
【特許文献1】特開2000−159731号公報
【特許文献2】特公昭60−11020号公報
【特許文献3】特公平3−4534号公報
【特許文献4】特開平5−39338号公報
【特許文献5】特開平5−93031号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら上記従来の技術においては、以下のような課題を有していた。
(1)(特許文献2)には多価アルコールから第3級アミンを製造した実施例の記載がないため、本発明者らが明細書の記載に従ってステアリン酸銅、ステアリン酸ニッケル、ステアリン酸バリウムを触媒原料に用いて、1,6−へキサンジオール(多価アルコール)を、モルホリンに代えてジメチルアミン(第2級アミン)と反応させる追試を行ったところ、触媒が凝集してしまい高速で効率的なアミノ化反応を実現できなかった。これらの触媒原料は、極性の高い多価アルコール中では有効に活性化されず、また活性化されたとしても触媒の安定性が不十分なため、触媒を十分活性化させることができず、多価アルコールを効率よくアミノ化することができなかった。
(2)(特許文献3)の実施例13には、銅−ニッケル−ルテニウム系触媒を用いて、1,6−へキサンジオールをアミノ化した実施例が記載されているが、(特許文献3)に開示された触媒の第8族白金元素は、高価で触媒の製造コストが嵩み工業的に不利であるという課題を有していた。さらに、該特許の触媒の活性を追試した結果、触媒製造コストの基礎になる銅単位重量当たりの触媒活性(反応速度)が低く、生産性が乏しいことが確認された。
(3)(特許文献4)や(特許文献5)に開示の技術も、助触媒としてパラジウム等の第8族白金元素を用いているため、触媒の製造コストが嵩み工業的に不利であるという課題を有していた。また、触媒の活性が低いため、多価アルコールに対する触媒の使用量が2〜4wt%と非常に多く多大なランニングコストを要するという課題を有していた。
(4)逐次反応で進行する多価アルコールのアミノ化反応は、化学反応式(F)で示される2段目の反応性が非常に低いため、(特許文献2)乃至(特許文献5)に開示された触媒では活性が低く反応の完結に長時間を要し、また多量の副生物(アルドール縮合物)が生成するため、目的とするアミンやアミノアルコールを高収率で選択性良く製造できなかった。
【0007】
本発明は上記従来の課題を解決するもので、触媒にパラジウムやルテニウム等の貴金属を用いていないので、ランニングコストを抑制することができるとともに、高い反応速度で高収率かつ選択性よく工業的に有用な第3級アミン等のアミノ化合物を製造できるアミノ化合物の製造方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
上記従来の課題を解決するために本発明のアミノ化合物の製造方法は、以下の構成を有している。
本発明の請求項1に記載のアミノ化合物の製造方法は、多価アルコールとアンモニア若しくは第1級アミン又は第2級アミンとを、銅、ニッケル、カルシウム、アルカリ金属又はアルカリ土類金属(カルシウムを除く)を必須成分とする触媒の存在下、反応させる構成を有している。
この構成により、以下のような作用が得られる。
(1)銅、ニッケル、カルシウム、アルカリ金属又はアルカリ土類金属(カルシウムを除く)を必須成分とする触媒の存在下で反応させることによって、高い反応速度で高収率かつ選択性よく工業的に有用な第3級アミン等のアミノ化合物を製造することができる。特に、アミノ化反応は、化学反応式(F)で示される2段目の反応速度が極めて低いのであるが、従来と比較して、2段目の反応速度が著しく高く高活性化できることがわかった。
(2)触媒が高活性であるため、反応条件が温和であるとともに、少量の触媒で短時間で反応を完結させることができ低原価で生産性に著しく優れる。
(3)触媒にパラジウムやルテニウム等の貴金属を用いていないので、触媒のランニングコストを抑制することができる。
(4)貴金属含有に由来する原料アミンおよび生成アミンの不均化反応が大幅に抑制され、生成アミンの選択性を向上させることができる。
【0009】
ここで、出発原料の多価アルコールとしては、1,3−プロパンジオール,1,4−ブタンジオール、1,5−ペンタンジオール、1,6−へキサンジオール、1,8−オクタンジオール、1,9−ノナンジオール、1,10−デカンジオール、1,12−ドデカンジオール、12−ヒドロキシステアリルアルコール、エチレングリコール、トリエチレングリコール、プロピレングリコール等の2価アルコール、グリセリン等の3価アルコール等が用いられる。1,10−デカンジオールは、ひまし油のアルカリ酸化によって製造されるセバシン酸又はそのジメチルエステルの水素還元によって製造することができ、12−ヒドロキシステアリルアルコールは、リシノレイン酸の水素化によって製造することができる。
【0010】
出発原料のアミノアルコールとしては、化学反応式(E),(F)の逐次反応の中間体であって、前記多価アルコールをアミノ化することで得られるアミノ基と水酸基を有する化合物が用いられ、例えば、モノエタノールアミン、ジエタノールアミン、メチルジエタノールアミン、メチルエタノールアミン、ジメチルエタノールアミン、ジエチルエタノールアミン、ジイソプロピルエタノールアミン、ジブチルエタノールアミンが挙げられる。
【0011】
出発原料としての原料アミンは、アンモニア、一般式R1NH2で示される第1級アミン、一般式R2N2Hで示される第2級アミンが用いられる。
ここで、R1は炭素数1〜6の直鎖又は分岐鎖、脂環式のアルキル基、モルホリル基等の脂環式ヘテロ環であり、第1級アミンとしては、メチルアミン、エチルアミン、プロピルアミン、シクロヘキシルアミン等を挙げることができる。R2は炭素数1〜4の直鎖のアルキル基であり、第2級アミンとしては、ジメチルアミン、ジエチルアミン、ジプロピルアミン、ジブチルアミン等を挙げることができる。また、その他の原料アミンとしてはベンジルアミン等の芳香族アミン、シクロヘキシアミン等の脂環式アミン、フルフリルアミン等のヘテロ芳香族アミン、ピロリジン,ピペリジン,ピペラジン,ピロリドン等の環状アミンが挙げられる。
【0012】
銅、ニッケル、カルシウム及びアルカリ土類金属(カルシウムを除く)を必須成分とする触媒の触媒原料としては、(a)銅のカルボン酸塩又は銅の分子内錯体の1種又は2種以上、(b)ニッケルのカルボン酸塩又はニッケルの分子内錯体の1種又は2種以上、(c)カルシウムのカルボン酸塩又はカルシウム錯体の1種又は2種以上、(d)アルカリ金属又はアルカリ土類金属(カルシウムを除く)のカルボン酸塩の1種又は2種以上の混合物が用いられる。
アミノ化反応を実施するには、まず触媒原料を還元活性化させる必要がある。例えば、出発原料の多価アルコール若しくはアミノアルコールに触媒原料を加熱溶解させ、水素又は他の還元剤を導入して還元活性化させた後(以下、還元活性化処理という。)、原料アミンを導入することでアミノ化反応を進行させることができる。また、触媒原料を高級アルコール等の溶媒に加熱溶解させ、還元活性化処理の後、出発原料の多価アルコールやアミノアルコールと原料アミンとを導入することでアミノ化反応を進行させることができる。還元活性化処理によって得られた触媒は、見掛け上均一なコロイド状触媒(銅/ニッケル粒子径は約1nm)となる。
【0013】
触媒原料中、(a)銅のカルボン酸塩及び銅の分子内錯体は、還元活性化処理の過程で、金属銅にまで還元される。銅のカルボン酸塩を形成するカルボン酸としては、分子中にカルボキシル基を有するものであれば芳香族系であっても、分岐を有するものでも、直鎖アルキル基に複数のカルボキシル基や、他の置換基を有するものであってもよく、例えば、カプロン酸、エナント酸、カプリル酸、ペラルゴン酸、カプリン酸、ウンデカン酸、ラウリン酸、トリデカン酸、ミリスチン酸、ペンタデカン酸、パルミチン酸、ステアリン酸、オレイン酸等を挙げることができる。好ましいのは炭素数6以上のカルボン酸であり、特に好ましくは炭素数12以上のカルボン酸である。
炭素数5以下のカルボン酸塩は還元中、遊離したカルボン酸の影響によって金属コロイドが凝集し易く活性が低下し易いため好ましくない。銅の分子内錯体としては、例えば、アセチルアセトン錯体やジメチルグリオキシム錯体等、イオウを含有しない一般のキレート化合物を挙げることができる。
【0014】
また、触媒原料中、(b)ニッケルのカルボン酸塩及びニッケルの分子内錯体も、還元活性化処理の過程で還元される。カルボン酸塩、分子内錯体としては、前記カルボン酸、前記分子内錯体と同様の有機配位子を例示できる。なお、カルボン酸としては炭素数6以上のものが好ましい。炭素数5以下のカルボン酸塩は還元中、遊離したカルボン酸の影響によって金属コロイドが凝集し易く活性が低下し易いためである。
【0015】
また、触媒原料中、(c)カルシウムのカルボン酸塩及びカルシウム錯体は、アミノ化反応中に次第に還元され、銅及びニッケルと共に強力な触媒作用を発現する。カルボン酸としては前記カルボン酸と同様のものを例示できる。カルシウム錯体としては、例えば、アセチルアセトン錯体、ジメチルグリオキシム錯体等、無機陰イオンを持たない一般のキレート化合物が挙げられる。
なお、カルボン酸としては炭素数6以上のものが好ましい。銅、ニッケルの場合と同様にカルボン酸を遊離させ、銅/ニッケル金属コロイドを凝集させ易く活性を低下させ易いためである。
【0016】
触媒原料中、(d)アルカリ金属又はアルカリ土類金属(カルシウムを除く)のカルボン酸塩は、還元活性化処理及びアミノ化反応中も還元されることなく、銅−ニッケル−カルシウム系コロイド触媒の安定化剤として機能する。なかでもアルカリ土類金属のカルボン酸塩、特にバリウムのカルボン酸塩が有効である。バリウムは、銅やニッケルと比較して特に還元され難く、触媒の活性を維持する安定化剤として特に有効に機能するからである。
カルボン酸塩としては、前記したものと同様のものを例示でき、例えばステアリン酸バリウム、ラウリン酸バリウム、ステアリン酸ナトリウム等を挙げることができる。なかでも炭素数8〜30好ましくは10〜24特に18〜24のステアリン酸、ベヘニン酸、リグノセリン酸等が好適に用いられる。容易に入手できるとともに、本発明者らの実験の結果、炭素数8〜30のカルボン酸塩は、カルボキシル基の鎖長効果により銅/ニッケル金属コロイドの凝集抑制効果が高く、高い触媒活性を与えることがわかったからである。
なお、銅、ニッケル、アルカリ金属、アルカリ土類金属のカルボン酸塩は、特公昭59−27617号公報等に記載された周知の方法を用いて製造できる。
【0017】
触媒原料の還元活性化処理で用いる水素以外の他の還元剤としては、Al(C2H5)3、(C2H5)2Al(OC2H5)等を用いることができる。
また、触媒原料を溶解させる溶媒としては、高沸点の高級アルコールや流動パラフィン等を用いることができる。溶媒中で触媒原料を還元活性化することによって、高濃度の触媒溶液を製造することができる。この触媒溶液中で、多価アルコールやアミノアルコールのアミノ化反応を行うこともできる。
触媒原料の還元活性化処理では、多価アルコールやアミノアルコール、溶媒中に触媒原料を投入し、昇温と同時に水素等の還元剤を連続的に供給する。160℃付近から2価の銅の還元が始まり、200℃未満で触媒の活性化が完了する。還元活性化処理後、アミノ化反応の進行とともにコロイド状触媒を含有する反応混合物の色調が淡黄色(透明)から黒色へと変化し、次第に赤褐色の均一なコロイド状触媒へと変化し、高活性を発現するようになる。初期の淡黄色から黒色の状態の期間は、高活性のコロイド状触媒への移行期間にあり、一種の誘導期である。多価アルコールや高級アルコール等の鎖長が短くなるにつれ(例えば1,9−ノナンジオール、1,8−オクタンジオール等)、極性が高くなり誘導期間が長くなる傾向がみられるため、多価アルコールは鎖長が長い方が反応し易く好ましくない。また、溶媒としての高級アルコールの鎖長も沸点の点で長いほうが有利である。沸点の違いを利用して、反応生成物(アミノ化合物)を気化させ蒸留分離できるからである。
【0018】
還元活性化処理後は、反応器を100〜250℃好ましくは150〜220℃より好ましくは180〜220℃に設定し、多価アルコールや溶媒等に第1級アミンや第2級アミン等のガス状の原料アミンを導入し、アミノ化反応を開始させる。反応温度が180℃より低くなるにつれ反応速度が低下する傾向がみられ、150℃より低くなるにつれこの傾向が顕著になり、100℃より低いと生産性に著しく欠けるため好ましくない。反応温度が220℃より高くなるにつれ副反応が加速される傾向がみられ、250℃より高くなると顕著になるため好ましくない。
アミノ化反応は、−0.5〜10MPa好ましくは−0.05〜1MPaより好ましくは0.1〜0.5MPaの範囲で行うのが好適である。アミノ化反応は脱水反応であるため、加圧条件下では反応速度の低下を招くためである。
【0019】
アミノ化反応では、第1級アミンや第2級アミン等の原料アミンを導入すると数分間の誘導期の後、水が留出し始め反応の進行を確認できる。反応は水素を導入しない条件下でも進行する。多価アルコールやアミノアルコール等の脱水素によって発生した活性化水素が反応に使われるからである。しかし、水素を導入して水素の存在下で反応を行うのが好ましい。反応時間を若干短縮できるとともに、導入された水素が反応水の系外への搬出を助けるからである。水を系外へ効率よく搬出させるため、反応器内に導入された反応水搬出用の水素,窒素や不活性ガス等は消費されないので、水素に代えて、又は水素に混合して、窒素や希ガス等の不活性ガスを反応器内に導入することもできる。
水の生成とともに生成物である油分も留出するので、常法によって油水分離し、必要に応じて油分を反応器に戻しアミノ化反応を進行させる。反応の進行は、アミン価、水酸基価、或いはガスクロマトグラフィ分析によって追跡することができる。
アミノ化反応が終了すると水の留出も停止する。反応温度、触媒の濃度、アミンの供給速度にもよるが、アミノ化反応は2〜10時間で完了させることができる。
【0020】
触媒の濃度としては、金属銅を基準にして0.001〜10wt%(出発原料のアルコールに対して)好ましくは0.01〜5wt%より好ましくは0.05〜2wt%が好適である。濃度が0.05wt%より低くなるにつれ反応速度が低下する傾向がみられ、0.001wt%より低くなると生産性に著しく欠けるため好ましくない。濃度が2wt%より高くなるにつれ副反応が促進される傾向がみられ、10wt%を超えると顕著になるため好ましくない。
【0021】
触媒の組成としては、原子比で、銅:ニッケル:カルシウム:アルカリ金属又はアルカリ土類金属(カルシウムを除く)=5:1:1:1が最適である。なお、触媒の組成において、カルシウムに対するアルカリ金属又はアルカリ土類金属(カルシウムを除く)の比率は、原子比で0.1〜10が好適である。前記比率が0.1未満では、金属コロイド系の安定性が激減して金属コロイドの凝集が促進され触媒が失活し、10を超えると反応速度が大きく低下するからである。
また、触媒の組成において、銅に対するカルシウムの比率は、原子比で0.1〜0.5が好適である。前記比率が0.1未満や0.5を超えると反応速度が大きく低下するからである。
【0022】
アミノ化反応において、反応器内に供給される原料アミン(アンモニア,第1級アミン,第2級アミン)の単位時間当たりの供給速度(L/時間)としては、標準状態(25℃、0.1MPa)で、出発原料のアルコールの水酸基1モル当たり0.01〜100モル/時間、好ましくは0.1〜10モル/時間、特に好ましくは0.2〜5モル/時間がよい。0.01モル/時間未満では反応速度が遅く生産性に著しく欠けるため好ましくない。100モル/時間を越える場合は、原料アミンによる触媒被毒が顕著になって反応速度と収率の低下をきたし、さらに不均化も大きく促進されるため好ましくない。
【0023】
アミノ化反応は、回分式、連続式いずれの方法も可能である。回分式の場合は、例えば、通常の攪拌層型反応器、インジェクター方式の撹拌型反応器やループ式反応器等を用いることができる。連続式の場合も、特別の撹拌装置は必要なく、ガス撹拌式等の反応器を用いることができる。
【0024】
本発明によって得られるアミノ化合物としては、N,N,N’,N’-テトラメチル-1,6-ヘキサメチレンジアン、N,N,N’,N’-テトラメチル-1,8-オクタメチレンジアン、N,N,N’,N’-テトラメチル-1,9-ノナメチレンジアン、N,N,N’,N’-テトラメチル-1,10-デカメチレンジアン、N,N,N’,N’-テトラメチル-1,12-ドデカメチレンジアン、12-ヒドロキシ-N,N-ジメチルステアリルアミン、及び12−N,N−ジメチル−N’,N’−ジメチルステアリルアミン等の第3級アミン、これらの第3級アミンの中間体であるアミノアルコールを挙げることができる。これらのアミノ化合物は、ポリウレタン及びウレタンフォーム製造用触媒として好適に用いられる。
【0025】
アミノ化反応終了後は、反応混合物を冷却し活性炭等の吸着剤に吸着させることによって触媒を濾過分離することができる。但し、吸着時には触媒を還元状態に保つ必要がある。
しかし、コロイド状の触媒(銅/ニッケル粒子径は約1nm)は通常の濾過操作では分離不可能なので、通常の蒸留操作によって留分と残渣に分けるのが好ましい。残渣には触媒が存在しており、これを次回の反応にそのまま再使用することができるため、固体触媒の場合に必要な触媒の濾過工程を要さず作業性に優れる。
本発明の触媒は、還元活性処理後は極性溶液に対して極めて安定であり、アセトン溶液として1週間放置しても触媒が凝集しないことを確認した。さらに耐極性を向上させるため、触媒成分の内の安定化剤(アルカリ金属又はアルカリ土類金属(カルシウムを除く)成分)を増量することも有効である。また、繰り返し反応を行っても触媒の性能はほとんど低下しなかった。
【0026】
本発明の請求項2に記載の発明は、請求項1に記載のアミノ化合物の製造方法であって、前記触媒が、(a)銅のカルボン酸塩又は銅の分子内錯体の1種又は2種以上と、(b)ニッケルのカルボン酸塩又はニッケルの分子内錯体の1種又は2種以上と、(c)カルシウムのカルボン酸塩又はカルシウム錯体の1種又は2種以上と、(d)アルカリ金属又はアルカリ土類金属(カルシウムを除く)のカルボン酸塩の1種又は2種以上と、の混合物が、前記多価アルコール若しくは前記アミノアルコール又は溶媒中で、水素又は他の還元剤で還元処理された構成を有している。
この構成により、請求項1で得られる作用に加え、以下のような作用が得られる。
(1)触媒の原料が金属石鹸であるため、固体触媒を製造する場合に必要となる金属水酸化物の製造、水洗、乾燥、粉砕、分級等の煩雑なプロセスが不要なため、生産性に著しく優れる。
(2)多価アルコール等で還元処理された触媒はコロイド状のため、回分式及び連続式のいずれの方法にも適用できるとともに小規模生産にも容易に対応でき、自在性に優れる。
【0027】
本発明の請求項3に記載の発明は、請求項2に記載のアミノ化合物の製造方法であって、前記多価アルコールや前記アミノアルコールより低極性の前記溶媒中で、前記触媒が還元処理され、前記触媒を含有する前記溶媒に、前記多価アルコール及び/又は前記アミノアルコールと、前記アンモニア若しくは前記第1級アミン又は前記第2級アミン(原料アミン)と、を連続的に供給し反応させる構成を有している。
この構成により、請求項2で得られる作用に加え、以下のような作用が得られる。
(1)溶媒中で触媒を還元活性化させた後、触媒を含有する溶媒に原料の多価アルコールやアミノアルコールと第2級アミン等の原料アミンとを少量ずつ連続的に供給し反応させると、高極性の多価アルコール(例えば、炭素数2〜8の多価アルコールである1,6−ヘキサンジオールや1,8−オクタンジオール等)やアミノアルコールの場合でも、コロイド状の触媒が多価アルコール等の極性の影響を受け難いため、凝集し難く高活性を維持できる。このため、原料が高極性の炭素数2〜8の多価アルコールやアミノアルコールであっても、誘導期を完全に消滅させ、溶媒への原料の供給と同時に即座にアミノ化反応を開始させることができ、生産性を著しく高めることができるとともに、従来では不可能と考えられていた多彩なアミンの製造を可能にすることができ応用性に著しく優れる。これに対し、極性が高い炭素数2〜8の多価アルコールに触媒原料を溶解し還元活性化処理を行った後、これに第2級アミン等の原料アミンを供給する方法では、多価アルコール中で触媒が凝集する傾向がみられ、本来の活性が発現せず数時間に亘る誘導期がみられる場合があることがわかった。
【0028】
ここで、溶媒としては、原料の多価アルコールやアミノアルコールよりも低極性の高級アルコールや流動パラフィン等が用いられる。特に、低極性で、かつ、目的とする反応生成物(アミノ化合物)よりも高沸点の長鎖(炭素数12〜40好ましくは18〜24)の1価アルコール(ステアリルアルコール、ベヘニルアルコール、リグノアルコール等)や流動パラフィンが好適である。蒸留によって反応生成物(アミノ化合物)を溶媒と分離できるため、生産性に著しく優れるからである。
溶媒中で触媒原料を還元活性化することによって、溶媒に触媒が均一溶解した高濃度の触媒溶液を製造することができる。溶媒として高級アルコールを用いる場合、還元活性化された触媒の存在下で高級アルコールをアミノ化する。溶媒の高級アルコールの水酸基を消滅させ、水酸基を有する多価アルコールやアミノアルコールのアミノ化だけを観測できるようにするためである。
この触媒溶液に固定床プロセスと同様の考え方で、多価アルコールやアミノアルコール及びアミンを連続的に供給することで、アミノ化反応を行うことができる。得られたアミノ化合物は、触媒溶液より沸点が低いことを利用して連続的に留出させることができる。
【0029】
本発明の請求項4に記載の発明は、請求項2又は3に記載のアミノ化合物の製造方法であって、前記溶媒の沸点が、反応生成物の沸点より高いという構成を有している。
この構成により、請求項3で得られる作用に加え、以下のような作用が得られる。
(1)溶媒と反応生成物(アミノ化合物)との沸点の違いを利用して、蒸留によって反応生成物を溶媒と分離できるため、生産性に優れる。
【発明の効果】
【0030】
以上のように、本発明のアミノ化合物の製造方法によれば、以下のような有利な効果が得られる。
請求項1に記載の発明によれば、
(1)銅、ニッケル、カルシウム、アルカリ金属又はアルカリ土類金属(カルシウムを除く)を必須成分とする触媒の存在下で反応させることによって、高い反応速度で高収率かつ選択性よく工業的に有用な第3級アミン等のアミノ化合物を製造することができるアミノ化合物の製造方法を提供できる。
(2)触媒が高活性であるため、反応条件が温和であるとともに、少量の触媒で短時間で反応を完結させることができ生産性に著しく優れたアミノ化合物の製造方法を提供できる。
(3)触媒にパラジウムやルテニウム等の貴金属を用いていないので、触媒のランニングコストを抑制することができるアミノ化合物の製造方法を提供できる。
(4)貴金属含有に由来する原料アミンおよび生成アミンの不均化反応が大幅に抑制され、生成アミンの選択性を向上できアミノ化合物の優れた製造方法を提供できる。
【0031】
請求項2に記載の発明によれば、請求項1の効果に加え、
(1)触媒の原料が金属石鹸であるため、固体触媒を製造する場合に必要となる金属水酸化物の製造、水洗、乾燥、粉砕、分級等の煩雑なプロセスが不要なため、生産性に著しく優れたアミノ化合物の製造方法を提供できる。
(2)多価アルコール等で還元処理された触媒はコロイド状のため、回分式及び連続式のいずれの方法にも適用できるとともに小規模生産にも容易に対応でき、自在性に優れたアミノ化合物の製造方法を提供できる。
【0032】
請求項3に記載の発明によれば、請求項2の効果に加え、
(1)溶媒に高活性のコロイド状の触媒を安定に存在させることができるので、溶媒に出発原料である多価アルコールやアミンを連続的に供給すると、多価アルコール等の極性の影響を受けて触媒が凝集することなく活性低下を引き起こさないので、溶媒への原料の供給と同時に即座にアミノ化反応を開始させることができ、生産性を著しく高めることができるとともに、従来では不可能と考えられていた多彩なアミンの製造を可能にすることができ応用性に著しく優れたアミノ化合物の製造方法を提供できる。
【0033】
請求項4に記載の発明によれば、請求項2又は3の効果に加え、
(1)溶媒と反応生成物(アミノ化合物)との沸点の違いを利用して、蒸留によって反応生成物を溶媒と分離でき生産性に優れたアミノ化合物の製造方法を提供できる。
【発明を実施するための最良の形態】
【0034】
以下、本発明を実施するための最良の形態を、図面を参照しながら説明する。
(実施の形態1)
図1は実施の形態1におけるアミノ化合物の製造装置を示す模式図である。
図中、1は出発原料を連続式に反応させてアミノ化合物を連続式に製造する製造装置、2は反応器、2aは反応器2に接続され後述する溶媒や触媒原料を反応器2内に供給する供給管、3は反応器2の外周壁に配設されたヒータ等の加熱装置、4は反応器2内に配設された撹拌器、5は原料ガスや還元剤を反応器2内に導入するスパージャー(多孔ノズル)等のガス供給部、6はガス供給部5に水素等の還元剤を導く還元剤供給管、7はガス供給部5にガス状のアンモニア,第1級アミン,第2級アミンの原料アミンを導く原料ガス供給管、8は反応器2内に多価アルコールやアミノアルコールの原料アルコールを導入する原料アルコール供給管、9は使用済みの触媒を含有する溶媒等を反応器2から排出する排出管、10は反応器2の頂部に接続され発生蒸気を反応器2の外部に抜き出す蒸気管、11は蒸気管10に配設され反応器2で発生した蒸気を冷却凝縮させる冷却器、12は凝縮した反応生成物(アミノ化合物)が流れる流出管、13は流出管12に接続され流出する反応生成物(アミノ化合物)を受ける受器、14は受器13に接続され反応生成物(アミノ化合物)を取り出す採取管、15は排ガス管、16は反応器2内に貯留された高級アルコールや流動パラフィン等の溶媒と触媒とを含有する触媒含有溶液、17は受器13に貯留された反応生成物(アミノ化合物)と反応水である。受器13内で反応水は下層に、反応生成物は上層に分離している。
なお、本実施の形態においては、触媒含有溶液16の溶媒は原料アルコールよりも低極性で、かつ、目的とする反応生成物(アミノ化合物)よりも高沸点のステアリルアルコール、ベヘニルアルコール、リグノアルコール等の長鎖の1価アルコールや流動パラフィンが用いられている。
【0035】
以上のように構成された実施の形態1におけるアミノ化合物の製造方法について、以下、図面を参照しながら説明する。
始めに、供給管2aから反応器2に溶媒を供給した後、ステアリン酸銅,ステアリン酸ニッケル,ステアリン酸カルシウム,ステアリン酸バリウム等の触媒原料を反応器2内に投入する。撹拌器4を回転させながら、加熱装置3によって反応器2を昇温させると同時に、ガス供給部5から還元剤を連続的に供給し、触媒を溶媒中で還元活性化させ、触媒含有溶液16を生成する。
還元活性化処理後、反応器2を好ましくは180〜220℃に設定し、原料アルコールを原料アルコール供給管8から触媒含有溶液16に少量ずつ連続的に供給するとともに、ガス供給部5から触媒含有溶液16にガス状の原料アミンを連続的に供給し、触媒含有溶液16中で原料アルコールのアミノ化反応を開始させる。
触媒含有溶液16の溶媒より低沸点の反応生成物(アミノ化合物)と反応水は、気化して蒸気管10から反応器2の外部に排出され、冷却器11によって凝縮され連続的に反応生成物(アミノ化合物)を製造することができる。
【0036】
以上説明したような実施の形態1におけるアミノ化合物の製造方法によれば、以下のような作用が得られる。
(1)溶媒中で触媒を還元活性化させた後、触媒含有溶液16に原料アルコールと原料アミンとを少量ずつ連続的に供給し反応させると、原料アルコールが高極性の多価アルコール(例えば、炭素数2〜8の多価アルコールである1,6−ヘキサンジオールや1,8−オクタンジオール等)の場合でも、コロイド状の触媒が原料アルコールの極性の影響を受け難いため、凝集し難く高活性を維持できる。このため、誘導期を完全に消滅させ、触媒含有溶液16への原料の供給と同時に即座にアミノ化反応を開始させることができ、生産性を著しく高めることができる。一方、極性が高い原料アルコール(炭素数2〜8の多価アルコール)に触媒原料を溶解し還元活性化処理を行った後、これに原料アミンを供給する方法では、原料アルコール中で触媒が凝集する傾向がみられ、本来の活性が発現せず数時間に亘る誘導期がみられ生産性に欠け、さらに反応混合物中には高沸点物が多く生成され収率も低下する。
(2)触媒含有溶液16の溶媒の沸点が反応生成物(アミノ化合物)の沸点より高いため、溶媒と反応生成物との沸点の違いを利用して、蒸留によって反応生成物を溶媒と分離できるため生産性に優れる。
【実施例】
【0037】
以下、本発明を実施例により具体的に説明する。なお、本発明はこれらの実施例に限定されるものではない。なお、生成したアミノ化合物の同定は、ガスクロマトグラフィとGC/MS(ガスクロマトグラフィ/質量分析法)で行った。
(実施例1)
生成した水を分離するための凝縮器及び分離器、反応混合物サンプリング器、排ガス出口管、原料ガス導入管(多孔質ガラス製のスパージャー)、撹拌器、温度計を設けた500mLのフラスコに、多価アルコールとして1,12−ドデカンジオールを200g仕込み、触媒原料としてステアリン酸銅2.0g(多価アルコールに対する金属銅0.1wt%)、ステアリン酸ニッケル0.4g(多価アルコールに対する金属ニッケル0.02wt%)、ステアリン酸カルシウム0.4g(多価アルコールに対する金属カルシウム0.02wt%)、ステアリン酸バリウム0.4g(多価アルコールに対する金属バリウム0.02wt%)を加えた後、撹拌器を回転させ、フラスコ内を窒素で置換し昇温した。触媒原料の4種類の金属石鹸は、100℃に達するまでに均一に溶解した。100℃に達したら窒素を水素に切換え、水素ガスを、流量計を通じて22L/時間の流速でフラスコ内にバブリングさせて還元活性化処理を行った。170〜190℃で2価の銅とニッケルの特徴的な緑色が次第に淡色化し、触媒原料が還元され見掛け上均一なコロイド状触媒となった。反応温度を210℃に保ち、第2級アミンのジメチルアミンを常圧で28L/時間の流速で水素(流速22L/時間)との混合ガスとして連続供給した。
まもなく、水の留出を伴ってアミノ化反応が進行しだした。反応開始時、フラスコ内の反応混合物の色相は黒色であったが、反応の進行とともにフラスコ内の触媒は褐色の完全なコロイド状になり、急激に反応速度が向上した。1時間間隔で反応混合物(反応水を除く)をサンプリングしてガスクロマトグラフィで分析し、転化率、生成物比率、収率、反応速度を算出した。反応速度は、化学反応式(E)で示す1段目の反応、化学反応式(F)で示す2段目の反応について、銅の単位モル当たり、ジメチルアミン単位モル供給速度当たりの反応速度(mole・h−1・mole(Cu)−1・[mole(DMA)・h−1]−1)を各々算出した。
なお、ガスクロマトグラフィの分析条件は以下のとおりである。
機種:島津製作所製GC−14B、キャピラリーカラム:0.32mm×30m、キャリアガス:窒素 30mL/分、充填剤:DB−17、カラム温度:100〜270℃、270℃で13分間保持、昇温速度:10℃/分、検知器:FID、試料濃度:10%、スプリット比:20。
【0038】
(実施例2)
多価アルコールとして1,10−デカンジオールを用い、ジメチルアミンを28L/時間の流速で供給した以外は、実施例1と同様にしてアミノ化反応を行った。
【0039】
(実施例3)
多価アルコールとして1,9−ノナンジオールを用い、ジメチルアミンを28L/時間の流速で供給した以外は、実施例1と同様にしてアミノ化反応を行った。
【0040】
(実施例4)
多価アルコールとして1,8−オクタンジオールを用い、ジメチルアミンを28L/時間の流速で供給した以外は、実施例1と同様にしてアミノ化反応を行った。
【0041】
(実施例5)
生成した水を分離するための凝縮器及び分離器、反応混合物サンプリング器、排ガス出口管、原料ガス導入管、撹拌器、温度計を設けた500mLのフラスコに、溶媒としてベヘニルアルコール(炭素数22)を200g仕込み、触媒原料としてステアリン酸銅4.0g(溶媒の高級アルコールに対する金属銅0.2wt%)、ステアリン酸ニッケル0.8g(高級アルコールに対する金属ニッケル0.04wt%)、ステアリン酸カルシウム0.8g(高級アルコールに対する金属カルシウム0.04wt%)、ステアリン酸バリウム0.8g(高級アルコールに対する金属バリウム0.04wt%)を加えた後、撹拌器を回転させ、フラスコ内を窒素で置換し昇温した。触媒原料の4種類の金属石鹸は、100℃に達するまでに均一に溶解した。100℃に達したら窒素を水素に切換え、水素ガスを、流量計を通じて22L/時間の流速でフラスコ内にバブリングさせて還元活性化処理を行った。170〜190℃で2価の銅とニッケルの特徴的な緑色が次第に淡色化し、触媒原料が還元され見掛け上均一なコロイド状触媒となった。反応温度を210℃に保ち、第2級アミンのジメチルアミンを常圧で28L/時間の流速で水素(流速22L/時間)との混合ガスとして3時間連続供給し、ベヘニルアルコールがアミノ化されてN,N−ジメチルベヘニルアミンが生成した触媒溶液を得た。なお、ベヘニルアルコールの転化率は100%であった。
210℃に保った触媒溶液中に、多価アルコールとして1,6−ヘキサンジオールを0.48モル/時間の供給速度で連続して添加するとともに、第2級アミンとしてジメチルアミンを常圧で1.0モル/時間の供給速度で水素ガスとの混合ガスとしてバブリングして連続供給した。なお、水素ガスの供給速度は22L/時間であった。
1、6−ヘキサンジオールの供給開始とともに、直ちに水の留出を伴ってアミノ化反応が進行した。誘導期は全く観察されなかった。反応混合物は反応水とともに定常的に反応系外に留出させた。定常に達してから(平均滞留時間2.1時間)、留出した反応混合物(反応水を除く)をサンプリングしてガスクロマトグラフィ分析を行い、転化率、生成物比率、収率、反応速度を算出した。
【0042】
(実施例6)
多価アルコールとして12−ヒドロキシステアリルアルコールを用い、ジメチルアミンを17L/時間の流速で供給した以外は、実施例1と同様にしてアミノ化反応を行った。
【0043】
(実施例7)
触媒原料としてステアリン酸銅2.0g(多価アルコールに対する金属銅0.1wt%)、ステアリン酸ニッケル0.4g(多価アルコールに対する金属ニッケル0.02wt%)、ステアリン酸カルシウム0.1g(多価アルコールに対する金属カルシウム0.005wt%、金属銅に対する金属カルシウムの比率0.05)、ステアリン酸バリウム0.4g(多価アルコールに対する金属バリウム0.02wt%)を加えた以外は、実施例1と同様にしてアミノ化反応を行った。
【0044】
(実施例8)
触媒原料としてステアリン酸銅2.0g(多価アルコールに対する金属銅0.1wt%)、ステアリン酸ニッケル0.4g(多価アルコールに対する金属ニッケル0.02wt%)、ステアリン酸カルシウム0.2g(多価アルコールに対する金属カルシウム0.01wt%、金属銅に対する金属カルシウムの比率0.1)、ステアリン酸バリウム0.4g(多価アルコールに対する金属バリウム0.02wt%)を加えた以外は、実施例1と同様にしてアミノ化反応を行った。
【0045】
(実施例9)
触媒原料としてステアリン酸銅2.0g(多価アルコールに対する金属銅0.1wt%)、ステアリン酸ニッケル0.4g(多価アルコールに対する金属ニッケル0.02wt%)、ステアリン酸カルシウム1.0g(多価アルコールに対する金属カルシウム0.04wt%、金属銅に対する金属カルシウムの比率0.5)、ステアリン酸バリウム0.4g(多価アルコールに対する金属バリウム0.02wt%)を加えた以外は、実施例1と同様にしてアミノ化反応を行った。
【0046】
(実施例10)
触媒原料としてステアリン酸銅2.0g(多価アルコールに対する金属銅0.1wt%)、ステアリン酸ニッケル0.4g(多価アルコールに対する金属ニッケル0.02wt%)、ステアリン酸カルシウム1.2g(多価アルコールに対する金属カルシウム0.06wt%、金属銅に対する金属カルシウムの比率0.6)、ステアリン酸バリウム0.4g(多価アルコールに対する金属バリウム0.02wt%)を加えた以外は、実施例1と同様にしてアミノ化反応を行った。
【0047】
(比較例1)
触媒原料としてステアリン酸銅2.0g(多価アルコールに対する金属銅0.1wt%)、ステアリン酸ニッケル0.4g(多価アルコールに対する金属ニッケル0.02wt%)、ステアリン酸バリウム0.4g(多価アルコールに対する金属バリウム0.02wt%)を加えた以外は、実施例1と同様にしてアミノ化反応を行った。比較例1は、触媒原料にステアリン酸カルシウムを加えていない点で、実施例1と相違する。
【0048】
(比較例2)
(特許文献3)に記載された実施例1に従って、合成ゼオライトに担持させた銅−ニッケル−白金族元素の3元触媒(Cu:Ni:Ru=4:1:0.01、担体はY型ゼオライト、担持量は金属酸化物を基準として50wt%)を調製した。
生成した水を分離するための凝縮器及び分離器、反応混合物サンプリング器、排ガス出口管、原料ガス導入管、撹拌器、温度計を設けた500mLのフラスコに、多価アルコールとして1,10−デカンジオール200gと、調製した触媒0.62g(多価アルコールに対する金属銅0.1wt%)を仕込み撹拌しながら、フラスコ内を窒素で置換し昇温した。100℃に達したら窒素を水素に切換え、水素ガスを、流量計を通じて22L/時間の流速でフラスコ内に吹き込み210℃まで昇温した。反応温度を210℃に保ち、第2級アミンのジメチルアミンを常圧で27L/時間の流速で水素(流速22L/時間)との混合ガスとして連続供給し、反応を、ガスクロマトグラフィを用いて追跡した。
【0049】
(比較例3)
触媒の担体が合成ゼオライトMS−13Xであること以外は比較例2と全く同じ条件で、1,10−デカンジオールのアミノ化反応を行った。
【0050】
(表1)に、実施例1〜10における触媒原料の各金属の多価アルコールに対する質量分率を示し、(表2)に、実施例1〜6及び比較例1〜3の反応時間(時間)、多価アルコールからアミノ化合物への転化率(%)、サンプリングした反応時間経過後の反応混合物(反応水を除く)の多価アルコール比率(%)、ジ3級アミン比率(%)、モノ3級アミン比率(%)、高沸点物比率(%)、低沸点物比率(%)、アミノ化反応1段目と2段目の反応速度(mole・h−1・mole(Cu)−1・[mole(DMA)・h−1]−1)(銅の単位モル当たり、ジメチルアミンの単位モル供給速度当たりの反応速度)をまとめて示した。なお、(表1)において、ジ3級アミンと表記しているのは、実施例1及び比較例1においてはN,N,N’,N’−テトラメチル−1,12−ドデカンジアミンであり、実施例2、比較例2及び比較例3においてはN,N,N’,N’−テトラメチル−1,10−デカンジアミンであり、実施例3においてはN,N,N’,N’−テトラメチル−1,9−ノナンジアミンであり、実施例4においてはN,N,N’,N’−テトラメチル−1,8−オクタンジアミンであり、実施例5においてはN,N,N’,N’−テトラメチル−1,6−ヘキサンジアミンであり、実施例6においては12−N,N−ジメチルアミノ−1−N’,N’−ジメチルステアリルアミンであり、モノ3級アミンと表記しているのは、実施例1及び比較例1においては12−N,N−ジメチルアミノ−1−ドデカノールであり、実施例2、比較例2及び比較例3においては10−N,N−ジメチルアミノ−デカノール−1であり、実施例3においては9−N,N−ジメチルアミノ−ノナノール−1であり、実施例4においては8−N,N−ジメチルアミノ−オクタノール−1であり、実施例5においては6−N,N−ジメチルアミノ−ヘキサノール−1であり、実施例6においては12−N,N−ジメチルアミノステアリルアルコールである。
【0051】
【表1】

【0052】
【表2】

【0053】
(表2)において実施例1と比較例1とを比較すると、実施例1では反応7時間目で転化率99.9%、ジ3級アミンとモノ3級アミンが各々84.2%、10.8%(合計95.0%)、高沸点物と低沸点物が各々4.2%、0.6%であったのに対し、比較例1では反応35時間目でも転化率94.0%、ジ3級アミンとモノ3級アミンが各々70.4%、12.3%(合計82.7%)、高沸点物と低沸点物が各々9.8%、0.8%であり、実施例1は転化率が高く、目的とする第3級アミンが高い選択性で得られていることが明らかになった。また、1段目と2段目の反応速度においても、比較例1に対して実施例1は、3〜4倍の極めて高い反応速度で反応が進行したことが明らかになった。
比較例1は、触媒原料のステアリン酸カルシウムを加えておらず、触媒が銅−ニッケル−バリウムの3元触媒であることから、触媒活性は実施例1の触媒の1/3以下と大きく下回っており、カルシウム含有コロイダル触媒の優位性を明確に確認することができた。
【0054】
次に、実施例2と比較例2とを比較すると、実施例2では反応7時間目で転化率100%、ジ3級アミンとモノ3級アミンが各々88.3%、5.7%(合計94.0%)であったのに対し、比較例2では反応6時間目で転化率34.0%、ジ3級アミンとモノ3級アミンが各々2.9%、29.1%(合計32.0%)であり、実施例2は転化率が高く、目的とする第3級アミンが高い選択性で得られていることが明らかになった。また、2段目の反応速度を比較すると、比較例2に対して実施例2は、40倍以上の極めて高い反応速度で反応が進行したことが明らかになった。
なお、比較例3は、比較例2と比較すると2段目のアミノ化反応速度が大きく向上しているものの、実施例2との比較から明らかなように、本発明で使用するカルシウム含有コロイダル触媒の方が、圧倒的に触媒活性が高いことが明らかになった。
本実施例によれば、アミノ化反応1段目の反応生成物であるアミノアルコールと、反応2段目の反応生成物である第3級アミンが、いずれも高い反応速度で得られることから、アミノアルコールや第3級アミンを低原価で量産でき、生産性に著しく優れることが明らかになった。
【0055】
また、実施例3及び4では、反応19時間目で転化率はほぼ100%、ジ3級アミンとモノ3級アミンの合計が約90%であることから、転化率が高く、目的とする第3級アミンが高い選択性で得られていることが明らかになった。
また、実施例6によれば、反応16時間での転化率、12−ヒドロキシ−1−N,N−ジメチルステアリルアミン(モノ3級アミン)及び12−N,N−ジメチルアミノ−1−N’,N’−ジメチルステアリルアミン(ジ3級アミン)の生成比率は、それぞれ94.7%、61.6%、33.1%であり、1段目のアミノ化反応速度(mole・h−1・mole(Cu)−1・[mole(DMA)・h−1]−1)は13であり、2段目のアミノ化反応速度(単位は既述)は4であった。以上のことから、カルシウム含有コロイダル触媒を使用することにより、12−ヒドロキシステアリルアルコールから12−ヒドロキシ−1−N,N−ジメチルステアリルアミンを製造するだけでなく、安定な12−ヒドロキシル基をアミノ化して、12−N,N−ジメチルアミノ−1−N’,N’−ジメチルステアリルアミンも製造できることが明らかになり、本発明で使用するカルシウム含有コロイダル触媒の触媒活性の高さを示すことができた。
なお、(表2)において、多価アルコール比率、ジ3級アミン比率、モノ3級アミン比率、高沸点物比率、低沸点物比率の合計が100%に満たない実施例や比較例があるのは、ガスクロマトグラフィ分析に伴う誤差、触媒原料由来のエステル等による影響が考えられるが、詳細は検討中である。
【0056】
さらに、触媒溶液に多価アルコールとジメチルアミンを連続的に供給した実施例5では、誘導期が全く観察されなかっただけでなく、平均滞留時間(反応時間)2.1時間で転化率99.5%、ジ3級アミンとモノ3級アミンが各々85.9%、11.8%(合計97.7%)、高沸点物と低沸点物が各々1.2%、0.2%であり、高い転化率と選択性を実現できるとともに、高沸点物が極めて少なくできることが明らかになった。また、アミノ化反応速度は1段目305、2段目262であり、本実施例及び比較例の中で最高の値を示した。
なお、実施例5と同じ1,6−ヘキサンジオールのアミノ化反応を、連続式プロセスによらず(触媒溶液を使用することなく)実施例1〜4と同様の回分式反応で行った場合、反応時間5.5時間で転化率20%であり、ジ3級アミンとモノ3級アミンの合計収率は20%であった。
また、実施例5で行った連続式プロセスを、実施例3及び4の1,9−ノナンジオール及び1,8−オクタンジオールのアミノ化反応に適用したところ、実施例5の場合と同様に、誘導期間を完全に消滅させることができた。
これにより、実施例5で行った連続式プロセスの圧倒的優位性が示された。
【0057】
なお、反応1時間における実施例7,10のジ3級アミン及びモノ3級アミンの生成比率と、実施例8,9のジ3級アミン及びモノ3級アミンの生成比率とを比較したところ、実施例7,10は、実施例8,9に比べて大きく低下していた。本実施例により、触媒の組成において、銅に対するカルシウムの比率が原子比で0.1〜0.5の範囲を外れると、触媒の活性が低下することが確認された。
【0058】
なお、実施例1〜5において、触媒原料として、ステアリン酸銅、ステアリン酸ニッケル及びステアリン酸カルシウムに代えて、ミリスチン酸銅、銅アセチルアセトン、銅ジメチルグリオキシム、ニッケルジメチルグリオキシム、ペラルゴン酸ニッケル、ニッケルアセチルアセトン、ラウリン酸カルシウムを用いた場合も、ほぼ100%の転化率が得られ、同様の傾向が確認された。また、実施例1〜5において、ステアリン酸バリウムに代えて、ラウリン酸バリウム、ステアリン酸ナトリウムを用いた場合も、ほぼ100%の転化率が得られ同様の傾向が確認された。しかし、ラウリン酸バリウム、ステアリン酸ナトリウムを用いた場合は、ステアリン酸バリウムを用いた場合より若干反応速度が低いことが確認された。これは、ラウリン酸に比べて鎖長の長いステアリン酸の金属塩は、銅/ニッケル金属コロイドの凝集抑制効果がラウリン酸塩より優れていることを示している。また、バリウムのステアリン酸塩は、銅/ニッケル金属コロイドの凝集抑制効果がナトリウムのステアリン酸塩の凝集抑制効果より優れていることを示している。
また、原料アミンとして、アンモニア、メチルアミン、シクロヘキシアミン等を用いた場合も、実施例1〜5と同様に、対応する第3級アミンが得られることを確認した。
【0059】
以上のように本実施例によれば、銅、ニッケル、カルシウム、アルカリ金属又はアルカリ土類金属(カルシウムを除く)を必須成分とする触媒を用いて反応させることにより、高収率かつ選択性よく第3級アミンが得られることが明らかになった。また、律速段階である2段目のアミノ化反応においても、極めて高い反応速度で反応を完結できることが明らかになった。さらに、触媒溶液に多価アルコールとジエチルアミンを連続的に供給することによって、触媒の本来の活性を発現させることができ、誘導期が全くなく、極めて高い反応速度が得られるとともに、極めて高い選択性が実現できることが明らかになった。これにより、従来では不可能と考えられていた多彩なアミンの製造を可能にすることができ、応用性に著しく優れたアミノ化合物の製造方法を提供できる。
【産業上の利用可能性】
【0060】
本発明は、多価アルコールやアミノアルコールとアンモニア若しくは第1級アミン又は第2級アミンとを反応させて、対応する第3級アミンやアミノアルコール等を製造するアミノ化合物の製造方法に関し、触媒にパラジウムやルテニウム等の貴金属を用いていないので、ランニングコストを大幅に低減することができるとともに、本発明のアミノ化反応は基本的に水素を必要としない(触媒原料の還元活性化処理は除く)反応であり、触媒成分としてカルシウムの併用がその効果を強化しているため、高い反応速度で高収率かつ選択性よく工業的に有用な第3級アミン等のアミノ化合物を製造できるアミノ化合物の製造方法を提供することができる。
【図面の簡単な説明】
【0061】
【図1】実施の形態1におけるアミノ化合物の製造装置を示す模式図
【符号の説明】
【0062】
1 アミノ化合物の製造装置
2 反応器
2a 供給管
3 加熱装置
4 撹拌器
5 ガス供給部
6 還元剤(水素)供給管
7 原料ガス(原料アミン)供給管
8 原料アルコール供給管
9 排出管
10 蒸気管
11 冷却器
12 流出管
13 受器
14 採取管
15 排ガス管
16 触媒含有溶液
17 反応生成物と反応水
【特許請求の範囲】
【請求項1】
多価アルコール及び/又は前記多価アルコールがアミノ化されたアミノアルコールと、アンモニア若しくは第1級アミン又は第2級アミンとを、銅、ニッケル、カルシウム、アルカリ金属又はアルカリ土類金属(カルシウムを除く)を必須成分とする触媒の存在下、反応させることを特徴とするアミノ化合物の製造方法。
【請求項2】
前記触媒が、(a)銅のカルボン酸塩又は銅の分子内錯体の1種又は2種以上と、(b)ニッケルのカルボン酸塩又はニッケルの分子内錯体の1種又は2種以上と、(c)カルシウムのカルボン酸塩又はカルシウム錯体の1種又は2種以上と、(d)アルカリ金属又はアルカリ土類金属(カルシウムを除く)のカルボン酸塩の1種又は2種以上と、の混合物が、前記多価アルコール若しくは前記アミノアルコール又は溶媒中で、水素又は他の還元剤で還元処理されたものであることを特徴とする請求項1に記載のアミノ化合物の製造方法。
【請求項3】
前記多価アルコールや前記アミノアルコールより低極性の前記溶媒中で、前記触媒が還元処理され、前記触媒を含有する前記溶媒に、前記多価アルコール及び/又は前記アミノアルコールと、前記アンモニア若しくは前記第1級アミン又は前記第2級アミンと、を連続的に供給し反応させることを特徴とする請求項2に記載のアミノ化合物の製造方法。
【請求項4】
前記溶媒の沸点が、反応生成物の沸点より高いことを特徴とする請求項2又は3に記載のアミノ化合物の製造方法。
【請求項1】
多価アルコール及び/又は前記多価アルコールがアミノ化されたアミノアルコールと、アンモニア若しくは第1級アミン又は第2級アミンとを、銅、ニッケル、カルシウム、アルカリ金属又はアルカリ土類金属(カルシウムを除く)を必須成分とする触媒の存在下、反応させることを特徴とするアミノ化合物の製造方法。
【請求項2】
前記触媒が、(a)銅のカルボン酸塩又は銅の分子内錯体の1種又は2種以上と、(b)ニッケルのカルボン酸塩又はニッケルの分子内錯体の1種又は2種以上と、(c)カルシウムのカルボン酸塩又はカルシウム錯体の1種又は2種以上と、(d)アルカリ金属又はアルカリ土類金属(カルシウムを除く)のカルボン酸塩の1種又は2種以上と、の混合物が、前記多価アルコール若しくは前記アミノアルコール又は溶媒中で、水素又は他の還元剤で還元処理されたものであることを特徴とする請求項1に記載のアミノ化合物の製造方法。
【請求項3】
前記多価アルコールや前記アミノアルコールより低極性の前記溶媒中で、前記触媒が還元処理され、前記触媒を含有する前記溶媒に、前記多価アルコール及び/又は前記アミノアルコールと、前記アンモニア若しくは前記第1級アミン又は前記第2級アミンと、を連続的に供給し反応させることを特徴とする請求項2に記載のアミノ化合物の製造方法。
【請求項4】
前記溶媒の沸点が、反応生成物の沸点より高いことを特徴とする請求項2又は3に記載のアミノ化合物の製造方法。
【図1】




【公開番号】特開2008−44930(P2008−44930A)
【公開日】平成20年2月28日(2008.2.28)
【国際特許分類】
【出願番号】特願2007−162732(P2007−162732)
【出願日】平成19年6月20日(2007.6.20)
【出願人】(592135041)小倉合成工業株式会社 (4)
【Fターム(参考)】
【公開日】平成20年2月28日(2008.2.28)
【国際特許分類】
【出願日】平成19年6月20日(2007.6.20)
【出願人】(592135041)小倉合成工業株式会社 (4)
【Fターム(参考)】
[ Back to top ]

