アルギン酸リアーゼ
【課題】本件発明が解決しようとする課題は、アルギン酸から効率的にウロン酸単糖を製造する方法を提供することである。
【解決手段】本発明者らは、海藻分解菌AR06株(Pseudoalteromonas atlantica)から新規なエキソ型アルギン酸分解酵素alyC及びalyDを同定し、これを用いたウロン酸単糖の製造方法の発明を完成した。
【解決手段】本発明者らは、海藻分解菌AR06株(Pseudoalteromonas atlantica)から新規なエキソ型アルギン酸分解酵素alyC及びalyDを同定し、これを用いたウロン酸単糖の製造方法の発明を完成した。
【発明の詳細な説明】
【技術分野】
【0001】
本件発明はアルギン酸リアーゼに関する。更に詳しくは、本発明は、アルギン酸から不飽和ウロン酸単糖を効率的に産生するアルギン酸リアーゼ、及び、アルギン酸から不飽和ウロン酸単糖を効率的に産生する方法に関する。
【背景技術】
【0002】
アルギン酸(alginic acid, alginate)は、D-マンヌロン酸(M)とL-グルロン酸(G)の2種のウロン酸のピラノース環型が主としてβ1->4結合した多糖である。MとGの組成比は起源となる生物(主に藻類)により異なるが、Mブロック、Gブロック、及びMとGの混合ブロックが存在する(図1参照)。
【0003】
アルギン酸は自然界に豊富に存在するため、アルギン酸をM又はGの最小単位まで分解することにより不飽和ウロン酸単糖を効率的に製造できると期待される。現在までに、幾つかのアルギン酸分解酵素(アルギン酸リアーゼ)が同定されているが、これらは2つ以上のM又はGからなるオリゴ糖を生成する「エンド型(endo-type)」アルギン酸リアーゼ(図2参照)と、ウロン酸単糖を生成する「エキソ型(exo-type)」アルギン酸リアーゼ(図3参照)に大別できる。
【0004】
エンド型アルギン酸リアーゼとしては、アルテロモナス属の微生物由来の酵素(特許文献1)が報告されており、エキソアルギン酸リアーゼとしては、スフィンゴモナス属A1株由来の酵素(非特許文献1)が報告されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2000-342278
【非特許文献】
【0006】
【非特許文献1】Molecular identification of oligoalginate lyase of Sphingomonas sp. strain A1 as one of the enzymes required for complete depolymerization of alginate. Hashimoto W, Miyake O, Momma K, Kawai S, Murata K. J Bacteriol. 2000 Aug;182(16):4572-7.
【発明の概要】
【発明が解決しようとする課題】
【0007】
本件発明が解決しようとする課題は、アルギン酸から効率的にウロン酸単糖を製造する方法を提供することである。本発明者らは、海藻分解菌AR06株(Pseudoalteromonas atlantica)から新規なエキソ型アルギン酸分解酵素を同定し、これを用いたウロン酸単糖の製造方法の発明を完成した。
【課題を解決するための手段】
【0008】
即ち、本件発明は以下の実施形態を含むが、これらに限定されない。
[実施形態1]
配列番号:1に示されるアミノ酸配列又は当該配列と少なくとも86%の同一性を有するアミノ酸配列からなる単離されたポリペプチド:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
[実施形態2]
以下の工程を含む、不飽和ウロン酸単糖の製造方法:
(a)少なくとも2つのウロン酸部分を含むアルギン酸を提供する工程、
(b)当該アルギン酸に実施形態1に記載されたポリペプチドを接触させる工程、及び
(c)上記工程のアルギン酸及びポリペプチドの混合物を水の存在下で保温する工程。
[実施形態3]
当該工程(c)の前に、当該アルギン酸に配列番号:2に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、実施形態2に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
[実施形態4]
当該工程(c)の前に、当該アルギン酸に配列番号:3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、実施形態2に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
[実施形態5]
当該工程(c)の前に、当該アルギン酸に配列番号:2に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程、及び、当該アルギン酸に配列番号:3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、実施形態2に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
[実施形態6]
配列番号:2に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチド:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
[実施形態7]
以下の工程を含む、不飽和ウロン酸単糖の製造方法:
(a)少なくとも2つのウロン酸部分を含むアルギン酸を提供する工程、
(b)当該アルギン酸に実施形態6に記載されたポリペプチドを接触させる工程、及び
(c)上記工程のアルギン酸及びポリペプチドの混合物を水の存在下で保温する工程。
[実施形態8]
当該工程(c)の前に、当該アルギン酸に配列番号:3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、実施形態7に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
【発明の効果】
【0009】
本件発明が提供するエキソ型アルギン酸分解酵素及びこれを用いた方法により、効率的なウロン酸単糖の製造が可能になる。
【図面の簡単な説明】
【0010】
【図1】アルギン酸の構造を示す模式図である。図中、nは自然数である。
【図2】エンド型アルギン酸リアーゼによるアルギン酸の切断の模式図である。
【図3】エキソ型アルギン酸リアーゼによるアルギン酸の分解の模式図である。
【図4】精製アルギン酸リアーゼをSDS-ポリアクリルゲル電気泳動で分離し、CBB染色した写真である。
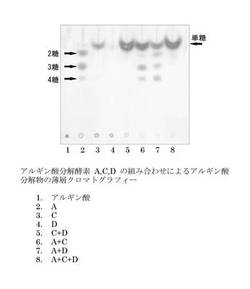
【図5】アルギン酸分解酵素A、C、又はDをアルギン酸に作用させたサンプルを薄層クロマトグラフィーに展開した結果を示す。レーン1:アルギン酸のみのサンプル(ネガティブコントロール)。レーン2:アルギン酸にalyAタンパク質を作用させたサンプル。レーン3:アルギン酸にalyCタンパク質を作用させたサンプル。レーン4:アルギン酸にalyDタンパク質を作用させたサンプル。レーン5:アルギン酸にalyCタンパク質及びalyDタンパク質を作用させたサンプル。レーン6:アルギン酸にalyAタンパク質及びalyCタンパク質を作用させたサンプル。レーン7:アルギン酸にalyAタンパク質及びalyDタンパク質を作用させたサンプル。レーン8:アルギン酸にalyAタンパク質、alyCタンパク質、及びalyDタンパク質を作用させたサンプル。
【図6】アルギン酸分解酵素C又はDをMブロック(M)、Gブロック(G)、MGブロック(MG)アルギン酸に作用させたサンプルを薄層クロマトグラフィーに展開した結果を示す。レーン1: 2〜4糖のオリゴ糖サンプル。レーン2: Mアルギン酸にalyCタンパク質を作用させたサンプル。レーン3: Gアルギン酸にalyCタンパク質を作用させたサンプル。レーン4: MGアルギン酸にalyCタンパク質を作用させたサンプル。レーン5: Mアルギン酸にalyDタンパク質を作用させたサンプル。レーン6: Gアルギン酸にalyDタンパク質を作用させたサンプル。レーン7: MGアルギン酸にalyDタンパク質を作用させたサンプル。レーン8: 2〜4糖のオリゴ糖サンプル。レーン9: MGアルギン酸にalyCタンパク質及びalyDタンパク質を作用させたサンプル。
【発明を実施するための形態】
【0011】
本件発明のポリペプチドは、配列番号:1又は2に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなるポリペプチドであり、また、本件発明の製造方法に使用されるポリペプチドは、配列番号:1、2、又は3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなるポリペプチドである。いずれの発明においても、同一性のレベルは少なくとも85%、86%、87%、88%、89%、好ましくは、90%、91%、92%、93%、94%、より好ましくは、95%、96%、97%、98%、又は99%、あるいは100%同一である。
【0012】
配列番号:1、2、又は3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなるポリペプチドは、いずれもアルギン酸リアーゼ活性を有する。
【0013】
ここで、配列番号:1と少なくとも85%の同一性を有するアミノ酸配列からなるポリペプチドは、配列番号:1のポリペプチドのMブロックに対するアルギン酸リアーゼ活性と比較して、30%以上、好ましくは、50%以上又は70%以上のMブロックに対するアルギン酸リアーゼ活性を有する。配列番号:1と少なくとも85%の同一性を有するアミノ酸配列からなるポリペプチドは、配列番号:1のポリペプチドのGブロックに対するアルギン酸リアーゼ活性と比較して、30%以上、好ましくは、50%以上又は70%以上のGブロックに対するアルギン酸リアーゼ活性を有する。配列番号:1と少なくとも85%の同一性を有するアミノ酸配列からなるポリペプチドは、配列番号:1のポリペプチドのMGブロックに対するアルギン酸リアーゼ活性と比較して、30%以上、好ましくは、50%以上又は70%以上のMGブロックに対するアルギン酸リアーゼ活性を有する。
【0014】
また、配列番号:2と少なくとも85%の同一性を有するアミノ酸配列からなるポリペプチドは、配列番号:2のポリペプチドのGブロックに対するアルギン酸リアーゼ活性と比較して、30%以上、好ましくは、50%以上又は70%以上のGブロックに対するアルギン酸リアーゼ活性を有する。
【0015】
本件発明に関して「単離された」ポリペプチドというときは、自然界にかつて存在しなかったレベルまで精製され、目的の活性を十分に示すことを意味する。即ち、「単離された」ポリペプチドには、微量又はある程度の不純物が含まれうる。
【0016】
本願明細書において「アルギン酸」というときは、出発材料として用いたアルギン酸のアルギン酸リアーゼによる部分分解物、例えばオリゴ糖、も含まれる。ただし、不飽和ウロン酸単糖はアルギン酸に含まれない。
【0017】
本発明に関して「不飽和ウロン酸単糖」というときは、「アルギン酸もしくはアルギン酸オリゴ糖末端から、エキソ型アルギン酸リアーゼのβ-脱離反応により遊離した、非還元末端に二重結合を持つ不飽和単糖」を意味する。
【0018】
本発明に関して、アルギン酸の「ウロン酸部分」というときは、アルギン酸中のβ1->4結合したMもしくはGを意味する。
【0019】
本発明に関して、アルギン酸と単数又は複数のポリペプチドを「接触させる」というときは、これらを固体、水溶液、又は懸濁液のいずれかの形態で混合することを意味する。アルギン酸と単数又は複数のポリペプチドは、混合する前にそれぞれ異なる形態であって構わない。
【0020】
本発明に関して、「水の存在下で」保温するというときは、アルギン酸と単数又は複数のポリペプチドの両者を固体の形態で混合した場合には、水を加えることを意味する。アルギン酸及びポリペプチドの混合物が既に水を含んでいる場合には、水の量を適宜調節してもよい。
【0021】
本発明に関して、水の存在下で「保温する」というときは、本願発明に使用するポリペプチドがアルギン酸リアーゼ活性を発揮しうる範囲に温度を保つことを意味する。保温時間は、アルギン酸の分解が確認できる時間であればどのような時間でもよい。
【0022】
アルギン酸に複数のポリペプチドを接触させる場合には、複数のポリペプチドを同時に接触させてもよいし、順次接触させてもよい。アルギン酸に複数のポリペプチドを順次接触させる場合には、一のポリペプチドをアルギン酸に接触させる工程と、他のポリペプチドをアルギン酸に接触させる工程の間に、アルギン酸及びポリペプチドの混合物を水の存在下で保温する工程を追加してもよい。即ち、本願明細書において、「工程(c)の前に」というときは、「最終的な保温工程の前に」という意味であり、保温工程の回数を限定するものではない。
【0023】
本願明細書において「アルギン酸分解酵素」と「アルギン酸リアーゼ」は同義で用いる。また、alyCと記載した場合には、alyC遺伝子、alyC遺伝子から転写されるmRNA、又はalyC遺伝子がコードするタンパク質のいずれかを表す。これらをalyC遺伝子、alyC mRNA、又はalyCタンパク質などと記載することもある。文脈上明らかな場合には、遺伝子、mRNA、又はタンパク質の語を省略する場合もある。alyD及びalyAという記載についても同様である。
【実施例】
【0024】
[実施例1]
[実験材料及び実験方法]
<アルギン酸>
アルギン酸ナトリウム (500 cps; NACALAI TESQUE, INC.)を用いた。
【0025】
<微生物及び培養条件>
AR06株用の完全培地としてマリンブロス Difco (Marine broth, MB) を用いた。(最小培地としてはArtificial Sea Water (ASW) 培地を用い、炭素源としてアルギン酸ナトリウムを0.3%加えて使用した。)培養は20℃で行った。寒天培地を用いる場合には、寒天粉末を培地に対して最終濃度1.5% (w/v) 添加した。
【0026】
【表1】

【0027】
【表2】

【0028】
E. coli DH5αはプラスミドの構築とタンパク質の発現のための宿主として用いた。完全培地として、E. coli にはLB 培地 (LB broth, LB) を用いた。E. coliの選択培地には必要に応じて、アンピシリン (Ap) を最終濃度50μg/mlとなるように添加した。培養は37℃で行った。
【0029】
【表3】

【0030】
制限酵素およびその他の酵素類は、TAKARA BIO INC、TOYOBO CO., LTD.、New England Biolabs Inc. 各社のいずれかのものを購入し、添付説明書の指示に従って用いた。その他の組換えDNA 関連操作は、常法(Sambrook et al., Molecular cloning, Cold Spring Harbor Laboratory (1989)) に従った。E. coliからのプラスミドの回収はQIAprep Spin Miniprep Kit (QIAGEN) を用いて行った。
【0031】
それぞれの発現プラスミドをE. coli DH5αに形質転換し、IPTGによる誘導でタンパク質の発現を誘導した。LBにてODが定常期になるまで培養した各E. coli株を1/5に希釈し、0.1 mM IPTG誘導下、20 ℃にて一晩培養した。
【0032】
<海藻分解菌AR06株のアルギン酸リアーゼC遺伝子(alyC)のクローニング>
AR06株よりQIAGEN Genomic-tip 500/G (QIAGEN) にて抽出したゲノムDNAを用いて、Illumina Genome Analyzerにより全ゲノム解析を行い、合計1,188 MbのシングルリードAR06株ゲノム配列を取得した。第2世代シーケンサーで得られる短い断片配列に特化したde novo assembleプログラムVelvet (Zerbino et al, 2008) を用い、AR06株ゲノムのアセンブルを行い、41bp以上の長さを持つコンティグが1781個得られた。
【0033】
AR06 株ゲノム配列コンティグに対して、類縁菌であるAlteromonadales bacterium TW-7 株のputative alginate lyase (locus_tag; ATW7_03777), putative alginate lyase precursor (locus_tag; ATW7_06243), putative chondroitin AC/alginate lyase (locus_tag; ATW7_06248)とP. haloplanctis TAC125株のputative alginate lyase (locus_tag; PSHAa0571), alyll (locus_tag; PSHAa1748), putative alginate lyase precursor (partial match) (locus_tag; PSHAa1749)の6つのCDS用いて検索を行い、コンティグ134 の相補鎖上に位置することを見出した。
【0034】
ベクターの作成
C末端にヒスチジンタグを付加した組換えタンパク質発現用のベクターを作製した。プライマーGTIR-Fp(GTGCACTCTCAGTACAATCTGC) とGTIR-Rp (TATGCGGTGTGAAATACCGCACA) を用いて、KOD-Plus (TOYOBO)によるPCRでpGReenTIR(国立遺伝学研究所)を増幅し、T4 Polynucleotide Kinase(TaKaRa Bio)にてリン酸化後、ライゲーションハイ(TOYOBO)によるセルフライゲーションにより、ベクター上のNdeI部位を一ヶ所除いたプラスミドpGTkを作成した。pET26b(Novagen/ Merck KGaA, Darmstadt, Germany)からヒスチジンタグ断片を含むNdeI-平滑化Bpu1102Iを切り出し、pGTkのNdeI-平滑化ASP718に挿入し、pGTk3を作成した。
【0035】
alyCはN末端にシグナルペプチドを有することが推定されたので、シグナルペプチドを除いた30 番目のコドン (Ala をコード) から3’末端までをプライマーalyCmn (TGGCGCATCCAAATTTGGTAATAAC) とalyCcxI (ATCCCTCGAGCTCCTGATTATTCTTCATC) を用いてKOD-Plus (TOYOBO)によるPCRで増幅し、XhoI消化後、pGTk3の平滑化NdeI-XhoI部位に挿入し、pLACHを作製した。
【0036】
<海藻分解菌AR06株のアルギン酸リアーゼD遺伝子(alyD)のクローニング>
alyCと同様に、AR06 株ゲノム配列コンティグに対して、類縁菌であるAlteromonadales bacterium TW-7 株とP. haloplanctis TAC125株のアルギン酸リアーゼ遺伝子を用いて検索を行い、コンティグ134 の相補鎖上に位置することを見出した。
【0037】
alyDはN末端にシグナルペプチドを有することが推定されたので、シグナルペプチドを除いた24番目のコドン (Lysをコード) から3’末端までをプライマーalyDmn(TGAAAGATTATTTTGTAGACACTAAACAAG)とalyDcXI(CATCACTCGAGGTTCACCTTATTTAAAACG)を用いてKOD-Plus (TOYOBO)によるPCRで増幅し、XhoI消化後、pGTk3の平滑化NdeI-XhoI部位に挿入し、pLADHを作製した。
【0038】
<海藻分解菌AR06株のアルギン酸リアーゼA遺伝子(alyA)のクローニング>
前述のアルギン酸リアーゼ遺伝子と同様にAR06 株ゲノム配列コンティグに対して、類縁菌であるPseudoalteromonas. elyakovii IAM14594株の持つ菌体外アルギン酸リアーゼ遺伝子alyPEEC(Carbohydrate Research 2001 Sep 21;335(1):11-21)を用いて検索を行い、コンティグ486のセンス鎖上に位置することを見出した。
【0039】
<海藻分解菌AR06株のアルギン酸リアーゼC遺伝子(alyC)のDNA配列>
alyC mRNAの開始コドンから終止コドンに対応する核酸配列を以下に示す。この配列は、配列番号:4の配列と同一である。
>
ATGATGAATTTAACCCAAAATAAGTCATTATTTAAAACGCTGGGTGTCACTGTAAGTGCCTTAGTTTTATCGATAAACGCCTACGCAGCGCATCCAAATTTGGTAATAACCAATGATGATGTACAGCAAATGCGCCAAGCAATTAGCAACAATGAACAGGGCAAGTTTGCCAACGCATTTGCAGCGCTTAAGGCACAAGTGGATGAGCAAATTAAAAGCCCTATAACAGTGCCTGTACCAAAAGACGGTGGGGGAGGGTATACCCACGAACGACACAAAAAAAATTATCAGCTTATGTATAACGCCGGTGTTATTTATCAGCTTAGCCAAGATGATAAATACGCTCATTACGTACGTGATATGTTGCTTGAGTATGCCAAATTATACCCAACACTTGATGTACACCCTAAGCGCAAAGTTAAGTCGCAAAACCCAGGTAAACTATTTTGGCAAAGCCTTAATGAGGCCATGTGGCTTGTTTATACCATTCAAGCATACGATTTAGTGCATGATGCGTTAAGCGCCGCTAATATTAAAACCATCGAAAATGACTTACTGCGCCCAGTATCGTTATTTTTATCACAAGGCCAGCCATCAACCTTTAACAAGGTACATAACCATGGTACGTGGGCTACAGCCGGTGTAGGCATGGCAGGGTATGTATTAGATGAATCTGAGTGGGTCGAAAAGTCTCTTTACGATTTAGATAAATCGGGCGAGGGTGGCTTTATTAAGCAGCTAGACATGCTGTTTTCGCCACAGGGCTATTACAACGAAGGTCCTTATTATCAACGCTTTGCACTACTTCCGTTTGTTACCTTTGCTAAAGCAATTGAAAACAACGAACCGCAGCGAGACATTTTTGAATATCGCGATGGCATATTACTTAAAGCCATTGATACCACTATTCAGCTAAGCTATAACGGTTTGTTTTTCCCGATAAACGATGCAATTAAAAGTAAAGGTATAGACACAATAGAGCTGGTACACGGTGTAACAGCCGCTTATGGTTTAACACACGATACTGGTTACTTAGATATAGCTAAAAAGCAAAATCAAATAATACTCTCTGGCGATGGCCTAAAAGTGGCTCAAGCGCTGGATAAAAATAAGCAAACTCCTTATGTATTTAAATCGGTTGCGTTTGGCGATGGTAACGATGGCGAGCAAGGGGCGTTGGTAGTAATGCGTACGCAAACTGGTGGCGACCAAGCACTTTTATTTAAACCTGCCGCACAGGGTTTAGGGCATGGACATTTTGATAAATTAACATGGCAGTTTTACGATCATGGCAATGAAATTGTATCTGATTATGGCGCTGCACGTTTTTTAAATGTTGAGGCTAAATACGGCGGCCGTTACCTACCAGAAAACGAAACTTACGCAAAACATACCGTGGCACACAATACGGTTGTGATTGATGAAACCTCGCATTTTAATGCAAATGTTAAACTGGGTAATAACAATCATCCTACGCTTAATTTCTTTGAAACAAACCAATACGGAACGGTGTCAAGTGGGCAAATAAGCACCGCTTACAAAGGTGTTGAGCTTGAACGCACGTTAGCGTTAATTAATTTACCTATGCTTGAAAGCACGCTTGCAGTTGATATTTTTAATGTGACTGCAGATACCTCCCATAAAATTGATTTACCACTGCATTACAAAGGCCAATTAATTGATACCAGCTTTGAGTTACTTGGTAACACCAAAAGCTTAGCTGCGCTGGGTGATAAAAATGGCTATCAACATTTATGGTTAAAAGCACAATCGCAACCAGATGAAGGCCTAGCAAAGGTAACGTGGTTAAACGACAACGGCCGTTTTTATACACAAACTAGCCTAGTAAAAGGGGATGAGTCTTTCTTATTTACGCAAATAGGGGCAAACGATCCACACTTTAATCTTCGTAACGAAAATGGCTACATTCGCCGTGTAGAAGGTAAAAAACAGCATAAATTTATTTCAGTACTTGAGCCTCACGGTGAATACAACCCAAGTAAAGAATATACCCTAGAGGCTGTTAGCCGTGTATCGTCACTTAAGTATGACGCGCAAGAGCACTTAGACCTAATTGAAGTTAAAGTAAAAAATAATACCTATTTGGTTGCTATCAACAAAGCCGATAAAGCAGCTAAACACACATTCACATATCAAAATAAAGCATTCACCTTAAATGGCCGCCTTGGCGTTTATGCGATGAAGAATAATCAGGAGTAA
【0040】
<海藻分解菌AR06株のアルギン酸リアーゼD遺伝子(alyD)のDNA配列>
alyD mRNAの開始コドンから終止コドンに対応する核酸配列を以下に示す。この配列は、配列番号:5の配列と同一である。
>
ATGCGTTTAATTAATATAATAAAGCTTAGCCTAGTTCTTATTGGGTGCACATCCACACAATTGGCAGCCAAAGATTATTTTGTAGACACTAAACAAGCTTTTCAAGAGATCTCTGACAAACTCGTTGCTGGCGATAAAGTAACTCTCAAAGACGGTACGTGGTCTAATTTCGAAATTTTATTACAAGGCCAAGGAACCAAAAACGCCCCTATAAAGCTTACAGCGCAAACCAAGGGTAATGTTATTTTATCAGGGCAATCTAATTTAAGACTGGCGGGTTCGTATTTAGAAGTGTCAGGGCTTGTATTTAAAAATGGTTATACGCCTAGCTCAGCCGTTATTGAATTTCGTAAAAATAAAGATGAGCTTGCTACTCACTCCCGCGTAACACAAGTCGTTATCGATAACTACAATAACCCCGATAAACGAGAATCAGACTATTGGGTGGCTCTATATGGTAAACACAATCGTTTTGATCACAGCCACTTAGTAGGTAAACGTAACAAAGGCGTTACGGTTGCAGTAAGGCTTAATAGTGAGCAAAGCCAACAAAACCACCATCAAATTGATCATAACTTCTTTGGCTATCGTCCTACTTTTGGATCTAACGGCGGTGAAACACTGCGCATTGGTACTAGCCACTATTCATTAAGTGATTCATTGACCTTAGTTGAAAACAACTACTTTGAACGTACTAACGGCGAAGTAGAAATAATCTCGGTTAAATCAGGGAAAAACCAAATCCGCAATAATGTGTTTTTTGAATCTCGCGGCACACTAACGCTGCGCCATGGTAATGGCAATATTATAGAAGAGAACGTTTTTTTTGGTAACGGTGTAGATCACACAGGTGGCATTCGCATCATTAATAAAAACCAAACAGTAAAAAATAACTACTTAGAAGGTTTAACAGGCTACCGTTTTGGCAGTGGTTTTACGGTTATGAACGGCGTACCTAACTCACCAATAAATCGCTACCATCAGGTAGAAAACGCGACAATTGAAAACAATACCTATGTAAATGTGCGTCATATACAACTTGGTGCAGGTAGCGATAGCGAGCGTAGCGCTGCACCAATTAATAGCGTAATGAAAAATAACCTTATTATTAATCAAAATGGCGAGCAGCCTTTTACAACCTTTGATGATGTAAGCGGTATTAAATTTAGTGAAAATGTAGCTAATACCCAGGTATTAAAAGAGTTAAATTACGGTGTTAAACAGCAAAATGTAACACTAACCAGAGCTAGTAACGGTTTACTGTATCCTGAATCAAGCAAAATTAGTGCAGGTGCTAAACGCGGTTTAAAGGTGCTAAAAAAGGCCGATACCGGCGTTAGTTGGTATCCAAAAACAGAGCAAGTTGTAGCATTTGATACGGGTAAAACTCACCAGGTTAAAGCAACTGCAGATGCCTTACTTAACGCAATCAATGCAGCCCAAACGGGTGATGTATTAGAGCTTGCAGATGGTCAATACGATGTATCTAAACTCGTTAAAATAACAAAAGTGCTTACCCTTAAGGCTAAACATACTGGCAAAGCTAAGCTGACCTACCAACGCTCCACCTTATTCGAAATTCATGATGGCGGTAGCTTAAAGCTAGATGGTTTAGTTATTTCGGGTGAAAACGCACCTGATGCCATTAATAATAGTGTGGTACGTACTAAAAAGTGGGGCATGGTTGATAACTACCGCTTTGAAATACACAACTCACAATTAACTAATCTTGATATTAATCACTCATTTCACTTTTTTGTAACGGGTAAAGGGGCGATGGCAGATGAAATCACGTTAGTAAATAACACCTTTAAAAATGTAACTGGCGATATTTTACGTCTCGATACCGAAATAGAAGACTTAGGTATTTATAACGCAGAGTATGTAACACTTAAAAACAATACCTTTAATGAGGTAGCCGGTGGCGTCGTTAAGTTATACCGAGGTGGAAGTGATGAAAGCACCTTTGGTCCGCATTTATTAATGACCAATAACACCCTAACTAAAGTAGGTTTAGGTAAGCGTAACAAGGCGCAAGCGAGTGTGTATGCGCACGGTGTACAAGTAACAAATATTGCAAGCAACGTATTTGAAAAATCGGCACCGATTAAAATTGAGCACACGGTTGGTGAGCCAATAACAGCCATTACAGATAACACCTTTGATGCAACTCAAGCGCCAAGCGTAAAAGAGTTACGTGTAGCGGGCCCGCACACGGCAACGATTAAAAATAACAACGTTTTAAATAAGGTGAACTAA
【0041】
<海藻分解菌AR06株のアルギン酸リアーゼA遺伝子(alyA)のDNA配列>
alyA mRNAの開始コドンから終止コドンに対応する核酸配列を以下に示す。この配列は、配列番号:6の配列と同一である。
>
ATGATTAACCATAAAAAACTGTTTTTTTACAGCGCAATTGCGACAAGTTCAGCGCTATCTCATGCTGCAACAATTAATAATGCAGGCTTTGAAAGTGGCTTTAGTAACTGGAACGAAACCGACCCAGCCGCTATTTCTTCAGATGCTTACAGTGGCTCAAAATCGTTAAAAATTCAGGGCAGTCCAGCACGGGTTTATCAAGTGGTAGATATACAGCCTAACACTGAATACACCCTAAGTGCTTATGTGCTGGGTAAAGGGCAAATTGGTGTAAACGATTTAAATGGTTTATTTAAAAACCAAACCTTTAATGTTTCTTCGTGGACTAAAGTAACAAAAACATTTACCTCAGCAAACACCAATTCACTTCAGGTTTTTGCTAAACATTACAACAACACCAGCGATGTAAGGTTTGATAATTTTGCCTTGGTTGAGGGCAGCGGCAGTAATGATGGTGGCTCAGATGGCGGCAGCGATAACTCAAATGGTTCAACAATTCCTAGCAGCATAACCAGTGGTAGCATTTTTGATTTAGAGGGGGATAACCCAAATCCTCTCGTTGACGATAGCACCTTAGTGTTTGTGCCGTTAGAGGCACAACATATTACGCCTAATGGTAATGGCTGGCGTCATGAGTATAAGGTTAAAGAAAGTTTACGCGTTGCTATGACTCAAACCTATGAAGTGTTCGAAGCTACGGTAAAAGTTGAGATGTCTGATGGCGGAAAAACAATTATATCGCAGCACCATGCTAGCGATACCGGCACTATATCTAAAGTGTATGTGTCGGATACTGATGAATCGGGCTTTAATGATAGCGTAGCGAACAACGGAATTTTTGATGTGTACGTACGTTTACGTAATACCAGCGGTAATGAAGAAAAATTTGCTTTGGGTACAATGACCAGCGGTGAGACATTTAACTTGCGGGTAGTTAATAACTACGGCGATGTAGAGGTTACGGCATTCGGTAACTCGTTCGGTATACCAGTAGAGGATGATTCGCAGTCATACTTTAAGTTTGGTAACTACCTGCAATCGCAAGACCCATACACATTAGATAAATGTGGTGAGGCCGGAAACTCTAACTCGTTTAAAAACTGTTTTGAGGATTTAGGCATTACAGAGTCAAAAGTGACGATGACCAATGTGAGTTATACGCGCGAAACTAATTAA
【0042】
<海藻分解菌AR06株のアルギン酸リアーゼCタンパク質のアミノ酸配列>
アルギン酸リアーゼCタンパク質の全長アミノ酸配列を以下に示す。この配列は、配列番号:1の配列と同一である。
>
MMNLTQNKSLFKTLGVTVSALVLSINAYAAHPNLVITNDDVQQMRQAISNNEQGKFANAFAALKAQVDEQIKSPITVPVPKDGGGGYTHERHKKNYQLMYNAGVIYQLSQDDKYAHYVRDMLLEYAKLYPTLDVHPKRKVKSQNPGKLFWQSLNEAMWLVYTIQAYDLVHDALSAANIKTIENDLLRPVSLFLSQGQPSTFNKVHNHGTWATAGVGMAGYVLDESEWVEKSLYDLDKSGEGGFIKQLDMLFSPQGYYNEGPYYQRFALLPFVTFAKAIENNEPQRDIFEYRDGILLKAIDTTIQLSYNGLFFPINDAIKSKGIDTIELVHGVTAAYGLTHDTGYLDIAKKQNQIILSGDGLKVAQALDKNKQTPYVFKSVAFGDGNDGEQGALVVMRTQTGGDQALLFKPAAQGLGHGHFDKLTWQFYDHGNEIVSDYGAARFLNVEAKYGGRYLPENETYAKHTVAHNTVVIDETSHFNANVKLGNNNHPTLNFFETNQYGTVSSGQISTAYKGVELERTLALINLPMLESTLAVDIFNVTADTSHKIDLPLHYKGQLIDTSFELLGNTKSLAALGDKNGYQHLWLKAQSQPDEGLAKVTWLNDNGRFYTQTSLVKGDESFLFTQIGANDPHFNLRNENGYIRRVEGKKQHKFISVLEPHGEYNPSKEYTLEAVSRVSSLKYDAQEHLDLIEVKVKNNTYLVAINKADKAAKHTFTYQNKAFTLNGRLGVYAMKNNQE
【0043】
<海藻分解菌AR06株のアルギン酸リアーゼDタンパク質のアミノ酸配列>
アルギン酸リアーゼDタンパク質の全長アミノ酸配列を以下に示す。この配列は、配列番号: 2の配列と同一である。
>
MRLINIIKLSLVLIGCTSTQLAAKDYFVDTKQAFQEISDKLVAGDKVTLKDGTWSNFEILLQGQGTKNAPIKLTAQTKGNVILSGQSNLRLAGSYLEVSGLVFKNGYTPSSAVIEFRKNKDELATHSRVTQVVIDNYNNPDKRESDYWVALYGKHNRFDHSHLVGKRNKGVTVAVRLNSEQSQQNHHQIDHNFFGYRPTFGSNGGETLRIGTSHYSLSDSLTLVENNYFERTNGEVEIISVKSGKNQIRNNVFFESRGTLTLRHGNGNIIEENVFFGNGVDHTGGIRIINKNQTVKNNYLEGLTGYRFGSGFTVMNGVPNSPINRYHQVENATIENNTYVNVRHIQLGAGSDSERSAAPINSVMKNNLIINQNGEQPFTTFDDVSGIKFSENVANTQVLKELNYGVKQQNVTLTRASNGLLYPESSKISAGAKRGLKVLKKADTGVSWYPKTEQVVAFDTGKTHQVKATADALLNAINAAQTGDVLELADGQYDVSKLVKITKVLTLKAKHTGKAKLTYQRSTLFEIHDGGSLKLDGLVISGENAPDAINNSVVRTKKWGMVDNYRFEIHNSQLTNLDINHSFHFFVTGKGAMADEITLVNNTFKNVTGDILRLDTEIEDLGIYNAEYVTLKNNTFNEVAGGVVKLYRGGSDESTFGPHLLMTNNTLTKVGLGKRNKAQASVYAHGVQVTNIASNVFEKSAPIKIEHTVGEPITAITDNTFDATQAPSVKELRVAGPHTATIKNNNVLNKVN
【0044】
<海藻分解菌AR06株のアルギン酸リアーゼAタンパク質のアミノ酸配列>
アルギン酸リアーゼAタンパク質の全長アミノ酸配列を以下に示す。この配列は、配列番号: 3の配列と同一である。
>
MINHKKLFFYSAIATSSALSHAATINNAGFESGFSNWNETDPAAISSDAYSGSKSLKIQGSPARVYQVVDIQPNTEYTLSAYVLGKGQIGVNDLNGLFKNQTFNVSSWTKVTKTFTSANTNSLQVFAKHYNNTSDVRFDNFALVEGSGSNDGGSDGGSDNSNGSTIPSSITSGSIFDLEGDNPNPLVDDSTLVFVPLEAQHITPNGNGWRHEYKVKESLRVAMTQTYEVFEATVKVEMSDGGKTIISQHHASDTGTISKVYVSDTDESGFNDSVANNGIFDVYVRLRNTSGNEEKFALGTMTSGETFNLRVVNNYGDVEVTAFGNSFGIPVEDDSQSYFKFGNYLQSQDPYTLDKCGEAGNSNSFKNCFEDLGITESKVTMTNVSYTRETN
【0045】
<組換え大腸菌発現系からのアルギン酸リアーゼCの精製>
IPTGによる誘導で組換えタンパク質の発現を誘導した、プラスミドpLACHを保持する大腸菌DH5α菌体を遠心分離により回収した。菌体をPBS(-)に懸濁後、ソニケーターにより破砕した。上清画分を遠心分離にて回収し、さらに、0.22μのフィルターにより濾過した。
【0046】
組換え発現アルギン酸リアーゼCはTALONspin Column(Clontech/ TaKaRa Bio)により精製した。回収されたアルギン酸リアーゼCは、10kDaのアミコンウルトラ(Amicon Ultra, Millipore社)-0.5 遠心式フィルターユニットにより濃縮とPBS(-)へのバッファー交換を行い精製アルギン酸リアーゼCを得た。
【0047】
<組換え大腸菌発現系からのアルギン酸リアーゼDの精製>
IPTGによる誘導で組換えタンパク質の発現を誘導した、プラスミドpLADHを保持する大腸菌DH5α菌体を遠心分離により回収した。菌体をPBS(-)に懸濁後、ソニケーターにより破砕した。上清画分を遠心分離にて回収し、さらに、0.22μのフィルターにより濾過した。
【0048】
組換え発現アルギン酸リアーゼDはTALONspin Column(Clontech)により精製した。回収されたアルギン酸リアーゼDは、10kDaのアミコンウルトラ(Amicon Ultra)-0.5 遠心式フィルターユニットにより濃縮とPBS(-)へのバッファー交換を行い精製アルギン酸リアーゼDを得た。
【0049】
<AR06培養液からのアルギン酸リアーゼAの精製>
MBにてODが定常期に達するまで培養したAR06株を、アルギン酸0.3%含有ASWに1/100vol加え、20℃,24時間培養した。上清画分を遠心分離にて回収し、終濃度80%の硫安を加え1時間4℃に静置した。遠心分離により沈殿を回収し、PBS(-)に懸濁後0.22μフィルターにより濾過した。Slide-A-Lyzer 10,000 MWCO Dialysis Cassette(Thermo Fisher Scientific K.K.)により透析し、PBS(-)へのバッファー交換を行い濃度を0.5 μg/μlに調製してアルギン酸リアーゼAの粗酵素液を得た。(Appl Microbiol Biotechnol. 2010 Mar;86(2):567-76)
【0050】
<酵素及びタンパク質アッセイ>
タンパク質の濃度はBCA Protein Assay - Reducing Agent Compatible(Thermo Fisher Scientific K.K.)により測定した。
【0051】
10-20%グラジエントプレキャストゲル長生 (マリソルSIC)を用いて精製アルギン酸リアーゼのSDS-ポリアクリルゲル電気泳動を行った。泳動後のゲルはクイック-CBBプラス(Wako Pure Chemical Industries, Ltd.)を用いて染色した。結果を図4に示す。Image J(http://rsb.info.nih.gov/ij/)による解析により、精製アルギン酸リアーゼCは96%、精製アルギン酸リアーゼDは42%の精製度であった。
【0052】
アルギン酸リアーゼAによるアルギン酸の分解:アルギン酸リアーゼAの粗酵素100μlと、等量の2%アルギン酸溶液を混合し、37℃で一晩分解した。
【0053】
アルギン酸リアーゼCによるアルギン酸の分解:精製アルギン酸リアーゼCを12μg含有する100μlのPBS(-)と、等量の2%アルギン酸溶液を混合し、37℃一晩分解した。
【0054】
アルギン酸リアーゼDによるアルギン酸の分解:精製アルギン酸リアーゼDを26.6μg含有する100μlのPBS(-)と、等量の2%アルギン酸溶液を混合し、37℃一晩分解した。
【0055】
アルギン酸リアーゼCとアルギン酸リアーゼDによるアルギン酸の分解:精製アルギン酸リアーゼCを12μgと精製アルギン酸リアーゼDを26.6μg含有する100μlのPBS(-)と、等量の2%アルギン酸溶液を混合し、37℃一晩分解した。
【0056】
アルギン酸リアーゼAとアルギン酸リアーゼCによるアルギン酸の分解:アルギン酸リアーゼAの粗酵素17μlと、精製アルギン酸リアーゼCを12μg含有する100μlのPBS(-)と、117μlの2%アルギン酸溶液を混合し、37℃一晩分解した。
【0057】
アルギン酸リアーゼAとアルギン酸リアーゼDによるアルギン酸の分解:アルギン酸リアーゼAの粗酵素17μlと、精製アルギン酸リアーゼDを26.6μg含有する100μlのPBS(-)と、117μlの2%アルギン酸溶液を混合し、37℃一晩分解した。
【0058】
アルギン酸リアーゼAとアルギン酸リアーゼCとアルギン酸リアーゼDによるアルギン酸の分解:アルギン酸リアーゼAの粗酵素17μlと、精製アルギン酸リアーゼCを12μgと精製アルギン酸リアーゼDを26.6μg含有する100μlのPBS(-)と、117μlの2%アルギン酸溶液を混合し、37℃一晩分解した。
【0059】
<薄層クロマトグラフィー>
アルギン酸分解産物を、薄層クロマトグラフィーによって確認した。シリカゲルHPTLCプレート(Merck) に各試料を1μlスポットし、乾燥させた。ブタノール:ギ酸:水=4:6:1 (v/v)の展開液を用いて展開後、0.2%ナフトレゾルシンエタノールと20%硫酸を等量混合した発色液をスプレーした。100℃, 10分間の加熱で検出した。
【0060】
[結果及び考察]
バイオインフォマティクスを利用した解析により、alyC、alyD、及びalyAのコードするタンパク質に関して以下のことが予測された。
【0061】
alyC:2,220 bp,739 アミノ酸をコードし、等電点pI 6.64、分子量82.7 kDaと演繹された。N末端に29 アミノ酸のシグナルペプチドを有し、細胞外膜に存在すると予想された。アミノ酸残基G388 からN468に、ヘパリナーゼ様ドメインHeparinase II/III-like protein (pfam07940) を有していた。Alteromonadales bacterium TW-7 株のputative chondroitin AC/alginate lyase (ATW7_06248) とPseudoalteromonas atlantica TAC125 株のputativealginate lyase (PSHAa1748) に、アミノ酸レベルででそれぞれ83%と84%の同一性を示した。
【0062】
alyD:2,259 bp,752 アミノ酸をコードし、等電点pI 9.11、分子量82.7 kDaと演繹された。N末端に23 アミノ酸のシグナルペプチドを有し、細胞外膜に存在すると予想された。保存性のあるドメインは見いだせなかった。Alteromonadales bacterium TW-7 株のputative alginate lyase precursor (ATW7_06243) とPseudoalteromonas atlantica TAC125 株のputativealginate lyase precursor (partial match) ( PSHAa1749 ) に、アミノ酸レベルでそれぞれ77%と77%の同一性を示した。
【0063】
alyA:1,176 bp,391 アミノ酸をコードし、等電点pI 4.57、分子量42.4 kDaと演繹された。N 末端に22 アミノ酸のシグナルペプチドを有し、細胞外に分泌されると予想された。シグナルペプチドに続き、carbohydrate-binding domain (CBM) [CBM_4_9(pfam02018)] がA23-E145 に、アルギン酸リアーゼドメイン[Alginate_lyase2 (pfam08787)] がD177-E376 に存在すると予想された。[Carbohydrate-Active enZymes (CAZy) database,http://www.cazy.org/]では、polysaccharide lyase (EC 4.2.2.-) を構造の特異性を反映したアミノ酸配列の相同性により、21 のfamily に分類している。AR06 株のalyA は、polysaccharidelyase family 18 の菌体外アルギン酸リアーゼであるPseudoalteromonas elyakovii IAM 14594のAlyPEECと76%のアミノ酸レベルの同一性 を示した。さらに、C末端側の233 アミノ酸は、Pseudoalteromonas sp. strain 272 のAALyase と同一であった。
【0064】
アルギン酸分解酵素A、C、又はDをアルギン酸に作用させた結果を図5に示す。アルギン酸は分子量が大きいので展開は見られなかった(レーン1)。アルギン酸にalyAタンパク質を作用させた場合には、2糖、3糖、及び4糖のアルギン酸分解物が確認された(レーン2)。これは、alyA酵素がエンド型アルギン酸リアーゼであることを示す。
【0065】
一方、アルギン酸にalyCタンパク質を作用させた場合には、オリゴ糖は確認されず、不飽和ウロン酸単糖の生成が確認された(レーン3)。この結果は、alyC酵素がエキソ型アルギン酸リアーゼであることを示す。また、アルギン酸にalyDタンパク質を作用させた場合には、オリゴ糖は確認されず、微量の不飽和ウロン酸単糖の生成が確認された(レーン4)。この結果は、alyD単独ではalyC単独よりもアルギン酸分解活性が低いことを示唆する。
【0066】
驚くべきことに、アルギン酸にalyC及びalyDの両者を作用させた場合には、それぞれ単独に作用させた場合に生成される量の和を遥かに凌ぐ、不飽和ウロン酸単糖の生成が観察された(レーン5)。この結果は、alyC及びalyDの組み合わせにより、それぞれ単独の結果からは予想できない顕著な効果が得られることを示している。alyC及びalyDが未知の機構により協働していると予想される。
【0067】
アルギン酸にalyA及びalyC(レーン6)、又は、alyA及びalyD(レーン7)を作用させた場合には、不飽和ウロン酸単糖、2糖、3糖、及び4糖の生成が観察された。保温時間を長くすることにより、オリゴ糖は全て不飽和ウロン酸単糖まで分解されると予想される。
【0068】
アルギン酸にalyA、alyC、及びalyDを作用させた場合には、オリゴ糖は確認されず、不飽和ウロン酸単糖の生成が確認された(レーン8)。
【0069】
以上の結果より、alyC酵素又はalyD酵素のいずれか一方又は両方、あるいは、alyC酵素又はalyD酵素のいずれか一方又は両方とalyA酵素の組み合わせにより、アルギン酸から不飽和ウロン酸単糖を生産できることが証明された。
【0070】
[実施例2]
[実験材料及び実験方法]
<アルギン酸ナトリウムからのMブロックとGブロック調製>
アルギン酸はマンヌロン酸とグルロン酸で構成されたヘテロポリマーであるが、マンヌロン酸(M)ブロックとグルロン酸(G)ブロックからなるアルギン酸をHaugらの酸加水分解による方法(Acta Chem Scand. 1966 20:183-190)を改変して以下のように調製した。
【0071】
操 作
1. 10 gのアルギン酸ナトリウムを蒸留水950 mlに加温溶解させた。
2. 50 mlの6N HClを加えよく混ぜ、100℃で20分間保温して加水分解した。
3. 遠心分離(10,000 rpm, 20 min)を行った。
4. 上清をNaOHで中和後、0.1MとなるようNaClを加えた。その後2倍量のエタノールを加え、沈殿を遠心分離 (10,000 rpm, 10 min) で回収後、70%エタノールと99%エタノールで洗浄、凍結乾燥させた。これにより、MGブロックからなるアルギン酸(MGブロックと呼ぶことがある)を得た。
5. 沈殿に1,000 mlの0.3 N HClを加え、100℃で20時間保温して加水分解した。分解終了後、遠心分離した沈殿を蒸留水に懸濁して、500 mlになるようにNaOHで中和・溶解させた。
6. 終濃度が0.1 MになるようにNaClを添加した。その後、HClを加え、pH 2.85にあわせた。沈殿が生じた。
7. 遠心分離(10,000 rpm, 20 min)を行った。
8. 上清は、NaOHにて中和後、2倍量のエタノールを加えた。沈殿を遠心分離(10,000 rpm, 10 min)で回収後、70%エタノールと99%エタノールで洗浄後、凍結乾燥させた。これにより、Mブロックからなるアルギン酸(Mブロックと呼ぶことがある)を得た。
9. 沈殿は、中和しながら溶解させ、終濃度が0.1 MになるようNaClを加えた。2倍量のエタノールを加え混合した。沈殿を遠心分離(10,000 rpm, 10 min)で回収後、70%エタノールと99%エタノールで洗浄後、凍結乾燥させた。これにより、Gブロックからなるアルギン酸(Gブロックと呼ぶことがある)を得た。
10. 各アルギン酸の組成は、日本電子製ECA-500を用いたH1-NMRにより確認した。
【0072】
<アルギン酸リアーゼCによるMブロック(M)、Gブロック(G)、MGブロック(MG)アルギン酸の分解>
精製アルギン酸リアーゼCを12μg含有する100μlのPBS(-)と、等量の2%M、G、MGアルギン酸溶液を混合し、37℃一晩分解した。
【0073】
アルギン酸リアーゼDによるM、G、MGアルギン酸の分解:精製アルギン酸リアーゼDを26.6μg含有する100μlのPBS(-)と、等量の2%M、G、MGアルギン酸溶液を混合し、37℃一晩分解した。
【0074】
アルギン酸リアーゼCとアルギン酸リアーゼDによるMGアルギン酸の分解:精製アルギン酸リアーゼCを12μgと精製アルギン酸リアーゼDを26.6μg含有する100μlのPBS(-)と、等量の2%MGアルギン酸溶液を混合し、37℃一晩分解した。
【0075】
[結果及び考察]
アルギン酸分解酵素C又はDをM、G、又はMGアルギン酸に作用させた結果を図6に示す。アルギン酸リアーゼCはMアルギン酸に対して高い分解活性を示したが(レーン2)、Gアルギン酸とMGアルギン酸に対してはそれ程高い分解活性を示さなかった(レーン3、4)。対照的にアルギン酸リアーゼDは、Mアルギン酸とMGアルギン酸にはほとんど分解活性を示さなかったが(レーン5、7)、Gアルギン酸に対して高い分解活性を示した(レーン6)。MGアルギン酸に対しては、アルギン酸リアーゼCとアルギン酸リアーゼDを合わせることにより高い分解活性を示した(レーン9)。
【産業上の利用可能性】
【0076】
本件発明により、アルギン酸から不飽和ウロン酸単糖を効率的に製造することができる。また、酵素により産生された不飽和単糖は自然にα-ケト酸に転換し、更に、デヒドロゲナーゼにより2-ケト-3-デオキシグルコネート(KDG)に転換される。KDGは中間体として様々な生物において利用可能である。
【技術分野】
【0001】
本件発明はアルギン酸リアーゼに関する。更に詳しくは、本発明は、アルギン酸から不飽和ウロン酸単糖を効率的に産生するアルギン酸リアーゼ、及び、アルギン酸から不飽和ウロン酸単糖を効率的に産生する方法に関する。
【背景技術】
【0002】
アルギン酸(alginic acid, alginate)は、D-マンヌロン酸(M)とL-グルロン酸(G)の2種のウロン酸のピラノース環型が主としてβ1->4結合した多糖である。MとGの組成比は起源となる生物(主に藻類)により異なるが、Mブロック、Gブロック、及びMとGの混合ブロックが存在する(図1参照)。
【0003】
アルギン酸は自然界に豊富に存在するため、アルギン酸をM又はGの最小単位まで分解することにより不飽和ウロン酸単糖を効率的に製造できると期待される。現在までに、幾つかのアルギン酸分解酵素(アルギン酸リアーゼ)が同定されているが、これらは2つ以上のM又はGからなるオリゴ糖を生成する「エンド型(endo-type)」アルギン酸リアーゼ(図2参照)と、ウロン酸単糖を生成する「エキソ型(exo-type)」アルギン酸リアーゼ(図3参照)に大別できる。
【0004】
エンド型アルギン酸リアーゼとしては、アルテロモナス属の微生物由来の酵素(特許文献1)が報告されており、エキソアルギン酸リアーゼとしては、スフィンゴモナス属A1株由来の酵素(非特許文献1)が報告されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2000-342278
【非特許文献】
【0006】
【非特許文献1】Molecular identification of oligoalginate lyase of Sphingomonas sp. strain A1 as one of the enzymes required for complete depolymerization of alginate. Hashimoto W, Miyake O, Momma K, Kawai S, Murata K. J Bacteriol. 2000 Aug;182(16):4572-7.
【発明の概要】
【発明が解決しようとする課題】
【0007】
本件発明が解決しようとする課題は、アルギン酸から効率的にウロン酸単糖を製造する方法を提供することである。本発明者らは、海藻分解菌AR06株(Pseudoalteromonas atlantica)から新規なエキソ型アルギン酸分解酵素を同定し、これを用いたウロン酸単糖の製造方法の発明を完成した。
【課題を解決するための手段】
【0008】
即ち、本件発明は以下の実施形態を含むが、これらに限定されない。
[実施形態1]
配列番号:1に示されるアミノ酸配列又は当該配列と少なくとも86%の同一性を有するアミノ酸配列からなる単離されたポリペプチド:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
[実施形態2]
以下の工程を含む、不飽和ウロン酸単糖の製造方法:
(a)少なくとも2つのウロン酸部分を含むアルギン酸を提供する工程、
(b)当該アルギン酸に実施形態1に記載されたポリペプチドを接触させる工程、及び
(c)上記工程のアルギン酸及びポリペプチドの混合物を水の存在下で保温する工程。
[実施形態3]
当該工程(c)の前に、当該アルギン酸に配列番号:2に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、実施形態2に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
[実施形態4]
当該工程(c)の前に、当該アルギン酸に配列番号:3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、実施形態2に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
[実施形態5]
当該工程(c)の前に、当該アルギン酸に配列番号:2に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程、及び、当該アルギン酸に配列番号:3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、実施形態2に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
[実施形態6]
配列番号:2に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチド:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
[実施形態7]
以下の工程を含む、不飽和ウロン酸単糖の製造方法:
(a)少なくとも2つのウロン酸部分を含むアルギン酸を提供する工程、
(b)当該アルギン酸に実施形態6に記載されたポリペプチドを接触させる工程、及び
(c)上記工程のアルギン酸及びポリペプチドの混合物を水の存在下で保温する工程。
[実施形態8]
当該工程(c)の前に、当該アルギン酸に配列番号:3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、実施形態7に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
【発明の効果】
【0009】
本件発明が提供するエキソ型アルギン酸分解酵素及びこれを用いた方法により、効率的なウロン酸単糖の製造が可能になる。
【図面の簡単な説明】
【0010】
【図1】アルギン酸の構造を示す模式図である。図中、nは自然数である。
【図2】エンド型アルギン酸リアーゼによるアルギン酸の切断の模式図である。
【図3】エキソ型アルギン酸リアーゼによるアルギン酸の分解の模式図である。
【図4】精製アルギン酸リアーゼをSDS-ポリアクリルゲル電気泳動で分離し、CBB染色した写真である。
【図5】アルギン酸分解酵素A、C、又はDをアルギン酸に作用させたサンプルを薄層クロマトグラフィーに展開した結果を示す。レーン1:アルギン酸のみのサンプル(ネガティブコントロール)。レーン2:アルギン酸にalyAタンパク質を作用させたサンプル。レーン3:アルギン酸にalyCタンパク質を作用させたサンプル。レーン4:アルギン酸にalyDタンパク質を作用させたサンプル。レーン5:アルギン酸にalyCタンパク質及びalyDタンパク質を作用させたサンプル。レーン6:アルギン酸にalyAタンパク質及びalyCタンパク質を作用させたサンプル。レーン7:アルギン酸にalyAタンパク質及びalyDタンパク質を作用させたサンプル。レーン8:アルギン酸にalyAタンパク質、alyCタンパク質、及びalyDタンパク質を作用させたサンプル。
【図6】アルギン酸分解酵素C又はDをMブロック(M)、Gブロック(G)、MGブロック(MG)アルギン酸に作用させたサンプルを薄層クロマトグラフィーに展開した結果を示す。レーン1: 2〜4糖のオリゴ糖サンプル。レーン2: Mアルギン酸にalyCタンパク質を作用させたサンプル。レーン3: Gアルギン酸にalyCタンパク質を作用させたサンプル。レーン4: MGアルギン酸にalyCタンパク質を作用させたサンプル。レーン5: Mアルギン酸にalyDタンパク質を作用させたサンプル。レーン6: Gアルギン酸にalyDタンパク質を作用させたサンプル。レーン7: MGアルギン酸にalyDタンパク質を作用させたサンプル。レーン8: 2〜4糖のオリゴ糖サンプル。レーン9: MGアルギン酸にalyCタンパク質及びalyDタンパク質を作用させたサンプル。
【発明を実施するための形態】
【0011】
本件発明のポリペプチドは、配列番号:1又は2に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなるポリペプチドであり、また、本件発明の製造方法に使用されるポリペプチドは、配列番号:1、2、又は3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなるポリペプチドである。いずれの発明においても、同一性のレベルは少なくとも85%、86%、87%、88%、89%、好ましくは、90%、91%、92%、93%、94%、より好ましくは、95%、96%、97%、98%、又は99%、あるいは100%同一である。
【0012】
配列番号:1、2、又は3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなるポリペプチドは、いずれもアルギン酸リアーゼ活性を有する。
【0013】
ここで、配列番号:1と少なくとも85%の同一性を有するアミノ酸配列からなるポリペプチドは、配列番号:1のポリペプチドのMブロックに対するアルギン酸リアーゼ活性と比較して、30%以上、好ましくは、50%以上又は70%以上のMブロックに対するアルギン酸リアーゼ活性を有する。配列番号:1と少なくとも85%の同一性を有するアミノ酸配列からなるポリペプチドは、配列番号:1のポリペプチドのGブロックに対するアルギン酸リアーゼ活性と比較して、30%以上、好ましくは、50%以上又は70%以上のGブロックに対するアルギン酸リアーゼ活性を有する。配列番号:1と少なくとも85%の同一性を有するアミノ酸配列からなるポリペプチドは、配列番号:1のポリペプチドのMGブロックに対するアルギン酸リアーゼ活性と比較して、30%以上、好ましくは、50%以上又は70%以上のMGブロックに対するアルギン酸リアーゼ活性を有する。
【0014】
また、配列番号:2と少なくとも85%の同一性を有するアミノ酸配列からなるポリペプチドは、配列番号:2のポリペプチドのGブロックに対するアルギン酸リアーゼ活性と比較して、30%以上、好ましくは、50%以上又は70%以上のGブロックに対するアルギン酸リアーゼ活性を有する。
【0015】
本件発明に関して「単離された」ポリペプチドというときは、自然界にかつて存在しなかったレベルまで精製され、目的の活性を十分に示すことを意味する。即ち、「単離された」ポリペプチドには、微量又はある程度の不純物が含まれうる。
【0016】
本願明細書において「アルギン酸」というときは、出発材料として用いたアルギン酸のアルギン酸リアーゼによる部分分解物、例えばオリゴ糖、も含まれる。ただし、不飽和ウロン酸単糖はアルギン酸に含まれない。
【0017】
本発明に関して「不飽和ウロン酸単糖」というときは、「アルギン酸もしくはアルギン酸オリゴ糖末端から、エキソ型アルギン酸リアーゼのβ-脱離反応により遊離した、非還元末端に二重結合を持つ不飽和単糖」を意味する。
【0018】
本発明に関して、アルギン酸の「ウロン酸部分」というときは、アルギン酸中のβ1->4結合したMもしくはGを意味する。
【0019】
本発明に関して、アルギン酸と単数又は複数のポリペプチドを「接触させる」というときは、これらを固体、水溶液、又は懸濁液のいずれかの形態で混合することを意味する。アルギン酸と単数又は複数のポリペプチドは、混合する前にそれぞれ異なる形態であって構わない。
【0020】
本発明に関して、「水の存在下で」保温するというときは、アルギン酸と単数又は複数のポリペプチドの両者を固体の形態で混合した場合には、水を加えることを意味する。アルギン酸及びポリペプチドの混合物が既に水を含んでいる場合には、水の量を適宜調節してもよい。
【0021】
本発明に関して、水の存在下で「保温する」というときは、本願発明に使用するポリペプチドがアルギン酸リアーゼ活性を発揮しうる範囲に温度を保つことを意味する。保温時間は、アルギン酸の分解が確認できる時間であればどのような時間でもよい。
【0022】
アルギン酸に複数のポリペプチドを接触させる場合には、複数のポリペプチドを同時に接触させてもよいし、順次接触させてもよい。アルギン酸に複数のポリペプチドを順次接触させる場合には、一のポリペプチドをアルギン酸に接触させる工程と、他のポリペプチドをアルギン酸に接触させる工程の間に、アルギン酸及びポリペプチドの混合物を水の存在下で保温する工程を追加してもよい。即ち、本願明細書において、「工程(c)の前に」というときは、「最終的な保温工程の前に」という意味であり、保温工程の回数を限定するものではない。
【0023】
本願明細書において「アルギン酸分解酵素」と「アルギン酸リアーゼ」は同義で用いる。また、alyCと記載した場合には、alyC遺伝子、alyC遺伝子から転写されるmRNA、又はalyC遺伝子がコードするタンパク質のいずれかを表す。これらをalyC遺伝子、alyC mRNA、又はalyCタンパク質などと記載することもある。文脈上明らかな場合には、遺伝子、mRNA、又はタンパク質の語を省略する場合もある。alyD及びalyAという記載についても同様である。
【実施例】
【0024】
[実施例1]
[実験材料及び実験方法]
<アルギン酸>
アルギン酸ナトリウム (500 cps; NACALAI TESQUE, INC.)を用いた。
【0025】
<微生物及び培養条件>
AR06株用の完全培地としてマリンブロス Difco (Marine broth, MB) を用いた。(最小培地としてはArtificial Sea Water (ASW) 培地を用い、炭素源としてアルギン酸ナトリウムを0.3%加えて使用した。)培養は20℃で行った。寒天培地を用いる場合には、寒天粉末を培地に対して最終濃度1.5% (w/v) 添加した。
【0026】
【表1】

【0027】
【表2】

【0028】
E. coli DH5αはプラスミドの構築とタンパク質の発現のための宿主として用いた。完全培地として、E. coli にはLB 培地 (LB broth, LB) を用いた。E. coliの選択培地には必要に応じて、アンピシリン (Ap) を最終濃度50μg/mlとなるように添加した。培養は37℃で行った。
【0029】
【表3】

【0030】
制限酵素およびその他の酵素類は、TAKARA BIO INC、TOYOBO CO., LTD.、New England Biolabs Inc. 各社のいずれかのものを購入し、添付説明書の指示に従って用いた。その他の組換えDNA 関連操作は、常法(Sambrook et al., Molecular cloning, Cold Spring Harbor Laboratory (1989)) に従った。E. coliからのプラスミドの回収はQIAprep Spin Miniprep Kit (QIAGEN) を用いて行った。
【0031】
それぞれの発現プラスミドをE. coli DH5αに形質転換し、IPTGによる誘導でタンパク質の発現を誘導した。LBにてODが定常期になるまで培養した各E. coli株を1/5に希釈し、0.1 mM IPTG誘導下、20 ℃にて一晩培養した。
【0032】
<海藻分解菌AR06株のアルギン酸リアーゼC遺伝子(alyC)のクローニング>
AR06株よりQIAGEN Genomic-tip 500/G (QIAGEN) にて抽出したゲノムDNAを用いて、Illumina Genome Analyzerにより全ゲノム解析を行い、合計1,188 MbのシングルリードAR06株ゲノム配列を取得した。第2世代シーケンサーで得られる短い断片配列に特化したde novo assembleプログラムVelvet (Zerbino et al, 2008) を用い、AR06株ゲノムのアセンブルを行い、41bp以上の長さを持つコンティグが1781個得られた。
【0033】
AR06 株ゲノム配列コンティグに対して、類縁菌であるAlteromonadales bacterium TW-7 株のputative alginate lyase (locus_tag; ATW7_03777), putative alginate lyase precursor (locus_tag; ATW7_06243), putative chondroitin AC/alginate lyase (locus_tag; ATW7_06248)とP. haloplanctis TAC125株のputative alginate lyase (locus_tag; PSHAa0571), alyll (locus_tag; PSHAa1748), putative alginate lyase precursor (partial match) (locus_tag; PSHAa1749)の6つのCDS用いて検索を行い、コンティグ134 の相補鎖上に位置することを見出した。
【0034】
ベクターの作成
C末端にヒスチジンタグを付加した組換えタンパク質発現用のベクターを作製した。プライマーGTIR-Fp(GTGCACTCTCAGTACAATCTGC) とGTIR-Rp (TATGCGGTGTGAAATACCGCACA) を用いて、KOD-Plus (TOYOBO)によるPCRでpGReenTIR(国立遺伝学研究所)を増幅し、T4 Polynucleotide Kinase(TaKaRa Bio)にてリン酸化後、ライゲーションハイ(TOYOBO)によるセルフライゲーションにより、ベクター上のNdeI部位を一ヶ所除いたプラスミドpGTkを作成した。pET26b(Novagen/ Merck KGaA, Darmstadt, Germany)からヒスチジンタグ断片を含むNdeI-平滑化Bpu1102Iを切り出し、pGTkのNdeI-平滑化ASP718に挿入し、pGTk3を作成した。
【0035】
alyCはN末端にシグナルペプチドを有することが推定されたので、シグナルペプチドを除いた30 番目のコドン (Ala をコード) から3’末端までをプライマーalyCmn (TGGCGCATCCAAATTTGGTAATAAC) とalyCcxI (ATCCCTCGAGCTCCTGATTATTCTTCATC) を用いてKOD-Plus (TOYOBO)によるPCRで増幅し、XhoI消化後、pGTk3の平滑化NdeI-XhoI部位に挿入し、pLACHを作製した。
【0036】
<海藻分解菌AR06株のアルギン酸リアーゼD遺伝子(alyD)のクローニング>
alyCと同様に、AR06 株ゲノム配列コンティグに対して、類縁菌であるAlteromonadales bacterium TW-7 株とP. haloplanctis TAC125株のアルギン酸リアーゼ遺伝子を用いて検索を行い、コンティグ134 の相補鎖上に位置することを見出した。
【0037】
alyDはN末端にシグナルペプチドを有することが推定されたので、シグナルペプチドを除いた24番目のコドン (Lysをコード) から3’末端までをプライマーalyDmn(TGAAAGATTATTTTGTAGACACTAAACAAG)とalyDcXI(CATCACTCGAGGTTCACCTTATTTAAAACG)を用いてKOD-Plus (TOYOBO)によるPCRで増幅し、XhoI消化後、pGTk3の平滑化NdeI-XhoI部位に挿入し、pLADHを作製した。
【0038】
<海藻分解菌AR06株のアルギン酸リアーゼA遺伝子(alyA)のクローニング>
前述のアルギン酸リアーゼ遺伝子と同様にAR06 株ゲノム配列コンティグに対して、類縁菌であるPseudoalteromonas. elyakovii IAM14594株の持つ菌体外アルギン酸リアーゼ遺伝子alyPEEC(Carbohydrate Research 2001 Sep 21;335(1):11-21)を用いて検索を行い、コンティグ486のセンス鎖上に位置することを見出した。
【0039】
<海藻分解菌AR06株のアルギン酸リアーゼC遺伝子(alyC)のDNA配列>
alyC mRNAの開始コドンから終止コドンに対応する核酸配列を以下に示す。この配列は、配列番号:4の配列と同一である。
>
ATGATGAATTTAACCCAAAATAAGTCATTATTTAAAACGCTGGGTGTCACTGTAAGTGCCTTAGTTTTATCGATAAACGCCTACGCAGCGCATCCAAATTTGGTAATAACCAATGATGATGTACAGCAAATGCGCCAAGCAATTAGCAACAATGAACAGGGCAAGTTTGCCAACGCATTTGCAGCGCTTAAGGCACAAGTGGATGAGCAAATTAAAAGCCCTATAACAGTGCCTGTACCAAAAGACGGTGGGGGAGGGTATACCCACGAACGACACAAAAAAAATTATCAGCTTATGTATAACGCCGGTGTTATTTATCAGCTTAGCCAAGATGATAAATACGCTCATTACGTACGTGATATGTTGCTTGAGTATGCCAAATTATACCCAACACTTGATGTACACCCTAAGCGCAAAGTTAAGTCGCAAAACCCAGGTAAACTATTTTGGCAAAGCCTTAATGAGGCCATGTGGCTTGTTTATACCATTCAAGCATACGATTTAGTGCATGATGCGTTAAGCGCCGCTAATATTAAAACCATCGAAAATGACTTACTGCGCCCAGTATCGTTATTTTTATCACAAGGCCAGCCATCAACCTTTAACAAGGTACATAACCATGGTACGTGGGCTACAGCCGGTGTAGGCATGGCAGGGTATGTATTAGATGAATCTGAGTGGGTCGAAAAGTCTCTTTACGATTTAGATAAATCGGGCGAGGGTGGCTTTATTAAGCAGCTAGACATGCTGTTTTCGCCACAGGGCTATTACAACGAAGGTCCTTATTATCAACGCTTTGCACTACTTCCGTTTGTTACCTTTGCTAAAGCAATTGAAAACAACGAACCGCAGCGAGACATTTTTGAATATCGCGATGGCATATTACTTAAAGCCATTGATACCACTATTCAGCTAAGCTATAACGGTTTGTTTTTCCCGATAAACGATGCAATTAAAAGTAAAGGTATAGACACAATAGAGCTGGTACACGGTGTAACAGCCGCTTATGGTTTAACACACGATACTGGTTACTTAGATATAGCTAAAAAGCAAAATCAAATAATACTCTCTGGCGATGGCCTAAAAGTGGCTCAAGCGCTGGATAAAAATAAGCAAACTCCTTATGTATTTAAATCGGTTGCGTTTGGCGATGGTAACGATGGCGAGCAAGGGGCGTTGGTAGTAATGCGTACGCAAACTGGTGGCGACCAAGCACTTTTATTTAAACCTGCCGCACAGGGTTTAGGGCATGGACATTTTGATAAATTAACATGGCAGTTTTACGATCATGGCAATGAAATTGTATCTGATTATGGCGCTGCACGTTTTTTAAATGTTGAGGCTAAATACGGCGGCCGTTACCTACCAGAAAACGAAACTTACGCAAAACATACCGTGGCACACAATACGGTTGTGATTGATGAAACCTCGCATTTTAATGCAAATGTTAAACTGGGTAATAACAATCATCCTACGCTTAATTTCTTTGAAACAAACCAATACGGAACGGTGTCAAGTGGGCAAATAAGCACCGCTTACAAAGGTGTTGAGCTTGAACGCACGTTAGCGTTAATTAATTTACCTATGCTTGAAAGCACGCTTGCAGTTGATATTTTTAATGTGACTGCAGATACCTCCCATAAAATTGATTTACCACTGCATTACAAAGGCCAATTAATTGATACCAGCTTTGAGTTACTTGGTAACACCAAAAGCTTAGCTGCGCTGGGTGATAAAAATGGCTATCAACATTTATGGTTAAAAGCACAATCGCAACCAGATGAAGGCCTAGCAAAGGTAACGTGGTTAAACGACAACGGCCGTTTTTATACACAAACTAGCCTAGTAAAAGGGGATGAGTCTTTCTTATTTACGCAAATAGGGGCAAACGATCCACACTTTAATCTTCGTAACGAAAATGGCTACATTCGCCGTGTAGAAGGTAAAAAACAGCATAAATTTATTTCAGTACTTGAGCCTCACGGTGAATACAACCCAAGTAAAGAATATACCCTAGAGGCTGTTAGCCGTGTATCGTCACTTAAGTATGACGCGCAAGAGCACTTAGACCTAATTGAAGTTAAAGTAAAAAATAATACCTATTTGGTTGCTATCAACAAAGCCGATAAAGCAGCTAAACACACATTCACATATCAAAATAAAGCATTCACCTTAAATGGCCGCCTTGGCGTTTATGCGATGAAGAATAATCAGGAGTAA
【0040】
<海藻分解菌AR06株のアルギン酸リアーゼD遺伝子(alyD)のDNA配列>
alyD mRNAの開始コドンから終止コドンに対応する核酸配列を以下に示す。この配列は、配列番号:5の配列と同一である。
>
ATGCGTTTAATTAATATAATAAAGCTTAGCCTAGTTCTTATTGGGTGCACATCCACACAATTGGCAGCCAAAGATTATTTTGTAGACACTAAACAAGCTTTTCAAGAGATCTCTGACAAACTCGTTGCTGGCGATAAAGTAACTCTCAAAGACGGTACGTGGTCTAATTTCGAAATTTTATTACAAGGCCAAGGAACCAAAAACGCCCCTATAAAGCTTACAGCGCAAACCAAGGGTAATGTTATTTTATCAGGGCAATCTAATTTAAGACTGGCGGGTTCGTATTTAGAAGTGTCAGGGCTTGTATTTAAAAATGGTTATACGCCTAGCTCAGCCGTTATTGAATTTCGTAAAAATAAAGATGAGCTTGCTACTCACTCCCGCGTAACACAAGTCGTTATCGATAACTACAATAACCCCGATAAACGAGAATCAGACTATTGGGTGGCTCTATATGGTAAACACAATCGTTTTGATCACAGCCACTTAGTAGGTAAACGTAACAAAGGCGTTACGGTTGCAGTAAGGCTTAATAGTGAGCAAAGCCAACAAAACCACCATCAAATTGATCATAACTTCTTTGGCTATCGTCCTACTTTTGGATCTAACGGCGGTGAAACACTGCGCATTGGTACTAGCCACTATTCATTAAGTGATTCATTGACCTTAGTTGAAAACAACTACTTTGAACGTACTAACGGCGAAGTAGAAATAATCTCGGTTAAATCAGGGAAAAACCAAATCCGCAATAATGTGTTTTTTGAATCTCGCGGCACACTAACGCTGCGCCATGGTAATGGCAATATTATAGAAGAGAACGTTTTTTTTGGTAACGGTGTAGATCACACAGGTGGCATTCGCATCATTAATAAAAACCAAACAGTAAAAAATAACTACTTAGAAGGTTTAACAGGCTACCGTTTTGGCAGTGGTTTTACGGTTATGAACGGCGTACCTAACTCACCAATAAATCGCTACCATCAGGTAGAAAACGCGACAATTGAAAACAATACCTATGTAAATGTGCGTCATATACAACTTGGTGCAGGTAGCGATAGCGAGCGTAGCGCTGCACCAATTAATAGCGTAATGAAAAATAACCTTATTATTAATCAAAATGGCGAGCAGCCTTTTACAACCTTTGATGATGTAAGCGGTATTAAATTTAGTGAAAATGTAGCTAATACCCAGGTATTAAAAGAGTTAAATTACGGTGTTAAACAGCAAAATGTAACACTAACCAGAGCTAGTAACGGTTTACTGTATCCTGAATCAAGCAAAATTAGTGCAGGTGCTAAACGCGGTTTAAAGGTGCTAAAAAAGGCCGATACCGGCGTTAGTTGGTATCCAAAAACAGAGCAAGTTGTAGCATTTGATACGGGTAAAACTCACCAGGTTAAAGCAACTGCAGATGCCTTACTTAACGCAATCAATGCAGCCCAAACGGGTGATGTATTAGAGCTTGCAGATGGTCAATACGATGTATCTAAACTCGTTAAAATAACAAAAGTGCTTACCCTTAAGGCTAAACATACTGGCAAAGCTAAGCTGACCTACCAACGCTCCACCTTATTCGAAATTCATGATGGCGGTAGCTTAAAGCTAGATGGTTTAGTTATTTCGGGTGAAAACGCACCTGATGCCATTAATAATAGTGTGGTACGTACTAAAAAGTGGGGCATGGTTGATAACTACCGCTTTGAAATACACAACTCACAATTAACTAATCTTGATATTAATCACTCATTTCACTTTTTTGTAACGGGTAAAGGGGCGATGGCAGATGAAATCACGTTAGTAAATAACACCTTTAAAAATGTAACTGGCGATATTTTACGTCTCGATACCGAAATAGAAGACTTAGGTATTTATAACGCAGAGTATGTAACACTTAAAAACAATACCTTTAATGAGGTAGCCGGTGGCGTCGTTAAGTTATACCGAGGTGGAAGTGATGAAAGCACCTTTGGTCCGCATTTATTAATGACCAATAACACCCTAACTAAAGTAGGTTTAGGTAAGCGTAACAAGGCGCAAGCGAGTGTGTATGCGCACGGTGTACAAGTAACAAATATTGCAAGCAACGTATTTGAAAAATCGGCACCGATTAAAATTGAGCACACGGTTGGTGAGCCAATAACAGCCATTACAGATAACACCTTTGATGCAACTCAAGCGCCAAGCGTAAAAGAGTTACGTGTAGCGGGCCCGCACACGGCAACGATTAAAAATAACAACGTTTTAAATAAGGTGAACTAA
【0041】
<海藻分解菌AR06株のアルギン酸リアーゼA遺伝子(alyA)のDNA配列>
alyA mRNAの開始コドンから終止コドンに対応する核酸配列を以下に示す。この配列は、配列番号:6の配列と同一である。
>
ATGATTAACCATAAAAAACTGTTTTTTTACAGCGCAATTGCGACAAGTTCAGCGCTATCTCATGCTGCAACAATTAATAATGCAGGCTTTGAAAGTGGCTTTAGTAACTGGAACGAAACCGACCCAGCCGCTATTTCTTCAGATGCTTACAGTGGCTCAAAATCGTTAAAAATTCAGGGCAGTCCAGCACGGGTTTATCAAGTGGTAGATATACAGCCTAACACTGAATACACCCTAAGTGCTTATGTGCTGGGTAAAGGGCAAATTGGTGTAAACGATTTAAATGGTTTATTTAAAAACCAAACCTTTAATGTTTCTTCGTGGACTAAAGTAACAAAAACATTTACCTCAGCAAACACCAATTCACTTCAGGTTTTTGCTAAACATTACAACAACACCAGCGATGTAAGGTTTGATAATTTTGCCTTGGTTGAGGGCAGCGGCAGTAATGATGGTGGCTCAGATGGCGGCAGCGATAACTCAAATGGTTCAACAATTCCTAGCAGCATAACCAGTGGTAGCATTTTTGATTTAGAGGGGGATAACCCAAATCCTCTCGTTGACGATAGCACCTTAGTGTTTGTGCCGTTAGAGGCACAACATATTACGCCTAATGGTAATGGCTGGCGTCATGAGTATAAGGTTAAAGAAAGTTTACGCGTTGCTATGACTCAAACCTATGAAGTGTTCGAAGCTACGGTAAAAGTTGAGATGTCTGATGGCGGAAAAACAATTATATCGCAGCACCATGCTAGCGATACCGGCACTATATCTAAAGTGTATGTGTCGGATACTGATGAATCGGGCTTTAATGATAGCGTAGCGAACAACGGAATTTTTGATGTGTACGTACGTTTACGTAATACCAGCGGTAATGAAGAAAAATTTGCTTTGGGTACAATGACCAGCGGTGAGACATTTAACTTGCGGGTAGTTAATAACTACGGCGATGTAGAGGTTACGGCATTCGGTAACTCGTTCGGTATACCAGTAGAGGATGATTCGCAGTCATACTTTAAGTTTGGTAACTACCTGCAATCGCAAGACCCATACACATTAGATAAATGTGGTGAGGCCGGAAACTCTAACTCGTTTAAAAACTGTTTTGAGGATTTAGGCATTACAGAGTCAAAAGTGACGATGACCAATGTGAGTTATACGCGCGAAACTAATTAA
【0042】
<海藻分解菌AR06株のアルギン酸リアーゼCタンパク質のアミノ酸配列>
アルギン酸リアーゼCタンパク質の全長アミノ酸配列を以下に示す。この配列は、配列番号:1の配列と同一である。
>
MMNLTQNKSLFKTLGVTVSALVLSINAYAAHPNLVITNDDVQQMRQAISNNEQGKFANAFAALKAQVDEQIKSPITVPVPKDGGGGYTHERHKKNYQLMYNAGVIYQLSQDDKYAHYVRDMLLEYAKLYPTLDVHPKRKVKSQNPGKLFWQSLNEAMWLVYTIQAYDLVHDALSAANIKTIENDLLRPVSLFLSQGQPSTFNKVHNHGTWATAGVGMAGYVLDESEWVEKSLYDLDKSGEGGFIKQLDMLFSPQGYYNEGPYYQRFALLPFVTFAKAIENNEPQRDIFEYRDGILLKAIDTTIQLSYNGLFFPINDAIKSKGIDTIELVHGVTAAYGLTHDTGYLDIAKKQNQIILSGDGLKVAQALDKNKQTPYVFKSVAFGDGNDGEQGALVVMRTQTGGDQALLFKPAAQGLGHGHFDKLTWQFYDHGNEIVSDYGAARFLNVEAKYGGRYLPENETYAKHTVAHNTVVIDETSHFNANVKLGNNNHPTLNFFETNQYGTVSSGQISTAYKGVELERTLALINLPMLESTLAVDIFNVTADTSHKIDLPLHYKGQLIDTSFELLGNTKSLAALGDKNGYQHLWLKAQSQPDEGLAKVTWLNDNGRFYTQTSLVKGDESFLFTQIGANDPHFNLRNENGYIRRVEGKKQHKFISVLEPHGEYNPSKEYTLEAVSRVSSLKYDAQEHLDLIEVKVKNNTYLVAINKADKAAKHTFTYQNKAFTLNGRLGVYAMKNNQE
【0043】
<海藻分解菌AR06株のアルギン酸リアーゼDタンパク質のアミノ酸配列>
アルギン酸リアーゼDタンパク質の全長アミノ酸配列を以下に示す。この配列は、配列番号: 2の配列と同一である。
>
MRLINIIKLSLVLIGCTSTQLAAKDYFVDTKQAFQEISDKLVAGDKVTLKDGTWSNFEILLQGQGTKNAPIKLTAQTKGNVILSGQSNLRLAGSYLEVSGLVFKNGYTPSSAVIEFRKNKDELATHSRVTQVVIDNYNNPDKRESDYWVALYGKHNRFDHSHLVGKRNKGVTVAVRLNSEQSQQNHHQIDHNFFGYRPTFGSNGGETLRIGTSHYSLSDSLTLVENNYFERTNGEVEIISVKSGKNQIRNNVFFESRGTLTLRHGNGNIIEENVFFGNGVDHTGGIRIINKNQTVKNNYLEGLTGYRFGSGFTVMNGVPNSPINRYHQVENATIENNTYVNVRHIQLGAGSDSERSAAPINSVMKNNLIINQNGEQPFTTFDDVSGIKFSENVANTQVLKELNYGVKQQNVTLTRASNGLLYPESSKISAGAKRGLKVLKKADTGVSWYPKTEQVVAFDTGKTHQVKATADALLNAINAAQTGDVLELADGQYDVSKLVKITKVLTLKAKHTGKAKLTYQRSTLFEIHDGGSLKLDGLVISGENAPDAINNSVVRTKKWGMVDNYRFEIHNSQLTNLDINHSFHFFVTGKGAMADEITLVNNTFKNVTGDILRLDTEIEDLGIYNAEYVTLKNNTFNEVAGGVVKLYRGGSDESTFGPHLLMTNNTLTKVGLGKRNKAQASVYAHGVQVTNIASNVFEKSAPIKIEHTVGEPITAITDNTFDATQAPSVKELRVAGPHTATIKNNNVLNKVN
【0044】
<海藻分解菌AR06株のアルギン酸リアーゼAタンパク質のアミノ酸配列>
アルギン酸リアーゼAタンパク質の全長アミノ酸配列を以下に示す。この配列は、配列番号: 3の配列と同一である。
>
MINHKKLFFYSAIATSSALSHAATINNAGFESGFSNWNETDPAAISSDAYSGSKSLKIQGSPARVYQVVDIQPNTEYTLSAYVLGKGQIGVNDLNGLFKNQTFNVSSWTKVTKTFTSANTNSLQVFAKHYNNTSDVRFDNFALVEGSGSNDGGSDGGSDNSNGSTIPSSITSGSIFDLEGDNPNPLVDDSTLVFVPLEAQHITPNGNGWRHEYKVKESLRVAMTQTYEVFEATVKVEMSDGGKTIISQHHASDTGTISKVYVSDTDESGFNDSVANNGIFDVYVRLRNTSGNEEKFALGTMTSGETFNLRVVNNYGDVEVTAFGNSFGIPVEDDSQSYFKFGNYLQSQDPYTLDKCGEAGNSNSFKNCFEDLGITESKVTMTNVSYTRETN
【0045】
<組換え大腸菌発現系からのアルギン酸リアーゼCの精製>
IPTGによる誘導で組換えタンパク質の発現を誘導した、プラスミドpLACHを保持する大腸菌DH5α菌体を遠心分離により回収した。菌体をPBS(-)に懸濁後、ソニケーターにより破砕した。上清画分を遠心分離にて回収し、さらに、0.22μのフィルターにより濾過した。
【0046】
組換え発現アルギン酸リアーゼCはTALONspin Column(Clontech/ TaKaRa Bio)により精製した。回収されたアルギン酸リアーゼCは、10kDaのアミコンウルトラ(Amicon Ultra, Millipore社)-0.5 遠心式フィルターユニットにより濃縮とPBS(-)へのバッファー交換を行い精製アルギン酸リアーゼCを得た。
【0047】
<組換え大腸菌発現系からのアルギン酸リアーゼDの精製>
IPTGによる誘導で組換えタンパク質の発現を誘導した、プラスミドpLADHを保持する大腸菌DH5α菌体を遠心分離により回収した。菌体をPBS(-)に懸濁後、ソニケーターにより破砕した。上清画分を遠心分離にて回収し、さらに、0.22μのフィルターにより濾過した。
【0048】
組換え発現アルギン酸リアーゼDはTALONspin Column(Clontech)により精製した。回収されたアルギン酸リアーゼDは、10kDaのアミコンウルトラ(Amicon Ultra)-0.5 遠心式フィルターユニットにより濃縮とPBS(-)へのバッファー交換を行い精製アルギン酸リアーゼDを得た。
【0049】
<AR06培養液からのアルギン酸リアーゼAの精製>
MBにてODが定常期に達するまで培養したAR06株を、アルギン酸0.3%含有ASWに1/100vol加え、20℃,24時間培養した。上清画分を遠心分離にて回収し、終濃度80%の硫安を加え1時間4℃に静置した。遠心分離により沈殿を回収し、PBS(-)に懸濁後0.22μフィルターにより濾過した。Slide-A-Lyzer 10,000 MWCO Dialysis Cassette(Thermo Fisher Scientific K.K.)により透析し、PBS(-)へのバッファー交換を行い濃度を0.5 μg/μlに調製してアルギン酸リアーゼAの粗酵素液を得た。(Appl Microbiol Biotechnol. 2010 Mar;86(2):567-76)
【0050】
<酵素及びタンパク質アッセイ>
タンパク質の濃度はBCA Protein Assay - Reducing Agent Compatible(Thermo Fisher Scientific K.K.)により測定した。
【0051】
10-20%グラジエントプレキャストゲル長生 (マリソルSIC)を用いて精製アルギン酸リアーゼのSDS-ポリアクリルゲル電気泳動を行った。泳動後のゲルはクイック-CBBプラス(Wako Pure Chemical Industries, Ltd.)を用いて染色した。結果を図4に示す。Image J(http://rsb.info.nih.gov/ij/)による解析により、精製アルギン酸リアーゼCは96%、精製アルギン酸リアーゼDは42%の精製度であった。
【0052】
アルギン酸リアーゼAによるアルギン酸の分解:アルギン酸リアーゼAの粗酵素100μlと、等量の2%アルギン酸溶液を混合し、37℃で一晩分解した。
【0053】
アルギン酸リアーゼCによるアルギン酸の分解:精製アルギン酸リアーゼCを12μg含有する100μlのPBS(-)と、等量の2%アルギン酸溶液を混合し、37℃一晩分解した。
【0054】
アルギン酸リアーゼDによるアルギン酸の分解:精製アルギン酸リアーゼDを26.6μg含有する100μlのPBS(-)と、等量の2%アルギン酸溶液を混合し、37℃一晩分解した。
【0055】
アルギン酸リアーゼCとアルギン酸リアーゼDによるアルギン酸の分解:精製アルギン酸リアーゼCを12μgと精製アルギン酸リアーゼDを26.6μg含有する100μlのPBS(-)と、等量の2%アルギン酸溶液を混合し、37℃一晩分解した。
【0056】
アルギン酸リアーゼAとアルギン酸リアーゼCによるアルギン酸の分解:アルギン酸リアーゼAの粗酵素17μlと、精製アルギン酸リアーゼCを12μg含有する100μlのPBS(-)と、117μlの2%アルギン酸溶液を混合し、37℃一晩分解した。
【0057】
アルギン酸リアーゼAとアルギン酸リアーゼDによるアルギン酸の分解:アルギン酸リアーゼAの粗酵素17μlと、精製アルギン酸リアーゼDを26.6μg含有する100μlのPBS(-)と、117μlの2%アルギン酸溶液を混合し、37℃一晩分解した。
【0058】
アルギン酸リアーゼAとアルギン酸リアーゼCとアルギン酸リアーゼDによるアルギン酸の分解:アルギン酸リアーゼAの粗酵素17μlと、精製アルギン酸リアーゼCを12μgと精製アルギン酸リアーゼDを26.6μg含有する100μlのPBS(-)と、117μlの2%アルギン酸溶液を混合し、37℃一晩分解した。
【0059】
<薄層クロマトグラフィー>
アルギン酸分解産物を、薄層クロマトグラフィーによって確認した。シリカゲルHPTLCプレート(Merck) に各試料を1μlスポットし、乾燥させた。ブタノール:ギ酸:水=4:6:1 (v/v)の展開液を用いて展開後、0.2%ナフトレゾルシンエタノールと20%硫酸を等量混合した発色液をスプレーした。100℃, 10分間の加熱で検出した。
【0060】
[結果及び考察]
バイオインフォマティクスを利用した解析により、alyC、alyD、及びalyAのコードするタンパク質に関して以下のことが予測された。
【0061】
alyC:2,220 bp,739 アミノ酸をコードし、等電点pI 6.64、分子量82.7 kDaと演繹された。N末端に29 アミノ酸のシグナルペプチドを有し、細胞外膜に存在すると予想された。アミノ酸残基G388 からN468に、ヘパリナーゼ様ドメインHeparinase II/III-like protein (pfam07940) を有していた。Alteromonadales bacterium TW-7 株のputative chondroitin AC/alginate lyase (ATW7_06248) とPseudoalteromonas atlantica TAC125 株のputativealginate lyase (PSHAa1748) に、アミノ酸レベルででそれぞれ83%と84%の同一性を示した。
【0062】
alyD:2,259 bp,752 アミノ酸をコードし、等電点pI 9.11、分子量82.7 kDaと演繹された。N末端に23 アミノ酸のシグナルペプチドを有し、細胞外膜に存在すると予想された。保存性のあるドメインは見いだせなかった。Alteromonadales bacterium TW-7 株のputative alginate lyase precursor (ATW7_06243) とPseudoalteromonas atlantica TAC125 株のputativealginate lyase precursor (partial match) ( PSHAa1749 ) に、アミノ酸レベルでそれぞれ77%と77%の同一性を示した。
【0063】
alyA:1,176 bp,391 アミノ酸をコードし、等電点pI 4.57、分子量42.4 kDaと演繹された。N 末端に22 アミノ酸のシグナルペプチドを有し、細胞外に分泌されると予想された。シグナルペプチドに続き、carbohydrate-binding domain (CBM) [CBM_4_9(pfam02018)] がA23-E145 に、アルギン酸リアーゼドメイン[Alginate_lyase2 (pfam08787)] がD177-E376 に存在すると予想された。[Carbohydrate-Active enZymes (CAZy) database,http://www.cazy.org/]では、polysaccharide lyase (EC 4.2.2.-) を構造の特異性を反映したアミノ酸配列の相同性により、21 のfamily に分類している。AR06 株のalyA は、polysaccharidelyase family 18 の菌体外アルギン酸リアーゼであるPseudoalteromonas elyakovii IAM 14594のAlyPEECと76%のアミノ酸レベルの同一性 を示した。さらに、C末端側の233 アミノ酸は、Pseudoalteromonas sp. strain 272 のAALyase と同一であった。
【0064】
アルギン酸分解酵素A、C、又はDをアルギン酸に作用させた結果を図5に示す。アルギン酸は分子量が大きいので展開は見られなかった(レーン1)。アルギン酸にalyAタンパク質を作用させた場合には、2糖、3糖、及び4糖のアルギン酸分解物が確認された(レーン2)。これは、alyA酵素がエンド型アルギン酸リアーゼであることを示す。
【0065】
一方、アルギン酸にalyCタンパク質を作用させた場合には、オリゴ糖は確認されず、不飽和ウロン酸単糖の生成が確認された(レーン3)。この結果は、alyC酵素がエキソ型アルギン酸リアーゼであることを示す。また、アルギン酸にalyDタンパク質を作用させた場合には、オリゴ糖は確認されず、微量の不飽和ウロン酸単糖の生成が確認された(レーン4)。この結果は、alyD単独ではalyC単独よりもアルギン酸分解活性が低いことを示唆する。
【0066】
驚くべきことに、アルギン酸にalyC及びalyDの両者を作用させた場合には、それぞれ単独に作用させた場合に生成される量の和を遥かに凌ぐ、不飽和ウロン酸単糖の生成が観察された(レーン5)。この結果は、alyC及びalyDの組み合わせにより、それぞれ単独の結果からは予想できない顕著な効果が得られることを示している。alyC及びalyDが未知の機構により協働していると予想される。
【0067】
アルギン酸にalyA及びalyC(レーン6)、又は、alyA及びalyD(レーン7)を作用させた場合には、不飽和ウロン酸単糖、2糖、3糖、及び4糖の生成が観察された。保温時間を長くすることにより、オリゴ糖は全て不飽和ウロン酸単糖まで分解されると予想される。
【0068】
アルギン酸にalyA、alyC、及びalyDを作用させた場合には、オリゴ糖は確認されず、不飽和ウロン酸単糖の生成が確認された(レーン8)。
【0069】
以上の結果より、alyC酵素又はalyD酵素のいずれか一方又は両方、あるいは、alyC酵素又はalyD酵素のいずれか一方又は両方とalyA酵素の組み合わせにより、アルギン酸から不飽和ウロン酸単糖を生産できることが証明された。
【0070】
[実施例2]
[実験材料及び実験方法]
<アルギン酸ナトリウムからのMブロックとGブロック調製>
アルギン酸はマンヌロン酸とグルロン酸で構成されたヘテロポリマーであるが、マンヌロン酸(M)ブロックとグルロン酸(G)ブロックからなるアルギン酸をHaugらの酸加水分解による方法(Acta Chem Scand. 1966 20:183-190)を改変して以下のように調製した。
【0071】
操 作
1. 10 gのアルギン酸ナトリウムを蒸留水950 mlに加温溶解させた。
2. 50 mlの6N HClを加えよく混ぜ、100℃で20分間保温して加水分解した。
3. 遠心分離(10,000 rpm, 20 min)を行った。
4. 上清をNaOHで中和後、0.1MとなるようNaClを加えた。その後2倍量のエタノールを加え、沈殿を遠心分離 (10,000 rpm, 10 min) で回収後、70%エタノールと99%エタノールで洗浄、凍結乾燥させた。これにより、MGブロックからなるアルギン酸(MGブロックと呼ぶことがある)を得た。
5. 沈殿に1,000 mlの0.3 N HClを加え、100℃で20時間保温して加水分解した。分解終了後、遠心分離した沈殿を蒸留水に懸濁して、500 mlになるようにNaOHで中和・溶解させた。
6. 終濃度が0.1 MになるようにNaClを添加した。その後、HClを加え、pH 2.85にあわせた。沈殿が生じた。
7. 遠心分離(10,000 rpm, 20 min)を行った。
8. 上清は、NaOHにて中和後、2倍量のエタノールを加えた。沈殿を遠心分離(10,000 rpm, 10 min)で回収後、70%エタノールと99%エタノールで洗浄後、凍結乾燥させた。これにより、Mブロックからなるアルギン酸(Mブロックと呼ぶことがある)を得た。
9. 沈殿は、中和しながら溶解させ、終濃度が0.1 MになるようNaClを加えた。2倍量のエタノールを加え混合した。沈殿を遠心分離(10,000 rpm, 10 min)で回収後、70%エタノールと99%エタノールで洗浄後、凍結乾燥させた。これにより、Gブロックからなるアルギン酸(Gブロックと呼ぶことがある)を得た。
10. 各アルギン酸の組成は、日本電子製ECA-500を用いたH1-NMRにより確認した。
【0072】
<アルギン酸リアーゼCによるMブロック(M)、Gブロック(G)、MGブロック(MG)アルギン酸の分解>
精製アルギン酸リアーゼCを12μg含有する100μlのPBS(-)と、等量の2%M、G、MGアルギン酸溶液を混合し、37℃一晩分解した。
【0073】
アルギン酸リアーゼDによるM、G、MGアルギン酸の分解:精製アルギン酸リアーゼDを26.6μg含有する100μlのPBS(-)と、等量の2%M、G、MGアルギン酸溶液を混合し、37℃一晩分解した。
【0074】
アルギン酸リアーゼCとアルギン酸リアーゼDによるMGアルギン酸の分解:精製アルギン酸リアーゼCを12μgと精製アルギン酸リアーゼDを26.6μg含有する100μlのPBS(-)と、等量の2%MGアルギン酸溶液を混合し、37℃一晩分解した。
【0075】
[結果及び考察]
アルギン酸分解酵素C又はDをM、G、又はMGアルギン酸に作用させた結果を図6に示す。アルギン酸リアーゼCはMアルギン酸に対して高い分解活性を示したが(レーン2)、Gアルギン酸とMGアルギン酸に対してはそれ程高い分解活性を示さなかった(レーン3、4)。対照的にアルギン酸リアーゼDは、Mアルギン酸とMGアルギン酸にはほとんど分解活性を示さなかったが(レーン5、7)、Gアルギン酸に対して高い分解活性を示した(レーン6)。MGアルギン酸に対しては、アルギン酸リアーゼCとアルギン酸リアーゼDを合わせることにより高い分解活性を示した(レーン9)。
【産業上の利用可能性】
【0076】
本件発明により、アルギン酸から不飽和ウロン酸単糖を効率的に製造することができる。また、酵素により産生された不飽和単糖は自然にα-ケト酸に転換し、更に、デヒドロゲナーゼにより2-ケト-3-デオキシグルコネート(KDG)に転換される。KDGは中間体として様々な生物において利用可能である。
【特許請求の範囲】
【請求項1】
配列番号:1に示されるアミノ酸配列又は当該配列と少なくとも86%の同一性を有するアミノ酸配列からなる単離されたポリペプチド:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
【請求項2】
以下の工程を含む、不飽和ウロン酸単糖の製造方法:
(a)少なくとも2つのウロン酸部分を含むアルギン酸を提供する工程、
(b)当該アルギン酸に請求項1に記載されたポリペプチドを接触させる工程、及び
(c)上記工程のアルギン酸及びポリペプチドの混合物を水の存在下で保温する工程。
【請求項3】
当該工程(c)の前に、当該アルギン酸に配列番号:2に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、請求項2に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
【請求項4】
当該工程(c)の前に、当該アルギン酸に配列番号:3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、請求項2に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
【請求項5】
当該工程(c)の前に、当該アルギン酸に配列番号:2に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程、及び、当該アルギン酸に配列番号:3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、請求項2に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドは共にアルギン酸リアーゼ活性を有する。
【請求項6】
配列番号:2に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチド:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
【請求項7】
以下の工程を含む、不飽和ウロン酸単糖の製造方法:
(a)少なくとも2つのウロン酸部分を含むアルギン酸を提供する工程、
(b)当該アルギン酸に請求項6に記載されたポリペプチドを接触させる工程、及び
(c)上記工程のアルギン酸及びポリペプチドの混合物を水の存在下で保温する工程。
【請求項8】
当該工程(c)の前に、当該アルギン酸に配列番号:3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、請求項7に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
【請求項1】
配列番号:1に示されるアミノ酸配列又は当該配列と少なくとも86%の同一性を有するアミノ酸配列からなる単離されたポリペプチド:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
【請求項2】
以下の工程を含む、不飽和ウロン酸単糖の製造方法:
(a)少なくとも2つのウロン酸部分を含むアルギン酸を提供する工程、
(b)当該アルギン酸に請求項1に記載されたポリペプチドを接触させる工程、及び
(c)上記工程のアルギン酸及びポリペプチドの混合物を水の存在下で保温する工程。
【請求項3】
当該工程(c)の前に、当該アルギン酸に配列番号:2に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、請求項2に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
【請求項4】
当該工程(c)の前に、当該アルギン酸に配列番号:3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、請求項2に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
【請求項5】
当該工程(c)の前に、当該アルギン酸に配列番号:2に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程、及び、当該アルギン酸に配列番号:3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、請求項2に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドは共にアルギン酸リアーゼ活性を有する。
【請求項6】
配列番号:2に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチド:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
【請求項7】
以下の工程を含む、不飽和ウロン酸単糖の製造方法:
(a)少なくとも2つのウロン酸部分を含むアルギン酸を提供する工程、
(b)当該アルギン酸に請求項6に記載されたポリペプチドを接触させる工程、及び
(c)上記工程のアルギン酸及びポリペプチドの混合物を水の存在下で保温する工程。
【請求項8】
当該工程(c)の前に、当該アルギン酸に配列番号:3に示されるアミノ酸配列又は当該配列と少なくとも85%の同一性を有するアミノ酸配列からなる単離されたポリペプチドを接触させる工程を更に含む、請求項7に記載の不飽和ウロン酸単糖の製造方法:
ここで、当該ポリペプチドはアルギン酸リアーゼ活性を有する。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2012−235773(P2012−235773A)
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願番号】特願2012−95272(P2012−95272)
【出願日】平成24年4月19日(2012.4.19)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成18年度、水産庁、水産業振興型技術開発委託事業のうち「水産バイオマスの資源化技術開発事業」、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(501168814)独立行政法人水産総合研究センター (103)
【Fターム(参考)】
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願日】平成24年4月19日(2012.4.19)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成18年度、水産庁、水産業振興型技術開発委託事業のうち「水産バイオマスの資源化技術開発事業」、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(501168814)独立行政法人水産総合研究センター (103)
【Fターム(参考)】
[ Back to top ]

