アルコールの製造方法
【課題】アルコール生産効率および簡便性に優れるイオン液体を用いてバイオマスからアルコールを生成する技術を提供する。
【解決手段】イオン液体と、セルロースを含む材料とを混合した状態で加熱してアルコールを生成する工程を含む、アルコール製造方法。
【解決手段】イオン液体と、セルロースを含む材料とを混合した状態で加熱してアルコールを生成する工程を含む、アルコール製造方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アルコールの製造方法に関する。
【背景技術】
【0002】
現在、世界のエネルギー消費は約9割が石油をはじめとする化石燃料に依存しており、エネルギー枯渇の窮地に立たされている。また、近年の原油価格の上昇に加え、炭酸ガスの増加や地球温暖化等の世界的な環境問題が注目されており、将来的に予想される化石燃料の枯渇および原油価格の高止まり等に先立ち、世界各国で化石燃料に代わる新たな再生可能エネルギーの開発が進められている。このような状況の下、バイオエタノールをはじめとするバイオ燃料の開発導入に係る動きがブラジル、米国、アジア各国を中心に各国で活発化するなど、バイオ燃料への期待が高まっている。しかしながら、これらの大半は、サトウキビやトウモロコシ等の食用や飼料作物を原料として生産されているため、現在、農家の転作等による余波が穀物市場の高騰を連鎖的に招いている。したがって、中長期的には、食用や飼料作物と競合しないバイオ燃料の実用化を目指して、廃木材や草本類等の未利用資源の活用が世界規模で重要となる。
【0003】
これに対して、木質系や草本系等のバイオマス資源から糖を生成し、その得られた糖から燃料として有用なエタノール等のアルコールを生成する技術が知られている。木質系および草本系のバイオマス資源の多くには、セルロースが存在している。セルロースは多くの植物体に存在する高分子で、D-グルコピラノースがβ-1,4-グルコシド結合した多糖類である(「化3」参照)。しかしながら、強固な結晶構造を有するため、一般の化学反応に用いられる汎用の有機溶媒には溶解しない。セルロース溶解系としては、リチウムクロライド(LiCl)/N,N-ジメチルアセトアミド(DMAc)、ジメチルスルホキシド(DMSO)/パラホルムアルデヒド、N-メチルモルフォリン-N-オキシド、58%Ca(SCN)2水溶液、NaOH水溶液等が知られている(例えば、非特許文献1参照)が、これらに加えて、近年イオン液体が新たなセルロースの溶剤として見出され、バイオマス研究への応用に関する研究もなされている(例えば、非特許文献2および3参照)。非特許文献4および5には、イオン液体としての1-ブチル-3-メチルイミダゾリウムクロライド([C4mim]Cl)等のハロゲン系オニウム塩がセルロースを溶解すること、および、セルロースの誘導化を起こさずに天然状態で溶解が可能となることから、溶解後にセルロースの化学修飾を前述のイオン液体中で行うことが報告されている。また、非特許文献6には、前述のハロゲン系オニウム塩にセルロースを溶解して酸触媒で加水分解し、反応生成物としてグルコースを得ることができることが開示されている。さらに、前述した文献の他に、イオン液体を用いたセルロース類の溶解方法が開示されている文献としては、特許文献1から3および非特許文献7などが挙げられる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特表2005−506401号公報
【特許文献2】特開2006−137677号公報
【特許文献3】特開2008−50595号公報
【非特許文献】
【0005】
【非特許文献1】磯貝明、セルロースの材料科学、東京大学出版会(2001)
【非特許文献2】宮藤久士、機能材料、第27巻第10号(2007)、pp.33-37
【非特許文献3】Ohno H., et al. (2009), Chemistry Letters, 38, 1, pp.2-7
【非特許文献4】Swatloski R.P., et al. (2002), J. Am. Chem. Soc., 124, pp.4974-4975
【非特許文献5】Wu. J., et al., (2007), Biomacromol., 5, 2, pp.266-268
【非特許文献6】Changzhi L.I., et al., (2007), Adv. Synth. Catal., 349, 11/12, pp.1847-1850
【非特許文献7】Kamiya N., et al. (2008), Biotechnol. Lett., 30, pp.1037-1040
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、従来の木質系等のバイオマスからのアルコールの製造においては、バイオマスの主要成分であるセルロースやヘミセルロースを加水分解して糖を生成(糖化)する工程と、生成した糖を酵母や細菌により糖を発酵させることによりアルコールを生成する工程、の2工程が必要であった(図3参照)。したがって、バイオマスからのアルコール製造工程全体では、製造装置等が複雑化し、煩雑な作業が必要となり、コストおよび作業時間が嵩むという問題があった。
【0007】
また、前述した糖化する工程においては、硫酸による加水分解が必要となるため、処理コスト面および環境面で問題視されていた。また、生成したグルコース等の糖の過分解を抑制するために反応制御が必要であった。
【0008】
さらに、硫酸を用いる以外の糖化方法として、バイオマスに対して、(1)粉砕、蒸煮(蒸煮爆砕、蒸煮、熱水分解・加圧熱水処理等)、エネルギー線(電子線、γ線、マイクロウエーブ)の照射等の物理的方法で処理する物理的前処理、(2)酸(硫酸、亜硫酸、リン酸)、アルカリ(カセイソーダ、アンモニアなど)などを用いて化学的処理する化学的前処理、(3)白色腐朽菌等のリグニン分解菌を用いて行う生物的前処理、または、(4)イオン液体などの溶媒を用いて溶解するソルボリシス(加溶媒分解)処理、による前処理を行い、リグニン等の難分解性成分を分解した後に、セルラーゼのような糖化酵素を加えてセルロースを加水分解して糖にする酵素糖化方法がある。バイオマス資源に含まれるセルロースは、強固な結晶構造を有し、水に不溶であるため、セルラーゼ等のセルロース分解酵素による糖化ではセルロース分解速度が極めて遅い。前述の(1)から(4)の方法は、酵素処理前に予め種々の前処理をして、セルロースを分解して糖化し易くさせる方法である。
【0009】
しかしながら、この方法では、糖化酵素を用いるため、コストの面で問題があった。
【0010】
さらに、前述の(1)の前処理方法では、蒸煮のための高温・高圧装置や、電子線、γ線、マイクロウエーブ等のエネルギー線の照射装置などの高価な装置が必要なため、設備費が高くなり、さらに、前処理工程の管理を厳密に行う必要があった。また、前述の(2)の前処理方法においては、バイオマスの糖化または前処理に当たり、酸やアルカリ等の化学薬品を用いるため、それらの薬品に耐え得る設備を使用する必要があることから、設備費が高くなるという問題があった。そして、糖化または前処理に用いた酸やアルカリの中和処理とそれによって発生する大量の中和廃棄物(例えば、硫酸カルシウムなど)の処理、あるいは、前処理に用いた溶媒の除去を行う必要があるため、手間やコストが掛かり、しかも、環境面での問題があった。さらに、前述の(3)の前処理方法では、リグニンの分解に通常2カ月から半年という極めて長い時間を要するため、バイオマスの分解および糖化を短期間で行うことができず、効率の良い糖化方法ではなかった。さらに、酵素糖化工程およびその次工程である酵母等による糖の発酵工程のために、白色腐朽菌を除去する必要が生じ、手間が掛かるという問題があった。
【0011】
一方、前述の(4)に基づく前処理方法では、他の前処理方法のような不都合は生じないが、最終生産物であるアルコールを得るためには、セルロースを溶解後の糖化酵素処理を経て、さらに細菌等による発酵工程が必要であることには変わりなかった。さらに、前述の特許文献および非特許文献においては、イオン液体を用いてバイオマス等の炭素源から直接的に(即ち、一段階で)アルコールを製造することについては何ら開示されていない。
【課題を解決するための手段】
【0012】
即ち、本発明によれば、イオン液体と、セルロースを含む材料とを混合した状態で加熱してアルコールを生成する工程を含むアルコール製造方法が提供される。この方法によれば、セルロースを含む材料からアルコールを効率よく製造することができる。また、本発明によれば、イオン液体と、セルロースを含む材料と、酸触媒とを混合した状態で加熱してアルコールを生成する工程を含むアルコール製造方法が提供される。この方法によっても、セルロースを含む材料からアルコールを効率よく製造することができる。
【発明の効果】
【0013】
本発明によれば、バイオマス等から簡便かつ効率的なアルコール生産を実現することができる。
【図面の簡単な説明】
【0014】
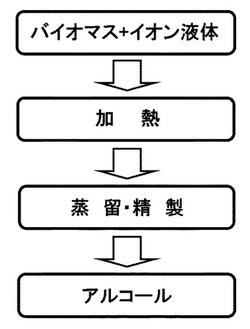
【図1】図1は、実施の形態に係るバイオマス資源からのアルコール製造プロセスを説明するための流れ図である。
【図2】図2は、実施の形態に係るアルコール製造方法に基づく未利用バイオマス資源の燃料用アルコールとしての再利用のサイクルを説明するための概念図である。
【図3】図3は、従来のバイオマス資源からのアルコール製造プロセスを説明するための流れ図である。
【発明を実施するための最良の形態】
【0015】
本発明者は、鋭意検討を重ねた結果、イオン液体のセルロース等に対する溶解性に注目し、イオン液体と、木材等のセルロース含有材料を加熱することにより、バイオマス等を糖化することにより糖を生成する工程、および、糖を発酵することによりアルコールを生成する工程を単一で行うことができ、かつ、高いアルコール生産性を有することを確認してバイオマスから直接的にアルコールが生産可能であることを見出し、本発明を完成するに至った。
【0016】
以下、本発明の実施の形態について具体的に説明する。
【0017】
図1に、実施の形態に係るバイオマス資源からのアルコール製造プロセスを示す。本実施形態は、イオン液体と、セルロースを含むバイオマス等の材料を加熱することでアルコールを製造する方法に関する。好ましくは、イオン液体とセルロースを含む材料との混合物を加熱して反応を行い、その後冷却してアルコールを分離精製する。ここで、「混合物」とは、セルロースを含む材料(以下、「セルロースを含む材料」とは、セルロースを含むバイオマス等の材料のみならず、単なるセルロースそのものについても含む概念であるものとする)が、イオン液体中で溶解した状態であるか否かを問わず混じり合った状態をいい、セルロースを含む材料が、イオン液体中に懸濁した状態で存在するものも含む。
【0018】
また、加熱は、イオン液体の溶解温度やイオン液体とセルロースを含む材料との反応性等を考慮して、適宜設定することができ、イオン液体とセルロースを含む材料との混合物を調製してから行う必要はなく、混合に先駆けてイオン液体のみを予め加熱した後に、これに、セルロースを含む材料を添加してからさらに加熱を行ってもよい。
【0019】
イオン液体とセルロースを含む材料との加熱反応は、例えば、充分に混合可能な機能を有する攪拌装置と、温度等を調節可能な装置とを備えた反応槽に、イオン液体、セルロース等を入れて反応することができる。反応槽内の温度を調整するための手段としては、反応槽内の温度検出器に連動させたヒーターのオン、オフによる他、過熱の場合に冷却制御する装置等を設けてもよい。
【0020】
加熱温度は、50℃から200℃が好ましく、より好ましくは、80℃から150℃であり、最も好ましくは、90℃から120℃である。かかる加熱温度は、イオン液体単独で加熱を行う際にも適用される。加熱温度が50℃以上であれば、イオン液体とセルロース等の反応が充分に行われ、アルコールの生産効率が高くなり、また、イオン液体単独で加熱を行う場合でも、50℃以上でのイオン液体の処理では、イオン液体が溶解しやすくなり、さらに、セルロース等との反応が充分に行われるため、アルコール生産量が向上するからである。一方、150℃以下の加熱温度においては、セルロース等の過分解が生じにくく、アルコール生産効率が向上するからである。
【0021】
また、加熱時間は、1時間から12時間が好ましく、より好ましくは、2時間から6時間であり、最も好ましくは、3時間から5時間である。かかる加熱時間は、イオン液体単独で加熱を行う際にも適用される。1時間以上の場合には、アルコール生産効率が向上し、また、イオン液体のみの加熱を行う際であっても、イオン液体が溶解しやすくなり、さらに、セルロース等との反応が充分に行われるため、アルコール生産量が向上するからである。一方、加熱時間が12時間以下であれば、セルロース等の過分解が生じにくく、アルコール生産効率が向上するからである。
【0022】
さらに、加熱処理は、イオン液体の溶解温度やイオン液体とセルロースおよび/またはセルロースを含む材料との反応性等に応じて、2段階以上としてもよい。例えば、70℃から90℃、1時間加熱した後、さらに、100℃から120℃、2時間の加熱を行うことができる。この段階的な加熱は、同一の混合物で行ってもよいし、例えば、イオン液体単独で第一の加熱を行った後に、これにセルロースおよび/またはセルロースを含む材料を添加して第二の加熱を行ってもよい。
【0023】
前述の加熱反応により生成したアルコールは、蒸留法、逆浸透膜法、浸透気化膜法、超臨界ガス抽出法や超音波霧化法等の公知の分離精製方法により回収することができる。蒸留法により分離精製する場合、例えば、反応槽に冷却器を連結し、冷却器内でアルコールを濃縮させることにより、アルコールを分離・回収することができる。
【0024】
実施の形態に係るアルコール製造方法により製造されるアルコールは、エタノールを含んでいてもよい。後述するように、イオン液体とセルロースを含む材料とを加熱することによりエタノールが生成することを、本発明者は見出している。
【0025】
実施の形態に係るアルコール製造方法によれば、糖化工程および発酵工程の2段階の工程を経ることなく、バイオマスを単一の工程により簡便かつ効率よくアルコールに変換することができる。また、環境負荷、コストや手間の削減につながることはいうまでもない。
【0026】
実施の形態に係るアルコール製造方法の出発物質であるイオン液体とセルロースを含む材料とについて、以下に説明する。
【0027】
[イオン液体]
実施の形態に係るアルコール製造方法に用いるイオン液体を構成するカチオンとしては、特に限定されないが、安定性に優れている、アンモニウムカチオンおよびヘテロ環オニウムカチオンが好ましい。
【0028】
アンモニウムカチオンとしては、例えば、安定性に優れている、トリメチルプロピルアンモニウムイオン、トリメチルヘキシリルアンモニウムイオン、テトラペンチルアンモニウムイオン、ジエチルトリメチル(2-メトキシエチル)アンモニウムイオン等の脂肪族4級アンモニウムイオン、N-ブチル-N-メチルピロリジニウムイオン等の脂環式4級アンモニウムイオン等が挙げられる。
【0029】
ヘテロ環オニウムカチオンとしては、例えば、安定性に優れている、イミダゾリウムカチオン、ピリジニウムカチオン等が挙げられる。イミダゾリウムカチオンの具体例としては、1-エチル-3-メチルイミダゾリウムイオン、1-ブチル-3-メチルイミダゾリウムイオン、1-プロピル-3-メチルイミダゾリウムイオン、1-ヘキシル-3-メチルイミダゾリウムイオン等のジアルキルイミダゾリウムカチオン、1-(1,2または3-ヒドロキシプロピル)-3-メチルイミダゾリウムイオン、1,2,3-トリメチルイミダゾリウムイオン、1,2-ジメチル-3-プロピルイミダゾリウムイオン、1-ブチル-2,3-ジメチルイミダゾリウムイオン、1-ヘキシル-2,3-ジメチルイミダゾリウムイオン等のトリアルキルイミダゾリウムカチオンが挙げられる。
【0030】
また、ピリジニウムカチオンとしては、例えば、安定性に優れている、N-プロピルピリジニウムイオン、N-ブチルピリジニウムイオン、1-ブチル-4-メチルピリジニウムイオン、1-ブチル-2,4-ジメチルピリジニウムイオン等が挙げられる。
【0031】
実施の形態に係るアルコール製造方法に用いるイオン液体を構成するカチオンとしては、これらのうちの一種でもよく、2種以上の併用とすることもできる。
【0032】
これらのカチオンのうち、セルロースを含む材料との反応性および取り扱い等の観点から鑑みて、イミダゾリウムカチオンおよびピリジニウムカチオンが好ましく、より好ましくは、イミダゾリウムカチオンである。
【0033】
実施の形態に係るアルコール製造方法に用いるイオン液体を構成するアニオンとしては、特に限定されないが、例えば、水素結合受容性に優れている、Cl-、Br-、SCN-、HSO4-、CH3SO3-、CH3CH(OH)COO-等のアニオンが挙げられる。
【0034】
これらのうち、セルロースまたはセルロースを含む材料との反応性および取り扱い等の観点から鑑みて、Cl-およびBr-が好ましい。
【0035】
実施の形態に係るアルコール製造方法においては、イオン液体のうち、セルロース溶解性の観点から好ましいのは、100℃以下で液体であるイオン液体である。さらに好ましくは、取り扱い等の観点から、室温(25℃付近)で液体であるイオン液体である。
【0036】
前述したようなイオン液体としては、例えば、安定性および水素結合受容性に優れている、1-エチル-3-メチルイミダゾリウムクロライド、1-エチル-3-メチルイミダゾリウムブロマイド、1-エチル-2,3-ジメチルイミダゾリウムクロライド、1-エチル-2,3-ジメチルイミダゾリウムブロマイド、1-ブチル-3-メチルイミダゾリウムクロライド、1-ブチル-3-メチルイミダゾリウムブロマイド、1-ブチル-2,3-ジメチルイミダゾリウムクロライド、1-ブチル-2,3-ジメチルイミダゾリウムブロマイド、1-ヘキシル-3-メチルイミダゾリウムクロライド、1-ヘキシル-3-メチルイミダゾリウムブロマイド、1-ヘキシル-2,3-ジメチルイミダゾリウムクロライド、1-ヘキシル-2,3-ジメチルイミダゾリウムブロマイド、1-オクチル-3-メチルイミダゾリウムクロライド、1-オクチル-3-メチルイミダゾリウムブロマイド、1-オクチル-2,3-ジメチルイミダゾリウムクロライド、1-オクチル-2,3-ジメチルイミダゾリウムブロマイド等が挙げられ、より好ましくは、セルロース溶解性に優れている、1-エチル-3-メチルイミダゾリウムクロライド、1-エチル-3-メチルイミダゾリウムブロマイド、1-ブチル-3-メチルイミダゾリウムクロライド、1-ブチル-3-メチルイミダゾリウムブロマイド、1-ヘキシル-3-メチルイミダゾリウムクロライド、1-ヘキシル-3-メチルイミダゾリウムブロマイドであり、最も好ましくは、1-ブチル-3-メチルイミダゾリウムクロライド[C4mim]Clおよび1-ヘキシル-3-メチルイミダゾリウムブロマイド[C6mim]Brである(「化1」および「化2」参照)。
【0037】
【化1】

【0038】
【化2】

【0039】
[セルロースおよびセルロースを含む材料]
実施の形態に係るアルコールの製造方法に用いるセルロースとしては、コットンリンター、木材パルプ、サルファイトパルプや溶解パルプ等から得られる植物系のセルロース、アセトバクター属(Acetobacter)等に属する微生物が生産するセルロース、再生セルロースおよび微結晶セルロース等が挙げられる。
【0040】
【化3】

【0041】
また、実施の形態に係るセルロースを含む材料(なお、「セルロースを含む材料」とは、セルロースを含むバイオマス等の材料のみならず、単なるセルロースそのものについても含む概念であるものとする)としては、特に限定されることはなく、木質系または草本系の材料(バイオマス等)を含んでいてもよい。木質系の材料としては、建築廃材等の廃木材、製材残材、間伐材、林地残材などを含む木材、おがくず、古紙・廃紙等の紙類およびパルプ等を挙げることができる。草本系の材料としては、小麦フスマ等のフスマ、稲藁・麦藁等の藁およびもみ殻などを含む農業残渣、バガス、刈り草および雑草類等を挙げることができる。後述するように、スギの木粉またはセルロースとイオン液体を加熱することで、直接的にエタノールを製造することができ、エタノール収率が高いことを本発明者は見出している。
【0042】
図2は、実施の形態に係るアルコール製造方法に基づく未利用バイオマス資源の燃料用アルコールとしての再利用のサイクルを説明するための概念図である。このように、実施の形態に係るアルコール製造方法は、未利用バイオマス資源を効率よくアルコールに変換することができるため、バイオマスと燃料用アルコールとの間で資源の循環システムを構築することができる。そのため、地球環境保全および産業の発展を両立しうるエネルギー供給システムを構築することができる。
【0043】
実施の形態に係るアルコール製造方法に用いるセルロースを含む材料は、イオン液体との反応性の観点から、イオン液体の重量に基づいて、0.5重量%から25重量%が好ましく、より好ましくは、1重量%から10重量%、最も好ましくは、2重量%から5重量%である。
【0044】
[その他の添加物質]
実施の形態に係るアルコール製造方法においては、イオン液体とセルロースを含む材料との反応前または反応時に、酸触媒を添加することができる。酸触媒を添加することにより、後述するように、イオン液体とセルロースを含む材料との反応性が向上し、アルコール収率が高くなる。
【0045】
酸触媒としては、例えば、プロトン供与性に優れる、硫酸、塩酸、リン酸等の液体酸触媒や、イオン交換樹脂等の固体酸触媒等が挙げられる。これらのうち、イオン液体とセルロース等の反応性の観点から、硫酸、リン酸および陽イオン交換樹脂が好ましく、より好ましくは、強酸性陽イオン交換樹脂である。
【0046】
実施の形態に係るアルコール製造方法に用いる酸触媒としては、これらのうちの一種でもよく、2種以上の併用とすることもできる。
【0047】
酸触媒を添加する場合の加熱処理は、イオン液体とセルロースを含む材料との反応性に応じて適宜設定することが可能である。例えば、イオン液体、セルロースを含む材料、および、酸触媒の混合物により、前述の加熱温度および加熱時間に基づいて行うことができる。また、イオン液体およびセルロースを含む材料の混合物を加熱した後、酸触媒を添加して加熱してもよい。さらに、イオン液体のみを予め加熱した後に、これに、セルロースを含む材料を添加してから加熱を行い、次いで、酸触媒を添加して加熱してもよい。さらにまた、酸触媒を添加しないイオン液体とセルロースを含む材料との加熱処理と同様に、加熱温度を段階的に変えて加熱することも可能である。例えば、イオン液体、若しくは、イオン液体およびセルロース等を70℃から90℃、1時間加熱した後に、酸触媒を添加してさらに100℃から120℃、2時間の加熱を行うことができる。
【0048】
以上、図面を参照して本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【実施例】
【0049】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0050】
[実験例1]
1-ヘキシル-3-メチルイミダゾリウムブロマイド([C6mim]Br)3gおよびスギ木粉100mgを試験管に採取し、90℃にて1時間加熱した。その後、120℃で2時間加熱し、放冷した。放冷後のサンプルにイオン交換水7mLを添加して反応生成物全体が均一となるように攪拌した後、0.45μmのメンブランフィルター(ミリポア社製 Millipore Millex LH 25mm)で濾過し、濾液をGC‐FID分析に供した。
分析の結果、反応生成物の組成は、エタノールが2.2mgであった。
【0051】
[実験例2]
[C6mim]Br3gおよびスギ木粉100mgを試験管に採取し、90℃にて1時間加熱した。その後、強酸性陽イオン交換樹脂(ダウ・ケミカル社製 ダウエックス(商標)50W×8)0.1gを添加して120℃で2時間加熱し、放冷した。放冷後は、実験例1と同様の処理を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが6.3mgであった。
【0052】
[実験例3]
実験例2において、[C6mim]Brとスギ木粉の加熱温度を80℃、および、強酸性陽イオン交換樹脂を添加して加熱した際の温度を100℃とした以外は、実験例2と同様の方法で実験を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが1.0mgであった。
【0053】
[実験例4]
実験例2において、強酸性陽イオン交換樹脂を硫酸(0.1mL)に代えた以外は、実験例2と同様の方法で実験を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが1.0mgであった。
【0054】
[実験例5]
実験例4において、[C6mim]Brとスギ木粉の加熱温度を80℃、および、硫酸を添加して加熱した際の温度を100℃とした以外は、実験例4と同様の方法で実験を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが1.5mgであった。
【0055】
[実験例6]
実験例2において、強酸性陽イオン交換樹脂をリン酸(0.1mL)に代えた以外は、実験例2と同様の方法で実験を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが3.4mgであった。
【0056】
[実験例7]
1-ブチル-3-メチルイミダゾリウムクロライド([C4mim]Cl)3gを試験管に採取して70℃にて15分間加熱し溶解した。次いで、前述の試験管にスギ木粉100mgを添加して70℃にて1時間加熱した。その後、強酸性陽イオン交換樹脂(実験例2と同様のもの)0.1g添加して120℃、2時間さらに加熱し、放冷した。放冷後は、実験例1と同様の処理を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが7.7mgであった。
【0057】
なお、表1に実験例1から7の結果を示す。なお、表中の[C6mim]Brは、1-ヘキシル-3-メチルイミダゾリウムブロマイド、[C4mim]Clは、1-ブチル-3-メチルイミダゾリウムクロライドをそれぞれ示す。
【0058】
【表1】

【0059】
[実験例8]
[C4mim]Cl3gを試験管に採取して70℃にて15分間加熱し溶解した。次いで、前述の試験管にセルロース(微結晶セルロース:メルク社製)100mgを添加して70℃にて1時間加熱した。その後、120℃、2時間さらに加熱し、放冷した。放冷後は、実験例1と同様の処理を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが3.7mgであった。
【0060】
[実施例9]
[C4mim]Cl3gを試験管に採取して70℃にて15分間加熱し溶解した。次いで、前述の試験管にセルロース100mgを添加して70℃にて1時間加熱した。その後、強酸性陽イオン交換樹脂(実験例2と同様のもの)0.1g添加して120℃、2時間さらに加熱し、放冷した。放冷後は、実験例1と同様の処理を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが4.2mgであった。
【0061】
[実験例10]
実験例3において、スギ木粉をセルロース(100mg)とした以外は、実験例3と同様の方法で実験を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが1.0mgであった。
【0062】
[実験例11]
実験例5において、スギ木粉をセルロース(100mg)とした以外は、実験例5と同様の方法で実験を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが1.0mgであった。
【0063】
なお、表2に実験例8から11の結果を示す。なお、表中の[C4mim]Clは、1-ブチル-3-メチルイミダゾリウムクロライド、[C6mim]Brは、1-ヘキシル-3-メチルイミダゾリウムブロマイドをそれぞれ示す。
【0064】
【表2】

【0065】
[GC‐FID分析]
イオン液体とセルロースまたはセルロースを含む材料の反応生成物をGC‐FID分析した。その分析条件は以下に示すとおりである。
【0066】
(GC‐FID分析条件)
分析カラム:DB-WAX
カラム温度:50℃(5分)-10℃/分-200℃
注入口温度:230℃
キャリアーガス;N2
カラムヘッド圧;2kg/cm3
試料注入量;1μL
【0067】
[結果と考察]
表1および表2に示すとおり、イオン液体とセルロースまたは木粉との加熱反応により、エタノールが得られることが明らかとなった。したがって、木質系のバイオマスから、イオン液体との加熱処理のみの単一の工程により、直接的にエタノールが生成することが示唆された。
【0068】
また、酸触媒としての強酸性陽イオン交換樹脂を添加して加熱した場合、エタノールの生産量は高くなる傾向となった(特に、実験例2、7および9参照)。イオン交換樹脂は、イオン液体とセルロースとの反応性を向上させることが示唆された。
【0069】
かかる結果より、実施の形態のアルコール製造方法によれば、バイオマスを加水分解して糖を生成(糖化)する工程を行うことなく、バイオマスから直接的に単一工程で効率的かつ簡便にエタノールを生産することができる。したがって、酸等による糖化処理を行わなくてもよいため、これに伴う環境面、設備面、作業面およびコスト面等での負荷が低減される。よって、実施の形態のアルコール製造方法は、産業上の優位性および有用性に富むものである。
【0070】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることはいわゆる当業者に理解されるところである。
【0071】
例えば、前述の実施例では、スギ木粉およびセルロースを反応材料として用いているが、他の木質系・草本系のバイオマスなどを用いることもできる。実施例の結果に基づき、スギ木粉およびセルロースから直接的にエタノールを生産することが可能であることが実証されたことを本発明者は確認していることから、その他の木質系・草本系のバイオマスなどであっても利用可能である。
【技術分野】
【0001】
本発明は、アルコールの製造方法に関する。
【背景技術】
【0002】
現在、世界のエネルギー消費は約9割が石油をはじめとする化石燃料に依存しており、エネルギー枯渇の窮地に立たされている。また、近年の原油価格の上昇に加え、炭酸ガスの増加や地球温暖化等の世界的な環境問題が注目されており、将来的に予想される化石燃料の枯渇および原油価格の高止まり等に先立ち、世界各国で化石燃料に代わる新たな再生可能エネルギーの開発が進められている。このような状況の下、バイオエタノールをはじめとするバイオ燃料の開発導入に係る動きがブラジル、米国、アジア各国を中心に各国で活発化するなど、バイオ燃料への期待が高まっている。しかしながら、これらの大半は、サトウキビやトウモロコシ等の食用や飼料作物を原料として生産されているため、現在、農家の転作等による余波が穀物市場の高騰を連鎖的に招いている。したがって、中長期的には、食用や飼料作物と競合しないバイオ燃料の実用化を目指して、廃木材や草本類等の未利用資源の活用が世界規模で重要となる。
【0003】
これに対して、木質系や草本系等のバイオマス資源から糖を生成し、その得られた糖から燃料として有用なエタノール等のアルコールを生成する技術が知られている。木質系および草本系のバイオマス資源の多くには、セルロースが存在している。セルロースは多くの植物体に存在する高分子で、D-グルコピラノースがβ-1,4-グルコシド結合した多糖類である(「化3」参照)。しかしながら、強固な結晶構造を有するため、一般の化学反応に用いられる汎用の有機溶媒には溶解しない。セルロース溶解系としては、リチウムクロライド(LiCl)/N,N-ジメチルアセトアミド(DMAc)、ジメチルスルホキシド(DMSO)/パラホルムアルデヒド、N-メチルモルフォリン-N-オキシド、58%Ca(SCN)2水溶液、NaOH水溶液等が知られている(例えば、非特許文献1参照)が、これらに加えて、近年イオン液体が新たなセルロースの溶剤として見出され、バイオマス研究への応用に関する研究もなされている(例えば、非特許文献2および3参照)。非特許文献4および5には、イオン液体としての1-ブチル-3-メチルイミダゾリウムクロライド([C4mim]Cl)等のハロゲン系オニウム塩がセルロースを溶解すること、および、セルロースの誘導化を起こさずに天然状態で溶解が可能となることから、溶解後にセルロースの化学修飾を前述のイオン液体中で行うことが報告されている。また、非特許文献6には、前述のハロゲン系オニウム塩にセルロースを溶解して酸触媒で加水分解し、反応生成物としてグルコースを得ることができることが開示されている。さらに、前述した文献の他に、イオン液体を用いたセルロース類の溶解方法が開示されている文献としては、特許文献1から3および非特許文献7などが挙げられる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特表2005−506401号公報
【特許文献2】特開2006−137677号公報
【特許文献3】特開2008−50595号公報
【非特許文献】
【0005】
【非特許文献1】磯貝明、セルロースの材料科学、東京大学出版会(2001)
【非特許文献2】宮藤久士、機能材料、第27巻第10号(2007)、pp.33-37
【非特許文献3】Ohno H., et al. (2009), Chemistry Letters, 38, 1, pp.2-7
【非特許文献4】Swatloski R.P., et al. (2002), J. Am. Chem. Soc., 124, pp.4974-4975
【非特許文献5】Wu. J., et al., (2007), Biomacromol., 5, 2, pp.266-268
【非特許文献6】Changzhi L.I., et al., (2007), Adv. Synth. Catal., 349, 11/12, pp.1847-1850
【非特許文献7】Kamiya N., et al. (2008), Biotechnol. Lett., 30, pp.1037-1040
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、従来の木質系等のバイオマスからのアルコールの製造においては、バイオマスの主要成分であるセルロースやヘミセルロースを加水分解して糖を生成(糖化)する工程と、生成した糖を酵母や細菌により糖を発酵させることによりアルコールを生成する工程、の2工程が必要であった(図3参照)。したがって、バイオマスからのアルコール製造工程全体では、製造装置等が複雑化し、煩雑な作業が必要となり、コストおよび作業時間が嵩むという問題があった。
【0007】
また、前述した糖化する工程においては、硫酸による加水分解が必要となるため、処理コスト面および環境面で問題視されていた。また、生成したグルコース等の糖の過分解を抑制するために反応制御が必要であった。
【0008】
さらに、硫酸を用いる以外の糖化方法として、バイオマスに対して、(1)粉砕、蒸煮(蒸煮爆砕、蒸煮、熱水分解・加圧熱水処理等)、エネルギー線(電子線、γ線、マイクロウエーブ)の照射等の物理的方法で処理する物理的前処理、(2)酸(硫酸、亜硫酸、リン酸)、アルカリ(カセイソーダ、アンモニアなど)などを用いて化学的処理する化学的前処理、(3)白色腐朽菌等のリグニン分解菌を用いて行う生物的前処理、または、(4)イオン液体などの溶媒を用いて溶解するソルボリシス(加溶媒分解)処理、による前処理を行い、リグニン等の難分解性成分を分解した後に、セルラーゼのような糖化酵素を加えてセルロースを加水分解して糖にする酵素糖化方法がある。バイオマス資源に含まれるセルロースは、強固な結晶構造を有し、水に不溶であるため、セルラーゼ等のセルロース分解酵素による糖化ではセルロース分解速度が極めて遅い。前述の(1)から(4)の方法は、酵素処理前に予め種々の前処理をして、セルロースを分解して糖化し易くさせる方法である。
【0009】
しかしながら、この方法では、糖化酵素を用いるため、コストの面で問題があった。
【0010】
さらに、前述の(1)の前処理方法では、蒸煮のための高温・高圧装置や、電子線、γ線、マイクロウエーブ等のエネルギー線の照射装置などの高価な装置が必要なため、設備費が高くなり、さらに、前処理工程の管理を厳密に行う必要があった。また、前述の(2)の前処理方法においては、バイオマスの糖化または前処理に当たり、酸やアルカリ等の化学薬品を用いるため、それらの薬品に耐え得る設備を使用する必要があることから、設備費が高くなるという問題があった。そして、糖化または前処理に用いた酸やアルカリの中和処理とそれによって発生する大量の中和廃棄物(例えば、硫酸カルシウムなど)の処理、あるいは、前処理に用いた溶媒の除去を行う必要があるため、手間やコストが掛かり、しかも、環境面での問題があった。さらに、前述の(3)の前処理方法では、リグニンの分解に通常2カ月から半年という極めて長い時間を要するため、バイオマスの分解および糖化を短期間で行うことができず、効率の良い糖化方法ではなかった。さらに、酵素糖化工程およびその次工程である酵母等による糖の発酵工程のために、白色腐朽菌を除去する必要が生じ、手間が掛かるという問題があった。
【0011】
一方、前述の(4)に基づく前処理方法では、他の前処理方法のような不都合は生じないが、最終生産物であるアルコールを得るためには、セルロースを溶解後の糖化酵素処理を経て、さらに細菌等による発酵工程が必要であることには変わりなかった。さらに、前述の特許文献および非特許文献においては、イオン液体を用いてバイオマス等の炭素源から直接的に(即ち、一段階で)アルコールを製造することについては何ら開示されていない。
【課題を解決するための手段】
【0012】
即ち、本発明によれば、イオン液体と、セルロースを含む材料とを混合した状態で加熱してアルコールを生成する工程を含むアルコール製造方法が提供される。この方法によれば、セルロースを含む材料からアルコールを効率よく製造することができる。また、本発明によれば、イオン液体と、セルロースを含む材料と、酸触媒とを混合した状態で加熱してアルコールを生成する工程を含むアルコール製造方法が提供される。この方法によっても、セルロースを含む材料からアルコールを効率よく製造することができる。
【発明の効果】
【0013】
本発明によれば、バイオマス等から簡便かつ効率的なアルコール生産を実現することができる。
【図面の簡単な説明】
【0014】
【図1】図1は、実施の形態に係るバイオマス資源からのアルコール製造プロセスを説明するための流れ図である。
【図2】図2は、実施の形態に係るアルコール製造方法に基づく未利用バイオマス資源の燃料用アルコールとしての再利用のサイクルを説明するための概念図である。
【図3】図3は、従来のバイオマス資源からのアルコール製造プロセスを説明するための流れ図である。
【発明を実施するための最良の形態】
【0015】
本発明者は、鋭意検討を重ねた結果、イオン液体のセルロース等に対する溶解性に注目し、イオン液体と、木材等のセルロース含有材料を加熱することにより、バイオマス等を糖化することにより糖を生成する工程、および、糖を発酵することによりアルコールを生成する工程を単一で行うことができ、かつ、高いアルコール生産性を有することを確認してバイオマスから直接的にアルコールが生産可能であることを見出し、本発明を完成するに至った。
【0016】
以下、本発明の実施の形態について具体的に説明する。
【0017】
図1に、実施の形態に係るバイオマス資源からのアルコール製造プロセスを示す。本実施形態は、イオン液体と、セルロースを含むバイオマス等の材料を加熱することでアルコールを製造する方法に関する。好ましくは、イオン液体とセルロースを含む材料との混合物を加熱して反応を行い、その後冷却してアルコールを分離精製する。ここで、「混合物」とは、セルロースを含む材料(以下、「セルロースを含む材料」とは、セルロースを含むバイオマス等の材料のみならず、単なるセルロースそのものについても含む概念であるものとする)が、イオン液体中で溶解した状態であるか否かを問わず混じり合った状態をいい、セルロースを含む材料が、イオン液体中に懸濁した状態で存在するものも含む。
【0018】
また、加熱は、イオン液体の溶解温度やイオン液体とセルロースを含む材料との反応性等を考慮して、適宜設定することができ、イオン液体とセルロースを含む材料との混合物を調製してから行う必要はなく、混合に先駆けてイオン液体のみを予め加熱した後に、これに、セルロースを含む材料を添加してからさらに加熱を行ってもよい。
【0019】
イオン液体とセルロースを含む材料との加熱反応は、例えば、充分に混合可能な機能を有する攪拌装置と、温度等を調節可能な装置とを備えた反応槽に、イオン液体、セルロース等を入れて反応することができる。反応槽内の温度を調整するための手段としては、反応槽内の温度検出器に連動させたヒーターのオン、オフによる他、過熱の場合に冷却制御する装置等を設けてもよい。
【0020】
加熱温度は、50℃から200℃が好ましく、より好ましくは、80℃から150℃であり、最も好ましくは、90℃から120℃である。かかる加熱温度は、イオン液体単独で加熱を行う際にも適用される。加熱温度が50℃以上であれば、イオン液体とセルロース等の反応が充分に行われ、アルコールの生産効率が高くなり、また、イオン液体単独で加熱を行う場合でも、50℃以上でのイオン液体の処理では、イオン液体が溶解しやすくなり、さらに、セルロース等との反応が充分に行われるため、アルコール生産量が向上するからである。一方、150℃以下の加熱温度においては、セルロース等の過分解が生じにくく、アルコール生産効率が向上するからである。
【0021】
また、加熱時間は、1時間から12時間が好ましく、より好ましくは、2時間から6時間であり、最も好ましくは、3時間から5時間である。かかる加熱時間は、イオン液体単独で加熱を行う際にも適用される。1時間以上の場合には、アルコール生産効率が向上し、また、イオン液体のみの加熱を行う際であっても、イオン液体が溶解しやすくなり、さらに、セルロース等との反応が充分に行われるため、アルコール生産量が向上するからである。一方、加熱時間が12時間以下であれば、セルロース等の過分解が生じにくく、アルコール生産効率が向上するからである。
【0022】
さらに、加熱処理は、イオン液体の溶解温度やイオン液体とセルロースおよび/またはセルロースを含む材料との反応性等に応じて、2段階以上としてもよい。例えば、70℃から90℃、1時間加熱した後、さらに、100℃から120℃、2時間の加熱を行うことができる。この段階的な加熱は、同一の混合物で行ってもよいし、例えば、イオン液体単独で第一の加熱を行った後に、これにセルロースおよび/またはセルロースを含む材料を添加して第二の加熱を行ってもよい。
【0023】
前述の加熱反応により生成したアルコールは、蒸留法、逆浸透膜法、浸透気化膜法、超臨界ガス抽出法や超音波霧化法等の公知の分離精製方法により回収することができる。蒸留法により分離精製する場合、例えば、反応槽に冷却器を連結し、冷却器内でアルコールを濃縮させることにより、アルコールを分離・回収することができる。
【0024】
実施の形態に係るアルコール製造方法により製造されるアルコールは、エタノールを含んでいてもよい。後述するように、イオン液体とセルロースを含む材料とを加熱することによりエタノールが生成することを、本発明者は見出している。
【0025】
実施の形態に係るアルコール製造方法によれば、糖化工程および発酵工程の2段階の工程を経ることなく、バイオマスを単一の工程により簡便かつ効率よくアルコールに変換することができる。また、環境負荷、コストや手間の削減につながることはいうまでもない。
【0026】
実施の形態に係るアルコール製造方法の出発物質であるイオン液体とセルロースを含む材料とについて、以下に説明する。
【0027】
[イオン液体]
実施の形態に係るアルコール製造方法に用いるイオン液体を構成するカチオンとしては、特に限定されないが、安定性に優れている、アンモニウムカチオンおよびヘテロ環オニウムカチオンが好ましい。
【0028】
アンモニウムカチオンとしては、例えば、安定性に優れている、トリメチルプロピルアンモニウムイオン、トリメチルヘキシリルアンモニウムイオン、テトラペンチルアンモニウムイオン、ジエチルトリメチル(2-メトキシエチル)アンモニウムイオン等の脂肪族4級アンモニウムイオン、N-ブチル-N-メチルピロリジニウムイオン等の脂環式4級アンモニウムイオン等が挙げられる。
【0029】
ヘテロ環オニウムカチオンとしては、例えば、安定性に優れている、イミダゾリウムカチオン、ピリジニウムカチオン等が挙げられる。イミダゾリウムカチオンの具体例としては、1-エチル-3-メチルイミダゾリウムイオン、1-ブチル-3-メチルイミダゾリウムイオン、1-プロピル-3-メチルイミダゾリウムイオン、1-ヘキシル-3-メチルイミダゾリウムイオン等のジアルキルイミダゾリウムカチオン、1-(1,2または3-ヒドロキシプロピル)-3-メチルイミダゾリウムイオン、1,2,3-トリメチルイミダゾリウムイオン、1,2-ジメチル-3-プロピルイミダゾリウムイオン、1-ブチル-2,3-ジメチルイミダゾリウムイオン、1-ヘキシル-2,3-ジメチルイミダゾリウムイオン等のトリアルキルイミダゾリウムカチオンが挙げられる。
【0030】
また、ピリジニウムカチオンとしては、例えば、安定性に優れている、N-プロピルピリジニウムイオン、N-ブチルピリジニウムイオン、1-ブチル-4-メチルピリジニウムイオン、1-ブチル-2,4-ジメチルピリジニウムイオン等が挙げられる。
【0031】
実施の形態に係るアルコール製造方法に用いるイオン液体を構成するカチオンとしては、これらのうちの一種でもよく、2種以上の併用とすることもできる。
【0032】
これらのカチオンのうち、セルロースを含む材料との反応性および取り扱い等の観点から鑑みて、イミダゾリウムカチオンおよびピリジニウムカチオンが好ましく、より好ましくは、イミダゾリウムカチオンである。
【0033】
実施の形態に係るアルコール製造方法に用いるイオン液体を構成するアニオンとしては、特に限定されないが、例えば、水素結合受容性に優れている、Cl-、Br-、SCN-、HSO4-、CH3SO3-、CH3CH(OH)COO-等のアニオンが挙げられる。
【0034】
これらのうち、セルロースまたはセルロースを含む材料との反応性および取り扱い等の観点から鑑みて、Cl-およびBr-が好ましい。
【0035】
実施の形態に係るアルコール製造方法においては、イオン液体のうち、セルロース溶解性の観点から好ましいのは、100℃以下で液体であるイオン液体である。さらに好ましくは、取り扱い等の観点から、室温(25℃付近)で液体であるイオン液体である。
【0036】
前述したようなイオン液体としては、例えば、安定性および水素結合受容性に優れている、1-エチル-3-メチルイミダゾリウムクロライド、1-エチル-3-メチルイミダゾリウムブロマイド、1-エチル-2,3-ジメチルイミダゾリウムクロライド、1-エチル-2,3-ジメチルイミダゾリウムブロマイド、1-ブチル-3-メチルイミダゾリウムクロライド、1-ブチル-3-メチルイミダゾリウムブロマイド、1-ブチル-2,3-ジメチルイミダゾリウムクロライド、1-ブチル-2,3-ジメチルイミダゾリウムブロマイド、1-ヘキシル-3-メチルイミダゾリウムクロライド、1-ヘキシル-3-メチルイミダゾリウムブロマイド、1-ヘキシル-2,3-ジメチルイミダゾリウムクロライド、1-ヘキシル-2,3-ジメチルイミダゾリウムブロマイド、1-オクチル-3-メチルイミダゾリウムクロライド、1-オクチル-3-メチルイミダゾリウムブロマイド、1-オクチル-2,3-ジメチルイミダゾリウムクロライド、1-オクチル-2,3-ジメチルイミダゾリウムブロマイド等が挙げられ、より好ましくは、セルロース溶解性に優れている、1-エチル-3-メチルイミダゾリウムクロライド、1-エチル-3-メチルイミダゾリウムブロマイド、1-ブチル-3-メチルイミダゾリウムクロライド、1-ブチル-3-メチルイミダゾリウムブロマイド、1-ヘキシル-3-メチルイミダゾリウムクロライド、1-ヘキシル-3-メチルイミダゾリウムブロマイドであり、最も好ましくは、1-ブチル-3-メチルイミダゾリウムクロライド[C4mim]Clおよび1-ヘキシル-3-メチルイミダゾリウムブロマイド[C6mim]Brである(「化1」および「化2」参照)。
【0037】
【化1】

【0038】
【化2】

【0039】
[セルロースおよびセルロースを含む材料]
実施の形態に係るアルコールの製造方法に用いるセルロースとしては、コットンリンター、木材パルプ、サルファイトパルプや溶解パルプ等から得られる植物系のセルロース、アセトバクター属(Acetobacter)等に属する微生物が生産するセルロース、再生セルロースおよび微結晶セルロース等が挙げられる。
【0040】
【化3】

【0041】
また、実施の形態に係るセルロースを含む材料(なお、「セルロースを含む材料」とは、セルロースを含むバイオマス等の材料のみならず、単なるセルロースそのものについても含む概念であるものとする)としては、特に限定されることはなく、木質系または草本系の材料(バイオマス等)を含んでいてもよい。木質系の材料としては、建築廃材等の廃木材、製材残材、間伐材、林地残材などを含む木材、おがくず、古紙・廃紙等の紙類およびパルプ等を挙げることができる。草本系の材料としては、小麦フスマ等のフスマ、稲藁・麦藁等の藁およびもみ殻などを含む農業残渣、バガス、刈り草および雑草類等を挙げることができる。後述するように、スギの木粉またはセルロースとイオン液体を加熱することで、直接的にエタノールを製造することができ、エタノール収率が高いことを本発明者は見出している。
【0042】
図2は、実施の形態に係るアルコール製造方法に基づく未利用バイオマス資源の燃料用アルコールとしての再利用のサイクルを説明するための概念図である。このように、実施の形態に係るアルコール製造方法は、未利用バイオマス資源を効率よくアルコールに変換することができるため、バイオマスと燃料用アルコールとの間で資源の循環システムを構築することができる。そのため、地球環境保全および産業の発展を両立しうるエネルギー供給システムを構築することができる。
【0043】
実施の形態に係るアルコール製造方法に用いるセルロースを含む材料は、イオン液体との反応性の観点から、イオン液体の重量に基づいて、0.5重量%から25重量%が好ましく、より好ましくは、1重量%から10重量%、最も好ましくは、2重量%から5重量%である。
【0044】
[その他の添加物質]
実施の形態に係るアルコール製造方法においては、イオン液体とセルロースを含む材料との反応前または反応時に、酸触媒を添加することができる。酸触媒を添加することにより、後述するように、イオン液体とセルロースを含む材料との反応性が向上し、アルコール収率が高くなる。
【0045】
酸触媒としては、例えば、プロトン供与性に優れる、硫酸、塩酸、リン酸等の液体酸触媒や、イオン交換樹脂等の固体酸触媒等が挙げられる。これらのうち、イオン液体とセルロース等の反応性の観点から、硫酸、リン酸および陽イオン交換樹脂が好ましく、より好ましくは、強酸性陽イオン交換樹脂である。
【0046】
実施の形態に係るアルコール製造方法に用いる酸触媒としては、これらのうちの一種でもよく、2種以上の併用とすることもできる。
【0047】
酸触媒を添加する場合の加熱処理は、イオン液体とセルロースを含む材料との反応性に応じて適宜設定することが可能である。例えば、イオン液体、セルロースを含む材料、および、酸触媒の混合物により、前述の加熱温度および加熱時間に基づいて行うことができる。また、イオン液体およびセルロースを含む材料の混合物を加熱した後、酸触媒を添加して加熱してもよい。さらに、イオン液体のみを予め加熱した後に、これに、セルロースを含む材料を添加してから加熱を行い、次いで、酸触媒を添加して加熱してもよい。さらにまた、酸触媒を添加しないイオン液体とセルロースを含む材料との加熱処理と同様に、加熱温度を段階的に変えて加熱することも可能である。例えば、イオン液体、若しくは、イオン液体およびセルロース等を70℃から90℃、1時間加熱した後に、酸触媒を添加してさらに100℃から120℃、2時間の加熱を行うことができる。
【0048】
以上、図面を参照して本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【実施例】
【0049】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0050】
[実験例1]
1-ヘキシル-3-メチルイミダゾリウムブロマイド([C6mim]Br)3gおよびスギ木粉100mgを試験管に採取し、90℃にて1時間加熱した。その後、120℃で2時間加熱し、放冷した。放冷後のサンプルにイオン交換水7mLを添加して反応生成物全体が均一となるように攪拌した後、0.45μmのメンブランフィルター(ミリポア社製 Millipore Millex LH 25mm)で濾過し、濾液をGC‐FID分析に供した。
分析の結果、反応生成物の組成は、エタノールが2.2mgであった。
【0051】
[実験例2]
[C6mim]Br3gおよびスギ木粉100mgを試験管に採取し、90℃にて1時間加熱した。その後、強酸性陽イオン交換樹脂(ダウ・ケミカル社製 ダウエックス(商標)50W×8)0.1gを添加して120℃で2時間加熱し、放冷した。放冷後は、実験例1と同様の処理を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが6.3mgであった。
【0052】
[実験例3]
実験例2において、[C6mim]Brとスギ木粉の加熱温度を80℃、および、強酸性陽イオン交換樹脂を添加して加熱した際の温度を100℃とした以外は、実験例2と同様の方法で実験を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが1.0mgであった。
【0053】
[実験例4]
実験例2において、強酸性陽イオン交換樹脂を硫酸(0.1mL)に代えた以外は、実験例2と同様の方法で実験を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが1.0mgであった。
【0054】
[実験例5]
実験例4において、[C6mim]Brとスギ木粉の加熱温度を80℃、および、硫酸を添加して加熱した際の温度を100℃とした以外は、実験例4と同様の方法で実験を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが1.5mgであった。
【0055】
[実験例6]
実験例2において、強酸性陽イオン交換樹脂をリン酸(0.1mL)に代えた以外は、実験例2と同様の方法で実験を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが3.4mgであった。
【0056】
[実験例7]
1-ブチル-3-メチルイミダゾリウムクロライド([C4mim]Cl)3gを試験管に採取して70℃にて15分間加熱し溶解した。次いで、前述の試験管にスギ木粉100mgを添加して70℃にて1時間加熱した。その後、強酸性陽イオン交換樹脂(実験例2と同様のもの)0.1g添加して120℃、2時間さらに加熱し、放冷した。放冷後は、実験例1と同様の処理を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが7.7mgであった。
【0057】
なお、表1に実験例1から7の結果を示す。なお、表中の[C6mim]Brは、1-ヘキシル-3-メチルイミダゾリウムブロマイド、[C4mim]Clは、1-ブチル-3-メチルイミダゾリウムクロライドをそれぞれ示す。
【0058】
【表1】

【0059】
[実験例8]
[C4mim]Cl3gを試験管に採取して70℃にて15分間加熱し溶解した。次いで、前述の試験管にセルロース(微結晶セルロース:メルク社製)100mgを添加して70℃にて1時間加熱した。その後、120℃、2時間さらに加熱し、放冷した。放冷後は、実験例1と同様の処理を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが3.7mgであった。
【0060】
[実施例9]
[C4mim]Cl3gを試験管に採取して70℃にて15分間加熱し溶解した。次いで、前述の試験管にセルロース100mgを添加して70℃にて1時間加熱した。その後、強酸性陽イオン交換樹脂(実験例2と同様のもの)0.1g添加して120℃、2時間さらに加熱し、放冷した。放冷後は、実験例1と同様の処理を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが4.2mgであった。
【0061】
[実験例10]
実験例3において、スギ木粉をセルロース(100mg)とした以外は、実験例3と同様の方法で実験を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが1.0mgであった。
【0062】
[実験例11]
実験例5において、スギ木粉をセルロース(100mg)とした以外は、実験例5と同様の方法で実験を行った。
GC‐FID分析の結果、反応生成物の組成は、エタノールが1.0mgであった。
【0063】
なお、表2に実験例8から11の結果を示す。なお、表中の[C4mim]Clは、1-ブチル-3-メチルイミダゾリウムクロライド、[C6mim]Brは、1-ヘキシル-3-メチルイミダゾリウムブロマイドをそれぞれ示す。
【0064】
【表2】

【0065】
[GC‐FID分析]
イオン液体とセルロースまたはセルロースを含む材料の反応生成物をGC‐FID分析した。その分析条件は以下に示すとおりである。
【0066】
(GC‐FID分析条件)
分析カラム:DB-WAX
カラム温度:50℃(5分)-10℃/分-200℃
注入口温度:230℃
キャリアーガス;N2
カラムヘッド圧;2kg/cm3
試料注入量;1μL
【0067】
[結果と考察]
表1および表2に示すとおり、イオン液体とセルロースまたは木粉との加熱反応により、エタノールが得られることが明らかとなった。したがって、木質系のバイオマスから、イオン液体との加熱処理のみの単一の工程により、直接的にエタノールが生成することが示唆された。
【0068】
また、酸触媒としての強酸性陽イオン交換樹脂を添加して加熱した場合、エタノールの生産量は高くなる傾向となった(特に、実験例2、7および9参照)。イオン交換樹脂は、イオン液体とセルロースとの反応性を向上させることが示唆された。
【0069】
かかる結果より、実施の形態のアルコール製造方法によれば、バイオマスを加水分解して糖を生成(糖化)する工程を行うことなく、バイオマスから直接的に単一工程で効率的かつ簡便にエタノールを生産することができる。したがって、酸等による糖化処理を行わなくてもよいため、これに伴う環境面、設備面、作業面およびコスト面等での負荷が低減される。よって、実施の形態のアルコール製造方法は、産業上の優位性および有用性に富むものである。
【0070】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることはいわゆる当業者に理解されるところである。
【0071】
例えば、前述の実施例では、スギ木粉およびセルロースを反応材料として用いているが、他の木質系・草本系のバイオマスなどを用いることもできる。実施例の結果に基づき、スギ木粉およびセルロースから直接的にエタノールを生産することが可能であることが実証されたことを本発明者は確認していることから、その他の木質系・草本系のバイオマスなどであっても利用可能である。
【特許請求の範囲】
【請求項1】
イオン液体と、セルロースを含む材料と、を混合した状態で加熱してアルコールを生成する工程を含む、アルコール製造方法。
【請求項2】
前記アルコールを生成する工程が、前記イオン液体を加熱した後に、前記セルロースを含む材料を前記イオン液体中に添加してさらに加熱する工程を含む、請求項1に記載のアルコール製造方法。
【請求項3】
セルロースを含む材料と、イオン液体と、酸触媒と、を混合した状態で加熱してアルコールを生成する工程を含む、アルコール製造方法。
【請求項4】
前記酸触媒が、硫酸、塩酸、リン酸およびイオン交換樹脂からなる群より選ばれる一種以上の酸触媒を含む、請求項3に記載のアルコール製造方法。
【請求項5】
前記アルコールを生成する工程が、前記イオン液体と前記セルロースを含む材料とを混合した状態で加熱した後に、前記酸触媒を前記イオン液体および前記セルロースを含む材料の混合物中に添加してさらに加熱する工程を含む、請求項3または4に記載のアルコール製造方法。
【請求項6】
前記アルコールを生成する工程が、前記イオン液体を加熱した後に、前記セルロースを含む材料を前記イオン液体中に添加して加熱する工程と、次いで、前記酸触媒を前記イオン液体および前記セルロースを含む材料の混合物中に添加してさらに加熱する工程と、を含む、請求項3から5の何れか一項に記載のアルコール製造方法。
【請求項7】
前記加熱を、50℃から200℃の温度で行う、請求項1から6の何れか一項に記載のアルコール製造方法。
【請求項8】
前記加熱を、1時間から12時間行う、請求項1から7の何れか一項に記載のアルコール製造方法。
【請求項9】
前記イオン液体を構成するカチオンが、アンモニウムカチオン、イミダゾリウムカチオンおよびピリジニウムカチオンから選ばれる一種以上のカチオンを含む、請求項1から8の何れか一項に記載のアルコール製造方法。
【請求項10】
前記イオン液体を構成するアニオンが、Cl-、Br-、SCN-、HSO4-、CH3SO3-およびCH3CH(OH)COO-からなる群より選ばれる一種以上のアニオンを含む、請求項1から8の何れか一項に記載のアルコール製造方法。
【請求項11】
前記イオン液体が、1-ヘキシル-3-メチルイミダゾリウムブロマイドまたは1-ブチル-3-メチルイミダゾリウムクロライドである、請求項1から8の何れか一項に記載のアルコール製造方法。
【請求項12】
前記セルロースを含む材料が、木材、おがくず、紙類、パルプ、フスマ、藁、もみ殻、農業残渣、バガス、刈り草および雑草類からなる群より選ばれる一種以上の材料を含む、請求項1から11の何れか一項に記載のアルコール製造方法。
【請求項13】
前記セルロースを含む材料が、前記イオン液体の重量に基づいて、0.5重量%から25重量%であることを特徴とする、請求項1から12の何れか一項に記載のアルコール製造方法。
【請求項14】
前記アルコールが、エタノールを含む、請求項1から13の何れか一項に記載のアルコール製造方法。
【請求項1】
イオン液体と、セルロースを含む材料と、を混合した状態で加熱してアルコールを生成する工程を含む、アルコール製造方法。
【請求項2】
前記アルコールを生成する工程が、前記イオン液体を加熱した後に、前記セルロースを含む材料を前記イオン液体中に添加してさらに加熱する工程を含む、請求項1に記載のアルコール製造方法。
【請求項3】
セルロースを含む材料と、イオン液体と、酸触媒と、を混合した状態で加熱してアルコールを生成する工程を含む、アルコール製造方法。
【請求項4】
前記酸触媒が、硫酸、塩酸、リン酸およびイオン交換樹脂からなる群より選ばれる一種以上の酸触媒を含む、請求項3に記載のアルコール製造方法。
【請求項5】
前記アルコールを生成する工程が、前記イオン液体と前記セルロースを含む材料とを混合した状態で加熱した後に、前記酸触媒を前記イオン液体および前記セルロースを含む材料の混合物中に添加してさらに加熱する工程を含む、請求項3または4に記載のアルコール製造方法。
【請求項6】
前記アルコールを生成する工程が、前記イオン液体を加熱した後に、前記セルロースを含む材料を前記イオン液体中に添加して加熱する工程と、次いで、前記酸触媒を前記イオン液体および前記セルロースを含む材料の混合物中に添加してさらに加熱する工程と、を含む、請求項3から5の何れか一項に記載のアルコール製造方法。
【請求項7】
前記加熱を、50℃から200℃の温度で行う、請求項1から6の何れか一項に記載のアルコール製造方法。
【請求項8】
前記加熱を、1時間から12時間行う、請求項1から7の何れか一項に記載のアルコール製造方法。
【請求項9】
前記イオン液体を構成するカチオンが、アンモニウムカチオン、イミダゾリウムカチオンおよびピリジニウムカチオンから選ばれる一種以上のカチオンを含む、請求項1から8の何れか一項に記載のアルコール製造方法。
【請求項10】
前記イオン液体を構成するアニオンが、Cl-、Br-、SCN-、HSO4-、CH3SO3-およびCH3CH(OH)COO-からなる群より選ばれる一種以上のアニオンを含む、請求項1から8の何れか一項に記載のアルコール製造方法。
【請求項11】
前記イオン液体が、1-ヘキシル-3-メチルイミダゾリウムブロマイドまたは1-ブチル-3-メチルイミダゾリウムクロライドである、請求項1から8の何れか一項に記載のアルコール製造方法。
【請求項12】
前記セルロースを含む材料が、木材、おがくず、紙類、パルプ、フスマ、藁、もみ殻、農業残渣、バガス、刈り草および雑草類からなる群より選ばれる一種以上の材料を含む、請求項1から11の何れか一項に記載のアルコール製造方法。
【請求項13】
前記セルロースを含む材料が、前記イオン液体の重量に基づいて、0.5重量%から25重量%であることを特徴とする、請求項1から12の何れか一項に記載のアルコール製造方法。
【請求項14】
前記アルコールが、エタノールを含む、請求項1から13の何れか一項に記載のアルコール製造方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2010−189324(P2010−189324A)
【公開日】平成22年9月2日(2010.9.2)
【国際特許分類】
【出願番号】特願2009−35888(P2009−35888)
【出願日】平成21年2月18日(2009.2.18)
【出願人】(000192903)神奈川県 (65)
【Fターム(参考)】
【公開日】平成22年9月2日(2010.9.2)
【国際特許分類】
【出願日】平成21年2月18日(2009.2.18)
【出願人】(000192903)神奈川県 (65)
【Fターム(参考)】
[ Back to top ]

