アルツハイマー病、プリオン病、及び他のアミロイド症と関連するアミロイド線維を分解し及び減少させるナットウキナーゼ
【課題】哺乳類被検体中のアルツハイマー病、プリオン病、及び/又は他のアミロイド症における前形成した又は前沈着したアミロイド線維を溶解し又は破壊し、並びに/又はアミロイド形成、沈着、蓄積、又は残留を阻害する方法が開示される。
【解決手段】該方法中では、治療的に有効量のナットウキナーゼが投与される。
【解決手段】該方法中では、治療的に有効量のナットウキナーゼが投与される。
【発明の詳細な説明】
【技術分野】
【0001】
本願は2008年11月22日付け出願の米国特許仮出願第61/117,096号に対して優先権を主張するものであり、該出願はこの参照によって本明細書に完全に組み込まれる。
【0002】
本発明は一般的にはアミロイド、プリオン、及び他のタンパク質凝集物の分解と排除に関する。より特異的には、アルツハイマー病、プリオン病、及び他のアミロイド症を治療する治療介入において、アミロイド線維形成を分解し及び減少させる方法に関する。
【背景技術】
【0003】
納豆、ゆでた大豆から作られる発酵食品は、アジアで千年以上にわたり食されてきた。納豆から単離される発酵微生物はグラム陽性内生胞子を形成する細菌バチルス・スブチリス(又はナットウ)(正式には、バチルスナットウと表記する)である。ナットウキナーゼは、バチルス・スブチリス(又はナットウ)から分泌される細胞外酵素であり、アルカリセリンプロテアーゼファミリーに属し、その触媒中心は、3つの保存された残基Asp−32、His−64、及びSer−221を含む。それは、分子量27.7kDaであり、等電点8.7である。ナットウキナーゼは275アミノ酸からなり、遺伝子配列はサブチリシンファミリーの他のメンバーのものと相同である(サブチリシンEと99.5%相同であり、サブチリシンBPN’と86%、サブチリシンカールスバーグと72%相同である)。それは、血栓中のフィブリンを分解するだけではなく、プラスミノーゲンアクチベーター阻害剤タイプIをも切断する。
【0004】
ナットウキナーゼは、プラスミン(血液中にある天然の血栓溶解プロテアーゼ)よりも血栓溶解活性が高く、プラスミノーゲンアクチベーターに対する作用のためプラスミノーゲンからプラスミンの生産を増加させる。これらの観察は、経口投与の後、腸管を通して吸収され繊維素溶解を誘導するという事実と共に、ナットウキナーゼを循環器疾患の治療のための潜在的な血栓溶解剤とする。納豆の食事補給は、動脈の内膜肥厚を抑制し、内皮傷害後に見られる壁在血栓の溶解を導く。他の臨床的血栓溶解剤、例えばウロキナーゼ及びストレプトキナーゼは、高価でかつ腸管で不安定である。血栓症のための繊維素溶解治療及びアテローム動脈硬化症の予防において、ナットウキナーゼの経口投与による使用は、従って興味深い。ナットウキナーゼは、身体の血行を改善する補助的栄養物として現在使用されている。多くの研究がナットウキナーゼについて行われているが、ナットウキナーゼが、アミロイドを(それはまた高度に不溶性でプロテアーゼに抵抗性である)分解できるかどうかについては興味を持たれていなかった。
【発明の概要】
【課題を解決するための手段】
【0005】
本発明はナットウキナーゼの応用に関する。一つの側面において、本発明はナットウキナーゼを使用することで多種多様のアミロイド線維を分解する方法に関する。ナットウキナーゼは身体中のアミロイドを消化するのに使用され得る。なぜならそれは、食用酵素で、補助的栄養物として使用されてきたからだ。他の側面では、本発明は、ナットウキナーゼを用いて感染性のプリオンを除去する方法に関する。プリオンは多様なプリオン病へと導く感染病原体である。プリオン病は食事、手術、及び輸血により伝染され得る。ナットウキナーゼは、動物飼料、手術器具、及び血液製剤などからプリオンを除去するのに使用され得る。
【0006】
一つの側面として、本発明は、哺乳類の被検体中でのアルツハイマー病、プリオン病、及び/又は他のアミロイド症において、前形成され、又は、前沈着したアミロイド線維を溶解し又は破壊する方法、並びに/又はアミロイド形成、沈着、蓄積、残留を阻害する方法に関する。該方法は、治療的に有効量のナットウキナーゼ及び該被検体中でアルツハイマー病、プリオン病、及び/又は他のアミロイド症を治療するのに効果があると選択された治療容量のナットウキナーゼを含む組成物を該被検体に投与する工程を含む方法である。
【0007】
本発明の一つの実施形態では、ナットウキナーゼは発酵された大豆食品から抽出される。
【0008】
本発明の別の実施形態では、該アミロイド線維は、Aβアミロイド線維、プリオン線維、インスリン線維、トランスサイレチン線維、及びβ―ミクログロブリン線維からなるグループより選択される。
【0009】
本発明の別の実施形態では、該アミロイド線維は、アルツハイマー病のAβアミロイド線維及びプリオンタンパク質(PrPSc)のミスフォールドした/感染性の形態からなるグループより選択される。
【0010】
さらに、本発明の別の実施形態では、該アミロイド線維は、トランスサイレチン、β2−ミクログロブリン、IAPP(アミリン)、及びベータアミロイドからなるグループより選択される。
【0011】
本発明の別の実施形態では、ナットウキナーゼの治療容量はアルツハイマー病を治療するのに有効量なものとして選択される。
【0012】
本発明の別の実施形態では、ナットウキナーゼの治療容量はプリオン病を治療するのに有効量なものとして選択される。
【0013】
本発明の別の実施形態では、ナットウキナーゼの治療容量は、家族性アミロイド多発ニューロパチー、透析関連アミロイド症、二型糖尿病、及び脳アミロイド血管症からなるグループより選択された他のアミロイド症を治療するのに有効量なものとして選択される。
【0014】
治療的に有効量のナットウキナーゼは、経口で、エアーゾルスプレーで、又は、非経口的に注射又は注入できる形態で投与され得る。
【0015】
別の面では、本発明は、インビトロのアミロイド環境において、前形成した又は前沈着したアミロイド線維を溶解し又は破壊し、並びに/又はアミロイド形成、沈着、蓄積、又は残留を阻害する方法に関する。該方法は、有効量のナットウキナーゼ及びアミロイドを治療するのに効果があると選択された有効量のナットウキナーゼを含む組成物をインビトロ環境に加えることを含む。
【0016】
本発明の一つの実施形態では、該アミロイドはアルツハイマー病及び/又はプリオン病に関連する。
【0017】
本発明の一つの実施形態では、該インビトロ環境は、医療機器、医薬製剤、及び動物飼料からなるグループより選択された物を含む。医療機器は手術器具及び血液透析チューブからなるグループより選択され得る。
【0018】
本発明の一つの実施形態では、該医薬製剤は血液製剤である。
【0019】
他の側面では、本発明はアミロイド線維の分解を触媒する方法に関する。該方法は、アミロイド線維とアミロイド線維を分解するのに有効量のナットウキナーゼを含む組成物とを接触させる工程を含む。
【0020】
本発明の一つの実施形態では、該方法は、該接触工程の前にその必要に応じて、該組成物を哺乳類被検体に投与する工程をさらに含む。
【0021】
本発明の別の実施形態では、該接触工程は、インビトロの環境下で、プリオンタンパク質が混入されやすい物に関して実行される。該物は、医療機器、医薬製剤、及び動物飼料からなるグループより選択され得る。該インビトロ環境はAβアミロイド線維、プリオン線維、インスリン線維、トランスサイレチン線維、β―ミクログロブリン線維、及びその任意の組み合わせからなるグループより選択されるアミロイド線維を含み得る。
【0022】
ここでのバリエーションや修飾は、この開示の新規な概念の精神と範囲から離れることなしに影響を受け得るが、これら及び他の側面は以下の図と共に取り入れられる好ましい実施形態の以下の記述から明らかになるであろう。
【0023】
付随した図は、本発明の一つ又は複数の実施形態を説明し、文書で記述したものと共に、本発明の原理を説明するのに役立つ。どこにおいても可能な限り、同じ参照番号が、同一又は類似の実施形態の要素を指すのに図全体を通して使用される。
【図面の簡単な説明】
【0024】
【図1】図1は、精製されたナットウキナーゼ(矢印により示される)を示すSDS−PAGEゲルの写真である。
【0025】
【図2】図2A−2Cは、ナットウキナーゼによる消化前後のタンパク質のCDスペクトルを示すグラフ表示である。線(i)は酵素添加直後のスペクトルを示す。線(ii)及び(iii)は、それぞれ1及び48時間消化した試料のスペクトルを示す。
【0026】
【図3】図3A−3CはThT結合アッセイを使ってナットウキナーゼによる消化前後のタンパク質の蛍光発光スペクトルを示すグラフ表示である。線(i)は酵素添加直後のスペクトルを示す。線(ii)及び(iii)は、それぞれ1及び48時間消化した試料のスペクトルを示す。
【0027】
【図4】図4A−4Bは、異なるpHにおけるナットウキナーゼによるインスリン線維の分解を示すグラフである。
【0028】
【図5】図5A−5Bは、異なる温度におけるナットウキナーゼによるインスリン線維の分解を示すグラフである。
【0029】
【図6】図6は、様々なプロテアーゼによるAβ40線維の分解を比較したグラフである。
【0030】
【図7】図7は、Aβ40線維分解のナットウキナーゼ濃度依存性を示すグラフである。
【0031】
【図8】図8Aは、ナットウキナーゼによるTTR線維分解を示すグラフである。
【0032】
図8Bは、ナットウキナーゼによるβ2−ミクログロブリン線維の分解を示すグラフである。
【0033】
【図9】図9は、ナットウキナーゼで消化した263K感染脳ホモジネートのウエスタンブロットを示す写真である。プリオンは1E4抗体で検出された。
【発明を実施するための最良の形態】
【0034】
本明細書中で使用される用語は、本技術中で、本発明の文脈の範囲内で、及び、それぞれの用語が使用される特異的文脈において一般的にその通常の意味を持つ。本発明を記述するのに使用されたある種の用語は、以下に、又は本明細書中のどこかで議論されて、本発明の記述に関して、実務家にさらなるガイダンスを供与する。便宜上、ある種の用語は、強調され、例えば、イタリックス及び/又はクォーテーションマークを使用される。その強調の使用は用語の範囲と意味に影響を及ぼさない。用語の範囲と意味は、それが強調されるか否かを問わず、同じ文脈では同一である。同一のことが一以上の方法で言及され得ることも理解される。結果的に、代替言語及び同義語が、本明細書中で議論される任意の一またはそれ以上の用語のために使用され得り、用語が本明細書中で詳しく述べられたり議論されたりするかどうかに関わらず任意の特別な意味を持たない。ある種の用語の同義語が提供される。一つ又は複数の同義語で詳説することは他の同義語の使用を除外しない。本明細書中で議論される任意の用語の例を含む本明細書中のどこかで使われる実施例の使用は、ただ説明するものであり、本発明又は例示された任意の用語の範囲と意味を限定するものでは全くない。同様に、本発明は本明細書中に挙げられた多様な実施形態に限定されない。
【0035】
他に定義されない限り、本明細書中で使用される全ての技術的及び科学的用語は、本発明が関係する分野における当業者に一般的に理解されるものと同一の意味を持つ。矛盾する点がある場合は、本文書が定義を含めて優先する。
【0036】
本明細書中で使用される、「だいたい」、「約」、「およそ」は、与えられた値又は範囲の20%以内、好ましくは10%以内、より好ましくは5%以内を一般的に意味する。本明細書中で与えられた数的量はおよそであり、表現で述べられていない場合、「だいたい」、「約」、「およそ」の用語が推論され得ることを意味する。
【0037】
本明細書中で使用される「アミロイド」は、特異的な構造特徴を共有する不溶性の線維状タンパク質凝集体である。器官におけるアミロイドの異常な蓄積はアミロイド症を誘導し得、様々な神経変性疾患に役割を担い得る。アミロイドの沈着はタンパク質性集団の沈着である。
【0038】
「アミロイドβ」、「アミロイドベータ(Aβ又はAベータ)」及び「ベータアミロイド」の用語は互換的である。
【0039】
「プリオン」の用語は、主としてタンパク質で構成される感染性病原体を意味する。これまでに発見されてきた全てのそのような病原体は、ミスフォールドしたタンパク質の状態を伝達することで増殖する。該タンパク質それ自身は自己複製をせず、その過程は、宿主中の該ポリペプチドの存在に依存している。プリオンタンパク質のミスフォールドした形態は、様々な哺乳類中の多数の疾患に関与することが示唆され、家畜では牛海綿状脳症(BSE、「狂牛病」としても知られている)及びヒトではクロイツフェルト・ヤコブ病を含む。全ての既知のプリオン病は脳又は他の神経組織の構造に影響を与え、全てのものは現在治療法がなく、必ず死に至る。一般的な用法として、プリオンは感染の理論上のユニットを指す。科学における表示法としてPrPCは、内在性のプリオンタンパク質(PrP)の形態を指し、それは、多数の組織に見出される。しかしながら、PrPScは、PrPのミスフォールドした形態を指し、それは、アミロイドプラークの形成及び神経変性に責任を負う。
【0040】
<アミロイドとアミロイド症>
アミロイドは、広範であるが特異的な細胞外タンパク質沈着のグループを指す一般的な用語であり、その全てが共通の形態の特質、染色特性、及びX線回折スペクトルを有する。沈着したアミロイドタンパク質の性質に関わらず、全てのアミロイドは以下の特性を有する。1)光学顕微鏡レベルで無定形の様相で、ヘマトキシリン及びエオシン染色を使ってエオシン好性に染まる。2)全てはコンゴレッドで染色され、偏光下で観察すると赤/緑の複屈折を示す。3)全ては主としてベータプリーツシート二次構造を含む。及び4)超微細構造的にアミロイドは通常、不確定の長さと、直径7−10nmの枝別れのない原線維からなる。
【0041】
アミロイドは今日、沈着した特異的なアミロイドタンパク質に従って分類される。アミロイド病は、限定されるわけではないが、アルツハイマー病、ダウン症、及びアミロイド症を有するオランダ型遺伝性脳出血に関連するアミロイドを含む(ここでは、特異的アミロイドはβ−アミロイドタンパク質又はAβと称する)。慢性炎症、様々な形態の悪性腫瘍及び家族性地中海熱に関連するアミロイドを含む(ここでは、特異的アミロイドはAAアミロイド、又は炎症関連アミロイド症と称する)。多発性骨髄腫及びB細胞疾患に関連するアミロイドを含む(ここでは、特異的アミロイドはALアミロイドと称する)。二型糖尿病と関連するアミロイドを含む(ここでは、特異的アミロイドはアミリン又は膵島アミロイドと称する)。クロイツフェルト・ヤコブ病、ゲルストマン・ストロイスラー症候群、クールー病及び動物のスクレイピーを含むプリオン病と関連するアミロイドを含む(ここでは、特異的アミロイドはPrPアミロイドと称する)。長期血液透析及び手根管症候群と関連するアミロイドを含む(ここでは、特異的アミロイドはβ2−ミクログロブリンアミロイドと称する)。老人性心臓アミロイド及び家族性アミロイド多発ニューロパチーと関連するアミロイドを含む(ここでは、特異的アミロイドはプレアルブミン又はトランスサイレチンアミロイドと称する)。甲状腺の髄様がんなどの内分泌腫瘍と関連するアミロイドを含む(ここでは、特異的アミロイドはプロカルシトニンの変異体と称する)。及び全身性アミロイド症を含む。V.N.UverskyとA.L.Fink(2004)「アミロイドフィブリル化の立体構造の制約:折りたたまれていないことの重要性」Biochimica et Biophysica Acta、1968、131−153を参照し、それはこの参照により完全に本明細書中に取り込まれる。
【0042】
臨床症状におけるアミロイドの沈着は、β‐プリーツシート構造の存在に関わる共通の物理的特性を共有しているが、多数の異なる化学的型が存在し、及びさらなる型が将来記述されるであろうことが現在明らかになっている。アミロイド症一般に作用するであろういくつかの共通する病理学的メカニズムがあると現在考えられている。多くの症例において、循環する前駆体タンパク質は、インタクト又は異常な分子の過剰生産(例えば、形質細胞疾患)、減少する分解又は排出(いくつかの二次的アミロイド症候群中の血清アミロイドA及び長期血液透析中のβ2−ミクログロブリン)、又は変異体タンパク質と関連する遺伝子異常(例えば、家族性アミロイド多発ニューロパチー)から生じる。より大きな前駆体タンパク質分子のタンパク質分解が多くの型のアミロイド症で起こり、通常細胞外に局在し重合及び組織沈着としてベータプリーツシート構造をとる低分子量断片の生産を生じる。何が関与する正確なメカニズムであるか、及び何がタンパク質分解のプロセス及び/又は翻訳修飾中の変化を導く異常な原因であるのかは、ほとんどのアミロイドで知られていない。
【0043】
慢性炎症、様々な形態の悪性腫瘍及び家族性地中海熱に関連するアミロイド(すなわちAAアミロイド又は、炎症関連アミロイド症)を含み、例えば多発性骨髄腫及びB細胞疾患に関連するアミロイド(すなわちALアミロイド)を含む全身性アミロイドは、一般的に中枢神経系の外部に存在する多様な器官と組織中にあるアミロイド沈着に関与することが知られている。これらの病気のアミロイド沈着は、例えば、肝臓、心臓、脾臓、消化管、腎臓、皮膚及び/又は肺に生じ得る。これらのアミロイド症の大部分は、明らかな治療又は効果的な処置がなく、アミロイド沈着の結果は患者にとって有害なものでありうる。例えば、腎臓におけるアミロイド沈着は腎不全を引き起こし得、一方、心臓におけるアミロイド沈着は心不全を引き起こし得る。これらの患者にとって、全身器官中のアミロイドの蓄積は、一般的に3−5年以内に死に至る。他のアミロイド症は一つの器官又は組織に影響し得る。例えばアルツハイマー病及びダウン症候群を有する患者の脳で見られるAβアミロイド沈着、クロイツフェルト・ヤコブ病、ゲルストマン・ストロイスラー症候群、クールー病を有する患者の脳で見出されるPrPアミロイド沈着、二型糖尿病の90%の患者の膵臓のランゲルハンス島で見出される膵島アミロイド(アミリン)、長期血液透析を行っている患者に見られるような手根管症候群を導く内側神経中のβ2−ミクログロブリンアミロイド沈着、老人性心臓アミロイドを有する患者の心臓中に観察されるプレアルブミン/トランスサイレチンアミロイド、及び家族性アミロイド多発ニューロパチーを有する患者の末梢神経に観察されるプレアルブミン/トランスサイレチンアミロイドがある。
【0044】
Table1はアミロイド沈着を特徴とする疾患のリストであり、以下のものを含む。アルツハイマー病、プリオン病、ハンチントン病、AAアミロイド症、膵島アミロイド症、遺伝性全身性アミロイド症、家族性アミロイド症、老人性全身性アミロイド症、ピック病、ALアミロイド症、パーキンソン病、びまん性レビー小体病、心房性アミロイド症、局所注入アミロイド症などがある。アミロイドを形成するであろうタンパク質は、限定はされないが、プリオンタンパク質、Aβペプチド、システインC、ハンチンチン、アンドロゲン受容体タンパク質、アタキシン―1、血清アミロイドA、IAPP、カルシトニン、リゾチーム、ゲルソリン、トランスサイレチン、アポリポプロテインA1、β−2−ミクログロブリン、免疫グロブリン軽鎖可変ドメイン、アルファ−シヌクレイン、フィブリノーゲン、心房性ナトリウム利尿因子、インスリンなどを含む。
【0045】
【表1】

【0046】
<アルツハイマー病と老齢人口>
アルツハイマー病は、β―アミロイドタンパク質又はAβと称する39−43アミノ酸ペプチドが線維状の形態で蓄積し、細胞外アミロイドプラーク及び脳の血管壁中にアミロイドとして存在することで特徴づけられる。アルツハイマー病の線維状Aβアミロイド沈着は、患者にとって有害なものであると信じられ、アルツハイマー病の独特の特徴である毒性と神経細胞死へと結果的に導くものである。アミロイドがアルツハイマー病の病理の主要な原因因子であるとする累積証拠がある。多様な他のヒトの疾患はまたアミロイドの沈着を示し、通常全身の器官(すなわち、中枢神経系の外に存在する器官や組織)が、器官の機能障害や不全へと導くアミロイドの蓄積と関係する。アルツハイマー病及び「全身性」アミロイド症においては、現在治療と効果的な処置がなく、患者は病気の発病から3から10年以内に通常死に至る(米国特許No.6607,758B2を参照し、この参照により本明細書中に完全に組み込まれる)。
【0047】
アルツハイマー病及び他のアミロイド症で起こる、アミロイドの形成、沈着、蓄積、及び/又は残留を停止させ又は逆転させる治療法のための新たな化合物又は薬剤が、従って切に必要とされている。
【0048】
<アルツハイマー病の治療標的としてのアミロイド>
アルツハイマー病は、β−アミロイドタンパク質、Aβ又はβ/A4と称される39−43アミノ酸ペプチドの沈着と蓄積によって特徴づけられる。Aβはβ−アミロイド前駆体タンパク質(APP又はβ−APP)と称されるより大きな前駆体タンパク質に由来し、それはいくつかのオルターナティブスプライシングによる変異体を有する。最も多量にあるβPPsの形態は695、751及び770アミノ酸からなるタンパク質を含む。
【0049】
小さなAβペプチドは、アルツハイマー病の患者の脳中にある「プラーク」のアミロイド沈着を作り出す主要な構成成分である。さらに、アルツハイマー病は、神経細胞の細胞質中に異常に蓄積する対になったらせん状の線維からなる多数の神経線維「濃縮体」の存在によって特徴づけられる。アルツハイマー病の病理学的特徴は、従って、プラークの中心核に沈着するアミロイドを有する「プラーク」及び「濃縮体」の存在である。アルツハイマー病の脳に見出される他の主要な病変の型は、脳の実質中及び脳の外側に存在する髄膜血管壁中の両者に見られる血管壁中のアミロイドの蓄積である。血管壁に局在するアミロイド沈着は、脳血管アミロイド又はコンゴレッド親和性血管障害と称する。
【0050】
アルツハイマー病中のアミロイドの重要性、並びに該病気の「プラーク」及び「濃縮体」の特徴が該病気の原因であるのか若しくは単なる結果であるのかどうかについての科学的議論が長年にわたり続いてきた。最近数年間の中で、研究によると、アミロイドは真にアルツハイマー病の原因因子であり、単なる無実の傍観者として見なされるべきではないと示唆される。細胞培養中でのアルツハイマーAβタンパク質は、短期間の間で神経細胞の変性を引き起こすことが示された。研究では、神経毒性効果を担っているのは、全てのアミロイドの特徴である線維構造(主としてβプリーツシート二次構造からなる)だと示唆している。Aβはまた、海馬のスライス培養で神経毒性があることが見出され、トランスジェニックマウスで神経細胞死を誘導することが分かった。ラット脳へのアルツハイマーAβの注入はまた、記憶障害及び神経機能障害を引き起こす。
【0051】
おそらく、Aβアミロイドがアルツハイマー病の病理に直接関与するとする最も説得力のある証拠は遺伝学的研究から来ている。Aβの生産が前駆体であるベータアミロイド前駆タンパク質をコードする遺伝子の変異から生じていることが発見されてきた。家族性アルツハイマー病の早期発症を引き起こすベータアミロイド前駆体タンパク質遺伝子の変異の同定が、アミロイドが本病気の根底にある病理プロセスの中心であるとする最も強い議論である。報告された4つの病気を引き起こす変異が発見され、それが家族性アルツハイマー病を引き起こすAβの重要性を実証する。これらの研究の全ては、ヒト患者の脳で線維状Aβの形成、沈着、蓄積及び/又は残留を減少し、排除し、又は予防する薬剤を提供することが、効果的な治療に役立つと信じられることを示唆している(米国特許No.6,607,758B2を参照)。
【0052】
5つの異なるタンパク質及びペプチドから形成されるアミロイド線維を分解するナットウキナーゼの能力を試験する実験が行われた。最初のサンプルはAβ40線維であった。なぜなら、アミロイドプラークの形成がアルツハイマー病の病理学的特性であり、並びに、Aβ40はヒトアミロイド前駆タンパク質の主要な切断産物及びアミロイドプラークの主要な構成成分の一つであるからだ。2つ目のサンプルは、糖尿病の患者に繰り返しインスリンを注射することが注射局在アミロイド症を引き起こしうるので、インスリン線維である。3つ目のサンプルは、プリオンがプリオン病を担う病原体であるので、プリオンペプチド線維である。ヒトプリオン配列(108−144)に対応するプリオンペプチドが、以前の観察ではそれがアミロイド構造を形成する最も可能性のある領域であるので、アミロイド線維を生産するために合成された。ヒトプリオンタンパク質は129番目の位置にMet又はValを有する。結果として生じるアミロイド線維が試験試薬であるチオフラビンT(ThT)でより強い蛍光シグナルを与えるので、Valを含む配列が選ばれた(Hsu et al.、(2009)「バチルス・スブチリスナットウ由来のナットウキナーゼのアミロイド分解能力」J.Agric.Food Chem.57(2)、pp503−508、この参照により本明細書中に完全に組み込まれる)。4つ目と5つ目はトランスサイレチンとβ2−ミクログロブリンである。
【実施例】
【0053】
本発明の範囲を限定する意図はなしに、本発明の実施形態による代表的な器具、装置、方法、及びそれに関連する結果が以下に与えられる。タイトル又はサブタイトルが読み手の便宜のために実施例中に使用され得ることに注意をするが、それは本発明の範囲を限定すべきものではない。さらに、ある種の理論が本明細書中で提案され開示される。しかしながら、それが正しいものであるか誤ったものであるかに関わらず、任意の特異的理論又は作用の図式に関わることなく本発明が本発明に沿って実行される限り、本発明の範囲を限定するべきものではない。
【0054】
<材料と方法>
<ナットウキナーゼの生産と精製>
バチルス・スブチリスナットウは、商業的に流通している製品から単離され4℃においてNB斜面培養で維持された。ナットウキナーゼの生産は7リッターの発酵槽(Bioflo 110モジュラー卓上発酵槽、New Brunswick Scientific、NJ、USA)中で、以前記載された方法に基づいて行われた。発酵のパラメーターは以下に記す。可動範囲は5リットルの5%(w/v)豆乳(5リットルの水中に250gの大豆粉末)、通気速度は1.0容量/容量/分で、攪拌速度800rpm、及び気温は37℃である。全ての以下の工程は4℃である。28時間後、上澄み液が12,000gで遠心分離することで回収され、10kDaでカットオフするアミコンウルトラ膜で濃縮された。濃縮された酵素溶液は、320mlのHiPrep26/60セファクリルS−100高分解能ゲル(アマシャムバイオサイエンス)で充填されたゲルろ過カラム(2.6x60cm)にアプライされた。そしてそれは、50mMリン酸ナトリウム及び150mM NaCl、pH7.0の移動相で、流速0.5mL/minである。1ミリリットルの画分が回収され、ナットウキナーゼの活性があり、15%SDS−PAGEでシングルバンドを示すものがプールされた。ナットウキナーゼの活性は基質としてS2251(H−D−Val−Leu−Lys−pNA;シグマ)を使った発色方法により測定された。
【0055】
<ペプチド合成>
ペプチドAβ40(DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVV;配列ID番号:1)及び129番目の位置にValを有する108−144のヒトプリオンペプチド配列(huPrPと略記する)(Ac−NMKHMAGAAAAGAVVGGLGGYVLGSAMSRPIIHFGSD−NH2;配列ID番号:2)は、PS3ペプチド合成機(ライニン)上でFmoc−ポリアミド法により合成された。全長タンパク質の立体配置を模倣するために、huPrPペプチドのN末端はアセチル化(Ac−)され、C末端はアミド化(−NH2)されている。プレロードされたFmoc−Val−Wang樹脂(置換0.47mmol/g)は、アナスペックInc,から購入され、Aβ40の合成に使用された。リンクアミドAM樹脂(置換0.74mmol/g)は、ノババイオケムから購入され、huPrPの合成に使用された。Fmoc−アミノ酸派生物(0.4mmol)は、4.45%(v/v)N−メチルモルフォリンを含むジメチルフォルムアミド(DMF)中で0.4mmolのベンゾトリアゾル−1−イル−オキシ−トリス−ピロリジノ−フォスフォニウムヘキサフルオロフォスフェートを使った0.1mmolの樹脂に結合された。huPrPのN末端のアセチル化は、合成過程中でアミノ酸派生物を使う代わりに、0.4mmolの無水酢酸を使って行われた。Fmoc切断は、DMF中で20%(v/v)ピペリジンを使って行われた。9.4mLのトリフルオロ酢酸、0.1mLのトリイソプロピルシラン、0.25mLの水及び0.25mLのエタンジチオールの混合物で室温1−2時間の間攪拌することで、ペプチドは該樹脂から切り離され、3倍容量の氷冷メチルt−ブチルエーテルで沈殿させ、4℃で10分間2000gで遠心分離された。ペレットはさらに2回メチルt−ブチルエーテルで洗浄され真空乾燥された。結果としてできた白色の粉末は、VydacC18カラム(10mmx250mm)及び0.1%トリフルオロ酢酸(v/v)を含むアセトニトリル−水混合物を使った逆相HPLCによって精製された。最終産物は、マトリックス支援レーザー脱離イオン(MALDI)質量分析装置で解析された。望まれる生産物を含んだ画分は凍結乾燥され−20℃で保管された。
【0056】
<アミロイド線維の調製>
Aβ40線維形成のために、500μM Aβ40保存液が75%トリフルオロエタノール中に調製された。ペプチド濃度は275nmの吸光度で定量された。線維を形成するために、保存液は、20mMリン酸ナトリウム緩衝液、150mM KCl、pH7.0中で25μMに希釈され、25℃で約2週間インキュベートされた。huPrP線維は、huPrPペプチドを20mM NaOAc、140mM NaCl、pH3.7の溶液中に最終濃度50μMで溶解し、該溶液を25℃で約1週間インキュベートすることで調製された。インスリン線維を得るためには、ウシインスリン(シグマ)は希塩酸(pH2.1)中に2.5mg/mLの濃度で溶解され、60℃で約2日間インキュベートされた。
【0057】
血漿からのヒトトランスサイレチン(TTR)及び尿からのヒトβ2−ミクログロブリン(β2−M)はシグマから購入した。TTRが線維を形成するためには、4mg/mlのTTRはまず、pH7.4の緩衝液(10mMリン酸、100mM KCl、1mM EDTA)に溶解し、次にpH4.4の緩衝液(50mM NaOAc、100mM KCl)で0.2mg/mlに希釈し、37℃で3日間インキュベートされた。β2−M線維は、pH2.5の緩衝液(25mM NaOAc、25mMリン酸、0.05% NaN3)中でβ2−Mを84μMの濃度に溶解されることで調製され、37℃において250rpmで攪拌しながら1日間インキュベートされた。
【0058】
線維形成は、円二色性分光法を用いて218nmの負の楕円率の出現、又は蛍光分光法を用いてThTの結合による蛍光発光によりモニターされた。
【0059】
<円二色性(CD)分光法>
それぞれの試料は1−mmの石英セル中に配置され、200と250nmの間のCDスペクトルがJ−715CDスペクトルメーター(JASCO、日本)で記録された。バンド間隔は2nmでセットされ、ステップ分解能は0.05nmである。それぞれの試料に対して二回のスキャンが平均化された。
【0060】
<チオフラビンT結合アッセイ>
チオフラビンT(ThT)結合アッセイは、アミロイド線維に結合することでThTにおける蛍光強度変化を測定する。チオフラビンT蛍光定量法は、アミロイド線維の存在の同定に頻繁に使用されてきた。チオフラビンTは線維状アミロイドタンパク質に結合することが知られ、蛍光の減少又は増加がアミロイド線維の量の減少又は増加と相関することが以前から示されてきた。37℃でインキュベートされたアルツハイマーAβ(1−40)タンパク質は、自発的にアミロイド線維を形成する傾向があり、時間と共に量が増加する。アルツハイマー病及び他のアミロイド症では、アミロイド線維の成長はアミロイドタンパク質の自己相互作用(すなわちAβ−Aβ相互作用)に関わると信じられている。
【0061】
5mMのThT(シグマ)の保存液は、2mgの染料を140mM NaCl、pH8.5を含む100mMリン酸緩衝液1.25mL中に溶解し、該溶液を0.22μmミリポアフィルターを通過させて調製される。新鮮な希釈標準溶液は、最終染料濃度を200μMに調節することで調製された。30μLの試料は、30μLの200μM ThT染料溶液と室温で1分間混合し、460と600nmの間の蛍光発色が442nmで励起したFP−750分光蛍光光度計(JASCO、日本)上で、3−mm光路長長方形キュベット中で測定された。
【0062】
<プロテアーゼ溶液>
本研究中で使用される全てのプロテアーゼの保存液(ナットウキナーゼ以外は全てシグマから購入)は、49μMの濃度で調製され、ブラッドフォードアッセイ(バイオラド)で定量された。プロテアーゼ溶液は、販売元の指導に基づき、異なる緩衝液中に調製された。ナットウキナーゼとサブチリシンカールスバーグは、150mM NaCl、pH7を含む50mMリン酸緩衝液中に溶解された。プロテイナーゼKは、10mM Tris−HCl、pH7緩衝液中に溶解された。トリプシンは1mM HClに溶解され、ヒトプラスミンは蒸留水に溶解された。他のプロテアーゼと比較するために、ナットウキナーゼはpH7緩衝液に溶解された。トランスサイレチン及びβ2−ミクログロブリンを分解するため、ナットウキナーゼは同じ緩衝液であるがpH7.4のものに溶解された。
【0063】
<ナットウキナーゼによる異なる種類のアミロイド線維の分解>
準備されたAβ40、huPrP、インスリン線維は、室温において20分間14,000gで遠心分離することで回収され、150mM NaCl、pH7を含む50mMリン酸緩衝液中に懸濁された。より均質な線維を得るために、該線維溶液は使用前に10分間超音波浴にインキュベートされた。酵素反応のため、1μLのナットウキナーゼ溶液は179μLのそれぞれの種類の線維溶液と混合され(最終的なナットウキナーゼの濃度:0.27μM)、該混合液は40℃で1時間インキュベートされた。線維の消化はCD分光法及び/又はThT結合アッセイによって測定された。トランスサイレチン(TTR)及びβ2−M線維では、該消化反応は生理学的条件下(pH7.4及び37℃)で、行われた。TTR線維は、室温において20分間14,000gで遠心分離することで回収され、150mM NaCl、pH7.4を含む50mMリン酸緩衝液中に懸濁された。β2−M線維は遠心分離で回収することができなかった。β2−M線維溶液は、該酵素を加える前に、pH7.4の50mMリン酸緩衝液中に3倍希釈された。
【0064】
<ナットウキナーゼのアミロイド分解活性における温度及びpHの影響>
この実験では、より多量の線維が必要とされるので、インスリン線維がナットウキナーゼ反応の基質として使用された。インスリンは商業的に入手可能で及びインスリン線維を作製するのにたった2日しかかからない。ナットウキナーゼ活性における温度の影響は、pH7で30℃から60℃までの様々な温度で消化することにより測定された。インスリン線維の分解はThT結合アッセイを使ってモニターされた。ナットウキナーゼ活性におけるpHの効果を試験するために、インスリン線維は以下の緩衝液に懸濁された。50mM NaOAc及び150mM NaCl(pH5)、50mMリン酸及び150mM NaCl(pH6及び7)、50mM Tris−HCl及び150mM NaCl(pH8及び9)、50mMグリシン−NaOH及び150mM NaCl(pH10)。反応は40℃で実施された。ナットウキナーゼ活性は、ThT結合アッセイがpH感受性なので、CD分光法により測定された。
【0065】
<異なるプロテアーゼのAβ線維分解活性の比較>
酵素反応は、ナットウキナーゼ、プロテイナーゼK、サブチリシンカールスバーグ、トリプシン又はプラスミンを使って37℃でpH7にて1時間行われた。反応混合液は1μLのプロテアーゼ保存液(49μM)及び179μLのAβ線維溶液を含み、ThT結合アッセイで試験するために、30μLの混合液が15分おきに分取された。
【0066】
<ナットウキナーゼによるAβ線維分解率の測定>
線維状のAβペプチド濃度は、全体のAβ濃度から遠心分離後上澄み画分中にある凝集していないAβペプチド濃度を引き算することで測定された。該線維は150mM NaCl、pH7.4を含む50mMリン酸緩衝液中に懸濁された。ナットウキナーゼは異なる酵素濃度で線維溶液中に加えられ、37℃でインキュベートされた。異なるインキュベーション時間の後、残存する線維の量がThT結合アッセイにより測定された。線維分解率は、線維分解の時間経過から計算された。
【0067】
<スクレイピー感染ハムスター脳の消化>
263K系統のプリオン(Caughy博士の研究室より提供された)に感染したハムスターの脳のホモジネート(10%)は、pH10グリシン/NaOH緩衝液(50mMグリシン、150mM NaCl)で4%に希釈され、50μg/mlのナットウキナーゼを使って50℃で消化された。該消化は7時間行われ、反応液は25μg/mlのナットウキナーゼを1時間ごとにさらに加えられた。最初の反応液の容量は100μLであった。分解の効果をアッセイするために、10μLの試料が1時間おきに分取され、反応は1mMPMSFで停止された。
【0068】
<ウエスタンブロット及びPrPScの検出>
SDS−PAGEに先立ち、消化された263K脳ホモジネートは、2% SDS及び1%2−メルカプトエタノールを含むサンプルローディング緩衝液で100℃10分間沸騰させられた。プリオンタンパク質(PrPSc)は、一次抗体1E4(Abcam、合成されたウシプリオンペプチド108−119で作製された)を0.25μg/ml、及び0.33μg/mlの西洋わさびペルオキシダーゼを抱合するヤギ抗マウスIgG(パーキンエルマ―)を使って検出された。シグナルは富士医療用X線フィルムで記録された。
【0069】
<実施例1:ナットウキナーゼはペプチドから形成されたアミロイド線維を分解及び減少させる>
ナットウキナーゼはゲルろ過クロマトグラフィーによって液体培養から精製された。ナットウキナーゼを含む画分は活性アッセイを用いて同定され、そして、SDS−PAGE上の27.7kDaのバンドの存在を検査された。該バンドはN末端シークエンス解析により分析された。純粋なタンパク質を示す画分が集められ凍結乾燥された(図1)。 図1は矢印で指し示すように精製されたナットウキナーゼの15%SDS−PAGEを示す。
【0070】
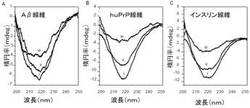
ナットウキナーゼがアミロイド分解活性を有するかどうか測定するために、合成Aβ40ペプチドから形成されたAβ40線維、合成ヒトプリオンペプチド(129番目にバリンを有する108−144のヒトプリオンタンパク質アミノ酸を含む)から形成されたhuPrP線維、精製したウシインスリンから形成されたインスリン線維が使用された。40℃でpH7において、ナットウキナーゼは3つの線維全てを分解した。それは、1時間消化後、CDスペクトル中で218nmにおける負の楕円率の振幅の減少によって示され、そのことはβプリーツシート構造の消失を示す(図2)。図2では、酵素添加直後のスペクトルが線(i)で示される。1及び48時間消化した試料のスペクトルがそれぞれ線(ii)及び線(iii)で示される。
【0071】
同様な結果がThT結合アッセイを使用して得られた。その中で、487nmにおけるThT蛍光強度の減少は、ナットウキナーゼ消化後のアミロイド構造の消失を示唆している(図3)。図3は、ThT結合アッセイを使った40℃でpH7におけるナットウキナーゼによる消化前後のAβ40線維(A)、huPrP線維(B)、及びインスリン線維(C)の蛍光発光スペクトルを示す。酵素添加直後のスペクトルが線(i)で示される。1及び48時間消化した試料のスペクトルがそれぞれ線(ii)及び線(iii)で示される。
【0072】
これらの結果は、ナットウキナーゼが3つの異なるアミロイド線維の全てを分解できることを実証する。
【0073】
ナットウキナーゼが、前形成されたアルツハイマー病及びプリオン病のアミロイド線維の「溶解」又は「破壊」を引き起こすことができるという発見は、器官及び/又は組織に相当なアミロイド沈着を既に有する患者に使用され得る任意の潜在的抗アミロイド薬剤にとって重要である。例えば、中期から後期のステージにあるアルツハイマー病の患者は、神経プラーク及び脳血管アミロイド沈着の両者を一部として、脳に多量のアミロイド沈着を有する。前もって存在するアミロイドの溶解を引き起こす天然の治療薬は、これらの患者に使用するのに有利である。
【0074】
<実施例2:ナットウキナーゼはpH及び温度依存的にアミロイドを消化する>
ナットウキナーゼの線維分解活性は、中性及びアルカリpH(7−12)において安定であることが知られ、pH5以下では不安定である。ナットウキナーゼのアミロイド分解活性におけるpHの効果を試験するために、40℃で広い範囲のpH値(pH5−10)においてインスリン線維のタンパク質消化が行われた。図4は異なるpHでのナットウキナーゼによるインスリン線維の分解を示す。消化は40℃で行われ、CD分光法でモニターされた。図4Aは残存するアミロイド線維を測定することでモニターされた分解の時間経過を示し、図4Bは1時間消化のデータを使って計算された異なるpHにおけるアミロイド分解のパーセンテージを示す。100%は、処置前の試料の218nmにおけるCD楕円率として定義する。値は2回の実験結果の平均±SEMである。結果は、ナットウキナーゼ活性はpHの上昇に伴って穏やかに増加し、テストした範囲ではpH10で最大の活性に至ることを示した。pH5ではナットウキナーゼは活性が全くなかった。
【0075】
さらに、ナットウキナーゼの線維分解活性は60℃以上で次第に失われることが報告されてきた。我々は従って、pH7で異なる温度においてナットウキナーゼのアミロイド分解活性を試験した。図5は、30から60℃の間での異なる温度におけるナットウキナーゼによるインスリン線維の分解を示す。該消化はpH7のリン酸緩衝液中で行われ、ThT結合アッセイを使ってモニターされた。図5Aは、残存するアミロイド線維を測定することでモニターされた分解の時間経過である。図5Bは、1時間消化のデータを使って計算された異なる温度におけるアミロイド分解のパーセンテージを示す。100%は処置前の試料の487nmにおける蛍光強度として定義する。値は2回の実験結果の平均±SEMである。
【0076】
図5Aに示されるように、60℃においてインスリン線維は最初の数分間に急速に分解される。しかし、おそらくナットウキナーゼの不活性化又は自己消化のために、その後消化は停止する。50℃においては、急速な初期消化が観察され、引き続きゆっくり消化される。一方、40℃においては初期の反応はより早くはないが、消化は継続し、他の場合よりもより完全に消化された。
【0077】
<実施例3:アミロイドの消化においてナットウキナーゼはプラスミンよりも効果的である>
ナットウキナーゼと他のいくつかのセリンプロテアーゼが、Aβ線維を37℃でpH7において消化する能力が試験された。使用されたプロテアーゼは、プロテイナーゼK(ケラチン分解酵素でプリオン病の研究に使用されるサブチリシン様セリンプロテアーゼ)、サブチリシンカールスバーグ(サブチリシン様セリンプロテアーゼ)、トリプシン、及びプラスミン(線維分解セリンプロテアーゼ)である。図6はAβ40線維分解の、プロテイナーゼK、ナットウキナーゼ、サブチリシンカールスバーグ、トリプシン及びプラスミンによる比較の結果を示す。該消化は37℃でpH7において行われ、15分ごとのThT結合アッセイによりモニターされた。100%はインキュベーション前のコントロールの487nmにおける蛍光強度として定義された。
【0078】
図6に示されるように、37℃でpH7においてプロテイナーゼK及びサブチリシンカールスバーグは、Aβ線維を最も高率で分解した。加水分解率はナットウキナーゼがより遅く、トリプシンはずっと遅く、一方プラスミンは効果がなかった。体温を模倣するために、該消化はプロテイナーゼK、サブチリシンカールスバーグ、又はナットウキナーゼの最適な温度で行われなかったが、これらのプロテアーゼのアミロイド分解活性はトリプシン及びプラスミンのものよりずっと大きかった。プラスミンはAβモノマー及び凝集したAβを分解することができることが示されてきた。しかし、その率(0.003s−1)は凝集したフィブリン(0.064s−1)を分解する率よりも20倍低く、Aβモノマー(0.48s−1)を分解する率よりも160倍低い。我々の研究では、同じ反応条件のもと、ナットウキナーゼはアミロイドを分断することにおいてプラスミンよりもより効率的であった。ナットウキナーゼによるAβ線維分解率は、37℃でpH7.4において0.015s−1であった(図7)。図7はAβ線維分解におけるナットウキナーゼの濃度依存を示す。Aβ線維(44μM)は、37℃でpH7.4のリン酸緩衝液中で、ナットウキナーゼ(最終酵素濃度、0.12、0.18、0.24、0.30、又は0.36μM)と共にインキュベートされた。値は2回の実験結果の平均±SEMである。
【0079】
<実施例4:ナットウキナーゼは精製したヒトタンパク質から形成されたアミロイド線維を消化する>
37℃でpH7.4の条件において、TTR線維は1時間でナットウキナーゼによりほぼ完全に分解された。β2−M線維に関しては、2時間でほぼ完全に分解された(図8)。TTR及びβ2−M線維の蛍光シグナルは時間と共に減少したが、ナットウキナーゼの線維分解能力は有意であった。図8A−Bは、37℃でpH7.4におけるナットウキナーゼによるTTR線維及びβ2−M線維の分解を示す。該消化は487nmにおけるThT蛍光発光によりモニターされた。100%はThT結合による初期線維の蛍光強度として定義される。値は2回の実験結果の平均±SEMである。
【0080】
<実施例5:ナットウキナーゼはインビボで形成されたプリオンを分解する>
263K系統のプリオンに感染したハムスターの脳ホモジネートが、50℃でpH10において50μg/mlのナットウキナーゼで消化された。ナットウキナーゼは短期間にこの消化の条件で最も効率的に機能するが、この高い分解効率を維持することができない。該ホモジネート中のプリオンを完全に分解するために、ウエスタンブロットのためのある程度の試料を分取した後、1時間ごとに25μg/mlのナットウキナーゼをさらに追加した。図9は、ナットウキナーゼで消化された263K感染の脳ホモジネートのウエスタンブロットの結果を示す。プリオンは1E4抗体で検出された。図9で示されるように、プロテアーゼ抵抗性のプリオンのコア(約30kDa)が徐々に分解された。該消化においてより高濃度のナットウキナーゼを使った場合、プリオンのシグナルは検出されないであろうことが期待された。
【0081】
<ディスカッション>
上記の実験では、ナットウキナーゼのアミロイド分解能を試験するために、Aβ40アミロイド線維、インスリンアミロイド線維、huPrP(108−144のプリオン配列を含む)アミロイド線維、TTRアミロイド線維、及びβ2Mアミロイド線維を含む5種類のインビトロで調製されたアミロイド線維及びインビボで形成されたハムスターのプリオン(263K系統)が使用された。ナットウキナーゼでこれらのアミロイド線維を処理した後、該アミロイド量は減少し(図2、3、8、及び9)、それはナットウキナーゼの一般的なアミロイド分解能力を示している。
【0082】
ナットウキナーゼのこのアミロイド分解能力は、それがアミロイド関連の病気の治療に有益であり得ることを示唆する。バチルス・リチェニフォルミス(Bacillus Licheniformis)により生産される羽毛分解酵素ケラチナーゼ(ベルサザイム)は、加熱前のプリオンを分解することができ、肉や骨料理中のプリオンを不活性化及び医療器具の汚染除去のために有益であるが、経口投与できない。免疫グロブリン軽鎖、トランスサイレチン、β2−ミクログロブリン、血清アミロイドAタンパク質、Aβペプチド、及びインスリンを含む多くのタンパク質及びペプチドは、体内にアミロイド沈着を形成することができる。Aβペプチドは、低密度リポタンパク質受容体関連タンパク質及びP糖タンパク質の助けを借りて、脳から血管に移動することができる。さらに、プリオン病は輸血により伝達され得、それは血液中でのプリオンの存在を示唆する。アミロイド線維は不溶性でプロテアーゼによって容易に分解できない。安全に経口投与されアミロイド線維を分解する酵素の発見は、アミロイド関連の病気の治療に非常に有益であり得る。ナットウキナーゼは血液凝固を溶解するだけではなく、アミロイド線維をも分解する。我々のアミロイド分解研究では、それが中性のpHで体温において活性があることを実証した。ラット、イヌ、ヒトにおける以前の結果によると、ナットウキナーゼが経口投与されると血液循環に入ることが示唆され、従って身体中の様々な場所のアミロイド沈着を除去する潜在能力がある。さらに、プリオン病は汚染された外科器具の使用により伝達され得る。ナットウキナーゼは50℃の温度を許容でき、pH10といった塩基性の条件下でより良く機能するので、器具のプリオン汚染除去に有益であろうことを示唆する(図9)。
【0083】
結論として、ナットウキナーゼは数百年にわたりヒトと動物により食されてきた食用酵素である。ヒト又はヒトによって使用され得る任意の物にナットウキナーゼを使用することは安全である。ナットウキナーゼは身体中の様々なアミロイド線維を消化し及び除去するのに使用され得る。外科器具又は動物飼料から感染性のプリオンタンパク質を除去するのに使用され得る。ナットウキナーゼは血液製剤からプリオン又はアミロイド線維を除去し、血液透析チューブにおけるアミロイド沈殿を予防するためにも使用され得る。
【産業上の利用可能性】
【0084】
<本発明の治療応用のさらなる側面と利用化>
患者に投与する前に、ナットウキナーゼは一つ又は複数の医薬的に許容される担体、希釈剤、又は賦形剤を有する医薬組成物中に処方され得る。本発明の一つの実施形態では、アルツハイマー病、プリオン病、二型糖尿病又は任意の他のアミロイド症を有する患者は、商業的に入手可能なナットウキナーゼを丸剤、錠剤、カプレット、ソフト及びハードのゼラチンカプセル、トローチ剤、べジキャップ、液滴、溶液、シロップ、ティーバッグ、及び/又は樹皮粉末形態中に入れて経口的に摂取し得る。
【0085】
別の実施形態では、任意の形態で商業的に入手されたナットウキナーゼは、適切な担体、賦形剤、及び希釈剤を使ってさらに調節される。それらは、ラクトース、デキストロース、スクロース、ソービトル、マニトール、スターチ、アカシアゴム、リン酸カルシウム、アルギン酸塩、トラガカント、ゼラチン、ケイ酸カルシウム、微結晶性セルロース、ポリビニルピロリドン、セルロース、水シロップ、メチルセルロース、メチル及びプロピルヒドロキシ安息香酸、タルク、ステアリン酸マグネシウム、及びミネラルオイルを含む。該処方はさらに、潤滑剤、湿潤剤、乳化及び懸濁剤、保存剤、甘味剤、又は香味剤を含み得る。ナットウキナーゼを含む組成物は、患者に投与された後、有効成分が急速な、持続した、又は遅延した反応を提供できるように処方され得る。ナットウキナーゼの組成物は好ましくは単位容量形態で処方され、それぞれの容量は1から約10,000mgのナットウキナーゼを含み、より通常では250又は500から約1,000又は2,000mgを含む。しかしながら、投与される治療容量は、処置される臨床状態、アミロイドの蓄積により影響を受ける又は影響を受けることが疑われる器官又は組織、選択された投与経路を含む相当する状況を考慮して医者により決定されるであろうことが理解される。従って、上記容量範囲はいかなる状況でも発明の範囲を限定する意図ではない。「単位容量形態」という用語は、ヒト被検体及び他の哺乳類に対しての単位容量として適した物理的に分離した単位を指す。それぞれの単位は、適した医薬担体と関連して望ましい治療効果を奏するよう計算された活性ナットウキナーゼの前もって決定された量を含む。
【0086】
以下の処方例は例証するだけで、任意の状況で発明の範囲を限定する意図ではない。ハードゼラチンカプセルは、500mgのナットウキナーゼ、400mgのスターチ、及び20mgのステアリン酸マグネシウムを使用することで調製され得る。上記成分が混ぜられて、920mg容量でハードゼラチンカプセルに詰められる。
【0087】
錠剤が500mgのナットウキナーゼ、800mgの微結晶セルロース、20mgのヒュームド二酸化ケイ素、及び10mgのステアリン酸を使用して調製される。該組成物は混合され、それぞれ1230mg重量の錠剤を形成するように圧縮される。
【0088】
エアロゾル溶液が、重量比:0.25のナットウキナーゼ、29.75のエタノール、及び70のプロペラント22(クロロジフルオロメタン)を使用して調製される。ナットウキナーゼはエタノールと混合される。該混合物はプロペラント22の一部に加えられ、‐30℃に冷却され、充填器具に移される。必要量がステンレスの鋼鉄製容器に詰められ、残りのプロペラントで希釈される。(上記リストした)該値の単位が容器に張り付けられる。そのようなエアロゾル形態のナットウキナーゼは、エアロゾル又は点鼻薬スプレーを使用することで、脳に関するアミロイドの治療(アルツハイマー病、ダウン症、プリオン病などのような)に有益であり得る。以前の研究では、これら中枢神経系のアミロイド症において、病理に役割を担うであろう可能な環境因子の侵入の初期形態は、鼻腔を通して外界から由来し得ることを示唆する。
【0089】
錠剤は、240mgのナットウキナーゼ、180mgのスターチ、140mgの微結晶セルロース、16mgのポリビニルピロリドン(水中で10%として)、18mgのカルボキシメチルスターチナトリウム、2mgのステアリン酸マグネシウム、及び2mgのタルク(全体で600mg)を使用して製造される。ナットウキナーゼ、スターチ、及びセルロースは、No.45網目状U.S.ふるいを通過させ徹底的に混合される。ポリビニルピロリドンの溶液は、No.14網目状U.S.ふるいを通過させた残りの粉末と混合される。そのように製造された顆粒は乾燥され、No.18網目状U.S.ふるいを通過させられる。前もってNo.60網目状U.S.ふるいを通過した、カルボキシメチルスターチナトリウム、ステアリン酸マグネシウム、及びタルクは該顆粒に加えられ、混合後に、錠剤製造機でそれぞれが600mg重量の錠剤を生産するように圧縮される。
【0090】
それぞれ160mgの薬剤を含むカプセルが、160mgのナットウキナーゼ、118mgのスターチ、118mgの微結晶セルロース、及び4mgのステアリン酸マグネシウム(総量=400mg)を使って製造される。ナットウキナーゼ、セルロース、及びステアリン酸マグネシウムは混合され、No.45網目状U.S.ふるいを通過させられ、400mgの容量でハードゼラチンカプセルに充填される。
【0091】
それぞれ225mgのナットウキナーゼを含む座薬が、225mgのナットウキナーゼ、2,000mgの飽和脂肪酸グリセリド(総量=2,225mg)を使って製造される。ナットウキナーゼはNo.60網目状U.S.ふるいを通過させられ、必要最小限の熱で前もって溶かされた飽和脂肪酸グリセリド中に懸濁された。該混合物はそれから、名目上2g容量の座薬の型に注がれて、冷却させられる。
【0092】
それぞれ5ml容量で50mgの薬剤を含む懸濁剤が、50mgのナットウキナーゼ、50mgのカルボキシメチルセルロースナトリウム、1.25mlのシロップ、0.10mlの安息香酸溶液、香料、色素、及び総量5mlにするための精製水を使って製造される。該薬剤はNo.45網目状U.S.ふるいを通過させられ、カルボキシメチルセルロースナトリウム及びシロップと混合され、滑らかなペーストを形成する。安息香酸溶液、香料、色素は相当な水で希釈され、攪拌しながら添加される。十分量の水がそれから加えられ、必要容量が生産される。
【0093】
静脈注射の処方が、250mgのナットウキナーゼ、及び1000mgの等張食塩水を使用して調製される。上記成分の溶液が、治療の必要に応じて被検体に1分に1mlの速度で静脈投与される。
【0094】
本発明の一つの実施形態では、ナットウキナーゼは任意の医薬的に許容されるビークルで投与され得る。本明細書中で使用される「医薬的に許容されるビークル」は、限定はされないが、任意の及び全ての溶媒、滅菌した液体を含む。それらは、石油、動物、野菜又は合成起源を含む水及び油で、ピーナッツ油、大豆油、ミネラルオイル、ごま油及びそれに類似するもの、分散媒、塗料、抗細菌及び抗真菌剤、等張及び吸収遅延剤、及び該化合物の活性と両立し及び被検体に生理学的に許容される類似物である。医薬的に許容されるビークルの例は正常食塩水緩衝液(0.15モーラーNaCl)である。医薬的に活性のある物質に対するそのような溶液や薬剤の使用は先行技術によく知られている。補助的な活性のある化合物が該組成物にまた取り込まれ得る。適した医薬賦形剤は、スターチ、グルコース、ラクトース、スクロース、ゼラチン、麦芽、米、小麦粉、チョーク、シリカゲル、炭酸マグネシウム、ステアリン酸ナトリウム、グリセロールモノステアリン酸、タルク、食塩、乾燥スキムミルク、グリセロール、プロピレン、グリコール、水、エタノール、及びそれに類似するものを含む。これらの組成物は、溶液、懸濁液、錠剤、丸剤、カプセル、粉末、除放処方及びそれに類似するものの形態を取り得る。
【0095】
被検体におけるアミロイドの形成、沈着、蓄積、及び/又は残留は、被検体に治療容量でナットウキナーゼを投与することにより阻害される。被検体の用語はアミロイド症が起こり得る生命体を含む意図である。被検体の例は、ヒト、サル、ウシ、イヌ、ヒツジ、ネコ、ネズミ、ラット、及びそのトランスジェニックな種を含む。治療される被検体へのナットウキナーゼの投与は、既知の手順で被検体中のアミロイド症を阻害するのに有効な容量及び期間を用いて行われ得る。治療効果を達成するのに必要なナットウキナーゼの有効量は、被検体中の器官又は組織部位に既に沈着しているアミロイドの量、被検体の年齢、性別及び体重、並びにアミロイド形成、沈着、蓄積、残留を阻害し、及び/又は被検体中の前形成されたアミロイドの溶解を生じるナットウキナーゼの処方の能力に従って変化し得る。投与計画が、従って、最適な治療効果を提供するために調整される。例えば、いくつかの分割された容量が毎日投与され、該容量は治療状況の必要に応じて比例して減少され得る。ナットウキナーゼの効果的な容量範囲の非限定的な実施例は、10から1000mg/kg体重/日、又は10から100mg/kg体重である。
【0096】
ナットウキナーゼ送達の異なる様式が使用され得る。まず、一つの投与経路は経口投与である。代わりに、ナットウキナーゼは、皮下、静脈中、腹腔内の様な注射によって投与される全ての経路のような、他の適した経路によって投与され得る。投与経路に依存して、該活性化合物は、ナットウキナーゼを不活性化し得る酸及び他の天然の状況の作用からナットウキナーゼを保護するための物質でコートされ得る。
【0097】
ナットウキナーゼを投与するためには、その活性化を阻害する物質でコートし又は共に投与することが必要であろう。例えば、ナットウキナーゼは適切な担体、例えばリポソーム又は希釈剤中で被検体に投与され得る。医薬的に許容される希釈剤は、生理食塩水及び水溶性緩衝液を含む。リポソームは、典型的なリポソームと同様にwater−in−oil−in−water型CGFエマルジョンを含む。
【0098】
ナットウキナーゼは非経口的に又は腹腔内にもまた投与され得る。分散媒がグリセロール、液体ポリエチレングリコール及びその混合物、並びに油中に調製され得る。通常の保存及び使用の条件下では、それらの調製物は微生物の成長を阻止する保存料を含み得る。
【0099】
注射による使用に適した医薬組成物は、滅菌水溶液又は分散剤、及び無菌の注射可能な溶液又は分散剤の調製のための滅菌粉末を含む。全ての場合において、該組成物は無菌で、現存する注射器で容易に使用可能な程度に流体でなければならない。それは、製造と保存の条件下において安定で、細菌や真菌のような微生物に汚染しないように保存されなければならない。ビークルは、例えば、水、エタノール、ポリオール(例えばグリセロール、プロピレングリコール、及び液体ポリエチレングリコール、並びにそれに類似するもの)、その適切な混合物、及び植物油を含む溶液又は分散剤であり得る。適切な流動性が、例えば、レシチンのようなコーティングを使用することによって、分散剤の場合は要求される粒子サイズを維持することにより、及び界面活性剤を使用することにより維持され得る。微生物の作用の阻止が、様々な抗細菌剤及び抗真菌剤、例えば、パラベン、クロロブタノール、フェノール、アスコルビン酸、チメローサル、及びそれに類似するものによって達成され得る。多くの場合、組成物中に、等張剤、例えば糖、食塩、又はマニトール及びソービトールの様なポリアルコールを含むことが好まれる。注射可能な組成物の持続的吸収が、組成物中に吸収を遅延させる薬剤、例えばモノステアリン酸アルミニウム又はゼラチンを含むことによりもたらされ得る。
【0100】
滅菌した注射用溶液は、上記に列挙された成分の一つ又はその組み合わせを有する適切な溶媒中に必要量ナットウキナーゼを取り込むことで調製され、引き続きフィルター滅菌され得る。一般的に、分散剤は、ナットウキナーゼを、塩基性の分散媒及び上記に列挙されたものの中から必要とされる他の成分を含む滅菌したビークル中に取り込むことにより調製される。滅菌した注射用溶液の調製のための滅菌粉末の場合、その調製方法は真空乾燥及び凍結乾燥により、その前もって滅菌フィルター処理した溶液から、ナットウキナーゼ及び任意の所望の成分の粉末を生じる。
【0101】
アルツハイマー病、プリオン病、及び他の中枢神経系アミロイド症に対するナットウキナーゼは、血液脳関門を通過するように最適化されるだろう。導入方法は、限定はされないが、全身投与、非経口的投与、すなわち腹腔内、静脈内、口周囲、皮下、筋中、動脈内、皮内、筋中、鼻腔内、硬膜外、及び経口経路を含む。一つの実施形態では、ナットウキナーゼは、脳室内注射により脳脊髄液に直接投与され得る。特別な実施形態では、治療の必要な領域又は組織に局所的にナットウキナーゼを投与することが望まれ得る。このことは、例えば、限定されるわけではないが、手術中の局所的注入、局所的投与、注射で、浸透圧ポンプでカニューレを使った注入により、カテーテルを使って、坐薬を使って、又はインプラントを使って達成され得る。
【0102】
まだ別の実施形態では、ナットウキナーゼは浸透圧ポンプの様な制御された放出システムで送達され得る。まだ別の実施形態で、制御された放出システムは、治療標的、すなわち脳に近接して設置され得、従って、全身投与容量のほんの一部しか必要としない。
【0103】
上記したシステム及び構成成分に関しては、本明細書中で他に特定し又は記述していないが、それらが作られ、組み立てられ又は使用されるそのようなシステム及び構成成分及び方式の作用機構並びに特定事項は、本明細書中に開示された目的に効果を及ぼすために、お互いに及び本明細書中に記載された発明の他の要素と協調的に働き、そしてその全てが当業者の知識の範囲内にあると信じられる。当業者に一般的に知られたことをここで繰り返す一致した試みは、従ってなされていない。
【0104】
本発明の代表的な実施形態の先の記述は、説明及び記載する目的のためだけに提示されており、開示された詳細な形態に徹底的又は発明を限定する意図ではない。多くの修飾及び変異が、上記教示するものに鑑みて可能である。
【0105】
実施形態及び実施例が本発明の原理を説明するために選ばれ及び記述された。当業者が本発明及び様々な実施形態並びに様々な修飾を利用可能なように、その実際の適用は、熟慮された特定の使用に適したものになっている。代替する実施形態は、本発明がその精神及び範囲から離れることなしに関連する当業者に明白なものになっているだろう。従って、本発明の範囲は、本明細書中に記載される先の記載及び代表的実施形態よりも付加された特許請求の範囲により定義される。
【0106】
特許、特許出願及び様々な刊行物を含みうるいくつかの参照は、本発明の記載中に引用され及び議論される。そのような参照の引用及び/又は議論は、本発明の記載を単に明らかにするために提供され、任意のそのような参照が本明細書中に記載された発明の「先行技術」であることを認めるものではない。本明細書中に引用され及び議論された全ての参照は、この参照により完全に、及びそれぞれの参照が参照により個々に取り込まれたかと同じ程度に本明細書中に組み込まれる。
【技術分野】
【0001】
本願は2008年11月22日付け出願の米国特許仮出願第61/117,096号に対して優先権を主張するものであり、該出願はこの参照によって本明細書に完全に組み込まれる。
【0002】
本発明は一般的にはアミロイド、プリオン、及び他のタンパク質凝集物の分解と排除に関する。より特異的には、アルツハイマー病、プリオン病、及び他のアミロイド症を治療する治療介入において、アミロイド線維形成を分解し及び減少させる方法に関する。
【背景技術】
【0003】
納豆、ゆでた大豆から作られる発酵食品は、アジアで千年以上にわたり食されてきた。納豆から単離される発酵微生物はグラム陽性内生胞子を形成する細菌バチルス・スブチリス(又はナットウ)(正式には、バチルスナットウと表記する)である。ナットウキナーゼは、バチルス・スブチリス(又はナットウ)から分泌される細胞外酵素であり、アルカリセリンプロテアーゼファミリーに属し、その触媒中心は、3つの保存された残基Asp−32、His−64、及びSer−221を含む。それは、分子量27.7kDaであり、等電点8.7である。ナットウキナーゼは275アミノ酸からなり、遺伝子配列はサブチリシンファミリーの他のメンバーのものと相同である(サブチリシンEと99.5%相同であり、サブチリシンBPN’と86%、サブチリシンカールスバーグと72%相同である)。それは、血栓中のフィブリンを分解するだけではなく、プラスミノーゲンアクチベーター阻害剤タイプIをも切断する。
【0004】
ナットウキナーゼは、プラスミン(血液中にある天然の血栓溶解プロテアーゼ)よりも血栓溶解活性が高く、プラスミノーゲンアクチベーターに対する作用のためプラスミノーゲンからプラスミンの生産を増加させる。これらの観察は、経口投与の後、腸管を通して吸収され繊維素溶解を誘導するという事実と共に、ナットウキナーゼを循環器疾患の治療のための潜在的な血栓溶解剤とする。納豆の食事補給は、動脈の内膜肥厚を抑制し、内皮傷害後に見られる壁在血栓の溶解を導く。他の臨床的血栓溶解剤、例えばウロキナーゼ及びストレプトキナーゼは、高価でかつ腸管で不安定である。血栓症のための繊維素溶解治療及びアテローム動脈硬化症の予防において、ナットウキナーゼの経口投与による使用は、従って興味深い。ナットウキナーゼは、身体の血行を改善する補助的栄養物として現在使用されている。多くの研究がナットウキナーゼについて行われているが、ナットウキナーゼが、アミロイドを(それはまた高度に不溶性でプロテアーゼに抵抗性である)分解できるかどうかについては興味を持たれていなかった。
【発明の概要】
【課題を解決するための手段】
【0005】
本発明はナットウキナーゼの応用に関する。一つの側面において、本発明はナットウキナーゼを使用することで多種多様のアミロイド線維を分解する方法に関する。ナットウキナーゼは身体中のアミロイドを消化するのに使用され得る。なぜならそれは、食用酵素で、補助的栄養物として使用されてきたからだ。他の側面では、本発明は、ナットウキナーゼを用いて感染性のプリオンを除去する方法に関する。プリオンは多様なプリオン病へと導く感染病原体である。プリオン病は食事、手術、及び輸血により伝染され得る。ナットウキナーゼは、動物飼料、手術器具、及び血液製剤などからプリオンを除去するのに使用され得る。
【0006】
一つの側面として、本発明は、哺乳類の被検体中でのアルツハイマー病、プリオン病、及び/又は他のアミロイド症において、前形成され、又は、前沈着したアミロイド線維を溶解し又は破壊する方法、並びに/又はアミロイド形成、沈着、蓄積、残留を阻害する方法に関する。該方法は、治療的に有効量のナットウキナーゼ及び該被検体中でアルツハイマー病、プリオン病、及び/又は他のアミロイド症を治療するのに効果があると選択された治療容量のナットウキナーゼを含む組成物を該被検体に投与する工程を含む方法である。
【0007】
本発明の一つの実施形態では、ナットウキナーゼは発酵された大豆食品から抽出される。
【0008】
本発明の別の実施形態では、該アミロイド線維は、Aβアミロイド線維、プリオン線維、インスリン線維、トランスサイレチン線維、及びβ―ミクログロブリン線維からなるグループより選択される。
【0009】
本発明の別の実施形態では、該アミロイド線維は、アルツハイマー病のAβアミロイド線維及びプリオンタンパク質(PrPSc)のミスフォールドした/感染性の形態からなるグループより選択される。
【0010】
さらに、本発明の別の実施形態では、該アミロイド線維は、トランスサイレチン、β2−ミクログロブリン、IAPP(アミリン)、及びベータアミロイドからなるグループより選択される。
【0011】
本発明の別の実施形態では、ナットウキナーゼの治療容量はアルツハイマー病を治療するのに有効量なものとして選択される。
【0012】
本発明の別の実施形態では、ナットウキナーゼの治療容量はプリオン病を治療するのに有効量なものとして選択される。
【0013】
本発明の別の実施形態では、ナットウキナーゼの治療容量は、家族性アミロイド多発ニューロパチー、透析関連アミロイド症、二型糖尿病、及び脳アミロイド血管症からなるグループより選択された他のアミロイド症を治療するのに有効量なものとして選択される。
【0014】
治療的に有効量のナットウキナーゼは、経口で、エアーゾルスプレーで、又は、非経口的に注射又は注入できる形態で投与され得る。
【0015】
別の面では、本発明は、インビトロのアミロイド環境において、前形成した又は前沈着したアミロイド線維を溶解し又は破壊し、並びに/又はアミロイド形成、沈着、蓄積、又は残留を阻害する方法に関する。該方法は、有効量のナットウキナーゼ及びアミロイドを治療するのに効果があると選択された有効量のナットウキナーゼを含む組成物をインビトロ環境に加えることを含む。
【0016】
本発明の一つの実施形態では、該アミロイドはアルツハイマー病及び/又はプリオン病に関連する。
【0017】
本発明の一つの実施形態では、該インビトロ環境は、医療機器、医薬製剤、及び動物飼料からなるグループより選択された物を含む。医療機器は手術器具及び血液透析チューブからなるグループより選択され得る。
【0018】
本発明の一つの実施形態では、該医薬製剤は血液製剤である。
【0019】
他の側面では、本発明はアミロイド線維の分解を触媒する方法に関する。該方法は、アミロイド線維とアミロイド線維を分解するのに有効量のナットウキナーゼを含む組成物とを接触させる工程を含む。
【0020】
本発明の一つの実施形態では、該方法は、該接触工程の前にその必要に応じて、該組成物を哺乳類被検体に投与する工程をさらに含む。
【0021】
本発明の別の実施形態では、該接触工程は、インビトロの環境下で、プリオンタンパク質が混入されやすい物に関して実行される。該物は、医療機器、医薬製剤、及び動物飼料からなるグループより選択され得る。該インビトロ環境はAβアミロイド線維、プリオン線維、インスリン線維、トランスサイレチン線維、β―ミクログロブリン線維、及びその任意の組み合わせからなるグループより選択されるアミロイド線維を含み得る。
【0022】
ここでのバリエーションや修飾は、この開示の新規な概念の精神と範囲から離れることなしに影響を受け得るが、これら及び他の側面は以下の図と共に取り入れられる好ましい実施形態の以下の記述から明らかになるであろう。
【0023】
付随した図は、本発明の一つ又は複数の実施形態を説明し、文書で記述したものと共に、本発明の原理を説明するのに役立つ。どこにおいても可能な限り、同じ参照番号が、同一又は類似の実施形態の要素を指すのに図全体を通して使用される。
【図面の簡単な説明】
【0024】
【図1】図1は、精製されたナットウキナーゼ(矢印により示される)を示すSDS−PAGEゲルの写真である。
【0025】
【図2】図2A−2Cは、ナットウキナーゼによる消化前後のタンパク質のCDスペクトルを示すグラフ表示である。線(i)は酵素添加直後のスペクトルを示す。線(ii)及び(iii)は、それぞれ1及び48時間消化した試料のスペクトルを示す。
【0026】
【図3】図3A−3CはThT結合アッセイを使ってナットウキナーゼによる消化前後のタンパク質の蛍光発光スペクトルを示すグラフ表示である。線(i)は酵素添加直後のスペクトルを示す。線(ii)及び(iii)は、それぞれ1及び48時間消化した試料のスペクトルを示す。
【0027】
【図4】図4A−4Bは、異なるpHにおけるナットウキナーゼによるインスリン線維の分解を示すグラフである。
【0028】
【図5】図5A−5Bは、異なる温度におけるナットウキナーゼによるインスリン線維の分解を示すグラフである。
【0029】
【図6】図6は、様々なプロテアーゼによるAβ40線維の分解を比較したグラフである。
【0030】
【図7】図7は、Aβ40線維分解のナットウキナーゼ濃度依存性を示すグラフである。
【0031】
【図8】図8Aは、ナットウキナーゼによるTTR線維分解を示すグラフである。
【0032】
図8Bは、ナットウキナーゼによるβ2−ミクログロブリン線維の分解を示すグラフである。
【0033】
【図9】図9は、ナットウキナーゼで消化した263K感染脳ホモジネートのウエスタンブロットを示す写真である。プリオンは1E4抗体で検出された。
【発明を実施するための最良の形態】
【0034】
本明細書中で使用される用語は、本技術中で、本発明の文脈の範囲内で、及び、それぞれの用語が使用される特異的文脈において一般的にその通常の意味を持つ。本発明を記述するのに使用されたある種の用語は、以下に、又は本明細書中のどこかで議論されて、本発明の記述に関して、実務家にさらなるガイダンスを供与する。便宜上、ある種の用語は、強調され、例えば、イタリックス及び/又はクォーテーションマークを使用される。その強調の使用は用語の範囲と意味に影響を及ぼさない。用語の範囲と意味は、それが強調されるか否かを問わず、同じ文脈では同一である。同一のことが一以上の方法で言及され得ることも理解される。結果的に、代替言語及び同義語が、本明細書中で議論される任意の一またはそれ以上の用語のために使用され得り、用語が本明細書中で詳しく述べられたり議論されたりするかどうかに関わらず任意の特別な意味を持たない。ある種の用語の同義語が提供される。一つ又は複数の同義語で詳説することは他の同義語の使用を除外しない。本明細書中で議論される任意の用語の例を含む本明細書中のどこかで使われる実施例の使用は、ただ説明するものであり、本発明又は例示された任意の用語の範囲と意味を限定するものでは全くない。同様に、本発明は本明細書中に挙げられた多様な実施形態に限定されない。
【0035】
他に定義されない限り、本明細書中で使用される全ての技術的及び科学的用語は、本発明が関係する分野における当業者に一般的に理解されるものと同一の意味を持つ。矛盾する点がある場合は、本文書が定義を含めて優先する。
【0036】
本明細書中で使用される、「だいたい」、「約」、「およそ」は、与えられた値又は範囲の20%以内、好ましくは10%以内、より好ましくは5%以内を一般的に意味する。本明細書中で与えられた数的量はおよそであり、表現で述べられていない場合、「だいたい」、「約」、「およそ」の用語が推論され得ることを意味する。
【0037】
本明細書中で使用される「アミロイド」は、特異的な構造特徴を共有する不溶性の線維状タンパク質凝集体である。器官におけるアミロイドの異常な蓄積はアミロイド症を誘導し得、様々な神経変性疾患に役割を担い得る。アミロイドの沈着はタンパク質性集団の沈着である。
【0038】
「アミロイドβ」、「アミロイドベータ(Aβ又はAベータ)」及び「ベータアミロイド」の用語は互換的である。
【0039】
「プリオン」の用語は、主としてタンパク質で構成される感染性病原体を意味する。これまでに発見されてきた全てのそのような病原体は、ミスフォールドしたタンパク質の状態を伝達することで増殖する。該タンパク質それ自身は自己複製をせず、その過程は、宿主中の該ポリペプチドの存在に依存している。プリオンタンパク質のミスフォールドした形態は、様々な哺乳類中の多数の疾患に関与することが示唆され、家畜では牛海綿状脳症(BSE、「狂牛病」としても知られている)及びヒトではクロイツフェルト・ヤコブ病を含む。全ての既知のプリオン病は脳又は他の神経組織の構造に影響を与え、全てのものは現在治療法がなく、必ず死に至る。一般的な用法として、プリオンは感染の理論上のユニットを指す。科学における表示法としてPrPCは、内在性のプリオンタンパク質(PrP)の形態を指し、それは、多数の組織に見出される。しかしながら、PrPScは、PrPのミスフォールドした形態を指し、それは、アミロイドプラークの形成及び神経変性に責任を負う。
【0040】
<アミロイドとアミロイド症>
アミロイドは、広範であるが特異的な細胞外タンパク質沈着のグループを指す一般的な用語であり、その全てが共通の形態の特質、染色特性、及びX線回折スペクトルを有する。沈着したアミロイドタンパク質の性質に関わらず、全てのアミロイドは以下の特性を有する。1)光学顕微鏡レベルで無定形の様相で、ヘマトキシリン及びエオシン染色を使ってエオシン好性に染まる。2)全てはコンゴレッドで染色され、偏光下で観察すると赤/緑の複屈折を示す。3)全ては主としてベータプリーツシート二次構造を含む。及び4)超微細構造的にアミロイドは通常、不確定の長さと、直径7−10nmの枝別れのない原線維からなる。
【0041】
アミロイドは今日、沈着した特異的なアミロイドタンパク質に従って分類される。アミロイド病は、限定されるわけではないが、アルツハイマー病、ダウン症、及びアミロイド症を有するオランダ型遺伝性脳出血に関連するアミロイドを含む(ここでは、特異的アミロイドはβ−アミロイドタンパク質又はAβと称する)。慢性炎症、様々な形態の悪性腫瘍及び家族性地中海熱に関連するアミロイドを含む(ここでは、特異的アミロイドはAAアミロイド、又は炎症関連アミロイド症と称する)。多発性骨髄腫及びB細胞疾患に関連するアミロイドを含む(ここでは、特異的アミロイドはALアミロイドと称する)。二型糖尿病と関連するアミロイドを含む(ここでは、特異的アミロイドはアミリン又は膵島アミロイドと称する)。クロイツフェルト・ヤコブ病、ゲルストマン・ストロイスラー症候群、クールー病及び動物のスクレイピーを含むプリオン病と関連するアミロイドを含む(ここでは、特異的アミロイドはPrPアミロイドと称する)。長期血液透析及び手根管症候群と関連するアミロイドを含む(ここでは、特異的アミロイドはβ2−ミクログロブリンアミロイドと称する)。老人性心臓アミロイド及び家族性アミロイド多発ニューロパチーと関連するアミロイドを含む(ここでは、特異的アミロイドはプレアルブミン又はトランスサイレチンアミロイドと称する)。甲状腺の髄様がんなどの内分泌腫瘍と関連するアミロイドを含む(ここでは、特異的アミロイドはプロカルシトニンの変異体と称する)。及び全身性アミロイド症を含む。V.N.UverskyとA.L.Fink(2004)「アミロイドフィブリル化の立体構造の制約:折りたたまれていないことの重要性」Biochimica et Biophysica Acta、1968、131−153を参照し、それはこの参照により完全に本明細書中に取り込まれる。
【0042】
臨床症状におけるアミロイドの沈着は、β‐プリーツシート構造の存在に関わる共通の物理的特性を共有しているが、多数の異なる化学的型が存在し、及びさらなる型が将来記述されるであろうことが現在明らかになっている。アミロイド症一般に作用するであろういくつかの共通する病理学的メカニズムがあると現在考えられている。多くの症例において、循環する前駆体タンパク質は、インタクト又は異常な分子の過剰生産(例えば、形質細胞疾患)、減少する分解又は排出(いくつかの二次的アミロイド症候群中の血清アミロイドA及び長期血液透析中のβ2−ミクログロブリン)、又は変異体タンパク質と関連する遺伝子異常(例えば、家族性アミロイド多発ニューロパチー)から生じる。より大きな前駆体タンパク質分子のタンパク質分解が多くの型のアミロイド症で起こり、通常細胞外に局在し重合及び組織沈着としてベータプリーツシート構造をとる低分子量断片の生産を生じる。何が関与する正確なメカニズムであるか、及び何がタンパク質分解のプロセス及び/又は翻訳修飾中の変化を導く異常な原因であるのかは、ほとんどのアミロイドで知られていない。
【0043】
慢性炎症、様々な形態の悪性腫瘍及び家族性地中海熱に関連するアミロイド(すなわちAAアミロイド又は、炎症関連アミロイド症)を含み、例えば多発性骨髄腫及びB細胞疾患に関連するアミロイド(すなわちALアミロイド)を含む全身性アミロイドは、一般的に中枢神経系の外部に存在する多様な器官と組織中にあるアミロイド沈着に関与することが知られている。これらの病気のアミロイド沈着は、例えば、肝臓、心臓、脾臓、消化管、腎臓、皮膚及び/又は肺に生じ得る。これらのアミロイド症の大部分は、明らかな治療又は効果的な処置がなく、アミロイド沈着の結果は患者にとって有害なものでありうる。例えば、腎臓におけるアミロイド沈着は腎不全を引き起こし得、一方、心臓におけるアミロイド沈着は心不全を引き起こし得る。これらの患者にとって、全身器官中のアミロイドの蓄積は、一般的に3−5年以内に死に至る。他のアミロイド症は一つの器官又は組織に影響し得る。例えばアルツハイマー病及びダウン症候群を有する患者の脳で見られるAβアミロイド沈着、クロイツフェルト・ヤコブ病、ゲルストマン・ストロイスラー症候群、クールー病を有する患者の脳で見出されるPrPアミロイド沈着、二型糖尿病の90%の患者の膵臓のランゲルハンス島で見出される膵島アミロイド(アミリン)、長期血液透析を行っている患者に見られるような手根管症候群を導く内側神経中のβ2−ミクログロブリンアミロイド沈着、老人性心臓アミロイドを有する患者の心臓中に観察されるプレアルブミン/トランスサイレチンアミロイド、及び家族性アミロイド多発ニューロパチーを有する患者の末梢神経に観察されるプレアルブミン/トランスサイレチンアミロイドがある。
【0044】
Table1はアミロイド沈着を特徴とする疾患のリストであり、以下のものを含む。アルツハイマー病、プリオン病、ハンチントン病、AAアミロイド症、膵島アミロイド症、遺伝性全身性アミロイド症、家族性アミロイド症、老人性全身性アミロイド症、ピック病、ALアミロイド症、パーキンソン病、びまん性レビー小体病、心房性アミロイド症、局所注入アミロイド症などがある。アミロイドを形成するであろうタンパク質は、限定はされないが、プリオンタンパク質、Aβペプチド、システインC、ハンチンチン、アンドロゲン受容体タンパク質、アタキシン―1、血清アミロイドA、IAPP、カルシトニン、リゾチーム、ゲルソリン、トランスサイレチン、アポリポプロテインA1、β−2−ミクログロブリン、免疫グロブリン軽鎖可変ドメイン、アルファ−シヌクレイン、フィブリノーゲン、心房性ナトリウム利尿因子、インスリンなどを含む。
【0045】
【表1】

【0046】
<アルツハイマー病と老齢人口>
アルツハイマー病は、β―アミロイドタンパク質又はAβと称する39−43アミノ酸ペプチドが線維状の形態で蓄積し、細胞外アミロイドプラーク及び脳の血管壁中にアミロイドとして存在することで特徴づけられる。アルツハイマー病の線維状Aβアミロイド沈着は、患者にとって有害なものであると信じられ、アルツハイマー病の独特の特徴である毒性と神経細胞死へと結果的に導くものである。アミロイドがアルツハイマー病の病理の主要な原因因子であるとする累積証拠がある。多様な他のヒトの疾患はまたアミロイドの沈着を示し、通常全身の器官(すなわち、中枢神経系の外に存在する器官や組織)が、器官の機能障害や不全へと導くアミロイドの蓄積と関係する。アルツハイマー病及び「全身性」アミロイド症においては、現在治療と効果的な処置がなく、患者は病気の発病から3から10年以内に通常死に至る(米国特許No.6607,758B2を参照し、この参照により本明細書中に完全に組み込まれる)。
【0047】
アルツハイマー病及び他のアミロイド症で起こる、アミロイドの形成、沈着、蓄積、及び/又は残留を停止させ又は逆転させる治療法のための新たな化合物又は薬剤が、従って切に必要とされている。
【0048】
<アルツハイマー病の治療標的としてのアミロイド>
アルツハイマー病は、β−アミロイドタンパク質、Aβ又はβ/A4と称される39−43アミノ酸ペプチドの沈着と蓄積によって特徴づけられる。Aβはβ−アミロイド前駆体タンパク質(APP又はβ−APP)と称されるより大きな前駆体タンパク質に由来し、それはいくつかのオルターナティブスプライシングによる変異体を有する。最も多量にあるβPPsの形態は695、751及び770アミノ酸からなるタンパク質を含む。
【0049】
小さなAβペプチドは、アルツハイマー病の患者の脳中にある「プラーク」のアミロイド沈着を作り出す主要な構成成分である。さらに、アルツハイマー病は、神経細胞の細胞質中に異常に蓄積する対になったらせん状の線維からなる多数の神経線維「濃縮体」の存在によって特徴づけられる。アルツハイマー病の病理学的特徴は、従って、プラークの中心核に沈着するアミロイドを有する「プラーク」及び「濃縮体」の存在である。アルツハイマー病の脳に見出される他の主要な病変の型は、脳の実質中及び脳の外側に存在する髄膜血管壁中の両者に見られる血管壁中のアミロイドの蓄積である。血管壁に局在するアミロイド沈着は、脳血管アミロイド又はコンゴレッド親和性血管障害と称する。
【0050】
アルツハイマー病中のアミロイドの重要性、並びに該病気の「プラーク」及び「濃縮体」の特徴が該病気の原因であるのか若しくは単なる結果であるのかどうかについての科学的議論が長年にわたり続いてきた。最近数年間の中で、研究によると、アミロイドは真にアルツハイマー病の原因因子であり、単なる無実の傍観者として見なされるべきではないと示唆される。細胞培養中でのアルツハイマーAβタンパク質は、短期間の間で神経細胞の変性を引き起こすことが示された。研究では、神経毒性効果を担っているのは、全てのアミロイドの特徴である線維構造(主としてβプリーツシート二次構造からなる)だと示唆している。Aβはまた、海馬のスライス培養で神経毒性があることが見出され、トランスジェニックマウスで神経細胞死を誘導することが分かった。ラット脳へのアルツハイマーAβの注入はまた、記憶障害及び神経機能障害を引き起こす。
【0051】
おそらく、Aβアミロイドがアルツハイマー病の病理に直接関与するとする最も説得力のある証拠は遺伝学的研究から来ている。Aβの生産が前駆体であるベータアミロイド前駆タンパク質をコードする遺伝子の変異から生じていることが発見されてきた。家族性アルツハイマー病の早期発症を引き起こすベータアミロイド前駆体タンパク質遺伝子の変異の同定が、アミロイドが本病気の根底にある病理プロセスの中心であるとする最も強い議論である。報告された4つの病気を引き起こす変異が発見され、それが家族性アルツハイマー病を引き起こすAβの重要性を実証する。これらの研究の全ては、ヒト患者の脳で線維状Aβの形成、沈着、蓄積及び/又は残留を減少し、排除し、又は予防する薬剤を提供することが、効果的な治療に役立つと信じられることを示唆している(米国特許No.6,607,758B2を参照)。
【0052】
5つの異なるタンパク質及びペプチドから形成されるアミロイド線維を分解するナットウキナーゼの能力を試験する実験が行われた。最初のサンプルはAβ40線維であった。なぜなら、アミロイドプラークの形成がアルツハイマー病の病理学的特性であり、並びに、Aβ40はヒトアミロイド前駆タンパク質の主要な切断産物及びアミロイドプラークの主要な構成成分の一つであるからだ。2つ目のサンプルは、糖尿病の患者に繰り返しインスリンを注射することが注射局在アミロイド症を引き起こしうるので、インスリン線維である。3つ目のサンプルは、プリオンがプリオン病を担う病原体であるので、プリオンペプチド線維である。ヒトプリオン配列(108−144)に対応するプリオンペプチドが、以前の観察ではそれがアミロイド構造を形成する最も可能性のある領域であるので、アミロイド線維を生産するために合成された。ヒトプリオンタンパク質は129番目の位置にMet又はValを有する。結果として生じるアミロイド線維が試験試薬であるチオフラビンT(ThT)でより強い蛍光シグナルを与えるので、Valを含む配列が選ばれた(Hsu et al.、(2009)「バチルス・スブチリスナットウ由来のナットウキナーゼのアミロイド分解能力」J.Agric.Food Chem.57(2)、pp503−508、この参照により本明細書中に完全に組み込まれる)。4つ目と5つ目はトランスサイレチンとβ2−ミクログロブリンである。
【実施例】
【0053】
本発明の範囲を限定する意図はなしに、本発明の実施形態による代表的な器具、装置、方法、及びそれに関連する結果が以下に与えられる。タイトル又はサブタイトルが読み手の便宜のために実施例中に使用され得ることに注意をするが、それは本発明の範囲を限定すべきものではない。さらに、ある種の理論が本明細書中で提案され開示される。しかしながら、それが正しいものであるか誤ったものであるかに関わらず、任意の特異的理論又は作用の図式に関わることなく本発明が本発明に沿って実行される限り、本発明の範囲を限定するべきものではない。
【0054】
<材料と方法>
<ナットウキナーゼの生産と精製>
バチルス・スブチリスナットウは、商業的に流通している製品から単離され4℃においてNB斜面培養で維持された。ナットウキナーゼの生産は7リッターの発酵槽(Bioflo 110モジュラー卓上発酵槽、New Brunswick Scientific、NJ、USA)中で、以前記載された方法に基づいて行われた。発酵のパラメーターは以下に記す。可動範囲は5リットルの5%(w/v)豆乳(5リットルの水中に250gの大豆粉末)、通気速度は1.0容量/容量/分で、攪拌速度800rpm、及び気温は37℃である。全ての以下の工程は4℃である。28時間後、上澄み液が12,000gで遠心分離することで回収され、10kDaでカットオフするアミコンウルトラ膜で濃縮された。濃縮された酵素溶液は、320mlのHiPrep26/60セファクリルS−100高分解能ゲル(アマシャムバイオサイエンス)で充填されたゲルろ過カラム(2.6x60cm)にアプライされた。そしてそれは、50mMリン酸ナトリウム及び150mM NaCl、pH7.0の移動相で、流速0.5mL/minである。1ミリリットルの画分が回収され、ナットウキナーゼの活性があり、15%SDS−PAGEでシングルバンドを示すものがプールされた。ナットウキナーゼの活性は基質としてS2251(H−D−Val−Leu−Lys−pNA;シグマ)を使った発色方法により測定された。
【0055】
<ペプチド合成>
ペプチドAβ40(DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVV;配列ID番号:1)及び129番目の位置にValを有する108−144のヒトプリオンペプチド配列(huPrPと略記する)(Ac−NMKHMAGAAAAGAVVGGLGGYVLGSAMSRPIIHFGSD−NH2;配列ID番号:2)は、PS3ペプチド合成機(ライニン)上でFmoc−ポリアミド法により合成された。全長タンパク質の立体配置を模倣するために、huPrPペプチドのN末端はアセチル化(Ac−)され、C末端はアミド化(−NH2)されている。プレロードされたFmoc−Val−Wang樹脂(置換0.47mmol/g)は、アナスペックInc,から購入され、Aβ40の合成に使用された。リンクアミドAM樹脂(置換0.74mmol/g)は、ノババイオケムから購入され、huPrPの合成に使用された。Fmoc−アミノ酸派生物(0.4mmol)は、4.45%(v/v)N−メチルモルフォリンを含むジメチルフォルムアミド(DMF)中で0.4mmolのベンゾトリアゾル−1−イル−オキシ−トリス−ピロリジノ−フォスフォニウムヘキサフルオロフォスフェートを使った0.1mmolの樹脂に結合された。huPrPのN末端のアセチル化は、合成過程中でアミノ酸派生物を使う代わりに、0.4mmolの無水酢酸を使って行われた。Fmoc切断は、DMF中で20%(v/v)ピペリジンを使って行われた。9.4mLのトリフルオロ酢酸、0.1mLのトリイソプロピルシラン、0.25mLの水及び0.25mLのエタンジチオールの混合物で室温1−2時間の間攪拌することで、ペプチドは該樹脂から切り離され、3倍容量の氷冷メチルt−ブチルエーテルで沈殿させ、4℃で10分間2000gで遠心分離された。ペレットはさらに2回メチルt−ブチルエーテルで洗浄され真空乾燥された。結果としてできた白色の粉末は、VydacC18カラム(10mmx250mm)及び0.1%トリフルオロ酢酸(v/v)を含むアセトニトリル−水混合物を使った逆相HPLCによって精製された。最終産物は、マトリックス支援レーザー脱離イオン(MALDI)質量分析装置で解析された。望まれる生産物を含んだ画分は凍結乾燥され−20℃で保管された。
【0056】
<アミロイド線維の調製>
Aβ40線維形成のために、500μM Aβ40保存液が75%トリフルオロエタノール中に調製された。ペプチド濃度は275nmの吸光度で定量された。線維を形成するために、保存液は、20mMリン酸ナトリウム緩衝液、150mM KCl、pH7.0中で25μMに希釈され、25℃で約2週間インキュベートされた。huPrP線維は、huPrPペプチドを20mM NaOAc、140mM NaCl、pH3.7の溶液中に最終濃度50μMで溶解し、該溶液を25℃で約1週間インキュベートすることで調製された。インスリン線維を得るためには、ウシインスリン(シグマ)は希塩酸(pH2.1)中に2.5mg/mLの濃度で溶解され、60℃で約2日間インキュベートされた。
【0057】
血漿からのヒトトランスサイレチン(TTR)及び尿からのヒトβ2−ミクログロブリン(β2−M)はシグマから購入した。TTRが線維を形成するためには、4mg/mlのTTRはまず、pH7.4の緩衝液(10mMリン酸、100mM KCl、1mM EDTA)に溶解し、次にpH4.4の緩衝液(50mM NaOAc、100mM KCl)で0.2mg/mlに希釈し、37℃で3日間インキュベートされた。β2−M線維は、pH2.5の緩衝液(25mM NaOAc、25mMリン酸、0.05% NaN3)中でβ2−Mを84μMの濃度に溶解されることで調製され、37℃において250rpmで攪拌しながら1日間インキュベートされた。
【0058】
線維形成は、円二色性分光法を用いて218nmの負の楕円率の出現、又は蛍光分光法を用いてThTの結合による蛍光発光によりモニターされた。
【0059】
<円二色性(CD)分光法>
それぞれの試料は1−mmの石英セル中に配置され、200と250nmの間のCDスペクトルがJ−715CDスペクトルメーター(JASCO、日本)で記録された。バンド間隔は2nmでセットされ、ステップ分解能は0.05nmである。それぞれの試料に対して二回のスキャンが平均化された。
【0060】
<チオフラビンT結合アッセイ>
チオフラビンT(ThT)結合アッセイは、アミロイド線維に結合することでThTにおける蛍光強度変化を測定する。チオフラビンT蛍光定量法は、アミロイド線維の存在の同定に頻繁に使用されてきた。チオフラビンTは線維状アミロイドタンパク質に結合することが知られ、蛍光の減少又は増加がアミロイド線維の量の減少又は増加と相関することが以前から示されてきた。37℃でインキュベートされたアルツハイマーAβ(1−40)タンパク質は、自発的にアミロイド線維を形成する傾向があり、時間と共に量が増加する。アルツハイマー病及び他のアミロイド症では、アミロイド線維の成長はアミロイドタンパク質の自己相互作用(すなわちAβ−Aβ相互作用)に関わると信じられている。
【0061】
5mMのThT(シグマ)の保存液は、2mgの染料を140mM NaCl、pH8.5を含む100mMリン酸緩衝液1.25mL中に溶解し、該溶液を0.22μmミリポアフィルターを通過させて調製される。新鮮な希釈標準溶液は、最終染料濃度を200μMに調節することで調製された。30μLの試料は、30μLの200μM ThT染料溶液と室温で1分間混合し、460と600nmの間の蛍光発色が442nmで励起したFP−750分光蛍光光度計(JASCO、日本)上で、3−mm光路長長方形キュベット中で測定された。
【0062】
<プロテアーゼ溶液>
本研究中で使用される全てのプロテアーゼの保存液(ナットウキナーゼ以外は全てシグマから購入)は、49μMの濃度で調製され、ブラッドフォードアッセイ(バイオラド)で定量された。プロテアーゼ溶液は、販売元の指導に基づき、異なる緩衝液中に調製された。ナットウキナーゼとサブチリシンカールスバーグは、150mM NaCl、pH7を含む50mMリン酸緩衝液中に溶解された。プロテイナーゼKは、10mM Tris−HCl、pH7緩衝液中に溶解された。トリプシンは1mM HClに溶解され、ヒトプラスミンは蒸留水に溶解された。他のプロテアーゼと比較するために、ナットウキナーゼはpH7緩衝液に溶解された。トランスサイレチン及びβ2−ミクログロブリンを分解するため、ナットウキナーゼは同じ緩衝液であるがpH7.4のものに溶解された。
【0063】
<ナットウキナーゼによる異なる種類のアミロイド線維の分解>
準備されたAβ40、huPrP、インスリン線維は、室温において20分間14,000gで遠心分離することで回収され、150mM NaCl、pH7を含む50mMリン酸緩衝液中に懸濁された。より均質な線維を得るために、該線維溶液は使用前に10分間超音波浴にインキュベートされた。酵素反応のため、1μLのナットウキナーゼ溶液は179μLのそれぞれの種類の線維溶液と混合され(最終的なナットウキナーゼの濃度:0.27μM)、該混合液は40℃で1時間インキュベートされた。線維の消化はCD分光法及び/又はThT結合アッセイによって測定された。トランスサイレチン(TTR)及びβ2−M線維では、該消化反応は生理学的条件下(pH7.4及び37℃)で、行われた。TTR線維は、室温において20分間14,000gで遠心分離することで回収され、150mM NaCl、pH7.4を含む50mMリン酸緩衝液中に懸濁された。β2−M線維は遠心分離で回収することができなかった。β2−M線維溶液は、該酵素を加える前に、pH7.4の50mMリン酸緩衝液中に3倍希釈された。
【0064】
<ナットウキナーゼのアミロイド分解活性における温度及びpHの影響>
この実験では、より多量の線維が必要とされるので、インスリン線維がナットウキナーゼ反応の基質として使用された。インスリンは商業的に入手可能で及びインスリン線維を作製するのにたった2日しかかからない。ナットウキナーゼ活性における温度の影響は、pH7で30℃から60℃までの様々な温度で消化することにより測定された。インスリン線維の分解はThT結合アッセイを使ってモニターされた。ナットウキナーゼ活性におけるpHの効果を試験するために、インスリン線維は以下の緩衝液に懸濁された。50mM NaOAc及び150mM NaCl(pH5)、50mMリン酸及び150mM NaCl(pH6及び7)、50mM Tris−HCl及び150mM NaCl(pH8及び9)、50mMグリシン−NaOH及び150mM NaCl(pH10)。反応は40℃で実施された。ナットウキナーゼ活性は、ThT結合アッセイがpH感受性なので、CD分光法により測定された。
【0065】
<異なるプロテアーゼのAβ線維分解活性の比較>
酵素反応は、ナットウキナーゼ、プロテイナーゼK、サブチリシンカールスバーグ、トリプシン又はプラスミンを使って37℃でpH7にて1時間行われた。反応混合液は1μLのプロテアーゼ保存液(49μM)及び179μLのAβ線維溶液を含み、ThT結合アッセイで試験するために、30μLの混合液が15分おきに分取された。
【0066】
<ナットウキナーゼによるAβ線維分解率の測定>
線維状のAβペプチド濃度は、全体のAβ濃度から遠心分離後上澄み画分中にある凝集していないAβペプチド濃度を引き算することで測定された。該線維は150mM NaCl、pH7.4を含む50mMリン酸緩衝液中に懸濁された。ナットウキナーゼは異なる酵素濃度で線維溶液中に加えられ、37℃でインキュベートされた。異なるインキュベーション時間の後、残存する線維の量がThT結合アッセイにより測定された。線維分解率は、線維分解の時間経過から計算された。
【0067】
<スクレイピー感染ハムスター脳の消化>
263K系統のプリオン(Caughy博士の研究室より提供された)に感染したハムスターの脳のホモジネート(10%)は、pH10グリシン/NaOH緩衝液(50mMグリシン、150mM NaCl)で4%に希釈され、50μg/mlのナットウキナーゼを使って50℃で消化された。該消化は7時間行われ、反応液は25μg/mlのナットウキナーゼを1時間ごとにさらに加えられた。最初の反応液の容量は100μLであった。分解の効果をアッセイするために、10μLの試料が1時間おきに分取され、反応は1mMPMSFで停止された。
【0068】
<ウエスタンブロット及びPrPScの検出>
SDS−PAGEに先立ち、消化された263K脳ホモジネートは、2% SDS及び1%2−メルカプトエタノールを含むサンプルローディング緩衝液で100℃10分間沸騰させられた。プリオンタンパク質(PrPSc)は、一次抗体1E4(Abcam、合成されたウシプリオンペプチド108−119で作製された)を0.25μg/ml、及び0.33μg/mlの西洋わさびペルオキシダーゼを抱合するヤギ抗マウスIgG(パーキンエルマ―)を使って検出された。シグナルは富士医療用X線フィルムで記録された。
【0069】
<実施例1:ナットウキナーゼはペプチドから形成されたアミロイド線維を分解及び減少させる>
ナットウキナーゼはゲルろ過クロマトグラフィーによって液体培養から精製された。ナットウキナーゼを含む画分は活性アッセイを用いて同定され、そして、SDS−PAGE上の27.7kDaのバンドの存在を検査された。該バンドはN末端シークエンス解析により分析された。純粋なタンパク質を示す画分が集められ凍結乾燥された(図1)。 図1は矢印で指し示すように精製されたナットウキナーゼの15%SDS−PAGEを示す。
【0070】
ナットウキナーゼがアミロイド分解活性を有するかどうか測定するために、合成Aβ40ペプチドから形成されたAβ40線維、合成ヒトプリオンペプチド(129番目にバリンを有する108−144のヒトプリオンタンパク質アミノ酸を含む)から形成されたhuPrP線維、精製したウシインスリンから形成されたインスリン線維が使用された。40℃でpH7において、ナットウキナーゼは3つの線維全てを分解した。それは、1時間消化後、CDスペクトル中で218nmにおける負の楕円率の振幅の減少によって示され、そのことはβプリーツシート構造の消失を示す(図2)。図2では、酵素添加直後のスペクトルが線(i)で示される。1及び48時間消化した試料のスペクトルがそれぞれ線(ii)及び線(iii)で示される。
【0071】
同様な結果がThT結合アッセイを使用して得られた。その中で、487nmにおけるThT蛍光強度の減少は、ナットウキナーゼ消化後のアミロイド構造の消失を示唆している(図3)。図3は、ThT結合アッセイを使った40℃でpH7におけるナットウキナーゼによる消化前後のAβ40線維(A)、huPrP線維(B)、及びインスリン線維(C)の蛍光発光スペクトルを示す。酵素添加直後のスペクトルが線(i)で示される。1及び48時間消化した試料のスペクトルがそれぞれ線(ii)及び線(iii)で示される。
【0072】
これらの結果は、ナットウキナーゼが3つの異なるアミロイド線維の全てを分解できることを実証する。
【0073】
ナットウキナーゼが、前形成されたアルツハイマー病及びプリオン病のアミロイド線維の「溶解」又は「破壊」を引き起こすことができるという発見は、器官及び/又は組織に相当なアミロイド沈着を既に有する患者に使用され得る任意の潜在的抗アミロイド薬剤にとって重要である。例えば、中期から後期のステージにあるアルツハイマー病の患者は、神経プラーク及び脳血管アミロイド沈着の両者を一部として、脳に多量のアミロイド沈着を有する。前もって存在するアミロイドの溶解を引き起こす天然の治療薬は、これらの患者に使用するのに有利である。
【0074】
<実施例2:ナットウキナーゼはpH及び温度依存的にアミロイドを消化する>
ナットウキナーゼの線維分解活性は、中性及びアルカリpH(7−12)において安定であることが知られ、pH5以下では不安定である。ナットウキナーゼのアミロイド分解活性におけるpHの効果を試験するために、40℃で広い範囲のpH値(pH5−10)においてインスリン線維のタンパク質消化が行われた。図4は異なるpHでのナットウキナーゼによるインスリン線維の分解を示す。消化は40℃で行われ、CD分光法でモニターされた。図4Aは残存するアミロイド線維を測定することでモニターされた分解の時間経過を示し、図4Bは1時間消化のデータを使って計算された異なるpHにおけるアミロイド分解のパーセンテージを示す。100%は、処置前の試料の218nmにおけるCD楕円率として定義する。値は2回の実験結果の平均±SEMである。結果は、ナットウキナーゼ活性はpHの上昇に伴って穏やかに増加し、テストした範囲ではpH10で最大の活性に至ることを示した。pH5ではナットウキナーゼは活性が全くなかった。
【0075】
さらに、ナットウキナーゼの線維分解活性は60℃以上で次第に失われることが報告されてきた。我々は従って、pH7で異なる温度においてナットウキナーゼのアミロイド分解活性を試験した。図5は、30から60℃の間での異なる温度におけるナットウキナーゼによるインスリン線維の分解を示す。該消化はpH7のリン酸緩衝液中で行われ、ThT結合アッセイを使ってモニターされた。図5Aは、残存するアミロイド線維を測定することでモニターされた分解の時間経過である。図5Bは、1時間消化のデータを使って計算された異なる温度におけるアミロイド分解のパーセンテージを示す。100%は処置前の試料の487nmにおける蛍光強度として定義する。値は2回の実験結果の平均±SEMである。
【0076】
図5Aに示されるように、60℃においてインスリン線維は最初の数分間に急速に分解される。しかし、おそらくナットウキナーゼの不活性化又は自己消化のために、その後消化は停止する。50℃においては、急速な初期消化が観察され、引き続きゆっくり消化される。一方、40℃においては初期の反応はより早くはないが、消化は継続し、他の場合よりもより完全に消化された。
【0077】
<実施例3:アミロイドの消化においてナットウキナーゼはプラスミンよりも効果的である>
ナットウキナーゼと他のいくつかのセリンプロテアーゼが、Aβ線維を37℃でpH7において消化する能力が試験された。使用されたプロテアーゼは、プロテイナーゼK(ケラチン分解酵素でプリオン病の研究に使用されるサブチリシン様セリンプロテアーゼ)、サブチリシンカールスバーグ(サブチリシン様セリンプロテアーゼ)、トリプシン、及びプラスミン(線維分解セリンプロテアーゼ)である。図6はAβ40線維分解の、プロテイナーゼK、ナットウキナーゼ、サブチリシンカールスバーグ、トリプシン及びプラスミンによる比較の結果を示す。該消化は37℃でpH7において行われ、15分ごとのThT結合アッセイによりモニターされた。100%はインキュベーション前のコントロールの487nmにおける蛍光強度として定義された。
【0078】
図6に示されるように、37℃でpH7においてプロテイナーゼK及びサブチリシンカールスバーグは、Aβ線維を最も高率で分解した。加水分解率はナットウキナーゼがより遅く、トリプシンはずっと遅く、一方プラスミンは効果がなかった。体温を模倣するために、該消化はプロテイナーゼK、サブチリシンカールスバーグ、又はナットウキナーゼの最適な温度で行われなかったが、これらのプロテアーゼのアミロイド分解活性はトリプシン及びプラスミンのものよりずっと大きかった。プラスミンはAβモノマー及び凝集したAβを分解することができることが示されてきた。しかし、その率(0.003s−1)は凝集したフィブリン(0.064s−1)を分解する率よりも20倍低く、Aβモノマー(0.48s−1)を分解する率よりも160倍低い。我々の研究では、同じ反応条件のもと、ナットウキナーゼはアミロイドを分断することにおいてプラスミンよりもより効率的であった。ナットウキナーゼによるAβ線維分解率は、37℃でpH7.4において0.015s−1であった(図7)。図7はAβ線維分解におけるナットウキナーゼの濃度依存を示す。Aβ線維(44μM)は、37℃でpH7.4のリン酸緩衝液中で、ナットウキナーゼ(最終酵素濃度、0.12、0.18、0.24、0.30、又は0.36μM)と共にインキュベートされた。値は2回の実験結果の平均±SEMである。
【0079】
<実施例4:ナットウキナーゼは精製したヒトタンパク質から形成されたアミロイド線維を消化する>
37℃でpH7.4の条件において、TTR線維は1時間でナットウキナーゼによりほぼ完全に分解された。β2−M線維に関しては、2時間でほぼ完全に分解された(図8)。TTR及びβ2−M線維の蛍光シグナルは時間と共に減少したが、ナットウキナーゼの線維分解能力は有意であった。図8A−Bは、37℃でpH7.4におけるナットウキナーゼによるTTR線維及びβ2−M線維の分解を示す。該消化は487nmにおけるThT蛍光発光によりモニターされた。100%はThT結合による初期線維の蛍光強度として定義される。値は2回の実験結果の平均±SEMである。
【0080】
<実施例5:ナットウキナーゼはインビボで形成されたプリオンを分解する>
263K系統のプリオンに感染したハムスターの脳ホモジネートが、50℃でpH10において50μg/mlのナットウキナーゼで消化された。ナットウキナーゼは短期間にこの消化の条件で最も効率的に機能するが、この高い分解効率を維持することができない。該ホモジネート中のプリオンを完全に分解するために、ウエスタンブロットのためのある程度の試料を分取した後、1時間ごとに25μg/mlのナットウキナーゼをさらに追加した。図9は、ナットウキナーゼで消化された263K感染の脳ホモジネートのウエスタンブロットの結果を示す。プリオンは1E4抗体で検出された。図9で示されるように、プロテアーゼ抵抗性のプリオンのコア(約30kDa)が徐々に分解された。該消化においてより高濃度のナットウキナーゼを使った場合、プリオンのシグナルは検出されないであろうことが期待された。
【0081】
<ディスカッション>
上記の実験では、ナットウキナーゼのアミロイド分解能を試験するために、Aβ40アミロイド線維、インスリンアミロイド線維、huPrP(108−144のプリオン配列を含む)アミロイド線維、TTRアミロイド線維、及びβ2Mアミロイド線維を含む5種類のインビトロで調製されたアミロイド線維及びインビボで形成されたハムスターのプリオン(263K系統)が使用された。ナットウキナーゼでこれらのアミロイド線維を処理した後、該アミロイド量は減少し(図2、3、8、及び9)、それはナットウキナーゼの一般的なアミロイド分解能力を示している。
【0082】
ナットウキナーゼのこのアミロイド分解能力は、それがアミロイド関連の病気の治療に有益であり得ることを示唆する。バチルス・リチェニフォルミス(Bacillus Licheniformis)により生産される羽毛分解酵素ケラチナーゼ(ベルサザイム)は、加熱前のプリオンを分解することができ、肉や骨料理中のプリオンを不活性化及び医療器具の汚染除去のために有益であるが、経口投与できない。免疫グロブリン軽鎖、トランスサイレチン、β2−ミクログロブリン、血清アミロイドAタンパク質、Aβペプチド、及びインスリンを含む多くのタンパク質及びペプチドは、体内にアミロイド沈着を形成することができる。Aβペプチドは、低密度リポタンパク質受容体関連タンパク質及びP糖タンパク質の助けを借りて、脳から血管に移動することができる。さらに、プリオン病は輸血により伝達され得、それは血液中でのプリオンの存在を示唆する。アミロイド線維は不溶性でプロテアーゼによって容易に分解できない。安全に経口投与されアミロイド線維を分解する酵素の発見は、アミロイド関連の病気の治療に非常に有益であり得る。ナットウキナーゼは血液凝固を溶解するだけではなく、アミロイド線維をも分解する。我々のアミロイド分解研究では、それが中性のpHで体温において活性があることを実証した。ラット、イヌ、ヒトにおける以前の結果によると、ナットウキナーゼが経口投与されると血液循環に入ることが示唆され、従って身体中の様々な場所のアミロイド沈着を除去する潜在能力がある。さらに、プリオン病は汚染された外科器具の使用により伝達され得る。ナットウキナーゼは50℃の温度を許容でき、pH10といった塩基性の条件下でより良く機能するので、器具のプリオン汚染除去に有益であろうことを示唆する(図9)。
【0083】
結論として、ナットウキナーゼは数百年にわたりヒトと動物により食されてきた食用酵素である。ヒト又はヒトによって使用され得る任意の物にナットウキナーゼを使用することは安全である。ナットウキナーゼは身体中の様々なアミロイド線維を消化し及び除去するのに使用され得る。外科器具又は動物飼料から感染性のプリオンタンパク質を除去するのに使用され得る。ナットウキナーゼは血液製剤からプリオン又はアミロイド線維を除去し、血液透析チューブにおけるアミロイド沈殿を予防するためにも使用され得る。
【産業上の利用可能性】
【0084】
<本発明の治療応用のさらなる側面と利用化>
患者に投与する前に、ナットウキナーゼは一つ又は複数の医薬的に許容される担体、希釈剤、又は賦形剤を有する医薬組成物中に処方され得る。本発明の一つの実施形態では、アルツハイマー病、プリオン病、二型糖尿病又は任意の他のアミロイド症を有する患者は、商業的に入手可能なナットウキナーゼを丸剤、錠剤、カプレット、ソフト及びハードのゼラチンカプセル、トローチ剤、べジキャップ、液滴、溶液、シロップ、ティーバッグ、及び/又は樹皮粉末形態中に入れて経口的に摂取し得る。
【0085】
別の実施形態では、任意の形態で商業的に入手されたナットウキナーゼは、適切な担体、賦形剤、及び希釈剤を使ってさらに調節される。それらは、ラクトース、デキストロース、スクロース、ソービトル、マニトール、スターチ、アカシアゴム、リン酸カルシウム、アルギン酸塩、トラガカント、ゼラチン、ケイ酸カルシウム、微結晶性セルロース、ポリビニルピロリドン、セルロース、水シロップ、メチルセルロース、メチル及びプロピルヒドロキシ安息香酸、タルク、ステアリン酸マグネシウム、及びミネラルオイルを含む。該処方はさらに、潤滑剤、湿潤剤、乳化及び懸濁剤、保存剤、甘味剤、又は香味剤を含み得る。ナットウキナーゼを含む組成物は、患者に投与された後、有効成分が急速な、持続した、又は遅延した反応を提供できるように処方され得る。ナットウキナーゼの組成物は好ましくは単位容量形態で処方され、それぞれの容量は1から約10,000mgのナットウキナーゼを含み、より通常では250又は500から約1,000又は2,000mgを含む。しかしながら、投与される治療容量は、処置される臨床状態、アミロイドの蓄積により影響を受ける又は影響を受けることが疑われる器官又は組織、選択された投与経路を含む相当する状況を考慮して医者により決定されるであろうことが理解される。従って、上記容量範囲はいかなる状況でも発明の範囲を限定する意図ではない。「単位容量形態」という用語は、ヒト被検体及び他の哺乳類に対しての単位容量として適した物理的に分離した単位を指す。それぞれの単位は、適した医薬担体と関連して望ましい治療効果を奏するよう計算された活性ナットウキナーゼの前もって決定された量を含む。
【0086】
以下の処方例は例証するだけで、任意の状況で発明の範囲を限定する意図ではない。ハードゼラチンカプセルは、500mgのナットウキナーゼ、400mgのスターチ、及び20mgのステアリン酸マグネシウムを使用することで調製され得る。上記成分が混ぜられて、920mg容量でハードゼラチンカプセルに詰められる。
【0087】
錠剤が500mgのナットウキナーゼ、800mgの微結晶セルロース、20mgのヒュームド二酸化ケイ素、及び10mgのステアリン酸を使用して調製される。該組成物は混合され、それぞれ1230mg重量の錠剤を形成するように圧縮される。
【0088】
エアロゾル溶液が、重量比:0.25のナットウキナーゼ、29.75のエタノール、及び70のプロペラント22(クロロジフルオロメタン)を使用して調製される。ナットウキナーゼはエタノールと混合される。該混合物はプロペラント22の一部に加えられ、‐30℃に冷却され、充填器具に移される。必要量がステンレスの鋼鉄製容器に詰められ、残りのプロペラントで希釈される。(上記リストした)該値の単位が容器に張り付けられる。そのようなエアロゾル形態のナットウキナーゼは、エアロゾル又は点鼻薬スプレーを使用することで、脳に関するアミロイドの治療(アルツハイマー病、ダウン症、プリオン病などのような)に有益であり得る。以前の研究では、これら中枢神経系のアミロイド症において、病理に役割を担うであろう可能な環境因子の侵入の初期形態は、鼻腔を通して外界から由来し得ることを示唆する。
【0089】
錠剤は、240mgのナットウキナーゼ、180mgのスターチ、140mgの微結晶セルロース、16mgのポリビニルピロリドン(水中で10%として)、18mgのカルボキシメチルスターチナトリウム、2mgのステアリン酸マグネシウム、及び2mgのタルク(全体で600mg)を使用して製造される。ナットウキナーゼ、スターチ、及びセルロースは、No.45網目状U.S.ふるいを通過させ徹底的に混合される。ポリビニルピロリドンの溶液は、No.14網目状U.S.ふるいを通過させた残りの粉末と混合される。そのように製造された顆粒は乾燥され、No.18網目状U.S.ふるいを通過させられる。前もってNo.60網目状U.S.ふるいを通過した、カルボキシメチルスターチナトリウム、ステアリン酸マグネシウム、及びタルクは該顆粒に加えられ、混合後に、錠剤製造機でそれぞれが600mg重量の錠剤を生産するように圧縮される。
【0090】
それぞれ160mgの薬剤を含むカプセルが、160mgのナットウキナーゼ、118mgのスターチ、118mgの微結晶セルロース、及び4mgのステアリン酸マグネシウム(総量=400mg)を使って製造される。ナットウキナーゼ、セルロース、及びステアリン酸マグネシウムは混合され、No.45網目状U.S.ふるいを通過させられ、400mgの容量でハードゼラチンカプセルに充填される。
【0091】
それぞれ225mgのナットウキナーゼを含む座薬が、225mgのナットウキナーゼ、2,000mgの飽和脂肪酸グリセリド(総量=2,225mg)を使って製造される。ナットウキナーゼはNo.60網目状U.S.ふるいを通過させられ、必要最小限の熱で前もって溶かされた飽和脂肪酸グリセリド中に懸濁された。該混合物はそれから、名目上2g容量の座薬の型に注がれて、冷却させられる。
【0092】
それぞれ5ml容量で50mgの薬剤を含む懸濁剤が、50mgのナットウキナーゼ、50mgのカルボキシメチルセルロースナトリウム、1.25mlのシロップ、0.10mlの安息香酸溶液、香料、色素、及び総量5mlにするための精製水を使って製造される。該薬剤はNo.45網目状U.S.ふるいを通過させられ、カルボキシメチルセルロースナトリウム及びシロップと混合され、滑らかなペーストを形成する。安息香酸溶液、香料、色素は相当な水で希釈され、攪拌しながら添加される。十分量の水がそれから加えられ、必要容量が生産される。
【0093】
静脈注射の処方が、250mgのナットウキナーゼ、及び1000mgの等張食塩水を使用して調製される。上記成分の溶液が、治療の必要に応じて被検体に1分に1mlの速度で静脈投与される。
【0094】
本発明の一つの実施形態では、ナットウキナーゼは任意の医薬的に許容されるビークルで投与され得る。本明細書中で使用される「医薬的に許容されるビークル」は、限定はされないが、任意の及び全ての溶媒、滅菌した液体を含む。それらは、石油、動物、野菜又は合成起源を含む水及び油で、ピーナッツ油、大豆油、ミネラルオイル、ごま油及びそれに類似するもの、分散媒、塗料、抗細菌及び抗真菌剤、等張及び吸収遅延剤、及び該化合物の活性と両立し及び被検体に生理学的に許容される類似物である。医薬的に許容されるビークルの例は正常食塩水緩衝液(0.15モーラーNaCl)である。医薬的に活性のある物質に対するそのような溶液や薬剤の使用は先行技術によく知られている。補助的な活性のある化合物が該組成物にまた取り込まれ得る。適した医薬賦形剤は、スターチ、グルコース、ラクトース、スクロース、ゼラチン、麦芽、米、小麦粉、チョーク、シリカゲル、炭酸マグネシウム、ステアリン酸ナトリウム、グリセロールモノステアリン酸、タルク、食塩、乾燥スキムミルク、グリセロール、プロピレン、グリコール、水、エタノール、及びそれに類似するものを含む。これらの組成物は、溶液、懸濁液、錠剤、丸剤、カプセル、粉末、除放処方及びそれに類似するものの形態を取り得る。
【0095】
被検体におけるアミロイドの形成、沈着、蓄積、及び/又は残留は、被検体に治療容量でナットウキナーゼを投与することにより阻害される。被検体の用語はアミロイド症が起こり得る生命体を含む意図である。被検体の例は、ヒト、サル、ウシ、イヌ、ヒツジ、ネコ、ネズミ、ラット、及びそのトランスジェニックな種を含む。治療される被検体へのナットウキナーゼの投与は、既知の手順で被検体中のアミロイド症を阻害するのに有効な容量及び期間を用いて行われ得る。治療効果を達成するのに必要なナットウキナーゼの有効量は、被検体中の器官又は組織部位に既に沈着しているアミロイドの量、被検体の年齢、性別及び体重、並びにアミロイド形成、沈着、蓄積、残留を阻害し、及び/又は被検体中の前形成されたアミロイドの溶解を生じるナットウキナーゼの処方の能力に従って変化し得る。投与計画が、従って、最適な治療効果を提供するために調整される。例えば、いくつかの分割された容量が毎日投与され、該容量は治療状況の必要に応じて比例して減少され得る。ナットウキナーゼの効果的な容量範囲の非限定的な実施例は、10から1000mg/kg体重/日、又は10から100mg/kg体重である。
【0096】
ナットウキナーゼ送達の異なる様式が使用され得る。まず、一つの投与経路は経口投与である。代わりに、ナットウキナーゼは、皮下、静脈中、腹腔内の様な注射によって投与される全ての経路のような、他の適した経路によって投与され得る。投与経路に依存して、該活性化合物は、ナットウキナーゼを不活性化し得る酸及び他の天然の状況の作用からナットウキナーゼを保護するための物質でコートされ得る。
【0097】
ナットウキナーゼを投与するためには、その活性化を阻害する物質でコートし又は共に投与することが必要であろう。例えば、ナットウキナーゼは適切な担体、例えばリポソーム又は希釈剤中で被検体に投与され得る。医薬的に許容される希釈剤は、生理食塩水及び水溶性緩衝液を含む。リポソームは、典型的なリポソームと同様にwater−in−oil−in−water型CGFエマルジョンを含む。
【0098】
ナットウキナーゼは非経口的に又は腹腔内にもまた投与され得る。分散媒がグリセロール、液体ポリエチレングリコール及びその混合物、並びに油中に調製され得る。通常の保存及び使用の条件下では、それらの調製物は微生物の成長を阻止する保存料を含み得る。
【0099】
注射による使用に適した医薬組成物は、滅菌水溶液又は分散剤、及び無菌の注射可能な溶液又は分散剤の調製のための滅菌粉末を含む。全ての場合において、該組成物は無菌で、現存する注射器で容易に使用可能な程度に流体でなければならない。それは、製造と保存の条件下において安定で、細菌や真菌のような微生物に汚染しないように保存されなければならない。ビークルは、例えば、水、エタノール、ポリオール(例えばグリセロール、プロピレングリコール、及び液体ポリエチレングリコール、並びにそれに類似するもの)、その適切な混合物、及び植物油を含む溶液又は分散剤であり得る。適切な流動性が、例えば、レシチンのようなコーティングを使用することによって、分散剤の場合は要求される粒子サイズを維持することにより、及び界面活性剤を使用することにより維持され得る。微生物の作用の阻止が、様々な抗細菌剤及び抗真菌剤、例えば、パラベン、クロロブタノール、フェノール、アスコルビン酸、チメローサル、及びそれに類似するものによって達成され得る。多くの場合、組成物中に、等張剤、例えば糖、食塩、又はマニトール及びソービトールの様なポリアルコールを含むことが好まれる。注射可能な組成物の持続的吸収が、組成物中に吸収を遅延させる薬剤、例えばモノステアリン酸アルミニウム又はゼラチンを含むことによりもたらされ得る。
【0100】
滅菌した注射用溶液は、上記に列挙された成分の一つ又はその組み合わせを有する適切な溶媒中に必要量ナットウキナーゼを取り込むことで調製され、引き続きフィルター滅菌され得る。一般的に、分散剤は、ナットウキナーゼを、塩基性の分散媒及び上記に列挙されたものの中から必要とされる他の成分を含む滅菌したビークル中に取り込むことにより調製される。滅菌した注射用溶液の調製のための滅菌粉末の場合、その調製方法は真空乾燥及び凍結乾燥により、その前もって滅菌フィルター処理した溶液から、ナットウキナーゼ及び任意の所望の成分の粉末を生じる。
【0101】
アルツハイマー病、プリオン病、及び他の中枢神経系アミロイド症に対するナットウキナーゼは、血液脳関門を通過するように最適化されるだろう。導入方法は、限定はされないが、全身投与、非経口的投与、すなわち腹腔内、静脈内、口周囲、皮下、筋中、動脈内、皮内、筋中、鼻腔内、硬膜外、及び経口経路を含む。一つの実施形態では、ナットウキナーゼは、脳室内注射により脳脊髄液に直接投与され得る。特別な実施形態では、治療の必要な領域又は組織に局所的にナットウキナーゼを投与することが望まれ得る。このことは、例えば、限定されるわけではないが、手術中の局所的注入、局所的投与、注射で、浸透圧ポンプでカニューレを使った注入により、カテーテルを使って、坐薬を使って、又はインプラントを使って達成され得る。
【0102】
まだ別の実施形態では、ナットウキナーゼは浸透圧ポンプの様な制御された放出システムで送達され得る。まだ別の実施形態で、制御された放出システムは、治療標的、すなわち脳に近接して設置され得、従って、全身投与容量のほんの一部しか必要としない。
【0103】
上記したシステム及び構成成分に関しては、本明細書中で他に特定し又は記述していないが、それらが作られ、組み立てられ又は使用されるそのようなシステム及び構成成分及び方式の作用機構並びに特定事項は、本明細書中に開示された目的に効果を及ぼすために、お互いに及び本明細書中に記載された発明の他の要素と協調的に働き、そしてその全てが当業者の知識の範囲内にあると信じられる。当業者に一般的に知られたことをここで繰り返す一致した試みは、従ってなされていない。
【0104】
本発明の代表的な実施形態の先の記述は、説明及び記載する目的のためだけに提示されており、開示された詳細な形態に徹底的又は発明を限定する意図ではない。多くの修飾及び変異が、上記教示するものに鑑みて可能である。
【0105】
実施形態及び実施例が本発明の原理を説明するために選ばれ及び記述された。当業者が本発明及び様々な実施形態並びに様々な修飾を利用可能なように、その実際の適用は、熟慮された特定の使用に適したものになっている。代替する実施形態は、本発明がその精神及び範囲から離れることなしに関連する当業者に明白なものになっているだろう。従って、本発明の範囲は、本明細書中に記載される先の記載及び代表的実施形態よりも付加された特許請求の範囲により定義される。
【0106】
特許、特許出願及び様々な刊行物を含みうるいくつかの参照は、本発明の記載中に引用され及び議論される。そのような参照の引用及び/又は議論は、本発明の記載を単に明らかにするために提供され、任意のそのような参照が本明細書中に記載された発明の「先行技術」であることを認めるものではない。本明細書中に引用され及び議論された全ての参照は、この参照により完全に、及びそれぞれの参照が参照により個々に取り込まれたかと同じ程度に本明細書中に組み込まれる。
【特許請求の範囲】
【請求項1】
哺乳類被検体中のアルツハイマー病、プリオン病、及び/又は他のアミロイド症における前形成した又は前沈着したアミロイド線維を溶解し又は破壊し、並びに/又はアミロイド形成、沈着、蓄積、又は残留を阻害する方法であって、該方法は、治療的に有効量のナットウキナーゼ及び該被検体中でアルツハイマー病、プリオン病、及び/又は他のアミロイド症を治療するのに効果があると選択された治療容量のナットウキナーゼを含む組成物を該被検体に投与する工程を含む方法。
【請求項2】
該ナットウキナーゼが発酵した大豆食品から抽出される、請求項1記載の方法。
【請求項3】
該アミロイド線維がAβアミロイド線維、プリオン線維、インスリン線維、トランスサイレチン線維、及びβ2−ミクログロブリン線維からなるグループより選択される、請求項1記載の方法。
【請求項4】
該アミロイド線維がアルツハイマー病のAβアミロイド線維及び感染性プリオンPrPScからなるグループより選択される、請求項1記載の方法。
【請求項5】
ナットウキナーゼの該治療容量がアルツハイマー病を治療するのに有効であるとして選択される、請求項4記載の方法。
【請求項6】
ナットウキナーゼの該治療容量がプリオン病を治療するのに有効であるとして選択される、請求項4記載の方法。
【請求項7】
該アミロイド線維がトランスサイレチン、β2−ミクログロブリン、IAPP(アミリン)、及びベータアミロイドからなるグループより選択される、請求項1記載の方法。
【請求項8】
該他のアミロイド症が家族性アミロイド多発ニューロパチー、透析関連アミロイド症、二型糖尿病、及び脳アミロイド血管症からなるグループより選択される、請求項7記載の方法。
【請求項9】
該治療的に有効量のナットウキナーゼが、経口で、エアロゾルスプレーにより、若しくは非経口的に注射又は注入形態で投与される、請求項1記載の方法。
【請求項10】
インビトロのアミロイド環境において、前形成した又は前沈着したアミロイド線維を溶解し又は破壊し、並びに/又はアミロイド形成、沈着、蓄積、又は残留を阻害する方法で、該方法は、治療的に有効量のナットウキナーゼ及びアミロイドを治療するのに効果があると選択された治療容量のナットウキナーゼを含む組成物をインビトロ環境に加えることを含む方法。
【請求項11】
該アミロイドがアルツハイマー病及び/又はプリオン病と関連する、請求項10記載の方法。
【請求項12】
該アミロイドがプリオン病と関連する、請求項10記載の方法。
【請求項13】
該インビトロ環境が医療機器、医薬製剤、及び動物飼料からなるグループより選択された物を含む、請求項10記載の方法。
【請求項14】
該医療機器が外科器具及び血液透析チューブからなるグループより選択される、請求項13記載の方法。
【請求項15】
該医薬製剤が血液製剤である、請求項13記載の方法。
【請求項16】
アミロイド線維とアミロイド線維を分解するために効果的な量のナットウキナーゼを含む組成物とを接触させる工程を含むアミロイド線維の分解を触媒する方法。
【請求項17】
該アミロイド線維がAβアミロイド線維、プリオン線維、インスリン線維、トランスサイレチン線維、β−ミクログロブリン線維、及びその任意の組み合わせからなるグループより選択される、請求項16記載の方法。
【請求項18】
該接触工程の前にその必要に応じて哺乳類被検体に該組成物を投与する工程をさらに含む、請求項16記載の方法。
【請求項19】
該接触工程がプリオンタンパク質に汚染されたことが疑われる物にインビトロ環境で行われる、請求項16記載の方法。
【請求項20】
該物が医療機器、医薬製剤、及び動物飼料からなるグループより選択される、請求項19記載の方法。
【請求項1】
哺乳類被検体中のアルツハイマー病、プリオン病、及び/又は他のアミロイド症における前形成した又は前沈着したアミロイド線維を溶解し又は破壊し、並びに/又はアミロイド形成、沈着、蓄積、又は残留を阻害する方法であって、該方法は、治療的に有効量のナットウキナーゼ及び該被検体中でアルツハイマー病、プリオン病、及び/又は他のアミロイド症を治療するのに効果があると選択された治療容量のナットウキナーゼを含む組成物を該被検体に投与する工程を含む方法。
【請求項2】
該ナットウキナーゼが発酵した大豆食品から抽出される、請求項1記載の方法。
【請求項3】
該アミロイド線維がAβアミロイド線維、プリオン線維、インスリン線維、トランスサイレチン線維、及びβ2−ミクログロブリン線維からなるグループより選択される、請求項1記載の方法。
【請求項4】
該アミロイド線維がアルツハイマー病のAβアミロイド線維及び感染性プリオンPrPScからなるグループより選択される、請求項1記載の方法。
【請求項5】
ナットウキナーゼの該治療容量がアルツハイマー病を治療するのに有効であるとして選択される、請求項4記載の方法。
【請求項6】
ナットウキナーゼの該治療容量がプリオン病を治療するのに有効であるとして選択される、請求項4記載の方法。
【請求項7】
該アミロイド線維がトランスサイレチン、β2−ミクログロブリン、IAPP(アミリン)、及びベータアミロイドからなるグループより選択される、請求項1記載の方法。
【請求項8】
該他のアミロイド症が家族性アミロイド多発ニューロパチー、透析関連アミロイド症、二型糖尿病、及び脳アミロイド血管症からなるグループより選択される、請求項7記載の方法。
【請求項9】
該治療的に有効量のナットウキナーゼが、経口で、エアロゾルスプレーにより、若しくは非経口的に注射又は注入形態で投与される、請求項1記載の方法。
【請求項10】
インビトロのアミロイド環境において、前形成した又は前沈着したアミロイド線維を溶解し又は破壊し、並びに/又はアミロイド形成、沈着、蓄積、又は残留を阻害する方法で、該方法は、治療的に有効量のナットウキナーゼ及びアミロイドを治療するのに効果があると選択された治療容量のナットウキナーゼを含む組成物をインビトロ環境に加えることを含む方法。
【請求項11】
該アミロイドがアルツハイマー病及び/又はプリオン病と関連する、請求項10記載の方法。
【請求項12】
該アミロイドがプリオン病と関連する、請求項10記載の方法。
【請求項13】
該インビトロ環境が医療機器、医薬製剤、及び動物飼料からなるグループより選択された物を含む、請求項10記載の方法。
【請求項14】
該医療機器が外科器具及び血液透析チューブからなるグループより選択される、請求項13記載の方法。
【請求項15】
該医薬製剤が血液製剤である、請求項13記載の方法。
【請求項16】
アミロイド線維とアミロイド線維を分解するために効果的な量のナットウキナーゼを含む組成物とを接触させる工程を含むアミロイド線維の分解を触媒する方法。
【請求項17】
該アミロイド線維がAβアミロイド線維、プリオン線維、インスリン線維、トランスサイレチン線維、β−ミクログロブリン線維、及びその任意の組み合わせからなるグループより選択される、請求項16記載の方法。
【請求項18】
該接触工程の前にその必要に応じて哺乳類被検体に該組成物を投与する工程をさらに含む、請求項16記載の方法。
【請求項19】
該接触工程がプリオンタンパク質に汚染されたことが疑われる物にインビトロ環境で行われる、請求項16記載の方法。
【請求項20】
該物が医療機器、医薬製剤、及び動物飼料からなるグループより選択される、請求項19記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2010−120942(P2010−120942A)
【公開日】平成22年6月3日(2010.6.3)
【国際特許分類】
【外国語出願】
【出願番号】特願2009−265701(P2009−265701)
【出願日】平成21年11月20日(2009.11.20)
【出願人】(596118493)アカデミア シニカ (33)
【氏名又は名称原語表記】ACADEMIA SINICA
【Fターム(参考)】
【公開日】平成22年6月3日(2010.6.3)
【国際特許分類】
【出願番号】特願2009−265701(P2009−265701)
【出願日】平成21年11月20日(2009.11.20)
【出願人】(596118493)アカデミア シニカ (33)
【氏名又は名称原語表記】ACADEMIA SINICA
【Fターム(参考)】
[ Back to top ]

