アルツハイマー病の診断のための繊維芽細胞成長パターン
アルツハイマー病を診断する方法が提供される。少なくとも5つの方法の診断的測定が示される:方法1:集積スコア;方法2:凝集の数あたりの平均凝集面積;方法3:細胞遊走分析;方法4:フラクタル分析;方法5:空隙性分析。ある実施形態において、対象の皮膚のサンプルが、繊維芽細胞のネットワークを提供し、それは撮像され、画像のフラクタル次元が算出される。フラクタル次元は、年齢が一致するコントロール(非アルツハイマー病細胞)データベースに対して比較されて、対照がアルツハイマー病を有するか否かが決定される。繊維芽細胞のネットワークは、マトリックス、例えば、タンパク質中で培養されてよい。
【発明の詳細な説明】
【発明の概要】
【0001】
本発明は、2009年10月2日出願の米国仮出願61/248,368、2010年5月13日出願の米国仮出願61/344,045、2010年7月8日出願の米国仮出願61/362,518および2010年7月19日出願の米国仮出願61/365,545の優先権を主張するものであり、それらの開示は、それらの全体において参照することによりここに組み込まれる。
【0002】
[発明の分野]
本発明は、バイオマーカーとして繊維芽細胞成長パターンを使用するアルツハイマー病を診断する方法に関する。
【0003】
[発明の背景]
アルツハイマー病は、神経変性障害であり、進行性の記憶力および認知機能の低下により特徴づけられる。500万人を超えるアメリカ人が、進行的な不治の病と共に生きていると推定される。アルツハイマー病は、脳細胞を破壊し、記憶障害と生活の質を低下する思考および行動の問題を引き起こす。ADには、既知の治療法がないが、症状の治療は、ADを患う100万人の人々および彼らの家族の生活の質を改善できる。ADの早期診断は、生活の質を最大にする選択を行うための時間を患者に与え、未知の問題についての不安を減少し、未来について計画するためのより多くの時間を与え、治療からの利益のよりよい機会を提供する。
【0004】
アルツハイマー病を診断するための高感受性であり、且つ高度に特異的な試験の必要性が存在する。本発明者らは、これまでの既知の診断試験に比べて高感受性であり、且つ高度に特異的な様式におけるアルツハイマー病の診断のために有用な独自のアルツハイマー病特異的なバイオマーカーを初めて特定した。特に、本発明者らは、アルツハイマー病の診断のためのバイオマーカーとしての繊維芽細胞成長パターンを特定した。従って、ここにおいて開示される独自のアルツハイマー病特異的なバイオマーカーは、アルツハイマー病の検出および診断のために高度な感受性と特異性とを有する診断方法のための基礎として役立つ。本発明の独自のアルツハイマー病特異的なバイオマーカーはまた、脳ネットワークのモデルとして、並びにアルツハイマー病の治療および予防において治療剤として使用され得る化合物を同定するためのスクリーニング方法のために有用であってよい。
【0005】
[発明の概要]
ある好ましい実施形態において、本発明は、5つの別々の手順に向けられるアッセイ、ここにおいて(1)集積スコア法;(2)凝集の数あたりの平均凝集面積法;(3)細胞遊走分析法;(4)フラクタル分析法;および(5)空隙性分析法;と称される手順を使用するアルツハイマー病の診断方法に向う。
【0006】
ある実施形態において、本発明は、ヒト対象におけるアルツハイマー病の診断方法であって、(a)ヒト対象から1つまたは1つ以上の細胞を得ること;(b)1つまたは1つ以上の細胞をある期間に亘り培養すること;(c)細胞凝集の平均面積を測定し、平均面積を凝集の数で割って、凝集の数あたりの面積を得ること;(d)工程(c)の結果と非アルツハイマー病細胞を用いて測定された凝集の数あたりの面積とを比較すること;および(e)工程(d)の比較に基づいて、アルツハイマー病の存在または不在を診断すること;の工程を含む方法に向う。
【0007】
工程(c)において測定された凝集の数あたりの面積が、工程(d)において測定された凝集の数あたりの面積よりも大きいときには、方法はアルツハイマー病が陽性であることを示す。ある好ましい実施態様において、差は統計学的に有意である。
【0008】
好ましい実施形態において、診断は、1つまたは1つ以上の更なる診断方法を使用して確認される。1つまたは1つ以上の更なる診断方法は、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法、および空隙性分析を含む方法からなる群より選択される。
【0009】
好ましい実施形態において、ここで開示される方法は、繊維芽細胞である細胞を使用するが、血液細胞または神経系細胞などの他の細胞が使用されてもよい。
【0010】
実施形態において、既知の非アルツハイマー病細胞は、AC細胞である。
【0011】
ある実施形態において、細胞はタンパク質混合物中で培養される。タンパク質混合物は、細胞外マトリックス調製物を含み、それはラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよびそれらの組み合わせを含む。タンパク質混合物は、更に成長因子を含んでもよい。細胞外マトリックスタンパク質は、腫瘍から抽出されてよい。ある実施形態において、腫瘍はEHSマウス肉腫である。
【0012】
ある実施形態において、本発明は、(a)ヒト対象から1つまたは1つ以上の細胞を得ること;(b)1つまたは1つ以上の細胞をある期間に亘り培養すること;(c)前記ある期間の終わりに細胞の画像を得ること;(d)画像における細胞のネットワークに関するフラクタル次元を決定すること;(e)工程(d)の結果と既知の非アルツハイマー病細胞に関して独立して決定されたフラクタル次元とを比較すること;を含む方法に向う。
【0013】
ある実施形態において、工程(d)において算出されたフラクタル次元が、既知の非アルツハイマー病細胞に関するフラクタル次元よりも統計学的に有意に低いときに、比較はアルツハイマー病を示す。
【0014】
好ましい実施形態において、ADは、1つまたは1つ以上の更なる診断方法を使用して確認される。1つまたは1つ以上の更なる診断方法は、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される。
【0015】
ある実施形態において、フラクタル次元は、ボックス集計手続きを使用して算出される。ある実施形態において、ボックス集計手続きは、エッジ検出手続きを含む。
【0016】
ある実施形態において、対象は、既知の非アルツハイマー病細胞を提供するコントロール対象と年齢が一致する。ある実施形態において、細胞培養期間は、約24時間または約36時間または約48時間である。
【0017】
ある実施形態において、細胞は、タンパク質混合物中で培養される。タンパク質混合物は、細胞外マトリックス調製物を含んでもよく、それは、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含んでもよい。タンパク質混合物は、更に成長因子を含んでもよい。細胞外マトリックスタンパク質は、腫瘍から抽出されてもよい。ある実施形態において、腫瘍はEHSマウス肉腫である。
【0018】
ある実施形態において、本発明は、(a)ヒト対象からの繊維芽細胞のネットワークの画像のフラクタル次元を決定すること;(b)既知の非アルツハイマー病細胞からの繊維芽細胞のネットワークの画像のフラクタル次元を決定すること;(c)工程(a)および(b)の結果を比較すること;を含む方法に向う。
【0019】
ある実施形態において、工程(a)において決定されたフラクタル次元が、工程(b)において決定されたフラクタル次元よりも統計学的に有意に低いときには、診断はアルツハイマー病を示す。
【0020】
ある実施形態において、対象は、既知の非アルツハイマー病細胞を提供するコントロール対象と年齢が一致する。
【0021】
ある実施形態において、本発明は、(a)対象からの繊維芽細胞のネットワークの画像のフラクタル次元を算出すること;(b)工程(a)の結果と、既知の非アルツハイマー病細胞に関して独立して決定されたフラクタル次元とを比較すること;を含むヒト対象におけるアルツハイマー病の診断方法に向い、ここで、工程(a)において算出されたフラクタル次元が、既知の非アルツハイマー病細胞に関するフラクタル次元よりも統計学的に有意に低いときに、診断は、対象におけるアルツハイマー病について陽性である。
【0022】
ある実施形態において、対象は、既知の非アルツハイマー病細胞を提供するコントロール対象と年齢が一致する。
【0023】
ある実施形態において、本発明は、ヒト対象におけるアルツハイマー病の診断方法であって、(a)外科用刃を使用して対象の末梢皮膚繊維芽細胞のサンプルを得ること;(b)インキュベータを使用してサンプルをある期間に亘りインキュベートすること;(c)撮像装置を使用してある期間の終わりにサンプルの画像を得ること;(d)コンピュータを使用して画像における繊維芽細胞のネットワークに関するフラクタル次元を算出すること;(e)工程(d)の結果を、既知の非アルツハイマー病細胞に関して独立して決定されたフラクタル次元と比較すること;を含み、ここにおいて、工程(d)で算出されたフラクタル次元が、既知の非アルツハイマー病細胞に関するフラクタル次元よりも統計学的に有意に低いときに、診断は、対象におけるアルツハイマー病について陽性である方法に向う。
【0024】
ある実施形態において、細胞はタンパク質混合物中で培養される。タンパク質混合物は、細胞外マトリックス調製物を含んでよく、それはラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含んでよい。タンパク質混合物は、更に成長因子を含んでもよい。細胞外マトリックスタンパク質は、腫瘍から抽出されてもよい。ある実施形態において、腫瘍はEHSマウス肉腫である。
【0025】
ある実施形態において、本発明は、ヒト対象においてアルツハイマー病を診断する方法に向い、当該方法は、(a)外科用刃を用いて、対象の末梢皮膚繊維芽細胞のサンプルを得ることと;(b)インキュベータを用いて、サンプルをある期間に亘りインキュベートすることと;(c)撮像装置を用いて、前記ある期間の終わりにサンプルの画像を得ることと;(d)コンピュータを用いて画像における繊維芽細胞のネットワークに関するフラクタル次元を算出することと;(e)コンピュータを用いて、工程(d)のフラクタル次元を、種々の年齢のコントロール対象から得られた非アルツハイマー病細胞から生成されたフラクタル次元を有するデータベースに入力することと;(f)コンピュータを用いて、工程(d)の算出されたフラクタル次元を、データベースのデータと比較することにより、対象を診断することと;含む。
【0026】
ある実施形態において、サンプルはゼラチン様タンパク質混合物中でインキュベートされる。
【0027】
ある実施形態において、細胞は、ゼラチン様タンパク質混合物中で培養またはインキュベートされる。タンパク質混合物は、細胞外マトリックス調製物であってよく、それは、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含んでもよい。タンパク質混合物は、更に成長因子を含んでもよい。細胞外マトリックスタンパク質は、腫瘍から抽出されてもよい。ある実施形態において、腫瘍はEHSマウス肉腫である。
【0028】
ある実施形態において、本発明は、種々の年齢のコントロール対象から得られた非アルツハイマー病細胞から生成されたフラクタル次元データのデータベースを有するコンピュータ読み取り可能媒体に向い、当該媒体は、(a)画像のフラクタル次元を算出する;
(b)フラクタル次元を、フラクタル次元データのデータベースと比較する;および
(c)工程(b)の比較に基づいて、診断を出力する;ための命令を含む。
【0029】
ある実施形態において、本発明は、(a)ヒト対象からの皮膚細胞をある期間に亘り培養することと;(b)細胞の繊維芽細胞のネットワークに関連する細胞形態学的特徴を測定することと;(c)細胞形態学的特徴に関する演算を行うことと;(d)工程(c)の結果と、既知の非アルツハイマー病細胞に関連する独立して決定されたパラメータと比較することと;を含む方法に向う。
【0030】
ある実施形態において、細胞形態学的特徴は、繊維芽細胞凝集塊(または凝集)の数、繊維芽細胞凝集塊(または凝集)の大きさ、繊維芽細胞凝集塊(または凝集)の成長率およびそれらの組み合わせからなる群より選択される。
【0031】
ある実施形態において、細胞形態学的特徴は、大きい凝集塊(または凝集)の存在または不在、凝集塊(または凝集)に対して付着した細胞の存在または不在、大きな凝集塊(または凝集)成長の存在または不在、凝集塊(または凝集)の数、以前に形成された凝集塊(または凝集)のネットワークからの残留エッジの存在または不在、細胞遊走の数、パーコレーションに近い細胞の存在または不在である。
【0032】
ある実施形態において、工程(c)の演算は、それぞれの細胞形態学的特徴に対して離散値を割り当てること、および前記値を合計することを含む。
【0033】
ある実施形態において、合計は、ADの診断またはADの不在の診断のために使用される。
【0034】
ある実施形態において、細胞は、タンパク質混合物中で培養される。タンパク質混合物は、細胞外マトリックス調製物を含んでもよく、それは、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含んでもよい。タンパク質混合物は、更に成長因子を含んでもよい。細胞外マトリックスタンパク質は、腫瘍から抽出されてもよい。ある実施形態において、腫瘍はEHSマウス肉腫である。
【0035】
ある実施形態において、本発明は、対象においてアルツハイマー病を診断する方法であって、(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程;(b)ある期間を超えた1つまたは1つ以上の細胞のフラクタル次元を測定する工程;(c)フラクタル次元を時間の関数としてプロットしてフラクタル次元曲線を得る工程;(d)フラクタル次元曲線を、非アルツハイマー病細胞および非アルツハイマー病認知症(非ADD)細胞から得たフラクタル次元曲線と比較する工程;および(e)対象においてアルツハイマー病の存在または不在を診断する工程;を含む方法に向う。
【0036】
ある実施形態において、対象から得られた1つまたは1つ以上の細胞から測定されたフラクタル次元曲線が、非アルツハイマー病細胞および非ADD細胞から得たフラクタル次元曲線とは統計学的に有意に異なるときに、診断は、対象におけるアルツハイマー病について陽性である。
【0037】
ある実施形態において、対象から得られた1つの細胞または1つ以上の細胞は繊維芽細胞である。
【0038】
好ましい実施形態において、診断は1つまたは1つ以上の更なる診断方法を使用して確認される。1つまたは1つ以上の更なる診断方法は、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される
ある実施形態において、本発明は、対象においてアルツハイマー病を診断する方法であって、(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程と;(b)培養された細胞の1つまたは1つ以上の特徴に基づいて集積スコアを決定する工程と;(c)集積スコアを、非アルツハイマー病細胞について決定された集積スコアと比較する工程と;(d)対象におけるアルツハイマー病の存在または不在を診断する工程と;を含む方法に向う。
【0039】
ある実施形態において、集積スコアを算出するために使用される特徴は、凝集の大きさ、凝集に対する細胞の付着、凝集成長の兆候、凝集の数、ネットワーク内のエッジ、細胞遊走の兆候およびパーコレーション限界に対する近さ(または細胞密度)からなる群より選択される。
【0040】
好ましい実施形態において、診断は1つまたは1つ以上の更なる診断方法を使用して確認される。1つまたは1つ以上の更なる診断方法は、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される。
【0041】
ある実施形態において、本発明は、対象においてアルツハイマー病を診断する方法であって、(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程と;(b)遊走細胞の数を決定する工程と;(c)遊走細胞の数を、非アルツハイマー病細胞についての遊走細胞の数と比較する工程と;(d)対象におけるアルツハイマー病の存在または不在を診断する工程と;を含む方法に向う。
【0042】
ある実施形態において、対象から得られた遊走細胞の数が、遊走非アルツハイマー病細胞の数よりも統計学的に有意に小さいときに、診断は、ADについて陽性である。
【0043】
ある実施形態において、細胞は繊維芽細胞である。
【0044】
好ましい実施形態において、診断は1つまたは1つ以上の更なる診断を使用して確認される。1つまたは1つ以上の更なる診断方法は、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される。
【0045】
ある実施形態において、本発明は、対象においてアルツハイマー病を診断する方法であって、(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程と;(b)細胞の空隙性を決定する工程と;(c)細胞の空隙性を、非アルツハイマー病細胞の空隙性と比較する工程と;(d)対象におけるアルツハイマー病の存在または不在を診断する工程と;を含む方法に向う。
【0046】
ある実施形態において、対象から得られた細胞の空隙性が、非アルツハイマー病細胞の空隙性よりも統計学的に有意に高いときに、診断は、ADについて陽性である。
【0047】
好ましい実施形態において、診断は1つまたは1つ以上の更なる診断を使用して確認される。1つまたは1つ以上の更なる診断方法は、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される。
【0048】
ある実施形態において、細胞は繊維芽細胞である。
【0049】
ある実施形態において、本発明は、アルツハイマー病の治療または予防のための1つまたは1つ以上の薬物候補を開発するために有用なリード化合物をスクリーニングする方法であって、(a)細胞培養培地において1つまたは1つ以上のAD細胞を培養する工程と;(b)AD細胞を化合物と接触させる工程と;(c)AD細胞の1つまたは1つ以上の特徴が、化合物と接触されていない非アルツハイマー病細胞の特徴のように変化しているか否かを決定する工程と;を含む方法に向う。
【0050】
ある実施形態において、細胞は繊維芽細胞である。
【0051】
ある実施形態において、特徴は、フラクタル次元または集積スコアまたは凝集の数あたりの平均凝集面積または細胞遊走または空隙性である。
【0052】
ある実施形態において、本発明は、対象におけるアルツハイマー病持続期間を決定する方法であって、(a)対象から1つまたは1つ以上の細胞を得ること;(b)既知のAD細胞株について、細胞遊走特性または凝集の数あたりの平均面積を測定すること;(c)工程(b)において得られたデータを使用して検量線を作成すること;工程(a)において得られた細胞について遊走特性または凝集の数あたりの平均面積を測定すること;および(d)対象におけるAD病持続期間を決定すること;を含む方法に向う。
【0053】
ある実施形態において、細胞は繊維芽細胞である。
【0054】
ある実施形態において、対象は、10、9、8、7、6、5、4、3、2または1年または1年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される。
【0055】
ある実施形態において、本発明は、対象におけるアルツハイマー病(AD)の存在と非アルツハイマー病認知症(非ADD)の存在とを識別する方法であって、(a)対象から1つまたは1つ以上の細胞を得ることと;(b)ある期間を越えて1つまたは1つ以上の細胞のフラクタル次元を測定することと;(c)フラクタル次元を時間の関数としてプロットしてフラクタル次元曲線を得ることと;(d)フラクタル次元曲線を、既知の非アルツハイマー病細胞、既知の非アルツハイマー病認知症(非ADD)細胞および既知のAD細胞から得られたフラクタル次元曲線と比較することと;(e)対象におけるADと非ADDとを識別することと;を含む方法に向う。
【0056】
ある実施形態において、細胞は繊維芽細胞である。
【0057】
ある実施形態において、本発明は、対象におけるアルツハイマー病の存在と非アルツハイマー病認知症の存在とを識別する方法であって、(a)対象から1つまたは1つ以上の細胞を得ることと;(b)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養することと;(c)遊走細胞の数を決定することと;(d)遊走細胞の数を、既知の非アルツハイマー病細胞、既知のAD細胞および既知の非ADD細胞についての遊走細胞の数と比較することと;(e)対象におけるADと非ADDとを識別することと;を含む方法に向う。
【0058】
ある実施形態において、細胞は繊維芽細胞である。
【0059】
1つの実施形態において、本発明は、ヒト対象においてアルツハイマー病を診断する方法であって、(a)対象からの繊維芽細胞のネットワークの画像のフラクタル次元を算出すること;(b)工程(a)の結果を、既知の非アルツハイマー病細胞に関して独立して決定されたフラクタル次元と比較すること;ここにおいて、工程(a)において算出されたフラクタル次元が、既知の非アルツハイマー病細胞に関するフラクタル次元をよりも統計学的に有意に低いときに、診断は陽性であり、或いは、そうでないときには、診断は陰性である;および(c)診断すること;を含む方法を提供する。
【図面の簡単な説明】
【0060】
【図1】繊維芽細胞の初期準備。
【図2】集積スコアプロトコール。
【図3】フラクタル分析プロトコール。
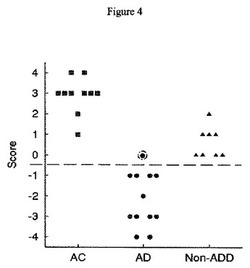
【図4】集積スコア法。播種後48時間での皮膚細胞繊維芽細胞についての8つの特徴の合計を表す総スコア(AC=年齢が一致したコントロール:AD=アルツハイマー病;非ADD=非アルツハイマー病、例えば、パーキンソン病(PD)およびハンチントン病(HD))認知症)。
【図5】図5Aおよび図5B;アルツハイマー病繊維芽細胞(A)および正常コントロール(B)についての凝集の例。面積は、凝集に渡って楕円をフィッティングすることによりμm2で測定され、凝集は、10倍の画像において手動でカウントされた。楕円は、凝集のエッジが楕円の内側に入るように、各凝集を渡ってフィッティングされた。同様の手順が全ての画像の全域で一様に使用された。
【図6】48時間での繊維芽細胞。31細胞株について凝集の数あたりの平均面積:年齢が一致したコントロール(NAC=10)、アルツハイマー病(NAD=12)および非アルツハイマー病認知症(NNon-ADD=9)、例えば、パーキンソン病(PD)およびハンチントン病(HD)。エラーバーは、平均値の標準誤差を表す。
【図7】結果の再現性。4つの繰り返された細胞株についての凝集の数あたりの平均面積。実験は、同じ細胞株について少なくとも1か月離した。細胞の初期の数は10%以内であった。
【図8】図8Aおよび図8B;赤色のドットで印を付けた自由な遊走細胞の例。播種後48時間でのアルツハイマー病(AD)繊維芽細胞、左図(図8A)および非アルツハイマー病認知症(非ADD;ハンチントン病)繊維芽細胞、右図(図8B)。
【図9】遊走細胞の数に対する遊走率。緑色四角−アルツハイマー病(nAD=10)、青色三角−非アルツハイマー病認知症(nNon−ADD=7)および赤色円−年齢が一致したコントロール(nAC=9)。青色線は分離閾値である。
【図10】遊走率を遊走細胞の数に掛ける。緑色四角−アルツハイマー病(nAD=10)、青色三角−非アルツハイマー病認知症(nNon−ADD=7)および赤色円−年齢が一致したコントロール(nAC=9)。
【図11】図11Aおよび図11B;フラクタル分析。図11A:フラクタル曲線と回復領域にフィットした直線の例。図11B:フラクタル曲線の切片に対する傾きを示す母集団データ(N=31;NAC=10;NAD=12;NNon−ADD=9)。
【図12】空隙性分析。図12A:空隙性曲線の例。図12B:平均空隙性を示す母集団データ(N=8;NAC=1;NAD=4;Nnon−ADD=3)。
【図13】12ウェルプレート内でのマトリゲルの厚さと体積の間の比例関係。マトリゲル体積が400〜800μLの範囲にあるとき、マトリゲル層の厚さは1.04〜2.08mmの範囲にある。
【図14】マトリゲルの初期体積におけるフラクタル次元と空隙性の検出感度。フラクタル次元(図14A)と空隙性(図14B)は、大きい量のマトリゲル、600μL(赤色)、700μL(ピンク)および800μL(青緑色)と比較して、少量のマトリゲル、400μL(赤色)と500μL(緑色)について定性的に異なる傾向を有する。大きい量(>600μL)については、より多くのマトリゲルが添加されるほど、フラクタル次元(図14A)と空隙性(図14B)における影響はより大きくなる。参考のために、以前の実験の全てにおいて、我々は700μLのマトリゲルを使用した。
【図15】図15Aおよび図15B;マトリゲルの初期体積における48時間でのAD凝集の検出感度。図15A:マトリゲルの初期体積に対する48時間および79時間での凝集数あたりの面積。図15B:マトリゲルの初期体積の関数としての面積/数についての変化率。グラフは(1)700μLのマトリゲルを使用することの重要性を示し、そこにおいて曲線は、ピークと影響が最大であることを示す。(2)アルツハイマー病凝集の大きさの増大と、この時間枠40〜80時間における数の減少。これは、パネルAにおいて、2つの異なる時点、48時間および79時間での数あたりの凝集面積を示すことにより示される。緑色曲線は、赤色曲線の上部にあり、これは、面積における成長および/または数の減少を示す。実験的に両方が観察される。パネルBは、48時間〜79時間でのこの測定面積/#における変化率を示す。言い換えれば、パネルAからの曲線を取り、それらを差し引き、時間間隔で割る。AD繊維芽細胞は、40時間後に、凝集から離れて遊走することはできない。従って、凝集は、この時間枠内でAD細胞についてより大きく成長する。コントロール、AC、の場合について、これは観察されず、細胞は凝集から離れて遊走することができる。
【図16】インキュベーションの24時間後の年齢が一致するコントロール(AC)繊維芽細胞ネットワークの描写。
【図17】インキュベーションの24時間後のアルツハイマー病患者繊維芽細胞ネットワークの描写。
【図18】時間に対するACおよびAD対象のフラクタル次元の描写。
【図19】インキュベーションの24時間後のACに対するADのネットワークのフラクタル次元の描写。
【図20】図20Aおよび図20B;図21A:AD繊維芽細胞株。罹患期間に伴う凝集の数あたりの平均凝集面積の直線的な増加を示すグラフ。言い換えれば、直接関係が、罹患期間と(平均凝集面積)/(凝集の数)との間に存在する。各四角に隣接する数は、試験された細胞株の数である。図20B:AD繊維芽細胞株。罹患期間と遊走細胞の数の間の線形相関。各四角に隣接する数は、試験された細胞株の数である。これらの相関関係を使用して、アルツハイマー病の早期、中期および後期にある患者を同定することが可能である。疾患の早期にある患者は、治療に対する高い反応性を有する。患者がどれくらいの期間に亘りアルツハイマー病を有しているかを知ることは、治療の目的と治療管理で使用される戦略を患者毎に導くことを助ける。
【詳細な説明】
【0061】
略語:AC:年齢が一致するコントロール;AD:アルツハイマー病;AvC:細胞の平均数;DC:細胞の密度;DMEM:ダルベッコ改変イーグル培地;EtOH:エタノール;FBS:ウシ胎仔血清;非ADD:非アルツハイマー病認知症;RM:室温。
【0062】
ここで使用されるとき、「空隙性」は、フラクタルが空間を満たす程度をいう。更に、それはフラクタルを分類およびテクスチャするために使用され、それらは、同じフラクタル次元を共有してもよいと同時に、非常に視覚的に異なっても見える。密度の高いフラクタルは、低い空隙性を有する。フラクタルの粗さが増大すると、空隙性;直感的に「ギャップ」を意味する間隙も増大する(より大きなギャップ=より高い空隙性)。空隙性は一般的に記号Lにより示される。
【数1】

【0063】
ある実施形態における本発明は、末梢皮膚繊維芽細胞を使用するアルツハイマー病を診断する方法に関する。本発明の様々な実施形態において、繊維芽細胞の定量的、定性的および/または半定量的な側面が使用され、ADの存在または不在が決定される。
【0064】
1つの実施形態において、方法は、フラクタル次元測定を用いてヒト皮膚繊維芽細胞ネットワークの複雑性の定量化を含む。もう1つの実施形態において、方法は、皮膚繊維芽細胞の特徴の合計に基づいて、総スコアを算出することを含む。もう1つの実施形態において、方法は、皮膚繊維芽細胞の凝集塊の数あたりの面積を算出することを含む。方法は、非AD認知症症例および年齢が一致したコントロール(AC)症例からAD患者を早期にスクリーニングすることを可能にする。
【0065】
末梢皮膚繊維芽細胞を使用するアルツハイマー病(AD)を診断する方法が記載される。この方法は、特殊な物質(マトリゲル)および繊維芽細胞凝集形態におけるネットワーク形成、凝集、連絡、力学的移動性の測定によりヒト皮膚繊維芽細胞成長パターンの複雑性を定量化する。
【0066】
マトリゲルマトリックスは、マウス肉腫から抽出され、これは細胞外マトリックス(ECM)タンパク質に富む。それは、ラミニン、続いてコラーゲンIV、ヘパラン硫酸化プロテオグリカンおよびエンタクチン1からなる。37℃で、マトリゲルは重合し、生物学的に活性なマトリックス物質を生成し、これは哺乳類細胞基底膜に類似する。BD還元マトリゲルマトリックス成長因子(GFR)は、ゲル基質のより高度に明確な基底膜作成を必要とする利用のために特に十分に適していることが見出されている。
【0067】
診断的測定の5つの方法が存在する:
1.方法1:集積スコア
2.方法2:凝集の数あたりの平均凝集面積
3.方法3:細胞遊走分析
4.方法4:フラクタル分析
5.方法5:空隙性分析。
【0068】
繊維芽細胞成長パターンの更なる測定が開発され、バイオプシーにより採取されたアルツハイマー病(AD)、非アルツハイマー病認知症(非ADD)および年齢が一致したコントロール細胞の間の診断的な識別が可能である。診断効果は、細胞外マトリックス修飾剤を添加することにより改善されてよい。
【0069】
方法1 集積スコア
この研究において、培養の1〜2時間以内に皮膚繊維芽細胞は、マトリゲル上で接触して測定可能なネットワークを形成する。この状態は、細胞形態、細胞の生化学的な機能、細胞運動性または浸潤、および遺伝子発現を研究するための生理学的に関連する環境を提供する。1日後、これらのネットワークは変性し、エッジが後退し、測定可能な凝集が残る。
【0070】
8つのパラメータを使用して、マトリゲル上への播種後の48時間後に、年齢が一致したコントロール(AC)からのAD繊維芽細胞と、非アルツハイマー病認知症(非ADD)とが区別される:
1.大きい凝集の存在
2.凝集に対する細胞の付着
3.凝集成長の兆候
4.少数の凝集(10倍画像において<10)
5.多数の凝集(10倍画像において>10)
6.ネットワーク内の測定可能なエッジ
7.細胞遊走の兆候
8.パーコレーション限界への近さ(細胞は連続的な流れを形成する)。
【0071】
これらの8つのパラメータから、数量的なスコアが以下のように導入される:
1.上述の最初の4つのパラメータは、アルツハイマー病(AD)に特異的であり、存在するときには、それぞれについて「−1」の点数を付け、不在のときには「0」を付ける。
【0072】
2.後半の4つのパラメータは、非ADおよびACに特異的であり、存在するときには「+1」の点数を付け、不在のときには「0」を付ける。
【0073】
3.総スコアは、8つの全部の値の合計として算出される。総スコアが正または0のとき、細胞はACまたは非ADDである。総スコアが負のとき、細胞はADである。
【0074】
播種後の48時間での皮膚繊維芽細胞の8つの特徴の合計を示す総スコアは、図4に示される。
【0075】
方法2 凝集の数あたりの面積
8つのパラメータの2つは、凝集の数あたりの面積の大きさで表され、それは、ACおよび非ADDについてよりもADについての方が相当に高い(診断精度96%、N=31(nAD=12、nAC=10およびnnon−ADD=9))、ACに対するADについてp<0.000001、および非ADDに対するADについてp<0.00001)。
【0076】
AD細胞は、大きな孤立した凝集と、少量の遊走または遊走の不在を示す(図5A)。正常コントロールおよび非ADD繊維芽細胞は、多くの小さな凝集塊と、凝集の間の高いレベルの遊走とを示す(図5B)。
【0077】
方法3 細胞遊走
集積スコア法とは異なり、細胞遊走法は、AD、ACおよび非ADD細胞との間を識別することが可能である。図9および10を参照されたい。
【0078】
自由遊走細胞は、48時間、N1、でカウントされ、約7時間後、N2、にカウントされ、遊走率がR=(N2−N1)/ΔTとして算出され、ΔTはカウント間の時間間隔である。自由遊走細胞は、凝集に対して付着していない細胞であり、図8において赤色ドットにより示されるような細胞である。
【0079】
個体群データ(図9、10)は、アルツハイマー病繊維芽細胞(AD−緑色四角形)および非アルツハイマー病認知症繊維芽細胞(非ADD−青色三角形)が、年齢が一致したコントロール繊維芽細胞(AC−赤色円形)と比較して、有意に少数の遊走細胞と遊走率を有することを示す。アルツハイマー病繊維芽細胞(緑色四角形)は、最も少数の遊走細胞と最も低い遊走率を示し、他方、年齢が一致したコントロール(赤色円形)は、最も多数の遊走細胞と最も高い遊走率を示す。興味深いことに、非ADD細胞は、(1つの例外が伴い)ADおよびACからは区別される(図5および6)。
【0080】
遊走の観点から、非アルツハイマー病認知症繊維芽細胞は、アルツハイマー病繊維芽細胞から良好に区別される。
【0081】
方法4 フラクタル分析
集積スコア法とは異なり、フラクタル分析法は、AD、ACおよび非ADD細胞の間を識別することが可能である(p<0.01)。図11Bを参照されたい。
【0082】
フラクタル分析法は、フラクタル次元により測定されるようなネットラークの複雑性を利用する。組織培養中で増殖したときに、アルツハイマー病に罹患する患者から採取された細胞、好ましくは繊維芽細胞は、AC細胞よりも統計学的に有意に低いフラクタル次元を有する。また、この物理学的なパラメータにより測定されるネットワークの複雑性は、ACおよび非ADD繊維芽細胞と比較したとき、ADから採取された繊維芽細胞は顕著に異なる。ネットワークの変性後(〜48時間)、細胞は遊走し、数日以内にコンフルエントに達する。この回復は、フラクタル次元における直線的増加により捕捉される(図11A)。時間の関数としてフラクタル次元を追跡する各曲線の切片に対する傾きは、3つの群、AC、ADおよび非ADDにおいて顕著に異なる(96%精度、n=31(NAD=12、NAC=10、Nnon−ADD=9);ACに対するADについてp<0.000l、非ADDに対してADについてp<0.00001)。最初の方法とは異なり、第2の方法は、ACと非ADDとの間を識別する(p<0.01)(図11B)。
【0083】
方法5 空隙性分析
空隙性分析法は、繊維芽細胞パターンの間隙を定量化し、識別の第2のレベルとして使用される複雑性を補完する測定である。また、繊維芽細胞の平均空隙性は、ACおよび非ADD繊維芽細胞と比較したときに、ADから採取された繊維芽細胞の方がより高い。典型的に、空隙性は、ネットワーク変性が最大であるときに、即ち、孤立した凝集のみが見えるときに、増大し、ピークになる(図12A)。間隙は、ネットワーク変性が開始したときに生じる。
【0084】
複雑性の動態のこれらの測定は、新たな機会を提供し、最小限の侵襲性手順でAD患者を診断する。方法の容易性および低コスト性はAD患者に有用なスクリーニング法である。ADの脳における神経ネットワークと同様にヒト皮膚繊維芽細胞ネットワークは、フラクタル次元により測定されるような複雑性の減少を示す。ヒト皮膚繊維芽細胞ネットワークは、正確なAD診断および薬物スクリーニングに有用な脳ネットワークモデルを提供する。
【0085】
アルツハイマー病繊維芽細胞の障害された垂直な遊走
同じ数の繊維芽細胞(50細胞/mm3)を、AD細胞株について12ウェルプレート内で増加量100μLずつ400μL〜800μLまで増大した体積のマトリゲル上に播種した。マトリゲル体積、V、の増大は、関係式:V=(πr2)h、ここでr=11.05mmに従い、マトリゲル層の厚さに比例して増加を生じる(図13)。
【0086】
頂部表面から底部表面までの垂直な細胞遊走は、マトリゲル層の厚さの増大にともなってより難しくなる。遊走におけるこの困難性は、フラクタル次元、空隙性および数によりここで定量化される(図14)。
【0087】
約24時間後、ネットワーク変性および凝集は、後に残される。ここで、我々は、数あたりの面積のマトリゲルの初期体積への依存性を示す(図12)。少ない体積のマトリゲル、400および500μLでは、凝集が存在しないのに対して、>500μLの大きな体積では、それらの数により割った凝集の面積は、700μLでピークになる曲線である。極めて制限される数のアルツハイマー病症例について、凝集の数により割った面積は、閾値に近く(図6参照)、遅い時間での凝集の測定は、これらの症例をより良好に区別するための助けになるだろう。79時間後、これらの凝集は、大きさが増し、それらの数は減少し、それにより面積/数の比は、更に互角にまで増大する(図15A中の緑色曲線)。48時間と79時間については共に、効果は700μLの初期体積のために最適である。また、面積/数についての変化率は(図3B)、ピークを有する曲線であり、マトリゲルの最適な初期体積が700μLであるという見解を強化する。
【0088】
上述で示された実験において、我々は、10%のウシ胎仔血清(FBS)および1%ペニシリン/ストレプトマイシン(PS)含有の1.5mLのダルベッコ改変イーグル培地(DMEM)を使用した。血清飢餓は、示された測定の更なる大きな撹乱を有する。
【0089】
フラクタル次元法
1つの実施形態において、フラクタル次元は、原画像、これはデジタル画像であってもよいが、これを、例えば、2つのガウスの相違を使用するなどのエッジ検出手続きを経てフィルタ処理した後に、標準ボックス集計手続きを用いて算出される。ADは、培養されたヒト皮膚繊維芽細胞の定量的な画像分析に基づいて診断されてよい。1つの実施形態において、サンプルは、パンチバイオプシーを経て採取される。一般に、外科用刃が使用されてよい。個体群データは、AC症例が、AD症例よりも有意に高いフラクタル次元を有することを示す。減少した複雑性のヒト皮膚繊維芽細胞ネットワークAD症例は、ACおよび比AD認知症症例から識別される。
【0090】
他の画像処理の所定の方法が、ボックス集計または線分検出の代わりに本発明において使用されてよい。
【0091】
方法の容易性および低コスト性は、他の複雑でコストの掛かる技術に訴える前に、AD患者をスクリーニングするために有用である。AD脳における神経ネットワークと同様にヒト皮膚繊維芽細胞ネットワークは、フラクタル次元により測定されるように、複雑性の減少を示す。1つの実施形態において、ヒト皮膚繊維芽細胞ネットワークは、新たな薬物スクリーニングのために有用であり得る脳ネットワークのモデルであってよい。
【0092】
図16は、インキュベーションの24時間後の年齢が一致したコントロール(AC)繊維芽細胞ネットワークを示す。1つの実施形態において、ネットワークのデジタル画像が得られる。図17は、インキュベーションの24時間後のアルツハイマー病患者繊維芽細胞ネットワークを示す。1つの実施形態において、ネットワークのデジタル画像が得られる。図18は、時間に対するACおよびAD対象のフラクタル次元を示す。2つの細胞株についてのフラクタル次元により測定された細胞ネットワークのダイナミクスは、ADよりもACについてよりも高いフラクタル次元を示す。有意な分類が、インキュベーションのおおよそ数時間後に顕著になる。図19は、インキュベーションの24時間後のACネットワークに対するADのフラクタル次元の散布図を示す。
【0093】
フラクタルは一般に、粗いまたは崩壊した幾何学的な形状であり、これは、部分に分けることが可能であり、その各々は(少なくともおおよそ)全体の縮小コピーであり、これは「自己相似性」と呼ばれる性質である。目的(フラクタル)は、全てのスケールで厳密に同じ構造を示す必要はないが、同じ「タイプ」の構造が、全てのスケールにおいて見られなくてはならない。ヒト皮膚繊維芽細胞ネットワークは、自然発生フラクタルの例である。
【0094】
線の考慮。線が、半分に分割されるとき、それにより、当初の線を再現するこれらの半分が2つ得られる。線が4つの断片に分割されるとき、それにより当該線の範囲を保証する4つが得られる。一般に、長さ「s」の線分が与えられると、当初の線の範囲を保証する断片の数はN(s)=(1/s)1により与えられる。
【0095】
正方形の考慮。正方形がそれぞれ半分の辺長を有する小さい正方形に分割されるとき、それにより4つ(22=4)のこれらの小さい正方形が得られ、当初の正方形が形成される。正方形が、それぞれ四分の1の辺長を有する小さい正方形に分割されるとき、それにより16(24=16)の小さい正方形が得られ、当初の正方形が形成される。上述のように、一片の数についての表現が記載でき、大きさ「s」が当初正方形の範囲を保証するために必要であり、それはN(s)=(1/s)2である。立方体については、結果はN(s)=(1/s)3である。
【0096】
上述の例における指数1、2および3は、それぞれ線、正方形および立方形の次元である。これはN(s)=(l/s)Dと一般化でき、ここで、Dは次元であり、上述のような整数であるが、それらであることが必ずしも必要ではない。両辺の対数を取れば、log(N(s))=Dlog(l/s)であり、言い換えれば、log(l/s)に対してlog(N(s))をプロットすることにより、その傾き(D)が次元であり、次元が評価できる。傾きが整数ではないときには、目的物はフラクタルであり、次元はフラクタル次元である。
【0097】
複雑性は、生物および非生物のそれら自身をどのようにパターンに組織化できるか、系としてどのように相互作用するかの研究である。複雑性は、極めて多くの専門分野に亘り、生物学から物理学までの非常に広い分類の分野の科学者が関与している。ヒト皮膚繊維芽細胞ネットワークの複雑性は、それらのフラクタル次元をコンピューティングすることにより定量化できる。
【0098】
1つの実施形態において、エッジ検出が本発明において使用される。エッジ検出は、画像処理の分野、特に、特徴検出および特徴抽出の領域において使用される用語であり、デジタル画像、例えば、そこで画像輝度が鋭く変化するまたは他の不連続を有するデジタル画像における点を同定することを目的とするアルゴリズムを指す。
【0099】
むしろ画像形成モデルのための一般的な仮定の下で、画像輝度における不連続性は、深度における1または1以上の不連続性、表面配向性における不連続、物質特性における変化および背景照明における変化に対応しそうであることが示される。
【0100】
理想的な状況において、画像に対してエッジ検出を適用する結果は、対象物の境界線を示す一組の関連する曲線を導くことが可能であり、表面の境界線は表面配向性における不連続性に対応する十分な曲線としてマーキングする。従って、画像へのエッジ検出の適用は、処理されるべきデータの量を有意に減少することが可能であり、それにより関連性が少ないと看做され得る情報を除去することが可能であり、同時に、画像の重要な構造特性を保存する。エッジ検出工程が成功すれば、そのために、当初画像における情報内容を解釈するという続く目的が大幅に簡易化できる。
【0101】
エッジ検出のための多くの方法が存在するが、それらの大部分は、2つの範疇、検索系およびゼロ交差系にグループ分けできる。検索系の方法は、エッジ強度、通常、一次導関数式、例えば、勾配度などの測定をまず計算すること、次に、エッジの軌跡配向性、通常、勾配方向の計算された推量を使用して勾配度の軌跡指向性最大値を検索することによりエッジを検出する。ゼロ交差系の方法は、エッジを見つけるために画像から計算された二次導関数式、通常、ラプラスのゼロ交差またはゼロ交差の非線形微分式におけるゼロ交差について検索する。エッジ検出のための前処理工程として、平滑化段階、例えば、ガウス平滑化が適用されてよい。他の実施形態において、雑音除去アルゴリズムが使用されてもよい。
【0102】
公開されているエッジ検出方法は、適用される平滑化フィルタの種類およびエッジ強度の測定が計算される方法が主に異なる。多くのエッジ検出方法が画像勾配の計算に依存することから、それらはまた、xおよびy方向における勾配推量を計算するために使用されるフィルタの種類が異なる。
【0103】
1つの実施形態において、方法は、ボックス集計手続きを使用する。画像は、例えば、コンピュータによりボックスで覆われる。目的は、画像を覆うために必要とされるボックスの数がボックスの大きさと共に、どのように変化するかを見つけることである。目的物が1次、例えば、線であるとき、上述のようにN(s)=(1/s)1が期待される。より高い次元などについても同様である。そのような手続きは、サンプルのデジタル画像を使用してコンピュータにおいて実行することが可能である。
【0104】
1つの実施形態において、データベースは、種々の年齢の多くの異なる非アルツハイマー病コントロール(AC)対象について作られてもよい。データベースは、試験されたヒト対象が、年齢が一致したACデータに対して評価できるように作られてもよい。
【0105】
1つの実施形態において、繊維芽細胞ネットワークの複雑性は、フラクタル次元および空隙性曲線の測定により定量化される。これらの物理学的パラメータにより測定されたネットワークの複雑性はまた、ACおよび非ADD繊維芽細胞と比較したときに、ADから採取された繊維芽細胞について顕著に異なる。ネットワークが変性した後に、例として約48時間後に、細胞は遊走し、数日の後にコンフルエントに達する。1つの実施形態において、この回復は、フラクタル次元における直線的な増加により捕捉される。時間の関数としてフラクタル次元を追跡する各曲線の切片に対する傾きは、3つの群、AC、ADおよび非ADDにおいて顕著に異なる(100%の精度、n=26(AD=10、AC=10、非ADD=6);ACに対するADについてp<0.000l、非ADDに対するADについてp<0.0000l)。この方法は、ACと非ADDとの間の識別可能な相違を示す。
【0106】
細胞形態学的特徴を利用する方法
培養後の短時間内に、例えば、1時間以内に、測定可能なネットワークが形成する。1つの実施形態において、培養は、ゼラチン様タンパク質混合物中で行われ、それは、細胞形態を研究するために実行可能な環境を提供する。ある時間の後、例えば、約1日後、これらのネットワークは変性し、エッジが後退して、測定可能な「凝集塊」または凝集が後に残される。
【0107】
本発明の何れかの方法と同様に、画像は、細胞またはサンプルを得ることと、および細胞またはサンプルをある期間に亘り培養またはインキュベートすることとにより作成されてよい。1つの実施形態において、ある期間は、約48時間である、または何れかの1時間増大区画である。期間中、細胞またはサンプル繊維芽細胞ネットワークは変化する。次に、画像が撮られる。定量的、定性的および半定量的な情報が画像から収集される。
【0108】
1つの実施形態において、画像のある特徴は値を割り当てられてよい。例えば、画像を調査することにより、以下の非包括的および非限定的な特徴が確認されてもよく、任意に値を割り当てられてもよい:(1)大きい凝集塊が存在するか?(2)細胞が凝集塊に対して付着しているか?(3)大きな凝集塊が成長しているか?(4)極僅かの凝集塊が存在しているか?例えば、10倍画像において5未満または5に等しい(5)多数の凝集塊が存在しているか?(例えば、10倍画像において5よりも多く)(6)以前に形成されたネットワークからの残留エッジが(例えば、マトリゲル中に)存在するか?(7)多くの細胞遊走が存在するか?(8)パーコレーションに近い細胞(即ち、画像の左右または上下に実質的に連続的な流れを形成する細胞)であるか?。
【0109】
ある実施形態において、これらの特徴の一部の列記のみが考慮されてもよい。8つのパラメータの2つは、測定された凝集の数あたりの面積の比で表される。この比は、年齢が一致したコントロール(AC)および非アルツハイマー病変性(非ADD)よりもADについてはかなり高い(診断精度96%、N=30(AD=12、AC=10および非ADD=8)ACに対するADについてp<0.00000l、非ADDに対するADについてp<0.0000l)。これらの特徴の何れかまたは全ては、手動または従来技術において公知であるような画像処理方法を介して確認されてもよい。
【0110】
1つの実施形態において、「特徴」、例えば、8つの特徴(またはそのサブセットまたは拡張された特徴セット)が値を割り当てられる。値は、相関研究に従い、例えば、AD細胞との相関またはAC若しくは非ADD細胞との相関に従って割り当てられてよい。1つの実施形態において、上述された(1)〜(4)の特徴は、AD繊維芽細胞と相関し、次に、これらは例えば、存在するときには−1の値が割り当てられ、不在のときには0が割り当てられる。実際の値は、単なる例として示されるが、他の値もまた割り当てられてよい。1つの実施形態において、上述の(5)〜(8)の特徴は、ACおよび非ADD繊維芽細胞と相関する。パーキンソン病(PD)およびハンチントン病(HD)は、非ADD細胞の非限定的な例である。特徴(5)〜(8)は、存在するときには+1の値が割り当てられ、不在のときには0が割り当てられる。1つの実施形態において、割り当てられた値は、各凝集塊について合計されてもよい。合計された値が次に、図4に示されるように、プロットされてもよい。
【0111】
もう1つの実施形態において、特徴の値は、測定される特徴の「強度」に従い中間値が割り当てられてもよい。例えば、特徴(1)である「大きな凝集塊が存在するか?」は、−1(極めて大きな凝集塊に対して)〜0(極めて小さい凝集塊について)の間の何れかの中間値が割り当てられてもよい。例えば、−0.9の値が、比較的「大きな凝集塊」について割り当てられてもよく、−0.8の値が僅かに小さい(それでもまだ「大きい」)凝集塊に対して割り当てられてもよいなどである。上述の特徴(または他の特徴)の何れかについての段階的なスケールは所定の実験を通して策定されてもよい。1つの実施形態において、方法は、画像処理技術を使用して完全に自動化されてもよく、更に特徴の全て(または多分幾つかのみ)が完全な段階的な、即ち、デジタル基準で定量化されてもよい。
【0112】
図4に示されるように、AD細胞、例えば、図5Aに示されるものなどは、特徴として大きな孤立した凝集塊を示し、AC細胞および非ADD細胞と比較して、僅かな遊走〜遊走は不在である。その結果として、AD細胞は、このスキームにおいて、典型的に比較的に小さい数までを合計する値、典型的に負の数を有する。正常なコントロールおよび非ADD繊維芽細胞、例えば、図5Bに示すようなものは、多数のより小さい凝集塊および凝集塊の間の高レベルの遊走を示す。その結果として、このスキームにおいてACおよび非ADD細胞は、典型的に比較的に大きい数までを合計する値、典型的に正の数を有する。上述の方法は、ADの診断のための更なるもう1つの方法を提供する。
【0113】
面積を利用する方法
もう1つの実施形態において、凝集の面積が算出される。例えば、図5B(AC細胞)に示される凝集塊の面積が算出される。これは、何れかの適切な方法により、例えば、これに限定するものではないが、凝集塊を横切る楕円をフィッティングすることにより実行されてよい。次に凝集塊が画像上でカウントされてよい。カウント並びに面積算出は、手動で行われるか、例えば、従来技術において公知の画像処理技術により自動で行われるかの何れかで行われてもよい。図5Bに示される数は、平方ミクロン、μ2の凝集塊の面積を表す。同様に、AD細胞の面積、例えば、図5Aに示されるものが、算出されてよい。例示として、図5Aで示される面積は12.670μ2であり、図5Bに示されるAC細胞の面積と関連付けられるものよりもかなり大きい。凝集塊の数あたりの面積が、図7に示されるようにプロットされてよい。
【0114】
図7は、上述の方法により算出されたときの凝集塊の数あたりの面積の対数プロットである。注目すべきことには、AD細胞についての凝集塊あたりの面積は、ACまたは非ADD細胞の何れかについての凝集塊の数あたりの面積よりも有意に高い。上述の方法は、更なるもう1つのADを診断する方法を提供する。
【0115】
本発明の他の実施形態において、上述の方法の何れかが組み合わされてもよい。例えば、フラクタル次元が算出され、および/または特徴が割り当てられて合計され、および/または凝集塊の数あたりの面積が算出されてもよい。1つの実施形態において、ADの陽性診断は、2つまたは2つ以上の上述の方法が独立して陽性診断を示すときのみになされる。他の実施形態において、ADの陽性診断は、全ての方法(例えば、3つの異なる方法、特に、例えば、フラクタル次元、特徴の合計および面積方法)が独立して陽性診断を示すときのみになされる。他の実施形態において、偽陽性および偽陰性は、「統計学的に有意性」の定義を調整することにより、例えば、上述の変数の何れかについての個体群標準偏差のある倍数で診断閾値を設定することにより回避または最小化することが可能である。
【0116】
本発明の何れかの実施形態において、細胞は、タンパク質混合物中で培養またはインキュベートされてもよい。1つの実施形態において、タンパク質混合物は、ゼラチン様タンパク質混合物である。非限定的な例であるゼラチン様タンパク質混合物は、マトリゲルTMである。マトリゲルTMは、エンゲルブレス−ホルム−スウォーム(Engelbreth−Holm−Swarm、EHS)マウス肉腫細胞から分泌されるゼラチン様タンパク質混合物のための商標名であり、BDバイオサイエンスにより販売されている。この混合物は、多くの組織において見出される複合細胞外環境に類似し、細胞培養のための基質として細胞生物学者により使用される。BDバイサイエンスはhttp://www.bdbiosciences.ca.にウェブサイトを維持する。
【0117】
1つの実施形態において、細胞は、基底膜調製物中で培養またはインキュベートされる。1つの実施形態において、この調製物は、可溶化されている。1つの実施形態において、基底膜調製物は、腫瘍から抽出される。1つの実施形態において、腫瘍は、エンゲルブレス−ホルム−スウォーム(EHS)マウス肉腫、細胞外マトリックスタンパク質に富む腫瘍である。その主な構成要素は、ラミニン、続いてコラーゲンIV、ヘパラン硫酸化プロテオグリカン、エンタクチン/ナイドジェンである。ある実施形態において、この調製物は、TGF−β、上皮成長因子、インスリン様成長因子、繊維芽細胞成長因子、組織プラスミノーゲン活性化因子および/または他の成長因子を含み、それはEHS腫瘍中に天然に存在してもよく、存在しなくともよい。
【0118】
1つの実施形態において、細胞は、細胞外マトリックスタンパク質を含む調製物中で培養またはインキュベートされる。1つの実施形態において、調製物は、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含む。1つの実施形態において、調製物は腫瘍から抽出される。1つの実施形態において、腫瘍は、エンゲルブレス−ホルム−スウォーム(EHS)マウス肉腫である。1つの実施形態において、調製物は更に成長因子を含む。1つの実施形態において、調製物は更にTGF−β、上皮成長因子、インスリン様成長因子、繊維芽細胞成長因子、組織プラスミノーゲン活性化因子、および/またはそれらの組み合わせ、および/または他の成長因子を含む。1つの実施形態において、TGF−β、上皮成長因子、インスリン様成長因子、繊維芽細胞成長因子、組織プラスミノーゲン活性化因子および/または他の成長因子はEHS腫瘍中に天然に存在してもよい。1つの実施形態において、成長因子は、EHSマウス肉腫において天然に存在する。
【0119】
1つの実施形態において、調製物は細胞外マトリックスタンパク質調製物を含み、それは、正常および形質転換された固定依存性類上皮および他の細胞種の両方の付着および分化のために有効である。これらは、ニューロン、肝細胞、セルトリ細胞、ヒヨコ水晶体および血管内皮細胞を含む。1つの実施形態において、細胞外マトリックスタンパク質調製物は、成体ラット肝細胞における遺伝子発現に影響を与えてもよく、並びにマウスおよびヒト乳房上皮細胞における三次元培養に影響を与えてもよい。1つの実施形態において、これは、幾つかの種類の腫瘍細胞浸潤アッセイのための基礎であり、インビボでの末梢神経新生を支持し、インビトロおよびインビボの両方における血管形成の研究のために必要な基質を提供するだろう。1つの実施形態において、細胞外マトリックスタンパク質はまた、インビボにおける免疫抑制マウスにおけるヒト腫瘍の増殖を支持する。
【0120】
1つの実施形態において、ある体積の冷却された細胞外マトリックスタンパク質が組織培養実験機器上に分配される。ここで使用されるとき、「冷却された」は、室温よりも低い温度をいい、好ましくは約15℃未満、更に好ましくは約10℃未満、より好ましくは約5℃未満、最も好ましくは約4℃である。上昇した温度でのインキュベーションされるとき、細胞外マトリックスタンパク質は、自己会合して薄フィルムを形成し、それは実験機器の表面を覆う。ここで使用されるとき、「上昇した」は室温を超える温度をいい、好ましくは約20℃を超える、より好ましくは25℃を超える、より好ましくは約30℃を超える、更に好ましくは約35℃を超える、最も好ましくは37℃を超え、それはおおよそ平均ヒト体温である。
【0121】
細胞外マトリクスタンパク質上で培養された細胞は、複雑な細胞行動を示し、それは実験室条件下で観察されることが困難な他のものである。例えば、内皮細胞は細胞外マトリックスタンパク質でコートされた表面において入り組んだクモの巣様のネットワークを形成するが、プラスチック表面では形成しない。そのようなネットワークは、血液を含む生きた組織を満たす微小血管毛細管系を高度に連想させる。従って、内皮細胞がそのようなネットワークを構築するプロセスは、生物学研究者にとって非常に興味深く、細胞外マトリックスタンパク質はこの観察を可能にする。
【0122】
幾つかの実施形態において、より多くの体積の細胞外マトリックスタンパク質を使用して厚い三次元ゲルを作成することが好ましいかもしれない。厚いゲルの有用性は、それらが表面からのゲル内部への細胞の遊走を誘導することである。幾つかの実施形態において、この遊走行動は、研究者によって腫瘍細胞転移のモデルとして研究される。
【0123】
細胞外マトリックスタンパク質の複雑な細胞行動を刺激する能力は、それらの不均一組成の結果である。幾つかの実施形態において、細胞外マトリックスタンパク質の主な成分は、構造タンパク質、例えば、ラミニンおよびコラーゲンなどであり、それらは、一連の接着ペプチドを有する培養細胞に提示され、それはそれらの自然環境において接触するであろうものである。幾つかの実施形態はまた、成長因子を使用し、それは多くの細胞種の分化と増殖を促進する。細胞外マトリックスタンパク質はまた、少量中に多数の他のタンパク質を含んでもよい。
【0124】
ここで開示されるような繊維芽細胞ネットワーク複雑性のダイナミクスの測定は、最小限の侵襲的な手順でAD患者の診断するための新たな機会を提供する。AD脳おける神経ネットワークと同様に、ヒト皮膚繊維芽細胞ネットワークは、ACおよび非ADD細胞と比較してフラクタル次元により測定されるような複雑性の減少を示す。ヒト皮膚繊維芽細胞ネットワークは、正確なAD診断および薬物スクリーニングのために有用な脳ネットワークモデルを提供する。
【0125】
全ての書物、論文または特許文献は、ここにおいて参照することにより本開示に矛盾することなく、本明細書に組み込まれる。本発明は、以下に例として記載されるが、それは説明を意図するものであり、本発明の範囲を制限するものではない。
【0126】
例1:BD還元マトリゲルマトリックス成長因子での12ウェルプレートのコーティング
装置および物質:クラスIIA/B3生物学的安全キャビネット(Forma Scientific)。C02水−ジャケットインキャベータ(Forma Scientific)。倒立顕微鏡。パスツールピペット。血清学的ピペット。ピッペトエイド(Omega Cat.No.P5017)、BD還元マトリゲルマトリックス成長因子(BD Biosciences、Cat.No.354230)(アリコート800μLおよび−20℃で貯蔵)。滅菌12ウェル培養プレート(Coming Inc.,Cat. No.3S12)。
【0127】
手順:使用前にBD還元マトリゲルマトリックス成長因子を氷上4℃で30分間解凍し、前冷却されたピペット、チップおよび12ウェル培養プレートを使用する。マトリゲルが液体であり、固体凝集を有さないことを確認する。
【0128】
厚いゲル方法:冷却ピペットを用い、BD還元マトリゲルマトリックス成長因子を均質に混合する。使用前および1ウェルあたり700μLのBD還元マトリゲルマトリックス成長因子の添加中に12ウェル培養プレートを氷上で30分間維持する。細胞培養プレートの表面上のゲルの均一性を倒立顕微鏡下で検証し、気泡回避する。12ウェルプレートを37℃で30分間配置する。BD還元マトリゲルマトリックス成長因子の頂部に細胞懸濁液を添加する。細胞の密度は、50細胞/mm3に調整する(下記参照)。
【0129】
例2;播種のためのヒト皮膚繊維芽細胞の調製
装置および物質。クラスIIA/B3生物学的安全キャビネット(Forma Scientific)。C02水−ジャケットインキュベータ(Forma Scientific)。倒立顕微鏡。T−E(トリプシン−EDTA溶液1倍)(−20℃で貯蔵)。M−2(培地2)10%FBSおよび1%PS含有のDMEM。パスツールピペット。血清学的ピペット。ピッペトエイド(Omega Cat.No.P5017)。培養フラスコ、ベントキャップ、25cm2。15mLおよび50mL滅菌プラスチックチューブ。500mLボトルトップフィルタ。水浴遠心機。
【0130】
手順:T−EおよびM−2培地を水浴中、37℃で解凍および暖める。
【0131】
組織断片を含むフラスコ培養:培養培地を吸引によってフラスコから除去および廃棄する。トリプシンを不活性化できる血清残渣を除去するために、2mLのT−Eを添加し、直ちに吸引する。フラスコに対して2mLのT−Eを添加し、37℃で3〜5分間インキュベートする。培養フラスコ表面からの細胞の剥離時間は全ての患者について同一ではなく、3〜5分間の範囲で各症例について調整することが必要である。
【0132】
顕微鏡下での細胞の観察:丸みを帯びているときには、それらは剥離している。大部分が丸みを帯びていないときには、それらが丸みを帯びているように見えるまで、懸濁液をインキュベータ内に更に1分間または2分間放置する。5mLのM−2培地を添加し、トリプシン活性化を阻害する。ピペッティングによって穏やかに撹拌し、フラスコの底から細胞を剥離するが、細胞断片に接触または組織断片が剥離しないように気をつける。(ピペットによって)細胞懸濁液を15mL滅菌プラスチックチューブに移し、それを1000RPM(スピード3)で5分間遠心分離し、上清を廃棄し、細胞を3mLのM−2培地に懸濁する。ピペッティングによって穏やかに撹拌し、15mLの滅菌プラスチックチューブの底から細胞を剥離する。
【0133】
例3:ヒト皮膚繊維芽細胞のカウント
装置および物質。クラスIIA/B3生物学的安全キャビネット(Forma Scientific)。倒立顕微鏡。細胞カウントチャンバ−レビィダブル(VWR scientific,Cat.No.15170−208)。パスツールピペット。血清学的ピペット。ピッペトエイド(Omega Cat.No.P5017)。滅菌12ウェル培養プレート(Coming Inc.,Cat.No.3512)。
【0134】
手順:0.25mLの細胞懸濁液を細胞カウントチャンバに添加し、頂部にカバーガラスを置く。
【0135】
繊維芽細胞を含む細胞カウントチャンバ−レビィダブル:細胞を固定し、次に倒立顕微鏡下で9つの大四角内の細胞の数をカウントする。10を乗じた細胞の平均数(AvC)は、細胞/mm3の数で表される細胞の密度(DC)を与える。細胞懸濁液をM−2培地で希釈し、1.5mLの総体積中に50細胞/mm3の密度を達成する。細胞懸濁液について(1.5ml)x(50)/AvCを用いて、M−2培地で1.5mLまで完全に配置する。3つのウェルを各細胞株について使用する。従って、工程における数3に3を掛ける。15mLの滅菌プラスチックチューブ内に4.5mLの混合物を調製し、10mLのピペットを使用して穏やかに均質化する。3つのウェルのそれぞれに1.5mLを添加する。3つのウェルプレートに患者コード、日付および継代数をラベルする。12ウェル培養プレートの外側に70%のEtOHをスプレーし、インキュベータ内に配置する。
【0136】
例4:画像分析を経るヒト皮膚繊維芽細胞の初期細胞密度の検証
装置および物質:倒立顕微鏡。イメージJ。
【0137】
手順:インキュベータ内での10分間の後に、12ウェル培養プレートを取り出し、倒立顕微鏡下に置く。
【0138】
画像分析を使用する細胞カウント:4倍対物レンズ下で、視野の中心にウェルの中心を配置する。10倍の対物レンズに換えて、左/右および上/下に1つの視野を動かすことにより中心に加えて他の4つの視野で1つの画像を得る。イメージJ下で画像を読み込み、処理/雑音/デスペックルに進む。次に処理/雑音/二値/二値生成に進む。二値画像を2〜3回デスペックルし、次に細胞カウントのために分析/粒子分析を使用する。結果は、合計/カウント下にある。細胞の自動カウントは、手動カウントの〜12%の差で多く見積もり過ぎることに注意する。初期細胞密度についてのより低い閾値は、45細胞/mm3であり、それは、10倍下で細胞数にして190細胞に対応し、1.4のフラクタル次元に対応する。初期細胞密度についてのより高い閾値は、62細胞/mm3であり、それは10倍下で細胞数にして650細胞に対応し、1.62のフラクタル次元に対応する。2つの閾値の外側に平均細胞数を有する何れのウェルも破棄される。
【0139】
例5:方法1:スコア
装置および物質:倒立顕微鏡(Westover Digital AMID Model 2000)。ミクロン2.0.0ウェストオーバー・サイエンティフィック2008(Micron 2.0.0 Westover Scientific 2008)。イメージJ。
【0140】
手順:48時間で写真を撮り、後に8つの基準に基づいて総スコアを測定する。3つの基準(1、4および5、以下を参照)は、凝集の数あたりの平均面積により定量的に表される。
【0141】
スクリーニングのために使用されるパラメータ:
1.大きな凝集の存在
2.凝集に対する細胞の付着
3.凝集成長の兆候
4.少数の凝集(10倍画像において<10)
5.多数の凝集(10倍画像において>10)
6.ネットワーク内の測定可能なエッジ
7.細胞遊走の兆候
8.パーコレーション限界に対する近さ(細胞は連続的な流れを形成する)。
【0142】
総スコア:(1)最初の4つのパラメータは、アルツハイマー病(AD)に特異的であり、存在するときには「−1」の点数が付けられ、不在のときには「0」が付けられる。(2)後の4つのパラメータは年齢が一致したコントロール(AC)に対して、および非アルツハイマー病認知症(非ADD)に対して特異的であり、存在するときには「+1」の点数が付けられ、不在のときには「0」が付けられる。(3)8つの値の全ての合計としての総スコアの算出する。総スコアが正またはゼロであるときには、細胞はACまたは非ADDである。総スコアが負のときには、細胞はADである。
【0143】
凝集の数あたりの平均面積:(1)ミクロン2.0.0に画像を取り込み、測定/楕円面積下で1つ1つ凝集を測定する。凝集に楕円をフィッティングし、面積がソフトウエアにより自動的に提供される。(2)集計表に面積を集め、凝集の数を関数「カウント」で自動的に抽出する。(3)各画像について平均面積と凝集の平均数、並びに2つの比を算出する。(4)各ウェルについて5つの画像の全てについて#凝集あたりで面積を平均化する。(5)細胞株について3つのウェルの全てについて#凝集あたりで面積を平均化する。(6)#凝集あたりの面積が1000よりも小さいときには、細胞株はACまたは非ADDであり、1000よりも大きいときには、細胞はADである。
【0144】
例6:方法2;フラクタル分析
装置および物質:倒立顕微鏡(Westover Digital AMID Model 2000)。イメージJ。プラグ・イン・フラックラック(Plug in FracLac)。
【0145】
手順:48時間後に写真撮影およびフラクタル次元を算出する。
【0146】
スクリーニングのために使用されるパラメータ:(1)大きな凝集の存在。
【0147】
例7:培地の調製
培地の調製:DMEM(高グルコース)、Cat.No.10313−039、インビトロジェン・ギブコ(4℃冷蔵庫内で貯蔵);FBS、Cat.No.10082−147、インビトロジェン・ギブコ(アリコート50mLおよび−20℃で貯蔵);PS(ペニシリンおよびストレプトマイシン溶液)Cat.No.15140−122、インビトロジェン(アリコオート5mLおよび−20℃で貯蔵)。M−1(培地1)、45%および1%のPSを含むDMEM。M−2(培地2)10%および1%のPSを含むDMEM。濾過、表示および4℃冷蔵庫内で1ヶ月まで貯蔵)。
【発明の概要】
【0001】
本発明は、2009年10月2日出願の米国仮出願61/248,368、2010年5月13日出願の米国仮出願61/344,045、2010年7月8日出願の米国仮出願61/362,518および2010年7月19日出願の米国仮出願61/365,545の優先権を主張するものであり、それらの開示は、それらの全体において参照することによりここに組み込まれる。
【0002】
[発明の分野]
本発明は、バイオマーカーとして繊維芽細胞成長パターンを使用するアルツハイマー病を診断する方法に関する。
【0003】
[発明の背景]
アルツハイマー病は、神経変性障害であり、進行性の記憶力および認知機能の低下により特徴づけられる。500万人を超えるアメリカ人が、進行的な不治の病と共に生きていると推定される。アルツハイマー病は、脳細胞を破壊し、記憶障害と生活の質を低下する思考および行動の問題を引き起こす。ADには、既知の治療法がないが、症状の治療は、ADを患う100万人の人々および彼らの家族の生活の質を改善できる。ADの早期診断は、生活の質を最大にする選択を行うための時間を患者に与え、未知の問題についての不安を減少し、未来について計画するためのより多くの時間を与え、治療からの利益のよりよい機会を提供する。
【0004】
アルツハイマー病を診断するための高感受性であり、且つ高度に特異的な試験の必要性が存在する。本発明者らは、これまでの既知の診断試験に比べて高感受性であり、且つ高度に特異的な様式におけるアルツハイマー病の診断のために有用な独自のアルツハイマー病特異的なバイオマーカーを初めて特定した。特に、本発明者らは、アルツハイマー病の診断のためのバイオマーカーとしての繊維芽細胞成長パターンを特定した。従って、ここにおいて開示される独自のアルツハイマー病特異的なバイオマーカーは、アルツハイマー病の検出および診断のために高度な感受性と特異性とを有する診断方法のための基礎として役立つ。本発明の独自のアルツハイマー病特異的なバイオマーカーはまた、脳ネットワークのモデルとして、並びにアルツハイマー病の治療および予防において治療剤として使用され得る化合物を同定するためのスクリーニング方法のために有用であってよい。
【0005】
[発明の概要]
ある好ましい実施形態において、本発明は、5つの別々の手順に向けられるアッセイ、ここにおいて(1)集積スコア法;(2)凝集の数あたりの平均凝集面積法;(3)細胞遊走分析法;(4)フラクタル分析法;および(5)空隙性分析法;と称される手順を使用するアルツハイマー病の診断方法に向う。
【0006】
ある実施形態において、本発明は、ヒト対象におけるアルツハイマー病の診断方法であって、(a)ヒト対象から1つまたは1つ以上の細胞を得ること;(b)1つまたは1つ以上の細胞をある期間に亘り培養すること;(c)細胞凝集の平均面積を測定し、平均面積を凝集の数で割って、凝集の数あたりの面積を得ること;(d)工程(c)の結果と非アルツハイマー病細胞を用いて測定された凝集の数あたりの面積とを比較すること;および(e)工程(d)の比較に基づいて、アルツハイマー病の存在または不在を診断すること;の工程を含む方法に向う。
【0007】
工程(c)において測定された凝集の数あたりの面積が、工程(d)において測定された凝集の数あたりの面積よりも大きいときには、方法はアルツハイマー病が陽性であることを示す。ある好ましい実施態様において、差は統計学的に有意である。
【0008】
好ましい実施形態において、診断は、1つまたは1つ以上の更なる診断方法を使用して確認される。1つまたは1つ以上の更なる診断方法は、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法、および空隙性分析を含む方法からなる群より選択される。
【0009】
好ましい実施形態において、ここで開示される方法は、繊維芽細胞である細胞を使用するが、血液細胞または神経系細胞などの他の細胞が使用されてもよい。
【0010】
実施形態において、既知の非アルツハイマー病細胞は、AC細胞である。
【0011】
ある実施形態において、細胞はタンパク質混合物中で培養される。タンパク質混合物は、細胞外マトリックス調製物を含み、それはラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよびそれらの組み合わせを含む。タンパク質混合物は、更に成長因子を含んでもよい。細胞外マトリックスタンパク質は、腫瘍から抽出されてよい。ある実施形態において、腫瘍はEHSマウス肉腫である。
【0012】
ある実施形態において、本発明は、(a)ヒト対象から1つまたは1つ以上の細胞を得ること;(b)1つまたは1つ以上の細胞をある期間に亘り培養すること;(c)前記ある期間の終わりに細胞の画像を得ること;(d)画像における細胞のネットワークに関するフラクタル次元を決定すること;(e)工程(d)の結果と既知の非アルツハイマー病細胞に関して独立して決定されたフラクタル次元とを比較すること;を含む方法に向う。
【0013】
ある実施形態において、工程(d)において算出されたフラクタル次元が、既知の非アルツハイマー病細胞に関するフラクタル次元よりも統計学的に有意に低いときに、比較はアルツハイマー病を示す。
【0014】
好ましい実施形態において、ADは、1つまたは1つ以上の更なる診断方法を使用して確認される。1つまたは1つ以上の更なる診断方法は、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される。
【0015】
ある実施形態において、フラクタル次元は、ボックス集計手続きを使用して算出される。ある実施形態において、ボックス集計手続きは、エッジ検出手続きを含む。
【0016】
ある実施形態において、対象は、既知の非アルツハイマー病細胞を提供するコントロール対象と年齢が一致する。ある実施形態において、細胞培養期間は、約24時間または約36時間または約48時間である。
【0017】
ある実施形態において、細胞は、タンパク質混合物中で培養される。タンパク質混合物は、細胞外マトリックス調製物を含んでもよく、それは、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含んでもよい。タンパク質混合物は、更に成長因子を含んでもよい。細胞外マトリックスタンパク質は、腫瘍から抽出されてもよい。ある実施形態において、腫瘍はEHSマウス肉腫である。
【0018】
ある実施形態において、本発明は、(a)ヒト対象からの繊維芽細胞のネットワークの画像のフラクタル次元を決定すること;(b)既知の非アルツハイマー病細胞からの繊維芽細胞のネットワークの画像のフラクタル次元を決定すること;(c)工程(a)および(b)の結果を比較すること;を含む方法に向う。
【0019】
ある実施形態において、工程(a)において決定されたフラクタル次元が、工程(b)において決定されたフラクタル次元よりも統計学的に有意に低いときには、診断はアルツハイマー病を示す。
【0020】
ある実施形態において、対象は、既知の非アルツハイマー病細胞を提供するコントロール対象と年齢が一致する。
【0021】
ある実施形態において、本発明は、(a)対象からの繊維芽細胞のネットワークの画像のフラクタル次元を算出すること;(b)工程(a)の結果と、既知の非アルツハイマー病細胞に関して独立して決定されたフラクタル次元とを比較すること;を含むヒト対象におけるアルツハイマー病の診断方法に向い、ここで、工程(a)において算出されたフラクタル次元が、既知の非アルツハイマー病細胞に関するフラクタル次元よりも統計学的に有意に低いときに、診断は、対象におけるアルツハイマー病について陽性である。
【0022】
ある実施形態において、対象は、既知の非アルツハイマー病細胞を提供するコントロール対象と年齢が一致する。
【0023】
ある実施形態において、本発明は、ヒト対象におけるアルツハイマー病の診断方法であって、(a)外科用刃を使用して対象の末梢皮膚繊維芽細胞のサンプルを得ること;(b)インキュベータを使用してサンプルをある期間に亘りインキュベートすること;(c)撮像装置を使用してある期間の終わりにサンプルの画像を得ること;(d)コンピュータを使用して画像における繊維芽細胞のネットワークに関するフラクタル次元を算出すること;(e)工程(d)の結果を、既知の非アルツハイマー病細胞に関して独立して決定されたフラクタル次元と比較すること;を含み、ここにおいて、工程(d)で算出されたフラクタル次元が、既知の非アルツハイマー病細胞に関するフラクタル次元よりも統計学的に有意に低いときに、診断は、対象におけるアルツハイマー病について陽性である方法に向う。
【0024】
ある実施形態において、細胞はタンパク質混合物中で培養される。タンパク質混合物は、細胞外マトリックス調製物を含んでよく、それはラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含んでよい。タンパク質混合物は、更に成長因子を含んでもよい。細胞外マトリックスタンパク質は、腫瘍から抽出されてもよい。ある実施形態において、腫瘍はEHSマウス肉腫である。
【0025】
ある実施形態において、本発明は、ヒト対象においてアルツハイマー病を診断する方法に向い、当該方法は、(a)外科用刃を用いて、対象の末梢皮膚繊維芽細胞のサンプルを得ることと;(b)インキュベータを用いて、サンプルをある期間に亘りインキュベートすることと;(c)撮像装置を用いて、前記ある期間の終わりにサンプルの画像を得ることと;(d)コンピュータを用いて画像における繊維芽細胞のネットワークに関するフラクタル次元を算出することと;(e)コンピュータを用いて、工程(d)のフラクタル次元を、種々の年齢のコントロール対象から得られた非アルツハイマー病細胞から生成されたフラクタル次元を有するデータベースに入力することと;(f)コンピュータを用いて、工程(d)の算出されたフラクタル次元を、データベースのデータと比較することにより、対象を診断することと;含む。
【0026】
ある実施形態において、サンプルはゼラチン様タンパク質混合物中でインキュベートされる。
【0027】
ある実施形態において、細胞は、ゼラチン様タンパク質混合物中で培養またはインキュベートされる。タンパク質混合物は、細胞外マトリックス調製物であってよく、それは、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含んでもよい。タンパク質混合物は、更に成長因子を含んでもよい。細胞外マトリックスタンパク質は、腫瘍から抽出されてもよい。ある実施形態において、腫瘍はEHSマウス肉腫である。
【0028】
ある実施形態において、本発明は、種々の年齢のコントロール対象から得られた非アルツハイマー病細胞から生成されたフラクタル次元データのデータベースを有するコンピュータ読み取り可能媒体に向い、当該媒体は、(a)画像のフラクタル次元を算出する;
(b)フラクタル次元を、フラクタル次元データのデータベースと比較する;および
(c)工程(b)の比較に基づいて、診断を出力する;ための命令を含む。
【0029】
ある実施形態において、本発明は、(a)ヒト対象からの皮膚細胞をある期間に亘り培養することと;(b)細胞の繊維芽細胞のネットワークに関連する細胞形態学的特徴を測定することと;(c)細胞形態学的特徴に関する演算を行うことと;(d)工程(c)の結果と、既知の非アルツハイマー病細胞に関連する独立して決定されたパラメータと比較することと;を含む方法に向う。
【0030】
ある実施形態において、細胞形態学的特徴は、繊維芽細胞凝集塊(または凝集)の数、繊維芽細胞凝集塊(または凝集)の大きさ、繊維芽細胞凝集塊(または凝集)の成長率およびそれらの組み合わせからなる群より選択される。
【0031】
ある実施形態において、細胞形態学的特徴は、大きい凝集塊(または凝集)の存在または不在、凝集塊(または凝集)に対して付着した細胞の存在または不在、大きな凝集塊(または凝集)成長の存在または不在、凝集塊(または凝集)の数、以前に形成された凝集塊(または凝集)のネットワークからの残留エッジの存在または不在、細胞遊走の数、パーコレーションに近い細胞の存在または不在である。
【0032】
ある実施形態において、工程(c)の演算は、それぞれの細胞形態学的特徴に対して離散値を割り当てること、および前記値を合計することを含む。
【0033】
ある実施形態において、合計は、ADの診断またはADの不在の診断のために使用される。
【0034】
ある実施形態において、細胞は、タンパク質混合物中で培養される。タンパク質混合物は、細胞外マトリックス調製物を含んでもよく、それは、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含んでもよい。タンパク質混合物は、更に成長因子を含んでもよい。細胞外マトリックスタンパク質は、腫瘍から抽出されてもよい。ある実施形態において、腫瘍はEHSマウス肉腫である。
【0035】
ある実施形態において、本発明は、対象においてアルツハイマー病を診断する方法であって、(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程;(b)ある期間を超えた1つまたは1つ以上の細胞のフラクタル次元を測定する工程;(c)フラクタル次元を時間の関数としてプロットしてフラクタル次元曲線を得る工程;(d)フラクタル次元曲線を、非アルツハイマー病細胞および非アルツハイマー病認知症(非ADD)細胞から得たフラクタル次元曲線と比較する工程;および(e)対象においてアルツハイマー病の存在または不在を診断する工程;を含む方法に向う。
【0036】
ある実施形態において、対象から得られた1つまたは1つ以上の細胞から測定されたフラクタル次元曲線が、非アルツハイマー病細胞および非ADD細胞から得たフラクタル次元曲線とは統計学的に有意に異なるときに、診断は、対象におけるアルツハイマー病について陽性である。
【0037】
ある実施形態において、対象から得られた1つの細胞または1つ以上の細胞は繊維芽細胞である。
【0038】
好ましい実施形態において、診断は1つまたは1つ以上の更なる診断方法を使用して確認される。1つまたは1つ以上の更なる診断方法は、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される
ある実施形態において、本発明は、対象においてアルツハイマー病を診断する方法であって、(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程と;(b)培養された細胞の1つまたは1つ以上の特徴に基づいて集積スコアを決定する工程と;(c)集積スコアを、非アルツハイマー病細胞について決定された集積スコアと比較する工程と;(d)対象におけるアルツハイマー病の存在または不在を診断する工程と;を含む方法に向う。
【0039】
ある実施形態において、集積スコアを算出するために使用される特徴は、凝集の大きさ、凝集に対する細胞の付着、凝集成長の兆候、凝集の数、ネットワーク内のエッジ、細胞遊走の兆候およびパーコレーション限界に対する近さ(または細胞密度)からなる群より選択される。
【0040】
好ましい実施形態において、診断は1つまたは1つ以上の更なる診断方法を使用して確認される。1つまたは1つ以上の更なる診断方法は、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される。
【0041】
ある実施形態において、本発明は、対象においてアルツハイマー病を診断する方法であって、(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程と;(b)遊走細胞の数を決定する工程と;(c)遊走細胞の数を、非アルツハイマー病細胞についての遊走細胞の数と比較する工程と;(d)対象におけるアルツハイマー病の存在または不在を診断する工程と;を含む方法に向う。
【0042】
ある実施形態において、対象から得られた遊走細胞の数が、遊走非アルツハイマー病細胞の数よりも統計学的に有意に小さいときに、診断は、ADについて陽性である。
【0043】
ある実施形態において、細胞は繊維芽細胞である。
【0044】
好ましい実施形態において、診断は1つまたは1つ以上の更なる診断を使用して確認される。1つまたは1つ以上の更なる診断方法は、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される。
【0045】
ある実施形態において、本発明は、対象においてアルツハイマー病を診断する方法であって、(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程と;(b)細胞の空隙性を決定する工程と;(c)細胞の空隙性を、非アルツハイマー病細胞の空隙性と比較する工程と;(d)対象におけるアルツハイマー病の存在または不在を診断する工程と;を含む方法に向う。
【0046】
ある実施形態において、対象から得られた細胞の空隙性が、非アルツハイマー病細胞の空隙性よりも統計学的に有意に高いときに、診断は、ADについて陽性である。
【0047】
好ましい実施形態において、診断は1つまたは1つ以上の更なる診断を使用して確認される。1つまたは1つ以上の更なる診断方法は、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される。
【0048】
ある実施形態において、細胞は繊維芽細胞である。
【0049】
ある実施形態において、本発明は、アルツハイマー病の治療または予防のための1つまたは1つ以上の薬物候補を開発するために有用なリード化合物をスクリーニングする方法であって、(a)細胞培養培地において1つまたは1つ以上のAD細胞を培養する工程と;(b)AD細胞を化合物と接触させる工程と;(c)AD細胞の1つまたは1つ以上の特徴が、化合物と接触されていない非アルツハイマー病細胞の特徴のように変化しているか否かを決定する工程と;を含む方法に向う。
【0050】
ある実施形態において、細胞は繊維芽細胞である。
【0051】
ある実施形態において、特徴は、フラクタル次元または集積スコアまたは凝集の数あたりの平均凝集面積または細胞遊走または空隙性である。
【0052】
ある実施形態において、本発明は、対象におけるアルツハイマー病持続期間を決定する方法であって、(a)対象から1つまたは1つ以上の細胞を得ること;(b)既知のAD細胞株について、細胞遊走特性または凝集の数あたりの平均面積を測定すること;(c)工程(b)において得られたデータを使用して検量線を作成すること;工程(a)において得られた細胞について遊走特性または凝集の数あたりの平均面積を測定すること;および(d)対象におけるAD病持続期間を決定すること;を含む方法に向う。
【0053】
ある実施形態において、細胞は繊維芽細胞である。
【0054】
ある実施形態において、対象は、10、9、8、7、6、5、4、3、2または1年または1年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される。
【0055】
ある実施形態において、本発明は、対象におけるアルツハイマー病(AD)の存在と非アルツハイマー病認知症(非ADD)の存在とを識別する方法であって、(a)対象から1つまたは1つ以上の細胞を得ることと;(b)ある期間を越えて1つまたは1つ以上の細胞のフラクタル次元を測定することと;(c)フラクタル次元を時間の関数としてプロットしてフラクタル次元曲線を得ることと;(d)フラクタル次元曲線を、既知の非アルツハイマー病細胞、既知の非アルツハイマー病認知症(非ADD)細胞および既知のAD細胞から得られたフラクタル次元曲線と比較することと;(e)対象におけるADと非ADDとを識別することと;を含む方法に向う。
【0056】
ある実施形態において、細胞は繊維芽細胞である。
【0057】
ある実施形態において、本発明は、対象におけるアルツハイマー病の存在と非アルツハイマー病認知症の存在とを識別する方法であって、(a)対象から1つまたは1つ以上の細胞を得ることと;(b)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養することと;(c)遊走細胞の数を決定することと;(d)遊走細胞の数を、既知の非アルツハイマー病細胞、既知のAD細胞および既知の非ADD細胞についての遊走細胞の数と比較することと;(e)対象におけるADと非ADDとを識別することと;を含む方法に向う。
【0058】
ある実施形態において、細胞は繊維芽細胞である。
【0059】
1つの実施形態において、本発明は、ヒト対象においてアルツハイマー病を診断する方法であって、(a)対象からの繊維芽細胞のネットワークの画像のフラクタル次元を算出すること;(b)工程(a)の結果を、既知の非アルツハイマー病細胞に関して独立して決定されたフラクタル次元と比較すること;ここにおいて、工程(a)において算出されたフラクタル次元が、既知の非アルツハイマー病細胞に関するフラクタル次元をよりも統計学的に有意に低いときに、診断は陽性であり、或いは、そうでないときには、診断は陰性である;および(c)診断すること;を含む方法を提供する。
【図面の簡単な説明】
【0060】
【図1】繊維芽細胞の初期準備。
【図2】集積スコアプロトコール。
【図3】フラクタル分析プロトコール。
【図4】集積スコア法。播種後48時間での皮膚細胞繊維芽細胞についての8つの特徴の合計を表す総スコア(AC=年齢が一致したコントロール:AD=アルツハイマー病;非ADD=非アルツハイマー病、例えば、パーキンソン病(PD)およびハンチントン病(HD))認知症)。
【図5】図5Aおよび図5B;アルツハイマー病繊維芽細胞(A)および正常コントロール(B)についての凝集の例。面積は、凝集に渡って楕円をフィッティングすることによりμm2で測定され、凝集は、10倍の画像において手動でカウントされた。楕円は、凝集のエッジが楕円の内側に入るように、各凝集を渡ってフィッティングされた。同様の手順が全ての画像の全域で一様に使用された。
【図6】48時間での繊維芽細胞。31細胞株について凝集の数あたりの平均面積:年齢が一致したコントロール(NAC=10)、アルツハイマー病(NAD=12)および非アルツハイマー病認知症(NNon-ADD=9)、例えば、パーキンソン病(PD)およびハンチントン病(HD)。エラーバーは、平均値の標準誤差を表す。
【図7】結果の再現性。4つの繰り返された細胞株についての凝集の数あたりの平均面積。実験は、同じ細胞株について少なくとも1か月離した。細胞の初期の数は10%以内であった。
【図8】図8Aおよび図8B;赤色のドットで印を付けた自由な遊走細胞の例。播種後48時間でのアルツハイマー病(AD)繊維芽細胞、左図(図8A)および非アルツハイマー病認知症(非ADD;ハンチントン病)繊維芽細胞、右図(図8B)。
【図9】遊走細胞の数に対する遊走率。緑色四角−アルツハイマー病(nAD=10)、青色三角−非アルツハイマー病認知症(nNon−ADD=7)および赤色円−年齢が一致したコントロール(nAC=9)。青色線は分離閾値である。
【図10】遊走率を遊走細胞の数に掛ける。緑色四角−アルツハイマー病(nAD=10)、青色三角−非アルツハイマー病認知症(nNon−ADD=7)および赤色円−年齢が一致したコントロール(nAC=9)。
【図11】図11Aおよび図11B;フラクタル分析。図11A:フラクタル曲線と回復領域にフィットした直線の例。図11B:フラクタル曲線の切片に対する傾きを示す母集団データ(N=31;NAC=10;NAD=12;NNon−ADD=9)。
【図12】空隙性分析。図12A:空隙性曲線の例。図12B:平均空隙性を示す母集団データ(N=8;NAC=1;NAD=4;Nnon−ADD=3)。
【図13】12ウェルプレート内でのマトリゲルの厚さと体積の間の比例関係。マトリゲル体積が400〜800μLの範囲にあるとき、マトリゲル層の厚さは1.04〜2.08mmの範囲にある。
【図14】マトリゲルの初期体積におけるフラクタル次元と空隙性の検出感度。フラクタル次元(図14A)と空隙性(図14B)は、大きい量のマトリゲル、600μL(赤色)、700μL(ピンク)および800μL(青緑色)と比較して、少量のマトリゲル、400μL(赤色)と500μL(緑色)について定性的に異なる傾向を有する。大きい量(>600μL)については、より多くのマトリゲルが添加されるほど、フラクタル次元(図14A)と空隙性(図14B)における影響はより大きくなる。参考のために、以前の実験の全てにおいて、我々は700μLのマトリゲルを使用した。
【図15】図15Aおよび図15B;マトリゲルの初期体積における48時間でのAD凝集の検出感度。図15A:マトリゲルの初期体積に対する48時間および79時間での凝集数あたりの面積。図15B:マトリゲルの初期体積の関数としての面積/数についての変化率。グラフは(1)700μLのマトリゲルを使用することの重要性を示し、そこにおいて曲線は、ピークと影響が最大であることを示す。(2)アルツハイマー病凝集の大きさの増大と、この時間枠40〜80時間における数の減少。これは、パネルAにおいて、2つの異なる時点、48時間および79時間での数あたりの凝集面積を示すことにより示される。緑色曲線は、赤色曲線の上部にあり、これは、面積における成長および/または数の減少を示す。実験的に両方が観察される。パネルBは、48時間〜79時間でのこの測定面積/#における変化率を示す。言い換えれば、パネルAからの曲線を取り、それらを差し引き、時間間隔で割る。AD繊維芽細胞は、40時間後に、凝集から離れて遊走することはできない。従って、凝集は、この時間枠内でAD細胞についてより大きく成長する。コントロール、AC、の場合について、これは観察されず、細胞は凝集から離れて遊走することができる。
【図16】インキュベーションの24時間後の年齢が一致するコントロール(AC)繊維芽細胞ネットワークの描写。
【図17】インキュベーションの24時間後のアルツハイマー病患者繊維芽細胞ネットワークの描写。
【図18】時間に対するACおよびAD対象のフラクタル次元の描写。
【図19】インキュベーションの24時間後のACに対するADのネットワークのフラクタル次元の描写。
【図20】図20Aおよび図20B;図21A:AD繊維芽細胞株。罹患期間に伴う凝集の数あたりの平均凝集面積の直線的な増加を示すグラフ。言い換えれば、直接関係が、罹患期間と(平均凝集面積)/(凝集の数)との間に存在する。各四角に隣接する数は、試験された細胞株の数である。図20B:AD繊維芽細胞株。罹患期間と遊走細胞の数の間の線形相関。各四角に隣接する数は、試験された細胞株の数である。これらの相関関係を使用して、アルツハイマー病の早期、中期および後期にある患者を同定することが可能である。疾患の早期にある患者は、治療に対する高い反応性を有する。患者がどれくらいの期間に亘りアルツハイマー病を有しているかを知ることは、治療の目的と治療管理で使用される戦略を患者毎に導くことを助ける。
【詳細な説明】
【0061】
略語:AC:年齢が一致するコントロール;AD:アルツハイマー病;AvC:細胞の平均数;DC:細胞の密度;DMEM:ダルベッコ改変イーグル培地;EtOH:エタノール;FBS:ウシ胎仔血清;非ADD:非アルツハイマー病認知症;RM:室温。
【0062】
ここで使用されるとき、「空隙性」は、フラクタルが空間を満たす程度をいう。更に、それはフラクタルを分類およびテクスチャするために使用され、それらは、同じフラクタル次元を共有してもよいと同時に、非常に視覚的に異なっても見える。密度の高いフラクタルは、低い空隙性を有する。フラクタルの粗さが増大すると、空隙性;直感的に「ギャップ」を意味する間隙も増大する(より大きなギャップ=より高い空隙性)。空隙性は一般的に記号Lにより示される。
【数1】

【0063】
ある実施形態における本発明は、末梢皮膚繊維芽細胞を使用するアルツハイマー病を診断する方法に関する。本発明の様々な実施形態において、繊維芽細胞の定量的、定性的および/または半定量的な側面が使用され、ADの存在または不在が決定される。
【0064】
1つの実施形態において、方法は、フラクタル次元測定を用いてヒト皮膚繊維芽細胞ネットワークの複雑性の定量化を含む。もう1つの実施形態において、方法は、皮膚繊維芽細胞の特徴の合計に基づいて、総スコアを算出することを含む。もう1つの実施形態において、方法は、皮膚繊維芽細胞の凝集塊の数あたりの面積を算出することを含む。方法は、非AD認知症症例および年齢が一致したコントロール(AC)症例からAD患者を早期にスクリーニングすることを可能にする。
【0065】
末梢皮膚繊維芽細胞を使用するアルツハイマー病(AD)を診断する方法が記載される。この方法は、特殊な物質(マトリゲル)および繊維芽細胞凝集形態におけるネットワーク形成、凝集、連絡、力学的移動性の測定によりヒト皮膚繊維芽細胞成長パターンの複雑性を定量化する。
【0066】
マトリゲルマトリックスは、マウス肉腫から抽出され、これは細胞外マトリックス(ECM)タンパク質に富む。それは、ラミニン、続いてコラーゲンIV、ヘパラン硫酸化プロテオグリカンおよびエンタクチン1からなる。37℃で、マトリゲルは重合し、生物学的に活性なマトリックス物質を生成し、これは哺乳類細胞基底膜に類似する。BD還元マトリゲルマトリックス成長因子(GFR)は、ゲル基質のより高度に明確な基底膜作成を必要とする利用のために特に十分に適していることが見出されている。
【0067】
診断的測定の5つの方法が存在する:
1.方法1:集積スコア
2.方法2:凝集の数あたりの平均凝集面積
3.方法3:細胞遊走分析
4.方法4:フラクタル分析
5.方法5:空隙性分析。
【0068】
繊維芽細胞成長パターンの更なる測定が開発され、バイオプシーにより採取されたアルツハイマー病(AD)、非アルツハイマー病認知症(非ADD)および年齢が一致したコントロール細胞の間の診断的な識別が可能である。診断効果は、細胞外マトリックス修飾剤を添加することにより改善されてよい。
【0069】
方法1 集積スコア
この研究において、培養の1〜2時間以内に皮膚繊維芽細胞は、マトリゲル上で接触して測定可能なネットワークを形成する。この状態は、細胞形態、細胞の生化学的な機能、細胞運動性または浸潤、および遺伝子発現を研究するための生理学的に関連する環境を提供する。1日後、これらのネットワークは変性し、エッジが後退し、測定可能な凝集が残る。
【0070】
8つのパラメータを使用して、マトリゲル上への播種後の48時間後に、年齢が一致したコントロール(AC)からのAD繊維芽細胞と、非アルツハイマー病認知症(非ADD)とが区別される:
1.大きい凝集の存在
2.凝集に対する細胞の付着
3.凝集成長の兆候
4.少数の凝集(10倍画像において<10)
5.多数の凝集(10倍画像において>10)
6.ネットワーク内の測定可能なエッジ
7.細胞遊走の兆候
8.パーコレーション限界への近さ(細胞は連続的な流れを形成する)。
【0071】
これらの8つのパラメータから、数量的なスコアが以下のように導入される:
1.上述の最初の4つのパラメータは、アルツハイマー病(AD)に特異的であり、存在するときには、それぞれについて「−1」の点数を付け、不在のときには「0」を付ける。
【0072】
2.後半の4つのパラメータは、非ADおよびACに特異的であり、存在するときには「+1」の点数を付け、不在のときには「0」を付ける。
【0073】
3.総スコアは、8つの全部の値の合計として算出される。総スコアが正または0のとき、細胞はACまたは非ADDである。総スコアが負のとき、細胞はADである。
【0074】
播種後の48時間での皮膚繊維芽細胞の8つの特徴の合計を示す総スコアは、図4に示される。
【0075】
方法2 凝集の数あたりの面積
8つのパラメータの2つは、凝集の数あたりの面積の大きさで表され、それは、ACおよび非ADDについてよりもADについての方が相当に高い(診断精度96%、N=31(nAD=12、nAC=10およびnnon−ADD=9))、ACに対するADについてp<0.000001、および非ADDに対するADについてp<0.00001)。
【0076】
AD細胞は、大きな孤立した凝集と、少量の遊走または遊走の不在を示す(図5A)。正常コントロールおよび非ADD繊維芽細胞は、多くの小さな凝集塊と、凝集の間の高いレベルの遊走とを示す(図5B)。
【0077】
方法3 細胞遊走
集積スコア法とは異なり、細胞遊走法は、AD、ACおよび非ADD細胞との間を識別することが可能である。図9および10を参照されたい。
【0078】
自由遊走細胞は、48時間、N1、でカウントされ、約7時間後、N2、にカウントされ、遊走率がR=(N2−N1)/ΔTとして算出され、ΔTはカウント間の時間間隔である。自由遊走細胞は、凝集に対して付着していない細胞であり、図8において赤色ドットにより示されるような細胞である。
【0079】
個体群データ(図9、10)は、アルツハイマー病繊維芽細胞(AD−緑色四角形)および非アルツハイマー病認知症繊維芽細胞(非ADD−青色三角形)が、年齢が一致したコントロール繊維芽細胞(AC−赤色円形)と比較して、有意に少数の遊走細胞と遊走率を有することを示す。アルツハイマー病繊維芽細胞(緑色四角形)は、最も少数の遊走細胞と最も低い遊走率を示し、他方、年齢が一致したコントロール(赤色円形)は、最も多数の遊走細胞と最も高い遊走率を示す。興味深いことに、非ADD細胞は、(1つの例外が伴い)ADおよびACからは区別される(図5および6)。
【0080】
遊走の観点から、非アルツハイマー病認知症繊維芽細胞は、アルツハイマー病繊維芽細胞から良好に区別される。
【0081】
方法4 フラクタル分析
集積スコア法とは異なり、フラクタル分析法は、AD、ACおよび非ADD細胞の間を識別することが可能である(p<0.01)。図11Bを参照されたい。
【0082】
フラクタル分析法は、フラクタル次元により測定されるようなネットラークの複雑性を利用する。組織培養中で増殖したときに、アルツハイマー病に罹患する患者から採取された細胞、好ましくは繊維芽細胞は、AC細胞よりも統計学的に有意に低いフラクタル次元を有する。また、この物理学的なパラメータにより測定されるネットワークの複雑性は、ACおよび非ADD繊維芽細胞と比較したとき、ADから採取された繊維芽細胞は顕著に異なる。ネットワークの変性後(〜48時間)、細胞は遊走し、数日以内にコンフルエントに達する。この回復は、フラクタル次元における直線的増加により捕捉される(図11A)。時間の関数としてフラクタル次元を追跡する各曲線の切片に対する傾きは、3つの群、AC、ADおよび非ADDにおいて顕著に異なる(96%精度、n=31(NAD=12、NAC=10、Nnon−ADD=9);ACに対するADについてp<0.000l、非ADDに対してADについてp<0.00001)。最初の方法とは異なり、第2の方法は、ACと非ADDとの間を識別する(p<0.01)(図11B)。
【0083】
方法5 空隙性分析
空隙性分析法は、繊維芽細胞パターンの間隙を定量化し、識別の第2のレベルとして使用される複雑性を補完する測定である。また、繊維芽細胞の平均空隙性は、ACおよび非ADD繊維芽細胞と比較したときに、ADから採取された繊維芽細胞の方がより高い。典型的に、空隙性は、ネットワーク変性が最大であるときに、即ち、孤立した凝集のみが見えるときに、増大し、ピークになる(図12A)。間隙は、ネットワーク変性が開始したときに生じる。
【0084】
複雑性の動態のこれらの測定は、新たな機会を提供し、最小限の侵襲性手順でAD患者を診断する。方法の容易性および低コスト性はAD患者に有用なスクリーニング法である。ADの脳における神経ネットワークと同様にヒト皮膚繊維芽細胞ネットワークは、フラクタル次元により測定されるような複雑性の減少を示す。ヒト皮膚繊維芽細胞ネットワークは、正確なAD診断および薬物スクリーニングに有用な脳ネットワークモデルを提供する。
【0085】
アルツハイマー病繊維芽細胞の障害された垂直な遊走
同じ数の繊維芽細胞(50細胞/mm3)を、AD細胞株について12ウェルプレート内で増加量100μLずつ400μL〜800μLまで増大した体積のマトリゲル上に播種した。マトリゲル体積、V、の増大は、関係式:V=(πr2)h、ここでr=11.05mmに従い、マトリゲル層の厚さに比例して増加を生じる(図13)。
【0086】
頂部表面から底部表面までの垂直な細胞遊走は、マトリゲル層の厚さの増大にともなってより難しくなる。遊走におけるこの困難性は、フラクタル次元、空隙性および数によりここで定量化される(図14)。
【0087】
約24時間後、ネットワーク変性および凝集は、後に残される。ここで、我々は、数あたりの面積のマトリゲルの初期体積への依存性を示す(図12)。少ない体積のマトリゲル、400および500μLでは、凝集が存在しないのに対して、>500μLの大きな体積では、それらの数により割った凝集の面積は、700μLでピークになる曲線である。極めて制限される数のアルツハイマー病症例について、凝集の数により割った面積は、閾値に近く(図6参照)、遅い時間での凝集の測定は、これらの症例をより良好に区別するための助けになるだろう。79時間後、これらの凝集は、大きさが増し、それらの数は減少し、それにより面積/数の比は、更に互角にまで増大する(図15A中の緑色曲線)。48時間と79時間については共に、効果は700μLの初期体積のために最適である。また、面積/数についての変化率は(図3B)、ピークを有する曲線であり、マトリゲルの最適な初期体積が700μLであるという見解を強化する。
【0088】
上述で示された実験において、我々は、10%のウシ胎仔血清(FBS)および1%ペニシリン/ストレプトマイシン(PS)含有の1.5mLのダルベッコ改変イーグル培地(DMEM)を使用した。血清飢餓は、示された測定の更なる大きな撹乱を有する。
【0089】
フラクタル次元法
1つの実施形態において、フラクタル次元は、原画像、これはデジタル画像であってもよいが、これを、例えば、2つのガウスの相違を使用するなどのエッジ検出手続きを経てフィルタ処理した後に、標準ボックス集計手続きを用いて算出される。ADは、培養されたヒト皮膚繊維芽細胞の定量的な画像分析に基づいて診断されてよい。1つの実施形態において、サンプルは、パンチバイオプシーを経て採取される。一般に、外科用刃が使用されてよい。個体群データは、AC症例が、AD症例よりも有意に高いフラクタル次元を有することを示す。減少した複雑性のヒト皮膚繊維芽細胞ネットワークAD症例は、ACおよび比AD認知症症例から識別される。
【0090】
他の画像処理の所定の方法が、ボックス集計または線分検出の代わりに本発明において使用されてよい。
【0091】
方法の容易性および低コスト性は、他の複雑でコストの掛かる技術に訴える前に、AD患者をスクリーニングするために有用である。AD脳における神経ネットワークと同様にヒト皮膚繊維芽細胞ネットワークは、フラクタル次元により測定されるように、複雑性の減少を示す。1つの実施形態において、ヒト皮膚繊維芽細胞ネットワークは、新たな薬物スクリーニングのために有用であり得る脳ネットワークのモデルであってよい。
【0092】
図16は、インキュベーションの24時間後の年齢が一致したコントロール(AC)繊維芽細胞ネットワークを示す。1つの実施形態において、ネットワークのデジタル画像が得られる。図17は、インキュベーションの24時間後のアルツハイマー病患者繊維芽細胞ネットワークを示す。1つの実施形態において、ネットワークのデジタル画像が得られる。図18は、時間に対するACおよびAD対象のフラクタル次元を示す。2つの細胞株についてのフラクタル次元により測定された細胞ネットワークのダイナミクスは、ADよりもACについてよりも高いフラクタル次元を示す。有意な分類が、インキュベーションのおおよそ数時間後に顕著になる。図19は、インキュベーションの24時間後のACネットワークに対するADのフラクタル次元の散布図を示す。
【0093】
フラクタルは一般に、粗いまたは崩壊した幾何学的な形状であり、これは、部分に分けることが可能であり、その各々は(少なくともおおよそ)全体の縮小コピーであり、これは「自己相似性」と呼ばれる性質である。目的(フラクタル)は、全てのスケールで厳密に同じ構造を示す必要はないが、同じ「タイプ」の構造が、全てのスケールにおいて見られなくてはならない。ヒト皮膚繊維芽細胞ネットワークは、自然発生フラクタルの例である。
【0094】
線の考慮。線が、半分に分割されるとき、それにより、当初の線を再現するこれらの半分が2つ得られる。線が4つの断片に分割されるとき、それにより当該線の範囲を保証する4つが得られる。一般に、長さ「s」の線分が与えられると、当初の線の範囲を保証する断片の数はN(s)=(1/s)1により与えられる。
【0095】
正方形の考慮。正方形がそれぞれ半分の辺長を有する小さい正方形に分割されるとき、それにより4つ(22=4)のこれらの小さい正方形が得られ、当初の正方形が形成される。正方形が、それぞれ四分の1の辺長を有する小さい正方形に分割されるとき、それにより16(24=16)の小さい正方形が得られ、当初の正方形が形成される。上述のように、一片の数についての表現が記載でき、大きさ「s」が当初正方形の範囲を保証するために必要であり、それはN(s)=(1/s)2である。立方体については、結果はN(s)=(1/s)3である。
【0096】
上述の例における指数1、2および3は、それぞれ線、正方形および立方形の次元である。これはN(s)=(l/s)Dと一般化でき、ここで、Dは次元であり、上述のような整数であるが、それらであることが必ずしも必要ではない。両辺の対数を取れば、log(N(s))=Dlog(l/s)であり、言い換えれば、log(l/s)に対してlog(N(s))をプロットすることにより、その傾き(D)が次元であり、次元が評価できる。傾きが整数ではないときには、目的物はフラクタルであり、次元はフラクタル次元である。
【0097】
複雑性は、生物および非生物のそれら自身をどのようにパターンに組織化できるか、系としてどのように相互作用するかの研究である。複雑性は、極めて多くの専門分野に亘り、生物学から物理学までの非常に広い分類の分野の科学者が関与している。ヒト皮膚繊維芽細胞ネットワークの複雑性は、それらのフラクタル次元をコンピューティングすることにより定量化できる。
【0098】
1つの実施形態において、エッジ検出が本発明において使用される。エッジ検出は、画像処理の分野、特に、特徴検出および特徴抽出の領域において使用される用語であり、デジタル画像、例えば、そこで画像輝度が鋭く変化するまたは他の不連続を有するデジタル画像における点を同定することを目的とするアルゴリズムを指す。
【0099】
むしろ画像形成モデルのための一般的な仮定の下で、画像輝度における不連続性は、深度における1または1以上の不連続性、表面配向性における不連続、物質特性における変化および背景照明における変化に対応しそうであることが示される。
【0100】
理想的な状況において、画像に対してエッジ検出を適用する結果は、対象物の境界線を示す一組の関連する曲線を導くことが可能であり、表面の境界線は表面配向性における不連続性に対応する十分な曲線としてマーキングする。従って、画像へのエッジ検出の適用は、処理されるべきデータの量を有意に減少することが可能であり、それにより関連性が少ないと看做され得る情報を除去することが可能であり、同時に、画像の重要な構造特性を保存する。エッジ検出工程が成功すれば、そのために、当初画像における情報内容を解釈するという続く目的が大幅に簡易化できる。
【0101】
エッジ検出のための多くの方法が存在するが、それらの大部分は、2つの範疇、検索系およびゼロ交差系にグループ分けできる。検索系の方法は、エッジ強度、通常、一次導関数式、例えば、勾配度などの測定をまず計算すること、次に、エッジの軌跡配向性、通常、勾配方向の計算された推量を使用して勾配度の軌跡指向性最大値を検索することによりエッジを検出する。ゼロ交差系の方法は、エッジを見つけるために画像から計算された二次導関数式、通常、ラプラスのゼロ交差またはゼロ交差の非線形微分式におけるゼロ交差について検索する。エッジ検出のための前処理工程として、平滑化段階、例えば、ガウス平滑化が適用されてよい。他の実施形態において、雑音除去アルゴリズムが使用されてもよい。
【0102】
公開されているエッジ検出方法は、適用される平滑化フィルタの種類およびエッジ強度の測定が計算される方法が主に異なる。多くのエッジ検出方法が画像勾配の計算に依存することから、それらはまた、xおよびy方向における勾配推量を計算するために使用されるフィルタの種類が異なる。
【0103】
1つの実施形態において、方法は、ボックス集計手続きを使用する。画像は、例えば、コンピュータによりボックスで覆われる。目的は、画像を覆うために必要とされるボックスの数がボックスの大きさと共に、どのように変化するかを見つけることである。目的物が1次、例えば、線であるとき、上述のようにN(s)=(1/s)1が期待される。より高い次元などについても同様である。そのような手続きは、サンプルのデジタル画像を使用してコンピュータにおいて実行することが可能である。
【0104】
1つの実施形態において、データベースは、種々の年齢の多くの異なる非アルツハイマー病コントロール(AC)対象について作られてもよい。データベースは、試験されたヒト対象が、年齢が一致したACデータに対して評価できるように作られてもよい。
【0105】
1つの実施形態において、繊維芽細胞ネットワークの複雑性は、フラクタル次元および空隙性曲線の測定により定量化される。これらの物理学的パラメータにより測定されたネットワークの複雑性はまた、ACおよび非ADD繊維芽細胞と比較したときに、ADから採取された繊維芽細胞について顕著に異なる。ネットワークが変性した後に、例として約48時間後に、細胞は遊走し、数日の後にコンフルエントに達する。1つの実施形態において、この回復は、フラクタル次元における直線的な増加により捕捉される。時間の関数としてフラクタル次元を追跡する各曲線の切片に対する傾きは、3つの群、AC、ADおよび非ADDにおいて顕著に異なる(100%の精度、n=26(AD=10、AC=10、非ADD=6);ACに対するADについてp<0.000l、非ADDに対するADについてp<0.0000l)。この方法は、ACと非ADDとの間の識別可能な相違を示す。
【0106】
細胞形態学的特徴を利用する方法
培養後の短時間内に、例えば、1時間以内に、測定可能なネットワークが形成する。1つの実施形態において、培養は、ゼラチン様タンパク質混合物中で行われ、それは、細胞形態を研究するために実行可能な環境を提供する。ある時間の後、例えば、約1日後、これらのネットワークは変性し、エッジが後退して、測定可能な「凝集塊」または凝集が後に残される。
【0107】
本発明の何れかの方法と同様に、画像は、細胞またはサンプルを得ることと、および細胞またはサンプルをある期間に亘り培養またはインキュベートすることとにより作成されてよい。1つの実施形態において、ある期間は、約48時間である、または何れかの1時間増大区画である。期間中、細胞またはサンプル繊維芽細胞ネットワークは変化する。次に、画像が撮られる。定量的、定性的および半定量的な情報が画像から収集される。
【0108】
1つの実施形態において、画像のある特徴は値を割り当てられてよい。例えば、画像を調査することにより、以下の非包括的および非限定的な特徴が確認されてもよく、任意に値を割り当てられてもよい:(1)大きい凝集塊が存在するか?(2)細胞が凝集塊に対して付着しているか?(3)大きな凝集塊が成長しているか?(4)極僅かの凝集塊が存在しているか?例えば、10倍画像において5未満または5に等しい(5)多数の凝集塊が存在しているか?(例えば、10倍画像において5よりも多く)(6)以前に形成されたネットワークからの残留エッジが(例えば、マトリゲル中に)存在するか?(7)多くの細胞遊走が存在するか?(8)パーコレーションに近い細胞(即ち、画像の左右または上下に実質的に連続的な流れを形成する細胞)であるか?。
【0109】
ある実施形態において、これらの特徴の一部の列記のみが考慮されてもよい。8つのパラメータの2つは、測定された凝集の数あたりの面積の比で表される。この比は、年齢が一致したコントロール(AC)および非アルツハイマー病変性(非ADD)よりもADについてはかなり高い(診断精度96%、N=30(AD=12、AC=10および非ADD=8)ACに対するADについてp<0.00000l、非ADDに対するADについてp<0.0000l)。これらの特徴の何れかまたは全ては、手動または従来技術において公知であるような画像処理方法を介して確認されてもよい。
【0110】
1つの実施形態において、「特徴」、例えば、8つの特徴(またはそのサブセットまたは拡張された特徴セット)が値を割り当てられる。値は、相関研究に従い、例えば、AD細胞との相関またはAC若しくは非ADD細胞との相関に従って割り当てられてよい。1つの実施形態において、上述された(1)〜(4)の特徴は、AD繊維芽細胞と相関し、次に、これらは例えば、存在するときには−1の値が割り当てられ、不在のときには0が割り当てられる。実際の値は、単なる例として示されるが、他の値もまた割り当てられてよい。1つの実施形態において、上述の(5)〜(8)の特徴は、ACおよび非ADD繊維芽細胞と相関する。パーキンソン病(PD)およびハンチントン病(HD)は、非ADD細胞の非限定的な例である。特徴(5)〜(8)は、存在するときには+1の値が割り当てられ、不在のときには0が割り当てられる。1つの実施形態において、割り当てられた値は、各凝集塊について合計されてもよい。合計された値が次に、図4に示されるように、プロットされてもよい。
【0111】
もう1つの実施形態において、特徴の値は、測定される特徴の「強度」に従い中間値が割り当てられてもよい。例えば、特徴(1)である「大きな凝集塊が存在するか?」は、−1(極めて大きな凝集塊に対して)〜0(極めて小さい凝集塊について)の間の何れかの中間値が割り当てられてもよい。例えば、−0.9の値が、比較的「大きな凝集塊」について割り当てられてもよく、−0.8の値が僅かに小さい(それでもまだ「大きい」)凝集塊に対して割り当てられてもよいなどである。上述の特徴(または他の特徴)の何れかについての段階的なスケールは所定の実験を通して策定されてもよい。1つの実施形態において、方法は、画像処理技術を使用して完全に自動化されてもよく、更に特徴の全て(または多分幾つかのみ)が完全な段階的な、即ち、デジタル基準で定量化されてもよい。
【0112】
図4に示されるように、AD細胞、例えば、図5Aに示されるものなどは、特徴として大きな孤立した凝集塊を示し、AC細胞および非ADD細胞と比較して、僅かな遊走〜遊走は不在である。その結果として、AD細胞は、このスキームにおいて、典型的に比較的に小さい数までを合計する値、典型的に負の数を有する。正常なコントロールおよび非ADD繊維芽細胞、例えば、図5Bに示すようなものは、多数のより小さい凝集塊および凝集塊の間の高レベルの遊走を示す。その結果として、このスキームにおいてACおよび非ADD細胞は、典型的に比較的に大きい数までを合計する値、典型的に正の数を有する。上述の方法は、ADの診断のための更なるもう1つの方法を提供する。
【0113】
面積を利用する方法
もう1つの実施形態において、凝集の面積が算出される。例えば、図5B(AC細胞)に示される凝集塊の面積が算出される。これは、何れかの適切な方法により、例えば、これに限定するものではないが、凝集塊を横切る楕円をフィッティングすることにより実行されてよい。次に凝集塊が画像上でカウントされてよい。カウント並びに面積算出は、手動で行われるか、例えば、従来技術において公知の画像処理技術により自動で行われるかの何れかで行われてもよい。図5Bに示される数は、平方ミクロン、μ2の凝集塊の面積を表す。同様に、AD細胞の面積、例えば、図5Aに示されるものが、算出されてよい。例示として、図5Aで示される面積は12.670μ2であり、図5Bに示されるAC細胞の面積と関連付けられるものよりもかなり大きい。凝集塊の数あたりの面積が、図7に示されるようにプロットされてよい。
【0114】
図7は、上述の方法により算出されたときの凝集塊の数あたりの面積の対数プロットである。注目すべきことには、AD細胞についての凝集塊あたりの面積は、ACまたは非ADD細胞の何れかについての凝集塊の数あたりの面積よりも有意に高い。上述の方法は、更なるもう1つのADを診断する方法を提供する。
【0115】
本発明の他の実施形態において、上述の方法の何れかが組み合わされてもよい。例えば、フラクタル次元が算出され、および/または特徴が割り当てられて合計され、および/または凝集塊の数あたりの面積が算出されてもよい。1つの実施形態において、ADの陽性診断は、2つまたは2つ以上の上述の方法が独立して陽性診断を示すときのみになされる。他の実施形態において、ADの陽性診断は、全ての方法(例えば、3つの異なる方法、特に、例えば、フラクタル次元、特徴の合計および面積方法)が独立して陽性診断を示すときのみになされる。他の実施形態において、偽陽性および偽陰性は、「統計学的に有意性」の定義を調整することにより、例えば、上述の変数の何れかについての個体群標準偏差のある倍数で診断閾値を設定することにより回避または最小化することが可能である。
【0116】
本発明の何れかの実施形態において、細胞は、タンパク質混合物中で培養またはインキュベートされてもよい。1つの実施形態において、タンパク質混合物は、ゼラチン様タンパク質混合物である。非限定的な例であるゼラチン様タンパク質混合物は、マトリゲルTMである。マトリゲルTMは、エンゲルブレス−ホルム−スウォーム(Engelbreth−Holm−Swarm、EHS)マウス肉腫細胞から分泌されるゼラチン様タンパク質混合物のための商標名であり、BDバイオサイエンスにより販売されている。この混合物は、多くの組織において見出される複合細胞外環境に類似し、細胞培養のための基質として細胞生物学者により使用される。BDバイサイエンスはhttp://www.bdbiosciences.ca.にウェブサイトを維持する。
【0117】
1つの実施形態において、細胞は、基底膜調製物中で培養またはインキュベートされる。1つの実施形態において、この調製物は、可溶化されている。1つの実施形態において、基底膜調製物は、腫瘍から抽出される。1つの実施形態において、腫瘍は、エンゲルブレス−ホルム−スウォーム(EHS)マウス肉腫、細胞外マトリックスタンパク質に富む腫瘍である。その主な構成要素は、ラミニン、続いてコラーゲンIV、ヘパラン硫酸化プロテオグリカン、エンタクチン/ナイドジェンである。ある実施形態において、この調製物は、TGF−β、上皮成長因子、インスリン様成長因子、繊維芽細胞成長因子、組織プラスミノーゲン活性化因子および/または他の成長因子を含み、それはEHS腫瘍中に天然に存在してもよく、存在しなくともよい。
【0118】
1つの実施形態において、細胞は、細胞外マトリックスタンパク質を含む調製物中で培養またはインキュベートされる。1つの実施形態において、調製物は、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含む。1つの実施形態において、調製物は腫瘍から抽出される。1つの実施形態において、腫瘍は、エンゲルブレス−ホルム−スウォーム(EHS)マウス肉腫である。1つの実施形態において、調製物は更に成長因子を含む。1つの実施形態において、調製物は更にTGF−β、上皮成長因子、インスリン様成長因子、繊維芽細胞成長因子、組織プラスミノーゲン活性化因子、および/またはそれらの組み合わせ、および/または他の成長因子を含む。1つの実施形態において、TGF−β、上皮成長因子、インスリン様成長因子、繊維芽細胞成長因子、組織プラスミノーゲン活性化因子および/または他の成長因子はEHS腫瘍中に天然に存在してもよい。1つの実施形態において、成長因子は、EHSマウス肉腫において天然に存在する。
【0119】
1つの実施形態において、調製物は細胞外マトリックスタンパク質調製物を含み、それは、正常および形質転換された固定依存性類上皮および他の細胞種の両方の付着および分化のために有効である。これらは、ニューロン、肝細胞、セルトリ細胞、ヒヨコ水晶体および血管内皮細胞を含む。1つの実施形態において、細胞外マトリックスタンパク質調製物は、成体ラット肝細胞における遺伝子発現に影響を与えてもよく、並びにマウスおよびヒト乳房上皮細胞における三次元培養に影響を与えてもよい。1つの実施形態において、これは、幾つかの種類の腫瘍細胞浸潤アッセイのための基礎であり、インビボでの末梢神経新生を支持し、インビトロおよびインビボの両方における血管形成の研究のために必要な基質を提供するだろう。1つの実施形態において、細胞外マトリックスタンパク質はまた、インビボにおける免疫抑制マウスにおけるヒト腫瘍の増殖を支持する。
【0120】
1つの実施形態において、ある体積の冷却された細胞外マトリックスタンパク質が組織培養実験機器上に分配される。ここで使用されるとき、「冷却された」は、室温よりも低い温度をいい、好ましくは約15℃未満、更に好ましくは約10℃未満、より好ましくは約5℃未満、最も好ましくは約4℃である。上昇した温度でのインキュベーションされるとき、細胞外マトリックスタンパク質は、自己会合して薄フィルムを形成し、それは実験機器の表面を覆う。ここで使用されるとき、「上昇した」は室温を超える温度をいい、好ましくは約20℃を超える、より好ましくは25℃を超える、より好ましくは約30℃を超える、更に好ましくは約35℃を超える、最も好ましくは37℃を超え、それはおおよそ平均ヒト体温である。
【0121】
細胞外マトリクスタンパク質上で培養された細胞は、複雑な細胞行動を示し、それは実験室条件下で観察されることが困難な他のものである。例えば、内皮細胞は細胞外マトリックスタンパク質でコートされた表面において入り組んだクモの巣様のネットワークを形成するが、プラスチック表面では形成しない。そのようなネットワークは、血液を含む生きた組織を満たす微小血管毛細管系を高度に連想させる。従って、内皮細胞がそのようなネットワークを構築するプロセスは、生物学研究者にとって非常に興味深く、細胞外マトリックスタンパク質はこの観察を可能にする。
【0122】
幾つかの実施形態において、より多くの体積の細胞外マトリックスタンパク質を使用して厚い三次元ゲルを作成することが好ましいかもしれない。厚いゲルの有用性は、それらが表面からのゲル内部への細胞の遊走を誘導することである。幾つかの実施形態において、この遊走行動は、研究者によって腫瘍細胞転移のモデルとして研究される。
【0123】
細胞外マトリックスタンパク質の複雑な細胞行動を刺激する能力は、それらの不均一組成の結果である。幾つかの実施形態において、細胞外マトリックスタンパク質の主な成分は、構造タンパク質、例えば、ラミニンおよびコラーゲンなどであり、それらは、一連の接着ペプチドを有する培養細胞に提示され、それはそれらの自然環境において接触するであろうものである。幾つかの実施形態はまた、成長因子を使用し、それは多くの細胞種の分化と増殖を促進する。細胞外マトリックスタンパク質はまた、少量中に多数の他のタンパク質を含んでもよい。
【0124】
ここで開示されるような繊維芽細胞ネットワーク複雑性のダイナミクスの測定は、最小限の侵襲的な手順でAD患者の診断するための新たな機会を提供する。AD脳おける神経ネットワークと同様に、ヒト皮膚繊維芽細胞ネットワークは、ACおよび非ADD細胞と比較してフラクタル次元により測定されるような複雑性の減少を示す。ヒト皮膚繊維芽細胞ネットワークは、正確なAD診断および薬物スクリーニングのために有用な脳ネットワークモデルを提供する。
【0125】
全ての書物、論文または特許文献は、ここにおいて参照することにより本開示に矛盾することなく、本明細書に組み込まれる。本発明は、以下に例として記載されるが、それは説明を意図するものであり、本発明の範囲を制限するものではない。
【0126】
例1:BD還元マトリゲルマトリックス成長因子での12ウェルプレートのコーティング
装置および物質:クラスIIA/B3生物学的安全キャビネット(Forma Scientific)。C02水−ジャケットインキャベータ(Forma Scientific)。倒立顕微鏡。パスツールピペット。血清学的ピペット。ピッペトエイド(Omega Cat.No.P5017)、BD還元マトリゲルマトリックス成長因子(BD Biosciences、Cat.No.354230)(アリコート800μLおよび−20℃で貯蔵)。滅菌12ウェル培養プレート(Coming Inc.,Cat. No.3S12)。
【0127】
手順:使用前にBD還元マトリゲルマトリックス成長因子を氷上4℃で30分間解凍し、前冷却されたピペット、チップおよび12ウェル培養プレートを使用する。マトリゲルが液体であり、固体凝集を有さないことを確認する。
【0128】
厚いゲル方法:冷却ピペットを用い、BD還元マトリゲルマトリックス成長因子を均質に混合する。使用前および1ウェルあたり700μLのBD還元マトリゲルマトリックス成長因子の添加中に12ウェル培養プレートを氷上で30分間維持する。細胞培養プレートの表面上のゲルの均一性を倒立顕微鏡下で検証し、気泡回避する。12ウェルプレートを37℃で30分間配置する。BD還元マトリゲルマトリックス成長因子の頂部に細胞懸濁液を添加する。細胞の密度は、50細胞/mm3に調整する(下記参照)。
【0129】
例2;播種のためのヒト皮膚繊維芽細胞の調製
装置および物質。クラスIIA/B3生物学的安全キャビネット(Forma Scientific)。C02水−ジャケットインキュベータ(Forma Scientific)。倒立顕微鏡。T−E(トリプシン−EDTA溶液1倍)(−20℃で貯蔵)。M−2(培地2)10%FBSおよび1%PS含有のDMEM。パスツールピペット。血清学的ピペット。ピッペトエイド(Omega Cat.No.P5017)。培養フラスコ、ベントキャップ、25cm2。15mLおよび50mL滅菌プラスチックチューブ。500mLボトルトップフィルタ。水浴遠心機。
【0130】
手順:T−EおよびM−2培地を水浴中、37℃で解凍および暖める。
【0131】
組織断片を含むフラスコ培養:培養培地を吸引によってフラスコから除去および廃棄する。トリプシンを不活性化できる血清残渣を除去するために、2mLのT−Eを添加し、直ちに吸引する。フラスコに対して2mLのT−Eを添加し、37℃で3〜5分間インキュベートする。培養フラスコ表面からの細胞の剥離時間は全ての患者について同一ではなく、3〜5分間の範囲で各症例について調整することが必要である。
【0132】
顕微鏡下での細胞の観察:丸みを帯びているときには、それらは剥離している。大部分が丸みを帯びていないときには、それらが丸みを帯びているように見えるまで、懸濁液をインキュベータ内に更に1分間または2分間放置する。5mLのM−2培地を添加し、トリプシン活性化を阻害する。ピペッティングによって穏やかに撹拌し、フラスコの底から細胞を剥離するが、細胞断片に接触または組織断片が剥離しないように気をつける。(ピペットによって)細胞懸濁液を15mL滅菌プラスチックチューブに移し、それを1000RPM(スピード3)で5分間遠心分離し、上清を廃棄し、細胞を3mLのM−2培地に懸濁する。ピペッティングによって穏やかに撹拌し、15mLの滅菌プラスチックチューブの底から細胞を剥離する。
【0133】
例3:ヒト皮膚繊維芽細胞のカウント
装置および物質。クラスIIA/B3生物学的安全キャビネット(Forma Scientific)。倒立顕微鏡。細胞カウントチャンバ−レビィダブル(VWR scientific,Cat.No.15170−208)。パスツールピペット。血清学的ピペット。ピッペトエイド(Omega Cat.No.P5017)。滅菌12ウェル培養プレート(Coming Inc.,Cat.No.3512)。
【0134】
手順:0.25mLの細胞懸濁液を細胞カウントチャンバに添加し、頂部にカバーガラスを置く。
【0135】
繊維芽細胞を含む細胞カウントチャンバ−レビィダブル:細胞を固定し、次に倒立顕微鏡下で9つの大四角内の細胞の数をカウントする。10を乗じた細胞の平均数(AvC)は、細胞/mm3の数で表される細胞の密度(DC)を与える。細胞懸濁液をM−2培地で希釈し、1.5mLの総体積中に50細胞/mm3の密度を達成する。細胞懸濁液について(1.5ml)x(50)/AvCを用いて、M−2培地で1.5mLまで完全に配置する。3つのウェルを各細胞株について使用する。従って、工程における数3に3を掛ける。15mLの滅菌プラスチックチューブ内に4.5mLの混合物を調製し、10mLのピペットを使用して穏やかに均質化する。3つのウェルのそれぞれに1.5mLを添加する。3つのウェルプレートに患者コード、日付および継代数をラベルする。12ウェル培養プレートの外側に70%のEtOHをスプレーし、インキュベータ内に配置する。
【0136】
例4:画像分析を経るヒト皮膚繊維芽細胞の初期細胞密度の検証
装置および物質:倒立顕微鏡。イメージJ。
【0137】
手順:インキュベータ内での10分間の後に、12ウェル培養プレートを取り出し、倒立顕微鏡下に置く。
【0138】
画像分析を使用する細胞カウント:4倍対物レンズ下で、視野の中心にウェルの中心を配置する。10倍の対物レンズに換えて、左/右および上/下に1つの視野を動かすことにより中心に加えて他の4つの視野で1つの画像を得る。イメージJ下で画像を読み込み、処理/雑音/デスペックルに進む。次に処理/雑音/二値/二値生成に進む。二値画像を2〜3回デスペックルし、次に細胞カウントのために分析/粒子分析を使用する。結果は、合計/カウント下にある。細胞の自動カウントは、手動カウントの〜12%の差で多く見積もり過ぎることに注意する。初期細胞密度についてのより低い閾値は、45細胞/mm3であり、それは、10倍下で細胞数にして190細胞に対応し、1.4のフラクタル次元に対応する。初期細胞密度についてのより高い閾値は、62細胞/mm3であり、それは10倍下で細胞数にして650細胞に対応し、1.62のフラクタル次元に対応する。2つの閾値の外側に平均細胞数を有する何れのウェルも破棄される。
【0139】
例5:方法1:スコア
装置および物質:倒立顕微鏡(Westover Digital AMID Model 2000)。ミクロン2.0.0ウェストオーバー・サイエンティフィック2008(Micron 2.0.0 Westover Scientific 2008)。イメージJ。
【0140】
手順:48時間で写真を撮り、後に8つの基準に基づいて総スコアを測定する。3つの基準(1、4および5、以下を参照)は、凝集の数あたりの平均面積により定量的に表される。
【0141】
スクリーニングのために使用されるパラメータ:
1.大きな凝集の存在
2.凝集に対する細胞の付着
3.凝集成長の兆候
4.少数の凝集(10倍画像において<10)
5.多数の凝集(10倍画像において>10)
6.ネットワーク内の測定可能なエッジ
7.細胞遊走の兆候
8.パーコレーション限界に対する近さ(細胞は連続的な流れを形成する)。
【0142】
総スコア:(1)最初の4つのパラメータは、アルツハイマー病(AD)に特異的であり、存在するときには「−1」の点数が付けられ、不在のときには「0」が付けられる。(2)後の4つのパラメータは年齢が一致したコントロール(AC)に対して、および非アルツハイマー病認知症(非ADD)に対して特異的であり、存在するときには「+1」の点数が付けられ、不在のときには「0」が付けられる。(3)8つの値の全ての合計としての総スコアの算出する。総スコアが正またはゼロであるときには、細胞はACまたは非ADDである。総スコアが負のときには、細胞はADである。
【0143】
凝集の数あたりの平均面積:(1)ミクロン2.0.0に画像を取り込み、測定/楕円面積下で1つ1つ凝集を測定する。凝集に楕円をフィッティングし、面積がソフトウエアにより自動的に提供される。(2)集計表に面積を集め、凝集の数を関数「カウント」で自動的に抽出する。(3)各画像について平均面積と凝集の平均数、並びに2つの比を算出する。(4)各ウェルについて5つの画像の全てについて#凝集あたりで面積を平均化する。(5)細胞株について3つのウェルの全てについて#凝集あたりで面積を平均化する。(6)#凝集あたりの面積が1000よりも小さいときには、細胞株はACまたは非ADDであり、1000よりも大きいときには、細胞はADである。
【0144】
例6:方法2;フラクタル分析
装置および物質:倒立顕微鏡(Westover Digital AMID Model 2000)。イメージJ。プラグ・イン・フラックラック(Plug in FracLac)。
【0145】
手順:48時間後に写真撮影およびフラクタル次元を算出する。
【0146】
スクリーニングのために使用されるパラメータ:(1)大きな凝集の存在。
【0147】
例7:培地の調製
培地の調製:DMEM(高グルコース)、Cat.No.10313−039、インビトロジェン・ギブコ(4℃冷蔵庫内で貯蔵);FBS、Cat.No.10082−147、インビトロジェン・ギブコ(アリコート50mLおよび−20℃で貯蔵);PS(ペニシリンおよびストレプトマイシン溶液)Cat.No.15140−122、インビトロジェン(アリコオート5mLおよび−20℃で貯蔵)。M−1(培地1)、45%および1%のPSを含むDMEM。M−2(培地2)10%および1%のPSを含むDMEM。濾過、表示および4℃冷蔵庫内で1ヶ月まで貯蔵)。
【特許請求の範囲】
【請求項1】
ヒト対象においてアルツハイマー病を診断する方法であって、以下の工程を含む方法;
(a)ヒト対象から1つまたは1つ以上の細胞を得ること;
(b)1つまたは1つ以上の細胞をある期間に亘り培養すること;
(c)細胞凝集の平均面積を決定し、平均面積を凝集の数で割って、凝集の数あたりの面積を得ること;
(d)工程(c)の結果を、非アルツハイマー病細胞を用いて決定された凝集の数あたりの面積と比較すること;および
(e)工程(d)の比較に基づいて、アルツハイマー病の存在または不在を診断すること。
【請求項2】
請求項1に記載の方法であって、工程(c)において決定された凝集の数あたりの面積が、工程(d)において決定された凝集の数あたりの面積よりも大きいときに、診断は、アルツハイマー病について陽性である方法。
【請求項3】
請求項1に記載の方法であって、診断が1つまたは1つ以上の更なる診断方法を用いて確認される方法。
【請求項4】
請求項3に記載の方法であって、1つまたは1つ以上の更なる診断方法が、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される方法。
【請求項5】
請求項1に記載の方法であって、細胞が繊維芽細胞である方法。
【請求項6】
請求項1に記載の方法であって、工程(d)における非アルツハイマー病細胞がAC細胞である方法。
【請求項7】
請求項1に記載の方法であって、細胞がタンパク質混合物中で培養される方法。
【請求項8】
請求項7に記載の方法であって、タンパク質混合物が、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含む細胞外マトリックス調製物を含む方法。
【請求項9】
請求項8に記載の方法であって、タンパク質混合物が更に成長因子を含む方法。
【請求項10】
請求項8に記載の方法であって、細胞外マトリックスタンパク質が腫瘍から抽出される方法。
【請求項11】
請求項10に記載の方法であって、腫瘍がEHSマウス肉腫である方法。
【請求項12】
以下を含む方法;
(a)ヒト対象から1つまたは1つ以上の細胞を得ること;
(b)1つまたは1つ以上の細胞をある期間に亘り培養すること;
(c)前記ある期間の終わりに細胞の画像を得ること;
(d)画像における細胞のネットワークに関するフラクタル次元を決定すること;および
(e)工程(d)の結果と、既知の非アルツハイマー病細胞に関して独立して決定されたフラクタル次元とを比較すること。
【請求項13】
請求項12に記載の方法であって、工程(d)において算出されたフラクタル次元が、既知の非アルツハイマー病細胞に関するフラクタル次元よりも統計学的に有意に低いときに、対象はアルツハイマー病であることを示す方法。
【請求項14】
請求項13に記載の方法であって、アルツハイマー病が1つまたは1つ以上の診断方法を使用して確認される方法。
【請求項15】
請求項14に記載の方法であって、1つまたは1つ以上の診断方法が、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される方法。
【請求項16】
請求項12に記載の方法であって、フラクタル次元がボックス集計手続きを用いて算出される方法。
【請求項17】
請求項16に記載の方法であって、ボックス集計手続きがエッジ検出手続きを含む方法。
【請求項18】
請求項12に記載の方法であって、対象が、既知の非アルツハイマー病細胞を提供するコントロール対象と年齢が一致する方法。
【請求項19】
請求項12に記載の方法であって、ある期間が約24時間である方法。
【請求項20】
請求項12に記載の方法であって、細胞がタンパク質混合物中で培養される方法。
【請求項21】
請求項20に記載の方法であって、タンパク質混合物が、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含む細胞外マトリックス調製物を含む方法。
【請求項22】
請求項21に記載の方法であって、タンパク質混合物が更に成長因子を含む方法。
【請求項23】
請求項21に記載の方法であって、細胞外マトリックスタンパク質が腫瘍から抽出される方法。
【請求項24】
請求項23に記載の方法であって、腫瘍がEHSマウス肉腫である方法。
【請求項25】
以下を含む方法;
(a)ヒト対象からの繊維芽細胞のネットワークの画像のフラクタル次元を決定すること;
(b)既知の非アルツハイマー病細胞からの繊維芽細胞のネットワークの画像のフラクタル次元を決定すること;および
(c)工程(a)および(b)の結果を比較すること。
【請求項26】
請求項25に記載の方法であって、工程(a)において決定されたフラクタル次元が工程(b)において決定されたフラクタル次元よりも統計学的に有意に低いときに、診断は、アルツハイマー病を示す方法。
【請求項27】
請求項25に記載の方法であって、対象が既知の非アルツハイマー病細胞を提供するコントロール対象と年齢が一致する方法。
【請求項28】
ヒト対象においてアルツハイマー病を診断する方法であって、
(a)対象からの繊維芽細胞のネットワークの画像のフラクタル次元を算出すること;および
(b)工程(a)の結果を、既知の非アルツハイマー病細胞に関して独立して決定されたフラクタル次元と比較すること;
を含み、
ここで、工程(a)において算出されたフラクタル次元が、既知の非アルツハイマー病細胞に関するフラクタル次元よりも統計学的に有意に低いときに、診断は、対象におけるアルツハイマー病について陽性である方法。
【請求項29】
請求項28に記載の方法であって、対象が既知の非アルツハイマー病細胞を提供するコントロール対象と年齢が一致する方法。
【請求項30】
ヒト対象においてアルツハイマー病を診断する方法であって、
(a)外科用刃を用いて、対象の末梢皮膚繊維芽細胞のサンプルを得ること;
(b)インキュベータを用いてサンプルをある期間に亘りインキュベートすること;
(c)撮像装置を用いて、前記ある期間の終わりにサンプルの画像を得ること;
(d)コンピュータを用いて画像における繊維芽細胞のネットワークに関するフラクタル次元を算出すること;および
(e)工程(d)の結果と、既知の非アルツハイマー病細胞に関して独立して決定されたフラクタル次元とを比較すること;
を含み、
ここで、工程(d)において算出されたフラクタル次元が、既知の非アルツハイマー病細胞に関するフラクタル次元よりも統計学的に有意に低いときに、診断は、対象におけるアルツハイマー病について陽性である診断する方法。
【請求項31】
請求項30に記載の方法であって、サンプルがタンパク質混合物中でインキュベートされる方法。
【請求項32】
請求項31に記載の方法であって、タンパク質混合物が、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含む細胞外マトリックス調製物を含む方法。
【請求項33】
請求項32に記載の方法であって、タンパク質混合物が更に成長因子を含む方法。
【請求項34】
請求項32に記載の方法であって、細胞外マトリックスタンパク質が腫瘍から抽出される方法。
【請求項35】
請求項34に記載の方法であって、腫瘍がEHSマウス肉腫である方法。
【請求項36】
ヒト対象においてアルツハイマー病を診断する方法であって、以下を含む方法;
(a)外科用刃を用いて対象の末梢皮膚繊維芽細胞のサンプルを得ること;
(b)インキュベータを用いてサンプルをある期間に亘りインキュベートすること;
(c)撮像装置を用いて、前記ある期間の終わりにサンプルの画像を得ること;
(d)コンピュータを用いて画像における繊維芽細胞のネットワークに関するフラクタル次元を算出すること;
(e)コンピュータを用いて、工程(d)のフラクタル次元を、種々の年齢のコントロール対象から得られた非アルツハイマー病細胞から生成されたフラクタル次元データを有するデータベースに入力すること;および
(f)コンピュータを用いて、工程(d)の算出されたフラクタル次元と、データベースのデータとを比較することにより、対象を診断すること。
【請求項37】
請求項36に記載の方法であって、サンプルが、ゼラチン様タンパク質混合物中でインキュベートされる方法。
【請求項38】
請求項37に記載の方法であって、ゼラチン様タンパク質混合物が、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含む細胞外マトリックス調製物を含む方法。
【請求項39】
請求項37に記載の方法であって、ゼラチン様タンパク質混合物が更に成長因子を含む方法。
【請求項40】
請求項38に記載の方法であって、細胞外マトリックスタンパク質が腫瘍から抽出される方法。
【請求項41】
請求項40に記載の方法であって、腫瘍がEHSマウス肉腫である方法。
【請求項42】
種々の年齢のコントロール対象から得られた非アルツハイマー病細胞から生成されたフラクタル次元データのデータベースを有するコンピュータ読み取り可能媒体であって、
(a)画像のフラクタル次元を算出する;
(b)フラクタル次元を、フラクタル次元データのデータベースと比較する;および
(c)工程(b)の比較に基づいて、診断を出力する;
ための命令を含むコンピュータ読み取り可能媒体。
【請求項43】
以下を含む方法;
(a)ヒト対象からの皮膚細胞をある期間に亘り培養すること;
(b)細胞の繊維芽細胞のネットワークに関連する細胞形態学的特徴を測定すること;
(c)細胞形態学的特徴に関する演算を行うこと;および
(d)工程(c)の演算と、既知の非アルツハイマー病細胞に関連する独立して決定されたパラメータと比較すること。
【請求項44】
請求項43に記載の方法であって、細胞形態学的特徴が、繊維芽細胞凝集塊の数、繊維芽細胞凝集塊の大きさ、繊維芽細胞凝集塊の成長率およびそれらの組み合わせからなる群より選択される方法。
【請求項45】
請求項43に記載の方法であって、細胞形態学的特徴が、大きい凝集塊の存在または不在、凝集塊に対して付着した細胞の存在または不在、大きな凝集塊成長の存在または不在、凝集塊の数、以前に形成された凝集塊のネットワークからの残留エッジの存在または不在、細胞遊走の数、パーコレーションに近い細胞の存在または不在である方法。
【請求項46】
請求項43に記載の方法であって、工程(c)の演算が、それぞれの細胞形態学的特徴に対して離散値を割り当てること、および前記値を合計することを含む方法。
【請求項47】
請求項46に記載の方法であって、合計が使用されて、ADが診断またはADの不在が診断される方法。
【請求項48】
請求項43に記載の方法であって、細胞がタンパク質混合物中で培養される方法。
【請求項49】
請求項48に記載の方法であって、タンパク質混合物が、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含む細胞外マトリックス調製物を含む方法。
【請求項50】
請求項48に記載の方法であって、タンパク質混合物が更に成長因子を含む方法。
【請求項51】
請求項49に記載の方法であって、細胞外マトリックスタンパク質が腫瘍から抽出される方法。
【請求項52】
請求項51に記載の方法であって、腫瘍がEHSマウス肉腫である方法。
【請求項53】
対象においてアルツハイマー病を診断する方法であって、以下を含む方法;
(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程;
(b)ある期間を越えて1つまたは1つ以上の細胞のフラクタル次元を測定する工程;
(c)時間の関数としてフラクタル次元をプロットしてフラクタル次元曲線を得る工程;
(d)フラクタル次元曲線を、非アルツハイマー病細胞および非アルツハイマー病認知症(非ADD)細胞から得たフラクタル次元曲線と比較する工程;および
(e)対象におけるアルツハイマー病の存在または不在を診断する工程。
【請求項54】
請求項53に記載の方法であって、対象から得られた単数または複数の細胞から測定されたフラクタル次元曲線が、非アルツハイマー病細胞および非ADD細胞から得られたフラクタル次元曲線とは統計学的に有意に異なるときに、診断は、対象におけるアルツハイマー病について陽性である方法。
【請求項55】
請求項54に記載の方法であって、対象から得られた単数または複数の細胞が繊維芽細胞である方法。
【請求項56】
請求項53に記載の方法であって、診断が1つまたは1つ以上の更なる診断方法により確認される方法。
【請求項57】
請求項56に記載の方法であって、1つまたは1つ以上の更なる診断方法が、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される方法。
【請求項58】
対象においてアルツハイマー病を診断する方法であって、以下を含む方法;
(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程;
(b)培養された細胞の1つまたは1つ以上の特徴に基づいて集積スコアを決定する工程;
(c)集積スコアを、非アルツハイマー病細胞について決定された集積スコアと比較する工程;および
(d)対象におけるアルツハイマー病の存在または不在を診断する工程。
【請求項59】
請求項58に記載の方法であって、集積スコアを算出するために使用される特徴が、凝集の大きさ、凝集に対する細胞の付着、凝集成長の兆候、凝集の数、ネットワーク内のエッジ、細胞遊走の兆候およびパーコレーション限界に対する近さ(または細胞密度)からなる群より選択される方法。
【請求項60】
請求項58に記載の方法であって、診断が1つまたは1つ以上の更なる診断方法により確認される方法。
【請求項61】
請求項60に記載の方法であって、1つまたは1つ以上の診断方法が、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される方法。
【請求項62】
対象においてアルツハイマー病を診断する方法であって、以下を含む方法;
(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程;
(b)遊走細胞の数を決定する工程;
(c)遊走細胞の数を、非アルツハイマー病細胞についての遊走細胞の数と比較する工程;および
(d)対象におけるアルツハイマー病の存在または不在を診断する工程。
【請求項63】
請求項62に記載の方法であって、対象から得られた遊走細胞の数が、遊走非アルツハイマー病細胞の数よりも統計学的に有意に小さいときに、診断は、ADについて陽性である方法。
【請求項64】
請求項62に記載の方法であって、細胞が繊維芽細胞である方法。
【請求項65】
請求項62に記載の方法であって、診断が1つまたは1つ以上の更なる診断方法により確認される方法。
【請求項66】
請求項65に記載の方法であって、1つまたは1つ以上の更なる診断方法が、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される方法。
【請求項67】
対象においてアルツハイマー病を診断する方法であって、以下を含む方法;
(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程;
(b)細胞の空隙性を決定する工程;
(c)細胞の空隙性を、非アルツハイマー病細胞の空隙性と比較する工程;および
(d)対象におけるアルツハイマーの存在または不在を診断する工程。
【請求項68】
請求項67に記載の方法であって、対象から得られた細胞の空隙性が、非アルツハイマー病細胞の空隙性よりも統計学的に有意に高いときに、診断は、ADについて陽性である方法。
【請求項69】
請求項67に記載の方法であって、診断が1つまたは1つ以上の更なる診断方法により確認される方法。
【請求項70】
請求項69に記載の方法であって、1つまたは1つ以上の更なる診断方法が、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される方法。
【請求項71】
請求項67に記載の方法であって、細胞が繊維芽細胞である方法。
【請求項72】
アルツハイマー病を治療または予防するための1つまたは1つ以上の薬物候補を開発するために有用なリード化合物をスクリーニングする方法であって、以下を含む方法;
(a)細胞培養培地中で1つまたは1つ以上のAD細胞を培養する工程;
(b)AD細胞を化合物と接触させる工程;および
(c)AD細胞の1つまたは1つ以上の特徴が、化合物と接触されていない非アルツハイマー病細胞の特徴に類似するように変化しているか否かを決定する工程。
【請求項73】
請求項72に記載の方法であって、細胞が繊維芽細胞である方法。
【請求項74】
請求項72に記載の方法であって、特徴がフラクタル次元である方法。
【請求項75】
請求項72に記載の方法であって、特徴が集積スコアである方法。
【請求項76】
請求項72に記載の方法であって、特徴が凝集の数あたりの平均凝集面積である方法。
【請求項77】
請求項72に記載の方法であって、特徴が細胞遊走である方法。
【請求項78】
請求項72に記載の方法であって、特徴が空隙性である方法。
【請求項79】
対象におけるアルツハイマー病持続期間を決定する方法であって、以下を含む方法;
(a)対象から1つまたは1つ以上の細胞を得ること;
(b)既知のAD細胞株について、細胞遊走特性または凝集の数あたりの平均面積を測定すること;
(c)工程(b)において得られたデータを用いて検量線を作成すること;
(d)工程(a)において得られた細胞について、遊走特性または凝集の数あたりの平均面積を測定すること;および
(e)対象におけるAD病持続期間を決定すること。
【請求項80】
請求項79に記載の方法であって、細胞が繊維芽細胞である方法。
【請求項81】
請求項79に記載の方法であって、10年または10年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項82】
請求項79に記載の方法であって、9年または9年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項83】
請求項79に記載の方法であって、8年または8年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項84】
請求項79に記載の方法であって、7年または7年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項85】
請求項79に記載の方法であって、6年または6年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項86】
請求項79に記載の方法であって、5年または5年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項87】
請求項79に記載の方法であって、4年または4年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項88】
請求項79に記載の方法であって、3年または3年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項89】
請求項79に記載の方法であって、2年または2年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項90】
請求項79に記載の方法であって、1年または1年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応を有すると同定される方法。
【請求項91】
対象におけるアルツハイマー病の存在と非アルツハイマー病認知症の存在とを識別する方法であって、以下を含む方法;
(a)対象から1つまたは1つ以上の細胞を得ること;
(b)ある期間を越えて1つまたは1つ以上の細胞のフラクタル次元を測定すること;
(c)フラクタル次元を時間の関数としてプロットしてフラクタル次元曲線を得ること;
(d)フラクタル次元曲線を、既知の非アルツハイマー病細胞、既知の非アルツハイマー病認知症(非ADD)細胞および既知のAD細胞から得られたフラクタル次元曲線と比較すること;および
(e)対象におけるADと非ADDとを識別すること。
【請求項92】
請求項91に記載の方法であって、細胞が繊維芽細胞である方法。
【請求項93】
対象におけるアルツハイマー病の存在と非アルツハイマー病認知症の存在とを識別する方法であって、以下を含む方法;
(a)対象から1つまたは1つ以上の細胞を得ること;
(b)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養すること;
(c)遊走細胞の数を決定すること;
(d)遊走細胞の数を、既知の非アルツハイマー病細胞、既知のAD細胞および既知の非ADD細胞についての遊走細胞の数と比較すること;および
(e)対象におけるADと非ADDとを識別すること。
【請求項94】
請求項93に記載の方法であって、細胞が繊維芽細胞である方法。
【請求項1】
ヒト対象においてアルツハイマー病を診断する方法であって、以下の工程を含む方法;
(a)ヒト対象から1つまたは1つ以上の細胞を得ること;
(b)1つまたは1つ以上の細胞をある期間に亘り培養すること;
(c)細胞凝集の平均面積を決定し、平均面積を凝集の数で割って、凝集の数あたりの面積を得ること;
(d)工程(c)の結果を、非アルツハイマー病細胞を用いて決定された凝集の数あたりの面積と比較すること;および
(e)工程(d)の比較に基づいて、アルツハイマー病の存在または不在を診断すること。
【請求項2】
請求項1に記載の方法であって、工程(c)において決定された凝集の数あたりの面積が、工程(d)において決定された凝集の数あたりの面積よりも大きいときに、診断は、アルツハイマー病について陽性である方法。
【請求項3】
請求項1に記載の方法であって、診断が1つまたは1つ以上の更なる診断方法を用いて確認される方法。
【請求項4】
請求項3に記載の方法であって、1つまたは1つ以上の更なる診断方法が、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される方法。
【請求項5】
請求項1に記載の方法であって、細胞が繊維芽細胞である方法。
【請求項6】
請求項1に記載の方法であって、工程(d)における非アルツハイマー病細胞がAC細胞である方法。
【請求項7】
請求項1に記載の方法であって、細胞がタンパク質混合物中で培養される方法。
【請求項8】
請求項7に記載の方法であって、タンパク質混合物が、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含む細胞外マトリックス調製物を含む方法。
【請求項9】
請求項8に記載の方法であって、タンパク質混合物が更に成長因子を含む方法。
【請求項10】
請求項8に記載の方法であって、細胞外マトリックスタンパク質が腫瘍から抽出される方法。
【請求項11】
請求項10に記載の方法であって、腫瘍がEHSマウス肉腫である方法。
【請求項12】
以下を含む方法;
(a)ヒト対象から1つまたは1つ以上の細胞を得ること;
(b)1つまたは1つ以上の細胞をある期間に亘り培養すること;
(c)前記ある期間の終わりに細胞の画像を得ること;
(d)画像における細胞のネットワークに関するフラクタル次元を決定すること;および
(e)工程(d)の結果と、既知の非アルツハイマー病細胞に関して独立して決定されたフラクタル次元とを比較すること。
【請求項13】
請求項12に記載の方法であって、工程(d)において算出されたフラクタル次元が、既知の非アルツハイマー病細胞に関するフラクタル次元よりも統計学的に有意に低いときに、対象はアルツハイマー病であることを示す方法。
【請求項14】
請求項13に記載の方法であって、アルツハイマー病が1つまたは1つ以上の診断方法を使用して確認される方法。
【請求項15】
請求項14に記載の方法であって、1つまたは1つ以上の診断方法が、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される方法。
【請求項16】
請求項12に記載の方法であって、フラクタル次元がボックス集計手続きを用いて算出される方法。
【請求項17】
請求項16に記載の方法であって、ボックス集計手続きがエッジ検出手続きを含む方法。
【請求項18】
請求項12に記載の方法であって、対象が、既知の非アルツハイマー病細胞を提供するコントロール対象と年齢が一致する方法。
【請求項19】
請求項12に記載の方法であって、ある期間が約24時間である方法。
【請求項20】
請求項12に記載の方法であって、細胞がタンパク質混合物中で培養される方法。
【請求項21】
請求項20に記載の方法であって、タンパク質混合物が、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含む細胞外マトリックス調製物を含む方法。
【請求項22】
請求項21に記載の方法であって、タンパク質混合物が更に成長因子を含む方法。
【請求項23】
請求項21に記載の方法であって、細胞外マトリックスタンパク質が腫瘍から抽出される方法。
【請求項24】
請求項23に記載の方法であって、腫瘍がEHSマウス肉腫である方法。
【請求項25】
以下を含む方法;
(a)ヒト対象からの繊維芽細胞のネットワークの画像のフラクタル次元を決定すること;
(b)既知の非アルツハイマー病細胞からの繊維芽細胞のネットワークの画像のフラクタル次元を決定すること;および
(c)工程(a)および(b)の結果を比較すること。
【請求項26】
請求項25に記載の方法であって、工程(a)において決定されたフラクタル次元が工程(b)において決定されたフラクタル次元よりも統計学的に有意に低いときに、診断は、アルツハイマー病を示す方法。
【請求項27】
請求項25に記載の方法であって、対象が既知の非アルツハイマー病細胞を提供するコントロール対象と年齢が一致する方法。
【請求項28】
ヒト対象においてアルツハイマー病を診断する方法であって、
(a)対象からの繊維芽細胞のネットワークの画像のフラクタル次元を算出すること;および
(b)工程(a)の結果を、既知の非アルツハイマー病細胞に関して独立して決定されたフラクタル次元と比較すること;
を含み、
ここで、工程(a)において算出されたフラクタル次元が、既知の非アルツハイマー病細胞に関するフラクタル次元よりも統計学的に有意に低いときに、診断は、対象におけるアルツハイマー病について陽性である方法。
【請求項29】
請求項28に記載の方法であって、対象が既知の非アルツハイマー病細胞を提供するコントロール対象と年齢が一致する方法。
【請求項30】
ヒト対象においてアルツハイマー病を診断する方法であって、
(a)外科用刃を用いて、対象の末梢皮膚繊維芽細胞のサンプルを得ること;
(b)インキュベータを用いてサンプルをある期間に亘りインキュベートすること;
(c)撮像装置を用いて、前記ある期間の終わりにサンプルの画像を得ること;
(d)コンピュータを用いて画像における繊維芽細胞のネットワークに関するフラクタル次元を算出すること;および
(e)工程(d)の結果と、既知の非アルツハイマー病細胞に関して独立して決定されたフラクタル次元とを比較すること;
を含み、
ここで、工程(d)において算出されたフラクタル次元が、既知の非アルツハイマー病細胞に関するフラクタル次元よりも統計学的に有意に低いときに、診断は、対象におけるアルツハイマー病について陽性である診断する方法。
【請求項31】
請求項30に記載の方法であって、サンプルがタンパク質混合物中でインキュベートされる方法。
【請求項32】
請求項31に記載の方法であって、タンパク質混合物が、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含む細胞外マトリックス調製物を含む方法。
【請求項33】
請求項32に記載の方法であって、タンパク質混合物が更に成長因子を含む方法。
【請求項34】
請求項32に記載の方法であって、細胞外マトリックスタンパク質が腫瘍から抽出される方法。
【請求項35】
請求項34に記載の方法であって、腫瘍がEHSマウス肉腫である方法。
【請求項36】
ヒト対象においてアルツハイマー病を診断する方法であって、以下を含む方法;
(a)外科用刃を用いて対象の末梢皮膚繊維芽細胞のサンプルを得ること;
(b)インキュベータを用いてサンプルをある期間に亘りインキュベートすること;
(c)撮像装置を用いて、前記ある期間の終わりにサンプルの画像を得ること;
(d)コンピュータを用いて画像における繊維芽細胞のネットワークに関するフラクタル次元を算出すること;
(e)コンピュータを用いて、工程(d)のフラクタル次元を、種々の年齢のコントロール対象から得られた非アルツハイマー病細胞から生成されたフラクタル次元データを有するデータベースに入力すること;および
(f)コンピュータを用いて、工程(d)の算出されたフラクタル次元と、データベースのデータとを比較することにより、対象を診断すること。
【請求項37】
請求項36に記載の方法であって、サンプルが、ゼラチン様タンパク質混合物中でインキュベートされる方法。
【請求項38】
請求項37に記載の方法であって、ゼラチン様タンパク質混合物が、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含む細胞外マトリックス調製物を含む方法。
【請求項39】
請求項37に記載の方法であって、ゼラチン様タンパク質混合物が更に成長因子を含む方法。
【請求項40】
請求項38に記載の方法であって、細胞外マトリックスタンパク質が腫瘍から抽出される方法。
【請求項41】
請求項40に記載の方法であって、腫瘍がEHSマウス肉腫である方法。
【請求項42】
種々の年齢のコントロール対象から得られた非アルツハイマー病細胞から生成されたフラクタル次元データのデータベースを有するコンピュータ読み取り可能媒体であって、
(a)画像のフラクタル次元を算出する;
(b)フラクタル次元を、フラクタル次元データのデータベースと比較する;および
(c)工程(b)の比較に基づいて、診断を出力する;
ための命令を含むコンピュータ読み取り可能媒体。
【請求項43】
以下を含む方法;
(a)ヒト対象からの皮膚細胞をある期間に亘り培養すること;
(b)細胞の繊維芽細胞のネットワークに関連する細胞形態学的特徴を測定すること;
(c)細胞形態学的特徴に関する演算を行うこと;および
(d)工程(c)の演算と、既知の非アルツハイマー病細胞に関連する独立して決定されたパラメータと比較すること。
【請求項44】
請求項43に記載の方法であって、細胞形態学的特徴が、繊維芽細胞凝集塊の数、繊維芽細胞凝集塊の大きさ、繊維芽細胞凝集塊の成長率およびそれらの組み合わせからなる群より選択される方法。
【請求項45】
請求項43に記載の方法であって、細胞形態学的特徴が、大きい凝集塊の存在または不在、凝集塊に対して付着した細胞の存在または不在、大きな凝集塊成長の存在または不在、凝集塊の数、以前に形成された凝集塊のネットワークからの残留エッジの存在または不在、細胞遊走の数、パーコレーションに近い細胞の存在または不在である方法。
【請求項46】
請求項43に記載の方法であって、工程(c)の演算が、それぞれの細胞形態学的特徴に対して離散値を割り当てること、および前記値を合計することを含む方法。
【請求項47】
請求項46に記載の方法であって、合計が使用されて、ADが診断またはADの不在が診断される方法。
【請求項48】
請求項43に記載の方法であって、細胞がタンパク質混合物中で培養される方法。
【請求項49】
請求項48に記載の方法であって、タンパク質混合物が、ラミニン、コラーゲン、ヘパリン硫酸化プロテオグリカン、エンタクチン/ナイドジェンおよび/またはそれらの組み合わせを含む細胞外マトリックス調製物を含む方法。
【請求項50】
請求項48に記載の方法であって、タンパク質混合物が更に成長因子を含む方法。
【請求項51】
請求項49に記載の方法であって、細胞外マトリックスタンパク質が腫瘍から抽出される方法。
【請求項52】
請求項51に記載の方法であって、腫瘍がEHSマウス肉腫である方法。
【請求項53】
対象においてアルツハイマー病を診断する方法であって、以下を含む方法;
(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程;
(b)ある期間を越えて1つまたは1つ以上の細胞のフラクタル次元を測定する工程;
(c)時間の関数としてフラクタル次元をプロットしてフラクタル次元曲線を得る工程;
(d)フラクタル次元曲線を、非アルツハイマー病細胞および非アルツハイマー病認知症(非ADD)細胞から得たフラクタル次元曲線と比較する工程;および
(e)対象におけるアルツハイマー病の存在または不在を診断する工程。
【請求項54】
請求項53に記載の方法であって、対象から得られた単数または複数の細胞から測定されたフラクタル次元曲線が、非アルツハイマー病細胞および非ADD細胞から得られたフラクタル次元曲線とは統計学的に有意に異なるときに、診断は、対象におけるアルツハイマー病について陽性である方法。
【請求項55】
請求項54に記載の方法であって、対象から得られた単数または複数の細胞が繊維芽細胞である方法。
【請求項56】
請求項53に記載の方法であって、診断が1つまたは1つ以上の更なる診断方法により確認される方法。
【請求項57】
請求項56に記載の方法であって、1つまたは1つ以上の更なる診断方法が、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される方法。
【請求項58】
対象においてアルツハイマー病を診断する方法であって、以下を含む方法;
(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程;
(b)培養された細胞の1つまたは1つ以上の特徴に基づいて集積スコアを決定する工程;
(c)集積スコアを、非アルツハイマー病細胞について決定された集積スコアと比較する工程;および
(d)対象におけるアルツハイマー病の存在または不在を診断する工程。
【請求項59】
請求項58に記載の方法であって、集積スコアを算出するために使用される特徴が、凝集の大きさ、凝集に対する細胞の付着、凝集成長の兆候、凝集の数、ネットワーク内のエッジ、細胞遊走の兆候およびパーコレーション限界に対する近さ(または細胞密度)からなる群より選択される方法。
【請求項60】
請求項58に記載の方法であって、診断が1つまたは1つ以上の更なる診断方法により確認される方法。
【請求項61】
請求項60に記載の方法であって、1つまたは1つ以上の診断方法が、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される方法。
【請求項62】
対象においてアルツハイマー病を診断する方法であって、以下を含む方法;
(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程;
(b)遊走細胞の数を決定する工程;
(c)遊走細胞の数を、非アルツハイマー病細胞についての遊走細胞の数と比較する工程;および
(d)対象におけるアルツハイマー病の存在または不在を診断する工程。
【請求項63】
請求項62に記載の方法であって、対象から得られた遊走細胞の数が、遊走非アルツハイマー病細胞の数よりも統計学的に有意に小さいときに、診断は、ADについて陽性である方法。
【請求項64】
請求項62に記載の方法であって、細胞が繊維芽細胞である方法。
【請求項65】
請求項62に記載の方法であって、診断が1つまたは1つ以上の更なる診断方法により確認される方法。
【請求項66】
請求項65に記載の方法であって、1つまたは1つ以上の更なる診断方法が、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される方法。
【請求項67】
対象においてアルツハイマー病を診断する方法であって、以下を含む方法;
(a)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養する工程;
(b)細胞の空隙性を決定する工程;
(c)細胞の空隙性を、非アルツハイマー病細胞の空隙性と比較する工程;および
(d)対象におけるアルツハイマーの存在または不在を診断する工程。
【請求項68】
請求項67に記載の方法であって、対象から得られた細胞の空隙性が、非アルツハイマー病細胞の空隙性よりも統計学的に有意に高いときに、診断は、ADについて陽性である方法。
【請求項69】
請求項67に記載の方法であって、診断が1つまたは1つ以上の更なる診断方法により確認される方法。
【請求項70】
請求項69に記載の方法であって、1つまたは1つ以上の更なる診断方法が、集積スコアを決定することを含む方法、凝集の数あたりの面積を算出することを含む方法、細胞遊走分析を含む方法、フラクタル分析を含む方法および空隙性分析を含む方法からなる群より選択される方法。
【請求項71】
請求項67に記載の方法であって、細胞が繊維芽細胞である方法。
【請求項72】
アルツハイマー病を治療または予防するための1つまたは1つ以上の薬物候補を開発するために有用なリード化合物をスクリーニングする方法であって、以下を含む方法;
(a)細胞培養培地中で1つまたは1つ以上のAD細胞を培養する工程;
(b)AD細胞を化合物と接触させる工程;および
(c)AD細胞の1つまたは1つ以上の特徴が、化合物と接触されていない非アルツハイマー病細胞の特徴に類似するように変化しているか否かを決定する工程。
【請求項73】
請求項72に記載の方法であって、細胞が繊維芽細胞である方法。
【請求項74】
請求項72に記載の方法であって、特徴がフラクタル次元である方法。
【請求項75】
請求項72に記載の方法であって、特徴が集積スコアである方法。
【請求項76】
請求項72に記載の方法であって、特徴が凝集の数あたりの平均凝集面積である方法。
【請求項77】
請求項72に記載の方法であって、特徴が細胞遊走である方法。
【請求項78】
請求項72に記載の方法であって、特徴が空隙性である方法。
【請求項79】
対象におけるアルツハイマー病持続期間を決定する方法であって、以下を含む方法;
(a)対象から1つまたは1つ以上の細胞を得ること;
(b)既知のAD細胞株について、細胞遊走特性または凝集の数あたりの平均面積を測定すること;
(c)工程(b)において得られたデータを用いて検量線を作成すること;
(d)工程(a)において得られた細胞について、遊走特性または凝集の数あたりの平均面積を測定すること;および
(e)対象におけるAD病持続期間を決定すること。
【請求項80】
請求項79に記載の方法であって、細胞が繊維芽細胞である方法。
【請求項81】
請求項79に記載の方法であって、10年または10年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項82】
請求項79に記載の方法であって、9年または9年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項83】
請求項79に記載の方法であって、8年または8年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項84】
請求項79に記載の方法であって、7年または7年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項85】
請求項79に記載の方法であって、6年または6年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項86】
請求項79に記載の方法であって、5年または5年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項87】
請求項79に記載の方法であって、4年または4年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項88】
請求項79に記載の方法であって、3年または3年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項89】
請求項79に記載の方法であって、2年または2年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応性を有すると同定される方法。
【請求項90】
請求項79に記載の方法であって、1年または1年未満に亘りADを有すると同定された対象が、ADの治療に対して高い反応を有すると同定される方法。
【請求項91】
対象におけるアルツハイマー病の存在と非アルツハイマー病認知症の存在とを識別する方法であって、以下を含む方法;
(a)対象から1つまたは1つ以上の細胞を得ること;
(b)ある期間を越えて1つまたは1つ以上の細胞のフラクタル次元を測定すること;
(c)フラクタル次元を時間の関数としてプロットしてフラクタル次元曲線を得ること;
(d)フラクタル次元曲線を、既知の非アルツハイマー病細胞、既知の非アルツハイマー病認知症(非ADD)細胞および既知のAD細胞から得られたフラクタル次元曲線と比較すること;および
(e)対象におけるADと非ADDとを識別すること。
【請求項92】
請求項91に記載の方法であって、細胞が繊維芽細胞である方法。
【請求項93】
対象におけるアルツハイマー病の存在と非アルツハイマー病認知症の存在とを識別する方法であって、以下を含む方法;
(a)対象から1つまたは1つ以上の細胞を得ること;
(b)対象から1つまたは1つ以上の細胞を得て、組織培養培地中で1つまたは1つ以上の細胞を培養すること;
(c)遊走細胞の数を決定すること;
(d)遊走細胞の数を、既知の非アルツハイマー病細胞、既知のAD細胞および既知の非ADD細胞についての遊走細胞の数と比較すること;および
(e)対象におけるADと非ADDとを識別すること。
【請求項94】
請求項93に記載の方法であって、細胞が繊維芽細胞である方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【公表番号】特表2013−506852(P2013−506852A)
【公表日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願番号】特願2012−532380(P2012−532380)
【出願日】平成22年10月2日(2010.10.2)
【国際出願番号】PCT/US2010/051236
【国際公開番号】WO2011/041761
【国際公開日】平成23年4月7日(2011.4.7)
【出願人】(503310224)ブランシェット・ロックフェラー・ニューロサイエンスィズ・インスティテュート (25)
【Fターム(参考)】
【公表日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願日】平成22年10月2日(2010.10.2)
【国際出願番号】PCT/US2010/051236
【国際公開番号】WO2011/041761
【国際公開日】平成23年4月7日(2011.4.7)
【出願人】(503310224)ブランシェット・ロックフェラー・ニューロサイエンスィズ・インスティテュート (25)
【Fターム(参考)】
[ Back to top ]

