アルツハイマー病IIの治療のための置換エタン−1,2−ジアミン
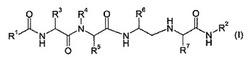
本発明は、下記式(I)の化合物並びにそのアルツハイマー病及び他の類似疾患を治療又は予防するための使用に関する。
【化1】

(式中、R1、R2、R3、R4、R5、R6、R7及びR8は、本明細書及び特許請求の範囲で定義されるとおりである。)
【化1】

(式中、R1、R2、R3、R4、R5、R6、R7及びR8は、本明細書及び特許請求の範囲で定義されるとおりである。)
【発明の詳細な説明】
【発明の詳細な説明】
【0001】
〔発明の背景〕
1.技術分野
本発明は、新規な置換エチレンジアミン並びにそのアルツハイマー病及び他の類似疾患の治療又は予防のための使用に関する。
【0002】
2.背景情報
アルツハイマー病(AD)は主に老化に関連する脳の進行性変性疾患である。ADの臨床症状は、記憶、認知、推理、判断、及び見当識の損失によって特徴づけられる。病気が進行するにつれ、運動、感覚、及び言語能力も影響を受け、複数の認知機能の全体的障害がもたらされる。これら認知喪失は徐々に起こるが、一般的に重度の障害をもたらし、最終的に4〜12年の範囲で死に至る。
アルツハイマー病は、脳内における以下の2つの主要な病因となる所見によって特徴づけられる:神経原線維濃縮体及びβアミロイド(又は神経突起)斑(主にAβとして知られるペプチドフラグメントの凝集体で構成される)。ADの個体は、特徴のあるβ-アミロイド沈着を脳内(βアミロイド斑)及び血管内(βアミロイド脈管障害)に示すと共に神経原線維濃縮体を示す。神経原線維濃縮体は、アルツハイマー病で生じるのみなあrず。他の痴呆誘導障害でも生じる。剖検では、多数のこれら病変は、通常、記憶と認知のために重要なヒト脳の領域内で見られる。
臨床的にADでない多くの高齢者の脳内では、より制限された解剖学的分布で少数のこれら病変が見られる。
アミロイド形成斑及び血管のアミロイド脈管障害は、三染色体性21(ダウン症候群)、オランダ型アミロイド症のある遺伝性脳溢血(HCHWA-D)、及び他の神経変性障害のある個体の脳をも特徴づける。β-アミロイドはADの決定的特徴であり、今や発症の原因となる前駆体又は因子であると考えられている。認知活動の原因である脳の領域内におけるAβの沈着がADの発症の主要因子である。β-アミロイド斑は主にアミロイドβペプチド(Aβ、βA4と称されることもある)で構成される。Aβペプチドは、アミロイド前駆体タンパク質(APP)のタンパク質分解によって誘導され、39〜42のアミノ酸で構成されている。いくつかのセクレターゼと呼ばれるプロテアーゼがAPPのプロセシングに関与している。
AβペプチドのN-末端におけるβ-セクレターゼによるAPPの分解及びC-末端における1又は2以上のγ-セクレターゼによるAPPの分解がβ-アミロイド形成経路、すなわちAβが形成される経路を構成する。α-セクレターゼによるAPPの分解はα-sAPP、すなわちAPPの分泌型を生成し、これはβ-アミロイド斑の形成をもたらさない。この代替経路がAβペプチドの形成を不可能にする。APPのタンパク質分解プロセシングフラグメントの詳細は、例えば米国特許第5,441,870号;第5,721,130号;及び第5,942,400号に記載されている。
【0003】
アスパルチルプロテアーゼは、β-セクレターゼ分解部位におけるAPPのプロセシングの原因である酵素として同定されている。β-セクレターゼ酵素はBACE、Asp2、am Memapsin2といった変名を用いて開示されている。例えば、Sindha et. al., 1999, Nature 402 : 537-554及び公開PCT出願WO00/17369を参照されたい。
数系統の証拠が、β-アミロイドペプチド(Aβ)の進行性脳沈着がADの病原の生産的な役割を果たし、かつ認知症状の数年又は数十年先行しうることを示している。例えばSelkoe, 1991, Neuron 6: 487-498を参照されたい。培養で成長した神経細胞からのAβの放出及び正常個体とAD患者の両者の脳脊髄液(CSF)内でのAβの存在が実証されている。例えば、Seubert et al., 1992, Nature 359: 325-327を参照されたい。
β-セクレターゼによるAPPプロセシングの結果としてAβが蓄積するので、この酵素の活性の阻害がADの治療に望ましいことが提案されており、例えばVassar, R. 2002, Adv. Drug Deliv. Rev. 54, 1589-1602を参照されたい。β-セクレターゼ切断部位でのAPPのin vivoプロセシングは、Aβ生産の律速段階と考えられるので、ADの治療のための治療標的である。例えば、Sabbagh, M., et al., 1997, Alz. Dis. Rev. 3,1-19を参照されたい。
BACE1ノックアウトマウスはAβを生産できず、正常な表現型を示す。APPを過剰発現するトランスジェニックマウスと交配させると、その子孫はコントロール動物と比較して脳内のAβの量が少ない(Luo et. al., 2001 Nature Neuroscience 4: 231-232)。この証拠は、β-セクレターゼ活性の阻害と脳内のAβの減少がAD及び他のβアミロイド障害の治療法を提供するという提案をさらに支持する。
国際特許出願WO00/47618は、β-セクレターゼ酵素及びその使用法を特定している。この出願は、該酵素の活性部位に結合し、かつ該酵素のアフィニティーカラム精製に有用なオリゴペプチドインヒビターをも開示している。さらに、WO00/77030は、スタチン分子に基づく、β-セクレターゼ活性のテトラペプチドインヒビターを開示している。
【0004】
アルツハイマー病の治療のために種々の医薬が提案されているが、いずれも実際に成功していない。米国特許第5,175,281号はアルツハイマー病の治療に有用であるとしてアミノステロイドを開示している。米国特許第5,502,187号はアルツハイマー病の治療に有用であるとして二環式ヘテロ環式アミンを開示している。
EP 652 009 A1は、βアミロイドペプチド生産を細胞培養内及びin vivoで阻害する、アスパルチルプロテアーゼのインヒビターを開示している。細胞内β-アミロイドペプチドの生産を阻害する化合物はアルツハイマー病の治療で有用である。
WO00/69262は、新規なβ-セクレターゼと、そのアルツハイマー病に対して可能性のある薬物候補をスクリーニングするためのアッセイにおける使用について開示している。
WO01/00663は、メマプシン2(ヒトβ-セクレターゼ)及び触媒的に活性な組換え酵素を開示している。さらに、メマプシン2のインヒビターの同定方法、及び2種のインヒビターが開示されている。開示されている両インヒビターはペプチドである。
WO01/00665は、アルツハイマー病の治療に有用なメマプシン2のインヒビターを開示している。
WO03/057721は、アルツハイマー病の治療用の置換アミノカルボキサミドを開示している。
現在、アルツハイマー病の進行を停止、予防、又は逆転するための有効な治療はない。従って、アルツハイマー病の進行を遅らせ、及び/又はまず第一にアルツハイマー病を予防できる、十分な血漿及び/又は脳安定性のある医薬に対する切迫した要望がある。
β-セクレターゼの有効なインヒビターであり、APPのβセクレターゼ-媒介分解を阻害し、Aβ生産の有効なインヒビターであり、及び/又はアミロイドβ沈着又は斑の低減に有効な化合物が、AD等のアミロイドβ沈着又は斑によって特徴づけられる疾患の治療及び予防のために必要である。
【0005】
〔発明の簡単な概要〕
驚くべきことに、下記式(I)の置換エタン-1,2-ジアミンがAPPのβセクレターゼ-媒介分解の優れた阻害と十分な血漿安定性を示すことが分かった。
従って、本発明は第1実施形態では下記式(I)の群1の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0006】
【化1】

【0007】
(式中、
R1は、
a) C1-4-アルキル-又はC3-6-シクロアルキル-基
(ここで、該C1-4-アルキル-基の1個の非末端メチレン基は、任意に窒素又は酸素原子と置き換わっていてもよく、かつ
該C1-4-アルキル-又はC3-6-シクロアルキル-基は、HO-CO-、HO-PO2-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されている)、
b) アリール-基、
(ここで、該アリール-基は任意に、ハロゲン、C1-3-アルキル-、HO-、HO-CO-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、又は
c) ヘテロアリール-基
(ここで、該ヘテロアリール-基は任意に、ハロゲン、C1-3-アルキル-、HO-、HO-CO-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R2は、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-5-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-5-アルキル-、アリール-、アリール-C1-5-アルキル-、ヘテロアリール-、ヘテロアリール-C1-5-アルキル-、C3-8-シクロアルキル-C2-5-アルケニル-、ヘテロサイクリル-C2-5-アルケニル-、アリール-C2-5-アルケニル-、ヘテロアリール-C2-5-アルケニル-、C3-8-シクロアルキル-C2-5-アルキニル-、ヘテロサイクリル-C2-5-アルキニル-、アリール-C2-5-アルキニル-又はヘテロアリール-C2-5-アルキニル-基を表し
(前記各基は、C1-3-アルキル-、HO-C1-3-アルキル-、HO-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-、C1-3-アルキル-O-CO-C1-3-アルキル-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ホルミル-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-、(R8)2N-C1-3-アルキル-、(R8)2N-CO-、(R8)2N-CO-C1-3-アルキル-、C1-3-アルキル-CO-N(R8)-、(R8)2N-SO2-、C1-3-アルキル-SO2-及びC1-3-アルキル-SO2-N(R8)-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-、C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R4は、水素、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-又はC3-8-シクロアルキル-C1-3-アルキル-基を表し
(前記各基は、任意に1又は2以上のフッ素原子で置換されていてもよい)、
R5は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-、C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R6は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-、C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R7は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R8は、それぞれ相互独立に水素、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-3-アルキル-、アリール-、アリール-C1-3-アルキル-、ヘテロアリール-、ヘテロアリール-C1-3-アルキル-、C3-8シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表す
(前記各基は、任意に、C1-3-アルキル-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ヒドロキシ-、ニトロ-、シアノ-、H2N-及びH2N-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)。)
【0008】
さらに、本発明は、式(I)の化合物又はその医薬的に許容しうる塩若しくは溶媒和物と、医薬的に許容しうる担体又は希釈剤とを含む医薬組成物に関する。
本発明の別の局面は、式(I)の化合物又はその医薬的に許容しうる塩若しくは溶媒和物の、アミロイド前駆体タンパク質の異常なプロセシング及び/又はAβペプチドの凝集に関連する疾患若しくは状態及び/又はAβペプチドによって誘発される状態を有する患者を治療する際、或いは患者が前記疾患又は状態になるのを予防する際に使う医薬の製造における使用である。前記状態は、アルツハイマー病、びまん性レビー小体型アルツハイマー病、ダウン症候群、MCI(“軽度認知障害(Mild Cognitive Impairment”)、オランダ型アミロイド症のある遺伝性脳溢血、脳アミロイド血管症、外傷性脳損傷、痴呆症、パーキンソン症候群、膵臓炎、封入体筋炎(IBM)又は中枢神経性若しくは末梢神経性アミロイド症から選択される。
さらに、本発明は、β-セクレターゼ活性の阻害方法であって、前記β-セクレターゼを有効な阻害量の式(I)の化合物にさらす工程を含む方法に関する。
本発明は、アミロイド前駆体タンパク質(APP)のβ-セクレターゼ-媒介分解を阻害するための化合物、組成物、キット、及び方法を提供する。
さらに詳しくは、本発明の化合物、組成物、及び方法は、Aβペプチドの生産を阻害するため、及び病原形のAβペプチドに関連するいずれのヒト又は動物の疾患若しくは状態を治療又は予防するためにも有効である。
従って、本発明のさらなる目的は、本発明の化合物の、β-セクレターゼの阻害によって改変しうる疾患及び状態の治療又は予防用薬物の製造のための使用に関する。
本発明の化合物、組成物、及び方法は、アルツハイマー病(AD)を有するヒトの治療、ADの発症の予防若しくは遅延の補助、軽度認知障害(MCI)の患者の治療、及び予防しなければMCIからADに進行するであろう当該患者のADの発症の予防又は遅延、ダウン症候群の治療、オランダ型アミロイド症のある遺伝性脳溢血の治療、脳β-アミロイド血管症の治療とその単回及び反復性皮質下出血のような潜在的結果の予防、血管と変性の入り混じった原因に関連する痴呆症といった他の変性痴呆症の治療、パーキンソン病関連痴呆症、進行性核上麻痺関連痴呆症、皮質基底変性関連痴呆症、及びびまん性レビー小体型ADの治療に有用である。
本発明の化合物はβ-セクレターゼ阻害活性を有する。
本発明の化合物の該阻害活性は、例えば、本明細書で述べるか又は技術上周知の1又は2以上のアッセイを用いて容易に実証される。
【0009】
〔発明の詳細な説明〕
本発明は、アルツハイマー病の治療と予防に有用な式(I)の化合物に関する。
ここで、本発明の化合物を説明するために前述した、また後述するいくつかの表現についてさらに完全に定義する。
本発明では、用語アルキルは、特に断らない限り、1〜8個の炭素原子、好ましくは1〜6個の炭素原子、最も好ましくは1〜5個の炭素原子、特に1、2又は3個の炭素原子を有する不分岐若しくは分岐炭化水素基を意味する。例は、メチル、エチル、プロピル、ブチル、ペンチル、ヘキシル等である。特に断らない限り、上記用語プロピル、ブチル、ペンチル、ヘキシル、ヘプチル、オクチルは、n-プロピル、イソプロピル、n-ブチル、イソ-ブチル、tert-ブチル、n-ペンチル、イソ-ペンチル、ネオ-ペンチル、tert-ペンチル、n-ヘキシル、イソ-ヘキシル等のようなすべての可能な異性形をも包含する。場合によっては、一般的な略語を用いて上記アルキル基を示し、例えばメチルはMe、エチルはEt等である。
用語アルキルは、特に断らない限り、フッ素で一置換又は多置換されている当該アルキル基をも包含する。例として、トリフルオロメチル、トリフルオロメトキシ、ジフルオロメトキシ、ペルフルオロエチル、ペルフルオロプロピル、2,2,2-トリフルオロエチル、2,2,2-トリフルオロエトキシ、1,1,1-トリフルオロプロパ-2-イル等が挙げられる。
好ましいフッ素化アルキル基はフルオロメチル、ジフルオロメチル及びトリフルオロメチルである。
用語ハロゲンは、一般的にフッ素、塩素、臭素又はヨウ素、特にF、Cl及びBrを意味する。
用語アルケニルは、特に断らない限り、2〜8個の炭素原子、好ましくは2〜6個の炭素原子、最も好ましくは2〜4個の炭素原子と、1〜3個の二重結合とを有する分岐若しくは不分岐炭化水素基を意味し、例えば、エテニル、プロペニル、アリル、1-ブテニル、1-ペンテニル、1-ヘキセニル等が挙げられる。
用語アルキニルは、特に断らない限り、2〜8個の炭素原子、好ましくは2〜6個の炭素原子、最も好ましくは2〜4個の炭素原子と、1又は2個の三重結合とを有する分岐若しくは不分岐炭化水素基を意味し、エチニル、プロピニル、プロパルギル、ブチニル、ペンチニル等が挙げられる。
用語シクロアルキル(他の基の一部であるアルキル基、特にシクロアルキル-アルキル-又はシクロアルコキシ-を含む)は、特に断らない限り、3〜12個の炭素原子を有する飽和炭素環式基を意味する。シクロアルキルは単環式、又は多環式縮合系でよい。好ましくは、シクロアルキル基は、3〜8個の炭素原子、最も好ましくは3、4、5又は6個の炭素原子、特に3又は6個の炭素原子を有する単環式である。例は、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル等である。最も好ましくはシクロプロピル及びシクロヘキシルである。
用語アリール基は、特に断らない限り、単環(例えば、フェニル)、多環(例えば、ビフェニル)、又は多縮合芳香族環(例えば、ナフチル、アントリル)を有する芳香族炭素環式基を意味する。例は、フェニル、ビフェニル、1-ナフチル、2-ナフチル、アントラセニル、フェナントレニルである。“アリール”の特に好ましい意味はフェニルである。
用語ヘテロアリール基は、特に断らない限り、窒素、酸素、又はイオウから選択される少なくとも1、2、3、又は4個のヘテロ原子を含有する5-、6-、又は7-員環の1又は2以上の芳香族若しくは不飽和環系を意味し、9〜11個の原子の縮合環系を包含する。用語ヘテロアリール基は、該環中に酸素原子で置換されている窒素原子を含有するヘテロアリール基(ヘテロアリールN-オキシド)をも包含する。典型的なヘテロアリールN-オキシドはピリジン-2-イルN-オキシド、ピリジン-3-イルN-オキシド、ピリジン-4-イルN-オキシド、ピロリルN-オキシド、ピリミジニルN-オキシド、ピリダジニルN-オキシド、ピラジニルN-オキシド、キノリニルN-オキシド、インドリルN-オキシド、インドリニルN-オキシド、イソキノリルN-オキシド、キナゾリニルN-オキシド、キノキサリニルN-オキシド、フタラジニルN-オキシド、イミダゾリルN-オキシド、イソキサゾリルN-オキシド、オキサゾリルN-オキシド、チアゾリルN-オキシド、インドリジニルN-オキシド、インダゾリルN-オキシド、ベンゾチアゾリルN-オキシド、ベンゾイミダゾリルN-オキシド、ピロリルN-オキシド、オキサジアゾリルN-オキシド、チアジアゾリルN-オキシド、トリアゾリルN-オキシド、テトラゾリルN-オキシドである。ヘテロアリール基のさらなる例は、チオフェニル、ピリジニル、ピリミジニル、キノリニル、ベンゾチエニル、インドリル、インドリニル、ピリダジニル、ピラジニル、イソインドリル、イソキノリル、キナゾリニル、キノキサリニル、フタラジニル、イミダゾリル、イソキサゾリル、ピラゾリル、オキサゾリル、チアゾリル、インドリジニル、インダゾリル、ベンゾチアゾリル、ベンゾイミダゾリル、ベンゾフラニル、フラニル、チエニル、ピロリル、オキサジアゾリル、チアジアゾリル、トリアゾリル、テトラゾリル、オキサゾロピリジニル、イミダゾピリジニル、イソチアゾリル、ナフチリジニル、シンノリニル、カルバゾリル、β-カルボリニル、イソクロマニル、クロマニル、テトラヒドロイソキノリニル、イソインドリニル、イソベンゾテトラヒドロフラニル、イソベンゾテトラヒドロチエニル、イソベンゾチエニル、ベンゾオキサゾリル、ピリドピリジニル、ベンゾテトラヒドロフラニル、ベンゾテトラヒドロチエニル、プリニル、ベンゾジオキソリル、トリアジニル、フェノキサジニル、フェノチアジニル、プテリジニル、ベンゾチアゾリル、イミダゾピリジニル、イミダゾチアゾリル、ジヒドロベンゾイソキサジニル、ベンゾイソキサジニル、ベンゾオキサジニル、ジヒドロベンゾイソチアジニル、ベンゾピラニル、ベンゾチオピラニル、クマリニル、イソクマリニル、クロモニル、クロマノニル、テトラヒドロキノリニル、ジヒドロキノリニル、ジヒドロキノリノニル、ジヒドロイソキノリノニル、ジヒドロクマリニル、ジヒドロイソクマリニル、イソインドリノニル、ベンゾジオキサニル、ベンゾオキサゾリノニル、ベンゾチオピラニルS-オキシド、ベンゾチオピラニルS,S-ジオキシド、ベンゾ[1,3]ジオキソールである。
好ましいヘテロアリール基は下記式で示される基及びベンゾイミダゾリル-基である。
【0010】
【化2】

【0011】
用語ヘテロサイクリル基は、特に断らない限り、窒素、酸素、又はイオウから選択される少なくとも1、2、3、又は4個のヘテロ原子を含有する5-、6-、又は7-員環の1又は2以上の飽和炭素環系を意味し、9〜11個の原子の縮合環系を包含する。本発明の好ましいヘテロ環として、モルフォリニル、チオモルフォリニル、チオモルフォリニルS-オキシド、チオモルフォリニルS,S-ジオキシド、ピペラジニル、ホモピペラジニル、ピロリジニル、ピロリニル、テトラヒドロピラニル、ピペリジニル、テトラヒドロフラニル、テトラヒドロチエニル、ホモピペリジニル、モルフォリニル、ホモモルフォリニル、ホモチオモルフォリニル、ホモチオモルフォリニルS,S-ジオキシド、オキサゾリジノニル、ジヒドロピラゾリル、ジヒドロピロリル、ジヒドロピラジニル、ジヒドロピリジニル、ジヒドロピリミジニル、ジヒドロフリル、ジヒドロピラニル、アゼパニル、ジアゼパニル、テトラヒドロチエニルS-オキシド、テトラヒドロチエニルS,S-ジオキシド及びホモチオモルフォリニルS-オキシドが挙げられる。特に好ましいヘテロサイクリル基はモルフォリニルである。
シクロアルキル-アルキル-、ヘテロサイクリル-アルキル-、アリール-アルキル-、ヘテロアリール-アルキル-のような用語は、シクロアルキル、ヘテロサイクリル、アリール又はヘテロアリール基で置換されている、上記定義どおりのアルキル基を意味する。アリール-アルキル基の例はベンジル又は2-フェニルエチルである。シクロアルキル-アルキル-基の例はシクロプロピルメチル-、シクロヘキシルメチル又はシクロペンチルエチルである。
上述した多くの用語は、式又は基の定義で繰り返し使用され、各場合、相互独立に上記意味の1つを有する。
【0012】
この出願で使用する用語“任意に置換されていてもよい”は、そのように示される基が、置換されていないか又は指定した置換基で一置換又は多置換されていることを示す。問題の基が多置換されている場合、当該置換基は同一又は異なってよい。
本発明の化合物は不斉炭素原子を含み、例えば、不斉炭素原子の数、絶対配置及び相対配置によって、可能な異性体の1つの形態で存在し、又はその混合物として存在しうる。例えば、対掌体及び/又はジアステレオマー等の純粋な異性体として、或いはエナンチオマー混合物、例えばラセミ体、ジアステレオマー混合物又はラセミ混合物等の異性体混合物として存在しうる。本発明は、純粋な異性体及び可能なすべての異性体混合物の両者に関し、かつ各場合に立体化学の詳細が特に言及されていない場合でさえ、前述した、また後述するとおりに解釈するものとする。
記号“-”は、一般的に鎖中の2つの原子間の結合及びその定義している分子の残部への基の結合点を示す。例えば、アリール-C1-3-アルキル-基は、アリールアルキル-基(例えば2-フェニルエチル-)(該フェニル基がエチル基に結合し、このエチル基が分子の残部に結合している)を示す。置換基の原子の記数法は、置換基が結合している、該分子の残部に最も近い原子で開始する。
例えば、用語“3-カルボキシプロピル-基”はカルボキシ基がプロピル基の第3炭素原子に結合している、下記置換基を意味する。
【0013】
【化3】

【0014】
用語“1-メチルプロピル-”、“2,2-ジメチルプロピル-”又は“シクロプロピルメチル-”は、下記基を意味する。
【0015】
【化4】

【0016】
サブ式でアスタリスクを用いて、定義している分子の残部に連結している結合を示す。
【0017】
好ましい実施形態では、本発明は、式(I)中、
R1が、
a) C1-4-アルキル-基
(ここで、前記C1-4-アルキル-は、HO-CO-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されている)、
b) アリール-基
(任意に、フルオロ、HO-及びHO-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、又は
c) ヘテロアリール-基
(任意に、フルオロ、クロロ、Me、HO-及びHO-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R2がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-5-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-5-アルキル-、アリール-、アリール-C1-5-アルキル-、ヘテロアリール-又はヘテロアリール-C1-5-アルキル-基を表し
(前記各基は、C1-3-アルキル-、HO-C1-3-アルキル-、HO-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ホルミル-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-、(R8)2N-C1-3-アルキル-、(R8)2N-CO-、(R8)2N-CO-C1-3-アルキル-、C1-3-アルキル-CO-N(R8)-、(R8)2N-SO2-、C1-3-アルキル-SO2-及びC1-3-アルキル-SO2-N(R8)-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R4が水素、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-又はC3-8-シクロアルキル-C1-3-アルキル-基を表し
(前記各基は、任意に1又は2以上のフッ素原子で置換されていてもよい)、
R5がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R6がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R7がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R8がそれぞれ相互独立に水素、C1-6-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-3-アルキル-、アリール-、アリール-C1-3-アルキル-、ヘテロアリール-又はヘテロアリール-C1-3-アルキル-基を表す
(前記各基は、任意に、C1-3-アルキル-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ヒドロキシ-、ニトロ-、シアノ-、H2N-及びH2N-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
式(I)の群2の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0018】
さらに好ましい実施形態では、本発明は、式(I)中、
R1が、
a) HO-CO-(CH2)n-又はHO-SO2-(CH2)n-基(ここで、nは1、2、3又は4である)、又は
b) キノリニルN-オキシド、イソキノリニルN-オキシド、ピリジン-2-イルN-オキシド、ピリジン-3-イルN-オキシド、ピリジン-4-イルN-オキシド、又は
c) フェニル基
(ここで、前記フェニル基は、任意に、ハロゲン及びヒドロキシ-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R8がそれぞれ相互独立に水素又はC1-6-アルキル-基を表し
(ここで、前記C1-6-アルキル-基は、任意に、C1-3-アルキル-O-、ハロゲン、カルボキシ-、ヒドロキシ-、ニトロ-、シアノ-及びH2N-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
かつR2、R3、R4、R5、R6及びR7は、群1又は2の化合物について定義したとおりである、
式(I)の群3の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0019】
さらに好ましい実施形態では、本発明は、式(I)中、
R1が、
a) HO-CO-(CH2)n-基(ここで、nは1、2、3又は4である)、
b) ピリジン-2-イルN-オキシド、ピリジン-3-イルN-オキシド、ピリジン-4-イルN-オキシド、又は
c) フェニル基
(ここで、前記フェニル基は、任意に、ハロゲン及びヒドロキシから成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R8がそれぞれ相互独立に水素又はC1-6-アルキル-基を表し
(ここで、前記C1-6-アルキル-基は、任意に、C1-3-アルキル-O-及びフルオロから成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
かつR2、R3、R4、R5、R6及びR7は、群1又は2の化合物について定義したとおりである、
式(I)の群4の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0020】
さらに好ましい実施形態では、本発明は、式(I)中、
R1がHO-CO-(CH2)3-、ピリジン-2-イルN-オキシド、ピリジン-3-イルN-オキシド、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、
R8がそれぞれ相互独立に水素又はC1-6-アルキル-基を表し、
かつR2、R3、R4、R5、R6及びR7は、群1又は2の化合物について定義したとおりである、
式(I)の群5の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0021】
さらに好ましい実施形態では、本発明は、式(I)中、
R1がHO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、
R8がそれぞれ相互独立に水素又はC1-3-アルキル-基を表し、
かつR2、R3、R4、R5、R6及びR7は、群1又は2の化合物について定義したとおりである、
式(I)の群6の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0022】
さらに好ましい実施形態では、本発明は、式(I)中、
R2がC1-5-アルキル-、C2-5-アルケニル-、C2-5-アルキニル-、C3-6-シクロアルキル-C1-5-アルキル-、フェニル-C1-5-アルキル-又はヘテロアリール-C1-5-アルキル-基を表し
(ここで、前記C1-5-アルキル-基は、任意に1又は2以上のフッ素原子で置換されていてもよく、かつ
前記フェニル基は、任意に、C1-3-アルキル-、ニトロ-、ハロゲン、ヒドロキシ-、カルボキシ-、(R8)2N-、(R8)2N-C1-3-アルキル-、(R8)2N-CO-C1-3-アルキル-、C1-3-アルキル-CO-N(R8)-、C1-3-アルキル-SO2-、(R8)2N-CO-、HO-C1-3-アルキル-、HO-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-及びC1-3-アルキル-SO2-N(R8)-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル-、フェニル-C1-4-アルキル-C3-6-シクロアルキル-C1-3-アルキル、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R4が水素又はC1-4-アルキル-基を表し
(任意に、1又は2以上のフッ素原子で置換されていてもよい)、
R5がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル-、フェニル-C1-4-アルキル-、C3-6-シクロアルキル-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R6がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル- 、フェニル-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル、C3-6-シクロアルキル-C1-3-アルキル、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R7がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル-、フェニル-C1-4-アルキル-基、C3-6-シクロアルキル-C1-3-アルキル、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-基から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
かつR1及びR8は群1、2、3、4、5又は6の化合物について定義したとおりである、
式(I)の群7の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0023】
さらに好ましい実施形態では、本発明は、式(I)中、
R2がC1-3-アルキル-、C3-6-シクロアルキル-C1-3-アルキル-、フェニル-C1-3-アルキル-又はピリジル-C1-3-アルキル-基を表し
(ここで、前記C1-3-アルキル-基は、任意に1又は2以上のフッ素原子で置換されていてもよく、かつ
前記フェニル基は、任意に、C1-3-アルキル-、ニトロ-、ヒドロキシ-、カルボキシ-、H2N-、H2N-CH2-、H2N-CO-CH2-、Me-CO-NH-、Me-SO2-、H2N-CO-、HO-CH2-、HOCO-CH2-、Me-OCO-CH2-、Me-OCO-、及びMe-SO2-NH-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3がC1-5-アルキル-基を表し、
R4が水素を表し、
R5がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R6がC1-4-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R7がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表し
(ここで、前記アルキル-基は、任意に、カルボキシ-、ヒドロキシ-、H2N-及びH2N-CO-基から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
かつR1は群1、2、3、4、5又は6の化合物について定義したとおりである、
式(I)の群8の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0024】
さらに好ましい実施形態では、本発明は、式(I)中、
R2がエチル-、n-プロピル-若しくは2-メチルプロピル-基、又は下記置換基から成る群より選択される置換基を表し、
【0025】
【化5】

【0026】
R3がC1-5-アルキル-基を表し、
R4が水素を表し、
R5がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R6がC1-4-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R7がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表し
(ここで、前記アルキル-基は、任意に、カルボキシ-、ヒドロキシ-、H2N-及びH2N-CO-基から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
かつR1は、群1、2、3、4、5又は6の化合物について定義したとおりである、
式(I)の群9の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0027】
さらに好ましい実施形態では、本発明は、式(I)中、
R2がエチル-、n-プロピル-若しくは2-メチルプロピル-基、又は下記置換基から成る群より選択される置換基を表し、
【0028】
【化6】

【0029】
R3が下記置換基から成る群より選択される置換基を表し、
【0030】
【化7】

【0031】
R4が水素を表し、
R5が下記置換基から成る群より選択される置換基を表し、
【0032】
【化8】

【0033】
R6が下記置換基から成る群より選択される置換基を表し、
【0034】
【化9】

【0035】
R7がメチル-、エチル-、n-プロピル-若しくはn-ブチル-基、又は下記置換基から成る群より選択される置換基を表し、
【0036】
【化10】

【0037】
かつR1は、群1、2、3、4、5又は6の化合物について定義したとおりである、
式(I)の群10の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0038】
さらに好ましい実施形態では、本発明は、下記式(Ia)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0039】
【化11】

【0040】
(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、群1、2、3、4、5、6、7、8、9又は10の化合物について定義したとおりである。)
【0041】
別のさらに好ましい実施形態では、本発明は、下記式(Ib)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0042】
【化12】

【0043】
(式中、
R1はHO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、群1、2、3、4、5、6、7、8、9又は10の化合物について定義したとおりである。)
【0044】
別のさらに好ましい実施形態では、本発明は、下記式(Ic)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0045】
【化13】

【0046】
(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、群1、2、3、4、5、6、7、8、9又は10の化合物について定義したとおりである。)
【0047】
別のさらに好ましい実施形態では、本発明は、下記式(Id)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0048】
【化14】

【0049】
(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、群1、2、3、4、5、6、7、8、9又は10の化合物について定義したとおりである。)
【0050】
別のさらに好ましい実施形態では、本発明は、下記式(Ie)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0051】
【化15】

【0052】
(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、群1、2、3、4、5、6、7、8、9又は10の化合物について定義したとおりである。)
【0053】
別のさらに好ましい実施形態では、本発明は、下記式(If)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0054】
【化16】

【0055】
(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、群1、2、3、4、5、6、7、8、9又は10の化合物について定義したとおりである。)
【0056】
最も好ましくは下記式(I)〜(58)の化合物である。
【0057】
【化17】

【0058】
【化18】

【0059】
【化19】

【0060】
【化20】

【0061】
【化21】

【0062】
【化22】

【0063】
【化23】

【0064】
【化24】

【0065】
【化25】

【0066】
本発明の化合物は、当業者に周知の出発化合物から当業者に周知の方法で製造される。このプロセス化学は当業者に周知である。以下の反応スキームは本発明の化合物のペプチド合成を示す。
当業者にはこれらがすべて有機化学の周知反応であることが分かるだろう(Houben-Weyl− Methods of Organic Chemistry, Vol E22, Synthesis of Peptides and Peptidomimetics, M. Goodman, A. Felix, L. Moroder, C. Toniolo Eds., Georg Thieme Verlag Stuttgart, New York)。本発明の式(I)の生物学的に活性な化合物の化学構造を知っている、本技術の熟練化学者は、何らさらなる情報がなくても既知の出発原料から既知の方法で本発明の化合物を調製できるだろう。従って、以下の説明は必ずしも必要でないが、本発明の化合物の製造を望む当業者に役に立つと考えられる。
スキームAは、式(I)の化合物の固相ペプチド合成を示す。
ポリマーとして商業的に入手可能な[3-{[エチル-Fmoc-アミノ]-メチル}-インドール-1-イル-アセチルAM樹脂(Indol resin, Novabiochem)を使用する。DMF中のピペリジンによるFmoc-基の切断(工程a)後、ペプチド化学の標準的方法、例えばHATU/HOBtで第1のアミノ酸をカップリングする(工程b)。Fmoc-基の脱保護(工程b)後、次のアミノ酸(Fmoc-Abu)を適切なペプチドカップリング試薬、例えばDIC/HOBtでカップリングする(工程c)。Fmoc-基の切断(工程c)後、還元剤としてNaCNBH3の存在下Fmoc-ロイシナールで還元的アルキル化を行う(工程d)。その結果生じた二級アミン基を(Boc)2Oでキャッピングする。工程a)、b)及びc)を適用し、それぞれアミノ酸Fmoc-homoPhe及びFmoc-Leuを用いて、ペプチド構築を完成した。標準的なアシル化法でN-末端キャッピング基の導入を達成できる(工程g)。酸、例えばトリフルオロ酢酸との反応によって、ポリマーからC-末端ペプチドN-エチルアミドを切断する。
この合成手順により、式(I)の位置R1、R3、R4、R5、R6、及びR7に種々の残基を組み入れることができる。
スキームA(実施例番号1)
【0067】
【化26】

【0068】
スキームBは、C-末端アミド部分を変化させたペプチドの合成を示す。この目的では、商業的に入手可能な(ホルミルインドリル)アセトアミドメチルポリスチレン樹脂を使用する。第1反応で、NaCNBH3の存在下シクロヘキシルメチルアミンでアルデヒド基を還元的にアルキル化した(工程a)。スキームAに示したように、さらなるペプチド構築及び該ポリマーからの切断を行った。
スキームB(実施例番号2)
【0069】
【化27】

【0070】
以下に概要を示す一般的合成スキームに従う液相化学によって、本発明の化合物を合成することができる。この方法により、それぞれのアミノ酸、カルボン酸又はアミンを利用して、R1、R2、R3、R4、R5、R6、及びR7の変形が可能である。
スキームCに示されるように、中心コアe)を構築した。標準的なカップリング条件、特にTBTU/DIPEAを用いて、Boc-保護アミノ酸をアミノ酸t-ブチルエステルb)とカップリングして二保護ジペプチドc)を得た。c)をボランジメチルスルフィド複合体で還元してジアミンd)を得た。慎重なクロマトグラフィー後、Boc-脱保護して単保護生成物e)を得た。
スキームC:
【0071】
【化28】

【0072】
代替手順では、下記スキームDに示すように単保護ジペプチドf)を調製した。
スキームD:
【0073】
【化29】

【0074】
対応するアミノ酸アルコールのDees/Martin酸化によって得たBoc-保護アミノ酸アルデヒドg)をアミノ酸エステルh)で還元的アルキル化して二保護ジアミンi)を得、Boc-脱保護して単保護生成物f)を得た。
下記スキームEに従って最終生成物I)を得た。
スキームE:
【0075】
【化30】

【0076】
R5を有するBoc-保護アミノ酸エステルから出発する標準的ペプチドカップリング手順及びBoc-脱保護工程を用いてN-末端部k)を構築した。引き続き、エステルj)を加水分解して遊離酸k)を得た。標準的ペプチドカップリング条件、特にTBTU/DIPEAを用いてジアミンe)又はf)をN-末端部k)とカップリングした。メチルエステルの場合はLiOHを用い、t-ブチルエステルの場合はTFAを用いてエステルm)を加水分解後、生じた酸を対応アミンp)とカップリングしてアミドl)を得た。
場合によっては、最終生成物m)を得るための最終工程で保護前駆体からC-末端R2を遊離させる必要があった。下記スキームFは一例を示した。エステルl)を加水分解して遊離酸m)を得た。
スキームF:
【0077】
【化31】

【0078】
代替手順では、下記スキームGに従って最終化合物を得た。
スキームG:
【0079】
【化32】

【0080】
従って、C-末端部n)の合成の第1工程では、Boc-保護アミノ酸o)とアミンp)を用いて標準的ペプチドカップリング手順でアミドq)を構築した。q)のBoc-脱保護と対応Boc-保護アミノ酸アルデヒドg)による還元的アルキル化によってジペプチドアミドr)を得た。Boc-脱保護とN-末端部k)とのカップリングによって最終生成物l)を得た。
特に定義しない限り、本明細書で使用するすべての科学用語及び技術用語は、この発明が属する技術の当業者が一般的に解釈する意味と同じ意味を有する。本明細書で参照したすべての特許及び刊行物は、引用によってすべての目的のため本明細書に組み込まれる。以下の定義及び説明は、本明細書及び特許請求の範囲の両者を含むこの全文書を通じて使用する用語に使われる。
すべての温度は摂氏温度であり、
(M+H)+は、親原子+水素原子の正イオンを表し、
Abuは2-アミノ酪酸を表し、
BOCは1,1-ジメチルエトキシカルボニル又はt-ブトキシカルボニルを表し、
BOPはベンゾトリアゾール-l-イルオキシ-トリス(ジメチルアミノ)ホスホニウムヘキサフルオロホスフェートを表し、
Bzlはベンジルを表し、
CBZはベンジルオキシカルボニルを表し、
CDIは1,1'-カルボニルジイミダゾールを表し、
クロマトグラフィー(カラム及びフラッシュクロマトグラフィー)は、(担体,溶出液)として示され、化合物の精製/分離法を表す。妥当なフラクションをプールし、濃縮して所望化合物を得るものと解釈し、
CMRはC-13磁気共鳴スペクトル分析(化学シフトはTMSから低磁場にppm(8)で記録される)を表し、
DICはジシクロヘキシルカルボジイミドを表し、
DIPAMPは(R,R)-1,2-エタンジイルビス[(2-メトキシフェニル)フェニルホスフィン]を表し、
DCMはジクロロメタンを表し、
Dipeaはジイソプロピルエチルアミンを表し、
DIPEAはジイソプロピルエチルアミンを表し、
DMFはジメチルホルムアミドを表し、
EDCはエチル-1-(3-ジメチルアミノプロピル)カルボジイミド又は1-(3-ジメチルアミノプロピル)-3-エチル(etliyl)カルボジイミドハイドロクロライドを表し、
EIは電子衝撃を表す。CIは化学イオン化を表す。FABは高速原子衝撃法を表し、
エーテルは、特に断らない限り、ジエチルエーテルを指し、
FMOCは9-フルオレニルメチルカーボネートを表し、
HATUはO-(7-アザベンゾトリアゾール-1-イル)-N,N,N',N'-テトラメチルウロニウムヘキサフルオロ-ホスフェートを表し、
HBTUは2-(1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムヘキサフルオロホスフェートを表し、
HOAcは酢酸を表し、
HOBtは1-ヒドロキシベンゾトリアゾール水和物を表し、
HRMSは高分解能質量分析を表し、
IRは赤外分光分析を表し、
MPLCは中圧液体クロマトグラフィーを表し、
MSはm/e、m/z又は質量/電荷単位で示される質量分析を表し、
NBSはN-ブロモスクシンイミドを表し、
NMMはN-メチルモルフォリンを表し、
NMPはN-メチルピロリドンを表し、
NMRは核(プロトン)磁気共鳴スペクトル分析(化学シフトはTMSから低磁場にppm(d)で記録される)を表し、
psiはポンド/in2を表し、
RFは保持係数を表し、
RTは保持時間を表し、
食塩水は塩化ナトリウム飽和水溶液を表し、
Staは(3S,4S)-4-アミノ-3-ヒドロキシ-6-メチル-ヘプタン酸を表し、
TBTUは1-[ビス(ジメチルアミノ)メチレン]-1-H-ベンゾトリアゾリウム(triazolim)-テトラフルオロボレート-3-オキシドを表し、
tBuはtert.-ブチルを表し、
TFAはトリフルオロ酢酸を表し、
THFはテトラヒドロフランを表し、
TMOFはオルトギ酸トリメチルを表す。
【0081】
“医薬的に許容しうる”という表現は、組成物、製剤、安定性、患者の許容性及びバイオアベイラビリティーについて、薬理学的/毒性学的観点から患者にとって許容性であり、かつ物理学的/化学的観点から医薬品を製造する化学者にとって許容性である当該特性及び/又は物質を意味する。溶媒対を使用する場合、使用する溶媒の比は体積/体積(v/v)である。溶媒中の固体の溶解度を使用する場合、溶媒に対する固体の比は質量/体積(wt/v)である。
【実施例】
【0082】
さらに推敲することなく、当業者は先行する記述を用いて本発明をその最大限まで実施できると考えられる。
以下の詳細例は、本発明の種々の化合物をどうやって調製するか、及び/又は本発明の種々の方法をどうやって遂行するかを説明しており、単に例示としてみなすべきであり、如何なる場合にも先行する開示の限定と解釈すべきでない。当業者には、反応物質と、反応条件及び方法との両者について、該手順から適切な変形が即座に分かるだろう。
分析用HPLC-MS及び/又はNMRで生成物を分析した。
HPLC-条件1:カラム:Waters Xterra MS, C18, 2.1×50mm, 3.5μm
カラム温度(℃):60.0
流速:1.0ml/分
溶媒A:水+0.1% TFA。溶媒B:MeCN+0.1% TFA。勾配:4.0分で95%のA→2%のA
HPLC-条件2:カラム:Waters Xterra MS. C18. 4.6×50mm, 3.5μm
カラム温度(℃):40.0
流速:1ml/分
溶媒A:水+0.1% TFA。溶媒B:MeCN+0.1% TFA。
勾配:5.1分で95%のA→2%のA
HPLC-条件3:カラム:Waters Xterra MS, C18, 2.1×50mm, 3.5μm
カラム温度(℃):25.0
流速:0.4ml/分
溶媒A:水+0.1% TFA。溶媒B:MeCN+0.1% TFA。
勾配:5.1分で95%のA→2%のA
HPLC-条件4:カラム:Varian Microsorb 100, C18, 4.6×50mm, 3.0μm
カラム温度(℃):25.0
流速:1.0ml/分
溶媒A:水+0.1% TFA。溶媒B:MeCN+0.1% TFA。
勾配:4.5分で95%のA→2%のA
HPLC-条件5:カラム:Varian Microsorb, C18, 21.2×250mm, 8.0μm
カラム温度(℃):25.0
流速:20.0ml/分
溶媒A:水+0.1% TFA。溶媒B:MeCN+0.1% TFA。
勾配:20.0分で90%のA→50%のA
HPLC-条件6:カラム:Waters Xterra MS, C18, 4.6×30mm, 2.5μm
カラム温度(℃):25.0
流速:1.0ml/分
溶媒A:水+0.1% TFA。溶媒B:MeCN+0.1% TFA。
勾配:4.4分で95%のA→2%のA
【0083】
実施例1:
【0084】
【化33】

【0085】
[3-((エチル-Fmoc-アミノ)-メチル)-1-インドール-イル]アセチルAM樹脂(277mg,0.2mmol)(Novabiochem)を用いて標準的な固相ペプチド合成によって本化合物を合成した。
DMF中30%のピペリジンによる2及び20分の処理でFmoc-脱保護を行った。溶媒としてDMF中で16時間、HATU(5当量)、HOBt(5当量)、Dipea(5当量)及びFmoc-保護アミノ酸(5当量)で第1アミノ酸のカップリングを行った。第1アミノ酸のカップリングを1回繰り返した。カップリング試薬としてTBTU(5当量)、HOBt(5当量)、Dipea(15当量)及びアミノ酸(5当量)で溶媒としてDMFを用いて他のアミノ酸のカップリングを行った。
Fmoc-2-アミノ酪酸のカップリングとFmoc-脱保護後、調製したてのFmoc-ロイシナール(3.5当量)とNaCNBH3(10.5当量)(DMF/HOAc(99:1,2ml)中)で16時間還元的にアミノ基をアルキル化した。アルキル化後、樹脂を慎重にDMF/HOAc(99:1)、DMF、5% Dipea(DMF中)及びDMFで洗浄した。生じた二級アミノ基をDMF中で16時間Boc2O(10当量)及びDipea(10当量)との反応で保護した。
次のFmoc-アミノ酸を前述したようなペプチド鎖が完成するまでカップリングした。溶媒としてDMF中、4-ニコチン酸N-オキシド(5当量)、TBTU(5当量)、HOBt(5当量)、Dipea(15当量)で末端のアセチル化を行った。
TFA/水(95:5)で1時間処理して樹脂からの切断を達成した。このTFA溶液を減圧下でエバポレートし、ジエチルエーテルを加えてペプチドを沈殿させた。沈殿物をアセトニトリル/水に溶かし、分取用逆相HPLCで精製した。精製生成物を凍結乾燥した。収量90mg(59%)。
生成物を分析用HPLC-MSとNMRで分析した。分析データは構造と一致した。実測値[M+H]+ 625.4;RT=4.58分(HPLC-条件3)。
実施例番号1.1〜1.25を同様に合成した。分析データは構造と一致した。
【0086】
【化34】

【0087】
【化35】

【0088】
【化36】

【0089】
【化37】

【0090】
実施例2:
【0091】
【化38】

【0092】
3-(ホルミルインドリル)アセトアミドメチルポリスチレン樹脂(100mg,0.11mmol)(Merckbiosciences)を用いて標準的固相ペプチド合成で本化合物を合成した。
第1の還元的アルキル化のため、樹脂を1,2-ジクロロエタン/TMOF(2:1)で洗浄してから1,2-ジクロロエタン/TMOF 1:1(1ml)中のシクロヘキシルメチルアミン(10当量)の溶液と反応させた。5分後、固体Na(OAc)3BH(10当量)と1,2-ジクロロエタン/TMOF 2:1(1ml)を加え、該懸濁液を室温で一晩振とうさせた。樹脂を慎重にDMF、MeOH、THF及びDCMで洗浄した。
DMF中30%のピペリジンによる2及び20分の処理でFmoc-脱保護を行った。次に、樹脂を慎重にDMFで洗浄した。溶媒としてDMF中で一晩、TBTU(5当量)、HOBt(5当量)、Dipea(10当量)及びFmoc-保護アミノ酸(5当量)でアミノ酸のカップリングを行った。
第1アミノ酸のカップリングとFmoc-脱保護後、Fmoc-ロイシナール(3.5当量)とNaCNBH3(10.5当量)(DMF/HOAc(99:1,2ml)中)で2.25時間アミノ基を還元的にアルキル化した。アルキル化後、樹脂を慎重にDMF/HOAc(99:1)、DMF、5% Dipea(DMF中)及びDMFで洗浄した。結果の二級アミノ基をDMF中で16時間Boc2O(10当量)及びDipea(10当量)との反応によって保護した。
次のFmoc-アミノ酸とN-末端カルボン酸を上述したようなペプチド鎖が完成するまでカップリングした。
TFA/DCM(5:95)で2時間処理して樹脂からの切断を行った。溶液をエバポレートし、TFA/水(95:5)で1時間処理した。このTFA溶液を減圧下でエバポレートし、ジエチルエーテルを加えてペプチドを沈殿させた。沈殿物をアセトニトリル/水に溶かして逆相HPLCで精製した。精製生成物を凍結乾燥した。
生成物を分析用HPLC-MSとNMRで分析した。分析データは構造と一致した。実測値[M+H]+ 610.6;RT=4.26分(HPLC-条件2)。
実施例2.1〜2.13を同様に合成した。分析データは構造と一致した。
【0093】
【化39】

【0094】
【化40】

【0095】
実施例3:
【0096】
【化41】

【0097】
a)3-aの調製:
【0098】
【化42】

【0099】
5.0g(18.8mmol)の(S)-2-tert-ブトキシカルボニルアミノ-3-フェニル-プロピオン酸、3.4g(18.8mmol)の(S)-2-アミノ-プロピオン酸-tert-ブチルエステル-ハイドロクロライド及び6.8ml(37.7mmol)のDIPEAを20mlのTHFに溶かした。6.1g(18.8mmol)のTBTUと2.6g(18.8mmol)のHOBtを加えた。反応混合物を室温で4時間撹拌し、NaHCO3溶液で希釈し、酢酸エチルで抽出した。混ぜ合わせた有機相を濃縮し、残留物をフラッシュクロマトグラフィー(シリカゲル,ジクロロメタン/エタノール 98:2)で精製して5.8g(78%)の3-aを得た。
ES-MS(M+H)+=393
RT(HPLC-条件6)= 3.42分
b) 3-bの調製:
【0100】
【化43】

【0101】
2.9g(7.4mmol)の3-aを10mlのTHFに溶かし、氷冷下で14.8ml(29.6mmol)の2Nのホウ素-ジメチルスルフィド-複合体を加えた。混合物を室温で一晩撹拌し、氷冷下、メタノールで慎重に希釈した。反応をNaHCO3溶液と酢酸エチルで抽出し、混ぜ合わせた有機相を乾燥させ、濃縮し、残留物をクロマトグラフィー(Flashmaster, 50gカラム,ジクロロメタン/エタノール 100:0→95:5)で精製して1.9g(68%)の3-bを得た。
c) 3-cの調製:
【0102】
【化44】

【0103】
10mlの酢酸エチル中の2.9g(4.6mmol)の3-bを535μlの4N HCl(1,4-ジオキサン中)で処理し、室温で6時間撹拌した。混合物を濃縮して定量的な3-cを得た。
RT(HPLC-条件6)= 2.13分
d) 3-dの調製:
【0104】
【化45】

【0105】
5mlのメタノール中の850mg(2.2mmol)の(S)-2-{(S)-4,4-ジメチル-2-[(1-オキシ-ピリジン-4-カルボニル)-アミノ]-ペンタノイルアミノ}-ペンタン酸メチルエステルを5ml(25.0mmol)の5N LiOHで処理し、室温で一晩撹拌した。反応を濃縮し、4N HClで酸性にし、メタノール/ジクロロメタンの混合物で抽出した。混合有機相を乾燥させ、濃縮して700mg(86%)の3-dを得た。
ES-MS(M+H)+=366
e) 3-eの調製:
【0106】
【化46】

【0107】
3-aの調製と同様に、150mg(0.54mmol)の3-cと197mg(0.54mmol)の3-dから245mg(73%)の3-eを得た。
RT(HPLC-条件6)=2.76分
f) 3-fの調製:
【0108】
【化47】

【0109】
5mlのジクロロメタン中の580mg(0.9mmol)の3-eを500μl(6.5mmol)のTFAで処理し、50℃で5時間撹拌した。混合物を濃縮し、残留物をクロマトグラフィー(Flashmaster, 20gカラム,ジクロロメタン/エタノール 100:0→95:5)で精製して580mg(88%)の3-fを得た。
ES-MS(M+H)+=570
RT(HPLC-条件6)= 2.35分
g) 3-gの調製:
【0110】
【化48】

【0111】
3-aの調製と同様に、75mg(0.13mmol)の3-fと15μl(0.13mmol)の4-アミノメチル-フェニルアミンから14mg(16%)の3-gを得た。
ES-MS(M+H)+=674
RT(HPLC-条件6)=2.28分
3-gの調製と同様に、3-fと相当量のアミンを用いて追従実施例を調製した。
【0112】
【化49】

【0113】
【化50】

【0114】
実施例4:
【0115】
【化51】

【0116】
a) 4-aの調製:
【0117】
【化52】

【0118】
3-aの調製と同様に、100mg(0.18mmol)の3-fと29μl(0.18mmol)の4-アミノメチル-安息香酸メチルエステルから46.0mg(37%)の4-aを得た。
ES-MS(M+H)+=717
RT(HPLC-条件6)=2.66分
b) 4-bの調製:
【0119】
【化53】

【0120】
2mlのメタノール中の36mg(0.05mmol)の4-aを300μl(1.0mmol)の8% LiOHで処理し、室温で一晩撹拌した。混合物を4N HClで酸性にし、酢酸エチルで抽出し、乾燥させ、濃縮して13mg(37%)の4-bを得た。
ES-MS(M+H)+=703
RT(HPLC-条件4)=4.05分
実施例5:
【0121】
【化54】

【0122】
a) 5-aの調製:
【0123】
【化55】

【0124】
50mlの酢酸エチル中の1.9g(9.4mmol)の(R)-1-(4-ニトロ-フェニル)-エチルアミン-ハイドロクロライドを7.4g(32.8mmol)の塩化スズ(II)-二水和物で処理し、室温で一晩撹拌した。混合物をNH3で塩基性にしてろ過した。ろ液を水で抽出し、有機相を乾燥させ、濃縮して794mg(62%)の5-aを得た。
ES-MS(M+H)+=136
RT(HPLC-条件6)=1.37分
b) 5-bの調製:
【0125】
【化56】

【0126】
3-aの調製と同様に、125mg(0.18mmol)の3-fと24mg(0.18mmol)の5-aから4.0mg(3%)の5-bを得た。
ES-MS(M+H)+=688
RT(HPLC-条件6)=2.37分
実施例6:
【0127】
【化57】

【0128】
a) 6-aの調製:
【0129】
【化58】

【0130】
1.0g(4.5mmol)の(4-アミノ-ベンジル)-カルバミン酸-tert-ブチルエステルを30mlのジクロロメタンに溶かして363ml(4.5mmol)のピリジンを加えた。混合物を0℃に冷却して352μl(4.5mmol)の塩化メタンスルホニルをゆっくり添加した。反応を室温で一晩撹拌し、ろ過し、ろ液を濃縮した。残留物をクロマトグラフィー(Flashmaster, 20gカラム,シクロヘキサン/酢酸エチル 50:50→100:0)で精製して640mg(47%)の6-aを得た。
RT(HPLC-条件6)=2.71分
b) 6-bの調製:
【0131】
【化59】

【0132】
640mg(2.1mmol)の6-aをジクロロメタン/TFAの1:1混合物で処理し、混合物を室温で一晩撹拌し、濃縮して定量的に6-bを得た。
ES-MS(M+H)+=201
c) 6-cの調製:
【0133】
【化60】

【0134】
3-aの調製と同様に、100mg(0.18mmol)の3-fと42mg(0.18mmol)の6-bから29.0mg(22%)の6-cを得た。
ES-MS(M+H)+=752
RT(HPLC-条件6)=2.47分
実施例7:
【0135】
【化61】

【0136】
a) 7-aの調製:
【0137】
【化62】

【0138】
25mlのDMF中の6.0g(42.1mmol)の4-クロロ-ベンゼン-1,2-ジアミンと4.9ml(44.4mmol)の4-メチルモルフォリンの溶液に25mlのDMF中の4.5g(20.1mmol)のL-アラニンtert-ブチルエステル-ハイドロクロライドと3.6g(22.2mmol)のCDIの混合物を加えた。反応を室温で一晩撹拌し、濃縮し、ジクロロメタンと水で希釈した。不溶性固体をろ過し、ろ液のニ相を分離し、水相をジクロロメタンで2回抽出した。混ぜ合わせた有機相を乾燥させ、濃縮した。残留物をフラッシュカラム(シリカゲル,ジクロロメタン/エタノール 100:0→95:5)で精製して6.0g(86%)の褐色結晶7-aを得た。
ES(-)-MS(M-H)-=346/348 (クロロアイソトープ)
RF=0.35(シリカゲル,ジクロロメタン/エタノール 19:1)
b) 7-bの調製:
【0139】
【化63】

【0140】
6.0g(17.3mmol)の7-aを30mlの酢酸で処理し、室温で一晩撹拌した。混合物を濃縮し、残留物をフラッシュカラム(シリカゲル,ジクロロメタン/エタノール 100:0→98:2)で精製して5.0g(88%)の褐色結晶7-bを得た。
ES-MS (M+H)+ =330/332(クロロアイソトープ)
RF=0.40(シリカゲル,ジクロロメタン/エタノール 19:1)
c) 7-cの調製:
【0141】
【化64】

【0142】
5.0g(15.2mmol)の7-bを100mlのメタノールに溶かし、40mlのジクロロメタンと1.0gのPd/C(10%)を加えた。Parr装置内、室温及び3.4×105Pa(50psi)の水素圧で1時間混合物を水素化した。結晶をろ別し、ろ液を濃縮し、残留物をフラッシュカラム(シリカゲル,ジクロロメタン/エタノール/NH3 95:5:0.2)で精製して1.1g(36%)の黄色油7-cを得た。
ES-MS(M+H)+=196/198(クロロアイソトープ)
RF=0.37(シリカゲル,ジクロロメタン/エタノール/NH3 4:1:0.2)
d) 7-dの調製:
【0143】
【化65】

【0144】
3-aの調製と同様に、100mg(0.18mmol)の3-fと28mg(0.18mmol)の7-cから29.0mg(22%)の7-dを得た。
ES-MS(M+H)+=713
RT(HPLC-条件6)=2.58分
【0145】
実施例8:
【0146】
【化66】

【0147】
a) 8-aの調製:
【0148】
【化67】

【0149】
25.0g(0.2mol)の4-ホルミル-ベンゾニトリルを150mlのメタノールに溶かし、2gPd/C(10%)を加えた。Parr装置内、室温及び3.4×105Pa(50psi)の水素圧で7時間混合物を水素化した。結晶をろ別し、ろ液を濃縮し、ジエチルエーテルを添加して22.3g(87%)の8-aを結晶させた。
ES-MS(M+H)+=138
b) 8-bの調製:
【0150】
【化68】

【0151】
3-aの調製と同様に、100mg(0.18mmol)の3-fと24.1mg(0.18mmol)の8-aから36.0mg(21%)の8-bを得た。
ES-MS(M+H)+=689
RT(HPLC-条件6)=2.45分
【0152】
実施例9:
【0153】
【化69】

【0154】
a) 9-aの調製:
【0155】
【化70】

【0156】
3-aの調製と同様に、10.0g(49.2mmol)の(S)-2-tert-ブトキシカルボニルアミノ-酪酸と24.7ml(49.5mmol)のエチルアミンから定量的に9-aを得た。
ES-MS(M+H)+=231
RT(HPLC-条件4)=2.80分
b) 9-bの調製:
【0157】
【化71】

【0158】
11.3g(49.1mmol)の2-aを1,4-ジオキサン中25ml(100mmol)の4N HClで処理し、室温で一晩撹拌した。反応を濃縮して定量的に9-bを得た。
ES-MS(M+H)+=131
RT(HPLC-条件6)=2.38分
c) 2-cの調製:
【0159】
【化72】

【0160】
150mlのジクロロメタン中の3.0g(18.0mmol)の9-bと2.4g(19.0mmol)のDIPEAを室温で15分撹拌してから4.5g(18.0mmol)の((S)-1-ベンジル-2-オキソ-エチル)-カルバミン酸-tert-ブチルエステルを加え、混合物を0℃に冷却した。その後、3.0ml(50.0mmol)の酢酸と7.6g(36.0mmol)のナトリウムトリアセトキシボロヒドリドを加え、反応を室温で一晩撹拌した。混合物をNaHCO3溶液で希釈し、酢酸エチルで抽出した。有機相を濃縮して定量的に2-cを得た。
ES-MS(M+H)+=264
RT(HPLC-条件6)=1.91分
d) 9-dの調製:
【0161】
【化73】

【0162】
9-bの調製と同様に、2.0g(5.5mmol)の2-cから定量的に9-dを得た。
RT(HPLC-条件6)=1.91分
e) 9-eの調製:
【0163】
【化74】

【0164】
3-aの調製と同様に、100.0mg(0.27mmol)の3-dと82.5mg(0.27mmol)の9-dから17.0mg(10%)の9-eを得た。
ES-MS(M+H)+=611
RT(HPLC-条件5)=18.8分
【0165】
〔実施例A〕
医薬製剤の例:
a) 錠剤 1錠当たり
活性物質(実施例1) 50mg
ラクトース 170mg
トウモロコシデンプン 260mg
ポリビニルピロリドン 15mg
ステアリン酸マグネシウム 5mg
500mg
微細に粉砕した活性物質、ラクトース及び一部のトウモロコシデンプンを一緒に混合する。混合物を篩ってからポリビニルピロリドンの水溶液で湿らせ、混練し、湿式造粒して乾燥させる。この顆粒、残りのトウモロコシデンプン及びステアリン酸マグネシウムを篩って一緒に混合する。混合物を圧縮して適切な形状と大きさの錠剤を生成する。
【0166】
b) 錠剤 1錠当たり
活性物質(実施例1) 40mg
トウモロコシデンプン 210mg
ラクトース 65mg
微結晶性セルロース 40mg
ポリビニルピロリドン 20mg
ナトリウム-カルボキシメチルデンプン 23mg
ステアリン酸マグネシウム 2mg
400mg
微細に粉砕した活性物質、一部のトウモロコシデンプン、ラクトース、微結晶性セルロース及びポリビニルピロリドンを一緒に混合し、混合物を篩い、残りのトウモロコシデンプン及び水とこねて顆粒を形成し、乾燥させて篩う。ナトリウム−カルボキシメチルデンプンとステアリン酸マグネシウムを加えて混ぜ合わせ、混合物を圧縮して適切な大きさの錠剤を形成する。
【0167】
c) コーティング錠 1コーティング錠当たり
活性物質(実施例1) 5mg
トウモロコシデンプン 41.5mg
ラクトース 30mg
ポリビニルピロリドン 3mg
ステアリン酸マグネシウム 0.5mg
80mg
活性物質、トウモロコシデンプン、ラクトース及びポリビニルピロリドンを完全に混ぜ合わせて水で湿らせる。この湿練薬をメッシュサイズ1mmの篩いに押し通し、約45℃で乾燥させてから該顆粒を同じ篩いに通す。ステアリン酸マグネシウムを混ぜ入れた後、錠剤製造機で直径6mmの凸状の錠剤コアを打錠する。このようにして得た錠剤コアを公知の様式で本質的に糖とタルクから成る被覆材にてコーティングする。完成コーティング錠をワックスで磨く。
【0168】
d) カプセル剤 1カプセル剤当たり
活性物質(実施例1) 25mg
トウモロコシデンプン 283.5mg
ステアリン酸マグネシウム 1.5mg
310mg
活性物質とトウモロコシデンプンを混合し、水で湿らせる。この湿練薬を篩って乾燥させる。乾燥顆粒を篩い、ステアリン酸マグネシウムと混合する。完成混合物を1号サイズのゼラチンカプセルに詰める。
【0169】
e) アンプル溶液
活性物質(実施例1) 0.5mg
塩化ナトリウム 50mg
注射用水 5ml
活性物質をそれ自体のpH又は任意に5.5〜6.5のpHにて水に溶かし、塩化ナトリウムを加えて等張にする。得られた溶液を熱源なしでろ過し、ろ液を無菌条件下でアンプル中に移してから滅菌し、溶融封止する。アンプルは0.5mg、2.5mg及び5.0mgの活性物質を含む。
【0170】
f) 座剤
活性物質(実施例2) 30mg
固形脂肪 1670mg
1700mg
固形脂肪を融かす。粉砕した活性物質を40℃で均一に分散させる。これを38℃に冷却し、わずかに冷却した座剤型に注ぐ。
【0171】
本明細書では、用語“治療”は、本発明の化合物を疾患の少なくとも暫定診断でヒトに使用できることを意味する。本発明の化合物は、疾患の進行を遅延又は減速することによって、より有益な寿命を個体に与えるだろう。
用語“予防”は、投与時点ではおそらく疾患を有していると診断されていないが、一般的に該疾患を発症すると予測されるか又は該疾患のリスクが高いであろう患者に本発明の化合物を投与すると有用であることを意味する。本発明の化合物は、症状の発生を減速し、疾患の発症を遅延し、又は個体が該疾患を発症するのを多少なりとも予防するだろう。
予防は、年齢、家族歴、遺伝子若しくは染色体の異常のため、及び/又は該疾患の1若しくは2以上の生物学的マーカー、例えば脳組織若しくは脳液内におけるAPP若しくはAPP分解産物の既知の遺伝子突然変異の存在のため該疾患の素因があると考えられる当該個体への本発明の化合物の投与をも包含する。
本発明の化合物は治療的に有効な量で投与される。治療的に有効な量は、当業者には分かるように、使用する個々の化合物及び投与経路によって変わるだろう。
本発明の化合物を経口、非経口(IV、IM、デポ-IM、SQ、及びデポ-SQ)、舌下、鼻腔内、吸入で、くも膜下腔内、局所、又は直腸に投与することができる。当業者に既知の剤形が本発明の送達に適する。
治療的に有効な量の本発明の化合物を含む組成物が提供される。本化合物は、好ましくは経口投与用の錠剤、カプセル剤、若しくはエリキシル剤、又は非経口投与用の無菌溶液若しくは懸濁液、又は吸入投与用のエアロゾル等の適切な医薬製剤に調合される。典型的に、当業者に周知の技術と手順を用いて上記化合物を医薬組成物に調合される。
約1〜500mgの本発明の化合物若しくはその混合物又はその医薬的に許容しうる塩を、医薬的に許容しうるビヒクル、担体、賦形剤、結合剤、保存剤、安定剤、香料などと混ぜて、一般に認められている製薬プラクティスで必要とされる単位剤形にする。当該組成物又は製剤中の活性物質の量は、指示した範囲の適切な用量が得られるような量である。組成物は、好ましくは単位剤形で調合され、各用量は、約2〜約100mg、さらに好ましくは約10〜30mgの活性成分を含む。用語“単位剤形”は、ヒト対象及び他の動物の単位用量として好適な物理的に別個の単位を意味し、各単位は、所望の治療効果をもたらすように計算した所定量の活性物質を適切な医薬賦形剤と共に含有する。
本明細書で提供する化合物の投与に好適な医薬担体又はビヒクルには、当業者が個々の投与様式に適切であると分かっているいずれの担体も含まれる。さらに、活性物質を、所望作用を損なわない他の活性物質、或いは所望作用を補助し、又は別の作用を有する物質と混合することもできる。
組成物中に単独の医薬的活性物質として本化合物を調合してよく、或いは1又は2以上の異なる活性成分と併用してもよい。
化合物の濃度は、投与すると、該化合物を投与する目的の障害の少なくとも1つの症状を軽減又は改善する量の送達に有効な濃度である。典型的に、組成物は単用量投与用に調合される。
【0172】
本発明の化合物及び組成物を多用量容器又は単用量容器に封入することができる。本発明の化合物及び組成物をキット、例えば使用するために組み立てられる構成部品を含むキットで提供することができる。例えば、凍結乾燥形態の化合物インヒビターと、適切な希釈剤を使用前に組み合わせるように別個の構成要素として提供しうる。キットが化合物インヒビターと同時投与用の第二治療薬とを含むことができる。インヒビターと第二治療薬を別個の構成部品として提供してもよい。キットが複数の容器を含んでよく、各容器は、1又は2以上の単位用量の本発明の化合物を保持する。容器は、好ましくは所望の投与態様に適合させる。投与態様として、限定するものではないが、経口投与用の錠剤、ゲルカプセル剤、徐放カプセル剤等;非経口投与用のデポ製品、予充填注射器、アンプル、バイアル等;並びに局所投与用のパッチ、メディパッド(medipad)、クリーム等、及び吸入投与用の任意に予充填された吸入器が挙げられる。
医薬製剤中の活性化合物の濃度は、該活性化合物の吸収、不活性化、及び排泄、投与計画、並びに投与量のみならず当業者に周知の他の因子によって決まるだろう。
さらに、いずれかの個々の対象について、個体の必要性及び該組成物の投与を管理又は監督する人の専門的判断に従って経時的に特有の投与法を調整しなければならないこと、及び本明細書で述べた濃度範囲は単に例示であり、請求項の組成物の範囲又はプラクティスを限定する意図でないことを理解すべきである。
【0173】
経口投与が望ましい場合、胃の酸性環境から本化合物を保護する組成物で本化合物を提供すべきである。例えば、胃内でその統合性を維持し、腸内で活性化合物を放出する腸溶性コーティング剤中で組成物を調合することができる。抗酸又は他のこのような成分と組み合わせて組成物を調合してもよい。
経口用組成物は、一般的に不活性希釈剤又は食用担体を含み、圧縮して錠剤とし、又はゼラチンカプセルに封入される。経口治療的投与の目的では、活性化合物を賦形剤と共に組み入れて、錠剤、カプセル剤、ロゼンジ剤又はトローチ剤の形態で使用できる。
組成物の一部として医薬的に適合しうる結合剤及びアジュバント材を含めることができる。
錠剤、丸剤、カプセル剤、トローチ剤などは、以下のいずれの成分又は同じ性質の化合物をも含有しうる:限定するものではないが、トラガカントゴム、アカシアゴム、トウモロコシデンプン、又はゼラチン等の結合剤;微結晶性セルロース、デンプン、又はラクトース等の賦形剤;限定するものではないが、アルギニン酸及びトウモロコシデンプン等の崩壊剤;限定するものではないが、ステアリン酸マグネシウム等の潤沢剤;限定するものではないが、コロイド二酸化ケイ素などのギルダント(gildant);スクロース又はサッカリン等の甘味料;及びペパーミント、サリチル酸メチル、又は果実香味料などの調味料。
単位剤形がカプセル剤の場合、それは上記タイプの材料に加え、脂肪油などの液状担体を含むことができる。さらに、単位剤形は、その単位剤形の物理的形態を改変する種々の他の材料、例えば、糖及び他の腸溶性物質のコーティング剤を含むことができる。本化合物をエリキシル剤、懸濁剤、シロップ剤、ウェハース、チューインガム等の成分として投与することもできる。シロップ剤は、活性化合物に加え、甘味料としてのスクロース、並びに特定の保存剤、色素や着色剤、及び香料を含んでよい。
活性材料を、所望作用を損なわない他の活性材料、又は所望作用を補充する材料と混合することもできる。
このような製剤の調製方法は当業者に周知である。
【0174】
経口剤形は、1日に1、2、3、又は4回患者に投与される。1日3回以下、さらに好ましくは1日に1回又は2回本発明の化合物を投与することが好ましい。従って、経口剤形で本発明の化合物を投与することが好ましい。どんな経口剤形であっても、本発明の化合物を胃の酸性環境から保護するように設計することが好ましい。腸溶性コーティング錠は当業者に周知である。さらに、それぞれ酸性の胃から保護するためにコーティングした小球を充填したカプセル剤も当業者に周知である。
経口投与する場合、β-セクレターゼ活性を阻害するため、Aβ生産を阻害するため、Aβ沈着を阻害するため、又はADを治療若しくは予防するために治療的に有効な投与量は、約0.1mg/日〜約1,000mg/日である。好ましくは経口用量は約1mg/日〜約100mg/日である。さらに好ましくは経口用量は約5mg/日〜約50mg/日である。患者は、ある用量で開始しうるが、その用量は患者の状態と共に経時的に変化しうることが分かる。
【0175】
ここで、本発明は本発明の新規化合物及び本発明の化合物の新規使用方法である。本発明の特定化合物と所望剤形を考慮すれば、当業者は、その適切な剤形を調製かつ投与する方法が分かるだろう。
本発明の化合物は、上述したのと同じ様式で、同じ投与経路により、同じ医薬剤形を用いて、かつ同じ投与計画で、MCI(軽度認知障害)の疾患を予防するか又は該患者を治療するため及びMCIからADに進行するであろう当該患者におけるアルツハイマー病の発症を予防又は遅延するため、ダウン症候群を治療又は予防するため、オランダ型アミロイド症のある遺伝性脳溢血を有するヒトを治療するため、脳アミロイド血管症を治療し、その潜在的結果、すなわち単回及び反復性皮質下出血を予防するため、血管と変性の入り混じった原因の痴呆症、パーキンソン病関連痴呆症、進行性核上麻痺関連痴呆症、皮質基底変性関連痴呆症、及びびまん性レビー小体型ADといった他の変性痴呆症を治療するために使用される。
本発明の化合物を相互に併用し、或いは上記状態を治療又は予防するために使用される他の治療薬又はアプローチと併用することができる。このような薬剤又はアプローチとして、β-セクレターゼインヒビター;γ-セクレターゼインヒビター;アミロイド凝集インヒビター(例えば、アルゼメド(Alzhemed));直接又は間接的に作用する神経保護化合物;抗-酸化剤、例えばビタミンE及びギンコリド;抗-炎症薬、例えばCox-インヒビター又はNSAIDs;HMG-CoAレダクターゼインヒビター(スタチン);アセチルコリン-エステラーゼインヒビター、例えばドネペジル、リバスチグミン、タクリン、ガランタミン;NMDA受容体アンタゴニスト(例えばメマンチン);AMPAアゴニスト;神経伝達物質の放出又は濃度を調節する化合物(例えばNS-2330);成長ホルモンの放出を誘導する化合物(例えばイブタモレンメシラート(ibutamoren mesylate)及びカプロモレリン(capromorelin));CB-1受容体アンタゴニスト又はインバースアゴニスト;ミノサイクリン又はリファンピシンのような抗生物質;PDE-IV及びPDE-IXインヒビター;GABAAインバースアゴニスト;ニコチンアゴニスト;ヒスタミンH3アンタゴニスト、5HT-4アゴニスト又は部分アゴニスト;5HT-6アンタゴニスト;a2-アドレノレセプターアンタゴニスト;ムスカリン性M1アゴニスト;ムスカリン性M2アンタゴニスト;代謝調節型グルタミン酸-受容体5ポジティブモジュレーター;及び本発明の化合物の効力及び/又は安全性が上昇するか又は副作用が低減するように、受容体又は酵素を調節する化合物が挙げられる。
1又は2以上の本発明の化合物と、アルゼメド、ビタミンE、ギンコリド、ドネペジル、リバスチグミン、タクリン、ガランタミン、メマンチン、NS-2330、イブタモレンメシラート、カプロモレリン、ミノサイクリン及びリファンピシンから成る群より選択される1又は2以上の追加活性成分とを含む、該組合せが好ましい。
本発明の組合せでは、本発明の化合物と上記組合せ相手を別々(例えば、キットの部品)に投与してよく、或いは一緒に1つの医薬組成物(例えばカプセル剤又は錠剤)で投与してもよい。さらに、本発明の組合せの一要素の投与は該組合せの他要素の投与の前、投与と同時、又は投与後でよい。本発明の化合物とその1又は2以上の追加活性成分が別個の製剤中に存在する場合、これら別個の製剤を同時又は逐次的に投与してよい。
上記疾患及び状態の治療又は予防のため、本発明の化合物を免疫学的アプローチ、例えば、Aβペプチド若しくはその誘導体による免疫化又は抗-Aβペプチド抗体の投与などと併用することができる。
【0176】
当業者には、この技術に熟練した投薬医師に周知なように、投与の正確な用量と頻度は、投与される本発明の個々の化合物、治療される個々の状態、治療される状態の重症度、個々の患者の年齢、体重、全身の健康状態、及び該個体が取ってよい他の医薬によって決まることが明白だろう。
上記組合せ相手の用量範囲は、それぞれ該化合物を単独で使用したときに所望の治療効果を引き起こすために必要な臨床的に有効な量の約1/5〜1倍である。
従って、本発明のさらなる目的は、本発明の化合物の、β-セクレターゼの阻害によって改変できる疾患及び状態の治療又は予防用医薬の製造のため少なくとも1種の追加活性成分と組み合わせた使用に関する。
本発明のさらなる目的は、本発明の化合物と、少なくとも1種の追加活性成分とを含んでなる医薬である。
本発明の化合物は、APP695イソ型、若しくはその変異体に数えられるMet595とAsp596との間のAPP、又はAPP751若しくはAPP770のような異なるイソ型、又はその変異体の対応部位(“βセクレターゼ部位”と呼ばれることもある)における切断を阻害する。特定の理論に拘泥されたくないが、β-セクレターゼ活性の阻害がβアミロイドペプチド(Aβ)の生産を阻害すると考えられる。阻害活性は、β-セクレターゼ酵素の存在下でのAPP基質の切断を、該阻害化合物の存在下、β-セクレターゼ切断部位での切断を引き起こすのに一般的に十分な条件下で分析する種々の阻害アッセイの1つで実証される。未処理又は不活性コントロールと比較したβ-セクレターゼ切断部位におけるAPP切断の減少が阻害活性と関係する。本発明の化合物インヒビターの効力を実証するために使用しうるアッセイシステムは既知である。代表的なアッセイシステムは例えば米国特許第5,942,400号、第5,744,346号、及び以下の実施例に記載されている。
天然、変異及び/又は合成APP基質と、天然、変異、及び/又は合成酵素と、試験化合物とを用いて、β-セクレターゼの酵素活性とAβの生産をin vitro又はin vivo分析することができる。この分析は、天然、変異、及び/又は合成APPと酵素を発現する一次又は二次細胞、天然のAPPと酵素を発現する動物モデルを含むことができ、或いは該基質と酵素を発現するトランスジェニック動物モデル及び非トランスジェニック動物モデルを利用することもできる。酵素活性の検出は、例えば、イムノアッセイ、蛍光定量的若しくは色素生産性アッセイ、HPLC、又は他の検出手段による1又は2以上の切断産物の分析によってでよい。阻害化合物の非存在下で反応系内のβ-セクレターゼ媒介切断が観察かつ測定されるコントロールに比し、生産されるβ-セクレターゼ切断産物の量を減らす能力を有する化合物として阻害化合物を定量する。
種々の形態のβ-セクレターゼ酵素が知られており、酵素活性及び酵素活性の阻害のアッセイに有効かつ有用である。これには酵素の天然、組換え、及び合成形態が含まれる。ヒトβ-セクレターゼはβ部位APP切断酵素(Beta Site APP Cleaving Enzyme)(BACE)、Asp2、及びメマプシン2として知られ、例えば、米国特許第5,744,346号及び公開PCT特許出願W098/22597、WO00/03819、WO01/23533、及びWO00/17369、並びに発行文献(Hussain et. al., 1999, Mol. Cell. Neurosci. 14: 419-427; Vassar et. al., 1999, Science 286 : 735-741; Yan et. al., 1999, Nature 402: 533-537; Sinha et. al., 1999, Nature40: 537-540;及びLin et. al., 2000, PNAS USA 97 : 1456-1460)で特徴づけられている。該酵素の合成形も開示されている(W098/22597及びWO00/17369)。ヒト脳組織からβ-セクレターゼを抽出かつ精製することができ、また、細胞、例えば、組換え酵素を発現する哺乳動物細胞内で生産することができる。
【0177】
〔BACEのin vitro活性の定量〕
種々のアッセイ技術でBACEの活性を分析できるが、すべて適切な緩衝液内で、触媒的に活性な形態のBACEを可能性のある基質とインキュベートする。基質の性質によって決まる種々の方法を適用して、基質濃度の低減又は産物濃度の上昇をモニターできる。この方法として、限定するものではないが、HPLC-MS分析、蛍光アッセイ、蛍光クエンチングアッセイが挙げられる。基質は、選択した検出システムに適した色素と接合しうるか又はタンパク質基質に伸長しうるBACEで加水分解できるアミノ酸を含有するペプチドでよい。酵素源として、全長BACE酵素のみならず、該タンパク質の触媒的に活性な外部ドメインも使用できる。試験化合物とBACE結合化合物の競合に基づいた代替アッセイ形式を使用できる。
IC50決定のため、アッセイでは種々濃度の化合物をインキュベートする。化合物を加えないコントロールウェルにおける酵素反応シグナルと比較して検出されるシグナルの50%減少を示した化合物の濃度を計算することによって相対的な化合物阻害効力を決定する。
有用な阻害化合物は、50μモル未満の濃度、好ましくは10μモル以下の濃度、さらに好ましくは1μモル以下、最も好ましくは10ナノモル以下の濃度でβ-セクレターゼ酵素活性の50%を阻害する効力がある。
本発明の化合物のin vitroのBACE阻害プロフィールを得るため、実施例で概要を述べるようなアッセイで本発明の化合物を試験することができる。
【0178】
実施例BACEアッセイ:
試験する各化合物について、酵素源として、myc-his標識に融合され、かつHEK293/APP/BACEect.細胞からOptiMETM(Invitrogen)中に分泌されたBACE(aa 1-454)の外部ドメインを用いて蛍光クエンチングアッセイでBACE活性をモニターする。使用する基質ペプチドは、アミノ酸配列SEVNLDAEFKを有し、かつN-末端にCy3-発蛍光団及びC-末端にCy5Q-クエンチャー(Amersham)を有する。この基質を1mg/mlでDMSOに溶かす。
96ウェルプレート内で、BACEの外部ドメインを含む10μlのOptiMEM、所望濃度の化合物と最大濃度1%のDMSOを含む100μlの水、1μMの基質ペプチド、及び20mMのNaOAcの存在下(pH 4.4、全アッセイ体積200μl)でアッセイを行う。蛍光光度計内で反応を30℃にてインキュベートし、基質の切断を30分間の動力学として記録する(ex:530nm、em:590nm)。
緩衝液の調製又は化合物の希釈に用いる水は最高純度の水である。インヒビター又は酵素を含まないブランクウェルが各プレートに含まれる。
実施例1〜58として例示した式(I)の化合物は20μモル濃度未満のIC50値を示す。
【0179】
〔Aβ分泌アッセイ〕
種々の起源の細胞系でAβの分泌をモニターすることができる。代表的セットの該細胞として、限定するものではないが、APP又はAPPの変異形(限定するものではないが、スウェーデン又はロンドン/インディアナ突然変異が挙げられる)で安定的又は一時的にトランスフェクトされた、ヒト胎児腎臓293細胞(HEK293)、チャイニーズハムスター卵巣細胞(CHO)、ヒトH4神経膠腫(neuroglimoa)細胞、ヒトU373-MG星細胞種神経膠芽腫(astrocytoma glioblastoma)細胞、マウス神経芽細胞腫N2a細胞が挙げられる。例えば、問題のヒトAPP cDNAを含有するpcDNA3プラスミド(Invitrogen)を、Lipofectamine(Invitrogen)のようなトランスフェクション試薬を用いて製造業者の説明書に従って導入することによって細胞のトランスフェクションを達成することができる。
遺伝子修飾せずに十分な量のAβを産生する細胞から、又は高感度のAβ検出アッセイを用いて、日常的な基礎に基づいてAβの分泌を分析することもできる。この種の分析に好適な細胞として、限定するものではないが、ヒトIMR-32神経芽細胞腫細胞が挙げられる。
例えばHsiaoら(Hsiao et al 1996 Science 274: 99-102)によって記載されているマウスのようなAPPトランスジェニックマウス由来の胎仔又は新生子孫から得られる脳誘導細胞からAβの分泌を分析することもできる。さらに、ラット又はモルモット等の他の生物由来の脳誘導細胞も使用しうる。
有用な阻害化合物は、これらの細胞アッセイにおいて50μモル未満の濃度、好ましくは10μモル以下の濃度、さらに好ましくは1μモル以下、最も好ましくは10ナノモル以下の濃度でβ-セクレターゼ酵素活性の50%を阻害する効力がある。
【0180】
〔実施例Aβ分泌アッセイ〕
以下、CMVプロモーターの制御下でAPP751を安定して発現するU373-MG細胞からのAβの定量の手順を与える。
DMEM+グルコース、ピルビン酸ナトリウム、グルタミン、ピリドキシン-HCl、及び10% FCSのような培養基内で細胞を維持することができる。細胞を5%のCO2の水飽和環境内37℃にてインキュベーター内で細胞を保持する。化合物をアッセイするため、コンフルエントな細胞層を50μM〜50pMの範囲の濃度の化合物(最初DMSOに溶かし、アッセイのために150μlの上記培養基で希釈)と12〜24時間インキュベートする。この時間中、化合物の存在下と非存在下のAβの生産をAβ40とAβ42に特異的なサンドイッチELISAでモニターする。抗体6E10(Senetek)及びSGY3160(C. Eckman, Mayo Clinic, Jacksonville, Florida)を捕獲抗体として用いてプレートに固定化する。Aβ含有細胞培養の上清を添加する前にBlock Ace(Serotec)で非特異的なタンパク質の結合を遮断する。Aβ40及びAβ42に特異的な検出抗体(Nanotools, Germany)を、基質CSPD/Sapphire II(Applied Biosystems)を用いて、製造業者の説明書に従って、活性が数量化されているアルカリ性ホスファターゼと結合させる。
非特異的毒性関連メカニズムによって誘導されるAβレベルの変化における該化合物の潜在的な効果は、60分後のAlamarBlue(Resazurin)の還元によって取り扱われる。
化合物を加えないコントロールウェルの細胞と比べて検出シグナルの50%の減少を示した化合物の濃度を計算することによって、無毒化合物の効力を決定する。
実施例1〜58として例示した式(I)の化合物は10μモル濃度未満のIC50値を示す。
上述したように、種々の動物モデルを用いてβ-セクレターゼ活性及び/又はAβを放出するためのAPPのプロセシングを分析することができる。例えば、APP基質とβ-セクレターゼ酵素を発現するトランスジェニック動物を用いて本発明の化合物の阻害活性を実証することができる。特定のトランスジェニック動物モデルは、例えば米国特許第5,877,399号;第5,612,486号;第5,387,742号;第5,720,936号;第5,850,003号;第5,877,015号;及び第5,811,633号並びにGames et. al., 1995, Nature 373: 523に開示されている。ADの病態生理学に関連する特徴を示す動物が好ましい。本明細書で述べた本発明の化合物インヒビターのトランスジェニックマウスへの投与は、本化合物の阻害活性を実証する代替法を提供する。医薬的に有効な担体中、かつ妥当な治療量で標的組織に到達する投与経路によって本化合物を投与することも好ましい。
【発明の詳細な説明】
【0001】
〔発明の背景〕
1.技術分野
本発明は、新規な置換エチレンジアミン並びにそのアルツハイマー病及び他の類似疾患の治療又は予防のための使用に関する。
【0002】
2.背景情報
アルツハイマー病(AD)は主に老化に関連する脳の進行性変性疾患である。ADの臨床症状は、記憶、認知、推理、判断、及び見当識の損失によって特徴づけられる。病気が進行するにつれ、運動、感覚、及び言語能力も影響を受け、複数の認知機能の全体的障害がもたらされる。これら認知喪失は徐々に起こるが、一般的に重度の障害をもたらし、最終的に4〜12年の範囲で死に至る。
アルツハイマー病は、脳内における以下の2つの主要な病因となる所見によって特徴づけられる:神経原線維濃縮体及びβアミロイド(又は神経突起)斑(主にAβとして知られるペプチドフラグメントの凝集体で構成される)。ADの個体は、特徴のあるβ-アミロイド沈着を脳内(βアミロイド斑)及び血管内(βアミロイド脈管障害)に示すと共に神経原線維濃縮体を示す。神経原線維濃縮体は、アルツハイマー病で生じるのみなあrず。他の痴呆誘導障害でも生じる。剖検では、多数のこれら病変は、通常、記憶と認知のために重要なヒト脳の領域内で見られる。
臨床的にADでない多くの高齢者の脳内では、より制限された解剖学的分布で少数のこれら病変が見られる。
アミロイド形成斑及び血管のアミロイド脈管障害は、三染色体性21(ダウン症候群)、オランダ型アミロイド症のある遺伝性脳溢血(HCHWA-D)、及び他の神経変性障害のある個体の脳をも特徴づける。β-アミロイドはADの決定的特徴であり、今や発症の原因となる前駆体又は因子であると考えられている。認知活動の原因である脳の領域内におけるAβの沈着がADの発症の主要因子である。β-アミロイド斑は主にアミロイドβペプチド(Aβ、βA4と称されることもある)で構成される。Aβペプチドは、アミロイド前駆体タンパク質(APP)のタンパク質分解によって誘導され、39〜42のアミノ酸で構成されている。いくつかのセクレターゼと呼ばれるプロテアーゼがAPPのプロセシングに関与している。
AβペプチドのN-末端におけるβ-セクレターゼによるAPPの分解及びC-末端における1又は2以上のγ-セクレターゼによるAPPの分解がβ-アミロイド形成経路、すなわちAβが形成される経路を構成する。α-セクレターゼによるAPPの分解はα-sAPP、すなわちAPPの分泌型を生成し、これはβ-アミロイド斑の形成をもたらさない。この代替経路がAβペプチドの形成を不可能にする。APPのタンパク質分解プロセシングフラグメントの詳細は、例えば米国特許第5,441,870号;第5,721,130号;及び第5,942,400号に記載されている。
【0003】
アスパルチルプロテアーゼは、β-セクレターゼ分解部位におけるAPPのプロセシングの原因である酵素として同定されている。β-セクレターゼ酵素はBACE、Asp2、am Memapsin2といった変名を用いて開示されている。例えば、Sindha et. al., 1999, Nature 402 : 537-554及び公開PCT出願WO00/17369を参照されたい。
数系統の証拠が、β-アミロイドペプチド(Aβ)の進行性脳沈着がADの病原の生産的な役割を果たし、かつ認知症状の数年又は数十年先行しうることを示している。例えばSelkoe, 1991, Neuron 6: 487-498を参照されたい。培養で成長した神経細胞からのAβの放出及び正常個体とAD患者の両者の脳脊髄液(CSF)内でのAβの存在が実証されている。例えば、Seubert et al., 1992, Nature 359: 325-327を参照されたい。
β-セクレターゼによるAPPプロセシングの結果としてAβが蓄積するので、この酵素の活性の阻害がADの治療に望ましいことが提案されており、例えばVassar, R. 2002, Adv. Drug Deliv. Rev. 54, 1589-1602を参照されたい。β-セクレターゼ切断部位でのAPPのin vivoプロセシングは、Aβ生産の律速段階と考えられるので、ADの治療のための治療標的である。例えば、Sabbagh, M., et al., 1997, Alz. Dis. Rev. 3,1-19を参照されたい。
BACE1ノックアウトマウスはAβを生産できず、正常な表現型を示す。APPを過剰発現するトランスジェニックマウスと交配させると、その子孫はコントロール動物と比較して脳内のAβの量が少ない(Luo et. al., 2001 Nature Neuroscience 4: 231-232)。この証拠は、β-セクレターゼ活性の阻害と脳内のAβの減少がAD及び他のβアミロイド障害の治療法を提供するという提案をさらに支持する。
国際特許出願WO00/47618は、β-セクレターゼ酵素及びその使用法を特定している。この出願は、該酵素の活性部位に結合し、かつ該酵素のアフィニティーカラム精製に有用なオリゴペプチドインヒビターをも開示している。さらに、WO00/77030は、スタチン分子に基づく、β-セクレターゼ活性のテトラペプチドインヒビターを開示している。
【0004】
アルツハイマー病の治療のために種々の医薬が提案されているが、いずれも実際に成功していない。米国特許第5,175,281号はアルツハイマー病の治療に有用であるとしてアミノステロイドを開示している。米国特許第5,502,187号はアルツハイマー病の治療に有用であるとして二環式ヘテロ環式アミンを開示している。
EP 652 009 A1は、βアミロイドペプチド生産を細胞培養内及びin vivoで阻害する、アスパルチルプロテアーゼのインヒビターを開示している。細胞内β-アミロイドペプチドの生産を阻害する化合物はアルツハイマー病の治療で有用である。
WO00/69262は、新規なβ-セクレターゼと、そのアルツハイマー病に対して可能性のある薬物候補をスクリーニングするためのアッセイにおける使用について開示している。
WO01/00663は、メマプシン2(ヒトβ-セクレターゼ)及び触媒的に活性な組換え酵素を開示している。さらに、メマプシン2のインヒビターの同定方法、及び2種のインヒビターが開示されている。開示されている両インヒビターはペプチドである。
WO01/00665は、アルツハイマー病の治療に有用なメマプシン2のインヒビターを開示している。
WO03/057721は、アルツハイマー病の治療用の置換アミノカルボキサミドを開示している。
現在、アルツハイマー病の進行を停止、予防、又は逆転するための有効な治療はない。従って、アルツハイマー病の進行を遅らせ、及び/又はまず第一にアルツハイマー病を予防できる、十分な血漿及び/又は脳安定性のある医薬に対する切迫した要望がある。
β-セクレターゼの有効なインヒビターであり、APPのβセクレターゼ-媒介分解を阻害し、Aβ生産の有効なインヒビターであり、及び/又はアミロイドβ沈着又は斑の低減に有効な化合物が、AD等のアミロイドβ沈着又は斑によって特徴づけられる疾患の治療及び予防のために必要である。
【0005】
〔発明の簡単な概要〕
驚くべきことに、下記式(I)の置換エタン-1,2-ジアミンがAPPのβセクレターゼ-媒介分解の優れた阻害と十分な血漿安定性を示すことが分かった。
従って、本発明は第1実施形態では下記式(I)の群1の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0006】
【化1】

【0007】
(式中、
R1は、
a) C1-4-アルキル-又はC3-6-シクロアルキル-基
(ここで、該C1-4-アルキル-基の1個の非末端メチレン基は、任意に窒素又は酸素原子と置き換わっていてもよく、かつ
該C1-4-アルキル-又はC3-6-シクロアルキル-基は、HO-CO-、HO-PO2-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されている)、
b) アリール-基、
(ここで、該アリール-基は任意に、ハロゲン、C1-3-アルキル-、HO-、HO-CO-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、又は
c) ヘテロアリール-基
(ここで、該ヘテロアリール-基は任意に、ハロゲン、C1-3-アルキル-、HO-、HO-CO-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R2は、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-5-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-5-アルキル-、アリール-、アリール-C1-5-アルキル-、ヘテロアリール-、ヘテロアリール-C1-5-アルキル-、C3-8-シクロアルキル-C2-5-アルケニル-、ヘテロサイクリル-C2-5-アルケニル-、アリール-C2-5-アルケニル-、ヘテロアリール-C2-5-アルケニル-、C3-8-シクロアルキル-C2-5-アルキニル-、ヘテロサイクリル-C2-5-アルキニル-、アリール-C2-5-アルキニル-又はヘテロアリール-C2-5-アルキニル-基を表し
(前記各基は、C1-3-アルキル-、HO-C1-3-アルキル-、HO-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-、C1-3-アルキル-O-CO-C1-3-アルキル-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ホルミル-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-、(R8)2N-C1-3-アルキル-、(R8)2N-CO-、(R8)2N-CO-C1-3-アルキル-、C1-3-アルキル-CO-N(R8)-、(R8)2N-SO2-、C1-3-アルキル-SO2-及びC1-3-アルキル-SO2-N(R8)-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-、C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R4は、水素、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-又はC3-8-シクロアルキル-C1-3-アルキル-基を表し
(前記各基は、任意に1又は2以上のフッ素原子で置換されていてもよい)、
R5は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-、C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R6は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-、C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R7は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R8は、それぞれ相互独立に水素、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-3-アルキル-、アリール-、アリール-C1-3-アルキル-、ヘテロアリール-、ヘテロアリール-C1-3-アルキル-、C3-8シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表す
(前記各基は、任意に、C1-3-アルキル-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ヒドロキシ-、ニトロ-、シアノ-、H2N-及びH2N-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)。)
【0008】
さらに、本発明は、式(I)の化合物又はその医薬的に許容しうる塩若しくは溶媒和物と、医薬的に許容しうる担体又は希釈剤とを含む医薬組成物に関する。
本発明の別の局面は、式(I)の化合物又はその医薬的に許容しうる塩若しくは溶媒和物の、アミロイド前駆体タンパク質の異常なプロセシング及び/又はAβペプチドの凝集に関連する疾患若しくは状態及び/又はAβペプチドによって誘発される状態を有する患者を治療する際、或いは患者が前記疾患又は状態になるのを予防する際に使う医薬の製造における使用である。前記状態は、アルツハイマー病、びまん性レビー小体型アルツハイマー病、ダウン症候群、MCI(“軽度認知障害(Mild Cognitive Impairment”)、オランダ型アミロイド症のある遺伝性脳溢血、脳アミロイド血管症、外傷性脳損傷、痴呆症、パーキンソン症候群、膵臓炎、封入体筋炎(IBM)又は中枢神経性若しくは末梢神経性アミロイド症から選択される。
さらに、本発明は、β-セクレターゼ活性の阻害方法であって、前記β-セクレターゼを有効な阻害量の式(I)の化合物にさらす工程を含む方法に関する。
本発明は、アミロイド前駆体タンパク質(APP)のβ-セクレターゼ-媒介分解を阻害するための化合物、組成物、キット、及び方法を提供する。
さらに詳しくは、本発明の化合物、組成物、及び方法は、Aβペプチドの生産を阻害するため、及び病原形のAβペプチドに関連するいずれのヒト又は動物の疾患若しくは状態を治療又は予防するためにも有効である。
従って、本発明のさらなる目的は、本発明の化合物の、β-セクレターゼの阻害によって改変しうる疾患及び状態の治療又は予防用薬物の製造のための使用に関する。
本発明の化合物、組成物、及び方法は、アルツハイマー病(AD)を有するヒトの治療、ADの発症の予防若しくは遅延の補助、軽度認知障害(MCI)の患者の治療、及び予防しなければMCIからADに進行するであろう当該患者のADの発症の予防又は遅延、ダウン症候群の治療、オランダ型アミロイド症のある遺伝性脳溢血の治療、脳β-アミロイド血管症の治療とその単回及び反復性皮質下出血のような潜在的結果の予防、血管と変性の入り混じった原因に関連する痴呆症といった他の変性痴呆症の治療、パーキンソン病関連痴呆症、進行性核上麻痺関連痴呆症、皮質基底変性関連痴呆症、及びびまん性レビー小体型ADの治療に有用である。
本発明の化合物はβ-セクレターゼ阻害活性を有する。
本発明の化合物の該阻害活性は、例えば、本明細書で述べるか又は技術上周知の1又は2以上のアッセイを用いて容易に実証される。
【0009】
〔発明の詳細な説明〕
本発明は、アルツハイマー病の治療と予防に有用な式(I)の化合物に関する。
ここで、本発明の化合物を説明するために前述した、また後述するいくつかの表現についてさらに完全に定義する。
本発明では、用語アルキルは、特に断らない限り、1〜8個の炭素原子、好ましくは1〜6個の炭素原子、最も好ましくは1〜5個の炭素原子、特に1、2又は3個の炭素原子を有する不分岐若しくは分岐炭化水素基を意味する。例は、メチル、エチル、プロピル、ブチル、ペンチル、ヘキシル等である。特に断らない限り、上記用語プロピル、ブチル、ペンチル、ヘキシル、ヘプチル、オクチルは、n-プロピル、イソプロピル、n-ブチル、イソ-ブチル、tert-ブチル、n-ペンチル、イソ-ペンチル、ネオ-ペンチル、tert-ペンチル、n-ヘキシル、イソ-ヘキシル等のようなすべての可能な異性形をも包含する。場合によっては、一般的な略語を用いて上記アルキル基を示し、例えばメチルはMe、エチルはEt等である。
用語アルキルは、特に断らない限り、フッ素で一置換又は多置換されている当該アルキル基をも包含する。例として、トリフルオロメチル、トリフルオロメトキシ、ジフルオロメトキシ、ペルフルオロエチル、ペルフルオロプロピル、2,2,2-トリフルオロエチル、2,2,2-トリフルオロエトキシ、1,1,1-トリフルオロプロパ-2-イル等が挙げられる。
好ましいフッ素化アルキル基はフルオロメチル、ジフルオロメチル及びトリフルオロメチルである。
用語ハロゲンは、一般的にフッ素、塩素、臭素又はヨウ素、特にF、Cl及びBrを意味する。
用語アルケニルは、特に断らない限り、2〜8個の炭素原子、好ましくは2〜6個の炭素原子、最も好ましくは2〜4個の炭素原子と、1〜3個の二重結合とを有する分岐若しくは不分岐炭化水素基を意味し、例えば、エテニル、プロペニル、アリル、1-ブテニル、1-ペンテニル、1-ヘキセニル等が挙げられる。
用語アルキニルは、特に断らない限り、2〜8個の炭素原子、好ましくは2〜6個の炭素原子、最も好ましくは2〜4個の炭素原子と、1又は2個の三重結合とを有する分岐若しくは不分岐炭化水素基を意味し、エチニル、プロピニル、プロパルギル、ブチニル、ペンチニル等が挙げられる。
用語シクロアルキル(他の基の一部であるアルキル基、特にシクロアルキル-アルキル-又はシクロアルコキシ-を含む)は、特に断らない限り、3〜12個の炭素原子を有する飽和炭素環式基を意味する。シクロアルキルは単環式、又は多環式縮合系でよい。好ましくは、シクロアルキル基は、3〜8個の炭素原子、最も好ましくは3、4、5又は6個の炭素原子、特に3又は6個の炭素原子を有する単環式である。例は、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル等である。最も好ましくはシクロプロピル及びシクロヘキシルである。
用語アリール基は、特に断らない限り、単環(例えば、フェニル)、多環(例えば、ビフェニル)、又は多縮合芳香族環(例えば、ナフチル、アントリル)を有する芳香族炭素環式基を意味する。例は、フェニル、ビフェニル、1-ナフチル、2-ナフチル、アントラセニル、フェナントレニルである。“アリール”の特に好ましい意味はフェニルである。
用語ヘテロアリール基は、特に断らない限り、窒素、酸素、又はイオウから選択される少なくとも1、2、3、又は4個のヘテロ原子を含有する5-、6-、又は7-員環の1又は2以上の芳香族若しくは不飽和環系を意味し、9〜11個の原子の縮合環系を包含する。用語ヘテロアリール基は、該環中に酸素原子で置換されている窒素原子を含有するヘテロアリール基(ヘテロアリールN-オキシド)をも包含する。典型的なヘテロアリールN-オキシドはピリジン-2-イルN-オキシド、ピリジン-3-イルN-オキシド、ピリジン-4-イルN-オキシド、ピロリルN-オキシド、ピリミジニルN-オキシド、ピリダジニルN-オキシド、ピラジニルN-オキシド、キノリニルN-オキシド、インドリルN-オキシド、インドリニルN-オキシド、イソキノリルN-オキシド、キナゾリニルN-オキシド、キノキサリニルN-オキシド、フタラジニルN-オキシド、イミダゾリルN-オキシド、イソキサゾリルN-オキシド、オキサゾリルN-オキシド、チアゾリルN-オキシド、インドリジニルN-オキシド、インダゾリルN-オキシド、ベンゾチアゾリルN-オキシド、ベンゾイミダゾリルN-オキシド、ピロリルN-オキシド、オキサジアゾリルN-オキシド、チアジアゾリルN-オキシド、トリアゾリルN-オキシド、テトラゾリルN-オキシドである。ヘテロアリール基のさらなる例は、チオフェニル、ピリジニル、ピリミジニル、キノリニル、ベンゾチエニル、インドリル、インドリニル、ピリダジニル、ピラジニル、イソインドリル、イソキノリル、キナゾリニル、キノキサリニル、フタラジニル、イミダゾリル、イソキサゾリル、ピラゾリル、オキサゾリル、チアゾリル、インドリジニル、インダゾリル、ベンゾチアゾリル、ベンゾイミダゾリル、ベンゾフラニル、フラニル、チエニル、ピロリル、オキサジアゾリル、チアジアゾリル、トリアゾリル、テトラゾリル、オキサゾロピリジニル、イミダゾピリジニル、イソチアゾリル、ナフチリジニル、シンノリニル、カルバゾリル、β-カルボリニル、イソクロマニル、クロマニル、テトラヒドロイソキノリニル、イソインドリニル、イソベンゾテトラヒドロフラニル、イソベンゾテトラヒドロチエニル、イソベンゾチエニル、ベンゾオキサゾリル、ピリドピリジニル、ベンゾテトラヒドロフラニル、ベンゾテトラヒドロチエニル、プリニル、ベンゾジオキソリル、トリアジニル、フェノキサジニル、フェノチアジニル、プテリジニル、ベンゾチアゾリル、イミダゾピリジニル、イミダゾチアゾリル、ジヒドロベンゾイソキサジニル、ベンゾイソキサジニル、ベンゾオキサジニル、ジヒドロベンゾイソチアジニル、ベンゾピラニル、ベンゾチオピラニル、クマリニル、イソクマリニル、クロモニル、クロマノニル、テトラヒドロキノリニル、ジヒドロキノリニル、ジヒドロキノリノニル、ジヒドロイソキノリノニル、ジヒドロクマリニル、ジヒドロイソクマリニル、イソインドリノニル、ベンゾジオキサニル、ベンゾオキサゾリノニル、ベンゾチオピラニルS-オキシド、ベンゾチオピラニルS,S-ジオキシド、ベンゾ[1,3]ジオキソールである。
好ましいヘテロアリール基は下記式で示される基及びベンゾイミダゾリル-基である。
【0010】
【化2】

【0011】
用語ヘテロサイクリル基は、特に断らない限り、窒素、酸素、又はイオウから選択される少なくとも1、2、3、又は4個のヘテロ原子を含有する5-、6-、又は7-員環の1又は2以上の飽和炭素環系を意味し、9〜11個の原子の縮合環系を包含する。本発明の好ましいヘテロ環として、モルフォリニル、チオモルフォリニル、チオモルフォリニルS-オキシド、チオモルフォリニルS,S-ジオキシド、ピペラジニル、ホモピペラジニル、ピロリジニル、ピロリニル、テトラヒドロピラニル、ピペリジニル、テトラヒドロフラニル、テトラヒドロチエニル、ホモピペリジニル、モルフォリニル、ホモモルフォリニル、ホモチオモルフォリニル、ホモチオモルフォリニルS,S-ジオキシド、オキサゾリジノニル、ジヒドロピラゾリル、ジヒドロピロリル、ジヒドロピラジニル、ジヒドロピリジニル、ジヒドロピリミジニル、ジヒドロフリル、ジヒドロピラニル、アゼパニル、ジアゼパニル、テトラヒドロチエニルS-オキシド、テトラヒドロチエニルS,S-ジオキシド及びホモチオモルフォリニルS-オキシドが挙げられる。特に好ましいヘテロサイクリル基はモルフォリニルである。
シクロアルキル-アルキル-、ヘテロサイクリル-アルキル-、アリール-アルキル-、ヘテロアリール-アルキル-のような用語は、シクロアルキル、ヘテロサイクリル、アリール又はヘテロアリール基で置換されている、上記定義どおりのアルキル基を意味する。アリール-アルキル基の例はベンジル又は2-フェニルエチルである。シクロアルキル-アルキル-基の例はシクロプロピルメチル-、シクロヘキシルメチル又はシクロペンチルエチルである。
上述した多くの用語は、式又は基の定義で繰り返し使用され、各場合、相互独立に上記意味の1つを有する。
【0012】
この出願で使用する用語“任意に置換されていてもよい”は、そのように示される基が、置換されていないか又は指定した置換基で一置換又は多置換されていることを示す。問題の基が多置換されている場合、当該置換基は同一又は異なってよい。
本発明の化合物は不斉炭素原子を含み、例えば、不斉炭素原子の数、絶対配置及び相対配置によって、可能な異性体の1つの形態で存在し、又はその混合物として存在しうる。例えば、対掌体及び/又はジアステレオマー等の純粋な異性体として、或いはエナンチオマー混合物、例えばラセミ体、ジアステレオマー混合物又はラセミ混合物等の異性体混合物として存在しうる。本発明は、純粋な異性体及び可能なすべての異性体混合物の両者に関し、かつ各場合に立体化学の詳細が特に言及されていない場合でさえ、前述した、また後述するとおりに解釈するものとする。
記号“-”は、一般的に鎖中の2つの原子間の結合及びその定義している分子の残部への基の結合点を示す。例えば、アリール-C1-3-アルキル-基は、アリールアルキル-基(例えば2-フェニルエチル-)(該フェニル基がエチル基に結合し、このエチル基が分子の残部に結合している)を示す。置換基の原子の記数法は、置換基が結合している、該分子の残部に最も近い原子で開始する。
例えば、用語“3-カルボキシプロピル-基”はカルボキシ基がプロピル基の第3炭素原子に結合している、下記置換基を意味する。
【0013】
【化3】

【0014】
用語“1-メチルプロピル-”、“2,2-ジメチルプロピル-”又は“シクロプロピルメチル-”は、下記基を意味する。
【0015】
【化4】

【0016】
サブ式でアスタリスクを用いて、定義している分子の残部に連結している結合を示す。
【0017】
好ましい実施形態では、本発明は、式(I)中、
R1が、
a) C1-4-アルキル-基
(ここで、前記C1-4-アルキル-は、HO-CO-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されている)、
b) アリール-基
(任意に、フルオロ、HO-及びHO-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、又は
c) ヘテロアリール-基
(任意に、フルオロ、クロロ、Me、HO-及びHO-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R2がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-5-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-5-アルキル-、アリール-、アリール-C1-5-アルキル-、ヘテロアリール-又はヘテロアリール-C1-5-アルキル-基を表し
(前記各基は、C1-3-アルキル-、HO-C1-3-アルキル-、HO-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ホルミル-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-、(R8)2N-C1-3-アルキル-、(R8)2N-CO-、(R8)2N-CO-C1-3-アルキル-、C1-3-アルキル-CO-N(R8)-、(R8)2N-SO2-、C1-3-アルキル-SO2-及びC1-3-アルキル-SO2-N(R8)-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R4が水素、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-又はC3-8-シクロアルキル-C1-3-アルキル-基を表し
(前記各基は、任意に1又は2以上のフッ素原子で置換されていてもよい)、
R5がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R6がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R7がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R8がそれぞれ相互独立に水素、C1-6-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-3-アルキル-、アリール-、アリール-C1-3-アルキル-、ヘテロアリール-又はヘテロアリール-C1-3-アルキル-基を表す
(前記各基は、任意に、C1-3-アルキル-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ヒドロキシ-、ニトロ-、シアノ-、H2N-及びH2N-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
式(I)の群2の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0018】
さらに好ましい実施形態では、本発明は、式(I)中、
R1が、
a) HO-CO-(CH2)n-又はHO-SO2-(CH2)n-基(ここで、nは1、2、3又は4である)、又は
b) キノリニルN-オキシド、イソキノリニルN-オキシド、ピリジン-2-イルN-オキシド、ピリジン-3-イルN-オキシド、ピリジン-4-イルN-オキシド、又は
c) フェニル基
(ここで、前記フェニル基は、任意に、ハロゲン及びヒドロキシ-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R8がそれぞれ相互独立に水素又はC1-6-アルキル-基を表し
(ここで、前記C1-6-アルキル-基は、任意に、C1-3-アルキル-O-、ハロゲン、カルボキシ-、ヒドロキシ-、ニトロ-、シアノ-及びH2N-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
かつR2、R3、R4、R5、R6及びR7は、群1又は2の化合物について定義したとおりである、
式(I)の群3の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0019】
さらに好ましい実施形態では、本発明は、式(I)中、
R1が、
a) HO-CO-(CH2)n-基(ここで、nは1、2、3又は4である)、
b) ピリジン-2-イルN-オキシド、ピリジン-3-イルN-オキシド、ピリジン-4-イルN-オキシド、又は
c) フェニル基
(ここで、前記フェニル基は、任意に、ハロゲン及びヒドロキシから成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R8がそれぞれ相互独立に水素又はC1-6-アルキル-基を表し
(ここで、前記C1-6-アルキル-基は、任意に、C1-3-アルキル-O-及びフルオロから成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
かつR2、R3、R4、R5、R6及びR7は、群1又は2の化合物について定義したとおりである、
式(I)の群4の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0020】
さらに好ましい実施形態では、本発明は、式(I)中、
R1がHO-CO-(CH2)3-、ピリジン-2-イルN-オキシド、ピリジン-3-イルN-オキシド、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、
R8がそれぞれ相互独立に水素又はC1-6-アルキル-基を表し、
かつR2、R3、R4、R5、R6及びR7は、群1又は2の化合物について定義したとおりである、
式(I)の群5の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0021】
さらに好ましい実施形態では、本発明は、式(I)中、
R1がHO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、
R8がそれぞれ相互独立に水素又はC1-3-アルキル-基を表し、
かつR2、R3、R4、R5、R6及びR7は、群1又は2の化合物について定義したとおりである、
式(I)の群6の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0022】
さらに好ましい実施形態では、本発明は、式(I)中、
R2がC1-5-アルキル-、C2-5-アルケニル-、C2-5-アルキニル-、C3-6-シクロアルキル-C1-5-アルキル-、フェニル-C1-5-アルキル-又はヘテロアリール-C1-5-アルキル-基を表し
(ここで、前記C1-5-アルキル-基は、任意に1又は2以上のフッ素原子で置換されていてもよく、かつ
前記フェニル基は、任意に、C1-3-アルキル-、ニトロ-、ハロゲン、ヒドロキシ-、カルボキシ-、(R8)2N-、(R8)2N-C1-3-アルキル-、(R8)2N-CO-C1-3-アルキル-、C1-3-アルキル-CO-N(R8)-、C1-3-アルキル-SO2-、(R8)2N-CO-、HO-C1-3-アルキル-、HO-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-及びC1-3-アルキル-SO2-N(R8)-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル-、フェニル-C1-4-アルキル-C3-6-シクロアルキル-C1-3-アルキル、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R4が水素又はC1-4-アルキル-基を表し
(任意に、1又は2以上のフッ素原子で置換されていてもよい)、
R5がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル-、フェニル-C1-4-アルキル-、C3-6-シクロアルキル-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R6がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル- 、フェニル-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル、C3-6-シクロアルキル-C1-3-アルキル、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R7がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル-、フェニル-C1-4-アルキル-基、C3-6-シクロアルキル-C1-3-アルキル、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-基から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
かつR1及びR8は群1、2、3、4、5又は6の化合物について定義したとおりである、
式(I)の群7の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0023】
さらに好ましい実施形態では、本発明は、式(I)中、
R2がC1-3-アルキル-、C3-6-シクロアルキル-C1-3-アルキル-、フェニル-C1-3-アルキル-又はピリジル-C1-3-アルキル-基を表し
(ここで、前記C1-3-アルキル-基は、任意に1又は2以上のフッ素原子で置換されていてもよく、かつ
前記フェニル基は、任意に、C1-3-アルキル-、ニトロ-、ヒドロキシ-、カルボキシ-、H2N-、H2N-CH2-、H2N-CO-CH2-、Me-CO-NH-、Me-SO2-、H2N-CO-、HO-CH2-、HOCO-CH2-、Me-OCO-CH2-、Me-OCO-、及びMe-SO2-NH-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3がC1-5-アルキル-基を表し、
R4が水素を表し、
R5がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R6がC1-4-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R7がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表し
(ここで、前記アルキル-基は、任意に、カルボキシ-、ヒドロキシ-、H2N-及びH2N-CO-基から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
かつR1は群1、2、3、4、5又は6の化合物について定義したとおりである、
式(I)の群8の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0024】
さらに好ましい実施形態では、本発明は、式(I)中、
R2がエチル-、n-プロピル-若しくは2-メチルプロピル-基、又は下記置換基から成る群より選択される置換基を表し、
【0025】
【化5】

【0026】
R3がC1-5-アルキル-基を表し、
R4が水素を表し、
R5がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R6がC1-4-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R7がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表し
(ここで、前記アルキル-基は、任意に、カルボキシ-、ヒドロキシ-、H2N-及びH2N-CO-基から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
かつR1は、群1、2、3、4、5又は6の化合物について定義したとおりである、
式(I)の群9の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0027】
さらに好ましい実施形態では、本発明は、式(I)中、
R2がエチル-、n-プロピル-若しくは2-メチルプロピル-基、又は下記置換基から成る群より選択される置換基を表し、
【0028】
【化6】

【0029】
R3が下記置換基から成る群より選択される置換基を表し、
【0030】
【化7】

【0031】
R4が水素を表し、
R5が下記置換基から成る群より選択される置換基を表し、
【0032】
【化8】

【0033】
R6が下記置換基から成る群より選択される置換基を表し、
【0034】
【化9】

【0035】
R7がメチル-、エチル-、n-プロピル-若しくはn-ブチル-基、又は下記置換基から成る群より選択される置換基を表し、
【0036】
【化10】

【0037】
かつR1は、群1、2、3、4、5又は6の化合物について定義したとおりである、
式(I)の群10の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0038】
さらに好ましい実施形態では、本発明は、下記式(Ia)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0039】
【化11】

【0040】
(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、群1、2、3、4、5、6、7、8、9又は10の化合物について定義したとおりである。)
【0041】
別のさらに好ましい実施形態では、本発明は、下記式(Ib)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0042】
【化12】

【0043】
(式中、
R1はHO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、群1、2、3、4、5、6、7、8、9又は10の化合物について定義したとおりである。)
【0044】
別のさらに好ましい実施形態では、本発明は、下記式(Ic)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0045】
【化13】

【0046】
(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、群1、2、3、4、5、6、7、8、9又は10の化合物について定義したとおりである。)
【0047】
別のさらに好ましい実施形態では、本発明は、下記式(Id)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0048】
【化14】

【0049】
(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、群1、2、3、4、5、6、7、8、9又は10の化合物について定義したとおりである。)
【0050】
別のさらに好ましい実施形態では、本発明は、下記式(Ie)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0051】
【化15】

【0052】
(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、群1、2、3、4、5、6、7、8、9又は10の化合物について定義したとおりである。)
【0053】
別のさらに好ましい実施形態では、本発明は、下記式(If)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物に関する。
【0054】
【化16】

【0055】
(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、群1、2、3、4、5、6、7、8、9又は10の化合物について定義したとおりである。)
【0056】
最も好ましくは下記式(I)〜(58)の化合物である。
【0057】
【化17】

【0058】
【化18】

【0059】
【化19】

【0060】
【化20】

【0061】
【化21】

【0062】
【化22】

【0063】
【化23】

【0064】
【化24】

【0065】
【化25】

【0066】
本発明の化合物は、当業者に周知の出発化合物から当業者に周知の方法で製造される。このプロセス化学は当業者に周知である。以下の反応スキームは本発明の化合物のペプチド合成を示す。
当業者にはこれらがすべて有機化学の周知反応であることが分かるだろう(Houben-Weyl− Methods of Organic Chemistry, Vol E22, Synthesis of Peptides and Peptidomimetics, M. Goodman, A. Felix, L. Moroder, C. Toniolo Eds., Georg Thieme Verlag Stuttgart, New York)。本発明の式(I)の生物学的に活性な化合物の化学構造を知っている、本技術の熟練化学者は、何らさらなる情報がなくても既知の出発原料から既知の方法で本発明の化合物を調製できるだろう。従って、以下の説明は必ずしも必要でないが、本発明の化合物の製造を望む当業者に役に立つと考えられる。
スキームAは、式(I)の化合物の固相ペプチド合成を示す。
ポリマーとして商業的に入手可能な[3-{[エチル-Fmoc-アミノ]-メチル}-インドール-1-イル-アセチルAM樹脂(Indol resin, Novabiochem)を使用する。DMF中のピペリジンによるFmoc-基の切断(工程a)後、ペプチド化学の標準的方法、例えばHATU/HOBtで第1のアミノ酸をカップリングする(工程b)。Fmoc-基の脱保護(工程b)後、次のアミノ酸(Fmoc-Abu)を適切なペプチドカップリング試薬、例えばDIC/HOBtでカップリングする(工程c)。Fmoc-基の切断(工程c)後、還元剤としてNaCNBH3の存在下Fmoc-ロイシナールで還元的アルキル化を行う(工程d)。その結果生じた二級アミン基を(Boc)2Oでキャッピングする。工程a)、b)及びc)を適用し、それぞれアミノ酸Fmoc-homoPhe及びFmoc-Leuを用いて、ペプチド構築を完成した。標準的なアシル化法でN-末端キャッピング基の導入を達成できる(工程g)。酸、例えばトリフルオロ酢酸との反応によって、ポリマーからC-末端ペプチドN-エチルアミドを切断する。
この合成手順により、式(I)の位置R1、R3、R4、R5、R6、及びR7に種々の残基を組み入れることができる。
スキームA(実施例番号1)
【0067】
【化26】

【0068】
スキームBは、C-末端アミド部分を変化させたペプチドの合成を示す。この目的では、商業的に入手可能な(ホルミルインドリル)アセトアミドメチルポリスチレン樹脂を使用する。第1反応で、NaCNBH3の存在下シクロヘキシルメチルアミンでアルデヒド基を還元的にアルキル化した(工程a)。スキームAに示したように、さらなるペプチド構築及び該ポリマーからの切断を行った。
スキームB(実施例番号2)
【0069】
【化27】

【0070】
以下に概要を示す一般的合成スキームに従う液相化学によって、本発明の化合物を合成することができる。この方法により、それぞれのアミノ酸、カルボン酸又はアミンを利用して、R1、R2、R3、R4、R5、R6、及びR7の変形が可能である。
スキームCに示されるように、中心コアe)を構築した。標準的なカップリング条件、特にTBTU/DIPEAを用いて、Boc-保護アミノ酸をアミノ酸t-ブチルエステルb)とカップリングして二保護ジペプチドc)を得た。c)をボランジメチルスルフィド複合体で還元してジアミンd)を得た。慎重なクロマトグラフィー後、Boc-脱保護して単保護生成物e)を得た。
スキームC:
【0071】
【化28】

【0072】
代替手順では、下記スキームDに示すように単保護ジペプチドf)を調製した。
スキームD:
【0073】
【化29】

【0074】
対応するアミノ酸アルコールのDees/Martin酸化によって得たBoc-保護アミノ酸アルデヒドg)をアミノ酸エステルh)で還元的アルキル化して二保護ジアミンi)を得、Boc-脱保護して単保護生成物f)を得た。
下記スキームEに従って最終生成物I)を得た。
スキームE:
【0075】
【化30】

【0076】
R5を有するBoc-保護アミノ酸エステルから出発する標準的ペプチドカップリング手順及びBoc-脱保護工程を用いてN-末端部k)を構築した。引き続き、エステルj)を加水分解して遊離酸k)を得た。標準的ペプチドカップリング条件、特にTBTU/DIPEAを用いてジアミンe)又はf)をN-末端部k)とカップリングした。メチルエステルの場合はLiOHを用い、t-ブチルエステルの場合はTFAを用いてエステルm)を加水分解後、生じた酸を対応アミンp)とカップリングしてアミドl)を得た。
場合によっては、最終生成物m)を得るための最終工程で保護前駆体からC-末端R2を遊離させる必要があった。下記スキームFは一例を示した。エステルl)を加水分解して遊離酸m)を得た。
スキームF:
【0077】
【化31】

【0078】
代替手順では、下記スキームGに従って最終化合物を得た。
スキームG:
【0079】
【化32】

【0080】
従って、C-末端部n)の合成の第1工程では、Boc-保護アミノ酸o)とアミンp)を用いて標準的ペプチドカップリング手順でアミドq)を構築した。q)のBoc-脱保護と対応Boc-保護アミノ酸アルデヒドg)による還元的アルキル化によってジペプチドアミドr)を得た。Boc-脱保護とN-末端部k)とのカップリングによって最終生成物l)を得た。
特に定義しない限り、本明細書で使用するすべての科学用語及び技術用語は、この発明が属する技術の当業者が一般的に解釈する意味と同じ意味を有する。本明細書で参照したすべての特許及び刊行物は、引用によってすべての目的のため本明細書に組み込まれる。以下の定義及び説明は、本明細書及び特許請求の範囲の両者を含むこの全文書を通じて使用する用語に使われる。
すべての温度は摂氏温度であり、
(M+H)+は、親原子+水素原子の正イオンを表し、
Abuは2-アミノ酪酸を表し、
BOCは1,1-ジメチルエトキシカルボニル又はt-ブトキシカルボニルを表し、
BOPはベンゾトリアゾール-l-イルオキシ-トリス(ジメチルアミノ)ホスホニウムヘキサフルオロホスフェートを表し、
Bzlはベンジルを表し、
CBZはベンジルオキシカルボニルを表し、
CDIは1,1'-カルボニルジイミダゾールを表し、
クロマトグラフィー(カラム及びフラッシュクロマトグラフィー)は、(担体,溶出液)として示され、化合物の精製/分離法を表す。妥当なフラクションをプールし、濃縮して所望化合物を得るものと解釈し、
CMRはC-13磁気共鳴スペクトル分析(化学シフトはTMSから低磁場にppm(8)で記録される)を表し、
DICはジシクロヘキシルカルボジイミドを表し、
DIPAMPは(R,R)-1,2-エタンジイルビス[(2-メトキシフェニル)フェニルホスフィン]を表し、
DCMはジクロロメタンを表し、
Dipeaはジイソプロピルエチルアミンを表し、
DIPEAはジイソプロピルエチルアミンを表し、
DMFはジメチルホルムアミドを表し、
EDCはエチル-1-(3-ジメチルアミノプロピル)カルボジイミド又は1-(3-ジメチルアミノプロピル)-3-エチル(etliyl)カルボジイミドハイドロクロライドを表し、
EIは電子衝撃を表す。CIは化学イオン化を表す。FABは高速原子衝撃法を表し、
エーテルは、特に断らない限り、ジエチルエーテルを指し、
FMOCは9-フルオレニルメチルカーボネートを表し、
HATUはO-(7-アザベンゾトリアゾール-1-イル)-N,N,N',N'-テトラメチルウロニウムヘキサフルオロ-ホスフェートを表し、
HBTUは2-(1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムヘキサフルオロホスフェートを表し、
HOAcは酢酸を表し、
HOBtは1-ヒドロキシベンゾトリアゾール水和物を表し、
HRMSは高分解能質量分析を表し、
IRは赤外分光分析を表し、
MPLCは中圧液体クロマトグラフィーを表し、
MSはm/e、m/z又は質量/電荷単位で示される質量分析を表し、
NBSはN-ブロモスクシンイミドを表し、
NMMはN-メチルモルフォリンを表し、
NMPはN-メチルピロリドンを表し、
NMRは核(プロトン)磁気共鳴スペクトル分析(化学シフトはTMSから低磁場にppm(d)で記録される)を表し、
psiはポンド/in2を表し、
RFは保持係数を表し、
RTは保持時間を表し、
食塩水は塩化ナトリウム飽和水溶液を表し、
Staは(3S,4S)-4-アミノ-3-ヒドロキシ-6-メチル-ヘプタン酸を表し、
TBTUは1-[ビス(ジメチルアミノ)メチレン]-1-H-ベンゾトリアゾリウム(triazolim)-テトラフルオロボレート-3-オキシドを表し、
tBuはtert.-ブチルを表し、
TFAはトリフルオロ酢酸を表し、
THFはテトラヒドロフランを表し、
TMOFはオルトギ酸トリメチルを表す。
【0081】
“医薬的に許容しうる”という表現は、組成物、製剤、安定性、患者の許容性及びバイオアベイラビリティーについて、薬理学的/毒性学的観点から患者にとって許容性であり、かつ物理学的/化学的観点から医薬品を製造する化学者にとって許容性である当該特性及び/又は物質を意味する。溶媒対を使用する場合、使用する溶媒の比は体積/体積(v/v)である。溶媒中の固体の溶解度を使用する場合、溶媒に対する固体の比は質量/体積(wt/v)である。
【実施例】
【0082】
さらに推敲することなく、当業者は先行する記述を用いて本発明をその最大限まで実施できると考えられる。
以下の詳細例は、本発明の種々の化合物をどうやって調製するか、及び/又は本発明の種々の方法をどうやって遂行するかを説明しており、単に例示としてみなすべきであり、如何なる場合にも先行する開示の限定と解釈すべきでない。当業者には、反応物質と、反応条件及び方法との両者について、該手順から適切な変形が即座に分かるだろう。
分析用HPLC-MS及び/又はNMRで生成物を分析した。
HPLC-条件1:カラム:Waters Xterra MS, C18, 2.1×50mm, 3.5μm
カラム温度(℃):60.0
流速:1.0ml/分
溶媒A:水+0.1% TFA。溶媒B:MeCN+0.1% TFA。勾配:4.0分で95%のA→2%のA
HPLC-条件2:カラム:Waters Xterra MS. C18. 4.6×50mm, 3.5μm
カラム温度(℃):40.0
流速:1ml/分
溶媒A:水+0.1% TFA。溶媒B:MeCN+0.1% TFA。
勾配:5.1分で95%のA→2%のA
HPLC-条件3:カラム:Waters Xterra MS, C18, 2.1×50mm, 3.5μm
カラム温度(℃):25.0
流速:0.4ml/分
溶媒A:水+0.1% TFA。溶媒B:MeCN+0.1% TFA。
勾配:5.1分で95%のA→2%のA
HPLC-条件4:カラム:Varian Microsorb 100, C18, 4.6×50mm, 3.0μm
カラム温度(℃):25.0
流速:1.0ml/分
溶媒A:水+0.1% TFA。溶媒B:MeCN+0.1% TFA。
勾配:4.5分で95%のA→2%のA
HPLC-条件5:カラム:Varian Microsorb, C18, 21.2×250mm, 8.0μm
カラム温度(℃):25.0
流速:20.0ml/分
溶媒A:水+0.1% TFA。溶媒B:MeCN+0.1% TFA。
勾配:20.0分で90%のA→50%のA
HPLC-条件6:カラム:Waters Xterra MS, C18, 4.6×30mm, 2.5μm
カラム温度(℃):25.0
流速:1.0ml/分
溶媒A:水+0.1% TFA。溶媒B:MeCN+0.1% TFA。
勾配:4.4分で95%のA→2%のA
【0083】
実施例1:
【0084】
【化33】

【0085】
[3-((エチル-Fmoc-アミノ)-メチル)-1-インドール-イル]アセチルAM樹脂(277mg,0.2mmol)(Novabiochem)を用いて標準的な固相ペプチド合成によって本化合物を合成した。
DMF中30%のピペリジンによる2及び20分の処理でFmoc-脱保護を行った。溶媒としてDMF中で16時間、HATU(5当量)、HOBt(5当量)、Dipea(5当量)及びFmoc-保護アミノ酸(5当量)で第1アミノ酸のカップリングを行った。第1アミノ酸のカップリングを1回繰り返した。カップリング試薬としてTBTU(5当量)、HOBt(5当量)、Dipea(15当量)及びアミノ酸(5当量)で溶媒としてDMFを用いて他のアミノ酸のカップリングを行った。
Fmoc-2-アミノ酪酸のカップリングとFmoc-脱保護後、調製したてのFmoc-ロイシナール(3.5当量)とNaCNBH3(10.5当量)(DMF/HOAc(99:1,2ml)中)で16時間還元的にアミノ基をアルキル化した。アルキル化後、樹脂を慎重にDMF/HOAc(99:1)、DMF、5% Dipea(DMF中)及びDMFで洗浄した。生じた二級アミノ基をDMF中で16時間Boc2O(10当量)及びDipea(10当量)との反応で保護した。
次のFmoc-アミノ酸を前述したようなペプチド鎖が完成するまでカップリングした。溶媒としてDMF中、4-ニコチン酸N-オキシド(5当量)、TBTU(5当量)、HOBt(5当量)、Dipea(15当量)で末端のアセチル化を行った。
TFA/水(95:5)で1時間処理して樹脂からの切断を達成した。このTFA溶液を減圧下でエバポレートし、ジエチルエーテルを加えてペプチドを沈殿させた。沈殿物をアセトニトリル/水に溶かし、分取用逆相HPLCで精製した。精製生成物を凍結乾燥した。収量90mg(59%)。
生成物を分析用HPLC-MSとNMRで分析した。分析データは構造と一致した。実測値[M+H]+ 625.4;RT=4.58分(HPLC-条件3)。
実施例番号1.1〜1.25を同様に合成した。分析データは構造と一致した。
【0086】
【化34】

【0087】
【化35】

【0088】
【化36】

【0089】
【化37】

【0090】
実施例2:
【0091】
【化38】

【0092】
3-(ホルミルインドリル)アセトアミドメチルポリスチレン樹脂(100mg,0.11mmol)(Merckbiosciences)を用いて標準的固相ペプチド合成で本化合物を合成した。
第1の還元的アルキル化のため、樹脂を1,2-ジクロロエタン/TMOF(2:1)で洗浄してから1,2-ジクロロエタン/TMOF 1:1(1ml)中のシクロヘキシルメチルアミン(10当量)の溶液と反応させた。5分後、固体Na(OAc)3BH(10当量)と1,2-ジクロロエタン/TMOF 2:1(1ml)を加え、該懸濁液を室温で一晩振とうさせた。樹脂を慎重にDMF、MeOH、THF及びDCMで洗浄した。
DMF中30%のピペリジンによる2及び20分の処理でFmoc-脱保護を行った。次に、樹脂を慎重にDMFで洗浄した。溶媒としてDMF中で一晩、TBTU(5当量)、HOBt(5当量)、Dipea(10当量)及びFmoc-保護アミノ酸(5当量)でアミノ酸のカップリングを行った。
第1アミノ酸のカップリングとFmoc-脱保護後、Fmoc-ロイシナール(3.5当量)とNaCNBH3(10.5当量)(DMF/HOAc(99:1,2ml)中)で2.25時間アミノ基を還元的にアルキル化した。アルキル化後、樹脂を慎重にDMF/HOAc(99:1)、DMF、5% Dipea(DMF中)及びDMFで洗浄した。結果の二級アミノ基をDMF中で16時間Boc2O(10当量)及びDipea(10当量)との反応によって保護した。
次のFmoc-アミノ酸とN-末端カルボン酸を上述したようなペプチド鎖が完成するまでカップリングした。
TFA/DCM(5:95)で2時間処理して樹脂からの切断を行った。溶液をエバポレートし、TFA/水(95:5)で1時間処理した。このTFA溶液を減圧下でエバポレートし、ジエチルエーテルを加えてペプチドを沈殿させた。沈殿物をアセトニトリル/水に溶かして逆相HPLCで精製した。精製生成物を凍結乾燥した。
生成物を分析用HPLC-MSとNMRで分析した。分析データは構造と一致した。実測値[M+H]+ 610.6;RT=4.26分(HPLC-条件2)。
実施例2.1〜2.13を同様に合成した。分析データは構造と一致した。
【0093】
【化39】

【0094】
【化40】

【0095】
実施例3:
【0096】
【化41】

【0097】
a)3-aの調製:
【0098】
【化42】

【0099】
5.0g(18.8mmol)の(S)-2-tert-ブトキシカルボニルアミノ-3-フェニル-プロピオン酸、3.4g(18.8mmol)の(S)-2-アミノ-プロピオン酸-tert-ブチルエステル-ハイドロクロライド及び6.8ml(37.7mmol)のDIPEAを20mlのTHFに溶かした。6.1g(18.8mmol)のTBTUと2.6g(18.8mmol)のHOBtを加えた。反応混合物を室温で4時間撹拌し、NaHCO3溶液で希釈し、酢酸エチルで抽出した。混ぜ合わせた有機相を濃縮し、残留物をフラッシュクロマトグラフィー(シリカゲル,ジクロロメタン/エタノール 98:2)で精製して5.8g(78%)の3-aを得た。
ES-MS(M+H)+=393
RT(HPLC-条件6)= 3.42分
b) 3-bの調製:
【0100】
【化43】

【0101】
2.9g(7.4mmol)の3-aを10mlのTHFに溶かし、氷冷下で14.8ml(29.6mmol)の2Nのホウ素-ジメチルスルフィド-複合体を加えた。混合物を室温で一晩撹拌し、氷冷下、メタノールで慎重に希釈した。反応をNaHCO3溶液と酢酸エチルで抽出し、混ぜ合わせた有機相を乾燥させ、濃縮し、残留物をクロマトグラフィー(Flashmaster, 50gカラム,ジクロロメタン/エタノール 100:0→95:5)で精製して1.9g(68%)の3-bを得た。
c) 3-cの調製:
【0102】
【化44】

【0103】
10mlの酢酸エチル中の2.9g(4.6mmol)の3-bを535μlの4N HCl(1,4-ジオキサン中)で処理し、室温で6時間撹拌した。混合物を濃縮して定量的な3-cを得た。
RT(HPLC-条件6)= 2.13分
d) 3-dの調製:
【0104】
【化45】

【0105】
5mlのメタノール中の850mg(2.2mmol)の(S)-2-{(S)-4,4-ジメチル-2-[(1-オキシ-ピリジン-4-カルボニル)-アミノ]-ペンタノイルアミノ}-ペンタン酸メチルエステルを5ml(25.0mmol)の5N LiOHで処理し、室温で一晩撹拌した。反応を濃縮し、4N HClで酸性にし、メタノール/ジクロロメタンの混合物で抽出した。混合有機相を乾燥させ、濃縮して700mg(86%)の3-dを得た。
ES-MS(M+H)+=366
e) 3-eの調製:
【0106】
【化46】

【0107】
3-aの調製と同様に、150mg(0.54mmol)の3-cと197mg(0.54mmol)の3-dから245mg(73%)の3-eを得た。
RT(HPLC-条件6)=2.76分
f) 3-fの調製:
【0108】
【化47】

【0109】
5mlのジクロロメタン中の580mg(0.9mmol)の3-eを500μl(6.5mmol)のTFAで処理し、50℃で5時間撹拌した。混合物を濃縮し、残留物をクロマトグラフィー(Flashmaster, 20gカラム,ジクロロメタン/エタノール 100:0→95:5)で精製して580mg(88%)の3-fを得た。
ES-MS(M+H)+=570
RT(HPLC-条件6)= 2.35分
g) 3-gの調製:
【0110】
【化48】

【0111】
3-aの調製と同様に、75mg(0.13mmol)の3-fと15μl(0.13mmol)の4-アミノメチル-フェニルアミンから14mg(16%)の3-gを得た。
ES-MS(M+H)+=674
RT(HPLC-条件6)=2.28分
3-gの調製と同様に、3-fと相当量のアミンを用いて追従実施例を調製した。
【0112】
【化49】

【0113】
【化50】

【0114】
実施例4:
【0115】
【化51】

【0116】
a) 4-aの調製:
【0117】
【化52】

【0118】
3-aの調製と同様に、100mg(0.18mmol)の3-fと29μl(0.18mmol)の4-アミノメチル-安息香酸メチルエステルから46.0mg(37%)の4-aを得た。
ES-MS(M+H)+=717
RT(HPLC-条件6)=2.66分
b) 4-bの調製:
【0119】
【化53】

【0120】
2mlのメタノール中の36mg(0.05mmol)の4-aを300μl(1.0mmol)の8% LiOHで処理し、室温で一晩撹拌した。混合物を4N HClで酸性にし、酢酸エチルで抽出し、乾燥させ、濃縮して13mg(37%)の4-bを得た。
ES-MS(M+H)+=703
RT(HPLC-条件4)=4.05分
実施例5:
【0121】
【化54】

【0122】
a) 5-aの調製:
【0123】
【化55】

【0124】
50mlの酢酸エチル中の1.9g(9.4mmol)の(R)-1-(4-ニトロ-フェニル)-エチルアミン-ハイドロクロライドを7.4g(32.8mmol)の塩化スズ(II)-二水和物で処理し、室温で一晩撹拌した。混合物をNH3で塩基性にしてろ過した。ろ液を水で抽出し、有機相を乾燥させ、濃縮して794mg(62%)の5-aを得た。
ES-MS(M+H)+=136
RT(HPLC-条件6)=1.37分
b) 5-bの調製:
【0125】
【化56】

【0126】
3-aの調製と同様に、125mg(0.18mmol)の3-fと24mg(0.18mmol)の5-aから4.0mg(3%)の5-bを得た。
ES-MS(M+H)+=688
RT(HPLC-条件6)=2.37分
実施例6:
【0127】
【化57】

【0128】
a) 6-aの調製:
【0129】
【化58】

【0130】
1.0g(4.5mmol)の(4-アミノ-ベンジル)-カルバミン酸-tert-ブチルエステルを30mlのジクロロメタンに溶かして363ml(4.5mmol)のピリジンを加えた。混合物を0℃に冷却して352μl(4.5mmol)の塩化メタンスルホニルをゆっくり添加した。反応を室温で一晩撹拌し、ろ過し、ろ液を濃縮した。残留物をクロマトグラフィー(Flashmaster, 20gカラム,シクロヘキサン/酢酸エチル 50:50→100:0)で精製して640mg(47%)の6-aを得た。
RT(HPLC-条件6)=2.71分
b) 6-bの調製:
【0131】
【化59】

【0132】
640mg(2.1mmol)の6-aをジクロロメタン/TFAの1:1混合物で処理し、混合物を室温で一晩撹拌し、濃縮して定量的に6-bを得た。
ES-MS(M+H)+=201
c) 6-cの調製:
【0133】
【化60】

【0134】
3-aの調製と同様に、100mg(0.18mmol)の3-fと42mg(0.18mmol)の6-bから29.0mg(22%)の6-cを得た。
ES-MS(M+H)+=752
RT(HPLC-条件6)=2.47分
実施例7:
【0135】
【化61】

【0136】
a) 7-aの調製:
【0137】
【化62】

【0138】
25mlのDMF中の6.0g(42.1mmol)の4-クロロ-ベンゼン-1,2-ジアミンと4.9ml(44.4mmol)の4-メチルモルフォリンの溶液に25mlのDMF中の4.5g(20.1mmol)のL-アラニンtert-ブチルエステル-ハイドロクロライドと3.6g(22.2mmol)のCDIの混合物を加えた。反応を室温で一晩撹拌し、濃縮し、ジクロロメタンと水で希釈した。不溶性固体をろ過し、ろ液のニ相を分離し、水相をジクロロメタンで2回抽出した。混ぜ合わせた有機相を乾燥させ、濃縮した。残留物をフラッシュカラム(シリカゲル,ジクロロメタン/エタノール 100:0→95:5)で精製して6.0g(86%)の褐色結晶7-aを得た。
ES(-)-MS(M-H)-=346/348 (クロロアイソトープ)
RF=0.35(シリカゲル,ジクロロメタン/エタノール 19:1)
b) 7-bの調製:
【0139】
【化63】

【0140】
6.0g(17.3mmol)の7-aを30mlの酢酸で処理し、室温で一晩撹拌した。混合物を濃縮し、残留物をフラッシュカラム(シリカゲル,ジクロロメタン/エタノール 100:0→98:2)で精製して5.0g(88%)の褐色結晶7-bを得た。
ES-MS (M+H)+ =330/332(クロロアイソトープ)
RF=0.40(シリカゲル,ジクロロメタン/エタノール 19:1)
c) 7-cの調製:
【0141】
【化64】

【0142】
5.0g(15.2mmol)の7-bを100mlのメタノールに溶かし、40mlのジクロロメタンと1.0gのPd/C(10%)を加えた。Parr装置内、室温及び3.4×105Pa(50psi)の水素圧で1時間混合物を水素化した。結晶をろ別し、ろ液を濃縮し、残留物をフラッシュカラム(シリカゲル,ジクロロメタン/エタノール/NH3 95:5:0.2)で精製して1.1g(36%)の黄色油7-cを得た。
ES-MS(M+H)+=196/198(クロロアイソトープ)
RF=0.37(シリカゲル,ジクロロメタン/エタノール/NH3 4:1:0.2)
d) 7-dの調製:
【0143】
【化65】

【0144】
3-aの調製と同様に、100mg(0.18mmol)の3-fと28mg(0.18mmol)の7-cから29.0mg(22%)の7-dを得た。
ES-MS(M+H)+=713
RT(HPLC-条件6)=2.58分
【0145】
実施例8:
【0146】
【化66】

【0147】
a) 8-aの調製:
【0148】
【化67】

【0149】
25.0g(0.2mol)の4-ホルミル-ベンゾニトリルを150mlのメタノールに溶かし、2gPd/C(10%)を加えた。Parr装置内、室温及び3.4×105Pa(50psi)の水素圧で7時間混合物を水素化した。結晶をろ別し、ろ液を濃縮し、ジエチルエーテルを添加して22.3g(87%)の8-aを結晶させた。
ES-MS(M+H)+=138
b) 8-bの調製:
【0150】
【化68】

【0151】
3-aの調製と同様に、100mg(0.18mmol)の3-fと24.1mg(0.18mmol)の8-aから36.0mg(21%)の8-bを得た。
ES-MS(M+H)+=689
RT(HPLC-条件6)=2.45分
【0152】
実施例9:
【0153】
【化69】

【0154】
a) 9-aの調製:
【0155】
【化70】

【0156】
3-aの調製と同様に、10.0g(49.2mmol)の(S)-2-tert-ブトキシカルボニルアミノ-酪酸と24.7ml(49.5mmol)のエチルアミンから定量的に9-aを得た。
ES-MS(M+H)+=231
RT(HPLC-条件4)=2.80分
b) 9-bの調製:
【0157】
【化71】

【0158】
11.3g(49.1mmol)の2-aを1,4-ジオキサン中25ml(100mmol)の4N HClで処理し、室温で一晩撹拌した。反応を濃縮して定量的に9-bを得た。
ES-MS(M+H)+=131
RT(HPLC-条件6)=2.38分
c) 2-cの調製:
【0159】
【化72】

【0160】
150mlのジクロロメタン中の3.0g(18.0mmol)の9-bと2.4g(19.0mmol)のDIPEAを室温で15分撹拌してから4.5g(18.0mmol)の((S)-1-ベンジル-2-オキソ-エチル)-カルバミン酸-tert-ブチルエステルを加え、混合物を0℃に冷却した。その後、3.0ml(50.0mmol)の酢酸と7.6g(36.0mmol)のナトリウムトリアセトキシボロヒドリドを加え、反応を室温で一晩撹拌した。混合物をNaHCO3溶液で希釈し、酢酸エチルで抽出した。有機相を濃縮して定量的に2-cを得た。
ES-MS(M+H)+=264
RT(HPLC-条件6)=1.91分
d) 9-dの調製:
【0161】
【化73】

【0162】
9-bの調製と同様に、2.0g(5.5mmol)の2-cから定量的に9-dを得た。
RT(HPLC-条件6)=1.91分
e) 9-eの調製:
【0163】
【化74】

【0164】
3-aの調製と同様に、100.0mg(0.27mmol)の3-dと82.5mg(0.27mmol)の9-dから17.0mg(10%)の9-eを得た。
ES-MS(M+H)+=611
RT(HPLC-条件5)=18.8分
【0165】
〔実施例A〕
医薬製剤の例:
a) 錠剤 1錠当たり
活性物質(実施例1) 50mg
ラクトース 170mg
トウモロコシデンプン 260mg
ポリビニルピロリドン 15mg
ステアリン酸マグネシウム 5mg
500mg
微細に粉砕した活性物質、ラクトース及び一部のトウモロコシデンプンを一緒に混合する。混合物を篩ってからポリビニルピロリドンの水溶液で湿らせ、混練し、湿式造粒して乾燥させる。この顆粒、残りのトウモロコシデンプン及びステアリン酸マグネシウムを篩って一緒に混合する。混合物を圧縮して適切な形状と大きさの錠剤を生成する。
【0166】
b) 錠剤 1錠当たり
活性物質(実施例1) 40mg
トウモロコシデンプン 210mg
ラクトース 65mg
微結晶性セルロース 40mg
ポリビニルピロリドン 20mg
ナトリウム-カルボキシメチルデンプン 23mg
ステアリン酸マグネシウム 2mg
400mg
微細に粉砕した活性物質、一部のトウモロコシデンプン、ラクトース、微結晶性セルロース及びポリビニルピロリドンを一緒に混合し、混合物を篩い、残りのトウモロコシデンプン及び水とこねて顆粒を形成し、乾燥させて篩う。ナトリウム−カルボキシメチルデンプンとステアリン酸マグネシウムを加えて混ぜ合わせ、混合物を圧縮して適切な大きさの錠剤を形成する。
【0167】
c) コーティング錠 1コーティング錠当たり
活性物質(実施例1) 5mg
トウモロコシデンプン 41.5mg
ラクトース 30mg
ポリビニルピロリドン 3mg
ステアリン酸マグネシウム 0.5mg
80mg
活性物質、トウモロコシデンプン、ラクトース及びポリビニルピロリドンを完全に混ぜ合わせて水で湿らせる。この湿練薬をメッシュサイズ1mmの篩いに押し通し、約45℃で乾燥させてから該顆粒を同じ篩いに通す。ステアリン酸マグネシウムを混ぜ入れた後、錠剤製造機で直径6mmの凸状の錠剤コアを打錠する。このようにして得た錠剤コアを公知の様式で本質的に糖とタルクから成る被覆材にてコーティングする。完成コーティング錠をワックスで磨く。
【0168】
d) カプセル剤 1カプセル剤当たり
活性物質(実施例1) 25mg
トウモロコシデンプン 283.5mg
ステアリン酸マグネシウム 1.5mg
310mg
活性物質とトウモロコシデンプンを混合し、水で湿らせる。この湿練薬を篩って乾燥させる。乾燥顆粒を篩い、ステアリン酸マグネシウムと混合する。完成混合物を1号サイズのゼラチンカプセルに詰める。
【0169】
e) アンプル溶液
活性物質(実施例1) 0.5mg
塩化ナトリウム 50mg
注射用水 5ml
活性物質をそれ自体のpH又は任意に5.5〜6.5のpHにて水に溶かし、塩化ナトリウムを加えて等張にする。得られた溶液を熱源なしでろ過し、ろ液を無菌条件下でアンプル中に移してから滅菌し、溶融封止する。アンプルは0.5mg、2.5mg及び5.0mgの活性物質を含む。
【0170】
f) 座剤
活性物質(実施例2) 30mg
固形脂肪 1670mg
1700mg
固形脂肪を融かす。粉砕した活性物質を40℃で均一に分散させる。これを38℃に冷却し、わずかに冷却した座剤型に注ぐ。
【0171】
本明細書では、用語“治療”は、本発明の化合物を疾患の少なくとも暫定診断でヒトに使用できることを意味する。本発明の化合物は、疾患の進行を遅延又は減速することによって、より有益な寿命を個体に与えるだろう。
用語“予防”は、投与時点ではおそらく疾患を有していると診断されていないが、一般的に該疾患を発症すると予測されるか又は該疾患のリスクが高いであろう患者に本発明の化合物を投与すると有用であることを意味する。本発明の化合物は、症状の発生を減速し、疾患の発症を遅延し、又は個体が該疾患を発症するのを多少なりとも予防するだろう。
予防は、年齢、家族歴、遺伝子若しくは染色体の異常のため、及び/又は該疾患の1若しくは2以上の生物学的マーカー、例えば脳組織若しくは脳液内におけるAPP若しくはAPP分解産物の既知の遺伝子突然変異の存在のため該疾患の素因があると考えられる当該個体への本発明の化合物の投与をも包含する。
本発明の化合物は治療的に有効な量で投与される。治療的に有効な量は、当業者には分かるように、使用する個々の化合物及び投与経路によって変わるだろう。
本発明の化合物を経口、非経口(IV、IM、デポ-IM、SQ、及びデポ-SQ)、舌下、鼻腔内、吸入で、くも膜下腔内、局所、又は直腸に投与することができる。当業者に既知の剤形が本発明の送達に適する。
治療的に有効な量の本発明の化合物を含む組成物が提供される。本化合物は、好ましくは経口投与用の錠剤、カプセル剤、若しくはエリキシル剤、又は非経口投与用の無菌溶液若しくは懸濁液、又は吸入投与用のエアロゾル等の適切な医薬製剤に調合される。典型的に、当業者に周知の技術と手順を用いて上記化合物を医薬組成物に調合される。
約1〜500mgの本発明の化合物若しくはその混合物又はその医薬的に許容しうる塩を、医薬的に許容しうるビヒクル、担体、賦形剤、結合剤、保存剤、安定剤、香料などと混ぜて、一般に認められている製薬プラクティスで必要とされる単位剤形にする。当該組成物又は製剤中の活性物質の量は、指示した範囲の適切な用量が得られるような量である。組成物は、好ましくは単位剤形で調合され、各用量は、約2〜約100mg、さらに好ましくは約10〜30mgの活性成分を含む。用語“単位剤形”は、ヒト対象及び他の動物の単位用量として好適な物理的に別個の単位を意味し、各単位は、所望の治療効果をもたらすように計算した所定量の活性物質を適切な医薬賦形剤と共に含有する。
本明細書で提供する化合物の投与に好適な医薬担体又はビヒクルには、当業者が個々の投与様式に適切であると分かっているいずれの担体も含まれる。さらに、活性物質を、所望作用を損なわない他の活性物質、或いは所望作用を補助し、又は別の作用を有する物質と混合することもできる。
組成物中に単独の医薬的活性物質として本化合物を調合してよく、或いは1又は2以上の異なる活性成分と併用してもよい。
化合物の濃度は、投与すると、該化合物を投与する目的の障害の少なくとも1つの症状を軽減又は改善する量の送達に有効な濃度である。典型的に、組成物は単用量投与用に調合される。
【0172】
本発明の化合物及び組成物を多用量容器又は単用量容器に封入することができる。本発明の化合物及び組成物をキット、例えば使用するために組み立てられる構成部品を含むキットで提供することができる。例えば、凍結乾燥形態の化合物インヒビターと、適切な希釈剤を使用前に組み合わせるように別個の構成要素として提供しうる。キットが化合物インヒビターと同時投与用の第二治療薬とを含むことができる。インヒビターと第二治療薬を別個の構成部品として提供してもよい。キットが複数の容器を含んでよく、各容器は、1又は2以上の単位用量の本発明の化合物を保持する。容器は、好ましくは所望の投与態様に適合させる。投与態様として、限定するものではないが、経口投与用の錠剤、ゲルカプセル剤、徐放カプセル剤等;非経口投与用のデポ製品、予充填注射器、アンプル、バイアル等;並びに局所投与用のパッチ、メディパッド(medipad)、クリーム等、及び吸入投与用の任意に予充填された吸入器が挙げられる。
医薬製剤中の活性化合物の濃度は、該活性化合物の吸収、不活性化、及び排泄、投与計画、並びに投与量のみならず当業者に周知の他の因子によって決まるだろう。
さらに、いずれかの個々の対象について、個体の必要性及び該組成物の投与を管理又は監督する人の専門的判断に従って経時的に特有の投与法を調整しなければならないこと、及び本明細書で述べた濃度範囲は単に例示であり、請求項の組成物の範囲又はプラクティスを限定する意図でないことを理解すべきである。
【0173】
経口投与が望ましい場合、胃の酸性環境から本化合物を保護する組成物で本化合物を提供すべきである。例えば、胃内でその統合性を維持し、腸内で活性化合物を放出する腸溶性コーティング剤中で組成物を調合することができる。抗酸又は他のこのような成分と組み合わせて組成物を調合してもよい。
経口用組成物は、一般的に不活性希釈剤又は食用担体を含み、圧縮して錠剤とし、又はゼラチンカプセルに封入される。経口治療的投与の目的では、活性化合物を賦形剤と共に組み入れて、錠剤、カプセル剤、ロゼンジ剤又はトローチ剤の形態で使用できる。
組成物の一部として医薬的に適合しうる結合剤及びアジュバント材を含めることができる。
錠剤、丸剤、カプセル剤、トローチ剤などは、以下のいずれの成分又は同じ性質の化合物をも含有しうる:限定するものではないが、トラガカントゴム、アカシアゴム、トウモロコシデンプン、又はゼラチン等の結合剤;微結晶性セルロース、デンプン、又はラクトース等の賦形剤;限定するものではないが、アルギニン酸及びトウモロコシデンプン等の崩壊剤;限定するものではないが、ステアリン酸マグネシウム等の潤沢剤;限定するものではないが、コロイド二酸化ケイ素などのギルダント(gildant);スクロース又はサッカリン等の甘味料;及びペパーミント、サリチル酸メチル、又は果実香味料などの調味料。
単位剤形がカプセル剤の場合、それは上記タイプの材料に加え、脂肪油などの液状担体を含むことができる。さらに、単位剤形は、その単位剤形の物理的形態を改変する種々の他の材料、例えば、糖及び他の腸溶性物質のコーティング剤を含むことができる。本化合物をエリキシル剤、懸濁剤、シロップ剤、ウェハース、チューインガム等の成分として投与することもできる。シロップ剤は、活性化合物に加え、甘味料としてのスクロース、並びに特定の保存剤、色素や着色剤、及び香料を含んでよい。
活性材料を、所望作用を損なわない他の活性材料、又は所望作用を補充する材料と混合することもできる。
このような製剤の調製方法は当業者に周知である。
【0174】
経口剤形は、1日に1、2、3、又は4回患者に投与される。1日3回以下、さらに好ましくは1日に1回又は2回本発明の化合物を投与することが好ましい。従って、経口剤形で本発明の化合物を投与することが好ましい。どんな経口剤形であっても、本発明の化合物を胃の酸性環境から保護するように設計することが好ましい。腸溶性コーティング錠は当業者に周知である。さらに、それぞれ酸性の胃から保護するためにコーティングした小球を充填したカプセル剤も当業者に周知である。
経口投与する場合、β-セクレターゼ活性を阻害するため、Aβ生産を阻害するため、Aβ沈着を阻害するため、又はADを治療若しくは予防するために治療的に有効な投与量は、約0.1mg/日〜約1,000mg/日である。好ましくは経口用量は約1mg/日〜約100mg/日である。さらに好ましくは経口用量は約5mg/日〜約50mg/日である。患者は、ある用量で開始しうるが、その用量は患者の状態と共に経時的に変化しうることが分かる。
【0175】
ここで、本発明は本発明の新規化合物及び本発明の化合物の新規使用方法である。本発明の特定化合物と所望剤形を考慮すれば、当業者は、その適切な剤形を調製かつ投与する方法が分かるだろう。
本発明の化合物は、上述したのと同じ様式で、同じ投与経路により、同じ医薬剤形を用いて、かつ同じ投与計画で、MCI(軽度認知障害)の疾患を予防するか又は該患者を治療するため及びMCIからADに進行するであろう当該患者におけるアルツハイマー病の発症を予防又は遅延するため、ダウン症候群を治療又は予防するため、オランダ型アミロイド症のある遺伝性脳溢血を有するヒトを治療するため、脳アミロイド血管症を治療し、その潜在的結果、すなわち単回及び反復性皮質下出血を予防するため、血管と変性の入り混じった原因の痴呆症、パーキンソン病関連痴呆症、進行性核上麻痺関連痴呆症、皮質基底変性関連痴呆症、及びびまん性レビー小体型ADといった他の変性痴呆症を治療するために使用される。
本発明の化合物を相互に併用し、或いは上記状態を治療又は予防するために使用される他の治療薬又はアプローチと併用することができる。このような薬剤又はアプローチとして、β-セクレターゼインヒビター;γ-セクレターゼインヒビター;アミロイド凝集インヒビター(例えば、アルゼメド(Alzhemed));直接又は間接的に作用する神経保護化合物;抗-酸化剤、例えばビタミンE及びギンコリド;抗-炎症薬、例えばCox-インヒビター又はNSAIDs;HMG-CoAレダクターゼインヒビター(スタチン);アセチルコリン-エステラーゼインヒビター、例えばドネペジル、リバスチグミン、タクリン、ガランタミン;NMDA受容体アンタゴニスト(例えばメマンチン);AMPAアゴニスト;神経伝達物質の放出又は濃度を調節する化合物(例えばNS-2330);成長ホルモンの放出を誘導する化合物(例えばイブタモレンメシラート(ibutamoren mesylate)及びカプロモレリン(capromorelin));CB-1受容体アンタゴニスト又はインバースアゴニスト;ミノサイクリン又はリファンピシンのような抗生物質;PDE-IV及びPDE-IXインヒビター;GABAAインバースアゴニスト;ニコチンアゴニスト;ヒスタミンH3アンタゴニスト、5HT-4アゴニスト又は部分アゴニスト;5HT-6アンタゴニスト;a2-アドレノレセプターアンタゴニスト;ムスカリン性M1アゴニスト;ムスカリン性M2アンタゴニスト;代謝調節型グルタミン酸-受容体5ポジティブモジュレーター;及び本発明の化合物の効力及び/又は安全性が上昇するか又は副作用が低減するように、受容体又は酵素を調節する化合物が挙げられる。
1又は2以上の本発明の化合物と、アルゼメド、ビタミンE、ギンコリド、ドネペジル、リバスチグミン、タクリン、ガランタミン、メマンチン、NS-2330、イブタモレンメシラート、カプロモレリン、ミノサイクリン及びリファンピシンから成る群より選択される1又は2以上の追加活性成分とを含む、該組合せが好ましい。
本発明の組合せでは、本発明の化合物と上記組合せ相手を別々(例えば、キットの部品)に投与してよく、或いは一緒に1つの医薬組成物(例えばカプセル剤又は錠剤)で投与してもよい。さらに、本発明の組合せの一要素の投与は該組合せの他要素の投与の前、投与と同時、又は投与後でよい。本発明の化合物とその1又は2以上の追加活性成分が別個の製剤中に存在する場合、これら別個の製剤を同時又は逐次的に投与してよい。
上記疾患及び状態の治療又は予防のため、本発明の化合物を免疫学的アプローチ、例えば、Aβペプチド若しくはその誘導体による免疫化又は抗-Aβペプチド抗体の投与などと併用することができる。
【0176】
当業者には、この技術に熟練した投薬医師に周知なように、投与の正確な用量と頻度は、投与される本発明の個々の化合物、治療される個々の状態、治療される状態の重症度、個々の患者の年齢、体重、全身の健康状態、及び該個体が取ってよい他の医薬によって決まることが明白だろう。
上記組合せ相手の用量範囲は、それぞれ該化合物を単独で使用したときに所望の治療効果を引き起こすために必要な臨床的に有効な量の約1/5〜1倍である。
従って、本発明のさらなる目的は、本発明の化合物の、β-セクレターゼの阻害によって改変できる疾患及び状態の治療又は予防用医薬の製造のため少なくとも1種の追加活性成分と組み合わせた使用に関する。
本発明のさらなる目的は、本発明の化合物と、少なくとも1種の追加活性成分とを含んでなる医薬である。
本発明の化合物は、APP695イソ型、若しくはその変異体に数えられるMet595とAsp596との間のAPP、又はAPP751若しくはAPP770のような異なるイソ型、又はその変異体の対応部位(“βセクレターゼ部位”と呼ばれることもある)における切断を阻害する。特定の理論に拘泥されたくないが、β-セクレターゼ活性の阻害がβアミロイドペプチド(Aβ)の生産を阻害すると考えられる。阻害活性は、β-セクレターゼ酵素の存在下でのAPP基質の切断を、該阻害化合物の存在下、β-セクレターゼ切断部位での切断を引き起こすのに一般的に十分な条件下で分析する種々の阻害アッセイの1つで実証される。未処理又は不活性コントロールと比較したβ-セクレターゼ切断部位におけるAPP切断の減少が阻害活性と関係する。本発明の化合物インヒビターの効力を実証するために使用しうるアッセイシステムは既知である。代表的なアッセイシステムは例えば米国特許第5,942,400号、第5,744,346号、及び以下の実施例に記載されている。
天然、変異及び/又は合成APP基質と、天然、変異、及び/又は合成酵素と、試験化合物とを用いて、β-セクレターゼの酵素活性とAβの生産をin vitro又はin vivo分析することができる。この分析は、天然、変異、及び/又は合成APPと酵素を発現する一次又は二次細胞、天然のAPPと酵素を発現する動物モデルを含むことができ、或いは該基質と酵素を発現するトランスジェニック動物モデル及び非トランスジェニック動物モデルを利用することもできる。酵素活性の検出は、例えば、イムノアッセイ、蛍光定量的若しくは色素生産性アッセイ、HPLC、又は他の検出手段による1又は2以上の切断産物の分析によってでよい。阻害化合物の非存在下で反応系内のβ-セクレターゼ媒介切断が観察かつ測定されるコントロールに比し、生産されるβ-セクレターゼ切断産物の量を減らす能力を有する化合物として阻害化合物を定量する。
種々の形態のβ-セクレターゼ酵素が知られており、酵素活性及び酵素活性の阻害のアッセイに有効かつ有用である。これには酵素の天然、組換え、及び合成形態が含まれる。ヒトβ-セクレターゼはβ部位APP切断酵素(Beta Site APP Cleaving Enzyme)(BACE)、Asp2、及びメマプシン2として知られ、例えば、米国特許第5,744,346号及び公開PCT特許出願W098/22597、WO00/03819、WO01/23533、及びWO00/17369、並びに発行文献(Hussain et. al., 1999, Mol. Cell. Neurosci. 14: 419-427; Vassar et. al., 1999, Science 286 : 735-741; Yan et. al., 1999, Nature 402: 533-537; Sinha et. al., 1999, Nature40: 537-540;及びLin et. al., 2000, PNAS USA 97 : 1456-1460)で特徴づけられている。該酵素の合成形も開示されている(W098/22597及びWO00/17369)。ヒト脳組織からβ-セクレターゼを抽出かつ精製することができ、また、細胞、例えば、組換え酵素を発現する哺乳動物細胞内で生産することができる。
【0177】
〔BACEのin vitro活性の定量〕
種々のアッセイ技術でBACEの活性を分析できるが、すべて適切な緩衝液内で、触媒的に活性な形態のBACEを可能性のある基質とインキュベートする。基質の性質によって決まる種々の方法を適用して、基質濃度の低減又は産物濃度の上昇をモニターできる。この方法として、限定するものではないが、HPLC-MS分析、蛍光アッセイ、蛍光クエンチングアッセイが挙げられる。基質は、選択した検出システムに適した色素と接合しうるか又はタンパク質基質に伸長しうるBACEで加水分解できるアミノ酸を含有するペプチドでよい。酵素源として、全長BACE酵素のみならず、該タンパク質の触媒的に活性な外部ドメインも使用できる。試験化合物とBACE結合化合物の競合に基づいた代替アッセイ形式を使用できる。
IC50決定のため、アッセイでは種々濃度の化合物をインキュベートする。化合物を加えないコントロールウェルにおける酵素反応シグナルと比較して検出されるシグナルの50%減少を示した化合物の濃度を計算することによって相対的な化合物阻害効力を決定する。
有用な阻害化合物は、50μモル未満の濃度、好ましくは10μモル以下の濃度、さらに好ましくは1μモル以下、最も好ましくは10ナノモル以下の濃度でβ-セクレターゼ酵素活性の50%を阻害する効力がある。
本発明の化合物のin vitroのBACE阻害プロフィールを得るため、実施例で概要を述べるようなアッセイで本発明の化合物を試験することができる。
【0178】
実施例BACEアッセイ:
試験する各化合物について、酵素源として、myc-his標識に融合され、かつHEK293/APP/BACEect.細胞からOptiMETM(Invitrogen)中に分泌されたBACE(aa 1-454)の外部ドメインを用いて蛍光クエンチングアッセイでBACE活性をモニターする。使用する基質ペプチドは、アミノ酸配列SEVNLDAEFKを有し、かつN-末端にCy3-発蛍光団及びC-末端にCy5Q-クエンチャー(Amersham)を有する。この基質を1mg/mlでDMSOに溶かす。
96ウェルプレート内で、BACEの外部ドメインを含む10μlのOptiMEM、所望濃度の化合物と最大濃度1%のDMSOを含む100μlの水、1μMの基質ペプチド、及び20mMのNaOAcの存在下(pH 4.4、全アッセイ体積200μl)でアッセイを行う。蛍光光度計内で反応を30℃にてインキュベートし、基質の切断を30分間の動力学として記録する(ex:530nm、em:590nm)。
緩衝液の調製又は化合物の希釈に用いる水は最高純度の水である。インヒビター又は酵素を含まないブランクウェルが各プレートに含まれる。
実施例1〜58として例示した式(I)の化合物は20μモル濃度未満のIC50値を示す。
【0179】
〔Aβ分泌アッセイ〕
種々の起源の細胞系でAβの分泌をモニターすることができる。代表的セットの該細胞として、限定するものではないが、APP又はAPPの変異形(限定するものではないが、スウェーデン又はロンドン/インディアナ突然変異が挙げられる)で安定的又は一時的にトランスフェクトされた、ヒト胎児腎臓293細胞(HEK293)、チャイニーズハムスター卵巣細胞(CHO)、ヒトH4神経膠腫(neuroglimoa)細胞、ヒトU373-MG星細胞種神経膠芽腫(astrocytoma glioblastoma)細胞、マウス神経芽細胞腫N2a細胞が挙げられる。例えば、問題のヒトAPP cDNAを含有するpcDNA3プラスミド(Invitrogen)を、Lipofectamine(Invitrogen)のようなトランスフェクション試薬を用いて製造業者の説明書に従って導入することによって細胞のトランスフェクションを達成することができる。
遺伝子修飾せずに十分な量のAβを産生する細胞から、又は高感度のAβ検出アッセイを用いて、日常的な基礎に基づいてAβの分泌を分析することもできる。この種の分析に好適な細胞として、限定するものではないが、ヒトIMR-32神経芽細胞腫細胞が挙げられる。
例えばHsiaoら(Hsiao et al 1996 Science 274: 99-102)によって記載されているマウスのようなAPPトランスジェニックマウス由来の胎仔又は新生子孫から得られる脳誘導細胞からAβの分泌を分析することもできる。さらに、ラット又はモルモット等の他の生物由来の脳誘導細胞も使用しうる。
有用な阻害化合物は、これらの細胞アッセイにおいて50μモル未満の濃度、好ましくは10μモル以下の濃度、さらに好ましくは1μモル以下、最も好ましくは10ナノモル以下の濃度でβ-セクレターゼ酵素活性の50%を阻害する効力がある。
【0180】
〔実施例Aβ分泌アッセイ〕
以下、CMVプロモーターの制御下でAPP751を安定して発現するU373-MG細胞からのAβの定量の手順を与える。
DMEM+グルコース、ピルビン酸ナトリウム、グルタミン、ピリドキシン-HCl、及び10% FCSのような培養基内で細胞を維持することができる。細胞を5%のCO2の水飽和環境内37℃にてインキュベーター内で細胞を保持する。化合物をアッセイするため、コンフルエントな細胞層を50μM〜50pMの範囲の濃度の化合物(最初DMSOに溶かし、アッセイのために150μlの上記培養基で希釈)と12〜24時間インキュベートする。この時間中、化合物の存在下と非存在下のAβの生産をAβ40とAβ42に特異的なサンドイッチELISAでモニターする。抗体6E10(Senetek)及びSGY3160(C. Eckman, Mayo Clinic, Jacksonville, Florida)を捕獲抗体として用いてプレートに固定化する。Aβ含有細胞培養の上清を添加する前にBlock Ace(Serotec)で非特異的なタンパク質の結合を遮断する。Aβ40及びAβ42に特異的な検出抗体(Nanotools, Germany)を、基質CSPD/Sapphire II(Applied Biosystems)を用いて、製造業者の説明書に従って、活性が数量化されているアルカリ性ホスファターゼと結合させる。
非特異的毒性関連メカニズムによって誘導されるAβレベルの変化における該化合物の潜在的な効果は、60分後のAlamarBlue(Resazurin)の還元によって取り扱われる。
化合物を加えないコントロールウェルの細胞と比べて検出シグナルの50%の減少を示した化合物の濃度を計算することによって、無毒化合物の効力を決定する。
実施例1〜58として例示した式(I)の化合物は10μモル濃度未満のIC50値を示す。
上述したように、種々の動物モデルを用いてβ-セクレターゼ活性及び/又はAβを放出するためのAPPのプロセシングを分析することができる。例えば、APP基質とβ-セクレターゼ酵素を発現するトランスジェニック動物を用いて本発明の化合物の阻害活性を実証することができる。特定のトランスジェニック動物モデルは、例えば米国特許第5,877,399号;第5,612,486号;第5,387,742号;第5,720,936号;第5,850,003号;第5,877,015号;及び第5,811,633号並びにGames et. al., 1995, Nature 373: 523に開示されている。ADの病態生理学に関連する特徴を示す動物が好ましい。本明細書で述べた本発明の化合物インヒビターのトランスジェニックマウスへの投与は、本化合物の阻害活性を実証する代替法を提供する。医薬的に有効な担体中、かつ妥当な治療量で標的組織に到達する投与経路によって本化合物を投与することも好ましい。
【特許請求の範囲】
【請求項1】
下記式(I)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【化1】

(式中、
R1は、
a) C1-4-アルキル-又はC3-6-シクロアルキル-基
(ここで、該C1-4-アルキル-基の1個の非末端メチレン基は、任意に窒素又は酸素原子と置き換わっていてもよく、かつ
該C1-4-アルキル-又はC3-6-シクロアルキル-基は、HO-CO-、HO-PO2-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されている)、
b) アリール-基、
(ここで、該アリール-基は任意に、ハロゲン、C1-3-アルキル-、HO-、HO-CO-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、又は
c) ヘテロアリール-基
(ここで、該ヘテロアリール-基は任意に、ハロゲン、C1-3-アルキル-、HO-、HO-CO-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R2は、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-5-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-5-アルキル-、アリール-、アリール-C1-5-アルキル-、ヘテロアリール-、ヘテロアリール-C1-5-アルキル-、C3-8-シクロアルキル-C2-5-アルケニル-、ヘテロサイクリル-C2-5-アルケニル-、アリール-C2-5-アルケニル-、ヘテロアリール-C2-5-アルケニル-、C3-8-シクロアルキル-C2-5-アルキニル-、ヘテロサイクリル-C2-5-アルキニル-、アリール-C2-5-アルキニル-又はヘテロアリール-C2-5-アルキニル-基を表し
(前記各基は、C1-3-アルキル-、HO-C1-3-アルキル-、HO-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-、C1-3-アルキル-O-CO-C1-3-アルキル-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ホルミル-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-、(R8)2N-C1-3-アルキル-、(R8)2N-CO-、(R8)2N-CO-C1-3-アルキル-、C1-3-アルキル-CO-N(R8)-、(R8)2N-SO2-、C1-3-アルキル-SO2-及びC1-3-アルキル-SO2-N(R8)-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-、C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R4は、水素、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-又はC3-8-シクロアルキル-C1-3-アルキル-基を表し
(前記各基は、任意に1又は2以上のフッ素原子で置換されていてもよい)、
R5は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-、C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R6は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-、C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R7は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R8は、それぞれ相互独立に水素、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-3-アルキル-、アリール-、アリール-C1-3-アルキル-、ヘテロアリール-、ヘテロアリール-C1-3-アルキル-、C3-8シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表す
(前記各基は、任意に、C1-3-アルキル-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ヒドロキシ-、ニトロ-、シアノ-、H2N-及びH2N-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)。)
【請求項2】
式(I)中、
R1が、
a) C1-4-アルキル-基
(ここで、前記C1-4-アルキル-は、HO-CO-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されている)、
b) アリール-基
(任意に、フルオロ、HO-及びHO-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、又は
c) ヘテロアリール-基
(任意に、フルオロ、クロロ、Me、HO-及びHO-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R2がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-5-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-5-アルキル-、アリール-、アリール-C1-5-アルキル-、ヘテロアリール-又はヘテロアリール-C1-5-アルキル-基を表し
(前記各基は、C1-3-アルキル-、HO-C1-3-アルキル-、HO-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ホルミル-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-、(R8)2N-C1-3-アルキル-、(R8)2N-CO-、(R8)2N-CO-C1-3-アルキル-、C1-3-アルキル-CO-N(R8)-、(R8)2N-SO2-、C1-3-アルキル-SO2-及びC1-3-アルキル-SO2-N(R8)-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R4が水素、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-又はC3-8-シクロアルキル-C1-3-アルキル-基を表し
(前記各基は、任意に1又は2以上のフッ素原子で置換されていてもよい)、
R5がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R6がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R7がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R8がそれぞれ相互独立に水素、C1-6-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-3-アルキル-、アリール-、アリール-C1-3-アルキル-、ヘテロアリール-又はヘテロアリール-C1-3-アルキル-基を表す
(前記各基は、任意に、C1-3-アルキル-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ヒドロキシ-、ニトロ-、シアノ-、H2N-及びH2N-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
請求項1に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項3】
式(I)中、
R1が、
a) HO-CO-(CH2)n-又はHO-SO2-(CH2)n-基(ここで、nは1、2、3又は4である)、又は
b) キノリニルN-オキシド、イソキノリニルN-オキシド、ピリジン-2-イルN-オキシド、ピリジン-3-イルN-オキシド、ピリジン-4-イルN-オキシド、又は
c) フェニル基
(ここで、前記フェニル基は、任意に、ハロゲン及びヒドロキシ-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R8がそれぞれ相互独立に水素又はC1-6-アルキル-基を表す
(ここで、前記C1-6-アルキル-基は、任意に、C1-3-アルキル-O-、ハロゲン、カルボキシ-、ヒドロキシ-、ニトロ-、シアノ-及びH2N-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
請求項1又は2に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項4】
式(I)中、
R1が、
a) HO-CO-(CH2)n-基(ここで、nは1、2、3又は4である)、
b) ピリジン-2-イルN-オキシド、ピリジン-3-イルN-オキシド、ピリジン-4-イルN-オキシド、又は
c) フェニル基
(ここで、前記フェニル基は、任意に、ハロゲン及びヒドロキシから成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R8がそれぞれ相互独立に水素又はC1-6-アルキル-基を表す
(ここで、前記C1-6-アルキル-基は、任意に、C1-3-アルキル-O-及びフルオロから成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
請求項1又は2に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項5】
式(I)中、
R1がHO-CO-(CH2)3-、ピリジン-2-イルN-オキシド、ピリジン-3-イルN-オキシド、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、
R8がそれぞれ相互独立に水素又はC1-6-アルキル-基を表す、
請求項1又は2に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項6】
式(I)中、
R1がHO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、
R8がそれぞれ相互独立に水素又はC1-3-アルキル-基を表す、
請求項1又は2に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項7】
式(I)中、
R2がC1-5-アルキル-、C2-5-アルケニル-、C2-5-アルキニル-、C3-6-シクロアルキル-C1-5-アルキル-、フェニル-C1-5-アルキル-又はヘテロアリール-C1-5-アルキル-基を表し
(ここで、前記C1-5-アルキル-基は、任意に1又は2以上のフッ素原子で置換されていてもよく、かつ
前記フェニル基は、任意に、C1-3-アルキル-、ニトロ-、ハロゲン、ヒドロキシ-、カルボキシ-、(R8)2N-、(R8)2N-C1-3-アルキル-、(R8)2N-CO-C1-3-アルキル-、C1-3-アルキル-CO-N(R8)-、C1-3-アルキル-SO2-、(R8)2N-CO-、HO-C1-3-アルキル-、HO-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-及びC1-3-アルキル-SO2-N(R8)-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル-、フェニル-C1-4-アルキル-C3-6-シクロアルキル-C1-3-アルキル、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R4が水素又はC1-4-アルキル-基を表し
(任意に、1又は2以上のフッ素原子で置換されていてもよい)、
R5がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル-、フェニル-C1-4-アルキル-、C3-6-シクロアルキル-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R6がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル- 、フェニル-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル、C3-6-シクロアルキル-C1-3-アルキル、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R7がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル-、フェニル-C1-4-アルキル-基、C3-6-シクロアルキル-C1-3-アルキル、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表す
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-基から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
請求項1〜6のいずれか1項に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項8】
式(I)中、
R2がC1-3-アルキル-、C3-6-シクロアルキル-C1-3-アルキル-、フェニル-C1-3-アルキル-又はピリジル-C1-3-アルキル-基を表し
(ここで、前記C1-3-アルキル-基は、任意に1又は2以上のフッ素原子で置換されていてもよく、かつ
前記フェニル基は、任意に、C1-3-アルキル-、ニトロ-、ヒドロキシ-、カルボキシ-、H2N-、H2N-CH2-、H2N-CO-CH2-、Me-CO-NH-、Me-SO2-、H2N-CO-、HO-CH2-、HOCO-CH2-、Me-OCO-CH2-、Me-OCO-、及びMe-SO2-NH-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3がC1-5-アルキル-基を表し、
R4が水素を表し、
R5がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R6がC1-4-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R7がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表す
(ここで、前記アルキル-基は、任意に、カルボキシ-、ヒドロキシ-、H2N-及びH2N-CO-基から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
請求項1〜6のいずれか1項に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項9】
式(I)中、
R2がエチル-、n-プロピル-若しくは2-メチルプロピル-基、又は下記置換基から成る群より選択される置換基を表し、
【化2】

R3がC1-5-アルキル-基を表し、
R4が水素を表し、
R5がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R6がC1-4-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R7がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表す
(ここで、前記アルキル-基は、任意に、カルボキシ-、ヒドロキシ-、H2N-及びH2N-CO-基から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
請求項1〜6のいずれか1項に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項10】
式(I)中、
R2がエチル-、n-プロピル-若しくは2-メチルプロピル-基、又は下記置換基から成る群より選択される置換基を表し、
【化3】

R3が下記置換基から成る群より選択される置換基を表し、
【化4】

R4が水素を表し、
R5が下記置換基から成る群より選択される置換基を表し、
【化5】

R6が下記置換基から成る群より選択される置換基を表し、
【化6】

R7がメチル-、エチル-、n-プロピル-若しくはn-ブチル-基、又は下記置換基から成る群より選択される置換基を表す、
【化7】

請求項1〜6のいずれか1項に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項11】
下記式(Ia)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【化8】

(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、請求項1〜10のいずれか1項の定義どおりである。)
【請求項12】
下記式(Ib)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【化9】

(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、請求項1〜10のいずれか1項の定義どおりである。)
【請求項13】
下記式(Ic)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【化10】

(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R6、R7及びR8は、請求項1〜10のいずれか1項の定義どおりである。)
【請求項14】
下記式(Id)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【化11】

(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R4、R5、R6、R7及びR8は、請求項1〜10のいずれか1項の定義どおりである。)
【請求項15】
下記式(Ie)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【化12】

(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R6及びR8は、請求項1〜10のいずれか1項の定義どおりである。)
【請求項16】
下記式(If)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【化13】

(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R6及びR8は、請求項1〜10のいずれか1項の定義どおりである。)
【請求項17】
医薬としての請求項1〜16のいずれか1項に記載の化合物又はその医薬的に許容しうる塩若しくは溶媒和物。
【請求項18】
医薬としての請求項1〜17のいずれか1項に記載の化合物又はその医薬的に許容しうる塩若しくは溶媒和物と、医薬的に許容しうる担体又は希釈剤とを含む医薬組成物。
【請求項19】
β-セクレターゼインヒビター;γ-セクレターゼインヒビター;アミロイド凝集インヒビター;直接又は間接的に作用する神経保護化合物;抗-酸化剤;抗-炎症薬;HMG-CoAレダクターゼインヒビター;アセチルコリン-エステラーゼインヒビター;NMDA受容体アンタゴニスト;AMPAアゴニスト;神経伝達物質の放出又は濃度を調節する化合物;成長ホルモンの放出を誘導する化合物;CB-1受容体アンタゴニスト又はインバースアゴニスト;抗生物質;PDE-IV及びPDE-IXインヒビター、GABAAインバースアゴニスト;ニコチンアゴニスト;ヒスタミンH3アンタゴニスト;5HT-4アゴニスト又は部分アゴニスト;5HT-6アンタゴニスト;a2-アドレノレセプターアンタゴニスト;ムスカリン性M1アゴニスト;ムスカリン性M2アンタゴニスト;代謝調節型グルタミン酸-受容体5ポジティブモジュレーターから成る群より選択される1又は2以上の追加活性成分を含む請求項18に記載の医薬組成物。
【請求項20】
アルゼメド、ビタミンE、ギンコリド、ドネペジル、リバスチグミン、タクリン、ガランタミン、メマンチン、NS-2330、イブタモレンメシラート、カプロモレリン、ミノサイクリン及びリファンピシンから成る群より選択される1又は2以上の追加薬剤を含む、請求項18又は19に記載の医薬組成物。
【請求項21】
請求項1〜17のいずれか1項に記載の式(I)、(Ia)、(Ib)、(Ic)、(Id)、(Ie)若しくは(If)の化合物又はその医薬的に許容しうる塩若しくは溶媒和物、又は請求項18〜21のいずれか1項に記載の医薬組成物の、β-セクレターゼの阻害によって改変できる疾患及び状態の治療又は予防用薬物の製造における使用。
【請求項22】
請求項1〜17のいずれか1項に記載の式(I)、(Ia)、(Ib)、(Ic)、(Id)、(Ie)若しくは(If)の化合物又はその医薬的に許容しうる塩若しくは溶媒和物、又は請求項18〜21のいずれか1項に記載の医薬組成物の、アルツハイマー病、びまん性レビー小体型アルツハイマー病、ダウン症候群、MCI(“軽度認知障害”)、オランダ型アミロイド症のある遺伝性脳溢血、脳アミロイド血管症、外傷性脳損傷、痴呆症、パーキンソン症候群、膵臓炎、封入体筋炎(IBM)又は中枢神経性若しくは末梢神経性アミロイド症から選択される疾患又は状態を有する患者を治療する際、或いは患者が前記疾患又は状態になるのを予防す際に使うための薬物の製造における使用。
【請求項23】
β-セクレターゼ活性の阻害方法であって、前記β-セクレターゼを有効な阻害量の請求項1〜17のいずれか1項に記載の式(I)、(Ia)、(Ib)、(Ic)、(Id)、(Ie)又は(If)の化合物にさらす工程を含む方法。
【請求項1】
下記式(I)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【化1】

(式中、
R1は、
a) C1-4-アルキル-又はC3-6-シクロアルキル-基
(ここで、該C1-4-アルキル-基の1個の非末端メチレン基は、任意に窒素又は酸素原子と置き換わっていてもよく、かつ
該C1-4-アルキル-又はC3-6-シクロアルキル-基は、HO-CO-、HO-PO2-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されている)、
b) アリール-基、
(ここで、該アリール-基は任意に、ハロゲン、C1-3-アルキル-、HO-、HO-CO-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、又は
c) ヘテロアリール-基
(ここで、該ヘテロアリール-基は任意に、ハロゲン、C1-3-アルキル-、HO-、HO-CO-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R2は、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-5-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-5-アルキル-、アリール-、アリール-C1-5-アルキル-、ヘテロアリール-、ヘテロアリール-C1-5-アルキル-、C3-8-シクロアルキル-C2-5-アルケニル-、ヘテロサイクリル-C2-5-アルケニル-、アリール-C2-5-アルケニル-、ヘテロアリール-C2-5-アルケニル-、C3-8-シクロアルキル-C2-5-アルキニル-、ヘテロサイクリル-C2-5-アルキニル-、アリール-C2-5-アルキニル-又はヘテロアリール-C2-5-アルキニル-基を表し
(前記各基は、C1-3-アルキル-、HO-C1-3-アルキル-、HO-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-、C1-3-アルキル-O-CO-C1-3-アルキル-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ホルミル-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-、(R8)2N-C1-3-アルキル-、(R8)2N-CO-、(R8)2N-CO-C1-3-アルキル-、C1-3-アルキル-CO-N(R8)-、(R8)2N-SO2-、C1-3-アルキル-SO2-及びC1-3-アルキル-SO2-N(R8)-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-、C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R4は、水素、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-又はC3-8-シクロアルキル-C1-3-アルキル-基を表し
(前記各基は、任意に1又は2以上のフッ素原子で置換されていてもよい)、
R5は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-、C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R6は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-、C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R7は、C1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル-C3-8-シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R8は、それぞれ相互独立に水素、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-3-アルキル-、アリール-、アリール-C1-3-アルキル-、ヘテロアリール-、ヘテロアリール-C1-3-アルキル-、C3-8シクロアルキル-C2-3-アルケニル-、ヘテロサイクリル-C2-3-アルケニル-、アリール-C2-3-アルケニル-、ヘテロアリール-C2-3-アルケニル-、C3-8-シクロアルキル-C2-3-アルキニル-、ヘテロサイクリル-C2-3-アルキニル-、アリール-C2-3-アルキニル-又はヘテロアリール-C2-3-アルキニル-基を表す
(前記各基は、任意に、C1-3-アルキル-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ヒドロキシ-、ニトロ-、シアノ-、H2N-及びH2N-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)。)
【請求項2】
式(I)中、
R1が、
a) C1-4-アルキル-基
(ここで、前記C1-4-アルキル-は、HO-CO-及びHO-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されている)、
b) アリール-基
(任意に、フルオロ、HO-及びHO-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、又は
c) ヘテロアリール-基
(任意に、フルオロ、クロロ、Me、HO-及びHO-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R2がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-5-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-5-アルキル-、アリール-、アリール-C1-5-アルキル-、ヘテロアリール-又はヘテロアリール-C1-5-アルキル-基を表し
(前記各基は、C1-3-アルキル-、HO-C1-3-アルキル-、HO-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ホルミル-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-、(R8)2N-C1-3-アルキル-、(R8)2N-CO-、(R8)2N-CO-C1-3-アルキル-、C1-3-アルキル-CO-N(R8)-、(R8)2N-SO2-、C1-3-アルキル-SO2-及びC1-3-アルキル-SO2-N(R8)-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R4が水素、C1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-又はC3-8-シクロアルキル-C1-3-アルキル-基を表し
(前記各基は、任意に1又は2以上のフッ素原子で置換されていてもよい)、
R5がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R6がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R7がC1-8-アルキル-、C2-8-アルケニル-、C2-8-アルキニル-、C1-8-アルキル-O-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、アリール-、アリール-C1-4-アルキル-又はヘテロアリール-C1-3-アルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、(R8)2N-及び(R8)2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R8がそれぞれ相互独立に水素、C1-6-アルキル-、C3-8-シクロアルキル-、C3-8-シクロアルキル-C1-3-アルキル-、ヘテロサイクリル-、ヘテロサイクリル-C1-3-アルキル-、アリール-、アリール-C1-3-アルキル-、ヘテロアリール-又はヘテロアリール-C1-3-アルキル-基を表す
(前記各基は、任意に、C1-3-アルキル-、C1-3-アルキル-O-、ハロゲン-、カルボキシ-、ヒドロキシ-、ニトロ-、シアノ-、H2N-及びH2N-SO2-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
請求項1に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項3】
式(I)中、
R1が、
a) HO-CO-(CH2)n-又はHO-SO2-(CH2)n-基(ここで、nは1、2、3又は4である)、又は
b) キノリニルN-オキシド、イソキノリニルN-オキシド、ピリジン-2-イルN-オキシド、ピリジン-3-イルN-オキシド、ピリジン-4-イルN-オキシド、又は
c) フェニル基
(ここで、前記フェニル基は、任意に、ハロゲン及びヒドロキシ-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R8がそれぞれ相互独立に水素又はC1-6-アルキル-基を表す
(ここで、前記C1-6-アルキル-基は、任意に、C1-3-アルキル-O-、ハロゲン、カルボキシ-、ヒドロキシ-、ニトロ-、シアノ-及びH2N-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
請求項1又は2に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項4】
式(I)中、
R1が、
a) HO-CO-(CH2)n-基(ここで、nは1、2、3又は4である)、
b) ピリジン-2-イルN-オキシド、ピリジン-3-イルN-オキシド、ピリジン-4-イルN-オキシド、又は
c) フェニル基
(ここで、前記フェニル基は、任意に、ハロゲン及びヒドロキシから成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)
を表し、
R8がそれぞれ相互独立に水素又はC1-6-アルキル-基を表す
(ここで、前記C1-6-アルキル-基は、任意に、C1-3-アルキル-O-及びフルオロから成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
請求項1又は2に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項5】
式(I)中、
R1がHO-CO-(CH2)3-、ピリジン-2-イルN-オキシド、ピリジン-3-イルN-オキシド、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、
R8がそれぞれ相互独立に水素又はC1-6-アルキル-基を表す、
請求項1又は2に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項6】
式(I)中、
R1がHO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、
R8がそれぞれ相互独立に水素又はC1-3-アルキル-基を表す、
請求項1又は2に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項7】
式(I)中、
R2がC1-5-アルキル-、C2-5-アルケニル-、C2-5-アルキニル-、C3-6-シクロアルキル-C1-5-アルキル-、フェニル-C1-5-アルキル-又はヘテロアリール-C1-5-アルキル-基を表し
(ここで、前記C1-5-アルキル-基は、任意に1又は2以上のフッ素原子で置換されていてもよく、かつ
前記フェニル基は、任意に、C1-3-アルキル-、ニトロ-、ハロゲン、ヒドロキシ-、カルボキシ-、(R8)2N-、(R8)2N-C1-3-アルキル-、(R8)2N-CO-C1-3-アルキル-、C1-3-アルキル-CO-N(R8)-、C1-3-アルキル-SO2-、(R8)2N-CO-、HO-C1-3-アルキル-、HO-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-C1-3-アルキル-、C1-3-アルキル-O-CO-及びC1-3-アルキル-SO2-N(R8)-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル-、フェニル-C1-4-アルキル-C3-6-シクロアルキル-C1-3-アルキル、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R4が水素又はC1-4-アルキル-基を表し
(任意に、1又は2以上のフッ素原子で置換されていてもよい)、
R5がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル-、フェニル-C1-4-アルキル-、C3-6-シクロアルキル-C1-3-アルキル-、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R6がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル- 、フェニル-C1-4-アルキル-、ヘテロアリール-C1-3-アルキル、C3-6-シクロアルキル-C1-3-アルキル、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表し
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R7がC1-6-アルキル-、C2-6-アルケニル-、C2-6-アルキニル-、C1-6-アルキル-O-C1-3-アルキル-、フェニル-、フェニル-C1-4-アルキル-基、C3-6-シクロアルキル-C1-3-アルキル、C1-3-アルキル-S-C1-3-アルキル-又はC3-6-シクロアルキル-基を表す
(前記各基は、任意に、ハロゲン、カルボキシ-、ヒドロキシ-、シアノ-、ニトロ-、H2N-及びH2N-CO-基から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
請求項1〜6のいずれか1項に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項8】
式(I)中、
R2がC1-3-アルキル-、C3-6-シクロアルキル-C1-3-アルキル-、フェニル-C1-3-アルキル-又はピリジル-C1-3-アルキル-基を表し
(ここで、前記C1-3-アルキル-基は、任意に1又は2以上のフッ素原子で置換されていてもよく、かつ
前記フェニル基は、任意に、C1-3-アルキル-、ニトロ-、ヒドロキシ-、カルボキシ-、H2N-、H2N-CH2-、H2N-CO-CH2-、Me-CO-NH-、Me-SO2-、H2N-CO-、HO-CH2-、HOCO-CH2-、Me-OCO-CH2-、Me-OCO-、及びMe-SO2-NH-から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
R3がC1-5-アルキル-基を表し、
R4が水素を表し、
R5がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R6がC1-4-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R7がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表す
(ここで、前記アルキル-基は、任意に、カルボキシ-、ヒドロキシ-、H2N-及びH2N-CO-基から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
請求項1〜6のいずれか1項に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項9】
式(I)中、
R2がエチル-、n-プロピル-若しくは2-メチルプロピル-基、又は下記置換基から成る群より選択される置換基を表し、
【化2】

R3がC1-5-アルキル-基を表し、
R4が水素を表し、
R5がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R6がC1-4-アルキル-又はフェニル-C1-2-アルキル-基を表し、
R7がC1-5-アルキル-又はフェニル-C1-2-アルキル-基を表す
(ここで、前記アルキル-基は、任意に、カルボキシ-、ヒドロキシ-、H2N-及びH2N-CO-基から成る群より独立に選択される1又は2以上の置換基で置換されていてもよい)、
請求項1〜6のいずれか1項に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項10】
式(I)中、
R2がエチル-、n-プロピル-若しくは2-メチルプロピル-基、又は下記置換基から成る群より選択される置換基を表し、
【化3】

R3が下記置換基から成る群より選択される置換基を表し、
【化4】

R4が水素を表し、
R5が下記置換基から成る群より選択される置換基を表し、
【化5】

R6が下記置換基から成る群より選択される置換基を表し、
【化6】

R7がメチル-、エチル-、n-プロピル-若しくはn-ブチル-基、又は下記置換基から成る群より選択される置換基を表す、
【化7】

請求項1〜6のいずれか1項に記載の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【請求項11】
下記式(Ia)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【化8】

(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、請求項1〜10のいずれか1項の定義どおりである。)
【請求項12】
下記式(Ib)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【化9】

(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R7及びR8は、請求項1〜10のいずれか1項の定義どおりである。)
【請求項13】
下記式(Ic)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【化10】

(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R6、R7及びR8は、請求項1〜10のいずれか1項の定義どおりである。)
【請求項14】
下記式(Id)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【化11】

(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R4、R5、R6、R7及びR8は、請求項1〜10のいずれか1項の定義どおりである。)
【請求項15】
下記式(Ie)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【化12】

(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R6及びR8は、請求項1〜10のいずれか1項の定義どおりである。)
【請求項16】
下記式(If)の化合物、又はその医薬的に許容しうる互変異性体、エナンチオマー、ジアステレオマー、塩若しくは溶媒和物。
【化13】

(式中、
R1は、HO-CO-(CH2)3-、ピリジン-4-イルN-オキシド、フェニル-、4-ヒドロキシフェニル-又は4-ヒドロキシ-2,3,5,6-テトラフルオロフェニル-基を表し、かつ
R2、R3、R4、R5、R6及びR8は、請求項1〜10のいずれか1項の定義どおりである。)
【請求項17】
医薬としての請求項1〜16のいずれか1項に記載の化合物又はその医薬的に許容しうる塩若しくは溶媒和物。
【請求項18】
医薬としての請求項1〜17のいずれか1項に記載の化合物又はその医薬的に許容しうる塩若しくは溶媒和物と、医薬的に許容しうる担体又は希釈剤とを含む医薬組成物。
【請求項19】
β-セクレターゼインヒビター;γ-セクレターゼインヒビター;アミロイド凝集インヒビター;直接又は間接的に作用する神経保護化合物;抗-酸化剤;抗-炎症薬;HMG-CoAレダクターゼインヒビター;アセチルコリン-エステラーゼインヒビター;NMDA受容体アンタゴニスト;AMPAアゴニスト;神経伝達物質の放出又は濃度を調節する化合物;成長ホルモンの放出を誘導する化合物;CB-1受容体アンタゴニスト又はインバースアゴニスト;抗生物質;PDE-IV及びPDE-IXインヒビター、GABAAインバースアゴニスト;ニコチンアゴニスト;ヒスタミンH3アンタゴニスト;5HT-4アゴニスト又は部分アゴニスト;5HT-6アンタゴニスト;a2-アドレノレセプターアンタゴニスト;ムスカリン性M1アゴニスト;ムスカリン性M2アンタゴニスト;代謝調節型グルタミン酸-受容体5ポジティブモジュレーターから成る群より選択される1又は2以上の追加活性成分を含む請求項18に記載の医薬組成物。
【請求項20】
アルゼメド、ビタミンE、ギンコリド、ドネペジル、リバスチグミン、タクリン、ガランタミン、メマンチン、NS-2330、イブタモレンメシラート、カプロモレリン、ミノサイクリン及びリファンピシンから成る群より選択される1又は2以上の追加薬剤を含む、請求項18又は19に記載の医薬組成物。
【請求項21】
請求項1〜17のいずれか1項に記載の式(I)、(Ia)、(Ib)、(Ic)、(Id)、(Ie)若しくは(If)の化合物又はその医薬的に許容しうる塩若しくは溶媒和物、又は請求項18〜21のいずれか1項に記載の医薬組成物の、β-セクレターゼの阻害によって改変できる疾患及び状態の治療又は予防用薬物の製造における使用。
【請求項22】
請求項1〜17のいずれか1項に記載の式(I)、(Ia)、(Ib)、(Ic)、(Id)、(Ie)若しくは(If)の化合物又はその医薬的に許容しうる塩若しくは溶媒和物、又は請求項18〜21のいずれか1項に記載の医薬組成物の、アルツハイマー病、びまん性レビー小体型アルツハイマー病、ダウン症候群、MCI(“軽度認知障害”)、オランダ型アミロイド症のある遺伝性脳溢血、脳アミロイド血管症、外傷性脳損傷、痴呆症、パーキンソン症候群、膵臓炎、封入体筋炎(IBM)又は中枢神経性若しくは末梢神経性アミロイド症から選択される疾患又は状態を有する患者を治療する際、或いは患者が前記疾患又は状態になるのを予防す際に使うための薬物の製造における使用。
【請求項23】
β-セクレターゼ活性の阻害方法であって、前記β-セクレターゼを有効な阻害量の請求項1〜17のいずれか1項に記載の式(I)、(Ia)、(Ib)、(Ic)、(Id)、(Ie)又は(If)の化合物にさらす工程を含む方法。
【公表番号】特表2009−503027(P2009−503027A)
【公表日】平成21年1月29日(2009.1.29)
【国際特許分類】
【出願番号】特願2008−524513(P2008−524513)
【出願日】平成18年8月1日(2006.8.1)
【国際出願番号】PCT/EP2006/064885
【国際公開番号】WO2007/014946
【国際公開日】平成19年2月8日(2007.2.8)
【出願人】(503385923)ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング (976)
【Fターム(参考)】
【公表日】平成21年1月29日(2009.1.29)
【国際特許分類】
【出願日】平成18年8月1日(2006.8.1)
【国際出願番号】PCT/EP2006/064885
【国際公開番号】WO2007/014946
【国際公開日】平成19年2月8日(2007.2.8)
【出願人】(503385923)ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング (976)
【Fターム(参考)】
[ Back to top ]

