アンジオテンシン変換酵素阻害剤およびその用途
【課題】従来公知の有機合成化合物の形態のACE阻害剤(血圧降下剤)(例えば、カプトプリルなど)に代替しうる、副作用が低減されたペプチド性の薬剤を提供する。
【解決手段】水溶性エラスチンまたはそのエラスターゼ加水分解物を有効成分として含有する、アンジオテンシン変換酵素阻害剤、これを含有する血圧降下剤または飲食品により、上記課題は解決されうる。また、分子量1〜3万の水溶性エラスチンを、w/v換算で0.005〜0.5倍の濃度のエラスターゼの存在下、20〜50℃の温度で3〜72時間インキュベートすることにより、当該水溶性エラスチンを加水分解して当該水溶性エラスチンの分解物を得るという手法により、水溶性エラスチン分解物が製造されうる。
【解決手段】水溶性エラスチンまたはそのエラスターゼ加水分解物を有効成分として含有する、アンジオテンシン変換酵素阻害剤、これを含有する血圧降下剤または飲食品により、上記課題は解決されうる。また、分子量1〜3万の水溶性エラスチンを、w/v換算で0.005〜0.5倍の濃度のエラスターゼの存在下、20〜50℃の温度で3〜72時間インキュベートすることにより、当該水溶性エラスチンを加水分解して当該水溶性エラスチンの分解物を得るという手法により、水溶性エラスチン分解物が製造されうる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アンジオテンシン変換酵素阻害剤およびその用途に関する。
【背景技術】
【0002】
現代社会において、高血圧は動脈硬化へつながる深刻な生活習慣病の一つである。高血圧は特有の自覚症状がほとんどないため軽視する人も多いが、その状態を放置しておくと、動脈硬化が進行して脳や心臓に深刻な合併症をもたらし、最悪の場合は生命の危険にさらされる。
【0003】
高血圧に関与する因子の一つと考えられているアンジオテンシン変換酵素(ACE)は、生理活性ペプチドであるアンジオテンシンIを強い血管収縮作用を持つアンジオテンシンIIに変換する酵素である。ACEはまた、血圧を下げる活性を有する生理活性ペプチドであるブラジキニンを分解する作用も持つため、このACEを阻害することは効果的に血圧を降下させる作用につながる。また、一般に「ACE阻害剤」は脳や心臓などの臓器を保護する作用を併せ持っていることから、臓器障害の改善や進行を予防する効果も期待できる。血圧降下剤として現在広く用いられているACE阻害剤のほとんどは、カプトプリル、エナラプリル、アラセプリルなどの有機合成化合物であり、血管浮腫などの副作用を持つことが知られている。一方で、ペプチド性のACE阻害剤(血圧降下剤)はほとんど知られていないのが現状である。
【0004】
ところで、人体をはじめとする動物組織を構成するタンパク質として、エラスチンが知られている。このエラスチンは、コラーゲンと同様に細胞外において機能する繊維状のタンパク質であり、ゴムのように伸縮する性質(弾性)を有していることから、組織への柔軟性の付与に関与している。このため、伸縮性が必要とされる組織・器官(ヒトでは例えば、皮膚の真皮、靱帯、腱、血管壁など)に広く分布している。
【0005】
本願の発明者らは従来、動物性生体組織から水溶性エラスチンを単離する手法を開発することに成功し、当該手法に基づく水溶性エラスチンの製造方法を開示している(特許文献1を参照)。また、単離された水溶性エラスチンが動脈硬化の抑制、脂質代謝異常の改善、血栓形成の抑制といった作用を示すことも見出し、開示している(同じく特許文献1を参照)。ただし、単離された水溶性エラスチンがACE阻害作用(血圧降下作用)を示すことは、特許文献1を含めて従来技術においては知られていない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】再表2006/046626号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、従来公知の有機合成化合物の形態のACE阻害剤(血圧降下剤)(例えば、カプトプリルなど)に代替しうる、副作用が低減されたペプチド性の薬剤を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明者らは、上述したような従来技術の現状に鑑み、鋭意検討を行なった。その過程で、驚くべきことに、水溶性エラスチンまたはそのエラスターゼ加水分解物がACE阻害作用を示し、よって血圧降下作用を示すこと、を見出した。そしてこの知見に基づき、本発明を完成させるに至った。
【0009】
すなわち、本発明の一形態によれば、水溶性エラスチンまたはそのエラスターゼ加水分解物を有効成分として含有する、アンジオテンシン変換酵素阻害剤が提供される。この際、当該阻害剤は、前記エラスターゼ加水分解物を有効成分として含有することが好ましい。
【0010】
また、本発明の他の形態によれば、上記アンジオテンシン変換酵素阻害剤を含有する、血圧降下剤が提供される。
【0011】
さらに、本発明のさらに他の形態によれば、上記アンジオテンシン変換酵素阻害剤を含有する、飲食品が提供される。
【0012】
また、本発明のさらに他の形態によれば、水溶性エラスチンまたはそのエラスターゼ加水分解物を有効量含有する飲食品であって、高血圧を予防または改善する機能を有し、その機能表示が付された、飲食品が提供される。当該飲食品は、健康食品、機能性食品、特定保健用食品、栄養補助食品、疾病リスク低減表示が付された食品、または病者用食品であることが好ましい。
【0013】
本発明の別の形態では、水溶性エラスチンの製造方法もまた、提供される。すなわち、本発明の一形態によれば、分子量1〜3万の水溶性エラスチンを、w/v換算で0.001〜0.5倍の濃度のエラスターゼの存在下、20〜50℃の温度で3〜72時間インキュベートすることにより、前記水溶性エラスチンを加水分解して前記水溶性エラスチンの分解物を得る工程を含む、水溶性エラスチン分解物の製造方法が提供される。
【0014】
上記製造方法は、オクタデシル(ODS)−シリカゲルカラムクロマトグラフィ法を用いて前記分解物を精製する工程をさらに含むことが好ましい。この際、好ましくは、A液(0.1%トリフルオロ酢酸 in 5%アセトニトリル)とB液(0.1%トリフルオロ酢酸 in 95%アセトニトリル)との混合比が80/20〜50/50(A液/B液(v/v))である溶離液によって溶出される画分から前記分解物が精製される。
【0015】
また、上記製造方法は、溶出された画分であって前記分解物を含むものを凍結乾燥することにより、前記分解物を粉末の形態で得る工程をさらに含むことが好ましい。
【発明の効果】
【0016】
本発明によれば、従来の有機合成化合物の形態のACE阻害剤(血圧降下剤)と比較して副作用が低減されたペプチド性の薬剤が提供されうる。また、当該薬剤などに有効に利用されうるペプチドとして、簡便な手法によって水溶性エラスチンの分解物を得る技術もまた、提供されうる。
【図面の簡単な説明】
【0017】
【図1】実施例において、エラスターゼの濃度を0.01mg/mlに設定し、Tris−HCl緩衝液(0.2M、pH8.8)に溶解した水溶性エラスチン(2.0mg/ml)とともに、反応温度37℃で3時間、6時間、24時間インキュベートして分解反応を進行させた後、水溶性エラスチンが分解される様子をSDS−PAGE(CBB染色)により追跡した結果を示す写真である。
【図2】実施例において、エラスターゼの濃度を0.1mg/mlに設定し、Tris−HCl緩衝液(0.2M、pH8.8)に溶解した水溶性エラスチン(2.0mg/ml)とともに、反応温度37℃で3時間、6時間、24時間インキュベートして分解反応を進行させた後、水溶性エラスチンが分解される様子をSDS−PAGE(CBB染色)により追跡した結果を示す写真である。
【図3】実施例において、キモトリプシンの濃度を0.1mg/mlに設定し、Tris−HCl緩衝液(0.2M、pH8.8)に溶解した水溶性エラスチン(2.0mg/ml)とともに、反応温度37℃で3時間、6時間、24時間インキュベートして分解反応を進行させた後、水溶性エラスチンが分解される様子をSDS−PAGE(CBB染色)により追跡した結果を示す写真である。
【図4】実施例において、トリプシンの濃度を0.1mg/mlに設定し、Tris−HCl緩衝液(0.2M、pH8.8)に溶解した水溶性エラスチン(2.0mg/ml)とともに、反応温度37℃で3時間、6時間、24時間インキュベートして分解反応を進行させた後、水溶性エラスチンが分解される様子をSDS−PAGE(CBB染色)により追跡した結果を示す写真である。
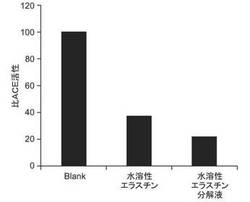
【図5】実施例において、水溶性エラスチンおよびそのエラスターゼ加水分解物のACE阻害活性を評価した結果を示すグラフである。
【発明を実施するための形態】
【0018】
以下、本発明を実施するための具体的な形態について詳細に説明するが、本発明の技術的範囲は下記の具体的な形態のみに限定されるわけではない。
【0019】
本発明の一形態は、水溶性エラスチンまたはそのエラスターゼ加水分解物(以下、単に「分解物」とも称する)を有効成分として含有する、アンジオテンシン変換酵素阻害剤(以下、単に「阻害剤」とも称する)である。
【0020】
当該形態に係るアンジオテンシン変換酵素阻害剤は、その有効成分として、「水溶性エラスチン」または「水溶性エラスチンのエラスターゼ加水分解物」を含有する点に特徴を有する。エラスチンは、動物、特に哺乳動物の皮膚の真皮、靭帯、腱、血管壁等の結合組織の中に、コラーゲンとともに存在するタンパク質である。エラスチンは、通常、生体内においては、3次元の網目構造の不溶性のタンパク質として存在している。このエラスチンを、酸またはアルカリで加水分解したり、酵素で処理することによって水溶性エラスチンが得られることは広く知られている。また、上述したように水溶性エラスチンが動脈硬化の抑制、脂質代謝異常の改善、血栓形成の抑制といった作用を示すことが本発明者らの研究によって見出されているが、本発明は、水溶性エラスチンやそのエラスターゼ加水分解物がACE阻害作用(血圧降下作用)を示すという新たな知見に基づき完成されたものである。
【0021】
本形態の阻害剤の有効成分として用いられる「水溶性エラスチン」の具体的な形態について特に制限はなく、従来公知の知見(例えば、上述した特許文献1など)により提供されている種々の形態が採用されうる。また、「水溶性エラスチン」としては、市販品が存在する場合には当該市販品を購入したものであってもよいし、上記特許文献1などに記載の公知の手法に従って動物性生体組織(例えば、ヒト以外の哺乳動物)等から自ら調製したものであってもよい。以下、動物性生体組織から水溶性エラスチンを自ら調製する手法について、特許文献1の記載に従い、簡単に説明する。
【0022】
動物性生体組織から水溶性エラスチンを製造する手法の一例としては、
(A1)動物性生体組織をコラーゲン除去処理することによって不溶性エラスチンを得る工程、
(A2)該不溶性エラスチンを可溶化液に溶解しエラスチン溶解可溶化液を得る工程、および、
(A3)該エラスチン溶解可溶化液を相分離操作によって2層に分離し、上層または下層から水溶性エラスチンを回収する工程、
を順次実施するという手法が例示される。
【0023】
また、動物性生体組織から水溶性エラスチンを製造する他の手法としては、
(B1)動物性生体組織を前処理する工程、
(B2)前処理された動物性生体組織を、アルカリ性溶液中に浸漬し、動物性生体組織から抽出されるコラーゲンやその他の不要タンパク質を含む溶液を除去するアルカリ抽出工程、
(B3)前記(B2)の操作を繰り返した後に、動物性生体組織残渣を溶解することにより、遊離した水溶性エラスチンを含む溶液を回収するアルカリ溶解工程、
(B4)該アルカリ溶解工程で回収された水溶性エラスチンを含有する溶液を相分離操作によって2層に分離し、上層または下層から水溶性エラスチンを回収する工程、
を順次実施するという手法が例示される。
【0024】
上述した2つの手法については、特許文献1(再表2006/046626号公報)および本願出願時の技術常識を参照することにより適宜実施可能であるため、ここでは詳細な説明を省略する。
【0025】
上述の手法によって回収(製造)された水溶性エラスチンは、最終工程(上記工程(A3)または工程(B4))における相分離によって低分子量(分子量約1〜3万)水溶性エラスチンと高分子量(分子量約3〜30万)水溶性エラスチンとに分画される。すなわち、水溶性エラスチンを30〜50℃に加熱すると相分離して白濁し、そのまま放置すると2層に分離する。この上層画分の平衡液相からは低分子量水溶性エラスチンが回収され、下層画分のコアセルベート相からは高分子量水溶性エラスチンが回収される。
【0026】
また、低分子量水溶性エラスチンと高分子量水溶性エラスチンのコアセルベーション特性(温度上昇で濁度が上昇し、温度降下で濁度がもとに戻る可逆的な性質)の検討の結果、高分子量水溶性エラスチンは加熱すると白濁することが確認でき、その濁度曲線が可逆的である。一方、低分子量水溶性エラスチンは、加熱しても白濁しない。本発明の阻害剤が「水溶性エラスチン」を含有する形態においては、当該阻害剤はこれらの低分子量水溶性エラスチンまたは高分子量水溶性エラスチンのいずれか、または双方を含有しうるが、少なくとも低分子量水溶性エラスチンを含有することが好ましい。これは、低分子量水溶性エラスチンは分子量サイズが小さく、阻害剤が飲食品や医薬などの用途(特に、経口用途)に用いられた際に消化吸収の面で好ましいためである。
【0027】
本発明の阻害剤に用いられうる水溶性エラスチンのうち、エラスチンを構成するアミノ酸の79〜84%がプロリン、グリシン、アラニン、バリンからなり、2〜3%がアスパラギン酸とグルタミン酸からなり、0.7〜1.3%がリジン、ヒスチジン、アルギニンからなり、0.2〜0.4%がデスモシンとイソデスモシンからなる、分子量が約1〜3万の低分子量水溶性エラスチンは、消化吸収性に優れているため、医薬や飲食品として利用できる。
【0028】
一方、本形態の阻害剤の有効成分として用いられる「水溶性エラスチンのエラスターゼ加水分解物(分解物)」の具体的な形態について特に制限はなく、従来公知の知見により提供されている種々の形態が採用されうる。また、当該分解物としては、市販品が存在する場合には当該市販品を購入したものであってもよいし、上述した入手経路から入手された水溶性エラスチンを原料として自らエラスターゼ酵素処理することにより調製したものであってもよい。以下、上記で得られた低分子量水溶性エラスチン(分子量約1〜3万)を原料として、これをエラスターゼ酵素処理することにより分解物を自ら調製する手法について、説明する。
【0029】
当該手法では、まず、原料として、分子量1〜3万の水溶性エラスチン(低分子量水溶性エラスチン)を準備する。その具体的な手法および準備された水溶性エラスチンの具体的な構成については上述したとおりである。
【0030】
続いて、準備された低分子量水溶性エラスチンを、エラスターゼの存在下、インキュベートする。これにより、当該低分子量水溶性エラスチンを加水分解して、水溶性エラスチンの分解物を得る。
【0031】
エラスターゼは、エラスチンを特異的な基質とするセリンプロテアーゼの1種であり、ウシの膵臓から最初に精製されたものである。エラスターゼの具体例としては、膵臓エラスターゼ(EC3.4.21.36)や白血球エラスターゼ(EC3.4.21.37)などが知られている。上述した手法において、インキュベートに用いられるエラスターゼの入手経路について特に制限はなく、従来公知の知見が適宜参照されうる。
【0032】
また、インキュベートする際の反応系におけるエラスターゼ濃度は、w/v換算で、水溶性エラスチンの0.001〜0.5倍であることが好ましく、0.005〜0.4倍であることがより好ましく、0.008〜0.3倍であることがさらに好ましく、0.01〜0.1倍であることが特に好ましい。この値が0.001倍未満であると、水溶性エラスチンの分解反応が十分に進行せず、分解物が効率的に得られない虞がある。一方、この値が0.5倍を超えると、水溶性エラスチンの分解反応自体は十分に進行しうるものの、エラスターゼ自身の分解物が生じて水溶性エラスチンの分解物へ混入してしまう虞がある。インキュベート時の温度およびインキュベート時間についても特に制限はないが、温度は好ましくは20〜50℃であり、より好ましくは30〜40℃であり、最も好ましくは37℃である。また、インキュベート時間は、好ましくは3〜72時間であり、より好ましくは6〜36時間であり、特に好ましくは12〜24時間である。
【0033】
上記のエラスターゼ酵素処理により得られた分解物は、そのまま阻害剤として用いられてもよいし、適宜精製処理が施された後に阻害剤として用いられてもよい。分解物の精製には、好ましくはシリカゲルカラム(より好ましくはオクタデシル(ODS)−シリカゲルカラム)を用いたカラムクロマトグラフィ法が用いられる。この際、溶離液としては、A液(0.1%トリフルオロ酢酸 in 5%アセトニトリル)とB液(0.1%トリフルオロ酢酸 in 95%アセトニトリル)との混合液が用いられうる。この場合、分解物は、A液とB液との混合比が80/20〜50/50(A液/B液(v/v))である溶離液によって溶出される画分から精製されうる。もちろん、他の組成を有する溶離液を用いた溶出によっても分解物は精製可能であって、本発明の技術的範囲が上記の形態のみに限定されるわけではない。また、上記特定のシリカゲルカラムを用いたカラムクロマトグラフィ法以外にも、限外ろ過法、逆相クロマトグラフィー(HPLC)法などの従来公知の手法によって、分解物を精製してもよい。
【0034】
例えば上述の分解物を含む溶出画分に対して凍結乾燥処理を施してもよい。これにより、水溶性エラスチンのエラスターゼ分解物を粉末形態で得ることが可能である。ここで、凍結乾燥処理の具体的な手法について特に制限はなく、従来公知の知見が適宜参照されうる。
【0035】
例えば上記のようにして得られた分解物の平均分子量その他の具体的な形態について特に制限はないが、平均分子量は2,000〜20,000程度であり、好ましくは5,000〜15,000である。分子量がこれらの範囲に存在する分解物を阻害剤として用いた場合には、特に経口用途(飲食品、経口投与が予定される医薬)に用いられた場合の消化吸収に優れるため、好ましい。かような観点から、本発明により提供される阻害剤は、水溶性エラスチンのエラスターゼ分解物を必須に含有するものであることが、当該分解物を含有しないものよりも好ましい。かような形態によれば、ACE阻害活性がより一層高い阻害剤が提供されうるという利点も存在する(後述する実施例を参照)。なお、水溶性エラスチンのエラスターゼ分解物の平均分子量の値としては、SDS−PAGEの泳動結果における中央値を算出することにより測定された値を採用するものとする。
【0036】
なお、食品産業センター技術研究報告書No.27, 2001, 21〜26頁には、エラスターゼ活性を持つ酵素処理によって製造した水溶性エラスチン(分子量は不明)を、高脂肪食負荷ラットおよび健常者に投与したところ、血中の総コレステロール、中性脂肪等が低下し、血中脂質代謝異常が改善されたことが報告されている。しかし、この報告で用いられている水溶性エラスチンは、これまで高純度と評価されている水溶性エラスチンとはアミノ酸組成がかなり異なっている(プロリン、グリシン、アラニン、バリンが68%に過ぎない)。そればかりか、エラスチンに特有のアミノ酸であるデスモシンおよびイソデスモシンも検出されていないことから、極度に低純度のもの、あるいはエラスチンとは異なるものではないかと推定される。
【0037】
本発明の阻害剤において用いられる水溶性エラスチンまたはそのエラスターゼ加水分解物は、易水溶性であり、水溶液として安定な性状を維持することができる。このため、医薬および飲食品に通常添加されうる成分との混和性に優れている。また、水溶性エラスチンまたはそのエラスターゼ加水分解物は、無毒、無味、無臭であって、安全性にも優れている。このため、においや味といった官能特性への影響や、副作用の心配がなく、日常の食生活に適宜取り入れて無理なく摂取することができる。また、水溶性エラスチンまたはそのエラスターゼ加水分解物は天然タンパク質としての特性を持ち、たとえ大量に摂取したとしても無害であり、体内では栄養源として利用されうる。
【0038】
本発明の一形態によるアンジオテンシン変換酵素阻害剤は、水溶性エラスチンまたはそのエラスターゼ加水分解物を有効成分として含む。ここで、「有効成分として含む」とは、本発明に係る阻害剤が、所望のACE阻害効果を発揮するのに充分な量(すなわち、有効量)の水溶性エラスチンまたはそのエラスターゼ加水分解物を含有することを意味する。
【0039】
したがって、水溶性エラスチンまたはそのエラスターゼ加水分解物を、そのままACE阻害剤として用いてもよいが、このような有効量で有効成分を含み、かつACE阻害効果を損なわない限りにおいて、本発明に係る阻害剤は、所望の製品形態に応じた薬理学的に許容されうる担体や、他の添加剤を含んでもよい。このような担体、および添加剤としては、例えば、賦形剤、結合剤、香料、緩衝剤、増粘剤、着色剤、安定剤、乳化剤、分散剤、懸濁化剤、崩壊剤、滑沢剤、防腐剤等が挙げられる。本発明に係る阻害剤は、経口または非経口的に投与または摂取することができる。経口用の形態としては、例えば、食品、食品添加剤、錠剤、散剤、細粒剤、顆粒剤、カプセル剤、丸剤、徐放剤などの固形製剤、溶液、懸濁液、乳濁液などの液状製剤の形態が挙げられる。非経口用の形態としては、例えば、注射剤、点滴剤、外用剤や座剤の形態が挙げられる。これらは、当該技術分野で通常行われている手法により、必要に応じて担体や添加剤とともに、製剤化もしくは製品化することができる。なお、上述したように、経口的に投与・摂取される製剤の形態を有する阻害剤は、水溶性エラスチンのエラスターゼ加水分解物を含むことが、当該阻害剤の投与・摂取後の消化吸収の観点から、好ましい。
【0040】
本発明に係る阻害剤において、所望のACE阻害効果を得るためには、上述した有効成分を、有効成分である水溶性エラスチンまたはそのエラスターゼ加水分解物換算で、成人一人の体重1kg当たり、1日に30〜6000mg投与または摂取することが好ましく、より好ましくは50〜2000mgであり、さらに好ましくは100〜1000mgである。1日の投与量もしくは摂取量が上記下限値未満であると、充分な効果が得られない虞がある。また上記上限値を超えて投与または摂取しても、それ以上の効果の増加はあまり望めない。本発明においては、この量の有効成分を1日1〜数回に分けて、阻害剤そのままの形態で、または、医薬、飲食品等の所望の形態とした上で、投与または摂取すればよい。
【0041】
本発明の阻害剤における有効成分である水溶性エラスチンまたはそのエラスターゼ加水分解物は、アンジオテンシン変換酵素(ACE;Angiotensin Converting Enzyme)の阻害作用を有する(後述する実施例を参照)。ACEはアンジオテンシンIから生理活性を有するアンジオテンシンIIを生成する反応を触媒する酵素である。そして、アンジオテンシンIIは血圧調節系において昇圧作用を示す生理活性ペプチドであることから、ACE阻害作用を有することが今般見出された水溶性エラスチンおよびそのエラスターゼ加水分解物は、血圧降下剤として作用することが期待されている。また、ACEはキニンの分解に関与するキニナーゼIIと同一の酵素であることから、ACE阻害によってブラジキニン、さらにはプロスタグランジンや一酸化窒素(NO)の増量を介してもまた、血圧調節系における降圧系が活性化される。したがって、本発明のACE阻害剤は、高血圧症の予防および/または治療のための、血圧降下剤として使用できる。すなわち、本発明によれば、上記ACE阻害剤を含有する血圧降下剤が提供される。
【0042】
また、本発明の他の形態によれば、水溶性エラスチンまたはそのエラスターゼ加水分解物の有効量を、哺乳動物に投与するかまたは摂取させることを含む、当該哺乳動物におけるACEを阻害する方法、当該哺乳動物の血圧を低下させる方法、あるいは、当該哺乳動物における高血圧症を予防および/または治療する方法が提供される。なお、「有効量」とは、ACE阻害や、これによる血圧の低下、高血圧の予防および/または治療といった所望の効果を発揮する上で少なくとも必要とされる有効成分の量を意味する。
【0043】
本発明に係る阻害剤は、それ単独でも使用することができるが、医薬、飲食品などの種々の組成物に添加剤として含有させることができ、ACE阻害効果を有する組成物を提供することができる。
【0044】
本発明に係る血圧降下剤として用いられうる医薬組成物は、上述したように、本発明に係るACE阻害剤を含むことを特徴とする。ここで、該医薬組成物において、ACE阻害剤の有効成分を有効量含むように、医薬組成物は、該阻害剤を適切な量で含むことが好ましい。
【0045】
したがって、本発明による医薬組成物は、所望の効果を発揮するのに充分な量(すなわち、有効量)の水溶性エラスチンまたはそのエラスターゼ加水分解物を含有するものであって、製剤化のために許容されうる添加剤を併用して、常法に従い、経口製剤または非経口製剤として調製したものである。このような製剤化のために許容されうる添加剤としては、例えば、賦形剤、安定剤、防腐剤、湿潤剤、乳化剤、滑沢剤、甘味料、着色料、香料、緩衝剤、酸化防止剤、pH調整剤、結合剤、増粘剤、分散剤、懸濁化剤、崩壊剤などを挙げることができる。本発明において、医薬組成物が経口製剤の場合には、食品、食品添加剤、錠剤、散剤、細粒剤、顆粒剤、カプセル剤、丸剤、徐放剤などの固形製剤、溶液、懸濁液、乳濁液などの液状製剤の形態をとることができる。また、非経口製剤の場合には、注射剤、点滴剤、外用剤や坐剤の形態をとることができる。簡易性の点からは、経口製剤であることが好ましい。
【0046】
本発明に係る医薬組成物は、必要に応じて、他の補助成分をさらに含んでいてもよい。このような併用可能な他の補助成分としては、例えば、ビタミン成分(例えば、ビタミンC、ビタミンE)、抗生物質、アミノ酸類、ペプチド類、ミネラル類(例えば、亜鉛、鉄、銅、マンガンなど)、核酸、多糖類、脂肪酸類、生薬などが挙げられる。
【0047】
さらに製剤化にあたって、本発明に係る有効成分以外の1種以上の医療上有効な有効成分(活性成分)をさらに添加し配合してもよい。また本発明に係る有効成分の投与にあたっては、本発明に係る有効成分以外の1種以上の医療上有効な有効成分を組み合わせて投与してもよい。
【0048】
本発明によれば、上述したACE阻害剤を含有する飲食品もまた、提供される。ここで、当該飲食品は、ACE阻害剤の有効成分を有効量含むように、当該阻害剤を適切な量で含むことが好ましい。ここで「有効成分を有効量含む」とは、個々の飲食品を通常喫食される量摂取した結果、有効成分としての効果を発揮しうるような量で有効成分を含有することを意味する。本発明に係る飲食品には、本発明に係る有効成分をそのまま、または上述したような阻害剤の形態で、飲食品に配合してもよい。また、本発明に係る飲食品は、本発明に係る有効成分に安定剤等の慣用の添加成分を加えて飲食品として調製したもの、各種タンパク質、糖類、脂肪、微量元素、ビタミン類等を、それらにさらに配合して調製したもの、液状、半液体状若しくは固体状にしたもの、ペースト状にしたもの、または、一般の飲食品へ有効成分を添加したものであってもよい。
【0049】
本発明において、「飲食品」は、医薬以外のものであって、哺乳動物が経口摂取可能な形態のものであれば特に制限はなく、その形態も液状物(溶液、懸濁液、乳濁液など)、半液体状物、粉末、または固体成形物のいずれのものであってもよい。このため飲食品は、例えば飲料の形態であってもよく、また、サプリメントのような栄養補助食品の錠剤形態であってもよい。
【0050】
飲食品として具体的には、例えば、即席麺、レトルト食品、缶詰、電子レンジ食品、即席スープ・みそ汁類、フリーズドライ食品などの即席食品類;清涼飲料、果汁飲料、野菜飲料、豆乳飲料、コーヒー飲料、茶飲料、粉末飲料、濃縮飲料、栄養飲料、アルコール飲料などの飲料類;パン、パスタ、麺、ケーキミックス、唐揚げ粉、パン粉などの小麦粉製品;飴、キャラメル、チューイングガム、チョコレート、クッキー、ビスケット、ケーキ、パイ、スナック、クラッカー、和菓子、デザート菓子などの菓子類;ソース、トマト加工調味料、風味調味料、調理ミックス、たれ類、ドレッシング類、つゆ類、カレー・シチューの素類などの調味料;加工油脂、バター、マーガリン、マヨネーズなどの油脂類;乳飲料、ヨーグルト類、乳酸菌飲料、アイスクリーム類、クリーム類などの乳製品;魚肉ハム・ソーセージ、水産練り製品などの水産加工品;畜肉ハム・ソーセージなどの畜産加工品;農産缶詰、ジャム・マーマレード類、漬け物、煮豆、シリアルなどの農産加工品;冷凍食品;栄養食品などが挙げられる。
【0051】
本発明に係る飲食品は、高血圧症に罹患しているか、または罹患していることが疑われる者、あるいは高血圧症への罹患のリスクが高い者に対して好適に使用することができる。ここで、高血圧症への罹患のリスクが高い者としては、例えば、体組成や食生活をはじめとする各種の指標を考慮して、または、健康診断等の診断・診察から、当該リスクが高いと判断された者や、そのようなリスクが高いと本人または周囲の者から認識されるに至った者が含まれる。
【0052】
本発明において「飲食品」には、健康食品、機能性食品、特定保健用食品、栄養補助食品、疾病リスク低減表示が付された食品、または、病者用食品のような分類のものも包含される。さらに「飲食品」という用語は、ヒト以外の哺乳動物を対象として使用される場合には、飼料を含む意味で用いられうる。ここでいう特定保健用食品とは、高血圧症の予防および/または改善等を目的として食品の製造または販売等を行う場合に、保健上の観点から、各国(例えば我が国)において法上の何らかの制限を受けることがある食品をいう。このような食品は、食品が疾病リスクを低減する可能性があること表示した食品、すなわち、疾病リスク低減表示を付した食品であってもよい。ここで、疾病リスク低減表示とは、疾病リスクを低減する可能性のある食品の表示であって、FAO/WHO合同食品規格委員会(コーデックス委員会)の定める規格に基づいて、またはその規格を参考にして、定められた表示または認められた表示でありうる。
【0053】
本発明の飲食品においては、上述した有効成分に加えて、他の機能を有する成分をさらに添加してもよい。また例えば、日常生活で摂取する食品、健康食品、機能性食品、サプリメント(例えば、カルシウム、マグネシウム等のミネラル類、ビタミンK等のビタミン類を1種以上含有する食品)に本発明の有効成分を配合することにより、本発明による効果に加えて、他の成分に基づく機能を併せ持つ飲食品を提供することができる。
【0054】
本発明の他の形態によれば、上述したACE阻害剤の有効成分である水溶性エラスチンまたはそのエラスターゼ加水分解物を有効量含有する飲食品であって、高血圧症を予防および/または改善する機能を有し、その機能表示が付された飲食品が提供される。ここで飲食品に付される機能表示は、例えば、製品の本体、容器、包装、説明書、添付文書、または宣伝物のいずれかに付することができる。
【0055】
本発明による飲食品の製造にあたっては、通常の飲食品の処方設計に用いられている糖類、香料、果汁、食品添加剤、安定剤などを適宜添加することができる。飲食品の製造は、当該技術分野に公知の製造技術を参照して実施することができる。本発明に係る飲食品は様々な形態を取ることができ、公知の医薬品の製造技術に準じて本発明に係る飲食品を製造してもよい。その場合には、本発明に係る阻害剤や医薬組成物の製造の項目において述べたような担体や添加剤を用いて製造することができる。また、製造段階において、本発明における機能以外の機能を発揮する他の成分または他の機能性食品と組み合わせることによって、多機能性の飲食品としてもよい。
【0056】
本発明に係る医薬組成物および飲食品を投与または摂取する場合、本発明に係る有効成分の投与量または摂取量は、受容者、受容者の年齢および体重、症状、投与時間、剤形、投与方法、薬剤の組み合わせ等に依存して決定されうる。本発明においては、少なくともACE阻害効果を得るために必要な1日あたりの有効成分の量を投与または摂取できるように、1日あたりの組成物または飲食品の投与量または摂取量を考慮し、組成物または飲食品中の含有量を適宜設定することが好ましい。
【0057】
したがって、本発明による医薬組成物または飲食品は、好ましくは、有効成分である水溶性エラスチンまたはそのエラスターゼ加水分解物を、当該有効成分換算で成人一人に1日あたり好ましくは30〜6000mg、より好ましくは50〜2000mg、さらに好ましくは100〜1000mgの範囲で提供される量含む。
【実施例】
【0058】
以下、実施例を用いて本発明の好適な実施形態についてより詳細に説明するが、本発明の技術的範囲が下記の実施例のみに限定して解釈されるべきではない。
【0059】
(概要)
以下ではまず、BSE等の問題のないブタの大動脈組織から高純度の水溶性エラスチンを調製し、種々の酵素を用いて高分子の水溶性エラスチンを低分子化してエラスチン由来ペプチドを得る条件検討を実施した。具体的には、酵素の種類、濃度、反応時間等を検討し、SDS−PAGE装置を用いて反応の進行状況を追跡した。次に、得られたエラスチン由来ペプチドについて、ACE阻害能の測定を実施した。
【0060】
(ブタ大動脈組織からの高純度水溶性エラスチンの調製)
以下の手法により、特許文献1の記載を参照しつつ、ブタ大動脈組織から、水溶性エラスチンを調製した。
【0061】
まず、ブタ大動脈をマスコロイダー(磨砕機)で処理し、処理後の組織に湿重量の約5倍量のアセトンを加え、室温にて24時間撹拌した。次いで、ろ過脱水式遠心分離機にて遠心分離(2,000rpm、室温、5分)を行い、アセトンを除去後、乾燥(50℃、3日間)して、アセトン脱脂組織を得た。
【0062】
得られた脱脂組織に、脱脂組織重量の約10倍量の1M NaClを加え、室温にて1時間撹拌した。(室温、1時間)。次いで、ろ過脱水式遠心分離機にて遠心分離(2,000rpm、室温、5分)を行い、残渣を回収した。この残渣に、脱脂組織重量の約10倍量の蒸留水を加え、当該残渣を洗浄(室温、1時間)した。その後、再度、ろ過脱水式遠心分離機にて遠心分離(2,000rpm、室温、5分)を行い、残渣を回収して、NaCl抽出残渣を得た。
【0063】
脱脂組織重量の約10倍量の0.1M NaOHを100℃に加熱し、そこに上記で得られたNaCl残渣を加え、撹拌(100℃、15分)した。次いで、ろ過脱水式遠心分離機にて遠心分離(2,000rpm、室温、5分)を行い、残渣を回収した。この残渣に、脱脂組織重量の約10倍量の蒸留水を加え、残渣を洗浄(室温、1時間)した。その後、再度、ろ過脱水式遠心分離機にて遠心分離(2,000rpm、室温、5分)を行い、残渣を回収して、不溶性エラスチンを得た。
【0064】
脱脂組織重量の約15倍量の0.75M NaOHを100℃に加熱し、そこに上記で得られた不溶性エラスチンを加え、撹拌(100℃、50分)した。次いで、撹拌後の溶液を氷冷後、酢酸を用いて中和し、冷却遠心分離機にて遠心分離(5,000rpm、4℃、20分)を行い、上清を回収した。得られた上清を透析(4℃、4日)した後、凍結乾燥処理を施して、粉末状の高純度水溶性エラスチンを得た。
【0065】
(エラスターゼを用いた水溶性エラスチンの分解)
上記で調製したブタ大動脈組織由来の水溶性エラスチンについて、消化酵素としてエラスターゼを用いた分解反応の検討を行った。エラスターゼの濃度を0.01mg/ml、0.1mg/ml、1.0mg/mlの3種に設定し、それぞれをTris−HCl緩衝液(0.2M、pH8.8)に溶解した水溶性エラスチン(2.0mg/ml)とともに、反応温度37℃で3時間、6時間、24時間インキュベートして、分解反応を進行させた。この際、水溶性エラスチンが分解される様子をSDS−PAGE(CBB染色)により追跡した。
【0066】
その結果、0.01mg/mlの酵素濃度においては、図1に示すように、24時間後においても水溶性エラスチンの分子量分布がほとんど変化することなく、分解が不十分であったことがわかる。一方、0.1mg/mlの酵素濃度においては、図2に示すように、反応時間が3時間、6時間と経過するにつれて分子量が低分子量側(下方向)へと変化していく様子が観察され、24時間後には水溶性エラスチンが十分に分解されることが確認された。なお、図2に示す結果において分子量28.0kDa付近に検出されている濃いバンドはエラスターゼに由来するものである。また、1mg/mlの酵素濃度では、SDS−PAGEにおいて短時間での分解が観察され、効率的な分解が期待されるものの、反応溶液の様子をHPLCで検討したところ、溶出時間10分から20分の範囲にエラスターゼ自身の分解物が溶出され、それらは水溶性エラスチンの分解物と同時に溶出され混ざり合ってしまう。また、エラスターゼの濃度が濃いために、酵素の自己消化由来の溶出物が多くなってしまい、水溶性エラスチン分解物の分離・分析に困難を伴うものと考えられた。そこで、水溶性エラスチンを十分に分解することができ、かつ、水溶性エラスチン分解物を効率的に精製することのできる最適なエラスターゼの濃度は0.1mg/ml程度であると推定された。
【0067】
(他の消化酵素による水溶性エラスチンの分解)
上記で調製したブタ大動脈組織由来の水溶性エラスチンについて、エラスターゼ以外のタンパク質分解酵素であるキモトリプシンおよびトリプシンを用いて分解反応を検討した。各酵素濃度はエラスターゼの最適濃度である0.1mg/mlとし、反応温度は37℃で、3時間、6時間、24時間後の分解の様子をエラスターゼの場合と同様にSDS−PAGEにより調べた(図3(キモトリプシン処理)および図4(トリプシン処理))。
【0068】
その結果、キモトリプシンまたはトリプシンを用いた分解処理では、24時間後においても分子量分布の変化が小さく顕著な分子量の低下が認められず、十分に分解することができなかった。このように両酵素を用いた場合には水溶性エラスチンを十分に低分子量化することが困難であることが示されたことから、水溶性エラスチンの分解反応にはエラスターゼ(酵素濃度0.1mg/ml程度)が最適であることが確認された。
【0069】
(簡易カラムを用いた水溶性エラスチン分解物の精製)
上記で、水溶性エラスチンの分解には濃度0.1mg/ml程度のエラスターゼを用いて約37℃にて24時間程度、処理を行うことが好ましいことが示された。ここでは、最終的に水溶性エラスチン分解物のみを精製するために、Sep−Pak C−18カラム(Waters社製)を用いたエラスチン分解物の分離を実施した。試料の溶出にはA液(0.1%TFA in 5%CH3CN)およびB液(0.1%TFA in 95%CH3CN)(TFA:トリフルオロ酢酸、CH3CN:アセトニトリル)の混合率を調節して溶出を行った。その結果、B液の割合が0%の段階においては、緩衝液由来の塩のみが溶出され、B液が35%の割合において目的の分解物が溶出された。最後にB液の割合を100%に上昇させエラスターゼのみの溶出を行い、順次各々の成分を分離した。このようにして、水溶性エラスチン分解物の画分のみを精製し、溶出試料を凍結乾燥し、目的物を白色粉末で得た。また、収率は1回目の調製が水溶性エラスチン18.8mgからエラスターゼ分解物15.9mg(84.6%)、2回目の調製が45.8mgから27.7mg(60.5%)と、いずれも60〜90%の高い収率で目的物(水溶性エラスチン分解物)を得ることができた。なお、得られた水溶性エラスチン分解物の平均分子量は10,000であった。
【0070】
(水溶性エラスチン分解物によるACE阻害能の評価)
ACE阻害活性の測定には、蛍光基質であるAbz-ε-Acp-Ala-Phe(p-NO2)-Leu-OH(渡辺化学工業)を使用した。反応は0.2M Tris−HCl(pH8.0+0.02M NaCl)緩衝液中で行い、酵素としてはウサギ(rabbit)ACE(Sigma社製)を使用した。具体的には、基質溶液(0.5ppm、2ml)に酵素(9unit、0.5ml)を加え、上記で調製した水溶性エラスチンまたは水溶性エラスチン分解物を阻害剤として(3mg、0.5ml)加えた。全ての活性測定には37℃で15分間反応を行った。
【0071】
阻害剤を加えない場合をACE活性100%として、水溶性エラスチンまたは水溶性エラスチン分解物のACE阻害能を調べたところ、図5に示すように、分解前の水溶性エラスチンのサンプルでは62%、エラスターゼ処理による分解後の水溶性エラスチン分解物のサンプルでは78%もの阻害能を示していた。したがって、水溶性エラスチンまたはそのエラスターゼ分解物は、ACEを阻害することにより、有効な血圧降下作用を持つことが示唆された。
【技術分野】
【0001】
本発明は、アンジオテンシン変換酵素阻害剤およびその用途に関する。
【背景技術】
【0002】
現代社会において、高血圧は動脈硬化へつながる深刻な生活習慣病の一つである。高血圧は特有の自覚症状がほとんどないため軽視する人も多いが、その状態を放置しておくと、動脈硬化が進行して脳や心臓に深刻な合併症をもたらし、最悪の場合は生命の危険にさらされる。
【0003】
高血圧に関与する因子の一つと考えられているアンジオテンシン変換酵素(ACE)は、生理活性ペプチドであるアンジオテンシンIを強い血管収縮作用を持つアンジオテンシンIIに変換する酵素である。ACEはまた、血圧を下げる活性を有する生理活性ペプチドであるブラジキニンを分解する作用も持つため、このACEを阻害することは効果的に血圧を降下させる作用につながる。また、一般に「ACE阻害剤」は脳や心臓などの臓器を保護する作用を併せ持っていることから、臓器障害の改善や進行を予防する効果も期待できる。血圧降下剤として現在広く用いられているACE阻害剤のほとんどは、カプトプリル、エナラプリル、アラセプリルなどの有機合成化合物であり、血管浮腫などの副作用を持つことが知られている。一方で、ペプチド性のACE阻害剤(血圧降下剤)はほとんど知られていないのが現状である。
【0004】
ところで、人体をはじめとする動物組織を構成するタンパク質として、エラスチンが知られている。このエラスチンは、コラーゲンと同様に細胞外において機能する繊維状のタンパク質であり、ゴムのように伸縮する性質(弾性)を有していることから、組織への柔軟性の付与に関与している。このため、伸縮性が必要とされる組織・器官(ヒトでは例えば、皮膚の真皮、靱帯、腱、血管壁など)に広く分布している。
【0005】
本願の発明者らは従来、動物性生体組織から水溶性エラスチンを単離する手法を開発することに成功し、当該手法に基づく水溶性エラスチンの製造方法を開示している(特許文献1を参照)。また、単離された水溶性エラスチンが動脈硬化の抑制、脂質代謝異常の改善、血栓形成の抑制といった作用を示すことも見出し、開示している(同じく特許文献1を参照)。ただし、単離された水溶性エラスチンがACE阻害作用(血圧降下作用)を示すことは、特許文献1を含めて従来技術においては知られていない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】再表2006/046626号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、従来公知の有機合成化合物の形態のACE阻害剤(血圧降下剤)(例えば、カプトプリルなど)に代替しうる、副作用が低減されたペプチド性の薬剤を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明者らは、上述したような従来技術の現状に鑑み、鋭意検討を行なった。その過程で、驚くべきことに、水溶性エラスチンまたはそのエラスターゼ加水分解物がACE阻害作用を示し、よって血圧降下作用を示すこと、を見出した。そしてこの知見に基づき、本発明を完成させるに至った。
【0009】
すなわち、本発明の一形態によれば、水溶性エラスチンまたはそのエラスターゼ加水分解物を有効成分として含有する、アンジオテンシン変換酵素阻害剤が提供される。この際、当該阻害剤は、前記エラスターゼ加水分解物を有効成分として含有することが好ましい。
【0010】
また、本発明の他の形態によれば、上記アンジオテンシン変換酵素阻害剤を含有する、血圧降下剤が提供される。
【0011】
さらに、本発明のさらに他の形態によれば、上記アンジオテンシン変換酵素阻害剤を含有する、飲食品が提供される。
【0012】
また、本発明のさらに他の形態によれば、水溶性エラスチンまたはそのエラスターゼ加水分解物を有効量含有する飲食品であって、高血圧を予防または改善する機能を有し、その機能表示が付された、飲食品が提供される。当該飲食品は、健康食品、機能性食品、特定保健用食品、栄養補助食品、疾病リスク低減表示が付された食品、または病者用食品であることが好ましい。
【0013】
本発明の別の形態では、水溶性エラスチンの製造方法もまた、提供される。すなわち、本発明の一形態によれば、分子量1〜3万の水溶性エラスチンを、w/v換算で0.001〜0.5倍の濃度のエラスターゼの存在下、20〜50℃の温度で3〜72時間インキュベートすることにより、前記水溶性エラスチンを加水分解して前記水溶性エラスチンの分解物を得る工程を含む、水溶性エラスチン分解物の製造方法が提供される。
【0014】
上記製造方法は、オクタデシル(ODS)−シリカゲルカラムクロマトグラフィ法を用いて前記分解物を精製する工程をさらに含むことが好ましい。この際、好ましくは、A液(0.1%トリフルオロ酢酸 in 5%アセトニトリル)とB液(0.1%トリフルオロ酢酸 in 95%アセトニトリル)との混合比が80/20〜50/50(A液/B液(v/v))である溶離液によって溶出される画分から前記分解物が精製される。
【0015】
また、上記製造方法は、溶出された画分であって前記分解物を含むものを凍結乾燥することにより、前記分解物を粉末の形態で得る工程をさらに含むことが好ましい。
【発明の効果】
【0016】
本発明によれば、従来の有機合成化合物の形態のACE阻害剤(血圧降下剤)と比較して副作用が低減されたペプチド性の薬剤が提供されうる。また、当該薬剤などに有効に利用されうるペプチドとして、簡便な手法によって水溶性エラスチンの分解物を得る技術もまた、提供されうる。
【図面の簡単な説明】
【0017】
【図1】実施例において、エラスターゼの濃度を0.01mg/mlに設定し、Tris−HCl緩衝液(0.2M、pH8.8)に溶解した水溶性エラスチン(2.0mg/ml)とともに、反応温度37℃で3時間、6時間、24時間インキュベートして分解反応を進行させた後、水溶性エラスチンが分解される様子をSDS−PAGE(CBB染色)により追跡した結果を示す写真である。
【図2】実施例において、エラスターゼの濃度を0.1mg/mlに設定し、Tris−HCl緩衝液(0.2M、pH8.8)に溶解した水溶性エラスチン(2.0mg/ml)とともに、反応温度37℃で3時間、6時間、24時間インキュベートして分解反応を進行させた後、水溶性エラスチンが分解される様子をSDS−PAGE(CBB染色)により追跡した結果を示す写真である。
【図3】実施例において、キモトリプシンの濃度を0.1mg/mlに設定し、Tris−HCl緩衝液(0.2M、pH8.8)に溶解した水溶性エラスチン(2.0mg/ml)とともに、反応温度37℃で3時間、6時間、24時間インキュベートして分解反応を進行させた後、水溶性エラスチンが分解される様子をSDS−PAGE(CBB染色)により追跡した結果を示す写真である。
【図4】実施例において、トリプシンの濃度を0.1mg/mlに設定し、Tris−HCl緩衝液(0.2M、pH8.8)に溶解した水溶性エラスチン(2.0mg/ml)とともに、反応温度37℃で3時間、6時間、24時間インキュベートして分解反応を進行させた後、水溶性エラスチンが分解される様子をSDS−PAGE(CBB染色)により追跡した結果を示す写真である。
【図5】実施例において、水溶性エラスチンおよびそのエラスターゼ加水分解物のACE阻害活性を評価した結果を示すグラフである。
【発明を実施するための形態】
【0018】
以下、本発明を実施するための具体的な形態について詳細に説明するが、本発明の技術的範囲は下記の具体的な形態のみに限定されるわけではない。
【0019】
本発明の一形態は、水溶性エラスチンまたはそのエラスターゼ加水分解物(以下、単に「分解物」とも称する)を有効成分として含有する、アンジオテンシン変換酵素阻害剤(以下、単に「阻害剤」とも称する)である。
【0020】
当該形態に係るアンジオテンシン変換酵素阻害剤は、その有効成分として、「水溶性エラスチン」または「水溶性エラスチンのエラスターゼ加水分解物」を含有する点に特徴を有する。エラスチンは、動物、特に哺乳動物の皮膚の真皮、靭帯、腱、血管壁等の結合組織の中に、コラーゲンとともに存在するタンパク質である。エラスチンは、通常、生体内においては、3次元の網目構造の不溶性のタンパク質として存在している。このエラスチンを、酸またはアルカリで加水分解したり、酵素で処理することによって水溶性エラスチンが得られることは広く知られている。また、上述したように水溶性エラスチンが動脈硬化の抑制、脂質代謝異常の改善、血栓形成の抑制といった作用を示すことが本発明者らの研究によって見出されているが、本発明は、水溶性エラスチンやそのエラスターゼ加水分解物がACE阻害作用(血圧降下作用)を示すという新たな知見に基づき完成されたものである。
【0021】
本形態の阻害剤の有効成分として用いられる「水溶性エラスチン」の具体的な形態について特に制限はなく、従来公知の知見(例えば、上述した特許文献1など)により提供されている種々の形態が採用されうる。また、「水溶性エラスチン」としては、市販品が存在する場合には当該市販品を購入したものであってもよいし、上記特許文献1などに記載の公知の手法に従って動物性生体組織(例えば、ヒト以外の哺乳動物)等から自ら調製したものであってもよい。以下、動物性生体組織から水溶性エラスチンを自ら調製する手法について、特許文献1の記載に従い、簡単に説明する。
【0022】
動物性生体組織から水溶性エラスチンを製造する手法の一例としては、
(A1)動物性生体組織をコラーゲン除去処理することによって不溶性エラスチンを得る工程、
(A2)該不溶性エラスチンを可溶化液に溶解しエラスチン溶解可溶化液を得る工程、および、
(A3)該エラスチン溶解可溶化液を相分離操作によって2層に分離し、上層または下層から水溶性エラスチンを回収する工程、
を順次実施するという手法が例示される。
【0023】
また、動物性生体組織から水溶性エラスチンを製造する他の手法としては、
(B1)動物性生体組織を前処理する工程、
(B2)前処理された動物性生体組織を、アルカリ性溶液中に浸漬し、動物性生体組織から抽出されるコラーゲンやその他の不要タンパク質を含む溶液を除去するアルカリ抽出工程、
(B3)前記(B2)の操作を繰り返した後に、動物性生体組織残渣を溶解することにより、遊離した水溶性エラスチンを含む溶液を回収するアルカリ溶解工程、
(B4)該アルカリ溶解工程で回収された水溶性エラスチンを含有する溶液を相分離操作によって2層に分離し、上層または下層から水溶性エラスチンを回収する工程、
を順次実施するという手法が例示される。
【0024】
上述した2つの手法については、特許文献1(再表2006/046626号公報)および本願出願時の技術常識を参照することにより適宜実施可能であるため、ここでは詳細な説明を省略する。
【0025】
上述の手法によって回収(製造)された水溶性エラスチンは、最終工程(上記工程(A3)または工程(B4))における相分離によって低分子量(分子量約1〜3万)水溶性エラスチンと高分子量(分子量約3〜30万)水溶性エラスチンとに分画される。すなわち、水溶性エラスチンを30〜50℃に加熱すると相分離して白濁し、そのまま放置すると2層に分離する。この上層画分の平衡液相からは低分子量水溶性エラスチンが回収され、下層画分のコアセルベート相からは高分子量水溶性エラスチンが回収される。
【0026】
また、低分子量水溶性エラスチンと高分子量水溶性エラスチンのコアセルベーション特性(温度上昇で濁度が上昇し、温度降下で濁度がもとに戻る可逆的な性質)の検討の結果、高分子量水溶性エラスチンは加熱すると白濁することが確認でき、その濁度曲線が可逆的である。一方、低分子量水溶性エラスチンは、加熱しても白濁しない。本発明の阻害剤が「水溶性エラスチン」を含有する形態においては、当該阻害剤はこれらの低分子量水溶性エラスチンまたは高分子量水溶性エラスチンのいずれか、または双方を含有しうるが、少なくとも低分子量水溶性エラスチンを含有することが好ましい。これは、低分子量水溶性エラスチンは分子量サイズが小さく、阻害剤が飲食品や医薬などの用途(特に、経口用途)に用いられた際に消化吸収の面で好ましいためである。
【0027】
本発明の阻害剤に用いられうる水溶性エラスチンのうち、エラスチンを構成するアミノ酸の79〜84%がプロリン、グリシン、アラニン、バリンからなり、2〜3%がアスパラギン酸とグルタミン酸からなり、0.7〜1.3%がリジン、ヒスチジン、アルギニンからなり、0.2〜0.4%がデスモシンとイソデスモシンからなる、分子量が約1〜3万の低分子量水溶性エラスチンは、消化吸収性に優れているため、医薬や飲食品として利用できる。
【0028】
一方、本形態の阻害剤の有効成分として用いられる「水溶性エラスチンのエラスターゼ加水分解物(分解物)」の具体的な形態について特に制限はなく、従来公知の知見により提供されている種々の形態が採用されうる。また、当該分解物としては、市販品が存在する場合には当該市販品を購入したものであってもよいし、上述した入手経路から入手された水溶性エラスチンを原料として自らエラスターゼ酵素処理することにより調製したものであってもよい。以下、上記で得られた低分子量水溶性エラスチン(分子量約1〜3万)を原料として、これをエラスターゼ酵素処理することにより分解物を自ら調製する手法について、説明する。
【0029】
当該手法では、まず、原料として、分子量1〜3万の水溶性エラスチン(低分子量水溶性エラスチン)を準備する。その具体的な手法および準備された水溶性エラスチンの具体的な構成については上述したとおりである。
【0030】
続いて、準備された低分子量水溶性エラスチンを、エラスターゼの存在下、インキュベートする。これにより、当該低分子量水溶性エラスチンを加水分解して、水溶性エラスチンの分解物を得る。
【0031】
エラスターゼは、エラスチンを特異的な基質とするセリンプロテアーゼの1種であり、ウシの膵臓から最初に精製されたものである。エラスターゼの具体例としては、膵臓エラスターゼ(EC3.4.21.36)や白血球エラスターゼ(EC3.4.21.37)などが知られている。上述した手法において、インキュベートに用いられるエラスターゼの入手経路について特に制限はなく、従来公知の知見が適宜参照されうる。
【0032】
また、インキュベートする際の反応系におけるエラスターゼ濃度は、w/v換算で、水溶性エラスチンの0.001〜0.5倍であることが好ましく、0.005〜0.4倍であることがより好ましく、0.008〜0.3倍であることがさらに好ましく、0.01〜0.1倍であることが特に好ましい。この値が0.001倍未満であると、水溶性エラスチンの分解反応が十分に進行せず、分解物が効率的に得られない虞がある。一方、この値が0.5倍を超えると、水溶性エラスチンの分解反応自体は十分に進行しうるものの、エラスターゼ自身の分解物が生じて水溶性エラスチンの分解物へ混入してしまう虞がある。インキュベート時の温度およびインキュベート時間についても特に制限はないが、温度は好ましくは20〜50℃であり、より好ましくは30〜40℃であり、最も好ましくは37℃である。また、インキュベート時間は、好ましくは3〜72時間であり、より好ましくは6〜36時間であり、特に好ましくは12〜24時間である。
【0033】
上記のエラスターゼ酵素処理により得られた分解物は、そのまま阻害剤として用いられてもよいし、適宜精製処理が施された後に阻害剤として用いられてもよい。分解物の精製には、好ましくはシリカゲルカラム(より好ましくはオクタデシル(ODS)−シリカゲルカラム)を用いたカラムクロマトグラフィ法が用いられる。この際、溶離液としては、A液(0.1%トリフルオロ酢酸 in 5%アセトニトリル)とB液(0.1%トリフルオロ酢酸 in 95%アセトニトリル)との混合液が用いられうる。この場合、分解物は、A液とB液との混合比が80/20〜50/50(A液/B液(v/v))である溶離液によって溶出される画分から精製されうる。もちろん、他の組成を有する溶離液を用いた溶出によっても分解物は精製可能であって、本発明の技術的範囲が上記の形態のみに限定されるわけではない。また、上記特定のシリカゲルカラムを用いたカラムクロマトグラフィ法以外にも、限外ろ過法、逆相クロマトグラフィー(HPLC)法などの従来公知の手法によって、分解物を精製してもよい。
【0034】
例えば上述の分解物を含む溶出画分に対して凍結乾燥処理を施してもよい。これにより、水溶性エラスチンのエラスターゼ分解物を粉末形態で得ることが可能である。ここで、凍結乾燥処理の具体的な手法について特に制限はなく、従来公知の知見が適宜参照されうる。
【0035】
例えば上記のようにして得られた分解物の平均分子量その他の具体的な形態について特に制限はないが、平均分子量は2,000〜20,000程度であり、好ましくは5,000〜15,000である。分子量がこれらの範囲に存在する分解物を阻害剤として用いた場合には、特に経口用途(飲食品、経口投与が予定される医薬)に用いられた場合の消化吸収に優れるため、好ましい。かような観点から、本発明により提供される阻害剤は、水溶性エラスチンのエラスターゼ分解物を必須に含有するものであることが、当該分解物を含有しないものよりも好ましい。かような形態によれば、ACE阻害活性がより一層高い阻害剤が提供されうるという利点も存在する(後述する実施例を参照)。なお、水溶性エラスチンのエラスターゼ分解物の平均分子量の値としては、SDS−PAGEの泳動結果における中央値を算出することにより測定された値を採用するものとする。
【0036】
なお、食品産業センター技術研究報告書No.27, 2001, 21〜26頁には、エラスターゼ活性を持つ酵素処理によって製造した水溶性エラスチン(分子量は不明)を、高脂肪食負荷ラットおよび健常者に投与したところ、血中の総コレステロール、中性脂肪等が低下し、血中脂質代謝異常が改善されたことが報告されている。しかし、この報告で用いられている水溶性エラスチンは、これまで高純度と評価されている水溶性エラスチンとはアミノ酸組成がかなり異なっている(プロリン、グリシン、アラニン、バリンが68%に過ぎない)。そればかりか、エラスチンに特有のアミノ酸であるデスモシンおよびイソデスモシンも検出されていないことから、極度に低純度のもの、あるいはエラスチンとは異なるものではないかと推定される。
【0037】
本発明の阻害剤において用いられる水溶性エラスチンまたはそのエラスターゼ加水分解物は、易水溶性であり、水溶液として安定な性状を維持することができる。このため、医薬および飲食品に通常添加されうる成分との混和性に優れている。また、水溶性エラスチンまたはそのエラスターゼ加水分解物は、無毒、無味、無臭であって、安全性にも優れている。このため、においや味といった官能特性への影響や、副作用の心配がなく、日常の食生活に適宜取り入れて無理なく摂取することができる。また、水溶性エラスチンまたはそのエラスターゼ加水分解物は天然タンパク質としての特性を持ち、たとえ大量に摂取したとしても無害であり、体内では栄養源として利用されうる。
【0038】
本発明の一形態によるアンジオテンシン変換酵素阻害剤は、水溶性エラスチンまたはそのエラスターゼ加水分解物を有効成分として含む。ここで、「有効成分として含む」とは、本発明に係る阻害剤が、所望のACE阻害効果を発揮するのに充分な量(すなわち、有効量)の水溶性エラスチンまたはそのエラスターゼ加水分解物を含有することを意味する。
【0039】
したがって、水溶性エラスチンまたはそのエラスターゼ加水分解物を、そのままACE阻害剤として用いてもよいが、このような有効量で有効成分を含み、かつACE阻害効果を損なわない限りにおいて、本発明に係る阻害剤は、所望の製品形態に応じた薬理学的に許容されうる担体や、他の添加剤を含んでもよい。このような担体、および添加剤としては、例えば、賦形剤、結合剤、香料、緩衝剤、増粘剤、着色剤、安定剤、乳化剤、分散剤、懸濁化剤、崩壊剤、滑沢剤、防腐剤等が挙げられる。本発明に係る阻害剤は、経口または非経口的に投与または摂取することができる。経口用の形態としては、例えば、食品、食品添加剤、錠剤、散剤、細粒剤、顆粒剤、カプセル剤、丸剤、徐放剤などの固形製剤、溶液、懸濁液、乳濁液などの液状製剤の形態が挙げられる。非経口用の形態としては、例えば、注射剤、点滴剤、外用剤や座剤の形態が挙げられる。これらは、当該技術分野で通常行われている手法により、必要に応じて担体や添加剤とともに、製剤化もしくは製品化することができる。なお、上述したように、経口的に投与・摂取される製剤の形態を有する阻害剤は、水溶性エラスチンのエラスターゼ加水分解物を含むことが、当該阻害剤の投与・摂取後の消化吸収の観点から、好ましい。
【0040】
本発明に係る阻害剤において、所望のACE阻害効果を得るためには、上述した有効成分を、有効成分である水溶性エラスチンまたはそのエラスターゼ加水分解物換算で、成人一人の体重1kg当たり、1日に30〜6000mg投与または摂取することが好ましく、より好ましくは50〜2000mgであり、さらに好ましくは100〜1000mgである。1日の投与量もしくは摂取量が上記下限値未満であると、充分な効果が得られない虞がある。また上記上限値を超えて投与または摂取しても、それ以上の効果の増加はあまり望めない。本発明においては、この量の有効成分を1日1〜数回に分けて、阻害剤そのままの形態で、または、医薬、飲食品等の所望の形態とした上で、投与または摂取すればよい。
【0041】
本発明の阻害剤における有効成分である水溶性エラスチンまたはそのエラスターゼ加水分解物は、アンジオテンシン変換酵素(ACE;Angiotensin Converting Enzyme)の阻害作用を有する(後述する実施例を参照)。ACEはアンジオテンシンIから生理活性を有するアンジオテンシンIIを生成する反応を触媒する酵素である。そして、アンジオテンシンIIは血圧調節系において昇圧作用を示す生理活性ペプチドであることから、ACE阻害作用を有することが今般見出された水溶性エラスチンおよびそのエラスターゼ加水分解物は、血圧降下剤として作用することが期待されている。また、ACEはキニンの分解に関与するキニナーゼIIと同一の酵素であることから、ACE阻害によってブラジキニン、さらにはプロスタグランジンや一酸化窒素(NO)の増量を介してもまた、血圧調節系における降圧系が活性化される。したがって、本発明のACE阻害剤は、高血圧症の予防および/または治療のための、血圧降下剤として使用できる。すなわち、本発明によれば、上記ACE阻害剤を含有する血圧降下剤が提供される。
【0042】
また、本発明の他の形態によれば、水溶性エラスチンまたはそのエラスターゼ加水分解物の有効量を、哺乳動物に投与するかまたは摂取させることを含む、当該哺乳動物におけるACEを阻害する方法、当該哺乳動物の血圧を低下させる方法、あるいは、当該哺乳動物における高血圧症を予防および/または治療する方法が提供される。なお、「有効量」とは、ACE阻害や、これによる血圧の低下、高血圧の予防および/または治療といった所望の効果を発揮する上で少なくとも必要とされる有効成分の量を意味する。
【0043】
本発明に係る阻害剤は、それ単独でも使用することができるが、医薬、飲食品などの種々の組成物に添加剤として含有させることができ、ACE阻害効果を有する組成物を提供することができる。
【0044】
本発明に係る血圧降下剤として用いられうる医薬組成物は、上述したように、本発明に係るACE阻害剤を含むことを特徴とする。ここで、該医薬組成物において、ACE阻害剤の有効成分を有効量含むように、医薬組成物は、該阻害剤を適切な量で含むことが好ましい。
【0045】
したがって、本発明による医薬組成物は、所望の効果を発揮するのに充分な量(すなわち、有効量)の水溶性エラスチンまたはそのエラスターゼ加水分解物を含有するものであって、製剤化のために許容されうる添加剤を併用して、常法に従い、経口製剤または非経口製剤として調製したものである。このような製剤化のために許容されうる添加剤としては、例えば、賦形剤、安定剤、防腐剤、湿潤剤、乳化剤、滑沢剤、甘味料、着色料、香料、緩衝剤、酸化防止剤、pH調整剤、結合剤、増粘剤、分散剤、懸濁化剤、崩壊剤などを挙げることができる。本発明において、医薬組成物が経口製剤の場合には、食品、食品添加剤、錠剤、散剤、細粒剤、顆粒剤、カプセル剤、丸剤、徐放剤などの固形製剤、溶液、懸濁液、乳濁液などの液状製剤の形態をとることができる。また、非経口製剤の場合には、注射剤、点滴剤、外用剤や坐剤の形態をとることができる。簡易性の点からは、経口製剤であることが好ましい。
【0046】
本発明に係る医薬組成物は、必要に応じて、他の補助成分をさらに含んでいてもよい。このような併用可能な他の補助成分としては、例えば、ビタミン成分(例えば、ビタミンC、ビタミンE)、抗生物質、アミノ酸類、ペプチド類、ミネラル類(例えば、亜鉛、鉄、銅、マンガンなど)、核酸、多糖類、脂肪酸類、生薬などが挙げられる。
【0047】
さらに製剤化にあたって、本発明に係る有効成分以外の1種以上の医療上有効な有効成分(活性成分)をさらに添加し配合してもよい。また本発明に係る有効成分の投与にあたっては、本発明に係る有効成分以外の1種以上の医療上有効な有効成分を組み合わせて投与してもよい。
【0048】
本発明によれば、上述したACE阻害剤を含有する飲食品もまた、提供される。ここで、当該飲食品は、ACE阻害剤の有効成分を有効量含むように、当該阻害剤を適切な量で含むことが好ましい。ここで「有効成分を有効量含む」とは、個々の飲食品を通常喫食される量摂取した結果、有効成分としての効果を発揮しうるような量で有効成分を含有することを意味する。本発明に係る飲食品には、本発明に係る有効成分をそのまま、または上述したような阻害剤の形態で、飲食品に配合してもよい。また、本発明に係る飲食品は、本発明に係る有効成分に安定剤等の慣用の添加成分を加えて飲食品として調製したもの、各種タンパク質、糖類、脂肪、微量元素、ビタミン類等を、それらにさらに配合して調製したもの、液状、半液体状若しくは固体状にしたもの、ペースト状にしたもの、または、一般の飲食品へ有効成分を添加したものであってもよい。
【0049】
本発明において、「飲食品」は、医薬以外のものであって、哺乳動物が経口摂取可能な形態のものであれば特に制限はなく、その形態も液状物(溶液、懸濁液、乳濁液など)、半液体状物、粉末、または固体成形物のいずれのものであってもよい。このため飲食品は、例えば飲料の形態であってもよく、また、サプリメントのような栄養補助食品の錠剤形態であってもよい。
【0050】
飲食品として具体的には、例えば、即席麺、レトルト食品、缶詰、電子レンジ食品、即席スープ・みそ汁類、フリーズドライ食品などの即席食品類;清涼飲料、果汁飲料、野菜飲料、豆乳飲料、コーヒー飲料、茶飲料、粉末飲料、濃縮飲料、栄養飲料、アルコール飲料などの飲料類;パン、パスタ、麺、ケーキミックス、唐揚げ粉、パン粉などの小麦粉製品;飴、キャラメル、チューイングガム、チョコレート、クッキー、ビスケット、ケーキ、パイ、スナック、クラッカー、和菓子、デザート菓子などの菓子類;ソース、トマト加工調味料、風味調味料、調理ミックス、たれ類、ドレッシング類、つゆ類、カレー・シチューの素類などの調味料;加工油脂、バター、マーガリン、マヨネーズなどの油脂類;乳飲料、ヨーグルト類、乳酸菌飲料、アイスクリーム類、クリーム類などの乳製品;魚肉ハム・ソーセージ、水産練り製品などの水産加工品;畜肉ハム・ソーセージなどの畜産加工品;農産缶詰、ジャム・マーマレード類、漬け物、煮豆、シリアルなどの農産加工品;冷凍食品;栄養食品などが挙げられる。
【0051】
本発明に係る飲食品は、高血圧症に罹患しているか、または罹患していることが疑われる者、あるいは高血圧症への罹患のリスクが高い者に対して好適に使用することができる。ここで、高血圧症への罹患のリスクが高い者としては、例えば、体組成や食生活をはじめとする各種の指標を考慮して、または、健康診断等の診断・診察から、当該リスクが高いと判断された者や、そのようなリスクが高いと本人または周囲の者から認識されるに至った者が含まれる。
【0052】
本発明において「飲食品」には、健康食品、機能性食品、特定保健用食品、栄養補助食品、疾病リスク低減表示が付された食品、または、病者用食品のような分類のものも包含される。さらに「飲食品」という用語は、ヒト以外の哺乳動物を対象として使用される場合には、飼料を含む意味で用いられうる。ここでいう特定保健用食品とは、高血圧症の予防および/または改善等を目的として食品の製造または販売等を行う場合に、保健上の観点から、各国(例えば我が国)において法上の何らかの制限を受けることがある食品をいう。このような食品は、食品が疾病リスクを低減する可能性があること表示した食品、すなわち、疾病リスク低減表示を付した食品であってもよい。ここで、疾病リスク低減表示とは、疾病リスクを低減する可能性のある食品の表示であって、FAO/WHO合同食品規格委員会(コーデックス委員会)の定める規格に基づいて、またはその規格を参考にして、定められた表示または認められた表示でありうる。
【0053】
本発明の飲食品においては、上述した有効成分に加えて、他の機能を有する成分をさらに添加してもよい。また例えば、日常生活で摂取する食品、健康食品、機能性食品、サプリメント(例えば、カルシウム、マグネシウム等のミネラル類、ビタミンK等のビタミン類を1種以上含有する食品)に本発明の有効成分を配合することにより、本発明による効果に加えて、他の成分に基づく機能を併せ持つ飲食品を提供することができる。
【0054】
本発明の他の形態によれば、上述したACE阻害剤の有効成分である水溶性エラスチンまたはそのエラスターゼ加水分解物を有効量含有する飲食品であって、高血圧症を予防および/または改善する機能を有し、その機能表示が付された飲食品が提供される。ここで飲食品に付される機能表示は、例えば、製品の本体、容器、包装、説明書、添付文書、または宣伝物のいずれかに付することができる。
【0055】
本発明による飲食品の製造にあたっては、通常の飲食品の処方設計に用いられている糖類、香料、果汁、食品添加剤、安定剤などを適宜添加することができる。飲食品の製造は、当該技術分野に公知の製造技術を参照して実施することができる。本発明に係る飲食品は様々な形態を取ることができ、公知の医薬品の製造技術に準じて本発明に係る飲食品を製造してもよい。その場合には、本発明に係る阻害剤や医薬組成物の製造の項目において述べたような担体や添加剤を用いて製造することができる。また、製造段階において、本発明における機能以外の機能を発揮する他の成分または他の機能性食品と組み合わせることによって、多機能性の飲食品としてもよい。
【0056】
本発明に係る医薬組成物および飲食品を投与または摂取する場合、本発明に係る有効成分の投与量または摂取量は、受容者、受容者の年齢および体重、症状、投与時間、剤形、投与方法、薬剤の組み合わせ等に依存して決定されうる。本発明においては、少なくともACE阻害効果を得るために必要な1日あたりの有効成分の量を投与または摂取できるように、1日あたりの組成物または飲食品の投与量または摂取量を考慮し、組成物または飲食品中の含有量を適宜設定することが好ましい。
【0057】
したがって、本発明による医薬組成物または飲食品は、好ましくは、有効成分である水溶性エラスチンまたはそのエラスターゼ加水分解物を、当該有効成分換算で成人一人に1日あたり好ましくは30〜6000mg、より好ましくは50〜2000mg、さらに好ましくは100〜1000mgの範囲で提供される量含む。
【実施例】
【0058】
以下、実施例を用いて本発明の好適な実施形態についてより詳細に説明するが、本発明の技術的範囲が下記の実施例のみに限定して解釈されるべきではない。
【0059】
(概要)
以下ではまず、BSE等の問題のないブタの大動脈組織から高純度の水溶性エラスチンを調製し、種々の酵素を用いて高分子の水溶性エラスチンを低分子化してエラスチン由来ペプチドを得る条件検討を実施した。具体的には、酵素の種類、濃度、反応時間等を検討し、SDS−PAGE装置を用いて反応の進行状況を追跡した。次に、得られたエラスチン由来ペプチドについて、ACE阻害能の測定を実施した。
【0060】
(ブタ大動脈組織からの高純度水溶性エラスチンの調製)
以下の手法により、特許文献1の記載を参照しつつ、ブタ大動脈組織から、水溶性エラスチンを調製した。
【0061】
まず、ブタ大動脈をマスコロイダー(磨砕機)で処理し、処理後の組織に湿重量の約5倍量のアセトンを加え、室温にて24時間撹拌した。次いで、ろ過脱水式遠心分離機にて遠心分離(2,000rpm、室温、5分)を行い、アセトンを除去後、乾燥(50℃、3日間)して、アセトン脱脂組織を得た。
【0062】
得られた脱脂組織に、脱脂組織重量の約10倍量の1M NaClを加え、室温にて1時間撹拌した。(室温、1時間)。次いで、ろ過脱水式遠心分離機にて遠心分離(2,000rpm、室温、5分)を行い、残渣を回収した。この残渣に、脱脂組織重量の約10倍量の蒸留水を加え、当該残渣を洗浄(室温、1時間)した。その後、再度、ろ過脱水式遠心分離機にて遠心分離(2,000rpm、室温、5分)を行い、残渣を回収して、NaCl抽出残渣を得た。
【0063】
脱脂組織重量の約10倍量の0.1M NaOHを100℃に加熱し、そこに上記で得られたNaCl残渣を加え、撹拌(100℃、15分)した。次いで、ろ過脱水式遠心分離機にて遠心分離(2,000rpm、室温、5分)を行い、残渣を回収した。この残渣に、脱脂組織重量の約10倍量の蒸留水を加え、残渣を洗浄(室温、1時間)した。その後、再度、ろ過脱水式遠心分離機にて遠心分離(2,000rpm、室温、5分)を行い、残渣を回収して、不溶性エラスチンを得た。
【0064】
脱脂組織重量の約15倍量の0.75M NaOHを100℃に加熱し、そこに上記で得られた不溶性エラスチンを加え、撹拌(100℃、50分)した。次いで、撹拌後の溶液を氷冷後、酢酸を用いて中和し、冷却遠心分離機にて遠心分離(5,000rpm、4℃、20分)を行い、上清を回収した。得られた上清を透析(4℃、4日)した後、凍結乾燥処理を施して、粉末状の高純度水溶性エラスチンを得た。
【0065】
(エラスターゼを用いた水溶性エラスチンの分解)
上記で調製したブタ大動脈組織由来の水溶性エラスチンについて、消化酵素としてエラスターゼを用いた分解反応の検討を行った。エラスターゼの濃度を0.01mg/ml、0.1mg/ml、1.0mg/mlの3種に設定し、それぞれをTris−HCl緩衝液(0.2M、pH8.8)に溶解した水溶性エラスチン(2.0mg/ml)とともに、反応温度37℃で3時間、6時間、24時間インキュベートして、分解反応を進行させた。この際、水溶性エラスチンが分解される様子をSDS−PAGE(CBB染色)により追跡した。
【0066】
その結果、0.01mg/mlの酵素濃度においては、図1に示すように、24時間後においても水溶性エラスチンの分子量分布がほとんど変化することなく、分解が不十分であったことがわかる。一方、0.1mg/mlの酵素濃度においては、図2に示すように、反応時間が3時間、6時間と経過するにつれて分子量が低分子量側(下方向)へと変化していく様子が観察され、24時間後には水溶性エラスチンが十分に分解されることが確認された。なお、図2に示す結果において分子量28.0kDa付近に検出されている濃いバンドはエラスターゼに由来するものである。また、1mg/mlの酵素濃度では、SDS−PAGEにおいて短時間での分解が観察され、効率的な分解が期待されるものの、反応溶液の様子をHPLCで検討したところ、溶出時間10分から20分の範囲にエラスターゼ自身の分解物が溶出され、それらは水溶性エラスチンの分解物と同時に溶出され混ざり合ってしまう。また、エラスターゼの濃度が濃いために、酵素の自己消化由来の溶出物が多くなってしまい、水溶性エラスチン分解物の分離・分析に困難を伴うものと考えられた。そこで、水溶性エラスチンを十分に分解することができ、かつ、水溶性エラスチン分解物を効率的に精製することのできる最適なエラスターゼの濃度は0.1mg/ml程度であると推定された。
【0067】
(他の消化酵素による水溶性エラスチンの分解)
上記で調製したブタ大動脈組織由来の水溶性エラスチンについて、エラスターゼ以外のタンパク質分解酵素であるキモトリプシンおよびトリプシンを用いて分解反応を検討した。各酵素濃度はエラスターゼの最適濃度である0.1mg/mlとし、反応温度は37℃で、3時間、6時間、24時間後の分解の様子をエラスターゼの場合と同様にSDS−PAGEにより調べた(図3(キモトリプシン処理)および図4(トリプシン処理))。
【0068】
その結果、キモトリプシンまたはトリプシンを用いた分解処理では、24時間後においても分子量分布の変化が小さく顕著な分子量の低下が認められず、十分に分解することができなかった。このように両酵素を用いた場合には水溶性エラスチンを十分に低分子量化することが困難であることが示されたことから、水溶性エラスチンの分解反応にはエラスターゼ(酵素濃度0.1mg/ml程度)が最適であることが確認された。
【0069】
(簡易カラムを用いた水溶性エラスチン分解物の精製)
上記で、水溶性エラスチンの分解には濃度0.1mg/ml程度のエラスターゼを用いて約37℃にて24時間程度、処理を行うことが好ましいことが示された。ここでは、最終的に水溶性エラスチン分解物のみを精製するために、Sep−Pak C−18カラム(Waters社製)を用いたエラスチン分解物の分離を実施した。試料の溶出にはA液(0.1%TFA in 5%CH3CN)およびB液(0.1%TFA in 95%CH3CN)(TFA:トリフルオロ酢酸、CH3CN:アセトニトリル)の混合率を調節して溶出を行った。その結果、B液の割合が0%の段階においては、緩衝液由来の塩のみが溶出され、B液が35%の割合において目的の分解物が溶出された。最後にB液の割合を100%に上昇させエラスターゼのみの溶出を行い、順次各々の成分を分離した。このようにして、水溶性エラスチン分解物の画分のみを精製し、溶出試料を凍結乾燥し、目的物を白色粉末で得た。また、収率は1回目の調製が水溶性エラスチン18.8mgからエラスターゼ分解物15.9mg(84.6%)、2回目の調製が45.8mgから27.7mg(60.5%)と、いずれも60〜90%の高い収率で目的物(水溶性エラスチン分解物)を得ることができた。なお、得られた水溶性エラスチン分解物の平均分子量は10,000であった。
【0070】
(水溶性エラスチン分解物によるACE阻害能の評価)
ACE阻害活性の測定には、蛍光基質であるAbz-ε-Acp-Ala-Phe(p-NO2)-Leu-OH(渡辺化学工業)を使用した。反応は0.2M Tris−HCl(pH8.0+0.02M NaCl)緩衝液中で行い、酵素としてはウサギ(rabbit)ACE(Sigma社製)を使用した。具体的には、基質溶液(0.5ppm、2ml)に酵素(9unit、0.5ml)を加え、上記で調製した水溶性エラスチンまたは水溶性エラスチン分解物を阻害剤として(3mg、0.5ml)加えた。全ての活性測定には37℃で15分間反応を行った。
【0071】
阻害剤を加えない場合をACE活性100%として、水溶性エラスチンまたは水溶性エラスチン分解物のACE阻害能を調べたところ、図5に示すように、分解前の水溶性エラスチンのサンプルでは62%、エラスターゼ処理による分解後の水溶性エラスチン分解物のサンプルでは78%もの阻害能を示していた。したがって、水溶性エラスチンまたはそのエラスターゼ分解物は、ACEを阻害することにより、有効な血圧降下作用を持つことが示唆された。
【特許請求の範囲】
【請求項1】
水溶性エラスチンまたはそのエラスターゼ加水分解物を有効成分として含有する、アンジオテンシン変換酵素阻害剤。
【請求項2】
前記エラスターゼ加水分解物を有効成分として含有する、請求項1に記載の阻害剤。
【請求項3】
請求項1または2に記載のアンジオテンシン変換酵素阻害剤を含有する、血圧降下剤。
【請求項4】
請求項1または2に記載のアンジオテンシン変換酵素阻害剤を含有し、高血圧の予防および/または治療に用いられる、医薬組成物。
【請求項5】
請求項1または2に記載のアンジオテンシン変換酵素阻害剤を含有する、飲食品。
【請求項6】
水溶性エラスチンまたはそのエラスターゼ加水分解物を有効量含有する飲食品であって、
高血圧症を予防および/または改善する機能を有し、その機能表示が付された、飲食品。
【請求項7】
健康食品、機能性食品、特定保健用食品、栄養補助食品、疾病リスク低減表示が付された食品、または病者用食品である、請求項6に記載の飲食品。
【請求項8】
分子量1〜3万の水溶性エラスチンを、w/v換算で0.001〜0.5倍の濃度のエラスターゼの存在下、20〜50℃の温度で3〜72時間インキュベートすることにより、前記水溶性エラスチンを加水分解して前記水溶性エラスチンの分解物を得る工程を含む、水溶性エラスチン分解物の製造方法。
【請求項9】
オクタデシル(ODS)−シリカゲルカラムを用いたカラムクロマトグラフィ法を用いて前記分解物を精製する工程をさらに含む、請求項8に記載の製造方法。
【請求項10】
A液(0.1%トリフルオロ酢酸 in 5%アセトニトリル)とB液(0.1%トリフルオロ酢酸 in 95%アセトニトリル)との混合比が80/20〜50/50(A液/B液(v/v))である溶離液によって溶出される画分から前記分解物が精製される、請求項9に記載の製造方法。
【請求項11】
溶出された画分であって前記分解物を含むものを凍結乾燥することにより、前記分解物を粉末の形態で得る工程をさらに含む、請求項9または10に記載の製造方法。
【請求項1】
水溶性エラスチンまたはそのエラスターゼ加水分解物を有効成分として含有する、アンジオテンシン変換酵素阻害剤。
【請求項2】
前記エラスターゼ加水分解物を有効成分として含有する、請求項1に記載の阻害剤。
【請求項3】
請求項1または2に記載のアンジオテンシン変換酵素阻害剤を含有する、血圧降下剤。
【請求項4】
請求項1または2に記載のアンジオテンシン変換酵素阻害剤を含有し、高血圧の予防および/または治療に用いられる、医薬組成物。
【請求項5】
請求項1または2に記載のアンジオテンシン変換酵素阻害剤を含有する、飲食品。
【請求項6】
水溶性エラスチンまたはそのエラスターゼ加水分解物を有効量含有する飲食品であって、
高血圧症を予防および/または改善する機能を有し、その機能表示が付された、飲食品。
【請求項7】
健康食品、機能性食品、特定保健用食品、栄養補助食品、疾病リスク低減表示が付された食品、または病者用食品である、請求項6に記載の飲食品。
【請求項8】
分子量1〜3万の水溶性エラスチンを、w/v換算で0.001〜0.5倍の濃度のエラスターゼの存在下、20〜50℃の温度で3〜72時間インキュベートすることにより、前記水溶性エラスチンを加水分解して前記水溶性エラスチンの分解物を得る工程を含む、水溶性エラスチン分解物の製造方法。
【請求項9】
オクタデシル(ODS)−シリカゲルカラムを用いたカラムクロマトグラフィ法を用いて前記分解物を精製する工程をさらに含む、請求項8に記載の製造方法。
【請求項10】
A液(0.1%トリフルオロ酢酸 in 5%アセトニトリル)とB液(0.1%トリフルオロ酢酸 in 95%アセトニトリル)との混合比が80/20〜50/50(A液/B液(v/v))である溶離液によって溶出される画分から前記分解物が精製される、請求項9に記載の製造方法。
【請求項11】
溶出された画分であって前記分解物を含むものを凍結乾燥することにより、前記分解物を粉末の形態で得る工程をさらに含む、請求項9または10に記載の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2012−56879(P2012−56879A)
【公開日】平成24年3月22日(2012.3.22)
【国際特許分類】
【出願番号】特願2010−201353(P2010−201353)
【出願日】平成22年9月8日(2010.9.8)
【出願人】(504174135)国立大学法人九州工業大学 (489)
【Fターム(参考)】
【公開日】平成24年3月22日(2012.3.22)
【国際特許分類】
【出願日】平成22年9月8日(2010.9.8)
【出願人】(504174135)国立大学法人九州工業大学 (489)
【Fターム(参考)】
[ Back to top ]

