アンタゴニストのヒトLIGHT特異的ヒトモノクローナル抗体
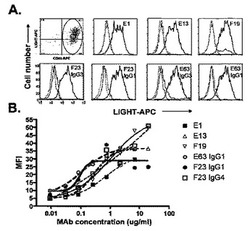
hLIGHTポリペプチドに免疫特異的に結合する、完全ヒト抗体などの抗体が、本明細書に提供される。また、hLIGHTポリペプチドに免疫特異的に結合する完全ヒト抗体などの抗体をコードする単離された核酸が提供される。hLIGHTポリペプチドに免疫特異的に結合する完全ヒト抗体などの抗体をコードする核酸を含むベクター及び宿主細胞が更に提供される。また、hLIGHTポリペプチドに免疫特異的に結合する完全ヒト抗体などの抗体を作製する方法が提供される。また、hLIGHTポリペプチドに免疫特異的に結合する完全ヒト抗体などの抗体を対象に投与することを含む、対象におけるhLIGHTを媒介した疾患を治療する方法が、本明細書に提供される。好ましい実施態様において、本明細書に提供したその抗hLIGHT抗体は、インビボでのhLIGHT生物活性(例えば、hLIGHTを媒介した、hLIGHT受容体を発現する細胞からのCCL20、IL-8、又はRANTESの産生、又は分泌)を寛解させ、中和し、又はさもなければ阻害するであろう。また、サンプルにおけるhLIGHTの検出のための方法、並びに例えばhLIGHT活性が有害である障害に罹患しているヒト対象において、hLIGHT活性を寛解させ、中和し、又はさもなければ阻害するための方法が、本明細書に提供される。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
hLIGHTエピトープに特異的に結合する単離された抗体であって、該抗体による該hLIGHTエピトープへの結合が:
(a)E1抗体(ATCCアクセッション番号PTA-7729)、E13抗体(ATCCアクセッション番号PTA-7842)、若しくはE63抗体(ATCCアクセッション番号PTA-7818)、又は
(b)F19抗体(ATCCアクセッション番号PTA-7819)若しくはF23抗体(ATCCアクセッション番号PTA-7728);
により用量依存的様式で競合的に遮断されるが、但し、該hLIGHTエピトープへの結合が:
(a)E1抗体及びF19抗体、
(b)E1抗体及びF23抗体、
(c)E13抗体及びF19抗体、
(d)E13抗体及びF23抗体、
(e)E63抗体及びF19抗体、又は
(f)E63抗体及びF23抗体;
の両方により遮断されないことを条件とする、前記単離された抗体。
【請求項2】
hLIGHTエピトープに特異的に結合する単離された完全ヒト抗体であって、該抗体による該hLIGHTエピトープへの結合が:
(a)E1抗体、E13抗体、若しくはE63抗体、又は
(b)F19抗体若しくはF23抗体;
により用量依存的様式で競合的に遮断される、前記単離された完全ヒト抗体。
【請求項3】
アンタゴニスト抗体である、請求項1又は2記載の抗体。
【請求項4】
細胞表面で発現したhLIGHT又は可溶性hLIGHTへの結合について、HVEM、LTβR、又はそれらの融合タンパク質と競合する、請求項3記載の抗体。
【請求項5】
HVEM、LTβR、DcR3、若しくはそれらの任意の組み合わせの、細胞表面で発現したhLIGHT若しくは可溶性hLIGHTへの結合を部分的に又は完全に阻害する、請求項3記載の抗体。
【請求項6】
細胞表面で発現したhLIGHT受容体を有する細胞からのCCL20、IL-8、RANTES、又はそれらの任意の組み合わせのhLIGHTを媒介した分泌を部分的に又は完全に阻害する、請求項3記載の抗体。
【請求項7】
(a)配列番号1、2、3、4、又は5のいずれか1つに記載されるアミノ酸配列を有する重鎖可変領域(VH);及び/又は
(b)配列番号82、6、83、7、8、90、9、91、92、又は10のいずれか1つに記載されるアミノ酸配列を有する軽鎖可変領域(VL);
を含む、請求項1又は2記載の抗体。
【請求項8】
(a)配列番号1に記載されるアミノ酸配列を有するVHドメイン、及び配列番号82、6又は83のいずれか1つに記載されるアミノ酸配列を有するVLドメイン;
(b)配列番号2に記載されるアミノ酸配列を有するVHドメイン、及び配列番号7に記載されるアミノ酸配列を有するVLドメイン;
(c)配列番号3に記載されるアミノ酸配列を有するVHドメイン、及び配列番号8に記載されるアミノ酸配列を有するVLドメイン;
(d)配列番号4に記載されるアミノ酸配列を有するVHドメイン、及び配列番号90、9又は91のいずれか1つに記載されるアミノ酸配列を有するVLドメイン;又は、
(e)配列番号5に記載されるアミノ酸配列を有するVHドメイン、及び配列番号10に記載されるアミノ酸配列を有するVLドメイン;
を含む、請求項7記載の抗体。
【請求項9】
(a)配列番号1に記載されるアミノ酸配列を有するVHドメイン、及び配列番号6のいずれか1つに記載されるアミノ酸配列を有するVLドメイン;又は、
(b)配列番号4に記載されるアミノ酸配列を有するVHドメイン、及び配列番号9のいずれか1つに記載されるアミノ酸配列を有するVLドメイン;
を含む、請求項8記載の抗体。
【請求項10】
(a)(1)配列番号11、14、17、20、及び23からなる群から選択されるVH CDR1;
(2)配列番号12、15、18、21、及び24からなる群から選択されるVH CDR2;及び/若しくは
(3)配列番号13、16、19、22、及び25からなる群から選択されるVH CDR3;を含む重鎖可変領域;並びに/又は、
(b)(1)配列番号84、26、85、29、32、93、35、94、95、及び38からなる群から選択されるVL CDR1;
(2)配列番号86、27、87、30、33、96、36、97、98、及び39からなる群から選択されるVL CDR2;及び/若しくは
(3)配列番号88、28、89、31、34、99、37、100、101、及び40からなる群から選択されるVL CDR3;を含む軽鎖可変領域;
を含む、請求項1又は2記載の抗体。
【請求項11】
(a)配列番号11に記載されるアミノ酸配列を有するVH CDR1、配列番号12に記載されるアミノ酸配列を有するVH CDR2、及び配列番号13に記載されるアミノ酸配列を有するVH CDR3を含む重鎖可変領域;並びに/又は、
(b)配列番号84、26、又は85に記載されるアミノ酸配列を有するVL CDR1、配列番号86、27、又は87に記載されるアミノ酸配列を有するVL CDR2、及び配列番号88、28、又は89に記載されるアミノ酸配列を有するVL CDR3を含む軽鎖可変領域;
を含む、請求項10記載の抗体。
【請求項12】
配列番号26に記載されるアミノ酸配列を有するVL CDR1、配列番号27に記載されるアミノ酸配列を有するVL CDR2、及び配列番号28に記載されるアミノ酸配列を有するVL CDR3を含む軽鎖可変領域を含む、請求項11記載の抗体。
【請求項13】
(a)配列番号14に記載されるアミノ酸配列を有するVH CDR1、配列番号15に記載されるアミノ酸配列を有するVH CDR2、及び配列番号16に記載されるアミノ酸配列を有するVH CDR3を含む重鎖可変領域;並びに/又は、
(b)配列番号29に記載されるアミノ酸配列を有するVL CDR1、配列番号30に記載されるアミノ酸配列を有するVL CDR2、及び配列番号31に記載されるアミノ酸配列を有するVL CDR3を含む軽鎖可変領域;
を含む、請求項10記載の抗体。
【請求項14】
(a)配列番号17に記載されるアミノ酸配列を有するVH CDR1、配列番号18に記載されるアミノ酸配列を有するVH CDR2、及び配列番号19に記載されるアミノ酸配列を有するVH CDR3を含む重鎖可変領域;並びに/又は、
(b)配列番号32に記載されるアミノ酸配列を有するVL CDR1、配列番号33に記載されるアミノ酸配列を有するVL CDR2、及び配列番号34に記載されるアミノ酸配列を有するVL CDR3を含む軽鎖可変領域;
を含む、請求項10記載の抗体。
【請求項15】
(a)配列番号20に記載されるアミノ酸配列を有するVH CDR1、配列番号21に記載されるアミノ酸配列を有するVH CDR2、及び配列番号22に記載されるアミノ酸配列を有するVH CDR3を含む重鎖可変領域;並びに/又は、
(b)配列番号93、35、94、又は95に記載されるアミノ酸配列を有するVL CDR1、配列番号96、36、97、又は98に記載されるアミノ酸配列を有するVL CDR2、及び配列番号99、37、又は100、101に記載されるアミノ酸配列を有するVL CDR3を含む軽鎖可変領域;
を含む、請求項10記載の抗体。
【請求項16】
配列番号35に記載されるアミノ酸配列を有するVL CDR1、配列番号36に記載されるアミノ酸配列を有するVL CDR2、及び配列番号37に記載されるアミノ酸配列を有するVL CDR3を含む軽鎖可変領域を含む、請求項15記載の抗体。
【請求項17】
(a)配列番号23に記載されるアミノ酸配列を有するVH CDR1、配列番号24に記載されるアミノ酸配列を有するVH CDR2、及び配列番号25に記載されるアミノ酸配列を有するVH CDR3を含む重鎖可変領域;並びに/又は、
(b)配列番号38に記載されるアミノ酸配列を有するVL CDR1、配列番号39に記載されるアミノ酸配列を有するVL CDR2、及び配列番号40に記載されるアミノ酸配列を有するVL CDR3を含む軽鎖可変領域;
を含む、請求項10記載の抗体。
【請求項18】
前記単離された抗体が、E1抗体、E13抗体、E63抗体、F19抗体又はF23抗体である、請求項1又は2記載の抗体。
【請求項19】
(a)ストリンジェントな条件下で、配列番号41、42、43、44又は45のいずれか1つに記載されるヌクレオチド配列の相補鎖にハイブリダイズするヌクレオチド配列によりコードされるVH;及び/又は、
(b)ストリンジェントな条件下で、配列番号102、46、103、47、48、104、49、105、106、又は50のいずれか1つに記載されるヌクレオチド配列の相補鎖にハイブリダイズするヌクレオチド配列によりコードされるVL;
を含む、請求項1又は2記載の抗体。
【請求項20】
ストリンジェントな条件下で、配列番号46又は49に記載されるヌクレオチド配列の相補鎖にハイブリダイズするヌクレオチド配列によりコードされるVLを含む、請求項19記載の抗体。
【請求項21】
(a)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、又はPTA-7728を有するハイブリドーマによって産生される抗体のVH;及び/又は、
(b)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、又はPTA-7728を有するハイブリドーマによって産生される抗体のVL;
を含む、請求項1又は2記載の抗体。
【請求項22】
(a)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、若しくはPTA-7728、又はそれらの組み合わせを有するハイブリドーマによって産生される抗体のVH CDR1、VH CDR2及び/又はVH CDR3;並びに/又は、
(b)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、若しくはPTA-7728、又はそれらの組み合わせを有するハイブリドーマによって産生される抗体のVL CDR1、VL CDR2及び/又はVL CDR3;
を含む、請求項1又は2記載の抗体。
【請求項23】
ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、又はPTA-7728を有するハイブリドーマによって産生される、請求項1又は2記載の抗体。
【請求項24】
E1抗体、E13抗体又はE63抗体、F19抗体又はF23抗体である、請求項1又は2記載の抗体。
【請求項25】
IgG定常ドメインを含む、請求項1又は2記載の抗体。
【請求項26】
IgG1又はIgG4定常ドメインを含む、請求項25記載の抗体。
【請求項27】
完全ヒト抗体である、請求項1記載の抗体。
【請求項28】
キメラ抗体又はヒト化抗体である、請求項1記載の抗体。
【請求項29】
モノクローナル抗体である、請求項1又は2記載の抗体。
【請求項30】
組換え抗体である、請求項1又は2記載の抗体。
【請求項31】
抗原結合フラグメントである、請求項1記載の抗体。
【請求項32】
Fabフラグメント、F(ab')2 フラグメント、単鎖Fv(sFv)、ダイアボディ、トリアボディ、又はミニボディである、請求項1記載の抗体。
【請求項33】
請求項1又は2記載の抗体を含む組成物。
【請求項34】
請求項1又は2の抗体をコードする単離された核酸分子であって、該ヌクレオチド配列が、配列番号41、42、43、44、45、102、46、103、47、48、104、49、105、106、50のいずれか1つ、又はそれらの組み合わせを含む、前記単離された核酸分子。
【請求項35】
前記ヌクレオチド配列が、配列番号46又は49を含む、請求項34記載の単離された核酸分子。
【請求項36】
(a)ストリンジェントな条件下で、配列番号41、42、43、44、又は45のいずれか1つに記載されるヌクレオチド配列の相補鎖にハイブリダイズする配列;及び/又は、
(b)ストリンジェントな条件下で、配列番号102、46、103、47、48、104、49、105、106又は50のいずれか1つに記載されるヌクレオチド配列の相補鎖にハイブリダイズする配列;
を含む、請求項34記載の単離された核酸分子。
【請求項37】
ストリンジェントな条件下で、配列番号46又は49に記載されるヌクレオチド配列の相補鎖にハイブリダイズする配列を含む、請求項36記載の単離された核酸分子。
【請求項38】
配列番号1、2、3、4若しくは5のいずれか1つに記載されるVHのアミノ酸配列、及び/又は配列番号82、6、83、7、8、90、9、91、92若しくは10のいずれか1つに記載されるVLのアミノ酸配列をコードする核酸配列を含む、又は該核酸配列からなる、単離された核酸分子。
【請求項39】
配列番号6又は9に記載されるVLのアミノ酸配列をコードする核酸配列を含む、又は該核酸配列からなる、請求項38記載の単離された核酸分子。
【請求項40】
(a)配列番号11、14、17、20、及び23からなる群から選択されるVH CDR1;
(b)配列番号12、15、18、21、及び24からなる群から選択されるVH CDR2;
(c)配列番号13、16、19、22、及び25からなる群から選択されるVH CDR3;
(d)配列番号84、26、85、29、32、93、35、94、95、及び38からなる群から選択されるVL CDR1;
(e)配列番号86、27、87、30、33、96、36、97、98、及び39からなる群から選択されるVL CDR2;及び/又は、
(f)配列番号88、28、89、31、34、99、37、100、101、及び40からなる群から選択されるVL CDR3;
を有するポリペプチドをコードする配列を含む、又は該配列からなる、単離された核酸分子。
【請求項41】
VL CDR1が配列番号26若しくは35であり;VL CDR2が配列番号27若しくは36であり;及び/又はVL CDR3が配列番号28若しくは37である、請求項40記載の単離された核酸分子。
【請求項42】
(a)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、又はPTA-7728に記載されるハイブリドーマによって産生される抗体のVHのアミノ酸配列;及び/又は、
(b)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、又はPTA-7728に記載されるハイブリドーマによって産生される抗体のVLのアミノ酸配列;
をコードする核酸配列を含む、又は該核酸配列からなる、単離された核酸分子。
【請求項43】
(a)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、若しくはPTA-7728、又はそれらの組み合わせを有するハイブリドーマにより産生される抗体のVH CDR1、VH CDR2及び/又はVH CDR3;並びに/又は、
(b)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、若しくはPTA-7728、又はそれらの組み合わせを有するハイブリドーマにより産生される抗体のVL CDR1、VL CDR2及び/又はVL CDR3;
をコードする核酸配列を含む、単離された核酸分子。
【請求項44】
ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、若しくはPTA-7728に記載されるハイブリドーマにより産生される抗体をコードする核酸配列を含む、又は該核酸配列からなる、単離された核酸分子。
【請求項45】
請求項34〜44のいずれか1項記載の核酸分子を含むベクター。
【請求項46】
請求項45記載のベクターを含む宿主細胞。
【請求項47】
hLIGHTエピトープに免疫特異的に結合する抗体の製造方法であって、該抗体による該hLIGHTエピトープへの結合が:
(a)E1抗体、E13抗体、若しくはE63抗体、又は、
(b)F19抗体若しくはF23抗体;
によって用量依存的様式で競合的に遮断されるが、但し、該hLIGHTエピトープへの結合が:
(a)E1抗体及びF19抗体、
(b)E1抗体及びF23抗体、
(c)E13抗体及びF19抗体、
(d)E13抗体及びF23抗体、
(e)E63抗体及びF19抗体、又は
(f)E63抗体及びF23抗体;
の両方により遮断されないことを条件とし、
該抗体の産生を促進する条件下で、請求項46記載の宿主細胞を培養することを含む、前記製造方法。
【請求項48】
hLIGHTエピトープに免疫特異的に結合する、単離された完全ヒト抗体の製造方法であって、該抗体による該hLIGHTエピトープへの結合が:
(a)E1抗体、E13抗体、若しくはE63抗体、又は、
(b)F19抗体若しくはF23抗体;
によって用量依存的様式で競合的に遮断され、
該抗体の産生を促進する条件下で、請求項46記載の宿主細胞を培養することを含む、前記製造方法。
【請求項49】
請求項1又は2記載の抗体を産生するハイブリドーマ。
【請求項50】
ATCCアクセッション番号PTA-7729(124 El)、PTA- 7842(124 E13)、PTA-7818(124 E63)、PTA-7819(124 F19)又はPTA-7728(124 F23)を有するハイブリドーマ。
【請求項51】
炎症性腸疾患(IBD)の1以上の症状を、その必要のあるヒトにおいて緩和させる方法であって、該ヒトに、請求項33記載の組成物の有効量を投与することを含む、前記方法。
【請求項52】
移植片対宿主病(GVHD)の1以上の症状を、その必要のあるヒトにおいて緩和させる方法であって、該ヒトに、請求項33記載の組成物の有効量を投与することを含む、前記方法。
【請求項53】
hLIGHTの、HVEM、LTβR、DcR3、若しくはそれらの任意の組み合わせへの結合を、その必要のあるヒトにおいて低減又は阻害するための方法であって、該ヒトに、請求項33記載の組成物の有効量を投与することを含む、前記方法。
【請求項54】
CCL20、IL-8、RANTES、若しくはそれらの任意の組み合わせの分泌を、その必要のあるヒトにおいて低減又は阻害するための方法であって、該ヒトに、請求項33記載の組成物の有効量を投与することを含む、前記方法。
【請求項55】
hLIGHTの、HVEM、LTβR、DcR3、若しくはそれらの任意の組み合わせへの結合を、細胞表面で発現したhLIGHTを有する細胞において低減又は阻害するための方法であって、該細胞を、請求項1又は2記載の抗体の有効量と接触させることを含む、前記方法。
【請求項56】
hLIGHTの、HVEM、LTβR、DcR3、若しくはそれらの任意の組み合わせへの結合を、細胞表面で発現するHVEM、LTβR、DcR3、若しくはそれらの任意の組み合わせを有する細胞において低減又は阻害するための方法であって、該細胞を、請求項1又は2記載の抗体の有効量と接触させることを含む、前記方法。
【請求項57】
CCL20、IL-8、RANTES、若しくはそれらの任意の組み合わせの分泌を、細胞表面で発現したhLIGHT受容体を有する細胞において低減又は阻害するための方法であって、該細胞を、請求項1又は2記載の抗体の有効量と接触させることを含む、前記方法。
【請求項58】
前記hLIGHT受容体が、HVEM、LTβR又はDcR3である、請求項57記載の方法。
【請求項59】
前記hLIGHT受容体が、HVEM、LTβR又はDcR3である、請求項6記載の抗体。
【請求項60】
検出可能なタグをさらに含む、請求項1又は2記載の抗体。
【請求項61】
サンプル中のhLIGHTの検出方法であって、該サンプルを、請求項60記載の抗体と接触させることを含む、前記方法。
【請求項62】
前記サンプルが、細胞表面にhLIGHTを発現している細胞を含む、請求項61記載の方法。
【請求項63】
請求項1又は2記載の抗体を含むキット。
【請求項64】
請求項33記載の組成物を含むキット。
【請求項65】
アミノ酸位214にリジン又はグルタミン酸を含むhLIGHTに特異的に結合する、単離されたヒトモノクローナル抗体、又はそのhLIGHT結合フラグメント。
【請求項66】
アミノ酸位32にロイシン又はセリンを含むhLIGHTに特異的に結合する、単離されたヒトモノクローナル抗体、又はそのhLIGHT結合フラグメント。
【請求項67】
前記hLIGHTがさらに、アミノ酸位32にロイシン又はセリンを含む、請求項65記載の抗体。
【請求項68】
hLIGHT受容体を有する細胞においてhLIGHT生物活性を低減又は阻害する、請求項65〜67のいずれか1項記載の抗体。
【請求項69】
HVEM、LTβR、DcR3、若しくはこれらの任意の組み合わせの、細胞表面で発現したhLIGHT若しくは可溶性hLIGHTへの結合を部分的に又は完全に阻害する、請求項65〜68のいずれか1項記載の抗体。
【請求項70】
細胞表面で発現したhLIGHT受容体を有する細胞からのCCL20、IL-8、RANTES、若しくはこれらの任意の組み合わせのhLIGHTを媒介した分泌を部分的に又は完全に阻害する、請求項65〜69のいずれか1項記載の抗体。
【請求項71】
前記hLIGHTを媒介した分泌が、可溶性hLIGHTを媒介した分泌、又は細胞表面で発現したhLIGHTを媒介した分泌である、請求項70記載の抗体。
【請求項1】
hLIGHTエピトープに特異的に結合する単離された抗体であって、該抗体による該hLIGHTエピトープへの結合が:
(a)E1抗体(ATCCアクセッション番号PTA-7729)、E13抗体(ATCCアクセッション番号PTA-7842)、若しくはE63抗体(ATCCアクセッション番号PTA-7818)、又は
(b)F19抗体(ATCCアクセッション番号PTA-7819)若しくはF23抗体(ATCCアクセッション番号PTA-7728);
により用量依存的様式で競合的に遮断されるが、但し、該hLIGHTエピトープへの結合が:
(a)E1抗体及びF19抗体、
(b)E1抗体及びF23抗体、
(c)E13抗体及びF19抗体、
(d)E13抗体及びF23抗体、
(e)E63抗体及びF19抗体、又は
(f)E63抗体及びF23抗体;
の両方により遮断されないことを条件とする、前記単離された抗体。
【請求項2】
hLIGHTエピトープに特異的に結合する単離された完全ヒト抗体であって、該抗体による該hLIGHTエピトープへの結合が:
(a)E1抗体、E13抗体、若しくはE63抗体、又は
(b)F19抗体若しくはF23抗体;
により用量依存的様式で競合的に遮断される、前記単離された完全ヒト抗体。
【請求項3】
アンタゴニスト抗体である、請求項1又は2記載の抗体。
【請求項4】
細胞表面で発現したhLIGHT又は可溶性hLIGHTへの結合について、HVEM、LTβR、又はそれらの融合タンパク質と競合する、請求項3記載の抗体。
【請求項5】
HVEM、LTβR、DcR3、若しくはそれらの任意の組み合わせの、細胞表面で発現したhLIGHT若しくは可溶性hLIGHTへの結合を部分的に又は完全に阻害する、請求項3記載の抗体。
【請求項6】
細胞表面で発現したhLIGHT受容体を有する細胞からのCCL20、IL-8、RANTES、又はそれらの任意の組み合わせのhLIGHTを媒介した分泌を部分的に又は完全に阻害する、請求項3記載の抗体。
【請求項7】
(a)配列番号1、2、3、4、又は5のいずれか1つに記載されるアミノ酸配列を有する重鎖可変領域(VH);及び/又は
(b)配列番号82、6、83、7、8、90、9、91、92、又は10のいずれか1つに記載されるアミノ酸配列を有する軽鎖可変領域(VL);
を含む、請求項1又は2記載の抗体。
【請求項8】
(a)配列番号1に記載されるアミノ酸配列を有するVHドメイン、及び配列番号82、6又は83のいずれか1つに記載されるアミノ酸配列を有するVLドメイン;
(b)配列番号2に記載されるアミノ酸配列を有するVHドメイン、及び配列番号7に記載されるアミノ酸配列を有するVLドメイン;
(c)配列番号3に記載されるアミノ酸配列を有するVHドメイン、及び配列番号8に記載されるアミノ酸配列を有するVLドメイン;
(d)配列番号4に記載されるアミノ酸配列を有するVHドメイン、及び配列番号90、9又は91のいずれか1つに記載されるアミノ酸配列を有するVLドメイン;又は、
(e)配列番号5に記載されるアミノ酸配列を有するVHドメイン、及び配列番号10に記載されるアミノ酸配列を有するVLドメイン;
を含む、請求項7記載の抗体。
【請求項9】
(a)配列番号1に記載されるアミノ酸配列を有するVHドメイン、及び配列番号6のいずれか1つに記載されるアミノ酸配列を有するVLドメイン;又は、
(b)配列番号4に記載されるアミノ酸配列を有するVHドメイン、及び配列番号9のいずれか1つに記載されるアミノ酸配列を有するVLドメイン;
を含む、請求項8記載の抗体。
【請求項10】
(a)(1)配列番号11、14、17、20、及び23からなる群から選択されるVH CDR1;
(2)配列番号12、15、18、21、及び24からなる群から選択されるVH CDR2;及び/若しくは
(3)配列番号13、16、19、22、及び25からなる群から選択されるVH CDR3;を含む重鎖可変領域;並びに/又は、
(b)(1)配列番号84、26、85、29、32、93、35、94、95、及び38からなる群から選択されるVL CDR1;
(2)配列番号86、27、87、30、33、96、36、97、98、及び39からなる群から選択されるVL CDR2;及び/若しくは
(3)配列番号88、28、89、31、34、99、37、100、101、及び40からなる群から選択されるVL CDR3;を含む軽鎖可変領域;
を含む、請求項1又は2記載の抗体。
【請求項11】
(a)配列番号11に記載されるアミノ酸配列を有するVH CDR1、配列番号12に記載されるアミノ酸配列を有するVH CDR2、及び配列番号13に記載されるアミノ酸配列を有するVH CDR3を含む重鎖可変領域;並びに/又は、
(b)配列番号84、26、又は85に記載されるアミノ酸配列を有するVL CDR1、配列番号86、27、又は87に記載されるアミノ酸配列を有するVL CDR2、及び配列番号88、28、又は89に記載されるアミノ酸配列を有するVL CDR3を含む軽鎖可変領域;
を含む、請求項10記載の抗体。
【請求項12】
配列番号26に記載されるアミノ酸配列を有するVL CDR1、配列番号27に記載されるアミノ酸配列を有するVL CDR2、及び配列番号28に記載されるアミノ酸配列を有するVL CDR3を含む軽鎖可変領域を含む、請求項11記載の抗体。
【請求項13】
(a)配列番号14に記載されるアミノ酸配列を有するVH CDR1、配列番号15に記載されるアミノ酸配列を有するVH CDR2、及び配列番号16に記載されるアミノ酸配列を有するVH CDR3を含む重鎖可変領域;並びに/又は、
(b)配列番号29に記載されるアミノ酸配列を有するVL CDR1、配列番号30に記載されるアミノ酸配列を有するVL CDR2、及び配列番号31に記載されるアミノ酸配列を有するVL CDR3を含む軽鎖可変領域;
を含む、請求項10記載の抗体。
【請求項14】
(a)配列番号17に記載されるアミノ酸配列を有するVH CDR1、配列番号18に記載されるアミノ酸配列を有するVH CDR2、及び配列番号19に記載されるアミノ酸配列を有するVH CDR3を含む重鎖可変領域;並びに/又は、
(b)配列番号32に記載されるアミノ酸配列を有するVL CDR1、配列番号33に記載されるアミノ酸配列を有するVL CDR2、及び配列番号34に記載されるアミノ酸配列を有するVL CDR3を含む軽鎖可変領域;
を含む、請求項10記載の抗体。
【請求項15】
(a)配列番号20に記載されるアミノ酸配列を有するVH CDR1、配列番号21に記載されるアミノ酸配列を有するVH CDR2、及び配列番号22に記載されるアミノ酸配列を有するVH CDR3を含む重鎖可変領域;並びに/又は、
(b)配列番号93、35、94、又は95に記載されるアミノ酸配列を有するVL CDR1、配列番号96、36、97、又は98に記載されるアミノ酸配列を有するVL CDR2、及び配列番号99、37、又は100、101に記載されるアミノ酸配列を有するVL CDR3を含む軽鎖可変領域;
を含む、請求項10記載の抗体。
【請求項16】
配列番号35に記載されるアミノ酸配列を有するVL CDR1、配列番号36に記載されるアミノ酸配列を有するVL CDR2、及び配列番号37に記載されるアミノ酸配列を有するVL CDR3を含む軽鎖可変領域を含む、請求項15記載の抗体。
【請求項17】
(a)配列番号23に記載されるアミノ酸配列を有するVH CDR1、配列番号24に記載されるアミノ酸配列を有するVH CDR2、及び配列番号25に記載されるアミノ酸配列を有するVH CDR3を含む重鎖可変領域;並びに/又は、
(b)配列番号38に記載されるアミノ酸配列を有するVL CDR1、配列番号39に記載されるアミノ酸配列を有するVL CDR2、及び配列番号40に記載されるアミノ酸配列を有するVL CDR3を含む軽鎖可変領域;
を含む、請求項10記載の抗体。
【請求項18】
前記単離された抗体が、E1抗体、E13抗体、E63抗体、F19抗体又はF23抗体である、請求項1又は2記載の抗体。
【請求項19】
(a)ストリンジェントな条件下で、配列番号41、42、43、44又は45のいずれか1つに記載されるヌクレオチド配列の相補鎖にハイブリダイズするヌクレオチド配列によりコードされるVH;及び/又は、
(b)ストリンジェントな条件下で、配列番号102、46、103、47、48、104、49、105、106、又は50のいずれか1つに記載されるヌクレオチド配列の相補鎖にハイブリダイズするヌクレオチド配列によりコードされるVL;
を含む、請求項1又は2記載の抗体。
【請求項20】
ストリンジェントな条件下で、配列番号46又は49に記載されるヌクレオチド配列の相補鎖にハイブリダイズするヌクレオチド配列によりコードされるVLを含む、請求項19記載の抗体。
【請求項21】
(a)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、又はPTA-7728を有するハイブリドーマによって産生される抗体のVH;及び/又は、
(b)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、又はPTA-7728を有するハイブリドーマによって産生される抗体のVL;
を含む、請求項1又は2記載の抗体。
【請求項22】
(a)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、若しくはPTA-7728、又はそれらの組み合わせを有するハイブリドーマによって産生される抗体のVH CDR1、VH CDR2及び/又はVH CDR3;並びに/又は、
(b)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、若しくはPTA-7728、又はそれらの組み合わせを有するハイブリドーマによって産生される抗体のVL CDR1、VL CDR2及び/又はVL CDR3;
を含む、請求項1又は2記載の抗体。
【請求項23】
ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、又はPTA-7728を有するハイブリドーマによって産生される、請求項1又は2記載の抗体。
【請求項24】
E1抗体、E13抗体又はE63抗体、F19抗体又はF23抗体である、請求項1又は2記載の抗体。
【請求項25】
IgG定常ドメインを含む、請求項1又は2記載の抗体。
【請求項26】
IgG1又はIgG4定常ドメインを含む、請求項25記載の抗体。
【請求項27】
完全ヒト抗体である、請求項1記載の抗体。
【請求項28】
キメラ抗体又はヒト化抗体である、請求項1記載の抗体。
【請求項29】
モノクローナル抗体である、請求項1又は2記載の抗体。
【請求項30】
組換え抗体である、請求項1又は2記載の抗体。
【請求項31】
抗原結合フラグメントである、請求項1記載の抗体。
【請求項32】
Fabフラグメント、F(ab')2 フラグメント、単鎖Fv(sFv)、ダイアボディ、トリアボディ、又はミニボディである、請求項1記載の抗体。
【請求項33】
請求項1又は2記載の抗体を含む組成物。
【請求項34】
請求項1又は2の抗体をコードする単離された核酸分子であって、該ヌクレオチド配列が、配列番号41、42、43、44、45、102、46、103、47、48、104、49、105、106、50のいずれか1つ、又はそれらの組み合わせを含む、前記単離された核酸分子。
【請求項35】
前記ヌクレオチド配列が、配列番号46又は49を含む、請求項34記載の単離された核酸分子。
【請求項36】
(a)ストリンジェントな条件下で、配列番号41、42、43、44、又は45のいずれか1つに記載されるヌクレオチド配列の相補鎖にハイブリダイズする配列;及び/又は、
(b)ストリンジェントな条件下で、配列番号102、46、103、47、48、104、49、105、106又は50のいずれか1つに記載されるヌクレオチド配列の相補鎖にハイブリダイズする配列;
を含む、請求項34記載の単離された核酸分子。
【請求項37】
ストリンジェントな条件下で、配列番号46又は49に記載されるヌクレオチド配列の相補鎖にハイブリダイズする配列を含む、請求項36記載の単離された核酸分子。
【請求項38】
配列番号1、2、3、4若しくは5のいずれか1つに記載されるVHのアミノ酸配列、及び/又は配列番号82、6、83、7、8、90、9、91、92若しくは10のいずれか1つに記載されるVLのアミノ酸配列をコードする核酸配列を含む、又は該核酸配列からなる、単離された核酸分子。
【請求項39】
配列番号6又は9に記載されるVLのアミノ酸配列をコードする核酸配列を含む、又は該核酸配列からなる、請求項38記載の単離された核酸分子。
【請求項40】
(a)配列番号11、14、17、20、及び23からなる群から選択されるVH CDR1;
(b)配列番号12、15、18、21、及び24からなる群から選択されるVH CDR2;
(c)配列番号13、16、19、22、及び25からなる群から選択されるVH CDR3;
(d)配列番号84、26、85、29、32、93、35、94、95、及び38からなる群から選択されるVL CDR1;
(e)配列番号86、27、87、30、33、96、36、97、98、及び39からなる群から選択されるVL CDR2;及び/又は、
(f)配列番号88、28、89、31、34、99、37、100、101、及び40からなる群から選択されるVL CDR3;
を有するポリペプチドをコードする配列を含む、又は該配列からなる、単離された核酸分子。
【請求項41】
VL CDR1が配列番号26若しくは35であり;VL CDR2が配列番号27若しくは36であり;及び/又はVL CDR3が配列番号28若しくは37である、請求項40記載の単離された核酸分子。
【請求項42】
(a)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、又はPTA-7728に記載されるハイブリドーマによって産生される抗体のVHのアミノ酸配列;及び/又は、
(b)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、又はPTA-7728に記載されるハイブリドーマによって産生される抗体のVLのアミノ酸配列;
をコードする核酸配列を含む、又は該核酸配列からなる、単離された核酸分子。
【請求項43】
(a)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、若しくはPTA-7728、又はそれらの組み合わせを有するハイブリドーマにより産生される抗体のVH CDR1、VH CDR2及び/又はVH CDR3;並びに/又は、
(b)ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、若しくはPTA-7728、又はそれらの組み合わせを有するハイブリドーマにより産生される抗体のVL CDR1、VL CDR2及び/又はVL CDR3;
をコードする核酸配列を含む、単離された核酸分子。
【請求項44】
ATCCアクセッション番号PTA-7729、PTA-7842、PTA-7818、PTA-7819、若しくはPTA-7728に記載されるハイブリドーマにより産生される抗体をコードする核酸配列を含む、又は該核酸配列からなる、単離された核酸分子。
【請求項45】
請求項34〜44のいずれか1項記載の核酸分子を含むベクター。
【請求項46】
請求項45記載のベクターを含む宿主細胞。
【請求項47】
hLIGHTエピトープに免疫特異的に結合する抗体の製造方法であって、該抗体による該hLIGHTエピトープへの結合が:
(a)E1抗体、E13抗体、若しくはE63抗体、又は、
(b)F19抗体若しくはF23抗体;
によって用量依存的様式で競合的に遮断されるが、但し、該hLIGHTエピトープへの結合が:
(a)E1抗体及びF19抗体、
(b)E1抗体及びF23抗体、
(c)E13抗体及びF19抗体、
(d)E13抗体及びF23抗体、
(e)E63抗体及びF19抗体、又は
(f)E63抗体及びF23抗体;
の両方により遮断されないことを条件とし、
該抗体の産生を促進する条件下で、請求項46記載の宿主細胞を培養することを含む、前記製造方法。
【請求項48】
hLIGHTエピトープに免疫特異的に結合する、単離された完全ヒト抗体の製造方法であって、該抗体による該hLIGHTエピトープへの結合が:
(a)E1抗体、E13抗体、若しくはE63抗体、又は、
(b)F19抗体若しくはF23抗体;
によって用量依存的様式で競合的に遮断され、
該抗体の産生を促進する条件下で、請求項46記載の宿主細胞を培養することを含む、前記製造方法。
【請求項49】
請求項1又は2記載の抗体を産生するハイブリドーマ。
【請求項50】
ATCCアクセッション番号PTA-7729(124 El)、PTA- 7842(124 E13)、PTA-7818(124 E63)、PTA-7819(124 F19)又はPTA-7728(124 F23)を有するハイブリドーマ。
【請求項51】
炎症性腸疾患(IBD)の1以上の症状を、その必要のあるヒトにおいて緩和させる方法であって、該ヒトに、請求項33記載の組成物の有効量を投与することを含む、前記方法。
【請求項52】
移植片対宿主病(GVHD)の1以上の症状を、その必要のあるヒトにおいて緩和させる方法であって、該ヒトに、請求項33記載の組成物の有効量を投与することを含む、前記方法。
【請求項53】
hLIGHTの、HVEM、LTβR、DcR3、若しくはそれらの任意の組み合わせへの結合を、その必要のあるヒトにおいて低減又は阻害するための方法であって、該ヒトに、請求項33記載の組成物の有効量を投与することを含む、前記方法。
【請求項54】
CCL20、IL-8、RANTES、若しくはそれらの任意の組み合わせの分泌を、その必要のあるヒトにおいて低減又は阻害するための方法であって、該ヒトに、請求項33記載の組成物の有効量を投与することを含む、前記方法。
【請求項55】
hLIGHTの、HVEM、LTβR、DcR3、若しくはそれらの任意の組み合わせへの結合を、細胞表面で発現したhLIGHTを有する細胞において低減又は阻害するための方法であって、該細胞を、請求項1又は2記載の抗体の有効量と接触させることを含む、前記方法。
【請求項56】
hLIGHTの、HVEM、LTβR、DcR3、若しくはそれらの任意の組み合わせへの結合を、細胞表面で発現するHVEM、LTβR、DcR3、若しくはそれらの任意の組み合わせを有する細胞において低減又は阻害するための方法であって、該細胞を、請求項1又は2記載の抗体の有効量と接触させることを含む、前記方法。
【請求項57】
CCL20、IL-8、RANTES、若しくはそれらの任意の組み合わせの分泌を、細胞表面で発現したhLIGHT受容体を有する細胞において低減又は阻害するための方法であって、該細胞を、請求項1又は2記載の抗体の有効量と接触させることを含む、前記方法。
【請求項58】
前記hLIGHT受容体が、HVEM、LTβR又はDcR3である、請求項57記載の方法。
【請求項59】
前記hLIGHT受容体が、HVEM、LTβR又はDcR3である、請求項6記載の抗体。
【請求項60】
検出可能なタグをさらに含む、請求項1又は2記載の抗体。
【請求項61】
サンプル中のhLIGHTの検出方法であって、該サンプルを、請求項60記載の抗体と接触させることを含む、前記方法。
【請求項62】
前記サンプルが、細胞表面にhLIGHTを発現している細胞を含む、請求項61記載の方法。
【請求項63】
請求項1又は2記載の抗体を含むキット。
【請求項64】
請求項33記載の組成物を含むキット。
【請求項65】
アミノ酸位214にリジン又はグルタミン酸を含むhLIGHTに特異的に結合する、単離されたヒトモノクローナル抗体、又はそのhLIGHT結合フラグメント。
【請求項66】
アミノ酸位32にロイシン又はセリンを含むhLIGHTに特異的に結合する、単離されたヒトモノクローナル抗体、又はそのhLIGHT結合フラグメント。
【請求項67】
前記hLIGHTがさらに、アミノ酸位32にロイシン又はセリンを含む、請求項65記載の抗体。
【請求項68】
hLIGHT受容体を有する細胞においてhLIGHT生物活性を低減又は阻害する、請求項65〜67のいずれか1項記載の抗体。
【請求項69】
HVEM、LTβR、DcR3、若しくはこれらの任意の組み合わせの、細胞表面で発現したhLIGHT若しくは可溶性hLIGHTへの結合を部分的に又は完全に阻害する、請求項65〜68のいずれか1項記載の抗体。
【請求項70】
細胞表面で発現したhLIGHT受容体を有する細胞からのCCL20、IL-8、RANTES、若しくはこれらの任意の組み合わせのhLIGHTを媒介した分泌を部分的に又は完全に阻害する、請求項65〜69のいずれか1項記載の抗体。
【請求項71】
前記hLIGHTを媒介した分泌が、可溶性hLIGHTを媒介した分泌、又は細胞表面で発現したhLIGHTを媒介した分泌である、請求項70記載の抗体。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【公表番号】特表2010−502183(P2010−502183A)
【公表日】平成22年1月28日(2010.1.28)
【国際特許分類】
【出願番号】特願2009−526670(P2009−526670)
【出願日】平成19年8月24日(2007.8.24)
【国際出願番号】PCT/US2007/018832
【国際公開番号】WO2008/027338
【国際公開日】平成20年3月6日(2008.3.6)
【出願人】(000001029)協和発酵キリン株式会社 (276)
【出願人】(509058014)ラ ジェオルラ インスティテュート フォル アレルギー アンド イムムノロジー (1)
【Fターム(参考)】
【公表日】平成22年1月28日(2010.1.28)
【国際特許分類】
【出願日】平成19年8月24日(2007.8.24)
【国際出願番号】PCT/US2007/018832
【国際公開番号】WO2008/027338
【国際公開日】平成20年3月6日(2008.3.6)
【出願人】(000001029)協和発酵キリン株式会社 (276)
【出願人】(509058014)ラ ジェオルラ インスティテュート フォル アレルギー アンド イムムノロジー (1)
【Fターム(参考)】
[ Back to top ]

