アンチバイオグラム分類方法および装置、2次元キャリアマップ作成方法および装置、並びに感染対策指標の評価方法および装置
【課題】細菌検査の結果の中から統計的に有為な菌の異常集積を自動的に検出することのできる、菌の異常集積検出方法および装置を提供する。
【解決手段】菌の異常集積検出の対象とする場所毎に、既定の集計頻度で、既定の観察期間幅中の検体提出患者および当該検出の対象とする全ての菌について、菌毎に、菌が陽性だった患者数を集計し、全ての菌について、集計した菌毎の陽性患者数と、検体提出患者数と、予め求めた菌毎の陽性率による二項分布を用いて、菌の偏りのない分離において成立するベルヌーイ試行の確率を、菌の分離に偏りが無く且つ菌の分離が偶然のみに支配されているという帰無仮説によって計算し、計算された確率が既定値より小さい場合に、偶然のみに支配されている確率が小さく菌の分離に偏りがあって異常な集積があったと判定する。
【解決手段】菌の異常集積検出の対象とする場所毎に、既定の集計頻度で、既定の観察期間幅中の検体提出患者および当該検出の対象とする全ての菌について、菌毎に、菌が陽性だった患者数を集計し、全ての菌について、集計した菌毎の陽性患者数と、検体提出患者数と、予め求めた菌毎の陽性率による二項分布を用いて、菌の偏りのない分離において成立するベルヌーイ試行の確率を、菌の分離に偏りが無く且つ菌の分離が偶然のみに支配されているという帰無仮説によって計算し、計算された確率が既定値より小さい場合に、偶然のみに支配されている確率が小さく菌の分離に偏りがあって異常な集積があったと判定する。
【発明の詳細な説明】
【技術分野】
【0001】
本願発明は、菌の異常集積検出方法および装置、アンチバイオグラム分類方法および装
置、2次元キャリアマップ作成方法および装置、感染対策指標の評価方法および装置、菌
異常集積検出の警告スコア累積のグラフ化方法および装置に関するものである。
【背景技術】
【0002】
医療の高度化、人口構成の高齢化に伴い、病院内で免疫力の弱い易感染患者が占める割
合が増えている。易感染患者は健常人が感染症を発症しない様な病原性の弱い菌(いわゆ
る弱毒菌)によっても感染症を発症する。このような感染症を日和見(ひよりみ)感染症
と呼び、日和見感染症を起こす弱毒菌を日和見感染菌と呼ぶ。日和見感染菌の多くは、常
在菌や環境菌であり、患者や医療従事者の腸管などの常在細菌叢や、病院環境中に存在し
、病院内に長時間とどまる。病院内では抗菌薬(生物が作る抗生物質や合成された合成抗
菌薬の総称)が多用されているため、抗菌薬が効く感性菌は淘汰され、抗菌薬の効かない
耐性菌が選択される。このため、日和見感染菌の多くは、多剤耐性化しており、抗菌薬に
よる治療に抵抗するため、これらの細菌による院内感染症が発生すると治療が困難になる
。
【0003】
[菌の異常集積の検出に対する必要性に関する背景]
院内感染症の多くは、このような多剤耐性の日和見感染菌による難治感染症である。今
日、メチシリン耐性ブドウ球菌(MRSA)、多剤耐性緑膿菌(MDRP)などが、問題となって
いるが、様々な常在菌や環境菌が院内感染症の原因となるため、それら小数の特定の菌に
のみ注目していると、他の菌による院内感染症やその徴候を見落とすことになる。すべて
の菌の分離状況を監視し院内感染の徴候を把握するためには、連日ないし少なくとも数日
ごとに全ての菌種の分離状況を病棟あるいは病室ごとに集計してそれぞれの分離を評価す
る必要がある。これには膨大な作業が必要で、人手によって行うことは困難である。した
がって、菌の異常集積を自動的に検出することのできる技術の実現が強く望まれている。
【0004】
すなわち、院内感染症は、院内で上記各種菌が人為的に拡散され、拡散された菌が感染
症を起こすことで発症するものであるところ、院内で菌が人為的に拡散されると拡散され
た菌の分離数が通常より増加するので、特定の菌の分離数の増加、つまり菌の異常集積を
検出することができれば、院内感染の第一段階である人為的な菌の拡散を検出できること
になり、院内感染を未然に防ぐことができるようになる。この点に関し、電算機を用いた
リアルタイムのサーベイランスが実施できれば、特定の菌の分離数、分離率をリアルタイ
ムで算出することが可能であるが、検出の感度、特異性を保ちつつ自動化できる適当な統
計的手法が従来はなかった。
【0005】
そこで、本出願の発明者等は、二項分布を用いた菌の異常集積の検出を既に発案し(非
特許文献1、2参照)、この問題を解決したが、帰無仮説の確率であるベースラインレー
トとして何を用いるか(例えば集計期間の決定や重複排除の方法)、どのような期間幅ど
のような頻度で集計するのが適当であるかなど、解決すべ点がまだ存在している。
【0006】
[antibiogram分類に対する必要性に関する背景]
細菌による院内感染症は、主に、原因となる菌が病院内で拡散することによって起こる
。一方、菌が拡散しても感染症が発生しなければ院内感染症とはならない。菌が拡散した
ことを早期に検出し、確認できれば、院内感染症を未然に防ぐことができる。前記の菌の
異常集積の検出によって、異常な菌の集積を検出することができた場合でも、集積が院内
での菌の拡散に基づくものであるのか、たまたまその菌を持った人がその病棟に集まった
のか判断する必要がある。細菌は同じ菌種(例えば緑膿菌)として同定(つまり検査の結
果菌種を定める)されても、それぞれが少しずつ異なった遺伝的背景を持っている。ヒト
が同じ人類であっても、一人一人の遺伝子が少しずつ異なるのと同じである。ヒトと細菌
が異なるのは、増殖するときにヒトが父親と母親から半分ずつ遺伝子を受け継ぐのに対し
て、細菌は、無性の2分裂によって増殖するため、元となった菌と増殖した菌が、稀に起
きる変異による変化を除いて全く同じ遺伝子を持っていることである。したがって、細菌
の場合は、別の場所、別の時間に分離された菌が、同じ菌であるかどうかを正確に予測す
ることが可能である。場所や時間を隔てて分離された細菌が全く同じ菌であるかどうかを
最も正確に予測する方法は、それぞれの菌の全遺伝子配列を決定することである。しかし
現実には、全遺伝子配列を決定しなくとも、遺伝子配列の概要を調べたり、あるいは、菌
の特徴(つまりヒトで言えば肌の色や髪の色などの形質)から、それらの菌が同じ菌であ
るか別の菌に由来するものであるか、相当の精度で予測することができる。これは細菌が
、一般に短期間(例えば数十日単位)で著しい変異を生じることは稀であるが、長期間に
は遺伝子の大規模な組み替えを含む、様々な変異を生じることによる。
【0007】
臨床の現場でこのような菌の特徴としてもっとも良く用いられるのは、異なった種類の
抗菌薬に対する耐性(つまり薬が効かないこと)のパターンであるいわゆるantibiogram
(アンチバイオグラム)である。ある菌が抗菌薬ABCに耐性でDEFには感性(つまり薬が効
くこと)であり、同じ菌種に属する別の菌が抗菌薬ABCDに耐性でEFに感性であった場合、
それらの菌は別の由来であると予測できる。適当な薬剤の組み合わせを選ぶとACEに耐性
でBDFに感性、など全ての組み合わせ(つまりパターン)が出現する可能性があり、antibiogramが同じであると、それらの菌の由来が同じである可能性が少なくとも否定できないと結論できる。この方法は、細菌の抗菌薬に対する感受性(つまり耐性であるか感性であるか調べること)検査が保険診療の範囲内であり、日常の臨床検査としてひろく行われているために、このような疫学調査(つまり伝染性の疾患、環境要因による疾患など、集団で発生する疾患の因果関係を明らかにする研究方法)のために新たに費用が発生しない利点を持つ。antibiogramによる菌の同一性の予測は、遺伝子配列の概要による分類、さらに詳細な遺伝子解析(これらの解析は分子疫学的手法と呼ばれる)の結果と良く一致することが知られている。antibiogramで同一であることが否定できないと予測された菌の中には同一でないものも含まれるが、antibiogramで異なる菌と判断された菌は他の手法でも異なる菌と同定されるために、さらに詳細な分子疫学的手法を行うべきかどうかの判断とし、最初に行うべき調査である。一般病院で、分子疫学的手法による解析を行うことは、設備、費用の何れの面からも殆ど不可能である。多くの健康被害が発生した事例などに限って、大学、都道府県の衛生研究所、国立感染症研究所などが分子疫学的調査を行っている。
【0008】
現在、antibiogramは、臨床検査の結果として得られた菌の複数抗菌薬に対する感受性
を元に、人手によって整理が行われている。このとき、(1)菌の感受性はS(感性)、
I(中間)、R(耐性)としていわゆるSIR判定される。IとS、IとRの違いは検査
の誤差範囲であることがある。(2)多数の菌のantibiogramの整理を行う場合、全ての
菌に対して同じ抗菌薬の感受性が全て調べてあるとは限らない。(3)グループ分けが一
つに定まらない。などの問題があり、作業に多くの時間が掛かる、結果に自信が持てない
という問題がある。
【0009】
したがって、細菌検査を行う多くの臨床検査技師がantibiogramの整理を自動化する技
術の実現を希望している。
【0010】
antibiogramの自動整理はつまりパターンの分類であり、上記の理由から曖昧な要素を
含んでいると考えられたためか、電算機を利用してantibiogramを作表する仕組みはあっ
たが、従来、自動的に分類するためのプログラムは実現されていない。
【0011】
[2次元carrierマップに対する必要性に関する背景]
前記のantibiogram分類による抗菌薬分類をカラーコード化しいわゆる2次元carrierマ
ップを作成することも重要な技術であり、これによれば菌の拡散状態を容易に把握できる
ようになると考えられる。
【0012】
特定の菌の分離状況を2次元マップ化することはこれまでも行われてきたが、前記のと
おりにantibiogram分類の方法がなかったために、同一菌株の拡散を2次元マップ化し患
者の動線を考慮した解析を行う資料の自動作成はできなかった。
【0013】
したがって、このようなantibiogram自動分類に組み合わせた2次元carrierマップの自
動作成技術の実現も有用である。
【0014】
[PID感染対策指標の評価に対する必要性に関する背景]
院内感染対策においても様々な指標をグラフ化し、値、増減から対策を検討することが
重要である。例えば、院内感染菌として良く問題となるMRSA(メチシリン耐性黄色ブドウ
球菌)の分離患者数、分離率などをグラフ化して、それらが増える傾向にある場合、担当
者に注意を促し、この菌の病院内での拡散の原因を除くために接触予防策の強化などを行
う。一般にグラフ化することによって変化は明らかになるが、多くの指標のトレンドを目
視で正確に把握することは必ずしも容易ではなく、(1)目標値とのわずかなずれ、(2
)変化の速さ(グラフの傾き)などは、必ずしも正確に把握されない。
【0015】
PID(proportional-integral-differential)制御は、温度、速度の制御などで古く
から使われる方法であるが、コンピュータ技術の発達に伴ってさらに実用性が増し、民生
、工業などの制御にひろく使われている。
【0016】
したがって、PID技術によれば変化速度、微少偏位の継続、偏位を的確に評価するこ
とが可能であり、時に目視で見落とされることのある微少な偏位の持続、変化速度の差を
数量化、グラフ化できることに注目し、感染対策に於ける各種指標を正常に保つことを一
つの制御と考え、感染対策のトレンド解析にPID制御を応用することも有用であると考
えられる。
【0017】
[菌の異常集積の検出警告スコア累積のグラフ化に対する必要性に関する背景]
前述した二項分布を用いる菌の異常集積の検出技術を利用し、その出力として得られる
警告スコアを累積集計することも、院内感染対策に有用であると考えられるが、このよう
な技術は実現されていない。
【非特許文献1】藤本修平、「中小規模病院感染症監視システム」、厚生労働科学研究費補助金 医療安全総合研究事業、医療安全総合研究事業 院内感染の防止のための監視体制の整備、細菌検査室の機能向上に関する研究 平成17年度報告書、13-102. (2006)
【非特許文献2】藤本修平、「院内感染対策サーベイランスの効率化に関する研究」、厚生科学研究費補助金 新興・再興感染症研究事業 薬剤耐性菌の発生動向のネットワークに関する研究 平成15年度総括研究報告書、87-94. (2004)
【発明の概要】
【発明が解決しようとする課題】
【0018】
本願発明は、以上のとおりの事情に鑑み、電算機システムを用いて細菌検査の結果の中
から統計的に有為な菌の異常集積を自動的に検出することのできる、菌の異常集積検出方
法および菌の異常集積検出装置を提供することを課題としている。
【0019】
また、本願発明は、antibiogramの整理つまりパターンの分類を自動化することで、院
内感染の疫学調査を省力化し、かつ、誤りや見落としを防ぐことのできる、アンチバイオ
グラム分類方法およびアンチバイオグラム分類装置を提供することを課題としている。
【0020】
また、本願発明は、antibiogram分類による抗菌薬分類をカラーコード化し、菌の分離
を時間軸、空間軸でプロットして、同一患者を直線で結びつけて、同じ耐性パターンの菌
が病棟内などで拡散している状態を容易に把握できる2次元carrierマップを自動的に作
成することのできる、2次元キャリアマップ作成方法および2次元キャリアマップ作成装
置を提供することを課題としている。
【0021】
また、本願発明は、感染対策のトレンド解析にPID制御を応用し、感染対策に於ける
各種指標を正常に保つことができ、指標として実数を用いることが適当でないことや、積
分期間が長い場合は過去の影響が及ぶ期間が不適切に長くなることの障害を排除し、様々
なグラフ評価を正確に可能ならしめる、PID法によるグラフ評価技術、つまりPID法
による感染対策指標の評価方法および装置を提供することを課題としている。
【0022】
また、本願発明は、上記菌の異常集積検出を利用して、その出力として得られる警告ス
コアを累積集計しグラフ化することのできる、菌自動集積検出の警告スコア累積のグラフ
化方法および装置を提供することを課題としている。
【課題を解決するための手段】
【0023】
本願発明は、上記の課題を解決するものとして、
菌の異常集積検出の対象とする場所毎に、既定の集計頻度で、既定の観察期間幅中の検
体提出患者および当該検出の対象とする全ての菌について、菌毎に、菌が陽性だった患者
数を集計し、
全ての菌について、集計した菌毎の陽性患者数と、検体提出患者数と、予め求めた菌毎
の陽性率による二項分布を用いて、菌の偏りのない分離において成立するベルヌーイ試行
の確率を、菌の分離に偏りが無く且つ菌の分離が偶然のみに支配されているという帰無仮
説によって計算し、
計算された確率が既定値より小さい場合に、偶然のみに支配されている確率が小さく菌
の分離に偏りがあって異常な集積があったと判定する、
菌の異常集積検出方法であって、
前記ベースラインレートの算出を行う際に、同一患者の重複排除を月および人ののべ数
となるように行うことによって、前記ベースラインレートが前記二項分布の単回の独立試
行の確率となるようにする、
ことを特徴とする菌の異常集積検出方法、
を提供し、また、
菌の異常集積検出の対象とする場所毎に、既定の集計頻度で、既定の観察期間幅中の検
体提出患者および当該検出の対象とする全ての菌について、菌毎に、菌が陽性だった患者
数を集計して予め求められた集計データと、
全ての菌について、集計した菌毎の陽性患者数と、検体提出患者数と、予め求めた菌毎
の陽性率とによる
二項分布を用いて、菌の偏りのない分離において成立するベルヌーイ試行の確率を、菌の
分離に偏りが無く且つ菌の分離が偶然のみに支配されているという帰無仮説によって計算
し、
計算された確率が既定値より小さい場合に、偶然のみに支配されている確率が小さく菌
の分離に偏りがあって異常な集積があったと判定する、
菌の異常集積検出装置であって、
前記ベースラインレートの算出を行う際に、同一患者の重複排除を月および人ののべ数
となるように行うことによって、前記ベースラインレートが前記二項分布の単回の独立試
行の確率となるようにする、
ことを特徴とする菌の異常集積検出装置
を提供する。
【0024】
また、本願発明は、上記の課題を解決するものとして、
SIR判定を用いて菌の持つ薬剤耐性のパターンであるアンチバイオグラムを分類する
方法であって、
2つの菌の組み合わせのうちで、全ての抗菌薬剤に対して一つでもSとRの違いがある
組み合わせを不一致組み合わせと判定して、当該2つの菌同士で一致する薬剤の数を0点
とし、互いにSまたは互いにRである組み合わせを一致組み合わせと判定して、当該2つ
の菌同士で一致する薬剤の数N点を求め、
この一致不一致の判定をすべての菌の組み合わせに対して行い、
一致する薬剤の数N点が既定の閾値以上になる菌のグループを作る、
ことを特徴とするアンチバイオグラム分類方法、
を提供し、また、
SIR判定を用いて菌の持つ薬剤耐性のパターンであるアンチバイオグラムを分類する
装置であって、
2つの菌の組み合わせのうちで、全ての抗菌薬剤に対して一つでもSとRの違いがある
組み合わせを不一致組み合わせと判定して、当該2つの菌同士で一致する薬剤の数を0点
とし、互いにSまたは互いにRである組み合わせを一致組み合わせと判定して、当該2つ
の菌同士で一致する薬剤の数N点を求める手段と、
この一致不一致の判定をすべての菌の組み合わせに対して行う手段と、
一致する薬剤の数N点が既定の閾値以上になる菌のグループを作る手段と、
を備えることを特徴とするアンチバイオグラム分類装置、
を提供する。
【0025】
また、本願発明は、上記の課題を解決するものとして、
上記のアンチバイオグラム分類方法によって分類された菌のグループに基づき2次元キ
ャリアマップを作成する方法であって、
前記菌のグループをカラーコード化し、
分離された患者、場所、時期の3つのパラメータに基づいて、2次元キャリアマップ上
の時間軸、空間軸に沿って各菌の分離データをプロットし、
同一患者を線で結ぶ、
ことを特徴とする2次元キャリアマップ作成方法、
を提供し、また、
上記のアンチバイオグラム分類装置によって分類された菌のグループに基づき2次元キ
ャリアマップを作成する装置であって、
前記菌のグループをカラーコード手段と、
分離された患者、場所、時期の3つのパラメータに基づいて、2次元キャリアマップ上
の時間軸、空間軸に沿って各菌の分離データをプロットする手段と、
同一患者を線で結ぶ手段と、
を備えることを特徴とする2次元キャリアマップ作成装置、
を提供する。
【0026】
また、本願発明は、上記の課題を解決するものとして、
感染対策の指標となる数値の変動および偏りを評価する方法であって、
既定の観察期間単位ごとに、目標値との隔たりを示すP因子、時間軸において一つ前の
観察単位との差を示すD因子、過去の既定の期間の偏差の和を示すI因子を計算し、
これらP因子、D因子、I因子の和をPID値とし、PID値、またはPID値の絶対
値であるPID正値を、感染対策の成果が目標値に達するための努力の程度の指標として
用いる、
ことを特徴とする感染対策指標の評価方法、
を提供し、また、
感染対策の指標となる数値の変動および偏りを評価する装置であって、
既定の観察期間単位ごとに、目標値との隔たりを示すP因子、時間軸において一つ前の
観察単位との差を示すD因子、過去の既定の期間の偏差の和を示すI因子を計算する手段
と、
これらP因子、D因子、I因子の和をPID値とし、PID値、またはPID値の絶対
値であるPID正値を、感染対策の成果が目標値に達するための努力の程度の指標として
用いる手段と、
を備えることを特徴とする感染対策指標の評価装置、
を提供する。
【0027】
また、本願発明は、上記の課題を解決するものとして、
上記の菌の異常集積検出方法の出力として得られる警告スコアを累積集計してグラフ化
する方法であって、
前記計算された菌の偏りのない分離を表すベルヌーイ試行の確率を閾値で分類し、確率
が低いものに高いスコアを与えて得られる警告スコアを、菌ごとに一定期間ごとに集計し
、集計結果を、横軸を時間軸、縦軸を警告スコアとしてグラフ化する、
ことを特徴とする菌異常集積検出の警告スコア累積のグラフ化方法、
を提供し、また、
上記の菌の異常集積検出装置の出力として得られる警告スコアを累積集計してグラフ化
する装置であって、
前記計算された菌の偏りのない分離を表すベルヌーイ試行の確率を閾値で分類し、確率
が低いものに高いスコアを与えて得られる警告スコアを、菌ごとに一定期間ごとに集計す
る手段と、集計結果を、横軸を時間軸、縦軸を警告スコアとしてグラフ化する手段と、
を備えることを特徴とする菌異常集積検出の警告スコア累積のグラフ化装置、
を提供する。
【0028】
そしてさらに、本願発明は、前記各種方法あるいは装置の機能をコンピュータに実行さ
せるためのプログラムおよび当該プログラムを記録したコンピュータ読取可能な記録媒体
をも提供する。
【発明を実施するための形態】
【0029】
[菌の異常集積検出]
本願発明における菌の異常集積の検出の原理は以下のとおりである。
【0030】
細菌の分離は、培養陽性、陰性の2つの値のみを取り、偏りなく分離されるとき、いわ
ゆるsporadicな分離のときには、毎回独立に菌の分離率(baseline rate:ベースライン
レート)にしたがって偶然に支配されて発生するいわゆるベルヌーイ試行である。偏りの
ないベルヌーイ試行は、その確率が二項分布(例えば下記数1で表される累積二項分布)
によって計算できることに注目し、菌の分離に偏りが無く、菌の分離が偶然のみに支配さ
れているという帰無仮説によってその確率を計算し、計算された確率が十分に小さい場合
、偶然のみに支配されている確率が小さく、何らかの偏りがあった、すなわち菌の分離に
異常な集積があったと結論する。これにより、すべての菌について、病院全体、病棟ごと
、病室ごとの菌の分離に偏りがあったかどうかを評価できれば、すべての菌種についての
菌の異常集積を自動的に確実に捕捉する事が可能になる。
【0031】
【数1】

ここで、p=ベースラインレート、n=検体提出患者数、k=陽性患者数である。
ある菌種が特定の場所(病棟など)で偶然によるよりも多くの患者から分離された場合
、その場所の中で拡散(感染または保菌)が発生したことが疑われ、実際に拡散(感染ま
たは保菌)が発生していた場合は、(1)その場所での感染対策(衛生的手技)に問題が
ある可能性が示唆される。(2)拡散が続けば、ある確率で院内感染症の発生(アウトブ
レイク)に結びつくことが考えられる。したがって、すべての菌種についての菌の異常集
積を自動的に確実に捕捉する事ができれば、不十分な感染対策に基づくアウトブレイクを
未然に防ぐことができる。
【0032】
そして、この二項分布を用いた菌の異常集積の検出は、さらに具体的には、以下の設定
条件の下に実行される。
(1)ベースラインレートの算出を行う際に、同一患者の重複排除を月および人ののべ数
となるように行うことによって、前記ベースラインレートが前記二項分布の単回の独立試
行の確率となるようにする。このとき、同一患者の重複排除は、既定期間毎、たとえば1
年毎に行ってもよい。さらにあるいは、ベースラインレートに、前記場所の菌の陽性率あ
るいは全国平均の陽性率をとり、これにより客観的な分離の効果の評価も実現させる。全
国平均とは、全国的サーベイランスで得た菌の陽性率を指す。また、同規模、同種の病院
特性(救急病院、急性期病院、慢性期病院、老人病院、小児科病院など)によって層別化
した全国平均も含む。
(2)集計は、複数の既定の観察幅、たとえば毎日、1日、7日、14日、30日の観察
幅で行う。
(3)菌の検査結果は確定するまでに日数がかかるので、即時性のために、中間報告が行
われるたびに再集計をかける。
【0033】
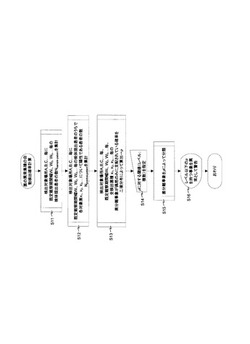
より具体的には、たとえば図1に示したように、まず、検出の対象とする全病院、各病
棟、各診療科などの場所毎(例えば病院A,病院B,病院C・・・、病棟A,病棟B,病
棟C・・・、診療科A,診療科B,診療科C・・・、に、1日、7日、14日、30日な
どの複数の既定の観察期間幅(いわゆるウィンドウ)W1,W2,W3・・・中の検体提出
患者(つまり細菌検査を行った患者)Nsample-patientと、すべての菌x1,x2,x3・・・
についてそれぞれその菌が陽性だった患者数Npositive-patientを集計する(ステップS
11、S12)。この集計は、連日あるいは既定の期間の頻度で行う。たとえば、1年間
に亘って、W1=1日,W2=14日,W3=30日の観察期間を順次繰り返しながら各観
察期間毎のNsample-patient、Npositive-patientをデータベースに集計、入力する。
【0034】
一方、たとえば図2に示したように、すべての菌について、その菌の陽性率Rpositive
、つまり一人の患者を検査してその菌が検出される確率を、たとえば1年など十分に長い
期間についてその菌が陽性だった患者数を検体提出患者数で除して、予め求めておく。よ
り具体的には、まず、データ集計期間を指定し(ステップS21)、検体提出患者数と細
菌種毎の陽性検出患者数を集計入力し(ステップS23,S24)、菌陽性率Rpositive
を算出する(ステップS25)。
このとき、本願発明では、同一患者の重複排除を月および人ののべ数となるように行う
(ステップS22)。より具体的には、たとえば図3に例示したように、同じ患者から所
定観察期間内(たとえば30日以内)に同じ菌種が検出されたか否かを判断する(ステッ
プS31)。検出されていない場合には重複排除処理せず(ステップS33)、検出され
ていない場合には抗菌薬感受性が関与する集計があるか否かを判断する(ステップS32
)。集計がない場合には重複排除処理せず(ステップS33)、集計がある場合には耐性
判断のある重複菌を排除する(ステップS34)。具体的には、初期設定として共通の抗
菌薬数を0とし(ステップS35)、各抗菌薬について耐性に違いがあるか否かを判断す
る(ステップS37)。違いがない場合には共通の抗菌薬数=共通の抗菌薬数+1として
(ステップS38)、判断処理をループさせ(ステップS36−S38)、耐性に違いが
ある場合には別の菌として集計する(ステップS311)。全ての抗菌薬について判断が
終わった後(ステップS36)、共通の抗菌薬数がいずれかの株の検査抗菌薬数と同じで
あるか否かを判断する(ステップS39)。同じである場合には同じ菌として処理し(ス
テップS312)、違う場合には共通の抗菌薬数が所定値(たとえば5)以上であるか否
かを判断し(ステップS310)、所定値以上でない場合には別の菌として集計し(ステ
ップS311)、所定値以上である場合には同じ菌として処理する(ステップS312)
。そして、同じ菌に対して重複排除処理を実行する、つまり集計データから重複菌を削除
する(ステップS313)。続いて、時系列上先に検査が行われた菌の検査抗菌薬数が時
系列上後に検査が行われた菌の検査抗菌薬数以上であるか否かを判断する(ステップS3
14)。これが成り立つ場合には先の検査を残し(ステップS315)、成り立たない場
合には所定観察期間の判断の日付として先の検査の検体検出日を受け継ぎ(ステップS3
16)、後の検査を残す(ステップS317)。
図4は、以上の重複排除を含めた各処理に従い算出した菌陽性率Rpositiveの一例であ
る。
【0035】
菌の分離が偏りなく、偶然にのみ支配されていると仮定した場合に、それぞれの場所で
それぞれの菌がそれぞれの数それぞれの検査患者数から分離される確率Pisolationは、そ
の菌の陽性率Rpositiveであり、ある場所で、ある菌が、ある人数の患者から分離される
確率Pisolationは、それらの数と、検査患者数Nsample-patientと、その菌の陽性率Rposi
tiveから二項分布を用いて求めることができる(ステップS13(図1))。さらに、そ
の数より少ない数が分離される確率を加える、つまり累積二項分布を用いることによって
、例えば、6人検査して4人までがその菌が陽性である確率を求めることができる。本願
発明では、全ての場所毎、全ての観察期間、全ての菌種について毎日その確率を計算する
。
【0036】
観察期間幅を複数設ける目的は、短い鋭い変化、長期のなだらかな変化の何れも見落と
さないためである。これらの幅で、連日、確率計算し続けることで、小さな集積も特異的
に検出することができる。
菌の分離確率Pisolationのより具体的な算出処理は、たとえば図5に示したように、上
述した数式1に従い、初期設定としてP=0とし(ステップS51)、m=kからnまで
(ステップS52)次の計算をする。まず、nCm(=Cx)を計算し(ステップS53)、ア
ル順番で丁度m個菌が出る確率pm(1−p)n-m(=Ptankai)を求め(ステップS54
)、丁度m個菌が出る確率Cx Ptankai(=Pkumiawase)を算出し(ステップS55)、P=
P+Ptankaiとする(ステップS56)。
【0037】
本願発明では、さらに、計算した分離確率Pisolationをその値によって分類し、異常集
積の危険度(警告レベル)として、問題の発生した場所、集計の日時、観察期間幅、菌種
、陽性患者数、検体提出患者数、確率など、危険度を表示して警告としている。
より具体的には、分離確率Pisolationに対する閾値(複数のレベル)を予め指定してお
き(ステップS14(図1))、菌分離事象を分離確率Pisolationによって分類する(ス
テップS15)。そして、各レベル以下の分離確率Pisolationを持つ事象を異常として警
告する(ステップS16)。
【0038】
なお、当該技術の応用として、antibiogram分類技術と組み合わせ、分類毎の異常集積
を検出することによって、特定の耐性菌が病院内、あるいは、地域で拡散した場合にこれ
を自動的に検出することが可能になる。
【0039】
[antibiogram分類]
本願発明におけるSIR判定を用いたantibiogram分類の原理は以下のとおりである。
【0040】
SIR判定のうちで曖昧さの残るI(中間)の扱いについて検討した結果、IはS(感
性)、R(耐性)の何れとも取れるため、決定因子にならず、検査を行っていないのと同
様の扱いでよいことが分かった。同一であることをスコア化して判断する方法は最終的な
組み合わせに曖昧さが残るため、実用性が低いことが分かった。そこで、本願発明のanti
biogram分類は、論理的に(つまりrule based algorithmで)同じグループに属すること
が否定できない組み合わせを網羅するものである。
【0041】
さらに説明すると、たとえば図6および図7のフローチャートに示すように、まず、2
つの菌A−Bの組み合わせのうちで(ステップS56、ステップS71−S72)、一つ
でもSとRの違いがある組み合わせ、つまり互いにSまたは互いにRでない組み合わせは
同じグループに属することが否定できるため除外し(ステップS62−S63、ステップ
S73)、それら2つの菌の間で一致する抗菌薬剤の数がないものとして、検査数を0点
とする(ステップS64、ステップS74)。それ以外について、つまり互いにSまたは
互いにRである組み合わせについて、2つの菌の間で一致する抗菌薬剤の数Nを求め、検
査数N点とする(ステップS65、ステップS75−S76)。一致する検査の数に一定
の基準(例えば3つ以上など)を設け、すべての菌に対して一致不一致の判定をし、判定
表を作成する。判定表を元に、お互いに一致する検査数が一定基準以上になる菌のグルー
プを作る(ステップS66−S67、ステップS77−S78)。組み合わせを作るため
に、集合論を利用した手法を用いる。
【0042】
より具体的には、例えば以下のように処理する。
【0043】
(1)SIR判定のIをデータ入力がないものとして扱い、SとRの一致不一致のみを
判断する。
【0044】
(2)すべての2つの組み合わせであるパターンを比較し、耐性S,Rに一つでも異な
るものが有れば排除する((3)において0点とする)
(3)耐性が一致している抗菌薬数を得点化し、閾値(たとえば3点)以上の抗菌薬数
を持つ2つのパターンの同一性を判定する。
【0045】
(4)2つのパターンの関係である同一性から3つ以上の組み合わせを得る。
【0046】
ここで、たとえば、2つのパターンの関係である同一性から3つ以上の組み合わせを得
る具体的アルゴリズムの一例は、図8に示すとおりである。集合Aiは菌株xiと耐性パター
ンの同一性が否定できない菌株の集合である。菌株xjが集合Aiの要素であるとき、菌株xi
は集合Ajの要素である。Ai、Ajが与えられると、それらと耐性パターンが同一である事が
否定できない3番目の菌株は共通集合となる。したがって、耐性が一致している抗菌薬数
を得点化した値が閾値以上の組み合わせの集合を主記憶上に持つことによって、高い効率
で3番目以降の菌株の組み合わせを得ることができる。
【0047】
たとえば図9および図10は、本願発明によるantibiogram自動分類の一結果を示すも
のであり、図9は一致する検査結果数の一覧表、図10は自動分類結果である。図9にお
ける検出対象場所毎、検体提出患者毎のSIR集計データに基づき、図10におけるよう
な一致耐性薬剤点数が得られているのがわかる。
より具体的には、図7中のステップS73において、たとえば図10にて菌K41とK
70のSIRを比較すると、薬剤AZTに対してK41がR、K70がSであるので、K
41−K70は不一致組合せと判断し、ステップS64において、K41−K70は不一
致組合せなので0点とする(図9参照)。一方、ステップS65において、たとえば図1
0にて菌41と菌42のSIRを比較すると、まず、少なくとも一方の菌がIである薬剤
AZT、CTXを除き、つまり、薬剤AZTに対してK42がIであり、薬剤CTXに対
してK41、K42の両方がIであるので、AZT、CTXに対するK41−K42間の
S/Rは判断対象外とし、続いて、それ以外の薬剤については、薬剤AMK、GM、PI
PCの全てに対して互いにSであるので、K41−K42は一致組合せと判断する。そし
て、ステップS66において、K41−K42は薬剤AMK、GM、PIPCの3個で一
致するので3点とする(図9参照)。同様に、たとえばK42−K50は薬剤AMK、G
Mの2個で一致するので2点とする(図9参照)。
そして、グループ化の結果例については、図示していないが、上述したとおりのグルー
プ化処理によって、耐性パターンが同一である事が否定できない菌のグループ化、つまり
菌のantibiogram分類を実現することができる。
【0048】
なお、以上のantibiogram分類技術の応用として、次述の2次元careerマップと組み合
わせることによって実用性が増す。
【0049】
また、グループ分けに対して、時間的、空間的集積を指摘する(特定の耐性菌が拡散し
ている危険性を指摘する)仕組みを付け加えることが考えられる。
【0050】
また、各薬剤の平均耐性率が得られるようになれば、antibiogramの一致率に重みつけ
ることが可能となる。確からしさの指数として用いる仕組みを付け加えることも考えられ
る。
ところで、以上のantibiogramの自動分類については、図6に例示した本処理の前に、
処理の対象となるデータに前処理を施すことによって、劇的に処理量を減らすことができ
る。具体的には、図11に例示したように、まず、SIR判定の結果が全ての菌について
同じか、つまり全てRまたはIであるか、または全てSまたはIであるかを判断し(ステ
ップS111−S113)、該当する抗菌薬剤をたとえば図8の表から除いて分類処理対
象外とする(ステップS114)。続いて、全く同じ感受性パターンの菌を一つの菌とし
て扱う。すなわち、SIRの組合せが同じ菌群をグループ化してその代表の菌を表にする
(ステップS115)。そして、図6(あるいは図7)のとおりの分類処理後に、ステッ
プS115でグループ化した代表の結果を、ステップS66、S77により得られたグル
ープ全体に複写する(ステップS116)。なお、前処理において、全ての検体に対する
SRのパターンが同じ抗菌薬が複数あった場合、代表として一方のみを残す処理を実行し
てもよい。 図12はこの前処理によりグループ化した代表の一例、図13は図12のグ
ループ化した代表をS66、S77によるグループ全体に複写した場合における分類結果
の一例、図14はそのカラーコード化の結果の一例を示す。
【0051】
[2次元carrierマップ作成]
本願発明における2次元carrierマップ作成の原理は、たとえば図15にも例示したよ
うに、以下のとおりである。図16は、本原理に従い、図14の分類カラーコードに基づ
いて作成した2次元carrierマップの一例である。
【0052】
まず、前記antibiogram分類による抗菌薬分類を、つまりantibiogram分類によって同一
菌であることが否定できない菌のグループをカラーコード化する。グループ毎に異なる色
を設定すればよい。
【0053】
次に、分離された患者、場所、時期の3つのパラメータに基づいて、マップ上の時間軸
、空間軸に沿って各菌の分離データをプロットする。
【0054】
そして、同一患者の各プロットを線で結ぶ。
【0055】
より具体的には、図15に沿って以下のように処理する。
【0056】
(1)antibiogramを自動分類した後、各菌のグループ毎に異なる色を選択し、グルー
プと色とを関連付けて設定記憶しておく(ステップS151)。
【0057】
(2)X軸を時間軸、Y軸を全ての検体のリストアップ軸とする2次元carrierマップ
を用意する。Y軸に沿って、全ての検体を、検体毎に予め記録されている患者情報、位置
情報(建物、階、病棟、病室など)、検体採取日時に基づきソーティングし、マップ上左
側部位にリストとして縦に1列に並べて表示させる(ステップS152)。もちろんXY
はこの逆の組み合わせとしもよい。
【0058】
(3)その検体の採取日時に相当するX位置でリストのY位置の高さの位置にプロット
する(ステップS153)。各プロットはantibiogram分類グループ分けの色を付ける(
ステップS154)。複数のantibiogram分類グループに属する場合は、必要なだけ横ま
たは縦に並べる。
【0059】
(4)同じ患者からの検体のプロット間に直線データを付与してマップ上に表示させる
(ステップS155)。
【0060】
以上により、同じ耐性パターンの菌が病棟内などで拡散している状態を解析して、非常
に容易に把握することが可能になる。
【0061】
例えば、図16に示した例では、丸枠内の茶色およびオリーブ色に分類される菌は、こ
の患者さん以外からはほとんど検出されないので、同時期に同じ病棟に入院した別の患者
さんから同じ分類の菌が出たとすると、院内感染が否定できないことが分かる。
【0062】
[PID法による感染対策指標の評価]
本願発明におけるPID感染対策指標評価の原理は以下のとおりである。
【0063】
PID制御の元データとして、感染対策の指標化(標準化)した数値、例えば菌の分離
率、陽性患者数、感染症発症患者数、発熱などの感染症症状陽性患者数、炎症検査陽性患
者数、感染症検査陽性患者数、および、それらの率、たとえば感染症の発生率、を用いる
。
【0064】
より具体的には、たとえば図17に示したように、まず、PID制御の元データとして
、グラフ化可能な各種指標に対して目標値を設定する(ステップS171)。
【0065】
次に、目標値との偏差、目標値との偏差の蓄積(時間積分)、変化の速さ(時間微分)
を算出する。具体的には、既定の観察期間単位ごとに、目標値との隔たり(偏差)を示す
P因子、時間軸において一つ前の観察単位との差を示すD因子(変化の早さ、時間微分)
、過去の既定の期間の偏差の和を示すI因子(偏差の蓄積、時間積分)を計算する(ステ
ップS172)。
【0066】
続いて、上記算出したP因子、D因子、I因子の和をPID値とする(ステップS17
3)。ここで、I因子の和を取る期間を過去の任意の期間あるいは既定の観察期間幅とす
ることが好ましい。
【0067】
そして、このPID値に従って、つまりPID値を感染対策の成果が目標値にするため
の努力の程度の指標として用いて、PID制御が実行されるが(ステップS174)、こ
のPID制御は常に指標を良い方向(小さい方向あるいは大きい方向)に動かすことが要
求される。目標が、値が小さい方向である場合、実測値が目標より低くなったからと言っ
て、値を増やす(「感染対策を悪くする」)必要はない。そこで、それぞれの値の絶対値
を採る「PID正値」を用いることが必要になる。
PID制御は、時間軸と観察値、率など標準化した観察値の組であって、グラフ化でき
るデータに対し、目標値を設置し、目標値との偏差を元に、データの経時的変化の傾向を
確実に把握することを目的としている。時刻t0からtnにおいて、値x0からxnをとる観
察値について、偏差(P因子)、積分値(I因子)、微分値(D因子)を求める方法を示
す。なお、Pk,Ik,Dk,PIDkは時間tkにおけるP,I,D因子の値およびPID
値を示し、Pak,Iak,Dak,PIDakは相当のP,I,D正値およびPID正値を
示す。具体的な数式の一例は以下のとおりであり、この式に従った各処理ステップは図1
8に示すとおりとなる。
【数2】

【0068】
また、本願発明では、積分期間を指定できるようにもできる。
【0069】
[菌自動集積の検出警告スコア累積のグラフ化]
本願発明における菌自動集積の検出警告スコア累積のグラフ化の原理は以下のとおりで
ある。
【0070】
前述した本願発明における二項分布を用いた菌の異常集積の検出を利用し、その出力と
して得られる警告スコアを累積集計する。集積に対する警告のスコアを指数として一定期
間ごと(例えば一ヶ月ごと)にスコアの累積を集計し、グラフ化する。
【0071】
具体的には、まず、前述した本願発明における二項分布を用いた菌の異常集積検出によ
る出力として得られた警告スコアを、菌ごとに一定期間(例えば一ヶ月)ごとに集計する
。ここで、警告スコアは、菌の分離が、sporadicであるという帰無仮説に基づいて計算さ
れた確率を閾値で分類し、確率が低いものに高いスコアを与えて得られる。例えば、p<0
.001:3点、p<0.005:2点、p<0.01:1点。
さらに具体的には、例えば図19にも例示したように、まずプロットする期間を指定し
(ステップS191)、菌陽性患者数1の菌の扱いを指定する、つまり集計するしないを
指定する(ステップS192)。プロットする菌を指定し(ステップS193)、警告ス
コア表を用いて、指定期間、指定集計法、指定菌の警告スコアの月合計(警告スコア累積
)表を作成する(ステップS194)。集計日、菌、菌陽性患者数、検査対象患者数、お
よび警告スコアを含む警告スコア表は、予め感染症監視サーバーといったコンピュータシ
ステムに記憶されている(データベース等)。作成された警告スコア累積表はまたコンピ
ュータシステムに記憶される。
【0072】
そして、集計の結果つまり警告累積表データに基づき、たとえば図20に例示したよう
なグラフを作成する(ステップS195)。図20のグラフは、横軸が時間軸、縦軸が警
告スコアを表す。この図20に示したグラフは、セラチアマルセッセンスに関するシミュ
レーションの一例を示しており、6年間以上にわたって、ほぼ半年ごとに、セラチアマル
セッセンスの病院内での異常集積が発生していることが分かる。
ここで、この警告スコア累積のグラフから集積を繰り返す菌種を特定し、それらの菌の
疫学的特徴(たとえば良く分離される材料、感染経路など)を組み合わせることで、重点的
に行うべき感染対策を具体的にかつ自動的に示すことが可能になる。
まず、図21に例示したように、菌の異常集積の自動検出の警告(レベル)を月ごとに
合計したものを警告スコア累積とする。
次に、図20に例示したように、警告スコア累積をグラフ化する。これにより、長期間
の院内での細菌の拡散状況を俯瞰することができる。
そして、全ての分離菌について警告スコア累積を集計すると、院内拡散を繰り返してい
る菌を知ることができる。細菌は、菌毎に、どのような材料から良く分離されるかが異な
る。たとえば、大腸菌は、便、尿から多く分離され、ブドウ球菌は、皮膚や鼻腔から多く
分離される。院内拡散を繰り返している菌について、どのような材料から多く分離される
菌であるか、菌毎の検査材料別の分離頻度からその材料を知ると、拡散の原因となってい
る感染源を知ることができる。図22の集計例では、この施設では、近年、シトロバクタ
ー、腸球菌、エンテロバクターの院内拡散を繰り返しており、これらは、便から多く分離
される菌であることから、便の取り扱いが不良であることが予測される。そして、菌別、
検査材料別の分離頻度はその病院のデータ、あるいは、全国データから容易に求めること
ができるため、これから、共通の検査材料を感染源として自動的に判定することができる
。また、菌によっては、拡散経路がよく分かっているものもあり、そのようなものについ
ては、菌と主な感染経路を入力した知識データベースと結合することによって精度を上げ
ることも可能である。
これによれば、院内拡散を繰り返している菌種が多く分離される検査材料をその菌が院
内拡散をしている感染源としてその感染源に関する感染対策を強化することでそれらの菌
の院内拡散を防ぐことができ、それによって、院内感染事故(アウトブレーク)を未然に防
ぐことができるようになる。
すなわち、病院から分離される菌の解析によって、院内での拡散が繰り返されていて、
院内感染症の原因となる可能性が高い「課題菌」を解析し、その病院で強化すべき感染対
策を示すことができる。
細菌は、自ら移動することがほとんどできないため、感染の最初のステップとして、菌
が被感染者の侵入(定着)門戸に到達するためには、何らかの人為的な介在が必要となる
。
感染症の6要素のモデル(Jackson MM. General principles of epidemiology. ;APIC
infection control and applied epidemiology: principles of practice. St. Louis: M
osby, 1996;1:1-19)は、菌が感染源から排泄され、患者に侵入するまでのステップをわ
かりやすく分類したものである。感染源、排泄経路、感染経路、侵入経路、被感染者は、
病原体(菌)によって、異なり、たとえば、ある菌は、便に常在し、別の菌は、鼻腔に常在
し、また、常在しなくとも、病原性の違いにより、主に分離される材料が決まっている。
一方、病原体、感染源、排泄経路、感染経路、侵入経路、被感染者はそれぞれにある程度
関連を持っているが、たとえば、排泄経路がおなじ呼吸器であっても、感染経路が、飛沫
感染による場合と、さらに細かいエロゾルにより空気とともに移動するために、空気感染
と呼ばれる感染経路を取る場合、また、接触感染を取る場合もあるなど、それぞれのステ
ップが、ある程度独立している。
感染対策は、病原体、感染源、排泄経路、感染経路、侵入経路、被感染者のリンクに介
入して感染を防ぐことである。
したがって、最も重要な点は、病院内で院内拡散を繰り返している菌について、共通す
る因子を見つけることによって、どの要素の、どのような種類の因子が、感染対策の弱点
になっているかを明らかにすることである。
従って、院内拡散を繰り返している菌の検出法、上記因子の共通項を見つけ出すアルゴ
リズムは特に限定されないが、以下にその一例について説明する。なお、感染頻度などの
要素を6要素に加えて採用することが有用でもあると考えられる。
図23は、院内拡散を繰り返す菌のスコア化について説明するための図である。
<ステップS221>
まず、初期処理として、課題菌表を空にする。課題菌とは、警告スコア累積合計スコア
など院内拡散を繰り返している菌であり、課題菌表とはこれらを表としたもので、菌名(
菌コード)と警告スコア累積合計スコアなどより求める拡散の危険度を示す数値(危険ラ
ンク:危険度が高いものをより大きい数値とする)などを表としたものである。危険ラン
クの求め方については限定しない。課題菌表は予め感染症監視サーバーといったコンピュ
ータシステムに記憶されている(データベース等)。
<ステップS222>
警告スコア累積合計スコア表(図21参照)から、高スコア菌を選択し、課題菌表へ追
加する。高スコア菌とは、警告スコア累積合計スコアの数値が大きい菌を指す。たとえば
、上位から、10菌種を高スコア菌とする。あるいは、たとえば、月平均20以上の菌を高ス
コア菌とするなど、複数の方法で数値の大きい菌を選ぶことができる。
<ステップS223>
警告スコア累積合計スコア表(図21参照)から、スコア増加傾向菌を選択し、課題菌
表へ追加する。スコア増加傾向菌とは、警告スコア累積合計スコアの全体の合計では、高
スコア菌にならないが、たとえば、直近数ヶ月に限定してみるとスコアが高く、警告スコ
ア累積合計スコアが過去に比べて増加傾向のある菌を指す。
<ステップS224>
課題菌およびその感染因子(排泄経路、感染源、感染経路、侵入門戸、被感染者など)
の表を作成する。具体的には、上記のとおりに各菌が追加されて作成された課題菌表と、
予め記録されている菌・感染因子表とを組み合わせて作成される。菌・感染因子表として
は既知のものを用い、その中の菌群から該当する課題菌の感染因子を検索し、課題菌・感
染因子表に追加する。
<ステップS225>
作成された課題菌・感染因子表をデータベースから読み出し、コンピュータディスプレ
イ等に表示させる。
<ステップS226>
感染因子別および内容別得点(当該菌の数、または、当該菌の危険ランク合計)の表を
作成する。具体的な作成処理は、次の通りである。
(1)まず、感染因子(排泄経路、感染源、感染経路、侵入門戸、被感染者など)のそれ
ぞれの表の各欄を0点とする。
(2)最初にステップ224で得られた課題菌・感染因子表の最初の課題菌を処理の対象と
する。
(3)その最初の課題菌の各々について、各々の得点表のその菌のもつ性質の欄にその菌
の危険ランクを加える。たとえば、感染経路について接触感染をとるのであれば、感染経
路の得点表の接触感染にその菌の危険ランク(たとえば12)あるいは危険ランクを用いな
い集計では1を加え、さらに、侵入門戸が口であれば、侵入門戸の得点表の口の欄に同様
に危険ランク(を加えるどの表においても同じ値、先の例では12または1を加えることに
なる。)。
(4)次に2番目の課題菌について同様に処理し、順次、全ての課題菌が終わるまで処理
を行う。
<ステップS227>
感染因子別および内容別得点(当該菌の数、または、当該菌の危険ランク合計)の表を
降順に並べ替える。
<ステップS228>
感染因子別及び高得点要素をデータベースから読み出し、コンピュータディスプレイ等
に表示させる。ここで、得点、得点力カテゴリー別に色分けすることが好ましい。具体的
な表示処理は、次の通りである。
(1)まず、感染因子(排泄経路、感染源、感染経路、侵入門戸、被感染者など)の最初
の因子たとえば、排泄経路を処理の対象とする。
(2)得点表では尿、便、乳汁、血液、唾液、咳、痰、皮膚などの排泄経路毎に、得点が
求まっているので、得点の多い順(降順)に表を並び替える。順位の高いものに赤など目
立つ色を付け、表を表示する。
(3)次に、他の因子たとえば、感染源を処理の対象とし、同様の処理を行う。順次、全
ての課題菌が終わるまで処理を行う。
【0073】
以上により、例えば、数ヶ月から十数年の集積状況を把握することによって、(1)問
題の発見と対策立案、(2)対策の効果判定が可能になり、院内感染対策に有用である。
(3)全分離菌について数ヶ月から十数年の異常集積の状況を把握する事によって、異常
集積のみとめられた複数の菌種の主な感染様式から、対策の問題点を把握する事が可能と
なり、効率的な対策の立案が可能となり有用である。同様の集計は全国サーベイランスシ
ステムにおいても可能であり、同様の効果が得られる。
【0074】
[装置構成]
以上のとおりの本願発明における各処理は、図24に例示した全体構成を持つ装置によ
り実行することができる。図24の装置1は、バス15に処理部(CPU)10、記憶部
(内部メモリ、外部メモリ)11、入力部(キーボード、マウス)12、出力部(モニタ
、プリンタ)13及び通信制御部14が接続される構成である。この装置11は、通信制
御部14を介してネットワーク16に接続されている。ネットワーク16に接続された装
置1などの端末から他の端末等に格納された各処理に必要な各種データを入手することが
可能である。処理部10は、記憶部11に格納されたプログラムを読み出すことにより、
前述した各種処理を実行する。
【図面の簡単な説明】
【0075】
【図1】本願発明について説明するための菌異常集積検出のフローチャート。
【図2】菌陽性率算出処理のフローチャート。
【図3】重複排除処理のフローチャート。
【図4】菌陽性率の算出結果の一例。
【図5】菌分離確率算出処理のフローチャート。
【図6】本願発明について説明するためのantibiogram自動分類のフローチャート。
【図7】antibiogram自動分類のより具体的なフローチャート。
【図8】antibiogram自動分類フローにおける菌グループ化の一例について説明するための概念図。
【図9】本願発明によるantibiogram自動分類の一結果。
【図10】本願発明によるantibiogram自動分類の一結果。
【図11】antibiogram自動分類における前処理および後処理のフローチャート。
【図12】前処理によるグループ化した代表の一例。
【図13】分類結果の一例。
【図14】カラーコード化の一例。
【図15】本願発明について説明するための2次元carrierマップ作成のフローチャート。
【図16】本願発明による2次元carrierマップの一例。
【図17】本願発明について説明するPID法による感染対策指標評価のフローチャート。
【図18】P、I、D正値およびPID正値算出処理のフローチャート。
【図19】本発明について説明するための菌異常集積検出の警告スコア累積のグラフ化のフローチャート。
【図20】本願発明による菌異常集積検出の警告スコア累積のグラフの一例。
【図21】警告スコア累積の一例。
【図22】警告スコア累積グラフの別の一例。
【図23】本願発明による院内拡散を繰り返す菌のスコア化のフローチャート。
【図24】本願発明について説明するためのシステムブロック図。
【技術分野】
【0001】
本願発明は、菌の異常集積検出方法および装置、アンチバイオグラム分類方法および装
置、2次元キャリアマップ作成方法および装置、感染対策指標の評価方法および装置、菌
異常集積検出の警告スコア累積のグラフ化方法および装置に関するものである。
【背景技術】
【0002】
医療の高度化、人口構成の高齢化に伴い、病院内で免疫力の弱い易感染患者が占める割
合が増えている。易感染患者は健常人が感染症を発症しない様な病原性の弱い菌(いわゆ
る弱毒菌)によっても感染症を発症する。このような感染症を日和見(ひよりみ)感染症
と呼び、日和見感染症を起こす弱毒菌を日和見感染菌と呼ぶ。日和見感染菌の多くは、常
在菌や環境菌であり、患者や医療従事者の腸管などの常在細菌叢や、病院環境中に存在し
、病院内に長時間とどまる。病院内では抗菌薬(生物が作る抗生物質や合成された合成抗
菌薬の総称)が多用されているため、抗菌薬が効く感性菌は淘汰され、抗菌薬の効かない
耐性菌が選択される。このため、日和見感染菌の多くは、多剤耐性化しており、抗菌薬に
よる治療に抵抗するため、これらの細菌による院内感染症が発生すると治療が困難になる
。
【0003】
[菌の異常集積の検出に対する必要性に関する背景]
院内感染症の多くは、このような多剤耐性の日和見感染菌による難治感染症である。今
日、メチシリン耐性ブドウ球菌(MRSA)、多剤耐性緑膿菌(MDRP)などが、問題となって
いるが、様々な常在菌や環境菌が院内感染症の原因となるため、それら小数の特定の菌に
のみ注目していると、他の菌による院内感染症やその徴候を見落とすことになる。すべて
の菌の分離状況を監視し院内感染の徴候を把握するためには、連日ないし少なくとも数日
ごとに全ての菌種の分離状況を病棟あるいは病室ごとに集計してそれぞれの分離を評価す
る必要がある。これには膨大な作業が必要で、人手によって行うことは困難である。した
がって、菌の異常集積を自動的に検出することのできる技術の実現が強く望まれている。
【0004】
すなわち、院内感染症は、院内で上記各種菌が人為的に拡散され、拡散された菌が感染
症を起こすことで発症するものであるところ、院内で菌が人為的に拡散されると拡散され
た菌の分離数が通常より増加するので、特定の菌の分離数の増加、つまり菌の異常集積を
検出することができれば、院内感染の第一段階である人為的な菌の拡散を検出できること
になり、院内感染を未然に防ぐことができるようになる。この点に関し、電算機を用いた
リアルタイムのサーベイランスが実施できれば、特定の菌の分離数、分離率をリアルタイ
ムで算出することが可能であるが、検出の感度、特異性を保ちつつ自動化できる適当な統
計的手法が従来はなかった。
【0005】
そこで、本出願の発明者等は、二項分布を用いた菌の異常集積の検出を既に発案し(非
特許文献1、2参照)、この問題を解決したが、帰無仮説の確率であるベースラインレー
トとして何を用いるか(例えば集計期間の決定や重複排除の方法)、どのような期間幅ど
のような頻度で集計するのが適当であるかなど、解決すべ点がまだ存在している。
【0006】
[antibiogram分類に対する必要性に関する背景]
細菌による院内感染症は、主に、原因となる菌が病院内で拡散することによって起こる
。一方、菌が拡散しても感染症が発生しなければ院内感染症とはならない。菌が拡散した
ことを早期に検出し、確認できれば、院内感染症を未然に防ぐことができる。前記の菌の
異常集積の検出によって、異常な菌の集積を検出することができた場合でも、集積が院内
での菌の拡散に基づくものであるのか、たまたまその菌を持った人がその病棟に集まった
のか判断する必要がある。細菌は同じ菌種(例えば緑膿菌)として同定(つまり検査の結
果菌種を定める)されても、それぞれが少しずつ異なった遺伝的背景を持っている。ヒト
が同じ人類であっても、一人一人の遺伝子が少しずつ異なるのと同じである。ヒトと細菌
が異なるのは、増殖するときにヒトが父親と母親から半分ずつ遺伝子を受け継ぐのに対し
て、細菌は、無性の2分裂によって増殖するため、元となった菌と増殖した菌が、稀に起
きる変異による変化を除いて全く同じ遺伝子を持っていることである。したがって、細菌
の場合は、別の場所、別の時間に分離された菌が、同じ菌であるかどうかを正確に予測す
ることが可能である。場所や時間を隔てて分離された細菌が全く同じ菌であるかどうかを
最も正確に予測する方法は、それぞれの菌の全遺伝子配列を決定することである。しかし
現実には、全遺伝子配列を決定しなくとも、遺伝子配列の概要を調べたり、あるいは、菌
の特徴(つまりヒトで言えば肌の色や髪の色などの形質)から、それらの菌が同じ菌であ
るか別の菌に由来するものであるか、相当の精度で予測することができる。これは細菌が
、一般に短期間(例えば数十日単位)で著しい変異を生じることは稀であるが、長期間に
は遺伝子の大規模な組み替えを含む、様々な変異を生じることによる。
【0007】
臨床の現場でこのような菌の特徴としてもっとも良く用いられるのは、異なった種類の
抗菌薬に対する耐性(つまり薬が効かないこと)のパターンであるいわゆるantibiogram
(アンチバイオグラム)である。ある菌が抗菌薬ABCに耐性でDEFには感性(つまり薬が効
くこと)であり、同じ菌種に属する別の菌が抗菌薬ABCDに耐性でEFに感性であった場合、
それらの菌は別の由来であると予測できる。適当な薬剤の組み合わせを選ぶとACEに耐性
でBDFに感性、など全ての組み合わせ(つまりパターン)が出現する可能性があり、antibiogramが同じであると、それらの菌の由来が同じである可能性が少なくとも否定できないと結論できる。この方法は、細菌の抗菌薬に対する感受性(つまり耐性であるか感性であるか調べること)検査が保険診療の範囲内であり、日常の臨床検査としてひろく行われているために、このような疫学調査(つまり伝染性の疾患、環境要因による疾患など、集団で発生する疾患の因果関係を明らかにする研究方法)のために新たに費用が発生しない利点を持つ。antibiogramによる菌の同一性の予測は、遺伝子配列の概要による分類、さらに詳細な遺伝子解析(これらの解析は分子疫学的手法と呼ばれる)の結果と良く一致することが知られている。antibiogramで同一であることが否定できないと予測された菌の中には同一でないものも含まれるが、antibiogramで異なる菌と判断された菌は他の手法でも異なる菌と同定されるために、さらに詳細な分子疫学的手法を行うべきかどうかの判断とし、最初に行うべき調査である。一般病院で、分子疫学的手法による解析を行うことは、設備、費用の何れの面からも殆ど不可能である。多くの健康被害が発生した事例などに限って、大学、都道府県の衛生研究所、国立感染症研究所などが分子疫学的調査を行っている。
【0008】
現在、antibiogramは、臨床検査の結果として得られた菌の複数抗菌薬に対する感受性
を元に、人手によって整理が行われている。このとき、(1)菌の感受性はS(感性)、
I(中間)、R(耐性)としていわゆるSIR判定される。IとS、IとRの違いは検査
の誤差範囲であることがある。(2)多数の菌のantibiogramの整理を行う場合、全ての
菌に対して同じ抗菌薬の感受性が全て調べてあるとは限らない。(3)グループ分けが一
つに定まらない。などの問題があり、作業に多くの時間が掛かる、結果に自信が持てない
という問題がある。
【0009】
したがって、細菌検査を行う多くの臨床検査技師がantibiogramの整理を自動化する技
術の実現を希望している。
【0010】
antibiogramの自動整理はつまりパターンの分類であり、上記の理由から曖昧な要素を
含んでいると考えられたためか、電算機を利用してantibiogramを作表する仕組みはあっ
たが、従来、自動的に分類するためのプログラムは実現されていない。
【0011】
[2次元carrierマップに対する必要性に関する背景]
前記のantibiogram分類による抗菌薬分類をカラーコード化しいわゆる2次元carrierマ
ップを作成することも重要な技術であり、これによれば菌の拡散状態を容易に把握できる
ようになると考えられる。
【0012】
特定の菌の分離状況を2次元マップ化することはこれまでも行われてきたが、前記のと
おりにantibiogram分類の方法がなかったために、同一菌株の拡散を2次元マップ化し患
者の動線を考慮した解析を行う資料の自動作成はできなかった。
【0013】
したがって、このようなantibiogram自動分類に組み合わせた2次元carrierマップの自
動作成技術の実現も有用である。
【0014】
[PID感染対策指標の評価に対する必要性に関する背景]
院内感染対策においても様々な指標をグラフ化し、値、増減から対策を検討することが
重要である。例えば、院内感染菌として良く問題となるMRSA(メチシリン耐性黄色ブドウ
球菌)の分離患者数、分離率などをグラフ化して、それらが増える傾向にある場合、担当
者に注意を促し、この菌の病院内での拡散の原因を除くために接触予防策の強化などを行
う。一般にグラフ化することによって変化は明らかになるが、多くの指標のトレンドを目
視で正確に把握することは必ずしも容易ではなく、(1)目標値とのわずかなずれ、(2
)変化の速さ(グラフの傾き)などは、必ずしも正確に把握されない。
【0015】
PID(proportional-integral-differential)制御は、温度、速度の制御などで古く
から使われる方法であるが、コンピュータ技術の発達に伴ってさらに実用性が増し、民生
、工業などの制御にひろく使われている。
【0016】
したがって、PID技術によれば変化速度、微少偏位の継続、偏位を的確に評価するこ
とが可能であり、時に目視で見落とされることのある微少な偏位の持続、変化速度の差を
数量化、グラフ化できることに注目し、感染対策に於ける各種指標を正常に保つことを一
つの制御と考え、感染対策のトレンド解析にPID制御を応用することも有用であると考
えられる。
【0017】
[菌の異常集積の検出警告スコア累積のグラフ化に対する必要性に関する背景]
前述した二項分布を用いる菌の異常集積の検出技術を利用し、その出力として得られる
警告スコアを累積集計することも、院内感染対策に有用であると考えられるが、このよう
な技術は実現されていない。
【非特許文献1】藤本修平、「中小規模病院感染症監視システム」、厚生労働科学研究費補助金 医療安全総合研究事業、医療安全総合研究事業 院内感染の防止のための監視体制の整備、細菌検査室の機能向上に関する研究 平成17年度報告書、13-102. (2006)
【非特許文献2】藤本修平、「院内感染対策サーベイランスの効率化に関する研究」、厚生科学研究費補助金 新興・再興感染症研究事業 薬剤耐性菌の発生動向のネットワークに関する研究 平成15年度総括研究報告書、87-94. (2004)
【発明の概要】
【発明が解決しようとする課題】
【0018】
本願発明は、以上のとおりの事情に鑑み、電算機システムを用いて細菌検査の結果の中
から統計的に有為な菌の異常集積を自動的に検出することのできる、菌の異常集積検出方
法および菌の異常集積検出装置を提供することを課題としている。
【0019】
また、本願発明は、antibiogramの整理つまりパターンの分類を自動化することで、院
内感染の疫学調査を省力化し、かつ、誤りや見落としを防ぐことのできる、アンチバイオ
グラム分類方法およびアンチバイオグラム分類装置を提供することを課題としている。
【0020】
また、本願発明は、antibiogram分類による抗菌薬分類をカラーコード化し、菌の分離
を時間軸、空間軸でプロットして、同一患者を直線で結びつけて、同じ耐性パターンの菌
が病棟内などで拡散している状態を容易に把握できる2次元carrierマップを自動的に作
成することのできる、2次元キャリアマップ作成方法および2次元キャリアマップ作成装
置を提供することを課題としている。
【0021】
また、本願発明は、感染対策のトレンド解析にPID制御を応用し、感染対策に於ける
各種指標を正常に保つことができ、指標として実数を用いることが適当でないことや、積
分期間が長い場合は過去の影響が及ぶ期間が不適切に長くなることの障害を排除し、様々
なグラフ評価を正確に可能ならしめる、PID法によるグラフ評価技術、つまりPID法
による感染対策指標の評価方法および装置を提供することを課題としている。
【0022】
また、本願発明は、上記菌の異常集積検出を利用して、その出力として得られる警告ス
コアを累積集計しグラフ化することのできる、菌自動集積検出の警告スコア累積のグラフ
化方法および装置を提供することを課題としている。
【課題を解決するための手段】
【0023】
本願発明は、上記の課題を解決するものとして、
菌の異常集積検出の対象とする場所毎に、既定の集計頻度で、既定の観察期間幅中の検
体提出患者および当該検出の対象とする全ての菌について、菌毎に、菌が陽性だった患者
数を集計し、
全ての菌について、集計した菌毎の陽性患者数と、検体提出患者数と、予め求めた菌毎
の陽性率による二項分布を用いて、菌の偏りのない分離において成立するベルヌーイ試行
の確率を、菌の分離に偏りが無く且つ菌の分離が偶然のみに支配されているという帰無仮
説によって計算し、
計算された確率が既定値より小さい場合に、偶然のみに支配されている確率が小さく菌
の分離に偏りがあって異常な集積があったと判定する、
菌の異常集積検出方法であって、
前記ベースラインレートの算出を行う際に、同一患者の重複排除を月および人ののべ数
となるように行うことによって、前記ベースラインレートが前記二項分布の単回の独立試
行の確率となるようにする、
ことを特徴とする菌の異常集積検出方法、
を提供し、また、
菌の異常集積検出の対象とする場所毎に、既定の集計頻度で、既定の観察期間幅中の検
体提出患者および当該検出の対象とする全ての菌について、菌毎に、菌が陽性だった患者
数を集計して予め求められた集計データと、
全ての菌について、集計した菌毎の陽性患者数と、検体提出患者数と、予め求めた菌毎
の陽性率とによる
二項分布を用いて、菌の偏りのない分離において成立するベルヌーイ試行の確率を、菌の
分離に偏りが無く且つ菌の分離が偶然のみに支配されているという帰無仮説によって計算
し、
計算された確率が既定値より小さい場合に、偶然のみに支配されている確率が小さく菌
の分離に偏りがあって異常な集積があったと判定する、
菌の異常集積検出装置であって、
前記ベースラインレートの算出を行う際に、同一患者の重複排除を月および人ののべ数
となるように行うことによって、前記ベースラインレートが前記二項分布の単回の独立試
行の確率となるようにする、
ことを特徴とする菌の異常集積検出装置
を提供する。
【0024】
また、本願発明は、上記の課題を解決するものとして、
SIR判定を用いて菌の持つ薬剤耐性のパターンであるアンチバイオグラムを分類する
方法であって、
2つの菌の組み合わせのうちで、全ての抗菌薬剤に対して一つでもSとRの違いがある
組み合わせを不一致組み合わせと判定して、当該2つの菌同士で一致する薬剤の数を0点
とし、互いにSまたは互いにRである組み合わせを一致組み合わせと判定して、当該2つ
の菌同士で一致する薬剤の数N点を求め、
この一致不一致の判定をすべての菌の組み合わせに対して行い、
一致する薬剤の数N点が既定の閾値以上になる菌のグループを作る、
ことを特徴とするアンチバイオグラム分類方法、
を提供し、また、
SIR判定を用いて菌の持つ薬剤耐性のパターンであるアンチバイオグラムを分類する
装置であって、
2つの菌の組み合わせのうちで、全ての抗菌薬剤に対して一つでもSとRの違いがある
組み合わせを不一致組み合わせと判定して、当該2つの菌同士で一致する薬剤の数を0点
とし、互いにSまたは互いにRである組み合わせを一致組み合わせと判定して、当該2つ
の菌同士で一致する薬剤の数N点を求める手段と、
この一致不一致の判定をすべての菌の組み合わせに対して行う手段と、
一致する薬剤の数N点が既定の閾値以上になる菌のグループを作る手段と、
を備えることを特徴とするアンチバイオグラム分類装置、
を提供する。
【0025】
また、本願発明は、上記の課題を解決するものとして、
上記のアンチバイオグラム分類方法によって分類された菌のグループに基づき2次元キ
ャリアマップを作成する方法であって、
前記菌のグループをカラーコード化し、
分離された患者、場所、時期の3つのパラメータに基づいて、2次元キャリアマップ上
の時間軸、空間軸に沿って各菌の分離データをプロットし、
同一患者を線で結ぶ、
ことを特徴とする2次元キャリアマップ作成方法、
を提供し、また、
上記のアンチバイオグラム分類装置によって分類された菌のグループに基づき2次元キ
ャリアマップを作成する装置であって、
前記菌のグループをカラーコード手段と、
分離された患者、場所、時期の3つのパラメータに基づいて、2次元キャリアマップ上
の時間軸、空間軸に沿って各菌の分離データをプロットする手段と、
同一患者を線で結ぶ手段と、
を備えることを特徴とする2次元キャリアマップ作成装置、
を提供する。
【0026】
また、本願発明は、上記の課題を解決するものとして、
感染対策の指標となる数値の変動および偏りを評価する方法であって、
既定の観察期間単位ごとに、目標値との隔たりを示すP因子、時間軸において一つ前の
観察単位との差を示すD因子、過去の既定の期間の偏差の和を示すI因子を計算し、
これらP因子、D因子、I因子の和をPID値とし、PID値、またはPID値の絶対
値であるPID正値を、感染対策の成果が目標値に達するための努力の程度の指標として
用いる、
ことを特徴とする感染対策指標の評価方法、
を提供し、また、
感染対策の指標となる数値の変動および偏りを評価する装置であって、
既定の観察期間単位ごとに、目標値との隔たりを示すP因子、時間軸において一つ前の
観察単位との差を示すD因子、過去の既定の期間の偏差の和を示すI因子を計算する手段
と、
これらP因子、D因子、I因子の和をPID値とし、PID値、またはPID値の絶対
値であるPID正値を、感染対策の成果が目標値に達するための努力の程度の指標として
用いる手段と、
を備えることを特徴とする感染対策指標の評価装置、
を提供する。
【0027】
また、本願発明は、上記の課題を解決するものとして、
上記の菌の異常集積検出方法の出力として得られる警告スコアを累積集計してグラフ化
する方法であって、
前記計算された菌の偏りのない分離を表すベルヌーイ試行の確率を閾値で分類し、確率
が低いものに高いスコアを与えて得られる警告スコアを、菌ごとに一定期間ごとに集計し
、集計結果を、横軸を時間軸、縦軸を警告スコアとしてグラフ化する、
ことを特徴とする菌異常集積検出の警告スコア累積のグラフ化方法、
を提供し、また、
上記の菌の異常集積検出装置の出力として得られる警告スコアを累積集計してグラフ化
する装置であって、
前記計算された菌の偏りのない分離を表すベルヌーイ試行の確率を閾値で分類し、確率
が低いものに高いスコアを与えて得られる警告スコアを、菌ごとに一定期間ごとに集計す
る手段と、集計結果を、横軸を時間軸、縦軸を警告スコアとしてグラフ化する手段と、
を備えることを特徴とする菌異常集積検出の警告スコア累積のグラフ化装置、
を提供する。
【0028】
そしてさらに、本願発明は、前記各種方法あるいは装置の機能をコンピュータに実行さ
せるためのプログラムおよび当該プログラムを記録したコンピュータ読取可能な記録媒体
をも提供する。
【発明を実施するための形態】
【0029】
[菌の異常集積検出]
本願発明における菌の異常集積の検出の原理は以下のとおりである。
【0030】
細菌の分離は、培養陽性、陰性の2つの値のみを取り、偏りなく分離されるとき、いわ
ゆるsporadicな分離のときには、毎回独立に菌の分離率(baseline rate:ベースライン
レート)にしたがって偶然に支配されて発生するいわゆるベルヌーイ試行である。偏りの
ないベルヌーイ試行は、その確率が二項分布(例えば下記数1で表される累積二項分布)
によって計算できることに注目し、菌の分離に偏りが無く、菌の分離が偶然のみに支配さ
れているという帰無仮説によってその確率を計算し、計算された確率が十分に小さい場合
、偶然のみに支配されている確率が小さく、何らかの偏りがあった、すなわち菌の分離に
異常な集積があったと結論する。これにより、すべての菌について、病院全体、病棟ごと
、病室ごとの菌の分離に偏りがあったかどうかを評価できれば、すべての菌種についての
菌の異常集積を自動的に確実に捕捉する事が可能になる。
【0031】
【数1】

ここで、p=ベースラインレート、n=検体提出患者数、k=陽性患者数である。
ある菌種が特定の場所(病棟など)で偶然によるよりも多くの患者から分離された場合
、その場所の中で拡散(感染または保菌)が発生したことが疑われ、実際に拡散(感染ま
たは保菌)が発生していた場合は、(1)その場所での感染対策(衛生的手技)に問題が
ある可能性が示唆される。(2)拡散が続けば、ある確率で院内感染症の発生(アウトブ
レイク)に結びつくことが考えられる。したがって、すべての菌種についての菌の異常集
積を自動的に確実に捕捉する事ができれば、不十分な感染対策に基づくアウトブレイクを
未然に防ぐことができる。
【0032】
そして、この二項分布を用いた菌の異常集積の検出は、さらに具体的には、以下の設定
条件の下に実行される。
(1)ベースラインレートの算出を行う際に、同一患者の重複排除を月および人ののべ数
となるように行うことによって、前記ベースラインレートが前記二項分布の単回の独立試
行の確率となるようにする。このとき、同一患者の重複排除は、既定期間毎、たとえば1
年毎に行ってもよい。さらにあるいは、ベースラインレートに、前記場所の菌の陽性率あ
るいは全国平均の陽性率をとり、これにより客観的な分離の効果の評価も実現させる。全
国平均とは、全国的サーベイランスで得た菌の陽性率を指す。また、同規模、同種の病院
特性(救急病院、急性期病院、慢性期病院、老人病院、小児科病院など)によって層別化
した全国平均も含む。
(2)集計は、複数の既定の観察幅、たとえば毎日、1日、7日、14日、30日の観察
幅で行う。
(3)菌の検査結果は確定するまでに日数がかかるので、即時性のために、中間報告が行
われるたびに再集計をかける。
【0033】
より具体的には、たとえば図1に示したように、まず、検出の対象とする全病院、各病
棟、各診療科などの場所毎(例えば病院A,病院B,病院C・・・、病棟A,病棟B,病
棟C・・・、診療科A,診療科B,診療科C・・・、に、1日、7日、14日、30日な
どの複数の既定の観察期間幅(いわゆるウィンドウ)W1,W2,W3・・・中の検体提出
患者(つまり細菌検査を行った患者)Nsample-patientと、すべての菌x1,x2,x3・・・
についてそれぞれその菌が陽性だった患者数Npositive-patientを集計する(ステップS
11、S12)。この集計は、連日あるいは既定の期間の頻度で行う。たとえば、1年間
に亘って、W1=1日,W2=14日,W3=30日の観察期間を順次繰り返しながら各観
察期間毎のNsample-patient、Npositive-patientをデータベースに集計、入力する。
【0034】
一方、たとえば図2に示したように、すべての菌について、その菌の陽性率Rpositive
、つまり一人の患者を検査してその菌が検出される確率を、たとえば1年など十分に長い
期間についてその菌が陽性だった患者数を検体提出患者数で除して、予め求めておく。よ
り具体的には、まず、データ集計期間を指定し(ステップS21)、検体提出患者数と細
菌種毎の陽性検出患者数を集計入力し(ステップS23,S24)、菌陽性率Rpositive
を算出する(ステップS25)。
このとき、本願発明では、同一患者の重複排除を月および人ののべ数となるように行う
(ステップS22)。より具体的には、たとえば図3に例示したように、同じ患者から所
定観察期間内(たとえば30日以内)に同じ菌種が検出されたか否かを判断する(ステッ
プS31)。検出されていない場合には重複排除処理せず(ステップS33)、検出され
ていない場合には抗菌薬感受性が関与する集計があるか否かを判断する(ステップS32
)。集計がない場合には重複排除処理せず(ステップS33)、集計がある場合には耐性
判断のある重複菌を排除する(ステップS34)。具体的には、初期設定として共通の抗
菌薬数を0とし(ステップS35)、各抗菌薬について耐性に違いがあるか否かを判断す
る(ステップS37)。違いがない場合には共通の抗菌薬数=共通の抗菌薬数+1として
(ステップS38)、判断処理をループさせ(ステップS36−S38)、耐性に違いが
ある場合には別の菌として集計する(ステップS311)。全ての抗菌薬について判断が
終わった後(ステップS36)、共通の抗菌薬数がいずれかの株の検査抗菌薬数と同じで
あるか否かを判断する(ステップS39)。同じである場合には同じ菌として処理し(ス
テップS312)、違う場合には共通の抗菌薬数が所定値(たとえば5)以上であるか否
かを判断し(ステップS310)、所定値以上でない場合には別の菌として集計し(ステ
ップS311)、所定値以上である場合には同じ菌として処理する(ステップS312)
。そして、同じ菌に対して重複排除処理を実行する、つまり集計データから重複菌を削除
する(ステップS313)。続いて、時系列上先に検査が行われた菌の検査抗菌薬数が時
系列上後に検査が行われた菌の検査抗菌薬数以上であるか否かを判断する(ステップS3
14)。これが成り立つ場合には先の検査を残し(ステップS315)、成り立たない場
合には所定観察期間の判断の日付として先の検査の検体検出日を受け継ぎ(ステップS3
16)、後の検査を残す(ステップS317)。
図4は、以上の重複排除を含めた各処理に従い算出した菌陽性率Rpositiveの一例であ
る。
【0035】
菌の分離が偏りなく、偶然にのみ支配されていると仮定した場合に、それぞれの場所で
それぞれの菌がそれぞれの数それぞれの検査患者数から分離される確率Pisolationは、そ
の菌の陽性率Rpositiveであり、ある場所で、ある菌が、ある人数の患者から分離される
確率Pisolationは、それらの数と、検査患者数Nsample-patientと、その菌の陽性率Rposi
tiveから二項分布を用いて求めることができる(ステップS13(図1))。さらに、そ
の数より少ない数が分離される確率を加える、つまり累積二項分布を用いることによって
、例えば、6人検査して4人までがその菌が陽性である確率を求めることができる。本願
発明では、全ての場所毎、全ての観察期間、全ての菌種について毎日その確率を計算する
。
【0036】
観察期間幅を複数設ける目的は、短い鋭い変化、長期のなだらかな変化の何れも見落と
さないためである。これらの幅で、連日、確率計算し続けることで、小さな集積も特異的
に検出することができる。
菌の分離確率Pisolationのより具体的な算出処理は、たとえば図5に示したように、上
述した数式1に従い、初期設定としてP=0とし(ステップS51)、m=kからnまで
(ステップS52)次の計算をする。まず、nCm(=Cx)を計算し(ステップS53)、ア
ル順番で丁度m個菌が出る確率pm(1−p)n-m(=Ptankai)を求め(ステップS54
)、丁度m個菌が出る確率Cx Ptankai(=Pkumiawase)を算出し(ステップS55)、P=
P+Ptankaiとする(ステップS56)。
【0037】
本願発明では、さらに、計算した分離確率Pisolationをその値によって分類し、異常集
積の危険度(警告レベル)として、問題の発生した場所、集計の日時、観察期間幅、菌種
、陽性患者数、検体提出患者数、確率など、危険度を表示して警告としている。
より具体的には、分離確率Pisolationに対する閾値(複数のレベル)を予め指定してお
き(ステップS14(図1))、菌分離事象を分離確率Pisolationによって分類する(ス
テップS15)。そして、各レベル以下の分離確率Pisolationを持つ事象を異常として警
告する(ステップS16)。
【0038】
なお、当該技術の応用として、antibiogram分類技術と組み合わせ、分類毎の異常集積
を検出することによって、特定の耐性菌が病院内、あるいは、地域で拡散した場合にこれ
を自動的に検出することが可能になる。
【0039】
[antibiogram分類]
本願発明におけるSIR判定を用いたantibiogram分類の原理は以下のとおりである。
【0040】
SIR判定のうちで曖昧さの残るI(中間)の扱いについて検討した結果、IはS(感
性)、R(耐性)の何れとも取れるため、決定因子にならず、検査を行っていないのと同
様の扱いでよいことが分かった。同一であることをスコア化して判断する方法は最終的な
組み合わせに曖昧さが残るため、実用性が低いことが分かった。そこで、本願発明のanti
biogram分類は、論理的に(つまりrule based algorithmで)同じグループに属すること
が否定できない組み合わせを網羅するものである。
【0041】
さらに説明すると、たとえば図6および図7のフローチャートに示すように、まず、2
つの菌A−Bの組み合わせのうちで(ステップS56、ステップS71−S72)、一つ
でもSとRの違いがある組み合わせ、つまり互いにSまたは互いにRでない組み合わせは
同じグループに属することが否定できるため除外し(ステップS62−S63、ステップ
S73)、それら2つの菌の間で一致する抗菌薬剤の数がないものとして、検査数を0点
とする(ステップS64、ステップS74)。それ以外について、つまり互いにSまたは
互いにRである組み合わせについて、2つの菌の間で一致する抗菌薬剤の数Nを求め、検
査数N点とする(ステップS65、ステップS75−S76)。一致する検査の数に一定
の基準(例えば3つ以上など)を設け、すべての菌に対して一致不一致の判定をし、判定
表を作成する。判定表を元に、お互いに一致する検査数が一定基準以上になる菌のグルー
プを作る(ステップS66−S67、ステップS77−S78)。組み合わせを作るため
に、集合論を利用した手法を用いる。
【0042】
より具体的には、例えば以下のように処理する。
【0043】
(1)SIR判定のIをデータ入力がないものとして扱い、SとRの一致不一致のみを
判断する。
【0044】
(2)すべての2つの組み合わせであるパターンを比較し、耐性S,Rに一つでも異な
るものが有れば排除する((3)において0点とする)
(3)耐性が一致している抗菌薬数を得点化し、閾値(たとえば3点)以上の抗菌薬数
を持つ2つのパターンの同一性を判定する。
【0045】
(4)2つのパターンの関係である同一性から3つ以上の組み合わせを得る。
【0046】
ここで、たとえば、2つのパターンの関係である同一性から3つ以上の組み合わせを得
る具体的アルゴリズムの一例は、図8に示すとおりである。集合Aiは菌株xiと耐性パター
ンの同一性が否定できない菌株の集合である。菌株xjが集合Aiの要素であるとき、菌株xi
は集合Ajの要素である。Ai、Ajが与えられると、それらと耐性パターンが同一である事が
否定できない3番目の菌株は共通集合となる。したがって、耐性が一致している抗菌薬数
を得点化した値が閾値以上の組み合わせの集合を主記憶上に持つことによって、高い効率
で3番目以降の菌株の組み合わせを得ることができる。
【0047】
たとえば図9および図10は、本願発明によるantibiogram自動分類の一結果を示すも
のであり、図9は一致する検査結果数の一覧表、図10は自動分類結果である。図9にお
ける検出対象場所毎、検体提出患者毎のSIR集計データに基づき、図10におけるよう
な一致耐性薬剤点数が得られているのがわかる。
より具体的には、図7中のステップS73において、たとえば図10にて菌K41とK
70のSIRを比較すると、薬剤AZTに対してK41がR、K70がSであるので、K
41−K70は不一致組合せと判断し、ステップS64において、K41−K70は不一
致組合せなので0点とする(図9参照)。一方、ステップS65において、たとえば図1
0にて菌41と菌42のSIRを比較すると、まず、少なくとも一方の菌がIである薬剤
AZT、CTXを除き、つまり、薬剤AZTに対してK42がIであり、薬剤CTXに対
してK41、K42の両方がIであるので、AZT、CTXに対するK41−K42間の
S/Rは判断対象外とし、続いて、それ以外の薬剤については、薬剤AMK、GM、PI
PCの全てに対して互いにSであるので、K41−K42は一致組合せと判断する。そし
て、ステップS66において、K41−K42は薬剤AMK、GM、PIPCの3個で一
致するので3点とする(図9参照)。同様に、たとえばK42−K50は薬剤AMK、G
Mの2個で一致するので2点とする(図9参照)。
そして、グループ化の結果例については、図示していないが、上述したとおりのグルー
プ化処理によって、耐性パターンが同一である事が否定できない菌のグループ化、つまり
菌のantibiogram分類を実現することができる。
【0048】
なお、以上のantibiogram分類技術の応用として、次述の2次元careerマップと組み合
わせることによって実用性が増す。
【0049】
また、グループ分けに対して、時間的、空間的集積を指摘する(特定の耐性菌が拡散し
ている危険性を指摘する)仕組みを付け加えることが考えられる。
【0050】
また、各薬剤の平均耐性率が得られるようになれば、antibiogramの一致率に重みつけ
ることが可能となる。確からしさの指数として用いる仕組みを付け加えることも考えられ
る。
ところで、以上のantibiogramの自動分類については、図6に例示した本処理の前に、
処理の対象となるデータに前処理を施すことによって、劇的に処理量を減らすことができ
る。具体的には、図11に例示したように、まず、SIR判定の結果が全ての菌について
同じか、つまり全てRまたはIであるか、または全てSまたはIであるかを判断し(ステ
ップS111−S113)、該当する抗菌薬剤をたとえば図8の表から除いて分類処理対
象外とする(ステップS114)。続いて、全く同じ感受性パターンの菌を一つの菌とし
て扱う。すなわち、SIRの組合せが同じ菌群をグループ化してその代表の菌を表にする
(ステップS115)。そして、図6(あるいは図7)のとおりの分類処理後に、ステッ
プS115でグループ化した代表の結果を、ステップS66、S77により得られたグル
ープ全体に複写する(ステップS116)。なお、前処理において、全ての検体に対する
SRのパターンが同じ抗菌薬が複数あった場合、代表として一方のみを残す処理を実行し
てもよい。 図12はこの前処理によりグループ化した代表の一例、図13は図12のグ
ループ化した代表をS66、S77によるグループ全体に複写した場合における分類結果
の一例、図14はそのカラーコード化の結果の一例を示す。
【0051】
[2次元carrierマップ作成]
本願発明における2次元carrierマップ作成の原理は、たとえば図15にも例示したよ
うに、以下のとおりである。図16は、本原理に従い、図14の分類カラーコードに基づ
いて作成した2次元carrierマップの一例である。
【0052】
まず、前記antibiogram分類による抗菌薬分類を、つまりantibiogram分類によって同一
菌であることが否定できない菌のグループをカラーコード化する。グループ毎に異なる色
を設定すればよい。
【0053】
次に、分離された患者、場所、時期の3つのパラメータに基づいて、マップ上の時間軸
、空間軸に沿って各菌の分離データをプロットする。
【0054】
そして、同一患者の各プロットを線で結ぶ。
【0055】
より具体的には、図15に沿って以下のように処理する。
【0056】
(1)antibiogramを自動分類した後、各菌のグループ毎に異なる色を選択し、グルー
プと色とを関連付けて設定記憶しておく(ステップS151)。
【0057】
(2)X軸を時間軸、Y軸を全ての検体のリストアップ軸とする2次元carrierマップ
を用意する。Y軸に沿って、全ての検体を、検体毎に予め記録されている患者情報、位置
情報(建物、階、病棟、病室など)、検体採取日時に基づきソーティングし、マップ上左
側部位にリストとして縦に1列に並べて表示させる(ステップS152)。もちろんXY
はこの逆の組み合わせとしもよい。
【0058】
(3)その検体の採取日時に相当するX位置でリストのY位置の高さの位置にプロット
する(ステップS153)。各プロットはantibiogram分類グループ分けの色を付ける(
ステップS154)。複数のantibiogram分類グループに属する場合は、必要なだけ横ま
たは縦に並べる。
【0059】
(4)同じ患者からの検体のプロット間に直線データを付与してマップ上に表示させる
(ステップS155)。
【0060】
以上により、同じ耐性パターンの菌が病棟内などで拡散している状態を解析して、非常
に容易に把握することが可能になる。
【0061】
例えば、図16に示した例では、丸枠内の茶色およびオリーブ色に分類される菌は、こ
の患者さん以外からはほとんど検出されないので、同時期に同じ病棟に入院した別の患者
さんから同じ分類の菌が出たとすると、院内感染が否定できないことが分かる。
【0062】
[PID法による感染対策指標の評価]
本願発明におけるPID感染対策指標評価の原理は以下のとおりである。
【0063】
PID制御の元データとして、感染対策の指標化(標準化)した数値、例えば菌の分離
率、陽性患者数、感染症発症患者数、発熱などの感染症症状陽性患者数、炎症検査陽性患
者数、感染症検査陽性患者数、および、それらの率、たとえば感染症の発生率、を用いる
。
【0064】
より具体的には、たとえば図17に示したように、まず、PID制御の元データとして
、グラフ化可能な各種指標に対して目標値を設定する(ステップS171)。
【0065】
次に、目標値との偏差、目標値との偏差の蓄積(時間積分)、変化の速さ(時間微分)
を算出する。具体的には、既定の観察期間単位ごとに、目標値との隔たり(偏差)を示す
P因子、時間軸において一つ前の観察単位との差を示すD因子(変化の早さ、時間微分)
、過去の既定の期間の偏差の和を示すI因子(偏差の蓄積、時間積分)を計算する(ステ
ップS172)。
【0066】
続いて、上記算出したP因子、D因子、I因子の和をPID値とする(ステップS17
3)。ここで、I因子の和を取る期間を過去の任意の期間あるいは既定の観察期間幅とす
ることが好ましい。
【0067】
そして、このPID値に従って、つまりPID値を感染対策の成果が目標値にするため
の努力の程度の指標として用いて、PID制御が実行されるが(ステップS174)、こ
のPID制御は常に指標を良い方向(小さい方向あるいは大きい方向)に動かすことが要
求される。目標が、値が小さい方向である場合、実測値が目標より低くなったからと言っ
て、値を増やす(「感染対策を悪くする」)必要はない。そこで、それぞれの値の絶対値
を採る「PID正値」を用いることが必要になる。
PID制御は、時間軸と観察値、率など標準化した観察値の組であって、グラフ化でき
るデータに対し、目標値を設置し、目標値との偏差を元に、データの経時的変化の傾向を
確実に把握することを目的としている。時刻t0からtnにおいて、値x0からxnをとる観
察値について、偏差(P因子)、積分値(I因子)、微分値(D因子)を求める方法を示
す。なお、Pk,Ik,Dk,PIDkは時間tkにおけるP,I,D因子の値およびPID
値を示し、Pak,Iak,Dak,PIDakは相当のP,I,D正値およびPID正値を
示す。具体的な数式の一例は以下のとおりであり、この式に従った各処理ステップは図1
8に示すとおりとなる。
【数2】

【0068】
また、本願発明では、積分期間を指定できるようにもできる。
【0069】
[菌自動集積の検出警告スコア累積のグラフ化]
本願発明における菌自動集積の検出警告スコア累積のグラフ化の原理は以下のとおりで
ある。
【0070】
前述した本願発明における二項分布を用いた菌の異常集積の検出を利用し、その出力と
して得られる警告スコアを累積集計する。集積に対する警告のスコアを指数として一定期
間ごと(例えば一ヶ月ごと)にスコアの累積を集計し、グラフ化する。
【0071】
具体的には、まず、前述した本願発明における二項分布を用いた菌の異常集積検出によ
る出力として得られた警告スコアを、菌ごとに一定期間(例えば一ヶ月)ごとに集計する
。ここで、警告スコアは、菌の分離が、sporadicであるという帰無仮説に基づいて計算さ
れた確率を閾値で分類し、確率が低いものに高いスコアを与えて得られる。例えば、p<0
.001:3点、p<0.005:2点、p<0.01:1点。
さらに具体的には、例えば図19にも例示したように、まずプロットする期間を指定し
(ステップS191)、菌陽性患者数1の菌の扱いを指定する、つまり集計するしないを
指定する(ステップS192)。プロットする菌を指定し(ステップS193)、警告ス
コア表を用いて、指定期間、指定集計法、指定菌の警告スコアの月合計(警告スコア累積
)表を作成する(ステップS194)。集計日、菌、菌陽性患者数、検査対象患者数、お
よび警告スコアを含む警告スコア表は、予め感染症監視サーバーといったコンピュータシ
ステムに記憶されている(データベース等)。作成された警告スコア累積表はまたコンピ
ュータシステムに記憶される。
【0072】
そして、集計の結果つまり警告累積表データに基づき、たとえば図20に例示したよう
なグラフを作成する(ステップS195)。図20のグラフは、横軸が時間軸、縦軸が警
告スコアを表す。この図20に示したグラフは、セラチアマルセッセンスに関するシミュ
レーションの一例を示しており、6年間以上にわたって、ほぼ半年ごとに、セラチアマル
セッセンスの病院内での異常集積が発生していることが分かる。
ここで、この警告スコア累積のグラフから集積を繰り返す菌種を特定し、それらの菌の
疫学的特徴(たとえば良く分離される材料、感染経路など)を組み合わせることで、重点的
に行うべき感染対策を具体的にかつ自動的に示すことが可能になる。
まず、図21に例示したように、菌の異常集積の自動検出の警告(レベル)を月ごとに
合計したものを警告スコア累積とする。
次に、図20に例示したように、警告スコア累積をグラフ化する。これにより、長期間
の院内での細菌の拡散状況を俯瞰することができる。
そして、全ての分離菌について警告スコア累積を集計すると、院内拡散を繰り返してい
る菌を知ることができる。細菌は、菌毎に、どのような材料から良く分離されるかが異な
る。たとえば、大腸菌は、便、尿から多く分離され、ブドウ球菌は、皮膚や鼻腔から多く
分離される。院内拡散を繰り返している菌について、どのような材料から多く分離される
菌であるか、菌毎の検査材料別の分離頻度からその材料を知ると、拡散の原因となってい
る感染源を知ることができる。図22の集計例では、この施設では、近年、シトロバクタ
ー、腸球菌、エンテロバクターの院内拡散を繰り返しており、これらは、便から多く分離
される菌であることから、便の取り扱いが不良であることが予測される。そして、菌別、
検査材料別の分離頻度はその病院のデータ、あるいは、全国データから容易に求めること
ができるため、これから、共通の検査材料を感染源として自動的に判定することができる
。また、菌によっては、拡散経路がよく分かっているものもあり、そのようなものについ
ては、菌と主な感染経路を入力した知識データベースと結合することによって精度を上げ
ることも可能である。
これによれば、院内拡散を繰り返している菌種が多く分離される検査材料をその菌が院
内拡散をしている感染源としてその感染源に関する感染対策を強化することでそれらの菌
の院内拡散を防ぐことができ、それによって、院内感染事故(アウトブレーク)を未然に防
ぐことができるようになる。
すなわち、病院から分離される菌の解析によって、院内での拡散が繰り返されていて、
院内感染症の原因となる可能性が高い「課題菌」を解析し、その病院で強化すべき感染対
策を示すことができる。
細菌は、自ら移動することがほとんどできないため、感染の最初のステップとして、菌
が被感染者の侵入(定着)門戸に到達するためには、何らかの人為的な介在が必要となる
。
感染症の6要素のモデル(Jackson MM. General principles of epidemiology. ;APIC
infection control and applied epidemiology: principles of practice. St. Louis: M
osby, 1996;1:1-19)は、菌が感染源から排泄され、患者に侵入するまでのステップをわ
かりやすく分類したものである。感染源、排泄経路、感染経路、侵入経路、被感染者は、
病原体(菌)によって、異なり、たとえば、ある菌は、便に常在し、別の菌は、鼻腔に常在
し、また、常在しなくとも、病原性の違いにより、主に分離される材料が決まっている。
一方、病原体、感染源、排泄経路、感染経路、侵入経路、被感染者はそれぞれにある程度
関連を持っているが、たとえば、排泄経路がおなじ呼吸器であっても、感染経路が、飛沫
感染による場合と、さらに細かいエロゾルにより空気とともに移動するために、空気感染
と呼ばれる感染経路を取る場合、また、接触感染を取る場合もあるなど、それぞれのステ
ップが、ある程度独立している。
感染対策は、病原体、感染源、排泄経路、感染経路、侵入経路、被感染者のリンクに介
入して感染を防ぐことである。
したがって、最も重要な点は、病院内で院内拡散を繰り返している菌について、共通す
る因子を見つけることによって、どの要素の、どのような種類の因子が、感染対策の弱点
になっているかを明らかにすることである。
従って、院内拡散を繰り返している菌の検出法、上記因子の共通項を見つけ出すアルゴ
リズムは特に限定されないが、以下にその一例について説明する。なお、感染頻度などの
要素を6要素に加えて採用することが有用でもあると考えられる。
図23は、院内拡散を繰り返す菌のスコア化について説明するための図である。
<ステップS221>
まず、初期処理として、課題菌表を空にする。課題菌とは、警告スコア累積合計スコア
など院内拡散を繰り返している菌であり、課題菌表とはこれらを表としたもので、菌名(
菌コード)と警告スコア累積合計スコアなどより求める拡散の危険度を示す数値(危険ラ
ンク:危険度が高いものをより大きい数値とする)などを表としたものである。危険ラン
クの求め方については限定しない。課題菌表は予め感染症監視サーバーといったコンピュ
ータシステムに記憶されている(データベース等)。
<ステップS222>
警告スコア累積合計スコア表(図21参照)から、高スコア菌を選択し、課題菌表へ追
加する。高スコア菌とは、警告スコア累積合計スコアの数値が大きい菌を指す。たとえば
、上位から、10菌種を高スコア菌とする。あるいは、たとえば、月平均20以上の菌を高ス
コア菌とするなど、複数の方法で数値の大きい菌を選ぶことができる。
<ステップS223>
警告スコア累積合計スコア表(図21参照)から、スコア増加傾向菌を選択し、課題菌
表へ追加する。スコア増加傾向菌とは、警告スコア累積合計スコアの全体の合計では、高
スコア菌にならないが、たとえば、直近数ヶ月に限定してみるとスコアが高く、警告スコ
ア累積合計スコアが過去に比べて増加傾向のある菌を指す。
<ステップS224>
課題菌およびその感染因子(排泄経路、感染源、感染経路、侵入門戸、被感染者など)
の表を作成する。具体的には、上記のとおりに各菌が追加されて作成された課題菌表と、
予め記録されている菌・感染因子表とを組み合わせて作成される。菌・感染因子表として
は既知のものを用い、その中の菌群から該当する課題菌の感染因子を検索し、課題菌・感
染因子表に追加する。
<ステップS225>
作成された課題菌・感染因子表をデータベースから読み出し、コンピュータディスプレ
イ等に表示させる。
<ステップS226>
感染因子別および内容別得点(当該菌の数、または、当該菌の危険ランク合計)の表を
作成する。具体的な作成処理は、次の通りである。
(1)まず、感染因子(排泄経路、感染源、感染経路、侵入門戸、被感染者など)のそれ
ぞれの表の各欄を0点とする。
(2)最初にステップ224で得られた課題菌・感染因子表の最初の課題菌を処理の対象と
する。
(3)その最初の課題菌の各々について、各々の得点表のその菌のもつ性質の欄にその菌
の危険ランクを加える。たとえば、感染経路について接触感染をとるのであれば、感染経
路の得点表の接触感染にその菌の危険ランク(たとえば12)あるいは危険ランクを用いな
い集計では1を加え、さらに、侵入門戸が口であれば、侵入門戸の得点表の口の欄に同様
に危険ランク(を加えるどの表においても同じ値、先の例では12または1を加えることに
なる。)。
(4)次に2番目の課題菌について同様に処理し、順次、全ての課題菌が終わるまで処理
を行う。
<ステップS227>
感染因子別および内容別得点(当該菌の数、または、当該菌の危険ランク合計)の表を
降順に並べ替える。
<ステップS228>
感染因子別及び高得点要素をデータベースから読み出し、コンピュータディスプレイ等
に表示させる。ここで、得点、得点力カテゴリー別に色分けすることが好ましい。具体的
な表示処理は、次の通りである。
(1)まず、感染因子(排泄経路、感染源、感染経路、侵入門戸、被感染者など)の最初
の因子たとえば、排泄経路を処理の対象とする。
(2)得点表では尿、便、乳汁、血液、唾液、咳、痰、皮膚などの排泄経路毎に、得点が
求まっているので、得点の多い順(降順)に表を並び替える。順位の高いものに赤など目
立つ色を付け、表を表示する。
(3)次に、他の因子たとえば、感染源を処理の対象とし、同様の処理を行う。順次、全
ての課題菌が終わるまで処理を行う。
【0073】
以上により、例えば、数ヶ月から十数年の集積状況を把握することによって、(1)問
題の発見と対策立案、(2)対策の効果判定が可能になり、院内感染対策に有用である。
(3)全分離菌について数ヶ月から十数年の異常集積の状況を把握する事によって、異常
集積のみとめられた複数の菌種の主な感染様式から、対策の問題点を把握する事が可能と
なり、効率的な対策の立案が可能となり有用である。同様の集計は全国サーベイランスシ
ステムにおいても可能であり、同様の効果が得られる。
【0074】
[装置構成]
以上のとおりの本願発明における各処理は、図24に例示した全体構成を持つ装置によ
り実行することができる。図24の装置1は、バス15に処理部(CPU)10、記憶部
(内部メモリ、外部メモリ)11、入力部(キーボード、マウス)12、出力部(モニタ
、プリンタ)13及び通信制御部14が接続される構成である。この装置11は、通信制
御部14を介してネットワーク16に接続されている。ネットワーク16に接続された装
置1などの端末から他の端末等に格納された各処理に必要な各種データを入手することが
可能である。処理部10は、記憶部11に格納されたプログラムを読み出すことにより、
前述した各種処理を実行する。
【図面の簡単な説明】
【0075】
【図1】本願発明について説明するための菌異常集積検出のフローチャート。
【図2】菌陽性率算出処理のフローチャート。
【図3】重複排除処理のフローチャート。
【図4】菌陽性率の算出結果の一例。
【図5】菌分離確率算出処理のフローチャート。
【図6】本願発明について説明するためのantibiogram自動分類のフローチャート。
【図7】antibiogram自動分類のより具体的なフローチャート。
【図8】antibiogram自動分類フローにおける菌グループ化の一例について説明するための概念図。
【図9】本願発明によるantibiogram自動分類の一結果。
【図10】本願発明によるantibiogram自動分類の一結果。
【図11】antibiogram自動分類における前処理および後処理のフローチャート。
【図12】前処理によるグループ化した代表の一例。
【図13】分類結果の一例。
【図14】カラーコード化の一例。
【図15】本願発明について説明するための2次元carrierマップ作成のフローチャート。
【図16】本願発明による2次元carrierマップの一例。
【図17】本願発明について説明するPID法による感染対策指標評価のフローチャート。
【図18】P、I、D正値およびPID正値算出処理のフローチャート。
【図19】本発明について説明するための菌異常集積検出の警告スコア累積のグラフ化のフローチャート。
【図20】本願発明による菌異常集積検出の警告スコア累積のグラフの一例。
【図21】警告スコア累積の一例。
【図22】警告スコア累積グラフの別の一例。
【図23】本願発明による院内拡散を繰り返す菌のスコア化のフローチャート。
【図24】本願発明について説明するためのシステムブロック図。
【特許請求の範囲】
【請求項1】
菌の異常集積検出の対象とする場所毎に、既定の集計頻度で、既定の観察期間幅中の検
体提出患者および当該検出の対象とする全ての菌について、菌毎に、菌が陽性だった患者
数を集計し、
全ての菌について、集計した菌毎の陽性患者数と、検体提出患者数と、予め求めた菌毎
の陽性率であるベースラインレートによる二項分布を用いて、菌の偏りのない分離におい
て成立するベルヌーイ試行の確率を、菌の分離に偏りが無く且つ菌の分離が偶然のみに支
配されているという帰無仮説によって計算し、
計算された確率が既定値より小さい場合に、偶然のみに支配されている確率が小さく菌
の分離に偏りがあって異常な集積があったと判定する、
菌の異常集積検出方法であって、
前記ベースラインレートの算出を行う際に、同一患者の重複排除を月および人ののべ数
となるように行うことによって、前記ベースラインレートが前記二項分布の単回の独立試
行の確率となるようにする、
ことを特徴とする菌の異常集積検出方法。
【請求項2】
ベースラインレートに前記場所の菌の陽性率あるいは全国平均の陽性率をとる、請求項
1記載の菌の異常集積検出方法。
【請求項3】
前記集計を複数の既定の観察幅で連日あるいは既定の期間の頻度で行う、請求項1記載
の菌の異常集積検出方法。
【請求項4】
菌の異常集積検出の対象とする場所毎に、既定の集計頻度で、既定の観察期間幅中の検
体提出患者および当該検出の対象とする全ての菌について、菌毎に、菌が陽性だった患者
数を集計して予め求められた集計データと、
全ての菌について、集計した菌毎の陽性患者数と、検体提出患者数と、予め求めた菌毎
の陽性率とによる
二項分布を用いて、菌の偏りのない分離において成立するベルヌーイ試行の確率を、菌の
分離に偏りが無く且つ菌の分離が偶然のみに支配されているという帰無仮説によって計算
し、
計算された確率が既定値より小さい場合に、偶然のみに支配されている確率が小さく菌
の分離に偏りがあって異常な集積があったと判定する、
菌の異常集積検出装置であって、
前記ベースラインレートの算出を行う際に、同一患者の重複排除を月および人ののべ数
となるように行うことによって、前記ベースラインレートが前記二項分布の単回の独立試
行の確率となるようにする、
ことを特徴とする菌の異常集積検出装置。
【請求項5】
ベースラインレートに前記場所の菌の陽性率あるいは全国平均の陽性率をとる、請求項
4記載の菌の異常集積検出装置。
【請求項6】
前記集計を複数の既定の観察幅で連日あるいは既定の期間の頻度で行う、請求項4記載
の菌の異常集積検出装置。
【請求項7】
SIR判定を用いて菌の持つ薬剤耐性のパターンであるアンチバイオグラムを分類する
方法であって、
2つの菌の組み合わせのうちで、全ての抗菌薬剤に対して一つでもSとRの違いがある
組み合わせを不一致組み合わせと判定して、当該2つの菌同士で一致する薬剤の数を0点
とし、互いにSまたは互いにRである組み合わせを一致組み合わせと判定して、当該2つ
の菌同士で一致する薬剤の数N点を求め、
この一致不一致の判定をすべての菌の組み合わせに対して行い、
一致する薬剤の数N点が既定の閾値以上になる菌のグループを作る、
ことを特徴とするアンチバイオグラム分類方法。
【請求項8】
SIR判定を用いて菌の持つ薬剤耐性のパターンであるアンチバイオグラムを分類する
装置であって、
2つの菌の組み合わせのうちで、全ての抗菌薬剤に対して一つでもSとRの違いがある
組み合わせを不一致組み合わせと判定して、当該2つの菌同士で一致する薬剤の数を0点
とし、互いにSまたは互いにRである組み合わせを一致組み合わせと判定して、当該2つ
の菌同士で一致する薬剤の数N点を求める手段と、
この一致不一致の判定をすべての菌の組み合わせに対して行う手段と、
一致する薬剤の数N点が既定の閾値以上になる菌のグループを作る手段と、
を備えることを特徴とするアンチバイオグラム分類装置。
【請求項9】
請求項7記載のアンチバイオグラム分類方法によって分類された菌のグループに基づき
2次元キャリアマップを作成する方法であって、
前記菌のグループをカラーコード化し、
分離された患者、場所、時期の3つのパラメータに基づいて、2次元キャリアマップ上
の時間軸、空間軸に沿って各菌の分離データをプロットし、
同一患者の各プロット点を線で結ぶ、
ことを特徴とする2次元キャリアマップ作成方法。
【請求項10】
請求項8記載のアンチバイオグラム分類装置によって分類された菌のグループに基づき
2次元キャリアマップを作成する装置であって、
前記菌のグループをカラーコード手段と、
分離された患者、場所、時期の3つのパラメータに基づいて、2次元キャリアマップ上
の時間軸、空間軸に沿って各菌の分離データをプロットする手段と、
同一患者を線で結ぶ手段と、
を備えることを特徴とする2次元キャリアマップ作成装置。
【請求項11】
感染対策の指標となる数値の変動および偏りを評価する方法であって、
既定の観察期間単位ごとに、目標値との隔たりを示すP因子、時間軸において一つ前の
観察単位との差を示すD因子、過去の既定の期間の偏差の和を示すI因子を計算し、
これらP因子、D因子、I因子の和をPID値とし、PID値、またはPID値の絶対
値であるPID正値を、感染対策の成果が目標値に達するための努力の程度の指標として
用いる、
ことを特徴とする感染対策指標の評価方法。
【請求項12】
感染対策の指標が、菌の分離数、陽性患者数、感染症発症患者数、感染症症状陽性患者
数、炎症検査陽性患者数、感染症検査陽性患者数、および、それらの率のうちの少なくと
も一つである、請求項11記載の感染対策指標の評価方法。
【請求項13】
I因子の和を取る期間を過去の任意の期間あるいは既定の観察期間幅とする、請求項1
1記載の感染対策指標の評価方法。
【請求項14】
感染対策の指標となる数値の変動および偏りを評価する装置であって、
既定の観察期間単位ごとに、目標値との隔たりを示すP因子、時間軸において一つ前の
観察単位との差を示すD因子、過去の既定の期間の偏差の和を示すI因子を計算する手段
と、
これらP因子、D因子、I因子の和をPID値とし、PID値、またはPID値の絶対
値であるPID正値を、感染対策の成果が目標値に達するための努力の程度の指標として
用いる手段と、
を備えることを特徴とする感染対策指標の評価装置。
【請求項15】
感染対策の指標が、菌の分離数、陽性患者数、感染症発症患者数、感染症症状陽性患者
数、炎症検査陽性患者数、感染症検査陽性患者数、および、それらの率のうちの少なくと
も一つである、請求項14記載の感染対策指標の評価装置。
【請求項16】
I因子の和を取る期間を過去の任意の期間あるいは既定の観察期間幅とする、請求項1
4記載の感染対策指標の評価装置。
【請求項17】
請求項1記載の菌の異常集積検出方法の出力として得られる警告スコアを累積集計して
グラフ化する方法であって、
前記計算された菌の偏りのない分離を表すベルヌーイ試行の確率を閾値で分類し、確率
が閾値より低いものに高いスコアを与えて得られる警告スコアを、菌ごとに一定期間ごと
に集計し、集計結果を、横軸を時間軸、縦軸を警告スコアとしてグラフ化する、
ことを特徴とする菌異常集積検出の警告スコア累積のグラフ化方法。
【請求項18】
請求項4記載の菌の異常集積検出装置の出力として得られる警告スコアを累積集計して
グラフ化する装置であって、
前記計算された菌の偏りのない分離を表すベルヌーイ試行の確率を閾値で分類し、確率
が低いものに高いスコアを与えて得られる警告スコアを、菌ごとに一定期間ごとに集計す
る手段と、集計結果を、横軸を時間軸、縦軸を警告スコアとしてグラフ化する手段と、
を備えることを特徴とする菌異常集積検出の警告スコア累積のグラフ化装置。
【請求項1】
菌の異常集積検出の対象とする場所毎に、既定の集計頻度で、既定の観察期間幅中の検
体提出患者および当該検出の対象とする全ての菌について、菌毎に、菌が陽性だった患者
数を集計し、
全ての菌について、集計した菌毎の陽性患者数と、検体提出患者数と、予め求めた菌毎
の陽性率であるベースラインレートによる二項分布を用いて、菌の偏りのない分離におい
て成立するベルヌーイ試行の確率を、菌の分離に偏りが無く且つ菌の分離が偶然のみに支
配されているという帰無仮説によって計算し、
計算された確率が既定値より小さい場合に、偶然のみに支配されている確率が小さく菌
の分離に偏りがあって異常な集積があったと判定する、
菌の異常集積検出方法であって、
前記ベースラインレートの算出を行う際に、同一患者の重複排除を月および人ののべ数
となるように行うことによって、前記ベースラインレートが前記二項分布の単回の独立試
行の確率となるようにする、
ことを特徴とする菌の異常集積検出方法。
【請求項2】
ベースラインレートに前記場所の菌の陽性率あるいは全国平均の陽性率をとる、請求項
1記載の菌の異常集積検出方法。
【請求項3】
前記集計を複数の既定の観察幅で連日あるいは既定の期間の頻度で行う、請求項1記載
の菌の異常集積検出方法。
【請求項4】
菌の異常集積検出の対象とする場所毎に、既定の集計頻度で、既定の観察期間幅中の検
体提出患者および当該検出の対象とする全ての菌について、菌毎に、菌が陽性だった患者
数を集計して予め求められた集計データと、
全ての菌について、集計した菌毎の陽性患者数と、検体提出患者数と、予め求めた菌毎
の陽性率とによる
二項分布を用いて、菌の偏りのない分離において成立するベルヌーイ試行の確率を、菌の
分離に偏りが無く且つ菌の分離が偶然のみに支配されているという帰無仮説によって計算
し、
計算された確率が既定値より小さい場合に、偶然のみに支配されている確率が小さく菌
の分離に偏りがあって異常な集積があったと判定する、
菌の異常集積検出装置であって、
前記ベースラインレートの算出を行う際に、同一患者の重複排除を月および人ののべ数
となるように行うことによって、前記ベースラインレートが前記二項分布の単回の独立試
行の確率となるようにする、
ことを特徴とする菌の異常集積検出装置。
【請求項5】
ベースラインレートに前記場所の菌の陽性率あるいは全国平均の陽性率をとる、請求項
4記載の菌の異常集積検出装置。
【請求項6】
前記集計を複数の既定の観察幅で連日あるいは既定の期間の頻度で行う、請求項4記載
の菌の異常集積検出装置。
【請求項7】
SIR判定を用いて菌の持つ薬剤耐性のパターンであるアンチバイオグラムを分類する
方法であって、
2つの菌の組み合わせのうちで、全ての抗菌薬剤に対して一つでもSとRの違いがある
組み合わせを不一致組み合わせと判定して、当該2つの菌同士で一致する薬剤の数を0点
とし、互いにSまたは互いにRである組み合わせを一致組み合わせと判定して、当該2つ
の菌同士で一致する薬剤の数N点を求め、
この一致不一致の判定をすべての菌の組み合わせに対して行い、
一致する薬剤の数N点が既定の閾値以上になる菌のグループを作る、
ことを特徴とするアンチバイオグラム分類方法。
【請求項8】
SIR判定を用いて菌の持つ薬剤耐性のパターンであるアンチバイオグラムを分類する
装置であって、
2つの菌の組み合わせのうちで、全ての抗菌薬剤に対して一つでもSとRの違いがある
組み合わせを不一致組み合わせと判定して、当該2つの菌同士で一致する薬剤の数を0点
とし、互いにSまたは互いにRである組み合わせを一致組み合わせと判定して、当該2つ
の菌同士で一致する薬剤の数N点を求める手段と、
この一致不一致の判定をすべての菌の組み合わせに対して行う手段と、
一致する薬剤の数N点が既定の閾値以上になる菌のグループを作る手段と、
を備えることを特徴とするアンチバイオグラム分類装置。
【請求項9】
請求項7記載のアンチバイオグラム分類方法によって分類された菌のグループに基づき
2次元キャリアマップを作成する方法であって、
前記菌のグループをカラーコード化し、
分離された患者、場所、時期の3つのパラメータに基づいて、2次元キャリアマップ上
の時間軸、空間軸に沿って各菌の分離データをプロットし、
同一患者の各プロット点を線で結ぶ、
ことを特徴とする2次元キャリアマップ作成方法。
【請求項10】
請求項8記載のアンチバイオグラム分類装置によって分類された菌のグループに基づき
2次元キャリアマップを作成する装置であって、
前記菌のグループをカラーコード手段と、
分離された患者、場所、時期の3つのパラメータに基づいて、2次元キャリアマップ上
の時間軸、空間軸に沿って各菌の分離データをプロットする手段と、
同一患者を線で結ぶ手段と、
を備えることを特徴とする2次元キャリアマップ作成装置。
【請求項11】
感染対策の指標となる数値の変動および偏りを評価する方法であって、
既定の観察期間単位ごとに、目標値との隔たりを示すP因子、時間軸において一つ前の
観察単位との差を示すD因子、過去の既定の期間の偏差の和を示すI因子を計算し、
これらP因子、D因子、I因子の和をPID値とし、PID値、またはPID値の絶対
値であるPID正値を、感染対策の成果が目標値に達するための努力の程度の指標として
用いる、
ことを特徴とする感染対策指標の評価方法。
【請求項12】
感染対策の指標が、菌の分離数、陽性患者数、感染症発症患者数、感染症症状陽性患者
数、炎症検査陽性患者数、感染症検査陽性患者数、および、それらの率のうちの少なくと
も一つである、請求項11記載の感染対策指標の評価方法。
【請求項13】
I因子の和を取る期間を過去の任意の期間あるいは既定の観察期間幅とする、請求項1
1記載の感染対策指標の評価方法。
【請求項14】
感染対策の指標となる数値の変動および偏りを評価する装置であって、
既定の観察期間単位ごとに、目標値との隔たりを示すP因子、時間軸において一つ前の
観察単位との差を示すD因子、過去の既定の期間の偏差の和を示すI因子を計算する手段
と、
これらP因子、D因子、I因子の和をPID値とし、PID値、またはPID値の絶対
値であるPID正値を、感染対策の成果が目標値に達するための努力の程度の指標として
用いる手段と、
を備えることを特徴とする感染対策指標の評価装置。
【請求項15】
感染対策の指標が、菌の分離数、陽性患者数、感染症発症患者数、感染症症状陽性患者
数、炎症検査陽性患者数、感染症検査陽性患者数、および、それらの率のうちの少なくと
も一つである、請求項14記載の感染対策指標の評価装置。
【請求項16】
I因子の和を取る期間を過去の任意の期間あるいは既定の観察期間幅とする、請求項1
4記載の感染対策指標の評価装置。
【請求項17】
請求項1記載の菌の異常集積検出方法の出力として得られる警告スコアを累積集計して
グラフ化する方法であって、
前記計算された菌の偏りのない分離を表すベルヌーイ試行の確率を閾値で分類し、確率
が閾値より低いものに高いスコアを与えて得られる警告スコアを、菌ごとに一定期間ごと
に集計し、集計結果を、横軸を時間軸、縦軸を警告スコアとしてグラフ化する、
ことを特徴とする菌異常集積検出の警告スコア累積のグラフ化方法。
【請求項18】
請求項4記載の菌の異常集積検出装置の出力として得られる警告スコアを累積集計して
グラフ化する装置であって、
前記計算された菌の偏りのない分離を表すベルヌーイ試行の確率を閾値で分類し、確率
が低いものに高いスコアを与えて得られる警告スコアを、菌ごとに一定期間ごとに集計す
る手段と、集計結果を、横軸を時間軸、縦軸を警告スコアとしてグラフ化する手段と、
を備えることを特徴とする菌異常集積検出の警告スコア累積のグラフ化装置。
【図1】


【図2】


【図3】


【図5】


【図6】


【図7】


【図8】


【図13】


【図15】


【図17】


【図24】


【図4】


【図9】


【図10】


【図11】


【図12】


【図14】


【図16】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】




【図2】


【図3】


【図5】


【図6】


【図7】


【図8】


【図13】


【図15】


【図17】


【図24】


【図4】


【図9】


【図10】


【図11】


【図12】


【図14】


【図16】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【公開番号】特開2013−101675(P2013−101675A)
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願番号】特願2013−11915(P2013−11915)
【出願日】平成25年1月25日(2013.1.25)
【分割の表示】特願2008−161030(P2008−161030)の分割
【原出願日】平成20年6月19日(2008.6.19)
【出願人】(504145364)国立大学法人群馬大学 (352)
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願日】平成25年1月25日(2013.1.25)
【分割の表示】特願2008−161030(P2008−161030)の分割
【原出願日】平成20年6月19日(2008.6.19)
【出願人】(504145364)国立大学法人群馬大学 (352)
[ Back to top ]

