アンドロゲン受容体のN末端の活性化の小分子阻害剤
式(A)の構造を有する化合物が提供される。前立腺癌を含めた種々の適応症の治療のためのかかる化合物の使用、およびかかる化合物を必要とする治療方法が提供される。前立腺癌を含めた種々の適応症の治療のための式(F)の構造を有する化合物の使用、およびかかる化合物を必要とする治療方法もまた提供される。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願の相互参照)
本願は、2008年8月22日に出願された「アンドロゲン受容体のN末端の活性化の小分子阻害剤(SMALL MOLECULE INHIBITORS OF N-TERMINUS ACTIVATION OF THE ANDROGEN RECEPTOR)」というタイトルの米国仮特許出願番号第61/136,277号の利益を主張し、その出願はその全体が参照によって本明細書に援用される。
【0002】
(連邦政府による資金提供を受けた研究の記載)
本発明は、米国陸軍医療研究・資材司令部(U.S. Army Medical Research and Materiel Command)によって与えられた認可番号W81XWH-05-1-0058 (PC040768)のもとで、一部政府支援によりなされたものである。米国政府は、本発明において一定の権利を有し得る。
【0003】
(技術分野)
本発明は、治療剤(therapeutics)、その使用、および種々の癌を含めた種々の適応症の治療方法に関する。具体的には、本発明は、すべての病期、ならびにアンドロゲン依存性、アンドロゲン感受性、およびアンドロゲン非依存性(ホルモン抵抗性、去勢抵抗性、アンドロゲン遮断抵抗性、アンドロゲン除去抵抗性、アンドロゲン枯渇非依存性、去勢/再発性(castration-recurrent)、および抗アンドロゲン薬/再発性(anti-androgen-recurrent)ともいう)を含めた、前立腺癌などの癌の治療および治療方法に関する。
【背景技術】
【0004】
(背景)
アンドロゲンは、アンドロゲン受容体(androgen receptor)(AR)を介してその効果をもたらす。アンドロゲンは、広範囲の発育反応および生理学的反応における役割を果たし、男性性分化、精子形成の維持、および男性のゴナドトロピン調節にかかわっている。数系統の証拠が、アンドロゲンが前立腺の発癌の発達と関連していることを示している。まず第一に、アンドロゲンは、げっ歯類モデルにおいて前立腺の発癌を誘発しており、アナボリックステロイドの形態でアンドロゲンを受けた男性は、前立腺癌の発生率が高い。第二に、ヒトまたはイヌが思春期の前に去勢された場合、前立腺癌は発症しない。成人男性を去勢することは、前立腺の退縮および前立腺上皮のアポトーシスをもたらすが、他の男性外性器に対する影響を誘発しない。このアンドロゲンへの依存性は、化学的去勢または去勢手術(アンドロゲン除去)により前立腺癌を治療する、根底にある理論的根拠を提供する。
【0005】
アンドロゲンはまた、女性の癌における役割も果たしている。1つの例は卵巣癌であり、該癌ではアンドロゲンの濃度の上昇が、卵巣癌を発症する危険性の増大と関連している。ARが大多数の卵巣癌で検出されているのに対して、エストロゲン受容体α(Estrogen receptor-alpha)(ERa)およびプロゲステロン受容体は、50%未満の卵巣腫瘍でしか検出されていない。
【0006】
進行性前立腺癌に利用できる唯一の効果的な治療法は、アンドロゲンの除去であり、アンドロゲンは前立腺上皮細胞の生存に不可欠である。アンドロゲン除去療法は、血清前立腺特異抗原(prostate-specific antigen)(PSA)の減少に付随する全身腫瘍組織量の一時的な減少をもたらす。残念ながら前立腺癌は、結局はアンドロゲンの非存在下で再び増殖し得る(アンドロゲン非依存性疾患)。アンドロゲン非依存性疾患は、症状が始まる前に血清前立腺特異抗原(PSA)の力価が増大することを生化学的な特徴とする。該疾患がアンドロゲン非依存性となると、大抵の患者は2年以内に屈する。
【0007】
ARは、カルボキシ末端のリガンド結合領域(ligand-binding domain)(LBD)、2個の亜鉛フィンガーモチーフを含むDNA結合領域(DNA-binding domain)(DBD)、および1個以上の転写活性化領域を含むN末端領域(N-terminus domain)(NTD)を含めた別個の機能領域を有する。ARのLBDにアンドロゲン(リガンド)が結合すると、該受容体が、「通常は」アンドロゲンにより制御される遺伝子(PSAなど)のプロモーター領域およびエンハンサー領域の、アンドロゲン応答エレメント(androgen response element)(ARE)と呼ばれるその特異的なDNAのコンセンサス部位に効率的に結合し得、転写を起こすように、ARが活性化する。ARは、cAMP依存性プロテインキナーゼ(protein kinase)(PKA)経路の刺激作用、インターロイキン6(IL-6)、および種々の成長因子によって、アンドロゲンの非存在下で活性化され得る。ARのリガンド非依存性変態の機構は、1)細胞核の転位を示唆する細胞核のARタンパク質の増大;2)AR/ARE複合体形成の増大;および3)該NTD、を含むことが示されている(Sadar 1999 J. Biol. Chem. 274, 7777〜7783;Uedaら 2002 A J. Biol. Chem. 277, 7076〜7085;およびUedaら 2002 B J. Biol. Chem. 277, 38087〜38094)。ARは、アンドロゲン非依存性疾患において、別のシグナル伝達経路によって、精巣アンドロゲンの非存在下で活性化され得、このことは二次前立腺癌の腫瘍に細胞核のARタンパク質が存在しているという知見(Kimら 2002 Am. J. Pathol. 160, 219〜226;およびvan der Kwastら 1991 Inter. J. Cancer 48, 189〜193)と整合している。
【発明の概要】
【発明が解決しようとする課題】
【0008】
入手可能なAR阻害剤としては、ビカルタミド(カソデックス(Casodex)(登録商標))、ニルタミド、およびフルタミドなどの非ステロイド性抗アンドロゲン剤、ならびにステロイド性抗アンドロゲン剤のシプロテロンアセタートが挙げられる。これらの抗アンドロゲン剤は、ARのLBDを標的とし、おそらく不十分な親和性、およびこうした前述の抗アンドロゲン剤による、ARの活性化を引き起こす変異のために、大部分は機能していない(Taplin, M.E.ら Cancer Res., 59, 2511〜2515 (1999))。
【0009】
従来の治療法は、ARをそのC末端領域を通じてアンドロゲン依存的に活性化することに焦点を合わせている。ARに対するアンタゴニストを開発する最近の研究は、C末端に焦点を合わせており、具体的には、1)アロステリックポケットおよびAF-2活性(Estebanez-Perpinaら 2007, PNAS 104, 16074〜16079);2)非ステロイド性アンタゴニストの同定のためのコンピュータによる「薬物の目的再評価(repurposing)」手順(Bissonら 2007, PNAS 104, 11927〜11932);ならびにコアクチベーターまたはコリプレッサーの相互作用(Changら 2005, Mol Endocrinology 19, 2478〜2490;Hurら 2004, PLoS Biol 2, E274;Estebanez-Perpinaら 2005, JBC 280, 8060〜8068;Heら 2004, Mol Cell 16, 425〜438)に焦点を合わせている。
【0010】
NTDがアンドロゲンの非存在下でARの活性化における役割を果たしているため(Sadar, M.D. 1999 J. Biol. Chem. 274, 7777〜7783;Sadar MDら 1999 Endocr Relat Cancer. 6, 487〜502;Uedaら 2002 J. Biol. Chem. 277, 7076〜7085;Ueda 2002 J. Biol. Chem. 277, 38087〜38094;Blaszczykら 2004 Clin Cancer Res. 10, 1860〜9;Dehmら 2006 J Biol Chem. 28, 27882〜93;Gregoryら 2004 J Biol Chem. 279, 7119〜30)、ARのNTDはまた、薬物開発の標的でもある(例えばWO 2000/001813)。ARのNTDは、デコイ分子の適用(Quayleら 2007, Proc Natl Acad Sci U S A. 104, 1331〜1336)によって示されるように、前立腺癌のホルモンによる進行に重要である。
【0011】
ARのカルボキシ末端領域については結晶構造が解明されているが、NTDについては、その柔軟性の高さ、および溶液中での固有の無秩序さ(Reidら 2002 J. Biol. Chem. 277, 20079〜20086)のために解明されておらず、それにより実際の結合する薬物を発見するアプローチを妨げている。
【課題を解決するための手段】
【0012】
(概要)
本発明は、一部、本明細書中に記載した化合物がアンドロゲン受容体(AR)の活性を調節するという偶然の発見に基づく。具体的には、本明細書中で特定した化合物は、ARのN末端領域(NTD)のトランス活性化の阻害を示し、このことは、アンドロゲンの存在下および非存在下で、インビボの腫瘍増殖を阻止するのに有用であり得る。
【0013】
本明細書中に記載した化合物は、オーファン受容体および核内受容体(アンドロゲン受容体などのステロイド受容体を含む)の機構を調べるための、インビボまたはインビトロの研究用途(すなわち非臨床的なもの)に使用することができる。さらに、こうした化合物は、組換えタンパク質、培養液中で保持された細胞、および/または動物モデルを用いて、シグナル伝達経路ならびに/またはオーファン受容体および核内受容体の活性化を調べるための、インビボまたはインビトロの研究のために、個々にまたはキットの一部として、使用することができる。あるいは、本明細書中に記載した化合物は、市販用の包装および/または使用説明書と一体化させることができる。
【0014】
本発明はまた、一部、本明細書中に記載した化合物は、研究用途および治療用途のいずれについても、インビボまたはインビトロのいずれかで、アンドロゲン受容体の活性を調節するために使用することもできるという驚くべき発見にも基づく。該化合物は、アンドロゲン受容体の活性が調節され得るように、有効量で使用することができる。アンドロゲン受容体は、哺乳動物のものであってもよい。アンドロゲン受容体は、ヒトのものであってもよい。とりわけ該化合物は、ARのN末端領域(NTD)のトランス活性化を阻害するために使用することができる。該化合物の調節作用は、以下の適応症:前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患(polycystic ovary disease)、思春期早発症、および加齢性黄斑変性症の少なくとも1つの研究のためのインビボモデルまたはインビトロモデルのいずれかに使用することができる。さらに、該化合物の調節作用は、以下の適応症:前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症(精巣中毒症(testoxicosis))、および加齢性黄斑変性症の少なくとも1つの治療に使用することができる。治療する適応症は、前立腺癌であってもよい。該前立腺癌は、アンドロゲン非依存性前立腺癌であってもよい。該前立腺癌は、アンドロゲン依存性前立腺癌であってもよい。
【0015】
1つの実施態様によれば、式A:
【0016】
【化1】

【0017】
[式中、
Xは、CまたはNとすることができ;Yは、OまたはSとすることができ;
R1は、H、OH、J、OJ、SJ、またはNJJ’とすることができ、式中JまたはJ’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族もしくは部分的に芳香族の環式の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、COOR、CONH2、CONHR、CONR2、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R2は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、COOR、CONH2、CONHR、CONR2、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R3は、H、OH、OG、SG、NGG’、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、もしくは芳香族もしくは部分的に芳香族の環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、式中GおよびG’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族もしくは部分的に芳香族の環式の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、COOR、CONH2、CONHR、CONR2、R、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができ、式中Rは、非置換C1〜C10アルキルとすることができ;
R4およびR6は独立して、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、芳香族もしくは部分的に芳香族の環式、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基からなる群から選択することができ、その任意の置換基は、オキソ、COOH、OH、OR、R、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、非置換C1〜C10アルキルとすることができ(ただし、R4およびR6が共にHであることはなく、かつR4およびR6はいずれも
【0018】
【化2】

【0019】
ではない);
R5は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、CONH2、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;
【0020】
【化3】

【0021】
は単結合または二重結合とすることができる]
の構造を有する化合物(ただし、該化合物は、
【0022】
【化4】

【0023】
ではない)、またはその塩が提供される。
【0024】
さらなる実施態様によれば、式A:
【0025】
【化5】

【0026】
[式中、
Xは、CまたはNとすることができ;Yは、OまたはSとすることができ;
R1は、H、OH、J、またはOJとすることができ、式中Jは、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R2は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R3は、H、OH、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができ;
R4およびR6は独立して、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基からなる群から選択され、その任意の置換基は、オキソ、COOH、OH、F、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができ、アルキル基の炭素は任意にOで置換することができ[ただし、R4およびR6は共にHであることはなく、かつR4およびR6はいずれもt-Boc、FmocおよびCbz(本明細書中に記載した)ではない];
R5は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;
【0027】
【化6】

【0028】
は単結合または二重結合とすることができる]
の構造を有する化合物(ただし、該化合物は、
【0029】
【化7】

【0030】
ではない)、またはその塩が提供される。
【0031】
さらなる実施態様によれば、式A:
【0032】
【化8】

【0033】
[式中、
Xは、CまたはNとすることができ;Yは、OまたはSとすることができ;
R1は、H、OH、J、またはOJとすることができ、式中Jは、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R2は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R3は、H、OH、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができ;
R4およびR6は独立して、HまたはCOOCH2CH3からなる群から選択され(ただし、R4およびR6が共にHであることはない);
R5は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;
【0034】
【化9】

【0035】
は単結合または二重結合とすることができる]
の構造を有する化合物、またはその塩が提供される。
【0036】
さらなる実施態様によれば、式B:
【0037】
【化10】

【0038】
[式中、
Xは、CまたはNとすることができ;Yは、OまたはSとすることができ;
R1は、H、OH、J、OJ、SJ、またはNJJ’とすることができ、式中JまたはJ’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、OR、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができ;
R2は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R3は、H、OH、OG、SG、NGG’、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、式中GおよびG’は、炭素数1〜10の、直鎖状、分枝状、または非芳香族環式の、飽和または不飽和のアルキル基であり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができ;
R4は、H、または炭素数1〜10の、直鎖状、分枝状、芳香族環式、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、OR、R、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは非置換C1〜C10アルキルとすることができ[ただし、R4は、t-Boc、FmocおよびCbz(本明細書中に記載した)ではない];
R5は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;
Zは、任意に置換されたBu、Pr、Et、またはMeとすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;
【0039】
【化11】

【0040】
は単結合または二重結合とすることができる]
の構造を有する化合物(ただし、該化合物は、
【0041】
【化12】

【0042】
ではない)またはその塩が提供される。
【0043】
R3は、H、OH、OG、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であってもよく、式中Gは、炭素数1〜10の、直鎖状または分枝状の、飽和または不飽和のアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができる。あるいはR3は、H、OH、OBu、OPr、OEt、またはOMeであってもよい。あるいはR3はHであってもよい。
【0044】
R1は、H、OH、J、またはOJであってもよく、式中Jは、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、およびNO2のうちの1個以上から選択することができる。あるいはR1は、H、OH、J、またはOJであってもよく、式中Jは、炭素数1〜4の、直鎖状または分枝状の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択することができる。R1はまた、H、OH、OBu、OPr、OEt、OMe、Bu、Pr、Et、またはMeであってもよい。あるいはR1は、H、OH、J、またはOJであってもよく、式中Jは、炭素数1〜4の、直鎖状または分枝状の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択することができる。R1はまた、H、OH、OBu、OPr、OEt、またはOMeであってもよい。R1はOMeであってもよい。
【0045】
【化13】

【0046】
は二重結合であってもよい。
【0047】
R2は、H、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であってもよく、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、およびNO2のうちの1個以上から選択することができる。あるいはR2は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択することができる。あるいはR2は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、1個以上のハロゲンとすることができる。あるいはR2は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、1個以上のCl部分(moieties)とすることができる。
【0048】
R4は、H、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であってもよく、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SH、SO3H、およびNO2のうちの1個以上から選択することができる。あるいはR4は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択することができる。あるいはR4は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、1個以上のハロゲンから選択することができる。あるいはR4は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、1個以上のハロゲンとすることができる。あるいはR4は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、1個以上のCl部分とすることができる。
【0049】
R5は、H、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であってもよく、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができる。あるいはR5は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択することができる。あるいはR5は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、1個以上のハロゲンとすることができる。あるいはR5は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、1個以上のCl部分とすることができる。
【0050】
XはNであってもよい。YはOであってもよい。
【0051】
Zは、任意に置換されたBu、Pr、Et、またはMeであってもよく、その任意の置換基は、オキソ、OH、F、Cl、Br、およびIのうちの1個以上から選択することができる。あるいはZは、任意に置換されたBu、Pr、Et、またはMeであってもよく、その任意の置換基は、F、Cl、Br、およびIのうちの1個以上から選択することができる。
【0052】
さらなる実施態様によれば、式C:
【0053】
【化14】

【0054】
[式中、
Aは、Bu、Pr、Et、またはMeとすることができ;Mは、H、OH、OBu、OPr、OEt、OMe、Bu、Pr、Et、またはMeとすることができ;
Tは、
【0055】
【化15】

【0056】
とすることができ;
Eは、Bu、Pr、Et、またはMeとすることができ;
Qは、
【0057】
【化16】

【0058】
とすることができ;
Lは、Bu、Pr、Et、またはMeとすることができ;R8は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeとすることができ;R9は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeとすることができ;ここで、A、T、E、Q、およびLは、任意に置換されており、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができる]
の構造を有する化合物またはその塩が提供される。
【0059】
さらなる実施態様によれば、式D:
【0060】
【化17】

【0061】
[式中、Aは、Bu、Pr、Et、またはMeとすることができ;Dは、Bu、Pr、Et、またはMeとすることができ;Eは、Bu、Pr、Et、またはMeとすることができ;Lは、Bu、Pr、Et、またはMeとすることができ;R8は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeとすることができ;R9は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeとすることができる]
の構造を有する化合物またはその塩が提供される。
【0062】
さらなる実施態様によれば、式E:
【0063】
【化18】

【0064】
[式中、R8は、Cl3C、Cl2HC、ClH2C、Et、またはMeとすることができ;R9は、Cl3C、Cl2HC、ClH2C、Et、またはMeとすることができる]
の構造を有する化合物またはその塩が提供される。
【0065】
さらなる実施態様によれば、下記:
【0066】
【化19】

【0067】
の1つ以上から選択される、化合物またはその塩が提供される。
【0068】
さらなる実施態様によれば、下記:
【0069】
【化20】

【0070】
の1つ以上から選択される、化合物またはその塩が提供される。
【0071】
さらなる実施態様によれば、式A:
【0072】
【化21】

【0073】
[式中、
Xは、CまたはNとすることができ;Yは、OまたはSとすることができ;
R1は、H、OH、J、OJ、SJ、またはNJJ’とすることができ、式中JまたはJ’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R2は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R3は、H、OH、OG、SG、NGG’、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、式中GおよびG’は、炭素数1〜10の、直鎖状、分枝状、または非芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができ;
R4およびR6は独立して、H、または炭素数1〜10の、直鎖状、分枝状、芳香族環式、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基からなる群から選択され、その任意の置換基は、オキソ、COOH、OH、OR、R、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R5は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;
【0074】
【化22】

【0075】
は単結合または二重結合とすることができる]
の構造を有する化合物またはその塩を哺乳動物細胞に投与することを含む、ARの活性の調節方法が提供される。
【0076】
あるいは、本明細書中に記載した方法/使用で用いる化合物は、本明細書中に記載した式A〜Eのいずれか1つの構造を有していてもよい。
【0077】
さらなる実施態様によれば、アンドロゲン受容体(AR)の活性を調節するための本明細書中に示した化合物の使用が提供される。あるいは、該使用は、アンドロゲン受容体(AR)を調節するための医薬の製造のためのものとすることができる。あるいは、該使用は、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患(polycystic ovary disease)、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症の治療のためのもの、または該適応症の治療用の医薬の製造のためのものとすることができる。該適応症は、前立腺癌であってもよい。該前立腺癌は、アンドロゲン非依存性前立腺癌であってもよい。該前立腺癌は、アンドロゲン依存性前立腺癌であってもよい。
【0078】
別の実施態様によれば、上に示した式A、B、C、D、Eのいずれか1つの構造を有する化合物、または上に示した化合物のいずれか、および薬学的に許容される賦形剤を含む医薬組成物が提供される。
【0079】
別の実施態様によれば、いずれか1種の上記化合物に従った化合物、および薬学的に許容される賦形剤を含む、医薬組成物が提供される。
【0080】
さらなる実施態様によれば、スクリーニングされる化合物が本明細書中に記載した化合物から選択される、アンドロゲン受容体を調節する化合物のスクリーニング方法が提供される。
【0081】
さらなる実施態様によれば、アンドロゲン受容体(AR)の活性を調節するための、1種以上の本明細書中に記載した化合物が提供される。
【0082】
本明細書中に記載した化合物は、すべてのラセミ混合物、およびすべての個々の鏡像異性体、またはこれらの組み合わせが本明細書中に示されているか否かにかかわらず、それらを含むことが意図されている。任意の置換基は、ハロゲンであってもよい。R2、R4、R5、およびR6は、任意の天然に存在するアミノ酸、またはその置換された変異体の側鎖であってもよい。あるいはR2は、プロリンのものでも、フェニルアラニンのものでもない。あるいはR4およびR6は、プロリンのものでも、フェニルアラニンのものでもない。あるいはR5は、プロリンのものではない。アミノ酸側鎖は、脂肪族側鎖のバリン、ロイシン、イソロイシン、またはモノハロゲン化メチル型、ジハロゲン化メチル型、もしくはトリハロゲン化メチル型のバリン、ロイシン、もしくはイソロイシンの側鎖から選択してもよい。アミノ酸側鎖は、疎水性側鎖のアラニン、バリン、ロイシン、イソロイシン、トリプトファン、メチオニン、システイン、およびグリシンから選択してもよい。あるいはアミノ酸側鎖は、親水性側鎖のアスパラギン、グルタミン、セリン、トレオニン、およびチロシンから選択してもよい。あるいはアミノ酸側鎖は、塩基性側鎖のリシン、アルギニン、およびヒスチジンから選択してもよい。あるいはアミノ酸側鎖は、塩基性側鎖のアスパラギン酸、およびグルタミン酸から選択してもよい。あるいはアミノ酸側鎖は、本明細書中に記載した側鎖のいずれか、またはそれらのモノハロゲン化型、ジハロゲン化型、もしくはトリハロゲン化型から選択してもよい。ハロゲンは、F、Cl、Br、またはIであってもよい。あるいはR1、R2、R3、R4、R5、およびR6は、炭素数1〜10の、置換または非置換のアシル、例えばアセチル、プロピオニル、ブタノイル、またはペンタノイルなどであってもよい。
【0083】
哺乳動物細胞は、ヒト細胞であってもよい。ARの活性の調節は、ARのN末端領域の活性を阻害するためのものであってもよい。ARの活性の調節は、ARのN末端領域(NTD)の活性を阻害するためのものであってもよい。該調節は、インビボのものであってもよい。ARの活性の調節は、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症の治療のためのものであってもよい。該適応症は前立腺癌であってもよい。該前立腺癌は、アンドロゲン非依存性前立腺癌であってもよい。該前立腺癌は、アンドロゲン依存性前立腺癌であってもよい。
【0084】
さらなる実施態様によれば、式(K):
【0085】
【化23】

【0086】
[式中、
R25は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、COOR’、CONH2、CONHR’、CONR’2、R’、OH、OR’、F、Cl、Br、I、NH2、NHR’、NR’2、CN、SH、SR’、SO3H、SO3R’、SO2R’、OSO3R’、およびNO2のうちの1個以上から選択することができ、式中R’は、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R26は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、CONH2、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;
R27は、任意に置換されたBu、Pr、Et、またはMeとすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができる]
の化合物の製造方法が提供される。
【0087】
別の実施態様によれば、アンドロゲン受容体(AR)の活性を調節するための式(F):
【0088】
【化24】

【0089】
[式中、
R10は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R14、OH、OR14、F、Cl、Br、I、NH2、NHR14、NR142、CN、SH、SR14、SO3H、SO3R14、SO2R14、OSO3R14、およびNO2のうちの1個以上から選択することができ、式中R14は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基とすることができ;
R11は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R15、OH、OR15、F、Cl、Br、I、NH2、NHR15、NR152、CN、SH、SR15、SO3H、SO3R15、SO2R15、OSO3R15、およびNO2のうちの1個以上から選択することができ、式中R15は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基とすることができ;
R12は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R16、OH、OR16、F、Cl、Br、I、NH2、NHR16、NR162、CN、SH、SR16、SO3H、SO3R16、SO2R16、OSO3R16、およびNO2のうちの1個以上から選択することができ、式中R16は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基とすることができ;
R13は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R17、OH、OR17、F、Cl、Br、I、NH2、NHR17、NR172、CN、SH、SR17、SO3H、SO3R17、SO2R17、OSO3R17、およびNO2のうちの1個以上から選択することができ、式中R17は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基とすることができる]
の化合物またはその薬学的に許容される塩の使用が提供される。
【0090】
1つの実施態様において、R10は、例えば、限定されないが、H、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシとすることができ、ここでC1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシはそれぞれ、置換されていないか、または1個以上の置換基で置換されており、該置換基はそれぞれ独立して、オキソ、COOH、R14、OH、OR14、F、Cl、Br、I、NH2、NHR14、NR142、CN、SH、SR14、SO3H、SO3R14、SO2R14、OSO3R14、またはNO2とすることができ、式中R14は、例えば、限定されないが、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、または独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基とすることができ;
R11は、例えば、限定されないが、H、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシとすることができ、ここでC1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシはそれぞれ、置換されていないか、または1個以上の置換基で置換されており、該置換基はそれぞれ独立して、オキソ、COOH、R15、OH、OR15、F、Cl、Br、I、NH2、NHR15、NR152、CN、SH、SR15、SO3H、SO3R15、SO2R15、OSO3R15、またはNO2とすることができ、式中R15は、例えば、限定されないが、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、または独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基とすることができ;
R12は、例えば、限定されないが、H、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシとすることができ、ここでC1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシはそれぞれ、置換されていないか、または1個以上の置換基で置換されており、該置換基はそれぞれ独立して、オキソ、COOH、R16、OH、OR16、F、Cl、Br、I、NH2、NHR16、NR162、CN、SH、SR16、SO3H、SO3R16、SO2R16、OSO3R16、またはNO2とすることができ、式中R16は、例えば、限定されないが、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、または独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基とすることができ;
R13は、例えば、限定されないが、H、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシとすることができ、ここでC1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシはそれぞれ、置換されていないか、または1個以上の置換基で置換されており、該置換基はそれぞれ独立して、オキソ、COOH、R17、OH、OR17、F、Cl、Br、I、NH2、NHR17、NR172、CN、SH、SR17、SO3H、SO3R17、SO2R17、OSO3R17、またはNO2とすることができ、式中R17は、例えば、限定されないが、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、または独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基とすることができる。
【0091】
1つの実施態様において、R10は、例えば、限定されないが、Hまたは非置換C1〜10アルキルとすることができる。別の実施態様において、R10は、例えば、限定されないが、Meとすることができる。
【0092】
1つの実施態様において、R11は、例えば、限定されないが、Hまたは非置換C1〜10アルキルとすることができる。別の実施態様において、R11は、例えば、限定されないが、Meとすることができる。
【0093】
別の実施態様において、R12は、例えば、限定されないが、H、C1〜10アルキル、またはC2〜10アルケニルとすることができ、ここでC1〜10アルキルまたはC2〜10アルケニルはそれぞれ、置換されていないか、または1個以上の置換基で置換されており、該置換基はそれぞれ独立して、オキソ、COOH、R16、OH、OR16、F、Cl、Br、I、NH2、NHR16、NR162、CN、SH、SR16、SO3H、SO3R16、SO2R16、OSO3R16、またはNO2とすることができ、式中R16は、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、または独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基とすることができる。別の実施態様において、R12は、任意の天然に存在するアミノ酸の側鎖、またはその置換された変異体とすることができる。アミノ酸側鎖は、脂肪族側鎖のバリン、ロイシン、イソロイシン、またはモノハロゲン化メチル型、ジハロゲン化メチル型、もしくはトリハロゲン化メチル型のバリン、ロイシン、もしくはイソロイシンの側鎖から選択してもよい。アミノ酸側鎖は、疎水性側鎖のアラニン、バリン、ロイシン、イソロイシン、トリプトファン、メチオニン、システイン、およびグリシンから選択してもよい。アミノ酸側鎖は、親水性側鎖のアスパラギン、グルタミン、セリン、トレオニン、およびチロシンから選択してもよい。あるいはアミノ酸側鎖は、塩基性側鎖のリシン、アルギニン、およびヒスチジンから選択してもよい。あるいはアミノ酸側鎖は、塩基性側鎖のアスパラギン酸およびグルタミン酸から選択してもよい。あるいはアミノ酸側鎖は、本明細書中に記載した側鎖のいずれか、またはそれらのモノハロゲン化型、ジハロゲン化型、もしくはトリハロゲン化型から選択してもよい。ハロゲンは、F、Cl、Br、またはIであってもよい。さらなる実施態様において、R12は、例えば、限定されないが、バリン、ロイシン、イソロイシンの側鎖、またはその置換された変異体とすることができる。別の実施態様において、R12は、例えば、限定されないが、バリン、ロイシン、またはイソロイシンの側鎖のモノハロゲン化メチル変異体、ジハロゲン化メチル変異体、またはハロゲン化メチル変異体とすることができる。さらに別の実施態様において、R12は、例えば、限定されないが、-CH2-CH(CH3)CH3;-CH2-CH(CR183)CH3;-CH2-CH(CHR182)CH3;-CH2-CH(CH2R18)CH3;-CH2-CH(CR183)CH2R18;-CH2-CH(CHR182)CH2R18;-CH2-CH(CH2R18)CH2R18;-CH2-CH(CR183)CHR182;-CH2-CH(CHR182)CHR182;-CH2-CH(CH2R18)CHR182;-CH2-CH(CR183)CR183;-CH2-CH(CHR182)CR183;-CH2-CH(CH2R18)CR183;-CH(CH3)CH3;-CH(CR183)CH3;-CH(CHR182)CH3;-CH(CH2R18)CH3;-CH(CR183)CH2R18;-CH(CHR182)CH2R18;-CH(CH2R18)CH2R18;-CH(CR183)CHR182;-CH(CHR182)CHR182;-CH(CH2R18)CHR182;-CH(CR183)CR183;-CH(CHR182)CR183;-CH(CH2R18)CR183;-CH(CH3)-CH(CH3)CH3;-CH(CH3)-CH(CR183)CH3;-CH(CH3)-CH(CHR182)CH3;-CH(CH3)-CH(CH2R18)CH3;-CH(CH3)-CH(CR183)CH2R18;-CH(CH3)-CH(CHR182)CH2R18;-CH(CH3)-CH(CH2R18)CH2R18;-CH(CH3)-CH(CR183)CHR182;-CH(CH3)-CH(CHR182)CHR182;-CH(CH3)-CH(CH2R18)CHR182;-CH(CH3)-CH(CR183)CR183;-CH(CH3)-CH(CHR182)CR183;または-CH(CH3)-CH(CH2R18)CR183とすることができ、式中R18は、例えば、限定されないが、F、Cl、Br、またはIとすることができる。1つの実施態様において、R18は、例えば、限定されないが、Clとすることができる。さらに別の実施態様において、R12は、例えば、限定されないが、-CH2-CH(CCl3)CH3または-CH2-CH(CHCl2)CH3とすることができる。あるいはR12は、炭素数1〜10の、置換または非置換のアシル、例えばアセチル、プロピオニル、ブタノイル、またはペンタノイルなどとすることができる。
【0094】
別の実施態様において、R13は、例えば、限定されないが、H、C1〜10アルキル、またはC2〜10アルケニルとすることができ、ここでC1〜10アルキルまたはC2〜10アルケニルはそれぞれ、置換されていないか、または1個以上の置換基で置換されており、該置換基はそれぞれ独立して、オキソ、COOH、R17、OH、OR17、F、Cl、Br、I、NH2、NHR17、NR172、CN、SH、SR17、SO3H、SO3R17、SO2R17、OSO3R17、またはNO2とすることができ、式中R17は、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、または独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基とすることができる。別の実施態様において、R13は、任意の天然に存在するアミノ酸の側鎖、またはその置換された変異体とすることができる。アミノ酸側鎖は、脂肪族側鎖のバリン、ロイシン、イソロイシン、またはモノハロゲン化メチル型、ジハロゲン化メチル型、もしくはトリハロゲン化メチル型のバリン、ロイシン、もしくはイソロイシンの側鎖から選択してもよい。アミノ酸側鎖は、疎水性側鎖のアラニン、バリン、ロイシン、イソロイシン、トリプトファン、メチオニン、システイン、およびグリシンから選択してもよい。アミノ酸側鎖は、親水性側鎖のアスパラギン、グルタミン、セリン、トレオニン、およびチロシンから選択してもよい。あるいはアミノ酸側鎖は、塩基性側鎖のリシン、アルギニン、およびヒスチジンから選択してもよい。あるいはアミノ酸側鎖は、塩基性側鎖のアスパラギン酸およびグルタミン酸から選択してもよい。あるいはアミノ酸側鎖は、本明細書中に記載した側鎖のいずれか、またはそのモノハロゲン化型、ジハロゲン化型、もしくはトリハロゲン化型から選択してもよい。ハロゲンは、F、Cl、Br、またはIであってもよい。さらに別の実施態様において、R13は、例えば、限定されないが、バリン、ロイシン、またはイソロイシンの側鎖のモノハロゲン化メチル変異体、ジハロゲン化メチル変異体、またはハロゲン化メチル変異体とすることができる。1つの実施態様において、R13は、例えば、限定されないが、-CH2-CH(CH3)CH3;-CH2-CH(CR193)CH3;-CH2-CH(CHR192)CH3;-CH2-CH(CH2R19)CH3;-CH2-CH(CR193)CH2R19;-CH2-CH(CHR192)CH2R19;-CH2-CH(CH2R19)CH2R19;-CH2-CH(CR193)CHR192;-CH2-CH(CHR192)CHR192;-CH2-CH(CH2R19)CHR192;-CH2-CH(CR193)CR193;-CH2-CH(CHR192)CR193;-CH2-CH(CH2R19)CR193;-CH(CH3)CH3;-CH(CR193)CH3;-CH(CHR192)CH3;-CH(CH2R19)CH3;-CH(CR193)CH2R19;-CH(CHR192)CH2R19;-CH(CH2R19)CH2R19;-CH(CR193)CHR192;-CH(CHR192)CHR192;-CH(CH2R19)CHR192;-CH(CR193)CR193;-CH(CHR192)CR193;-CH(CH2R19)CR193;-CH(CH3)-CH(CH3)CH3;-CH(CH3)-CH(CR193)CH3;-CH(CH3)-CH(CHR192)CH3;-CH(CH3)-CH(CH2R19)CH3;-CH(CH3)-CH(CR193)CH2R19;-CH(CH3)-CH(CHR192)CH2R19;-CH(CH3)-CH(CH2R19)CH2R19;-CH(CH3)-CH(CR193)CHR192;-CH(CH3)-CH(CHR192)CHR192;-CH(CH3)-CH(CH2R19)CHR192;-CH(CH3)-CH(CR193)CR193;-CH(CH3)-CH(CHR192)CR193;または-CH(CH3)-CH(CH2R19)CR193とすることができ、式中R19は、例えば、限定されないが、F、Cl、Br、またはIとすることができる。1つの実施態様において、R19は、例えば、限定されないが、Clとすることができる。別の実施態様において、R13は、例えば、限定されないが、-CH2-CH(CCl3)CH3または-CH2-CH(CHCl2)CH3とすることができる。あるいはR13は、炭素数1〜10の、置換または非置換のアシル、例えばアセチル、プロピオニル、ブタノイル、またはペンタノイルなどとすることができる。
【0095】
別の実施態様によれば、アンドロゲン受容体(AR)の活性を調節するための、式:
【0096】
【化25】

【0097】
(式中R20およびR21はそれぞれ独立して、例えば、限定されないが、CCl3またはCHCl2とすることができる)の化合物、またはその薬学的に許容される塩の使用が提供される。
【0098】
別の実施態様によれば、アンドロゲン受容体(AR)の活性を調節するための、式:
【0099】
【化26】

【0100】
(式中R20およびR21はそれぞれ独立して、例えば、限定されないが、CCl3またはCHCl2とすることができる)の化合物、またはその薬学的に許容される塩の使用が提供される。
【0101】
さらなる実施態様において、アンドロゲン受容体(AR)の活性を調節するための、式:
【0102】
【化27−1】

【0103】
【化27−2】

【0104】
の化合物、またはその薬学的に許容される塩の使用が提供される。
【0105】
さらなる実施態様において、アンドロゲン受容体(AR)の活性を調節するための、式:
【0106】
【化28】

【0107】
の化合物、またはその薬学的に許容される塩の使用が提供される。
【0108】
さらなる実施態様において、アンドロゲン受容体(AR)の活性を調節するための、式:
【0109】
【化29−1】

【0110】
【化29−2】

【0111】
の化合物、またはその薬学的に許容される塩の使用が提供される。さらなる実施態様において、アンドロゲン受容体(AR)の活性を調節するための、式:
【0112】
【化30】

【0113】
の化合物、またはその薬学的に許容される塩の使用が提供される。
【0114】
さらなる実施態様によれば、アンドロゲン受容体(AR)の活性を調節するための上に示した化合物の使用が提供される。あるいは、該使用は、アンドロゲン受容体(AR)を調節するための医薬の製造のためのものであってもよい。あるいは、該使用は、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患(polycystic ovary disease)、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症の治療のためのものであってもよく、該適応症の治療用の医薬の製造のためのものであってもよい。該適応症は、前立腺癌であってもよい。該前立腺癌は、アンドロゲン非依存性前立腺癌であってもよい。該前立腺癌は、アンドロゲン依存性前立腺癌であってもよい。別の実施態様によれば、ARの活性の調節方法が提供され、該方法は、上に示した化合物またはその塩を哺乳動物細胞に投与することを含む。
【0115】
別の実施態様によれば、上に示した化合物または本明細書中に示したいずれかの化合物、および薬学的に許容される賦形剤を含む、医薬組成物が提供される。
【0116】
さらなる実施態様によれば、スクリーニングされる化合物が本明細書中に記載した化合物から選択される、アンドロゲン受容体を調節する化合物のスクリーニング方法が提供される。
【0117】
さらなる実施態様によれば、アンドロゲン受容体(AR)の活性を調節するための1種以上の本明細書中に記載した化合物が提供される。
【0118】
本明細書中に記載した化合物は、すべてのラセミ混合物、およびすべての個々の鏡像異性体、またはこれらの組み合わせが本明細書中に示されているか否かにかかわらず、それらを含むことが意図されている。
【0119】
アミノ酸側鎖は、1つ以上の下記のもの、または1つ以上の下記の側鎖の分類から選択することができる。
【0120】
【化31】

【0121】
【化32】

【0122】
【化33】

【0123】
【化34】

【0124】
【化35】

【0125】
【化36】

【0126】
【化37】

【0127】
【化38】

【図面の簡単な説明】
【0128】
【図1A】図1Aは、ARR3-lucを用いて安定にトランスフェクションし、R1881および海産の抽出物(10 ug/ml)で48時間処理したLNCaP細胞の溶解物(lystates)におけるルシフェラーゼ活性のCLIPR画像を示す。すべてのウェルは、R1881(1 nM)で処理し、各抽出物は横列に並んだ3ウェルに加えた(1列あたり4種の抽出物)。囲んだウェルは、このプレート上の06-80(三つ組み)を表し、90%よりも大きな阻害を示す。
【図1B】図1Bは、CB3.1と呼ばれる06-80に由来する活性のある単離された化合物(10 μg/ml)またはR1881(1 nM)およびDMSO(化合物の媒体)で48時間処理し、倒立顕微鏡を使って可視化した、LNCaP細胞の形態の顕微鏡写真を示す。
【図2】図2A〜2Cは、GRおよびPR、ならびにこれらの関連レポーター遺伝子コンストラクト(PSA-luc、GRE-lucまたはPRE-luc)の発現ベクターでトランスフェクションし、これらそれぞれのステロイド(10 nM、黒色のバー)に24時間曝露したLNCaP細胞において、CB3.1(5 μg/ml)は、ARE-ルシフェラーゼ活性を阻害したが、GRE-ルシフェラーゼ活性もPRE-ルシフェラーゼ活性も阻害しなかったことを示している。白色のバーは、ステロイドがない(エタノール対照)ことを示す。図中にグルココルチコイド受容体(glucocorticoid receptor)(GR)およびプロゲステロン受容体(progesterone receptor)(PR)がある。
【図3A】図3Aは、FSKによって誘発されるARのNTDのトランス活性化をシントカミドAが阻止することについての棒グラフを示す。シントカミドA(CB3.1)(5 μg/ml)をそのARのNTDを阻害する能力について調べた。LNCaP細胞をGal4DBD-AR1-558および相補的な(complimentary)5XGal4UAS-ルシフェラーゼレポーターの発現ベクターでコトランスフェクションした。FSKによるこのレポーターの誘発は、Gal4DBD-AR1-558融合タンパク質のトランス活性化の尺度である(Sadar 1999 J. Biol. Chem. 274, 7777〜7783)。R1881は、かかるアッセイを誘発せず(Gal4DBD-AR1-558キメラには存在しないARのリガンド結合領域(LBD)に結合する)、そのため使用しなかった。
【図3B】図3Bは、ビカルタミド(BIC、10 μM)またはCB3.1(5 μg/mL)で1時間処理してから、R1881(0.1 nM)を加えた、LNCaP細胞のアンドロゲン依存性の増殖をシントカミドA(CB3.1)が阻止することを示す、棒グラフを示す。細胞を収集し、アンドロゲンによる処理の3日後のBrdUの取り込みを測定した。CB3.1処理およびR1881処理と、R1881処理のみとの間のpは0.0001である。
【図3C】図3Cは、シントカミドA(CB3.1)がPC3細胞の増殖を阻止できないことを示す、棒グラフを示す。細胞を、媒体(DMSO)、CB3.1(5 μg/mL)で1日間処理してから、収集し、BrdUの取り込みを測定した。バーは、平均値±SEM(n=6)を表す。
【図4】図4は、シントカミドがLNCaP細胞におけるPSA mRNAのアンドロゲンによる誘発量を抑制することを示す、棒グラフを示す。細胞を、ビカルタミド(BIC、10 μM)、または10 μg/mlの各化合物(CB3.0(ジサミドA)、CB3.1(シントカミドA)、およびCB4.0(シントカミドB)を含むDMSO担体)で1時間前処理してから、合成アンドロゲンR1881(1 nM)を加え、次いでさらに16時間インキュベートしてから、全RNAを収集および単離した。PSA mRNAの濃度を、定量的リアルタイム(quantitative real-time)(qRT)PCRによって測定し、GAPDH mRNA(ハウスキーピング遺伝子)の濃度に対して正規化した。白色のバーはR1881がないことを示す。黒色のバーはR1881(1 nM)を示す。MNEは正規化された平均の発現(mean normalized expression)である。DMSO(R1881なし)は、個々の実験ごとに適宜1.0に設定した。バーは、各実験からの三つ組みの技術的試料を用いた3つの別々の実験からの平均値±SEを表す。
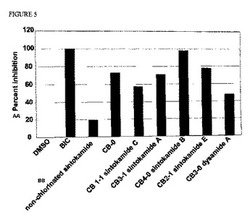
【図5】図5は、PSA(6.1)-ルシフェラーゼのR1881による誘発を、シントカミドA、B、CおよびE、ならびにジサミド(Dysimide)Aが阻害することを示す、棒グラフを示す。12ウェルプレート中のLNCaP細胞(1ウェルあたり8×104個の細胞)を、5%のFBSが補充されたフェノールレッドを含まないRPMIに播種し、翌日その細胞を、無血清のフェノールレッドを含まないRPMI中で、1ウェルあたり2.5 ulのリポフェクチンを用いて、PSA(6.1 kb)-ルシフェラーゼレポータープラスミド(0.5 μg/ウェル)、pLuc(1 μg/ウェル)でトランスフェクションした。トランスフェクション(transfaction)の24時間後、細胞をビカルタミド(BIC、10 μM)、非塩素化シントカミド(10 μM)、もしくは5 μg/mlのCB-0抽出物、またはシントカミドおよびジサミドAで1時間前処理してから、媒体(DMSO)またはR1881(1 nM)を加えた。24時間後に細胞を収集し、ルシフェラーゼ活性について分析した。データは、ブラッドフォード(Bradford)アッセイを用いて測定したタンパク質に対して正規化している。
【図6】図6は、シントカミドA(CB3.1)に応答したLNCaP異種移植片容積を示す、時間経過を示す。CB3.1は腫瘍の大きさを減少させたが、DMSOで処理した腫瘍は成長し続けた。1回目の注射の7日前に動物を去勢し、腫瘍容積を100%と定めた。3日ごとに30 mg/kg体重の用量で3日ごとに注射をした。B. 写真は、CB3.1で処理した、代表的な収集したLNCaP異種移植片のものである。黒色のバーは、10 mmを表す。
【発明を実施するための形態】
【0129】
(詳細な説明)
本明細書中に記載した新規な化合物群は、シントカミドA(1)〜E(5)を含み、これらはすべて、海綿[a) Kazlauskas, R. Murphy, P.T.; Wells, R.J.; Schoenholzer, P. Tetrahedron Lett. 1978, 4951〜, b) Kazlauskas, R. Murphy, P.T.; Wells, R.J. Tetrahedron Lett. 1978, 4949〜 , c) Hofheinz, W.; Oberhansli, W.E. Helv. Chim. Acta 1977, 60, 660〜, d) Erickson, K.; Wells, R. Aust. J. Chem. 1982, 35, 31〜38, e) Unson, M.D.; Rose, C.B.; Faulkner, D.J.; Brinen, L.S.; Steiner, J.R.; Clardy, J. J. Org. Chem. 1993, 58, 6336〜6343]、裸鰓類(nudibranchs)[Fahey, S.J.; Garson, M.J. J. Chem. Ecol. 2002, 28, 1773〜1785]、およびシアノバクテリア[Orjala, J.; Gerwick, W.H. J. Nat. Prod. 1996, 59, 427〜430]から単離されている塩素化ペプチドという小さなファミリーと関連しているようである。さらに、合成および修飾は、例えばWillardら, J. Org. Chem., 1984, 49, 3489〜3493、およびBrantleyら, Organic Letters, 1999, 第1巻, 13号, 2165〜2167に記載されている。
【0130】
本明細書中で使用される場合、語句「Cx〜yアルキル」または「Cx〜Cyアルキル」は、それが通常当業者に理解されている通りに使用されており、多くの場合、x〜yの数(整数xおよびyを含めてその範囲内のすべての個々の整数が含まれる)の炭素原子を含む炭素骨格または主炭素鎖を有する化学物質を指す。例えば、「C1〜10アルキル」は、その炭素骨格または主鎖に、1個、2個、3個、4個、5個、6個、7個、8個、9個、または10個の炭素原子(群)を有する化学物質である。
【0131】
本明細書中で使用される場合、用語「環式Cx〜yアルキル」または「環式Cx〜Cyアルキル」は、それが通常当業者に理解されている通りに使用されており、多くの場合、化学物質の炭素骨格または主鎖の少なくとも一部が、一緒に結合する原子の「ループ(loop)」、円(circle)、または環(ring)を形成するように結合している化合物または化学物質を指す。原子はすべてが互いに直接結合している必要はなく、むしろ「ループ」中のほんの2個の他の原子に直接結合していればよい。環式アルキルの非限定的な例としては、ベンゼン、トルエン、シクロペンタン、ビスフェノール、および1-クロロ-3-エチルシクロヘキサンが挙げられる。
【0132】
本明細書中で使用される場合、用語「分枝状」は、それが通常当業者に理解されている通りに使用されており、多くの場合、1つよりも多くの連続鎖に分かれる骨格または主鎖を含む化学物質を指す。1つよりも多くの方向に分かれる骨格または主鎖の部分は、直鎖状であってもよく、環式であってもよく、これらの任意の組み合わせであってもよい。分枝状アルキルの非限定的な例は、tert-ブチルおよびイソプロピルである。
【0133】
本明細書中で使用される場合、用語「非分枝状」は、それが通常当業者に理解されている通りに使用されており、多くの場合、1つよりも多くの(more that one)連続鎖に分かれない骨格または主鎖を含む化学物質を指す。非分枝状アルキルの非限定的な例は、メチル、エチル、n-プロピル、およびn-ブチルである。
【0134】
本明細書中で使用される場合、用語「置換」は、それが通常当業者に理解されている通りに使用されており、多くの場合、1個以上のヘテロ原子を含む異なる化学基で置き換えられた1個の化学基を有する化学物質を指す。別段特定しない限り、置換アルキルは、1個以上の水素原子(群)が水素(群)ではない1個以上の原子(群)で置換されているアルキルである。例えば、クロロメチルは、置換アルキルの非限定的な例であり、より具体的には置換メチルの例である。アミノエチルは、置換アルキルの別の非限定的な例であり、より具体的にはそれは置換エチルである。本明細書中に記載した官能基は、例えば、限定されないが、1個、2個、3個、4個、5個、6個、7個、8個、9個、または10個の置換基で置換されていてもよい。
【0135】
本明細書中で使用される場合、用語「非置換」は、それが通常当業者に理解されている通りに使用されており、多くの場合、炭化水素であり、かつ/またはヘテロ原子を含まない、化学物質を指す。非置換アルキルの非限定的な例としては、メチル、エチル、tert-ブチル、およびペンチルが挙げられる。
【0136】
本明細書中で使用される場合、化学物質に言及する場合の用語「飽和」は、それが通常当業者に理解されている通りに使用されており、多くの場合、単結合のみを含む化学物質を指す。飽和の化学物質の非限定的な例としては、エタン、tert-ブチル、およびN+H3が挙げられる。
【0137】
本明細書中で使用される場合、用語「ハロゲン化」は、それが通常当業者に理解される通りに使用されており、水素原子が塩素、フッ素、ヨウ素、または臭素などのハロゲン原子で置換されている、部分または化学物質を指す。例えば、天然に存在するアミノ酸の塩素化側鎖は、天然に存在するアミノ酸の側鎖に存在する1個以上の水素原子が1個以上の塩素原子で置換されている、天然に存在するアミノ酸の側鎖を指す。
【0138】
飽和C1〜C10アルキルの非限定的な例としては、メチル、エチル、n-プロピル、i-プロピル、sec-プロピル、n-ブチル、i-ブチル、sec-ブチル、t-ブチル、n-ペンチル、i-ペンチル、sec-ペンチル、t-ペンチル、n-ヘキシル、i-ヘキシル、1,2-ジメチルプロピル、2-エチルプロピル、1-メチル-2-エチルプロピル、1-エチル-2-メチルプロピル、1,1,2-トリメチルプロピル、1,1,2-トリエチルプロピル、1,1-ジメチルブチル、2,2-ジメチルブチル、2-エチルブチル、1,3-ジメチルブチル、2-メチルペンチル、3-メチルペンチル、sec-ヘキシル、t-ヘキシル、n-ヘプチル、i-ヘプチル、sec-ヘプチル、t-ヘプチル、n-オクチル、i-オクチル、sec-オクチル、t-オクチル、n-ノニル、i-ノニル、sec-ノニル、t-ノニル、n-デシル、i-デシル、sec-デシル、およびt-デシルを挙げることができる。C2〜C10アルケニルの非限定的な例としては、ビニル、アリル、イソプロペニル、1-プロペン-2-イル、1-ブテン-1-イル、1-ブテン-2-イル、1-ブテン-3-イル、2-ブテン-1-イル、2-ブテン-2-イル、オクテニル、およびデセニルを挙げることができる。C2〜C10アルキニルの非限定的な例としては、エチニル、プロピニル、ブチニル、ペンチニル、ヘキシニル、ヘプチニル、オクチニル、ノニニル、およびデシニルを挙げることができる。飽和C1〜C10アルキル、C2〜C10アルケニル、またはC2〜C10アルキニルは、例えば、限定されないが、独立して窒素、硫黄、または酸素である1個以上のヘテロ原子によって分断されていてもよい。
【0139】
飽和C3〜C10シクロアルキル基の非限定的な例としては、シクロプロパニル、シクロブタニル、シクロペンタニル、シクロヘキサニル、シクロヘプタニル、シクロオクタニル、シクロノナニル、およびシクロデカニルを挙げることができる。C3〜C10シクロアルケニル基の非限定的な例としては、シクロプロペニル、シクロブテニル、シクロペンテニル、シクロヘキセニル、シクロヘプテニル、シクロオクテニル、シクロノナンニル(cyclononanenyl)、およびシクロデカンニル(cyclodecanenyl)を挙げることができる。C3〜C10シクロアルキニルの非限定的な例としては、シクロプロピニル、シクロブチニル、シクロペンチニル、シクロヘキシニル、シクロヘプチニル、およびシクロオクチニルを挙げることができる。C6〜C10アリール基の非限定的な例としては、フェニル(Ph)、ペンタレニル、インデニル、ナフチル、およびアズレニルを挙げることができる。C6〜9アリール−C1〜4アルキル基は、例えば、限定されないが、上記のいずれかの箇所で定義したC6〜9アリール基を置換基として有する、上記のいずれかの箇所で定義したC1〜4アルキル基であってもよい。C6〜8アリール−C2〜4アルケニル基は、例えば、限定されないが、上記のいずれかの箇所で定義したC6〜8アリール基を置換基として有する、上記のいずれかの箇所で定義したC2〜4アルケニルであってもよい。C6〜8アリール−C2〜4アルキニル基は、例えば、限定されないが、上記のいずれかの箇所で定義したC6〜8アリール基を置換基として有する、上記のいずれかの箇所で定義したC2〜4アルキニル基であってもよい。独立して窒素、硫黄、または酸素である1個以上のヘテロ原子を含む、4〜10員の非芳香族複素環基の非限定的な例としては、ピロリジニル、ピロリニル、ピペリジニル、ピペラジニル、イミダゾリニル、ピラゾリジニル、イミダゾリジニル(imidazolydinyl)、モルホリニル、テトラヒドロピラニル、アゼチジニル、オキセタニル、オキサチオラニル、フタルイミド、およびスクシンイミドを挙げることができる。独立して窒素、硫黄、または酸素である1個以上のヘテロ原子を含む5〜10員の芳香族複素環基の非限定的な例としては、ピロリル、ピリジニル、ピリダジニル、ピリミジニル、ピラジニル(pirazinyl)、イミダゾリル、チアゾリル、およびオキサゾリルを挙げることができる。
【0140】
炭素数1〜10の、置換または非置換のアシルの非限定的な例としては、アセチル、プロピオニル、ブタノイル、およびペンタノイルが挙げられる。C1〜C10アルコキシの非限定的な例としては、メトキシ、エトキシ、プロポキシ、およびブトキシが挙げられる。
【0141】
天然に存在するアミノ酸のアミノ酸側鎖(amino acid side chains)(本明細書中で「(aa)」を用いて示していることが多い)は、当業者に周知であり、1995年にScientific American Booksによって出版された、James Darnellらによる「分子細胞生物学(Molecular Cell Biology)」第3版などの種々の教科書に見出すことができる。天然に存在するアミノ酸は、式(NH2)C(COOH)(H)(R)(式中、括弧内の化学基はそれぞれ、括弧内にない炭素に結合している)により表されることが多い。Rは、この特定の式における側鎖を表す。
【0142】
本明細書中で使用される場合、記号
【0143】
【化39】

【0144】
は、一方は示されており、他方は典型的には示されていない、2つの化学物質の間の連結位置での結合を示す。例えば、
【0145】
【化40】

【0146】
は、化学物質「XY」が、連結結合の位置を介して別の化学物質に結合していることを示す。さらに、示されていない化学物質への具体的な連結位置は、推測によって特定することができる。例えば、化合物CH3-R3(式中R3は、Hまたは
【0147】
【化41】

【0148】
である)は、R3が「XY」である場合、連結結合の位置は、R3がCH3に結合していることを示している結合と同じ結合であることを暗示する。
【0149】
天然に存在するアミノ酸の側鎖またはその塩素化型の例としては、-CH2-CH(CH3)CH3;-CH2-CH(CCl3)CH3;-CH2-CH(CHCl2)CH3;-CH2-CH(CH2Cl)CH3;-CH2-CH(CCl3)CH2Cl;-CH2-CH(CHCl2)CH2Cl;-CH2-CH(CH2Cl)CH2Cl;-CH2-CH(CCl3)CHCl2;-CH2-CH(CHCl2)CHCl2;-CH2-CH(CH2Cl)CHCl2;-CH2-CH(CCl3)CCl3;-CH2-CH(CHCl2)CCl3;-CH2-CH(CH2Cl)CCl3;-CH(CH3)CH3;-CH(CCl3)CH3;-CH(CHCl2)CH3;-CH(CH2Cl)CH3;-CH(CCl3)CH2Cl;-CH(CHCl2)CH2Cl;-CH(CH2Cl)CH2Cl;-CH(CCl3)CHCl2;-CH(CHCl2)CHCl2;-CH(CH2Cl)CHCl2;-CH(CCl3)CCl3;-CH(CHCl2)CCl3;-CH(CH2Cl)CCl3;-CH(CH3)-CH(CH3)CH3;-CH(CH3)-CH(CCl3)CH3;-CH(CH3)-CH(CHCl2)CH3;-CH(CH3)-CH(CH2Cl)CH3;-CH(CH3)-CH(CCl3)CH2Cl;-CH(CH3)-CH(CHCl2)CH2Cl;-CH(CH3)-CH(CH2Cl)CH2Cl;-CH(CH3)-CH(CCl3)CHCl2;-CH(CH3)-CH(CHCl2)CHCl2;-CH(CH3)-CH(CH2Cl)CHCl2;-CH(CH3)-CH(CCl3)CCl3;-CH(CH3)-CH(CHCl2)CCl3;および-CH(CH3)-CH(CH2Cl)CCl3が挙げられる。
【0150】
本明細書中に記載した式にかかわる実施態様は、本明細書中に示したもの、または記載したものを含めて、すべての考えられる立体化学的な代替物を含む。
【0151】
いくつかの実施態様において、本明細書中に記載した化合物、または上記のその許容される塩は、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患(polycystic ovary disease)、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症の全身的治療に使用することができる。いくつかの実施態様において、本明細書中に記載した化合物、または上記のその許容される塩は、本明細書中に記載した適応症の全身的治療のための医薬または組成物の製造に使用することができる。いくつかの実施態様において、本明細書中に記載した任意の適応症を全身的に治療する方法もまた提供される。本発明のいくつかの態様は、本明細書中に記載した化合物、および薬学的に許容される賦形剤または担体を含む組成物を利用する。いくつかの実施態様において、前立腺癌は、アンドロゲン非依存性前立腺癌(ホルモン抵抗性、去勢抵抗性、アンドロゲン遮断抵抗性、アンドロゲン除去抵抗性、アンドロゲン枯渇非依存性、去勢-再発性、抗アンドロゲン薬-再発性ともいう)である。いくつかの実施態様において、前立腺癌は、アンドロゲン依存性またはアンドロゲン感受性である。本明細書中に記載した任意の適応症を治療する方法もまた提供される。かかる方法は、本明細書中に記載した化合物もしくは本明細書中に記載した化合物の組成物、または有効量の本明細書中に記載した化合物もしくは本明細書中に記載した化合物の組成物を、それを必要とする対象に投与することを含むことができる。
【0152】
いくつかの実施態様によれば、本明細書中に記載した化合物のプロドラッグもまた提供される。当業者は、プロドラッグが、特定の条件下で本明細書中に記載した化合物またはその塩に変換される化合物であることを理解する。特定の条件としては、例えば、限定されないが、インビボの酵素的または非酵素的な手段を挙げることができる。プロドラッグの変換は、例えば、限定されないが、自発的に起こってもよく、また該変換は触媒され、別の薬剤、または物理的パラメータもしくは環境パラメータ、例えば、酵素、光、酸、温度、もしくはpH、の変化によって誘発されてもよい。いくつかの実施態様において、プロドラッグ自体は、薬理学的活性をほとんどまたは全く有していなくてもよいが、その後本明細書中に記載した化合物に変換されると、所望の活性を有する。プロドラッグは、例えば、限定されないが、本明細書中に記載した化合物中の適切な官能基(例えば、カルボン酸官能基-COOH、アルコール官能基-OH、または第一級もしくは第二級のアミン官能基)を適切な部分を用いて変換することによって、調製することができる。適切な部分は、当業者によって理解され、判断され得る。例えば、限定されないが、プロドラッグは、第一級または第二級のアミノ官能基をアミド官能基に変換することによって、形成することができる。例えば、限定されないが、プロドラッグは、カルボン酸官能基をエステル官能基に変換することによって形成してもよく、またアルコール官能基をエーテル官能基に変換することによって形成してもよい。プロドラッグ部分は、例えば、限定されないが、官能基をマスクするように作用する保護基、1つ以上の能動輸送機構もしくは受動輸送機構の基質として作用する基、または化合物の性質、例えば、溶解性、バイオアベイラビリティもしくは局在性を付与するか、もしくは高めるように作用する基、であってもよい。いくつかの実施態様において、本明細書中に記載した化合物またはその塩自体を、本明細書中に記載した他の化合物のプロドラッグとすることができる。
【0153】
本明細書中に記載した化合物は、遊離形態であってもよく、その塩の形態であってもよい。いくつかの実施態様において、本明細書中に記載した化合物は、当該技術分野で公知の薬学的に許容される塩(Bergeら, J. Pharm. Sci. 1977, 66, 1)の形態とすることができる。本明細書中で使用される薬学的に許容される塩としては、例えば親化合物の所望の薬理学的活性を有する塩(親化合物の生物学的有効性および/または性質を保持し、生物学的にかつ/またはその他の点で望ましくないことがない、塩)が挙げられる。塩を形成することが可能な1個以上の官能基を有する本明細書中に記載した化合物は、例えば、薬学的に許容される塩として形成することができる。1個以上の塩基性官能基を含む化合物は、例えば、薬学的に許容される有機酸または無機酸と、薬学的に許容される塩を形成することが可能であり得る。薬学的に許容される塩は、例えば、限定されないが、酢酸、アジピン酸、アルギン酸、アスパラギン酸、アスコルビン酸、安息香酸、ベンゼンスルホン酸、酪酸、ケイ皮酸、クエン酸、ショウノウ酸、カンファースルホン酸、シクロペンタンプロピオン酸、ジエチル酢酸、ジグルコン酸、ドデシルスルホン酸、エタンスルホン酸、ギ酸、フマル酸、グルコヘプタン酸、グルコン酸、グリセロリン酸、グリコール酸、ヘミスルホン酸(hemisulfonic acid)、ヘプタン酸、ヘキサン酸、塩酸、臭化水素酸、ヨウ化水素酸、2-ヒドロキシエタンスルホン酸、イソニコチン酸、乳酸、リンゴ酸、マレイン酸、マロン酸、マンデル酸、メタンスルホン酸、2-ナフタレンスルホン酸(2-napthalenesulfonic acid)、ナフタレンジスルホン酸、p-トルエンスルホン酸、ニコチン酸、硝酸、シュウ酸、パモ酸、ペクチン酸(pectinic acid)、3-フェニルプロピオン酸、リン酸、ピクリン酸、ピメリン酸、ピバル酸、プロピオン酸、ピルビン酸、サリチル酸、コハク酸、硫酸、スルファミン酸、酒石酸、チオシアン酸、またはウンデカン酸に由来するものであってもよい。1個以上の酸性官能基を含む化合物は、薬学的に許容される塩基、例えば、限定されないが、アルカリ金属またはアルカリ土類金属に基づく無機塩基、または第一級アミン化合物、第二級アミン化合物、第三級アミン化合物、第四級アミン化合物、置換アミン、天然に存在する置換アミン、環式アミン、もしくは塩基性イオン交換樹脂などの有機塩基、と薬学的に許容される塩を形成することが可能であり得る。薬学的に許容される塩は、例えば、限定されないが、アンモニウム、ナトリウム、カリウム、リチウム、カルシウム、マグネシウム、鉄、亜鉛、銅、マンガン、もしくはアルミニウムなどの薬学的に許容される金属カチオンの水酸化物、炭酸塩、もしくは重炭酸塩、アンモニア、ベンザチン、メグルミン、メチルアミン、ジメチルアミン、トリメチルアミン、エチルアミン、ジエチルアミン、トリエチルアミン、イソプロピルアミン、トリプロピルアミン、トリブチルアミン、エタノールアミン、ジエタノールアミン、2-ジメチルアミノエタノール、2-ジエチルアミノエタノール、ジシクロヘキシルアミン、リシン、アルギニン、ヒスチジン、カフェイン、ヒドラバミン(hydrabamine)、コリン、ベタイン、エチレンジアミン、グルコサミン、グルカミン、メチルグルカミン、テオブロミン、プリン類、ピペラジン、ピペリジン、プロカイン、N-エチルピペリジン、テオブロミン、テトラメチルアンモニウム化合物、テトラエチルアンモニウム化合物、ピリジン、N,N-ジメチルアニリン、N-メチルピペリジン、モルホリン、N-メチルモルホリン、N-エチルモルホリン、ジシクロヘキシルアミン、ジベンジルアミン、N,N-ジベンジルフェネチルアミン、1-エフェナミン、N,N'-ジベンジルエチレンジアミン、またはポリアミン樹脂に由来するものであってもよい。いくつかの実施態様において、本明細書中に記載した化合物は、酸性基および塩基性基をともに含むことができ、内部塩または双性イオン、例えば限定されないがベタイン類、の形態とすることができる。本明細書中に記載した塩は、当業者に知られている常套の方法によって、例えば限定されないが、遊離形態を、有機酸、無機酸、有機塩基、もしくは無機塩基と反応させることによって、または他の塩からの陰イオン交換もしくは陽イオン交換によって、製造することができる。当業者は、塩の製造は、化合物の単離および/または精製の間にインサイチュで行ってもよく、また塩の製造は、単離および/または精製した化合物を別途反応させることによって行ってもよいことを理解する。
【0154】
いくつかの実施態様において、本明細書中に記載した化合物、およびそのすべての異なる形態(例えば遊離形態、塩、多形体、異性体)は、溶媒付加形態、例えば溶媒和物、とすることができる。溶媒和物は、化合物またはその塩と物理的に会合した、化学量論的量の溶媒または非化学量論的量の溶媒のいずれかを含む。溶媒は、例えば、限定されないが、薬学的に許容される溶媒であってもよい。例えば、溶媒が水である場合、水和物が形成され、また溶媒がアルコールである場合、アルコラート(alcoholates)が形成される。
【0155】
いくつかの実施態様において、本明細書中に記載した化合物、およびそのすべての異なる形態(例えば遊離形態、塩、溶媒和物、異性体)は、結晶形態および/または非晶質形態、例えば、多形体、擬似多形体、立体配座多形体、非晶質形態、もしくはこれらの組み合わせ、を含むことができる。多形体は、同じ元素組成の化合物の異なる結晶充填配列を含む。多形体は、通常、異なるX線回折パターン、赤外線スペクトル、融点、密度、硬度、結晶形、光学特性および電気的特性、安定性、ならびに/または溶解度を有する。当業者は、再結晶溶媒、結晶化速度および保存温度を含む種々の要因が単一の結晶形態を優位にさせ得ることを理解する。
【0156】
いくつかの実施態様において、本明細書中に記載した化合物、およびそのすべての異なる形態(例えば遊離形態、塩、溶媒和物、多形体)は、幾何異性体、不斉炭素に基づく光学異性体、立体異性体、互変異性体、個々の鏡像異性体、個々のジアステレオマー、ラセミ体、ジアステレオマーの混合物、およびこれらの組み合わせなどの異性体を含み、便宜上示された式の記載によって限定されない。
【0157】
いくつかの実施態様において、本発明による医薬組成物は、かかる化合物の塩、好ましくは薬学的または生理学的に許容される塩を含むことができる。医薬製剤は、投与が、注射、吸入、局所投与、洗浄、または選択される治療に適するその他の様式によるかにかかわらず、典型的には、該製剤の投与様式について許容される1種以上の担体、賦形剤、または希釈剤を含むことになる。適切な担体、賦形剤、または希釈剤としては、かかる投与様式において使用するための、当該技術分野で公知のものが挙げられる。
【0158】
適切な医薬組成物は、当該技術分野で公知の手段によって製剤化することができ、その投与様式および用量は、当業者によって決定され得る。非経口投与については、化合物を、滅菌水もしくは生理食塩水、または非水溶性化合物の投与に使用される薬学的に許容される媒体、例えばビタミンKに使用されるものなど、に溶解することができる。腸内投与については、化合物を錠剤、カプセル剤で投与してもよく、液体形態に溶解してもよい。錠剤またはカプセル剤は、腸溶コーティングのものであってもよく、徐放用製剤様であってもよい。放出させる化合物を封入したポリマーもしくはタンパク質の微粒子、軟膏剤、ペースト剤、ゲル、ヒドロゲル、または溶液を含めて、化合物を投与するために局所的に(topically)または局所的に(locally)使用することができる、多数の適切な製剤が公知である。長期間にわたる放出を提供するために、徐放性の貼付剤またはインプラントを使用することができる。当業者に知られている多数の技術が、Alfonso GennaroによるRemington: the Science & Practice of Pharmacy, 第20版, Lippencott Williams & Wilkins, (2000)に記載されている。非経口投与用の製剤は、例えば、賦形剤、ポリエチレングリコールなどのポリアルキレングリコール、植物由来の油、または水素化ナフタレンを含んでいてもよい。化合物の放出を制御するために、生体適合性、生分解性のラクチド重合体、ラクチド/グリコリド共重合体、またはポリオキシエチレン-ポリオキシプロピレン共重合体を使用することができる。他の潜在的に有用な、調節性化合物の非経口的送達系としては、エチレン-酢酸ビニル共重合体粒子、浸透圧ポンプ、埋め込み型の注入系、およびリポソームが挙げられる。吸入用の製剤は、賦形剤、例えばラクトースを含んでいてもよく、例えばポリオキシエチレン-9-ラウリルエーテル、グリココール酸(glycocholate)およびデオキシコール酸(deoxycholate)を含む水溶液であってもよく、点鼻剤の形態で投与するための油性溶液であってもよく、ゲル様であってもよい。
【0159】
本発明による、または本発明で使用するための、化合物または医薬組成物は、インプラント、移植片、プロテーゼ、ステントなどの医療機器または医療器具によって、投与することができる。さらに、インプラントは、かかる化合物または組成物を含み、放出するように意図された、考案されたものであってもよい。1つの例は、ある期間にわたって化合物を放出するように適合した高分子材料でできたインプラントである。
【0160】
本発明による医薬組成物の「有効量」は、治療的有効量または予防的有効量を含む。「治療的有効量」は、腫瘍の大きさの減少、寿命の増大、または平均余命の増大などの所望の治療結果を達成するための、投薬時の、かつ必要な期間についての、効果的な量を指す。化合物の治療的有効量は、対象の病態、年齢、性別、および体重、ならびに対象において所望の反応を誘発する化合物の能力などの要因に応じて変化し得る。投薬計画は、最適な治療反応を提供するように調整することができる。治療的有効量はまた、治療的に有益な効果が、化合物の何らかの毒性効果または有害作用を上回る、量でもある。「予防的有効量」は、腫瘍の縮小、寿命の増大、平均余命の増大、または前立腺癌のアンドロゲン非依存性形態への進展の予防などの所望の予防的結果を達成するための、投薬時の、かつ必要な期間についての、効果的な量を指す。典型的には、疾患の前または疾患の初期段階には、予防用量が対象に使用され、したがって予防的有効量は、治療的有効量よりも少なくなり得る。
【0161】
投薬量の数値は、緩和させる病状の重症度によって変化し得ることに留意されたい。任意の特定の対象について、具体的な投薬計画は、個々の必要性、および組成物の投与を管理または監督する人の専門的な判断に応じて、経時的に調整することができる。本明細書中に示す投薬量の範囲は例示的なものに過ぎず、医療の実務家によって選択され得る投薬量の範囲を限定するものではない。組成物中の活性化合物(群)の量は、対象の病態、年齢、性別、および体重などの要因に応じて変化し得る。投薬計画は、最適な治療反応を提供するように調整することができる。例えば、単回のボーラス投与量を投与してもよく、いくつかの分割した用量を経時的に投与してもよく、用量を治療状況の要求によって示される通りに比例的に減少または増大させてもよい。投与の容易さ、および投薬量の均一性のために、投薬単位の形態で非経口的組成物を製剤化することが有利であり得る。
【0162】
いくつかの実施態様において、本明細書中に記載した化合物、およびそのすべての異なる形態は、例えば、限定されないが、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患(polycystic ovary disease)、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症のために、他の治療方法と併用して使用することができる。例えば、本明細書中に記載した化合物、およびすべてのその異なる形態は、手術、放射線療法(近接照射療法もしくは外部ビーム)、またはその他の治療法(例えばHIFU)とともに、ネオアジュバント(術前)療法、補助的(術中)療法、および/またはアジュバント(術後)療法として、使用することができる。
【0163】
一般に、本発明の化合物は、実質的な毒性をもたらすことなく使用されるべきである。本発明の化合物の毒性は、標準的な技術を用いて、例えば細胞培養物または実験動物で試験し、治療指数、すなわちLD50(個体群の50%に対して致死的な用量)とLD100(個体群の100%に対して致死的な用量)との比を特定することによって、定量することができる。しかしながら、状況によっては、例えば重篤な病状などでは、相当な過剰量の組成物を投与することが必要であることがある。本発明の化合物には、一部の濃度で毒性になり得るものがある。毒性のある濃度および毒性を示さない濃度を特定するために、用量設定の研究を使用することができる。毒性は、陰性対照としてARを発現しないPC3細胞を用いて、特定の化合物または組成物の諸細胞株にわたる特異性を調べることによって、評価することができる。化合物が他の組織に対する何らかの効果を有する場合、動物試験を使用して効能(indication)を示すことができる。抗アンドロゲン剤およびアンドロゲン不感性症候群は致死的ではないため、ARを標的にする全身療法は、おそらく他の組織に重大な問題を生じさせることにはならない。
【0164】
本明細書中に記載した化合物は、対象に投与することができる。本明細書中で使用される場合、「対象」は、ヒト、非ヒト霊長類、ラット、マウス、ウシ、ウマ、ブタ、ヒツジ、ヤギ、イヌ、ネコなどであってもよい。対象は、前立腺癌、乳癌、卵巣癌、または子宮内膜癌などの癌を有することが疑われるものであってもよく、該癌を有する危険性があるものであってもよく、ざ瘡、多毛症、脱毛症、良性前立腺肥大症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、または加齢性黄斑変性症を有することが疑われるものであってもよく、それを有する危険性があるものであってもよい。前立腺癌、乳癌、卵巣癌、または子宮内膜癌などの種々の癌の診断法、およびざ瘡、多毛症、脱毛症、良性前立腺肥大症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、または加齢性黄斑変性症の診断法、ならびに前立腺癌、乳癌、卵巣癌、または子宮内膜癌などの癌を臨床的に線引きすること(clinical delineation)、ざ瘡、多毛症、脱毛症、良性前立腺肥大症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、または加齢性黄斑変性症を診断し、臨床的に線引きすること(clinical delineation)は、当業者に知られている。
【0165】
本明細書中に記載した化合物は、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症の治療に使用することができる。本明細書中に記載した化合物は、前立腺癌の治療に使用することができる。本明細書中に記載した化合物は、アンドロゲン非依存性前立腺癌の治療に使用することができる。本明細書中に記載した化合物は、アンドロゲン依存性前立腺癌の治療に使用することができる。本明細書中に記載した化合物は、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症の治療用の医薬の製造に使用することができる。本明細書中に記載した化合物は、前立腺癌の治療用の医薬の製造に使用することができる。本明細書中に記載した化合物は、アンドロゲン非依存性前立腺癌の治療用の医薬の製造に使用することができる。本明細書中に記載した化合物は、アンドロゲン依存性前立腺癌の治療用の医薬の製造に使用することができる。本明細書中に記載した化合物は、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症の治療方法に使用することができる。該方法は、それを必要とする対象に、有効量の本明細書中に記載した化合物を投与することを含むことができる。本明細書中に記載した化合物は、前立腺癌の治療方法に使用することができ、該方法は、それを必要とする対象に、有効量の本明細書中に記載した化合物を投与することを含む。本明細書中に記載した化合物は、アンドロゲン非依存性前立腺癌の治療方法に使用することができ、該方法は、それを必要とする対象に、有効量の本明細書中に記載した化合物を投与することを含む。本明細書中に記載した化合物は、アンドロゲン依存性前立腺癌の治療方法に使用することができ、該方法はそれを必要とする対象に、有効量の本明細書中に記載した化合物を投与することを含む。
【0166】
本明細書中に記載した化合物はまた、アッセイにおいて、および研究目的で、使用することもできる。ARのリガンド非依存性の活性化は、例えば、ホルスコリン(forskolin)(FSK)を用いるcAMP依存性プロテインキナーゼ(PKA)経路の刺激作用による、アンドロゲン(リガンド)の非存在下でのARのトランス活性化を指す。本発明の化合物および組成物には、ARE-ルシフェラーゼ(ARE-luciferase)(ARE-luc)のFSKによる誘発およびアンドロゲン(例えばR1881)による誘発の双方を阻害し得るものもある。かかる化合物は、ARのリガンド依存性活性化およびリガンド非依存性活性化の双方に共通する機構を妨害し得る。このことは、熱ショックタンパク質の解離、不可欠な翻訳後修飾(例えば、アセチル化、リン酸化)、核移行、タンパク質-タンパク質相互作用、転写複合体の形成、コリプレッサーの放出、および/または分解の増大を含めた、ARの活性化におけるどのような段階にも関係し得る。本発明の化合物および組成物には、R1881のみを阻害し得、リガンド依存性活性化に特異的な機構(例えば、リガンド結合領域(LBD)のアンドロゲンへの接近可能性)を妨害し得るものもある。前立腺癌に加えて多数の疾患がアンドロゲン軸(androgen axis)に関係しており(例えば、ざ瘡、多毛症、脱毛症、良性前立腺肥大症)、この機構を妨害する化合物は、かかる病気を治療するために使用することができる。本発明の化合物および組成物には、FSKによる誘発を阻害し得るに過ぎず、ARのリガンド非依存性活性化に対する特異的な阻害剤であり得るものもある。これらの化合物および組成物は、FSKおよび/またはPKAの活動について通常起こる現象のカスケードを妨害し得、またARに対して役割を果たし得るどのような下流効果(例えばFSKは、ARの活性に強力な影響を有する、MAPK活性を増大させる)をも妨害し得る。例としては、cAMPおよびまたはPKAもしくは他のキナーゼの阻害剤を挙げることができる。本発明の化合物および組成物には、ARの基底レベルの活性(アンドロゲンなし、またはPKA経路の刺激作用)を誘発し得るものもある。本発明の化合物および組成物には、R1881またはFSKによる誘発を増大させ得るものもある。かかる化合物および組成物は、ARの転写またはトランス活性化を刺激し得る。本発明の化合物および組成物には、アンドロゲン受容体のN末端領域(ARのNTD)の活性を阻害し得るものもある。インターロイキン6(IL-6)もまた、LNCaP細胞におけるARのリガンド非依存性活性化を引き起こし、FSKに加えて使用され得る。本発明の化合物および組成物は、ARのNTDと相互作用することができ、またARのNTDのトランス活性化に必要な別のタンパク質と相互作用することができる。
【0167】
本発明において使用する化合物は、医薬の供給源(medical sources)から入手してもよく、天然に存在する化合物から公知の方法を用いて修飾してもよい。また、本発明の化合物の製造方法または合成方法は、公知の化学合成の原理を参照する当業者によって理解される。例えば、Willardら, J. Org. Chem., 1984, 49, 3489〜3493、およびBrantleyら, Organic Letters, 1999, 第1巻, 13号, 2165〜2167は、式A〜Eの化合物の製造のために考慮して適切に適合し得る、適切な合成手順を記載している。
【0168】
式A〜Eの化合物の化学的製造の一般的な方法を、以下の非限定的な例示的なスキームに記載する。
【0169】
【化42】

【0170】
式A〜Eの化合物はまた、以下の非限定的な例示的なスキームに記載される化学的方法によって製造することもできる。
【0171】
【化43−1】

【0172】
【化43−2】

【0173】
上記のスキームにおいて、R25、R26およびR27は、本明細書中のいずれかの箇所で定義した通りである。
【0174】
式A〜Eの化合物の化学的製造の一般的な方法を、非ハロゲン化ロイシン側鎖を例として用いて、以下の例示的な非限定的なスキームにも記載する。
【0175】
【化44】

【0176】
ハロゲン化型を提供する方法は、Brantley, S.ら, (1999) Organic Letters 1:2165〜67に記載されたトリクロロメチル置換基を与える手順を含めた当該技術から適したものとすることができる。
【0177】
別の実施態様によれば、式(K):
【0178】
【化45】

【0179】
[式中、R25は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、COOR’、CONH2、CONHR’、CONR’2、R’、OH、OR’、F、Cl、Br、I、NH2、NHR’、NR’2、CN、SH、SR’、SO3H、SO3R’、SO2R’、OSO3R’、およびNO2のうちの1個以上から選択することができ、式中R’は、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;R26は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、CONH2、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;R27は、任意に置換されたBu、Pr、Et、またはMeとすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができる]
の化合物の製造方法が提供される。
【0180】
1つの実施態様において、R25は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R’、OH、OR’、F、Cl、Br、I、NH2、NHR’、NR’2、CN、SH、SR’、SO3H、SO3R’、SO2R’、OSO3R’、およびNO2のうちの1個以上から選択することができ、式中R’は、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができる。別の実施態様において、R25は、H、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、およびNO2のうちの1個以上から選択することができる。あるいはR25は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択することができる。1つの実施態様において、例えば、限定されないが、R25は、本明細書中のいずれかの箇所に記載したR2と同じ定義であってよい。
【0181】
1つの実施態様において、R26は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができる。あるいはR26は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択することができる。1つの実施態様において、例えば、限定されないが、R26は、本明細書中のいずれかの箇所に記載したR5と同じ定義であってよい。
【0182】
1つの実施態様において、R27は、任意に置換されたBu、Pr、Et、またはMeとすることができ、その任意の置換基は、オキソ、OH、F、Cl、Br、およびIのうちの1個以上から選択することができる。あるいはR27は、任意に置換されたBu、Pr、Et、またはMeとすることができ、その任意の置換基は、F、Cl、Br、およびIのうちの1個以上から選択することができる。1つの実施態様において、例えば、限定されないが、R27は、本明細書中のいずれかの箇所に記載したZと同じ定義であってよい。
【0183】
1つの実施態様によれば、該方法は、例えば、限定されないが、
式(Q):
【0184】
【化46】

【0185】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物をn-BuLiと混合して、混合物を形成すること、および該混合物を式(S):
【0186】
【化47】

【0187】
(式中R26は上記のいずれかの箇所に定義した通りであり、Protは保護基である)の化合物と反応させて、式(T):
【0188】
【化48】

【0189】
(式中R25およびR26は上記のいずれかの箇所に定義した通りであり、Protは保護基である)の化合物を形成すること;
式(T)の化合物を脱保護して、式(U):
【0190】
【化49】

【0191】
(式中R25およびR26は上記のいずれかの箇所に定義した通りである)の化合物を形成すること;ならびに
式(U)の化合物をピリジン中で式(V):
【0192】
【化50】

【0193】
(式中R27は上記のいずれかの箇所に定義した通りである)の化合物と反応させて、式(K)の化合物を形成すること
を含むことができる。
【0194】
1つの実施態様によれば、式(Q)の化合物は、例えば、限定されないが、溶媒中でn-BuLiと混合することができる。溶媒は、特に限定されず、適切な溶媒は、当業者によって理解され、特定され得る。1つの実施態様において、溶媒は、例えば、限定されないが、非プロトン性溶媒とすることができる。1つの実施態様において、溶媒は、例えば、限定されないが、ジエチルエーテル、ジメチルホルムアミド(DMF)、またはテトラヒドロフラン(THF)とすることができる。1つの実施態様において、溶媒は、例えば、限定されないが、THFとすることができる。式(Q)の化合物をn-BuLiと混合するのに適した温度は、当業者によって理解され、特定され得る。1つの実施態様において、式(Q)の化合物は、例えば、限定されないが、-50℃などの、例えば、限定されないが、約-50℃以下であって、この範囲内の任意の特定の数値を含めた温度で、n-BuLiと混合することができる。1つの実施態様において、混合温度は、例えば、-50℃とすることができる。
【0195】
別の実施態様によれば、その混合物は、例えば、限定されないが、溶媒中で、式(S)の化合物と反応させることができる。溶媒は、特に限定されず、適切な溶媒は、当業者によって理解され、特定され得る。1つの実施態様において、溶媒は、例えば、限定されないが、非プロトン性溶媒とすることができる。1つの実施態様において、溶媒は、例えば、限定されないが、ジエチルエーテル、ジメチルホルムアミド(DMF)、またはテトラヒドロフラン(THF)とすることができる。1つの実施態様において、溶媒は、例えば、限定されないが、THFとすることができる。
【0196】
式(S)の化合物および式(T)の化合物の保護基Protは、特に限定されず、適切なアミン保護基は、当業者によって理解され、特定され得る。1つの実施態様において、保護基は、例えば、限定されないが、tert-ブチルオキシカルボニル(Boc)基、またはカルボベンジルオキシ(Cbz)基とすることができる。1つの実施態様において、保護基は、例えば、限定されないが、Bocとすることができる。
【0197】
式(T)の化合物から保護基Protを脱保護するか、または除去する適切な方法は、当業者によって理解され、特定され得る。1つの実施態様において、式(T)の化合物は、例えば、限定されないが、強酸を用いて脱保護することができる。1つの実施態様において、式(T)の化合物は、例えば、限定されないが、トリフルオロ酢酸(TFA)を用いて脱保護することができる。1つの実施態様において、式(T)の化合物の脱保護は、例えば、限定されないが、溶媒中で行うことができる。1つの実施態様において、溶媒は、例えば、限定されないが、ジクロロメタン(DCM)、DMF、クロロホルム、またはTHFとすることができる。1つの実施態様において、溶媒は、例えば、限定されないが、DCMとすることができる。
【0198】
式(U)の化合物と式(V)の化合物との適切な反応温度は、当業者によって理解され、特定され得る。1つの実施態様において、式(U)の化合物は、式(V)の化合物と、例えば、限定されないが、約-20℃以上約100℃まで(約100℃を含み、この範囲内の任意の特定の数値を含む)で反応させることができる。1つの実施態様において、式(U)の化合物は、式(V)の化合物と、例えば、限定されないが、室温で反応させることができる。
【0199】
別の実施態様によれば、式(K)の化合物の製造方法は、例えば、限定されないが、式(R):
【0200】
【化51】

【0201】
(式中R26およびProtは上記のいずれかの箇所に定義した通りである)の化合物を任意の順序で、p-ニトロフェノール、およびカルボジイミド含有化合物と混合して、式(S):
【0202】
【化52】

【0203】
(式中R26およびProtは上記のいずれかの箇所に定義した通りである)の化合物を形成することをさらに含むことができる。式(R)の化合物、p-ニトロフェノール、およびカルボジイミド含有化合物は、例えば、限定されないが、任意の順序で混合することができる。1つの実施態様において、例えば、限定されないが、式(R)の化合物は、p-ニトロフェノールと混合してから、カルボジイミド含有化合物と混合することができる。1つの実施態様において、例えば、限定されないが、式(R)の化合物は、カルボジイミド含有化合物と混合してから、p-ニトロフェノールを混合することができる。1つの実施態様において、例えば、限定されないが、式(R)の化合物、p-ニトロフェノール、およびカルボジイミド含有化合物は、同時に混合することができる。1つの実施態様において、式(S)の化合物は、例えば、限定されないが、溶媒中で形成することができる。適切な溶媒は、当業者によって理解され、特定され得る。1つの実施態様において、式(S)の化合物は、例えば、限定されないが、DMF、THF、ジアルキルエーテル溶媒、またはハロゲン化溶媒の中で形成することができる。1つの実施態様において、溶媒は、例えば、限定されないが、DMF、DCM、またはTHFであってもよい。1つの実施態様において、溶媒は、例えば、限定されないが、THFであってもよい。式(S)の化合物を形成するための適切な反応温度は、当業者によって理解され、特定され得る。1つの実施態様において、式(S)の化合物を形成するための反応温度は、例えば、限定されないが、約-20℃以上約50℃まで(約50℃を含み、この範囲内の任意の特定の数値を含む)とすることができる。1つの実施態様において、式(S)の化合物を形成するための反応温度は、例えば、限定されないが、5℃であってもよい。1つの実施態様において、カルボジイミド含有化合物は、例えば、限定されないが、ジシクロヘキシルカルボジイミド(DCC)またはジイソプロピルカルボジイミド(DIPC)であってもよい。1つの実施態様において、カルボジイミド含有化合物は、例えば、限定されないが、DCCであってもよい。
【0204】
別の実施態様によれば、式(K)の化合物の製造方法は、例えば、限定されないが、式(P):
【0205】
【化53】

【0206】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を、MeOH中でヒドラジン一水和物と反応させて、式(Q):
【0207】
【化54】

【0208】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を形成することをさらに含むことができる。
【0209】
別の実施態様によれば、式(K)の化合物の製造方法は、例えば、限定されないが、式(O):
【0210】
【化55】

【0211】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を、触媒としての濃H2SO4の存在下で、MeOH中、オルトギ酸トリメチルと反応させて、式(P):
【0212】
【化56】

【0213】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を形成することをさらに含むことができる。1つの実施態様において、MeOHは、例えば、限定されないが、無水MeOHであってもよい。
【0214】
別の実施態様によれば、式(K)の化合物の製造方法は、例えば、限定されないが、
式(M):
【0215】
【化57】

【0216】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を、塩素化剤と反応させて、式(N):
【0217】
【化58】

【0218】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を形成すること;および
式(N)の化合物を、マロン酸モノエチルとアルキルリチウム化合物とを混合することによって形成された懸濁液と反応させて、式(O):
【0219】
【化59】

【0220】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を形成すること
をさらに含むことができる。1つの実施態様において、塩素化剤は、例えば、限定されないが、SOCl2、塩化オキサリル、または三塩化リン(PCl3)であってもよい。1つの実施態様において、塩素化剤は、例えば、限定されないが、SOCl2であってもよい。1つの実施態様において、式(M)の化合物は、例えば、限定されないが、溶媒中で塩素化剤と反応させることができる。適切な溶媒は、当業者によって理解され、特定され得る。1つの実施態様において、溶媒は、例えば、限定されないが、DCM、THF、DMF、クロロホルム、またはジエチルエーテルであってもよい。1つの実施態様において、溶媒は、例えば、限定されないが、DCMであってもよい。1つの実施態様において、懸濁液は、例えば、限定されないが、溶媒中でマロン酸モノエチルをアルキルリチウム化合物と混合することによって形成することができる。1つの実施態様において、アルキルリチウム化合物は、例えば、限定されないが、エチルリチウム、プロピルリチウム、ペンチルリチウム、フェニルリチウム、またはブチルリチウム(n-BuLi)であってもよい。1つの実施態様において、アルキルリチウム化合物は、例えば、限定されないが、n-BuLiであってもよい。式(N)の化合物と懸濁液との適切な反応温度は、当業者によって理解され、また特定され得る。1つの実施態様において、式(N)の化合物は、例えば、限定されないが、約-50℃以下であって、この範囲内の任意の特定の温度を含めた温度で、懸濁液と反応させることができる。1つの実施態様において、式(N)の化合物は、例えば、限定されないが、約-78℃の温度で懸濁液と反応させることができる。
【0221】
別の実施態様によれば、式(K)の化合物の製造方法は、例えば、限定されないが、式(L):
【0222】
【化60】

【0223】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を、Na2CO3およびH2Oの存在下、約室温で、N-カルボエトキシフタルイミドと反応させて、式(M):
【0224】
【化61】

【0225】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を形成することをさらに含むことができる。
【0226】
いくつかの実施態様において、式(L)、(M)、(N)、(O)、(P)、(Q)、(R)、(S)、(T)または(U)(式中、R25、R26およびR27は、上記のいずれかの箇所に定義した通りである)の化合物がさらに提供される。いくつかの実施態様において、例えば、限定されないが、R25およびR26は独立して、ロイシンの一塩素化メチル側鎖、二塩素化メチル側鎖、または三塩素化メチル側鎖とすることができる。
【0227】
本発明の種々の別の実施態様および実施例を本明細書中に記載する。これらの実施態様および実施例は、説明的なものであり、本発明の範囲を限定するものと解釈するべきではない。
【実施例】
【0228】
全般的方法
細胞株、アンドロゲンおよびレポーター
LNCaP細胞は、高分化ヒト前立腺癌細胞(FSKによるARのリガンド非依存性活性化は該細胞中で特徴づけられた;Nazarethら 1996 J. Biol. Chem. 271, 19900〜19907; およびSadar 1999 J. Biol. Chem. 274, 7777〜7783)であるため、すべての実験について、最初にLNCaP細胞を使用した。LNCaP細胞は、内在性ARを発現し、前立腺特異抗原(prostate-specific antigen)(PSA)を分泌する(Horoszewiczら 1983 Cancer Res. 43, 1809〜1818)。LNCaP細胞は、細胞培養液中での単層としてか、または去勢された宿主においてアンドロゲン非依存性に発展する、はっきり特徴づけられた異種移植モデルにおける腫瘍としてか、のいずれかで成長させることができる(Satoら 1996 J. Steroid Biochem. Mol. Biol. 58, 139〜146; Gleaveら 1991 Cancer Res. 51, 3753〜3761; Satoら 1997 Cancer Res. 57, 1584〜1589; およびSadarら 2002 Mol. Cancer Ther. 1(8), 629〜637)。PC3ヒト前立腺癌細胞は機能的なARを発現しないため(Kaighnら1978 Natl. Cancer Inst. Monogr. 49, 17〜21)、該細胞をARに対する化合物の特異性を調べるために使用した。ARのNTDを特異的に標的とする小分子は、PC3細胞に対して効果を有しないはずである。このことは、小分子がその阻害効果をARが媒介することを特異的に阻止する場合、小分子はPC3細胞の増殖を変化させないはずであるということを意味する。R1881は安定であり、不安定な生理学的リガンドのジヒドロテストステロン(dihydrotestosterone)(DHT)と関連する諸問題を免れているため、R1881を使用した。いくつかの選択的なレポーター遺伝子コンストラクトを用いて、レポーターの特異性を判定することができる。広範に使用されている、特徴のはっきりしたAREによって駆動されるレポーター遺伝子コンストラクトには、いくつかのAREを含み、アンドロゲンおよびFSKによって高度に誘発されるPSA(6.1 kb)エンハンサー(enhance)/プロモーター(Uedaら 2002 A J. Biol. Chem. 277, 7076〜7085)、ならびにARR3-チミジンキナーゼ(tk)-ルシフェラーゼ(ARR3-thymidine kinase (tk)-luciferase)があり、該ARR3-チミジンキナーゼ(tk)-ルシフェラーゼは、ルシフェラーゼレポーターの上流にラットプロバシンのARE1領域およびARE2領域の3つの縦列反復を含む人工的なレポーターコンストラクトである(Snoekら 1996 J. Steroid Biochem. Mol. Biol. 59, 243〜250)。CMV-luc(AREがなく、構成的に活性である)を使用して、化合物は転写に対する普遍的な阻害効果は有していないと判定した。
【0229】
動物モデル
一部の実験では、SCIDマウスを使用した。ヒトの細胞株および移植性腫瘍は、免疫無防備状態の動物において生存し、SCIDマウスが最良の生着率(take rates)を示すため、SCIDマウスを選択した。すべての手順は、ブリティッシュコロンビア大学動物倫理委員会(University of British Columbia Committee for Animal Ethics)によって認可されており、毎年再審査されている。適切な動物保護を提供することができない緊急事態の場合、獣医または動物管理チーム(Animal Care Team)の裁量により動物を安楽死させる。獣医が検査および診察を担当する。署名された動物管理認可証(Animal Care Certificate)には、明確に「動物管理委員会(Animal Care Committee)は、上記実験計画または教育課程のために動物を使用することを検討および認可しており、関連する動物は、カナダ動物管理協会(Canadian Council on Animal Care)によって発行された実験動物の管理−カナダの指針(Care of Experimental Animals − A Guide for Canada)に含まれる原則に従って保護されることを保証している」と記載されている。
【0230】
皮下異種移植
LNCaPまたはPC3のヒト前立腺癌細胞(1×106個の細胞)の懸濁液150 μlを、6〜8週齢のオスの胸腺欠損SCIDマウスに、27ゲージの針によって、側腹部領域において、皮下接種した。接種は、動物がイソフルラン(isofluorane)麻酔にかかっている間に行った。腫瘍生着率(tumor take rate)はおよそ75%である。100 mm3の腫瘍を有する各マウスを無作為に治療群に割り当てた。去勢を以下に記載する通りに行った。触知可能となったか、または目に見えかつ少なくとも40 mm3となったLNCaP皮下腫瘍を有するマウスにおいて、腫瘍容積(式:L×W×H×0.5236)を測定した。動物を毎日モニターし、腫瘍を5日ごとに測定した。
【0231】
実験期間
腫瘍容積の評価(1000 mm3を超えない)を皮下異種移植実験の終了を決定する基準とした。
【0232】
組織学的検査(histology)および免疫組織化学的検査(immunohistochemistry)
ルーチン的な組織学的検査のために、実験完了時に主要な器官および異種移植片を収集し、10%の中性の緩衝化されたホルマリン中で固定し、次いでパラフィンで包埋した。固定した切片を切断し、ヘマトキシリン・エオシン染色(H&E)により染色した。異種移植片における増殖速度およびアポトーシスに対する化合物の可能な効果を特定するために、Ki-67での免疫染色およびTUNELアッセイを行った。Ki-67での免疫染色では、処理した組織切片に対して、0.5 μg/ml(1:50)のIgG濃度のMIB-1モノクローナル抗体を用いた。ARの濃度を免疫組織化学的検査またはウエスタンブロット解析によって測定した。
【0233】
進行を誘発するためのアンドロゲン除去
去勢によってアンドロゲン除去を完全なものにした。イソフルラン麻酔下で、5 mmの垂直の切開術を使用して、精巣が結合している精巣上体脂肪パッドを穏やかに取り除き、身体から精巣を除去した。精巣を血液供給物に結合させている索(cord)を縫合糸を用いて結紮し、次いで切断した。次いで索を腹腔に戻した。外科用縫合糸を使用して、切り口を閉じた。痛みを軽減するために、手術前にブプレノルフィン(0.05 mg/kg)を注射した。
【0234】
異種移植片および器官の回収
すべての異種移植片および主要な器官を解析のために回収した。回収は、CO2ガスによる心拍停止によって屠殺した後に行い、異種移植片または器官を免疫組織化学的検査の解析のために取り出した。
【0235】
安楽死
動物は、CO2ガスによる心拍停止によって屠殺した。この方法は、動物管理委員会(Animal Care Committee)によって定められた方針であり、環境に配慮したものであり、効率的であり、経済的であり、倫理的に認可されている。
【0236】
実施例
実施例1:アッセイに導かれた化合物の分画および単離
2006年6月にインドネシア、カリムンジャワ諸島(Karimunjawa archipelago)のパラウシントク(Palau Sintok)付近(北緯(N)55度02分52秒、東経(E)119度19分48秒)で、約15 mの深さの地点で、スキューバ(SCUBA)を用いて、手によって、ツチイロカイメン属(Dysidea)の種の試料を収集した。この海綿は、アムステルダム大学(University of Amsterdam)のRob van Soest教授によって同定され、証拠試料はアムステルダム動物学博物館(Zoological Museum of Amsterdam)に寄託されている(ZMA POR. 20602)。
【0237】
この新たに収集した灰色の海綿(140 g)を最初にMeOH中で保存し、カナダ、ブリティッシュコロンビア州(British Columbia)のバンクーバー(Vancouver)に、室温で5日間かけて輸送し、その後この試料を凍結させた。該海綿を小片に切断し、繰り返しMeOH(3×200 mL)に浸漬し、引き続いて該MeOHで抽出した。合わせたメタノール抽出物を真空中で濃縮し、次いで得られた油状物をEtOAc(4×5 mL)とH2O(20 mL)との間に分配した。合わせたEtOAc抽出物を蒸発乾固させ、得られた紫色の油状物を、4:1のMeOH/CH2Cl2を溶離液として用いてセファデックス(Sephadex)LH-20でのクロマトグラフィーに付し、ARR3-ルシフェラーゼアッセイにおいて活性を示した画分を得た。この物質を19:1のヘキサン/EtOAcからEtOAcまでの段階的(step)勾配を用いて、シリカゲルフラッシュクロマトグラフィーを用いて、さらに分画した。1:1のヘキサン/EtOAcにより溶出する画分を、13:7のMeCN/H2Oを溶離液として用い、CSC-Inertsil 150A/ODS2、5 μm 25×0.94 cmのカラムを用いて、C18逆相HPLCに付して、5つの画分を得た。最も極性の低い画分は純粋なシントカミドB(2)(4.4 mg)を含んでおり、二番目に極性の高い画分は、純粋なジサミドD(7)(0.2 mg)を含んでいた。最も早く溶出した最も極性の高い画分は、シントカミドC(3)およびシントカミドD(4)の混合物からなるものであった。同じカラムを用いるが、67:33のMeOH/H2Oを溶離液として用いるさらなるHPLC工程により、清浄なシントカミドC(3)(0.4 mg)およびシントカミドD(4)(0.3 mg)を得た。三番目に溶出した画分から、70:30のMeOH/H2Oを溶離液として用いて、さらにHPLCにより分画した後、非常に少量のシントカミドA(1)とともに、シントカミドE(5)(0.5 mg)の純粋な試料を得た。最後の画分から3:1のMeOH/H2Oを用いてシントカミドA(1)(29.6 mg)を得た。公知のジケトピペラジンであるジサミドA(6)およびB(7)もまた単離した。
【0238】
ナトリウム光(589 nm)を用いたJasco P-1010旋光計(Polarimeter)を用いて、旋光度を測定した。Waters 2487 Dual λ吸光度検出器(Absorbance Detector)を用いてUVスペクトルを記録した。5 mmのCPTCIクライオプローブを用いて、Bruker AV-600分光計で、1H NMRスペクトルおよび13C NMRスペクトルを記録した。1Hの化学シフトは残存するC6D6シグナル(δ 7.15 ppm)を基準としており、13Cの化学シフトは、該C6D6溶媒ピーク(δ 128.0 ppm)を基準としている。Bruker-Hewlett Packard 1100 Esquire-LCシステム質量分析計で低分解能ESI-QIT-MSを記録した。Merckの5554型シリカゲルプレートおよびWhatman MKC18Fプレートを分析用の薄層クロマトグラフィーに使用した。逆相HPLCによる精製は、Waters 996フォトダイオードアレイ検出器(Photodiode Array Detector)に結合したWaters 600E System Controllerによる液体クロマトグラフィーで行った。HPLCに用いたすべての溶媒は、Fisher HPLCグレードのものであった。(6)および(7)の構造は、これらの分光学的データと文献値(Su, J.-Y.ら (1993) J. Nat. Prod. 56:637〜642)とを比較することによって立証した。シントカミドA(1)は、MeOHからX線回折分析に適した結晶を与えた。ORTEP図によりNMR分析からの組成を立証し、絶対配置2S、4S、10R、16Sを明らかにした。シントカミドB(2)〜E(5)の構造は、シントカミドA(1)とMe18またはMe19での塩素化の程度が異なっている。
【0239】
【化62】

【0240】
シントカミドA(1):透明な油状物として単離した;[α]25D +35.9°(c 19.73、CH2Cl2);UV(CH2Cl2)λmax 224、242 nm;1H 表1参照;13Cおよび15N NMR 表2参照;陽イオンHRESIMS [M+Na]+ m/z 531.0145(C18H25N2O4Cl5Naについての計算値は531.0154)。
シントカミドB(2):透明な油状物として単離した;[α]25D +35.0°(c 2.93、CH2Cl2);UV(CH2Cl2)λmax 224、242 nm;1H 表1参照;13Cおよび15N NMR 表2参照;陽イオンHRESIMS [M+Na]+ m/z 564.9738(C18H24N2O4Cl6Naについての計算値は564.9765)。
シントカミドC(3):透明な油状物として単離した;[α]25D +58.7°(c 0.26、CH2Cl2);UV(CH2Cl2)λmax 224、242 nm;1H 表1参照;13Cおよび15N NMR 表2参照;陽イオンHRESIMS [M+Na]+ m/z 497.0532(C18H26N2O4Cl4Naについての計算値は497.0544)。
シントカミドD(4):透明な油状物として単離した;[α]25D +42.0°(c 0.20、CH2Cl2);UV(CH2Cl2)λmax 224、242 nm;1H 表1参照;13Cおよび15N NMR 表2参照;陽イオンHRESIMS [M+Na]+ m/z 497.0532(C18H26N2O4Cl4Naについての計算値は497.0544)。
シントカミドE(5):透明な油状物として単離した;[α]25D +47.6°(c 0.33、CH2Cl2);UV(CH2Cl2)λmax 224、242 nm;1H 表1参照;13Cおよび15N NMR 表2参照;陽イオンHRESIMS [M+Na]+ m/z 463.0931(C18H27N2O4Cl3Naについての計算値は463.0934)。
【0241】
【表1−1】

【0242】
【表1−2】

【0243】
【表2−1】

【0244】
【表2−2】

【0245】
実施例2:N-((R)-1-((S)-2-イソブチル-3-メトキシ-5-オキソ-2,5-ジヒドロ-1H-ピロール-1-イル)-4-メチル-1-オキソペンタン-2-イル)プロピオンアミドの合成
N-フタルイミド-L-ロイシン(1)
【0246】
【化63】

【0247】
L-ロイシン(5.12 g、39.1 mmol)およびNa2CO3(4.14 g、39.1 mmol)を40 mLの蒸留したH2Oに溶解した。この溶液にN-カルボエトキシ-フタルイミド(phathalimide)(8.55 g、39.1 mmol)を加え、次いで室温で2時間攪拌した。得られた透明な溶液を、6 N HClを用いてpH=0まで酸性化し、次いでヘキサン(3×100 mL)で抽出した。合わせた有機層を真空中で乾燥させた。シリカゲルでのカラムクロマトグラフィーを用い、ヘキサン/アセトン(3:1)で溶出させて、N-フタルイミド-L-ロイシン(1)(10.2 g、39.1 mmol、定量的)を無色の油状物として得た。1H NMR (400 MHz, CDCl3) δ 0.92 (d, J=6.70 Hz, 3 H), 0.94 (d, J=6.70 Hz, 3 H), 1.37 - 1.60 (m, 1 H), 1.95 (ddd, J=14.31, 10.05, 4.26 Hz, 1 H), 2.36 (ddd, J=14.31, 10.05, 4.26 Hz, 1 H), 4.99 (dd, J=11.57, 4.26 Hz, 1 H), 7.73 (dd, J=5.48, 3.05 Hz, 2 H), 7.85 (dd, J=5.48, 3.05 Hz, 2 H), 11.32 (br. s., 1 H); 13C NMR (75 MHz, CDCl3) δ: 21.2, 23.3, 25.3, 37.2, 50.6, 123.8, 131.9, 134.4, 167.9, 176.0。
【0248】
(S)-6-メチル-4-フタルイミド-3-オキソヘプタン酸エチル(3)
N-フタルイミド-L-ロイシン(1)(550 mg、2.11 mmol)を含む4 mLの乾燥DCMを、SOCl2(1.5 mL、20.5 mmol)とともに5時間還流した。過剰のSOCl2および溶媒を減圧下で蒸発させて、N-フタルイミド-L-ロイシニルクロリド(leucinyl chloride)(2)(535 mg、1.91 mmol、90%)を黄色油状物として生成させ、該生成物をさらに精製することなく使用した。マロン酸モノエチル(450 mg、3.41 mmol)を含む5 mLの乾燥THFに、-70℃でn-BuLi(3.7 mL、ヘキサン中2.0 M、7.4 mmol)を滴下して白色の懸濁液を得、これを-5℃まで穏やかに温め、次いで-78℃まで戻るように冷却した。酸塩化物(2)(535 mg、1.91 mmol)の溶解した2 mLの乾燥THFを、この懸濁液に、一度ですべて加え、この溶液をさらに20分間攪拌し、次いで7 mLの1 N HClと10 mLのエーテルとの溶液の中に注ぎ、5分間攪拌を続ける。この混合物を分離し、水層をエーテル(2×10 mL)で抽出した。合わせた有機層を飽和NaHCO3(3×10 mL)で洗浄した。無水MgSO4で乾燥させた後、エーテル相を真空中で蒸発させて、赤色の油状物を得た。この粗製物をシリカゲルでのクロマトグラフィー(ヘキサン/アセトン=93:7)に付して、同族の(homologous)1,3-ジケトンエステル(3)(336 mg、1.01 mmol、53%)を黄色油状物として得た。1H NMR (300 MHz, CDCl3) δ:0.93 (d, J=7.08 Hz, 3 H), 0.95 (d, J=7.08 Hz, 3 H), 1.23 (t, J=7.08 Hz, 3 H), 1.37 - 1.57 (m, 1 H), 1.91 (ddd, J=14.16, 10.05, 4.11 Hz, 1 H), 2.24 (ddd, J=14.16, 10.05, 4.11 Hz, 1 H), 3.52 (s, 2 H), 4.14 (q, J=7.08 Hz, 2 H), 5.00 (dd, J=11.31, 4.23 Hz, 1 H), 7.76 (dd, J=5.60, 3.08 Hz, 2 H), 7.88 (dd, J=5.60, 3.08 Hz, 2 H); 13C NMR (75 MHz, CDCl3) δ: 14.2, 21.3, 23.5, 25.3, 36.5, 46.5, 57.7, 61.9, 123.8, 131.9, 134.6, 166.6, 168.0, 198.3。
【0249】
(S,E)-3-メトキシ-6-メチル-4-フタルイミド-ヘプタ-2-エン酸メチル(4)
1,3-ジケトンエチルエステル(3)(186 mg、0.56 mmol)を含む5 mLの無水MeOHを、オルトギ酸トリメチル(2.5 mL、2.24 mmol)とともに、触媒量の濃H2SO4の存在下で12時間還流した。エーテル(80 mL)を加えた後、有機層を飽和NaHCO3(3×10 mL)で洗浄し、無水MgSO4で乾燥させ、次いで真空中で濃縮した。この粗製物を、ヘキサン/アセトン(9:1)を用いて溶出させるシリカゲルでのフラッシュクロマトグラフィーに付し、エステル交換されたE-エノールエーテル生成物(4)(130 mg、0.39 mmol)を70%の収率で黄色油状物として得た。1H NMR (300 MHz, CDCl3) δ: 0.96 (d, J=6.40 Hz, 3 H), 1.00 (d, J=6.62 Hz, 3 H), 1.49 - 1.60 (m, 1 H), 1.67 (ddd, J=13.19, 11.48, 3.88 Hz, 1 H), 2.66 (ddd, J=13.19, 11.48, 3.88 Hz, 1 H), 3.63 (s, 3 H), 3.74 (s, 3 H), 5.05 (s, 1 H), 6.33 (dd, J=11.42, 4.80 Hz, 1 H), 7.71 (dd, J=5.48, 2.97 Hz, 2 H), 7.83 (dd, J=5.48, 2.97 Hz, 2 H); 13C NMR (100 MHz, CDCl3) δ: 21.2, 23.4, 25.6, 38.3, 50.2, 51.4, 56.3, 91.2, 123.4, 132.2, 134.0, 167.0, 168.7, 172.3。
【0250】
(S)-5-イソブチル-4-メトキシ-1H-ピロール-2(5H)-オン(5)
【0251】
【化64】

【0252】
エノールエーテル(4)(53 mg、0.16 mmol)を含むMeOHを、過剰のヒドラジン一水和物(2 mL)とともに一晩還流した。溶媒を除去した後、残渣を50 mLのDCMに溶解し、40 mLの蒸留水を加えた。有機相を分離し、水層をDCM(3×40 mL)で抽出した。合わせた有機層を無水Na2SO4上でろ過し、次いで真空中で濃縮した。溶離液(elute)としてDCM/MeOH(200:1)を用いて、シリカゲルでのフラッシュクロマトグラフィーを用いて、テトラム酸(tetramic acid)(5)(15 mg、0.088 mmol)を55%の収率で白色固体として得た。1H NMR (400 MHz, CDCl3) δ: 0.95 (d, J=2.05 Hz, 3 H), 0.97 (d, J=2.05 Hz, 3 H), 1.38 (td, J=9.22, 4.78 Hz, 1 H), 1.64 (td, J=9.22, 4.78 Hz, 1 H), 1.70 - 1.83 (m, 1 H), 3.79 (s, 3 H), 4.06 (dd, J=9.56, 3.41 Hz, 1 H), 5.00 (d, J=1.02 Hz, 1 H), 6.24 (br. s., 1 H); 13C NMR (100 MHz, CDCl3) δ: 22.0, 23.6, 25.6, 41.6, 56.2, 58.4, 93.3, 174.5, 179.2; ESIMS [M+H]+ 170.2。
【0253】
(R)-2-(tert-ブトキシカルボニルアミノ)-4-メチルペンタン酸4-ニトロフェニル(6)
【0254】
【化65】

【0255】
Boc-D-ロイシン(462 mg、2.0 mmol)を含む5 mLの乾燥THFをp-ニトロフェノール(294 mg、2.1 mmol)に加え、次いでこの混合物を、5℃でDCC(413 mg、2.0 mmol)で処理し、次いで室温で一晩攪拌した。この溶液をろ過し、次いで真空中で乾燥させた。この粗製物をシリカゲルでのクロマトグラフィー(ヘキサン/アセトン=3:2)に付し、Boc-D-Leu-ONp(6)(420 mg、1.2 mmol)を60%の収率で無色の油状物として得た。1H NMR (400 MHz, CDCl3) δ: 1.02 (d, J=2.05 Hz, 3 H), 1.04 (d, J=2.05 Hz, 3 H), 1.47 (s, 9 H), 1.61 - 1.71 (m, 1 H), 1.75 - 1.86 (m, 2 H), 4.52 (br. s., 1 H), 4.94 (d, J=6.14 Hz, 1 H), 7.31 (d, J=9.22 Hz, 2 H), 8.28 (d, J=9.22 Hz, 2 H); 13C NMR (100 MHz, CDCl3) δ: 21.9, 23.0, 25.1, 28.5, 41.3, 52.7, 80.6, 122.5, 125.4, 145.6, 155.5, 155.7, 171.6。
【0256】
(R)-1-((S)-2-イソブチル-3-メトキシ-5-オキソ-2,5-ジヒドロ-1H-ピロール-1-イル)-4-メチル-1-オキソペンタン-2-イルカルバミン酸tert-ブチル(7)
【0257】
【化66】

【0258】
テトラム酸(tetramic acid)(5)(11.2 mg、0.066 mmol)を含む2 mLの乾燥THFを、-50℃で10分間n-BuLi(32 μl、1.60 M、0.066 mmol)で処理し、その後Boc-D-Leu-ONp(6)(25.6 mg、0.073 mmol)を含む2 mLの乾燥THFを15分間のうちに滴下した。この混合物をさらに10分間攪拌し、0.1 mLのAcOHを用いてクエンチし、真空中で蒸発させた。シリカゲルでのフラッシュクロマトグラフィー(ヘキサン/酢酸エチル=3:1)の後に、白色粉末として純粋なカップリング生成物(7)(12.0 mg、0.031 mmol)が得られ、収率は47%であった。1H NMR (400 MHz, CDCl3) δ: 0.89 (d, J=5.87 Hz, 3 H), 0.93 (d, J=6.60 Hz, 6 H), 1.04 (d, J=6.36 Hz, 3 H), 1.32 - 1.40 (m, 1 H), 1.46 (s, 9 H), 1.75 - 1.88 (m, 6 H), 4.58 (t, J=5.12 Hz, 1 H), 5.04 (s, 3 H), 5.10 (br.d, J=8.07 Hz, 1 H), 5.45 (td, J=2.93, 1.96 Hz, 1 H)。
【0259】
(S)-1-((R)-2-アミノ-4-メチルペンタノイル)-5-イソブチル-4-メトキシ-1H-ピロール-2(5H)-オン(8)
このBocで保護されたカップリング生成物(7)(5.0 mg、0.013 mmol)を含む1 mLの乾燥DCMに33%のTFAのDCM溶液1 mLを加え、10分間攪拌した。その溶媒を10 mLの25%のアンモニア溶液で中和し、DCM(3×10 mL)を用いて抽出した。有機相を合わせ、無水Na2SO4で乾燥させ、減圧濃縮した。この粗製物をシリカゲルでのフラッシュクロマトグラフィーに付し、DCM/MeOH(98:2)を用いて溶出させて、脱保護した生成物(8)(3.3 mg、0.012 mmol)を95%の収率で白色粉末として得た。1H NMR (400 MHz, CDCl3) δ: 0.90 (d, J=6.43 Hz, 3 H), 0.93 (d, J=2.92 Hz, 3 H), 0.95 (d, J=2.63 Hz, 3 H), 0.98 (d, J=6.72 Hz, 3 H), 1.32 (td, J=8.99, 4.82 Hz, 1 H), 1.54 (ddd, J=13.45, 9.06, 4.38 Hz, 1 H), 1.76 (td, J=13.37, 6.58 Hz, 1 H), 1.83 - 1.92 (m, 2 H), 3.87 (s, 3 H), 4.55 (dd, J=9.50, 4.24 Hz, 1 H), 4.60 (t, J=5.12 Hz, 1 H), 5.05 (s, 1 H); ESIMS [M+H]+ 283.3。
【0260】
N-((R)-1-((S)-2-イソブチル-3-メトキシ-5-オキソ-2,5-ジヒドロ-1H-ピロール-1-イル)-4-メチル-1-オキソペンタン-2-イル)プロピオンアミド(9)
【0261】
【化67】

【0262】
アミノ基がフリーの化合物(8)(1.0 mg、0.0035 mmol)を、プロピオン酸無水物(propionyl anhydride)(1.4 μl、0.011 mmol)を含む2 mLの乾燥ピリジンとともに室温で12時間攪拌した。この溶液を10 mLの1 N HClで酸性化し、酢酸エチル(3×10 mL)中に抽出した。合わせた有機相を無水MgSO4上でろ過し、真空中で蒸発させた。シリカゲルでのフラッシュクロマトグラフィー(ヘキサン/酢酸エチル=3:1)の後、無色の固体として80%の収率でN-プロピオニル化生成物(9)(1.0 mg、0.0029 mmol)を得た。1H NMR (600 MHz, CDCl3) δ: 0.88 (d, J=6.24 Hz, 3 H), 0.92 (d, J=6.60 Hz, 6 H), 1.05 (d, J=6.60 Hz, 3 H), 1.17 (t, J=7.52 Hz, 3 H), 1.40 (dt, J=6.97, 3.67 Hz, 1 H), 1.59 (dt, J=6.97, 3.67 Hz, 1 H), 1.75-1.79 (m, 1H), 1.80-1.83 (m, 3H), 2.25 (q, J=7.70 Hz, 2 H), 3.87 (s, 3 H), 4.57 (dd, J=6.24, 4.03 Hz, 1 H), 5.05 (s, 1 H), 5.75 (ddd, J=10.73, 9.08, 2.93 Hz, 1 H), 6.04 (d, J=8.80 Hz, 1 H); 13C NMR (150 MHz, CDCl3) δ 10.0, 21.4, 22.7, 23.8, 23.9, 24.3, 25.2, 29.9, 39.3, 41.7, 51.6, 58.9, 58.9, 93.6, 169.6, 173.1, 173.3, 181.0。
【0263】
この合成には全部で9段階があり、3.9%の全収率が認められた。
【0264】
実施例3:シントカミドAの生物学的活性
CB3.1を同定するためのスクリーニング(screen)
ハイスループットなスクリーニング(screen)を使用し、アンドロゲン受容体(AR)の活性を阻害する活性化合物を同定した。最初のスクリーニング(screen)は、ARR3-ルシフェラーゼ(luicferase)レポーターを安定に発現するLNCaP細胞を含む(comprising of)、細胞に基づくアッセイである。該アッセイは、合成アンドロゲンR1881を用いて内在性ARを活性化すること、およびルシフェラーゼ活性のレベルを測定すること、から構成されるものである。R1881を細胞に加える1時間前に海綿抽出物を加え、さらに48時間インキュベートしてから、収集し、細胞溶解物におけるルシフェラーゼ活性を測定した。海綿抽出物06-80は、アンドロゲンに誘発されるルシフェラーゼ活性を強く阻害した(図1A)。
【0265】
細胞毒性
この抽出物から、純粋な活性化合物シントカミドA(CB3.1)を単離し、CB3.1の阻害効果は一般的な細胞毒性によるものではないことを保証するために、LNCaP細胞の細胞形態を調べた。図1Bは、48時間CB3.1(10 μM)で処理したLNCaP細胞は、明白な毒性の徴候を有しておらず、ARの活性化に対する阻害効果は、単に一般的な細胞毒性によるものではなかったことを示している。R1881で処理した細胞もまた、細胞数の指標を提供するため、および比較のために、示している。CB3.1は、非特異的な毒性を伴う機構によって、アンドロゲンによって誘発されるルシフェラーゼ活性を減少させてはいなかった。
【0266】
ARのNTDのトランス活性化
CB3.1がARのNTDのトランス活性化を阻止したかを判定するために、AR NTD-Gal4DBDキメラタンパク質およびGal4-ルシフェラーゼレポーターのプラスミドで、LNCaP細胞をトランスフェクションし、CB3.1(5 μg/ml)で1時間前処理してから、ホルスコリン(FSK 50μM)をさらに24時間かけて加えた(Sadarら (1999) J. Biol. Chem. 274:7777〜83を参照)。CB3.1は、FSKによって誘発される、ARのNTDのトランス活性化を、基線レベルにまで減少させ(図3A参照)、ARのNTDのトランス活性化を阻害した。
【0267】
ステロイド受容体特異性
ARと、関連するヒトステロイド受容体(グルココルチコイド受容体(glucocorticoid receptor)(GR)およびプロゲステロン受容体(progesterone receptor)(PR))とのアミノ酸の配列類似性は、DNA結合領域(DBD)などの一部の領域において、相当なものである。ARのNTDは、PRおよびGRと、15%未満の相同性しか共有していないが、これらの受容体は、SRC-1(ステロイド受容体コアクチベーター-1)などの同じタンパク質のいくつかと相互作用する。そのため、レポーター遺伝子アッセイを用いて、ARの活性を阻止する候補化合物がGRおよびPRの転写活性になんらかの効果を有するかを判定した。細胞を、全長のhGRおよびPRβならびに関連するレポーター(すなわちpGR-LucレポーターまたはPRE-E1b-Lucレポーター)の発現プラスミドを用いて、コトランスフェクションした。次いで細胞をエタノール媒体、デキサメタゾン(GR)、4-プレグネン-3,20-ジオン(4-pregnene-3,20 dione)(プロゲステロン)(PR)で処理し、続いてルシフェラーゼ活性を測定した。PSA(6.1)ルシフェラーゼレポーターを用いて測定した場合、CB3.1(5 μg/ml)は、ARの活性を強く阻害したが(図2A参照)、リガンドに応答してPRE-ルシフェラーゼ活性もGRE-ルシフェラーゼ活性も阻害しなかった(図2B〜2C参照)。データは、CB3.1がGRルシフェラーゼレポーターおよびPRルシフェラーゼレポーターの誘発を阻害しなかったため、CB3.1は他のステロイド受容体のトランス活性化を変化させず、転写または翻訳に対する非特異的および一般的な効果を有しないこと、を示している。CB3.1は、ARに対して特異的であると思われ、全身的送達に由来する副作用はほとんどないと予想されることを示唆している。
【0268】
増殖アッセイ
CB3.1は、アンドロゲン(R1881)で処理されたLNCaP細胞の増殖を減少させた。LNCaP細胞を、ビカルタミド(cdx、10 μM、陽性対照)またはCB3.1(5 μg/ml)で1時間前処理してから、0.1 nMのR1881を加えた。3日後にBrdUの取り込みを測定して、アンドロゲンに応答した増殖の変化を示した(図3B参照)。0.1 nMのR1881は、対照(R1881および小分子用の媒体)よりも増殖を増大させた。CB3.1は、アンドロゲンによって誘発される増殖の阻止に有効であった。CB3.1は、ARを発現せず(Kaighnら 1978 Natl. Cancer Inst. Monogr. 49, 17〜21)、したがって成長および生存のためにARに依存しない、PC3ヒト前立腺癌細胞の増殖を、阻止しなかった(図3C参照)。
【0269】
実施例4:シントカミドはLNCaP細胞においてアンドロゲンによって誘発されるPSA mRNA量を抑制する
PSAは、エンハンサー領域およびプロモーター領域に、いくつかのはっきり特徴づけられたアンドロゲン応答エレメント(ARE)を含む、アンドロゲンにより制御される遺伝子である。PSA mRNAの量は、アンドロゲン受容体に依存する機構によって、アンドロゲンによって誘発される。シントカミドがアンドロゲンによって誘発される内在性遺伝子の発現も阻止するかを調べるために、合成アンドロゲンR1881に応答したときのPSA mRNA量を測定した。R1881は、PSA mRNA量を少なくとも3倍誘発し(図4参照)、これは抗アンドロゲン剤のビカルタミドおよび各シントカミドによって阻止することができた。このデータは、シントカミドがアンドロゲン受容体の転写活性を阻止することと合致している。
【0270】
実施例5:PSA(6.1)-ルシフェラーゼのR1881による誘発のシントカミドによる阻害
アンドロゲン応答エレメント(ARE)を含むアンドロゲン応答性レポーターを測定することによって、LNCaPヒト前立腺癌細胞において、内在性ARの活性化を測定した。PSA(6.1 kb)-ルシフェラーゼレポーター遺伝子コンストラクトは、いくつかのはっきり特徴づけられたAREを含み、アンドロゲンによって誘発される。LNCaP細胞を単層として保持し、PSA-ルシフェラーゼでトランスフェクションし、海綿から調製した粗製の抽出物(CB-0)、ならびに精製したシントカミドおよびジサミド(CB3.0(ジサミドA)、CB2.1(シントカミドE)、CB1.1(シントカミドC)、CB3.1(シントカミドA)、およびCB4.0(シントカミドB)、ならびに非塩素化シントカミドをスクリーニングするために使用した。合成アンドロゲンR1881(1 nM)は、PSA-ルシフェラーゼ活性をおよそ6倍誘発した。抗アンドロゲン剤ビカルタミド(BIC)は、この誘発を100%阻止した(図5参照)。不完全に精製した抽出物CB-0は、アンドロゲンによって誘発される活性を強く阻害した。すべての精製したシントカミドおよびジサミドAと同様に、非塩素化シントカミドは幾分活性を有していた。このデータは、シントカミドおよびジサミドがPSAの発現に対して阻害効果を有するという結論は、転写レベルのものであることを支持している。
【0271】
実施例6:シントカミドA(CB3.1)はLNCaP異種移植片の腫瘍増殖を減少させた
皮下異種移植モデルを用いて、インビトロでアンドロゲン受容体の活性化を阻害するシントカミドがこうした腫瘍に対して何らかの効果を有するかどうかを調べた。LNCaP皮下異種移植モデルを用いてCB3.1をインビボで調べた。毒性、ならびにCB3.1が腫瘍増殖およびアンドロゲン非依存性への進行に対して効果を有するかどうか、に関連する情報を提供するために、インビボ実験を行った。LNCaPヒト前立腺癌細胞は、内在性アンドロゲン受容体(AR)および前立腺特異抗原(PSA)を発現し、去勢された宿主においてアンドロゲン非依存性に発展する。LNCaP細胞(106個/ml)を少なくとも8週齢のNOD-SCIDオスマウス群に皮下移植した。細胞を75 μlのマトリゲル(Matrigel)を伴う75 μlのRPMI培地1640(5%のFBS)中に懸濁させ、麻酔下で宿主の側腹部領域に注射した。LNCaP細胞をNOD-SCIDオスマウス群に皮下移植し、腫瘍がおよそ100 mm3(平均値=123.3.1±27.4 mm3;n=18)となったときに動物を去勢し、無作為に2つの群に分けた。去勢の1週間後、動物を30 mg/kg体重の腫瘍内用量のCB3.1、または対等の容積の媒体(対照のDMSO)で3日ごとに処置した。CB3.1は、腫瘍容積の減少を示した(図6参照)。CB3.1の最初の注射の15日後に、腫瘍は1回目の注射の日の腫瘍容積の111.81%±38.12となっていた。一方、DMSOの注射の15日後、腫瘍は1回目の注射の日の腫瘍容積の180.27%±111.67となっていた。血清PSAは予後の指標を提供する。CB3.1を受けた動物について、血清PSAは、1回目の注射の15日後に98.47%±170.51となっていた。DMSOで処置した動物は、1回目の注射の15日後に倍加の血清PSA(すなわち203.73%±315.63)を有していた。腫瘍容積および血清PSAの数値は、媒体で処置した動物と比較して、CB3.1が全身腫瘍組織量および血清PSAを減少させるということと合致していた。実験期間時に動物体重の変化は認められず(開始:24.6±1.1グラム;終了:25.0±1.4グラム)、CB3.1が動物に対して一般的な毒性ではないことが示された。
【0272】
本発明の種々の実施態様を本明細書中に記載しているが、当業者の一般的な通常の知識によって、本発明の範囲内で、多数の改作および改変がなされ得る。かかる改変は、実質的に同じ方法で、同じ結果を達成するために、本発明の任意の態様を公知の均等物で置換することを含む。数値範囲は、その範囲を規定する数値を含む。単語「含む(comprising)」は、本明細書中で、語句「含むが、限定されない(including, but not limited to)」と実質的に同等のオープンエンドの用語として使用されており、単語「含む(comprises)」は、対応する意味を有する。本明細書中で使用される場合、単数形「1つの(a)」、「1つの(an)」、および「その(the)」は、文脈によって明確に別段指示されない限り、複数の指示対象を含む。したがって、例えば、「1つのもの(a thing)」への言及は、1個よりも多くのかかるものを含む。本明細書中での参考文献の引用は、かかる参考文献が本発明に対する先行技術であることを承認するものではない。
【技術分野】
【0001】
(関連出願の相互参照)
本願は、2008年8月22日に出願された「アンドロゲン受容体のN末端の活性化の小分子阻害剤(SMALL MOLECULE INHIBITORS OF N-TERMINUS ACTIVATION OF THE ANDROGEN RECEPTOR)」というタイトルの米国仮特許出願番号第61/136,277号の利益を主張し、その出願はその全体が参照によって本明細書に援用される。
【0002】
(連邦政府による資金提供を受けた研究の記載)
本発明は、米国陸軍医療研究・資材司令部(U.S. Army Medical Research and Materiel Command)によって与えられた認可番号W81XWH-05-1-0058 (PC040768)のもとで、一部政府支援によりなされたものである。米国政府は、本発明において一定の権利を有し得る。
【0003】
(技術分野)
本発明は、治療剤(therapeutics)、その使用、および種々の癌を含めた種々の適応症の治療方法に関する。具体的には、本発明は、すべての病期、ならびにアンドロゲン依存性、アンドロゲン感受性、およびアンドロゲン非依存性(ホルモン抵抗性、去勢抵抗性、アンドロゲン遮断抵抗性、アンドロゲン除去抵抗性、アンドロゲン枯渇非依存性、去勢/再発性(castration-recurrent)、および抗アンドロゲン薬/再発性(anti-androgen-recurrent)ともいう)を含めた、前立腺癌などの癌の治療および治療方法に関する。
【背景技術】
【0004】
(背景)
アンドロゲンは、アンドロゲン受容体(androgen receptor)(AR)を介してその効果をもたらす。アンドロゲンは、広範囲の発育反応および生理学的反応における役割を果たし、男性性分化、精子形成の維持、および男性のゴナドトロピン調節にかかわっている。数系統の証拠が、アンドロゲンが前立腺の発癌の発達と関連していることを示している。まず第一に、アンドロゲンは、げっ歯類モデルにおいて前立腺の発癌を誘発しており、アナボリックステロイドの形態でアンドロゲンを受けた男性は、前立腺癌の発生率が高い。第二に、ヒトまたはイヌが思春期の前に去勢された場合、前立腺癌は発症しない。成人男性を去勢することは、前立腺の退縮および前立腺上皮のアポトーシスをもたらすが、他の男性外性器に対する影響を誘発しない。このアンドロゲンへの依存性は、化学的去勢または去勢手術(アンドロゲン除去)により前立腺癌を治療する、根底にある理論的根拠を提供する。
【0005】
アンドロゲンはまた、女性の癌における役割も果たしている。1つの例は卵巣癌であり、該癌ではアンドロゲンの濃度の上昇が、卵巣癌を発症する危険性の増大と関連している。ARが大多数の卵巣癌で検出されているのに対して、エストロゲン受容体α(Estrogen receptor-alpha)(ERa)およびプロゲステロン受容体は、50%未満の卵巣腫瘍でしか検出されていない。
【0006】
進行性前立腺癌に利用できる唯一の効果的な治療法は、アンドロゲンの除去であり、アンドロゲンは前立腺上皮細胞の生存に不可欠である。アンドロゲン除去療法は、血清前立腺特異抗原(prostate-specific antigen)(PSA)の減少に付随する全身腫瘍組織量の一時的な減少をもたらす。残念ながら前立腺癌は、結局はアンドロゲンの非存在下で再び増殖し得る(アンドロゲン非依存性疾患)。アンドロゲン非依存性疾患は、症状が始まる前に血清前立腺特異抗原(PSA)の力価が増大することを生化学的な特徴とする。該疾患がアンドロゲン非依存性となると、大抵の患者は2年以内に屈する。
【0007】
ARは、カルボキシ末端のリガンド結合領域(ligand-binding domain)(LBD)、2個の亜鉛フィンガーモチーフを含むDNA結合領域(DNA-binding domain)(DBD)、および1個以上の転写活性化領域を含むN末端領域(N-terminus domain)(NTD)を含めた別個の機能領域を有する。ARのLBDにアンドロゲン(リガンド)が結合すると、該受容体が、「通常は」アンドロゲンにより制御される遺伝子(PSAなど)のプロモーター領域およびエンハンサー領域の、アンドロゲン応答エレメント(androgen response element)(ARE)と呼ばれるその特異的なDNAのコンセンサス部位に効率的に結合し得、転写を起こすように、ARが活性化する。ARは、cAMP依存性プロテインキナーゼ(protein kinase)(PKA)経路の刺激作用、インターロイキン6(IL-6)、および種々の成長因子によって、アンドロゲンの非存在下で活性化され得る。ARのリガンド非依存性変態の機構は、1)細胞核の転位を示唆する細胞核のARタンパク質の増大;2)AR/ARE複合体形成の増大;および3)該NTD、を含むことが示されている(Sadar 1999 J. Biol. Chem. 274, 7777〜7783;Uedaら 2002 A J. Biol. Chem. 277, 7076〜7085;およびUedaら 2002 B J. Biol. Chem. 277, 38087〜38094)。ARは、アンドロゲン非依存性疾患において、別のシグナル伝達経路によって、精巣アンドロゲンの非存在下で活性化され得、このことは二次前立腺癌の腫瘍に細胞核のARタンパク質が存在しているという知見(Kimら 2002 Am. J. Pathol. 160, 219〜226;およびvan der Kwastら 1991 Inter. J. Cancer 48, 189〜193)と整合している。
【発明の概要】
【発明が解決しようとする課題】
【0008】
入手可能なAR阻害剤としては、ビカルタミド(カソデックス(Casodex)(登録商標))、ニルタミド、およびフルタミドなどの非ステロイド性抗アンドロゲン剤、ならびにステロイド性抗アンドロゲン剤のシプロテロンアセタートが挙げられる。これらの抗アンドロゲン剤は、ARのLBDを標的とし、おそらく不十分な親和性、およびこうした前述の抗アンドロゲン剤による、ARの活性化を引き起こす変異のために、大部分は機能していない(Taplin, M.E.ら Cancer Res., 59, 2511〜2515 (1999))。
【0009】
従来の治療法は、ARをそのC末端領域を通じてアンドロゲン依存的に活性化することに焦点を合わせている。ARに対するアンタゴニストを開発する最近の研究は、C末端に焦点を合わせており、具体的には、1)アロステリックポケットおよびAF-2活性(Estebanez-Perpinaら 2007, PNAS 104, 16074〜16079);2)非ステロイド性アンタゴニストの同定のためのコンピュータによる「薬物の目的再評価(repurposing)」手順(Bissonら 2007, PNAS 104, 11927〜11932);ならびにコアクチベーターまたはコリプレッサーの相互作用(Changら 2005, Mol Endocrinology 19, 2478〜2490;Hurら 2004, PLoS Biol 2, E274;Estebanez-Perpinaら 2005, JBC 280, 8060〜8068;Heら 2004, Mol Cell 16, 425〜438)に焦点を合わせている。
【0010】
NTDがアンドロゲンの非存在下でARの活性化における役割を果たしているため(Sadar, M.D. 1999 J. Biol. Chem. 274, 7777〜7783;Sadar MDら 1999 Endocr Relat Cancer. 6, 487〜502;Uedaら 2002 J. Biol. Chem. 277, 7076〜7085;Ueda 2002 J. Biol. Chem. 277, 38087〜38094;Blaszczykら 2004 Clin Cancer Res. 10, 1860〜9;Dehmら 2006 J Biol Chem. 28, 27882〜93;Gregoryら 2004 J Biol Chem. 279, 7119〜30)、ARのNTDはまた、薬物開発の標的でもある(例えばWO 2000/001813)。ARのNTDは、デコイ分子の適用(Quayleら 2007, Proc Natl Acad Sci U S A. 104, 1331〜1336)によって示されるように、前立腺癌のホルモンによる進行に重要である。
【0011】
ARのカルボキシ末端領域については結晶構造が解明されているが、NTDについては、その柔軟性の高さ、および溶液中での固有の無秩序さ(Reidら 2002 J. Biol. Chem. 277, 20079〜20086)のために解明されておらず、それにより実際の結合する薬物を発見するアプローチを妨げている。
【課題を解決するための手段】
【0012】
(概要)
本発明は、一部、本明細書中に記載した化合物がアンドロゲン受容体(AR)の活性を調節するという偶然の発見に基づく。具体的には、本明細書中で特定した化合物は、ARのN末端領域(NTD)のトランス活性化の阻害を示し、このことは、アンドロゲンの存在下および非存在下で、インビボの腫瘍増殖を阻止するのに有用であり得る。
【0013】
本明細書中に記載した化合物は、オーファン受容体および核内受容体(アンドロゲン受容体などのステロイド受容体を含む)の機構を調べるための、インビボまたはインビトロの研究用途(すなわち非臨床的なもの)に使用することができる。さらに、こうした化合物は、組換えタンパク質、培養液中で保持された細胞、および/または動物モデルを用いて、シグナル伝達経路ならびに/またはオーファン受容体および核内受容体の活性化を調べるための、インビボまたはインビトロの研究のために、個々にまたはキットの一部として、使用することができる。あるいは、本明細書中に記載した化合物は、市販用の包装および/または使用説明書と一体化させることができる。
【0014】
本発明はまた、一部、本明細書中に記載した化合物は、研究用途および治療用途のいずれについても、インビボまたはインビトロのいずれかで、アンドロゲン受容体の活性を調節するために使用することもできるという驚くべき発見にも基づく。該化合物は、アンドロゲン受容体の活性が調節され得るように、有効量で使用することができる。アンドロゲン受容体は、哺乳動物のものであってもよい。アンドロゲン受容体は、ヒトのものであってもよい。とりわけ該化合物は、ARのN末端領域(NTD)のトランス活性化を阻害するために使用することができる。該化合物の調節作用は、以下の適応症:前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患(polycystic ovary disease)、思春期早発症、および加齢性黄斑変性症の少なくとも1つの研究のためのインビボモデルまたはインビトロモデルのいずれかに使用することができる。さらに、該化合物の調節作用は、以下の適応症:前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症(精巣中毒症(testoxicosis))、および加齢性黄斑変性症の少なくとも1つの治療に使用することができる。治療する適応症は、前立腺癌であってもよい。該前立腺癌は、アンドロゲン非依存性前立腺癌であってもよい。該前立腺癌は、アンドロゲン依存性前立腺癌であってもよい。
【0015】
1つの実施態様によれば、式A:
【0016】
【化1】

【0017】
[式中、
Xは、CまたはNとすることができ;Yは、OまたはSとすることができ;
R1は、H、OH、J、OJ、SJ、またはNJJ’とすることができ、式中JまたはJ’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族もしくは部分的に芳香族の環式の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、COOR、CONH2、CONHR、CONR2、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R2は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、COOR、CONH2、CONHR、CONR2、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R3は、H、OH、OG、SG、NGG’、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、もしくは芳香族もしくは部分的に芳香族の環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、式中GおよびG’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族もしくは部分的に芳香族の環式の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、COOR、CONH2、CONHR、CONR2、R、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができ、式中Rは、非置換C1〜C10アルキルとすることができ;
R4およびR6は独立して、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、芳香族もしくは部分的に芳香族の環式、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基からなる群から選択することができ、その任意の置換基は、オキソ、COOH、OH、OR、R、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、非置換C1〜C10アルキルとすることができ(ただし、R4およびR6が共にHであることはなく、かつR4およびR6はいずれも
【0018】
【化2】

【0019】
ではない);
R5は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、CONH2、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;
【0020】
【化3】

【0021】
は単結合または二重結合とすることができる]
の構造を有する化合物(ただし、該化合物は、
【0022】
【化4】

【0023】
ではない)、またはその塩が提供される。
【0024】
さらなる実施態様によれば、式A:
【0025】
【化5】

【0026】
[式中、
Xは、CまたはNとすることができ;Yは、OまたはSとすることができ;
R1は、H、OH、J、またはOJとすることができ、式中Jは、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R2は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R3は、H、OH、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができ;
R4およびR6は独立して、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基からなる群から選択され、その任意の置換基は、オキソ、COOH、OH、F、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができ、アルキル基の炭素は任意にOで置換することができ[ただし、R4およびR6は共にHであることはなく、かつR4およびR6はいずれもt-Boc、FmocおよびCbz(本明細書中に記載した)ではない];
R5は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;
【0027】
【化6】

【0028】
は単結合または二重結合とすることができる]
の構造を有する化合物(ただし、該化合物は、
【0029】
【化7】

【0030】
ではない)、またはその塩が提供される。
【0031】
さらなる実施態様によれば、式A:
【0032】
【化8】

【0033】
[式中、
Xは、CまたはNとすることができ;Yは、OまたはSとすることができ;
R1は、H、OH、J、またはOJとすることができ、式中Jは、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R2は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R3は、H、OH、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができ;
R4およびR6は独立して、HまたはCOOCH2CH3からなる群から選択され(ただし、R4およびR6が共にHであることはない);
R5は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;
【0034】
【化9】

【0035】
は単結合または二重結合とすることができる]
の構造を有する化合物、またはその塩が提供される。
【0036】
さらなる実施態様によれば、式B:
【0037】
【化10】

【0038】
[式中、
Xは、CまたはNとすることができ;Yは、OまたはSとすることができ;
R1は、H、OH、J、OJ、SJ、またはNJJ’とすることができ、式中JまたはJ’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、OR、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができ;
R2は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R3は、H、OH、OG、SG、NGG’、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、式中GおよびG’は、炭素数1〜10の、直鎖状、分枝状、または非芳香族環式の、飽和または不飽和のアルキル基であり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができ;
R4は、H、または炭素数1〜10の、直鎖状、分枝状、芳香族環式、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、OR、R、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは非置換C1〜C10アルキルとすることができ[ただし、R4は、t-Boc、FmocおよびCbz(本明細書中に記載した)ではない];
R5は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;
Zは、任意に置換されたBu、Pr、Et、またはMeとすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;
【0039】
【化11】

【0040】
は単結合または二重結合とすることができる]
の構造を有する化合物(ただし、該化合物は、
【0041】
【化12】

【0042】
ではない)またはその塩が提供される。
【0043】
R3は、H、OH、OG、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であってもよく、式中Gは、炭素数1〜10の、直鎖状または分枝状の、飽和または不飽和のアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができる。あるいはR3は、H、OH、OBu、OPr、OEt、またはOMeであってもよい。あるいはR3はHであってもよい。
【0044】
R1は、H、OH、J、またはOJであってもよく、式中Jは、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、およびNO2のうちの1個以上から選択することができる。あるいはR1は、H、OH、J、またはOJであってもよく、式中Jは、炭素数1〜4の、直鎖状または分枝状の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択することができる。R1はまた、H、OH、OBu、OPr、OEt、OMe、Bu、Pr、Et、またはMeであってもよい。あるいはR1は、H、OH、J、またはOJであってもよく、式中Jは、炭素数1〜4の、直鎖状または分枝状の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択することができる。R1はまた、H、OH、OBu、OPr、OEt、またはOMeであってもよい。R1はOMeであってもよい。
【0045】
【化13】

【0046】
は二重結合であってもよい。
【0047】
R2は、H、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であってもよく、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、およびNO2のうちの1個以上から選択することができる。あるいはR2は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択することができる。あるいはR2は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、1個以上のハロゲンとすることができる。あるいはR2は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、1個以上のCl部分(moieties)とすることができる。
【0048】
R4は、H、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であってもよく、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SH、SO3H、およびNO2のうちの1個以上から選択することができる。あるいはR4は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択することができる。あるいはR4は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、1個以上のハロゲンから選択することができる。あるいはR4は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、1個以上のハロゲンとすることができる。あるいはR4は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、1個以上のCl部分とすることができる。
【0049】
R5は、H、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であってもよく、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができる。あるいはR5は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択することができる。あるいはR5は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、1個以上のハロゲンとすることができる。あるいはR5は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であってもよく、その任意の置換基は、1個以上のCl部分とすることができる。
【0050】
XはNであってもよい。YはOであってもよい。
【0051】
Zは、任意に置換されたBu、Pr、Et、またはMeであってもよく、その任意の置換基は、オキソ、OH、F、Cl、Br、およびIのうちの1個以上から選択することができる。あるいはZは、任意に置換されたBu、Pr、Et、またはMeであってもよく、その任意の置換基は、F、Cl、Br、およびIのうちの1個以上から選択することができる。
【0052】
さらなる実施態様によれば、式C:
【0053】
【化14】

【0054】
[式中、
Aは、Bu、Pr、Et、またはMeとすることができ;Mは、H、OH、OBu、OPr、OEt、OMe、Bu、Pr、Et、またはMeとすることができ;
Tは、
【0055】
【化15】

【0056】
とすることができ;
Eは、Bu、Pr、Et、またはMeとすることができ;
Qは、
【0057】
【化16】

【0058】
とすることができ;
Lは、Bu、Pr、Et、またはMeとすることができ;R8は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeとすることができ;R9は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeとすることができ;ここで、A、T、E、Q、およびLは、任意に置換されており、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができる]
の構造を有する化合物またはその塩が提供される。
【0059】
さらなる実施態様によれば、式D:
【0060】
【化17】

【0061】
[式中、Aは、Bu、Pr、Et、またはMeとすることができ;Dは、Bu、Pr、Et、またはMeとすることができ;Eは、Bu、Pr、Et、またはMeとすることができ;Lは、Bu、Pr、Et、またはMeとすることができ;R8は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeとすることができ;R9は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeとすることができる]
の構造を有する化合物またはその塩が提供される。
【0062】
さらなる実施態様によれば、式E:
【0063】
【化18】

【0064】
[式中、R8は、Cl3C、Cl2HC、ClH2C、Et、またはMeとすることができ;R9は、Cl3C、Cl2HC、ClH2C、Et、またはMeとすることができる]
の構造を有する化合物またはその塩が提供される。
【0065】
さらなる実施態様によれば、下記:
【0066】
【化19】

【0067】
の1つ以上から選択される、化合物またはその塩が提供される。
【0068】
さらなる実施態様によれば、下記:
【0069】
【化20】

【0070】
の1つ以上から選択される、化合物またはその塩が提供される。
【0071】
さらなる実施態様によれば、式A:
【0072】
【化21】

【0073】
[式中、
Xは、CまたはNとすることができ;Yは、OまたはSとすることができ;
R1は、H、OH、J、OJ、SJ、またはNJJ’とすることができ、式中JまたはJ’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R2は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R3は、H、OH、OG、SG、NGG’、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、式中GおよびG’は、炭素数1〜10の、直鎖状、分枝状、または非芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択することができ;
R4およびR6は独立して、H、または炭素数1〜10の、直鎖状、分枝状、芳香族環式、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基からなる群から選択され、その任意の置換基は、オキソ、COOH、OH、OR、R、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択することができ、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R5は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;
【0074】
【化22】

【0075】
は単結合または二重結合とすることができる]
の構造を有する化合物またはその塩を哺乳動物細胞に投与することを含む、ARの活性の調節方法が提供される。
【0076】
あるいは、本明細書中に記載した方法/使用で用いる化合物は、本明細書中に記載した式A〜Eのいずれか1つの構造を有していてもよい。
【0077】
さらなる実施態様によれば、アンドロゲン受容体(AR)の活性を調節するための本明細書中に示した化合物の使用が提供される。あるいは、該使用は、アンドロゲン受容体(AR)を調節するための医薬の製造のためのものとすることができる。あるいは、該使用は、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患(polycystic ovary disease)、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症の治療のためのもの、または該適応症の治療用の医薬の製造のためのものとすることができる。該適応症は、前立腺癌であってもよい。該前立腺癌は、アンドロゲン非依存性前立腺癌であってもよい。該前立腺癌は、アンドロゲン依存性前立腺癌であってもよい。
【0078】
別の実施態様によれば、上に示した式A、B、C、D、Eのいずれか1つの構造を有する化合物、または上に示した化合物のいずれか、および薬学的に許容される賦形剤を含む医薬組成物が提供される。
【0079】
別の実施態様によれば、いずれか1種の上記化合物に従った化合物、および薬学的に許容される賦形剤を含む、医薬組成物が提供される。
【0080】
さらなる実施態様によれば、スクリーニングされる化合物が本明細書中に記載した化合物から選択される、アンドロゲン受容体を調節する化合物のスクリーニング方法が提供される。
【0081】
さらなる実施態様によれば、アンドロゲン受容体(AR)の活性を調節するための、1種以上の本明細書中に記載した化合物が提供される。
【0082】
本明細書中に記載した化合物は、すべてのラセミ混合物、およびすべての個々の鏡像異性体、またはこれらの組み合わせが本明細書中に示されているか否かにかかわらず、それらを含むことが意図されている。任意の置換基は、ハロゲンであってもよい。R2、R4、R5、およびR6は、任意の天然に存在するアミノ酸、またはその置換された変異体の側鎖であってもよい。あるいはR2は、プロリンのものでも、フェニルアラニンのものでもない。あるいはR4およびR6は、プロリンのものでも、フェニルアラニンのものでもない。あるいはR5は、プロリンのものではない。アミノ酸側鎖は、脂肪族側鎖のバリン、ロイシン、イソロイシン、またはモノハロゲン化メチル型、ジハロゲン化メチル型、もしくはトリハロゲン化メチル型のバリン、ロイシン、もしくはイソロイシンの側鎖から選択してもよい。アミノ酸側鎖は、疎水性側鎖のアラニン、バリン、ロイシン、イソロイシン、トリプトファン、メチオニン、システイン、およびグリシンから選択してもよい。あるいはアミノ酸側鎖は、親水性側鎖のアスパラギン、グルタミン、セリン、トレオニン、およびチロシンから選択してもよい。あるいはアミノ酸側鎖は、塩基性側鎖のリシン、アルギニン、およびヒスチジンから選択してもよい。あるいはアミノ酸側鎖は、塩基性側鎖のアスパラギン酸、およびグルタミン酸から選択してもよい。あるいはアミノ酸側鎖は、本明細書中に記載した側鎖のいずれか、またはそれらのモノハロゲン化型、ジハロゲン化型、もしくはトリハロゲン化型から選択してもよい。ハロゲンは、F、Cl、Br、またはIであってもよい。あるいはR1、R2、R3、R4、R5、およびR6は、炭素数1〜10の、置換または非置換のアシル、例えばアセチル、プロピオニル、ブタノイル、またはペンタノイルなどであってもよい。
【0083】
哺乳動物細胞は、ヒト細胞であってもよい。ARの活性の調節は、ARのN末端領域の活性を阻害するためのものであってもよい。ARの活性の調節は、ARのN末端領域(NTD)の活性を阻害するためのものであってもよい。該調節は、インビボのものであってもよい。ARの活性の調節は、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症の治療のためのものであってもよい。該適応症は前立腺癌であってもよい。該前立腺癌は、アンドロゲン非依存性前立腺癌であってもよい。該前立腺癌は、アンドロゲン依存性前立腺癌であってもよい。
【0084】
さらなる実施態様によれば、式(K):
【0085】
【化23】

【0086】
[式中、
R25は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、COOR’、CONH2、CONHR’、CONR’2、R’、OH、OR’、F、Cl、Br、I、NH2、NHR’、NR’2、CN、SH、SR’、SO3H、SO3R’、SO2R’、OSO3R’、およびNO2のうちの1個以上から選択することができ、式中R’は、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;
R26は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、CONH2、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;
R27は、任意に置換されたBu、Pr、Et、またはMeとすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができる]
の化合物の製造方法が提供される。
【0087】
別の実施態様によれば、アンドロゲン受容体(AR)の活性を調節するための式(F):
【0088】
【化24】

【0089】
[式中、
R10は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R14、OH、OR14、F、Cl、Br、I、NH2、NHR14、NR142、CN、SH、SR14、SO3H、SO3R14、SO2R14、OSO3R14、およびNO2のうちの1個以上から選択することができ、式中R14は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基とすることができ;
R11は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R15、OH、OR15、F、Cl、Br、I、NH2、NHR15、NR152、CN、SH、SR15、SO3H、SO3R15、SO2R15、OSO3R15、およびNO2のうちの1個以上から選択することができ、式中R15は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基とすることができ;
R12は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R16、OH、OR16、F、Cl、Br、I、NH2、NHR16、NR162、CN、SH、SR16、SO3H、SO3R16、SO2R16、OSO3R16、およびNO2のうちの1個以上から選択することができ、式中R16は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基とすることができ;
R13は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R17、OH、OR17、F、Cl、Br、I、NH2、NHR17、NR172、CN、SH、SR17、SO3H、SO3R17、SO2R17、OSO3R17、およびNO2のうちの1個以上から選択することができ、式中R17は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基とすることができる]
の化合物またはその薬学的に許容される塩の使用が提供される。
【0090】
1つの実施態様において、R10は、例えば、限定されないが、H、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシとすることができ、ここでC1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシはそれぞれ、置換されていないか、または1個以上の置換基で置換されており、該置換基はそれぞれ独立して、オキソ、COOH、R14、OH、OR14、F、Cl、Br、I、NH2、NHR14、NR142、CN、SH、SR14、SO3H、SO3R14、SO2R14、OSO3R14、またはNO2とすることができ、式中R14は、例えば、限定されないが、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、または独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基とすることができ;
R11は、例えば、限定されないが、H、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシとすることができ、ここでC1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシはそれぞれ、置換されていないか、または1個以上の置換基で置換されており、該置換基はそれぞれ独立して、オキソ、COOH、R15、OH、OR15、F、Cl、Br、I、NH2、NHR15、NR152、CN、SH、SR15、SO3H、SO3R15、SO2R15、OSO3R15、またはNO2とすることができ、式中R15は、例えば、限定されないが、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、または独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基とすることができ;
R12は、例えば、限定されないが、H、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシとすることができ、ここでC1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシはそれぞれ、置換されていないか、または1個以上の置換基で置換されており、該置換基はそれぞれ独立して、オキソ、COOH、R16、OH、OR16、F、Cl、Br、I、NH2、NHR16、NR162、CN、SH、SR16、SO3H、SO3R16、SO2R16、OSO3R16、またはNO2とすることができ、式中R16は、例えば、限定されないが、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、または独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基とすることができ;
R13は、例えば、限定されないが、H、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシとすることができ、ここでC1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C1〜10アシル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基、またはC1〜10アルコキシはそれぞれ、置換されていないか、または1個以上の置換基で置換されており、該置換基はそれぞれ独立して、オキソ、COOH、R17、OH、OR17、F、Cl、Br、I、NH2、NHR17、NR172、CN、SH、SR17、SO3H、SO3R17、SO2R17、OSO3R17、またはNO2とすることができ、式中R17は、例えば、限定されないが、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、または独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基とすることができる。
【0091】
1つの実施態様において、R10は、例えば、限定されないが、Hまたは非置換C1〜10アルキルとすることができる。別の実施態様において、R10は、例えば、限定されないが、Meとすることができる。
【0092】
1つの実施態様において、R11は、例えば、限定されないが、Hまたは非置換C1〜10アルキルとすることができる。別の実施態様において、R11は、例えば、限定されないが、Meとすることができる。
【0093】
別の実施態様において、R12は、例えば、限定されないが、H、C1〜10アルキル、またはC2〜10アルケニルとすることができ、ここでC1〜10アルキルまたはC2〜10アルケニルはそれぞれ、置換されていないか、または1個以上の置換基で置換されており、該置換基はそれぞれ独立して、オキソ、COOH、R16、OH、OR16、F、Cl、Br、I、NH2、NHR16、NR162、CN、SH、SR16、SO3H、SO3R16、SO2R16、OSO3R16、またはNO2とすることができ、式中R16は、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、または独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基とすることができる。別の実施態様において、R12は、任意の天然に存在するアミノ酸の側鎖、またはその置換された変異体とすることができる。アミノ酸側鎖は、脂肪族側鎖のバリン、ロイシン、イソロイシン、またはモノハロゲン化メチル型、ジハロゲン化メチル型、もしくはトリハロゲン化メチル型のバリン、ロイシン、もしくはイソロイシンの側鎖から選択してもよい。アミノ酸側鎖は、疎水性側鎖のアラニン、バリン、ロイシン、イソロイシン、トリプトファン、メチオニン、システイン、およびグリシンから選択してもよい。アミノ酸側鎖は、親水性側鎖のアスパラギン、グルタミン、セリン、トレオニン、およびチロシンから選択してもよい。あるいはアミノ酸側鎖は、塩基性側鎖のリシン、アルギニン、およびヒスチジンから選択してもよい。あるいはアミノ酸側鎖は、塩基性側鎖のアスパラギン酸およびグルタミン酸から選択してもよい。あるいはアミノ酸側鎖は、本明細書中に記載した側鎖のいずれか、またはそれらのモノハロゲン化型、ジハロゲン化型、もしくはトリハロゲン化型から選択してもよい。ハロゲンは、F、Cl、Br、またはIであってもよい。さらなる実施態様において、R12は、例えば、限定されないが、バリン、ロイシン、イソロイシンの側鎖、またはその置換された変異体とすることができる。別の実施態様において、R12は、例えば、限定されないが、バリン、ロイシン、またはイソロイシンの側鎖のモノハロゲン化メチル変異体、ジハロゲン化メチル変異体、またはハロゲン化メチル変異体とすることができる。さらに別の実施態様において、R12は、例えば、限定されないが、-CH2-CH(CH3)CH3;-CH2-CH(CR183)CH3;-CH2-CH(CHR182)CH3;-CH2-CH(CH2R18)CH3;-CH2-CH(CR183)CH2R18;-CH2-CH(CHR182)CH2R18;-CH2-CH(CH2R18)CH2R18;-CH2-CH(CR183)CHR182;-CH2-CH(CHR182)CHR182;-CH2-CH(CH2R18)CHR182;-CH2-CH(CR183)CR183;-CH2-CH(CHR182)CR183;-CH2-CH(CH2R18)CR183;-CH(CH3)CH3;-CH(CR183)CH3;-CH(CHR182)CH3;-CH(CH2R18)CH3;-CH(CR183)CH2R18;-CH(CHR182)CH2R18;-CH(CH2R18)CH2R18;-CH(CR183)CHR182;-CH(CHR182)CHR182;-CH(CH2R18)CHR182;-CH(CR183)CR183;-CH(CHR182)CR183;-CH(CH2R18)CR183;-CH(CH3)-CH(CH3)CH3;-CH(CH3)-CH(CR183)CH3;-CH(CH3)-CH(CHR182)CH3;-CH(CH3)-CH(CH2R18)CH3;-CH(CH3)-CH(CR183)CH2R18;-CH(CH3)-CH(CHR182)CH2R18;-CH(CH3)-CH(CH2R18)CH2R18;-CH(CH3)-CH(CR183)CHR182;-CH(CH3)-CH(CHR182)CHR182;-CH(CH3)-CH(CH2R18)CHR182;-CH(CH3)-CH(CR183)CR183;-CH(CH3)-CH(CHR182)CR183;または-CH(CH3)-CH(CH2R18)CR183とすることができ、式中R18は、例えば、限定されないが、F、Cl、Br、またはIとすることができる。1つの実施態様において、R18は、例えば、限定されないが、Clとすることができる。さらに別の実施態様において、R12は、例えば、限定されないが、-CH2-CH(CCl3)CH3または-CH2-CH(CHCl2)CH3とすることができる。あるいはR12は、炭素数1〜10の、置換または非置換のアシル、例えばアセチル、プロピオニル、ブタノイル、またはペンタノイルなどとすることができる。
【0094】
別の実施態様において、R13は、例えば、限定されないが、H、C1〜10アルキル、またはC2〜10アルケニルとすることができ、ここでC1〜10アルキルまたはC2〜10アルケニルはそれぞれ、置換されていないか、または1個以上の置換基で置換されており、該置換基はそれぞれ独立して、オキソ、COOH、R17、OH、OR17、F、Cl、Br、I、NH2、NHR17、NR172、CN、SH、SR17、SO3H、SO3R17、SO2R17、OSO3R17、またはNO2とすることができ、式中R17は、C1〜10アルキル、C2〜10アルケニル、C2〜10アルキニル、C3〜10シクロアルキル、C3〜10シクロアルケニル、C3〜10シクロアルキニル、C6〜10アリール、C6〜9アリール−C1〜4アルキル、C6〜8アリール−C2〜4アルケニル、C6〜8アリール−C2〜4アルキニル、独立してN、S、もしくはOである1個以上のヘテロ原子を含む4〜10員の非芳香族複素環基、または独立してN、S、もしくはOである1個以上のヘテロ原子を含む5〜10員の芳香族複素環基とすることができる。別の実施態様において、R13は、任意の天然に存在するアミノ酸の側鎖、またはその置換された変異体とすることができる。アミノ酸側鎖は、脂肪族側鎖のバリン、ロイシン、イソロイシン、またはモノハロゲン化メチル型、ジハロゲン化メチル型、もしくはトリハロゲン化メチル型のバリン、ロイシン、もしくはイソロイシンの側鎖から選択してもよい。アミノ酸側鎖は、疎水性側鎖のアラニン、バリン、ロイシン、イソロイシン、トリプトファン、メチオニン、システイン、およびグリシンから選択してもよい。アミノ酸側鎖は、親水性側鎖のアスパラギン、グルタミン、セリン、トレオニン、およびチロシンから選択してもよい。あるいはアミノ酸側鎖は、塩基性側鎖のリシン、アルギニン、およびヒスチジンから選択してもよい。あるいはアミノ酸側鎖は、塩基性側鎖のアスパラギン酸およびグルタミン酸から選択してもよい。あるいはアミノ酸側鎖は、本明細書中に記載した側鎖のいずれか、またはそのモノハロゲン化型、ジハロゲン化型、もしくはトリハロゲン化型から選択してもよい。ハロゲンは、F、Cl、Br、またはIであってもよい。さらに別の実施態様において、R13は、例えば、限定されないが、バリン、ロイシン、またはイソロイシンの側鎖のモノハロゲン化メチル変異体、ジハロゲン化メチル変異体、またはハロゲン化メチル変異体とすることができる。1つの実施態様において、R13は、例えば、限定されないが、-CH2-CH(CH3)CH3;-CH2-CH(CR193)CH3;-CH2-CH(CHR192)CH3;-CH2-CH(CH2R19)CH3;-CH2-CH(CR193)CH2R19;-CH2-CH(CHR192)CH2R19;-CH2-CH(CH2R19)CH2R19;-CH2-CH(CR193)CHR192;-CH2-CH(CHR192)CHR192;-CH2-CH(CH2R19)CHR192;-CH2-CH(CR193)CR193;-CH2-CH(CHR192)CR193;-CH2-CH(CH2R19)CR193;-CH(CH3)CH3;-CH(CR193)CH3;-CH(CHR192)CH3;-CH(CH2R19)CH3;-CH(CR193)CH2R19;-CH(CHR192)CH2R19;-CH(CH2R19)CH2R19;-CH(CR193)CHR192;-CH(CHR192)CHR192;-CH(CH2R19)CHR192;-CH(CR193)CR193;-CH(CHR192)CR193;-CH(CH2R19)CR193;-CH(CH3)-CH(CH3)CH3;-CH(CH3)-CH(CR193)CH3;-CH(CH3)-CH(CHR192)CH3;-CH(CH3)-CH(CH2R19)CH3;-CH(CH3)-CH(CR193)CH2R19;-CH(CH3)-CH(CHR192)CH2R19;-CH(CH3)-CH(CH2R19)CH2R19;-CH(CH3)-CH(CR193)CHR192;-CH(CH3)-CH(CHR192)CHR192;-CH(CH3)-CH(CH2R19)CHR192;-CH(CH3)-CH(CR193)CR193;-CH(CH3)-CH(CHR192)CR193;または-CH(CH3)-CH(CH2R19)CR193とすることができ、式中R19は、例えば、限定されないが、F、Cl、Br、またはIとすることができる。1つの実施態様において、R19は、例えば、限定されないが、Clとすることができる。別の実施態様において、R13は、例えば、限定されないが、-CH2-CH(CCl3)CH3または-CH2-CH(CHCl2)CH3とすることができる。あるいはR13は、炭素数1〜10の、置換または非置換のアシル、例えばアセチル、プロピオニル、ブタノイル、またはペンタノイルなどとすることができる。
【0095】
別の実施態様によれば、アンドロゲン受容体(AR)の活性を調節するための、式:
【0096】
【化25】

【0097】
(式中R20およびR21はそれぞれ独立して、例えば、限定されないが、CCl3またはCHCl2とすることができる)の化合物、またはその薬学的に許容される塩の使用が提供される。
【0098】
別の実施態様によれば、アンドロゲン受容体(AR)の活性を調節するための、式:
【0099】
【化26】

【0100】
(式中R20およびR21はそれぞれ独立して、例えば、限定されないが、CCl3またはCHCl2とすることができる)の化合物、またはその薬学的に許容される塩の使用が提供される。
【0101】
さらなる実施態様において、アンドロゲン受容体(AR)の活性を調節するための、式:
【0102】
【化27−1】

【0103】
【化27−2】

【0104】
の化合物、またはその薬学的に許容される塩の使用が提供される。
【0105】
さらなる実施態様において、アンドロゲン受容体(AR)の活性を調節するための、式:
【0106】
【化28】

【0107】
の化合物、またはその薬学的に許容される塩の使用が提供される。
【0108】
さらなる実施態様において、アンドロゲン受容体(AR)の活性を調節するための、式:
【0109】
【化29−1】

【0110】
【化29−2】

【0111】
の化合物、またはその薬学的に許容される塩の使用が提供される。さらなる実施態様において、アンドロゲン受容体(AR)の活性を調節するための、式:
【0112】
【化30】

【0113】
の化合物、またはその薬学的に許容される塩の使用が提供される。
【0114】
さらなる実施態様によれば、アンドロゲン受容体(AR)の活性を調節するための上に示した化合物の使用が提供される。あるいは、該使用は、アンドロゲン受容体(AR)を調節するための医薬の製造のためのものであってもよい。あるいは、該使用は、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患(polycystic ovary disease)、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症の治療のためのものであってもよく、該適応症の治療用の医薬の製造のためのものであってもよい。該適応症は、前立腺癌であってもよい。該前立腺癌は、アンドロゲン非依存性前立腺癌であってもよい。該前立腺癌は、アンドロゲン依存性前立腺癌であってもよい。別の実施態様によれば、ARの活性の調節方法が提供され、該方法は、上に示した化合物またはその塩を哺乳動物細胞に投与することを含む。
【0115】
別の実施態様によれば、上に示した化合物または本明細書中に示したいずれかの化合物、および薬学的に許容される賦形剤を含む、医薬組成物が提供される。
【0116】
さらなる実施態様によれば、スクリーニングされる化合物が本明細書中に記載した化合物から選択される、アンドロゲン受容体を調節する化合物のスクリーニング方法が提供される。
【0117】
さらなる実施態様によれば、アンドロゲン受容体(AR)の活性を調節するための1種以上の本明細書中に記載した化合物が提供される。
【0118】
本明細書中に記載した化合物は、すべてのラセミ混合物、およびすべての個々の鏡像異性体、またはこれらの組み合わせが本明細書中に示されているか否かにかかわらず、それらを含むことが意図されている。
【0119】
アミノ酸側鎖は、1つ以上の下記のもの、または1つ以上の下記の側鎖の分類から選択することができる。
【0120】
【化31】

【0121】
【化32】

【0122】
【化33】

【0123】
【化34】

【0124】
【化35】

【0125】
【化36】

【0126】
【化37】

【0127】
【化38】

【図面の簡単な説明】
【0128】
【図1A】図1Aは、ARR3-lucを用いて安定にトランスフェクションし、R1881および海産の抽出物(10 ug/ml)で48時間処理したLNCaP細胞の溶解物(lystates)におけるルシフェラーゼ活性のCLIPR画像を示す。すべてのウェルは、R1881(1 nM)で処理し、各抽出物は横列に並んだ3ウェルに加えた(1列あたり4種の抽出物)。囲んだウェルは、このプレート上の06-80(三つ組み)を表し、90%よりも大きな阻害を示す。
【図1B】図1Bは、CB3.1と呼ばれる06-80に由来する活性のある単離された化合物(10 μg/ml)またはR1881(1 nM)およびDMSO(化合物の媒体)で48時間処理し、倒立顕微鏡を使って可視化した、LNCaP細胞の形態の顕微鏡写真を示す。
【図2】図2A〜2Cは、GRおよびPR、ならびにこれらの関連レポーター遺伝子コンストラクト(PSA-luc、GRE-lucまたはPRE-luc)の発現ベクターでトランスフェクションし、これらそれぞれのステロイド(10 nM、黒色のバー)に24時間曝露したLNCaP細胞において、CB3.1(5 μg/ml)は、ARE-ルシフェラーゼ活性を阻害したが、GRE-ルシフェラーゼ活性もPRE-ルシフェラーゼ活性も阻害しなかったことを示している。白色のバーは、ステロイドがない(エタノール対照)ことを示す。図中にグルココルチコイド受容体(glucocorticoid receptor)(GR)およびプロゲステロン受容体(progesterone receptor)(PR)がある。
【図3A】図3Aは、FSKによって誘発されるARのNTDのトランス活性化をシントカミドAが阻止することについての棒グラフを示す。シントカミドA(CB3.1)(5 μg/ml)をそのARのNTDを阻害する能力について調べた。LNCaP細胞をGal4DBD-AR1-558および相補的な(complimentary)5XGal4UAS-ルシフェラーゼレポーターの発現ベクターでコトランスフェクションした。FSKによるこのレポーターの誘発は、Gal4DBD-AR1-558融合タンパク質のトランス活性化の尺度である(Sadar 1999 J. Biol. Chem. 274, 7777〜7783)。R1881は、かかるアッセイを誘発せず(Gal4DBD-AR1-558キメラには存在しないARのリガンド結合領域(LBD)に結合する)、そのため使用しなかった。
【図3B】図3Bは、ビカルタミド(BIC、10 μM)またはCB3.1(5 μg/mL)で1時間処理してから、R1881(0.1 nM)を加えた、LNCaP細胞のアンドロゲン依存性の増殖をシントカミドA(CB3.1)が阻止することを示す、棒グラフを示す。細胞を収集し、アンドロゲンによる処理の3日後のBrdUの取り込みを測定した。CB3.1処理およびR1881処理と、R1881処理のみとの間のpは0.0001である。
【図3C】図3Cは、シントカミドA(CB3.1)がPC3細胞の増殖を阻止できないことを示す、棒グラフを示す。細胞を、媒体(DMSO)、CB3.1(5 μg/mL)で1日間処理してから、収集し、BrdUの取り込みを測定した。バーは、平均値±SEM(n=6)を表す。
【図4】図4は、シントカミドがLNCaP細胞におけるPSA mRNAのアンドロゲンによる誘発量を抑制することを示す、棒グラフを示す。細胞を、ビカルタミド(BIC、10 μM)、または10 μg/mlの各化合物(CB3.0(ジサミドA)、CB3.1(シントカミドA)、およびCB4.0(シントカミドB)を含むDMSO担体)で1時間前処理してから、合成アンドロゲンR1881(1 nM)を加え、次いでさらに16時間インキュベートしてから、全RNAを収集および単離した。PSA mRNAの濃度を、定量的リアルタイム(quantitative real-time)(qRT)PCRによって測定し、GAPDH mRNA(ハウスキーピング遺伝子)の濃度に対して正規化した。白色のバーはR1881がないことを示す。黒色のバーはR1881(1 nM)を示す。MNEは正規化された平均の発現(mean normalized expression)である。DMSO(R1881なし)は、個々の実験ごとに適宜1.0に設定した。バーは、各実験からの三つ組みの技術的試料を用いた3つの別々の実験からの平均値±SEを表す。
【図5】図5は、PSA(6.1)-ルシフェラーゼのR1881による誘発を、シントカミドA、B、CおよびE、ならびにジサミド(Dysimide)Aが阻害することを示す、棒グラフを示す。12ウェルプレート中のLNCaP細胞(1ウェルあたり8×104個の細胞)を、5%のFBSが補充されたフェノールレッドを含まないRPMIに播種し、翌日その細胞を、無血清のフェノールレッドを含まないRPMI中で、1ウェルあたり2.5 ulのリポフェクチンを用いて、PSA(6.1 kb)-ルシフェラーゼレポータープラスミド(0.5 μg/ウェル)、pLuc(1 μg/ウェル)でトランスフェクションした。トランスフェクション(transfaction)の24時間後、細胞をビカルタミド(BIC、10 μM)、非塩素化シントカミド(10 μM)、もしくは5 μg/mlのCB-0抽出物、またはシントカミドおよびジサミドAで1時間前処理してから、媒体(DMSO)またはR1881(1 nM)を加えた。24時間後に細胞を収集し、ルシフェラーゼ活性について分析した。データは、ブラッドフォード(Bradford)アッセイを用いて測定したタンパク質に対して正規化している。
【図6】図6は、シントカミドA(CB3.1)に応答したLNCaP異種移植片容積を示す、時間経過を示す。CB3.1は腫瘍の大きさを減少させたが、DMSOで処理した腫瘍は成長し続けた。1回目の注射の7日前に動物を去勢し、腫瘍容積を100%と定めた。3日ごとに30 mg/kg体重の用量で3日ごとに注射をした。B. 写真は、CB3.1で処理した、代表的な収集したLNCaP異種移植片のものである。黒色のバーは、10 mmを表す。
【発明を実施するための形態】
【0129】
(詳細な説明)
本明細書中に記載した新規な化合物群は、シントカミドA(1)〜E(5)を含み、これらはすべて、海綿[a) Kazlauskas, R. Murphy, P.T.; Wells, R.J.; Schoenholzer, P. Tetrahedron Lett. 1978, 4951〜, b) Kazlauskas, R. Murphy, P.T.; Wells, R.J. Tetrahedron Lett. 1978, 4949〜 , c) Hofheinz, W.; Oberhansli, W.E. Helv. Chim. Acta 1977, 60, 660〜, d) Erickson, K.; Wells, R. Aust. J. Chem. 1982, 35, 31〜38, e) Unson, M.D.; Rose, C.B.; Faulkner, D.J.; Brinen, L.S.; Steiner, J.R.; Clardy, J. J. Org. Chem. 1993, 58, 6336〜6343]、裸鰓類(nudibranchs)[Fahey, S.J.; Garson, M.J. J. Chem. Ecol. 2002, 28, 1773〜1785]、およびシアノバクテリア[Orjala, J.; Gerwick, W.H. J. Nat. Prod. 1996, 59, 427〜430]から単離されている塩素化ペプチドという小さなファミリーと関連しているようである。さらに、合成および修飾は、例えばWillardら, J. Org. Chem., 1984, 49, 3489〜3493、およびBrantleyら, Organic Letters, 1999, 第1巻, 13号, 2165〜2167に記載されている。
【0130】
本明細書中で使用される場合、語句「Cx〜yアルキル」または「Cx〜Cyアルキル」は、それが通常当業者に理解されている通りに使用されており、多くの場合、x〜yの数(整数xおよびyを含めてその範囲内のすべての個々の整数が含まれる)の炭素原子を含む炭素骨格または主炭素鎖を有する化学物質を指す。例えば、「C1〜10アルキル」は、その炭素骨格または主鎖に、1個、2個、3個、4個、5個、6個、7個、8個、9個、または10個の炭素原子(群)を有する化学物質である。
【0131】
本明細書中で使用される場合、用語「環式Cx〜yアルキル」または「環式Cx〜Cyアルキル」は、それが通常当業者に理解されている通りに使用されており、多くの場合、化学物質の炭素骨格または主鎖の少なくとも一部が、一緒に結合する原子の「ループ(loop)」、円(circle)、または環(ring)を形成するように結合している化合物または化学物質を指す。原子はすべてが互いに直接結合している必要はなく、むしろ「ループ」中のほんの2個の他の原子に直接結合していればよい。環式アルキルの非限定的な例としては、ベンゼン、トルエン、シクロペンタン、ビスフェノール、および1-クロロ-3-エチルシクロヘキサンが挙げられる。
【0132】
本明細書中で使用される場合、用語「分枝状」は、それが通常当業者に理解されている通りに使用されており、多くの場合、1つよりも多くの連続鎖に分かれる骨格または主鎖を含む化学物質を指す。1つよりも多くの方向に分かれる骨格または主鎖の部分は、直鎖状であってもよく、環式であってもよく、これらの任意の組み合わせであってもよい。分枝状アルキルの非限定的な例は、tert-ブチルおよびイソプロピルである。
【0133】
本明細書中で使用される場合、用語「非分枝状」は、それが通常当業者に理解されている通りに使用されており、多くの場合、1つよりも多くの(more that one)連続鎖に分かれない骨格または主鎖を含む化学物質を指す。非分枝状アルキルの非限定的な例は、メチル、エチル、n-プロピル、およびn-ブチルである。
【0134】
本明細書中で使用される場合、用語「置換」は、それが通常当業者に理解されている通りに使用されており、多くの場合、1個以上のヘテロ原子を含む異なる化学基で置き換えられた1個の化学基を有する化学物質を指す。別段特定しない限り、置換アルキルは、1個以上の水素原子(群)が水素(群)ではない1個以上の原子(群)で置換されているアルキルである。例えば、クロロメチルは、置換アルキルの非限定的な例であり、より具体的には置換メチルの例である。アミノエチルは、置換アルキルの別の非限定的な例であり、より具体的にはそれは置換エチルである。本明細書中に記載した官能基は、例えば、限定されないが、1個、2個、3個、4個、5個、6個、7個、8個、9個、または10個の置換基で置換されていてもよい。
【0135】
本明細書中で使用される場合、用語「非置換」は、それが通常当業者に理解されている通りに使用されており、多くの場合、炭化水素であり、かつ/またはヘテロ原子を含まない、化学物質を指す。非置換アルキルの非限定的な例としては、メチル、エチル、tert-ブチル、およびペンチルが挙げられる。
【0136】
本明細書中で使用される場合、化学物質に言及する場合の用語「飽和」は、それが通常当業者に理解されている通りに使用されており、多くの場合、単結合のみを含む化学物質を指す。飽和の化学物質の非限定的な例としては、エタン、tert-ブチル、およびN+H3が挙げられる。
【0137】
本明細書中で使用される場合、用語「ハロゲン化」は、それが通常当業者に理解される通りに使用されており、水素原子が塩素、フッ素、ヨウ素、または臭素などのハロゲン原子で置換されている、部分または化学物質を指す。例えば、天然に存在するアミノ酸の塩素化側鎖は、天然に存在するアミノ酸の側鎖に存在する1個以上の水素原子が1個以上の塩素原子で置換されている、天然に存在するアミノ酸の側鎖を指す。
【0138】
飽和C1〜C10アルキルの非限定的な例としては、メチル、エチル、n-プロピル、i-プロピル、sec-プロピル、n-ブチル、i-ブチル、sec-ブチル、t-ブチル、n-ペンチル、i-ペンチル、sec-ペンチル、t-ペンチル、n-ヘキシル、i-ヘキシル、1,2-ジメチルプロピル、2-エチルプロピル、1-メチル-2-エチルプロピル、1-エチル-2-メチルプロピル、1,1,2-トリメチルプロピル、1,1,2-トリエチルプロピル、1,1-ジメチルブチル、2,2-ジメチルブチル、2-エチルブチル、1,3-ジメチルブチル、2-メチルペンチル、3-メチルペンチル、sec-ヘキシル、t-ヘキシル、n-ヘプチル、i-ヘプチル、sec-ヘプチル、t-ヘプチル、n-オクチル、i-オクチル、sec-オクチル、t-オクチル、n-ノニル、i-ノニル、sec-ノニル、t-ノニル、n-デシル、i-デシル、sec-デシル、およびt-デシルを挙げることができる。C2〜C10アルケニルの非限定的な例としては、ビニル、アリル、イソプロペニル、1-プロペン-2-イル、1-ブテン-1-イル、1-ブテン-2-イル、1-ブテン-3-イル、2-ブテン-1-イル、2-ブテン-2-イル、オクテニル、およびデセニルを挙げることができる。C2〜C10アルキニルの非限定的な例としては、エチニル、プロピニル、ブチニル、ペンチニル、ヘキシニル、ヘプチニル、オクチニル、ノニニル、およびデシニルを挙げることができる。飽和C1〜C10アルキル、C2〜C10アルケニル、またはC2〜C10アルキニルは、例えば、限定されないが、独立して窒素、硫黄、または酸素である1個以上のヘテロ原子によって分断されていてもよい。
【0139】
飽和C3〜C10シクロアルキル基の非限定的な例としては、シクロプロパニル、シクロブタニル、シクロペンタニル、シクロヘキサニル、シクロヘプタニル、シクロオクタニル、シクロノナニル、およびシクロデカニルを挙げることができる。C3〜C10シクロアルケニル基の非限定的な例としては、シクロプロペニル、シクロブテニル、シクロペンテニル、シクロヘキセニル、シクロヘプテニル、シクロオクテニル、シクロノナンニル(cyclononanenyl)、およびシクロデカンニル(cyclodecanenyl)を挙げることができる。C3〜C10シクロアルキニルの非限定的な例としては、シクロプロピニル、シクロブチニル、シクロペンチニル、シクロヘキシニル、シクロヘプチニル、およびシクロオクチニルを挙げることができる。C6〜C10アリール基の非限定的な例としては、フェニル(Ph)、ペンタレニル、インデニル、ナフチル、およびアズレニルを挙げることができる。C6〜9アリール−C1〜4アルキル基は、例えば、限定されないが、上記のいずれかの箇所で定義したC6〜9アリール基を置換基として有する、上記のいずれかの箇所で定義したC1〜4アルキル基であってもよい。C6〜8アリール−C2〜4アルケニル基は、例えば、限定されないが、上記のいずれかの箇所で定義したC6〜8アリール基を置換基として有する、上記のいずれかの箇所で定義したC2〜4アルケニルであってもよい。C6〜8アリール−C2〜4アルキニル基は、例えば、限定されないが、上記のいずれかの箇所で定義したC6〜8アリール基を置換基として有する、上記のいずれかの箇所で定義したC2〜4アルキニル基であってもよい。独立して窒素、硫黄、または酸素である1個以上のヘテロ原子を含む、4〜10員の非芳香族複素環基の非限定的な例としては、ピロリジニル、ピロリニル、ピペリジニル、ピペラジニル、イミダゾリニル、ピラゾリジニル、イミダゾリジニル(imidazolydinyl)、モルホリニル、テトラヒドロピラニル、アゼチジニル、オキセタニル、オキサチオラニル、フタルイミド、およびスクシンイミドを挙げることができる。独立して窒素、硫黄、または酸素である1個以上のヘテロ原子を含む5〜10員の芳香族複素環基の非限定的な例としては、ピロリル、ピリジニル、ピリダジニル、ピリミジニル、ピラジニル(pirazinyl)、イミダゾリル、チアゾリル、およびオキサゾリルを挙げることができる。
【0140】
炭素数1〜10の、置換または非置換のアシルの非限定的な例としては、アセチル、プロピオニル、ブタノイル、およびペンタノイルが挙げられる。C1〜C10アルコキシの非限定的な例としては、メトキシ、エトキシ、プロポキシ、およびブトキシが挙げられる。
【0141】
天然に存在するアミノ酸のアミノ酸側鎖(amino acid side chains)(本明細書中で「(aa)」を用いて示していることが多い)は、当業者に周知であり、1995年にScientific American Booksによって出版された、James Darnellらによる「分子細胞生物学(Molecular Cell Biology)」第3版などの種々の教科書に見出すことができる。天然に存在するアミノ酸は、式(NH2)C(COOH)(H)(R)(式中、括弧内の化学基はそれぞれ、括弧内にない炭素に結合している)により表されることが多い。Rは、この特定の式における側鎖を表す。
【0142】
本明細書中で使用される場合、記号
【0143】
【化39】

【0144】
は、一方は示されており、他方は典型的には示されていない、2つの化学物質の間の連結位置での結合を示す。例えば、
【0145】
【化40】

【0146】
は、化学物質「XY」が、連結結合の位置を介して別の化学物質に結合していることを示す。さらに、示されていない化学物質への具体的な連結位置は、推測によって特定することができる。例えば、化合物CH3-R3(式中R3は、Hまたは
【0147】
【化41】

【0148】
である)は、R3が「XY」である場合、連結結合の位置は、R3がCH3に結合していることを示している結合と同じ結合であることを暗示する。
【0149】
天然に存在するアミノ酸の側鎖またはその塩素化型の例としては、-CH2-CH(CH3)CH3;-CH2-CH(CCl3)CH3;-CH2-CH(CHCl2)CH3;-CH2-CH(CH2Cl)CH3;-CH2-CH(CCl3)CH2Cl;-CH2-CH(CHCl2)CH2Cl;-CH2-CH(CH2Cl)CH2Cl;-CH2-CH(CCl3)CHCl2;-CH2-CH(CHCl2)CHCl2;-CH2-CH(CH2Cl)CHCl2;-CH2-CH(CCl3)CCl3;-CH2-CH(CHCl2)CCl3;-CH2-CH(CH2Cl)CCl3;-CH(CH3)CH3;-CH(CCl3)CH3;-CH(CHCl2)CH3;-CH(CH2Cl)CH3;-CH(CCl3)CH2Cl;-CH(CHCl2)CH2Cl;-CH(CH2Cl)CH2Cl;-CH(CCl3)CHCl2;-CH(CHCl2)CHCl2;-CH(CH2Cl)CHCl2;-CH(CCl3)CCl3;-CH(CHCl2)CCl3;-CH(CH2Cl)CCl3;-CH(CH3)-CH(CH3)CH3;-CH(CH3)-CH(CCl3)CH3;-CH(CH3)-CH(CHCl2)CH3;-CH(CH3)-CH(CH2Cl)CH3;-CH(CH3)-CH(CCl3)CH2Cl;-CH(CH3)-CH(CHCl2)CH2Cl;-CH(CH3)-CH(CH2Cl)CH2Cl;-CH(CH3)-CH(CCl3)CHCl2;-CH(CH3)-CH(CHCl2)CHCl2;-CH(CH3)-CH(CH2Cl)CHCl2;-CH(CH3)-CH(CCl3)CCl3;-CH(CH3)-CH(CHCl2)CCl3;および-CH(CH3)-CH(CH2Cl)CCl3が挙げられる。
【0150】
本明細書中に記載した式にかかわる実施態様は、本明細書中に示したもの、または記載したものを含めて、すべての考えられる立体化学的な代替物を含む。
【0151】
いくつかの実施態様において、本明細書中に記載した化合物、または上記のその許容される塩は、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患(polycystic ovary disease)、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症の全身的治療に使用することができる。いくつかの実施態様において、本明細書中に記載した化合物、または上記のその許容される塩は、本明細書中に記載した適応症の全身的治療のための医薬または組成物の製造に使用することができる。いくつかの実施態様において、本明細書中に記載した任意の適応症を全身的に治療する方法もまた提供される。本発明のいくつかの態様は、本明細書中に記載した化合物、および薬学的に許容される賦形剤または担体を含む組成物を利用する。いくつかの実施態様において、前立腺癌は、アンドロゲン非依存性前立腺癌(ホルモン抵抗性、去勢抵抗性、アンドロゲン遮断抵抗性、アンドロゲン除去抵抗性、アンドロゲン枯渇非依存性、去勢-再発性、抗アンドロゲン薬-再発性ともいう)である。いくつかの実施態様において、前立腺癌は、アンドロゲン依存性またはアンドロゲン感受性である。本明細書中に記載した任意の適応症を治療する方法もまた提供される。かかる方法は、本明細書中に記載した化合物もしくは本明細書中に記載した化合物の組成物、または有効量の本明細書中に記載した化合物もしくは本明細書中に記載した化合物の組成物を、それを必要とする対象に投与することを含むことができる。
【0152】
いくつかの実施態様によれば、本明細書中に記載した化合物のプロドラッグもまた提供される。当業者は、プロドラッグが、特定の条件下で本明細書中に記載した化合物またはその塩に変換される化合物であることを理解する。特定の条件としては、例えば、限定されないが、インビボの酵素的または非酵素的な手段を挙げることができる。プロドラッグの変換は、例えば、限定されないが、自発的に起こってもよく、また該変換は触媒され、別の薬剤、または物理的パラメータもしくは環境パラメータ、例えば、酵素、光、酸、温度、もしくはpH、の変化によって誘発されてもよい。いくつかの実施態様において、プロドラッグ自体は、薬理学的活性をほとんどまたは全く有していなくてもよいが、その後本明細書中に記載した化合物に変換されると、所望の活性を有する。プロドラッグは、例えば、限定されないが、本明細書中に記載した化合物中の適切な官能基(例えば、カルボン酸官能基-COOH、アルコール官能基-OH、または第一級もしくは第二級のアミン官能基)を適切な部分を用いて変換することによって、調製することができる。適切な部分は、当業者によって理解され、判断され得る。例えば、限定されないが、プロドラッグは、第一級または第二級のアミノ官能基をアミド官能基に変換することによって、形成することができる。例えば、限定されないが、プロドラッグは、カルボン酸官能基をエステル官能基に変換することによって形成してもよく、またアルコール官能基をエーテル官能基に変換することによって形成してもよい。プロドラッグ部分は、例えば、限定されないが、官能基をマスクするように作用する保護基、1つ以上の能動輸送機構もしくは受動輸送機構の基質として作用する基、または化合物の性質、例えば、溶解性、バイオアベイラビリティもしくは局在性を付与するか、もしくは高めるように作用する基、であってもよい。いくつかの実施態様において、本明細書中に記載した化合物またはその塩自体を、本明細書中に記載した他の化合物のプロドラッグとすることができる。
【0153】
本明細書中に記載した化合物は、遊離形態であってもよく、その塩の形態であってもよい。いくつかの実施態様において、本明細書中に記載した化合物は、当該技術分野で公知の薬学的に許容される塩(Bergeら, J. Pharm. Sci. 1977, 66, 1)の形態とすることができる。本明細書中で使用される薬学的に許容される塩としては、例えば親化合物の所望の薬理学的活性を有する塩(親化合物の生物学的有効性および/または性質を保持し、生物学的にかつ/またはその他の点で望ましくないことがない、塩)が挙げられる。塩を形成することが可能な1個以上の官能基を有する本明細書中に記載した化合物は、例えば、薬学的に許容される塩として形成することができる。1個以上の塩基性官能基を含む化合物は、例えば、薬学的に許容される有機酸または無機酸と、薬学的に許容される塩を形成することが可能であり得る。薬学的に許容される塩は、例えば、限定されないが、酢酸、アジピン酸、アルギン酸、アスパラギン酸、アスコルビン酸、安息香酸、ベンゼンスルホン酸、酪酸、ケイ皮酸、クエン酸、ショウノウ酸、カンファースルホン酸、シクロペンタンプロピオン酸、ジエチル酢酸、ジグルコン酸、ドデシルスルホン酸、エタンスルホン酸、ギ酸、フマル酸、グルコヘプタン酸、グルコン酸、グリセロリン酸、グリコール酸、ヘミスルホン酸(hemisulfonic acid)、ヘプタン酸、ヘキサン酸、塩酸、臭化水素酸、ヨウ化水素酸、2-ヒドロキシエタンスルホン酸、イソニコチン酸、乳酸、リンゴ酸、マレイン酸、マロン酸、マンデル酸、メタンスルホン酸、2-ナフタレンスルホン酸(2-napthalenesulfonic acid)、ナフタレンジスルホン酸、p-トルエンスルホン酸、ニコチン酸、硝酸、シュウ酸、パモ酸、ペクチン酸(pectinic acid)、3-フェニルプロピオン酸、リン酸、ピクリン酸、ピメリン酸、ピバル酸、プロピオン酸、ピルビン酸、サリチル酸、コハク酸、硫酸、スルファミン酸、酒石酸、チオシアン酸、またはウンデカン酸に由来するものであってもよい。1個以上の酸性官能基を含む化合物は、薬学的に許容される塩基、例えば、限定されないが、アルカリ金属またはアルカリ土類金属に基づく無機塩基、または第一級アミン化合物、第二級アミン化合物、第三級アミン化合物、第四級アミン化合物、置換アミン、天然に存在する置換アミン、環式アミン、もしくは塩基性イオン交換樹脂などの有機塩基、と薬学的に許容される塩を形成することが可能であり得る。薬学的に許容される塩は、例えば、限定されないが、アンモニウム、ナトリウム、カリウム、リチウム、カルシウム、マグネシウム、鉄、亜鉛、銅、マンガン、もしくはアルミニウムなどの薬学的に許容される金属カチオンの水酸化物、炭酸塩、もしくは重炭酸塩、アンモニア、ベンザチン、メグルミン、メチルアミン、ジメチルアミン、トリメチルアミン、エチルアミン、ジエチルアミン、トリエチルアミン、イソプロピルアミン、トリプロピルアミン、トリブチルアミン、エタノールアミン、ジエタノールアミン、2-ジメチルアミノエタノール、2-ジエチルアミノエタノール、ジシクロヘキシルアミン、リシン、アルギニン、ヒスチジン、カフェイン、ヒドラバミン(hydrabamine)、コリン、ベタイン、エチレンジアミン、グルコサミン、グルカミン、メチルグルカミン、テオブロミン、プリン類、ピペラジン、ピペリジン、プロカイン、N-エチルピペリジン、テオブロミン、テトラメチルアンモニウム化合物、テトラエチルアンモニウム化合物、ピリジン、N,N-ジメチルアニリン、N-メチルピペリジン、モルホリン、N-メチルモルホリン、N-エチルモルホリン、ジシクロヘキシルアミン、ジベンジルアミン、N,N-ジベンジルフェネチルアミン、1-エフェナミン、N,N'-ジベンジルエチレンジアミン、またはポリアミン樹脂に由来するものであってもよい。いくつかの実施態様において、本明細書中に記載した化合物は、酸性基および塩基性基をともに含むことができ、内部塩または双性イオン、例えば限定されないがベタイン類、の形態とすることができる。本明細書中に記載した塩は、当業者に知られている常套の方法によって、例えば限定されないが、遊離形態を、有機酸、無機酸、有機塩基、もしくは無機塩基と反応させることによって、または他の塩からの陰イオン交換もしくは陽イオン交換によって、製造することができる。当業者は、塩の製造は、化合物の単離および/または精製の間にインサイチュで行ってもよく、また塩の製造は、単離および/または精製した化合物を別途反応させることによって行ってもよいことを理解する。
【0154】
いくつかの実施態様において、本明細書中に記載した化合物、およびそのすべての異なる形態(例えば遊離形態、塩、多形体、異性体)は、溶媒付加形態、例えば溶媒和物、とすることができる。溶媒和物は、化合物またはその塩と物理的に会合した、化学量論的量の溶媒または非化学量論的量の溶媒のいずれかを含む。溶媒は、例えば、限定されないが、薬学的に許容される溶媒であってもよい。例えば、溶媒が水である場合、水和物が形成され、また溶媒がアルコールである場合、アルコラート(alcoholates)が形成される。
【0155】
いくつかの実施態様において、本明細書中に記載した化合物、およびそのすべての異なる形態(例えば遊離形態、塩、溶媒和物、異性体)は、結晶形態および/または非晶質形態、例えば、多形体、擬似多形体、立体配座多形体、非晶質形態、もしくはこれらの組み合わせ、を含むことができる。多形体は、同じ元素組成の化合物の異なる結晶充填配列を含む。多形体は、通常、異なるX線回折パターン、赤外線スペクトル、融点、密度、硬度、結晶形、光学特性および電気的特性、安定性、ならびに/または溶解度を有する。当業者は、再結晶溶媒、結晶化速度および保存温度を含む種々の要因が単一の結晶形態を優位にさせ得ることを理解する。
【0156】
いくつかの実施態様において、本明細書中に記載した化合物、およびそのすべての異なる形態(例えば遊離形態、塩、溶媒和物、多形体)は、幾何異性体、不斉炭素に基づく光学異性体、立体異性体、互変異性体、個々の鏡像異性体、個々のジアステレオマー、ラセミ体、ジアステレオマーの混合物、およびこれらの組み合わせなどの異性体を含み、便宜上示された式の記載によって限定されない。
【0157】
いくつかの実施態様において、本発明による医薬組成物は、かかる化合物の塩、好ましくは薬学的または生理学的に許容される塩を含むことができる。医薬製剤は、投与が、注射、吸入、局所投与、洗浄、または選択される治療に適するその他の様式によるかにかかわらず、典型的には、該製剤の投与様式について許容される1種以上の担体、賦形剤、または希釈剤を含むことになる。適切な担体、賦形剤、または希釈剤としては、かかる投与様式において使用するための、当該技術分野で公知のものが挙げられる。
【0158】
適切な医薬組成物は、当該技術分野で公知の手段によって製剤化することができ、その投与様式および用量は、当業者によって決定され得る。非経口投与については、化合物を、滅菌水もしくは生理食塩水、または非水溶性化合物の投与に使用される薬学的に許容される媒体、例えばビタミンKに使用されるものなど、に溶解することができる。腸内投与については、化合物を錠剤、カプセル剤で投与してもよく、液体形態に溶解してもよい。錠剤またはカプセル剤は、腸溶コーティングのものであってもよく、徐放用製剤様であってもよい。放出させる化合物を封入したポリマーもしくはタンパク質の微粒子、軟膏剤、ペースト剤、ゲル、ヒドロゲル、または溶液を含めて、化合物を投与するために局所的に(topically)または局所的に(locally)使用することができる、多数の適切な製剤が公知である。長期間にわたる放出を提供するために、徐放性の貼付剤またはインプラントを使用することができる。当業者に知られている多数の技術が、Alfonso GennaroによるRemington: the Science & Practice of Pharmacy, 第20版, Lippencott Williams & Wilkins, (2000)に記載されている。非経口投与用の製剤は、例えば、賦形剤、ポリエチレングリコールなどのポリアルキレングリコール、植物由来の油、または水素化ナフタレンを含んでいてもよい。化合物の放出を制御するために、生体適合性、生分解性のラクチド重合体、ラクチド/グリコリド共重合体、またはポリオキシエチレン-ポリオキシプロピレン共重合体を使用することができる。他の潜在的に有用な、調節性化合物の非経口的送達系としては、エチレン-酢酸ビニル共重合体粒子、浸透圧ポンプ、埋め込み型の注入系、およびリポソームが挙げられる。吸入用の製剤は、賦形剤、例えばラクトースを含んでいてもよく、例えばポリオキシエチレン-9-ラウリルエーテル、グリココール酸(glycocholate)およびデオキシコール酸(deoxycholate)を含む水溶液であってもよく、点鼻剤の形態で投与するための油性溶液であってもよく、ゲル様であってもよい。
【0159】
本発明による、または本発明で使用するための、化合物または医薬組成物は、インプラント、移植片、プロテーゼ、ステントなどの医療機器または医療器具によって、投与することができる。さらに、インプラントは、かかる化合物または組成物を含み、放出するように意図された、考案されたものであってもよい。1つの例は、ある期間にわたって化合物を放出するように適合した高分子材料でできたインプラントである。
【0160】
本発明による医薬組成物の「有効量」は、治療的有効量または予防的有効量を含む。「治療的有効量」は、腫瘍の大きさの減少、寿命の増大、または平均余命の増大などの所望の治療結果を達成するための、投薬時の、かつ必要な期間についての、効果的な量を指す。化合物の治療的有効量は、対象の病態、年齢、性別、および体重、ならびに対象において所望の反応を誘発する化合物の能力などの要因に応じて変化し得る。投薬計画は、最適な治療反応を提供するように調整することができる。治療的有効量はまた、治療的に有益な効果が、化合物の何らかの毒性効果または有害作用を上回る、量でもある。「予防的有効量」は、腫瘍の縮小、寿命の増大、平均余命の増大、または前立腺癌のアンドロゲン非依存性形態への進展の予防などの所望の予防的結果を達成するための、投薬時の、かつ必要な期間についての、効果的な量を指す。典型的には、疾患の前または疾患の初期段階には、予防用量が対象に使用され、したがって予防的有効量は、治療的有効量よりも少なくなり得る。
【0161】
投薬量の数値は、緩和させる病状の重症度によって変化し得ることに留意されたい。任意の特定の対象について、具体的な投薬計画は、個々の必要性、および組成物の投与を管理または監督する人の専門的な判断に応じて、経時的に調整することができる。本明細書中に示す投薬量の範囲は例示的なものに過ぎず、医療の実務家によって選択され得る投薬量の範囲を限定するものではない。組成物中の活性化合物(群)の量は、対象の病態、年齢、性別、および体重などの要因に応じて変化し得る。投薬計画は、最適な治療反応を提供するように調整することができる。例えば、単回のボーラス投与量を投与してもよく、いくつかの分割した用量を経時的に投与してもよく、用量を治療状況の要求によって示される通りに比例的に減少または増大させてもよい。投与の容易さ、および投薬量の均一性のために、投薬単位の形態で非経口的組成物を製剤化することが有利であり得る。
【0162】
いくつかの実施態様において、本明細書中に記載した化合物、およびそのすべての異なる形態は、例えば、限定されないが、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患(polycystic ovary disease)、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症のために、他の治療方法と併用して使用することができる。例えば、本明細書中に記載した化合物、およびすべてのその異なる形態は、手術、放射線療法(近接照射療法もしくは外部ビーム)、またはその他の治療法(例えばHIFU)とともに、ネオアジュバント(術前)療法、補助的(術中)療法、および/またはアジュバント(術後)療法として、使用することができる。
【0163】
一般に、本発明の化合物は、実質的な毒性をもたらすことなく使用されるべきである。本発明の化合物の毒性は、標準的な技術を用いて、例えば細胞培養物または実験動物で試験し、治療指数、すなわちLD50(個体群の50%に対して致死的な用量)とLD100(個体群の100%に対して致死的な用量)との比を特定することによって、定量することができる。しかしながら、状況によっては、例えば重篤な病状などでは、相当な過剰量の組成物を投与することが必要であることがある。本発明の化合物には、一部の濃度で毒性になり得るものがある。毒性のある濃度および毒性を示さない濃度を特定するために、用量設定の研究を使用することができる。毒性は、陰性対照としてARを発現しないPC3細胞を用いて、特定の化合物または組成物の諸細胞株にわたる特異性を調べることによって、評価することができる。化合物が他の組織に対する何らかの効果を有する場合、動物試験を使用して効能(indication)を示すことができる。抗アンドロゲン剤およびアンドロゲン不感性症候群は致死的ではないため、ARを標的にする全身療法は、おそらく他の組織に重大な問題を生じさせることにはならない。
【0164】
本明細書中に記載した化合物は、対象に投与することができる。本明細書中で使用される場合、「対象」は、ヒト、非ヒト霊長類、ラット、マウス、ウシ、ウマ、ブタ、ヒツジ、ヤギ、イヌ、ネコなどであってもよい。対象は、前立腺癌、乳癌、卵巣癌、または子宮内膜癌などの癌を有することが疑われるものであってもよく、該癌を有する危険性があるものであってもよく、ざ瘡、多毛症、脱毛症、良性前立腺肥大症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、または加齢性黄斑変性症を有することが疑われるものであってもよく、それを有する危険性があるものであってもよい。前立腺癌、乳癌、卵巣癌、または子宮内膜癌などの種々の癌の診断法、およびざ瘡、多毛症、脱毛症、良性前立腺肥大症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、または加齢性黄斑変性症の診断法、ならびに前立腺癌、乳癌、卵巣癌、または子宮内膜癌などの癌を臨床的に線引きすること(clinical delineation)、ざ瘡、多毛症、脱毛症、良性前立腺肥大症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、または加齢性黄斑変性症を診断し、臨床的に線引きすること(clinical delineation)は、当業者に知られている。
【0165】
本明細書中に記載した化合物は、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症の治療に使用することができる。本明細書中に記載した化合物は、前立腺癌の治療に使用することができる。本明細書中に記載した化合物は、アンドロゲン非依存性前立腺癌の治療に使用することができる。本明細書中に記載した化合物は、アンドロゲン依存性前立腺癌の治療に使用することができる。本明細書中に記載した化合物は、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症の治療用の医薬の製造に使用することができる。本明細書中に記載した化合物は、前立腺癌の治療用の医薬の製造に使用することができる。本明細書中に記載した化合物は、アンドロゲン非依存性前立腺癌の治療用の医薬の製造に使用することができる。本明細書中に記載した化合物は、アンドロゲン依存性前立腺癌の治療用の医薬の製造に使用することができる。本明細書中に記載した化合物は、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、および加齢性黄斑変性症からなる群から選択される少なくとも1つの適応症の治療方法に使用することができる。該方法は、それを必要とする対象に、有効量の本明細書中に記載した化合物を投与することを含むことができる。本明細書中に記載した化合物は、前立腺癌の治療方法に使用することができ、該方法は、それを必要とする対象に、有効量の本明細書中に記載した化合物を投与することを含む。本明細書中に記載した化合物は、アンドロゲン非依存性前立腺癌の治療方法に使用することができ、該方法は、それを必要とする対象に、有効量の本明細書中に記載した化合物を投与することを含む。本明細書中に記載した化合物は、アンドロゲン依存性前立腺癌の治療方法に使用することができ、該方法はそれを必要とする対象に、有効量の本明細書中に記載した化合物を投与することを含む。
【0166】
本明細書中に記載した化合物はまた、アッセイにおいて、および研究目的で、使用することもできる。ARのリガンド非依存性の活性化は、例えば、ホルスコリン(forskolin)(FSK)を用いるcAMP依存性プロテインキナーゼ(PKA)経路の刺激作用による、アンドロゲン(リガンド)の非存在下でのARのトランス活性化を指す。本発明の化合物および組成物には、ARE-ルシフェラーゼ(ARE-luciferase)(ARE-luc)のFSKによる誘発およびアンドロゲン(例えばR1881)による誘発の双方を阻害し得るものもある。かかる化合物は、ARのリガンド依存性活性化およびリガンド非依存性活性化の双方に共通する機構を妨害し得る。このことは、熱ショックタンパク質の解離、不可欠な翻訳後修飾(例えば、アセチル化、リン酸化)、核移行、タンパク質-タンパク質相互作用、転写複合体の形成、コリプレッサーの放出、および/または分解の増大を含めた、ARの活性化におけるどのような段階にも関係し得る。本発明の化合物および組成物には、R1881のみを阻害し得、リガンド依存性活性化に特異的な機構(例えば、リガンド結合領域(LBD)のアンドロゲンへの接近可能性)を妨害し得るものもある。前立腺癌に加えて多数の疾患がアンドロゲン軸(androgen axis)に関係しており(例えば、ざ瘡、多毛症、脱毛症、良性前立腺肥大症)、この機構を妨害する化合物は、かかる病気を治療するために使用することができる。本発明の化合物および組成物には、FSKによる誘発を阻害し得るに過ぎず、ARのリガンド非依存性活性化に対する特異的な阻害剤であり得るものもある。これらの化合物および組成物は、FSKおよび/またはPKAの活動について通常起こる現象のカスケードを妨害し得、またARに対して役割を果たし得るどのような下流効果(例えばFSKは、ARの活性に強力な影響を有する、MAPK活性を増大させる)をも妨害し得る。例としては、cAMPおよびまたはPKAもしくは他のキナーゼの阻害剤を挙げることができる。本発明の化合物および組成物には、ARの基底レベルの活性(アンドロゲンなし、またはPKA経路の刺激作用)を誘発し得るものもある。本発明の化合物および組成物には、R1881またはFSKによる誘発を増大させ得るものもある。かかる化合物および組成物は、ARの転写またはトランス活性化を刺激し得る。本発明の化合物および組成物には、アンドロゲン受容体のN末端領域(ARのNTD)の活性を阻害し得るものもある。インターロイキン6(IL-6)もまた、LNCaP細胞におけるARのリガンド非依存性活性化を引き起こし、FSKに加えて使用され得る。本発明の化合物および組成物は、ARのNTDと相互作用することができ、またARのNTDのトランス活性化に必要な別のタンパク質と相互作用することができる。
【0167】
本発明において使用する化合物は、医薬の供給源(medical sources)から入手してもよく、天然に存在する化合物から公知の方法を用いて修飾してもよい。また、本発明の化合物の製造方法または合成方法は、公知の化学合成の原理を参照する当業者によって理解される。例えば、Willardら, J. Org. Chem., 1984, 49, 3489〜3493、およびBrantleyら, Organic Letters, 1999, 第1巻, 13号, 2165〜2167は、式A〜Eの化合物の製造のために考慮して適切に適合し得る、適切な合成手順を記載している。
【0168】
式A〜Eの化合物の化学的製造の一般的な方法を、以下の非限定的な例示的なスキームに記載する。
【0169】
【化42】

【0170】
式A〜Eの化合物はまた、以下の非限定的な例示的なスキームに記載される化学的方法によって製造することもできる。
【0171】
【化43−1】

【0172】
【化43−2】

【0173】
上記のスキームにおいて、R25、R26およびR27は、本明細書中のいずれかの箇所で定義した通りである。
【0174】
式A〜Eの化合物の化学的製造の一般的な方法を、非ハロゲン化ロイシン側鎖を例として用いて、以下の例示的な非限定的なスキームにも記載する。
【0175】
【化44】

【0176】
ハロゲン化型を提供する方法は、Brantley, S.ら, (1999) Organic Letters 1:2165〜67に記載されたトリクロロメチル置換基を与える手順を含めた当該技術から適したものとすることができる。
【0177】
別の実施態様によれば、式(K):
【0178】
【化45】

【0179】
[式中、R25は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、COOR’、CONH2、CONHR’、CONR’2、R’、OH、OR’、F、Cl、Br、I、NH2、NHR’、NR’2、CN、SH、SR’、SO3H、SO3R’、SO2R’、OSO3R’、およびNO2のうちの1個以上から選択することができ、式中R’は、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができ;R26は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、CONH2、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができ;R27は、任意に置換されたBu、Pr、Et、またはMeとすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができる]
の化合物の製造方法が提供される。
【0180】
1つの実施態様において、R25は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、R’、OH、OR’、F、Cl、Br、I、NH2、NHR’、NR’2、CN、SH、SR’、SO3H、SO3R’、SO2R’、OSO3R’、およびNO2のうちの1個以上から選択することができ、式中R’は、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルとすることができる。別の実施態様において、R25は、H、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、およびNO2のうちの1個以上から選択することができる。あるいはR25は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択することができる。1つの実施態様において、例えば、限定されないが、R25は、本明細書中のいずれかの箇所に記載したR2と同じ定義であってよい。
【0181】
1つの実施態様において、R26は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択することができる。あるいはR26は、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基とすることができ、その任意の置換基は、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択することができる。1つの実施態様において、例えば、限定されないが、R26は、本明細書中のいずれかの箇所に記載したR5と同じ定義であってよい。
【0182】
1つの実施態様において、R27は、任意に置換されたBu、Pr、Et、またはMeとすることができ、その任意の置換基は、オキソ、OH、F、Cl、Br、およびIのうちの1個以上から選択することができる。あるいはR27は、任意に置換されたBu、Pr、Et、またはMeとすることができ、その任意の置換基は、F、Cl、Br、およびIのうちの1個以上から選択することができる。1つの実施態様において、例えば、限定されないが、R27は、本明細書中のいずれかの箇所に記載したZと同じ定義であってよい。
【0183】
1つの実施態様によれば、該方法は、例えば、限定されないが、
式(Q):
【0184】
【化46】

【0185】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物をn-BuLiと混合して、混合物を形成すること、および該混合物を式(S):
【0186】
【化47】

【0187】
(式中R26は上記のいずれかの箇所に定義した通りであり、Protは保護基である)の化合物と反応させて、式(T):
【0188】
【化48】

【0189】
(式中R25およびR26は上記のいずれかの箇所に定義した通りであり、Protは保護基である)の化合物を形成すること;
式(T)の化合物を脱保護して、式(U):
【0190】
【化49】

【0191】
(式中R25およびR26は上記のいずれかの箇所に定義した通りである)の化合物を形成すること;ならびに
式(U)の化合物をピリジン中で式(V):
【0192】
【化50】

【0193】
(式中R27は上記のいずれかの箇所に定義した通りである)の化合物と反応させて、式(K)の化合物を形成すること
を含むことができる。
【0194】
1つの実施態様によれば、式(Q)の化合物は、例えば、限定されないが、溶媒中でn-BuLiと混合することができる。溶媒は、特に限定されず、適切な溶媒は、当業者によって理解され、特定され得る。1つの実施態様において、溶媒は、例えば、限定されないが、非プロトン性溶媒とすることができる。1つの実施態様において、溶媒は、例えば、限定されないが、ジエチルエーテル、ジメチルホルムアミド(DMF)、またはテトラヒドロフラン(THF)とすることができる。1つの実施態様において、溶媒は、例えば、限定されないが、THFとすることができる。式(Q)の化合物をn-BuLiと混合するのに適した温度は、当業者によって理解され、特定され得る。1つの実施態様において、式(Q)の化合物は、例えば、限定されないが、-50℃などの、例えば、限定されないが、約-50℃以下であって、この範囲内の任意の特定の数値を含めた温度で、n-BuLiと混合することができる。1つの実施態様において、混合温度は、例えば、-50℃とすることができる。
【0195】
別の実施態様によれば、その混合物は、例えば、限定されないが、溶媒中で、式(S)の化合物と反応させることができる。溶媒は、特に限定されず、適切な溶媒は、当業者によって理解され、特定され得る。1つの実施態様において、溶媒は、例えば、限定されないが、非プロトン性溶媒とすることができる。1つの実施態様において、溶媒は、例えば、限定されないが、ジエチルエーテル、ジメチルホルムアミド(DMF)、またはテトラヒドロフラン(THF)とすることができる。1つの実施態様において、溶媒は、例えば、限定されないが、THFとすることができる。
【0196】
式(S)の化合物および式(T)の化合物の保護基Protは、特に限定されず、適切なアミン保護基は、当業者によって理解され、特定され得る。1つの実施態様において、保護基は、例えば、限定されないが、tert-ブチルオキシカルボニル(Boc)基、またはカルボベンジルオキシ(Cbz)基とすることができる。1つの実施態様において、保護基は、例えば、限定されないが、Bocとすることができる。
【0197】
式(T)の化合物から保護基Protを脱保護するか、または除去する適切な方法は、当業者によって理解され、特定され得る。1つの実施態様において、式(T)の化合物は、例えば、限定されないが、強酸を用いて脱保護することができる。1つの実施態様において、式(T)の化合物は、例えば、限定されないが、トリフルオロ酢酸(TFA)を用いて脱保護することができる。1つの実施態様において、式(T)の化合物の脱保護は、例えば、限定されないが、溶媒中で行うことができる。1つの実施態様において、溶媒は、例えば、限定されないが、ジクロロメタン(DCM)、DMF、クロロホルム、またはTHFとすることができる。1つの実施態様において、溶媒は、例えば、限定されないが、DCMとすることができる。
【0198】
式(U)の化合物と式(V)の化合物との適切な反応温度は、当業者によって理解され、特定され得る。1つの実施態様において、式(U)の化合物は、式(V)の化合物と、例えば、限定されないが、約-20℃以上約100℃まで(約100℃を含み、この範囲内の任意の特定の数値を含む)で反応させることができる。1つの実施態様において、式(U)の化合物は、式(V)の化合物と、例えば、限定されないが、室温で反応させることができる。
【0199】
別の実施態様によれば、式(K)の化合物の製造方法は、例えば、限定されないが、式(R):
【0200】
【化51】

【0201】
(式中R26およびProtは上記のいずれかの箇所に定義した通りである)の化合物を任意の順序で、p-ニトロフェノール、およびカルボジイミド含有化合物と混合して、式(S):
【0202】
【化52】

【0203】
(式中R26およびProtは上記のいずれかの箇所に定義した通りである)の化合物を形成することをさらに含むことができる。式(R)の化合物、p-ニトロフェノール、およびカルボジイミド含有化合物は、例えば、限定されないが、任意の順序で混合することができる。1つの実施態様において、例えば、限定されないが、式(R)の化合物は、p-ニトロフェノールと混合してから、カルボジイミド含有化合物と混合することができる。1つの実施態様において、例えば、限定されないが、式(R)の化合物は、カルボジイミド含有化合物と混合してから、p-ニトロフェノールを混合することができる。1つの実施態様において、例えば、限定されないが、式(R)の化合物、p-ニトロフェノール、およびカルボジイミド含有化合物は、同時に混合することができる。1つの実施態様において、式(S)の化合物は、例えば、限定されないが、溶媒中で形成することができる。適切な溶媒は、当業者によって理解され、特定され得る。1つの実施態様において、式(S)の化合物は、例えば、限定されないが、DMF、THF、ジアルキルエーテル溶媒、またはハロゲン化溶媒の中で形成することができる。1つの実施態様において、溶媒は、例えば、限定されないが、DMF、DCM、またはTHFであってもよい。1つの実施態様において、溶媒は、例えば、限定されないが、THFであってもよい。式(S)の化合物を形成するための適切な反応温度は、当業者によって理解され、特定され得る。1つの実施態様において、式(S)の化合物を形成するための反応温度は、例えば、限定されないが、約-20℃以上約50℃まで(約50℃を含み、この範囲内の任意の特定の数値を含む)とすることができる。1つの実施態様において、式(S)の化合物を形成するための反応温度は、例えば、限定されないが、5℃であってもよい。1つの実施態様において、カルボジイミド含有化合物は、例えば、限定されないが、ジシクロヘキシルカルボジイミド(DCC)またはジイソプロピルカルボジイミド(DIPC)であってもよい。1つの実施態様において、カルボジイミド含有化合物は、例えば、限定されないが、DCCであってもよい。
【0204】
別の実施態様によれば、式(K)の化合物の製造方法は、例えば、限定されないが、式(P):
【0205】
【化53】

【0206】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を、MeOH中でヒドラジン一水和物と反応させて、式(Q):
【0207】
【化54】

【0208】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を形成することをさらに含むことができる。
【0209】
別の実施態様によれば、式(K)の化合物の製造方法は、例えば、限定されないが、式(O):
【0210】
【化55】

【0211】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を、触媒としての濃H2SO4の存在下で、MeOH中、オルトギ酸トリメチルと反応させて、式(P):
【0212】
【化56】

【0213】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を形成することをさらに含むことができる。1つの実施態様において、MeOHは、例えば、限定されないが、無水MeOHであってもよい。
【0214】
別の実施態様によれば、式(K)の化合物の製造方法は、例えば、限定されないが、
式(M):
【0215】
【化57】

【0216】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を、塩素化剤と反応させて、式(N):
【0217】
【化58】

【0218】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を形成すること;および
式(N)の化合物を、マロン酸モノエチルとアルキルリチウム化合物とを混合することによって形成された懸濁液と反応させて、式(O):
【0219】
【化59】

【0220】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を形成すること
をさらに含むことができる。1つの実施態様において、塩素化剤は、例えば、限定されないが、SOCl2、塩化オキサリル、または三塩化リン(PCl3)であってもよい。1つの実施態様において、塩素化剤は、例えば、限定されないが、SOCl2であってもよい。1つの実施態様において、式(M)の化合物は、例えば、限定されないが、溶媒中で塩素化剤と反応させることができる。適切な溶媒は、当業者によって理解され、特定され得る。1つの実施態様において、溶媒は、例えば、限定されないが、DCM、THF、DMF、クロロホルム、またはジエチルエーテルであってもよい。1つの実施態様において、溶媒は、例えば、限定されないが、DCMであってもよい。1つの実施態様において、懸濁液は、例えば、限定されないが、溶媒中でマロン酸モノエチルをアルキルリチウム化合物と混合することによって形成することができる。1つの実施態様において、アルキルリチウム化合物は、例えば、限定されないが、エチルリチウム、プロピルリチウム、ペンチルリチウム、フェニルリチウム、またはブチルリチウム(n-BuLi)であってもよい。1つの実施態様において、アルキルリチウム化合物は、例えば、限定されないが、n-BuLiであってもよい。式(N)の化合物と懸濁液との適切な反応温度は、当業者によって理解され、また特定され得る。1つの実施態様において、式(N)の化合物は、例えば、限定されないが、約-50℃以下であって、この範囲内の任意の特定の温度を含めた温度で、懸濁液と反応させることができる。1つの実施態様において、式(N)の化合物は、例えば、限定されないが、約-78℃の温度で懸濁液と反応させることができる。
【0221】
別の実施態様によれば、式(K)の化合物の製造方法は、例えば、限定されないが、式(L):
【0222】
【化60】

【0223】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を、Na2CO3およびH2Oの存在下、約室温で、N-カルボエトキシフタルイミドと反応させて、式(M):
【0224】
【化61】

【0225】
(式中R25は上記のいずれかの箇所に定義した通りである)の化合物を形成することをさらに含むことができる。
【0226】
いくつかの実施態様において、式(L)、(M)、(N)、(O)、(P)、(Q)、(R)、(S)、(T)または(U)(式中、R25、R26およびR27は、上記のいずれかの箇所に定義した通りである)の化合物がさらに提供される。いくつかの実施態様において、例えば、限定されないが、R25およびR26は独立して、ロイシンの一塩素化メチル側鎖、二塩素化メチル側鎖、または三塩素化メチル側鎖とすることができる。
【0227】
本発明の種々の別の実施態様および実施例を本明細書中に記載する。これらの実施態様および実施例は、説明的なものであり、本発明の範囲を限定するものと解釈するべきではない。
【実施例】
【0228】
全般的方法
細胞株、アンドロゲンおよびレポーター
LNCaP細胞は、高分化ヒト前立腺癌細胞(FSKによるARのリガンド非依存性活性化は該細胞中で特徴づけられた;Nazarethら 1996 J. Biol. Chem. 271, 19900〜19907; およびSadar 1999 J. Biol. Chem. 274, 7777〜7783)であるため、すべての実験について、最初にLNCaP細胞を使用した。LNCaP細胞は、内在性ARを発現し、前立腺特異抗原(prostate-specific antigen)(PSA)を分泌する(Horoszewiczら 1983 Cancer Res. 43, 1809〜1818)。LNCaP細胞は、細胞培養液中での単層としてか、または去勢された宿主においてアンドロゲン非依存性に発展する、はっきり特徴づけられた異種移植モデルにおける腫瘍としてか、のいずれかで成長させることができる(Satoら 1996 J. Steroid Biochem. Mol. Biol. 58, 139〜146; Gleaveら 1991 Cancer Res. 51, 3753〜3761; Satoら 1997 Cancer Res. 57, 1584〜1589; およびSadarら 2002 Mol. Cancer Ther. 1(8), 629〜637)。PC3ヒト前立腺癌細胞は機能的なARを発現しないため(Kaighnら1978 Natl. Cancer Inst. Monogr. 49, 17〜21)、該細胞をARに対する化合物の特異性を調べるために使用した。ARのNTDを特異的に標的とする小分子は、PC3細胞に対して効果を有しないはずである。このことは、小分子がその阻害効果をARが媒介することを特異的に阻止する場合、小分子はPC3細胞の増殖を変化させないはずであるということを意味する。R1881は安定であり、不安定な生理学的リガンドのジヒドロテストステロン(dihydrotestosterone)(DHT)と関連する諸問題を免れているため、R1881を使用した。いくつかの選択的なレポーター遺伝子コンストラクトを用いて、レポーターの特異性を判定することができる。広範に使用されている、特徴のはっきりしたAREによって駆動されるレポーター遺伝子コンストラクトには、いくつかのAREを含み、アンドロゲンおよびFSKによって高度に誘発されるPSA(6.1 kb)エンハンサー(enhance)/プロモーター(Uedaら 2002 A J. Biol. Chem. 277, 7076〜7085)、ならびにARR3-チミジンキナーゼ(tk)-ルシフェラーゼ(ARR3-thymidine kinase (tk)-luciferase)があり、該ARR3-チミジンキナーゼ(tk)-ルシフェラーゼは、ルシフェラーゼレポーターの上流にラットプロバシンのARE1領域およびARE2領域の3つの縦列反復を含む人工的なレポーターコンストラクトである(Snoekら 1996 J. Steroid Biochem. Mol. Biol. 59, 243〜250)。CMV-luc(AREがなく、構成的に活性である)を使用して、化合物は転写に対する普遍的な阻害効果は有していないと判定した。
【0229】
動物モデル
一部の実験では、SCIDマウスを使用した。ヒトの細胞株および移植性腫瘍は、免疫無防備状態の動物において生存し、SCIDマウスが最良の生着率(take rates)を示すため、SCIDマウスを選択した。すべての手順は、ブリティッシュコロンビア大学動物倫理委員会(University of British Columbia Committee for Animal Ethics)によって認可されており、毎年再審査されている。適切な動物保護を提供することができない緊急事態の場合、獣医または動物管理チーム(Animal Care Team)の裁量により動物を安楽死させる。獣医が検査および診察を担当する。署名された動物管理認可証(Animal Care Certificate)には、明確に「動物管理委員会(Animal Care Committee)は、上記実験計画または教育課程のために動物を使用することを検討および認可しており、関連する動物は、カナダ動物管理協会(Canadian Council on Animal Care)によって発行された実験動物の管理−カナダの指針(Care of Experimental Animals − A Guide for Canada)に含まれる原則に従って保護されることを保証している」と記載されている。
【0230】
皮下異種移植
LNCaPまたはPC3のヒト前立腺癌細胞(1×106個の細胞)の懸濁液150 μlを、6〜8週齢のオスの胸腺欠損SCIDマウスに、27ゲージの針によって、側腹部領域において、皮下接種した。接種は、動物がイソフルラン(isofluorane)麻酔にかかっている間に行った。腫瘍生着率(tumor take rate)はおよそ75%である。100 mm3の腫瘍を有する各マウスを無作為に治療群に割り当てた。去勢を以下に記載する通りに行った。触知可能となったか、または目に見えかつ少なくとも40 mm3となったLNCaP皮下腫瘍を有するマウスにおいて、腫瘍容積(式:L×W×H×0.5236)を測定した。動物を毎日モニターし、腫瘍を5日ごとに測定した。
【0231】
実験期間
腫瘍容積の評価(1000 mm3を超えない)を皮下異種移植実験の終了を決定する基準とした。
【0232】
組織学的検査(histology)および免疫組織化学的検査(immunohistochemistry)
ルーチン的な組織学的検査のために、実験完了時に主要な器官および異種移植片を収集し、10%の中性の緩衝化されたホルマリン中で固定し、次いでパラフィンで包埋した。固定した切片を切断し、ヘマトキシリン・エオシン染色(H&E)により染色した。異種移植片における増殖速度およびアポトーシスに対する化合物の可能な効果を特定するために、Ki-67での免疫染色およびTUNELアッセイを行った。Ki-67での免疫染色では、処理した組織切片に対して、0.5 μg/ml(1:50)のIgG濃度のMIB-1モノクローナル抗体を用いた。ARの濃度を免疫組織化学的検査またはウエスタンブロット解析によって測定した。
【0233】
進行を誘発するためのアンドロゲン除去
去勢によってアンドロゲン除去を完全なものにした。イソフルラン麻酔下で、5 mmの垂直の切開術を使用して、精巣が結合している精巣上体脂肪パッドを穏やかに取り除き、身体から精巣を除去した。精巣を血液供給物に結合させている索(cord)を縫合糸を用いて結紮し、次いで切断した。次いで索を腹腔に戻した。外科用縫合糸を使用して、切り口を閉じた。痛みを軽減するために、手術前にブプレノルフィン(0.05 mg/kg)を注射した。
【0234】
異種移植片および器官の回収
すべての異種移植片および主要な器官を解析のために回収した。回収は、CO2ガスによる心拍停止によって屠殺した後に行い、異種移植片または器官を免疫組織化学的検査の解析のために取り出した。
【0235】
安楽死
動物は、CO2ガスによる心拍停止によって屠殺した。この方法は、動物管理委員会(Animal Care Committee)によって定められた方針であり、環境に配慮したものであり、効率的であり、経済的であり、倫理的に認可されている。
【0236】
実施例
実施例1:アッセイに導かれた化合物の分画および単離
2006年6月にインドネシア、カリムンジャワ諸島(Karimunjawa archipelago)のパラウシントク(Palau Sintok)付近(北緯(N)55度02分52秒、東経(E)119度19分48秒)で、約15 mの深さの地点で、スキューバ(SCUBA)を用いて、手によって、ツチイロカイメン属(Dysidea)の種の試料を収集した。この海綿は、アムステルダム大学(University of Amsterdam)のRob van Soest教授によって同定され、証拠試料はアムステルダム動物学博物館(Zoological Museum of Amsterdam)に寄託されている(ZMA POR. 20602)。
【0237】
この新たに収集した灰色の海綿(140 g)を最初にMeOH中で保存し、カナダ、ブリティッシュコロンビア州(British Columbia)のバンクーバー(Vancouver)に、室温で5日間かけて輸送し、その後この試料を凍結させた。該海綿を小片に切断し、繰り返しMeOH(3×200 mL)に浸漬し、引き続いて該MeOHで抽出した。合わせたメタノール抽出物を真空中で濃縮し、次いで得られた油状物をEtOAc(4×5 mL)とH2O(20 mL)との間に分配した。合わせたEtOAc抽出物を蒸発乾固させ、得られた紫色の油状物を、4:1のMeOH/CH2Cl2を溶離液として用いてセファデックス(Sephadex)LH-20でのクロマトグラフィーに付し、ARR3-ルシフェラーゼアッセイにおいて活性を示した画分を得た。この物質を19:1のヘキサン/EtOAcからEtOAcまでの段階的(step)勾配を用いて、シリカゲルフラッシュクロマトグラフィーを用いて、さらに分画した。1:1のヘキサン/EtOAcにより溶出する画分を、13:7のMeCN/H2Oを溶離液として用い、CSC-Inertsil 150A/ODS2、5 μm 25×0.94 cmのカラムを用いて、C18逆相HPLCに付して、5つの画分を得た。最も極性の低い画分は純粋なシントカミドB(2)(4.4 mg)を含んでおり、二番目に極性の高い画分は、純粋なジサミドD(7)(0.2 mg)を含んでいた。最も早く溶出した最も極性の高い画分は、シントカミドC(3)およびシントカミドD(4)の混合物からなるものであった。同じカラムを用いるが、67:33のMeOH/H2Oを溶離液として用いるさらなるHPLC工程により、清浄なシントカミドC(3)(0.4 mg)およびシントカミドD(4)(0.3 mg)を得た。三番目に溶出した画分から、70:30のMeOH/H2Oを溶離液として用いて、さらにHPLCにより分画した後、非常に少量のシントカミドA(1)とともに、シントカミドE(5)(0.5 mg)の純粋な試料を得た。最後の画分から3:1のMeOH/H2Oを用いてシントカミドA(1)(29.6 mg)を得た。公知のジケトピペラジンであるジサミドA(6)およびB(7)もまた単離した。
【0238】
ナトリウム光(589 nm)を用いたJasco P-1010旋光計(Polarimeter)を用いて、旋光度を測定した。Waters 2487 Dual λ吸光度検出器(Absorbance Detector)を用いてUVスペクトルを記録した。5 mmのCPTCIクライオプローブを用いて、Bruker AV-600分光計で、1H NMRスペクトルおよび13C NMRスペクトルを記録した。1Hの化学シフトは残存するC6D6シグナル(δ 7.15 ppm)を基準としており、13Cの化学シフトは、該C6D6溶媒ピーク(δ 128.0 ppm)を基準としている。Bruker-Hewlett Packard 1100 Esquire-LCシステム質量分析計で低分解能ESI-QIT-MSを記録した。Merckの5554型シリカゲルプレートおよびWhatman MKC18Fプレートを分析用の薄層クロマトグラフィーに使用した。逆相HPLCによる精製は、Waters 996フォトダイオードアレイ検出器(Photodiode Array Detector)に結合したWaters 600E System Controllerによる液体クロマトグラフィーで行った。HPLCに用いたすべての溶媒は、Fisher HPLCグレードのものであった。(6)および(7)の構造は、これらの分光学的データと文献値(Su, J.-Y.ら (1993) J. Nat. Prod. 56:637〜642)とを比較することによって立証した。シントカミドA(1)は、MeOHからX線回折分析に適した結晶を与えた。ORTEP図によりNMR分析からの組成を立証し、絶対配置2S、4S、10R、16Sを明らかにした。シントカミドB(2)〜E(5)の構造は、シントカミドA(1)とMe18またはMe19での塩素化の程度が異なっている。
【0239】
【化62】

【0240】
シントカミドA(1):透明な油状物として単離した;[α]25D +35.9°(c 19.73、CH2Cl2);UV(CH2Cl2)λmax 224、242 nm;1H 表1参照;13Cおよび15N NMR 表2参照;陽イオンHRESIMS [M+Na]+ m/z 531.0145(C18H25N2O4Cl5Naについての計算値は531.0154)。
シントカミドB(2):透明な油状物として単離した;[α]25D +35.0°(c 2.93、CH2Cl2);UV(CH2Cl2)λmax 224、242 nm;1H 表1参照;13Cおよび15N NMR 表2参照;陽イオンHRESIMS [M+Na]+ m/z 564.9738(C18H24N2O4Cl6Naについての計算値は564.9765)。
シントカミドC(3):透明な油状物として単離した;[α]25D +58.7°(c 0.26、CH2Cl2);UV(CH2Cl2)λmax 224、242 nm;1H 表1参照;13Cおよび15N NMR 表2参照;陽イオンHRESIMS [M+Na]+ m/z 497.0532(C18H26N2O4Cl4Naについての計算値は497.0544)。
シントカミドD(4):透明な油状物として単離した;[α]25D +42.0°(c 0.20、CH2Cl2);UV(CH2Cl2)λmax 224、242 nm;1H 表1参照;13Cおよび15N NMR 表2参照;陽イオンHRESIMS [M+Na]+ m/z 497.0532(C18H26N2O4Cl4Naについての計算値は497.0544)。
シントカミドE(5):透明な油状物として単離した;[α]25D +47.6°(c 0.33、CH2Cl2);UV(CH2Cl2)λmax 224、242 nm;1H 表1参照;13Cおよび15N NMR 表2参照;陽イオンHRESIMS [M+Na]+ m/z 463.0931(C18H27N2O4Cl3Naについての計算値は463.0934)。
【0241】
【表1−1】

【0242】
【表1−2】

【0243】
【表2−1】

【0244】
【表2−2】

【0245】
実施例2:N-((R)-1-((S)-2-イソブチル-3-メトキシ-5-オキソ-2,5-ジヒドロ-1H-ピロール-1-イル)-4-メチル-1-オキソペンタン-2-イル)プロピオンアミドの合成
N-フタルイミド-L-ロイシン(1)
【0246】
【化63】

【0247】
L-ロイシン(5.12 g、39.1 mmol)およびNa2CO3(4.14 g、39.1 mmol)を40 mLの蒸留したH2Oに溶解した。この溶液にN-カルボエトキシ-フタルイミド(phathalimide)(8.55 g、39.1 mmol)を加え、次いで室温で2時間攪拌した。得られた透明な溶液を、6 N HClを用いてpH=0まで酸性化し、次いでヘキサン(3×100 mL)で抽出した。合わせた有機層を真空中で乾燥させた。シリカゲルでのカラムクロマトグラフィーを用い、ヘキサン/アセトン(3:1)で溶出させて、N-フタルイミド-L-ロイシン(1)(10.2 g、39.1 mmol、定量的)を無色の油状物として得た。1H NMR (400 MHz, CDCl3) δ 0.92 (d, J=6.70 Hz, 3 H), 0.94 (d, J=6.70 Hz, 3 H), 1.37 - 1.60 (m, 1 H), 1.95 (ddd, J=14.31, 10.05, 4.26 Hz, 1 H), 2.36 (ddd, J=14.31, 10.05, 4.26 Hz, 1 H), 4.99 (dd, J=11.57, 4.26 Hz, 1 H), 7.73 (dd, J=5.48, 3.05 Hz, 2 H), 7.85 (dd, J=5.48, 3.05 Hz, 2 H), 11.32 (br. s., 1 H); 13C NMR (75 MHz, CDCl3) δ: 21.2, 23.3, 25.3, 37.2, 50.6, 123.8, 131.9, 134.4, 167.9, 176.0。
【0248】
(S)-6-メチル-4-フタルイミド-3-オキソヘプタン酸エチル(3)
N-フタルイミド-L-ロイシン(1)(550 mg、2.11 mmol)を含む4 mLの乾燥DCMを、SOCl2(1.5 mL、20.5 mmol)とともに5時間還流した。過剰のSOCl2および溶媒を減圧下で蒸発させて、N-フタルイミド-L-ロイシニルクロリド(leucinyl chloride)(2)(535 mg、1.91 mmol、90%)を黄色油状物として生成させ、該生成物をさらに精製することなく使用した。マロン酸モノエチル(450 mg、3.41 mmol)を含む5 mLの乾燥THFに、-70℃でn-BuLi(3.7 mL、ヘキサン中2.0 M、7.4 mmol)を滴下して白色の懸濁液を得、これを-5℃まで穏やかに温め、次いで-78℃まで戻るように冷却した。酸塩化物(2)(535 mg、1.91 mmol)の溶解した2 mLの乾燥THFを、この懸濁液に、一度ですべて加え、この溶液をさらに20分間攪拌し、次いで7 mLの1 N HClと10 mLのエーテルとの溶液の中に注ぎ、5分間攪拌を続ける。この混合物を分離し、水層をエーテル(2×10 mL)で抽出した。合わせた有機層を飽和NaHCO3(3×10 mL)で洗浄した。無水MgSO4で乾燥させた後、エーテル相を真空中で蒸発させて、赤色の油状物を得た。この粗製物をシリカゲルでのクロマトグラフィー(ヘキサン/アセトン=93:7)に付して、同族の(homologous)1,3-ジケトンエステル(3)(336 mg、1.01 mmol、53%)を黄色油状物として得た。1H NMR (300 MHz, CDCl3) δ:0.93 (d, J=7.08 Hz, 3 H), 0.95 (d, J=7.08 Hz, 3 H), 1.23 (t, J=7.08 Hz, 3 H), 1.37 - 1.57 (m, 1 H), 1.91 (ddd, J=14.16, 10.05, 4.11 Hz, 1 H), 2.24 (ddd, J=14.16, 10.05, 4.11 Hz, 1 H), 3.52 (s, 2 H), 4.14 (q, J=7.08 Hz, 2 H), 5.00 (dd, J=11.31, 4.23 Hz, 1 H), 7.76 (dd, J=5.60, 3.08 Hz, 2 H), 7.88 (dd, J=5.60, 3.08 Hz, 2 H); 13C NMR (75 MHz, CDCl3) δ: 14.2, 21.3, 23.5, 25.3, 36.5, 46.5, 57.7, 61.9, 123.8, 131.9, 134.6, 166.6, 168.0, 198.3。
【0249】
(S,E)-3-メトキシ-6-メチル-4-フタルイミド-ヘプタ-2-エン酸メチル(4)
1,3-ジケトンエチルエステル(3)(186 mg、0.56 mmol)を含む5 mLの無水MeOHを、オルトギ酸トリメチル(2.5 mL、2.24 mmol)とともに、触媒量の濃H2SO4の存在下で12時間還流した。エーテル(80 mL)を加えた後、有機層を飽和NaHCO3(3×10 mL)で洗浄し、無水MgSO4で乾燥させ、次いで真空中で濃縮した。この粗製物を、ヘキサン/アセトン(9:1)を用いて溶出させるシリカゲルでのフラッシュクロマトグラフィーに付し、エステル交換されたE-エノールエーテル生成物(4)(130 mg、0.39 mmol)を70%の収率で黄色油状物として得た。1H NMR (300 MHz, CDCl3) δ: 0.96 (d, J=6.40 Hz, 3 H), 1.00 (d, J=6.62 Hz, 3 H), 1.49 - 1.60 (m, 1 H), 1.67 (ddd, J=13.19, 11.48, 3.88 Hz, 1 H), 2.66 (ddd, J=13.19, 11.48, 3.88 Hz, 1 H), 3.63 (s, 3 H), 3.74 (s, 3 H), 5.05 (s, 1 H), 6.33 (dd, J=11.42, 4.80 Hz, 1 H), 7.71 (dd, J=5.48, 2.97 Hz, 2 H), 7.83 (dd, J=5.48, 2.97 Hz, 2 H); 13C NMR (100 MHz, CDCl3) δ: 21.2, 23.4, 25.6, 38.3, 50.2, 51.4, 56.3, 91.2, 123.4, 132.2, 134.0, 167.0, 168.7, 172.3。
【0250】
(S)-5-イソブチル-4-メトキシ-1H-ピロール-2(5H)-オン(5)
【0251】
【化64】

【0252】
エノールエーテル(4)(53 mg、0.16 mmol)を含むMeOHを、過剰のヒドラジン一水和物(2 mL)とともに一晩還流した。溶媒を除去した後、残渣を50 mLのDCMに溶解し、40 mLの蒸留水を加えた。有機相を分離し、水層をDCM(3×40 mL)で抽出した。合わせた有機層を無水Na2SO4上でろ過し、次いで真空中で濃縮した。溶離液(elute)としてDCM/MeOH(200:1)を用いて、シリカゲルでのフラッシュクロマトグラフィーを用いて、テトラム酸(tetramic acid)(5)(15 mg、0.088 mmol)を55%の収率で白色固体として得た。1H NMR (400 MHz, CDCl3) δ: 0.95 (d, J=2.05 Hz, 3 H), 0.97 (d, J=2.05 Hz, 3 H), 1.38 (td, J=9.22, 4.78 Hz, 1 H), 1.64 (td, J=9.22, 4.78 Hz, 1 H), 1.70 - 1.83 (m, 1 H), 3.79 (s, 3 H), 4.06 (dd, J=9.56, 3.41 Hz, 1 H), 5.00 (d, J=1.02 Hz, 1 H), 6.24 (br. s., 1 H); 13C NMR (100 MHz, CDCl3) δ: 22.0, 23.6, 25.6, 41.6, 56.2, 58.4, 93.3, 174.5, 179.2; ESIMS [M+H]+ 170.2。
【0253】
(R)-2-(tert-ブトキシカルボニルアミノ)-4-メチルペンタン酸4-ニトロフェニル(6)
【0254】
【化65】

【0255】
Boc-D-ロイシン(462 mg、2.0 mmol)を含む5 mLの乾燥THFをp-ニトロフェノール(294 mg、2.1 mmol)に加え、次いでこの混合物を、5℃でDCC(413 mg、2.0 mmol)で処理し、次いで室温で一晩攪拌した。この溶液をろ過し、次いで真空中で乾燥させた。この粗製物をシリカゲルでのクロマトグラフィー(ヘキサン/アセトン=3:2)に付し、Boc-D-Leu-ONp(6)(420 mg、1.2 mmol)を60%の収率で無色の油状物として得た。1H NMR (400 MHz, CDCl3) δ: 1.02 (d, J=2.05 Hz, 3 H), 1.04 (d, J=2.05 Hz, 3 H), 1.47 (s, 9 H), 1.61 - 1.71 (m, 1 H), 1.75 - 1.86 (m, 2 H), 4.52 (br. s., 1 H), 4.94 (d, J=6.14 Hz, 1 H), 7.31 (d, J=9.22 Hz, 2 H), 8.28 (d, J=9.22 Hz, 2 H); 13C NMR (100 MHz, CDCl3) δ: 21.9, 23.0, 25.1, 28.5, 41.3, 52.7, 80.6, 122.5, 125.4, 145.6, 155.5, 155.7, 171.6。
【0256】
(R)-1-((S)-2-イソブチル-3-メトキシ-5-オキソ-2,5-ジヒドロ-1H-ピロール-1-イル)-4-メチル-1-オキソペンタン-2-イルカルバミン酸tert-ブチル(7)
【0257】
【化66】

【0258】
テトラム酸(tetramic acid)(5)(11.2 mg、0.066 mmol)を含む2 mLの乾燥THFを、-50℃で10分間n-BuLi(32 μl、1.60 M、0.066 mmol)で処理し、その後Boc-D-Leu-ONp(6)(25.6 mg、0.073 mmol)を含む2 mLの乾燥THFを15分間のうちに滴下した。この混合物をさらに10分間攪拌し、0.1 mLのAcOHを用いてクエンチし、真空中で蒸発させた。シリカゲルでのフラッシュクロマトグラフィー(ヘキサン/酢酸エチル=3:1)の後に、白色粉末として純粋なカップリング生成物(7)(12.0 mg、0.031 mmol)が得られ、収率は47%であった。1H NMR (400 MHz, CDCl3) δ: 0.89 (d, J=5.87 Hz, 3 H), 0.93 (d, J=6.60 Hz, 6 H), 1.04 (d, J=6.36 Hz, 3 H), 1.32 - 1.40 (m, 1 H), 1.46 (s, 9 H), 1.75 - 1.88 (m, 6 H), 4.58 (t, J=5.12 Hz, 1 H), 5.04 (s, 3 H), 5.10 (br.d, J=8.07 Hz, 1 H), 5.45 (td, J=2.93, 1.96 Hz, 1 H)。
【0259】
(S)-1-((R)-2-アミノ-4-メチルペンタノイル)-5-イソブチル-4-メトキシ-1H-ピロール-2(5H)-オン(8)
このBocで保護されたカップリング生成物(7)(5.0 mg、0.013 mmol)を含む1 mLの乾燥DCMに33%のTFAのDCM溶液1 mLを加え、10分間攪拌した。その溶媒を10 mLの25%のアンモニア溶液で中和し、DCM(3×10 mL)を用いて抽出した。有機相を合わせ、無水Na2SO4で乾燥させ、減圧濃縮した。この粗製物をシリカゲルでのフラッシュクロマトグラフィーに付し、DCM/MeOH(98:2)を用いて溶出させて、脱保護した生成物(8)(3.3 mg、0.012 mmol)を95%の収率で白色粉末として得た。1H NMR (400 MHz, CDCl3) δ: 0.90 (d, J=6.43 Hz, 3 H), 0.93 (d, J=2.92 Hz, 3 H), 0.95 (d, J=2.63 Hz, 3 H), 0.98 (d, J=6.72 Hz, 3 H), 1.32 (td, J=8.99, 4.82 Hz, 1 H), 1.54 (ddd, J=13.45, 9.06, 4.38 Hz, 1 H), 1.76 (td, J=13.37, 6.58 Hz, 1 H), 1.83 - 1.92 (m, 2 H), 3.87 (s, 3 H), 4.55 (dd, J=9.50, 4.24 Hz, 1 H), 4.60 (t, J=5.12 Hz, 1 H), 5.05 (s, 1 H); ESIMS [M+H]+ 283.3。
【0260】
N-((R)-1-((S)-2-イソブチル-3-メトキシ-5-オキソ-2,5-ジヒドロ-1H-ピロール-1-イル)-4-メチル-1-オキソペンタン-2-イル)プロピオンアミド(9)
【0261】
【化67】

【0262】
アミノ基がフリーの化合物(8)(1.0 mg、0.0035 mmol)を、プロピオン酸無水物(propionyl anhydride)(1.4 μl、0.011 mmol)を含む2 mLの乾燥ピリジンとともに室温で12時間攪拌した。この溶液を10 mLの1 N HClで酸性化し、酢酸エチル(3×10 mL)中に抽出した。合わせた有機相を無水MgSO4上でろ過し、真空中で蒸発させた。シリカゲルでのフラッシュクロマトグラフィー(ヘキサン/酢酸エチル=3:1)の後、無色の固体として80%の収率でN-プロピオニル化生成物(9)(1.0 mg、0.0029 mmol)を得た。1H NMR (600 MHz, CDCl3) δ: 0.88 (d, J=6.24 Hz, 3 H), 0.92 (d, J=6.60 Hz, 6 H), 1.05 (d, J=6.60 Hz, 3 H), 1.17 (t, J=7.52 Hz, 3 H), 1.40 (dt, J=6.97, 3.67 Hz, 1 H), 1.59 (dt, J=6.97, 3.67 Hz, 1 H), 1.75-1.79 (m, 1H), 1.80-1.83 (m, 3H), 2.25 (q, J=7.70 Hz, 2 H), 3.87 (s, 3 H), 4.57 (dd, J=6.24, 4.03 Hz, 1 H), 5.05 (s, 1 H), 5.75 (ddd, J=10.73, 9.08, 2.93 Hz, 1 H), 6.04 (d, J=8.80 Hz, 1 H); 13C NMR (150 MHz, CDCl3) δ 10.0, 21.4, 22.7, 23.8, 23.9, 24.3, 25.2, 29.9, 39.3, 41.7, 51.6, 58.9, 58.9, 93.6, 169.6, 173.1, 173.3, 181.0。
【0263】
この合成には全部で9段階があり、3.9%の全収率が認められた。
【0264】
実施例3:シントカミドAの生物学的活性
CB3.1を同定するためのスクリーニング(screen)
ハイスループットなスクリーニング(screen)を使用し、アンドロゲン受容体(AR)の活性を阻害する活性化合物を同定した。最初のスクリーニング(screen)は、ARR3-ルシフェラーゼ(luicferase)レポーターを安定に発現するLNCaP細胞を含む(comprising of)、細胞に基づくアッセイである。該アッセイは、合成アンドロゲンR1881を用いて内在性ARを活性化すること、およびルシフェラーゼ活性のレベルを測定すること、から構成されるものである。R1881を細胞に加える1時間前に海綿抽出物を加え、さらに48時間インキュベートしてから、収集し、細胞溶解物におけるルシフェラーゼ活性を測定した。海綿抽出物06-80は、アンドロゲンに誘発されるルシフェラーゼ活性を強く阻害した(図1A)。
【0265】
細胞毒性
この抽出物から、純粋な活性化合物シントカミドA(CB3.1)を単離し、CB3.1の阻害効果は一般的な細胞毒性によるものではないことを保証するために、LNCaP細胞の細胞形態を調べた。図1Bは、48時間CB3.1(10 μM)で処理したLNCaP細胞は、明白な毒性の徴候を有しておらず、ARの活性化に対する阻害効果は、単に一般的な細胞毒性によるものではなかったことを示している。R1881で処理した細胞もまた、細胞数の指標を提供するため、および比較のために、示している。CB3.1は、非特異的な毒性を伴う機構によって、アンドロゲンによって誘発されるルシフェラーゼ活性を減少させてはいなかった。
【0266】
ARのNTDのトランス活性化
CB3.1がARのNTDのトランス活性化を阻止したかを判定するために、AR NTD-Gal4DBDキメラタンパク質およびGal4-ルシフェラーゼレポーターのプラスミドで、LNCaP細胞をトランスフェクションし、CB3.1(5 μg/ml)で1時間前処理してから、ホルスコリン(FSK 50μM)をさらに24時間かけて加えた(Sadarら (1999) J. Biol. Chem. 274:7777〜83を参照)。CB3.1は、FSKによって誘発される、ARのNTDのトランス活性化を、基線レベルにまで減少させ(図3A参照)、ARのNTDのトランス活性化を阻害した。
【0267】
ステロイド受容体特異性
ARと、関連するヒトステロイド受容体(グルココルチコイド受容体(glucocorticoid receptor)(GR)およびプロゲステロン受容体(progesterone receptor)(PR))とのアミノ酸の配列類似性は、DNA結合領域(DBD)などの一部の領域において、相当なものである。ARのNTDは、PRおよびGRと、15%未満の相同性しか共有していないが、これらの受容体は、SRC-1(ステロイド受容体コアクチベーター-1)などの同じタンパク質のいくつかと相互作用する。そのため、レポーター遺伝子アッセイを用いて、ARの活性を阻止する候補化合物がGRおよびPRの転写活性になんらかの効果を有するかを判定した。細胞を、全長のhGRおよびPRβならびに関連するレポーター(すなわちpGR-LucレポーターまたはPRE-E1b-Lucレポーター)の発現プラスミドを用いて、コトランスフェクションした。次いで細胞をエタノール媒体、デキサメタゾン(GR)、4-プレグネン-3,20-ジオン(4-pregnene-3,20 dione)(プロゲステロン)(PR)で処理し、続いてルシフェラーゼ活性を測定した。PSA(6.1)ルシフェラーゼレポーターを用いて測定した場合、CB3.1(5 μg/ml)は、ARの活性を強く阻害したが(図2A参照)、リガンドに応答してPRE-ルシフェラーゼ活性もGRE-ルシフェラーゼ活性も阻害しなかった(図2B〜2C参照)。データは、CB3.1がGRルシフェラーゼレポーターおよびPRルシフェラーゼレポーターの誘発を阻害しなかったため、CB3.1は他のステロイド受容体のトランス活性化を変化させず、転写または翻訳に対する非特異的および一般的な効果を有しないこと、を示している。CB3.1は、ARに対して特異的であると思われ、全身的送達に由来する副作用はほとんどないと予想されることを示唆している。
【0268】
増殖アッセイ
CB3.1は、アンドロゲン(R1881)で処理されたLNCaP細胞の増殖を減少させた。LNCaP細胞を、ビカルタミド(cdx、10 μM、陽性対照)またはCB3.1(5 μg/ml)で1時間前処理してから、0.1 nMのR1881を加えた。3日後にBrdUの取り込みを測定して、アンドロゲンに応答した増殖の変化を示した(図3B参照)。0.1 nMのR1881は、対照(R1881および小分子用の媒体)よりも増殖を増大させた。CB3.1は、アンドロゲンによって誘発される増殖の阻止に有効であった。CB3.1は、ARを発現せず(Kaighnら 1978 Natl. Cancer Inst. Monogr. 49, 17〜21)、したがって成長および生存のためにARに依存しない、PC3ヒト前立腺癌細胞の増殖を、阻止しなかった(図3C参照)。
【0269】
実施例4:シントカミドはLNCaP細胞においてアンドロゲンによって誘発されるPSA mRNA量を抑制する
PSAは、エンハンサー領域およびプロモーター領域に、いくつかのはっきり特徴づけられたアンドロゲン応答エレメント(ARE)を含む、アンドロゲンにより制御される遺伝子である。PSA mRNAの量は、アンドロゲン受容体に依存する機構によって、アンドロゲンによって誘発される。シントカミドがアンドロゲンによって誘発される内在性遺伝子の発現も阻止するかを調べるために、合成アンドロゲンR1881に応答したときのPSA mRNA量を測定した。R1881は、PSA mRNA量を少なくとも3倍誘発し(図4参照)、これは抗アンドロゲン剤のビカルタミドおよび各シントカミドによって阻止することができた。このデータは、シントカミドがアンドロゲン受容体の転写活性を阻止することと合致している。
【0270】
実施例5:PSA(6.1)-ルシフェラーゼのR1881による誘発のシントカミドによる阻害
アンドロゲン応答エレメント(ARE)を含むアンドロゲン応答性レポーターを測定することによって、LNCaPヒト前立腺癌細胞において、内在性ARの活性化を測定した。PSA(6.1 kb)-ルシフェラーゼレポーター遺伝子コンストラクトは、いくつかのはっきり特徴づけられたAREを含み、アンドロゲンによって誘発される。LNCaP細胞を単層として保持し、PSA-ルシフェラーゼでトランスフェクションし、海綿から調製した粗製の抽出物(CB-0)、ならびに精製したシントカミドおよびジサミド(CB3.0(ジサミドA)、CB2.1(シントカミドE)、CB1.1(シントカミドC)、CB3.1(シントカミドA)、およびCB4.0(シントカミドB)、ならびに非塩素化シントカミドをスクリーニングするために使用した。合成アンドロゲンR1881(1 nM)は、PSA-ルシフェラーゼ活性をおよそ6倍誘発した。抗アンドロゲン剤ビカルタミド(BIC)は、この誘発を100%阻止した(図5参照)。不完全に精製した抽出物CB-0は、アンドロゲンによって誘発される活性を強く阻害した。すべての精製したシントカミドおよびジサミドAと同様に、非塩素化シントカミドは幾分活性を有していた。このデータは、シントカミドおよびジサミドがPSAの発現に対して阻害効果を有するという結論は、転写レベルのものであることを支持している。
【0271】
実施例6:シントカミドA(CB3.1)はLNCaP異種移植片の腫瘍増殖を減少させた
皮下異種移植モデルを用いて、インビトロでアンドロゲン受容体の活性化を阻害するシントカミドがこうした腫瘍に対して何らかの効果を有するかどうかを調べた。LNCaP皮下異種移植モデルを用いてCB3.1をインビボで調べた。毒性、ならびにCB3.1が腫瘍増殖およびアンドロゲン非依存性への進行に対して効果を有するかどうか、に関連する情報を提供するために、インビボ実験を行った。LNCaPヒト前立腺癌細胞は、内在性アンドロゲン受容体(AR)および前立腺特異抗原(PSA)を発現し、去勢された宿主においてアンドロゲン非依存性に発展する。LNCaP細胞(106個/ml)を少なくとも8週齢のNOD-SCIDオスマウス群に皮下移植した。細胞を75 μlのマトリゲル(Matrigel)を伴う75 μlのRPMI培地1640(5%のFBS)中に懸濁させ、麻酔下で宿主の側腹部領域に注射した。LNCaP細胞をNOD-SCIDオスマウス群に皮下移植し、腫瘍がおよそ100 mm3(平均値=123.3.1±27.4 mm3;n=18)となったときに動物を去勢し、無作為に2つの群に分けた。去勢の1週間後、動物を30 mg/kg体重の腫瘍内用量のCB3.1、または対等の容積の媒体(対照のDMSO)で3日ごとに処置した。CB3.1は、腫瘍容積の減少を示した(図6参照)。CB3.1の最初の注射の15日後に、腫瘍は1回目の注射の日の腫瘍容積の111.81%±38.12となっていた。一方、DMSOの注射の15日後、腫瘍は1回目の注射の日の腫瘍容積の180.27%±111.67となっていた。血清PSAは予後の指標を提供する。CB3.1を受けた動物について、血清PSAは、1回目の注射の15日後に98.47%±170.51となっていた。DMSOで処置した動物は、1回目の注射の15日後に倍加の血清PSA(すなわち203.73%±315.63)を有していた。腫瘍容積および血清PSAの数値は、媒体で処置した動物と比較して、CB3.1が全身腫瘍組織量および血清PSAを減少させるということと合致していた。実験期間時に動物体重の変化は認められず(開始:24.6±1.1グラム;終了:25.0±1.4グラム)、CB3.1が動物に対して一般的な毒性ではないことが示された。
【0272】
本発明の種々の実施態様を本明細書中に記載しているが、当業者の一般的な通常の知識によって、本発明の範囲内で、多数の改作および改変がなされ得る。かかる改変は、実質的に同じ方法で、同じ結果を達成するために、本発明の任意の態様を公知の均等物で置換することを含む。数値範囲は、その範囲を規定する数値を含む。単語「含む(comprising)」は、本明細書中で、語句「含むが、限定されない(including, but not limited to)」と実質的に同等のオープンエンドの用語として使用されており、単語「含む(comprises)」は、対応する意味を有する。本明細書中で使用される場合、単数形「1つの(a)」、「1つの(an)」、および「その(the)」は、文脈によって明確に別段指示されない限り、複数の指示対象を含む。したがって、例えば、「1つのもの(a thing)」への言及は、1個よりも多くのかかるものを含む。本明細書中での参考文献の引用は、かかる参考文献が本発明に対する先行技術であることを承認するものではない。
【特許請求の範囲】
【請求項1】
式(A):
【化1】

[式中、
Xは、CまたはNであり;
Yは、OまたはSであり;
R1は、H、OH、J、OJ、SJ、またはNJJ’であり、式中JまたはJ’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族もしくは部分的に芳香族の環式の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、COOR、CONH2、CONHR、CONR2、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルであり;
R2は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖であるか、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、COOR、CONH2、CONHR、CONR2、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルであり;
R3は、H、OH、OG、SG、NGG’、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、もしくは芳香族もしくは部分的に芳香族の環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、式中GおよびG’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族もしくは部分的に芳香族の環式の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、OH、COOR、CONH2、CONHR、CONR2、R、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択され、式中Rは、非置換C1〜C10アルキルであり;
R4およびR6は独立して、H、もしくはプロリン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、芳香族もしくは部分的に芳香族の環式、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基からなる群から選択され、その任意の置換基は、オキソ、COOH、OH、OR、R、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは、非置換C1〜C10アルキルであり(ただし、R4およびR6が共にHであることはなく、かつR4およびR6はいずれも
【化2】

ではない);
R5は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、CONH2、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択され;
【化3】

は単結合または二重結合である]
の化合物(ただし、該化合物は、
【化4】

ではない)またはその塩。
【請求項2】
式(B):
【化5】

[式中、
Xは、CまたはNであり;
Yは、OまたはSであり;
R1は、H、OH、J、OJ、SJ、またはNJJ’であり、式中JまたはJ’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択され;
R2は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルであり;
R3は、H、OH、OG、SG、NGG’、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、式中GおよびG’は、炭素数1〜10の、直鎖状、分枝状、または非芳香族環式の、飽和または不飽和のアルキル基であり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択され;
R4は、H、または炭素数1〜10の、直鎖状、分枝状、芳香族環式、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、OH、OR、R、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは非置換C1〜C10アルキルであり(ただし、R4は、
【化6】

ではない);
R5は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択され;
Zは、任意に置換されたBu、Pr、Et、またはMeであり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択され;
【化7】

は単結合または二重結合である]
の化合物(ただし、該化合物は、
【化8】

ではない)、またはその塩。
【請求項3】
R3が、H、OH、OG、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、式中Gが、炭素数1〜10の、直鎖状または分枝状の、飽和または不飽和のアルキル基であり、その任意の置換基が、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択される、請求項1または2に記載の化合物。
【請求項4】
R3が、H、OH、OBu、OPr、OEt、またはOMeである、請求項1〜3のいずれか1項に記載の化合物。
【請求項5】
R1が、H、OH、J、またはOJであり、式中Jが、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基が、オキソ、COOH、OH、F、Cl、Br、I、NH2、およびNO2のうちの1個以上から選択される、請求項1〜4のいずれか1項に記載の化合物。
【請求項6】
R1が、H、OH、J、またはOJであり、式中Jが、炭素数1〜4の、直鎖状または分枝状の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基が、オキソ、COOH、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択される、請求項1〜5のいずれか1項に記載の化合物。
【請求項7】
R1が、H、OH、OBu、OPr、OEt、OMe、Bu、Pr、Et、またはMeである、請求項1〜6のいずれか1項に記載の化合物。
【請求項8】
R1がOMeである、請求項1〜7のいずれか1項に記載の化合物。
【請求項9】
【化9】

が二重結合である、請求項1〜8のいずれか1項に記載の化合物。
【請求項10】
R2が、H、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基が、オキソ、COOH、OH、F、Cl、Br、I、NH2、およびNO2のうちの1個以上から選択される、請求項1〜9のいずれか1項に記載の化合物。
【請求項11】
R2が、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であり、その任意の置換基が、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択される、請求項1〜10のいずれか1項に記載の化合物。
【請求項12】
R4が、H、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基が、オキソ、COOH、OH、F、Cl、Br、I、NH2、SH、SO3H、およびNO2のうちの1個以上から選択される、請求項1〜11のいずれか1項に記載の化合物。
【請求項13】
R4が、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であり、その任意の置換基が、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択される、請求項1〜12のいずれか1項に記載の化合物。
【請求項14】
R5が、H、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基が、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択される、請求項1〜13のいずれか1項に記載の化合物。
【請求項15】
R5が、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であり、その任意の置換基が、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択される、請求項1〜14のいずれか1項に記載の化合物。
【請求項16】
XがNである、請求項1〜15のいずれか1項に記載の化合物。
【請求項17】
YがOである、請求項1〜16のいずれか1項に記載の化合物。
【請求項18】
Zが、任意に置換されたBu、Pr、Et、またはMeであり、その任意の置換基が、オキソ、OH、F、Cl、Br、およびIのうちの1個以上から選択される、請求項2〜17のいずれか1項に記載の化合物。
【請求項19】
Zが、任意に置換されたBu、Pr、Et、またはMeであり、その任意の置換基が、F、Cl、Br、およびIのうちの1個以上から選択される、請求項2〜17のいずれか1項に記載の化合物。
【請求項20】
式(C):
【化10】

[式中、
Aは、Bu、Pr、Et、またはMeであり;
Mは、H、OH、OBu、OPr、OEt、OMe、Bu、Pr、Et、またはMeであり;
Tは、
【化11】

であり;
Eは、Bu、Pr、Et、またはMeであり;
Qは、
【化12】

であり;
Lは、Bu、Pr、Et、またはMeであり;
R8は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeであり;
R9は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeであり;
ここで、A、T、E、Q、およびLは、任意に置換されており、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択される]
の化合物、またはその塩。
【請求項21】
式(D):
【化13】

[式中、
Aは、Bu、Pr、Et、またはMeであり;
Dは、Bu、Pr、Et、またはMeであり;
Eは、Bu、Pr、Et、またはMeであり;
Lは、Bu、Pr、Et、またはMeであり;
R8は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeであり;
R9は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeである]
の化合物、またはその塩。
【請求項22】
式(E):
【化14】

[式中、
R8は、Cl3C、Cl2HC、ClH2C、Et、またはMeであり;
R9は、Cl3C、Cl2HC、ClH2C、Et、またはMeである]
の化合物またはその塩。
【請求項23】
下記:
【化15】

の1つ以上から選択される、化合物またはその塩。
【請求項24】
下記:
【化16】

の1つ以上から選択される、化合物またはその塩。
【請求項25】
式A:
【化17】

[式中、
Xは、CまたはNであり;
Yは、OまたはSであり;
R1は、H、OH、J、OJ、SJ、またはNJJ’であり、式中JまたはJ’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルであり;
R2は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルであり;
R3は、H、OH、OG、SG、NGG’、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、式中GおよびG’は、炭素数1〜10の、直鎖状、分枝状、または非芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択され;
R4およびR6は独立して、H、または炭素数1〜10の、直鎖状、分枝状、芳香族環式、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基からなる群から選択され、その任意の置換基は、オキソ、COOH、OH、OR、R、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルであり;
R5は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択され;
【化18】

は単結合または二重結合である]
の構造を有する化合物またはその塩を哺乳動物細胞に投与することを含む、ARの活性の調節方法。
【請求項26】
アンドロゲン受容体(AR)の活性を調節するための、請求項1〜25に記載された1種以上の化合物の使用。
【請求項27】
アンドロゲン受容体(AR)の活性を調節するための医薬の製造における、請求項1〜25に記載された1種以上の化合物の使用。
【請求項28】
アンドロゲン受容体(AR)の活性を調節するための、請求項1〜25に記載された1種以上の化合物。
【請求項29】
請求項1〜25に記載されたいずれか1種の化合物に従った化合物、および薬学的に許容される賦形剤を含む、医薬組成物。
【請求項30】
式(K):
【化19】

[式中、
R25は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、COOR’、CONH2、CONHR’、CONR’2、R’、OH、OR’、F、Cl、Br、I、NH2、NHR’、NR’2、CN、SH、SR’、SO3H、SO3R’、SO2R’、OSO3R’、およびNO2のうちの1個以上から選択され、式中R’は、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルであり;
R26は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、CONH2、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択され;
R27は、任意に置換されたBu、Pr、Et、またはMeであり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択される]
の化合物の製造方法であって、
式(Q):
【化20】

(式中R25は上で定義した通りである)の化合物をn-BuLiと混合して、混合物を形成すること、および該混合物を式(S):
【化21】

(式中R26は上で定義した通りであり、Protは保護基である)の化合物と反応させて、式(T):
【化22】

(式中R25、R26、およびProtは、上で定義した通りである)の化合物を形成すること;
式(T)の化合物を脱保護して、式(U):
【化23】

(式中R25およびR26は上で定義した通りである)の化合物を形成すること;ならびに
式(U)の化合物をピリジン中で式(V):
【化24】

(式中R27は上で定義した通りである)の化合物と反応させて、式(K)の化合物を形成すること
を含む、方法。
【請求項31】
式(R):
【化25】

(式中R26およびProtは請求項30で定義した通りである)の化合物を任意の順序で、p-ニトロフェノール、およびカルボジイミド含有化合物と混合して、式(S):
【化26】

(式中R26およびProtは請求項30で定義した通りである)の化合物を形成することをさらに含む、請求項30に記載の方法。
【請求項32】
式(P):
【化27】

(式中R25は請求項30で定義した通りである)の化合物を、MeOH中でヒドラジン一水和物と反応させて、式(Q):
【化28】

(式中R25は請求項30で定義した通りである)の化合物を形成することをさらに含む、請求項30または31に記載の方法。
【請求項33】
式(O):
【化29】

(式中R25は請求項30で定義した通りである)の化合物を、触媒としての濃H2SO4の存在下で、MeOH中、オルトギ酸トリメチルと反応させて、式(P):
【化30】

(式中R25は請求項30で定義した通りである)の化合物を形成することをさらに含む、請求項32に記載の方法。
【請求項34】
式(M):
【化31】

(式中R25は請求項30で定義した通りである)の化合物を、塩素化剤と反応させて、式(N):
【化32】

(式中R25は請求項30で定義した通りである)の化合物を形成すること;および
式(N)の化合物を、マロン酸モノエチルとアルキルリチウム化合物とを混合することによって形成された懸濁液と反応させて、式(O):
【化33】

(式中R25は請求項30で定義した通りである)の化合物を形成すること
をさらに含む、請求項33に記載の方法。
【請求項35】
式(L):
【化34】

(式中R25は請求項30で定義した通りである)の化合物を、Na2CO3およびH2Oの存在下、室温で、N-カルボエトキシフタルイミドと反応させて、式(M):
【化35】

(式中R25は請求項30で定義した通りである)の化合物を形成することをさらに含む、請求項34に記載の方法。
【請求項36】
アンドロゲン受容体(AR)の活性を調節するための式(F):
【化36】

[式中、
R10は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、R14、OH、OR14、F、Cl、Br、I、NH2、NHR14、NR142、CN、SH、SR14、SO3H、SO3R14、SO2R14、OSO3R14、およびNO2のうちの1個以上から選択され、式中R14は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基であり;
R11は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、R15、OH、OR15、F、Cl、Br、I、NH2、NHR15、NR152、CN、SH、SR15、SO3H、SO3R15、SO2R15、OSO3R15、およびNO2のうちの1個以上から選択され、式中R15は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基であり;
R12は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、R16、OH、OR16、F、Cl、Br、I、NH2、NHR16、NR162、CN、SH、SR16、SO3H、SO3R16、SO2R16、OSO3R16、およびNO2のうちの1個以上から選択され、式中R16は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基であり;
R13は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、R17、OH、OR17、F、Cl、Br、I、NH2、NHR17、NR172、CN、SH、SR17、SO3H、SO3R17、SO2R17、OSO3R17、およびNO2のうちの1個以上から選択され、式中R17は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基である]
の化合物またはその薬学的に許容される塩の使用。
【請求項37】
R10およびR11がそれぞれ独立してHまたは非置換C1〜10アルキルである、請求項36に記載の使用。
【請求項38】
R12が、-CH2-CH(CH3)CH3;-CH2-CH(CR183)CH3;-CH2-CH(CHR182)CH3;-CH2-CH(CH2R18)CH3;-CH2-CH(CR183)CH2R18;-CH2-CH(CHR182)CH2R18;-CH2-CH(CH2R18)CH2R18;-CH2-CH(CR183)CHR182;-CH2-CH(CHR182)CHR182;-CH2-CH(CH2R18)CHR182;-CH2-CH(CR183)CR183;-CH2-CH(CHR182)CR183;-CH2-CH(CH2R18)CR183;-CH(CH3)CH3;-CH(CR183)CH3;-CH(CHR182)CH3;-CH(CH2R18)CH3;-CH(CR183)CH2R18;-CH(CHR182)CH2R18;-CH(CH2R18)CH2R18;-CH(CR183)CHR182;-CH(CHR182)CHR182;-CH(CH2R18)CHR182;-CH(CR183)CR183;-CH(CHR182)CR183;-CH(CH2R18)CR183;-CH(CH3)-CH(CH3)CH3;-CH(CH3)-CH(CR183)CH3;-CH(CH3)-CH(CHR182)CH3;-CH(CH3)-CH(CH2R18)CH3;-CH(CH3)-CH(CR183)CH2R18;-CH(CH3)-CH(CHR182)CH2R18;-CH(CH3)-CH(CH2R18)CH2R18;-CH(CH3)-CH(CR183)CHR182;-CH(CH3)-CH(CHR182)CHR182;-CH(CH3)-CH(CH2R18)CHR182;-CH(CH3)-CH(CR183)CR183;-CH(CH3)-CH(CHR182)CR183;または-CH(CH3)-CH(CH2R18)CR183であり(式中R18は、F、Cl、Br、またはIである);
R13が、-CH2-CH(CH3)CH3;-CH2-CH(CR193)CH3;-CH2-CH(CHR192)CH3;-CH2-CH(CH2R19)CH3;-CH2-CH(CR193)CH2R19;-CH2-CH(CHR192)CH2R19;-CH2-CH(CH2R19)CH2R19;-CH2-CH(CR193)CHR192;-CH2-CH(CHR192)CHR192;-CH2-CH(CH2R19)CHR192;-CH2-CH(CR193)CR193;-CH2-CH(CHR192)CR193;-CH2-CH(CH2R19)CR193;-CH(CH3)CH3;-CH(CR193)CH3;-CH(CHR192)CH3;-CH(CH2R19)CH3;-CH(CR193)CH2R19;-CH(CHR192)CH2R19;-CH(CH2R19)CH2R19;-CH(CR193)CHR192;-CH(CHR192)CHR192;-CH(CH2R19)CHR192;-CH(CR193)CR193;-CH(CHR192)CR193;-CH(CH2R19)CR193;-CH(CH3)-CH(CH3)CH3;-CH(CH3)-CH(CR193)CH3;-CH(CH3)-CH(CHR192)CH3;-CH(CH3)-CH(CH2R19)CH3;-CH(CH3)-CH(CR193)CH2R19;-CH(CH3)-CH(CHR192)CH2R19;-CH(CH3)-CH(CH2R19)CH2R19;-CH(CH3)-CH(CR193)CHR192;-CH(CH3)-CH(CHR192)CHR192;-CH(CH3)-CH(CH2R19)CHR192;-CH(CH3)-CH(CR193)CR193;-CH(CH3)-CH(CHR192)CR193;または-CH(CH3)-CH(CH2R19)CR193である(式中R19は、F、Cl、Br、またはIである)、請求項36または37に記載の使用。
【請求項39】
アンドロゲン受容体(AR)の活性を調節するための、式:
【化37】

(式中R20およびR21はそれぞれ独立してCCl3またはCHCl2である)の化合物またはその薬学的に許容される塩の使用。
【請求項40】
アンドロゲン受容体(AR)の活性を調節するための、式:
【化38−1】

【化38−2】

の化合物またはその薬学的に許容される塩の使用。
【請求項41】
アンドロゲン受容体(AR)の活性を調節するための、式:
【化39】

の化合物またはその薬学的に許容される塩の使用。
【請求項42】
ARの活性の調節がヒト細胞におけるものである、請求項36〜41のいずれか1項に記載の使用。
【請求項43】
ARの活性の調節が、ARのN末端領域(NTD)の活性を阻害するためのものである、請求項36〜42のいずれか1項に記載の使用。
【請求項44】
ARの活性の調節が、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、または加齢性黄斑変性症の予防または治療のためのものである、請求項36〜43のいずれか1項に記載の使用。
【請求項45】
ARの活性の調節が、前立腺癌の予防または治療のためのものである、請求項44に記載の使用。
【請求項46】
前立腺癌がアンドロゲン非依存性前立腺癌である、請求項45に記載の使用。
【請求項47】
前立腺癌がアンドロゲン依存性前立腺癌である、請求項45に記載の使用。
【請求項1】
式(A):
【化1】

[式中、
Xは、CまたはNであり;
Yは、OまたはSであり;
R1は、H、OH、J、OJ、SJ、またはNJJ’であり、式中JまたはJ’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族もしくは部分的に芳香族の環式の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、COOR、CONH2、CONHR、CONR2、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルであり;
R2は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖であるか、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、COOR、CONH2、CONHR、CONR2、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルであり;
R3は、H、OH、OG、SG、NGG’、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、もしくは芳香族もしくは部分的に芳香族の環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、式中GおよびG’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族もしくは部分的に芳香族の環式の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、OH、COOR、CONH2、CONHR、CONR2、R、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択され、式中Rは、非置換C1〜C10アルキルであり;
R4およびR6は独立して、H、もしくはプロリン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、芳香族もしくは部分的に芳香族の環式、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基からなる群から選択され、その任意の置換基は、オキソ、COOH、OH、OR、R、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは、非置換C1〜C10アルキルであり(ただし、R4およびR6が共にHであることはなく、かつR4およびR6はいずれも
【化2】

ではない);
R5は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、CONH2、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択され;
【化3】

は単結合または二重結合である]
の化合物(ただし、該化合物は、
【化4】

ではない)またはその塩。
【請求項2】
式(B):
【化5】

[式中、
Xは、CまたはNであり;
Yは、OまたはSであり;
R1は、H、OH、J、OJ、SJ、またはNJJ’であり、式中JまたはJ’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択され;
R2は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルであり;
R3は、H、OH、OG、SG、NGG’、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、式中GおよびG’は、炭素数1〜10の、直鎖状、分枝状、または非芳香族環式の、飽和または不飽和のアルキル基であり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択され;
R4は、H、または炭素数1〜10の、直鎖状、分枝状、芳香族環式、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、OH、OR、R、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは非置換C1〜C10アルキルであり(ただし、R4は、
【化6】

ではない);
R5は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択され;
Zは、任意に置換されたBu、Pr、Et、またはMeであり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択され;
【化7】

は単結合または二重結合である]
の化合物(ただし、該化合物は、
【化8】

ではない)、またはその塩。
【請求項3】
R3が、H、OH、OG、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、式中Gが、炭素数1〜10の、直鎖状または分枝状の、飽和または不飽和のアルキル基であり、その任意の置換基が、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択される、請求項1または2に記載の化合物。
【請求項4】
R3が、H、OH、OBu、OPr、OEt、またはOMeである、請求項1〜3のいずれか1項に記載の化合物。
【請求項5】
R1が、H、OH、J、またはOJであり、式中Jが、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基が、オキソ、COOH、OH、F、Cl、Br、I、NH2、およびNO2のうちの1個以上から選択される、請求項1〜4のいずれか1項に記載の化合物。
【請求項6】
R1が、H、OH、J、またはOJであり、式中Jが、炭素数1〜4の、直鎖状または分枝状の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基が、オキソ、COOH、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択される、請求項1〜5のいずれか1項に記載の化合物。
【請求項7】
R1が、H、OH、OBu、OPr、OEt、OMe、Bu、Pr、Et、またはMeである、請求項1〜6のいずれか1項に記載の化合物。
【請求項8】
R1がOMeである、請求項1〜7のいずれか1項に記載の化合物。
【請求項9】
【化9】

が二重結合である、請求項1〜8のいずれか1項に記載の化合物。
【請求項10】
R2が、H、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基が、オキソ、COOH、OH、F、Cl、Br、I、NH2、およびNO2のうちの1個以上から選択される、請求項1〜9のいずれか1項に記載の化合物。
【請求項11】
R2が、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であり、その任意の置換基が、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択される、請求項1〜10のいずれか1項に記載の化合物。
【請求項12】
R4が、H、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基が、オキソ、COOH、OH、F、Cl、Br、I、NH2、SH、SO3H、およびNO2のうちの1個以上から選択される、請求項1〜11のいずれか1項に記載の化合物。
【請求項13】
R4が、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であり、その任意の置換基が、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択される、請求項1〜12のいずれか1項に記載の化合物。
【請求項14】
R5が、H、または炭素数1〜10の、直鎖状もしくは分枝状の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基が、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択される、請求項1〜13のいずれか1項に記載の化合物。
【請求項15】
R5が、H、または炭素数1〜4の、直鎖状もしくは分枝状の、飽和の任意に置換されたアルキル基であり、その任意の置換基が、オキソ、OH、F、Cl、Br、I、およびNH2のうちの1個以上から選択される、請求項1〜14のいずれか1項に記載の化合物。
【請求項16】
XがNである、請求項1〜15のいずれか1項に記載の化合物。
【請求項17】
YがOである、請求項1〜16のいずれか1項に記載の化合物。
【請求項18】
Zが、任意に置換されたBu、Pr、Et、またはMeであり、その任意の置換基が、オキソ、OH、F、Cl、Br、およびIのうちの1個以上から選択される、請求項2〜17のいずれか1項に記載の化合物。
【請求項19】
Zが、任意に置換されたBu、Pr、Et、またはMeであり、その任意の置換基が、F、Cl、Br、およびIのうちの1個以上から選択される、請求項2〜17のいずれか1項に記載の化合物。
【請求項20】
式(C):
【化10】

[式中、
Aは、Bu、Pr、Et、またはMeであり;
Mは、H、OH、OBu、OPr、OEt、OMe、Bu、Pr、Et、またはMeであり;
Tは、
【化11】

であり;
Eは、Bu、Pr、Et、またはMeであり;
Qは、
【化12】

であり;
Lは、Bu、Pr、Et、またはMeであり;
R8は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeであり;
R9は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeであり;
ここで、A、T、E、Q、およびLは、任意に置換されており、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択される]
の化合物、またはその塩。
【請求項21】
式(D):
【化13】

[式中、
Aは、Bu、Pr、Et、またはMeであり;
Dは、Bu、Pr、Et、またはMeであり;
Eは、Bu、Pr、Et、またはMeであり;
Lは、Bu、Pr、Et、またはMeであり;
R8は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeであり;
R9は、Cl3C、Cl2HC、ClH2C、Bu、Pr、Et、またはMeである]
の化合物、またはその塩。
【請求項22】
式(E):
【化14】

[式中、
R8は、Cl3C、Cl2HC、ClH2C、Et、またはMeであり;
R9は、Cl3C、Cl2HC、ClH2C、Et、またはMeである]
の化合物またはその塩。
【請求項23】
下記:
【化15】

の1つ以上から選択される、化合物またはその塩。
【請求項24】
下記:
【化16】

の1つ以上から選択される、化合物またはその塩。
【請求項25】
式A:
【化17】

[式中、
Xは、CまたはNであり;
Yは、OまたはSであり;
R1は、H、OH、J、OJ、SJ、またはNJJ’であり、式中JまたはJ’は、炭素数1〜10の、直鎖状、分枝状、非芳香族環式、または芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルであり;
R2は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、R、OH、OR、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルであり;
R3は、H、OH、OG、SG、NGG’、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、式中GおよびG’は、炭素数1〜10の、直鎖状、分枝状、または非芳香族環式の、飽和または不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、CN、SH、SO3H、およびNO2のうちの1個以上から選択され;
R4およびR6は独立して、H、または炭素数1〜10の、直鎖状、分枝状、芳香族環式、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基からなる群から選択され、その任意の置換基は、オキソ、COOH、OH、OR、R、F、Cl、Br、I、NH2、NHR、NR2、CN、SH、SR、SO3H、SO3R、SO2R、OSO3R、およびNO2のうちの1個以上から選択され、式中Rは、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルであり;
R5は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択され;
【化18】

は単結合または二重結合である]
の構造を有する化合物またはその塩を哺乳動物細胞に投与することを含む、ARの活性の調節方法。
【請求項26】
アンドロゲン受容体(AR)の活性を調節するための、請求項1〜25に記載された1種以上の化合物の使用。
【請求項27】
アンドロゲン受容体(AR)の活性を調節するための医薬の製造における、請求項1〜25に記載された1種以上の化合物の使用。
【請求項28】
アンドロゲン受容体(AR)の活性を調節するための、請求項1〜25に記載された1種以上の化合物。
【請求項29】
請求項1〜25に記載されたいずれか1種の化合物に従った化合物、および薬学的に許容される賦形剤を含む、医薬組成物。
【請求項30】
式(K):
【化19】

[式中、
R25は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、COOR’、CONH2、CONHR’、CONR’2、R’、OH、OR’、F、Cl、Br、I、NH2、NHR’、NR’2、CN、SH、SR’、SO3H、SO3R’、SO2R’、OSO3R’、およびNO2のうちの1個以上から選択され、式中R’は、直鎖状または分枝状の、飽和および非置換のC1〜C10アルキルであり;
R26は、H、もしくはプロリンおよびフェニルアラニン以外のアミノ酸の側鎖、または炭素数1〜10の、直鎖状、分枝状、もしくは非芳香族環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、CONH2、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択され;
R27は、任意に置換されたBu、Pr、Et、またはMeであり、その任意の置換基は、オキソ、COOH、OH、F、Cl、Br、I、NH2、SO3H、およびNO2のうちの1個以上から選択される]
の化合物の製造方法であって、
式(Q):
【化20】

(式中R25は上で定義した通りである)の化合物をn-BuLiと混合して、混合物を形成すること、および該混合物を式(S):
【化21】

(式中R26は上で定義した通りであり、Protは保護基である)の化合物と反応させて、式(T):
【化22】

(式中R25、R26、およびProtは、上で定義した通りである)の化合物を形成すること;
式(T)の化合物を脱保護して、式(U):
【化23】

(式中R25およびR26は上で定義した通りである)の化合物を形成すること;ならびに
式(U)の化合物をピリジン中で式(V):
【化24】

(式中R27は上で定義した通りである)の化合物と反応させて、式(K)の化合物を形成すること
を含む、方法。
【請求項31】
式(R):
【化25】

(式中R26およびProtは請求項30で定義した通りである)の化合物を任意の順序で、p-ニトロフェノール、およびカルボジイミド含有化合物と混合して、式(S):
【化26】

(式中R26およびProtは請求項30で定義した通りである)の化合物を形成することをさらに含む、請求項30に記載の方法。
【請求項32】
式(P):
【化27】

(式中R25は請求項30で定義した通りである)の化合物を、MeOH中でヒドラジン一水和物と反応させて、式(Q):
【化28】

(式中R25は請求項30で定義した通りである)の化合物を形成することをさらに含む、請求項30または31に記載の方法。
【請求項33】
式(O):
【化29】

(式中R25は請求項30で定義した通りである)の化合物を、触媒としての濃H2SO4の存在下で、MeOH中、オルトギ酸トリメチルと反応させて、式(P):
【化30】

(式中R25は請求項30で定義した通りである)の化合物を形成することをさらに含む、請求項32に記載の方法。
【請求項34】
式(M):
【化31】

(式中R25は請求項30で定義した通りである)の化合物を、塩素化剤と反応させて、式(N):
【化32】

(式中R25は請求項30で定義した通りである)の化合物を形成すること;および
式(N)の化合物を、マロン酸モノエチルとアルキルリチウム化合物とを混合することによって形成された懸濁液と反応させて、式(O):
【化33】

(式中R25は請求項30で定義した通りである)の化合物を形成すること
をさらに含む、請求項33に記載の方法。
【請求項35】
式(L):
【化34】

(式中R25は請求項30で定義した通りである)の化合物を、Na2CO3およびH2Oの存在下、室温で、N-カルボエトキシフタルイミドと反応させて、式(M):
【化35】

(式中R25は請求項30で定義した通りである)の化合物を形成することをさらに含む、請求項34に記載の方法。
【請求項36】
アンドロゲン受容体(AR)の活性を調節するための式(F):
【化36】

[式中、
R10は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、R14、OH、OR14、F、Cl、Br、I、NH2、NHR14、NR142、CN、SH、SR14、SO3H、SO3R14、SO2R14、OSO3R14、およびNO2のうちの1個以上から選択され、式中R14は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基であり;
R11は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、R15、OH、OR15、F、Cl、Br、I、NH2、NHR15、NR152、CN、SH、SR15、SO3H、SO3R15、SO2R15、OSO3R15、およびNO2のうちの1個以上から選択され、式中R15は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基であり;
R12は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、R16、OH、OR16、F、Cl、Br、I、NH2、NHR16、NR162、CN、SH、SR16、SO3H、SO3R16、SO2R16、OSO3R16、およびNO2のうちの1個以上から選択され、式中R16は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基であり;
R13は、H、または炭素数1〜10の、直鎖状、分枝状、もしくは環式の、飽和もしくは不飽和の、任意に置換されたアルキル基であり、その任意の置換基は、オキソ、COOH、R17、OH、OR17、F、Cl、Br、I、NH2、NHR17、NR172、CN、SH、SR17、SO3H、SO3R17、SO2R17、OSO3R17、およびNO2のうちの1個以上から選択され、式中R17は、非置換C1〜C10の、直鎖状、分枝状、または環式の、飽和または不飽和のアルキル基である]
の化合物またはその薬学的に許容される塩の使用。
【請求項37】
R10およびR11がそれぞれ独立してHまたは非置換C1〜10アルキルである、請求項36に記載の使用。
【請求項38】
R12が、-CH2-CH(CH3)CH3;-CH2-CH(CR183)CH3;-CH2-CH(CHR182)CH3;-CH2-CH(CH2R18)CH3;-CH2-CH(CR183)CH2R18;-CH2-CH(CHR182)CH2R18;-CH2-CH(CH2R18)CH2R18;-CH2-CH(CR183)CHR182;-CH2-CH(CHR182)CHR182;-CH2-CH(CH2R18)CHR182;-CH2-CH(CR183)CR183;-CH2-CH(CHR182)CR183;-CH2-CH(CH2R18)CR183;-CH(CH3)CH3;-CH(CR183)CH3;-CH(CHR182)CH3;-CH(CH2R18)CH3;-CH(CR183)CH2R18;-CH(CHR182)CH2R18;-CH(CH2R18)CH2R18;-CH(CR183)CHR182;-CH(CHR182)CHR182;-CH(CH2R18)CHR182;-CH(CR183)CR183;-CH(CHR182)CR183;-CH(CH2R18)CR183;-CH(CH3)-CH(CH3)CH3;-CH(CH3)-CH(CR183)CH3;-CH(CH3)-CH(CHR182)CH3;-CH(CH3)-CH(CH2R18)CH3;-CH(CH3)-CH(CR183)CH2R18;-CH(CH3)-CH(CHR182)CH2R18;-CH(CH3)-CH(CH2R18)CH2R18;-CH(CH3)-CH(CR183)CHR182;-CH(CH3)-CH(CHR182)CHR182;-CH(CH3)-CH(CH2R18)CHR182;-CH(CH3)-CH(CR183)CR183;-CH(CH3)-CH(CHR182)CR183;または-CH(CH3)-CH(CH2R18)CR183であり(式中R18は、F、Cl、Br、またはIである);
R13が、-CH2-CH(CH3)CH3;-CH2-CH(CR193)CH3;-CH2-CH(CHR192)CH3;-CH2-CH(CH2R19)CH3;-CH2-CH(CR193)CH2R19;-CH2-CH(CHR192)CH2R19;-CH2-CH(CH2R19)CH2R19;-CH2-CH(CR193)CHR192;-CH2-CH(CHR192)CHR192;-CH2-CH(CH2R19)CHR192;-CH2-CH(CR193)CR193;-CH2-CH(CHR192)CR193;-CH2-CH(CH2R19)CR193;-CH(CH3)CH3;-CH(CR193)CH3;-CH(CHR192)CH3;-CH(CH2R19)CH3;-CH(CR193)CH2R19;-CH(CHR192)CH2R19;-CH(CH2R19)CH2R19;-CH(CR193)CHR192;-CH(CHR192)CHR192;-CH(CH2R19)CHR192;-CH(CR193)CR193;-CH(CHR192)CR193;-CH(CH2R19)CR193;-CH(CH3)-CH(CH3)CH3;-CH(CH3)-CH(CR193)CH3;-CH(CH3)-CH(CHR192)CH3;-CH(CH3)-CH(CH2R19)CH3;-CH(CH3)-CH(CR193)CH2R19;-CH(CH3)-CH(CHR192)CH2R19;-CH(CH3)-CH(CH2R19)CH2R19;-CH(CH3)-CH(CR193)CHR192;-CH(CH3)-CH(CHR192)CHR192;-CH(CH3)-CH(CH2R19)CHR192;-CH(CH3)-CH(CR193)CR193;-CH(CH3)-CH(CHR192)CR193;または-CH(CH3)-CH(CH2R19)CR193である(式中R19は、F、Cl、Br、またはIである)、請求項36または37に記載の使用。
【請求項39】
アンドロゲン受容体(AR)の活性を調節するための、式:
【化37】

(式中R20およびR21はそれぞれ独立してCCl3またはCHCl2である)の化合物またはその薬学的に許容される塩の使用。
【請求項40】
アンドロゲン受容体(AR)の活性を調節するための、式:
【化38−1】

【化38−2】

の化合物またはその薬学的に許容される塩の使用。
【請求項41】
アンドロゲン受容体(AR)の活性を調節するための、式:
【化39】

の化合物またはその薬学的に許容される塩の使用。
【請求項42】
ARの活性の調節がヒト細胞におけるものである、請求項36〜41のいずれか1項に記載の使用。
【請求項43】
ARの活性の調節が、ARのN末端領域(NTD)の活性を阻害するためのものである、請求項36〜42のいずれか1項に記載の使用。
【請求項44】
ARの活性の調節が、前立腺癌、乳癌、卵巣癌、子宮内膜癌、脱毛、ざ瘡、多毛症、卵巣嚢胞、多嚢胞性卵巣疾患、思春期早発症、または加齢性黄斑変性症の予防または治療のためのものである、請求項36〜43のいずれか1項に記載の使用。
【請求項45】
ARの活性の調節が、前立腺癌の予防または治療のためのものである、請求項44に記載の使用。
【請求項46】
前立腺癌がアンドロゲン非依存性前立腺癌である、請求項45に記載の使用。
【請求項47】
前立腺癌がアンドロゲン依存性前立腺癌である、請求項45に記載の使用。
【図1A】


【図1B】


【図2】


【図3A】


【図3B】


【図3C】


【図4】


【図5】


【図6】




【図1B】


【図2】


【図3A】


【図3B】


【図3C】


【図4】


【図5】


【図6】


【公表番号】特表2012−500778(P2012−500778A)
【公表日】平成24年1月12日(2012.1.12)
【国際特許分類】
【出願番号】特願2011−523280(P2011−523280)
【出願日】平成21年8月24日(2009.8.24)
【国際出願番号】PCT/CA2009/001173
【国際公開番号】WO2010/020055
【国際公開日】平成22年2月25日(2010.2.25)
【出願人】(511002951)
【出願人】(503384225)ザ ユニヴァーシティ オヴ ブリティッシュ コロンビア (4)
【Fターム(参考)】
【公表日】平成24年1月12日(2012.1.12)
【国際特許分類】
【出願日】平成21年8月24日(2009.8.24)
【国際出願番号】PCT/CA2009/001173
【国際公開番号】WO2010/020055
【国際公開日】平成22年2月25日(2010.2.25)
【出願人】(511002951)

【出願人】(503384225)ザ ユニヴァーシティ オヴ ブリティッシュ コロンビア (4)
【Fターム(参考)】
[ Back to top ]

